دوره 33، شماره 9 - ( آذر 1404 )
جلد 33 شماره 9 صفحات 9437-9419 |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.TMU.REC.1399.347
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Molaei K, Mirzayan Shanjani S, Gorzi A, Kazemzadeh Y, Banaifar A. Effect of Eight Weeks of Resistance Training and Testosterone Enanthate Consumption on Antioxidant Balance in the Kidney Tissue of Female Wistar Rats. JSSU 2025; 33 (9) :9419-9437
URL: http://jssu.ssu.ac.ir/article-1-6387-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6387-fa.html
ملایی خدیجه، میرزایان شانجانی ساناز، گُرزی علی، کاظمزاده یاسر، بنائیفر عبدالعلی. تأثیر هشت هفته تمرین مقاومتی و مصرف تستوسترون انانتات بر تعادل آنتیاکسیدانی در بافت کلیه موشهای صحرایی ماده نژاد ویستار. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (9) :9419-9437
متن کامل [PDF 969 kb]
(95 دریافت)
| چکیده (HTML) (182 مشاهده)
References:
1- Bond P, Smit DL, De Ronde W. Anabolic–Androgenic Steroids: How Do They Work and What Are the Risks? Front Endocrinol 2022; 13: 1059473.
2- Memudu AE, Dongo GA. A Study to Demonstrate the Potential of Anabolic Androgen Steroid to Activate Oxidative Tissue Damage, Nephrotoxicity and Decline Endogenous Antioxidant System in Renal Tissue of Adult Wistar Rats. Toxicol Rep 2023; 10: 320-26.
3- Reardon CL, Creado S. Drug Abuse in Athletes. Subst Abuse Rehabil 2014; 5: 95-105.
4- Riachy R, McKinney K, Tuvdendorj DR. Various Factors May Modulate the Effect of Exercise on Testosterone Levels in Men. J Funct Morphol Kinesiol 2020; 5(4): 81.
5- Karbasi S, Zaeemi M, Mohri M, Rashidlamir A, Moosavi Z. Outcomes of Testosterone Enanthate on Kidney of Male Wistar Rats Subjected to Resistance Training. Sci Sports 2017; 32(3): e107-e110.
6- Handelsman DJ, Hirschberg AL, Bermon S. Circulating Testosterone as the Hormonal Basis of Sex Differences in Athletic Performance. Endocr Rev 2018; 39(5): 803-29.
7- Huang G, Basaria S. Do Anabolic-Androgenic Steroids Have Performance-Enhancing Effects in Female Athletes? Mol Cell Endocrinol 2018; 464: 56-64.
8- Nelson BS, Hildebrandt T, Wallisch P. Anabolic-Androgenic Steroid Use Is Associated with Psychopathy, Risk-Taking, Anger, And Physical Problems. Sci Rep 2022; 12(1): 9133.
9- Collomp K, Ericsson M, Bernier N, Buisson C. Prevalence of Prohibited Substance Use and Methods by Female Athletes: Evidence of Gender-Related Differences. Front Sports Act Living 2022; 4: 839976.
10- Liu JD, Wu YQ. Anabolic-Androgenic Steroids and Cardiovascular Risk. Chin Med J (Engl) 2019; 132(18): 2229-36.
11- Burton GJ, Jauniaux E. Oxidative Stress. Best Pract Res Clin Obstet Gynaecol 2011; 25(3): 287-99.
12- Strycharz-Dudziak M, Fołtyn S, Dworzański J, Kiełczykowska M, Malm M, Drop B, et al. Glutathione Peroxidase (Gpx) and Superoxide Dismutase (SOD) in Oropharyngeal Cancer Associated with EBV and HPV Coinfection. Viruses 2020; 12(9): 1008.
13- Gaweł S, Wardas M, Niedworok E, Wardas P. Dialdehyd Malonowy (MDA) Jako Wskaźnik Procesów Peroksydacji Lipidów W Organizmie [Malondialdehyde (MDA) as a Lipid Peroxidation Marker]. Wiad Lek 2004; 57(9-10):453-5.
14- Su LJ, Zhang JH, Gomez H, Murugan R, Hong X, Xu D, et al. Reactive Oxygen Species-Induced Lipid Peroxidation in Apoptosis, Autophagy, And Ferroptosis. Oxid Med Cell Longev 2019; 2019: 5080843.
15- Asadi N, Bahmani M, Kheradmand A, Rafieian-Kopaei M. The Impact of Oxidative Stress on Testicular Function and the Role of Antioxidants in Improving It: A Review. J Clin Diagn Res 2017; 11(5): IE01-IE05.
16- Aydilek N, Aksakal M, Karakilcik AZ. Effects of Testosterone and Vitamin E on the Antioxidant System in Rabbit Testis. Andrologia 2004; 36(5): 277-81.
17- Choobineh H, Sadighi Gilani MA, Pasalar P, Jahanzad I, Ghorbani R, Hassanzadeh G. The Effects of Testosterone on Oxidative Stress Markers in Mice with Spinal Cord Injuries. Int J Fertil Steril 2016; 10(1): 87-93.
18- von Schantz T, Bensch S, Grahn M, Hasselquist D, Wittzell H. Good Genes, Oxidative Stress and Condition-Dependent Sexual Signals. Proc R Soc B 1999; 266(1414): 1-12.
19- Alonso-Alvarez C, Bertrand S, Faivre B, Chastel O, Sorci G. Testosterone and Oxidative Stress: The Oxidation Handicap Hypothesis. Proc Biol Sci 2007; 274(1611): 819-25.
20- Gyurászová M, Gurecká R, Bábíčková J, Tóthová Ľ. Oxidative Stress in the Pathophysiology of Kidney Disease: Implications for Noninvasive Monitoring and Identification of Biomarkers. Oxid Med Cell Longev 2020; 2020: 5478708.
21- Lobo V, Patil A, Phatak A, Chandra N. Free Radicals, Antioxidants and Functional Foods: Impact on Human Health. Pharmacogn Rev 2010; 4(8): 118-26.
22- Pellegrino D, La Russa D, Marrone A. Oxidative Imbalance and Kidney Damage: New Study Perspectives from Animal Models to Hospitalized Patients. Antioxidants 2019; 8(12): 594.
23- Filho SLA P, de Carvalho Gomes PEA, Forte GA, Lima LLL, da Silva Júnior GB, Martins AMC. De Francesco Daher E. Kidney Disease Associated with Androgenic–Anabolic Steroids and Vitamin Supplements Abuse: Be Aware! Nefrologia 2020; 40(1): 26-31.
24- Sadowska-Krępa E, Kłapcińska B, Jagsz S, Nowara A, Szołtysek-Bołdys I, Chalimoniuk M, et al. High-Dose Testosterone Enanthate Supplementation Boosts Oxidative Stress, But Exerts Little Effect on the Antioxidant Barrier in Sedentary Adolescent Male Rat Liver. Pharmacol Rep 2017; 69(4): 673-8.
25- Asmat U, Abad K, Ismail K. Diabetes Mellitus and Oxidative Stress – A Concise Review. Saudi Pharm J 2016; 24(5): 547-53.
26- Liu W, Akbarpour-Beni M, Movahed S, Gorzi A, Cheraghi E, Amini H. Neutralising the Testosterone Enanthate-Induced Oxidative Stress in Rats Uterine Tissue by Propolis and Chicory as Natural Antioxidants. Comparative Exercise Physiology 2023; 19(1): 87-93.
27- Jafari M, Matinhomaee H, Rahmati Ahmadabad S. The Effect of Eight Weeks of Aerobic Exercise and Coriander Seed Extract on Oxidative Stress and Cellular Energy Indices of Heart Tissue in Male Rats Poisoned with Hydrogen Peroxide. CMJA 2023; 13(1): 43-51. [Persian]
28- Gomes FC, Chuffa LG, Scarano WR, Pinheiro PF, Fávaro WJ, Domeniconi RF. Nandrolone Decanoate and Resistance Exercise Training Favor the Occurrence of Lesions and Activate the Inflammatory Response in the Ventral Prostate. Andrology 2016; 4(3): 473-80.
29- Hackney AC, Willett HN. Testosterone Responses to Intensive, Prolonged Endurance Exercise in Women. Endocrines 2020; 1(2): 119-24.
30- Gorzi A, Rajabi H, Gharakhanlou R, Dehkhoda MR, Hedayati M. The Effects of 8 Weeks of Resistance Training on Total and A12 Acetyl Cholinesterase Activity in Slow Twitch Muscles of Rats. Res Sport Med Technol 2017; 15(13): 9-16. [Persian]
31- Nazem F, Salehikia A, Marandi SM, Sahdadi A. Impact of a 12 Week Resistance and Concurrent Training on Bone Mechanical Strength and Mineral Density of Osteoporotic Male Wistar Rats. Feyz Med Sci J 2016; 20(2): 108-17. [Persian]
32- Joksimović J, Selaković D, Jakovljević V, Mihailović V, Katanić J, Boroja T, et al. Alterations of the Oxidative Status in Rat Hippocampus and Prodepressant Effect of Chronic Testosterone Enanthate Administration. Mol Cell Biochem 2017; 433(1-2): 41-50.
33- Arazi H, Rahmati S, Ghafoori H. The Interaction Effects of Resistance Training and Sustanon Abuse on Liver Antioxidant Activities and Serum Enzymes in Male Rats. Interv Med Appl Sci 2017; 9(3): 178-83.
34- Gorzi A, Ekradi S. The Effect of Intake Duration of Curcumin Supplementation During Strenuous Endurance Training on GPX Activity and MDA Levels of Liver, Heart and Skeletal Muscle in Male Wistar Rats. Sport Physiol 2020; 12(46): 139-56. [Persian]
35- Kaya H, Sezik M, Ozkaya O, Dittrich R, Siebzehnrubl E, Wildt L. Lipid Peroxidation at Various Estradiol Concentrations in Human Circulation During Ovarian Stimulation with Exogenous Gonadotropins. Horm Metab Res 2004; 36(10): 693.
36- Paoletti F, Aldinucci D, Mocali A, Caparrini A. A Sensitive Spectrophotometric Method for the Determination of Superoxide Dismutase Activity in Tissue Extracts. Anal Biochem 1986; 154(2): 536.
37- Paglia DE, Valentine WN. Studies on the Quantitative and Qualitative Characterization of Erythrocyte Glutathione Peroxidase. J Lab Clin Med 1967; 70: 158.
38- Tirupati A, Wang M, Lin JK, Fekete G, István B, Baker JS, et al. Effect of Different Exercise Modalities on Oxidative Stress: A Systematic Review. Biomed Res Int 2021; 2021: 1947928.
39- Bloomer RJ, Fry AC, Falvo MJ, Moore CA. Protein Carbonyls are Acutely Elevated Following Single Set Anaerobic Exercise in Resistance Trained Men. J Sci Med Sport 2007; 10(6): 411-7.
40- Zorov DB, Juhaszova M, Sollott SJ. Mitochondrial Reactive Oxygen Species (ROS) and ROS-Induced ROS Release. Physiol Rev 2014; 94(3): 909-50.
41- Parker L, McGuckin TA, Leicht AS. Influence of Exercise Intensity on Systemic Oxidative Stress and Antioxidant Capacity. Clin Physiol Funct Imaging 2014; 34(5): 377-83.
42- Ghiasi R, Mohammadi M, Ashrafi Helan J, Jafari Jozani SR, Mohammadi S, Ghiasi A, et al. Influence of Two Various Durations of Resistance Exercise on Oxidative Stress in the Male Rat’s Hearts. J Cardiovasc Thorac Res 2015; 7(4): 149-53.
43- Arjmand A, Abedi B, Hosseini SA. The Effect of Resistance Training on Malondialdehyde and Protein Carbonyl Concentration in the Heart Tissue of Rats Exposed to Stanozolol. Pharm Biomed Res 2020; 6(4): 261-8.
44- Liu JF, Chang WY, Chan KH, Tsai WY, Lin CL, Hsu MC. Blood Lipid Peroxides and Muscle Damage Increased Following Intensive Resistance Training of Female Weightlifters. Ann N Y Acad Sci 2005; 1042(1): 255-61.
45- McClean C, Davison GW. Circadian Clocks, Redox Homeostasis, And Exercise: Time to Connect the Dots? Antioxidants 2022; 11(2): 256.
46- Kawamura T, Muraoka I. Exercise-Induced Oxidative Stress and the Effects of Antioxidant Intake from A Physiological Viewpoint. Antioxidants 2018; 7(9): 119.
47- Riezzo I, Turillazzi E, Bello S, Cantatore S, Cerretani D, Di Paolo M, et al. Chronic Nandrolone Administration Promotes Oxidative Stress, Induction of Pro-Inflammatory Cytokine and TNF-Α Mediated Apoptosis in the Kidneys of CD1 Treated Mice. Toxicol Appl Pharmacol 2014; 280(1): 97-106.
48- Sadowska-Krępa E, Kłapcińska B, Nowara A, Jagsz S, Szołtysek-Bołdys I, et al. High-Dose Testosterone Supplementation Disturbs Liver Pro-Oxidant/Antioxidant Balance and Function in Adolescent Male Wistar Rats Undergoing Moderate-Intensity Endurance Training. PeerJ 2020; 8: e10228.
49- Jukic T, Drobne D, Pusavec S, Ihan A, Stubljar D, Starc A. Comparison of 3 Enzyme-Linked Immunoassay Methods to Evaluate Serum Concentrations of Infliximab and Antibodies to Infliximab in 32 Patients with Moderate to Severe Inflammatory Bowel Disease. Med Sci Monit 2023; 29: e939084.
50- Chodari L, Smailnejad S, Fallahi M, Khalaji N, Ghorbanzadeh V. Oxidative Stress Is Markedly Reduced By Combined Voluntary Exercise and Testosterone in the Heart of Diabetic Rats. Acta Endocrinol (Buchar) 2019; 15(2): 173-81.
51- Cruz-Topete D, Dominic P, Stokes KY. Uncovering Sex-Specific Mechanisms of Action of Testosterone and Redox Balance. Redox Biol 2020; 31: 101490.
52- Davey RA, Grossmann M. Androgen Receptor Structure, Function and Biology: From Bench to Bedside. Clin Biochem Rev 2016; 37(1): 3-15.
53- Tostes RC, Carneiro FS, Carvalho MH, Reckelhoff JF. Reactive Oxygen Species: Players in the Cardiovascular Effects of Testosterone. Am J Physiol Regul Integr Comp Physiol 2016; 310(1): R1-14.
54- Tenkorang MAA, Duong P, Cunningham RL. NADPH Oxidase Mediates Membrane Androgen Receptor-Induced Neurodegeneration. Endocrinology 2019; 160(4): 947-63.
55- Toro-Urrego N, Garcia-Segura LM, Echeverria V, Barreto GE. Testosterone Protects Mitochondrial Function and Regulates Neuroglobin Expression in Astrocytic Cells Exposed to Glucose Deprivation. Front Aging Neurosci 2016; 8: 152.
56- Ozbek E. Induction of Oxidative Stress in Kidney. Int J Nephrol 2012; 2012: 465897.
57- Frankenfeld SP, Oliveira LP, Ortenzi VH, Rego-Monteiro IC, Chaves EA, Ferreira AC, et al. The Anabolic Androgenic Steroid Nandrolone Decanoate Disrupts Redox Homeostasis in Liver, Heart and Kidney of Male Wistar Rats. PLoS One 2014; 9(9): e102699.
58- Albano GD, Amico F, Cocimano G, Liberto A, Maglietta F, Esposito M, et al. Adverse Effects of Anabolic-Androgenic Steroids: A Literature Review. Healthcare 2021; 9(1): 97.
59- Turillazzi E, Neri M, Cerretani D, Cantatore S, Frati P, Moltoni L, et al. Lipid Peroxidation and Apoptotic Response in Rat Brain Areas Induced by Long-Term Administration of Nandrolone: The Mutual Crosstalk Between ROS and NF-Κb. J Cell Mol Med 2016; 20(4): 601-12.
60- Peltola V, Huhtaniemi I, Metsa-Ketela T, Ahotupa M. Induction of Lipid Peroxidation During Steroidogenesis in the Rat Testis. Endocrinology 1996; 137(1): 105-12.
61- Mooradian AD. Antioxidant Properties of Steroids. J Steroid Biochem Mol Biol 1993; 45(6): 509-11.
62- Arazi H, Mohammadjafari H, Asadi A. Use of Anabolic Androgenic Steroids Produces Greater Oxidative Stress Responses to Resistance Exercise in Strength-Trained Men. Toxicol Rep 2017; 4: 282-86.
63- Davani-Davari D, Karimzadeh I, Khalili H. The Potential Effects of Anabolic-Androgenic Steroids and Growth Hormone as Commonly Used Sport Supplements on the Kidney: A Systematic Review. BMC Nephrol 2019; 20(1): 198.
64- Ho HJ, Shirakawa H. Oxidative Stress and Mitochondrial Dysfunction in Chronic Kidney Disease. Cells 2022; 12(1): 88.
65- Poljsak B, Šuput D, Milisav I. Achieving the Balance between ROS and Antioxidants: When to Use the Synthetic Antioxidants. Oxid Med Cell Longev 2013; 2013: 956792.
66- Sharifi-Rad M, Kumar NV, Zucca P, Varoni EM, Dini L, Panzarini E, et al. Lifestyle, Oxidative Stress, And Antioxidants: Back and Forth in the Pathophysiology of Chronic Diseases. Front Physiol 2020; 11: 694.
67- Lazzarino G, Listorti I, Bilotta G, Capozzolo T, Amorini AM, Longo S, et al. Water- and Fat-Soluble Antioxidants in Human Seminal Plasma and Serum of Fertile Males. Antioxidants (Basel) 2019; 8(4): 96.
68- Daenen K, Andries A, Mekahli D, Van Schepdael A, Jouret F, Bammens B. Oxidative Stress in Chronic Kidney Disease. Pediatr Nephrol 2019; 34(6): 975-91.
69- Tsatsakis A, Docea AO, Calina D, Tsarouhas K, Zamfira LM, Mitrut R, et al. A Mechanistic and Pathophysiological Approach for Stroke Associated with Drugs of Abuse. J Clin Med 2019; 8(9): 1295.
70- Poljsak B, Šuput D, Milisav I. Achieving the Balance between ROS and Antioxidants: When to Use the Synthetic Antioxidants. Oxid Med Cell Longev 2013; 2013: 956792.
71- Pham-Huy LA, He H, Pham-Huy C. Free Radicals, Antioxidants in Disease and Health. Int J Biomed Sci 2008; 4(2): 89-96.
متن کامل: (275 مشاهده)
مقدمه
استروئیدهای آنابولیک- آندروژنیک (Anabolic-androgenic steroids; AAS) دستهای از هورمونهای طبیعی و مصنوعی هستند که بهدلیل خواص عضلهسازی و افزایش قدرت در دوزهای بالا و غیردرمانی، بهطور گسترده مورد سوءمصرف قرار میگیرند. تستوسترون هورمون درونزاد اصلی متعلق به این دسته است. این هورمون بهطور گسترده بهصورت درمانی، در اشکال مختلف استری شده، بهعنوان درمان جایگزین در هیپوگنادیسم مردان استفاده میشود (1). AAS را میتوان بهعنوان گروهی از ترکیبات مصنوعی مشابه تستوسترون که بهصورت درونزا در بدن تولید میشوند، توصیف کرد (2). تستوسترون یک هورمون آندروژن است که بهطور طبیعی در مردان و زنان تولید میشود (3). این هورمون برای ارتقای ویژگیهای ثانویه جنسی مردانه و همچنین رشد عضلات و سازگاری عصبی- عضلانی مورد نیاز است (4). یکی از انواع داروهای مورد استفاده در ورزشکاران، تستوسترون انانتات است (3). از بین انواع مشتقات AAS، تستوسترون انانتات یک استروئید طولانیتر است که بهدلیل اثرگذاری مطلوب، در دسترس بودن و قیمت مناسب، یکی از محبوبترین و رایجترین استروئیدها در میان ورزشکاران رشتههای قدرتی و سایر رشتههای ورزشی میباشد. استفاده از تستوسترون انانتات همراه با تمرین مقاومتی میتواند منجربه افزایش حجم و قدرت عضلانی و بهبود عملکرد ورزشی در ورزشکاران شود (5). مطالعه هاندلسمن و همکاران در سال 2018 نشان میدهد مصرف تستوسترون در بین مردان ورزشکار بیشتر است از طرفی مصرف تستوسترون در زنان ورزشکار که تمرین مقاومتی انجام میدهند نیز رو بهافزایش است (6). با اینحال، برخلاف مطالعات بسیاری که اثرات افزایش عملکرد AAS را در ورزشکاران مرد نشان میدهد، اثرات AAS بر عملکرد بدنی در زنان بهطور گسترده مورد مطالعه قرار نگرفته است (7). گزارش شده است که میزان مصرف AAS در مردان ورزشکار۱۰ تا ۱۰۰ برابر بیشتر از دوزهای مصرفی در موارد بالینی است (8). در مورد میزان مصرف زنان ورزشکار اطلاعات دقیقی موجود نیست، اما برخی گزارشها نشان میدهند که برخی از ورزشکاران زن نیز از AAS با دوزهای مشابه با آنچه توسط ورزشکاران مرد استفاده میشود، مصرف میکردند (9). گزارش شده است که سوءمصرف ASS با عوارض جبرانناپذیری مانند: نارسایی قلبی، اختلالات رفتاری و اختلال در عملکرد کلیه و کبد همراه است و همچنین میتواند باعث بیماریهای کبدی و کلیوی مانند: اختلال انعقاد خون، فیبروز کبدی، هیپرتروفی کلیوی و نارسایی کلیوی شود (10). مطالعه کرباسی و همکاران در سال 2017 نشان دادهاند که تستوسترون انانتات با متصل شدن به گیرندههای آندروژنی روی توبولهای کلیوی و سلولهای مزانژیال در موشهای صحرایی نر باعث افزایش فشار اکسایشی میگردد که بدین معنی است که تستوسترون انانات میتواند با تحریک تولید رادیکالهای آزاد یا کاهش توانایی بدن برای خنثیسازی آنها، تعادل بین اکسیدانها و آنتیاکسیدانها را در بافت کلیه مختل کند (5). وقتی بین تولید گونههای اکسیژن فعال (Reactive oxygen species; ROS)، که مولکولهای حاوی اکسیژن بسیار واکنشپذیر هستند و توانایی بدن برای مقابله با اثرات مضر آنها، عدم تعادل ایجاد شود، فشار اکسایشی بهوجود میآید. فشار اکسایشی میتواند به سلولها، پروتئینها، لیپیدها و DNA آسیب برساند و در بیماریهای مختلف و پیری نقش دارد (11). سوپراکسید دیسموتاز (Superoxide dismutase; SOD) و گلوتاتیون پراکسیداز (Glutathione peroxidase; GPX)، آنزیمهای آنتیاکسیدانی هستند که نقش حیاتی در کاهش فشار اکسایشی دارند. SOD تبدیل رادیکالهای سوپراکسید را به پراکسید هیدروژن کاتالیز میکند، در حالیکه GPX با استفاده از گلوتاتیون احیا شده بهعنوان کوفاکتور، به تبدیل پراکسید هیدروژن به آب کمک میکند. این آنزیمها باهم کار میکنند تا ROS را خنثی کرده و از آسیب سلولی جلوگیری کنند (12). مالوندیآلدئید ((Malondialdehyde; MDA، یک نشانگر پراکسیداسیون لیپیدی است که زمانی رخ میدهد که ROS به لیپیدهای غشای سلولی حمله میکند و منجربه آسیب سلولی میشود (13). پراکسیداسیون لیپیدی شامل یک واکنش زنجیرهای است که منجربه تشکیل گونههای لیپیدی فعال از جملهMDA میشود. MDA، در نتیجه تجزیه اسیدهای چرب غیراشباع چندگانه توسط ROS تشکیل میشود (14). اسدی و همکاران در سال 2017 گزارش کردند پراکسیداسیون لیپیدی در غشای سلولی میتواند سیالیت و نفوذپذیری غشاهای سلولی را مختل کرده و به همه سلولها آسیب برساند. در این راستا، افزایش تولید ROS باعث پراکسیداسیون لیپیدی در اسپرم میشود. MDA بهدلیل تجزیه پراکسیدهای اسیدهای چرب غیراشباع تولید میشود. این موضوع یکی از شاخصهای مورد استفاده در مطالعات پراکسیداسیون لیپیدها در انسان و حیوانات بوده است (15). سطوح بالا MDA نشان دهنده افزایش حضور محصولات پراکسیداسیون لیپیدی است که منجربه افزایش فشار اکسایشی ناشی از مصرف مکمل تستوسترون میشود. تستوسترون میتواند با ترویج تولید ROS بر پراکسیداسیون لیپیدی تأثیر بگذارد (16). چوبینه و همکاران در سال 2016 نشان دادند که مطالعات روی تجویز تستوسترون اگزوژن میتواند تحتتأثیر دوز، مدت زمان و مسیر تجویز باشد. بنابراین، مطالعه تنظیم آنتیاکسیدان توسط استروئیدها میتواند به روشن شدن مکانیسمهای مولکولی عملکرد تستوسترون کمک کند. علاوه بر این، این آنزیمهای آنتیاکسیدانی عملکردهای همافزایی دارند. ناهنجاری یکی از آنزیمهای آنتیاکسیدانی میتواند بر فعالیت سایر آنزیمها تأثیر بگذارد. از آنجایی که تستوسترون معمولاً سرعت متابولیسم را بهبود میبخشد، میتوان انتظار داشت که دوز بالای تستوسترون ممکن است در عدم تعادل بین تولید ROS و دفاع آنتیاکسیدانی نقش داشته باشد و باعث افزایش خطر فشار اکسایشی شود (17). در این راستا، چندین محقق گزارش دادهاند که تستوسترون نقش پرواکسیدانی ایفا میکند و میتواند فشار اکسایشی را در بافتهای پستانداران القا کند (17،18). مطالعه آلوارز و همکاران در سال 2007 این فرضیه را مطرح کردهاند که تستوسترون دارای ویژگیهایی است که باعث افزایش اکسیداسیون میشود (19). از سوی دیگر، گزارش شده است که تستوسترون در پروستات انسان و سیستم عصبی موش صحرایی نیز اثر آنتیاکسیدانی دارد. در نتیجه، این نتایج نشان میدهند که خاصیت پرواکسیدانی تستوسترون میتواند وابسته به بافت و جنس باشد. در این راستا، بیضهها عمدتاً بهدلیل فعالیت آنتیاکسیدانی تستوسترون، مستعد آسیب ناشی از ROS هستند (17). ارتباط بین فشار اکسایشی و بیماریهای کلیوی از اهمیت قابلتوجهی برخوردار است. کلیهها اندامهای حیاتی مسئول تصفیه خون، تنظیم تعادل آب و الکترولیت، حفظ PH خون و دفع مواد زائد و سموم هستند (20). این عملکردها منجربه تولید مقدار قابلتوجهی از آنتیاکسیدانها و رادیکالهای آزاد در کلیهها میشود. اگر تعادل بین تولید آنتیاکسیدان و تولید رادیکالهای آزاد مختل شود، میتواند به فشار اکسایشی کمک کند (21). فشار اکسایشی در کلیهها با ایجاد و پیشرفت اختلالات کلیوی مختلف از جمله بیماری مزمن کلیه (Chronic Kidney Disease; CKD)، نفریت (التهاب کلیه) و آسیب کلیه مرتبط است. آسیب اکسیداتیو ناشی از رادیکالهای آزاد میتواند عملکرد کلیه را مختل کند، التهاب را تقویت کند و به آسیب بافتی کمک کند و در نهایت شرایط کلیوی را تشدید کند (22). مطالعه فیلهو و همکاران در سال 2020، تستوسترون اگزوژن را با کاهش میزان فیلتراسیون گلومرولی، پروتئینوری، آسیب توبولی و افزایش فشار اکسایشی در بافت کلیه مرتبط دانستهاند، که نشان دهنده پتانسیل نفروتوکسیک است که توجه را میطلبد (23). در کلیه، فشار اکسایشی میتواند اثرات مضری بر عملکرد کلیه داشته باشد و بهایجاد بیماریهای کلیوی مختلف مانند: نفروپاتی دیابتی، نفروپاتی فشار خون بالا و گلومرولونفریت کمک کند (24). نفروپاتی دیابتی یکی از بیماریهای کلیوی شایع است که بهطور مستقیم به افزایش فشار اکسایشی و ایجاد ROS در سلولهای کلیه ارتباط دارد. در این بیماری، افزایش گلوکز خون باعث تولید ROS در سلولهای کلیه میشود، که منجربه تخریب سلولهای کلیه و تغییرات ساختاری در این اندام میشود. بیماران مبتلا به نفروپاتی فشار خون بالا نیز در معرض فشار اکسایشی زیادی قرار دارند. افزایش فشار خون باعث فشار اضافی بر روی عروق کلیه میشود و منجربه تخریب ادمینالهای کلیه میشود که در نهایت به کاهش عملکرد کلیه منجر میشود. گلومرولونفریت یک دسته از بیماریهای کلیوی است که تحتتأثیر فشار اکسایشی قرار میگیرند. در این بیماری، التهاب در عروق خونی کلیه ایجاد میشود که میتواند به تخریب گلومرولها و کاهش عملکرد کلیه منجر شود. بنابراین، تنظیم و کاهش فشار اکسایشی در کلیهها و محافظت از آنها از طریق آنزیمهای آنتیاکسیدانی مانند: GPX، کاتالاز (CAT) و SOD بسیار اهمیت دارد (25). SOD یک آنزیم آنتیاکسیدانی مهم در کلیه است که آنیون سوپراکسید را به پراکسید هیدروژن تبدیل میکند و سپس توسط GPX سمزدایی میشود. کاهش فعالیت SOD و GPX، یا افزایش پراکسیداسیون لیپیدی، همانطور که با سطوح بالا MDA نشان داده میشود، نشانگرهای رایج فشار اکسایشی در کلیه هستند (26). بهدرستی ثابت شده است اتخاذ شیوههای مناسب زندگی از جمله انجام فعالیت ورزشی منظم سبب حفظ سلامتی در برابر بیماریهای مزمن میشود. در واقع فعالیتهای هوازی ظرفیت سازگاری بیوشیمیایی و متابولیکی بافتهای بدن را در مقابل شرایط فشارزا افزایش میدهند. از فعالیتهای هوازی بهعنوان عامل کاهش سطوح پراکسیداسیون لیپیدی جوانان و افراد مسن یاد شده است، در این رابطه هنوز نتایج متناقضی وجود دارد. بعضی از محققان عدم تغییر یا افزایش میزان MDA متعاقب تمرینات هوازی را بهمدت زمان این تمرینات مربوط میدانند (27). گومز و همکاران در سال 2016 گزارش کردند، استفاده از AAS عمدتاً با انجام فعالیتهای بدنی با شدت بالا و کوتاه مدت، با اضافه وزن بیش از ظرفیت هوازی عضلات مرتبط است. بسته به نوع تمرین، بار، فراوانی، مدت و شدت تمرین ممکن است اثرات مفید یا مضری در اندامها ایجاد کند (28). در مطالعهای که سادوسکا و همکارانش در سال 2017 انجام دادند، تأثیر تستوسترون انانتات همراه با تمرین استقامتی بر فشار اکسایشی را بررسی کردهاند. آنها دریافتند که تستوسترون انانتات تولید ROS و پراکسیداسیون لیپیدی را در بافت کبد موشها افزایش میدهد که نشان دهنده افزایش فشار اکسایشی است (24). هم¬چنین لیو و همکاران در سال 2023 نشان دادند مصرف هشت هفته تستوسترون انانتات و تمرین مقاومتی منجربه کاهش معنیدار SOD و GPX و افزایش معنیدار MDA در بافت رحم موشها گردید (26). در مورد ورزشکاران زنی که در فرآیند تمرینات استقامتی از تستوسترون استفاده میکنند، کلیهها با چالشهای منحصربهفردی روبهرو هستند. هاکنی و همکاران در سال ۲۰۲۰ گزارش کردند تمرینات استقامتی با شدت بالا میتواند مصرف اکسیژن و متابولیسم را افزایش داده و در نتیجه منجربه افزایش تولید ROS شود. هنگامیکه افزایش فشار اکسایشی بهعلت مصرف تستوسترون نیز به این فرآیند اضافه شود، ممکن است کلیهها با خطر آسیب اکسیداتیو بیشتری روبهرو شوند (29). بهنظر میرسد استفاده بیرویه از AAS توسط ورزشکاران ممکن است منجربه آسیبهای جبرانناپذیری در عملکرد فیزیولوژیک بسیاری از اندامها بهویژه کلیه شود. با توجه به وجود مطالعات اندک و نیاز به پژوهشهای بیشتر در این زمینه، میتواند بهافزایش اطلاعات و پیشگیری از آسیبهای کلیوی در این قشر جامعه منجر شود و همچنین مصرف رو بهافزایش استفاده از AAS در ورزشکاران زن و عدم وجود مطالعهای در مورد تأثیر همزمان تمرین مقاومتی با این شدت و مدت تمرین و مصرف تستوسترون انانتات بر روی بافت کلیه، مطالعه حاضر با هدف بررسی تأثیر هشت هفته تمرین مقاومتی و مصرف تستوسترون انانتات بر تعادل آنتیاکسیدانی در بافت کلیه موشهای صحرایی ماده نژاد ویستار میباشد.
روش بررسی
در این پژوهش تجربی 24 سر موش صحرایی ماده نژاد ویستار با سن هشت هفته و وزن 14/17±208/22 گرم از انستیتو پاستور (ایران) خریداری شد. ابتدا از بین موشهای صحرایی ماده، آزمودنیهایی که کاملاً سالم بودند و توانایی انجام فعالیت بدنی را داشتند، که این موارد از معیارهای ورود نمونهها در این پژوهش بود، بهعنوان نمونه آماری انتخاب شدند. همچنین مشاهده مشکلات ظاهری مانند: اختلال در حفظ تعادل، عدم توانایی انجام تمرین و سن موشها از هشت هفته بیشتر باشد از معیارهای خروج نمونهها در این پژوهش بود. در طول مدت پژوهش، حیوانات در قفسههای پلیکربنات شفاف، تولید شده در شرکت رازیراد با قابلیت شستوشو و در شرایط استاندارد (رطوبت 5±45 درصد و چرخه نور/ تاریکی ۱۲:۱۲ ساعت و دمای 2±۲2 درجه سانتیگراد) نگهداری شدند. در این پژوهش آب و غذا به اندازه کافی در اختیار حیوانات گذاشته شد و آنها بهطور آزادانه به آن دسترسی داشتند. برای اطمینان از شرایط محیطی مناسب و حفظ رطوبت دما و تهویه مناسب از دستگاه تهویه هوا و از دماسنج و رطوبتسنج برای پایش تغییرات شبانهروزی دما و رطوبت استفاده شد. در ابتدا بهمنظور آشناسازی حیوانات با شرایط آزمایشگاه، تمرینات بهمدت یک هفته با بالا رفتن از نردبان مخصوص تمرینات مقاومتی جوندگان انجام شد. سپس موشها بهطور تصادفی به سه گروه، شامل: 1) گروه کنترل (تعداد=8)، 2) گروه تمرین مقاومتی + دارونما (تعداد=8)، و 3) گروه تمرین مقاومتی + تستوسترون انانتات (تعداد=8) تقسیم شدند. گروههای تمرین مقاومتی + دارونما و تمرین مقاومتی + تستوسترون انانتات بهمدت هشت هفته، پنج روز در هفته تمرین مقاومتی و همچنین سه روز در هفته مصرف روغن زیتون (دارونما) و تستوسترون انانتات داشتند. گروه کنترل نیز جهت تجربه شرایط موجود و همسان¬سازی دریافت استرس ناشی از مواجهه با آزمون¬گر، در محل تمرینات حضور داشتند. لازم بهذکر است که گروه کنترل، تمرین مقاومتی و مصرف تستوسترون انانتات نداشتند. در پژوهش حاضر پروتکل تمرین، شامل برنامه هشت هفته ای تمرین مقاومتی، پنج روز تمرین و دو روز استراحت در هفته (چهار نوبت شش تایی با استراحت ۶۰ الی 120 ثانیه) بهصورت صعود از نردبان عمودی ۱ متری با ۲۶ پله و بستن وزنه به دم حیوانات، که وزنهها در هفته اول با 40 درصد وزن بدن موشها شروع شد، و هر هفته 20 درصد وزن بدن به وزنهها اضافه میشد. در هفته پنجم، بهمنظور جلوگیری از بیشتمرینی و همچنین ایجاد فرصت بازیافت مناسب به حیوانات جهت اجرای تمرینات سنگین در سه هفته پایانی، شدت تمرین با شدت هفته سوم انجام شد. بهطوری که در هفته پنجم، یک هفته کاهش بار یعنی 20 درصد نسبت به هفته قبل داشتیم، اما در هفته ششم 40 درصد وزن بدن موشها به حجم کار اضافه شد. در هفته هفتم و هشتم، 20 درصد وزن بدن موشها به بار در هفته اضافه شد (جدول1) و دو جلسه در هفته وزنکِشی انجام شد. برنامه تمرینی با اندکی تغییر از منبع معتبر اخذ شده می باشد (30). همچنین به منظور تحریک موش¬ها برای صعود از نردبان از شرطی کردن آنها برای رسیدن به غذا بالای نردبان استفاده شد. در این پژوهش هرگز از تقویت کنندههای منفی مانند: شوک الکتریکی، پمپ فشار هوا و... استفاده نشد و فقط از تحریک دستی و تکان دادن دم حیوانات جهت اجرای تمرینات استفاده شد (31). موشهای گروه تمرین مقاومتی + تستوسترون انانتات بهمیزان ۲۰ میلیگرم به¬ازای هر کیلوگرم از وزن بدن، تستوسترون انانتات (ساخت شرکت ایرانهورمون، با شماره سریال ۰۰۶۹) را بهصورت تزریق عضلانی (32) و همچنین گروه تمرین مقاومتی + دارونما، روغن زیتون را بهعنوان دارونما، سه روز در هفته دریافت نمودند (33). پس از انجام پروتکل پژوهش بهمنظور از بین بردن اثرات حاد تمرین، ۴۸ ساعت بعد از آخرین جلسه تمرین مقاومتی و مصرف تستوسترون انانتات، حیوانات پس از ۱2 ساعت ناشتایی با ترکیب زایلازین (سه تا پنج میلیگرم به ازای هر کیلوگرم از وزن بدن) و کتامین (سی تا پنجاه میلیگرم بهازای هر کیلوگرم از وزن بدن) بیهوش شدند. سپس طبق یک جدول زمانی از پیش تعیین شده، در زمان تشریح برای جلوگیری از تداخل اثر زمان تشریح (ریتم شبانهروزی) بر میزان هورمونها و...، گروههای کنترل، تمرین مقاومتی + دارونما و تمرین مقاومتی + تستوسترون انانتات بهصورت متناوب از گروههای متفاوت تشریح شدند (34)، سپس بافت کلیه حیوانات بهسرعت برداشته شد و در سرم فیزیولوژیک شستوشو داده شدند. نمونههای جمعآوری شده بهسرعت در میکروتیوپهای مخصوص آزمایشگاه قرار داده شدند، سپس بلافاصله با استفاده از نیتروژن مایع در دمای 196- درجه سانتیگراد منجمد شده و ضمن انتقال به آزمایشگاه برای سنجش متغیرهای پژوهش در یخچال با دمای ۸۰- درجه سانتیگراد نگهداری شدند.
فعالیت متغیرهای وابسته شامل: SOD، GPX و MDA به روش اسپکتروفتومتری بدین طریق اندازهگیری شدند؛ برای اندازهگیری میزان MDA از محلول هموژن خالص استفاده شد. اندازهگیری میزان MDA مطابق روش گزارش شده توسط (Kaya and Sezik et al.,2004) و با اندکی تغییر بهطور خلاصه بدین صورت انجام شد؛ اساس روش اندازهگیری MDA بافتی بر پایه واکنش با تیوباربیتوریک اسید (TBA)، استخراج با بوتانل نرمال، اندازهگیری جذب با روش اسپکتروفتومتری و مقایسه جذب با منحنی استاندارد میباشد و نتایج بهصورت nmol/mg protein بیان گردید (35). اندازهگیری میزان فعالیت آنزیم SOD بر روی محلول رویی تهیه شده از هموژن خالص بافت کلیه با استفاده از کیت Randox Laboratories Ltd, UK)) RANSOD ساخت کشور انگلستان محاسبه شد و بر اساس روش (Paoletti and Aldinucci et al.,1986) انجام گردید. فعالیت SOD در طول موج 505 نانومتر از طریق طیفسنجی محلول رویی اندازهگیری شد و نتایج بهصورت U/mg protein بیان گردید (36). برای اندازهگیری میزان فعالیت آنزیم GPX از محلول هموژن خالص استفاده شد. میزان فعالیت آنزیم GPX با استفاده از کیت ((RandoxLaboratories Ltd, Crumlin, UK RANSEL ساخت کشور انگلستان محاسبه گردید و بر اساس روش (Paglia and Valentine,1967) انجام شد و نتایج بهصورت U/mg protein بیان گردید (37).
تجزیه و تحلیل آماری
نرمال بودن توزیع دادهها با استفاده از آزمون شاپیرو- ویلک و همگنی واریانسها با استفاده از آزمون لِوِن بررسی و تأیید گردید. سپس از آزمون تحلیل واریانس یکراهه یا آنوا برای بررسی تفاوت بینگروهی استفاده شد. در ادامه برای تعیین محل تفاوت بینگروهی از آزمون تعقیبی بونفرونی استفاده شد. تمامی تحلیلهای آماری با نرم¬افزارversion 16 SPSS در سطح معناداری 0/05>P انجام گردید. نمودارها با استفاده از نرمافزارGraphPad Prism (9.4.0.673) ترسیم شدند.
نتایج
جدول 2 میانگین و انحراف استاندارد میزان فعالیت GPX، SOD و MDA موشهای ماده برای سه گروه کنترل، تمرین مقاومتی + دارونما و تمرین مقاومتی + تستوسترون انانتات را نشان میدهد. در این جدول همچنین نتایج مقایسه میانگین گروهها با استفاده از آزمونهای آنوا و تعقیبی بونفرونی نمایش داده شده است. نتایج آزمون تحلیل واریانس یکراهه نشان داد تفاوت معنیداری در میزان MDA در گروههای پژوهش وجود دارد (F(2,8)=68/470,P<0/0001 ). نتایج آزمون تعقیبی بونفرونی نشان داد میزان MDA در گروه تمرین مقاومتی + تستوسترون انانتات بهطور معنیداری بیشتر از گروههای کنترل (Mean Diff.(j-i)=0/702,P<0/0001) و تمرین مقاومتی + دارونما (Mean Diff.(j-i)=0/732,P<0/0001) بود؛ اما تفاوت معنیداری در میزان MDA گروههای کنترل و تمرین مقاومتی + دارونما مشاهده نشد (Mean Diff.(j-i)=-0/030,P>0/999) (شکل 1). نتایج آزمون تحلیل واریانس یکراهه نشان داد تفاوت معنیداری در میزان فعالیت SOD در گروههای پژوهش وجود دارد (F(2,8)=35/767,P<0/0001 ).نتایج آزمون تعقیبی نشان داد میزان فعالیت SOD در گروه تمرین مقاومتی + تستوسترون انانتات بهطور معنیداری کمتر از گروههای کنترل (Mean Diff.(j-i)=-3/24,P<0/0001) و تمرین مقاومتی + دارونما (Mean Diff.(j-i)=-3/45,P<0/0001) بود؛ اما تفاوت معنیداری در میزان فعالیت SOD گروههای کنترل و تمرین مقاومتی + دارونما مشاهده نشد (Mean Diff.(j-i)=0/21,P<0/999)(شکل 2). نتایج آزمون تحلیل واریانس یکراهه نشان داد تفاوت معنیداری در میزان فعالیت GPX در گروههای پژوهش وجود دارد (F(2,8)=28/968,P<0/0001 ). نتایج آزمون تعقیبی بونفرونی نشان داد میزان فعالیت GPX در گروه تمرین مقاومتی + تستوسترون انانتات به¬طور معنی¬داری کمتر از گروه-های کنترل(Mean Diff.(j-i)=-0/98,P<0/0001) و تمرین مقاومتی + دارونما (Mean Diff.(j-i)=-1/11,P<0/0001) بود؛ اما تفاوت معنی¬داری در میزان فعالیت GPX گروه¬های کنترل و تمرین مقاومتی + دارونما مشاهده نشد(Mean Diff.(j-i)=0/13,P<0/999) (شکل 3).
جدول1. پروتکل تمرین مقاومتی
.JPG)
جدول 2: میانگین و انحراف معیار میزان فعالیت GPX ، SOD و MDA موشهای ماده در گروههای پژوهش
.JPG)
MDA: مالون دیآلدئید؛ SOD: سوپراکسید دیسموتاز؛ GPX: گلوتاتیون پراکسیداز
a مقادیر بهصورت انحراف استاندارد ± میانگین نشان داده شدهاند.
b P<0/0001، اختلاف معنادار میانگین سه گروه (آزمون تحلیل واریانس یکراهه).
c P<0/0001، تمرین مقاومتی + تستوسترون انانتات درمقابل کنترل (آزمون تعقیبی بونفرونی).
d P<0/001 و e P<0/0001، تمرین مقاومتی + تستوسترون انانتات درمقابل تمرین مقاومتی + دارونما (آزمون تعقیبی بونفرونی).
.JPG)
شکل1: مقایسه تغییرات مقادیر MDA در بافت کلیه موشهای ماده در گروههای پژوهش
****: (P<0/0001 تفاوت معنیدار با استفاده از آزمون تعقیبی بونفرونی
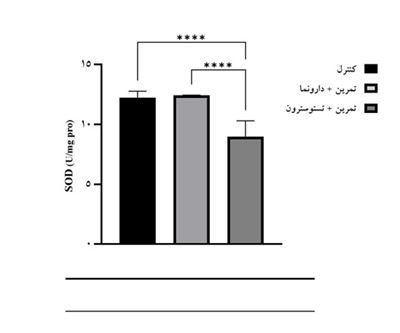
شکل2: مقایسه تغییرات مقادیر SOD در بافت کلیه موشهای ماده در گروههای پژوهش
****: (P<0/0001) تفاوت معنیدار با استفاده از آزمون تعقیبی بونفرونی
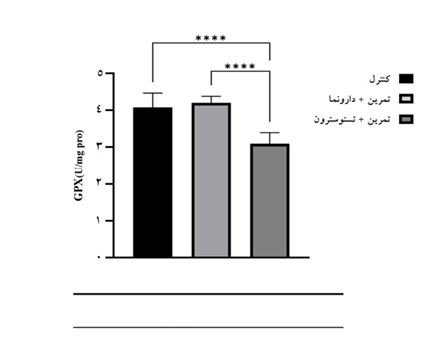
شکل3: مقایسه تغییرات مقادیر GPX در بافت کلیه موش¬های ماده در گروه¬های پژوهش
****: (P<0/0001) تفاوت معنی¬دار با استفاده از آزمون تعقیبی بونفرونی
بحث
هدف از پژوهش حاضر بررسی تأثیر هشت هفته تمرین مقاومتی بههمراه مصرف تستوسترون انانتات بر سطوح MDA، SOD و GPX در بافت کلیه موشهای صحرایی ماده نژاد ویستار میباشد. یافتههای پژوهش حاضر نشان داد که هشت هفته تمرین مقاومتی موجب افزایش معنیدار میزان MDA در گروه تمرین مقاومتی + تستوسترون انانتات نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما شد؛ اما تأثیر معنیداری در میزان MDA گروه¬های کنترل و تمرین مقاومتی + دارونما نداشت. همچنین موجب کاهش معنیدار میزان فعالیت SOD در گروه تمرین مقاومتی + تستوسترون انانتات نسبت به گروههای کنترل و تمرین مقاومتی + دارونما شد؛ اما تأثیر معنیداری در میزان فعالیت SOD گروه¬های کنترل و تمرین مقاومتی + دارونما نداشت. علاوه بر این، هشت هفته تمرین مقاومتی موجب کاهش معنی¬دار میزان فعالیت GPX در گروه تمرین مقاومتی + تستوسترون انانتات نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما شد؛ اما تأثیر معنی¬داری در میزان فعالیت GPX گروه¬های کنترل و تمرین مقاومتی + دارونما نداشت.
در این مطالعه تمرین مقاومتی بهتنهایی بر میزان فشار اکسایشی و فعالیت آنزیمهای آنتیاکسیدانی تأثیر نداشت. تیروپاتی و همکاران در سال 2021 گزارش کردند نوع ورزش عامل مهمی برای القای آسیب اکسایشی است، زیرا شدت زیاد دوچرخهسواری آسیب اکسایشی را کاهش میدهد و آنتیاکسیدانهای آنزیمی را افزایش میدهد (38)؛ اما همان شدت با ورزش سرعتی باعث افزایش آسیب اکسایشی میشود (39). بهطور مشابه، تمرینات مقاومتی مانند تمرین مقاومتی دایرهای آسیب اکسایشی را کاهش داده و سطح آنتیاکسیدان را در مقایسه با تمرین مقاومتی سنتی بهبود میبخشد، که نشان میدهد نوع تمرین همراه با حجم کل تمرین برای فشار اکسایشی ناشی از تمرین مهم است (40). از طرفی پارکر و همکاران در سال 2014 نشان دادهاند که حجم تمرین برای تخلیه آنتیاکسیدانها و افزایش فشار اکسایشی کافی نیست (41). تفاوت بین این مطالعات بهدلیل مدت زمان پروتکل تمرین، حالت تمرین و نشانگرهای آسیب اکسایشی تجزیه و تحلیل شده است. همسو با پژوهش حاضر، غیاثی و همکاران در سال ۲۰۱۵ گزارش کردند چهار ماه تمرین مقاومتی منجربه تغییر معناداری بر SOD بافت قلب موشها نشد (42). از طرفی مطالعه ارجمند و همکاران در سال ۲۰۲0 نشان داد هشت هفته تمرین مقاومتی باعث کاهش سطوح MDA بافت قلب موشها میشود (43). همچنین تمرین مقاومتی با شدت بالا کاهش GPX را در زنان وزنهبردار در پی دارد (44). بهنظر میرسد از دلایل تفاوت نتایج مطالعه حاضر با سایر مطالعات ممکن است بهعلت تفاوت شدت و مدت زمان تمرین باشد (45). فعالیت ورزشی با شدت بالا میتواند منجر به افزایش تولید ROS و در نتیجه تضعیف سیستم آنتیاکسیدانی شود (46). همسو با مطالعه ریزو و همکاران در سال ۲۰۱4 گزارش کردند مصرف AAS همراه با فعالیت بدنی با شدت بالا باعث کاهش فعالیت آنزیمهای آنتیاکسیدانی گلوتاتیون ردوکتاز (GR) و GPX میشود که باعث کاهش توانایی حذف رادیکالهای آزاد در کلیه میگردد (47). همسو با پژوهشی دیگر نشان داده شد که مصرف دوزهای بالای تستوسترون انانتات در موشها همراه با تمرین استقامتی باعث کاهش فعالیت SOD شده که میتواند به سیستم دفاعی و آنتیاکسیدانی آسیب برساند (48). از سوی دیگر، گزارش شده است که علت کاهش فعالیت آنزیمهای آنتیاکسیدانی، برهم خوردن ردوکس (اکسیدان- آنتیاکسیدان) میباشد، به این دلیل که تمرین مقاومتی با شدت بالا و یا در کوتاه مدت که بدن به سازگاری نرسیده است از طریق مکانیسمهایی مثل: تغییر هموستاز کلسیم، مسیر گزانتیناکسیداز، افزایش تولید رادیکالهای آزاد را در پی دارد که با توجه به افزایش تدریجی شدت تمرین در این پژوهش دلیل بهدست آمدن این نتایج میباشد (49). همسو با پژوهش حاضر، مطالعه گُرزی و اکرادی در سال 2020 نشان دادند که هشت هفته تمرین استقامتی شدید سبب کاهش معنادار فعالیت آنزیم آنتیاکسیدانی GPX و افزایش سطوح MDA در بافتهای کبد و قلب که نشاندهنده کاهش ظرفیت آنتیاکسیدانی و افزایش میزان فشار اکسایشیاند، شد؛ اگرچه تغییر نکردن این شاخصها در عضله اسکلتی نشاندهنده تفاوت پاسخها و سازگاریهای انواع بافتها به یک پروتکل تمرینی واحد است. بهنظر میرسد فعالیتهای ورزشی میتوانند همانند یک چاقوی دولبه عمل کنند! تمرین و فعالیت ورزشی، همانطور که تولید رادیکالهای آزاد آسیبرسان به مولکولهای بدن را از منابع گوناگون افزایش میدهد، بههمان نحو نیز قادر به بهبود دستگاه دفاع آنتیاکسیدانی میباشد (34).
یافته مهم پژوهش حاضر این است که مصرف هشت هفته تستوسترون انانتات بههمراه تمرین مقاومتی منجربه کاهش معنادار سطوحSOD و GPX نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما میشود. علاوه بر این، تستوسترون انانتات همراه با تمرین مقاومتی باعث افزایش معنادار سطوح MDA نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما میگردد، که این نشان میدهد مصرف تستوسترون انانتات همراه با تمرین مقاومتی باعث کاهش فعالیت آنزیمهای آنتیاکسیدانی و افزایش فشار اکسایشی نسبت به گروه¬های تمرین مقاومتی + دارونما و کنترل شده است، که همسو با یافتههای الچدوری و همکاران در سال 2019 گزارش کردند بهطور همزمان، درمان با تستوسترون و ورزش اثر همافزایی بر سطح آنزیمهای آنتیاکسیدانی در موشهای دیابتی و دیابتی اخته شده داشت. در حیوانات اخته شده مبتلا به دیابت، فعالیت SOD، GPX و CAT بهطور معناداری کاهش و سطح MDA بهطور معناداری در خون و بافت قلب افزایش یافت (50). تستوسترون از طریق اتصال به گیرندههای آندروژن واقع در سیتوپلاسم یا هسته، اثرات خود را بر سلولها اعمال میکند. پس از اتصال، کمپلکسهای گیرنده تستوسترون به هسته منتقل میشوند و بیان ژن را با تعامل با توالیهای DNA خاصی که بهعنوان عناصر پاسخ آندروژن (AREs)موجود در نواحی پروموتر ژنهای هدف شناخته میشوند، تعدیل میکند (51). در مورد آنزیمهای آنتیاکسیدانی، تستوسترون ممکن است مستقیمأ بر سطح بیان ژن آنها تأثیر بگذارد. برای مثال، کمپلکسهای گیرنده تستوسترون میتوانند به AREها در نواحی پروموتر ژنهای کدکننده GPX و SOD متصل شوند. این تعامل میتواند رونویسی این ژنها را تقویت یا سرکوب کند و در نتیجه بر تولید آنزیمهای GPX و SOD تأثیر بگذارد (52). تغییرات در سطح تستوسترون ممکن است بر سنتز یا جذب گلوتاتیون (GSH) تأثیر بگذارد و در نتیجه فعالیت GPX را تعدیل کند. علاوه بر این، تستوسترون ممکن است با مسیرهای سیگنالدهی درگیر در تنظیم آنزیم آنتیاکسیدانی تعامل داشته باشد. تستوسترون میتواند آبشارهای سیگنالینگ مانند: پروتئینکیناز B (Akt) و شاخص هستهای اریتروئید2 مربوط به فاکتور2 (Nrf2) را فعال کند که نقش کلیدی در دفاع آنتیاکسیدانی دارند (51). این مسیرها میتوانند بیان یا فعالیت آنزیمهای آنتیاکسیدانی از جمله GPX و SOD را تحریک کنند (16،53). همچنین تنکورانج و همکاران در سال ۲۰۱۹ نشان دادند تستوسترون که از طریق گیرنده آندروژن خود عمل میکند، میتواند تولید ROS را در سلولها القا کند. این پدیده به فعال شدن NADPH اکسیداز، یک کمپلکس آنزیمی متصل به غشاء و مسئول تولید ROS نسبت داده میشود. افزایش سطح ROS میتواند دفاع آنتیاکسیدانی درونزا را تحتتأثیر قرار دهد و منجربه فشار اکسایشی و اختلال در عملکرد آنزیمهای مهم مانند: GPX و SOD شود (54). کاهش مشاهده شده در سطوح GPX و SOD در موشهای مصرفکننده تستوسترون ممکن است به سازوکارهای متعدد نسبت داده شود. تستوسترون میتواند بیان ژنهای مرتبط با آنزیمهای آنتیاکسیدانی را تعدیل کند و بهطور بالقوه تولید آنها را کاهش دهد. علاوه بر این، تأثیر تستوسترون بر میتوکندری میتواند منجربه افزایش نشت الکترون در طول فسفوریلاسیون فشار اکسایشی شود و به تولید ROS کمک کند که همراه با کاهش بالقوه فعالیت آنزیم آنتیاکسیدانی است. میتوکندری، میتواند توانایی سلول را برای خنثی کردن ROS تضعیف کند و منجربه کاهش کلی در سطوح GPX و SOD شود (55). در پژوهش حاضر علاوه بر کاهش سطح آنزیم آنتیاکسیدان، افزایش قابلتوجهی در سطح MDA در موشهای مصرفکننده تستوسترون انانتات مشاهده شد که همسو با مطالعه آیدیلک و همکاران در سال 2004 نشان دادند شش هفته مصرف تستوسترون باعث افزایش معنادار MDA بافت کبد موشهای ماده مصرفکننده تستوسترون میشود (16). همسو با مطالعه اوزبک و همکاران در سال 2012 گزارش کردند افزایشی در سطح MDA در گروههای تحت درمان با تستوسترون وجود داشت که نشان میدهد آسیبهای اکسایشی کلیوی ناشی از AAS زنجیره لیپیدی را در بافت کلیه هدف قرار میدهد و منجر به انحلال اجزای لیپیدی بافت کلیه میشود (56). که همسو با یافتههای فرانکنفلد و همکاران در سال 2014 و آلبانو و همکاران در سال 2021 است که گزارش کردند مصرف مداوم تستوسترون، سازوکار آنتیاکسیدانی درونزا را مختل میکند که باید تنظیم شده باشد و MDA واسطه از بین بردن فشار اکسایشی است (57،58). افزایش همزمان سطح MDA در گروه تستوسترون و تمرین مقاومتی بر عدم تعادل بین تولید ROS و دفاع آنتیاکسیدانی تأکید میکند. تأثیر تستوسترون بر متابولیسم لیپید، بهویژه فعال شدن مسیرهای لیپولیتیک، میتواند منجربه افزایش ترشح اسیدهای چرب شود. این اسیدهای چرب مستعد اکسیداسیون، تولید پراکسیدهای لیپیدی و در نهایت MDA هستند که محصول پراکسیداسیون لیپیدی است. سطوح بالا MDA نشاندهنده روند مداوم آسیب اکسایشی به غشاهای سلولی است که میتواند یکپارچگی و عملکرد سلولی را بهخطر بیندازد (59). ناهمسو با مطالعه حاضر، یافتههای پلتولا و همکاران در سال 1996 و چوبینه و همکاران در سال 2016 گزارش کردند سطح MDA در گروههایی که تستوسترون دریافت کردند کاهش یافت، که نشان میدهد تستوسترون تولید H2O2 را سرکوب کرده و تولید MDA را کاهش داده است (60،17). همچنین در یک مطالعه آزمایشگاهی، مرادیان (1993) نشان داد که تجویز تستوسترون اگزوژن فعالیت پیشاکسیدانی قابلتوجهی ندارد (61). همسو با نتایج ارائه شده توسط شانتس و همکاران در سال 1999 اظهار داشتند که تستوسترون میتواند فشار اکسایشی را در بعضی بافتها القا کند (18). همچنین مطالعه اراضی و همکاران در سال 2017 نشان دادهاند، مصرف طولانی مدت دوزهای بالای AAS باعث افزایش متابولیسم سیتوکروم مونواکسیژناز و اختلال در زنجیره انتقال الکترونی شده که موجب افزایش تولید ROS و فشار اکسایشی میشود (62). از طرفی دوانی- دواری و همکاران در سال 2019 گزارش کردند، تستوسترون میتواند مستقیماً و به طور غیر مستقیم از طریق فعال سازی سیستم رنین- آنژیوتانسین- آلدوسترون و اندوتلین (از طریق افزایش NADPH اکسیداز) باعث ایجاد فشار اکسایشی شود (63). کلیه ها با انجام عملکردهای اساسی از جمله تنظیم مایعات و فشار خون، حذف مواد زائد و جذب مجدد مواد مغذی، نقش اساسی در حفظ سلامت کلی بدن ایفا میکنند (64). مطالعات کمی در مورد اثرات مصرف تستوسترون بر تعادل اکسایشی بافت کلیه انجام شده است. آلوارز و همکاران در سال ۲۰۰۷ گزارش کردند مصرف تستوسترون میتواند مجموعهای از رویدادها را آغاز کند که تعادل دقیق بین فشار اکسایشی و سیستمهای دفاعی آنتیاکسیدانی در سلولهای کلیوی را مختل کند (19). سلولها قادر به تولید بسیاری از آنتیاکسیدانها، مانند: GPX، SOD، CAT و GSH هستند، که بهحفظ هموستاز ردوکس سلولی در طول آسیب بافت اکسیداتیو در بدن کمک میکند (65). بدن دارای یک مکانیسم آنزیمی است که آسیب ناشی از ROS تولید شده در طول فشار اکسایشی را به حداقل میرساند، این امر توسط آنزیمهای آنتیاکسیدانی که بهصورت درونزا تولید میشوند انجام میشود (66) و در نتیجه با خنثی کردن یا ترمیم آسیب اکسایشی از بافتها در برابر اثرات مخرب ROS محافظت میکند (67). بافت کلیه در برابر آسیبهای بافت اکسیداتیو آسیبپذیر هستند، زیرا دارای تعداد زیادی اسیدهای چرب غیراشباع با زنجیره بلند (PUFAs) (2) و همچنین عملکردهای متابولیکی بسیار بالایی هستند که منجربه تولید بیش از حد رادیکالهای آزاد میشود (68). ROS آزاد شده توسط سلولهای کلیه یا حمله ترکیب سمی به کلیه میتواند منجربه آسیب بافت کلیوی شود که به بسیاری از بیماریهای نفرو دژنراتیو کمک میکند (66،69)، این توضیح میدهد که چرا کلیه مستعد ابتلا به بیماری کلیوی مزمن مرتبط با فشار اکسایشی است (70). گزارش شده است که قرار گرفتن در معرض ناندرولون دکانوات (ND) باعث هیپرتروفی در لولههای پیچخورده پروگزیمال و دیستال کلیههای موش میشود. علاوه بر این، هم فعالیت تستوسترون و هم اثر مستقیم ND بر گیرنده آندروژن ممکن است در ایجاد فیبروز کلیه پس از قرار گرفتن طولانی مدت در معرض ND نقش داشته باشند. نشان داده شده است که تجویز طولانیمدت ND در موشها باعث استرس و آسیب اکسیداتیو کلیه وابسته به دوز میشود. کلیههای موشهای تحت درمان با ND افزایش پراکسیداسیون لیپید و کاهش فعالیت آنزیمهای آنتیاکسیدانی مانند: GR و GPX را نشان دادند (58). ROS در کلیه عمدتاً از زنجیره تنفسی میتوکندری و اکسیدازهای NADPH (NOX) منشأ میگیرند (63). آنزیمهای محافظ مانند: SOD و CAT بهعنوان مکانیسمهای دفاعی سلولی برای مقابله با اثرات مضر رادیکالهای آزاد تکامل یافتهاند. گزارش شده است که فشار اکسایشی در انواع بیماریهای کلیوی مانند: گلومرولونفریت و نفریت توبولواینترستیشیال، نارسایی مزمن کلیه، پروتئینوری و اورمی نقش دارد. افراد مبتلا به بیماری کلیوی مرحله نهایی (ESRD) ، که این بیماری بهعنوان نارسایی کلیه نیز شناخته میشود، اغلب افزایش فعالیت پرواکسیدانی همراه با کاهش فعالیت آنتیاکسیدانی را نشان میدهند. بهویژه اکسیدانهای فعال مانند: پراکسی نیتریت (ONOO-) و رادیکالهای هیدروکسیل(OH-) این پتانسیل را دارند که بهطور گستردهای مولکولهای زیستی مانند: لیپیدها،DNA و پروتئین ها را تغییر دهند (71). در پژوهش حاضر کاهش فعالیت SOD و GPX احتمال دارد ناشی از استفاده زیاد آنها برای کاهش ROS باشد و از طرفی بهعلت محدود شدن آنزیمهای آنتیاکسیدانی توسط ROS باشد و ممکن است وضعیت اکسایشی- کاهشی را به سمت فشار اکسایشی تغییر دهد (13). با اینحال، در این پژوهش باید محدودیتهای خاصی را نیز در نظر گرفت. این مطالعه منحصراً بر روی موشهای صحرایی ماده نژاد ویستار، با حجم نمونه نسبتاً کوچک و دوز ثابت تستوسترون انانتات انجام شد، و دوره مداخله به هشت هفته محدود شد. بنابراین، تعمیمپذیری نتایج به سایر جمعیتها یا مدت زمانهای طولانیتر همچنان نامشخص است. علاوه بر این، میتوان به عدم بررسی تغییرات هیستوپاتولوژیک در بافت کلیه اشاره کرد.
نتیجهگیری
بهطور خلاصه، مطالعه ما نشان میدهد که مصرف مکمل تستوسترون انانتات همراه با تمرین مقاومتی سبب افزایش قابلتوجه در سطح فشار اکسایشی و کاهش فعالیت آنزیمهای آنتیاکسیدانی، نسبت به گروههای کنترل و تمرین مقاومتی + دارونما شد. علاوه بر این، انجام تمرین مقاومتی توسط گروه دارونما، سبب تغییر کم در سطح فشار اکسایشی و فعالیت آنزیمهای آنتیاکسیدانی، نسبت به گروه کنترل شد و تأثیر تمرین مقاومتی به لحاظ آماری معنادار نبود. بهطور کلی با توجه به یافتههای پژوهش حاضر، بهنظر میرسد سوءمصرف تستوسترون انانتات همراه با تمرین مقاومتی در موشهای ماده، ممکن است موجب افزایش رادیکالهای آزاد و در نتیجه افزایش فشار اکسایشی و کاهش فعالیت آنزیمهای آنتیاکسیدانی در بافت کلیه شود که موجب کاهش عملکرد سیستم آنتیاکسیدانی و باعث بهم خوردن تعادل آنتیاکسیدانی در بافت کلیه میشود. بدین معنی است که بدن بهطور طبیعی آنتیاکسیدهایی تولید میکند که رادیکالهای آزاد را خنثی میکنند. در پژوهش حاضر، بهنظر میرسد بهدلیل سوءمصرف تستوسترون انانتات، ممکن است این تعادل بهنفع رادیکالهای آزاد بههم خورده باشد، یعنی تولید آنتیاکسیدانها کافی نیست و توانایی بدن برای محافظت از خود در برابر آسیبهای ناشی از رادیکالهای آزاد، کاهش پیدا کرده است و در نتیجه موجب افزایش فشار اکسایشی و کاهش فعالیت آنزیمهای آنتیاکسیدانی میشود. توجه به این نکته مهم است که تحقیقات بیشتری برای بررسی نشانگرهای مولکولی اضافی، ارزیابی اثرات وابسته به دوز، استفاده از آزمودنیهای نر و بررسی قابلیت کاربرد این یافتهها به مدلهای انسانی مورد نیاز است. بهنظر می رسد اطلاعات و آموزش، ابزارهای اساسی برای پیشگیری از سوءمصرف AAS هستند. تا زمانی که سوءمصرف AAS در بین ورزشکاران رایج است، بهتر است کمپینهای اطلاعاتی در مورد AAS و سایر عوامل دوپینگ ایجاد شود. همچنین پیشنهاد میشود، در پژوهشهای آینده برای اطمینان بیشتر از نتایج، بهتراست تغییرات هیستوپاتولوژیکی بافت نیز اندازهگیری شود. بهنظر میرسد روشن کردن تعامل بین سازگاریهای ناشی از ورزش و تعدیل هورمونی میتواند راههای جدیدی را برای استراتژیهای پیشگیرانه و درمانی در پزشکی ورزشی، نفرولوژی و سلامت متابولیک باز کند.
سپاسگزاری
این مقاله بخشی از رساله دکتری فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد اسلامشهر میباشد. از تمام کسانی که ما را در انجام این پژوهش یاری نمودهاند نهایت تشکر و قدردانی را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
کلیه مراحل پژوهش تجربی حاضر بر اساس موازین اخلاقی و اصول راهنمای نگهداری و استفاده از حیوانات آزمایشگاهی منتشر شده توسط موسسه ملی بهداشت (NIH)انجام شد و در کمیته اخلاق در پژوهش، دانشکده پزشکی- دانشگاه علوم پزشکی آزاد اسلامی تهران با کد اخلاق (IR.IAU.TMU.REC.1399.347) مورد تایید قرارگرفته است).
مشارکت نویسندگان
نحوه مشارکت نویسندگان در این پژوهش بدین صورت است؛ خدیجه ملایی: روش شناسی، نرم افزار، پژوهش، گردآوری داده ها، اعتبارسنجی، نگارش، بررسی و ویرایش. ساناز میرزایان شانجانی: نگارش اصلی و ویرایش، بررسی و پژوهش، نظارت. علی گُرزی: پژوهش، روش شناسی، نرم افزار، نظارت، نگارش، بررسی و ویرایش. یاسر کاظم زاده: نظارت، بررسی و ویرایش. عبدالعلی بنائیفر: نظارت، بررسی و ویرایش.
استروئیدهای آنابولیک- آندروژنیک (Anabolic-androgenic steroids; AAS) دستهای از هورمونهای طبیعی و مصنوعی هستند که بهدلیل خواص عضلهسازی و افزایش قدرت در دوزهای بالا و غیردرمانی، بهطور گسترده مورد سوءمصرف قرار میگیرند. تستوسترون هورمون درونزاد اصلی متعلق به این دسته است. این هورمون بهطور گسترده بهصورت درمانی، در اشکال مختلف استری شده، بهعنوان درمان جایگزین در هیپوگنادیسم مردان استفاده میشود (1). AAS را میتوان بهعنوان گروهی از ترکیبات مصنوعی مشابه تستوسترون که بهصورت درونزا در بدن تولید میشوند، توصیف کرد (2). تستوسترون یک هورمون آندروژن است که بهطور طبیعی در مردان و زنان تولید میشود (3). این هورمون برای ارتقای ویژگیهای ثانویه جنسی مردانه و همچنین رشد عضلات و سازگاری عصبی- عضلانی مورد نیاز است (4). یکی از انواع داروهای مورد استفاده در ورزشکاران، تستوسترون انانتات است (3). از بین انواع مشتقات AAS، تستوسترون انانتات یک استروئید طولانیتر است که بهدلیل اثرگذاری مطلوب، در دسترس بودن و قیمت مناسب، یکی از محبوبترین و رایجترین استروئیدها در میان ورزشکاران رشتههای قدرتی و سایر رشتههای ورزشی میباشد. استفاده از تستوسترون انانتات همراه با تمرین مقاومتی میتواند منجربه افزایش حجم و قدرت عضلانی و بهبود عملکرد ورزشی در ورزشکاران شود (5). مطالعه هاندلسمن و همکاران در سال 2018 نشان میدهد مصرف تستوسترون در بین مردان ورزشکار بیشتر است از طرفی مصرف تستوسترون در زنان ورزشکار که تمرین مقاومتی انجام میدهند نیز رو بهافزایش است (6). با اینحال، برخلاف مطالعات بسیاری که اثرات افزایش عملکرد AAS را در ورزشکاران مرد نشان میدهد، اثرات AAS بر عملکرد بدنی در زنان بهطور گسترده مورد مطالعه قرار نگرفته است (7). گزارش شده است که میزان مصرف AAS در مردان ورزشکار۱۰ تا ۱۰۰ برابر بیشتر از دوزهای مصرفی در موارد بالینی است (8). در مورد میزان مصرف زنان ورزشکار اطلاعات دقیقی موجود نیست، اما برخی گزارشها نشان میدهند که برخی از ورزشکاران زن نیز از AAS با دوزهای مشابه با آنچه توسط ورزشکاران مرد استفاده میشود، مصرف میکردند (9). گزارش شده است که سوءمصرف ASS با عوارض جبرانناپذیری مانند: نارسایی قلبی، اختلالات رفتاری و اختلال در عملکرد کلیه و کبد همراه است و همچنین میتواند باعث بیماریهای کبدی و کلیوی مانند: اختلال انعقاد خون، فیبروز کبدی، هیپرتروفی کلیوی و نارسایی کلیوی شود (10). مطالعه کرباسی و همکاران در سال 2017 نشان دادهاند که تستوسترون انانتات با متصل شدن به گیرندههای آندروژنی روی توبولهای کلیوی و سلولهای مزانژیال در موشهای صحرایی نر باعث افزایش فشار اکسایشی میگردد که بدین معنی است که تستوسترون انانات میتواند با تحریک تولید رادیکالهای آزاد یا کاهش توانایی بدن برای خنثیسازی آنها، تعادل بین اکسیدانها و آنتیاکسیدانها را در بافت کلیه مختل کند (5). وقتی بین تولید گونههای اکسیژن فعال (Reactive oxygen species; ROS)، که مولکولهای حاوی اکسیژن بسیار واکنشپذیر هستند و توانایی بدن برای مقابله با اثرات مضر آنها، عدم تعادل ایجاد شود، فشار اکسایشی بهوجود میآید. فشار اکسایشی میتواند به سلولها، پروتئینها، لیپیدها و DNA آسیب برساند و در بیماریهای مختلف و پیری نقش دارد (11). سوپراکسید دیسموتاز (Superoxide dismutase; SOD) و گلوتاتیون پراکسیداز (Glutathione peroxidase; GPX)، آنزیمهای آنتیاکسیدانی هستند که نقش حیاتی در کاهش فشار اکسایشی دارند. SOD تبدیل رادیکالهای سوپراکسید را به پراکسید هیدروژن کاتالیز میکند، در حالیکه GPX با استفاده از گلوتاتیون احیا شده بهعنوان کوفاکتور، به تبدیل پراکسید هیدروژن به آب کمک میکند. این آنزیمها باهم کار میکنند تا ROS را خنثی کرده و از آسیب سلولی جلوگیری کنند (12). مالوندیآلدئید ((Malondialdehyde; MDA، یک نشانگر پراکسیداسیون لیپیدی است که زمانی رخ میدهد که ROS به لیپیدهای غشای سلولی حمله میکند و منجربه آسیب سلولی میشود (13). پراکسیداسیون لیپیدی شامل یک واکنش زنجیرهای است که منجربه تشکیل گونههای لیپیدی فعال از جملهMDA میشود. MDA، در نتیجه تجزیه اسیدهای چرب غیراشباع چندگانه توسط ROS تشکیل میشود (14). اسدی و همکاران در سال 2017 گزارش کردند پراکسیداسیون لیپیدی در غشای سلولی میتواند سیالیت و نفوذپذیری غشاهای سلولی را مختل کرده و به همه سلولها آسیب برساند. در این راستا، افزایش تولید ROS باعث پراکسیداسیون لیپیدی در اسپرم میشود. MDA بهدلیل تجزیه پراکسیدهای اسیدهای چرب غیراشباع تولید میشود. این موضوع یکی از شاخصهای مورد استفاده در مطالعات پراکسیداسیون لیپیدها در انسان و حیوانات بوده است (15). سطوح بالا MDA نشان دهنده افزایش حضور محصولات پراکسیداسیون لیپیدی است که منجربه افزایش فشار اکسایشی ناشی از مصرف مکمل تستوسترون میشود. تستوسترون میتواند با ترویج تولید ROS بر پراکسیداسیون لیپیدی تأثیر بگذارد (16). چوبینه و همکاران در سال 2016 نشان دادند که مطالعات روی تجویز تستوسترون اگزوژن میتواند تحتتأثیر دوز، مدت زمان و مسیر تجویز باشد. بنابراین، مطالعه تنظیم آنتیاکسیدان توسط استروئیدها میتواند به روشن شدن مکانیسمهای مولکولی عملکرد تستوسترون کمک کند. علاوه بر این، این آنزیمهای آنتیاکسیدانی عملکردهای همافزایی دارند. ناهنجاری یکی از آنزیمهای آنتیاکسیدانی میتواند بر فعالیت سایر آنزیمها تأثیر بگذارد. از آنجایی که تستوسترون معمولاً سرعت متابولیسم را بهبود میبخشد، میتوان انتظار داشت که دوز بالای تستوسترون ممکن است در عدم تعادل بین تولید ROS و دفاع آنتیاکسیدانی نقش داشته باشد و باعث افزایش خطر فشار اکسایشی شود (17). در این راستا، چندین محقق گزارش دادهاند که تستوسترون نقش پرواکسیدانی ایفا میکند و میتواند فشار اکسایشی را در بافتهای پستانداران القا کند (17،18). مطالعه آلوارز و همکاران در سال 2007 این فرضیه را مطرح کردهاند که تستوسترون دارای ویژگیهایی است که باعث افزایش اکسیداسیون میشود (19). از سوی دیگر، گزارش شده است که تستوسترون در پروستات انسان و سیستم عصبی موش صحرایی نیز اثر آنتیاکسیدانی دارد. در نتیجه، این نتایج نشان میدهند که خاصیت پرواکسیدانی تستوسترون میتواند وابسته به بافت و جنس باشد. در این راستا، بیضهها عمدتاً بهدلیل فعالیت آنتیاکسیدانی تستوسترون، مستعد آسیب ناشی از ROS هستند (17). ارتباط بین فشار اکسایشی و بیماریهای کلیوی از اهمیت قابلتوجهی برخوردار است. کلیهها اندامهای حیاتی مسئول تصفیه خون، تنظیم تعادل آب و الکترولیت، حفظ PH خون و دفع مواد زائد و سموم هستند (20). این عملکردها منجربه تولید مقدار قابلتوجهی از آنتیاکسیدانها و رادیکالهای آزاد در کلیهها میشود. اگر تعادل بین تولید آنتیاکسیدان و تولید رادیکالهای آزاد مختل شود، میتواند به فشار اکسایشی کمک کند (21). فشار اکسایشی در کلیهها با ایجاد و پیشرفت اختلالات کلیوی مختلف از جمله بیماری مزمن کلیه (Chronic Kidney Disease; CKD)، نفریت (التهاب کلیه) و آسیب کلیه مرتبط است. آسیب اکسیداتیو ناشی از رادیکالهای آزاد میتواند عملکرد کلیه را مختل کند، التهاب را تقویت کند و به آسیب بافتی کمک کند و در نهایت شرایط کلیوی را تشدید کند (22). مطالعه فیلهو و همکاران در سال 2020، تستوسترون اگزوژن را با کاهش میزان فیلتراسیون گلومرولی، پروتئینوری، آسیب توبولی و افزایش فشار اکسایشی در بافت کلیه مرتبط دانستهاند، که نشان دهنده پتانسیل نفروتوکسیک است که توجه را میطلبد (23). در کلیه، فشار اکسایشی میتواند اثرات مضری بر عملکرد کلیه داشته باشد و بهایجاد بیماریهای کلیوی مختلف مانند: نفروپاتی دیابتی، نفروپاتی فشار خون بالا و گلومرولونفریت کمک کند (24). نفروپاتی دیابتی یکی از بیماریهای کلیوی شایع است که بهطور مستقیم به افزایش فشار اکسایشی و ایجاد ROS در سلولهای کلیه ارتباط دارد. در این بیماری، افزایش گلوکز خون باعث تولید ROS در سلولهای کلیه میشود، که منجربه تخریب سلولهای کلیه و تغییرات ساختاری در این اندام میشود. بیماران مبتلا به نفروپاتی فشار خون بالا نیز در معرض فشار اکسایشی زیادی قرار دارند. افزایش فشار خون باعث فشار اضافی بر روی عروق کلیه میشود و منجربه تخریب ادمینالهای کلیه میشود که در نهایت به کاهش عملکرد کلیه منجر میشود. گلومرولونفریت یک دسته از بیماریهای کلیوی است که تحتتأثیر فشار اکسایشی قرار میگیرند. در این بیماری، التهاب در عروق خونی کلیه ایجاد میشود که میتواند به تخریب گلومرولها و کاهش عملکرد کلیه منجر شود. بنابراین، تنظیم و کاهش فشار اکسایشی در کلیهها و محافظت از آنها از طریق آنزیمهای آنتیاکسیدانی مانند: GPX، کاتالاز (CAT) و SOD بسیار اهمیت دارد (25). SOD یک آنزیم آنتیاکسیدانی مهم در کلیه است که آنیون سوپراکسید را به پراکسید هیدروژن تبدیل میکند و سپس توسط GPX سمزدایی میشود. کاهش فعالیت SOD و GPX، یا افزایش پراکسیداسیون لیپیدی، همانطور که با سطوح بالا MDA نشان داده میشود، نشانگرهای رایج فشار اکسایشی در کلیه هستند (26). بهدرستی ثابت شده است اتخاذ شیوههای مناسب زندگی از جمله انجام فعالیت ورزشی منظم سبب حفظ سلامتی در برابر بیماریهای مزمن میشود. در واقع فعالیتهای هوازی ظرفیت سازگاری بیوشیمیایی و متابولیکی بافتهای بدن را در مقابل شرایط فشارزا افزایش میدهند. از فعالیتهای هوازی بهعنوان عامل کاهش سطوح پراکسیداسیون لیپیدی جوانان و افراد مسن یاد شده است، در این رابطه هنوز نتایج متناقضی وجود دارد. بعضی از محققان عدم تغییر یا افزایش میزان MDA متعاقب تمرینات هوازی را بهمدت زمان این تمرینات مربوط میدانند (27). گومز و همکاران در سال 2016 گزارش کردند، استفاده از AAS عمدتاً با انجام فعالیتهای بدنی با شدت بالا و کوتاه مدت، با اضافه وزن بیش از ظرفیت هوازی عضلات مرتبط است. بسته به نوع تمرین، بار، فراوانی، مدت و شدت تمرین ممکن است اثرات مفید یا مضری در اندامها ایجاد کند (28). در مطالعهای که سادوسکا و همکارانش در سال 2017 انجام دادند، تأثیر تستوسترون انانتات همراه با تمرین استقامتی بر فشار اکسایشی را بررسی کردهاند. آنها دریافتند که تستوسترون انانتات تولید ROS و پراکسیداسیون لیپیدی را در بافت کبد موشها افزایش میدهد که نشان دهنده افزایش فشار اکسایشی است (24). هم¬چنین لیو و همکاران در سال 2023 نشان دادند مصرف هشت هفته تستوسترون انانتات و تمرین مقاومتی منجربه کاهش معنیدار SOD و GPX و افزایش معنیدار MDA در بافت رحم موشها گردید (26). در مورد ورزشکاران زنی که در فرآیند تمرینات استقامتی از تستوسترون استفاده میکنند، کلیهها با چالشهای منحصربهفردی روبهرو هستند. هاکنی و همکاران در سال ۲۰۲۰ گزارش کردند تمرینات استقامتی با شدت بالا میتواند مصرف اکسیژن و متابولیسم را افزایش داده و در نتیجه منجربه افزایش تولید ROS شود. هنگامیکه افزایش فشار اکسایشی بهعلت مصرف تستوسترون نیز به این فرآیند اضافه شود، ممکن است کلیهها با خطر آسیب اکسیداتیو بیشتری روبهرو شوند (29). بهنظر میرسد استفاده بیرویه از AAS توسط ورزشکاران ممکن است منجربه آسیبهای جبرانناپذیری در عملکرد فیزیولوژیک بسیاری از اندامها بهویژه کلیه شود. با توجه به وجود مطالعات اندک و نیاز به پژوهشهای بیشتر در این زمینه، میتواند بهافزایش اطلاعات و پیشگیری از آسیبهای کلیوی در این قشر جامعه منجر شود و همچنین مصرف رو بهافزایش استفاده از AAS در ورزشکاران زن و عدم وجود مطالعهای در مورد تأثیر همزمان تمرین مقاومتی با این شدت و مدت تمرین و مصرف تستوسترون انانتات بر روی بافت کلیه، مطالعه حاضر با هدف بررسی تأثیر هشت هفته تمرین مقاومتی و مصرف تستوسترون انانتات بر تعادل آنتیاکسیدانی در بافت کلیه موشهای صحرایی ماده نژاد ویستار میباشد.
روش بررسی
در این پژوهش تجربی 24 سر موش صحرایی ماده نژاد ویستار با سن هشت هفته و وزن 14/17±208/22 گرم از انستیتو پاستور (ایران) خریداری شد. ابتدا از بین موشهای صحرایی ماده، آزمودنیهایی که کاملاً سالم بودند و توانایی انجام فعالیت بدنی را داشتند، که این موارد از معیارهای ورود نمونهها در این پژوهش بود، بهعنوان نمونه آماری انتخاب شدند. همچنین مشاهده مشکلات ظاهری مانند: اختلال در حفظ تعادل، عدم توانایی انجام تمرین و سن موشها از هشت هفته بیشتر باشد از معیارهای خروج نمونهها در این پژوهش بود. در طول مدت پژوهش، حیوانات در قفسههای پلیکربنات شفاف، تولید شده در شرکت رازیراد با قابلیت شستوشو و در شرایط استاندارد (رطوبت 5±45 درصد و چرخه نور/ تاریکی ۱۲:۱۲ ساعت و دمای 2±۲2 درجه سانتیگراد) نگهداری شدند. در این پژوهش آب و غذا به اندازه کافی در اختیار حیوانات گذاشته شد و آنها بهطور آزادانه به آن دسترسی داشتند. برای اطمینان از شرایط محیطی مناسب و حفظ رطوبت دما و تهویه مناسب از دستگاه تهویه هوا و از دماسنج و رطوبتسنج برای پایش تغییرات شبانهروزی دما و رطوبت استفاده شد. در ابتدا بهمنظور آشناسازی حیوانات با شرایط آزمایشگاه، تمرینات بهمدت یک هفته با بالا رفتن از نردبان مخصوص تمرینات مقاومتی جوندگان انجام شد. سپس موشها بهطور تصادفی به سه گروه، شامل: 1) گروه کنترل (تعداد=8)، 2) گروه تمرین مقاومتی + دارونما (تعداد=8)، و 3) گروه تمرین مقاومتی + تستوسترون انانتات (تعداد=8) تقسیم شدند. گروههای تمرین مقاومتی + دارونما و تمرین مقاومتی + تستوسترون انانتات بهمدت هشت هفته، پنج روز در هفته تمرین مقاومتی و همچنین سه روز در هفته مصرف روغن زیتون (دارونما) و تستوسترون انانتات داشتند. گروه کنترل نیز جهت تجربه شرایط موجود و همسان¬سازی دریافت استرس ناشی از مواجهه با آزمون¬گر، در محل تمرینات حضور داشتند. لازم بهذکر است که گروه کنترل، تمرین مقاومتی و مصرف تستوسترون انانتات نداشتند. در پژوهش حاضر پروتکل تمرین، شامل برنامه هشت هفته ای تمرین مقاومتی، پنج روز تمرین و دو روز استراحت در هفته (چهار نوبت شش تایی با استراحت ۶۰ الی 120 ثانیه) بهصورت صعود از نردبان عمودی ۱ متری با ۲۶ پله و بستن وزنه به دم حیوانات، که وزنهها در هفته اول با 40 درصد وزن بدن موشها شروع شد، و هر هفته 20 درصد وزن بدن به وزنهها اضافه میشد. در هفته پنجم، بهمنظور جلوگیری از بیشتمرینی و همچنین ایجاد فرصت بازیافت مناسب به حیوانات جهت اجرای تمرینات سنگین در سه هفته پایانی، شدت تمرین با شدت هفته سوم انجام شد. بهطوری که در هفته پنجم، یک هفته کاهش بار یعنی 20 درصد نسبت به هفته قبل داشتیم، اما در هفته ششم 40 درصد وزن بدن موشها به حجم کار اضافه شد. در هفته هفتم و هشتم، 20 درصد وزن بدن موشها به بار در هفته اضافه شد (جدول1) و دو جلسه در هفته وزنکِشی انجام شد. برنامه تمرینی با اندکی تغییر از منبع معتبر اخذ شده می باشد (30). همچنین به منظور تحریک موش¬ها برای صعود از نردبان از شرطی کردن آنها برای رسیدن به غذا بالای نردبان استفاده شد. در این پژوهش هرگز از تقویت کنندههای منفی مانند: شوک الکتریکی، پمپ فشار هوا و... استفاده نشد و فقط از تحریک دستی و تکان دادن دم حیوانات جهت اجرای تمرینات استفاده شد (31). موشهای گروه تمرین مقاومتی + تستوسترون انانتات بهمیزان ۲۰ میلیگرم به¬ازای هر کیلوگرم از وزن بدن، تستوسترون انانتات (ساخت شرکت ایرانهورمون، با شماره سریال ۰۰۶۹) را بهصورت تزریق عضلانی (32) و همچنین گروه تمرین مقاومتی + دارونما، روغن زیتون را بهعنوان دارونما، سه روز در هفته دریافت نمودند (33). پس از انجام پروتکل پژوهش بهمنظور از بین بردن اثرات حاد تمرین، ۴۸ ساعت بعد از آخرین جلسه تمرین مقاومتی و مصرف تستوسترون انانتات، حیوانات پس از ۱2 ساعت ناشتایی با ترکیب زایلازین (سه تا پنج میلیگرم به ازای هر کیلوگرم از وزن بدن) و کتامین (سی تا پنجاه میلیگرم بهازای هر کیلوگرم از وزن بدن) بیهوش شدند. سپس طبق یک جدول زمانی از پیش تعیین شده، در زمان تشریح برای جلوگیری از تداخل اثر زمان تشریح (ریتم شبانهروزی) بر میزان هورمونها و...، گروههای کنترل، تمرین مقاومتی + دارونما و تمرین مقاومتی + تستوسترون انانتات بهصورت متناوب از گروههای متفاوت تشریح شدند (34)، سپس بافت کلیه حیوانات بهسرعت برداشته شد و در سرم فیزیولوژیک شستوشو داده شدند. نمونههای جمعآوری شده بهسرعت در میکروتیوپهای مخصوص آزمایشگاه قرار داده شدند، سپس بلافاصله با استفاده از نیتروژن مایع در دمای 196- درجه سانتیگراد منجمد شده و ضمن انتقال به آزمایشگاه برای سنجش متغیرهای پژوهش در یخچال با دمای ۸۰- درجه سانتیگراد نگهداری شدند.
فعالیت متغیرهای وابسته شامل: SOD، GPX و MDA به روش اسپکتروفتومتری بدین طریق اندازهگیری شدند؛ برای اندازهگیری میزان MDA از محلول هموژن خالص استفاده شد. اندازهگیری میزان MDA مطابق روش گزارش شده توسط (Kaya and Sezik et al.,2004) و با اندکی تغییر بهطور خلاصه بدین صورت انجام شد؛ اساس روش اندازهگیری MDA بافتی بر پایه واکنش با تیوباربیتوریک اسید (TBA)، استخراج با بوتانل نرمال، اندازهگیری جذب با روش اسپکتروفتومتری و مقایسه جذب با منحنی استاندارد میباشد و نتایج بهصورت nmol/mg protein بیان گردید (35). اندازهگیری میزان فعالیت آنزیم SOD بر روی محلول رویی تهیه شده از هموژن خالص بافت کلیه با استفاده از کیت Randox Laboratories Ltd, UK)) RANSOD ساخت کشور انگلستان محاسبه شد و بر اساس روش (Paoletti and Aldinucci et al.,1986) انجام گردید. فعالیت SOD در طول موج 505 نانومتر از طریق طیفسنجی محلول رویی اندازهگیری شد و نتایج بهصورت U/mg protein بیان گردید (36). برای اندازهگیری میزان فعالیت آنزیم GPX از محلول هموژن خالص استفاده شد. میزان فعالیت آنزیم GPX با استفاده از کیت ((RandoxLaboratories Ltd, Crumlin, UK RANSEL ساخت کشور انگلستان محاسبه گردید و بر اساس روش (Paglia and Valentine,1967) انجام شد و نتایج بهصورت U/mg protein بیان گردید (37).
تجزیه و تحلیل آماری
نرمال بودن توزیع دادهها با استفاده از آزمون شاپیرو- ویلک و همگنی واریانسها با استفاده از آزمون لِوِن بررسی و تأیید گردید. سپس از آزمون تحلیل واریانس یکراهه یا آنوا برای بررسی تفاوت بینگروهی استفاده شد. در ادامه برای تعیین محل تفاوت بینگروهی از آزمون تعقیبی بونفرونی استفاده شد. تمامی تحلیلهای آماری با نرم¬افزارversion 16 SPSS در سطح معناداری 0/05>P انجام گردید. نمودارها با استفاده از نرمافزارGraphPad Prism (9.4.0.673) ترسیم شدند.
نتایج
جدول 2 میانگین و انحراف استاندارد میزان فعالیت GPX، SOD و MDA موشهای ماده برای سه گروه کنترل، تمرین مقاومتی + دارونما و تمرین مقاومتی + تستوسترون انانتات را نشان میدهد. در این جدول همچنین نتایج مقایسه میانگین گروهها با استفاده از آزمونهای آنوا و تعقیبی بونفرونی نمایش داده شده است. نتایج آزمون تحلیل واریانس یکراهه نشان داد تفاوت معنیداری در میزان MDA در گروههای پژوهش وجود دارد (F(2,8)=68/470,P<0/0001 ). نتایج آزمون تعقیبی بونفرونی نشان داد میزان MDA در گروه تمرین مقاومتی + تستوسترون انانتات بهطور معنیداری بیشتر از گروههای کنترل (Mean Diff.(j-i)=0/702,P<0/0001) و تمرین مقاومتی + دارونما (Mean Diff.(j-i)=0/732,P<0/0001) بود؛ اما تفاوت معنیداری در میزان MDA گروههای کنترل و تمرین مقاومتی + دارونما مشاهده نشد (Mean Diff.(j-i)=-0/030,P>0/999) (شکل 1). نتایج آزمون تحلیل واریانس یکراهه نشان داد تفاوت معنیداری در میزان فعالیت SOD در گروههای پژوهش وجود دارد (F(2,8)=35/767,P<0/0001 ).نتایج آزمون تعقیبی نشان داد میزان فعالیت SOD در گروه تمرین مقاومتی + تستوسترون انانتات بهطور معنیداری کمتر از گروههای کنترل (Mean Diff.(j-i)=-3/24,P<0/0001) و تمرین مقاومتی + دارونما (Mean Diff.(j-i)=-3/45,P<0/0001) بود؛ اما تفاوت معنیداری در میزان فعالیت SOD گروههای کنترل و تمرین مقاومتی + دارونما مشاهده نشد (Mean Diff.(j-i)=0/21,P<0/999)(شکل 2). نتایج آزمون تحلیل واریانس یکراهه نشان داد تفاوت معنیداری در میزان فعالیت GPX در گروههای پژوهش وجود دارد (F(2,8)=28/968,P<0/0001 ). نتایج آزمون تعقیبی بونفرونی نشان داد میزان فعالیت GPX در گروه تمرین مقاومتی + تستوسترون انانتات به¬طور معنی¬داری کمتر از گروه-های کنترل(Mean Diff.(j-i)=-0/98,P<0/0001) و تمرین مقاومتی + دارونما (Mean Diff.(j-i)=-1/11,P<0/0001) بود؛ اما تفاوت معنی¬داری در میزان فعالیت GPX گروه¬های کنترل و تمرین مقاومتی + دارونما مشاهده نشد(Mean Diff.(j-i)=0/13,P<0/999) (شکل 3).
جدول1. پروتکل تمرین مقاومتی
.JPG)
جدول 2: میانگین و انحراف معیار میزان فعالیت GPX ، SOD و MDA موشهای ماده در گروههای پژوهش
.JPG)
MDA: مالون دیآلدئید؛ SOD: سوپراکسید دیسموتاز؛ GPX: گلوتاتیون پراکسیداز
a مقادیر بهصورت انحراف استاندارد ± میانگین نشان داده شدهاند.
b P<0/0001، اختلاف معنادار میانگین سه گروه (آزمون تحلیل واریانس یکراهه).
c P<0/0001، تمرین مقاومتی + تستوسترون انانتات درمقابل کنترل (آزمون تعقیبی بونفرونی).
d P<0/001 و e P<0/0001، تمرین مقاومتی + تستوسترون انانتات درمقابل تمرین مقاومتی + دارونما (آزمون تعقیبی بونفرونی).
.JPG)
شکل1: مقایسه تغییرات مقادیر MDA در بافت کلیه موشهای ماده در گروههای پژوهش
****: (P<0/0001 تفاوت معنیدار با استفاده از آزمون تعقیبی بونفرونی

شکل2: مقایسه تغییرات مقادیر SOD در بافت کلیه موشهای ماده در گروههای پژوهش
****: (P<0/0001) تفاوت معنیدار با استفاده از آزمون تعقیبی بونفرونی

شکل3: مقایسه تغییرات مقادیر GPX در بافت کلیه موش¬های ماده در گروه¬های پژوهش
****: (P<0/0001) تفاوت معنی¬دار با استفاده از آزمون تعقیبی بونفرونی
بحث
هدف از پژوهش حاضر بررسی تأثیر هشت هفته تمرین مقاومتی بههمراه مصرف تستوسترون انانتات بر سطوح MDA، SOD و GPX در بافت کلیه موشهای صحرایی ماده نژاد ویستار میباشد. یافتههای پژوهش حاضر نشان داد که هشت هفته تمرین مقاومتی موجب افزایش معنیدار میزان MDA در گروه تمرین مقاومتی + تستوسترون انانتات نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما شد؛ اما تأثیر معنیداری در میزان MDA گروه¬های کنترل و تمرین مقاومتی + دارونما نداشت. همچنین موجب کاهش معنیدار میزان فعالیت SOD در گروه تمرین مقاومتی + تستوسترون انانتات نسبت به گروههای کنترل و تمرین مقاومتی + دارونما شد؛ اما تأثیر معنیداری در میزان فعالیت SOD گروه¬های کنترل و تمرین مقاومتی + دارونما نداشت. علاوه بر این، هشت هفته تمرین مقاومتی موجب کاهش معنی¬دار میزان فعالیت GPX در گروه تمرین مقاومتی + تستوسترون انانتات نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما شد؛ اما تأثیر معنی¬داری در میزان فعالیت GPX گروه¬های کنترل و تمرین مقاومتی + دارونما نداشت.
در این مطالعه تمرین مقاومتی بهتنهایی بر میزان فشار اکسایشی و فعالیت آنزیمهای آنتیاکسیدانی تأثیر نداشت. تیروپاتی و همکاران در سال 2021 گزارش کردند نوع ورزش عامل مهمی برای القای آسیب اکسایشی است، زیرا شدت زیاد دوچرخهسواری آسیب اکسایشی را کاهش میدهد و آنتیاکسیدانهای آنزیمی را افزایش میدهد (38)؛ اما همان شدت با ورزش سرعتی باعث افزایش آسیب اکسایشی میشود (39). بهطور مشابه، تمرینات مقاومتی مانند تمرین مقاومتی دایرهای آسیب اکسایشی را کاهش داده و سطح آنتیاکسیدان را در مقایسه با تمرین مقاومتی سنتی بهبود میبخشد، که نشان میدهد نوع تمرین همراه با حجم کل تمرین برای فشار اکسایشی ناشی از تمرین مهم است (40). از طرفی پارکر و همکاران در سال 2014 نشان دادهاند که حجم تمرین برای تخلیه آنتیاکسیدانها و افزایش فشار اکسایشی کافی نیست (41). تفاوت بین این مطالعات بهدلیل مدت زمان پروتکل تمرین، حالت تمرین و نشانگرهای آسیب اکسایشی تجزیه و تحلیل شده است. همسو با پژوهش حاضر، غیاثی و همکاران در سال ۲۰۱۵ گزارش کردند چهار ماه تمرین مقاومتی منجربه تغییر معناداری بر SOD بافت قلب موشها نشد (42). از طرفی مطالعه ارجمند و همکاران در سال ۲۰۲0 نشان داد هشت هفته تمرین مقاومتی باعث کاهش سطوح MDA بافت قلب موشها میشود (43). همچنین تمرین مقاومتی با شدت بالا کاهش GPX را در زنان وزنهبردار در پی دارد (44). بهنظر میرسد از دلایل تفاوت نتایج مطالعه حاضر با سایر مطالعات ممکن است بهعلت تفاوت شدت و مدت زمان تمرین باشد (45). فعالیت ورزشی با شدت بالا میتواند منجر به افزایش تولید ROS و در نتیجه تضعیف سیستم آنتیاکسیدانی شود (46). همسو با مطالعه ریزو و همکاران در سال ۲۰۱4 گزارش کردند مصرف AAS همراه با فعالیت بدنی با شدت بالا باعث کاهش فعالیت آنزیمهای آنتیاکسیدانی گلوتاتیون ردوکتاز (GR) و GPX میشود که باعث کاهش توانایی حذف رادیکالهای آزاد در کلیه میگردد (47). همسو با پژوهشی دیگر نشان داده شد که مصرف دوزهای بالای تستوسترون انانتات در موشها همراه با تمرین استقامتی باعث کاهش فعالیت SOD شده که میتواند به سیستم دفاعی و آنتیاکسیدانی آسیب برساند (48). از سوی دیگر، گزارش شده است که علت کاهش فعالیت آنزیمهای آنتیاکسیدانی، برهم خوردن ردوکس (اکسیدان- آنتیاکسیدان) میباشد، به این دلیل که تمرین مقاومتی با شدت بالا و یا در کوتاه مدت که بدن به سازگاری نرسیده است از طریق مکانیسمهایی مثل: تغییر هموستاز کلسیم، مسیر گزانتیناکسیداز، افزایش تولید رادیکالهای آزاد را در پی دارد که با توجه به افزایش تدریجی شدت تمرین در این پژوهش دلیل بهدست آمدن این نتایج میباشد (49). همسو با پژوهش حاضر، مطالعه گُرزی و اکرادی در سال 2020 نشان دادند که هشت هفته تمرین استقامتی شدید سبب کاهش معنادار فعالیت آنزیم آنتیاکسیدانی GPX و افزایش سطوح MDA در بافتهای کبد و قلب که نشاندهنده کاهش ظرفیت آنتیاکسیدانی و افزایش میزان فشار اکسایشیاند، شد؛ اگرچه تغییر نکردن این شاخصها در عضله اسکلتی نشاندهنده تفاوت پاسخها و سازگاریهای انواع بافتها به یک پروتکل تمرینی واحد است. بهنظر میرسد فعالیتهای ورزشی میتوانند همانند یک چاقوی دولبه عمل کنند! تمرین و فعالیت ورزشی، همانطور که تولید رادیکالهای آزاد آسیبرسان به مولکولهای بدن را از منابع گوناگون افزایش میدهد، بههمان نحو نیز قادر به بهبود دستگاه دفاع آنتیاکسیدانی میباشد (34).
یافته مهم پژوهش حاضر این است که مصرف هشت هفته تستوسترون انانتات بههمراه تمرین مقاومتی منجربه کاهش معنادار سطوحSOD و GPX نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما میشود. علاوه بر این، تستوسترون انانتات همراه با تمرین مقاومتی باعث افزایش معنادار سطوح MDA نسبت به گروه¬های کنترل و تمرین مقاومتی + دارونما میگردد، که این نشان میدهد مصرف تستوسترون انانتات همراه با تمرین مقاومتی باعث کاهش فعالیت آنزیمهای آنتیاکسیدانی و افزایش فشار اکسایشی نسبت به گروه¬های تمرین مقاومتی + دارونما و کنترل شده است، که همسو با یافتههای الچدوری و همکاران در سال 2019 گزارش کردند بهطور همزمان، درمان با تستوسترون و ورزش اثر همافزایی بر سطح آنزیمهای آنتیاکسیدانی در موشهای دیابتی و دیابتی اخته شده داشت. در حیوانات اخته شده مبتلا به دیابت، فعالیت SOD، GPX و CAT بهطور معناداری کاهش و سطح MDA بهطور معناداری در خون و بافت قلب افزایش یافت (50). تستوسترون از طریق اتصال به گیرندههای آندروژن واقع در سیتوپلاسم یا هسته، اثرات خود را بر سلولها اعمال میکند. پس از اتصال، کمپلکسهای گیرنده تستوسترون به هسته منتقل میشوند و بیان ژن را با تعامل با توالیهای DNA خاصی که بهعنوان عناصر پاسخ آندروژن (AREs)موجود در نواحی پروموتر ژنهای هدف شناخته میشوند، تعدیل میکند (51). در مورد آنزیمهای آنتیاکسیدانی، تستوسترون ممکن است مستقیمأ بر سطح بیان ژن آنها تأثیر بگذارد. برای مثال، کمپلکسهای گیرنده تستوسترون میتوانند به AREها در نواحی پروموتر ژنهای کدکننده GPX و SOD متصل شوند. این تعامل میتواند رونویسی این ژنها را تقویت یا سرکوب کند و در نتیجه بر تولید آنزیمهای GPX و SOD تأثیر بگذارد (52). تغییرات در سطح تستوسترون ممکن است بر سنتز یا جذب گلوتاتیون (GSH) تأثیر بگذارد و در نتیجه فعالیت GPX را تعدیل کند. علاوه بر این، تستوسترون ممکن است با مسیرهای سیگنالدهی درگیر در تنظیم آنزیم آنتیاکسیدانی تعامل داشته باشد. تستوسترون میتواند آبشارهای سیگنالینگ مانند: پروتئینکیناز B (Akt) و شاخص هستهای اریتروئید2 مربوط به فاکتور2 (Nrf2) را فعال کند که نقش کلیدی در دفاع آنتیاکسیدانی دارند (51). این مسیرها میتوانند بیان یا فعالیت آنزیمهای آنتیاکسیدانی از جمله GPX و SOD را تحریک کنند (16،53). همچنین تنکورانج و همکاران در سال ۲۰۱۹ نشان دادند تستوسترون که از طریق گیرنده آندروژن خود عمل میکند، میتواند تولید ROS را در سلولها القا کند. این پدیده به فعال شدن NADPH اکسیداز، یک کمپلکس آنزیمی متصل به غشاء و مسئول تولید ROS نسبت داده میشود. افزایش سطح ROS میتواند دفاع آنتیاکسیدانی درونزا را تحتتأثیر قرار دهد و منجربه فشار اکسایشی و اختلال در عملکرد آنزیمهای مهم مانند: GPX و SOD شود (54). کاهش مشاهده شده در سطوح GPX و SOD در موشهای مصرفکننده تستوسترون ممکن است به سازوکارهای متعدد نسبت داده شود. تستوسترون میتواند بیان ژنهای مرتبط با آنزیمهای آنتیاکسیدانی را تعدیل کند و بهطور بالقوه تولید آنها را کاهش دهد. علاوه بر این، تأثیر تستوسترون بر میتوکندری میتواند منجربه افزایش نشت الکترون در طول فسفوریلاسیون فشار اکسایشی شود و به تولید ROS کمک کند که همراه با کاهش بالقوه فعالیت آنزیم آنتیاکسیدانی است. میتوکندری، میتواند توانایی سلول را برای خنثی کردن ROS تضعیف کند و منجربه کاهش کلی در سطوح GPX و SOD شود (55). در پژوهش حاضر علاوه بر کاهش سطح آنزیم آنتیاکسیدان، افزایش قابلتوجهی در سطح MDA در موشهای مصرفکننده تستوسترون انانتات مشاهده شد که همسو با مطالعه آیدیلک و همکاران در سال 2004 نشان دادند شش هفته مصرف تستوسترون باعث افزایش معنادار MDA بافت کبد موشهای ماده مصرفکننده تستوسترون میشود (16). همسو با مطالعه اوزبک و همکاران در سال 2012 گزارش کردند افزایشی در سطح MDA در گروههای تحت درمان با تستوسترون وجود داشت که نشان میدهد آسیبهای اکسایشی کلیوی ناشی از AAS زنجیره لیپیدی را در بافت کلیه هدف قرار میدهد و منجر به انحلال اجزای لیپیدی بافت کلیه میشود (56). که همسو با یافتههای فرانکنفلد و همکاران در سال 2014 و آلبانو و همکاران در سال 2021 است که گزارش کردند مصرف مداوم تستوسترون، سازوکار آنتیاکسیدانی درونزا را مختل میکند که باید تنظیم شده باشد و MDA واسطه از بین بردن فشار اکسایشی است (57،58). افزایش همزمان سطح MDA در گروه تستوسترون و تمرین مقاومتی بر عدم تعادل بین تولید ROS و دفاع آنتیاکسیدانی تأکید میکند. تأثیر تستوسترون بر متابولیسم لیپید، بهویژه فعال شدن مسیرهای لیپولیتیک، میتواند منجربه افزایش ترشح اسیدهای چرب شود. این اسیدهای چرب مستعد اکسیداسیون، تولید پراکسیدهای لیپیدی و در نهایت MDA هستند که محصول پراکسیداسیون لیپیدی است. سطوح بالا MDA نشاندهنده روند مداوم آسیب اکسایشی به غشاهای سلولی است که میتواند یکپارچگی و عملکرد سلولی را بهخطر بیندازد (59). ناهمسو با مطالعه حاضر، یافتههای پلتولا و همکاران در سال 1996 و چوبینه و همکاران در سال 2016 گزارش کردند سطح MDA در گروههایی که تستوسترون دریافت کردند کاهش یافت، که نشان میدهد تستوسترون تولید H2O2 را سرکوب کرده و تولید MDA را کاهش داده است (60،17). همچنین در یک مطالعه آزمایشگاهی، مرادیان (1993) نشان داد که تجویز تستوسترون اگزوژن فعالیت پیشاکسیدانی قابلتوجهی ندارد (61). همسو با نتایج ارائه شده توسط شانتس و همکاران در سال 1999 اظهار داشتند که تستوسترون میتواند فشار اکسایشی را در بعضی بافتها القا کند (18). همچنین مطالعه اراضی و همکاران در سال 2017 نشان دادهاند، مصرف طولانی مدت دوزهای بالای AAS باعث افزایش متابولیسم سیتوکروم مونواکسیژناز و اختلال در زنجیره انتقال الکترونی شده که موجب افزایش تولید ROS و فشار اکسایشی میشود (62). از طرفی دوانی- دواری و همکاران در سال 2019 گزارش کردند، تستوسترون میتواند مستقیماً و به طور غیر مستقیم از طریق فعال سازی سیستم رنین- آنژیوتانسین- آلدوسترون و اندوتلین (از طریق افزایش NADPH اکسیداز) باعث ایجاد فشار اکسایشی شود (63). کلیه ها با انجام عملکردهای اساسی از جمله تنظیم مایعات و فشار خون، حذف مواد زائد و جذب مجدد مواد مغذی، نقش اساسی در حفظ سلامت کلی بدن ایفا میکنند (64). مطالعات کمی در مورد اثرات مصرف تستوسترون بر تعادل اکسایشی بافت کلیه انجام شده است. آلوارز و همکاران در سال ۲۰۰۷ گزارش کردند مصرف تستوسترون میتواند مجموعهای از رویدادها را آغاز کند که تعادل دقیق بین فشار اکسایشی و سیستمهای دفاعی آنتیاکسیدانی در سلولهای کلیوی را مختل کند (19). سلولها قادر به تولید بسیاری از آنتیاکسیدانها، مانند: GPX، SOD، CAT و GSH هستند، که بهحفظ هموستاز ردوکس سلولی در طول آسیب بافت اکسیداتیو در بدن کمک میکند (65). بدن دارای یک مکانیسم آنزیمی است که آسیب ناشی از ROS تولید شده در طول فشار اکسایشی را به حداقل میرساند، این امر توسط آنزیمهای آنتیاکسیدانی که بهصورت درونزا تولید میشوند انجام میشود (66) و در نتیجه با خنثی کردن یا ترمیم آسیب اکسایشی از بافتها در برابر اثرات مخرب ROS محافظت میکند (67). بافت کلیه در برابر آسیبهای بافت اکسیداتیو آسیبپذیر هستند، زیرا دارای تعداد زیادی اسیدهای چرب غیراشباع با زنجیره بلند (PUFAs) (2) و همچنین عملکردهای متابولیکی بسیار بالایی هستند که منجربه تولید بیش از حد رادیکالهای آزاد میشود (68). ROS آزاد شده توسط سلولهای کلیه یا حمله ترکیب سمی به کلیه میتواند منجربه آسیب بافت کلیوی شود که به بسیاری از بیماریهای نفرو دژنراتیو کمک میکند (66،69)، این توضیح میدهد که چرا کلیه مستعد ابتلا به بیماری کلیوی مزمن مرتبط با فشار اکسایشی است (70). گزارش شده است که قرار گرفتن در معرض ناندرولون دکانوات (ND) باعث هیپرتروفی در لولههای پیچخورده پروگزیمال و دیستال کلیههای موش میشود. علاوه بر این، هم فعالیت تستوسترون و هم اثر مستقیم ND بر گیرنده آندروژن ممکن است در ایجاد فیبروز کلیه پس از قرار گرفتن طولانی مدت در معرض ND نقش داشته باشند. نشان داده شده است که تجویز طولانیمدت ND در موشها باعث استرس و آسیب اکسیداتیو کلیه وابسته به دوز میشود. کلیههای موشهای تحت درمان با ND افزایش پراکسیداسیون لیپید و کاهش فعالیت آنزیمهای آنتیاکسیدانی مانند: GR و GPX را نشان دادند (58). ROS در کلیه عمدتاً از زنجیره تنفسی میتوکندری و اکسیدازهای NADPH (NOX) منشأ میگیرند (63). آنزیمهای محافظ مانند: SOD و CAT بهعنوان مکانیسمهای دفاعی سلولی برای مقابله با اثرات مضر رادیکالهای آزاد تکامل یافتهاند. گزارش شده است که فشار اکسایشی در انواع بیماریهای کلیوی مانند: گلومرولونفریت و نفریت توبولواینترستیشیال، نارسایی مزمن کلیه، پروتئینوری و اورمی نقش دارد. افراد مبتلا به بیماری کلیوی مرحله نهایی (ESRD) ، که این بیماری بهعنوان نارسایی کلیه نیز شناخته میشود، اغلب افزایش فعالیت پرواکسیدانی همراه با کاهش فعالیت آنتیاکسیدانی را نشان میدهند. بهویژه اکسیدانهای فعال مانند: پراکسی نیتریت (ONOO-) و رادیکالهای هیدروکسیل(OH-) این پتانسیل را دارند که بهطور گستردهای مولکولهای زیستی مانند: لیپیدها،DNA و پروتئین ها را تغییر دهند (71). در پژوهش حاضر کاهش فعالیت SOD و GPX احتمال دارد ناشی از استفاده زیاد آنها برای کاهش ROS باشد و از طرفی بهعلت محدود شدن آنزیمهای آنتیاکسیدانی توسط ROS باشد و ممکن است وضعیت اکسایشی- کاهشی را به سمت فشار اکسایشی تغییر دهد (13). با اینحال، در این پژوهش باید محدودیتهای خاصی را نیز در نظر گرفت. این مطالعه منحصراً بر روی موشهای صحرایی ماده نژاد ویستار، با حجم نمونه نسبتاً کوچک و دوز ثابت تستوسترون انانتات انجام شد، و دوره مداخله به هشت هفته محدود شد. بنابراین، تعمیمپذیری نتایج به سایر جمعیتها یا مدت زمانهای طولانیتر همچنان نامشخص است. علاوه بر این، میتوان به عدم بررسی تغییرات هیستوپاتولوژیک در بافت کلیه اشاره کرد.
نتیجهگیری
بهطور خلاصه، مطالعه ما نشان میدهد که مصرف مکمل تستوسترون انانتات همراه با تمرین مقاومتی سبب افزایش قابلتوجه در سطح فشار اکسایشی و کاهش فعالیت آنزیمهای آنتیاکسیدانی، نسبت به گروههای کنترل و تمرین مقاومتی + دارونما شد. علاوه بر این، انجام تمرین مقاومتی توسط گروه دارونما، سبب تغییر کم در سطح فشار اکسایشی و فعالیت آنزیمهای آنتیاکسیدانی، نسبت به گروه کنترل شد و تأثیر تمرین مقاومتی به لحاظ آماری معنادار نبود. بهطور کلی با توجه به یافتههای پژوهش حاضر، بهنظر میرسد سوءمصرف تستوسترون انانتات همراه با تمرین مقاومتی در موشهای ماده، ممکن است موجب افزایش رادیکالهای آزاد و در نتیجه افزایش فشار اکسایشی و کاهش فعالیت آنزیمهای آنتیاکسیدانی در بافت کلیه شود که موجب کاهش عملکرد سیستم آنتیاکسیدانی و باعث بهم خوردن تعادل آنتیاکسیدانی در بافت کلیه میشود. بدین معنی است که بدن بهطور طبیعی آنتیاکسیدهایی تولید میکند که رادیکالهای آزاد را خنثی میکنند. در پژوهش حاضر، بهنظر میرسد بهدلیل سوءمصرف تستوسترون انانتات، ممکن است این تعادل بهنفع رادیکالهای آزاد بههم خورده باشد، یعنی تولید آنتیاکسیدانها کافی نیست و توانایی بدن برای محافظت از خود در برابر آسیبهای ناشی از رادیکالهای آزاد، کاهش پیدا کرده است و در نتیجه موجب افزایش فشار اکسایشی و کاهش فعالیت آنزیمهای آنتیاکسیدانی میشود. توجه به این نکته مهم است که تحقیقات بیشتری برای بررسی نشانگرهای مولکولی اضافی، ارزیابی اثرات وابسته به دوز، استفاده از آزمودنیهای نر و بررسی قابلیت کاربرد این یافتهها به مدلهای انسانی مورد نیاز است. بهنظر می رسد اطلاعات و آموزش، ابزارهای اساسی برای پیشگیری از سوءمصرف AAS هستند. تا زمانی که سوءمصرف AAS در بین ورزشکاران رایج است، بهتر است کمپینهای اطلاعاتی در مورد AAS و سایر عوامل دوپینگ ایجاد شود. همچنین پیشنهاد میشود، در پژوهشهای آینده برای اطمینان بیشتر از نتایج، بهتراست تغییرات هیستوپاتولوژیکی بافت نیز اندازهگیری شود. بهنظر میرسد روشن کردن تعامل بین سازگاریهای ناشی از ورزش و تعدیل هورمونی میتواند راههای جدیدی را برای استراتژیهای پیشگیرانه و درمانی در پزشکی ورزشی، نفرولوژی و سلامت متابولیک باز کند.
سپاسگزاری
این مقاله بخشی از رساله دکتری فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد اسلامشهر میباشد. از تمام کسانی که ما را در انجام این پژوهش یاری نمودهاند نهایت تشکر و قدردانی را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
کلیه مراحل پژوهش تجربی حاضر بر اساس موازین اخلاقی و اصول راهنمای نگهداری و استفاده از حیوانات آزمایشگاهی منتشر شده توسط موسسه ملی بهداشت (NIH)انجام شد و در کمیته اخلاق در پژوهش، دانشکده پزشکی- دانشگاه علوم پزشکی آزاد اسلامی تهران با کد اخلاق (IR.IAU.TMU.REC.1399.347) مورد تایید قرارگرفته است).
مشارکت نویسندگان
نحوه مشارکت نویسندگان در این پژوهش بدین صورت است؛ خدیجه ملایی: روش شناسی، نرم افزار، پژوهش، گردآوری داده ها، اعتبارسنجی، نگارش، بررسی و ویرایش. ساناز میرزایان شانجانی: نگارش اصلی و ویرایش، بررسی و پژوهش، نظارت. علی گُرزی: پژوهش، روش شناسی، نرم افزار، نظارت، نگارش، بررسی و ویرایش. یاسر کاظم زاده: نظارت، بررسی و ویرایش. عبدالعلی بنائیفر: نظارت، بررسی و ویرایش.
References:
1- Bond P, Smit DL, De Ronde W. Anabolic–Androgenic Steroids: How Do They Work and What Are the Risks? Front Endocrinol 2022; 13: 1059473.
2- Memudu AE, Dongo GA. A Study to Demonstrate the Potential of Anabolic Androgen Steroid to Activate Oxidative Tissue Damage, Nephrotoxicity and Decline Endogenous Antioxidant System in Renal Tissue of Adult Wistar Rats. Toxicol Rep 2023; 10: 320-26.
3- Reardon CL, Creado S. Drug Abuse in Athletes. Subst Abuse Rehabil 2014; 5: 95-105.
4- Riachy R, McKinney K, Tuvdendorj DR. Various Factors May Modulate the Effect of Exercise on Testosterone Levels in Men. J Funct Morphol Kinesiol 2020; 5(4): 81.
5- Karbasi S, Zaeemi M, Mohri M, Rashidlamir A, Moosavi Z. Outcomes of Testosterone Enanthate on Kidney of Male Wistar Rats Subjected to Resistance Training. Sci Sports 2017; 32(3): e107-e110.
6- Handelsman DJ, Hirschberg AL, Bermon S. Circulating Testosterone as the Hormonal Basis of Sex Differences in Athletic Performance. Endocr Rev 2018; 39(5): 803-29.
7- Huang G, Basaria S. Do Anabolic-Androgenic Steroids Have Performance-Enhancing Effects in Female Athletes? Mol Cell Endocrinol 2018; 464: 56-64.
8- Nelson BS, Hildebrandt T, Wallisch P. Anabolic-Androgenic Steroid Use Is Associated with Psychopathy, Risk-Taking, Anger, And Physical Problems. Sci Rep 2022; 12(1): 9133.
9- Collomp K, Ericsson M, Bernier N, Buisson C. Prevalence of Prohibited Substance Use and Methods by Female Athletes: Evidence of Gender-Related Differences. Front Sports Act Living 2022; 4: 839976.
10- Liu JD, Wu YQ. Anabolic-Androgenic Steroids and Cardiovascular Risk. Chin Med J (Engl) 2019; 132(18): 2229-36.
11- Burton GJ, Jauniaux E. Oxidative Stress. Best Pract Res Clin Obstet Gynaecol 2011; 25(3): 287-99.
12- Strycharz-Dudziak M, Fołtyn S, Dworzański J, Kiełczykowska M, Malm M, Drop B, et al. Glutathione Peroxidase (Gpx) and Superoxide Dismutase (SOD) in Oropharyngeal Cancer Associated with EBV and HPV Coinfection. Viruses 2020; 12(9): 1008.
13- Gaweł S, Wardas M, Niedworok E, Wardas P. Dialdehyd Malonowy (MDA) Jako Wskaźnik Procesów Peroksydacji Lipidów W Organizmie [Malondialdehyde (MDA) as a Lipid Peroxidation Marker]. Wiad Lek 2004; 57(9-10):453-5.
14- Su LJ, Zhang JH, Gomez H, Murugan R, Hong X, Xu D, et al. Reactive Oxygen Species-Induced Lipid Peroxidation in Apoptosis, Autophagy, And Ferroptosis. Oxid Med Cell Longev 2019; 2019: 5080843.
15- Asadi N, Bahmani M, Kheradmand A, Rafieian-Kopaei M. The Impact of Oxidative Stress on Testicular Function and the Role of Antioxidants in Improving It: A Review. J Clin Diagn Res 2017; 11(5): IE01-IE05.
16- Aydilek N, Aksakal M, Karakilcik AZ. Effects of Testosterone and Vitamin E on the Antioxidant System in Rabbit Testis. Andrologia 2004; 36(5): 277-81.
17- Choobineh H, Sadighi Gilani MA, Pasalar P, Jahanzad I, Ghorbani R, Hassanzadeh G. The Effects of Testosterone on Oxidative Stress Markers in Mice with Spinal Cord Injuries. Int J Fertil Steril 2016; 10(1): 87-93.
18- von Schantz T, Bensch S, Grahn M, Hasselquist D, Wittzell H. Good Genes, Oxidative Stress and Condition-Dependent Sexual Signals. Proc R Soc B 1999; 266(1414): 1-12.
19- Alonso-Alvarez C, Bertrand S, Faivre B, Chastel O, Sorci G. Testosterone and Oxidative Stress: The Oxidation Handicap Hypothesis. Proc Biol Sci 2007; 274(1611): 819-25.
20- Gyurászová M, Gurecká R, Bábíčková J, Tóthová Ľ. Oxidative Stress in the Pathophysiology of Kidney Disease: Implications for Noninvasive Monitoring and Identification of Biomarkers. Oxid Med Cell Longev 2020; 2020: 5478708.
21- Lobo V, Patil A, Phatak A, Chandra N. Free Radicals, Antioxidants and Functional Foods: Impact on Human Health. Pharmacogn Rev 2010; 4(8): 118-26.
22- Pellegrino D, La Russa D, Marrone A. Oxidative Imbalance and Kidney Damage: New Study Perspectives from Animal Models to Hospitalized Patients. Antioxidants 2019; 8(12): 594.
23- Filho SLA P, de Carvalho Gomes PEA, Forte GA, Lima LLL, da Silva Júnior GB, Martins AMC. De Francesco Daher E. Kidney Disease Associated with Androgenic–Anabolic Steroids and Vitamin Supplements Abuse: Be Aware! Nefrologia 2020; 40(1): 26-31.
24- Sadowska-Krępa E, Kłapcińska B, Jagsz S, Nowara A, Szołtysek-Bołdys I, Chalimoniuk M, et al. High-Dose Testosterone Enanthate Supplementation Boosts Oxidative Stress, But Exerts Little Effect on the Antioxidant Barrier in Sedentary Adolescent Male Rat Liver. Pharmacol Rep 2017; 69(4): 673-8.
25- Asmat U, Abad K, Ismail K. Diabetes Mellitus and Oxidative Stress – A Concise Review. Saudi Pharm J 2016; 24(5): 547-53.
26- Liu W, Akbarpour-Beni M, Movahed S, Gorzi A, Cheraghi E, Amini H. Neutralising the Testosterone Enanthate-Induced Oxidative Stress in Rats Uterine Tissue by Propolis and Chicory as Natural Antioxidants. Comparative Exercise Physiology 2023; 19(1): 87-93.
27- Jafari M, Matinhomaee H, Rahmati Ahmadabad S. The Effect of Eight Weeks of Aerobic Exercise and Coriander Seed Extract on Oxidative Stress and Cellular Energy Indices of Heart Tissue in Male Rats Poisoned with Hydrogen Peroxide. CMJA 2023; 13(1): 43-51. [Persian]
28- Gomes FC, Chuffa LG, Scarano WR, Pinheiro PF, Fávaro WJ, Domeniconi RF. Nandrolone Decanoate and Resistance Exercise Training Favor the Occurrence of Lesions and Activate the Inflammatory Response in the Ventral Prostate. Andrology 2016; 4(3): 473-80.
29- Hackney AC, Willett HN. Testosterone Responses to Intensive, Prolonged Endurance Exercise in Women. Endocrines 2020; 1(2): 119-24.
30- Gorzi A, Rajabi H, Gharakhanlou R, Dehkhoda MR, Hedayati M. The Effects of 8 Weeks of Resistance Training on Total and A12 Acetyl Cholinesterase Activity in Slow Twitch Muscles of Rats. Res Sport Med Technol 2017; 15(13): 9-16. [Persian]
31- Nazem F, Salehikia A, Marandi SM, Sahdadi A. Impact of a 12 Week Resistance and Concurrent Training on Bone Mechanical Strength and Mineral Density of Osteoporotic Male Wistar Rats. Feyz Med Sci J 2016; 20(2): 108-17. [Persian]
32- Joksimović J, Selaković D, Jakovljević V, Mihailović V, Katanić J, Boroja T, et al. Alterations of the Oxidative Status in Rat Hippocampus and Prodepressant Effect of Chronic Testosterone Enanthate Administration. Mol Cell Biochem 2017; 433(1-2): 41-50.
33- Arazi H, Rahmati S, Ghafoori H. The Interaction Effects of Resistance Training and Sustanon Abuse on Liver Antioxidant Activities and Serum Enzymes in Male Rats. Interv Med Appl Sci 2017; 9(3): 178-83.
34- Gorzi A, Ekradi S. The Effect of Intake Duration of Curcumin Supplementation During Strenuous Endurance Training on GPX Activity and MDA Levels of Liver, Heart and Skeletal Muscle in Male Wistar Rats. Sport Physiol 2020; 12(46): 139-56. [Persian]
35- Kaya H, Sezik M, Ozkaya O, Dittrich R, Siebzehnrubl E, Wildt L. Lipid Peroxidation at Various Estradiol Concentrations in Human Circulation During Ovarian Stimulation with Exogenous Gonadotropins. Horm Metab Res 2004; 36(10): 693.
36- Paoletti F, Aldinucci D, Mocali A, Caparrini A. A Sensitive Spectrophotometric Method for the Determination of Superoxide Dismutase Activity in Tissue Extracts. Anal Biochem 1986; 154(2): 536.
37- Paglia DE, Valentine WN. Studies on the Quantitative and Qualitative Characterization of Erythrocyte Glutathione Peroxidase. J Lab Clin Med 1967; 70: 158.
38- Tirupati A, Wang M, Lin JK, Fekete G, István B, Baker JS, et al. Effect of Different Exercise Modalities on Oxidative Stress: A Systematic Review. Biomed Res Int 2021; 2021: 1947928.
39- Bloomer RJ, Fry AC, Falvo MJ, Moore CA. Protein Carbonyls are Acutely Elevated Following Single Set Anaerobic Exercise in Resistance Trained Men. J Sci Med Sport 2007; 10(6): 411-7.
40- Zorov DB, Juhaszova M, Sollott SJ. Mitochondrial Reactive Oxygen Species (ROS) and ROS-Induced ROS Release. Physiol Rev 2014; 94(3): 909-50.
41- Parker L, McGuckin TA, Leicht AS. Influence of Exercise Intensity on Systemic Oxidative Stress and Antioxidant Capacity. Clin Physiol Funct Imaging 2014; 34(5): 377-83.
42- Ghiasi R, Mohammadi M, Ashrafi Helan J, Jafari Jozani SR, Mohammadi S, Ghiasi A, et al. Influence of Two Various Durations of Resistance Exercise on Oxidative Stress in the Male Rat’s Hearts. J Cardiovasc Thorac Res 2015; 7(4): 149-53.
43- Arjmand A, Abedi B, Hosseini SA. The Effect of Resistance Training on Malondialdehyde and Protein Carbonyl Concentration in the Heart Tissue of Rats Exposed to Stanozolol. Pharm Biomed Res 2020; 6(4): 261-8.
44- Liu JF, Chang WY, Chan KH, Tsai WY, Lin CL, Hsu MC. Blood Lipid Peroxides and Muscle Damage Increased Following Intensive Resistance Training of Female Weightlifters. Ann N Y Acad Sci 2005; 1042(1): 255-61.
45- McClean C, Davison GW. Circadian Clocks, Redox Homeostasis, And Exercise: Time to Connect the Dots? Antioxidants 2022; 11(2): 256.
46- Kawamura T, Muraoka I. Exercise-Induced Oxidative Stress and the Effects of Antioxidant Intake from A Physiological Viewpoint. Antioxidants 2018; 7(9): 119.
47- Riezzo I, Turillazzi E, Bello S, Cantatore S, Cerretani D, Di Paolo M, et al. Chronic Nandrolone Administration Promotes Oxidative Stress, Induction of Pro-Inflammatory Cytokine and TNF-Α Mediated Apoptosis in the Kidneys of CD1 Treated Mice. Toxicol Appl Pharmacol 2014; 280(1): 97-106.
48- Sadowska-Krępa E, Kłapcińska B, Nowara A, Jagsz S, Szołtysek-Bołdys I, et al. High-Dose Testosterone Supplementation Disturbs Liver Pro-Oxidant/Antioxidant Balance and Function in Adolescent Male Wistar Rats Undergoing Moderate-Intensity Endurance Training. PeerJ 2020; 8: e10228.
49- Jukic T, Drobne D, Pusavec S, Ihan A, Stubljar D, Starc A. Comparison of 3 Enzyme-Linked Immunoassay Methods to Evaluate Serum Concentrations of Infliximab and Antibodies to Infliximab in 32 Patients with Moderate to Severe Inflammatory Bowel Disease. Med Sci Monit 2023; 29: e939084.
50- Chodari L, Smailnejad S, Fallahi M, Khalaji N, Ghorbanzadeh V. Oxidative Stress Is Markedly Reduced By Combined Voluntary Exercise and Testosterone in the Heart of Diabetic Rats. Acta Endocrinol (Buchar) 2019; 15(2): 173-81.
51- Cruz-Topete D, Dominic P, Stokes KY. Uncovering Sex-Specific Mechanisms of Action of Testosterone and Redox Balance. Redox Biol 2020; 31: 101490.
52- Davey RA, Grossmann M. Androgen Receptor Structure, Function and Biology: From Bench to Bedside. Clin Biochem Rev 2016; 37(1): 3-15.
53- Tostes RC, Carneiro FS, Carvalho MH, Reckelhoff JF. Reactive Oxygen Species: Players in the Cardiovascular Effects of Testosterone. Am J Physiol Regul Integr Comp Physiol 2016; 310(1): R1-14.
54- Tenkorang MAA, Duong P, Cunningham RL. NADPH Oxidase Mediates Membrane Androgen Receptor-Induced Neurodegeneration. Endocrinology 2019; 160(4): 947-63.
55- Toro-Urrego N, Garcia-Segura LM, Echeverria V, Barreto GE. Testosterone Protects Mitochondrial Function and Regulates Neuroglobin Expression in Astrocytic Cells Exposed to Glucose Deprivation. Front Aging Neurosci 2016; 8: 152.
56- Ozbek E. Induction of Oxidative Stress in Kidney. Int J Nephrol 2012; 2012: 465897.
57- Frankenfeld SP, Oliveira LP, Ortenzi VH, Rego-Monteiro IC, Chaves EA, Ferreira AC, et al. The Anabolic Androgenic Steroid Nandrolone Decanoate Disrupts Redox Homeostasis in Liver, Heart and Kidney of Male Wistar Rats. PLoS One 2014; 9(9): e102699.
58- Albano GD, Amico F, Cocimano G, Liberto A, Maglietta F, Esposito M, et al. Adverse Effects of Anabolic-Androgenic Steroids: A Literature Review. Healthcare 2021; 9(1): 97.
59- Turillazzi E, Neri M, Cerretani D, Cantatore S, Frati P, Moltoni L, et al. Lipid Peroxidation and Apoptotic Response in Rat Brain Areas Induced by Long-Term Administration of Nandrolone: The Mutual Crosstalk Between ROS and NF-Κb. J Cell Mol Med 2016; 20(4): 601-12.
60- Peltola V, Huhtaniemi I, Metsa-Ketela T, Ahotupa M. Induction of Lipid Peroxidation During Steroidogenesis in the Rat Testis. Endocrinology 1996; 137(1): 105-12.
61- Mooradian AD. Antioxidant Properties of Steroids. J Steroid Biochem Mol Biol 1993; 45(6): 509-11.
62- Arazi H, Mohammadjafari H, Asadi A. Use of Anabolic Androgenic Steroids Produces Greater Oxidative Stress Responses to Resistance Exercise in Strength-Trained Men. Toxicol Rep 2017; 4: 282-86.
63- Davani-Davari D, Karimzadeh I, Khalili H. The Potential Effects of Anabolic-Androgenic Steroids and Growth Hormone as Commonly Used Sport Supplements on the Kidney: A Systematic Review. BMC Nephrol 2019; 20(1): 198.
64- Ho HJ, Shirakawa H. Oxidative Stress and Mitochondrial Dysfunction in Chronic Kidney Disease. Cells 2022; 12(1): 88.
65- Poljsak B, Šuput D, Milisav I. Achieving the Balance between ROS and Antioxidants: When to Use the Synthetic Antioxidants. Oxid Med Cell Longev 2013; 2013: 956792.
66- Sharifi-Rad M, Kumar NV, Zucca P, Varoni EM, Dini L, Panzarini E, et al. Lifestyle, Oxidative Stress, And Antioxidants: Back and Forth in the Pathophysiology of Chronic Diseases. Front Physiol 2020; 11: 694.
67- Lazzarino G, Listorti I, Bilotta G, Capozzolo T, Amorini AM, Longo S, et al. Water- and Fat-Soluble Antioxidants in Human Seminal Plasma and Serum of Fertile Males. Antioxidants (Basel) 2019; 8(4): 96.
68- Daenen K, Andries A, Mekahli D, Van Schepdael A, Jouret F, Bammens B. Oxidative Stress in Chronic Kidney Disease. Pediatr Nephrol 2019; 34(6): 975-91.
69- Tsatsakis A, Docea AO, Calina D, Tsarouhas K, Zamfira LM, Mitrut R, et al. A Mechanistic and Pathophysiological Approach for Stroke Associated with Drugs of Abuse. J Clin Med 2019; 8(9): 1295.
70- Poljsak B, Šuput D, Milisav I. Achieving the Balance between ROS and Antioxidants: When to Use the Synthetic Antioxidants. Oxid Med Cell Longev 2013; 2013: 956792.
71- Pham-Huy LA, He H, Pham-Huy C. Free Radicals, Antioxidants in Disease and Health. Int J Biomed Sci 2008; 4(2): 89-96.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی
دریافت: 1403/11/29 | پذیرش: 1404/2/17 | انتشار: 1404/9/15
دریافت: 1403/11/29 | پذیرش: 1404/2/17 | انتشار: 1404/9/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







