دوره 33، شماره 6 - ( شهریور 1404 )
جلد 33 شماره 6 صفحات 9105-9084 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Zeighamian V, jafari Nodoushan M, Lotfi M. Stem Cell-Based Therapeutic Approaches for Heart Failure. JSSU 2025; 33 (6) :9084-9105
URL: http://jssu.ssu.ac.ir/article-1-6373-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6373-fa.html
ضیغمیان وحیده، جعفری ندوشن مهدیه، لطفی مرضیه. رویکردهای درمانی مبتنی برسلولهای بنیادی برای نارسایی قلبی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (6) :9084-9105
متن کامل [PDF 1267 kb]
(191 دریافت)
| چکیده (HTML) (508 مشاهده)
References:
1- Savarese G, Becher PM, Lund LH, Seferovic P, Rosano GMC, Coats AJS. Global Burden of Heart Failure: A Comprehensive and Updated Review of Epidemiology. Cardiovasc Res 2023; 118(17): 3272-287.
2- Zehnder AR, Pedrosa Carrasco AJ, Etkind SN. Factors Associated with Hospitalisations of Patients with Chronic Heart Failure Approaching the End of Life: A Systematic Review. Palliat Med 2022; 36(10): 1452-68.
3- Rheault-Henry M, White I, Grover D, Atoui R. Stem Cell Therapy for Heart Failure: Medical Breakthrough, or Dead End? World J Stem Cells 2021; 13(4): 236-59.
4- Gill JK, Rehsia SK, Verma E, Sareen N, Dhingra S. Stem Cell Therapy for Cardiac Regeneration: Past, Present, and Future. Can J Physiol Pharmacol 2024; 102(3): 161-79.
5- Tanai E, Frantz S. Pathophysiology of Heart Failure. Compr Physiol 2015; 6(1): 187-214.
6- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure: Developed by the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC). with The Special Contribution of The Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2022; 24(1): 4-131.
7- Mouton AJ, Rivera OJ, Lindsey ML. Myocardial Infarction Remodeling that Progresses to Heart Failure: A Signaling Misunderstanding. Am J Physiol Heart Circ Physiol 2018; 315(1): H71-H79
8- Cahill TJ, Kharbanda RK. Heart Failure after Myocardial Infarction in the Era of Primary Percutaneous Coronary Intervention: Mechanisms, Incidence and Identification of Patients at Risk. World J Cardiol 2017; 9(5): 407-415.
9- Pan Y, Wu W, Jiang X, Liu Y. Mesenchymal Stem Cell-Derived Exosomes In Cardiovascular And Cerebrovascular Diseases: From Mechanisms To Therapy. Biomed Pharmacother 2023; 163: 114817.
10- Smadja DM. Stem Cell Therapy, Artificial Heart or Xenotransplantation: What will be New “Regenerative” Strategies in Heart Failure during the Next Decade? Stem Cell Rev Rep. 2023; 19(3): 694-99.
11- Olatunji G, Kokori E, Yusuf I, Ayanleke E, Damilare O, Afolabi S, et al. Stem Cell-Based Therapies for Heart Failure Management: A Narrative Review of Current Evidence and Future Perspectives. Heart Failure Reviews 2024; 29(3): 573-98.
12- Kalou Y, Al-Khani AM, Haider KH. Bone Marrow Mesenchymal Stem Cells for Heart Failure Treatment: A Systematic Review and Meta-Analysis. Heart Lung Circ 2023; 32(7): 870-80.
13- Guo R, Morimatsu M, Feng T, Lan F, Chang D, Wan F, et al. Stem Cell-Derived Cell Sheet Transplantation for Heart Tissue Repair in Myocardial Infarction. Stem Cell Research & Therapy 2020; 11(1): 19.
14- Banerjee MN, Bolli R, Hare JM. Clinical Studies of Cell Therapy in Cardiovascular Medicine: Recent Developments and Future Directions. Cir Res 2018; 123(2): 266-87.
15- Rikhtegar R, Pezeshkian M, Dolati S, Safaie N, Rad AA, Mahdipour M, et al. Stem Cells as Therapy for Heart Disease: Ipscs, Escs, Cscs, and Skeletal Myoblasts. Biomed Pharmacother 2019; 109: 304-13.
16- Mahmud S, Alam S, Emon NU, Boby UH, Ahmed F, Monjur-Al-Hossain ASM, et al. Opportunities and Challenges in Stem Cell Therapy in Cardiovascular Diseases: Position Standing in 2022. Saudi Pharm J 2022; 30(9): 1360-71.
17- Jalal S, Dastidar S, Tedesco FS. Advanced Models of Human Skeletal Muscle Differentiation, Development and Disease: Three-Dimensional Cultures, Organoids and Beyond. Curr Opin Cell Biol 2021; 73: 92-104
18- Araki K, Miyagawa S, Kawamura T, Ishii R, Watabe T, Harada A, et al. Autologous Skeletal Myoblast Patch Implantation Prevents the Deterioration of Myocardial Ischemia and Right Heart Dysfunction in a Pressure-Overloaded Right Heart Porcine Model. Plos one 2021; 16(2): e0247381.
19- Youssef AA, Ross EG, Bolli R, Pepine CJ, Leeper NJ, Yang PC. The Promise and Challenge of Induced Pluripotent Stem Cells for Cardiovascular Applications. JACC Basic Transl Sci. 2016; 1(6): 510-23.
20- Heldman AW, DiFede DL, Fishman JE, Zambrano JP, Trachtenberg BH, Karantalis V, et al. Transendocardial Mesenchymal Stem Cells and Mononuclear Bone Marrow Cells for Ischemic Cardiomyopathy: The TAC-HFT Randomized Trial. JAMA 2014; 311(1): 62-73.
21- Nasseri BA, Ebell W, Dandel M, Kukucka M, Gebker R, Doltra A, et al. Autologous CD133+ Bone Marrow Cells and Bypass Grafting for Regeneration of Ischaemic Myocardium: The Cardio133 Trial. Eur Heart J 2014; 35(19): 1263-74.
22- Hamshere S, Arnous S, Choudhury T, Choudry F, Mozid A, Yeo C, et al. Randomized Trial of Combination Cytokine and Adult Autologous Bone Marrow Progenitor Cell Administration in Patients with Non-Ischaemic Dilated Cardiomyopathy: The REGENERATE-DCM Clinical Trial. Eur Heart J2015; 36(44): 3061-9.
23- Choudry F, Hamshere S, Saunders N, Veerapen J, Bavnbek K, Knight C, et al. A Randomized Double-Blind Control Study of Early Intra-Coronary autologous Bone Marrow Cell Infusion in Acute Myocardial Infarction: The REGENERATE-AMI Clinical Trial. Eur heart J 2016; 37(3): 256-63.
24- Patel AN, Henry TD, Quyyumi AA, Schaer GL, Anderson RD, Toma C, et al. Ixmyelocel-T for Patients with Ischaemic Heart Failure: A Prospective Randomised Double-Blind Trial. Lancet 2016; 387(10036): 2412-21.
25- Bartunek J, Terzic A, Davison BA, Filippatos GS, Radovanovic S, Beleslin B, et al. Cardiopoietic Cell Therapy for Advanced Ischaemic Heart Failure: Results at 39 Weeks of the Prospective, Randomized, Double Blind, Sham-Controlled CHART-1 Clinical Trial. Eur Heart J 2017; 38(9): 648-60.
26- Bartolucci J, Verdugo FJ, González PL, Larrea RE, Abarzua E, Goset C, et al. Safety and Efficacy of the Intravenous Infusion of Umbilical Cord Mesenchymal Stem Cells in Patients with Heart Failure: A Phase 1/2 Randomized Controlled Trial (RIMECARD Trial [Randomized Clinical Trial of Intravenous Infusion Umbilical Cord Mesenchymal Stem Cells on Cardiopathy]). Circ Res 2017; 121(10): 1192-204.
27- Menasché P, Vanneaux V, Hagège A, Bel A, Cholley B, Parouchev A, et al. Transplantation of Human Embryonic Stem Cell–Derived Cardiovascular Progenitors for Severe Ischemic Left Ventricular Dysfunction. J Am College of Cardiol 2018; 71(4): 429-38.
28- Bolli R, Hare JM, March KL, Pepine CJ, Willerson JT, Perin EC, et al. Rationale and Design of the CONCERT-HF Trial (Combination of Mesenchymal and C-Kit+ Cardiac Stem Cells as Regenerative Therapy for Heart Failure). Circ Res 2018; 122(12): 1703-15.
29- Makkar RR, Kereiakes DJ, Aguirre F, Kowalchuk G, Chakravarty T, Malliaras K, et al. Intracoronary Allogeneic Heart Stem Cells to Achieve Myocardial Regeneration (ALLSTAR): A Randomized, Placebo-Controlled, Double-Blinded Trial. Eur Heart J 2020; 41(36): 3451-58.
30- Chakravarty T, Makkar RR, Ascheim DD, Traverse JH, Schatz R, DeMaria A, et al. Allogeneic Heart Stem Cells to Achieve Myocardial Regeneration (ALLSTAR) Trial: Rationale and Design. Cell Transp 2017; 26(2): 205-14.
31- Ostovaneh MR, Makkar RR, Ambale-Venkatesh B, Ascheim D, Chakravarty T, Henry TD, et al. Effect of Cardiosphere-Derived Cells on Segmental Myocardial Function after Myocardial Infarction: ALLSTAR Randomised Clinical Trial. Open Heart 2021; 8(2): e001614.
32- Mathiasen AB, Qayyum AA, Jørgensen E, Helqvist S, Kofoed KF, Haack‐Sørensen M, et al. Bone Marrow‐Derived Mesenchymal Stromal Cell Treatment in Patients with Ischaemic Heart Failure: Final 4‐Year Follow‐Up of the MSC‐HF Trial. Eur J Heart Failure 2020; 22(5): 884-92.
33- Ulus AT, Mungan C, Kurtoglu M, Celikkan FT, Akyol M, Sucu M, et al. Intramyocardial Transplantation of Umbilical Cord Mesenchymal Stromal Cells in Chronic Ischemic Cardiomyopathy: A Controlled, Randomized Clinical Trial (HUC-HEART Trial). Int J Stem Cells 2020; 13(3): 364-76.
34- Bolli R, Mitrani RD, Hare JM, Pepine CJ, Perin EC, Willerson JT, et al. A Phase II Study of Autologous Mesenchymal Stromal Cells and C‐Kit Positive Cardiac Cells, Alone or in Combination, in Patients with Ischaemic Heart Failure: The CCTRN CONCERT‐HF Trial. Eur J Heart Fail 2021; 23(4): 661-74.
35- Qayyum AA, van Klarenbosch B, Frljak S, Cerar A, Poglajen G, Traxler‐Weidenauer D, et al. Effect of Allogeneic Adipose Tissue‐Derived Mesenchymal Stromal Cell Treatment in Chronic Ischaemic Heart Failure with Reduced Ejection Fraction–The SCIENCE Trial. Eur J Heart Fail 2023; 25(4): 576-87
36- Perin EC, Borow KM, Henry TD, Mendelsohn FO, Miller LW, Swiggum E, et al. Randomized Trial of Targeted Transendocardial Mesenchymal Precursor Cell Therapy in Patients with Heart Failure. J American College of Cardiology 2023; 81(9): 849-63.
37- Nair N, Gongora E. Stem Cell Therapy in Heart Failure: Where Do We Stand Today? Biochim Biophys Acta Mol Basis Dis 2020; 1866(4): 165489.
38- Glicksman MA. Induced Pluripotent Stem Cells: The Most Versatile Source For Stem Cell Therapy. Clin ther 2018; 40(7): 1060-5.
39- Volarevic V, Markovic BS, Gazdic M, Volarevic A, Jovicic N, Arsenijevic N, et al. Ethical and Safety Issues of Stem Cell-Based Therapy. Int J Med Sci 2018; 15(1): 36-45.
40- Mende N, Laurenti E. Hematopoietic Stem and Progenitor Cells Outside the Bone Marrow: Where, When, and Why. Exp Hematol 2021; 104: 9-16
41- Hu S, Liu S, Zheng Z, Yuan X, Li L, Lu M, et al. Isolated Coronary Artery Bypass Graft Combined With Bone Marrow Mononuclear Cells Delivered Through A Graft Vessel for Patients with Previous Myocardial Infarction and Chronic Heart Failure: A Single-Center, Randomized, Double-Blind, Placebo-Controlled Clinical Trial. J Am Coll Cardiol 2011; 57(24): 2409-15.
42- Chowdhury MA, Zhang JJ, Chen WCW. Stem Cell Therapy For Heart Failure in the Clinics: New Perspectives in the Era of Precision Medicine and Artificial Intelligence. Front Physiol 2024; 14: 1344885.
43- Kasai-Brunswick TH, Carvalho AB, de Carvalho ACC. Stem Cell Therapies in Cardiac Diseases: Current Status and Future Possibilities. World J Stem Cells 2021; 13(9): 1231-47.
44- Nasser MI, Qi X, Zhu S, He Y, Zhao M, Guo H, et al. Current Situation and Future of Stem Cells in Cardiovascular Medicine. Biomed Pharmacother 2020; 132: 110813.
45- Dabiri S, Derakhshani A, Vahidi R, Farsinejad A. Peripheral Blood-Derived Mesenchymal Stem Cells: Growth Factor-Free Isolation, Molecular Characterization And Differentiation. Iran J Pathol 2018; 13(4): 461-66.
46- Visweswaran M, Pohl S, Arfuso F, Newsholme P, Dilley R, Pervaiz S, et al. Multi-Lineage Differentiation of Mesenchymal Stem Cells–To Wnt, or Not Wnt. Int J Biochem Cell Biol 2015; 68: 139-47
47- Lappin T, Cheng T. An Urgent Need for Standardization of Stem Cells and Stem Cell-Derived Products Toward Clinical Applications. Stem Cells Transl Med 2021; 10 Suppl 2(Suppl 2): S1-S3.
48- Cannella V, Piccione G, Altomare R, Marino A, Di Marco P, Russotto L, et al. Differentiation and Characterization of Rat Adipose Tissue Mesenchymal Stem Cells Into Endothelial‐Like Cells. Anat Histol Embryol 2018; 47(1): 11-20.
49- Yu H, Lu K, Zhu J, Wang Ja. Stem Cell Therapy for Ischemic Heart Diseases. Br Med Bull 2017;121(1): 135-54.
50- Bolli R, Solankhi M, Tang X-L, Kahlon A. Cell Therapy in Patients with Heart Failure: A Comprehensive Review and Emerging Concepts. Cardiovasc Res 2022; 118(4): 951-76.
51- Ankrum JA, Ong JF, Karp JM. Mesenchymal Stem Cells: Immune Evasive, Not Immune Privileged. Nat Biotechnol 2014; 32(3): 252-60.
52- Heathman TRJ, Rafiq QA, Chan AKC, Coopman K, Nienow AW, Kara B, et al. Characterization of Human Mesenchymal Stem Cells from Multiple Donors and the Implications for Large Scale Bioprocess Development. Biochem Engineering Journal 2016; 108: 14-23.
53- Neri S. Genetic Stability of Mesenchymal Stromal Cells for Regenerative Medicine Applications: A Fundamental Biosafety Aspect. Int J Mol Sci 2019; 20(10): 2406.
54- Bartosh TJ, Ylostalo JH. Preparation of Anti‐Inflammatory Mesenchymal Stem/Precursor Cells (Mscs) Through Sphere Formation Using Hanging‐Drop Culture Technique. Curr Protoc Stem Cell Biol 2014; 28: 2B.6.1-2B.6.23
55- Golpanian S, Wolf A, Hatzistergos KE, Hare JM. Rebuilding The Damaged Heart: Mesenchymal Stem Cells, Cell-Based Therapy, and Engineered Heart Tissue. Physiol Rev 2016; 96(3): 1127-68.
56- White SJ, Chong JJH. Mesenchymal Stem Cells in Cardiac Repair: Effects on Myocytes, Vasculature, and Fibroblasts. Clin Ther 2020; 42(10): 1880-91.
57- Guo Y, Yu Y, Hu S, Chen Y, Shen Z. The Therapeutic Potential of Mesenchymal Stem Cells for Cardiovascular Diseases. Cell Death & Disease 2020; 11(5): 349.
58- Wysoczynki M, Khan A, Bolli R. New Paradigms in Cell Therapy: Repeated Dosing, Intravenous Delivery, Immunomodulatory Actions, and New Cell Types. Circ Res 2018; 123(2): 138-58.
59- Bian D, Wu Y, Song G, Azizi R, Zamani A. The Application of Mesenchymal Stromal Cells (Mscs) and their Derivative Exosome in Skin Wound Healing: A Comprehensive Review. Stem Cell Res Ther 2022; 13(1): 24.
60- Domaszk O, Skwarek A, Wojciechowska M. In Search of the Holy Grail: Stem Cell Therapy as a Novel Treatment of Heart Failure with Preserved Ejection Fraction. Int J Mol Sci 2023; 24(5): 4903.
61- Jin Y, Li S, Yu Q, Chen T, Liu D. Application of Stem Cells in Regeneration Medicine. MedComm 2023; 4(4): e291.
62- González PL, Carvajal C, Cuenca J, Alcayaga-Miranda F, Figueroa FE, Bartolucci J, et al. Chorion Mesenchymal Stem Cells Show Superior Differentiation, Immunosuppressive, and Angiogenic Potentials in Comparison with Haploidentical Maternal Placental Cells. Stem Cells Trans Med 2015; 4(10): 1109-21.
63- Jiang W, Xu J. Immune Modulation by Mesenchymal Stem Cells. Cell prolif 2020; 53(1): e12712.
64- Yan W, Abu-El-Rub E, Saravanan S, Kirshenbaum LA, Arora RC, Dhingra S. Inflammation in Myocardial Injury: Mesenchymal Stem Cells as Potential Immunomodulators. Am J Physiol Heart Circ Physiol 2019; 317(2): H213-H225
65- Wang Y, Chen X, Cao W, Shi Y. Plasticity of Mesenchymal Stem Cells in Immunomodulation: Pathological and Therapeutic Implications. Nat Immunol 2014; 15(11): 1009-16.
66- Poomani MS, Mariappan I, Perumal R, Regurajan R, Muthan K, Subramanian V. Mesenchymal Stem Cell (Mscs) Therapy for Ischemic Heart Disease: A Promising Frontier. Global Heart 2022; 17(1): 19.
67- Attar A, Bahmanzadegan Jahromi F, Kavousi S, Monabati A, Kazemi A. Mesenchymal Stem Cell Transplantation after Acute Myocardial Infarction: A Meta-Analysis of Clinical Trials. Stem Cell Res Ther 2021; 12(1): 600.
68- Mathiasen AB, Qayyum AA, Jørgensen E, Helqvist S, Fischer-Nielsen A, Kofoed KF, et al. Bone Marrow-Derived Mesenchymal Stromal Cell Treatment in Patients with Severe Ischaemic Heart Failure: A Randomized Placebo-Controlled Trial (MSC-HF Trial). Eur Heart J 2015; 36(27): 1744-53.
69- Nigro P, Bassetti B, Cavallotti L, Catto V, Carbucicchio C, Pompilio G. Cell Therapy for Heart Disease after 15 Years: Unmet Expectations. Pharmacol Res 2018; 127: 77-91.
70- Kabat M, Bobkov I, Kumar S, Grumet M. Trends in Mesenchymal Stem Cell Clinical Trials 2004-2018: Is Efficacy Optimal in a Narrow Dose Range? Stem Cells Transl Med 2020; 9(1): 17-27.
71- Kakzanov Y, Sevilya Z, Veturi M, Goldman A, Lev E. Circulating Endothelial Progenitor Cells in Patients with Heart Failure with Preserved versus Reduced Ejection Fraction. Isr Med Assoc J. 2021; 23(6): 364-8.
72- Michler RE. The Current Status of Stem Cell Therapy in Ischemic Heart Disease. J Cardiac Surgery 2018; 33(9): 520-31.
73- Kourek C, Karatzanos E, Psarra K, Georgiopoulos G, Delis D, Linardatou V, et al. Endothelial Progenitor Cells Mobilization after Maximal Exercise According to Heart Failure Severity. World J Cardiol 2020; 12(11): 526-39.
74- Huang H, Huang W. Regulation of Endothelial Progenitor Cell Functions in Ischemic Heart Disease: New Therapeutic Targets for Cardiac Remodeling and Repair. Front Cardiovascular Med 2022; 9: 896782.
75- Pelliccia F, Zimarino M, De Luca G, Viceconte N, Tanzilli G, De Caterina R. Endothelial Progenitor Cells in Coronary Artery Disease: From Bench to Bedside. Stem Cells Transl Med 2022; 11(5): 451-60.
76- Wu WZ, Hu DJ, Wang ZY, Liao LS, Li CC. Endothelial Progenitor Cell Impairment Mediated Vasodilation Dysfunction Via Diminishing Nitric Oxide Production in Postmenopausal Females. Mol Med Rep 2019; 19(3): 2449-57.
77- Fathi E, Valipour B, Vietor I, Farahzadi R. An Overview of the Myocardial Regeneration Potential of Cardiac C-Kit+ Progenitor Cells Via PI3K and MAPK Signaling Pathways. Future Cardiol 2020; 16(3): 199-209.
78- Cianflone E, Torella M, Biamonte F, De Angelis A, Urbanek K, Costanzo FS, et al. Targeting Cardiac Stem Cell Senescence to Treat Cardiac Aging and Disease. Cells. 2020; 9(6): 1558.
79- Bartunek J, Behfar A, Dolatabadi D, Vanderheyden M, Ostojic M, Dens J, et al. Cardiopoietic Stem Cell Therapy in Heart Failure: The C-CURE (Cardiopoietic Stem Cell Therapy in Heart Failure) Multicenter Randomized Trial with Lineage-Specified Biologics. J Am Coll Cardiol 2013; 61(23): 2329-38.
80- Leong YY, Ng WH, Ellison-Hughes GM, Tan JJ. Cardiac Stem Cells for Myocardial Regeneration: They are Not Alone. Front Cardiovasc Med 2017; 4: 47.
81- Ibrahim AG-E, Cheng K, Marbán E. Exosomes as Critical Agents of Cardiac Regeneration Triggered by Cell Therapy. Stem Cell Reports 2014; 2(5): 606-19.
82- Mehanna RA, Essawy MM, Barkat MA, Awaad AK, Thabet EH, Hamed HA, et al. Cardiac Stem Cells: Current Knowledge and Future Prospects. World J Stem Cells 2022; 14(1): 1-40.
83- Sano T, Ito T, Ishigami S, Bandaru S, Sano S. Intrinsic Activation of Cardiosphere-Derived Cells Enhances Myocardial Repair. J Thoracic Cardiovasc Surg 2022; 163(4): 1479-90.
84- Hosoyama T, Samura M, Kudo T, Nishimoto A, Ueno K, Murata T, et al. Cardiosphere-Derived Cell Sheet Primed with Hypoxia Improves Left Ventricular Function of Chronically Infarcted Heart. Am J Transl Res 2015; 7(12): 2738-51.
85- Hasan AS, Luo L, Yan C, Zhang T-X, Urata Y, Goto S, et al. Cardiosphere-Derived Cells Facilitate Heart Repair by Modulating M1/M2 Macrophage Polarization and Neutrophil Recruitment. PLoS One 2016; 11(10): e0165255.
86- Patel AN, Silva F, Winters AA. Stem Cell Therapy for Heart Failure. Heart Fail Clin 2015; 11(2): 275-86.
87- Sano T, Ishigami S, Ito T, Sano S. Stem Cell Therapy in Heart Disease: Limitations and Future Possibilities. Acta Med Okayama 2020; 74(3): 185-90.
88- Müller P, Lemcke H, David R. Stem Cell Therapy in Heart Diseases–Cell Types, Mechanisms and Improvement Strategies. Cell Physiol Biochem 2018; 48(6): 2607-55.
89- Hassan N, Tchao J, Tobita K. Concise Review: Skeletal Muscle Stem Cells and Cardiac Lineage: Potential for Heart Repair. Stem Cells Transl Med 2014; 3(2): 183-93.
90- Iseoka H, Miyagawa S, Saito A, Harada A, Sawa Y. Role And Therapeutic Effects of Skeletal Muscle-Derived Non-Myogenic Cells in a Rat Myocardial Infarction Model. Stem Cell Res Ther 2020; 11(1): 69.
91- Sun R, Li X, Liu M, Zeng Y, Chen S, Zhang P. Advances in Stem Cell Therapy for Cardiovascular Disease. Intj Mol Med 2016; 38(1): 23-9.
92- Aguirre M, Escobar M, Forero Amézquita S, Cubillos D, Rincón C, Vanegas P, et al. Application of the Yamanaka Transcription Factors Oct4, Sox2, Klf4, and C-Myc from the Laboratory to the Clinic. Genes 2023; 14(9): 1697.
93- Liu G, David BT, Trawczynski M, Fessler RG. Advances in Pluripotent Stem Cells: History, Mechanisms, Technologies, and Applications. Stem Cell Rev Rep 2020; 16(1): 3-32.
94- Raab S, Klingenstein M, Liebau S, Linta L. A Comparative View on Human Somatic Cell Sources for Ipsc Generation. Stem Cells Int 2014; 2014(1): 768391.
95- Calado SM, Bento D, Justino D, Mendes-Silva L, Marques N, Bragança J. Generation of a Human Induced Pluripotent Stem Cell Line (Ualgi001-A) from a Patient with Left-Ventricular Noncompaction Cardiomyopathy. Stem Cell Res 2021; 53: 102302.
96- Cong X, Zhang S-M, Ellis MW, Luo J. Large Animal Models for the Clinical Application of Human Induced Pluripotent Stem Cells. Stem Cells Dev 2019; 28(19): 1288-98.
97- Gu M. Efficient Differentiation of Human Pluripotent Stem Cells to Endothelial Cells. Curr Protoc Hum Genet 2018; 98(1): e64.
98- Rosa S, Praça C, Pitrez PR, Gouveia PJ, Aranguren XL, Ricotti L, et al. Functional Characterization of Ipsc-Derived Arterial-And Venous-Like Endothelial Cells. Sci Rep 2019; 9(1): 3826.
99- Hartman ME, Dai D-F, Laflamme MA. Human Pluripotent Stem Cells: Prospects and Challenges as a Source of Cardiomyocytes for in Vitro Modeling and Cell-Based Cardiac Repair. Adv Drug Deliv Rev 2016; 96: 3-17.
100- Barbuti A, Benzoni P, Campostrini G, Dell'Era P. Human Derived Cardiomyocytes: A Decade of Knowledge after the Discovery of Induced Pluripotent Stem Cells. Dev Dynamics 2016; 245(12): 1145-58.
101- Yoshihara M, Hayashizaki Y, Murakawa Y. Genomic Instability of Ipscs: Challenges Towards their Clinical Applications. Stem Cell Reviews and Reports 2017; 13(1): 7-16.
102- Yuan HL, Chang L, Fan WW, Liu X, Li Q, Tian C, et al. Application and Challenges of Stem Cells in Cardiovascular Aging. Regen Therapy 2024; 25: 1-9.
103- Ye L, Chang YH, Xiong Q, Zhang P, Zhang L, Somasundaram P, et al. Cardiac Repair in a Porcine Model of Acute Myocardial Infarction with Human Induced Pluripotent Stem Cell-Derived Cardiovascular Cells. Cell Stem Cell 2014; 15(6): 750-61.
104- Rohani L, Johnson AA, Naghsh P, Rancourt DE, Ulrich H, Holland H. Concise Review: Molecular Cytogenetics and Quality Control: Clinical Guardians for Pluripotent Stem Cells. Stem Cells Transl Med 2018; 7(12): 867-75.
105- Gerbin KA, Murry CE. The Winding Road To Regenerating The Human Heart. Cardiovasc Pathol 2015; 24(3): 133-40.
106- Lemcke H, Voronina N, Steinhoff G, David R. Recent Progress In Stem Cell Modification For Cardiac Regeneration. Stem Cells Int 2018; 2018: 1909346.
107- Abdelwahid E, Kalvelyte A, Stulpinas A, De Carvalho KAT, Guarita-Souza LC, Foldes G. Stem Cell Death and Survival in Heart Regeneration and Repair. Apoptosis 2016; 21(3): 252-68.
108- Menasché P. Cell Therapy with Human ESC-Derived Cardiac Cells: Clinical Perspectives. Front Bioeng Biotechnol 2020; 8: 601560.
109- Nakamura K, Murry CE. Function Follows form―a Review of Cardiac Cell Therapy. Cir Journal 2019; 83(12): 2399-412.
110- Kalou YMN, Hashemi ASA, Joudeh RM, Aramini B, Haider KH. Mesenchymal Stem Cell-Based Heart Cell Therapy: The Effect of Route of Cell Delivery in the Clinical Perspective. In book: Stem cells: From Potential to Promise 2021;151-90.
111- Kanelidis AJ, Premer C, Lopez J, Balkan W, Hare JM. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Cir Res 2017; 120(7): 1139-50.
112- Abouzid MR, Umer AM, Jha SK, Akbar UA, Khraisat O, Saleh A, et al. Stem Cell Therapy for Myocardial Infarction and Heart Failure: A Comprehensive Systematic Review and Critical Analysis. Cureus 2024; 16(5): e59474.
113- Turner D, Rieger AC, Balkan W, Hare JM. Clinical-Based Cell Therapies for Heart Disease—Current and Future State. Rambam Maimonides Med J 2020; 11(2): e0015.
114- Jihwaprani MC, Sula I, Charbat MA, Haider KH. Establishing Delivery Route-Dependent Safety and Efficacy of Living Biodrug Mesenchymal Stem Cells in Heart Failure Patients. World J Cardiol 2024; 16(6): 339-54.
115- Menasché P. Cell Therapy Trials for Heart Regeneration—Lessons Learned and Future Directions. Nat Rev Cardiol 2018; 15(11): 659-71.
متن کامل: (299 مشاهده)
مقدمه
نارسایی قلبی (HF) یک بیماری قلبی عروقی شایع و ناتوانکننده است که تقریباً 64 میلیون نفر را در سراسر جهان تحت تأثیر قرار میدهد (1). این بیماری همچنین یکی از شایعترین علل بستری شدن در بیمارستان است (2) که با کاهش توانایی بطن برای دریافت یا خارج کردن مقادیر کافی خون و در نتیجه پرفیوژن ضعیف بافتهای محیطی مشخص میشود و اغلب باعث مرگ ناگهانی قلبی یا نارسایی اندام به دلیل عوارض ناشی از هیپوپرفیوژن میگردد (3). علت اولیه نارسایی قلبی، بیماری عروق کرونر و ایسکمی میوکارد است (4)، اما سایر عوامل خطر اصلی برای ایجاد نارسایی قلبی طیفی از عوامل زمینهای شامل دیابت شیرین، چاقی، فشار خون بالا، انفارکتوس قبلی میوکارد (MI)، سابقه خانوادگی و بیماریهای مزمن ریوی میباشد (5،6). در این میان شایعترین علت نارسایی قلبی، MI است که منجر به تغییرات ساختاری و عملکردی در قلب، آسیب سلولهای میوکارد به دلیل ایسکمی طولانیمدت و تشکیل بافت اسکار فیبروتیک میشود (7،8). علاوه بر این، آپوپتوز، کاردیومیوسیت و رگزایی دلایل مهمی برای پیشرفت HF هستند (9). علیرغم پیشرفتهای قابل توجه در تشخیص، مدیریت و درمانهای دارویی و غیردارویی، نارسایی قلبی همچنان با مرگ و میر بالایی همراه است (10) و با نرخ مرگ و میر 5 ساله 50% -25% پس از تشخیص، توسعه گزینههای درمانی موثرتر و جدیدتر ضروری میباشد (3). در جستوجو برای رویکردهای درمانی نوآورانه، درمانهای مبتنی بر سلولهای بنیادی بهعنوان نامزدهای امیدوارکننده ظاهر شدهاند که رویکردی اساساً متفاوت از درمانهای مرسوم که عمدتا بر مدیریت علائم تمرکز دارند را نشان میدهند. در چند دهه اخیر، سلولهای بنیادی به دلیل ویژگیهای مفید متعددی که دارند، از جمله ظرفیت قابلتوجهشان برای خود نوسازی و تمایز به انواع سلول¬ها، توجه محققان را در جستجوی استراتژیهای نوآورانه برای درمان نارسایی قلبی به خود جلب کردهاند (11). در حال حاضر، درمانهای مبتنی بر سلولهای بنیادی، پس از مطالعات وسیع آزمایشگاهی در مدلهای حیوانی، به مراحل پیشرفته ارزیابی بالینی در بیماران مبتلا به انفارکتوس میوکارد و نارسایی قلبی پیشرفت کرده است (12). هدف این مطالعه بحث در مورد کاربرد سلولهای بنیادی و پتانسیل درمانی آنها برای درمان نارسایی قلبی، مکانیسم عمل، چالشهای پیشرو و چشمانداز آتی به عنوان رویکرد امیدوارکننده در درمان نارسایی قلبی است.
روششناسی: در مطالعه حاضر، جمعآوری دادههای اولیه امکانپذیر نیست. تنها دادههای ثانویه با استفاده از جستجوی جامع ادبیات از پایگاههای داده معتبر، از جمله PubMed، ScienceDirect، Web of Science و Google Scholar گردآوری گردید. علاوه بر این، منابع واقعی مانند ClinicalTrials.gov برای تأیید دادههای کارآزمایی بالینی و سایر اطلاعات مهم مورد استفاده قرار گرفت. جستجو با استفاده از ترکیبی از کلمات کلیدی مرتبط و عبارات MeSH انجام شد. کلمات کلیدی شامل «نارسایی قلبی»، «سلولدرمانی»، «پزشکی بازساختی»، «سلولهای بنیادی»، «درمان»، «کارآزماییهای بالینی»، «ترمیم بافت قلبی» و اصطلاحات مرتبط بود. پس از حذف موارد تکراری، مقالات بر اساس عنوان و چکیده غربالگری شدند و سپس با بررسی متن کامل توسط محقق برای واجد شرایط بودن ارزیابی شدند. معیارهای ورود شامل مطالعات منتشر شده به زبان انگلیسی در 10 سال گذشته بود. مقالات بر اساس ارتباط آنها با درمانهای مبتنی بر سلولهای بنیادی برای درمان نارسایی قلبی انتخاب شدند و شامل تحقیقات اصلی و کارآزماییهای بالینی بودند. معیارهای خروج شامل مطالعاتی بود که به موضوع مرتبط نبودند، از جمله مطالعات غیرمرتبط با درمان با سلولهای بنیادی یا مطالعاتی که بر سایر بیماریهای قلبی متمرکز شده بودند.
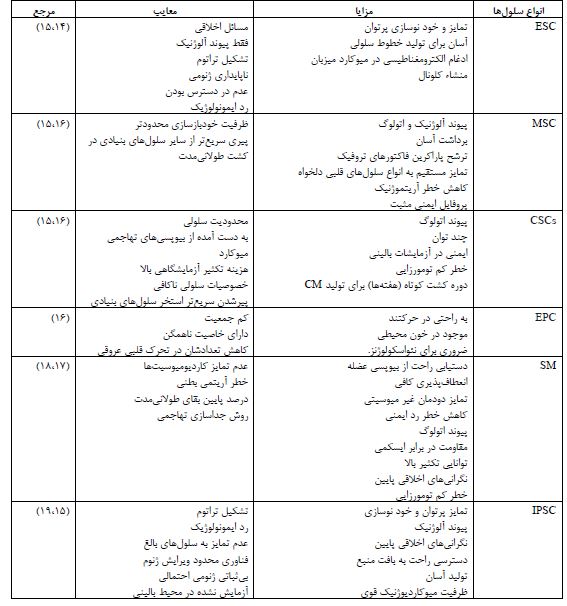
سلولهای بنیادی به عنوان یک درمان امیدوارکننده: با توجه به تواناییها و مکانیسمهای عمل متفاوت سلولهای بنیادی، انتخاب نوع سلولهای بنیادی برای کاربرد در پزشکی بازساختی، حائز اهمیت است (3). در مطالعات بالینی بر روی بیماریهای قلبی عروقی، محققان بیشتر از سلولهای پیشساز اندوتلیال (EPCs)، سلولهای بنیادی مزانشیمی (MSCs)، میوبلاستهای اسکلتی (SMs)، سلولهای پیشساز/بنیادی قلب (CPCs/CSCs)، کاردیومیوسیتهای مشتق از سلولهای بنیادی جنینی انسان (hESC-CMs) و کاردیومیوسیتهای مشتق از سلولهای بنیادی پرتوان القایی انسان (hiPSC-CMs) استفاده میکنند (13). ویژگیهای انواع مختلف سلولهای بنیادی و همچنین برخی از کارآزماییهای بالینی برجسته انسانی به ترتیب در جدول 1 و جدول 2 خلاصه شده است.
جدول 1: ویژگیهای انواع مختلف سلولهای بنیادی مورد استفاده برای بازسازی قلب
جدول 2: کارآزماییهای بالینی درمان با سلولهای بنیادی در نارسایی قلبی (2024-2014).
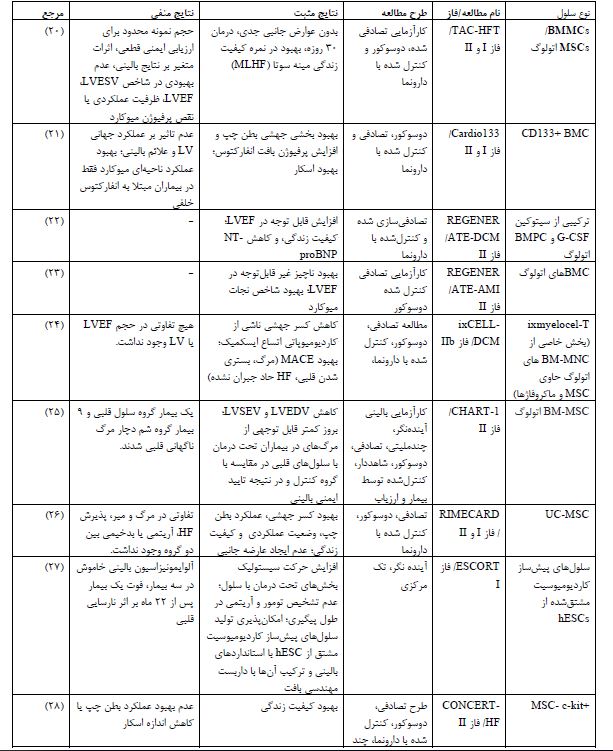
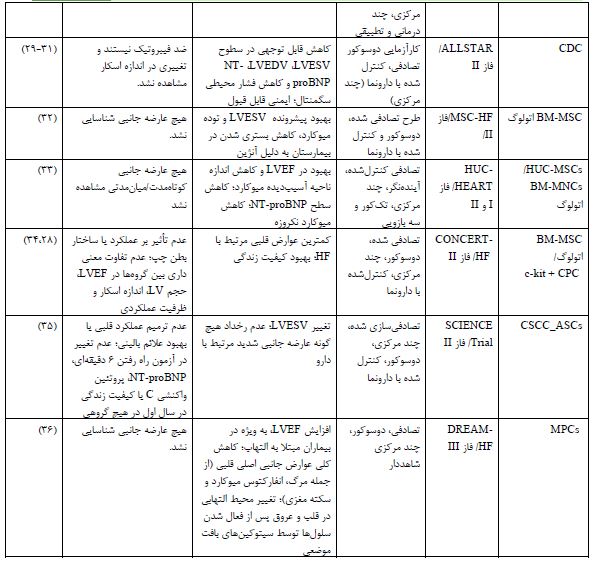
اختصارات. BMMCs: سلولهای تک هستهای مغز استخوان؛ MSC: سلولهای بنیادی مزانشیمی؛ BMC: سلول بنیادی مشتق از مغز استخوان؛ G-CSF: فاکتور محرک کلنی گرانولوسیت؛ BMPC: سلول پیشساز مغز استخوان بالغ؛ UC-MSC: سلول بنیادی مزانشیمی مشتق از بند ناف؛ hESCs: سلولهای بنیادی جنینی انسانی؛ CDC: سلول بنیادی مشتق از کاردیوسفر؛ CSCC_ASCs: سلولهای استرومایی مزانشیمی مشتق از بافت چربی؛ MPCs: سلولهای پیشساز مزانشیمی؛ HUC-MSCs: سلول-های استرومایی مزانشیمی مشتق از بند ناف انسانی؛ LVESV: حجم انتهای سیستولیک بطن چپ؛ LVEDV: حجم انتهای دیاستولیک بطن چپ؛ LVEF: کسر جهشی بطن چپ؛ LV: بطن چپ؛ NT-proB: پپتید ناتریورتیک نوع N ترمینال pro-B؛ MACE: عوارض جانبی عمده قلبی عروقی؛ HF: نارسایی قلبی
سلولهای بنیادی جنینی (ESCs): سلولهای بنیادی جنینی (ESCs) به دلیل تواناییشان در تکثیر نامحدود و تمایز به سلولهای هر سه لایه زایایی، کاندیدهای امیدوارکنندهای برای درمان بیماریهای قلبی هستند (37). این سلولها به دلیل ارائه مزایایی مانند ویژگی، انعطافپذیری و قدرت بالا برای بازسازی قلب و توانایی جایگزینی بافت آسیب دیده قلب با سلولهای عضله قلب سالم و عملکردی توجه زیادی را برای درمان نارسایی قلبی به خود جلب کردهاند (11). با اینحال منبع جنینی ESCهای انسانی، برخی از ملاحظات اخلاقی را به دلیل استفاده از جنین برای تولید ESC برانگیخت (38). در واقع فرآیند ایجاد یک خط ESC انسانی شامل استخراج توده سلولی داخلی از بلاستوسیست در مرحله 7-5 روز است و این امر میتواند جنین را از بین ببرد (3). علاوه براین مسائل ایمنی و شواهد مبنی بر تشکیل تراتوم- نوعی تومور- بهدنبال تزریق ESCها، کاربرد آنها را محدود نموده است (39). علیرغم این چالشها، ESCها یک رویکرد امیدوارکننده برای تحقیق باقی ماندهاند و تلاشها برای کشف پتانسیل آنها در عین رسیدگی به نگرانیهای اخلاقی ادامه دارد (11).
سلولهای بنیادی مشتق شده از مغز استخوان (BMDSCs): BMDSCها یکی از شناخته شدهترین انواع سلولها در درمان بیماریهای قلبی عروقی تا به امروز بودهاند (3). مغز استخوان محل اولیه تولید سلولهای خونی و حاوی اکثر سلولهای بنیادی و پیشساز خونساز (HSPCs) است (40). هرچند، پیشرفتهای اخیر پتانسیل آن را به عنوان منبعی غنی از سلولهای بنیادی غیرخونساز با نوید درمانی در نارسایی قلبی نشان داده است. در این دسته، چندین زیرگروه از سلولها به عنوان کاندیدهای درمانی امیدبخش ظاهر شده-اند (11). مطالعات قبلی نشان دادهاند که سلولهای تک هستهای اتولوگ مغز استخوان (BMMNCs) پتانسیل بهبود عملکرد قلب را از طریق رگزایی و بازسازی مستقیم میوکارد دارند (41). شواهد نشان میدهد این سلولها فاکتورهایی نظیر VEGF و HGF آزاد میکنند (42) که میتوانند تکثیر سلولی و رگزایی را تحریک کنند، پاسخ التهابی را تعدیل کنند و حفاظت از بافت ایسکمیک را تقویت کنند (43). مزیت اصلی این سلولها، جمعآوری راحت آنها از مغز استخوان بیمار بدون نگرانی از پسزدن سیستم ایمنی (11)، ایمن بودن و عدم تغییر ویژگیهای بیولوژیکی در هنگام جداسازی میباشد (3). سلولهای پیش ساز خالص شده، مانند سلولهای CD34+ و CD133+، زیرمجموعههای تخصصیتری را در مغز استخوان تشکیل میدهند که پتانسل بازسازی بالاتر و نتایج امیدوارکنندهای را در مطالعات پیش بالینی نشان دادهاند (11).
سلولهای بنیادی مزانشیمی (MSCs): MSCها، سلولهای چند توان مشتق شده از منابعی مانند مغز استخوان، بافت چربی، پالپ دندان و خون بند ناف هستند که پتانسیل درمانی قابلتوجهی را در درمان نارسایی قلبی نشان دادهاند (44). امروزه جداسازی آنها از خون محیطی نیز امکانپذیر شده است که بهنظر میرسد منبعی امیدوارکننده برای سلول درمانی آلوژنیک باشد (45). این سلولها به دلیل تواناییشان برای تمایز مزانشیمی به ردههای استئوسیتها، سلولهای چربی، کندروسیتها، میوسیتها، کاردیومیوسیتها، فیبروبلاستها، میوفیبروبلاست، سلولهای اپیتلیال، نورونها (47،46) و سلولهای شبه اندوتلیال ظرفیت بازسازی بالایی دارند (48). ایمنیزایی مطلوب به دلیل بیان متوسط مولکول اصلی سازگاری بافتی کلاس I (MHCI)، عدم بیان کمپلکس اصلی سازگاری بافتی II (MHC II) و خواص تعدیل کننده ایمنی (51-49)، سهولت جداسازی و نگهداری، پتانسیل گسترش ex vivo، تواناییشان در ترشح طیف وسیعی از فاکتورهای رشد موثر در باسازی بافت (52) و همچنین کمترین تمایل به تشکیل تراتوم، سلولهای بنیادی مزانشیمی را به کاندیدای مطلوبی برای مطالعات بالینی تبدیل نموده است (53). گفته میشود به دلیل اثرات ضد التهابی و پیش التهابی (56-54) اثرات ضدآپوپتوتیک، آنژیوژنیک، ضد فیبروتیک (58-56) و ترشح اگزوزومهای غنی شده از mRNAها، miRNAها، سیتوکینها و فاکتورهای رشد (59)، درمان با MSC ممکن است در بیماریهای قلبی مفید باشد. پتانسیل آنتیآپوپتوتیک قوی سلولهای بنیادی مزانشیمی مربوط به کاهش بیان سیستئین-اسپارتیک اسید پروتئاز-3 (Caspase-3)، افزایش بیان ژن لنفوم 2 سلول B (BCL-2)، سورویوین و HIF-1 میباشد. این اثر بهویژه در شرایط هیپوکسیک تشدید میشود (60). ظرفیت رگزایی سلولهای بنیادی مزانشیمی مرتبط با ترشح فاکتورهای پاراکرین مختلف در مسیرهای بازسازی بافت، از جمله فاکتور رشد اندوتلیال عروقی (VEGF)، فاکتور رشد سلولهای کبدی (HGF) و فاکتور رشد تبدیلکننده TGF-β است که به رگزایی و ترمیم بافت کمک میکنند (62،61). آنها همچنین مولکولهای سرکوبگر ایمنی مانند IL-10، پروستاگلاندین E2 (PGE2)، فاکتور تحریککننده کلنی ماکروفاژها و فاکتور نکروز تومور (TNF) را آزاد میکنند (65-63) که به جلوگیری از پاسخ ایمنی نامطلوب در میوکارد ایسکمیک کمک میکند و در نتیجه بافت را ترمیم مینماید (4). فعالیت ضد فیبروتیک این سلولها با تحریک فعالیت چندین متالوپروتئیناز (MMP)، به ویژه MMP-2، MMP-9، MMP-14 (66) و در نتیجه کاهش قابلتوجه رسوب الیاف کلاژن مرتبط می-باشد. علاوه بر این، از آنجاییکه رسوب کلاژن باعث کاهش آزادسازی VEGF میشود، اثر ضد فیبروتیک ممکن است رگزایی را تحریک کند (60). تاکنون، اثرات سلولهای بنیادی مزانشیمی بر بیماریهای قلبی عروقی بهطور گسترده در مطالعات بالینی مورد بررسی قرار گرفته است که نتایج آنها حاکی از قابلیت درمانی این سلول¬ها میباشد (67). کارآزمایی MSC-HF اولین مطالعه کنترل شده با دارونما بود که در بیماران با نارسایی قلبی مزمن انجام شد و نتایج نشان داد تزریق عضلانی MSC اتولوگ، ایمن است، عملکرد میوکارد را بهبود میبخشد و پذیرش در بیمارستان را کاهش میدهد (69،68). در حال حاضر، سلولهای بنیادی مزانشیمی از مغز استخوان و بند ناف بیشترین استفاده را برای درمان بیماریهای قلب دارند و پس از آن سلولهای مشتق از بافت چربی (70). تحقیقات کنونی با هدف اصلاح انتخاب سلول¬های بنیادی مزانشیمی بر اساس ویژگیهایی مانند قابلیتهای تعدیل کننده ایمنی و پتانسیل رگزایی، و همچنین بررسی رژیمهای دوز بهینه، زمانبندی تجویز و راههای تحویل برای به حداکثر رساندن اثربخشی درمانی این سلولها در حال انجام میباشد (11).
سلولهای پیش ساز اندوتلیال (EPCs): EPCها سلولهای در حال گردش مشتق از مغز استخوان هستند که با بیان آنتیژنهای سطحی CD133، CD34 و گیرنده فاکتور رشد اندوتلیال عروقی 2 (VEGFR-2) مشخص میگردند (71). مهمترین مزیت آنها این است که میتوانند بهصورت غیرتهاجمی از خون وریدی محیطی تامین شوند (60). نشان داده شده است که تجویز فاکتور تحریک کننده کلونی گرانولوسیت (G-CSF) تعداد EPCها را در گردش خون افزایش میدهد، و امکان بسیج و جمعآوری ایمن و موثر EPC از خون را فراهم میکند (72). نتایج مطالعات نشان میدهند که EPCها در محافظت از عروق، بازیابی اندوتلیوم ناکارآمد و آسیب دیده، ترویج رگزایی و تنظیم هموستاز عروقی نقش دارند (73) و میتوانند از طریق تنظیم پاسخهای ایمنی، نئوواسکولاریزاسیون، رسوب ماتریکس خارج سلولی و تشکیل ریزمحیط قلبی باعث ترمیم قلب پس از MI شوند (74). در این رابطه، فاکتورهایی نظیر فاکتور 1 ناشی از هیپوکسی (HIF-1)، فاکتور رشد اندوتلیال عروقی (VEGF)، پروتئین SHH و فاکتور 1 آلفا مشتق از سلول استرومایی (SDF-1α) که در هایپوکسی به میزان قابلتوجهی آزاد میگردند، نقش اساسی در فعالسازی و مهاجرت EPC ایفا میکنند (75،74). پس از مهاجرت EPC، آنها میتوانند به سلولهای اندوتلیال بالغ که دارای خواص رگزایی و عروقی بسیار زیادی هستند، تمایز پیدا کنند (75). علاوه بر این، EPCها ممکن است به دلیل بیان NO سنتاز اندوتلیالی (eNOS)، قادر به تنظیم وضعیت اتساع عروقی باشند (76). در مطالعات بالینی، کاربرد EPC بیشتر در بیماران مبتلا به بیماری عروق کرونر مورد بررسی قرار گرفته است. به نظر میرسد این روش درمانی عملی، ایمن و بسیار کارآمد در پیشگیری از عوارض ناشی از انفارکتوس حاد میوکارد باشد. تزریق EPC ممکن است بازسازی مضر پس از انفارکتوس را با افزایش نئوواسکولاریزاسیون کاهش دهد (60).
سلولهای بنیادی قلبی (CSCs): در قلب بالغ، یک سلول c-kit+ خود تجدید شونده برای اولین بار توسط Beltrami و همکاران کشف شد. این سلولها از احیای بافتهای آسیب دیده پشتیبانی میکنند و میتوانند به سلولهای کاردیومیوسیت، سلولهای ماهیچه صاف و سلولهای اندوتلیال تمایز یابند (16،77). CSCها چند توان بوده و در نیچهای میوکارد قلب تقسیم و تمایز مییابند. وجه تمایز آنها با سلولهای خونساز، آنتیژنهای سطح سلولی یعنی Scą-1 و ḾDR1 و c-kit میباشد. سلولهای پیشساز مغز استخوان نیز در حال مهاجرت c-kit را نشان میدهند اما KDR، CD31، یا CD45 را نشان نمیدهند، و بدین وسیله از CSCها متمایز میگردند (78،72). قدرت تمایز این سلولها به انواع مختلف سلولهای قلبی، آنها را کاندیدای ایدهآلی برای بازسازی بافت آسیبدیده قلب نموده است. فراتر از تمایز، آنها همچنین نقش مهمی در ترشح سیتوکینها و آزادسازی اگزوزومهایی دارند که سیستم ایمنی و ریزمحیط قلبی را تعدیل میکنند (11). کارآزماییهای بالینی مانند کارآزمایی C-CURE و کارآزمایی CHART-1، ایمنی و اثربخشی درمان مبتنی بر سلولهای بنیادی قلبی را در بیماران نارسایی قلبی بررسی کردهاند، و پیشرفتهای قابلتوجهی در عملکرد قلب نشان دادهاند (25،79). هر دو این کارآزماییها نشان میدهند که درمان با سلولهای بنیادی ایمن است و این پتانسیل را دارد که مزایای طولانیمدتی را برای عملکرد قلب در مبتلا به نارسایی قلبی، ارائه دهد (3).
سلولهای بنیادی مشتق از کاردیوسفر CDCs)): کاردیوسفرها یک جمعیت سلولی ناهمگن هستند که از کشت ریزنمونههای بیوپسی قلب بهدست میآیند (43). مرکز آنها از CSCها و میوفیبروبلاستها که توسط سلولهای پشتیبان تمایز یافته، مانند عضلات صاف عروق و سلولهای اندوتلیال احاطه گردیده است، تشکیل شده است. لایه بیرونی، سلولهای بنیادی را در برابر استرس اکسیداتیو محافظت میکند و برای حفظ توانایی خودتجدیدی آنها بسیار مهم است (80). آنها میتوانند به عنوان سلولهای بنیادی/پیشساز بالغ عمل کنند و توانایی تمایز به میوسیتها و سلولهای عروقی را در مدلهای موشی نشان دادهاند (42). عمدتاً با آزاد کردن فاکتورهای پاراکرین و اگزوزومهایی که آپوپتوز سلولی را مهار میکنند و رگزایی و تکثیر کاردیومیسیت را تقویت میکنند، به ترمیم قلب کمک میکنند (81). یکی از مهمترین این عوامل، اگزوزومهای حاوی miRNA-146a و پروتئین پلاسما مرتبط با بارداری ((PAPP-A)pregnancy-associated plasma protein-A ) هستند که فعالیت ضد آپوپتوزی قوی دارند (82). این سلولها مشابه MSCها، میتوانند با آزادسازی VEGF و فاکتور رشد شبه انسولین 1 (IGF-1) رگزایی را افزایش دهند (83). اثرات آنتیفیبروتیک آنها به تولید اندوگلین که باعث مهار TGF-β میگردد، نسبت داده میشود (84). علاوه بر این گفته میشود که آنها خواص تعدیل کننده ایمنی دارند و میتوانند فنوتیپ پیشالتهابی ماکروفاژ M1 که سیتوکینهایی مانند TNF-α, IL-1 و IL-6 را ترشح میکند به فنوتیپ ضد التهابی M2 تغییر دهند و شرایط مطلوب را برای ترمیم بافت تضمین نمایند. CDCها همچنین با کاهش جذب نوتروفیل، یک اثر سرکوب کننده ایمنی اعمال میکنند (85) .بر اساس مطالعات تجربی، درمان با CDC ممکن است مزایای بسیار زیادی را در درمان بیماریهای قلبی عروقی به همراه داشته باشد. با اینحال، از آنجاییکه روش نسبتاً جدیدی است، دادههای مربوط به استفاده از آن محدود میباشد. تا به امروز، پتانسیل بازسازی CDCها بیشتر در بیماران مبتلا به بیماریهای ایسکمیک قلبی مورد بررسی قرار گرفته است (60).
میوبلاستهای اسکلتی (SM): میوبلاستهای اسکلتی (SM)، سلولهای مشتق از سلولهای پیشساز ماهیچههای اسکلتی (سلولهای ماهوارهای) با ظرفیت بازسازی هستند (15). این سلولها اولین نوع سلولی بودند که هم در آزمایشات پیشبالینی و هم در آزمایشات بالینی برای بیماریهای قلبی مورد آزمایش قرار گرفتند و نتایج حاکی از پتانسیل بالای آنها در بهبود عملکرد قلب میباشد (87،86). استفاده از میوبلاستهای اسکلتی برای بازسازی قلب به دلیل جداسازی ساده و منبع اتولوگ آنها، تکثیر سریع در شرایط آزمایشگاهی، مقاومت در برابر شرایط ایسکمیک، ظرفیت میوژنیک و خطر کم تومورزایی است (89،88). اثر درمانی میوبلاستها ممکن است به تولید عوامل محرک رگزایی و یا تحرک سلولهای بنیادی نسبت داده میشود؛ مانند VEGF، HGF و SDF-1 (90). علیرغم پتانسیل درمانی و مزایای متعددشان، چالش-هایی در زمینه استفاده از این سلولها وجود دارد، از جمله؛ یکپارچگی عملکردی با بافت قلبی موجود، و همچنین نگرانیهای مربوط به آریتمی، پاسخهای ایمنی، بقای محدود سلولهای پیوندی، و تشکیل بالقوه بافت اسکار (11). به همین دلیل تمرکز بر میوبلاستهای اسکلتی برای درمان بیماریهای قلبی کاهش یافته است (91،88).
سلولهای بنیادی پرتوان القایی (iPSCs): این سلول¬ها برای اولین بار در سال 2006 توسط یاماناکا و همکارانش از فیبروبلاستها تولید شدند. محققان بهوسیله برنامهریزی مجدد سلولهای سوماتیک بالغ با استفاده از چهار فاکتور رونویسی شامل Oct3/4 ، Klf4، Sox2 و c-Myc، سلولهای سوماتیک تمایز یافته پرتوان را القا کردند (93،92). با توسعه سریع تحقیقات در حوزه این کشف نوآورانه، بهدست آوردن iPSCها تقریباً از هر نوع سلول سوماتیک بالغ، حتی از سلولهایی که به روشی کم تهاجمی از منابع سلولی به راحتی در دسترس هستند، از جمله لنفوسیتهای T خون محیطی، سلولهای لولهای کلیوی از نمونههای ادرار و کراتینوسیتها از فولیکولهای مو، امکانپذیر شد (95،94). بر خلاف همتایان جنینی خود، iPSCها به دلیل در دسترس بودن و پذیرش اخلاقی، برای مدلسازی بیماری و غربالگری دارو بسیار مورد توجه قرار گرفتهاند (96). iPSCها دارای مزیت منحصربهفردی هستند که میتوانند بهصورت کاملاً کنترل شده و گام به گام متمایز شوند. این به محققان اجازه میدهد تا پیشسازهای خاص دودمانی مانند سلولهای پیشساز قلبی (CPC) را ایجاد کنند (3). بهطور کلی نتایج حاکی از این است که iPSCها پتانسیل بیش از حدی برای بازسازی قلب دارند و کاردیومیوسیتهای مشتق شده از آنها ویژگیهای عملی سلولهای قلبی مانند انقباض، ضربان خودبهخود و بیان کانال یونی دارند (15)، که به این معنی است که بیوپسی برای تولید CSC در آینده ضروری نخواهد بود. این میتواند بهویژه در شرایط مرتبط با از دست دادن میوسیت (به عنوان مثال، سندرم حاد کرونری) برای معکوس کردن یا ترمیم آسیب قلبی مفید باشد (60). iPSCها همچنین میتوانند به سلولهای اندوتلیال شبه شریانی که مقادیر زیادی NO تولید میکنند تمایز پیدا کنند، که نشاندهنده کاربرد احتمالی آنها در نارسایی قلبی است (98،97). با اینحال، آنالیزهای عملکردی کاردیومیوسیتهای مشتق شده از iPSC نشان داده است که این سلولها نابالغ هستند و بیشتر به کاردیومیوسیتهای جنینی مربوط میشوند تا به قلب بالغ، که این یکی از چالشهای مهم برای کاربرد این سلولها است (100،99). همچنین، مطالعات مختلف ناپایداریهای ژنومی را در خطوط iPSC توصیف کردند که ناشی از تغییرات از قبل موجود در سلولهای بالغ والدین یا جهشهایی است که در طول فرآیند برنامهریزی مجدد و زمان کشت اتفاق میافتد (102،101). به همین دلیل کاربردهای بالینی این سلولها با محدودیتها جدی مواجه میباشد و برای اطمینان از ترجمه بالینی موفق، پرداختن به چالشهای مرتبط با استفاده از iPSCها، مانند خطر تشکیل تراتوم، هزینه بالای تولید (103) و کنترل کیفی دقیق برای دسترسی ایمن و کارآمد به iPSCها ضروری میباشد (104).
محدودیتها و چالش¬های استفاده از سلولهای بنیادی: اگرچه پروفایل ایمنی سلول درمانی رضایتبخش بهنظر میرسد اما اثربخشی کلی درمان با سلول¬های بنیادی در بهترین حالت، متوسط است. اگر بخواهیم رژیم درمانی سلول¬های بنیادی را در آینده بهینه کنیم، درک بسیاری از عواملی که در حال حاضر اثربخشی درمان را محدود می¬کنند، حیاتی است (3).
نوع سلول: در حال حاضر، هیچ اتفاقنظری در مورد بهترین منبع و نوع سلول مناسب برای بازسازی قلب وجود ندارد (69). یک سلول بنیادی ایدهآل می¬تواند خواص انقباضی و الکتروفیزیولوژیکی، پتانسیل تکثیر، پیوند و زنده ماندن در یک ناحیه ایسکمیک و توانایی القای یک اثر پاراکرین برای تحریک بازسازی درونزای قلب را داشته باشد، اگرچه هیچ نوع سلول بنیادی همه موارد را برآورده نکرده است (105). همچنین نگرانیهای مربوط به کاربرد بالینی برخی از انواع سلولهای بالینی چندتوان شامل خطر تشکیل تراتوم و رد ایمنی بدن پس از پیوند نیز موضوع قابلتوجهی میباشد (106). تاکنون، MSCها به دلیل سهولت جداسازی همراه با ظرفیت تکثیر آزمایشگاهی، پتانسیل تمایز چند توان، ایمونوژنیسیته پایین و پتانسیل پاراکرینی، در کارآزماییها مورد توجه ویژه قرار گرفتهاند. هرچند موضوع ناهمگونی بین سلولهای BM-MNC و MSC تحقیقات را به سمت جستجوی جمعیت سلولهای بنیادی خالصتر برای افزایش پتانسیل ترمیمی بیشتر سوق داده است (69). علاوه بر این استراتژیهایی شامل تکنیکهای حذف ژن و اصلاح ژن (106) برای افزایش مناسب بودن سلولهای بنیادی برای پیوند، تضمین ایمنی و سازگاری و همچنین توسعه استراتژیهای درمانی شخصیسازی شده استفاده شده است (88).
بقای سلولهای بنیادی پیوندی در داخل بدن: علاوه بر کشمکشهای مرتبط با شناسایی و انتخاب سلولهای بنیادی، اطمینان از بقای طولانیتر و پیوند سلولهای بنیادی در میوکارد ایسکمیک یکی دیگر از چالشهای مهم است. برخی از عوامل اصلی مرگ سلولی در میوکارد ایسکمیک شامل کاهش عرضه خون، افزایش استرس اکسیداتیو و افزایش التهاب در میوکارد است. بنابراین افزایش بقای سلولهای بنیادی در عضله قلب آسیب دیده، بهوسیله مهار مسیرهای مرگ سلولی، و افزایش بیان پروتئینهای بقای سلولی ممکن است برای ترجمه بالینی آنها مهم باشد (107). در حال حاضر برخی اصلاحات ژنتیکی سلولهای بنیادی برای افزایش ترشح ژنهای حامی بقا به منظور بهبود بقای سلولهای بنیادی در قلب انجام شده است (4).
زمان و دوز بهینه: در مورد زمان دقیق تجویز سلولها، فرض بر این است که هر چه فاصله زمانی بین آسیب میوکارد و تجویز سلول¬های بنیادی بیشتر باشد، کارایی درمانی کمتر میشود. لذا زمان تزریق یک مانع چالش برانگیز برای درمان نارسایی قلبی است (3). از سوی دیگر، بهینهسازی دوز سلولهای بنیادی برای پیوند بسیار مهم است. با توجه به اینکه تعداد سلولهای مختلف میتواند منجر به نتایج نهایی متفاوتی بر اساس نوع سلول و اندام پیوند گردد، تعداد سلولهای پیوند شده باید قبل از سازگاری بالینی درمان با سلولهای بنیادی بهینه شود (4). هرچند دوز ایدهآل سلولهای بنیادی برای دستیابی به یک اثر درمانی هنوز مورد تایید واقع نشده است (3). در این زمینه عوامل متعددی باید در نظر گرفته شوند، از جمله توده میوکارد از دست رفته و تکثیر احتمالی سلولهای باقی مانده (108). بهطور متوسط، 1 میلیارد کاردیومیوسیت پس از انفارکتوس میوکارد از بین می-رود. مطالعات تغییرات زیادی را در دوزهای سلولی نشان میدهند- از 106 ×1 تا 108 ×2 سلول برای بیماران تجویز میشود- که این میزان تجویز شده بسیار کمتر از سلولهای از دست رفته پس از آسیب میوکارد است. بر همین اساس شواهد نشان میدهد که اگر هدف بازسازی میوکارد آسیب دیده باشد، نیاز به دوزهای بیشتری از سلولها میباشد. با این حال، دوزهای زیادی از سلولها ممکن است باعث تجمعات سلولی شده و خطر آریتمی را افزایش دهند (3). نکته جالب توجه این است که در چندین کارآزمایی بالینی مشخص شده است که دوز پایینتر موثرتر از دوز بالاتر میباشد (69).
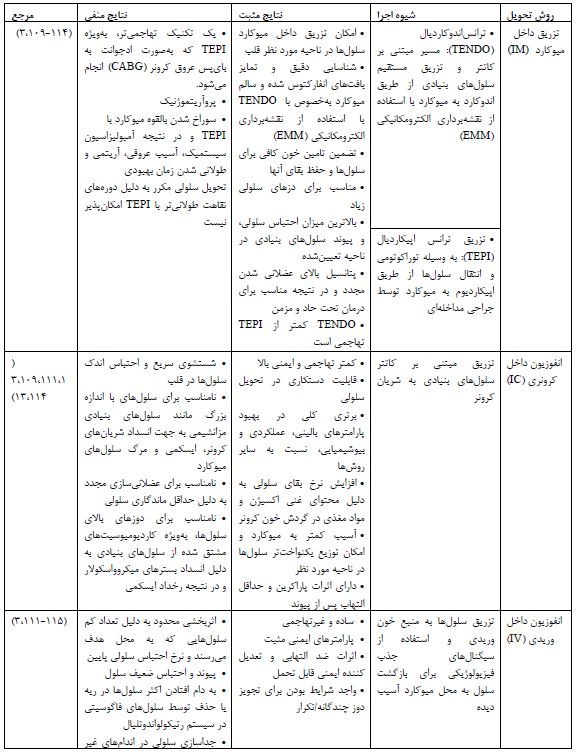
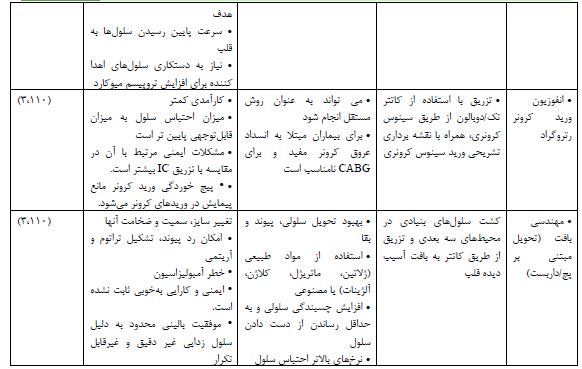
مسیر تزریق: پیوند تعداد کافی سلول به ناحیه مورد نظر میوکارد و دستیابی به حداکثر ماندگاری سلولها در این ناحیه هدف اولیه هر استراتژی تحویل سلول است (91). از سوی دیگر تحویل سلولی موفقیت آمیز به توانایی سلولها برای مهاجرت به ناحیه هدف مناسب، پتانسیل پیوند و توانایی آنها برای عملکرد همزمان با ریتم طبیعی قلب بدون تداخل بستگی دارد. چندین روش تزریق به صورت پیش بالینی مورد مطالعه قرار گرفته است، از جمله: تزریق داخل میوکارد (Intramyocardial injection (IM))، درون کرونری (Intracoronary (IC))، داخل وریدی (Intravenous (IV))، سینوس داخل کرونری رتروگراد (Retrograde intracoronary sinus) (109) و اخیرا مهندسی بافت و استفاده از ساختارهای سه بعدی (D3). تزریق IM به نوبه خود دارای 3 استراتژی، ترانس کرونری (Transcoronary)، تزریق اپیکاردیال (Trans Epicardial injection (TEPI)) و ترانس اندوکارد (Trans endocardial injection (TENDO)) میباشد (110). هرکدام از این روشها، دارای مزایا و معایب خاص خود میباشند که نیاز به توجه ویژه دارد (جدول 3).
ویژگیهای بیمار: در بین بیماران از نظر بیماریهای زمینهای، عوامل خطر، سبک زندگی و ساختارهای ژنومی تفاوتهایی وجود دارد. در حال حاضر، مشخص نیست که کدام نوع از افراد از درمان با سلولهای بنیادی بیشتر سود میبرند (42). اما به طورکلی گفته میشود، سن، فشارخون بالا، استعمال دخانیات، دیابت، داروها و وضعیت سلامت روان، همگی نقش کلیدی در موفقیت سلول درمانی ایفا میکنند و بر کیفیت سلول و واکنش گیرنده به سلولهای پیوندی تأثیر میگذارند (69). همچنین ممکن است درجه بیماری قلبی در بیمار بر اثربخشی سلول درمانی تأثیر بگذارد (3).
عوارض جانبی خاص: بررسی عوارض جانبی خاص گزارششده در چندین مطالعه، بینشهای ارزشمندی را در مورد پروفایلهای ایمنی درمانهای قلبی مبتنی بر سلول ارائه میکند و بر اهمیت هوشیاری و مدیریت پیشگیرانه عوارض احتمالی تاکید مینماید. برخی عوارض جانبی مشاهده شده در مطالعات درماتیت آلرژیک و بثورات پوستی، تاکیکاردی بطنی بود که بر لزوم نظارت کامل و مداخله پزشکی برای پرداختن به عوارض بالقوه مرتبط با این درمانها تاکید میکند. چندین نگرانی دیگر که در این حوزه مطرح میشود عبارتند از: رضایت آگاهانه و آسیبپذیری بیمار، ایمنی و اثربخشی، دسترسی نابرابر، سوالات اخلاقی در مورد سود بردن از بافتها و سلولهای انسانی (11).
جدول 3: مزایا و معایب مسیرهای تحوبل سلولهای بنیادی به قلب آسیب دیده
نتیجهگیری
نارسایی قلبی یک نگرانی بهداشت جهانی است که میلیونها نفر را در سراسر جهان تحت تاثیر قرار میدهد. با این وجود در حال حاضر هیچ گزینه درمانی مناسبی برای آن وجود ندارد و کماکان نرخ مرگ و میر آن بالا میباشد، لذا نیاز به رویکردهای درمانی نوآورانه پیش از پیش احساس میگردد. درمانهای مبتنی بر سلولهای بنیادی به دلیل ویژگیها و مزایایی متعددی که دارند به بهعنوان نامزدهای امیدوارکنندهای برای درمان نارسایی قلبی پدیدار شدهاند و نتایج امیدوارکنندهای از چندین مطالعه بالینی و تجربی وجود دارد. با اینحال، به دلیل چالشهای مرتبط با کاربرد سلول-های بنیادی ترجمه این پیشرفتها به عمل بالینی نیازمند یک رویکرد دقیق و سیستماتیک دارد و تلاشهای تحقیقاتی آینده باید در جهت بهینهسازی جنبههای مختلف درمانهای مبتنی بر این سلولها باشد. این مستلزم بررسی مجموعه متنوعی از انواع سلولهای بنیادی، مانند سلولهای پیشساز قلبی یا سلولهای اصلاحشده ژنتیکی است، تا مشخص شود کدامیک از آنها بیشترین تأثیر را در درمان دارد. افزایش اثربخشی و ایمنی درمان همچنان در اولویت است و مطالعات بالینی بیشتر برای تعیین اثربخشی و ایمنی درمان با سلولهای بنیادی، تعیین دوز مناسب و ایجاد دستورالعملهای درمان بالینی خاص، استفاده از پزشکی شخصی و درمانهای ترکیبی بسیار مهم است. فنآوریهای ویرایش ژنتیکی میتوانند در خط مقدم قرار گیرند که به محققین اجازه میدهند تا خواص درمانی سلولهای بنیادی را تقویت کنند. مطالعات همچنین باید تلاش خود را به ابداع تکنیکهای جدید تحویل، مانند داربستهای مهندسی بافت پیشرفته یا روشهای کمتهاجمی، برای افزایش دقت و پیوند سلولهای بنیادی در قلب اختصاص دهند. علاوه بر این نگرانیهای اخلاقی پیرامون کاربرد این سلولها باید مورد توجه قرار گیرد و تلاشها برای کاهش هزینه و توسعه دسترسی یکسان به درمانهای مبتنی بر سلولهای بنیادی برای جمعیت وسیعتر نیز امری ضروری میباشد.
مشارکت نویسندگان مروری
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
نارسایی قلبی (HF) یک بیماری قلبی عروقی شایع و ناتوانکننده است که تقریباً 64 میلیون نفر را در سراسر جهان تحت تأثیر قرار میدهد (1). این بیماری همچنین یکی از شایعترین علل بستری شدن در بیمارستان است (2) که با کاهش توانایی بطن برای دریافت یا خارج کردن مقادیر کافی خون و در نتیجه پرفیوژن ضعیف بافتهای محیطی مشخص میشود و اغلب باعث مرگ ناگهانی قلبی یا نارسایی اندام به دلیل عوارض ناشی از هیپوپرفیوژن میگردد (3). علت اولیه نارسایی قلبی، بیماری عروق کرونر و ایسکمی میوکارد است (4)، اما سایر عوامل خطر اصلی برای ایجاد نارسایی قلبی طیفی از عوامل زمینهای شامل دیابت شیرین، چاقی، فشار خون بالا، انفارکتوس قبلی میوکارد (MI)، سابقه خانوادگی و بیماریهای مزمن ریوی میباشد (5،6). در این میان شایعترین علت نارسایی قلبی، MI است که منجر به تغییرات ساختاری و عملکردی در قلب، آسیب سلولهای میوکارد به دلیل ایسکمی طولانیمدت و تشکیل بافت اسکار فیبروتیک میشود (7،8). علاوه بر این، آپوپتوز، کاردیومیوسیت و رگزایی دلایل مهمی برای پیشرفت HF هستند (9). علیرغم پیشرفتهای قابل توجه در تشخیص، مدیریت و درمانهای دارویی و غیردارویی، نارسایی قلبی همچنان با مرگ و میر بالایی همراه است (10) و با نرخ مرگ و میر 5 ساله 50% -25% پس از تشخیص، توسعه گزینههای درمانی موثرتر و جدیدتر ضروری میباشد (3). در جستوجو برای رویکردهای درمانی نوآورانه، درمانهای مبتنی بر سلولهای بنیادی بهعنوان نامزدهای امیدوارکننده ظاهر شدهاند که رویکردی اساساً متفاوت از درمانهای مرسوم که عمدتا بر مدیریت علائم تمرکز دارند را نشان میدهند. در چند دهه اخیر، سلولهای بنیادی به دلیل ویژگیهای مفید متعددی که دارند، از جمله ظرفیت قابلتوجهشان برای خود نوسازی و تمایز به انواع سلول¬ها، توجه محققان را در جستجوی استراتژیهای نوآورانه برای درمان نارسایی قلبی به خود جلب کردهاند (11). در حال حاضر، درمانهای مبتنی بر سلولهای بنیادی، پس از مطالعات وسیع آزمایشگاهی در مدلهای حیوانی، به مراحل پیشرفته ارزیابی بالینی در بیماران مبتلا به انفارکتوس میوکارد و نارسایی قلبی پیشرفت کرده است (12). هدف این مطالعه بحث در مورد کاربرد سلولهای بنیادی و پتانسیل درمانی آنها برای درمان نارسایی قلبی، مکانیسم عمل، چالشهای پیشرو و چشمانداز آتی به عنوان رویکرد امیدوارکننده در درمان نارسایی قلبی است.
روششناسی: در مطالعه حاضر، جمعآوری دادههای اولیه امکانپذیر نیست. تنها دادههای ثانویه با استفاده از جستجوی جامع ادبیات از پایگاههای داده معتبر، از جمله PubMed، ScienceDirect، Web of Science و Google Scholar گردآوری گردید. علاوه بر این، منابع واقعی مانند ClinicalTrials.gov برای تأیید دادههای کارآزمایی بالینی و سایر اطلاعات مهم مورد استفاده قرار گرفت. جستجو با استفاده از ترکیبی از کلمات کلیدی مرتبط و عبارات MeSH انجام شد. کلمات کلیدی شامل «نارسایی قلبی»، «سلولدرمانی»، «پزشکی بازساختی»، «سلولهای بنیادی»، «درمان»، «کارآزماییهای بالینی»، «ترمیم بافت قلبی» و اصطلاحات مرتبط بود. پس از حذف موارد تکراری، مقالات بر اساس عنوان و چکیده غربالگری شدند و سپس با بررسی متن کامل توسط محقق برای واجد شرایط بودن ارزیابی شدند. معیارهای ورود شامل مطالعات منتشر شده به زبان انگلیسی در 10 سال گذشته بود. مقالات بر اساس ارتباط آنها با درمانهای مبتنی بر سلولهای بنیادی برای درمان نارسایی قلبی انتخاب شدند و شامل تحقیقات اصلی و کارآزماییهای بالینی بودند. معیارهای خروج شامل مطالعاتی بود که به موضوع مرتبط نبودند، از جمله مطالعات غیرمرتبط با درمان با سلولهای بنیادی یا مطالعاتی که بر سایر بیماریهای قلبی متمرکز شده بودند.
سلولهای بنیادی به عنوان یک درمان امیدوارکننده: با توجه به تواناییها و مکانیسمهای عمل متفاوت سلولهای بنیادی، انتخاب نوع سلولهای بنیادی برای کاربرد در پزشکی بازساختی، حائز اهمیت است (3). در مطالعات بالینی بر روی بیماریهای قلبی عروقی، محققان بیشتر از سلولهای پیشساز اندوتلیال (EPCs)، سلولهای بنیادی مزانشیمی (MSCs)، میوبلاستهای اسکلتی (SMs)، سلولهای پیشساز/بنیادی قلب (CPCs/CSCs)، کاردیومیوسیتهای مشتق از سلولهای بنیادی جنینی انسان (hESC-CMs) و کاردیومیوسیتهای مشتق از سلولهای بنیادی پرتوان القایی انسان (hiPSC-CMs) استفاده میکنند (13). ویژگیهای انواع مختلف سلولهای بنیادی و همچنین برخی از کارآزماییهای بالینی برجسته انسانی به ترتیب در جدول 1 و جدول 2 خلاصه شده است.
جدول 1: ویژگیهای انواع مختلف سلولهای بنیادی مورد استفاده برای بازسازی قلب

جدول 2: کارآزماییهای بالینی درمان با سلولهای بنیادی در نارسایی قلبی (2024-2014).


اختصارات. BMMCs: سلولهای تک هستهای مغز استخوان؛ MSC: سلولهای بنیادی مزانشیمی؛ BMC: سلول بنیادی مشتق از مغز استخوان؛ G-CSF: فاکتور محرک کلنی گرانولوسیت؛ BMPC: سلول پیشساز مغز استخوان بالغ؛ UC-MSC: سلول بنیادی مزانشیمی مشتق از بند ناف؛ hESCs: سلولهای بنیادی جنینی انسانی؛ CDC: سلول بنیادی مشتق از کاردیوسفر؛ CSCC_ASCs: سلولهای استرومایی مزانشیمی مشتق از بافت چربی؛ MPCs: سلولهای پیشساز مزانشیمی؛ HUC-MSCs: سلول-های استرومایی مزانشیمی مشتق از بند ناف انسانی؛ LVESV: حجم انتهای سیستولیک بطن چپ؛ LVEDV: حجم انتهای دیاستولیک بطن چپ؛ LVEF: کسر جهشی بطن چپ؛ LV: بطن چپ؛ NT-proB: پپتید ناتریورتیک نوع N ترمینال pro-B؛ MACE: عوارض جانبی عمده قلبی عروقی؛ HF: نارسایی قلبی
سلولهای بنیادی جنینی (ESCs): سلولهای بنیادی جنینی (ESCs) به دلیل تواناییشان در تکثیر نامحدود و تمایز به سلولهای هر سه لایه زایایی، کاندیدهای امیدوارکنندهای برای درمان بیماریهای قلبی هستند (37). این سلولها به دلیل ارائه مزایایی مانند ویژگی، انعطافپذیری و قدرت بالا برای بازسازی قلب و توانایی جایگزینی بافت آسیب دیده قلب با سلولهای عضله قلب سالم و عملکردی توجه زیادی را برای درمان نارسایی قلبی به خود جلب کردهاند (11). با اینحال منبع جنینی ESCهای انسانی، برخی از ملاحظات اخلاقی را به دلیل استفاده از جنین برای تولید ESC برانگیخت (38). در واقع فرآیند ایجاد یک خط ESC انسانی شامل استخراج توده سلولی داخلی از بلاستوسیست در مرحله 7-5 روز است و این امر میتواند جنین را از بین ببرد (3). علاوه براین مسائل ایمنی و شواهد مبنی بر تشکیل تراتوم- نوعی تومور- بهدنبال تزریق ESCها، کاربرد آنها را محدود نموده است (39). علیرغم این چالشها، ESCها یک رویکرد امیدوارکننده برای تحقیق باقی ماندهاند و تلاشها برای کشف پتانسیل آنها در عین رسیدگی به نگرانیهای اخلاقی ادامه دارد (11).
سلولهای بنیادی مشتق شده از مغز استخوان (BMDSCs): BMDSCها یکی از شناخته شدهترین انواع سلولها در درمان بیماریهای قلبی عروقی تا به امروز بودهاند (3). مغز استخوان محل اولیه تولید سلولهای خونی و حاوی اکثر سلولهای بنیادی و پیشساز خونساز (HSPCs) است (40). هرچند، پیشرفتهای اخیر پتانسیل آن را به عنوان منبعی غنی از سلولهای بنیادی غیرخونساز با نوید درمانی در نارسایی قلبی نشان داده است. در این دسته، چندین زیرگروه از سلولها به عنوان کاندیدهای درمانی امیدبخش ظاهر شده-اند (11). مطالعات قبلی نشان دادهاند که سلولهای تک هستهای اتولوگ مغز استخوان (BMMNCs) پتانسیل بهبود عملکرد قلب را از طریق رگزایی و بازسازی مستقیم میوکارد دارند (41). شواهد نشان میدهد این سلولها فاکتورهایی نظیر VEGF و HGF آزاد میکنند (42) که میتوانند تکثیر سلولی و رگزایی را تحریک کنند، پاسخ التهابی را تعدیل کنند و حفاظت از بافت ایسکمیک را تقویت کنند (43). مزیت اصلی این سلولها، جمعآوری راحت آنها از مغز استخوان بیمار بدون نگرانی از پسزدن سیستم ایمنی (11)، ایمن بودن و عدم تغییر ویژگیهای بیولوژیکی در هنگام جداسازی میباشد (3). سلولهای پیش ساز خالص شده، مانند سلولهای CD34+ و CD133+، زیرمجموعههای تخصصیتری را در مغز استخوان تشکیل میدهند که پتانسل بازسازی بالاتر و نتایج امیدوارکنندهای را در مطالعات پیش بالینی نشان دادهاند (11).
سلولهای بنیادی مزانشیمی (MSCs): MSCها، سلولهای چند توان مشتق شده از منابعی مانند مغز استخوان، بافت چربی، پالپ دندان و خون بند ناف هستند که پتانسیل درمانی قابلتوجهی را در درمان نارسایی قلبی نشان دادهاند (44). امروزه جداسازی آنها از خون محیطی نیز امکانپذیر شده است که بهنظر میرسد منبعی امیدوارکننده برای سلول درمانی آلوژنیک باشد (45). این سلولها به دلیل تواناییشان برای تمایز مزانشیمی به ردههای استئوسیتها، سلولهای چربی، کندروسیتها، میوسیتها، کاردیومیوسیتها، فیبروبلاستها، میوفیبروبلاست، سلولهای اپیتلیال، نورونها (47،46) و سلولهای شبه اندوتلیال ظرفیت بازسازی بالایی دارند (48). ایمنیزایی مطلوب به دلیل بیان متوسط مولکول اصلی سازگاری بافتی کلاس I (MHCI)، عدم بیان کمپلکس اصلی سازگاری بافتی II (MHC II) و خواص تعدیل کننده ایمنی (51-49)، سهولت جداسازی و نگهداری، پتانسیل گسترش ex vivo، تواناییشان در ترشح طیف وسیعی از فاکتورهای رشد موثر در باسازی بافت (52) و همچنین کمترین تمایل به تشکیل تراتوم، سلولهای بنیادی مزانشیمی را به کاندیدای مطلوبی برای مطالعات بالینی تبدیل نموده است (53). گفته میشود به دلیل اثرات ضد التهابی و پیش التهابی (56-54) اثرات ضدآپوپتوتیک، آنژیوژنیک، ضد فیبروتیک (58-56) و ترشح اگزوزومهای غنی شده از mRNAها، miRNAها، سیتوکینها و فاکتورهای رشد (59)، درمان با MSC ممکن است در بیماریهای قلبی مفید باشد. پتانسیل آنتیآپوپتوتیک قوی سلولهای بنیادی مزانشیمی مربوط به کاهش بیان سیستئین-اسپارتیک اسید پروتئاز-3 (Caspase-3)، افزایش بیان ژن لنفوم 2 سلول B (BCL-2)، سورویوین و HIF-1 میباشد. این اثر بهویژه در شرایط هیپوکسیک تشدید میشود (60). ظرفیت رگزایی سلولهای بنیادی مزانشیمی مرتبط با ترشح فاکتورهای پاراکرین مختلف در مسیرهای بازسازی بافت، از جمله فاکتور رشد اندوتلیال عروقی (VEGF)، فاکتور رشد سلولهای کبدی (HGF) و فاکتور رشد تبدیلکننده TGF-β است که به رگزایی و ترمیم بافت کمک میکنند (62،61). آنها همچنین مولکولهای سرکوبگر ایمنی مانند IL-10، پروستاگلاندین E2 (PGE2)، فاکتور تحریککننده کلنی ماکروفاژها و فاکتور نکروز تومور (TNF) را آزاد میکنند (65-63) که به جلوگیری از پاسخ ایمنی نامطلوب در میوکارد ایسکمیک کمک میکند و در نتیجه بافت را ترمیم مینماید (4). فعالیت ضد فیبروتیک این سلولها با تحریک فعالیت چندین متالوپروتئیناز (MMP)، به ویژه MMP-2، MMP-9، MMP-14 (66) و در نتیجه کاهش قابلتوجه رسوب الیاف کلاژن مرتبط می-باشد. علاوه بر این، از آنجاییکه رسوب کلاژن باعث کاهش آزادسازی VEGF میشود، اثر ضد فیبروتیک ممکن است رگزایی را تحریک کند (60). تاکنون، اثرات سلولهای بنیادی مزانشیمی بر بیماریهای قلبی عروقی بهطور گسترده در مطالعات بالینی مورد بررسی قرار گرفته است که نتایج آنها حاکی از قابلیت درمانی این سلول¬ها میباشد (67). کارآزمایی MSC-HF اولین مطالعه کنترل شده با دارونما بود که در بیماران با نارسایی قلبی مزمن انجام شد و نتایج نشان داد تزریق عضلانی MSC اتولوگ، ایمن است، عملکرد میوکارد را بهبود میبخشد و پذیرش در بیمارستان را کاهش میدهد (69،68). در حال حاضر، سلولهای بنیادی مزانشیمی از مغز استخوان و بند ناف بیشترین استفاده را برای درمان بیماریهای قلب دارند و پس از آن سلولهای مشتق از بافت چربی (70). تحقیقات کنونی با هدف اصلاح انتخاب سلول¬های بنیادی مزانشیمی بر اساس ویژگیهایی مانند قابلیتهای تعدیل کننده ایمنی و پتانسیل رگزایی، و همچنین بررسی رژیمهای دوز بهینه، زمانبندی تجویز و راههای تحویل برای به حداکثر رساندن اثربخشی درمانی این سلولها در حال انجام میباشد (11).
سلولهای پیش ساز اندوتلیال (EPCs): EPCها سلولهای در حال گردش مشتق از مغز استخوان هستند که با بیان آنتیژنهای سطحی CD133، CD34 و گیرنده فاکتور رشد اندوتلیال عروقی 2 (VEGFR-2) مشخص میگردند (71). مهمترین مزیت آنها این است که میتوانند بهصورت غیرتهاجمی از خون وریدی محیطی تامین شوند (60). نشان داده شده است که تجویز فاکتور تحریک کننده کلونی گرانولوسیت (G-CSF) تعداد EPCها را در گردش خون افزایش میدهد، و امکان بسیج و جمعآوری ایمن و موثر EPC از خون را فراهم میکند (72). نتایج مطالعات نشان میدهند که EPCها در محافظت از عروق، بازیابی اندوتلیوم ناکارآمد و آسیب دیده، ترویج رگزایی و تنظیم هموستاز عروقی نقش دارند (73) و میتوانند از طریق تنظیم پاسخهای ایمنی، نئوواسکولاریزاسیون، رسوب ماتریکس خارج سلولی و تشکیل ریزمحیط قلبی باعث ترمیم قلب پس از MI شوند (74). در این رابطه، فاکتورهایی نظیر فاکتور 1 ناشی از هیپوکسی (HIF-1)، فاکتور رشد اندوتلیال عروقی (VEGF)، پروتئین SHH و فاکتور 1 آلفا مشتق از سلول استرومایی (SDF-1α) که در هایپوکسی به میزان قابلتوجهی آزاد میگردند، نقش اساسی در فعالسازی و مهاجرت EPC ایفا میکنند (75،74). پس از مهاجرت EPC، آنها میتوانند به سلولهای اندوتلیال بالغ که دارای خواص رگزایی و عروقی بسیار زیادی هستند، تمایز پیدا کنند (75). علاوه بر این، EPCها ممکن است به دلیل بیان NO سنتاز اندوتلیالی (eNOS)، قادر به تنظیم وضعیت اتساع عروقی باشند (76). در مطالعات بالینی، کاربرد EPC بیشتر در بیماران مبتلا به بیماری عروق کرونر مورد بررسی قرار گرفته است. به نظر میرسد این روش درمانی عملی، ایمن و بسیار کارآمد در پیشگیری از عوارض ناشی از انفارکتوس حاد میوکارد باشد. تزریق EPC ممکن است بازسازی مضر پس از انفارکتوس را با افزایش نئوواسکولاریزاسیون کاهش دهد (60).
سلولهای بنیادی قلبی (CSCs): در قلب بالغ، یک سلول c-kit+ خود تجدید شونده برای اولین بار توسط Beltrami و همکاران کشف شد. این سلولها از احیای بافتهای آسیب دیده پشتیبانی میکنند و میتوانند به سلولهای کاردیومیوسیت، سلولهای ماهیچه صاف و سلولهای اندوتلیال تمایز یابند (16،77). CSCها چند توان بوده و در نیچهای میوکارد قلب تقسیم و تمایز مییابند. وجه تمایز آنها با سلولهای خونساز، آنتیژنهای سطح سلولی یعنی Scą-1 و ḾDR1 و c-kit میباشد. سلولهای پیشساز مغز استخوان نیز در حال مهاجرت c-kit را نشان میدهند اما KDR، CD31، یا CD45 را نشان نمیدهند، و بدین وسیله از CSCها متمایز میگردند (78،72). قدرت تمایز این سلولها به انواع مختلف سلولهای قلبی، آنها را کاندیدای ایدهآلی برای بازسازی بافت آسیبدیده قلب نموده است. فراتر از تمایز، آنها همچنین نقش مهمی در ترشح سیتوکینها و آزادسازی اگزوزومهایی دارند که سیستم ایمنی و ریزمحیط قلبی را تعدیل میکنند (11). کارآزماییهای بالینی مانند کارآزمایی C-CURE و کارآزمایی CHART-1، ایمنی و اثربخشی درمان مبتنی بر سلولهای بنیادی قلبی را در بیماران نارسایی قلبی بررسی کردهاند، و پیشرفتهای قابلتوجهی در عملکرد قلب نشان دادهاند (25،79). هر دو این کارآزماییها نشان میدهند که درمان با سلولهای بنیادی ایمن است و این پتانسیل را دارد که مزایای طولانیمدتی را برای عملکرد قلب در مبتلا به نارسایی قلبی، ارائه دهد (3).
سلولهای بنیادی مشتق از کاردیوسفر CDCs)): کاردیوسفرها یک جمعیت سلولی ناهمگن هستند که از کشت ریزنمونههای بیوپسی قلب بهدست میآیند (43). مرکز آنها از CSCها و میوفیبروبلاستها که توسط سلولهای پشتیبان تمایز یافته، مانند عضلات صاف عروق و سلولهای اندوتلیال احاطه گردیده است، تشکیل شده است. لایه بیرونی، سلولهای بنیادی را در برابر استرس اکسیداتیو محافظت میکند و برای حفظ توانایی خودتجدیدی آنها بسیار مهم است (80). آنها میتوانند به عنوان سلولهای بنیادی/پیشساز بالغ عمل کنند و توانایی تمایز به میوسیتها و سلولهای عروقی را در مدلهای موشی نشان دادهاند (42). عمدتاً با آزاد کردن فاکتورهای پاراکرین و اگزوزومهایی که آپوپتوز سلولی را مهار میکنند و رگزایی و تکثیر کاردیومیسیت را تقویت میکنند، به ترمیم قلب کمک میکنند (81). یکی از مهمترین این عوامل، اگزوزومهای حاوی miRNA-146a و پروتئین پلاسما مرتبط با بارداری ((PAPP-A)pregnancy-associated plasma protein-A ) هستند که فعالیت ضد آپوپتوزی قوی دارند (82). این سلولها مشابه MSCها، میتوانند با آزادسازی VEGF و فاکتور رشد شبه انسولین 1 (IGF-1) رگزایی را افزایش دهند (83). اثرات آنتیفیبروتیک آنها به تولید اندوگلین که باعث مهار TGF-β میگردد، نسبت داده میشود (84). علاوه بر این گفته میشود که آنها خواص تعدیل کننده ایمنی دارند و میتوانند فنوتیپ پیشالتهابی ماکروفاژ M1 که سیتوکینهایی مانند TNF-α, IL-1 و IL-6 را ترشح میکند به فنوتیپ ضد التهابی M2 تغییر دهند و شرایط مطلوب را برای ترمیم بافت تضمین نمایند. CDCها همچنین با کاهش جذب نوتروفیل، یک اثر سرکوب کننده ایمنی اعمال میکنند (85) .بر اساس مطالعات تجربی، درمان با CDC ممکن است مزایای بسیار زیادی را در درمان بیماریهای قلبی عروقی به همراه داشته باشد. با اینحال، از آنجاییکه روش نسبتاً جدیدی است، دادههای مربوط به استفاده از آن محدود میباشد. تا به امروز، پتانسیل بازسازی CDCها بیشتر در بیماران مبتلا به بیماریهای ایسکمیک قلبی مورد بررسی قرار گرفته است (60).
میوبلاستهای اسکلتی (SM): میوبلاستهای اسکلتی (SM)، سلولهای مشتق از سلولهای پیشساز ماهیچههای اسکلتی (سلولهای ماهوارهای) با ظرفیت بازسازی هستند (15). این سلولها اولین نوع سلولی بودند که هم در آزمایشات پیشبالینی و هم در آزمایشات بالینی برای بیماریهای قلبی مورد آزمایش قرار گرفتند و نتایج حاکی از پتانسیل بالای آنها در بهبود عملکرد قلب میباشد (87،86). استفاده از میوبلاستهای اسکلتی برای بازسازی قلب به دلیل جداسازی ساده و منبع اتولوگ آنها، تکثیر سریع در شرایط آزمایشگاهی، مقاومت در برابر شرایط ایسکمیک، ظرفیت میوژنیک و خطر کم تومورزایی است (89،88). اثر درمانی میوبلاستها ممکن است به تولید عوامل محرک رگزایی و یا تحرک سلولهای بنیادی نسبت داده میشود؛ مانند VEGF، HGF و SDF-1 (90). علیرغم پتانسیل درمانی و مزایای متعددشان، چالش-هایی در زمینه استفاده از این سلولها وجود دارد، از جمله؛ یکپارچگی عملکردی با بافت قلبی موجود، و همچنین نگرانیهای مربوط به آریتمی، پاسخهای ایمنی، بقای محدود سلولهای پیوندی، و تشکیل بالقوه بافت اسکار (11). به همین دلیل تمرکز بر میوبلاستهای اسکلتی برای درمان بیماریهای قلبی کاهش یافته است (91،88).
سلولهای بنیادی پرتوان القایی (iPSCs): این سلول¬ها برای اولین بار در سال 2006 توسط یاماناکا و همکارانش از فیبروبلاستها تولید شدند. محققان بهوسیله برنامهریزی مجدد سلولهای سوماتیک بالغ با استفاده از چهار فاکتور رونویسی شامل Oct3/4 ، Klf4، Sox2 و c-Myc، سلولهای سوماتیک تمایز یافته پرتوان را القا کردند (93،92). با توسعه سریع تحقیقات در حوزه این کشف نوآورانه، بهدست آوردن iPSCها تقریباً از هر نوع سلول سوماتیک بالغ، حتی از سلولهایی که به روشی کم تهاجمی از منابع سلولی به راحتی در دسترس هستند، از جمله لنفوسیتهای T خون محیطی، سلولهای لولهای کلیوی از نمونههای ادرار و کراتینوسیتها از فولیکولهای مو، امکانپذیر شد (95،94). بر خلاف همتایان جنینی خود، iPSCها به دلیل در دسترس بودن و پذیرش اخلاقی، برای مدلسازی بیماری و غربالگری دارو بسیار مورد توجه قرار گرفتهاند (96). iPSCها دارای مزیت منحصربهفردی هستند که میتوانند بهصورت کاملاً کنترل شده و گام به گام متمایز شوند. این به محققان اجازه میدهد تا پیشسازهای خاص دودمانی مانند سلولهای پیشساز قلبی (CPC) را ایجاد کنند (3). بهطور کلی نتایج حاکی از این است که iPSCها پتانسیل بیش از حدی برای بازسازی قلب دارند و کاردیومیوسیتهای مشتق شده از آنها ویژگیهای عملی سلولهای قلبی مانند انقباض، ضربان خودبهخود و بیان کانال یونی دارند (15)، که به این معنی است که بیوپسی برای تولید CSC در آینده ضروری نخواهد بود. این میتواند بهویژه در شرایط مرتبط با از دست دادن میوسیت (به عنوان مثال، سندرم حاد کرونری) برای معکوس کردن یا ترمیم آسیب قلبی مفید باشد (60). iPSCها همچنین میتوانند به سلولهای اندوتلیال شبه شریانی که مقادیر زیادی NO تولید میکنند تمایز پیدا کنند، که نشاندهنده کاربرد احتمالی آنها در نارسایی قلبی است (98،97). با اینحال، آنالیزهای عملکردی کاردیومیوسیتهای مشتق شده از iPSC نشان داده است که این سلولها نابالغ هستند و بیشتر به کاردیومیوسیتهای جنینی مربوط میشوند تا به قلب بالغ، که این یکی از چالشهای مهم برای کاربرد این سلولها است (100،99). همچنین، مطالعات مختلف ناپایداریهای ژنومی را در خطوط iPSC توصیف کردند که ناشی از تغییرات از قبل موجود در سلولهای بالغ والدین یا جهشهایی است که در طول فرآیند برنامهریزی مجدد و زمان کشت اتفاق میافتد (102،101). به همین دلیل کاربردهای بالینی این سلولها با محدودیتها جدی مواجه میباشد و برای اطمینان از ترجمه بالینی موفق، پرداختن به چالشهای مرتبط با استفاده از iPSCها، مانند خطر تشکیل تراتوم، هزینه بالای تولید (103) و کنترل کیفی دقیق برای دسترسی ایمن و کارآمد به iPSCها ضروری میباشد (104).
محدودیتها و چالش¬های استفاده از سلولهای بنیادی: اگرچه پروفایل ایمنی سلول درمانی رضایتبخش بهنظر میرسد اما اثربخشی کلی درمان با سلول¬های بنیادی در بهترین حالت، متوسط است. اگر بخواهیم رژیم درمانی سلول¬های بنیادی را در آینده بهینه کنیم، درک بسیاری از عواملی که در حال حاضر اثربخشی درمان را محدود می¬کنند، حیاتی است (3).
نوع سلول: در حال حاضر، هیچ اتفاقنظری در مورد بهترین منبع و نوع سلول مناسب برای بازسازی قلب وجود ندارد (69). یک سلول بنیادی ایدهآل می¬تواند خواص انقباضی و الکتروفیزیولوژیکی، پتانسیل تکثیر، پیوند و زنده ماندن در یک ناحیه ایسکمیک و توانایی القای یک اثر پاراکرین برای تحریک بازسازی درونزای قلب را داشته باشد، اگرچه هیچ نوع سلول بنیادی همه موارد را برآورده نکرده است (105). همچنین نگرانیهای مربوط به کاربرد بالینی برخی از انواع سلولهای بالینی چندتوان شامل خطر تشکیل تراتوم و رد ایمنی بدن پس از پیوند نیز موضوع قابلتوجهی میباشد (106). تاکنون، MSCها به دلیل سهولت جداسازی همراه با ظرفیت تکثیر آزمایشگاهی، پتانسیل تمایز چند توان، ایمونوژنیسیته پایین و پتانسیل پاراکرینی، در کارآزماییها مورد توجه ویژه قرار گرفتهاند. هرچند موضوع ناهمگونی بین سلولهای BM-MNC و MSC تحقیقات را به سمت جستجوی جمعیت سلولهای بنیادی خالصتر برای افزایش پتانسیل ترمیمی بیشتر سوق داده است (69). علاوه بر این استراتژیهایی شامل تکنیکهای حذف ژن و اصلاح ژن (106) برای افزایش مناسب بودن سلولهای بنیادی برای پیوند، تضمین ایمنی و سازگاری و همچنین توسعه استراتژیهای درمانی شخصیسازی شده استفاده شده است (88).
بقای سلولهای بنیادی پیوندی در داخل بدن: علاوه بر کشمکشهای مرتبط با شناسایی و انتخاب سلولهای بنیادی، اطمینان از بقای طولانیتر و پیوند سلولهای بنیادی در میوکارد ایسکمیک یکی دیگر از چالشهای مهم است. برخی از عوامل اصلی مرگ سلولی در میوکارد ایسکمیک شامل کاهش عرضه خون، افزایش استرس اکسیداتیو و افزایش التهاب در میوکارد است. بنابراین افزایش بقای سلولهای بنیادی در عضله قلب آسیب دیده، بهوسیله مهار مسیرهای مرگ سلولی، و افزایش بیان پروتئینهای بقای سلولی ممکن است برای ترجمه بالینی آنها مهم باشد (107). در حال حاضر برخی اصلاحات ژنتیکی سلولهای بنیادی برای افزایش ترشح ژنهای حامی بقا به منظور بهبود بقای سلولهای بنیادی در قلب انجام شده است (4).
زمان و دوز بهینه: در مورد زمان دقیق تجویز سلولها، فرض بر این است که هر چه فاصله زمانی بین آسیب میوکارد و تجویز سلول¬های بنیادی بیشتر باشد، کارایی درمانی کمتر میشود. لذا زمان تزریق یک مانع چالش برانگیز برای درمان نارسایی قلبی است (3). از سوی دیگر، بهینهسازی دوز سلولهای بنیادی برای پیوند بسیار مهم است. با توجه به اینکه تعداد سلولهای مختلف میتواند منجر به نتایج نهایی متفاوتی بر اساس نوع سلول و اندام پیوند گردد، تعداد سلولهای پیوند شده باید قبل از سازگاری بالینی درمان با سلولهای بنیادی بهینه شود (4). هرچند دوز ایدهآل سلولهای بنیادی برای دستیابی به یک اثر درمانی هنوز مورد تایید واقع نشده است (3). در این زمینه عوامل متعددی باید در نظر گرفته شوند، از جمله توده میوکارد از دست رفته و تکثیر احتمالی سلولهای باقی مانده (108). بهطور متوسط، 1 میلیارد کاردیومیوسیت پس از انفارکتوس میوکارد از بین می-رود. مطالعات تغییرات زیادی را در دوزهای سلولی نشان میدهند- از 106 ×1 تا 108 ×2 سلول برای بیماران تجویز میشود- که این میزان تجویز شده بسیار کمتر از سلولهای از دست رفته پس از آسیب میوکارد است. بر همین اساس شواهد نشان میدهد که اگر هدف بازسازی میوکارد آسیب دیده باشد، نیاز به دوزهای بیشتری از سلولها میباشد. با این حال، دوزهای زیادی از سلولها ممکن است باعث تجمعات سلولی شده و خطر آریتمی را افزایش دهند (3). نکته جالب توجه این است که در چندین کارآزمایی بالینی مشخص شده است که دوز پایینتر موثرتر از دوز بالاتر میباشد (69).
مسیر تزریق: پیوند تعداد کافی سلول به ناحیه مورد نظر میوکارد و دستیابی به حداکثر ماندگاری سلولها در این ناحیه هدف اولیه هر استراتژی تحویل سلول است (91). از سوی دیگر تحویل سلولی موفقیت آمیز به توانایی سلولها برای مهاجرت به ناحیه هدف مناسب، پتانسیل پیوند و توانایی آنها برای عملکرد همزمان با ریتم طبیعی قلب بدون تداخل بستگی دارد. چندین روش تزریق به صورت پیش بالینی مورد مطالعه قرار گرفته است، از جمله: تزریق داخل میوکارد (Intramyocardial injection (IM))، درون کرونری (Intracoronary (IC))، داخل وریدی (Intravenous (IV))، سینوس داخل کرونری رتروگراد (Retrograde intracoronary sinus) (109) و اخیرا مهندسی بافت و استفاده از ساختارهای سه بعدی (D3). تزریق IM به نوبه خود دارای 3 استراتژی، ترانس کرونری (Transcoronary)، تزریق اپیکاردیال (Trans Epicardial injection (TEPI)) و ترانس اندوکارد (Trans endocardial injection (TENDO)) میباشد (110). هرکدام از این روشها، دارای مزایا و معایب خاص خود میباشند که نیاز به توجه ویژه دارد (جدول 3).
ویژگیهای بیمار: در بین بیماران از نظر بیماریهای زمینهای، عوامل خطر، سبک زندگی و ساختارهای ژنومی تفاوتهایی وجود دارد. در حال حاضر، مشخص نیست که کدام نوع از افراد از درمان با سلولهای بنیادی بیشتر سود میبرند (42). اما به طورکلی گفته میشود، سن، فشارخون بالا، استعمال دخانیات، دیابت، داروها و وضعیت سلامت روان، همگی نقش کلیدی در موفقیت سلول درمانی ایفا میکنند و بر کیفیت سلول و واکنش گیرنده به سلولهای پیوندی تأثیر میگذارند (69). همچنین ممکن است درجه بیماری قلبی در بیمار بر اثربخشی سلول درمانی تأثیر بگذارد (3).
عوارض جانبی خاص: بررسی عوارض جانبی خاص گزارششده در چندین مطالعه، بینشهای ارزشمندی را در مورد پروفایلهای ایمنی درمانهای قلبی مبتنی بر سلول ارائه میکند و بر اهمیت هوشیاری و مدیریت پیشگیرانه عوارض احتمالی تاکید مینماید. برخی عوارض جانبی مشاهده شده در مطالعات درماتیت آلرژیک و بثورات پوستی، تاکیکاردی بطنی بود که بر لزوم نظارت کامل و مداخله پزشکی برای پرداختن به عوارض بالقوه مرتبط با این درمانها تاکید میکند. چندین نگرانی دیگر که در این حوزه مطرح میشود عبارتند از: رضایت آگاهانه و آسیبپذیری بیمار، ایمنی و اثربخشی، دسترسی نابرابر، سوالات اخلاقی در مورد سود بردن از بافتها و سلولهای انسانی (11).
جدول 3: مزایا و معایب مسیرهای تحوبل سلولهای بنیادی به قلب آسیب دیده


نتیجهگیری
نارسایی قلبی یک نگرانی بهداشت جهانی است که میلیونها نفر را در سراسر جهان تحت تاثیر قرار میدهد. با این وجود در حال حاضر هیچ گزینه درمانی مناسبی برای آن وجود ندارد و کماکان نرخ مرگ و میر آن بالا میباشد، لذا نیاز به رویکردهای درمانی نوآورانه پیش از پیش احساس میگردد. درمانهای مبتنی بر سلولهای بنیادی به دلیل ویژگیها و مزایایی متعددی که دارند به بهعنوان نامزدهای امیدوارکنندهای برای درمان نارسایی قلبی پدیدار شدهاند و نتایج امیدوارکنندهای از چندین مطالعه بالینی و تجربی وجود دارد. با اینحال، به دلیل چالشهای مرتبط با کاربرد سلول-های بنیادی ترجمه این پیشرفتها به عمل بالینی نیازمند یک رویکرد دقیق و سیستماتیک دارد و تلاشهای تحقیقاتی آینده باید در جهت بهینهسازی جنبههای مختلف درمانهای مبتنی بر این سلولها باشد. این مستلزم بررسی مجموعه متنوعی از انواع سلولهای بنیادی، مانند سلولهای پیشساز قلبی یا سلولهای اصلاحشده ژنتیکی است، تا مشخص شود کدامیک از آنها بیشترین تأثیر را در درمان دارد. افزایش اثربخشی و ایمنی درمان همچنان در اولویت است و مطالعات بالینی بیشتر برای تعیین اثربخشی و ایمنی درمان با سلولهای بنیادی، تعیین دوز مناسب و ایجاد دستورالعملهای درمان بالینی خاص، استفاده از پزشکی شخصی و درمانهای ترکیبی بسیار مهم است. فنآوریهای ویرایش ژنتیکی میتوانند در خط مقدم قرار گیرند که به محققین اجازه میدهند تا خواص درمانی سلولهای بنیادی را تقویت کنند. مطالعات همچنین باید تلاش خود را به ابداع تکنیکهای جدید تحویل، مانند داربستهای مهندسی بافت پیشرفته یا روشهای کمتهاجمی، برای افزایش دقت و پیوند سلولهای بنیادی در قلب اختصاص دهند. علاوه بر این نگرانیهای اخلاقی پیرامون کاربرد این سلولها باید مورد توجه قرار گیرد و تلاشها برای کاهش هزینه و توسعه دسترسی یکسان به درمانهای مبتنی بر سلولهای بنیادی برای جمعیت وسیعتر نیز امری ضروری میباشد.
مشارکت نویسندگان مروری
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- Savarese G, Becher PM, Lund LH, Seferovic P, Rosano GMC, Coats AJS. Global Burden of Heart Failure: A Comprehensive and Updated Review of Epidemiology. Cardiovasc Res 2023; 118(17): 3272-287.
2- Zehnder AR, Pedrosa Carrasco AJ, Etkind SN. Factors Associated with Hospitalisations of Patients with Chronic Heart Failure Approaching the End of Life: A Systematic Review. Palliat Med 2022; 36(10): 1452-68.
3- Rheault-Henry M, White I, Grover D, Atoui R. Stem Cell Therapy for Heart Failure: Medical Breakthrough, or Dead End? World J Stem Cells 2021; 13(4): 236-59.
4- Gill JK, Rehsia SK, Verma E, Sareen N, Dhingra S. Stem Cell Therapy for Cardiac Regeneration: Past, Present, and Future. Can J Physiol Pharmacol 2024; 102(3): 161-79.
5- Tanai E, Frantz S. Pathophysiology of Heart Failure. Compr Physiol 2015; 6(1): 187-214.
6- McDonagh TA, Metra M, Adamo M, Gardner RS, Baumbach A, Böhm M, et al. 2021 ESC Guidelines for the Diagnosis and Treatment of Acute and Chronic Heart Failure: Developed by the Task Force for the Diagnosis and Treatment of Acute and Chronic Heart Failure of the European Society of Cardiology (ESC). with The Special Contribution of The Heart Failure Association (HFA) of the ESC. Eur J Heart Fail 2022; 24(1): 4-131.
7- Mouton AJ, Rivera OJ, Lindsey ML. Myocardial Infarction Remodeling that Progresses to Heart Failure: A Signaling Misunderstanding. Am J Physiol Heart Circ Physiol 2018; 315(1): H71-H79
8- Cahill TJ, Kharbanda RK. Heart Failure after Myocardial Infarction in the Era of Primary Percutaneous Coronary Intervention: Mechanisms, Incidence and Identification of Patients at Risk. World J Cardiol 2017; 9(5): 407-415.
9- Pan Y, Wu W, Jiang X, Liu Y. Mesenchymal Stem Cell-Derived Exosomes In Cardiovascular And Cerebrovascular Diseases: From Mechanisms To Therapy. Biomed Pharmacother 2023; 163: 114817.
10- Smadja DM. Stem Cell Therapy, Artificial Heart or Xenotransplantation: What will be New “Regenerative” Strategies in Heart Failure during the Next Decade? Stem Cell Rev Rep. 2023; 19(3): 694-99.
11- Olatunji G, Kokori E, Yusuf I, Ayanleke E, Damilare O, Afolabi S, et al. Stem Cell-Based Therapies for Heart Failure Management: A Narrative Review of Current Evidence and Future Perspectives. Heart Failure Reviews 2024; 29(3): 573-98.
12- Kalou Y, Al-Khani AM, Haider KH. Bone Marrow Mesenchymal Stem Cells for Heart Failure Treatment: A Systematic Review and Meta-Analysis. Heart Lung Circ 2023; 32(7): 870-80.
13- Guo R, Morimatsu M, Feng T, Lan F, Chang D, Wan F, et al. Stem Cell-Derived Cell Sheet Transplantation for Heart Tissue Repair in Myocardial Infarction. Stem Cell Research & Therapy 2020; 11(1): 19.
14- Banerjee MN, Bolli R, Hare JM. Clinical Studies of Cell Therapy in Cardiovascular Medicine: Recent Developments and Future Directions. Cir Res 2018; 123(2): 266-87.
15- Rikhtegar R, Pezeshkian M, Dolati S, Safaie N, Rad AA, Mahdipour M, et al. Stem Cells as Therapy for Heart Disease: Ipscs, Escs, Cscs, and Skeletal Myoblasts. Biomed Pharmacother 2019; 109: 304-13.
16- Mahmud S, Alam S, Emon NU, Boby UH, Ahmed F, Monjur-Al-Hossain ASM, et al. Opportunities and Challenges in Stem Cell Therapy in Cardiovascular Diseases: Position Standing in 2022. Saudi Pharm J 2022; 30(9): 1360-71.
17- Jalal S, Dastidar S, Tedesco FS. Advanced Models of Human Skeletal Muscle Differentiation, Development and Disease: Three-Dimensional Cultures, Organoids and Beyond. Curr Opin Cell Biol 2021; 73: 92-104
18- Araki K, Miyagawa S, Kawamura T, Ishii R, Watabe T, Harada A, et al. Autologous Skeletal Myoblast Patch Implantation Prevents the Deterioration of Myocardial Ischemia and Right Heart Dysfunction in a Pressure-Overloaded Right Heart Porcine Model. Plos one 2021; 16(2): e0247381.
19- Youssef AA, Ross EG, Bolli R, Pepine CJ, Leeper NJ, Yang PC. The Promise and Challenge of Induced Pluripotent Stem Cells for Cardiovascular Applications. JACC Basic Transl Sci. 2016; 1(6): 510-23.
20- Heldman AW, DiFede DL, Fishman JE, Zambrano JP, Trachtenberg BH, Karantalis V, et al. Transendocardial Mesenchymal Stem Cells and Mononuclear Bone Marrow Cells for Ischemic Cardiomyopathy: The TAC-HFT Randomized Trial. JAMA 2014; 311(1): 62-73.
21- Nasseri BA, Ebell W, Dandel M, Kukucka M, Gebker R, Doltra A, et al. Autologous CD133+ Bone Marrow Cells and Bypass Grafting for Regeneration of Ischaemic Myocardium: The Cardio133 Trial. Eur Heart J 2014; 35(19): 1263-74.
22- Hamshere S, Arnous S, Choudhury T, Choudry F, Mozid A, Yeo C, et al. Randomized Trial of Combination Cytokine and Adult Autologous Bone Marrow Progenitor Cell Administration in Patients with Non-Ischaemic Dilated Cardiomyopathy: The REGENERATE-DCM Clinical Trial. Eur Heart J2015; 36(44): 3061-9.
23- Choudry F, Hamshere S, Saunders N, Veerapen J, Bavnbek K, Knight C, et al. A Randomized Double-Blind Control Study of Early Intra-Coronary autologous Bone Marrow Cell Infusion in Acute Myocardial Infarction: The REGENERATE-AMI Clinical Trial. Eur heart J 2016; 37(3): 256-63.
24- Patel AN, Henry TD, Quyyumi AA, Schaer GL, Anderson RD, Toma C, et al. Ixmyelocel-T for Patients with Ischaemic Heart Failure: A Prospective Randomised Double-Blind Trial. Lancet 2016; 387(10036): 2412-21.
25- Bartunek J, Terzic A, Davison BA, Filippatos GS, Radovanovic S, Beleslin B, et al. Cardiopoietic Cell Therapy for Advanced Ischaemic Heart Failure: Results at 39 Weeks of the Prospective, Randomized, Double Blind, Sham-Controlled CHART-1 Clinical Trial. Eur Heart J 2017; 38(9): 648-60.
26- Bartolucci J, Verdugo FJ, González PL, Larrea RE, Abarzua E, Goset C, et al. Safety and Efficacy of the Intravenous Infusion of Umbilical Cord Mesenchymal Stem Cells in Patients with Heart Failure: A Phase 1/2 Randomized Controlled Trial (RIMECARD Trial [Randomized Clinical Trial of Intravenous Infusion Umbilical Cord Mesenchymal Stem Cells on Cardiopathy]). Circ Res 2017; 121(10): 1192-204.
27- Menasché P, Vanneaux V, Hagège A, Bel A, Cholley B, Parouchev A, et al. Transplantation of Human Embryonic Stem Cell–Derived Cardiovascular Progenitors for Severe Ischemic Left Ventricular Dysfunction. J Am College of Cardiol 2018; 71(4): 429-38.
28- Bolli R, Hare JM, March KL, Pepine CJ, Willerson JT, Perin EC, et al. Rationale and Design of the CONCERT-HF Trial (Combination of Mesenchymal and C-Kit+ Cardiac Stem Cells as Regenerative Therapy for Heart Failure). Circ Res 2018; 122(12): 1703-15.
29- Makkar RR, Kereiakes DJ, Aguirre F, Kowalchuk G, Chakravarty T, Malliaras K, et al. Intracoronary Allogeneic Heart Stem Cells to Achieve Myocardial Regeneration (ALLSTAR): A Randomized, Placebo-Controlled, Double-Blinded Trial. Eur Heart J 2020; 41(36): 3451-58.
30- Chakravarty T, Makkar RR, Ascheim DD, Traverse JH, Schatz R, DeMaria A, et al. Allogeneic Heart Stem Cells to Achieve Myocardial Regeneration (ALLSTAR) Trial: Rationale and Design. Cell Transp 2017; 26(2): 205-14.
31- Ostovaneh MR, Makkar RR, Ambale-Venkatesh B, Ascheim D, Chakravarty T, Henry TD, et al. Effect of Cardiosphere-Derived Cells on Segmental Myocardial Function after Myocardial Infarction: ALLSTAR Randomised Clinical Trial. Open Heart 2021; 8(2): e001614.
32- Mathiasen AB, Qayyum AA, Jørgensen E, Helqvist S, Kofoed KF, Haack‐Sørensen M, et al. Bone Marrow‐Derived Mesenchymal Stromal Cell Treatment in Patients with Ischaemic Heart Failure: Final 4‐Year Follow‐Up of the MSC‐HF Trial. Eur J Heart Failure 2020; 22(5): 884-92.
33- Ulus AT, Mungan C, Kurtoglu M, Celikkan FT, Akyol M, Sucu M, et al. Intramyocardial Transplantation of Umbilical Cord Mesenchymal Stromal Cells in Chronic Ischemic Cardiomyopathy: A Controlled, Randomized Clinical Trial (HUC-HEART Trial). Int J Stem Cells 2020; 13(3): 364-76.
34- Bolli R, Mitrani RD, Hare JM, Pepine CJ, Perin EC, Willerson JT, et al. A Phase II Study of Autologous Mesenchymal Stromal Cells and C‐Kit Positive Cardiac Cells, Alone or in Combination, in Patients with Ischaemic Heart Failure: The CCTRN CONCERT‐HF Trial. Eur J Heart Fail 2021; 23(4): 661-74.
35- Qayyum AA, van Klarenbosch B, Frljak S, Cerar A, Poglajen G, Traxler‐Weidenauer D, et al. Effect of Allogeneic Adipose Tissue‐Derived Mesenchymal Stromal Cell Treatment in Chronic Ischaemic Heart Failure with Reduced Ejection Fraction–The SCIENCE Trial. Eur J Heart Fail 2023; 25(4): 576-87
36- Perin EC, Borow KM, Henry TD, Mendelsohn FO, Miller LW, Swiggum E, et al. Randomized Trial of Targeted Transendocardial Mesenchymal Precursor Cell Therapy in Patients with Heart Failure. J American College of Cardiology 2023; 81(9): 849-63.
37- Nair N, Gongora E. Stem Cell Therapy in Heart Failure: Where Do We Stand Today? Biochim Biophys Acta Mol Basis Dis 2020; 1866(4): 165489.
38- Glicksman MA. Induced Pluripotent Stem Cells: The Most Versatile Source For Stem Cell Therapy. Clin ther 2018; 40(7): 1060-5.
39- Volarevic V, Markovic BS, Gazdic M, Volarevic A, Jovicic N, Arsenijevic N, et al. Ethical and Safety Issues of Stem Cell-Based Therapy. Int J Med Sci 2018; 15(1): 36-45.
40- Mende N, Laurenti E. Hematopoietic Stem and Progenitor Cells Outside the Bone Marrow: Where, When, and Why. Exp Hematol 2021; 104: 9-16
41- Hu S, Liu S, Zheng Z, Yuan X, Li L, Lu M, et al. Isolated Coronary Artery Bypass Graft Combined With Bone Marrow Mononuclear Cells Delivered Through A Graft Vessel for Patients with Previous Myocardial Infarction and Chronic Heart Failure: A Single-Center, Randomized, Double-Blind, Placebo-Controlled Clinical Trial. J Am Coll Cardiol 2011; 57(24): 2409-15.
42- Chowdhury MA, Zhang JJ, Chen WCW. Stem Cell Therapy For Heart Failure in the Clinics: New Perspectives in the Era of Precision Medicine and Artificial Intelligence. Front Physiol 2024; 14: 1344885.
43- Kasai-Brunswick TH, Carvalho AB, de Carvalho ACC. Stem Cell Therapies in Cardiac Diseases: Current Status and Future Possibilities. World J Stem Cells 2021; 13(9): 1231-47.
44- Nasser MI, Qi X, Zhu S, He Y, Zhao M, Guo H, et al. Current Situation and Future of Stem Cells in Cardiovascular Medicine. Biomed Pharmacother 2020; 132: 110813.
45- Dabiri S, Derakhshani A, Vahidi R, Farsinejad A. Peripheral Blood-Derived Mesenchymal Stem Cells: Growth Factor-Free Isolation, Molecular Characterization And Differentiation. Iran J Pathol 2018; 13(4): 461-66.
46- Visweswaran M, Pohl S, Arfuso F, Newsholme P, Dilley R, Pervaiz S, et al. Multi-Lineage Differentiation of Mesenchymal Stem Cells–To Wnt, or Not Wnt. Int J Biochem Cell Biol 2015; 68: 139-47
47- Lappin T, Cheng T. An Urgent Need for Standardization of Stem Cells and Stem Cell-Derived Products Toward Clinical Applications. Stem Cells Transl Med 2021; 10 Suppl 2(Suppl 2): S1-S3.
48- Cannella V, Piccione G, Altomare R, Marino A, Di Marco P, Russotto L, et al. Differentiation and Characterization of Rat Adipose Tissue Mesenchymal Stem Cells Into Endothelial‐Like Cells. Anat Histol Embryol 2018; 47(1): 11-20.
49- Yu H, Lu K, Zhu J, Wang Ja. Stem Cell Therapy for Ischemic Heart Diseases. Br Med Bull 2017;121(1): 135-54.
50- Bolli R, Solankhi M, Tang X-L, Kahlon A. Cell Therapy in Patients with Heart Failure: A Comprehensive Review and Emerging Concepts. Cardiovasc Res 2022; 118(4): 951-76.
51- Ankrum JA, Ong JF, Karp JM. Mesenchymal Stem Cells: Immune Evasive, Not Immune Privileged. Nat Biotechnol 2014; 32(3): 252-60.
52- Heathman TRJ, Rafiq QA, Chan AKC, Coopman K, Nienow AW, Kara B, et al. Characterization of Human Mesenchymal Stem Cells from Multiple Donors and the Implications for Large Scale Bioprocess Development. Biochem Engineering Journal 2016; 108: 14-23.
53- Neri S. Genetic Stability of Mesenchymal Stromal Cells for Regenerative Medicine Applications: A Fundamental Biosafety Aspect. Int J Mol Sci 2019; 20(10): 2406.
54- Bartosh TJ, Ylostalo JH. Preparation of Anti‐Inflammatory Mesenchymal Stem/Precursor Cells (Mscs) Through Sphere Formation Using Hanging‐Drop Culture Technique. Curr Protoc Stem Cell Biol 2014; 28: 2B.6.1-2B.6.23
55- Golpanian S, Wolf A, Hatzistergos KE, Hare JM. Rebuilding The Damaged Heart: Mesenchymal Stem Cells, Cell-Based Therapy, and Engineered Heart Tissue. Physiol Rev 2016; 96(3): 1127-68.
56- White SJ, Chong JJH. Mesenchymal Stem Cells in Cardiac Repair: Effects on Myocytes, Vasculature, and Fibroblasts. Clin Ther 2020; 42(10): 1880-91.
57- Guo Y, Yu Y, Hu S, Chen Y, Shen Z. The Therapeutic Potential of Mesenchymal Stem Cells for Cardiovascular Diseases. Cell Death & Disease 2020; 11(5): 349.
58- Wysoczynki M, Khan A, Bolli R. New Paradigms in Cell Therapy: Repeated Dosing, Intravenous Delivery, Immunomodulatory Actions, and New Cell Types. Circ Res 2018; 123(2): 138-58.
59- Bian D, Wu Y, Song G, Azizi R, Zamani A. The Application of Mesenchymal Stromal Cells (Mscs) and their Derivative Exosome in Skin Wound Healing: A Comprehensive Review. Stem Cell Res Ther 2022; 13(1): 24.
60- Domaszk O, Skwarek A, Wojciechowska M. In Search of the Holy Grail: Stem Cell Therapy as a Novel Treatment of Heart Failure with Preserved Ejection Fraction. Int J Mol Sci 2023; 24(5): 4903.
61- Jin Y, Li S, Yu Q, Chen T, Liu D. Application of Stem Cells in Regeneration Medicine. MedComm 2023; 4(4): e291.
62- González PL, Carvajal C, Cuenca J, Alcayaga-Miranda F, Figueroa FE, Bartolucci J, et al. Chorion Mesenchymal Stem Cells Show Superior Differentiation, Immunosuppressive, and Angiogenic Potentials in Comparison with Haploidentical Maternal Placental Cells. Stem Cells Trans Med 2015; 4(10): 1109-21.
63- Jiang W, Xu J. Immune Modulation by Mesenchymal Stem Cells. Cell prolif 2020; 53(1): e12712.
64- Yan W, Abu-El-Rub E, Saravanan S, Kirshenbaum LA, Arora RC, Dhingra S. Inflammation in Myocardial Injury: Mesenchymal Stem Cells as Potential Immunomodulators. Am J Physiol Heart Circ Physiol 2019; 317(2): H213-H225
65- Wang Y, Chen X, Cao W, Shi Y. Plasticity of Mesenchymal Stem Cells in Immunomodulation: Pathological and Therapeutic Implications. Nat Immunol 2014; 15(11): 1009-16.
66- Poomani MS, Mariappan I, Perumal R, Regurajan R, Muthan K, Subramanian V. Mesenchymal Stem Cell (Mscs) Therapy for Ischemic Heart Disease: A Promising Frontier. Global Heart 2022; 17(1): 19.
67- Attar A, Bahmanzadegan Jahromi F, Kavousi S, Monabati A, Kazemi A. Mesenchymal Stem Cell Transplantation after Acute Myocardial Infarction: A Meta-Analysis of Clinical Trials. Stem Cell Res Ther 2021; 12(1): 600.
68- Mathiasen AB, Qayyum AA, Jørgensen E, Helqvist S, Fischer-Nielsen A, Kofoed KF, et al. Bone Marrow-Derived Mesenchymal Stromal Cell Treatment in Patients with Severe Ischaemic Heart Failure: A Randomized Placebo-Controlled Trial (MSC-HF Trial). Eur Heart J 2015; 36(27): 1744-53.
69- Nigro P, Bassetti B, Cavallotti L, Catto V, Carbucicchio C, Pompilio G. Cell Therapy for Heart Disease after 15 Years: Unmet Expectations. Pharmacol Res 2018; 127: 77-91.
70- Kabat M, Bobkov I, Kumar S, Grumet M. Trends in Mesenchymal Stem Cell Clinical Trials 2004-2018: Is Efficacy Optimal in a Narrow Dose Range? Stem Cells Transl Med 2020; 9(1): 17-27.
71- Kakzanov Y, Sevilya Z, Veturi M, Goldman A, Lev E. Circulating Endothelial Progenitor Cells in Patients with Heart Failure with Preserved versus Reduced Ejection Fraction. Isr Med Assoc J. 2021; 23(6): 364-8.
72- Michler RE. The Current Status of Stem Cell Therapy in Ischemic Heart Disease. J Cardiac Surgery 2018; 33(9): 520-31.
73- Kourek C, Karatzanos E, Psarra K, Georgiopoulos G, Delis D, Linardatou V, et al. Endothelial Progenitor Cells Mobilization after Maximal Exercise According to Heart Failure Severity. World J Cardiol 2020; 12(11): 526-39.
74- Huang H, Huang W. Regulation of Endothelial Progenitor Cell Functions in Ischemic Heart Disease: New Therapeutic Targets for Cardiac Remodeling and Repair. Front Cardiovascular Med 2022; 9: 896782.
75- Pelliccia F, Zimarino M, De Luca G, Viceconte N, Tanzilli G, De Caterina R. Endothelial Progenitor Cells in Coronary Artery Disease: From Bench to Bedside. Stem Cells Transl Med 2022; 11(5): 451-60.
76- Wu WZ, Hu DJ, Wang ZY, Liao LS, Li CC. Endothelial Progenitor Cell Impairment Mediated Vasodilation Dysfunction Via Diminishing Nitric Oxide Production in Postmenopausal Females. Mol Med Rep 2019; 19(3): 2449-57.
77- Fathi E, Valipour B, Vietor I, Farahzadi R. An Overview of the Myocardial Regeneration Potential of Cardiac C-Kit+ Progenitor Cells Via PI3K and MAPK Signaling Pathways. Future Cardiol 2020; 16(3): 199-209.
78- Cianflone E, Torella M, Biamonte F, De Angelis A, Urbanek K, Costanzo FS, et al. Targeting Cardiac Stem Cell Senescence to Treat Cardiac Aging and Disease. Cells. 2020; 9(6): 1558.
79- Bartunek J, Behfar A, Dolatabadi D, Vanderheyden M, Ostojic M, Dens J, et al. Cardiopoietic Stem Cell Therapy in Heart Failure: The C-CURE (Cardiopoietic Stem Cell Therapy in Heart Failure) Multicenter Randomized Trial with Lineage-Specified Biologics. J Am Coll Cardiol 2013; 61(23): 2329-38.
80- Leong YY, Ng WH, Ellison-Hughes GM, Tan JJ. Cardiac Stem Cells for Myocardial Regeneration: They are Not Alone. Front Cardiovasc Med 2017; 4: 47.
81- Ibrahim AG-E, Cheng K, Marbán E. Exosomes as Critical Agents of Cardiac Regeneration Triggered by Cell Therapy. Stem Cell Reports 2014; 2(5): 606-19.
82- Mehanna RA, Essawy MM, Barkat MA, Awaad AK, Thabet EH, Hamed HA, et al. Cardiac Stem Cells: Current Knowledge and Future Prospects. World J Stem Cells 2022; 14(1): 1-40.
83- Sano T, Ito T, Ishigami S, Bandaru S, Sano S. Intrinsic Activation of Cardiosphere-Derived Cells Enhances Myocardial Repair. J Thoracic Cardiovasc Surg 2022; 163(4): 1479-90.
84- Hosoyama T, Samura M, Kudo T, Nishimoto A, Ueno K, Murata T, et al. Cardiosphere-Derived Cell Sheet Primed with Hypoxia Improves Left Ventricular Function of Chronically Infarcted Heart. Am J Transl Res 2015; 7(12): 2738-51.
85- Hasan AS, Luo L, Yan C, Zhang T-X, Urata Y, Goto S, et al. Cardiosphere-Derived Cells Facilitate Heart Repair by Modulating M1/M2 Macrophage Polarization and Neutrophil Recruitment. PLoS One 2016; 11(10): e0165255.
86- Patel AN, Silva F, Winters AA. Stem Cell Therapy for Heart Failure. Heart Fail Clin 2015; 11(2): 275-86.
87- Sano T, Ishigami S, Ito T, Sano S. Stem Cell Therapy in Heart Disease: Limitations and Future Possibilities. Acta Med Okayama 2020; 74(3): 185-90.
88- Müller P, Lemcke H, David R. Stem Cell Therapy in Heart Diseases–Cell Types, Mechanisms and Improvement Strategies. Cell Physiol Biochem 2018; 48(6): 2607-55.
89- Hassan N, Tchao J, Tobita K. Concise Review: Skeletal Muscle Stem Cells and Cardiac Lineage: Potential for Heart Repair. Stem Cells Transl Med 2014; 3(2): 183-93.
90- Iseoka H, Miyagawa S, Saito A, Harada A, Sawa Y. Role And Therapeutic Effects of Skeletal Muscle-Derived Non-Myogenic Cells in a Rat Myocardial Infarction Model. Stem Cell Res Ther 2020; 11(1): 69.
91- Sun R, Li X, Liu M, Zeng Y, Chen S, Zhang P. Advances in Stem Cell Therapy for Cardiovascular Disease. Intj Mol Med 2016; 38(1): 23-9.
92- Aguirre M, Escobar M, Forero Amézquita S, Cubillos D, Rincón C, Vanegas P, et al. Application of the Yamanaka Transcription Factors Oct4, Sox2, Klf4, and C-Myc from the Laboratory to the Clinic. Genes 2023; 14(9): 1697.
93- Liu G, David BT, Trawczynski M, Fessler RG. Advances in Pluripotent Stem Cells: History, Mechanisms, Technologies, and Applications. Stem Cell Rev Rep 2020; 16(1): 3-32.
94- Raab S, Klingenstein M, Liebau S, Linta L. A Comparative View on Human Somatic Cell Sources for Ipsc Generation. Stem Cells Int 2014; 2014(1): 768391.
95- Calado SM, Bento D, Justino D, Mendes-Silva L, Marques N, Bragança J. Generation of a Human Induced Pluripotent Stem Cell Line (Ualgi001-A) from a Patient with Left-Ventricular Noncompaction Cardiomyopathy. Stem Cell Res 2021; 53: 102302.
96- Cong X, Zhang S-M, Ellis MW, Luo J. Large Animal Models for the Clinical Application of Human Induced Pluripotent Stem Cells. Stem Cells Dev 2019; 28(19): 1288-98.
97- Gu M. Efficient Differentiation of Human Pluripotent Stem Cells to Endothelial Cells. Curr Protoc Hum Genet 2018; 98(1): e64.
98- Rosa S, Praça C, Pitrez PR, Gouveia PJ, Aranguren XL, Ricotti L, et al. Functional Characterization of Ipsc-Derived Arterial-And Venous-Like Endothelial Cells. Sci Rep 2019; 9(1): 3826.
99- Hartman ME, Dai D-F, Laflamme MA. Human Pluripotent Stem Cells: Prospects and Challenges as a Source of Cardiomyocytes for in Vitro Modeling and Cell-Based Cardiac Repair. Adv Drug Deliv Rev 2016; 96: 3-17.
100- Barbuti A, Benzoni P, Campostrini G, Dell'Era P. Human Derived Cardiomyocytes: A Decade of Knowledge after the Discovery of Induced Pluripotent Stem Cells. Dev Dynamics 2016; 245(12): 1145-58.
101- Yoshihara M, Hayashizaki Y, Murakawa Y. Genomic Instability of Ipscs: Challenges Towards their Clinical Applications. Stem Cell Reviews and Reports 2017; 13(1): 7-16.
102- Yuan HL, Chang L, Fan WW, Liu X, Li Q, Tian C, et al. Application and Challenges of Stem Cells in Cardiovascular Aging. Regen Therapy 2024; 25: 1-9.
103- Ye L, Chang YH, Xiong Q, Zhang P, Zhang L, Somasundaram P, et al. Cardiac Repair in a Porcine Model of Acute Myocardial Infarction with Human Induced Pluripotent Stem Cell-Derived Cardiovascular Cells. Cell Stem Cell 2014; 15(6): 750-61.
104- Rohani L, Johnson AA, Naghsh P, Rancourt DE, Ulrich H, Holland H. Concise Review: Molecular Cytogenetics and Quality Control: Clinical Guardians for Pluripotent Stem Cells. Stem Cells Transl Med 2018; 7(12): 867-75.
105- Gerbin KA, Murry CE. The Winding Road To Regenerating The Human Heart. Cardiovasc Pathol 2015; 24(3): 133-40.
106- Lemcke H, Voronina N, Steinhoff G, David R. Recent Progress In Stem Cell Modification For Cardiac Regeneration. Stem Cells Int 2018; 2018: 1909346.
107- Abdelwahid E, Kalvelyte A, Stulpinas A, De Carvalho KAT, Guarita-Souza LC, Foldes G. Stem Cell Death and Survival in Heart Regeneration and Repair. Apoptosis 2016; 21(3): 252-68.
108- Menasché P. Cell Therapy with Human ESC-Derived Cardiac Cells: Clinical Perspectives. Front Bioeng Biotechnol 2020; 8: 601560.
109- Nakamura K, Murry CE. Function Follows form―a Review of Cardiac Cell Therapy. Cir Journal 2019; 83(12): 2399-412.
110- Kalou YMN, Hashemi ASA, Joudeh RM, Aramini B, Haider KH. Mesenchymal Stem Cell-Based Heart Cell Therapy: The Effect of Route of Cell Delivery in the Clinical Perspective. In book: Stem cells: From Potential to Promise 2021;151-90.
111- Kanelidis AJ, Premer C, Lopez J, Balkan W, Hare JM. Route of Delivery Modulates the Efficacy of Mesenchymal Stem Cell Therapy for Myocardial Infarction: A Meta-Analysis of Preclinical Studies and Clinical Trials. Cir Res 2017; 120(7): 1139-50.
112- Abouzid MR, Umer AM, Jha SK, Akbar UA, Khraisat O, Saleh A, et al. Stem Cell Therapy for Myocardial Infarction and Heart Failure: A Comprehensive Systematic Review and Critical Analysis. Cureus 2024; 16(5): e59474.
113- Turner D, Rieger AC, Balkan W, Hare JM. Clinical-Based Cell Therapies for Heart Disease—Current and Future State. Rambam Maimonides Med J 2020; 11(2): e0015.
114- Jihwaprani MC, Sula I, Charbat MA, Haider KH. Establishing Delivery Route-Dependent Safety and Efficacy of Living Biodrug Mesenchymal Stem Cells in Heart Failure Patients. World J Cardiol 2024; 16(6): 339-54.
115- Menasché P. Cell Therapy Trials for Heart Regeneration—Lessons Learned and Future Directions. Nat Rev Cardiol 2018; 15(11): 659-71.
نوع مطالعه: مروری |
موضوع مقاله:
زیست شناسی
دریافت: 1403/11/8 | پذیرش: 1404/2/16 | انتشار: 1404/6/15
دریافت: 1403/11/8 | پذیرش: 1404/2/16 | انتشار: 1404/6/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







