دوره 33، شماره 3 - ( خرداد 1404 )
جلد 33 شماره 3 صفحات 8849-8831 |
برگشت به فهرست نسخه ها
Ethics code: IR.SCU.REC.1403.044
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mousavian A S, Shakerian S, Habibi A, Tabandeh M. Effect of Circadian Rhythm Following a Period of Continuous Physical Activity in the Morning and Evening on Neuronal Degradation Factors and Mir-132 in the Hippocampus of Mice with Metabolic Syndrome. JSSU 2025; 33 (3) :8831-8849
URL: http://jssu.ssu.ac.ir/article-1-6370-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6370-fa.html
موسویان آسیه سادات، شاکریان سعید، حبیبی عبدالحمید، تابنده محمدرضا. اثر ریتم شبانهروزی متعاقب یک دوره فعالیت بدنی تداومی در صبح و عصر برعوامل تخریب نورونی و miR-132 در هیپوکمپ موشهای دارای سندرم متابولیک. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (3) :8831-8849
متن کامل [PDF 1265 kb]
(270 دریافت)
| چکیده (HTML) (803 مشاهده)
متن کامل: (253 مشاهده)
مقدمه
ســندرم متابولیــک، نوعــی اختــلال در اســتفاده از انــرژی و ذخیرهسازی آن اسـت که میتواند با ایجاد تغییرات منفی در متابولیسم کلسترول مغزی و مقاومت به انسولین منجر به تخریب سلولهای عصبی گردد. تحقیقات اخیر نشان میدهند که عوامل ژنتیکی و محیطی مختلف ممکن است در ایجاد ارتباط بین سندرم متابولیک و بیماریهای نورودژنراتیو مؤثر باشند. همچنین، تأثیر مؤلفههای سندرم متابولیک، مانند قند خون بالا، کلسترول HDL پایین و چاقی بر کاهش عملکرد شناختی تأیید شده است (1). عوامل خطر محیطی، از جمله دیابت نوع ۲، چاقی و دیسلیپیدمی، به ویژگیهای بیماریزای عصبی، مانند کاهش مصرف گلوکز در مغز، استرس اکسیداتیو، التهاب و اختلال عملکرد میتوکندری منجر میشوند که میتوانند به تخریب نورونی منجر گردند (2) .مطالعات Positron emission tomography scan PET نشان دادهاند که مغز اسیدهای چرب را جذب میکند. سندرم متابولیک باعث افزایش جذب و تجمع این اسیدها در مغز میشود که این افزایش، با کاهش وزن رابطه معکوس دارد (3). همچنین، گزارش شده است که رژیمهای غذایی پرچرب ممکن است به بیماریهای نورودژنراتیو، مانند آلزایمر Alzheimer's disease (AD)، منجر شوند (4). درمان با متابولیتها، به بهبود جزئی شناختی و کاهش التهاب، آپوپتوز و نارسایی سیناپسی در مدلهای انسانی و موش منجر شده است (5). در مدلهای موش دیابتی (DM) نیز تغییراتی در متابولیسم گلوکز، سیگنالدهی انسولین، التهاب عصبی، هیپرفسفوریلاسیون تاو پروتئینهای تاو (Tau Proteins) پروتئینهایی هستند که ریزلولهها را تثبیت میکنند. پروتئین تاو در نورونهای دستگاه عصبی مرکزی به فراوانی و در آستروسیتها و الیگودندرسیتها به میزان کمتری یافت میشوند. عامل اصلی بیماریهای مرتبط به زوال عقل مانند آلزایمر و پارکینسون هستند و پردازش نادرست آمیلوئید بتا (Aβ) یک پروتئین ۳۶ تا ۴۳ پپتیدی و سازنده اصلی پلاکهای آمیلوئید است که در مغز مبتلایان به بیماری آلزایمر یافت میشود. مشاهده شده که این موارد از ویژگیهای برخی بیماریهای نورودژنراتیو هستند. با این حال، نتایج تحت تأثیر متغیرهایی مانند رژیم غذایی، زمان مطالعه و مداخلات مختلف از جمله افزایش تحرک قرار دارند که نتیجهگیری قطعی را دشوار میکند (6,7). مطالعات نشان دادهاند که تغییرات در توزیع و سطح کلسترول افزایش یافته در سندرم متابولیک، سیالیت غشاء و بخشهای لیپیدی تنظیمکننده، بر سنتز، رسوب و پاکسازی آمیلوئید بتا (Aβ) تأثیر میگذارد (8). پروتئین پیشساز آمیلوئید بتا (APP) و آنزیمهای پردازش آن (آلفا سکرترز و بتا سکرترز) در بخشهای لیپیدی غشاء قرار دارند و تولید Aβ به شدت به محیط لیپیدی غشاء وابسته است. افزایش کلسترول باعث افزایش تولید Aβ و کاهش کلسترول باعث کاهش سطح آن میشود. همچنین، کاهش کلسترول غشای پلاسمایی، سمیت Aβ را کاهش میدهد (9). افزایش سطح کلسترول غشای پلاسمایی در سندرم متابولیک منجر به تولید آپولیپوپروتئین APOE میشود که حامل اصلی کلسترول در مغز است (10). APOE4 بهعنوان عاملی در تشکیل آمیلوئید بتا (Aβ) شناخته شده و بر پاکسازی و رسوب آن تأثیر میگذارد. وقتی APOE به لیپید A1 متصل میشود، چسبندگی آن افزایش مییابد و تجزیه پروتئولیتیک Aβ را تسهیل کرده و از رسوب آن جلوگیری میکند (11). پروتئین غشایی ABCA1 که وظیفه انتقال کلسترول از سلول به آپولیپوپروتئینهای کملیپید را دارد، با کاهش کلسترول سلولی میتواند تولید Aβ را کاهش دهد و همچنین از طریق افزایش APOE لیپیدی، پاکسازی Aβ را بهبود بخشد. افزایش سطح کلسترول در نورونها و آستروسیتها نیز به افزایش سمیت Aβ منجر میشود (12). بیشتر تحقیقات در این حوزه با استفاده از دستکاریهای ژنتیکی یا دارویی انجام شدهاند. این مطالعات نشان میدهند که حذف ژن ABCA1 باعث کاهش پاکسازی کلسترول در مغز میشود. در مغز بزرگسالان، متابولیسم کلسترول از طریق تولید ۲۴S- هیدروکسی کلسترول (24OHC) متعادل میشود.24OHC به عنوان یکی از مشتقات کلسترول میتواند از سد خونی مغز عبور کرده و وارد گردش خون شود و حدود ۶ میلیگرم در ۲۴ ساعت توسط مغز به جریان خون آزاد میشود (13,14). در عین حال مقاومت به انسولین (IR) در بیماران دارای سندرم متابولیک بر متابولیسم کلسترول در مغز تأثیر میگذارد و ارتباط متقابلی بین این دو وجود دارد. هیپرکلسترولمی و اختلال در هموستاز کلسترول میتوانند باعث تشدید IR شوند، در حالیکه IR نیز میتواند متابولیسم کلسترول را مختل کند. انسولین، فاکتورهای رونویسی SREBP را که در بیوسنتز کلسترول نقش دارند، فعال میکند و باعث افزایش سنتز کلسترول میشود. IR ناشی از آمیلوئید بتا (Aβ) نیز هموستاز کلسترول را به هم میزند. افزایش قند خون و کمبود انسولین، سنتز کلسترول در مغز را از طریق کاهش بیان SREBP2 کاهش میدهد (15،16). تجمع کلسترول تنها در سنین پیری در هیپوکامپ با افزایش سمیت Aβ مشاهده میشود. کاهش سنمحور در بیان ABCA1 ممکن است این تفاوت را توضیح دهد. این کاهش ممکن است به شرایط التهابی مزمن یا تغییرات در اکسیاسترولهای مغزی مرتبط باشد، اما تحقیقات بیشتری برای روشن شدن مکانیسم دقیق آن نیاز است (17). سیستم ساعت شبانهروزی پستانداران به دو سطح تقسیم میشود: ساعت مرکزی و ساعتهای محیطی. ساعت مرکزی در هسته سوپراکیاسماتیک (SCN) واقع شده و اطلاعات زمانی را از نور خورشید دریافت کرده و به ساعتهای محیطی منتقل مینماید. این ساعتهای محیطی میتوانند بهطور مستقل بیان ژن را تنظیم کرده و نشانههای زمانی، مانند فعالیت حرکتی و رفتار تغذیهای را دریافت کنند (18). ورزش در شبانهروزی سیستم دو نقش دارد: بهعنوان یک نشانه زمانی عمل کرده و میتواند در تنظیم مجدد ساعتهای شبانهروزی مؤثر باشد. همچنین ورزش تأثیرات قابلتوجهی بر ترشح هورمونها و پارامترهای فیزیولوژیکی دارد. ژنهای PER2 و BMAL1 بهعنوان ژنهای فاز نوری تحت تأثیر REV-ERB تنظیم میشوند و با بیان ژنهای سرکوبگر ریتم شبانهروزی ارتباط دارند. REV-ERB به تنظیم متابولیسم کمک کرده و با حس کردن کمبود انرژی ناشی از ورزش، حساسیت به انسولین را افزایش میدهد (19). متابولیسم عضله اسکلتی نیز تحت تأثیر ریتم شبانهروزی قرار دارد؛ بهطوری که غلظت گلوکز در پلاسما در صبح اوج میگیرد و حساسیت به انسولین در صبح بیشتر است. میتوکندریهای عضله اسکلتی در ساعات شب ظرفیت اکسیداتیو بالاتری دارند. زمانبندی ورزش بر بافت موضعی و متابولیسم سیستمیک تأثیر میگذارد؛ بهویژه اینکه ورزش در شب به اکسیداسیون اسیدهای چرب آزاد (FFA) وابستگی بیشتری دارد (20). در مطالعهAsher و همکاران در سال 2015 نشان دادند که ورزش تأثیرات متفاوتی بر بیان ژن در گروه تمرین صبح و گروه تمرین عصر دارد. در گروه تمرین صبح، مسیرهای سیگنالدهی انسولین و متابولیسم گلوکز بهطور خاص افزایش یافت. همچنین، این گروه پس از ورزش کاهش شدیدتری در سطوح لیپیدها و اسیدهای آمینه در مقایسه با گروه تمرین عصر نشان داد (21). ورزش عصرگاهی با ظرفیت تمرین و استقامت بیشتری همراه است و این موضوع به اتکای بیشتر به کربوهیدراتها و دمای بالاتر بدن در عصر مرتبط است و در این زمان، کاهش مصرف اکسیژن و کاهش قند خون به ورزش کمک میکند (22). در عوض، اکسیداسیون اسیدهای چرب آزاد (FFA) در صبح بهطور بالقوه میتواند منجر به کاهش چربی بیشتری شود. همچنین، متابولیسم سیستم شبانهروزی در پستانداران تأثیر عمدهای بر متابولیسم انرژی دارد و جهش یا حذف ژنهای مرتبط با ریتم شبانهروزی میتواند منجر به متابولیسم انرژی ناکارآمد شود. در نهایت، ژنهای متابولیک اصلی و فعالیتهای آنها با سیستم ساعت فعالیتها همکاری نزدیکی دارند و برای تنظیم، هماهنگسازی و تنظیم دقیق فرآیندهای فیزیولوژیکی متنوع بسیار مهم هستند (23). ریزآرانایها (miRNAs) یا میکرو RNAها مولکولهای کوچک اسید ریبونوکلئیک (RNA) هستند که طول آنها بین 21 تا 32 نوکلئوتید متغیر است. این مولکولها از انواع RNA غیرکدکننده بهشمار میآیند که برای بسیاری از عملکردهای بیولوژیکی ضروری هستند. خواه با انجام مستقیم عملکرد موردنظر (RNA غیرکدکننده) و خواه با ایجاد یک الگو برای تولید پروتئینها (RNA پیامرسان). این مولکولها با اتصال به ناحیه UTR3 در mRNAهای هدف، باعث تخریب و سرکوب ترجمه آنها میشوند (24). miRNAs نقشهای حیاتی در کنترل عملکرد سلولهای مغزی دارند و تغییر در بیان آنها میتواند به بروز بیماریهای پاتولوژیک منجر شود. به همین دلیل، miRNAs به عنوان ابزارهایی برای تشخیص، پیشآگهی و درمان بیماریهای نورودژنراتیو مورد بررسی قرار میگیرند. با این حال، نقش و بیان دقیق آنها در سیستم عصبی پستانداران بالغ هنوز بهطور کامل روشن نشده است (25). یکی از miRNAs خاص مغز، miR-132 است که در تنظیم ساعت شبانهروزی در هسته سوپراکیاسماتیک (SCN) نقش دارد miR-132 تحت تأثیر نشانههای نور، بیان ژنهای ساعت را تعدیل کرده و اثرات ریتمساز نور را کاهش میدهد (26). تحقیقات نشان میدهد که miR-132 در سلولهای عصبی غنی است و باعث رشد و جوانهزنی نورونها (نوروژنز) میشود. همچنین، این miRNA میتواند لیپوژنز و کلستروژنز را برنامهریزی مجدد کند و فرآیندهای پاییندستی را که منجر به تغییرات در رونوشتهای تنظیمکننده متابولیسم و در نتیجه تغییر پروفایلهای چربی سرم میشود، آغاز کند (27). هرناندز و همکاران در سال 2016 نشان دادند که سطح Aβ در هیپوکامپ موشهای مبتلا به آلزایمر (AD) که miR-132 آنها حذف شده، نسبت به گروه کنترل بهطور قابلتوجهی افزایش یافته است. این نشان میدهد که فقدان miR-132 میتواند تولید، تجمع و رسوب Aβ را افزایش دهد (28).
miR-132بهویژه در تنظیم مسیرهای متابولیک لیپوژنز و کلستروژنز از طریق بیوسنتز SREBP2 و ABCA1 نقش دارد و بر تنظیم لیپیدها در سرم و بیان Aβ تأثیر میگذارد (29،30). همچنین، miR-132 تأثیراتی بر Aβ دارد که بهعنوان عامل آغازکننده بیماری آلزایمر و برخی بیماریهای نورودژنراتیو شناخته میشود (31). در پستانداران، miRNAs نقش مهمی در زمانبندی ساعت دارند. تحقیقات نشان دادهاند که miR-132 بهطور نوسانی در موشها بیان میشود و این miRNA تحت تأثیر نور قرار میگیرد. بهعلاوه، miRNAs بر حلقه رونویسی شبانهروزی هسته تأثیر میگذارند، هرچند که مکانیزمهای دقیق اثرگذاری آنها هنوز بهطور کامل شناخته نشده است (32). در مجموع، تحقیقات در رابطه با بیان miR-132 و استرس شبکه اندوپلاسمی (ER) بیشتر در اندامهایی مانند کلیه و مری انجام شده است. بنابراین، مطالعات بیشتری برای تعریف مکانیسمهای مربوط به miR-132 در هیپوکامپ و اثرات آن بر نورودژنراسیون و سایر فرآیندهای فیزیولوژیکی مورد نیاز است (33). به طور کلی، این مطالعه به بررسی سؤال اصلی این است که آیا تمرینات تداومی میتوانند بر متابولیسم کلسترول در هیپوکامپ و عوامل مؤثر مانند استرس شبکه اندوپلاسمی و تشکیل پلاکهای Aβ تأثیر بگذارند و در نتیجه به پیشگیری یا بهبود تخریب نورونی در افراد مبتلا به سندرم متابولیک کمک کنند. همچنین، اثرات کرنوبیولوژیک تمرین بر این متغیرها مورد بررسی قرار میگیرد. بهطور کلی، تحقیقات اخیر نشان داده است که اختلال در متابولیسم کلسترول در مغز در بیماران مبتلا به سندرم متابولیک، سبب بروز طیف گستردهای از تغییرات مولکولی منجر به آسیب عصبی و تجمع بتا آمیلوئید میشود. که فعالیت بدنی میتواند سبب کاهش عوارض سندرم متابولیک در مغز شود (35،34). اگر چه اکثر مطالعات اتفاق نظر دارند که تمرینات هوازی یک راه موثر برای مدیریت بیماریهای متابولیک است. با اینحال به نظر می¬رسد اختلالات نورودژنراتیو و در نظر گرفتن چالش زمان، ممکن است امکان تحلیل دقیقتری برای آسیبشناسی سندرم متابولیک و طراحی مداخلات درمانی وابسته به زمان که هنوز ناشناخته است، برای بهبود عملکرد عصبی و مدیریت مؤثر عوارض وابسته به بیماریهای متابولیک فراهم آورد. بنابراین، هدف از مطالعه حاضر تأثیر ریتم شبانه روزی و زمان-بندی فعالیت بدنی در صبح و عصر بر بیان ژنهای مرتبط با پردازش بتا آمیلوئید وابسته به miR-132 در موشهای دارای سندرم متابولیک میباشد.
روش بررسی
پژوهش حاضر از نوع مطالعه تجربی، از لحاظ اجرا آزمایشگاهی و به روش نمونه گیری تصادفی ساده میباشد. 48 سر موشهای آزمایشگاهی نر بالغ هشت تا ده هفتهای، نژاد NMRI با میانگین وزنی 3/22±26 گـرم از مرکز حیوانات آزمایشگاهی دانشگاه علوم پزشکی جندی شاپور اهواز خریداری و در محیطی با دمای 2±22 درجه سانتیگراد، رطوبت 45 تا 55 درصد و چرخه تاریکی_روشنایی 12:12 ساعته نگهداری شدند. در ابتـدا تعـداد 32 سـر مـوش بهطور تصادفـی انتخـاب و بــه مــدت 12 هفتــه بــا رژیم غذایی پرچرب و پرکالری(HFD) که بهطور معمول به اختلال در تعادل انرژی بدن منجر میشود و باعث پرخوری و چاقی میگردد، تغذیــه شدند (36). از طرفــی 16 ســر موش آزمایشگاهی تحــت رژیــم غذایــی اســتاندارد قــرار گرفتند کــه گــروه موشهای ســالم را تشــکیل دادند. چاقــی موشها بــا محاســبه شــاخص لــی، پــس از 12 هفتــه مصــرف غــذای چــرب، حاصــل شــد (36) ارزیابــی چاقــی (فرمول یک) در موشها، مشــابه در انســان و از ریشــه ســوم وزن بــدن (گــرم) تقســیم بــر طــول بــدن (ســانتیمتــر) ضــرب در 1000 بــهدســت آمــد (37).

فرمول یک: فرمول تعیین شاخص چاقی
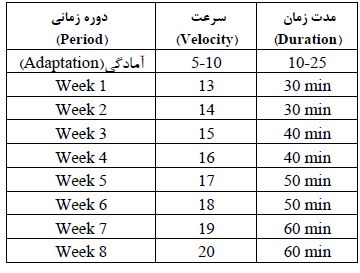
همچنیــن، بــرای ارزیابــی شاخصهای زیســتی ســندرم متابولیـک، مـوشهای چـاق شـده در اثـر رژیـم غذایـی پرچــرب و پرکالــری بــا خونگیری از وریـد دمـی، دسـی لیتـر و تـری گلیسـیرید بالاتـر از 110 میلیگرم بـر دسـی لیتـر دارا بودند، معیارهـای سـندرم متابولیـک اثبات گردید (37). ضمناً از مـوشهای گـروه کنتـرل و تغذیه شده بـا غـذای اسـتاندارد نیـز خونگیـری بـهعمـل آمـد. در ادامـه، موشهای آزمایشگاهی در 6 گــروه (N=8) شــامل گروه کنتــرل ســالم صبح، گـروه کنترل عصر سالم، گــروه کنتــرل صبح ســندرم متابولیــک، کنتــرل عصر ســندرم متابولیــک، گـروه تمریـن تداومی صبح سندرم متابولیک، گـروه تمریـن تداومی عصر سندرم متابولیک، تقسیمبندی شده و تـا پایـان مداخلـه ورزشــی غــذای مورد استفاده موشهای آزمایشگاهی، رژیــم اســتاندارد بــا کالــری طبیعــی بــود. تمریـن موشها بر روی تردمیل موشهای آزمایشگاهی بود که با دوره آشناسـازی 7 روزه (تمرین شم) شـروع شـد. به منظورآشنایی با دستگاه و کاهش استرس و سازگاری با شرایط تمرینی در طی یک هفته، تمرین کردند. برای ایجاد شـــرایط کاملاً یکســـان حیوانات بدون تمرین به مدت مشـــابه حیوانات تمرین کرده بر روی تردمیل موش¬های آزمایشگاهی قرار داده شدند. بهطور خلاصه، موشها برای دویدن روی تردمیل مخصوص موشهای آزمایشگاهی به مدت یک هفته از 10-25 دقیقه فعالیت دویدن با سرعت 5-10 متر در دقیقه قبل از انجام مداخله ورزشی 8 هفتهای سازگار شدند. تمرین تداومی با شدت کم تا متوسط (جدول 1): در گروههای تمرینـی بـه مـدت 2 مـاه (5 روز در هفتـه، در وقـت صبـح از سـاعت 10- 9و عصر از ساعت 19-20 برنامـه تمریـن تداومی را اجــرا کردند. آزمون حداکثر ســـرعت دویدن موشها، Vmax قبل از 6 هفته و 8 هفته پس از شـــروع پروتکل تمرینی، برای تعیین شــدت برنامه تمرینی و کنترل اعمال اضــافه بار مطابق با مطالعات قبلی انجام شــد (38). برای اجرای این آزمون، موشهای گروه تمرین تداومی با شدت متوسط moderate intensity continuous training (MICT) پس از گرم کردن با سرعت 5 الی 8 متر بر دقیقه با شیب صفر درجه شروع به دویدن کردند. ســـرعت تردمیل هر ۲ دقیقه یک بار به میزان 0/3 متر بر ثانیه ( حدود ۲ متر در دقیقه) افزایش یافت. Vmax ســرعتی بود که با وجود اعمال تحریکات ملایم (با چوب دســتی)، موش توانایی و یا تمایلی برای ادامه دویدن نداشته باشد. پروتکل تمرینی با اقتباس از تحقیقات منتشر شده قبلی (40،39) پس از برآورد حداکثر ســرعت دویدن موشهاVmax آغاز گردید. بهطوری که، پس از ۵ دقیقه گرم کردن با سرعت 5 متر بر دقیقه، موشها در گروه تمرین با شــدت 6۰-50 درصــد Vmax به مدت 60-30 دقیقه و پنج جلسه در هفته به مدت 8 هفته دویدند. در انتهای هر جلسه، سردکردن با سرعت 5 متر بر دقیقه به مدت 3 دقیقه اجرا شــد. در طول دوره مطالعه، موشها بر روی تردمیل، 13 متر در دقیقه به مدت 30 دقیقه در هفته اول دویدند. سپس سرعت هفتهای 1 متر در دقیقه و زمان 10 دقیقه هر دو هفته افزایش یافت که به سرعت هدف 20 متر در دقیقه و زمان 60 دقیقه افزایش یابد (جدول 1). بهطور خلاصه برنامه فعالیت بدنی (شکل 1): تمرین روزانه 60-30 دقیقهای به مدت 8 هفته (شکل 1)، با شدت 50-60% VMAX که 5 روز در هفته تکرار شد (41). تغییرات سندرم متابولیک، وزن، گلوکز خون، تریگلیسیرید و لیپوپروتئینها: متغیرهای وزن و گلوکز خون در حالت پایه (هفته اول) بین گروههای آزمایشی تفاوت معنیداری وجود نداشت و غلظت گلوکز خون ناشتا کمتر از 6/5 میلیمول/لیتر (117میلیگرم بر دسی¬لیتر) تریگلیسیرید HDL63/66 40/66و LDL 73/33 بود که نشاندهنده این است سطوح سرمی آنها در وضعیت استانداردی قرار داشته است. پس از 12 هفته تغذیه با رژیم غذائی پرکالری و پرچرب، افزایش معنیداری در وزن بدن، غلظت گلوکز، تریگلیسیرید و لیپوپروتئینهای خون موشهای تحت رژیم نسبت به گروه کنترل به وجود آمد (0/05>P). در گروههای سندرم متابولیک و سندرم متابولیک + تمرین، غلظت گلوکز خون ناشتا بیشتر از 6/5 میلیمول برلیتر (117میلیگرم بر دسیلیتر) بوده و تریگلیسیرید سرمی 16/133HDL 16/129 و LDL سرمی 132 بود که نشاندهنده تائید سندرم متابولیک در موشها است. 48 ســاعت بعــد از آخریــن جلسـه تمرینـی و 8 سـاعت ناشـتایی، موشهای صحرایـی بهوسیله تزریــق درون صفاقــی زایلازیــن (10 میلیگرم/ کیلــوگــرم) و کتامیــن (90 میلیگرم/کیلــوگــرم) بیهوش شــدند، خونگیری بــه میــزان 4 میلیلیتر مستقیماً از قلـب حیـوان صـورت گرفـت. بلافاصلـه توســط ســانتریفیوز بــا ســرعت 5000 دور بــر دقیقــه در مــدت 10 دقیقــه جداســازی شــد. ســپس ســرمها در میکروتیوبهــا جمعآوری و جهــت کاهــش احتمــال سـوگیری در آزمایشها کدگذاری گردیـد. بـرای سـنجش و تعییـن شاخصهای خونـی موردنظر سـرم تهیهشده از 4 میلیلیتر خـون اسـتفاده شـد. برای تهیه نمونه بافتی، ابتدا موشها با ترکیب کتامین زایلازین به نسبت 60 به 40 بیهوش شدند. سپس با جدا کردن سر موش با کمک قیچی مخصوص و جدا کردن کل مغز و خارج کردن آن از کاسه جمجمه، هیپوکامپ از سایر قسمتهای مختلف مغز جدا شد و بلافاصله در ازت قرار گرفت پس از منجمدشدن، بافت در یخچال مخصوص در دمای -80 درجه نگهداری شد. برای هموژن کردن، 100 میلیگرم از بافت بهوسیله بافر سالین در یک بشر استریل شستشو داده شد. بافت در یک میلیلیتر از بافر سالین هموژن خواهد شد و به مدت 16 ساعت در دمای 20- درجه سانتیگراد نگهداری شد. سپس بافت از حالت انجماد خارج و دوباره منجمد شد. جهت تخریب غشاء پلاسمایی این عمل سه بار تکرار خواهد شد. ترکیب حاصل به مدت 5 دقیقه با دور 5000 در دمای 2 تا 8 درجه سانتیگراد سانتریفوژ شد. سپس محلول رویی جدا و در دمای 80 - درجه سانتیگراد برای تجزیهوتحلیل بعدی نگهداری شد. پیش از انجام آزمایش، برای سنجش مقدار پروتئین ها، نمونه یکبار به مدت 2 دقیقه با دور 5000 سانتریفوژ شد و دوباره محلول رویی جدا و مورد استفاده قرار گرفت. جهت ارزیابی مقادیر پروتئینهای تحقیق از روش Realtime PCR و وسترنبلات استفاده شد. بهمنظور ارزیابی انجام وسترن بلات ابتدا نمونهها با استفاده از بافر لیز کننده RIPA و با استفاده از هموژنایزر، هموژنیزه شد. سپس نمونهها به مدت 10 دقیقه در دمای 40 درجه سانتیگراد و با دور 12000 در دقیقه سانتریفیوژ و مایع رویی جهت آنالیزهای بعدی استفاده میشوند. میزان پروتئین نمونهها با استفاده از روش برادفورد سنجیده شد. SDS-PAGE به روش متعارف با استفاده از ژل 10% و سیستم بافری پیوسته انجام شد. پس از انجام SDS-PAGE نمونهها با استفاده از روش متعارف و در دستگاه بلاتینگ به کاغذهای نیترو سلولز منتقل میشود. آمادهسازی کاغذها در بافر انتقال 2 ساعت قبل از انجام آزمون انجام شد. پس از انتقال نمونهها به کاغذهای نیتروسلولز انجام مراحل شستشو و مسدودسازی با Skimed milk 5% انجام شد. بهمنظور ردیابی پروتئینهای موردنظر از آنتیبادی اولیه پلیکلونال ضد پروتئینهای مورد مطالعه با رقت 200/1 و آنتیبادی ثانویه پلیکلونال ضد IgG با HRP استفاده شد. آشکارسازی با استفاده از کروموژن DAB انجام شد. از پروتئین GAPDH یا بتا اکتین بهعنوان کالیبراتور استفاده شد. ارزیابی نسبت دانسیته باندهای پروتئینهای هدف نسبت به GAPDH با استفاده از نرمافزار MEGA5 انجام شد و نتایج با واحد قراردادی و نسبت به بیان پروتئین کالیبراتور گزارش شد. بهمنظور ارزیابی بیانmiR-132 ، از روش Realtime PCR استفاده شد. از RNA U6 بهعنوان کالیبراتور استفاده شد. استخراج RNA با استفاده از روش فنول- کلروفورم-گوانیدین ایزوتیوسیانات و کیت تجاری miRcute miRNA Isolation Kit -Tiangen، چین انجام میشود. بهمنظور سنتز cDNA در ارزیابی بیان miRNAs از روش polyadenylation و کیتهای mirCUITE-Tiangen، چین استفاده شد. کیفیت RNA استخراجشده با استفاده از روخوانی نسبت جذب 280/260 و دستگاه نانودراپ انجام گردید. نمونههای cDNA به منظور انجام واکنش Real time PCR با استفاده از کیت miRcute miRNA qPCR Detection Kit (SYBR Green) و روش مقایسهای ΔΔCt مورد ارزیابی قرار گرفت. از ژن u6 بهعنوان کالیبراتور استفاده گردید. نتایج براساس فرمول عمومی ΔΔCt-2 گزارش شد. تمام نمونه¬ها با 2 بار تکرار انجام گردید.
تجزیه و تحلیل آماری
ﺑﺮای آﻧﺎﻟﯿﺰ آﻣﺎری از نرمافزار SPSS version 16 اﺳﺘﻔﺎده گردید. نرمال بودن توزیع دادهها با استفاده از آزمون شاپیرو-ویلک بررسی شد و همگنی واریانس ها با آزمون لون سنجیده شده است. محاسبات آماری از طریق نرمافزار با استفاده از نرمافزار (9.0.0) GraphPad Prism از مسیر تحلیل colume با استفاده از آنالیز Two-way Anova رسم شدهاند. آزمــون تعقیبــی توکــی و همچنیــن از آزمــون همبســتگی پیرســون نیــز بــرای بررســی رابطــه بیــن متغیرهــا اســتفاده و همچنین سطح معنیداری برای تمام روشهای آماری در سطح احتمال (P<0.05) در نظر گرفته شد. شـد.
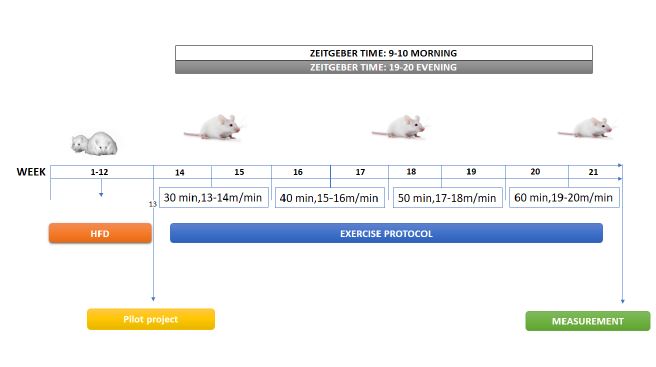
شکل 1: نمودارجریانی طراحی پژوهش
جدول 1: خلاصه برنامه تمرینی
نتایج
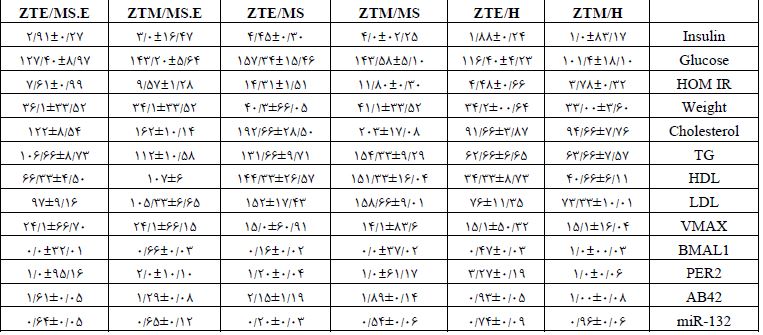
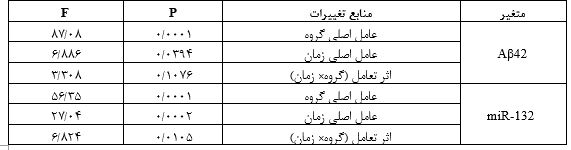
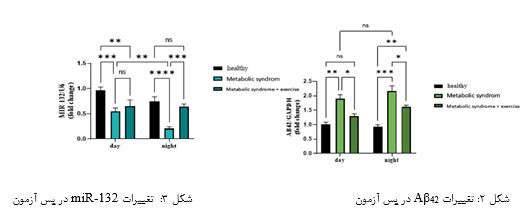
مطالعه حاضر نیز نشان داد که رژیم غذایی پرچرب می تواند ویژگیهای MetS را در مدل های جوندگان القا کند. موشهای آزمایشگاهی که با رژیم غذایی پرچرب تغذیه شدند، دچار چاقی، هیپرگلیسمی، دیسلیپیدمی و اختلال در تحمل گلوکز گردیدند (p˂0/05). به دلیل شیوع بالای سندرم متابولیک در سنین میانسالی، در این مطالعه رژیم غذایی را از 12 ماهگی معادل میانسالی در انسان آغاز کردیم و با توجه به اینکه که این اختلالات در متابولیسم کلسترول در مغز بیماران مبتلا به سندرم متابولیک میتواند به تغییرات مولکولی و آسیبهای عصبی منجر شود، بعد از 8 هفته اثرات کرنوبیولوژیک فعالیت بدنی بر عامل تخریب نورونی Aβ42 وmiR-132 را بررسی کردیم که بدین شکل تغییر یافتند (جدول 2).نتایج آزمون حداکثر سرعت نشان داد که تفاوت معنیداری بین گروههای تجربی در حالت پایه وجود ندارد (0/05 اثرات کرنوبیولوژیک تمرین بر بیان miR-132: بر اساس نتایج تحلیل واریانس دو راهه که در جدول 3 نشان داده شده است، جهت مقایسههای بین گروهی بیان miR-132 در هیپوکمپ موشهای سندرم متابولیک نشان داد که اثر اصلی گروه، اثر اصلی زمان و اثر تعامل (گروه× زمان) بر بیان پروتئین miR-132 در هیپوکمپ گروههای تحقیق معنیدار میباشد. بنابراین با توجه به معنیداری اثر تعامل (0/01=P)، اختلاف معنیداری بین میانگین miR-132 گروههای کنترل، سندرم متابولیک و سندرم متابولیک + تمرین در صبح و عصر وجود دارد. نتایج آزمون تعقیبی توکی برای اثر اصلی گروه نشان داد که سطح miR-132 در گروههای سندرم متابولیک و سندرم متابولیک + تمرین نسبت به گروه کنترل در روز افزایش معنیدار داشت (0/001 =P). همچنین افزایش معنیداری سطح miR-132 در گروههای سندرم متابولیک + تمرین نسبت به گروه سندرم متابولیک در روز مشاهده شد. نتایج آزمون تعقیبی توکی برای اثر اصلی زمان نشان دهنده افزایش معنیدار سطح miR-132 در صبح نسبت به عصر است(0/009 =P) اما این افزایش در مقایسه گروههای تمرین معنیدار نبود (0/9999≤P). با این حال نتایج آزمون تعقیبی توکی برای سطح miR-132 نشان داد که: 1) سطح miR-132 در گروه سندرم متابولیک نسبت به گروه کنترل در هر دو زمان صبح و عصر کاهش معنیداری یافت (0/001 =P). 2) سطح mir 132 در گروه کنترل (0/001 =P) نسبت به گروه سندرم متابولیک + تمرین (0/001 =P) در صبح نسبت به عصر کاهش معنیداری نشان داد. 3) سطح miR-132 در گروه سندرم متابولیک + تمرین نسبت به گروه سندرم متابولیک در عصر (0/001 =P) افزایش معنیدار داشت (شکل 3و2).
اثرات کرنوبیولوژیک تمرین بر پردازش بتا آمیلوئید: نتایج تحلیل واریانس دو راهه نشان داد (جدول 3) که اثر اصلی گروه (p=0/001) و اثر اصلی زمان (p=0/0394) برای سطح Aβ42 معنیدار است اما اثر تعامل (گروه× زمان) معنیدار نمیباشد (p=0/1076). بنابراین با توجه به سطح معنی¬داری اثر تعامل تفاوت معنیداری در غلظت (Aβ42) بین گروههای کنترل، سندرم متابولیک و سندرم منتابولیک + تمرین در اوایل فاز روشنائی و عصر وجود ندارد. نتایج آزمون تعقیبی توکی برای سطح پروتئین Aβ42نشان داد که: 1) سطح پروتئین Aβ42 در گروه سندرم متابولیک و سندرم متابولیک + تمرین نسبت به گروه کنترل در هر دو زمان صبح و عصر افزایش معنیداری یافت (0/001 =P). 2) سطح پروتئین Aβ42در گروه کنترل، سندرم متابولیک و سندرم متابولیک + تمرین در صبح نسبت به عصر Aβ42 معنیداری نشان نداد. 3) سطح پروتئین Aβ42در گروه سندرم متابولیک + تمرین نسبت به گروه سندرم متابولیک در عصر (0/002 =P) کاهش معنی¬دار داشت (شکل 3و2).
جدول 2: میانگین و انحراف معیار میزان تغییرات پارامترهای مورد مطالعه پس از مداخله در گروههای مختلف آزمایشی
جدول3: نتایج تحلیل واریانس دوراهه
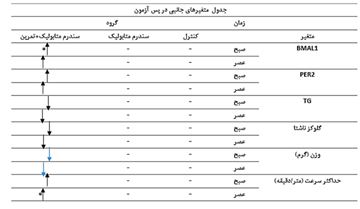
جدول 3: متغیرهای جانبی در پس¬آزمون
بحث
نتایج تحقیق حاضر نشان داد که تغییرات متابولیک ناشی از HFD بهطور قابلتوجهی باعث القاء فنوتیپ سندرم متابولیک میشود که با افزایش معنیدار شاخصهای مقاومت به انسولین از جمله؛ هیپرگلیسمی، هیپرانسولینمی و HOMA-IR هیپرکلسترولمی و افزایش تریگلیسیرید، تغییرات لیپوپروتئینها و افزایش وزن مشخص میشود. این نتایج بهطور کلی با یافتههای برخی از مطالعات که نشان دادهاند رژیمهای پرچرب منجر به افزایش وزن، هیپرگلیسمی و دیسلیپیدمی میشوند، همخوان است (1،3،37). برای مثال در مطالعه فریس و همکاران، در سال 2019 نشان دادند، استفاده از رژیم غذایی پرچرب از 12 ماهگی تأثیرات منفی بر وضعیت متابولیک موشها در مراحل میانسالی خواهد داشت (42). در این مطالعه، نتایج آزمون حداکثر سرعت نشان داد که هشت هفته تمرین هوازی منجر به بهبود معنادار سرعت حداکثر موشهای گروه سندرم متابولیک + تمرین نسبت به گروههای کنترل و سندرم متابولیک شد. این افزایش در آزمون حداکثر سرعت میتواند بهعنوان نشاندهنده بهبود عملکرد فیزیکی در گروههای تمرینی تفسیر شود. این یافتهها با نتایج مطالعه دیگر که تأثیر مثبت فعالیتهای ورزشی بر بهبود قدرت بدنی و ظرفیت فیزیکی در مدلهای حیوانی مبتلا به اختلالات متابولیک را نشان میدهند، همخوانی دارد (42). همچنین، بیشترین افزایش سرعت در گروههای تمرین در عصر مشاهده شد که میتواند به تأثیر زمان انجام تمرین بر نتایج بدنی و فیزیولوژیکی اشاره کند. این یافته با شواهد موجود در مطالعه Reilly & Waterhouse درسال 2009 مبنی بر تأثیر ریتم شبانهروزی بر عملکرد فیزیولوژیکی بدن هماهنگ است. در ساعات عصر، افزایش طبیعی دمای مرکزی بدن میتواند به بهبود توان عضلانی، افزایش جریان خون و ارتقاء عملکرد ورزشی منجر شود (43). Chtourou & Souissi در سال 2012 در مطالعهای نشان دادهاند که اوج عملکرد جسمی اغلب در اواخر بعدازظهر تا اوایل شب مشاهده میشود، زمانیکه بدن از نظر دما، ترشح هورمونها و واکنشهای عصبی در بهترین وضعیت قرار دارد همچنین، فرصت کافی برای تغذیه، استراحت و آمادگی روانی در طول روز میتواند در ارتقاء عملکرد عصرگاهی مؤثر باشد (44). یکی دیگر از جنبههای مهم این مطالعه تغییرات در شاخصهای مقاومت به انسولین از جمله گلوکز خون، انسولین و HOMA-IR است. این شاخصها نشاندهنده تغییرات در متابولیسم گلوکز و حساسیت به انسولین در مدلهای سندرم متابولیک هستند. نتایج این تحقیق نشان داد که میزان گلوکز خون، انسولین و HOMA-IR در گروههای سندرم متابولیک بیشتر از گروههای کنترل بود، اما این شاخصها پس از هشت هفته تمرین هوازی کاهش یافتند. بهطور خاص، تمرینات در عصر تأثیر بیشتری بر کاهش این شاخصها داشتند. این نتایج نشاندهنده تأثیر مثبت تمرین هوازی بر بهبود حساسیت به انسولین و کاهش مقاومت به انسولین در موشهای مبتلا به سندرم متابولیک است. این یافتهها با مطالعاتی چون مرادی و همکاران در سال 2022، که نشان دادهاند تمرینات ورزشی میتوانند مقاومت به انسولین را بهبود بخشند و متابولیسم گلوکز را تنظیم کنند، سازگاری دارد (45). همچنین نتایج تحقیق حاضر نشان داد که تمرین تداومی در عصر در مقایسه با صبح به طور مؤثری هایپرگلایسمی و مقاومت به انسولین ناشی از سندرم متابولیک را بهبود بخشید. این مزیت متابولیکی تا حدودی از طریق تنظیم ژنهای ساعت BMAL1 و PER2 توسط تمرین تناوبی میانجی¬گری میشود. این یافتهها میتواند نشاندهنده تأثیر فعالیت بدنی بر تنظیم ساعت زیستی و بهبود عملکرد مغزی در مدلهای سندرم متابولیک باشد. تغییرات در این پروتئینها میتواند به کاهش آسیبهای عصبی و بهبود عملکرد مغزی کمک کند و از این طریق تأثیرات متابولیک نامطلوب را کاهش دهد. مطالعهای از Zhai و همکاران، در سال 2024 که به بررسی اثرات تمرینات ورزشی بر ساعت بیولوژیک در مدلهای حیوانی دیابتی پرداخته، نیز نشان داده شده بهبود متغیرهای بیولوژیک و تأثیرات آنها بر روند درمان بسیار مفید است (46). پروتئینهای ساعت شبانهروزی مانند BMAL1 و PER2 نقش مهمی در تنظیم ریتم شبانهروزی دارند و میتوانند تأثیرات قابلتوجهی بر متابولیسم و پلاستیسیته عصبی داشته باشند. در تحقیق حاضر، نتایج نشان میدهد که کمترین میزان پروتئین BMAL1 در گروههای سندرم متابولیک، بهویژه در عصر مشاهده شد، در حالیکه بیشترین مقدار آن در گروه کنترل در صبح دیده شد. این نتایج نشان میدهند که سندرم متابولیک میتواند بر ریتم شبانهروزی پروتئینهای ساعت زیستی تأثیر بگذارد، بهطور خاص در گروه سندرم متابولیک پروتئین BMAL1 نسبت به گروه کنترل تغییرات منفی بیشتری دارد. پروتئین BMAL1 یکی از پروتئینهای کلیدی در سیستم ساعت بیولوژیک است که با تنظیم بیان ژنهای ساعت زیستی نقش مهمی در هماهنگ کردن فرآیندهای متابولیک و فیزیولوژیک ایفا میکند. کاهش سطح BMAL1 در گروههای سندرم متابولیک میتواند نشاندهنده اختلال در ریتم شبانهروزی و تنظیم ساعت بیولوژیک باشد که ممکن است باعث بدتر شدن علائم دیابت و اختلالات متابولیکی شود. در مطالعه Liu و همکاران، در سال 2020 نیز مشاهده شد که در مدلهای حیوانی سندرم متابولیک، کاهش سطح BMAL1 با بروز اختلالات متابولیکی و افزایش مقاومت به انسولین همراه است (47). از این رو، یافتههای تحقیق حاضر با این دادهها همخوانی دارند و به این نکته اشاره دارند که اختلال در پروتئینهای ساعت زیستی میتواند به عنوان یکی از عوامل مؤثر در بروز مشکلات متابولیکی و دیابت نوع 2 عمل کند. علاوه بر این، نتایج نشان داد که پروتئین BMAL1 در گروه سندرم متابولیک + تمرین در صبح نسبت به گروه سندرم متابولیک + تمرین در عصر افزایش یافته است. این تغییرات در سطح پروتئین BMAL1 نشاندهنده اثر مثبت تمرینات هوازی بر بازسازی و تنظیم مجدد ساعت زیستی در مدلهای سندرم متابولیک است. این یافتهها با نتایج مطالعهshen و همکاران در سال 2023 مشابه هستند که نشان دادند تمرینات ورزشی میتوانند اثرات مثبتی بر ریتمهای شبانهروزی بدن داشته و به بهبود عملکرد ساعت زیستی کمک کنند (48). پروتئین PER2 نیز در تحقیق حاضر تغییراتی را در سطح صبح و عصر نشان داد. کمترین میزان این پروتئین در گروه کنترل در صبح و بیشترین میزان آن در عصر مشاهده شد. این یافتهها بیانگر تنظیم دقیق ریتم شبانهروزی پروتئینهای ساعت زیستی در شرایط طبیعی هستند. اما در گروه سندرم متابولیک + تمرین، افزایش سطح پروتئین PER2 در صبح نسبت به عصر مشاهده شد که نشاندهنده اثرات مفید تمرینات ورزشی در تنظیم مجدد این پروتئین است. مطالعات متعدد، از جمله تحقیق Xu و همکاران، در سال 2021 نشان دادند که تمرینات ورزشی میتوانند تأثیرات مثبتی بر تنظیم پروتئینهای ساعت زیستی از جمله BMAL1 و PER2 داشته باشند (49). این اثرات میتوانند به تنظیم مجدد ریتمهای شبانهروزی و بهبود عملکرد متابولیک کمک کنند، که در نهایت منجر به کاهش عوارض دیابت و بهبود کیفیت زندگی افراد مبتلا به این بیماری میشود. همچنین نتایج تحقیق حاضر نشان داد، تمرین تداومی باعث کاهش سطوح Aβ42 در هر دو زمان صبح و عصر در هیپوکمپ موش های آزمایشگاهی می¬شود. تعدیل و افزایش میزان miR-132 در تمرین عصر تفاوت معنی داری را نشان می¬دهد. همسو با نتایج این مطالعه نشان داده شده است که است که زمانبندی شبانه¬روزی می¬تواند بر نتایج فعالیت بدنی در سطح مولکولی تأثیر بگذارد (48،50). شواهد در انسان (52، 51) و موش (53،54) نشان میدهد که انجام تمرینات ورزشی در زمان¬های مختلف روز منجر به اثرات متابولیکی متفاوتی می¬شود. با اینحال، اطلاعات در مورد مکانیسم¬های زیربنایی این تفاوتها محدود است. به نظر می¬رسد که ریتم-های فیزیولوژیکی تأثیر مستقیمی بر پاسخهای تمرینی دارد (50). Aβ42 یکی از پروتئینهای آمیلوئیدی است که در تشکیل پلاکهای آمیلوئید در مغز نقش دارد و به عنوان یک شاخص مهم در بیماری آلزایمر شناخته میشود. تجمع غیرطبیعی Aβ42 در مغز به طور مستقیم با اختلالات شناختی و نوروپلاستیسیته همراه است. در این مطالعه، افزایش سطح Aβ42 در گروههای سندرم متابولیک و سندرم متابولیک + تمرین نشاندهنده تأثیرات منفی این پروتئین در وضعیت پاتولوژیک سندرم متابولیک است، ولی کاهش سطح آن در گروه تمرین نسبت به گروه بدون تمرین، مؤید اثرات مثبت ورزش بر کاهش تجمع این پروتئین است. مطالعات مختلفی نشان دادهاند که تمرینات هوازی میتوانند سطح Aβ42 را کاهش دهند و از تجمع آن در مغز جلوگیری کنند. لذا، در مطالعهای توسطTang و همکاران در سال 2024 نشان داده شد که تمرینات هوازی قادرند سطح Aβ42 را در مدلهای حیوانی کاهش دهند (55). این مطالعه نیز مشابه به یافتههای ماست، که در آن مشاهده شد که گروههای تمرین شده در عصر سطح کمتری از Aβ42 را نسبت به گروه سندرم متابولیک نشان دادند. همچنین، تحقیقی توسطAnderot و همکاران در سال 2020 نشان داده شد که تمرینات ورزشی میتوانند با کاهش التهاب سیستمیک و بهبود فرآیندهای اتوفاژی از تجمع پروتئینهای آمیلوئیدی جلوگیری کنند (56). در این تحقیق، تفاوتهای مشاهده شده در سطح Aβ42 در دو زمان صبح و عصر نشاندهنده این است که زمان تمرین ممکن است بر پردازش پروتئینهای آمیلوئیدی تأثیر بگذارد. این نکته میتواند نشاندهنده اثرات متغیر تمرین در ساعات مختلف روز بر متابولیسم مغز و پردازش پروتئینها باشد. نتایج آزمون تعقیبی توکی نشان داد که سطح miR-132 در گروههای سندرم متابولیک و سندرم متابولیک + تمرین نسبت به گروه کنترل در روز افزایش معناداری داشته است. این نتیجه نشاندهنده اثر مثبت تمرینات ورزشی بر بیان miR-132 در هیپوکمپ موشهای مبتلا به سندرم متابولیک است. همچنین مشاهده شد که افزایش سطح miR-132 در گروه سندرم متابولیک + تمرین در مقایسه با گروه سندرم متابولیک بهطور معناداری بیشتر بوده است. این یافتهها به طور مستقیم تأثیر تمرینات هوازی بر تنظیم miRNAs در هیپوکمپ را تأیید میکنند. اکثر مطالعات پیشین نیز نشان دادهاند که تمرینات ورزشی میتوانند بر سطح miR-132 تأثیر بگذارند. به عنوان مثال، در تحقیق Mu, C, Gao و همکاران، در سال 2024 اثرات تمرینات ورزشی بر بیان miR-132 در مدلهای حیوانی سندرم متابولیک بررسی شد که نشان دادند فعالیت بدنی میتواند سطح miR-132 را در هیپوکمپ افزایش دهد و به بهبود پلاستیسیته سیناپسی و عملکرد شناختی کمک کند (57). همچنین Liu و همکاران در سال 2020 در مطالعهای بر روی موشهای مبتلا به آلزایمر، گزارش کردند که تمرینات ورزشی باعث افزایش miR-132 در هیپوکمپ و کاهش آسیبهای نورونی ناشی از آمیلوئید شدند (47). نتایج تحقیق حاضر نیز این اثرات مشابه را تایید میکنند و نشان میدهند که miR-132 به عنوان یک مولکول کلیدی در فرآیندهای پلاستیسیته عصبی میتواند تحت تأثیر تمرینات ورزشی قرار گیرد. در ارتباط با تأثیر زمان بر بیان miR-132 در مطالعه حاضر نشان دادیم که سطح miR-132 در زمانهای صبح نسبت به عصر افزایش معنیداری دارد. این یافتهها بهویژه برای گروههای تمرین حائز اهمیت است. در واقع، تفاوتهای زمانی در پاسخ به تمرینات میتواند نشاندهنده حساسیت متفاوت سیستمهای مولکولی به تمرین در ساعات مختلف روز باشد. این مورد میتواند به دلیل تأثیرات متفاوت ریتمهای شبانهروزی بر فرآیندهای سلولی و مولکولی در هیپوکمپ باشد. مطالعه Zhai و همکاران در سال 2024 نشان دادند که زمانبندی تمرینات بر میزان تغییرات miRNAs و دیگر نشانگرهای مولکولی تأثیر میگذارد (46). این یافتهها مشابه نتایج تحقیق حاضر هستند که نشان میدهند پاسخهای miRNAs به تمرینات ورزشی ممکن است تحت تأثیر زمان اجرای تمرینات قرار گیرند. بهطور خاص، در شرایط خاصی از جمله در ساعات صبح، پاسخها میتوانند شدت بیشتری داشته باشند که ممکن است ناشی از تفاوتهای درونسلولی و تنظیمات کرنوبیولوژیک باشد. در ارتباط با اثر تعامل گروه × زمان بر سطح miR-132، نتایج تحلیل تعامل (گروه × زمان) نشان داد که در گروه سندرم متابولیک، سطح miR-132 در هر دو زمان صبح و عصر نسبت به گروه کنترل کاهش معنیداری داشت. این نتیجه به خوبی نشاندهنده اختلالات مولکولی در گروههای مبتلا به سندرم متابولیک است که میتواند تأثیرات منفی این بیماری بر تنظیم miRNAs را توضیح دهد. به علاوه، در گروه سندرم متابولیک + تمرین، سطح miR-132 نسبت به گروه سندرم متابولیک در هر دو زمان صبح و عصر بهطور معناداری افزایش یافت که نشاندهنده تأثیر مثبت تمرینات ورزشی در تنظیم miR-132 حتی در شرایط پاتولوژیک است. این نتایج با مطالعات دیگر همخوانی دارد که نشان دادهاند اختلالات در تنظیم miRNAs در بیماریهایی مانند دیابت و سندرم متابولیک میتواند بر پلاستیسیته عصبی و عملکرد مغزی تأثیر منفی بگذارد. Mu, C, Gao و همکاران در سال 2024 در مطالعهای روی موشهای مبتلا به سندرم متابولیک گزارش کردند که کاهش miR-132 در هیپوکمپ به کاهش عملکرد شناختی و یادگیری منجر میشود. تمرینات ورزشی در این مطالعه باعث افزایش مجدد miR-132 و بهبود پلاستیسیته عصبی شدند که مشابه نتایج تحقیق حاضر است (57). در مطالعه همسوی Aten و همکاران، در سال 2018 نشان دادند که miR-132 بهطور قابلتوجهی در نورونها در AD و بسیاری از بیماری های نورودژنراتیو کاهش نشان داد و با توجه به فیزیولوژی شبانهروزی، بیان کرد که بیان miR-132 تحت کنترل نوسانگر شبانهروزی در SCN است (26). کاهش بیان miR-132 در بیماران مبتلا به AD و ALS نیز مشاهده می-شود، احتمالاً به این دلیل که miR-132 به شدت در مغز بیان می شود و چندین مسیر مرتبط با استرس اکسیداتیو را تنظیم میکند. miR-132 نمونه¬ای از این نوع پلیوتروپی تنظیمی miRNA با پیامدهای مستقیم در تخریب عصبی است (29،53). مطالعات نشان دادند که در مقابل، بیان miR-132 در ترویج التهاب در سلولهای چربی نقش دارد. این فرآیند در التهاب مزمن که ممکن است زمینه ساز مقاومت به انسولین در افراد چاق باشد، نقش دارد (28،58). در این رابطه Hernandez و همکاران، در سال 2016 دریافتند که مقدار Aβ42 محلول درون زا در هیپوکامپ در موش های AD تراریخته سه گانه 18 ماهه (3xTg-AD)با غیرفعالسازی miR-132 در مقایسه با گروه کنترل و بدون حذف miR-132 بهطور قابلتوجهی افزایش یافته است، که نشان داد که کمبود miR-132 در موش میتواند تولید Aβ افزایش دهد تجمع و رسوبگذاری نقش داشته باشد. علاوه بر این، با توجه به دادههای برخی مطالعات همسو، محققان دریافتند که سطح miR-132 در بیماران مبتلا به اختلال شناختی خفیف (MCI) و AD در مقایسه با افراد سالم پایینتر است و بین سطوحmiR-132 همبستگی منفی وجود دارد و سطح miR-132 و Aβ42 نامحلول نیز به طور قابل توجهی همبستگی داشتند (28). برای تأیید بیشتر ارتباط بین miR-132 و Aβ، نشان داده شد که miR132 در ردههای سلولی به طور پایدار Aβ (انسانی) را بیان میکنند. در ردههای سلولی، miR-132 بهطور قابلتوجهی سطوح Aβ40 و Aβ42 انسانی (محلول) را کاهش داد، که نشان میدهد کمبودmiR-132 باعث افزایش تولید Aβ میشود (28). در مجموع در مطالعه حاضر ما نشان دادیم که انجام تمرینات تداومی با شدت متوسط می¬تواند با تقویت ژن های ساعت به بهبود عوامل متابولیک و کاهش آمیلوئید بتا به دنبال بیان miR-132 در هیپوکمپ موش های دارای سندرم متابولیک منجر شود. از طرفی نشان دادیم تمرین در عصر تاثیر بیشتری در این ارتباط داشته است. از محدودیتهای پژوهش حاضر عدم کنترل غذای مصرفی، بررسی دیگر وهلههای ساعت بیولوژی مثل بعد از ظهر و همچنین ارزیابی دیگر ژنهای وابسته به ریتم شبانهروزی بوده است و در پژوهش حاضر مجالی جهت بررسی ریتم شبانهروزی در سایر اندامها و اعمال دیگر شدت¬ها و مدل¬های تمرینی نبوده است، لذا انجام پژوهشهایی با موارد عنوان شده پیشنهاد می¬گردد.
نتیجهگیری
نتایج تحقیق حاضر نشان داد که به دنبال تمرین تداومی و بهبود فاکتورهای متابولیک، کاهش میزان Aβ42 به دنبال افزایش بیان miR-132 در هیپوکامپ موشهای آزمایشگاهی دارای سندرم متابولیک رخ میدهد. تغییرات ایجادشده در miR-132 در عصر با کاهش عوامل تخریب نورونی همچون Aβ42 ناشی از این تمرینات ورزشی می¬تواند در ارتباط باشد. در نتیجه به نظر میرسد، تمرینات تداومی میتواند از طریق تعدیل فاکتورهای مرتبط با ریتم شبانهروزی و در نتیجه افزایش بیان پروتئین ها و miRNAs از تحلیل سیستم عصبی ناشی از سندرم متابولیک جلوگیری کند.
سپاسگزاری
بدینوسیله از زحمات اساتید و کادر محترم دانشکده تربیت بدنی و دامپزشکی دانشگاه شهید چمران اهواز تشکر و قدردانی می¬گردد. این مقاله منتج از پایان نامه مقطع دکتری رشته فیزیولوژی ورزشی می¬باشد که در دانشگاه شهید چمران اهواز تصویب و با حمایت مالی این دانشگاه به انجام رسیده است.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
ﺗﻤﺎم ﻣﺮاﺣﻞ آزﻣﺎیﺶ ﺑﺮ اﺳﺎس دستورالعمل ﮐﻤﯿﺘﻪ اﺧﻼق ﮐﺎر ﺑﺎ ﺣﯿﻮاﻧﺎت آزﻣﺎیﺸﮕﺎﻫﯽ داﻧﺸﮕﺎه ﺷﻬﯿﺪ ﭼﻤﺮان اﻫﻮاز باکد اخلاق IR.SCU.REC.1403.044 ﻃﺮاﺣﯽ و اﺟﺮا ﺷﺪ.
مشارکت نویسندگان
نوسینده اول و دوم و چهارم در ارائه ایده و در طراحی مطالعه، نویسنده اول در جمعآوری دادهها و در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
ســندرم متابولیــک، نوعــی اختــلال در اســتفاده از انــرژی و ذخیرهسازی آن اسـت که میتواند با ایجاد تغییرات منفی در متابولیسم کلسترول مغزی و مقاومت به انسولین منجر به تخریب سلولهای عصبی گردد. تحقیقات اخیر نشان میدهند که عوامل ژنتیکی و محیطی مختلف ممکن است در ایجاد ارتباط بین سندرم متابولیک و بیماریهای نورودژنراتیو مؤثر باشند. همچنین، تأثیر مؤلفههای سندرم متابولیک، مانند قند خون بالا، کلسترول HDL پایین و چاقی بر کاهش عملکرد شناختی تأیید شده است (1). عوامل خطر محیطی، از جمله دیابت نوع ۲، چاقی و دیسلیپیدمی، به ویژگیهای بیماریزای عصبی، مانند کاهش مصرف گلوکز در مغز، استرس اکسیداتیو، التهاب و اختلال عملکرد میتوکندری منجر میشوند که میتوانند به تخریب نورونی منجر گردند (2) .مطالعات Positron emission tomography scan PET نشان دادهاند که مغز اسیدهای چرب را جذب میکند. سندرم متابولیک باعث افزایش جذب و تجمع این اسیدها در مغز میشود که این افزایش، با کاهش وزن رابطه معکوس دارد (3). همچنین، گزارش شده است که رژیمهای غذایی پرچرب ممکن است به بیماریهای نورودژنراتیو، مانند آلزایمر Alzheimer's disease (AD)، منجر شوند (4). درمان با متابولیتها، به بهبود جزئی شناختی و کاهش التهاب، آپوپتوز و نارسایی سیناپسی در مدلهای انسانی و موش منجر شده است (5). در مدلهای موش دیابتی (DM) نیز تغییراتی در متابولیسم گلوکز، سیگنالدهی انسولین، التهاب عصبی، هیپرفسفوریلاسیون تاو پروتئینهای تاو (Tau Proteins) پروتئینهایی هستند که ریزلولهها را تثبیت میکنند. پروتئین تاو در نورونهای دستگاه عصبی مرکزی به فراوانی و در آستروسیتها و الیگودندرسیتها به میزان کمتری یافت میشوند. عامل اصلی بیماریهای مرتبط به زوال عقل مانند آلزایمر و پارکینسون هستند و پردازش نادرست آمیلوئید بتا (Aβ) یک پروتئین ۳۶ تا ۴۳ پپتیدی و سازنده اصلی پلاکهای آمیلوئید است که در مغز مبتلایان به بیماری آلزایمر یافت میشود. مشاهده شده که این موارد از ویژگیهای برخی بیماریهای نورودژنراتیو هستند. با این حال، نتایج تحت تأثیر متغیرهایی مانند رژیم غذایی، زمان مطالعه و مداخلات مختلف از جمله افزایش تحرک قرار دارند که نتیجهگیری قطعی را دشوار میکند (6,7). مطالعات نشان دادهاند که تغییرات در توزیع و سطح کلسترول افزایش یافته در سندرم متابولیک، سیالیت غشاء و بخشهای لیپیدی تنظیمکننده، بر سنتز، رسوب و پاکسازی آمیلوئید بتا (Aβ) تأثیر میگذارد (8). پروتئین پیشساز آمیلوئید بتا (APP) و آنزیمهای پردازش آن (آلفا سکرترز و بتا سکرترز) در بخشهای لیپیدی غشاء قرار دارند و تولید Aβ به شدت به محیط لیپیدی غشاء وابسته است. افزایش کلسترول باعث افزایش تولید Aβ و کاهش کلسترول باعث کاهش سطح آن میشود. همچنین، کاهش کلسترول غشای پلاسمایی، سمیت Aβ را کاهش میدهد (9). افزایش سطح کلسترول غشای پلاسمایی در سندرم متابولیک منجر به تولید آپولیپوپروتئین APOE میشود که حامل اصلی کلسترول در مغز است (10). APOE4 بهعنوان عاملی در تشکیل آمیلوئید بتا (Aβ) شناخته شده و بر پاکسازی و رسوب آن تأثیر میگذارد. وقتی APOE به لیپید A1 متصل میشود، چسبندگی آن افزایش مییابد و تجزیه پروتئولیتیک Aβ را تسهیل کرده و از رسوب آن جلوگیری میکند (11). پروتئین غشایی ABCA1 که وظیفه انتقال کلسترول از سلول به آپولیپوپروتئینهای کملیپید را دارد، با کاهش کلسترول سلولی میتواند تولید Aβ را کاهش دهد و همچنین از طریق افزایش APOE لیپیدی، پاکسازی Aβ را بهبود بخشد. افزایش سطح کلسترول در نورونها و آستروسیتها نیز به افزایش سمیت Aβ منجر میشود (12). بیشتر تحقیقات در این حوزه با استفاده از دستکاریهای ژنتیکی یا دارویی انجام شدهاند. این مطالعات نشان میدهند که حذف ژن ABCA1 باعث کاهش پاکسازی کلسترول در مغز میشود. در مغز بزرگسالان، متابولیسم کلسترول از طریق تولید ۲۴S- هیدروکسی کلسترول (24OHC) متعادل میشود.24OHC به عنوان یکی از مشتقات کلسترول میتواند از سد خونی مغز عبور کرده و وارد گردش خون شود و حدود ۶ میلیگرم در ۲۴ ساعت توسط مغز به جریان خون آزاد میشود (13,14). در عین حال مقاومت به انسولین (IR) در بیماران دارای سندرم متابولیک بر متابولیسم کلسترول در مغز تأثیر میگذارد و ارتباط متقابلی بین این دو وجود دارد. هیپرکلسترولمی و اختلال در هموستاز کلسترول میتوانند باعث تشدید IR شوند، در حالیکه IR نیز میتواند متابولیسم کلسترول را مختل کند. انسولین، فاکتورهای رونویسی SREBP را که در بیوسنتز کلسترول نقش دارند، فعال میکند و باعث افزایش سنتز کلسترول میشود. IR ناشی از آمیلوئید بتا (Aβ) نیز هموستاز کلسترول را به هم میزند. افزایش قند خون و کمبود انسولین، سنتز کلسترول در مغز را از طریق کاهش بیان SREBP2 کاهش میدهد (15،16). تجمع کلسترول تنها در سنین پیری در هیپوکامپ با افزایش سمیت Aβ مشاهده میشود. کاهش سنمحور در بیان ABCA1 ممکن است این تفاوت را توضیح دهد. این کاهش ممکن است به شرایط التهابی مزمن یا تغییرات در اکسیاسترولهای مغزی مرتبط باشد، اما تحقیقات بیشتری برای روشن شدن مکانیسم دقیق آن نیاز است (17). سیستم ساعت شبانهروزی پستانداران به دو سطح تقسیم میشود: ساعت مرکزی و ساعتهای محیطی. ساعت مرکزی در هسته سوپراکیاسماتیک (SCN) واقع شده و اطلاعات زمانی را از نور خورشید دریافت کرده و به ساعتهای محیطی منتقل مینماید. این ساعتهای محیطی میتوانند بهطور مستقل بیان ژن را تنظیم کرده و نشانههای زمانی، مانند فعالیت حرکتی و رفتار تغذیهای را دریافت کنند (18). ورزش در شبانهروزی سیستم دو نقش دارد: بهعنوان یک نشانه زمانی عمل کرده و میتواند در تنظیم مجدد ساعتهای شبانهروزی مؤثر باشد. همچنین ورزش تأثیرات قابلتوجهی بر ترشح هورمونها و پارامترهای فیزیولوژیکی دارد. ژنهای PER2 و BMAL1 بهعنوان ژنهای فاز نوری تحت تأثیر REV-ERB تنظیم میشوند و با بیان ژنهای سرکوبگر ریتم شبانهروزی ارتباط دارند. REV-ERB به تنظیم متابولیسم کمک کرده و با حس کردن کمبود انرژی ناشی از ورزش، حساسیت به انسولین را افزایش میدهد (19). متابولیسم عضله اسکلتی نیز تحت تأثیر ریتم شبانهروزی قرار دارد؛ بهطوری که غلظت گلوکز در پلاسما در صبح اوج میگیرد و حساسیت به انسولین در صبح بیشتر است. میتوکندریهای عضله اسکلتی در ساعات شب ظرفیت اکسیداتیو بالاتری دارند. زمانبندی ورزش بر بافت موضعی و متابولیسم سیستمیک تأثیر میگذارد؛ بهویژه اینکه ورزش در شب به اکسیداسیون اسیدهای چرب آزاد (FFA) وابستگی بیشتری دارد (20). در مطالعهAsher و همکاران در سال 2015 نشان دادند که ورزش تأثیرات متفاوتی بر بیان ژن در گروه تمرین صبح و گروه تمرین عصر دارد. در گروه تمرین صبح، مسیرهای سیگنالدهی انسولین و متابولیسم گلوکز بهطور خاص افزایش یافت. همچنین، این گروه پس از ورزش کاهش شدیدتری در سطوح لیپیدها و اسیدهای آمینه در مقایسه با گروه تمرین عصر نشان داد (21). ورزش عصرگاهی با ظرفیت تمرین و استقامت بیشتری همراه است و این موضوع به اتکای بیشتر به کربوهیدراتها و دمای بالاتر بدن در عصر مرتبط است و در این زمان، کاهش مصرف اکسیژن و کاهش قند خون به ورزش کمک میکند (22). در عوض، اکسیداسیون اسیدهای چرب آزاد (FFA) در صبح بهطور بالقوه میتواند منجر به کاهش چربی بیشتری شود. همچنین، متابولیسم سیستم شبانهروزی در پستانداران تأثیر عمدهای بر متابولیسم انرژی دارد و جهش یا حذف ژنهای مرتبط با ریتم شبانهروزی میتواند منجر به متابولیسم انرژی ناکارآمد شود. در نهایت، ژنهای متابولیک اصلی و فعالیتهای آنها با سیستم ساعت فعالیتها همکاری نزدیکی دارند و برای تنظیم، هماهنگسازی و تنظیم دقیق فرآیندهای فیزیولوژیکی متنوع بسیار مهم هستند (23). ریزآرانایها (miRNAs) یا میکرو RNAها مولکولهای کوچک اسید ریبونوکلئیک (RNA) هستند که طول آنها بین 21 تا 32 نوکلئوتید متغیر است. این مولکولها از انواع RNA غیرکدکننده بهشمار میآیند که برای بسیاری از عملکردهای بیولوژیکی ضروری هستند. خواه با انجام مستقیم عملکرد موردنظر (RNA غیرکدکننده) و خواه با ایجاد یک الگو برای تولید پروتئینها (RNA پیامرسان). این مولکولها با اتصال به ناحیه UTR3 در mRNAهای هدف، باعث تخریب و سرکوب ترجمه آنها میشوند (24). miRNAs نقشهای حیاتی در کنترل عملکرد سلولهای مغزی دارند و تغییر در بیان آنها میتواند به بروز بیماریهای پاتولوژیک منجر شود. به همین دلیل، miRNAs به عنوان ابزارهایی برای تشخیص، پیشآگهی و درمان بیماریهای نورودژنراتیو مورد بررسی قرار میگیرند. با این حال، نقش و بیان دقیق آنها در سیستم عصبی پستانداران بالغ هنوز بهطور کامل روشن نشده است (25). یکی از miRNAs خاص مغز، miR-132 است که در تنظیم ساعت شبانهروزی در هسته سوپراکیاسماتیک (SCN) نقش دارد miR-132 تحت تأثیر نشانههای نور، بیان ژنهای ساعت را تعدیل کرده و اثرات ریتمساز نور را کاهش میدهد (26). تحقیقات نشان میدهد که miR-132 در سلولهای عصبی غنی است و باعث رشد و جوانهزنی نورونها (نوروژنز) میشود. همچنین، این miRNA میتواند لیپوژنز و کلستروژنز را برنامهریزی مجدد کند و فرآیندهای پاییندستی را که منجر به تغییرات در رونوشتهای تنظیمکننده متابولیسم و در نتیجه تغییر پروفایلهای چربی سرم میشود، آغاز کند (27). هرناندز و همکاران در سال 2016 نشان دادند که سطح Aβ در هیپوکامپ موشهای مبتلا به آلزایمر (AD) که miR-132 آنها حذف شده، نسبت به گروه کنترل بهطور قابلتوجهی افزایش یافته است. این نشان میدهد که فقدان miR-132 میتواند تولید، تجمع و رسوب Aβ را افزایش دهد (28).
miR-132بهویژه در تنظیم مسیرهای متابولیک لیپوژنز و کلستروژنز از طریق بیوسنتز SREBP2 و ABCA1 نقش دارد و بر تنظیم لیپیدها در سرم و بیان Aβ تأثیر میگذارد (29،30). همچنین، miR-132 تأثیراتی بر Aβ دارد که بهعنوان عامل آغازکننده بیماری آلزایمر و برخی بیماریهای نورودژنراتیو شناخته میشود (31). در پستانداران، miRNAs نقش مهمی در زمانبندی ساعت دارند. تحقیقات نشان دادهاند که miR-132 بهطور نوسانی در موشها بیان میشود و این miRNA تحت تأثیر نور قرار میگیرد. بهعلاوه، miRNAs بر حلقه رونویسی شبانهروزی هسته تأثیر میگذارند، هرچند که مکانیزمهای دقیق اثرگذاری آنها هنوز بهطور کامل شناخته نشده است (32). در مجموع، تحقیقات در رابطه با بیان miR-132 و استرس شبکه اندوپلاسمی (ER) بیشتر در اندامهایی مانند کلیه و مری انجام شده است. بنابراین، مطالعات بیشتری برای تعریف مکانیسمهای مربوط به miR-132 در هیپوکامپ و اثرات آن بر نورودژنراسیون و سایر فرآیندهای فیزیولوژیکی مورد نیاز است (33). به طور کلی، این مطالعه به بررسی سؤال اصلی این است که آیا تمرینات تداومی میتوانند بر متابولیسم کلسترول در هیپوکامپ و عوامل مؤثر مانند استرس شبکه اندوپلاسمی و تشکیل پلاکهای Aβ تأثیر بگذارند و در نتیجه به پیشگیری یا بهبود تخریب نورونی در افراد مبتلا به سندرم متابولیک کمک کنند. همچنین، اثرات کرنوبیولوژیک تمرین بر این متغیرها مورد بررسی قرار میگیرد. بهطور کلی، تحقیقات اخیر نشان داده است که اختلال در متابولیسم کلسترول در مغز در بیماران مبتلا به سندرم متابولیک، سبب بروز طیف گستردهای از تغییرات مولکولی منجر به آسیب عصبی و تجمع بتا آمیلوئید میشود. که فعالیت بدنی میتواند سبب کاهش عوارض سندرم متابولیک در مغز شود (35،34). اگر چه اکثر مطالعات اتفاق نظر دارند که تمرینات هوازی یک راه موثر برای مدیریت بیماریهای متابولیک است. با اینحال به نظر می¬رسد اختلالات نورودژنراتیو و در نظر گرفتن چالش زمان، ممکن است امکان تحلیل دقیقتری برای آسیبشناسی سندرم متابولیک و طراحی مداخلات درمانی وابسته به زمان که هنوز ناشناخته است، برای بهبود عملکرد عصبی و مدیریت مؤثر عوارض وابسته به بیماریهای متابولیک فراهم آورد. بنابراین، هدف از مطالعه حاضر تأثیر ریتم شبانه روزی و زمان-بندی فعالیت بدنی در صبح و عصر بر بیان ژنهای مرتبط با پردازش بتا آمیلوئید وابسته به miR-132 در موشهای دارای سندرم متابولیک میباشد.
روش بررسی
پژوهش حاضر از نوع مطالعه تجربی، از لحاظ اجرا آزمایشگاهی و به روش نمونه گیری تصادفی ساده میباشد. 48 سر موشهای آزمایشگاهی نر بالغ هشت تا ده هفتهای، نژاد NMRI با میانگین وزنی 3/22±26 گـرم از مرکز حیوانات آزمایشگاهی دانشگاه علوم پزشکی جندی شاپور اهواز خریداری و در محیطی با دمای 2±22 درجه سانتیگراد، رطوبت 45 تا 55 درصد و چرخه تاریکی_روشنایی 12:12 ساعته نگهداری شدند. در ابتـدا تعـداد 32 سـر مـوش بهطور تصادفـی انتخـاب و بــه مــدت 12 هفتــه بــا رژیم غذایی پرچرب و پرکالری(HFD) که بهطور معمول به اختلال در تعادل انرژی بدن منجر میشود و باعث پرخوری و چاقی میگردد، تغذیــه شدند (36). از طرفــی 16 ســر موش آزمایشگاهی تحــت رژیــم غذایــی اســتاندارد قــرار گرفتند کــه گــروه موشهای ســالم را تشــکیل دادند. چاقــی موشها بــا محاســبه شــاخص لــی، پــس از 12 هفتــه مصــرف غــذای چــرب، حاصــل شــد (36) ارزیابــی چاقــی (فرمول یک) در موشها، مشــابه در انســان و از ریشــه ســوم وزن بــدن (گــرم) تقســیم بــر طــول بــدن (ســانتیمتــر) ضــرب در 1000 بــهدســت آمــد (37).

فرمول یک: فرمول تعیین شاخص چاقی
همچنیــن، بــرای ارزیابــی شاخصهای زیســتی ســندرم متابولیـک، مـوشهای چـاق شـده در اثـر رژیـم غذایـی پرچــرب و پرکالــری بــا خونگیری از وریـد دمـی، دسـی لیتـر و تـری گلیسـیرید بالاتـر از 110 میلیگرم بـر دسـی لیتـر دارا بودند، معیارهـای سـندرم متابولیـک اثبات گردید (37). ضمناً از مـوشهای گـروه کنتـرل و تغذیه شده بـا غـذای اسـتاندارد نیـز خونگیـری بـهعمـل آمـد. در ادامـه، موشهای آزمایشگاهی در 6 گــروه (N=8) شــامل گروه کنتــرل ســالم صبح، گـروه کنترل عصر سالم، گــروه کنتــرل صبح ســندرم متابولیــک، کنتــرل عصر ســندرم متابولیــک، گـروه تمریـن تداومی صبح سندرم متابولیک، گـروه تمریـن تداومی عصر سندرم متابولیک، تقسیمبندی شده و تـا پایـان مداخلـه ورزشــی غــذای مورد استفاده موشهای آزمایشگاهی، رژیــم اســتاندارد بــا کالــری طبیعــی بــود. تمریـن موشها بر روی تردمیل موشهای آزمایشگاهی بود که با دوره آشناسـازی 7 روزه (تمرین شم) شـروع شـد. به منظورآشنایی با دستگاه و کاهش استرس و سازگاری با شرایط تمرینی در طی یک هفته، تمرین کردند. برای ایجاد شـــرایط کاملاً یکســـان حیوانات بدون تمرین به مدت مشـــابه حیوانات تمرین کرده بر روی تردمیل موش¬های آزمایشگاهی قرار داده شدند. بهطور خلاصه، موشها برای دویدن روی تردمیل مخصوص موشهای آزمایشگاهی به مدت یک هفته از 10-25 دقیقه فعالیت دویدن با سرعت 5-10 متر در دقیقه قبل از انجام مداخله ورزشی 8 هفتهای سازگار شدند. تمرین تداومی با شدت کم تا متوسط (جدول 1): در گروههای تمرینـی بـه مـدت 2 مـاه (5 روز در هفتـه، در وقـت صبـح از سـاعت 10- 9و عصر از ساعت 19-20 برنامـه تمریـن تداومی را اجــرا کردند. آزمون حداکثر ســـرعت دویدن موشها، Vmax قبل از 6 هفته و 8 هفته پس از شـــروع پروتکل تمرینی، برای تعیین شــدت برنامه تمرینی و کنترل اعمال اضــافه بار مطابق با مطالعات قبلی انجام شــد (38). برای اجرای این آزمون، موشهای گروه تمرین تداومی با شدت متوسط moderate intensity continuous training (MICT) پس از گرم کردن با سرعت 5 الی 8 متر بر دقیقه با شیب صفر درجه شروع به دویدن کردند. ســـرعت تردمیل هر ۲ دقیقه یک بار به میزان 0/3 متر بر ثانیه ( حدود ۲ متر در دقیقه) افزایش یافت. Vmax ســرعتی بود که با وجود اعمال تحریکات ملایم (با چوب دســتی)، موش توانایی و یا تمایلی برای ادامه دویدن نداشته باشد. پروتکل تمرینی با اقتباس از تحقیقات منتشر شده قبلی (40،39) پس از برآورد حداکثر ســرعت دویدن موشهاVmax آغاز گردید. بهطوری که، پس از ۵ دقیقه گرم کردن با سرعت 5 متر بر دقیقه، موشها در گروه تمرین با شــدت 6۰-50 درصــد Vmax به مدت 60-30 دقیقه و پنج جلسه در هفته به مدت 8 هفته دویدند. در انتهای هر جلسه، سردکردن با سرعت 5 متر بر دقیقه به مدت 3 دقیقه اجرا شــد. در طول دوره مطالعه، موشها بر روی تردمیل، 13 متر در دقیقه به مدت 30 دقیقه در هفته اول دویدند. سپس سرعت هفتهای 1 متر در دقیقه و زمان 10 دقیقه هر دو هفته افزایش یافت که به سرعت هدف 20 متر در دقیقه و زمان 60 دقیقه افزایش یابد (جدول 1). بهطور خلاصه برنامه فعالیت بدنی (شکل 1): تمرین روزانه 60-30 دقیقهای به مدت 8 هفته (شکل 1)، با شدت 50-60% VMAX که 5 روز در هفته تکرار شد (41). تغییرات سندرم متابولیک، وزن، گلوکز خون، تریگلیسیرید و لیپوپروتئینها: متغیرهای وزن و گلوکز خون در حالت پایه (هفته اول) بین گروههای آزمایشی تفاوت معنیداری وجود نداشت و غلظت گلوکز خون ناشتا کمتر از 6/5 میلیمول/لیتر (117میلیگرم بر دسی¬لیتر) تریگلیسیرید HDL63/66 40/66و LDL 73/33 بود که نشاندهنده این است سطوح سرمی آنها در وضعیت استانداردی قرار داشته است. پس از 12 هفته تغذیه با رژیم غذائی پرکالری و پرچرب، افزایش معنیداری در وزن بدن، غلظت گلوکز، تریگلیسیرید و لیپوپروتئینهای خون موشهای تحت رژیم نسبت به گروه کنترل به وجود آمد (0/05>P). در گروههای سندرم متابولیک و سندرم متابولیک + تمرین، غلظت گلوکز خون ناشتا بیشتر از 6/5 میلیمول برلیتر (117میلیگرم بر دسیلیتر) بوده و تریگلیسیرید سرمی 16/133HDL 16/129 و LDL سرمی 132 بود که نشاندهنده تائید سندرم متابولیک در موشها است. 48 ســاعت بعــد از آخریــن جلسـه تمرینـی و 8 سـاعت ناشـتایی، موشهای صحرایـی بهوسیله تزریــق درون صفاقــی زایلازیــن (10 میلیگرم/ کیلــوگــرم) و کتامیــن (90 میلیگرم/کیلــوگــرم) بیهوش شــدند، خونگیری بــه میــزان 4 میلیلیتر مستقیماً از قلـب حیـوان صـورت گرفـت. بلافاصلـه توســط ســانتریفیوز بــا ســرعت 5000 دور بــر دقیقــه در مــدت 10 دقیقــه جداســازی شــد. ســپس ســرمها در میکروتیوبهــا جمعآوری و جهــت کاهــش احتمــال سـوگیری در آزمایشها کدگذاری گردیـد. بـرای سـنجش و تعییـن شاخصهای خونـی موردنظر سـرم تهیهشده از 4 میلیلیتر خـون اسـتفاده شـد. برای تهیه نمونه بافتی، ابتدا موشها با ترکیب کتامین زایلازین به نسبت 60 به 40 بیهوش شدند. سپس با جدا کردن سر موش با کمک قیچی مخصوص و جدا کردن کل مغز و خارج کردن آن از کاسه جمجمه، هیپوکامپ از سایر قسمتهای مختلف مغز جدا شد و بلافاصله در ازت قرار گرفت پس از منجمدشدن، بافت در یخچال مخصوص در دمای -80 درجه نگهداری شد. برای هموژن کردن، 100 میلیگرم از بافت بهوسیله بافر سالین در یک بشر استریل شستشو داده شد. بافت در یک میلیلیتر از بافر سالین هموژن خواهد شد و به مدت 16 ساعت در دمای 20- درجه سانتیگراد نگهداری شد. سپس بافت از حالت انجماد خارج و دوباره منجمد شد. جهت تخریب غشاء پلاسمایی این عمل سه بار تکرار خواهد شد. ترکیب حاصل به مدت 5 دقیقه با دور 5000 در دمای 2 تا 8 درجه سانتیگراد سانتریفوژ شد. سپس محلول رویی جدا و در دمای 80 - درجه سانتیگراد برای تجزیهوتحلیل بعدی نگهداری شد. پیش از انجام آزمایش، برای سنجش مقدار پروتئین ها، نمونه یکبار به مدت 2 دقیقه با دور 5000 سانتریفوژ شد و دوباره محلول رویی جدا و مورد استفاده قرار گرفت. جهت ارزیابی مقادیر پروتئینهای تحقیق از روش Realtime PCR و وسترنبلات استفاده شد. بهمنظور ارزیابی انجام وسترن بلات ابتدا نمونهها با استفاده از بافر لیز کننده RIPA و با استفاده از هموژنایزر، هموژنیزه شد. سپس نمونهها به مدت 10 دقیقه در دمای 40 درجه سانتیگراد و با دور 12000 در دقیقه سانتریفیوژ و مایع رویی جهت آنالیزهای بعدی استفاده میشوند. میزان پروتئین نمونهها با استفاده از روش برادفورد سنجیده شد. SDS-PAGE به روش متعارف با استفاده از ژل 10% و سیستم بافری پیوسته انجام شد. پس از انجام SDS-PAGE نمونهها با استفاده از روش متعارف و در دستگاه بلاتینگ به کاغذهای نیترو سلولز منتقل میشود. آمادهسازی کاغذها در بافر انتقال 2 ساعت قبل از انجام آزمون انجام شد. پس از انتقال نمونهها به کاغذهای نیتروسلولز انجام مراحل شستشو و مسدودسازی با Skimed milk 5% انجام شد. بهمنظور ردیابی پروتئینهای موردنظر از آنتیبادی اولیه پلیکلونال ضد پروتئینهای مورد مطالعه با رقت 200/1 و آنتیبادی ثانویه پلیکلونال ضد IgG با HRP استفاده شد. آشکارسازی با استفاده از کروموژن DAB انجام شد. از پروتئین GAPDH یا بتا اکتین بهعنوان کالیبراتور استفاده شد. ارزیابی نسبت دانسیته باندهای پروتئینهای هدف نسبت به GAPDH با استفاده از نرمافزار MEGA5 انجام شد و نتایج با واحد قراردادی و نسبت به بیان پروتئین کالیبراتور گزارش شد. بهمنظور ارزیابی بیانmiR-132 ، از روش Realtime PCR استفاده شد. از RNA U6 بهعنوان کالیبراتور استفاده شد. استخراج RNA با استفاده از روش فنول- کلروفورم-گوانیدین ایزوتیوسیانات و کیت تجاری miRcute miRNA Isolation Kit -Tiangen، چین انجام میشود. بهمنظور سنتز cDNA در ارزیابی بیان miRNAs از روش polyadenylation و کیتهای mirCUITE-Tiangen، چین استفاده شد. کیفیت RNA استخراجشده با استفاده از روخوانی نسبت جذب 280/260 و دستگاه نانودراپ انجام گردید. نمونههای cDNA به منظور انجام واکنش Real time PCR با استفاده از کیت miRcute miRNA qPCR Detection Kit (SYBR Green) و روش مقایسهای ΔΔCt مورد ارزیابی قرار گرفت. از ژن u6 بهعنوان کالیبراتور استفاده گردید. نتایج براساس فرمول عمومی ΔΔCt-2 گزارش شد. تمام نمونه¬ها با 2 بار تکرار انجام گردید.
تجزیه و تحلیل آماری
ﺑﺮای آﻧﺎﻟﯿﺰ آﻣﺎری از نرمافزار SPSS version 16 اﺳﺘﻔﺎده گردید. نرمال بودن توزیع دادهها با استفاده از آزمون شاپیرو-ویلک بررسی شد و همگنی واریانس ها با آزمون لون سنجیده شده است. محاسبات آماری از طریق نرمافزار با استفاده از نرمافزار (9.0.0) GraphPad Prism از مسیر تحلیل colume با استفاده از آنالیز Two-way Anova رسم شدهاند. آزمــون تعقیبــی توکــی و همچنیــن از آزمــون همبســتگی پیرســون نیــز بــرای بررســی رابطــه بیــن متغیرهــا اســتفاده و همچنین سطح معنیداری برای تمام روشهای آماری در سطح احتمال (P<0.05) در نظر گرفته شد. شـد.

شکل 1: نمودارجریانی طراحی پژوهش
جدول 1: خلاصه برنامه تمرینی

نتایج
مطالعه حاضر نیز نشان داد که رژیم غذایی پرچرب می تواند ویژگیهای MetS را در مدل های جوندگان القا کند. موشهای آزمایشگاهی که با رژیم غذایی پرچرب تغذیه شدند، دچار چاقی، هیپرگلیسمی، دیسلیپیدمی و اختلال در تحمل گلوکز گردیدند (p˂0/05). به دلیل شیوع بالای سندرم متابولیک در سنین میانسالی، در این مطالعه رژیم غذایی را از 12 ماهگی معادل میانسالی در انسان آغاز کردیم و با توجه به اینکه که این اختلالات در متابولیسم کلسترول در مغز بیماران مبتلا به سندرم متابولیک میتواند به تغییرات مولکولی و آسیبهای عصبی منجر شود، بعد از 8 هفته اثرات کرنوبیولوژیک فعالیت بدنی بر عامل تخریب نورونی Aβ42 وmiR-132 را بررسی کردیم که بدین شکل تغییر یافتند (جدول 2).
اثرات کرنوبیولوژیک تمرین بر پردازش بتا آمیلوئید: نتایج تحلیل واریانس دو راهه نشان داد (جدول 3) که اثر اصلی گروه (p=0/001) و اثر اصلی زمان (p=0/0394) برای سطح Aβ42 معنیدار است اما اثر تعامل (گروه× زمان) معنیدار نمیباشد (p=0/1076). بنابراین با توجه به سطح معنی¬داری اثر تعامل تفاوت معنیداری در غلظت (Aβ42) بین گروههای کنترل، سندرم متابولیک و سندرم منتابولیک + تمرین در اوایل فاز روشنائی و عصر وجود ندارد. نتایج آزمون تعقیبی توکی برای سطح پروتئین Aβ42نشان داد که: 1) سطح پروتئین Aβ42 در گروه سندرم متابولیک و سندرم متابولیک + تمرین نسبت به گروه کنترل در هر دو زمان صبح و عصر افزایش معنیداری یافت (0/001 =P). 2) سطح پروتئین Aβ42در گروه کنترل، سندرم متابولیک و سندرم متابولیک + تمرین در صبح نسبت به عصر Aβ42 معنیداری نشان نداد. 3) سطح پروتئین Aβ42در گروه سندرم متابولیک + تمرین نسبت به گروه سندرم متابولیک در عصر (0/002 =P) کاهش معنی¬دار داشت (شکل 3و2).
جدول 2: میانگین و انحراف معیار میزان تغییرات پارامترهای مورد مطالعه پس از مداخله در گروههای مختلف آزمایشی

جدول3: نتایج تحلیل واریانس دوراهه


جدول 3: متغیرهای جانبی در پس¬آزمون


بحث
نتایج تحقیق حاضر نشان داد که تغییرات متابولیک ناشی از HFD بهطور قابلتوجهی باعث القاء فنوتیپ سندرم متابولیک میشود که با افزایش معنیدار شاخصهای مقاومت به انسولین از جمله؛ هیپرگلیسمی، هیپرانسولینمی و HOMA-IR هیپرکلسترولمی و افزایش تریگلیسیرید، تغییرات لیپوپروتئینها و افزایش وزن مشخص میشود. این نتایج بهطور کلی با یافتههای برخی از مطالعات که نشان دادهاند رژیمهای پرچرب منجر به افزایش وزن، هیپرگلیسمی و دیسلیپیدمی میشوند، همخوان است (1،3،37). برای مثال در مطالعه فریس و همکاران، در سال 2019 نشان دادند، استفاده از رژیم غذایی پرچرب از 12 ماهگی تأثیرات منفی بر وضعیت متابولیک موشها در مراحل میانسالی خواهد داشت (42). در این مطالعه، نتایج آزمون حداکثر سرعت نشان داد که هشت هفته تمرین هوازی منجر به بهبود معنادار سرعت حداکثر موشهای گروه سندرم متابولیک + تمرین نسبت به گروههای کنترل و سندرم متابولیک شد. این افزایش در آزمون حداکثر سرعت میتواند بهعنوان نشاندهنده بهبود عملکرد فیزیکی در گروههای تمرینی تفسیر شود. این یافتهها با نتایج مطالعه دیگر که تأثیر مثبت فعالیتهای ورزشی بر بهبود قدرت بدنی و ظرفیت فیزیکی در مدلهای حیوانی مبتلا به اختلالات متابولیک را نشان میدهند، همخوانی دارد (42). همچنین، بیشترین افزایش سرعت در گروههای تمرین در عصر مشاهده شد که میتواند به تأثیر زمان انجام تمرین بر نتایج بدنی و فیزیولوژیکی اشاره کند. این یافته با شواهد موجود در مطالعه Reilly & Waterhouse درسال 2009 مبنی بر تأثیر ریتم شبانهروزی بر عملکرد فیزیولوژیکی بدن هماهنگ است. در ساعات عصر، افزایش طبیعی دمای مرکزی بدن میتواند به بهبود توان عضلانی، افزایش جریان خون و ارتقاء عملکرد ورزشی منجر شود (43). Chtourou & Souissi در سال 2012 در مطالعهای نشان دادهاند که اوج عملکرد جسمی اغلب در اواخر بعدازظهر تا اوایل شب مشاهده میشود، زمانیکه بدن از نظر دما، ترشح هورمونها و واکنشهای عصبی در بهترین وضعیت قرار دارد همچنین، فرصت کافی برای تغذیه، استراحت و آمادگی روانی در طول روز میتواند در ارتقاء عملکرد عصرگاهی مؤثر باشد (44). یکی دیگر از جنبههای مهم این مطالعه تغییرات در شاخصهای مقاومت به انسولین از جمله گلوکز خون، انسولین و HOMA-IR است. این شاخصها نشاندهنده تغییرات در متابولیسم گلوکز و حساسیت به انسولین در مدلهای سندرم متابولیک هستند. نتایج این تحقیق نشان داد که میزان گلوکز خون، انسولین و HOMA-IR در گروههای سندرم متابولیک بیشتر از گروههای کنترل بود، اما این شاخصها پس از هشت هفته تمرین هوازی کاهش یافتند. بهطور خاص، تمرینات در عصر تأثیر بیشتری بر کاهش این شاخصها داشتند. این نتایج نشاندهنده تأثیر مثبت تمرین هوازی بر بهبود حساسیت به انسولین و کاهش مقاومت به انسولین در موشهای مبتلا به سندرم متابولیک است. این یافتهها با مطالعاتی چون مرادی و همکاران در سال 2022، که نشان دادهاند تمرینات ورزشی میتوانند مقاومت به انسولین را بهبود بخشند و متابولیسم گلوکز را تنظیم کنند، سازگاری دارد (45). همچنین نتایج تحقیق حاضر نشان داد که تمرین تداومی در عصر در مقایسه با صبح به طور مؤثری هایپرگلایسمی و مقاومت به انسولین ناشی از سندرم متابولیک را بهبود بخشید. این مزیت متابولیکی تا حدودی از طریق تنظیم ژنهای ساعت BMAL1 و PER2 توسط تمرین تناوبی میانجی¬گری میشود. این یافتهها میتواند نشاندهنده تأثیر فعالیت بدنی بر تنظیم ساعت زیستی و بهبود عملکرد مغزی در مدلهای سندرم متابولیک باشد. تغییرات در این پروتئینها میتواند به کاهش آسیبهای عصبی و بهبود عملکرد مغزی کمک کند و از این طریق تأثیرات متابولیک نامطلوب را کاهش دهد. مطالعهای از Zhai و همکاران، در سال 2024 که به بررسی اثرات تمرینات ورزشی بر ساعت بیولوژیک در مدلهای حیوانی دیابتی پرداخته، نیز نشان داده شده بهبود متغیرهای بیولوژیک و تأثیرات آنها بر روند درمان بسیار مفید است (46). پروتئینهای ساعت شبانهروزی مانند BMAL1 و PER2 نقش مهمی در تنظیم ریتم شبانهروزی دارند و میتوانند تأثیرات قابلتوجهی بر متابولیسم و پلاستیسیته عصبی داشته باشند. در تحقیق حاضر، نتایج نشان میدهد که کمترین میزان پروتئین BMAL1 در گروههای سندرم متابولیک، بهویژه در عصر مشاهده شد، در حالیکه بیشترین مقدار آن در گروه کنترل در صبح دیده شد. این نتایج نشان میدهند که سندرم متابولیک میتواند بر ریتم شبانهروزی پروتئینهای ساعت زیستی تأثیر بگذارد، بهطور خاص در گروه سندرم متابولیک پروتئین BMAL1 نسبت به گروه کنترل تغییرات منفی بیشتری دارد. پروتئین BMAL1 یکی از پروتئینهای کلیدی در سیستم ساعت بیولوژیک است که با تنظیم بیان ژنهای ساعت زیستی نقش مهمی در هماهنگ کردن فرآیندهای متابولیک و فیزیولوژیک ایفا میکند. کاهش سطح BMAL1 در گروههای سندرم متابولیک میتواند نشاندهنده اختلال در ریتم شبانهروزی و تنظیم ساعت بیولوژیک باشد که ممکن است باعث بدتر شدن علائم دیابت و اختلالات متابولیکی شود. در مطالعه Liu و همکاران، در سال 2020 نیز مشاهده شد که در مدلهای حیوانی سندرم متابولیک، کاهش سطح BMAL1 با بروز اختلالات متابولیکی و افزایش مقاومت به انسولین همراه است (47). از این رو، یافتههای تحقیق حاضر با این دادهها همخوانی دارند و به این نکته اشاره دارند که اختلال در پروتئینهای ساعت زیستی میتواند به عنوان یکی از عوامل مؤثر در بروز مشکلات متابولیکی و دیابت نوع 2 عمل کند. علاوه بر این، نتایج نشان داد که پروتئین BMAL1 در گروه سندرم متابولیک + تمرین در صبح نسبت به گروه سندرم متابولیک + تمرین در عصر افزایش یافته است. این تغییرات در سطح پروتئین BMAL1 نشاندهنده اثر مثبت تمرینات هوازی بر بازسازی و تنظیم مجدد ساعت زیستی در مدلهای سندرم متابولیک است. این یافتهها با نتایج مطالعهshen و همکاران در سال 2023 مشابه هستند که نشان دادند تمرینات ورزشی میتوانند اثرات مثبتی بر ریتمهای شبانهروزی بدن داشته و به بهبود عملکرد ساعت زیستی کمک کنند (48). پروتئین PER2 نیز در تحقیق حاضر تغییراتی را در سطح صبح و عصر نشان داد. کمترین میزان این پروتئین در گروه کنترل در صبح و بیشترین میزان آن در عصر مشاهده شد. این یافتهها بیانگر تنظیم دقیق ریتم شبانهروزی پروتئینهای ساعت زیستی در شرایط طبیعی هستند. اما در گروه سندرم متابولیک + تمرین، افزایش سطح پروتئین PER2 در صبح نسبت به عصر مشاهده شد که نشاندهنده اثرات مفید تمرینات ورزشی در تنظیم مجدد این پروتئین است. مطالعات متعدد، از جمله تحقیق Xu و همکاران، در سال 2021 نشان دادند که تمرینات ورزشی میتوانند تأثیرات مثبتی بر تنظیم پروتئینهای ساعت زیستی از جمله BMAL1 و PER2 داشته باشند (49). این اثرات میتوانند به تنظیم مجدد ریتمهای شبانهروزی و بهبود عملکرد متابولیک کمک کنند، که در نهایت منجر به کاهش عوارض دیابت و بهبود کیفیت زندگی افراد مبتلا به این بیماری میشود. همچنین نتایج تحقیق حاضر نشان داد، تمرین تداومی باعث کاهش سطوح Aβ42 در هر دو زمان صبح و عصر در هیپوکمپ موش های آزمایشگاهی می¬شود. تعدیل و افزایش میزان miR-132 در تمرین عصر تفاوت معنی داری را نشان می¬دهد. همسو با نتایج این مطالعه نشان داده شده است که است که زمانبندی شبانه¬روزی می¬تواند بر نتایج فعالیت بدنی در سطح مولکولی تأثیر بگذارد (48،50). شواهد در انسان (52، 51) و موش (53،54) نشان میدهد که انجام تمرینات ورزشی در زمان¬های مختلف روز منجر به اثرات متابولیکی متفاوتی می¬شود. با اینحال، اطلاعات در مورد مکانیسم¬های زیربنایی این تفاوتها محدود است. به نظر می¬رسد که ریتم-های فیزیولوژیکی تأثیر مستقیمی بر پاسخهای تمرینی دارد (50). Aβ42 یکی از پروتئینهای آمیلوئیدی است که در تشکیل پلاکهای آمیلوئید در مغز نقش دارد و به عنوان یک شاخص مهم در بیماری آلزایمر شناخته میشود. تجمع غیرطبیعی Aβ42 در مغز به طور مستقیم با اختلالات شناختی و نوروپلاستیسیته همراه است. در این مطالعه، افزایش سطح Aβ42 در گروههای سندرم متابولیک و سندرم متابولیک + تمرین نشاندهنده تأثیرات منفی این پروتئین در وضعیت پاتولوژیک سندرم متابولیک است، ولی کاهش سطح آن در گروه تمرین نسبت به گروه بدون تمرین، مؤید اثرات مثبت ورزش بر کاهش تجمع این پروتئین است. مطالعات مختلفی نشان دادهاند که تمرینات هوازی میتوانند سطح Aβ42 را کاهش دهند و از تجمع آن در مغز جلوگیری کنند. لذا، در مطالعهای توسطTang و همکاران در سال 2024 نشان داده شد که تمرینات هوازی قادرند سطح Aβ42 را در مدلهای حیوانی کاهش دهند (55). این مطالعه نیز مشابه به یافتههای ماست، که در آن مشاهده شد که گروههای تمرین شده در عصر سطح کمتری از Aβ42 را نسبت به گروه سندرم متابولیک نشان دادند. همچنین، تحقیقی توسطAnderot و همکاران در سال 2020 نشان داده شد که تمرینات ورزشی میتوانند با کاهش التهاب سیستمیک و بهبود فرآیندهای اتوفاژی از تجمع پروتئینهای آمیلوئیدی جلوگیری کنند (56). در این تحقیق، تفاوتهای مشاهده شده در سطح Aβ42 در دو زمان صبح و عصر نشاندهنده این است که زمان تمرین ممکن است بر پردازش پروتئینهای آمیلوئیدی تأثیر بگذارد. این نکته میتواند نشاندهنده اثرات متغیر تمرین در ساعات مختلف روز بر متابولیسم مغز و پردازش پروتئینها باشد. نتایج آزمون تعقیبی توکی نشان داد که سطح miR-132 در گروههای سندرم متابولیک و سندرم متابولیک + تمرین نسبت به گروه کنترل در روز افزایش معناداری داشته است. این نتیجه نشاندهنده اثر مثبت تمرینات ورزشی بر بیان miR-132 در هیپوکمپ موشهای مبتلا به سندرم متابولیک است. همچنین مشاهده شد که افزایش سطح miR-132 در گروه سندرم متابولیک + تمرین در مقایسه با گروه سندرم متابولیک بهطور معناداری بیشتر بوده است. این یافتهها به طور مستقیم تأثیر تمرینات هوازی بر تنظیم miRNAs در هیپوکمپ را تأیید میکنند. اکثر مطالعات پیشین نیز نشان دادهاند که تمرینات ورزشی میتوانند بر سطح miR-132 تأثیر بگذارند. به عنوان مثال، در تحقیق Mu, C, Gao و همکاران، در سال 2024 اثرات تمرینات ورزشی بر بیان miR-132 در مدلهای حیوانی سندرم متابولیک بررسی شد که نشان دادند فعالیت بدنی میتواند سطح miR-132 را در هیپوکمپ افزایش دهد و به بهبود پلاستیسیته سیناپسی و عملکرد شناختی کمک کند (57). همچنین Liu و همکاران در سال 2020 در مطالعهای بر روی موشهای مبتلا به آلزایمر، گزارش کردند که تمرینات ورزشی باعث افزایش miR-132 در هیپوکمپ و کاهش آسیبهای نورونی ناشی از آمیلوئید شدند (47). نتایج تحقیق حاضر نیز این اثرات مشابه را تایید میکنند و نشان میدهند که miR-132 به عنوان یک مولکول کلیدی در فرآیندهای پلاستیسیته عصبی میتواند تحت تأثیر تمرینات ورزشی قرار گیرد. در ارتباط با تأثیر زمان بر بیان miR-132 در مطالعه حاضر نشان دادیم که سطح miR-132 در زمانهای صبح نسبت به عصر افزایش معنیداری دارد. این یافتهها بهویژه برای گروههای تمرین حائز اهمیت است. در واقع، تفاوتهای زمانی در پاسخ به تمرینات میتواند نشاندهنده حساسیت متفاوت سیستمهای مولکولی به تمرین در ساعات مختلف روز باشد. این مورد میتواند به دلیل تأثیرات متفاوت ریتمهای شبانهروزی بر فرآیندهای سلولی و مولکولی در هیپوکمپ باشد. مطالعه Zhai و همکاران در سال 2024 نشان دادند که زمانبندی تمرینات بر میزان تغییرات miRNAs و دیگر نشانگرهای مولکولی تأثیر میگذارد (46). این یافتهها مشابه نتایج تحقیق حاضر هستند که نشان میدهند پاسخهای miRNAs به تمرینات ورزشی ممکن است تحت تأثیر زمان اجرای تمرینات قرار گیرند. بهطور خاص، در شرایط خاصی از جمله در ساعات صبح، پاسخها میتوانند شدت بیشتری داشته باشند که ممکن است ناشی از تفاوتهای درونسلولی و تنظیمات کرنوبیولوژیک باشد. در ارتباط با اثر تعامل گروه × زمان بر سطح miR-132، نتایج تحلیل تعامل (گروه × زمان) نشان داد که در گروه سندرم متابولیک، سطح miR-132 در هر دو زمان صبح و عصر نسبت به گروه کنترل کاهش معنیداری داشت. این نتیجه به خوبی نشاندهنده اختلالات مولکولی در گروههای مبتلا به سندرم متابولیک است که میتواند تأثیرات منفی این بیماری بر تنظیم miRNAs را توضیح دهد. به علاوه، در گروه سندرم متابولیک + تمرین، سطح miR-132 نسبت به گروه سندرم متابولیک در هر دو زمان صبح و عصر بهطور معناداری افزایش یافت که نشاندهنده تأثیر مثبت تمرینات ورزشی در تنظیم miR-132 حتی در شرایط پاتولوژیک است. این نتایج با مطالعات دیگر همخوانی دارد که نشان دادهاند اختلالات در تنظیم miRNAs در بیماریهایی مانند دیابت و سندرم متابولیک میتواند بر پلاستیسیته عصبی و عملکرد مغزی تأثیر منفی بگذارد. Mu, C, Gao و همکاران در سال 2024 در مطالعهای روی موشهای مبتلا به سندرم متابولیک گزارش کردند که کاهش miR-132 در هیپوکمپ به کاهش عملکرد شناختی و یادگیری منجر میشود. تمرینات ورزشی در این مطالعه باعث افزایش مجدد miR-132 و بهبود پلاستیسیته عصبی شدند که مشابه نتایج تحقیق حاضر است (57). در مطالعه همسوی Aten و همکاران، در سال 2018 نشان دادند که miR-132 بهطور قابلتوجهی در نورونها در AD و بسیاری از بیماری های نورودژنراتیو کاهش نشان داد و با توجه به فیزیولوژی شبانهروزی، بیان کرد که بیان miR-132 تحت کنترل نوسانگر شبانهروزی در SCN است (26). کاهش بیان miR-132 در بیماران مبتلا به AD و ALS نیز مشاهده می-شود، احتمالاً به این دلیل که miR-132 به شدت در مغز بیان می شود و چندین مسیر مرتبط با استرس اکسیداتیو را تنظیم میکند. miR-132 نمونه¬ای از این نوع پلیوتروپی تنظیمی miRNA با پیامدهای مستقیم در تخریب عصبی است (29،53). مطالعات نشان دادند که در مقابل، بیان miR-132 در ترویج التهاب در سلولهای چربی نقش دارد. این فرآیند در التهاب مزمن که ممکن است زمینه ساز مقاومت به انسولین در افراد چاق باشد، نقش دارد (28،58). در این رابطه Hernandez و همکاران، در سال 2016 دریافتند که مقدار Aβ42 محلول درون زا در هیپوکامپ در موش های AD تراریخته سه گانه 18 ماهه (3xTg-AD)با غیرفعالسازی miR-132 در مقایسه با گروه کنترل و بدون حذف miR-132 بهطور قابلتوجهی افزایش یافته است، که نشان داد که کمبود miR-132 در موش میتواند تولید Aβ افزایش دهد تجمع و رسوبگذاری نقش داشته باشد. علاوه بر این، با توجه به دادههای برخی مطالعات همسو، محققان دریافتند که سطح miR-132 در بیماران مبتلا به اختلال شناختی خفیف (MCI) و AD در مقایسه با افراد سالم پایینتر است و بین سطوحmiR-132 همبستگی منفی وجود دارد و سطح miR-132 و Aβ42 نامحلول نیز به طور قابل توجهی همبستگی داشتند (28). برای تأیید بیشتر ارتباط بین miR-132 و Aβ، نشان داده شد که miR132 در ردههای سلولی به طور پایدار Aβ (انسانی) را بیان میکنند. در ردههای سلولی، miR-132 بهطور قابلتوجهی سطوح Aβ40 و Aβ42 انسانی (محلول) را کاهش داد، که نشان میدهد کمبودmiR-132 باعث افزایش تولید Aβ میشود (28). در مجموع در مطالعه حاضر ما نشان دادیم که انجام تمرینات تداومی با شدت متوسط می¬تواند با تقویت ژن های ساعت به بهبود عوامل متابولیک و کاهش آمیلوئید بتا به دنبال بیان miR-132 در هیپوکمپ موش های دارای سندرم متابولیک منجر شود. از طرفی نشان دادیم تمرین در عصر تاثیر بیشتری در این ارتباط داشته است. از محدودیتهای پژوهش حاضر عدم کنترل غذای مصرفی، بررسی دیگر وهلههای ساعت بیولوژی مثل بعد از ظهر و همچنین ارزیابی دیگر ژنهای وابسته به ریتم شبانهروزی بوده است و در پژوهش حاضر مجالی جهت بررسی ریتم شبانهروزی در سایر اندامها و اعمال دیگر شدت¬ها و مدل¬های تمرینی نبوده است، لذا انجام پژوهشهایی با موارد عنوان شده پیشنهاد می¬گردد.
نتیجهگیری
نتایج تحقیق حاضر نشان داد که به دنبال تمرین تداومی و بهبود فاکتورهای متابولیک، کاهش میزان Aβ42 به دنبال افزایش بیان miR-132 در هیپوکامپ موشهای آزمایشگاهی دارای سندرم متابولیک رخ میدهد. تغییرات ایجادشده در miR-132 در عصر با کاهش عوامل تخریب نورونی همچون Aβ42 ناشی از این تمرینات ورزشی می¬تواند در ارتباط باشد. در نتیجه به نظر میرسد، تمرینات تداومی میتواند از طریق تعدیل فاکتورهای مرتبط با ریتم شبانهروزی و در نتیجه افزایش بیان پروتئین ها و miRNAs از تحلیل سیستم عصبی ناشی از سندرم متابولیک جلوگیری کند.
سپاسگزاری
بدینوسیله از زحمات اساتید و کادر محترم دانشکده تربیت بدنی و دامپزشکی دانشگاه شهید چمران اهواز تشکر و قدردانی می¬گردد. این مقاله منتج از پایان نامه مقطع دکتری رشته فیزیولوژی ورزشی می¬باشد که در دانشگاه شهید چمران اهواز تصویب و با حمایت مالی این دانشگاه به انجام رسیده است.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
ﺗﻤﺎم ﻣﺮاﺣﻞ آزﻣﺎیﺶ ﺑﺮ اﺳﺎس دستورالعمل ﮐﻤﯿﺘﻪ اﺧﻼق ﮐﺎر ﺑﺎ ﺣﯿﻮاﻧﺎت آزﻣﺎیﺸﮕﺎﻫﯽ داﻧﺸﮕﺎه ﺷﻬﯿﺪ ﭼﻤﺮان اﻫﻮاز باکد اخلاق IR.SCU.REC.1403.044 ﻃﺮاﺣﯽ و اﺟﺮا ﺷﺪ.
مشارکت نویسندگان
نوسینده اول و دوم و چهارم در ارائه ایده و در طراحی مطالعه، نویسنده اول در جمعآوری دادهها و در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Ezkurdia A, Ramírez MJ, Solas M. Metabolic Syndrome as a Risk Factor for Alzheimer’s Disease: A Focus on Insulin Resistance. Inter J Molecular Sci Int J Mol Sci 2023; 24(5): 4354.
2- Arjunan A, Song J. Pharmacological and Physiological Roles of Adipokines and Myokines in Metabolic-Related Dementia. Biomedicine & Pharmacotherapy 2023; 163: 114847.
3- Simopoulos AP. Dietary Omega-3 Fatty Acid Deficiency and High Fructose Intake in the Development of Metabolic Syndrome, Brain Metabolic Abnormalities, And Non-Alcoholic Fatty Liver Disease. Nutrients 2013; 5(8): 2901-23.
4- Zuliani I, Lanzillotta C, Tramutola A, Barone E, Perluigi M, Rinaldo S, et al. High-Fat Diet Leads to Reduced Protein O-Glcnacylation and Mitochondrial Defects Promoting the Development of Alzheimer’s Disease Signatures. Int J Mol Sci 2021; 22(7): 3746.
5- Henriques JF, Serra D, Dinis TC, Almeida LM. The Anti-Neuroinflammatory Role of Anthocyanins and their Metabolites for the Prevention and Treatment of Brain Disorders. Int J Mol Sci 2020; 21(22): 8653.
6- Lynn J, Park M, Ogunwale C, Acquaah-Mensah GK. A Tale of Two Diseases: Exploring Mechanisms Linking Diabetes Mellitus with Alzheimer’s Disease. J Alzheimer's Dis 2022; 85(2): 485-501.
7- Menon S, Sengupta N. Influence of Hyperglycemic Conditions on Self-Association of the Alzheimer’s Amyloid Β (Aβ1–42) Peptide. Acs Omega 2017; 2(5): 2134-47.
8- Campos-Peña V, Pichardo-Rojas P, Sánchez-Barbosa T, Ortíz-Islas E, Rodríguez-Pérez CE, Montes P, et al. Amyloid Β, Lipid Metabolism, Basal Cholinergic System, and Therapeutics in Alzheimer’s Disease. Int J Mol Sci 2022; 23(20): 12092.
9- Rudajev V, Novotny J. Cholesterol-Dependent Amyloid Β Production: Space for Multifarious Interactions between Amyloid Precursor Protein, Secretases, and Cholesterol. Cell & Bioscience 2023; 13(1): 171.
10- Ahmed H, Wang Y, Griffiths WJ, Levey AI, Pikuleva I, Liang SH, et al. Brain Cholesterol and Alzheimer's Disease: Challenges and Opportunities in Probe and Drug Development. Brain. 2024; 147(5): 1622-35.
11- Raulin A-C, Doss SV, Trottier ZA, Ikezu TC, Bu G, Liu C-C. Apoe in Alzheimer’s Disease: Pathophysiology and Therapeutic Strategies. Molecular Neurodegener 2022; 17(1): 72.
12- Jacobo-Albavera L, Domínguez-Pérez M, Medina-Leyte DJ, González-Garrido A, Villarreal-Molina T. The Role of the ATP-Binding Cassette A1 (ABCA1) in Human Disease. Int J Mol sci 2021; 22(4): 1593.
13- Wu M, Zhai Y, Liang X, Chen W, Lin R, Ma L, et al. Connecting the Dots between Hypercholesterolemia and Alzheimer’s Disease: A Potential Mechanism Based on 27-Hydroxycholesterol. Front Neurosci 2022; 16: 842814.
14- Liu Lc, Liang Jy, Liu Yh, Liu B, Dong Xh, Cai Wh, et al. The Intersection of Cerebral Cholesterol Metabolism and Alzheimer's Disease: Mechanisms and Therapeutic Prospects. Heliyon 2024; 10(9): e30523.
15- Hong DY, Lee DH, Lee JY, Lee EC, Park SW, Lee MR, et al. Relationship between Brain Metabolic Disorders and Cognitive Impairment: LDL Receptor Defect. Int J Molecular Sci 2022; 23(15): 8384.
16- Gamba P, Staurenghi E, Testa G, Giannelli S, Sottero B, Leonarduzzi G. A Crosstalk between Brain Cholesterol Oxidation and Glucose Metabolism in Alzheimer’s Disease. Front Neurosci 2019; 13: 556.
17- Feringa FM, Van der Kant R. Cholesterol and Alzheimer’s Disease; From Risk Genes to Pathological Effects. Frontiers in Aging Neurosci 2021; 13: 690372.
18- Astiz M, Heyde I, Oster H. Mechanisms of Communication in the Mammalian Circadian Timing System. Int J Mol Sci 2019; 20(2): 343.
19- Healy KL, Morris AR, Liu AC. Circadian Synchrony: Sleep, Nutrition, and Physical Activity. Front Netw Physiol 2021; 1: 732243.
20- Harmsen JF, Kotte M, Habets I, Bosschee F, Frenken K, Jorgensen JA, et al. Exercise Training Modifies Skeletal Muscle Clock Gene Expression but Not 24‐Hour Rhythmicity in Substrate Metabolism of Men with Insulin Resistance. J Physiol 2023.
21- Asher G, Sassone-Corsi P. Time for Food: The Intimate Interplay between Nutrition, Metabolism, and the Circadian Clock. Cell 2015; 161(1): 84-92.
22- Bennett S, Sato S. Enhancing the Metabolic Benefits of Exercise: Is Timing the Key? Front Endocrinol 2023; 14: 987208.
23- Liu M, Zhang Z, Chen Y, Feng T, Zhou Q, Tian X. Circadian Clock and Lipid Metabolism Disorders: A Potential Therapeutic Strategy for Cancer. Frontiers in Endocrinol 2023; 14: 1292011.
24- Peng X, Wang Q, Li W, Ge G, Peng J, Xu Y, et al. Comprehensive Overview of Microrna Function in Rheumatoid Arthritis. Bone Res 2023; 11(1): 8.
25- Zhang J, Chen Z, Chen H, Deng Y, Li S, Jin L. Recent Advances in the Roles of Microrna and Microrna-Based Diagnosis in Neurodegenerative Diseases. Biosensor 2022; 12(12): 1074.
26- Aten S, Hansen KF, Price KH, Wheaton K, Kalidindi A, Garcia A, et al. Mir-132 couples the Circadian Clock to Daily Rhythms of Neuronal Plasticity and Cognition. Learning & Memory 2018; 25(5): 214-29.
27- Walgrave H, Penning A, Tosoni G, Snoeck S, Davie K, Davis E, et al. Microrna-132 Regulates Gene Expression Programs Involved in Microglial Homeostasis. IScience 2023; 26(6): 106829.
28- Hernandez-Rapp J, Rainone S, Goupil C, Dorval V, Smith PY, Saint-Pierre M, et al. Microrna-132/212 Deficiency Enhances Aβ Production and Senile Plaque Deposition in Alzheimer’s Disease Triple Transgenic Mice. Scientific reports 2016; 6(1): 30953.
29- Li Y, Zhang J, He J, Zhou W, Xiang G, Xu R. Microrna-132 Cause Apoptosis of Glioma Cells Through Blockade of the SREBP-1c Metabolic Pathway Related to SIRT1. Biomedicine & Pharmacotherapy 2016; 78: 177-84.
30- Salama II, Sami SM, Abdellatif GA, Mohsen A, Rasmy H, Kamel SA, et al. Plasma Micrornas Biomarkers in Mild Cognitive Impairment among Patients with Type 2 Diabetes Mellitus. PloS one 2020; 15(7): e0236453.
31- Zhang M, Bian Z. Alzheimer’s Disease and Microrna-132: A Widespread Pathological Factor and Potential Therapeutic Target. Front Neuros 2021; 15: 687973.
32- Mendoza-Viveros L, Obrietan K, Cheng H-M. Commentary: Mir-132/212 Modulates Seasonal Adaptation and Dendritic Morphology of the Central Circadian Clock. Cell Reports 2017; 19(3): 505.
33- Kouhnavardi S, Cabatic M, Mañas-Padilla MC, Malabanan M-A, Smani T, Cicvaric A, et al. Mirna-132/212 Deficiency Disrupts Selective Corticosterone Modulation of Dorsal Vs. Ventral Hippocampal Metaplasticity. Int J Mol Sci 2023; 24(11): 9565.
34- Babaei M, SiahKouhian M, Pourrahim A. The Effect of Physical Training on Brain-Derived Nerve Growth Factor Levels and Beta-Amyloid Plaques in Patients with Alzheimer's Disease: A Review Article. Paramedical Sci Military Health 2024; 19(1): 76-88.
35- Xu L, Liu R, Qin Y, Wang T. Brain Metabolism in Alzheimer’s Disease: Biological Mechanisms of Exercise. Transl Neurodegener 2023; 12(1): 33.
36- Huang WC, Xu JW, Li S, Ng XE, Tung YT. Effects of Exercise on High-Fat Diet–Induced Non-Alcoholic Fatty Liver Disease and Lipid Metabolism in Apoe Knockout Mice. Nutr Metab 2022; 19(1): 10.
37- Caponi PW, Lehnen AM, Pinto GH, Borges J, Markoski M, Machado UF, et al. Aerobic Exercise Training Induces Metabolic Benefits in Rats with Metabolic Syndrome Independent of Dietary Changes. Clinics 2013; 68(7): 1010-7.
38- Wang J, Polaki V, Chen S, Bihl JC. Exercise Improves Endothelial Function Associated with Alleviated Inflammation and Oxidative Stress of Perivascular Adipose Tissue in Type 2 Diabetic Mice. Oxid Med Cell Longev 2020; 2020: 8830537.
39- Ostler JE, Maurya SK, Dials J, Roof SR, Devor ST, Ziolo MT, et al. Effects of Insulin Resistance on Skeletal Muscle Growth and Exercise Capacity in Type 2 Diabetic Mouse Models. Am J Physiol Endocrinol Metab 2014; 306(6): E592-E605.
40- Lee S, Park Y, Dellsperger KC, Zhang C. Exercise Training Improves Endothelial Function Via Adiponectin-Dependent and Independent Pathways in Type 2 Diabetic Mice. Am J Physiol Heart Circ Physiol 2011; 301(2): H306-14
41- Chavanelle V, Boisseau N, Otero YF, Combaret L, Dardevet D, Montaurier C, et al. Effects of High-Intensity Interval Training and Moderate-Intensity Continuous Training on Glycaemic Control and Skeletal Muscle Mitochondrial Function in Db/Db Mice. Sci Rep 2017; 7(1): 204.
42- Song M, Bai Y, Song F. High-Fat Diet and Neuroinflammation: The Role of Mitochondria. Pharmacol Res 2025; 212: 107615.
43- Reilly T, Waterhouse J. Sports Performance: Is There Evidence That the Body Clock Plays a Role? Eur J Appl Physiol 2009; 106(3): 321-32.
44- Chtourou H, Souissi N. The Effect of Training at A Specific Time of Day: A Review. J Strength Cond Res 2012; 26(7): 1984-2005.
45- Moradi, Goodarz, Ghahremani, Mehran. The Effect of Aerobic and Interval Training on Adropin Levels and Insulin Resistance in Overweight Men. Exercise and Biokinesiology 2022; 27(14): 13-23.
46- Qu Y, Zhai S, Zhang D, Li T, Xie Y, Tao S, et al. Moderating Effects of Clock Genes DNA Methylation on the Relationship Between Physical Activity Trajectories and Depressive Symptoms Among Chinese College Students. Health Psychol 2024 Sep 30.
47- Liu Y, Huang H, Gao R, Liu, Y. Dynamic Phenotypes and Molecular Mechanisms to Understand the Pathogenesis of Diabetic Nephropathy in Two Widely Used Animal Models of Type 2 Diabetes Mellitus. Front Cell Dev Biol 2020; 8: 172.
48- Shen B, Ma C, Wu G, Liu H, Chen L, Yang G. Effects of Exercise on Circadian Rhythms in Humans. Front Pharmacol 2023; 14: 1282357.
49- Xu M, Zhu J, Liu XD, Luo MY, Xu NJ. Roles of Physical Exercise in Neurodegeneration: Reversal of Epigenetic Clock. Transl Neurodegener 2021; 10(1): 30.
50- Wolff CA, Esser KA. Exercise Timing and Circadian Rhythms. Curr Opin Physiol 2019; 10: 64-9.
51- Savikj M, Gabriel BM, Alm PS, Smith J, Caidahl K, Björnholm M, et al. Afternoon Exercise Is More Efficacious than Morning Exercise at Improving Blood Glucose Levels in Individuals with Type 2 Diabetes: A Randomised Crossover Trial. Diabetologia 2019; 62(2): 233-7.
52- Chiang SL, Heitkemper MM, Hung YJ, Tzeng WC, Lee MS, Lin CH. Effects of a 12-Week Moderate-Intensity Exercise Training on Blood Glucose Response in Patients with Type 2 Diabetes: A Prospective Longitudinal Study. Medicine 2019; 98(36): e16860.
53- Ezagouri S, Zwighaft Z, Sobel J, Baillieul S, Doutreleau S, Ladeuix B, et al. Physiological and Molecular Dissection of Daily Variance in Exercise Capacity. Cell Metab 2019; 30(1): 78-91
54- Sato S, Basse AL, Schönke M, Chen S, Samad M, Altıntaş A, et al. Time of Exercise Specifies the Impact on Muscle Metabolic Pathways and Systemic Energy Homeostasis. Cell Metab 2019; 30(1): 92-110.
55- Tang M, Guo JJ, Guo RX, Xu SJ, Lou Q, Hu QX, Wang QW. Progress of Research and Application of Non-Pharmacologic Intervention in Alzheimer's Disease. J Alzheimer’s Dis 2024; 102(2): 275-94.
56- Andreotti DZ, Silva JDN, Matumoto AM, Orellana AM, De Mello PS, Kawamoto EM. Effects of Physical Exercise on Autophagy and Apoptosis in Aged Brain: Human and Animal Studies. Front Nut 2020; 7: 94.
57- Mu C, Gao M, Xu W, Sun X, Chen T, Xu H, Qiu H. Mechanisms of Microrna-132 in Central Neurodegenerative Diseases: A Comprehensive Review. Biomedicine & Pharmacotherapy 2024; 170: 116029.
58- Metzinger-Le Meuth V, Metzinger L. The Roles of Micrornas in Obesity: Emphasizing Links with Chronic Kidney Disease and Cardiovascular Disorders. Obesities 2023; 3(3): 243-52.
1- Ezkurdia A, Ramírez MJ, Solas M. Metabolic Syndrome as a Risk Factor for Alzheimer’s Disease: A Focus on Insulin Resistance. Inter J Molecular Sci Int J Mol Sci 2023; 24(5): 4354.
2- Arjunan A, Song J. Pharmacological and Physiological Roles of Adipokines and Myokines in Metabolic-Related Dementia. Biomedicine & Pharmacotherapy 2023; 163: 114847.
3- Simopoulos AP. Dietary Omega-3 Fatty Acid Deficiency and High Fructose Intake in the Development of Metabolic Syndrome, Brain Metabolic Abnormalities, And Non-Alcoholic Fatty Liver Disease. Nutrients 2013; 5(8): 2901-23.
4- Zuliani I, Lanzillotta C, Tramutola A, Barone E, Perluigi M, Rinaldo S, et al. High-Fat Diet Leads to Reduced Protein O-Glcnacylation and Mitochondrial Defects Promoting the Development of Alzheimer’s Disease Signatures. Int J Mol Sci 2021; 22(7): 3746.
5- Henriques JF, Serra D, Dinis TC, Almeida LM. The Anti-Neuroinflammatory Role of Anthocyanins and their Metabolites for the Prevention and Treatment of Brain Disorders. Int J Mol Sci 2020; 21(22): 8653.
6- Lynn J, Park M, Ogunwale C, Acquaah-Mensah GK. A Tale of Two Diseases: Exploring Mechanisms Linking Diabetes Mellitus with Alzheimer’s Disease. J Alzheimer's Dis 2022; 85(2): 485-501.
7- Menon S, Sengupta N. Influence of Hyperglycemic Conditions on Self-Association of the Alzheimer’s Amyloid Β (Aβ1–42) Peptide. Acs Omega 2017; 2(5): 2134-47.
8- Campos-Peña V, Pichardo-Rojas P, Sánchez-Barbosa T, Ortíz-Islas E, Rodríguez-Pérez CE, Montes P, et al. Amyloid Β, Lipid Metabolism, Basal Cholinergic System, and Therapeutics in Alzheimer’s Disease. Int J Mol Sci 2022; 23(20): 12092.
9- Rudajev V, Novotny J. Cholesterol-Dependent Amyloid Β Production: Space for Multifarious Interactions between Amyloid Precursor Protein, Secretases, and Cholesterol. Cell & Bioscience 2023; 13(1): 171.
10- Ahmed H, Wang Y, Griffiths WJ, Levey AI, Pikuleva I, Liang SH, et al. Brain Cholesterol and Alzheimer's Disease: Challenges and Opportunities in Probe and Drug Development. Brain. 2024; 147(5): 1622-35.
11- Raulin A-C, Doss SV, Trottier ZA, Ikezu TC, Bu G, Liu C-C. Apoe in Alzheimer’s Disease: Pathophysiology and Therapeutic Strategies. Molecular Neurodegener 2022; 17(1): 72.
12- Jacobo-Albavera L, Domínguez-Pérez M, Medina-Leyte DJ, González-Garrido A, Villarreal-Molina T. The Role of the ATP-Binding Cassette A1 (ABCA1) in Human Disease. Int J Mol sci 2021; 22(4): 1593.
13- Wu M, Zhai Y, Liang X, Chen W, Lin R, Ma L, et al. Connecting the Dots between Hypercholesterolemia and Alzheimer’s Disease: A Potential Mechanism Based on 27-Hydroxycholesterol. Front Neurosci 2022; 16: 842814.
14- Liu Lc, Liang Jy, Liu Yh, Liu B, Dong Xh, Cai Wh, et al. The Intersection of Cerebral Cholesterol Metabolism and Alzheimer's Disease: Mechanisms and Therapeutic Prospects. Heliyon 2024; 10(9): e30523.
15- Hong DY, Lee DH, Lee JY, Lee EC, Park SW, Lee MR, et al. Relationship between Brain Metabolic Disorders and Cognitive Impairment: LDL Receptor Defect. Int J Molecular Sci 2022; 23(15): 8384.
16- Gamba P, Staurenghi E, Testa G, Giannelli S, Sottero B, Leonarduzzi G. A Crosstalk between Brain Cholesterol Oxidation and Glucose Metabolism in Alzheimer’s Disease. Front Neurosci 2019; 13: 556.
17- Feringa FM, Van der Kant R. Cholesterol and Alzheimer’s Disease; From Risk Genes to Pathological Effects. Frontiers in Aging Neurosci 2021; 13: 690372.
18- Astiz M, Heyde I, Oster H. Mechanisms of Communication in the Mammalian Circadian Timing System. Int J Mol Sci 2019; 20(2): 343.
19- Healy KL, Morris AR, Liu AC. Circadian Synchrony: Sleep, Nutrition, and Physical Activity. Front Netw Physiol 2021; 1: 732243.
20- Harmsen JF, Kotte M, Habets I, Bosschee F, Frenken K, Jorgensen JA, et al. Exercise Training Modifies Skeletal Muscle Clock Gene Expression but Not 24‐Hour Rhythmicity in Substrate Metabolism of Men with Insulin Resistance. J Physiol 2023.
21- Asher G, Sassone-Corsi P. Time for Food: The Intimate Interplay between Nutrition, Metabolism, and the Circadian Clock. Cell 2015; 161(1): 84-92.
22- Bennett S, Sato S. Enhancing the Metabolic Benefits of Exercise: Is Timing the Key? Front Endocrinol 2023; 14: 987208.
23- Liu M, Zhang Z, Chen Y, Feng T, Zhou Q, Tian X. Circadian Clock and Lipid Metabolism Disorders: A Potential Therapeutic Strategy for Cancer. Frontiers in Endocrinol 2023; 14: 1292011.
24- Peng X, Wang Q, Li W, Ge G, Peng J, Xu Y, et al. Comprehensive Overview of Microrna Function in Rheumatoid Arthritis. Bone Res 2023; 11(1): 8.
25- Zhang J, Chen Z, Chen H, Deng Y, Li S, Jin L. Recent Advances in the Roles of Microrna and Microrna-Based Diagnosis in Neurodegenerative Diseases. Biosensor 2022; 12(12): 1074.
26- Aten S, Hansen KF, Price KH, Wheaton K, Kalidindi A, Garcia A, et al. Mir-132 couples the Circadian Clock to Daily Rhythms of Neuronal Plasticity and Cognition. Learning & Memory 2018; 25(5): 214-29.
27- Walgrave H, Penning A, Tosoni G, Snoeck S, Davie K, Davis E, et al. Microrna-132 Regulates Gene Expression Programs Involved in Microglial Homeostasis. IScience 2023; 26(6): 106829.
28- Hernandez-Rapp J, Rainone S, Goupil C, Dorval V, Smith PY, Saint-Pierre M, et al. Microrna-132/212 Deficiency Enhances Aβ Production and Senile Plaque Deposition in Alzheimer’s Disease Triple Transgenic Mice. Scientific reports 2016; 6(1): 30953.
29- Li Y, Zhang J, He J, Zhou W, Xiang G, Xu R. Microrna-132 Cause Apoptosis of Glioma Cells Through Blockade of the SREBP-1c Metabolic Pathway Related to SIRT1. Biomedicine & Pharmacotherapy 2016; 78: 177-84.
30- Salama II, Sami SM, Abdellatif GA, Mohsen A, Rasmy H, Kamel SA, et al. Plasma Micrornas Biomarkers in Mild Cognitive Impairment among Patients with Type 2 Diabetes Mellitus. PloS one 2020; 15(7): e0236453.
31- Zhang M, Bian Z. Alzheimer’s Disease and Microrna-132: A Widespread Pathological Factor and Potential Therapeutic Target. Front Neuros 2021; 15: 687973.
32- Mendoza-Viveros L, Obrietan K, Cheng H-M. Commentary: Mir-132/212 Modulates Seasonal Adaptation and Dendritic Morphology of the Central Circadian Clock. Cell Reports 2017; 19(3): 505.
33- Kouhnavardi S, Cabatic M, Mañas-Padilla MC, Malabanan M-A, Smani T, Cicvaric A, et al. Mirna-132/212 Deficiency Disrupts Selective Corticosterone Modulation of Dorsal Vs. Ventral Hippocampal Metaplasticity. Int J Mol Sci 2023; 24(11): 9565.
34- Babaei M, SiahKouhian M, Pourrahim A. The Effect of Physical Training on Brain-Derived Nerve Growth Factor Levels and Beta-Amyloid Plaques in Patients with Alzheimer's Disease: A Review Article. Paramedical Sci Military Health 2024; 19(1): 76-88.
35- Xu L, Liu R, Qin Y, Wang T. Brain Metabolism in Alzheimer’s Disease: Biological Mechanisms of Exercise. Transl Neurodegener 2023; 12(1): 33.
36- Huang WC, Xu JW, Li S, Ng XE, Tung YT. Effects of Exercise on High-Fat Diet–Induced Non-Alcoholic Fatty Liver Disease and Lipid Metabolism in Apoe Knockout Mice. Nutr Metab 2022; 19(1): 10.
37- Caponi PW, Lehnen AM, Pinto GH, Borges J, Markoski M, Machado UF, et al. Aerobic Exercise Training Induces Metabolic Benefits in Rats with Metabolic Syndrome Independent of Dietary Changes. Clinics 2013; 68(7): 1010-7.
38- Wang J, Polaki V, Chen S, Bihl JC. Exercise Improves Endothelial Function Associated with Alleviated Inflammation and Oxidative Stress of Perivascular Adipose Tissue in Type 2 Diabetic Mice. Oxid Med Cell Longev 2020; 2020: 8830537.
39- Ostler JE, Maurya SK, Dials J, Roof SR, Devor ST, Ziolo MT, et al. Effects of Insulin Resistance on Skeletal Muscle Growth and Exercise Capacity in Type 2 Diabetic Mouse Models. Am J Physiol Endocrinol Metab 2014; 306(6): E592-E605.
40- Lee S, Park Y, Dellsperger KC, Zhang C. Exercise Training Improves Endothelial Function Via Adiponectin-Dependent and Independent Pathways in Type 2 Diabetic Mice. Am J Physiol Heart Circ Physiol 2011; 301(2): H306-14
41- Chavanelle V, Boisseau N, Otero YF, Combaret L, Dardevet D, Montaurier C, et al. Effects of High-Intensity Interval Training and Moderate-Intensity Continuous Training on Glycaemic Control and Skeletal Muscle Mitochondrial Function in Db/Db Mice. Sci Rep 2017; 7(1): 204.
42- Song M, Bai Y, Song F. High-Fat Diet and Neuroinflammation: The Role of Mitochondria. Pharmacol Res 2025; 212: 107615.
43- Reilly T, Waterhouse J. Sports Performance: Is There Evidence That the Body Clock Plays a Role? Eur J Appl Physiol 2009; 106(3): 321-32.
44- Chtourou H, Souissi N. The Effect of Training at A Specific Time of Day: A Review. J Strength Cond Res 2012; 26(7): 1984-2005.
45- Moradi, Goodarz, Ghahremani, Mehran. The Effect of Aerobic and Interval Training on Adropin Levels and Insulin Resistance in Overweight Men. Exercise and Biokinesiology 2022; 27(14): 13-23.
46- Qu Y, Zhai S, Zhang D, Li T, Xie Y, Tao S, et al. Moderating Effects of Clock Genes DNA Methylation on the Relationship Between Physical Activity Trajectories and Depressive Symptoms Among Chinese College Students. Health Psychol 2024 Sep 30.
47- Liu Y, Huang H, Gao R, Liu, Y. Dynamic Phenotypes and Molecular Mechanisms to Understand the Pathogenesis of Diabetic Nephropathy in Two Widely Used Animal Models of Type 2 Diabetes Mellitus. Front Cell Dev Biol 2020; 8: 172.
48- Shen B, Ma C, Wu G, Liu H, Chen L, Yang G. Effects of Exercise on Circadian Rhythms in Humans. Front Pharmacol 2023; 14: 1282357.
49- Xu M, Zhu J, Liu XD, Luo MY, Xu NJ. Roles of Physical Exercise in Neurodegeneration: Reversal of Epigenetic Clock. Transl Neurodegener 2021; 10(1): 30.
50- Wolff CA, Esser KA. Exercise Timing and Circadian Rhythms. Curr Opin Physiol 2019; 10: 64-9.
51- Savikj M, Gabriel BM, Alm PS, Smith J, Caidahl K, Björnholm M, et al. Afternoon Exercise Is More Efficacious than Morning Exercise at Improving Blood Glucose Levels in Individuals with Type 2 Diabetes: A Randomised Crossover Trial. Diabetologia 2019; 62(2): 233-7.
52- Chiang SL, Heitkemper MM, Hung YJ, Tzeng WC, Lee MS, Lin CH. Effects of a 12-Week Moderate-Intensity Exercise Training on Blood Glucose Response in Patients with Type 2 Diabetes: A Prospective Longitudinal Study. Medicine 2019; 98(36): e16860.
53- Ezagouri S, Zwighaft Z, Sobel J, Baillieul S, Doutreleau S, Ladeuix B, et al. Physiological and Molecular Dissection of Daily Variance in Exercise Capacity. Cell Metab 2019; 30(1): 78-91
54- Sato S, Basse AL, Schönke M, Chen S, Samad M, Altıntaş A, et al. Time of Exercise Specifies the Impact on Muscle Metabolic Pathways and Systemic Energy Homeostasis. Cell Metab 2019; 30(1): 92-110.
55- Tang M, Guo JJ, Guo RX, Xu SJ, Lou Q, Hu QX, Wang QW. Progress of Research and Application of Non-Pharmacologic Intervention in Alzheimer's Disease. J Alzheimer’s Dis 2024; 102(2): 275-94.
56- Andreotti DZ, Silva JDN, Matumoto AM, Orellana AM, De Mello PS, Kawamoto EM. Effects of Physical Exercise on Autophagy and Apoptosis in Aged Brain: Human and Animal Studies. Front Nut 2020; 7: 94.
57- Mu C, Gao M, Xu W, Sun X, Chen T, Xu H, Qiu H. Mechanisms of Microrna-132 in Central Neurodegenerative Diseases: A Comprehensive Review. Biomedicine & Pharmacotherapy 2024; 170: 116029.
58- Metzinger-Le Meuth V, Metzinger L. The Roles of Micrornas in Obesity: Emphasizing Links with Chronic Kidney Disease and Cardiovascular Disorders. Obesities 2023; 3(3): 243-52.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/10/30 | پذیرش: 1403/12/11 | انتشار: 1404/3/15
دریافت: 1403/10/30 | پذیرش: 1403/12/11 | انتشار: 1404/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







