دوره 33، شماره 3 - ( خرداد 1404 )
جلد 33 شماره 3 صفحات 8830-8820 |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.PIAU.REC.1403.002
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Madani F, Kazemzadeh Y, Mirzayan Shanjani S, Shirvani H. Effect of 8-Week- - Concurrent Training and Capsaicin Supplementation on the Expression of IGF-1 and FOXO3 Genes in the Quadriceps Muscle of Aged Male Wistar Rats. JSSU 2025; 33 (3) :8820-8830
URL: http://jssu.ssu.ac.ir/article-1-6351-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6351-fa.html
مدنی فاطمه، کاظم زاده یاسر، میرزایان شانجانی ساناز، شیروانی حسین. تاثیر هشت هفته تمرین ترکیبی و مکمل کپسایسین بر بیان ژنهای IGF-1 و FOXO3 در عضله چهارسرران موش های صحرایی نر سالمند نژاد ویستار. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (3) :8820-8830
متن کامل [PDF 932 kb]
(253 دریافت)
| چکیده (HTML) (876 مشاهده)
متن کامل: (391 مشاهده)
مقدمه
سالمندی فرآیندی آهسته و تدریجی است که با کاهش مداوم در عملکردهای فیزیولوژیکی بدن موجودات زنده در طول عمرشان همراه است و بهعنوان یک عامل خطرساز برای کاهش عملکرد اندامها و سلامت کلی در نظر گرفته میشود (1). امروزه جمعیت جهان به سرعت در حال پیر شدن است و در سرتاسر جهان نگرانیهای فزآیندهای در مورد چگونگی مراقبت از جمعیت بزرگ سالمندان وجود دارد. ایران نیز از این قائده مستثنی نیست، بهطوری که میتوان انتظار داشت، جمعیت سالمندی کشور، در سال 1429 تقریباً 24 درصد از جمعیت کل کشور را شامل شود (2). یکی از اختلالات اساسی و شایع در افراد سالمند، آتروفی عضلانی وابسته به سن یا " سارکوپنیا " می¬باشد که با کاهش تدریجی در توده، عملکرد و قدرت عضلانی همراه است (3). سارکوپنیا با طیف وسیعی از پیامدهای نامطلوب از جمله ضعف، از دست دادن استقلال، افزایش خطر سقوط و شکستکی اسنخوان و کاهش کیفیت زندگی و بیماریهای مرتبط با بیتحرکی و مرگ و میر (4) همراه است (3). سارکوپنیا از دهه چهارم زندگی شروع میشود (5). عضله اسکلتی که در حدود 40 درصد از وزن بدن را تشکیل میدهد و 50 تا 75 درصد از پروتئینهای بدن را شامل میشود (6)، یک بافت پیچیده است (7) که عملکردهای متعددی را انجام میدهد، از انقباض مکانیکی برای حرکت تا گرمازایی و متابولیسم. حفظ سلامت عضلات اسکلتی از نظر قدرت، توده و عملکرد پیشنیازی برای سلامتی است. حفظ توده عضلانی به معنی وجود تعادلی میان تجزیه و سنتز پروتئینهای عضله است. در شرایطی که میزان تجزیه بیش از میزان سنتز باشد آتروفی عضلانی و زمانی که میزان سنتز از تجزیه بیشتر شود، هایپرتروفی عضلانی رخ میدهد. لازم به ذکر است دو مسیر اصلی، مسئول تجزیه پروتئینها و دیگر ارگانهای داخلی سلول عضلانی میباشند: مسیر یوبیکویتین پروتئازوم و مسیر اتوفاژی لیزوزومال (8). مطالعات قبلی فواید فعالیت ورزشی را در مدیریت سارکوپنی نشان دادهاند. از آنجاییکه فعالیت ورزشی منجر به کاهش بروز بیماریهای مزمن، مقابله با از دست دادن توده عضلانی و افزایش طول عمر میشود، به همین علت امروزه به یک استراتژی موثر برای بهبود سلامت سالمندان تبدیل شده است (9). لازم به ذکر است که فعالیت ورزشی در پیشگیری از 35 بیماری مزمن، موثر میباشد (10). تمرین ترکیبی به اجرای تمرینات مقاومتی و استقامتی در یک برنامه تمرینی گفته میشود، که به عنوان یک روش ایمن و موثر برای جلوگیری از کاهش ظرفیتهای قلبی تنفسی و قدرت عضلانی در افراد سالمند معرفی شده است (11). ترکیب هر دو نوع ورزش استقامتی و مقاومتی در یک برنامه تمرینی منجر به سازگاریهای بیشتر در متغیرهای وابسته به سلامت و عملکرد بدن، مستقل از سن و جنس افراد، می¬شود (12). از سویی دیگر با افزایش سن تغییرات معنی-داری در عملکرد غدد درونریز رخ میدهد که میتوان به کاهش هورمونهای آنابولیک از جمله هورمونهای رشد و IGF-1 اشاره کرد، کاهش این هورمونها یکی از دلایل اصلی سارکوپنیا میباشند (13). بنابراین استفاده از مداخلاتی همچون فعالیت ورزشی یا مکملهای تغذیهای که به نحوی از این کاهش پیشگیری کند، بسیار مفید است. در همین راستا گزارش شده است که غلظت هورمون رشد در پاسخ به تمرینات مقاومتی و استقامتی افزایش مییابد، پس می¬توان انتظار داشت که تولید IGF-1 نیز افزایش یابد (14). IGF-1 از طریق مسیر AKT/ mTOR نقش مهمی را در سنتز پروتئینهای عضله اسکلتی ایفا میکند، زمانی که AKT غیر فعال شود، با فعال شدن فاکتور FOXO آتروفی عضلانی رخ میدهد، بنابراین بیان بالای IGF-1 یا AKT به مهار FOXO میانجامد. دیده شده که پس از انجام فعالیت ورزشی، FOXO3 بهطور معنیداری کاهش و در طول دوره بیتمرینی افزایش داشته است، بنابراین هایپرتروفی عضله اسکلتی ناشی از تمرین مقاومتی در افراد سالم را می¬توان تا حدودی به علت مهار FOXO توسط AKT دانست (15). افزایش سطح پروتئین FOXO3 هستهای در افراد سارکوپنیک مشاهده شده است (16). گرچه فورویاما و همکارانش در سال 2010 تغییری در بیان FOXO3 در نمونههای سالمند و جوان مشاهده نکردند (17). در این زمینه، اجرای تمرینات ترکیبی که به نوعی ویژگیهای هر دو تمرینات استقامتی و مقاومتی را شامل میشود با هدف بهبود مسیرهای سیگنالینگ منتهی هایپرتروفی عضلانی معرفی شده است (11). از طرفی، برخی مطالعات استفاده از مکمل¬های تغذیه¬ای با هدف بهبود ویژگی¬های آنتیاکسیدانی و ضدالتهابی که فرآیندهای تدریجی وابسته به سن را متاثر میکند پیشنهاد نمودهاند. در این بین مصرف کپسایسین مشتق از فلفل قرمز با هدف پیشگیری و یا مهار فرآیندهای وابسته به سارکوپنیا همچنین تحریک متابولیسم چربی و کنترل دیابت معرفی شده است (18). کپسایسین یک آگونیست انتخابی برای گیرندههای TRPV1 محسوب میشود، وجود این گیرندهها علاوه بر سیستم عصبی در سیستم عضلانی و بر روی شبکه سارکوپلاسمی هم دیده شده است (19). فعال شدن این گیرنده، به افزایش غظت کلسیم سیتوزولی و فعال شدن mTOR متعاقب آن میانجامد که در نهایت به هایپرتروفی عضلانی و محافظت در برابر آتروفی، در موشهای صحرایی میانجامد (20). کپسایسین می¬تواند آتروفی عضلانی ناشی از داروهای شیمیدرمانی را با تحریک سنتز پروتئین در عضلات اسکلتی و کاهش بیان پروتئینهای مرتبط با تخریب از جمله FOXO را، بهبود بخشد (20). درمان با کپسایسین، افزایش فسفریلاسیون FOXO1 را در بافت تومور موش¬های صحرایی نشان داده است (21). مطالعات نشان داده که کپسایسین میتواند محور PI3K/ AKT را در چندین لایه تعدیل کند، فعالیت PI3K را تحریک کرده و فسفریلاسیون و فعالسازی AKT را آغاز میکند که متعاقبا رویدادهای پایین دست مرتبط با تکثیر و بقای سلولی را منجر میشود، بدیهی است AKT به غیر فعال کردن FOXO می¬انجامد (22). گولر و همکارانش در سال 2020 نشان دادند که مصرف کپسایسین به افزایش بیان IGF-1 منجر میشود اگرچه با افزایش دوز مصرفی کپسایسین افزایش در سطح IGF-1 نیز اتفاق میافتد (23). از سویی در مطالعهای دیگر دیده شده است مصرف کپسایسین در موشهای دیابتی شده به کاهش بیان IGF1 میانجامد (24). علیرغم شواهد موجود، تاکنون مطالعهای که اثر مصرف کپسایسین در خلال تمرینات ورزش بر بیان ژن¬های IGF-1 و FOXO3 در عضلات اسکلتی افراد سالمند را ارزیابی نماید گزارش نشده است. از اینرو، مطالعه حاضر با هدف تعیین اثر مصرف کپسایسین در طول یک دوره تمرینات ترکیبی بر بیان ژنهای IGF-1 و FOXO3 در عضله چهار سر ران رتهای سالمند ارزیابی میشود.
روش بررسی
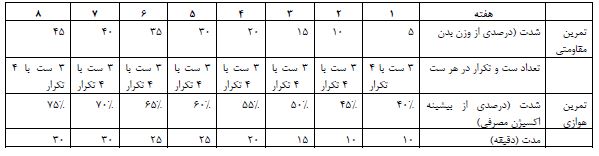
جامعه آماری این مطالعه تجربی-کاربردی را کلیه رتهای نر ویستار حیوان¬خانه دانشگاه علوم پزشکی بقیه الله تشکیل میدهند که از بین آنها 32 سر رت 90 هفته¬ای جهت شرکت در مطالعه انتخاب و بعد از یک هفته آشنایی با محیط آزمایشگاه به شیوه تصادفی در 4 گروه: 1) کنترل، 2) کپسایسین، 3) ورزش، 4) ترکیبی قرار گرفتند. کلیه رت¬های مورد مطالعه در شرایط کنترل شده نور (12 ساعت روشنایی و 12 ساعت تاریکی، شروع روشنایی 6 عصر و شروع خاموشی 6 صبح) با دمای (3±22 سانتیگراد)، و رطوبتی در دامنه 30 تا 60 نگهداری شدند. تعداد سه رت در قفسهایی از جنس پلکسیگلاس با درب توری و به ابعاد 25 در 27 در 43 سانتیمتر به گونهای نگهداری شد که آزادانه به آب و غذای استاندارد دسترسی داشته باشند. در سرتاسر دوره تحقیق رتها توسط یک نفر جابجا و دستکاری شدند. در ادامه به غیر از گروه کنترل، دیگر گروهها به مدت 8 هفته تحت مداخله قرار گرفتند به شکلی که در گروه کپسایسین، مکمل کپسایسین با خلوص 95 درصد که از شرکت سیگما آلدریج تهیه شده است به مدت 8 هفته با دوز روزانه 5 میلیگرم به ازای هر کیلوگرم وزن بدن (24). پس از شروع چرخه روشنایی گاواژ شد (25). گروه ورزش نیز به مدت 8 هفته تمرینات ترکیبی را به تعداد 5 جلسه در هفته در قالب تمرین مقاومتی و استقامتی مطابق با جدول 1 اجرا نمودند (26). تمرین مقاومتی در قالب بالارفتن از نردبان 26 پله¬ای یک متری با شیب 80 درصد با اعمال وزنه به دم موش ها در قالب 3 ست و 4 تکرار در هر ست اجرا شد. فاصله استراحت بین ستها 3 دقیقه و بین تکرارها یک دقیقه است. افزایش شدت تمرین در تمرینات استقامتی نیز بر پایه درصد اکسیژن مصرفی بیشینه روی تردمیل مخصوص جوندگان و بدون شیب اعمال شد. برای تبدیل سرعت نوارگردان به بیشینه اکسیژن مصرفی از روش هویدال و همکارانش در سال 2007 استفاده شد (27). به این ترتیب که ابتدا حیوانات به مدت 10 دقیقه با سرعت 10 متر در دقیقه مرحله گرمکردن را سپری کردند، سپس آزمون فزآینده ورزشی آغاز شد. در این مرحله هر 2 دقیقه، سرعت نوارگردان 0/03 متر بر ثانیه (حدود 1/8 تا 2 متر بر دقیقه) افزایش یافت، تا جایی که موشها قادر به ادامه فعالیت ورزشی نباشند. سپس میزان بیشینه اکسیژن مصرفی طبق فرمول Y=162x-1 بهدست آمد که x سرعت دویدن (متر بر ثانیه) و Y پاسخ VO2 است.
نمونهگیری بافتی و استخراج RNA: 24 ساعت پس از آخرین جلسه تمرینی (10 تا 12 ساعت ناشتا)، رتهای مورد مطالعه در هر گروه بهواسطه تزریق داخل صفاقی مخلوط کتامین 10 درصد و با دوز 50 میلیگرم بر کیلوگرم و زایلازین 2 درصد و با دوز 10 میلیگرم بر کیلوگرم بیهوش شدند. در ادامه عضله چهار سر ران رتها استخراج و پس از شستشو در سرم فیزیولوژیک در میکروتیوبهای 1/8 حاوی مایع RNAlater با نسبت 20 درصد جهت انجام آزمایشهای ژنتیک غوطه ور گردید. به جهت ارزیابی بیان ژنها، استخراج RNA(Ribonucleic Acid) در بافت عضله، طبق پروتکل محلول ترایزول ژنیکس انجام شد و پس از استخراج آن با غلظت و خلوص بالا، مراحل سنتز cDNA(Complementary DNA) انجام گرفت، سپس از آن برای انجام واکنش رونویسی معکوس استفاده شد. اندازه-گیری سطوح بیان ژنهای IGF-1 و FOXO3 بهوسیله روش کمی Real Time PCR انجام گرفت. در این مطالعه، تکثیر ژنهای FOXO3 و IGF-1 برای اندازه¬گیری بیان ژن توسط Real Time PCR بر اساس روش استاندارد صورت گرفت. از GAPDH به عنوان ژن کنترل استفاده گردید. الگوی توالی پرایمرها در جدول 2 بیان شدهاند.
تجزیه تحلیل آماری
از آزمون شاپرو ویلک جهت اطمینان از توزیع نرمال دادهها استفاده گردید. برای توصیف داده و رسم نمودارها از آمار توصیفی و برای مقایسه گروهها در متغیرهای مورد مطالعه از آزمون آنالیز واریانس دو طرفه و تست تعقیبی Tukey استفاده شد. سطح معنیداری نیز آلفای کمتر از 0/05 در نظر گرفته شد. کلیه بررسیهای آماری با استفاده از نرمافزارversion 16 SPSS انجام گرفت.
جدول 1: پروتکل اجرای تمرینات مقاومتی و استقامتی
جدول 2: الگوی پرایمرهای مورد استفاده در پژوهش

نتایج
بر پایه نتایج آزمون آنالیز واریانس دوطرفه تفاوت معنیداری در بیان FOXO3 بین گروه¬های مورد مطالعه مشاهده شد (0/009=P). از طرفی بر پایه نتایج آزمون تعقیبی توکی، در مقایسه با گروه کنترل، مصرف کپسایسین (0/001=P) و تمرین ترکیبی (0/011=P) مستقل از یکدیگر به کاهش بیان ژن FOXO3 در عضله چهارسرران منجر شدند. اما اثر متقابل تمرین ترکیبی و مصرف کپسایسین بر روی بیان ژن FOXO3 (P=0/066) معنیدار نبود (نمودار 1). از طرفی، تفاوت معنیداری در بیان FOXO3 بین سایر گروهها با همدیگر مشاهده نشد (0/05< P). همچنین نتایج آزمون آنالیز واریانس دوطرفه بیانگر تفاوت معنیدار بیان IGF-1 بین گروههای مورد مطالعه است (0/021=P). از طرفی بر پایه تست تعقیبی توکی، در مقایسه با گروه کنترل، مصرف کپسایسین بهتنهایی به افزایش معنیدار بیان ژن IGF-1 منجر شد (0/002=P). اثر تمرین ترکیبی (0/118=P) و همچنین اثر متقابل تمرین ترکیبی و کپسایسین (0/343=P) بر بیان ژن IGF-1 غیر معنیدار بود (نمودار 2). از طرفی، تفاوت معنیداری در بیان IGF-1 بین سایر گروهها با همدیگر مشاهده نشد (0/05< P).

نمودار1: اثر تمرین ترکیبی و کپسایسین بر بیان ژن FOXO3 در عضله چهارسرران موش¬های صحرایی سالمند نر نژاد ویستار
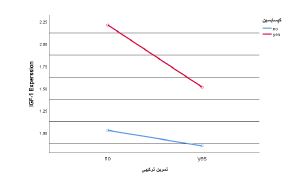
نمودار2: اثر تمرین ترکیبی و کپسایسین بر بیان ژن IGF-1 در عضله چهارسرران موش¬های صحرایی سالمند نر نژاد ویستار
بحث
بر پایه مقایسههای آماری، اگرچه مصرف کپسایسین افزایش بیان ژن IGF-1 را به دنبال داشت، اما تغییرات آن در گروه ورزش و گروه ترکیبی غیرمعنیدار بود. به عبارتی اجرای تمرینات مقاومتی و استقامتی در گروه ورزش و اجرای تمرینات توام با مصرف کپسایسین بیان IGF-1 را دستخوش تغییر نکرد. این یافتهها در حالی گزارش میشود که سطوح سیستیمیک و بیان IGF-1 با افزایش تدریجی سن در سنین سالمندی کاهش مییابد (28). از طرفی، افزایش سطوح پروتئین یا بیان IGF-1 در پاسخ به شیوههای درمانی مختلف، هایپرتروفی عضلانی را به دنبال دارد و روند آتروفی وابسته به سن را کاهش میدهد (29). همسو با یافتههای مطالعه حاضر، افزایش مسیرهای سیگنالینگ انسولین و IGF-1 در پاسخ به مصرف کپسایسین و مهار آپوپتوز سلولهای بتا به عنوان پیامد آن توسط لی و همکاران در سال 2024 گزارش شده است (30). از طرفی، عنوان شده است که مصرف کپسایسین منجر به افزایش تولید IGF-1 در سلولهای سرطانی میشود (31). از طرفی، فنگ و همکاران در سال 2022 افزایش بیان IGF-1 و هایپرتروفی عضلات اسکلتی متعاقب تمرینات ترکیبی را در موش¬های آزمایشگاهی گزارش نمودهاند (32) در مطالعه دیگری، بورست و همکاران در سال 2011 افزایش IGF-1 سرم را متعاقب 13 هفته تمرین مقاومتی توسط افراد سالم کم تحرک گزارش نموده اند (33). آنیبالینی و همکاران در سال 2017 نیز افزایش IGF-1 را همراه با بهبود آمادگی قلبی-تنفسی را متعاقب 16 هفته تمرین ترکیبی در قالب تمرینات مقاومتی و استقامتی در دیابتیهای نوع 2 گزارش نمودهاند (34). در مطالعه سئو و همکاران در سال 2020 نیز افزایش قابلتوجهی در سطوح IGF-1 و هورمون رشد متعاقب تمرینات هوازی و همچنین تمرینات ترکیبی (هوازی+مقاومتی) در زنان سالمند گزارش شده است. تاثیر فعالیتهای ترکیبی و هوازی بر میزان ترشح هورمون رشد و IGF-1 در زنان سالمند نشان داده است که تمرینات ترکیبی و هوازی هر دو منجر به افزایش میزان این هورمونها شده است (35). از طرفی نتیجه دیگر پژوهش نشان داد که تمرین ترکیبی و مصرف کپسایسین هر یک به تنهایی، منجر به کاهش قابل ملاحظهای در بیان ژن FOXO3 شد اگرچه موشهایی که کپسایسین مصرف کردند، در مقایسه با موشهایی که کپسایسین مصرف نکردند، پس از تمرین ترکیبی، کاهش محسوستری را در میانگین بیان ژن FOXO3 تجربه کردند.، همچنین اثر متقابل این دو، تاثیر معنیداری را بر بیان این ژن نداشت. ژن FOXO3 به دلیل غیر فعال شدنش در طول دوره رشد عضلانی به یکی از مهمترین ژنهای کنترل کننده توده عضلانی تبدیل شده است، زیرا به عنوان فاکتور پایین دست IGF-1 جایگاهی مهم در تخریب پروتئین و به¬هم خوردن بازگردش پروتئینی دارد، بنابراین غیر فعال کردن آن ممکن است یک هدف بالقوه در درمان آتروفی عضلانی باشد (36). مهار FOXO یکی از راهبردهای درمانی جدید در برابر سارکوپنیا محسوب میشود (37). همراستا با نتیجه بهدستآمده دیده شده است که تمرین ترکیبی سنتز پروتئین عضلانی را مستقیما از طریق مسیر AKT/ mTOR تسریع میکند، فعالسازی AKT بیان FOXO3 را مهار میکند، در نتیجه آتروفی عضلانی کاهش مییابد (38). از اینرو در مداخلات ورزشی، تنظیم مسیر AKT/ FOXO3 در کند کردن روند سارکوپنیا از اهمیت ویژهای برخوردار است. از طرفی دیگر نتایج نشان داده که تمرینات استقامتی در مقایسه با تمرینات مقاومتی در موشهای سرطانی، کاهش چشمگیرتری را در آتروژنها (ژنهای آتروفی) که پایین دست FOXO3 هستند، داشتهاند. مطالعهای گزارش داده است که یک جلسه تمرین ورزشی باعث افزایش بیان FOXO1 و FOXO3 میشود، در حالیکه تمرینات ورزشی طولانی مدت به کاهش بیان این فاکتور منجر شده است (39). از سویی دیگر با توجه به این مطلب که کپسایسین به عنوان آگونیست انتخابی گیرنده TRPV1 شناخته شده است و این گیرنده نقش مهمی در عملکرد عضلانی ایفا میکند و متابولیسم انرژی را در عضلات اسکلتی بهبود میبخشد (40)، بنابراین یکی از روشهای درمانی سارکوپنیا، فعال کردن این گیرنده است. کپسایسین با واسطه این کانال، فسفریلاسیون mTOR را برای تعدیل بیشتر هایپرتروفی عضلانی اعمال میکند. زیرا کپسایسین با فعال کردن این گیرنده، افزایش غلظت کلسیم سیتوزولی را بهدنبال دارد که در نهایت به هایپرتروفی عضله اسکلتی منجر میشود (20). همسو با نتیجه به دست آمده گفته شده که تجویز روزانه کپسایسین نه تنها ممکن است mTOR را فعال کند، بلکه از تخریب پروتئین توسط FOXO3 نیز جلوگیری می-کند(41). مطالعات آزمایشگاهی آشکار نمودهاند که کپسایسین از یک سو بهواسطه افزایش فعالیت مسیر AKT/mTOR و از سویی دیگر بهواسطه مهار FOXO مسیرهای منتهی به سنتز عضلانی را تحریک میکند (42). علیرغم اینکه اندازهگیری بیان IGF-1 و FOXO3 در پاسخ به تمرینات ترکیبی و مصرف کپسایسن از نقاط قوت مطالعه حاضر بهشمار می رود، اما عدم اندازهگیری برخی عواملی هورمونی و ژنتیکی موثر بر پیشگیری از آتروفی عضلانی یا سارکوپنی در سنین سالمندی نظیر AKT1، mTORc1 و PI3K از محدویتهای مطالعه بشمار میروند که اجرای مطالعات آتی با اندازهگیری این مولفهها جهت دستیابی به مکانیسم اصلی عهدهدار تغییرات وابسته به ورزش و کپسایسین پیشنهاد میشود.
نتیجهگیری
اجرای تمرینات ترکیبی در قالب ورزش مقاومتی و استقامتی و مصرف کپسایسین مستقل از یکدیگر با بهبود آتروفی در رتهای سالمند همراه هستند. با این وجود، اعمال همزمان آنها با اثربخشی بیشتری نسبت به هر یک از آنها به تنهایی همراه نیست که با توجه به نقش موثر هر دو مداخله، اندازهگیری سایر مولفههای هورمونی یا ژنتیکی موثر بر فرایند سنتز عضله با دستکاری مدت و شدت تمرین یا دوز مصرفی کپسایسین جهت دستیابی به مکانیسمهای اصلی عهدهدار این تغییرات پیشنهاد میشود.
سپاسگزاری
نویسندگان مقاله از کلیه همکاران در آزمایشگاه حیوانات و آزمایشگاه ژنتیک ژنیران تقدیر و تشکر مینمایند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپزال این مقاله توسط کمیته اخلاق دانشگاه پرند (IR.IAU.PIAU.REC.1403.002) تایید شده است.
مشارکت نویسندگان
حسین شیروانی در ارائه ایده، یاسر کاظمزاده، حسین شیروانی، فاطمه مدنی در طراحی مطالعه، فاطمه مدنی در جمعآوری دادهها، .فاطمه مدنی، ساناز میرزایان شانجانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
سالمندی فرآیندی آهسته و تدریجی است که با کاهش مداوم در عملکردهای فیزیولوژیکی بدن موجودات زنده در طول عمرشان همراه است و بهعنوان یک عامل خطرساز برای کاهش عملکرد اندامها و سلامت کلی در نظر گرفته میشود (1). امروزه جمعیت جهان به سرعت در حال پیر شدن است و در سرتاسر جهان نگرانیهای فزآیندهای در مورد چگونگی مراقبت از جمعیت بزرگ سالمندان وجود دارد. ایران نیز از این قائده مستثنی نیست، بهطوری که میتوان انتظار داشت، جمعیت سالمندی کشور، در سال 1429 تقریباً 24 درصد از جمعیت کل کشور را شامل شود (2). یکی از اختلالات اساسی و شایع در افراد سالمند، آتروفی عضلانی وابسته به سن یا " سارکوپنیا " می¬باشد که با کاهش تدریجی در توده، عملکرد و قدرت عضلانی همراه است (3). سارکوپنیا با طیف وسیعی از پیامدهای نامطلوب از جمله ضعف، از دست دادن استقلال، افزایش خطر سقوط و شکستکی اسنخوان و کاهش کیفیت زندگی و بیماریهای مرتبط با بیتحرکی و مرگ و میر (4) همراه است (3). سارکوپنیا از دهه چهارم زندگی شروع میشود (5). عضله اسکلتی که در حدود 40 درصد از وزن بدن را تشکیل میدهد و 50 تا 75 درصد از پروتئینهای بدن را شامل میشود (6)، یک بافت پیچیده است (7) که عملکردهای متعددی را انجام میدهد، از انقباض مکانیکی برای حرکت تا گرمازایی و متابولیسم. حفظ سلامت عضلات اسکلتی از نظر قدرت، توده و عملکرد پیشنیازی برای سلامتی است. حفظ توده عضلانی به معنی وجود تعادلی میان تجزیه و سنتز پروتئینهای عضله است. در شرایطی که میزان تجزیه بیش از میزان سنتز باشد آتروفی عضلانی و زمانی که میزان سنتز از تجزیه بیشتر شود، هایپرتروفی عضلانی رخ میدهد. لازم به ذکر است دو مسیر اصلی، مسئول تجزیه پروتئینها و دیگر ارگانهای داخلی سلول عضلانی میباشند: مسیر یوبیکویتین پروتئازوم و مسیر اتوفاژی لیزوزومال (8). مطالعات قبلی فواید فعالیت ورزشی را در مدیریت سارکوپنی نشان دادهاند. از آنجاییکه فعالیت ورزشی منجر به کاهش بروز بیماریهای مزمن، مقابله با از دست دادن توده عضلانی و افزایش طول عمر میشود، به همین علت امروزه به یک استراتژی موثر برای بهبود سلامت سالمندان تبدیل شده است (9). لازم به ذکر است که فعالیت ورزشی در پیشگیری از 35 بیماری مزمن، موثر میباشد (10). تمرین ترکیبی به اجرای تمرینات مقاومتی و استقامتی در یک برنامه تمرینی گفته میشود، که به عنوان یک روش ایمن و موثر برای جلوگیری از کاهش ظرفیتهای قلبی تنفسی و قدرت عضلانی در افراد سالمند معرفی شده است (11). ترکیب هر دو نوع ورزش استقامتی و مقاومتی در یک برنامه تمرینی منجر به سازگاریهای بیشتر در متغیرهای وابسته به سلامت و عملکرد بدن، مستقل از سن و جنس افراد، می¬شود (12). از سویی دیگر با افزایش سن تغییرات معنی-داری در عملکرد غدد درونریز رخ میدهد که میتوان به کاهش هورمونهای آنابولیک از جمله هورمونهای رشد و IGF-1 اشاره کرد، کاهش این هورمونها یکی از دلایل اصلی سارکوپنیا میباشند (13). بنابراین استفاده از مداخلاتی همچون فعالیت ورزشی یا مکملهای تغذیهای که به نحوی از این کاهش پیشگیری کند، بسیار مفید است. در همین راستا گزارش شده است که غلظت هورمون رشد در پاسخ به تمرینات مقاومتی و استقامتی افزایش مییابد، پس می¬توان انتظار داشت که تولید IGF-1 نیز افزایش یابد (14). IGF-1 از طریق مسیر AKT/ mTOR نقش مهمی را در سنتز پروتئینهای عضله اسکلتی ایفا میکند، زمانی که AKT غیر فعال شود، با فعال شدن فاکتور FOXO آتروفی عضلانی رخ میدهد، بنابراین بیان بالای IGF-1 یا AKT به مهار FOXO میانجامد. دیده شده که پس از انجام فعالیت ورزشی، FOXO3 بهطور معنیداری کاهش و در طول دوره بیتمرینی افزایش داشته است، بنابراین هایپرتروفی عضله اسکلتی ناشی از تمرین مقاومتی در افراد سالم را می¬توان تا حدودی به علت مهار FOXO توسط AKT دانست (15). افزایش سطح پروتئین FOXO3 هستهای در افراد سارکوپنیک مشاهده شده است (16). گرچه فورویاما و همکارانش در سال 2010 تغییری در بیان FOXO3 در نمونههای سالمند و جوان مشاهده نکردند (17). در این زمینه، اجرای تمرینات ترکیبی که به نوعی ویژگیهای هر دو تمرینات استقامتی و مقاومتی را شامل میشود با هدف بهبود مسیرهای سیگنالینگ منتهی هایپرتروفی عضلانی معرفی شده است (11). از طرفی، برخی مطالعات استفاده از مکمل¬های تغذیه¬ای با هدف بهبود ویژگی¬های آنتیاکسیدانی و ضدالتهابی که فرآیندهای تدریجی وابسته به سن را متاثر میکند پیشنهاد نمودهاند. در این بین مصرف کپسایسین مشتق از فلفل قرمز با هدف پیشگیری و یا مهار فرآیندهای وابسته به سارکوپنیا همچنین تحریک متابولیسم چربی و کنترل دیابت معرفی شده است (18). کپسایسین یک آگونیست انتخابی برای گیرندههای TRPV1 محسوب میشود، وجود این گیرندهها علاوه بر سیستم عصبی در سیستم عضلانی و بر روی شبکه سارکوپلاسمی هم دیده شده است (19). فعال شدن این گیرنده، به افزایش غظت کلسیم سیتوزولی و فعال شدن mTOR متعاقب آن میانجامد که در نهایت به هایپرتروفی عضلانی و محافظت در برابر آتروفی، در موشهای صحرایی میانجامد (20). کپسایسین می¬تواند آتروفی عضلانی ناشی از داروهای شیمیدرمانی را با تحریک سنتز پروتئین در عضلات اسکلتی و کاهش بیان پروتئینهای مرتبط با تخریب از جمله FOXO را، بهبود بخشد (20). درمان با کپسایسین، افزایش فسفریلاسیون FOXO1 را در بافت تومور موش¬های صحرایی نشان داده است (21). مطالعات نشان داده که کپسایسین میتواند محور PI3K/ AKT را در چندین لایه تعدیل کند، فعالیت PI3K را تحریک کرده و فسفریلاسیون و فعالسازی AKT را آغاز میکند که متعاقبا رویدادهای پایین دست مرتبط با تکثیر و بقای سلولی را منجر میشود، بدیهی است AKT به غیر فعال کردن FOXO می¬انجامد (22). گولر و همکارانش در سال 2020 نشان دادند که مصرف کپسایسین به افزایش بیان IGF-1 منجر میشود اگرچه با افزایش دوز مصرفی کپسایسین افزایش در سطح IGF-1 نیز اتفاق میافتد (23). از سویی در مطالعهای دیگر دیده شده است مصرف کپسایسین در موشهای دیابتی شده به کاهش بیان IGF1 میانجامد (24). علیرغم شواهد موجود، تاکنون مطالعهای که اثر مصرف کپسایسین در خلال تمرینات ورزش بر بیان ژن¬های IGF-1 و FOXO3 در عضلات اسکلتی افراد سالمند را ارزیابی نماید گزارش نشده است. از اینرو، مطالعه حاضر با هدف تعیین اثر مصرف کپسایسین در طول یک دوره تمرینات ترکیبی بر بیان ژنهای IGF-1 و FOXO3 در عضله چهار سر ران رتهای سالمند ارزیابی میشود.
روش بررسی
جامعه آماری این مطالعه تجربی-کاربردی را کلیه رتهای نر ویستار حیوان¬خانه دانشگاه علوم پزشکی بقیه الله تشکیل میدهند که از بین آنها 32 سر رت 90 هفته¬ای جهت شرکت در مطالعه انتخاب و بعد از یک هفته آشنایی با محیط آزمایشگاه به شیوه تصادفی در 4 گروه: 1) کنترل، 2) کپسایسین، 3) ورزش، 4) ترکیبی قرار گرفتند. کلیه رت¬های مورد مطالعه در شرایط کنترل شده نور (12 ساعت روشنایی و 12 ساعت تاریکی، شروع روشنایی 6 عصر و شروع خاموشی 6 صبح) با دمای (3±22 سانتیگراد)، و رطوبتی در دامنه 30 تا 60 نگهداری شدند. تعداد سه رت در قفسهایی از جنس پلکسیگلاس با درب توری و به ابعاد 25 در 27 در 43 سانتیمتر به گونهای نگهداری شد که آزادانه به آب و غذای استاندارد دسترسی داشته باشند. در سرتاسر دوره تحقیق رتها توسط یک نفر جابجا و دستکاری شدند. در ادامه به غیر از گروه کنترل، دیگر گروهها به مدت 8 هفته تحت مداخله قرار گرفتند به شکلی که در گروه کپسایسین، مکمل کپسایسین با خلوص 95 درصد که از شرکت سیگما آلدریج تهیه شده است به مدت 8 هفته با دوز روزانه 5 میلیگرم به ازای هر کیلوگرم وزن بدن (24). پس از شروع چرخه روشنایی گاواژ شد (25). گروه ورزش نیز به مدت 8 هفته تمرینات ترکیبی را به تعداد 5 جلسه در هفته در قالب تمرین مقاومتی و استقامتی مطابق با جدول 1 اجرا نمودند (26). تمرین مقاومتی در قالب بالارفتن از نردبان 26 پله¬ای یک متری با شیب 80 درصد با اعمال وزنه به دم موش ها در قالب 3 ست و 4 تکرار در هر ست اجرا شد. فاصله استراحت بین ستها 3 دقیقه و بین تکرارها یک دقیقه است. افزایش شدت تمرین در تمرینات استقامتی نیز بر پایه درصد اکسیژن مصرفی بیشینه روی تردمیل مخصوص جوندگان و بدون شیب اعمال شد. برای تبدیل سرعت نوارگردان به بیشینه اکسیژن مصرفی از روش هویدال و همکارانش در سال 2007 استفاده شد (27). به این ترتیب که ابتدا حیوانات به مدت 10 دقیقه با سرعت 10 متر در دقیقه مرحله گرمکردن را سپری کردند، سپس آزمون فزآینده ورزشی آغاز شد. در این مرحله هر 2 دقیقه، سرعت نوارگردان 0/03 متر بر ثانیه (حدود 1/8 تا 2 متر بر دقیقه) افزایش یافت، تا جایی که موشها قادر به ادامه فعالیت ورزشی نباشند. سپس میزان بیشینه اکسیژن مصرفی طبق فرمول Y=162x-1 بهدست آمد که x سرعت دویدن (متر بر ثانیه) و Y پاسخ VO2 است.
نمونهگیری بافتی و استخراج RNA: 24 ساعت پس از آخرین جلسه تمرینی (10 تا 12 ساعت ناشتا)، رتهای مورد مطالعه در هر گروه بهواسطه تزریق داخل صفاقی مخلوط کتامین 10 درصد و با دوز 50 میلیگرم بر کیلوگرم و زایلازین 2 درصد و با دوز 10 میلیگرم بر کیلوگرم بیهوش شدند. در ادامه عضله چهار سر ران رتها استخراج و پس از شستشو در سرم فیزیولوژیک در میکروتیوبهای 1/8 حاوی مایع RNAlater با نسبت 20 درصد جهت انجام آزمایشهای ژنتیک غوطه ور گردید. به جهت ارزیابی بیان ژنها، استخراج RNA(Ribonucleic Acid) در بافت عضله، طبق پروتکل محلول ترایزول ژنیکس انجام شد و پس از استخراج آن با غلظت و خلوص بالا، مراحل سنتز cDNA(Complementary DNA) انجام گرفت، سپس از آن برای انجام واکنش رونویسی معکوس استفاده شد. اندازه-گیری سطوح بیان ژنهای IGF-1 و FOXO3 بهوسیله روش کمی Real Time PCR انجام گرفت. در این مطالعه، تکثیر ژنهای FOXO3 و IGF-1 برای اندازه¬گیری بیان ژن توسط Real Time PCR بر اساس روش استاندارد صورت گرفت. از GAPDH به عنوان ژن کنترل استفاده گردید. الگوی توالی پرایمرها در جدول 2 بیان شدهاند.
تجزیه تحلیل آماری
از آزمون شاپرو ویلک جهت اطمینان از توزیع نرمال دادهها استفاده گردید. برای توصیف داده و رسم نمودارها از آمار توصیفی و برای مقایسه گروهها در متغیرهای مورد مطالعه از آزمون آنالیز واریانس دو طرفه و تست تعقیبی Tukey استفاده شد. سطح معنیداری نیز آلفای کمتر از 0/05 در نظر گرفته شد. کلیه بررسیهای آماری با استفاده از نرمافزارversion 16 SPSS انجام گرفت.
جدول 1: پروتکل اجرای تمرینات مقاومتی و استقامتی

جدول 2: الگوی پرایمرهای مورد استفاده در پژوهش

نتایج
بر پایه نتایج آزمون آنالیز واریانس دوطرفه تفاوت معنیداری در بیان FOXO3 بین گروه¬های مورد مطالعه مشاهده شد (0/009=P). از طرفی بر پایه نتایج آزمون تعقیبی توکی، در مقایسه با گروه کنترل، مصرف کپسایسین (0/001=P) و تمرین ترکیبی (0/011=P) مستقل از یکدیگر به کاهش بیان ژن FOXO3 در عضله چهارسرران منجر شدند. اما اثر متقابل تمرین ترکیبی و مصرف کپسایسین بر روی بیان ژن FOXO3 (P=0/066) معنیدار نبود (نمودار 1). از طرفی، تفاوت معنیداری در بیان FOXO3 بین سایر گروهها با همدیگر مشاهده نشد (0/05< P). همچنین نتایج آزمون آنالیز واریانس دوطرفه بیانگر تفاوت معنیدار بیان IGF-1 بین گروههای مورد مطالعه است (0/021=P). از طرفی بر پایه تست تعقیبی توکی، در مقایسه با گروه کنترل، مصرف کپسایسین بهتنهایی به افزایش معنیدار بیان ژن IGF-1 منجر شد (0/002=P). اثر تمرین ترکیبی (0/118=P) و همچنین اثر متقابل تمرین ترکیبی و کپسایسین (0/343=P) بر بیان ژن IGF-1 غیر معنیدار بود (نمودار 2). از طرفی، تفاوت معنیداری در بیان IGF-1 بین سایر گروهها با همدیگر مشاهده نشد (0/05< P).

نمودار1: اثر تمرین ترکیبی و کپسایسین بر بیان ژن FOXO3 در عضله چهارسرران موش¬های صحرایی سالمند نر نژاد ویستار

نمودار2: اثر تمرین ترکیبی و کپسایسین بر بیان ژن IGF-1 در عضله چهارسرران موش¬های صحرایی سالمند نر نژاد ویستار
بحث
بر پایه مقایسههای آماری، اگرچه مصرف کپسایسین افزایش بیان ژن IGF-1 را به دنبال داشت، اما تغییرات آن در گروه ورزش و گروه ترکیبی غیرمعنیدار بود. به عبارتی اجرای تمرینات مقاومتی و استقامتی در گروه ورزش و اجرای تمرینات توام با مصرف کپسایسین بیان IGF-1 را دستخوش تغییر نکرد. این یافتهها در حالی گزارش میشود که سطوح سیستیمیک و بیان IGF-1 با افزایش تدریجی سن در سنین سالمندی کاهش مییابد (28). از طرفی، افزایش سطوح پروتئین یا بیان IGF-1 در پاسخ به شیوههای درمانی مختلف، هایپرتروفی عضلانی را به دنبال دارد و روند آتروفی وابسته به سن را کاهش میدهد (29). همسو با یافتههای مطالعه حاضر، افزایش مسیرهای سیگنالینگ انسولین و IGF-1 در پاسخ به مصرف کپسایسین و مهار آپوپتوز سلولهای بتا به عنوان پیامد آن توسط لی و همکاران در سال 2024 گزارش شده است (30). از طرفی، عنوان شده است که مصرف کپسایسین منجر به افزایش تولید IGF-1 در سلولهای سرطانی میشود (31). از طرفی، فنگ و همکاران در سال 2022 افزایش بیان IGF-1 و هایپرتروفی عضلات اسکلتی متعاقب تمرینات ترکیبی را در موش¬های آزمایشگاهی گزارش نمودهاند (32) در مطالعه دیگری، بورست و همکاران در سال 2011 افزایش IGF-1 سرم را متعاقب 13 هفته تمرین مقاومتی توسط افراد سالم کم تحرک گزارش نموده اند (33). آنیبالینی و همکاران در سال 2017 نیز افزایش IGF-1 را همراه با بهبود آمادگی قلبی-تنفسی را متعاقب 16 هفته تمرین ترکیبی در قالب تمرینات مقاومتی و استقامتی در دیابتیهای نوع 2 گزارش نمودهاند (34). در مطالعه سئو و همکاران در سال 2020 نیز افزایش قابلتوجهی در سطوح IGF-1 و هورمون رشد متعاقب تمرینات هوازی و همچنین تمرینات ترکیبی (هوازی+مقاومتی) در زنان سالمند گزارش شده است. تاثیر فعالیتهای ترکیبی و هوازی بر میزان ترشح هورمون رشد و IGF-1 در زنان سالمند نشان داده است که تمرینات ترکیبی و هوازی هر دو منجر به افزایش میزان این هورمونها شده است (35). از طرفی نتیجه دیگر پژوهش نشان داد که تمرین ترکیبی و مصرف کپسایسین هر یک به تنهایی، منجر به کاهش قابل ملاحظهای در بیان ژن FOXO3 شد اگرچه موشهایی که کپسایسین مصرف کردند، در مقایسه با موشهایی که کپسایسین مصرف نکردند، پس از تمرین ترکیبی، کاهش محسوستری را در میانگین بیان ژن FOXO3 تجربه کردند.، همچنین اثر متقابل این دو، تاثیر معنیداری را بر بیان این ژن نداشت. ژن FOXO3 به دلیل غیر فعال شدنش در طول دوره رشد عضلانی به یکی از مهمترین ژنهای کنترل کننده توده عضلانی تبدیل شده است، زیرا به عنوان فاکتور پایین دست IGF-1 جایگاهی مهم در تخریب پروتئین و به¬هم خوردن بازگردش پروتئینی دارد، بنابراین غیر فعال کردن آن ممکن است یک هدف بالقوه در درمان آتروفی عضلانی باشد (36). مهار FOXO یکی از راهبردهای درمانی جدید در برابر سارکوپنیا محسوب میشود (37). همراستا با نتیجه بهدستآمده دیده شده است که تمرین ترکیبی سنتز پروتئین عضلانی را مستقیما از طریق مسیر AKT/ mTOR تسریع میکند، فعالسازی AKT بیان FOXO3 را مهار میکند، در نتیجه آتروفی عضلانی کاهش مییابد (38). از اینرو در مداخلات ورزشی، تنظیم مسیر AKT/ FOXO3 در کند کردن روند سارکوپنیا از اهمیت ویژهای برخوردار است. از طرفی دیگر نتایج نشان داده که تمرینات استقامتی در مقایسه با تمرینات مقاومتی در موشهای سرطانی، کاهش چشمگیرتری را در آتروژنها (ژنهای آتروفی) که پایین دست FOXO3 هستند، داشتهاند. مطالعهای گزارش داده است که یک جلسه تمرین ورزشی باعث افزایش بیان FOXO1 و FOXO3 میشود، در حالیکه تمرینات ورزشی طولانی مدت به کاهش بیان این فاکتور منجر شده است (39). از سویی دیگر با توجه به این مطلب که کپسایسین به عنوان آگونیست انتخابی گیرنده TRPV1 شناخته شده است و این گیرنده نقش مهمی در عملکرد عضلانی ایفا میکند و متابولیسم انرژی را در عضلات اسکلتی بهبود میبخشد (40)، بنابراین یکی از روشهای درمانی سارکوپنیا، فعال کردن این گیرنده است. کپسایسین با واسطه این کانال، فسفریلاسیون mTOR را برای تعدیل بیشتر هایپرتروفی عضلانی اعمال میکند. زیرا کپسایسین با فعال کردن این گیرنده، افزایش غلظت کلسیم سیتوزولی را بهدنبال دارد که در نهایت به هایپرتروفی عضله اسکلتی منجر میشود (20). همسو با نتیجه به دست آمده گفته شده که تجویز روزانه کپسایسین نه تنها ممکن است mTOR را فعال کند، بلکه از تخریب پروتئین توسط FOXO3 نیز جلوگیری می-کند(41). مطالعات آزمایشگاهی آشکار نمودهاند که کپسایسین از یک سو بهواسطه افزایش فعالیت مسیر AKT/mTOR و از سویی دیگر بهواسطه مهار FOXO مسیرهای منتهی به سنتز عضلانی را تحریک میکند (42). علیرغم اینکه اندازهگیری بیان IGF-1 و FOXO3 در پاسخ به تمرینات ترکیبی و مصرف کپسایسن از نقاط قوت مطالعه حاضر بهشمار می رود، اما عدم اندازهگیری برخی عواملی هورمونی و ژنتیکی موثر بر پیشگیری از آتروفی عضلانی یا سارکوپنی در سنین سالمندی نظیر AKT1، mTORc1 و PI3K از محدویتهای مطالعه بشمار میروند که اجرای مطالعات آتی با اندازهگیری این مولفهها جهت دستیابی به مکانیسم اصلی عهدهدار تغییرات وابسته به ورزش و کپسایسین پیشنهاد میشود.
نتیجهگیری
اجرای تمرینات ترکیبی در قالب ورزش مقاومتی و استقامتی و مصرف کپسایسین مستقل از یکدیگر با بهبود آتروفی در رتهای سالمند همراه هستند. با این وجود، اعمال همزمان آنها با اثربخشی بیشتری نسبت به هر یک از آنها به تنهایی همراه نیست که با توجه به نقش موثر هر دو مداخله، اندازهگیری سایر مولفههای هورمونی یا ژنتیکی موثر بر فرایند سنتز عضله با دستکاری مدت و شدت تمرین یا دوز مصرفی کپسایسین جهت دستیابی به مکانیسمهای اصلی عهدهدار این تغییرات پیشنهاد میشود.
سپاسگزاری
نویسندگان مقاله از کلیه همکاران در آزمایشگاه حیوانات و آزمایشگاه ژنتیک ژنیران تقدیر و تشکر مینمایند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپزال این مقاله توسط کمیته اخلاق دانشگاه پرند (IR.IAU.PIAU.REC.1403.002) تایید شده است.
مشارکت نویسندگان
حسین شیروانی در ارائه ایده، یاسر کاظمزاده، حسین شیروانی، فاطمه مدنی در طراحی مطالعه، فاطمه مدنی در جمعآوری دادهها، .فاطمه مدنی، ساناز میرزایان شانجانی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Franceschi C, Garagnani P, Morsiani C, Conte M, Santoro A, Grignolio A, et al. The Continuum of Aging and Age-Related Diseases: Common Mechanisms but Different Rates. Front Med (Lausanne) 2018; 5: 61.
2- Nikookar R, Ghaffari S, Akbari Kamrani AA, Sahaf R, Moghadam M, Ghadimi MR. Assessing the Duration of Unnecessary Hospitalization and Expenses in Older Individuals Suffering from Cerebral Vascular Accident in the Chronic Care Unit. Salmand: Iranian Journal of Ageing 2015; 10(2): 180-7. [Persian]
3- Anagnostou D, Theodorakis N, Hitas C, Kreouzi M, Pantos I, Vamvakou G, Nikolaou M. Sarcopenia and Cardiogeriatrics: The Links between Skeletal Muscle Decline and Cardiovascular Aging. Nutrients 2025; 17(2): 282.
4- Cruz-Jentoft AJ, Sayer AA. Sarcopenia. Lancet 2019; 393(10191): 2636-46.
5- Dodds RM, Syddall HE, Cooper R, Kuh D, Cooper C, Sayer AA. Global Variation in Grip Strength: A Systematic Review and Meta-Analysis of Normative Data. Age Ageing 2016; 45(2): 209-16.
6- Frontera WR, Ochala J. Skeletal Muscle: A Brief Review of Structure and Function. Calcif Tissue Int 2015; 96(3): 183-95.
7- Mukund K, Subramaniam S. Skeletal Muscle: A Review of Molecular Structure and Function, In Health and Disease. Wiley Interdiscip Rev Syst Biol Med 2020; 12(1): e1462.
8- Madani F, Kazem Zadeh YA. The Effect of 8 Weeks of Aerobic Exercise Along with Nano-Curcumin on the Expression of Atrogin-1 and Murf-1 Genes in Soleus Muscle of Male Wistar Rat: a Short Report. J Rafsanjan Uni Med Sci 2023; 22(7): 769-76.
9- Jeong DH, Kim MJ, Park CH. Effect of Combining Exercise with Adipose-Derived Mesenchymal Stem Cells in Muscle Atrophy Model of Sarcopenia. International J Molecular Sci 2025; 26(2): 451.
10- McGee SL, Hargreaves M. Exercise Adaptations: Molecular Mechanisms and Potential Targets for Therapeutic Benefit. Nat Rev Endocrinol 2020; 16(9): 495-505.
11- Khalafi M, Sakhaei MH, Rosenkranz SK, Symonds ME. Impact of Concurrent Training Versus Aerobic or Resistance Training on Cardiorespiratory Fitness and Muscular Strength in Middle-Aged to Older Adults: A Systematic Review and Meta-Analysis. Physiol Behav 2022; 254: 113888.
12- Methenitis S. A Brief Review on Concurrent Training: From Laboratory to the Field. Sports 2018; 6(4): 127.
13- Huo F, Liu Q, Liu H. Contribution of Muscle Satellite Cells to Sarcopenia. Front Physiol 2022; 13: 892749.
14- Taipale SR, Häkkinen K. Acute Hormonal and Force Responses to Combined Strength and Endurance Loadings in Men and Women: The “Order Effect”. PloS one 2013; 8(2): e55051.
15- Sheibani S, Daryanoosh F, Tanideh N, Rahimi M, Jamhiri I, Refahiat MA. Effect of High Intensity Interval Training and Detraining on Gene Expression of AKT/Foxo3a in Cardiac and Soleus Muscle of Male Rats. Ebnesina. 2020; 22(2): 15-23.
16- Gellhaus B, Böker KO, Schilling AF, Saul D. Therapeutic Consequences of Targeting the IGF-1/PI3K/AKT/FOXO3 Axis in Sarcopenia: A Narrative Review. Cells 2023; 12(24): 2787.
17- Furuyama T, Yamashita H, Kitayama K, Higami Y, Shimokawa I, Mori N. Effects of Aging and Caloric Restriction on the Gene Expression of Foxo1, 3, and 4 (FKHR, FKHRL1, and AFX) in the Rat Skeletal Muscles. Microscopy Research and Technique 2002; 59(4): 331-4.
18- Wang X, Wu X, Meng G, Bian S, Zhang Q, Liu L, et al. Consumption of Chilies and Sweet Peppers Is Associated with Lower Risk of Sarcopenia in Older Adults. Aging (Albany NY) 2021; 13(6): 9135.
19- Yang F, Zheng J. Understand Spiciness: Mechanism of TRPV1 Channel Activation by Capsaicin. Protein Cell 2017; 8(3): 169-77.
20- Huang KC, Chiang YF, Huang TC, Chen HY, Lin PH, Ali M, Hsia SM. Capsaicin Alleviates Cisplatin‐Induced Muscle Loss and Atrophy in Vitro and in Vivo. Cachexia Sarcopenia Muscle 2023; 14(1): 182-97.
21- Pramanik KC, Fofaria NM, Gupta P, Srivastava SK. CBP-Mediated FOXO-1 Acetylation Inhibits Pancreatic Tumor Growth by Targeting Sirt. Molecular cancer therapeutics 2014; 13(3): 687-98.
22- Wang L, Liu Y, Li S, Zha Z, Chen Y, Wang Q, et al. Capsaicin Alleviates Doxorubicin-Induced Acute Myocardial Injury by Regulating Iron Homeostasis and PI3K-Akt Signaling Pathway. Aging (Albany NY) 2023; 15(21): 11845.
23- Guler S, ZIK Β. The Effect of Capsaicin on IGF-I and IGF-IR Expression in Ovarian Granulosa Cells. Journal of the Hellenic Veterinary Medical Society 2020; 71(1): 1977-84.
24- Sun H, Wang Z, Tu B, Shao Z, Li Y, Han D, et al. Capsaicin Reduces Blood Glucose and Prevents Prostate Growth by Regulating Androgen, RAGE/IGF-1/Akt, TGF-Β/Smad Signalling Pathway and Reversing Epithelial-Mesenchymal Transition in Streptozotocin-Induced Diabetic Mice. Naunyn-Schmiedeberg's Archives of Pharmacology 2024; 397(10): 7659-71.
25- Mosqueda-Solis A, Sanchez J, Portillo MP, Palou A, Pico C. Combination of Capsaicin and Hesperidin Reduces the Effectiveness of Each Compound to Decrease the Adipocyte Size and to Induce Browning Features in Adipose Tissue of Western Diet Fed Rats. Journal of Agricultural and Food Chemistry 2018; 66(37): 9679-89.
26- Dotzert MS, McDonald MW, Murray MR, Nickels JZ, Noble EG, Melling CJ. Effect of Combined Exercise Versus Aerobic-Only Training on Skeletal Muscle Lipid Metabolism in a Rodent Model of Type 1 Diabetes. Canadian Journal of Diabetes 2018; 42(4): 404-11.
27- Høydal MA, Wisløff U, Kemi OJ, Ellingsen Ø. Running Speed and Maximal Oxygen Uptake in Rats and Mice: Practical Implications for Exercise Training. European J Prev Cardiol 2007; 14(6): 753-60.
28- Li CW, Yu K, Shyh‐Chang NG, Li GX, Jiang LJ, Yu SL, et al. Circulating Factors Associated with Sarcopenia During Ageing and after Intensive Lifestyle Intervention. Journal of Cachexia, Sarcopenia and Muscle 2019; 10(3): 586-600.
29- Schiaffino S, Mammucari C. Regulation of Skeletal Muscle Growth by the IGF1-Akt/PKB Pathway: Insights from Genetic Models. Skeletal Muscle 2011; 1: 1-4.
30- Li S, Hao L, Yu F, Li N, Deng J, Zhang J, et al. Capsaicin: A Spicy Way in Liver Disease. Frontiers in Pharmacology 2024; 15: 1451084.
31- Caprodossi S, Amantini C, Nabissi M, Morelli MB, Farfariello V, Santoni M, et al. Capsaicin Promotes a More Aggressive Gene Expression Phenotype and Invasiveness in Null-TRPV1 Urothelial Cancer Cells. Carcinogenesis 2011; 32(5): 686-94.
32- Feng L, Li B, Xi Y, Cai M, Tian Z. Aerobic Exercise and Resistance Exercise Alleviate Skeletal Muscle Atrophy through IGF-1/IGF-1R-PI3K/Akt Pathway in Mice with Myocardial Infarction. American Journal of Physiology-Cell Physiology 2022; 322(2): 164-76.
33- Borst SE, De Hoyos DV, Garzarella L, Vincent K, Pollock BH, Lowenthal DT, Pollock ML. Effects of Resistance Training on Insulin-Like Growth Factor-I and IGF Binding Proteins. Med Sci Sports Exerc 2001; 33(4): 648-53.
34- Annibalini G, Lucertini F, Agostini D, Vallorani L, Gioacchini A, Barbieri E, et al. Concurrent Aerobic and Resistance Training Has Anti‐Inflammatory Effects and Increases both Plasma and Leukocyte Levels of IGF‐1 in Late Middle‐Aged Type 2 Diabetic Patients. Oxid Med Cell Longev 2017; 2017(1): 3937842.
35- Seo DY, Hwang BG. Effects of Exercise Training on the Biochemical Pathways Associated with Sarcopenia. Physical Activity and Nutrition 2020; 24(3): 32.
36- Schiaffino S, Dyar KA, Ciciliot S, Blaauw B, Sandri M. Mechanisms Regulating Skeletal Muscle Growth and Atrophy. FEBS J 2013; 280(17): 4294-314.
37- Sasako T, Umehara T, Soeda K, Kaneko K, Suzuki M, Kobayashi N, et al. Deletion of Skeletal Muscle Akt1/2 Causes Osteosarcopenia and Reduces Lifespan in Mice. Nature Communications 2022; 13(1): 5655.
38- Xia Z, Cholewa J, Zhao Y, Shang HY, Yang YQ, Araújo Pessôa K, et al. Targeting Inflammation and Downstream Protein Metabolism in Sarcopenia: A Brief Up-Dated Description of Concurrent Exercise and Leucine-Based Multimodal Intervention. Frontiers in physiology 2017; 8: 434.
39- Sanchez AM. Foxo Transcription Factors and Endurance Training: A Role for Foxo1 and Foxo3 in Exercise-Induced Angiogenesis. J physiol 2015; 593(Pt 2): 363.
40- Vahidi Ferdowsi P, Ahuja KD, Beckett JM, Myers S. TRPV1 Activation by Capsaicin Mediates Glucose Oxidation and ATP Production Independent of Insulin Signalling in Mouse Skeletal Muscle Cells. Cells 2021; 10(6): 1560.
41- Hu Q, Liu H, Wang R, Yao L, Chen S, Wang Y, Lv C. Capsaicin Attenuates LPS-Induced Acute Lung Injury by Inhibiting Inflammation and Autophagy Through Regulation of the TRPV1/AKT Pathway. J Inflamm Res 2024; 17: 153-70.
42- Ito N, Ruegg UT, Kudo A, Miyagoe-Suzuki Y, Takeda SI. Activation of Calcium Signaling Through Trpv1 by Nnos and Peroxynitrite as a Key Trigger of Skeletal Muscle Hypertrophy. Nature Medicine 2013; 19(1): 101-6.
1- Franceschi C, Garagnani P, Morsiani C, Conte M, Santoro A, Grignolio A, et al. The Continuum of Aging and Age-Related Diseases: Common Mechanisms but Different Rates. Front Med (Lausanne) 2018; 5: 61.
2- Nikookar R, Ghaffari S, Akbari Kamrani AA, Sahaf R, Moghadam M, Ghadimi MR. Assessing the Duration of Unnecessary Hospitalization and Expenses in Older Individuals Suffering from Cerebral Vascular Accident in the Chronic Care Unit. Salmand: Iranian Journal of Ageing 2015; 10(2): 180-7. [Persian]
3- Anagnostou D, Theodorakis N, Hitas C, Kreouzi M, Pantos I, Vamvakou G, Nikolaou M. Sarcopenia and Cardiogeriatrics: The Links between Skeletal Muscle Decline and Cardiovascular Aging. Nutrients 2025; 17(2): 282.
4- Cruz-Jentoft AJ, Sayer AA. Sarcopenia. Lancet 2019; 393(10191): 2636-46.
5- Dodds RM, Syddall HE, Cooper R, Kuh D, Cooper C, Sayer AA. Global Variation in Grip Strength: A Systematic Review and Meta-Analysis of Normative Data. Age Ageing 2016; 45(2): 209-16.
6- Frontera WR, Ochala J. Skeletal Muscle: A Brief Review of Structure and Function. Calcif Tissue Int 2015; 96(3): 183-95.
7- Mukund K, Subramaniam S. Skeletal Muscle: A Review of Molecular Structure and Function, In Health and Disease. Wiley Interdiscip Rev Syst Biol Med 2020; 12(1): e1462.
8- Madani F, Kazem Zadeh YA. The Effect of 8 Weeks of Aerobic Exercise Along with Nano-Curcumin on the Expression of Atrogin-1 and Murf-1 Genes in Soleus Muscle of Male Wistar Rat: a Short Report. J Rafsanjan Uni Med Sci 2023; 22(7): 769-76.
9- Jeong DH, Kim MJ, Park CH. Effect of Combining Exercise with Adipose-Derived Mesenchymal Stem Cells in Muscle Atrophy Model of Sarcopenia. International J Molecular Sci 2025; 26(2): 451.
10- McGee SL, Hargreaves M. Exercise Adaptations: Molecular Mechanisms and Potential Targets for Therapeutic Benefit. Nat Rev Endocrinol 2020; 16(9): 495-505.
11- Khalafi M, Sakhaei MH, Rosenkranz SK, Symonds ME. Impact of Concurrent Training Versus Aerobic or Resistance Training on Cardiorespiratory Fitness and Muscular Strength in Middle-Aged to Older Adults: A Systematic Review and Meta-Analysis. Physiol Behav 2022; 254: 113888.
12- Methenitis S. A Brief Review on Concurrent Training: From Laboratory to the Field. Sports 2018; 6(4): 127.
13- Huo F, Liu Q, Liu H. Contribution of Muscle Satellite Cells to Sarcopenia. Front Physiol 2022; 13: 892749.
14- Taipale SR, Häkkinen K. Acute Hormonal and Force Responses to Combined Strength and Endurance Loadings in Men and Women: The “Order Effect”. PloS one 2013; 8(2): e55051.
15- Sheibani S, Daryanoosh F, Tanideh N, Rahimi M, Jamhiri I, Refahiat MA. Effect of High Intensity Interval Training and Detraining on Gene Expression of AKT/Foxo3a in Cardiac and Soleus Muscle of Male Rats. Ebnesina. 2020; 22(2): 15-23.
16- Gellhaus B, Böker KO, Schilling AF, Saul D. Therapeutic Consequences of Targeting the IGF-1/PI3K/AKT/FOXO3 Axis in Sarcopenia: A Narrative Review. Cells 2023; 12(24): 2787.
17- Furuyama T, Yamashita H, Kitayama K, Higami Y, Shimokawa I, Mori N. Effects of Aging and Caloric Restriction on the Gene Expression of Foxo1, 3, and 4 (FKHR, FKHRL1, and AFX) in the Rat Skeletal Muscles. Microscopy Research and Technique 2002; 59(4): 331-4.
18- Wang X, Wu X, Meng G, Bian S, Zhang Q, Liu L, et al. Consumption of Chilies and Sweet Peppers Is Associated with Lower Risk of Sarcopenia in Older Adults. Aging (Albany NY) 2021; 13(6): 9135.
19- Yang F, Zheng J. Understand Spiciness: Mechanism of TRPV1 Channel Activation by Capsaicin. Protein Cell 2017; 8(3): 169-77.
20- Huang KC, Chiang YF, Huang TC, Chen HY, Lin PH, Ali M, Hsia SM. Capsaicin Alleviates Cisplatin‐Induced Muscle Loss and Atrophy in Vitro and in Vivo. Cachexia Sarcopenia Muscle 2023; 14(1): 182-97.
21- Pramanik KC, Fofaria NM, Gupta P, Srivastava SK. CBP-Mediated FOXO-1 Acetylation Inhibits Pancreatic Tumor Growth by Targeting Sirt. Molecular cancer therapeutics 2014; 13(3): 687-98.
22- Wang L, Liu Y, Li S, Zha Z, Chen Y, Wang Q, et al. Capsaicin Alleviates Doxorubicin-Induced Acute Myocardial Injury by Regulating Iron Homeostasis and PI3K-Akt Signaling Pathway. Aging (Albany NY) 2023; 15(21): 11845.
23- Guler S, ZIK Β. The Effect of Capsaicin on IGF-I and IGF-IR Expression in Ovarian Granulosa Cells. Journal of the Hellenic Veterinary Medical Society 2020; 71(1): 1977-84.
24- Sun H, Wang Z, Tu B, Shao Z, Li Y, Han D, et al. Capsaicin Reduces Blood Glucose and Prevents Prostate Growth by Regulating Androgen, RAGE/IGF-1/Akt, TGF-Β/Smad Signalling Pathway and Reversing Epithelial-Mesenchymal Transition in Streptozotocin-Induced Diabetic Mice. Naunyn-Schmiedeberg's Archives of Pharmacology 2024; 397(10): 7659-71.
25- Mosqueda-Solis A, Sanchez J, Portillo MP, Palou A, Pico C. Combination of Capsaicin and Hesperidin Reduces the Effectiveness of Each Compound to Decrease the Adipocyte Size and to Induce Browning Features in Adipose Tissue of Western Diet Fed Rats. Journal of Agricultural and Food Chemistry 2018; 66(37): 9679-89.
26- Dotzert MS, McDonald MW, Murray MR, Nickels JZ, Noble EG, Melling CJ. Effect of Combined Exercise Versus Aerobic-Only Training on Skeletal Muscle Lipid Metabolism in a Rodent Model of Type 1 Diabetes. Canadian Journal of Diabetes 2018; 42(4): 404-11.
27- Høydal MA, Wisløff U, Kemi OJ, Ellingsen Ø. Running Speed and Maximal Oxygen Uptake in Rats and Mice: Practical Implications for Exercise Training. European J Prev Cardiol 2007; 14(6): 753-60.
28- Li CW, Yu K, Shyh‐Chang NG, Li GX, Jiang LJ, Yu SL, et al. Circulating Factors Associated with Sarcopenia During Ageing and after Intensive Lifestyle Intervention. Journal of Cachexia, Sarcopenia and Muscle 2019; 10(3): 586-600.
29- Schiaffino S, Mammucari C. Regulation of Skeletal Muscle Growth by the IGF1-Akt/PKB Pathway: Insights from Genetic Models. Skeletal Muscle 2011; 1: 1-4.
30- Li S, Hao L, Yu F, Li N, Deng J, Zhang J, et al. Capsaicin: A Spicy Way in Liver Disease. Frontiers in Pharmacology 2024; 15: 1451084.
31- Caprodossi S, Amantini C, Nabissi M, Morelli MB, Farfariello V, Santoni M, et al. Capsaicin Promotes a More Aggressive Gene Expression Phenotype and Invasiveness in Null-TRPV1 Urothelial Cancer Cells. Carcinogenesis 2011; 32(5): 686-94.
32- Feng L, Li B, Xi Y, Cai M, Tian Z. Aerobic Exercise and Resistance Exercise Alleviate Skeletal Muscle Atrophy through IGF-1/IGF-1R-PI3K/Akt Pathway in Mice with Myocardial Infarction. American Journal of Physiology-Cell Physiology 2022; 322(2): 164-76.
33- Borst SE, De Hoyos DV, Garzarella L, Vincent K, Pollock BH, Lowenthal DT, Pollock ML. Effects of Resistance Training on Insulin-Like Growth Factor-I and IGF Binding Proteins. Med Sci Sports Exerc 2001; 33(4): 648-53.
34- Annibalini G, Lucertini F, Agostini D, Vallorani L, Gioacchini A, Barbieri E, et al. Concurrent Aerobic and Resistance Training Has Anti‐Inflammatory Effects and Increases both Plasma and Leukocyte Levels of IGF‐1 in Late Middle‐Aged Type 2 Diabetic Patients. Oxid Med Cell Longev 2017; 2017(1): 3937842.
35- Seo DY, Hwang BG. Effects of Exercise Training on the Biochemical Pathways Associated with Sarcopenia. Physical Activity and Nutrition 2020; 24(3): 32.
36- Schiaffino S, Dyar KA, Ciciliot S, Blaauw B, Sandri M. Mechanisms Regulating Skeletal Muscle Growth and Atrophy. FEBS J 2013; 280(17): 4294-314.
37- Sasako T, Umehara T, Soeda K, Kaneko K, Suzuki M, Kobayashi N, et al. Deletion of Skeletal Muscle Akt1/2 Causes Osteosarcopenia and Reduces Lifespan in Mice. Nature Communications 2022; 13(1): 5655.
38- Xia Z, Cholewa J, Zhao Y, Shang HY, Yang YQ, Araújo Pessôa K, et al. Targeting Inflammation and Downstream Protein Metabolism in Sarcopenia: A Brief Up-Dated Description of Concurrent Exercise and Leucine-Based Multimodal Intervention. Frontiers in physiology 2017; 8: 434.
39- Sanchez AM. Foxo Transcription Factors and Endurance Training: A Role for Foxo1 and Foxo3 in Exercise-Induced Angiogenesis. J physiol 2015; 593(Pt 2): 363.
40- Vahidi Ferdowsi P, Ahuja KD, Beckett JM, Myers S. TRPV1 Activation by Capsaicin Mediates Glucose Oxidation and ATP Production Independent of Insulin Signalling in Mouse Skeletal Muscle Cells. Cells 2021; 10(6): 1560.
41- Hu Q, Liu H, Wang R, Yao L, Chen S, Wang Y, Lv C. Capsaicin Attenuates LPS-Induced Acute Lung Injury by Inhibiting Inflammation and Autophagy Through Regulation of the TRPV1/AKT Pathway. J Inflamm Res 2024; 17: 153-70.
42- Ito N, Ruegg UT, Kudo A, Miyagoe-Suzuki Y, Takeda SI. Activation of Calcium Signaling Through Trpv1 by Nnos and Peroxynitrite as a Key Trigger of Skeletal Muscle Hypertrophy. Nature Medicine 2013; 19(1): 101-6.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/9/17 | پذیرش: 1403/11/2 | انتشار: 1404/3/15
دریافت: 1403/9/17 | پذیرش: 1403/11/2 | انتشار: 1404/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







