دوره 33، شماره 3 - ( خرداد 1404 )
جلد 33 شماره 3 صفحات 8819-8795 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Bagheri A M, Raeisi Estabragh M A, Ohadi M. Investigating the Potential Use of Glycolipid Surfactants Extracted from Microbes as Anti-Aging Compounds in Cosmetic Formulations. JSSU 2025; 33 (3) :8795-8819
URL: http://jssu.ssu.ac.ir/article-1-6340-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6340-fa.html
باقری امیرمحمد، رئیسی استبرق محمدامین، اوحدی ماندانا. بررسی کاربرد بالقوه سورفکتانتهای گلیکولیپیدی استخراج شده از میکروبها بهعنوان ترکیبات ضد پیر پوستی در فرمولاسیونهای آرایشی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (3) :8795-8819
متن کامل [PDF 1521 kb]
(211 دریافت)
| چکیده (HTML) (707 مشاهده)
متن کامل: (190 مشاهده)
مقدمه
به عنوان بیرونیترین عضو بدن، پوست در حقیقت یک سد محافظتی است که محیط درونی بدن انسان را از محیط خارج جدا کرده و ما را در برابر آسیبهای ناشی از اشعه ماوراء بنفش Ultraviolet radiation ، از دست دادن مایعات حیاتی و نیز نفوذ میکروارگانیسمها مصون نگه میدارد. به علاوه، پوست نقش مهمی در آرایش ظاهری و حفظ مولفههای مربوط به زیبایی شناختی بدن انسان دارد (1،2). پوست به ترتیب از خارج به داخل از سه لایه اصلی به نامهای: اپیدرم Epidermis، درم Dermis و هیپودرم Hypodermis تشکیل میشود. اپیدرم حاوی سلولهایی است که وظیفه ساخت سلولهای لایه شاخی را برعهده دارند. به علاوه، سلولهای این لایه مسئول ساخت ملانوسیتها و مقاومت در برابر اشعه ماوراء بنفش نیز میباشند (3،4). درم حاوی سلولهای فیبروبلاست است که وظیفه سنتز و ترشح پروتئینهای ماتریکس خارج سلولی (مانند کلاژن و الاستین) را بر عهده دارد و خاصیت ارتجاعی و استحکام پوست را سبب میشوند. هیپودرم بافت چربی است که بلافاصله در زیر لایه درم قرار داشته و پوست را به ماهیچهها و استخوانها متصل میکند (5). از نظر بیولوژیکی، پیر پوستی با تجمیع تدریجی نقصهای مربوط به پروتئینهای ساختاری، اختلال در نوسازی بافتها و نیز از دست دادن تدریجی خاصیت ارتجاعی پوست مشخص میشود (6). علاوه بر افزایش سن، تماس مستقیم با اشعه ماوراء بنفش و مواد شیمیایی نیز از جمله مهمترین عوامل تسریع کننده روند پیری پوست بهشمار میآیند (7). پیر پوستی اساساً با ایجاد چین و چروک، کاهش انعطاف پذیری و در نهایت نقصان عملکرد محافظتی و اختلال در جنبه زیبایی شناختی آن همراه است. از اینرو، با توجه به پیشرفت علم و فناوری و نیز ارتقای استانداردهای سطح زندگی ارائه راهکارهای مناسب برای کنترل هرچه بهتر پیر پوستی بیش از پیش مورد توجه قرار گرفته است (8). تا به امروز محصولات مراقبتی بسیاری برای محافظت از پوست، بهبود ظاهر آن و کاهش روند پیری پوست با استفاده از منابع گوناگون طبیعی و شیمیایی فرموله شدهاند (9،10). در این بین، سورفکتانتهای مشتق شده از میکروبها Microbial surfactantsاز جمله محصولات طبیعی هستند که ادعا میشود از طریق مکانیسمهای مختلف از جمله تحریک رشد فیبروبلاستها، ظرفیت آنتیاکسیدان بالا و خواص ضدالتهابی مناسب، میتوانند اثرات ضد پیر پوستی مشخصی را سبب شوند (12,11). در این مطالعه قصد داریم تا به بررسی تأثیرات بالقوه سورفکتانتهای گلیکوپپتیدی مشتق شده از میکروبها به عنوان ترکیبات ضد پیری پوست بپردازیم.
روش بررسی
در این مطالعه که از نوع مطالعات مروری است جستوجوی مقالات از ابتدای سال 2000 تا ماه اکتبر 2024 صورت گرفت. برای این مهم، ابتدا در پایگاه های اطلاعاتی معبتر Scopus, ISC ،PubMed و Google scholar با استفاده از کلید واژههایی همچون: پوست، پیر پوستی، مکانیسم ایجاد پیر پوستی، سورفکتانتهای مشتق شده از میکروبها، سورفکتانتهای گلیکوپپتیدی Glycopeptide surfactants ، فرمولاسیونهای آرایشی، محصولات مراقبت از پوست و کاربردهای بالقوه جستوجو انجام شد. سپس، با توجه به میزان ارتباط محتوایی مقالات یافت شده به هدف مطالعه کنونی، مشخصات مجله و سال انتشار، اعتبار علمی آنها با استفاده از سامانه منبع یاب وزرات بهداشت مورد بررسی قرار گرفته و در نهایت تعداد 106 مقاله مرتبط بر اساس معیارهای ورود و خروج جهت انجام بررسیهای بیشتر انتخاب شدند. ارتباط حداقلی با موضوع پژوهش، انتشار پیش از سال 2000، انتشار مطالعه به زبانی به جز انگلیسی، تکراری بودن و نیز موجود نبودن متن کامل سبب خروج مقالات از روند بررسی گردید تا در نهایت تعداد 78 مقاله جهت نوشتن متن نهایی انتخاب شدند. پس از انجام غربالگری اولیه و حذف مقالات تکراری، موارد یافت مورد بررسی مجدد قرار گرفته و فرآیند نوشتن متن مقاله شده با مشاوره همکاران آغاز گردید. در نهایت، مقاله مروری نوشته شده و تصحیحات لازم بر روی آن صورت گرفت.
نتایج
پیر شدن فرآیندی پیچیده است که طیفی از عوامل ژنتیکی و محیطی در آن دخیل بوده و نقش مهمی در ایجاد بسیاری از اختلالات مرتبط با سلامتی انسان دارد. اگرچه با افزایش سن فرآیندهای زیستی گوناگونی به صورت پیشرونده در اندامها و بافتهای بدن مختلف آشکار میشود اما اساساً واضح نرین شواهد این فرآیند در پوست نمایان می¬شود چراکه قسمتهای داخلی از نظر بصری مشخص نیستند (13،14). قرار گیری بیش از حد در معرض نور و اشعههای یونیزان در کنار آلودگی با مواد شیمیایی یا سموم و تولید افسار گسیختهی گونههای فعال اکسیژن از جمله مهم¬ترین عوامل محیطی آسیب¬زا هستند که می¬توانند منجر به تغییرات فیزیولوژیکی دائمی از جمله تشکیل رنگدانه و چین و چروک در پوست شود (شکل 1) (15). از این رو، انتخاب روشی صحیح جهت مبارزه هرچه بهتر با پیر پوستی از اهمیت ویژه¬ای برخوردار است. در این بین، توجه کلی به وضعیت سلامت، نوع پوست، سبک زندگی فردی و سن شخصی باید قبل از انتخاب روش مبارزه مورد¬توجه قرارگیرد. امروزه، از روشهای درمانی تهاجمی Invasive همچون استفاده از لایهبردارهای شیمیایی، اشعه لیزر، رادیوفرکوئنسی Radiofrequencyو افزایش مصنوعی ضخامت پوست از طریق تزریق مستقیم چربی به عنوان متداول¬ترین روشهای درمان پیر پوستی یاد میشود. در سالهای اخیر، استفاده از راهکارهای غیرتهاجمی برای سرعت بخشیدن به فرآیندهای درون سلولی به منظور تسریع رشد و نمو سلولهای پوستی بر پایه این باور که " افزایش سرعت جایگزینی سلولهای قدیمی با جدید ظاهر پوست را بهبود میبخشد" بیش از پیش مورد توحه قرار گرفته است (16،17). به علاوه، تنظیم تولید الیاف کلاژن و الاستین به عنوان پروتوئینهای ساختاری پوست که نقش تعیین کنندهای در حفظ سلامت و جوانی پوست دارند نیز بهطور گسترده مورد بررسی قرار گرفته است. در اینباره مشخص شده است که تجویز موضعی آنتیاکسیدانها با از بین بردن رادیکالهای آزاد و خنثی کردن واکنشهای التهابی از طریق مکانیسمهای متفاوت میتوانند از تخریب الیاف کلاژن و ایجاد چین و چروکها جلوگیری کنند. برای مثال، عوامل آنتی اکسیدانی میتوانند از طریق مهار تشکیل یونهای فلزی بازسازی غشای سلولی اکسید شده را افزایش داده و نرخ زنده ماندن سلولی را بهبود ببخشند (18). به هر روی، اصلاح سبک زندگی از طریق ترک سیگار، کاهش استرس، تصحیح رژیم غذایی و افزایش فعالیت بدنی در کنار مراقبت روزانه از پوست و دوری حداکثری از اشعه ماورای بنفش خورشیدی همگی در کند کردن روند پیرپوستی ضروری هستند (16،17،19).
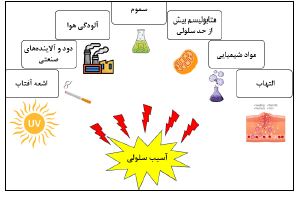
شکل 1: برخی از مهمترین عوامل خارجی پیر پوستی.
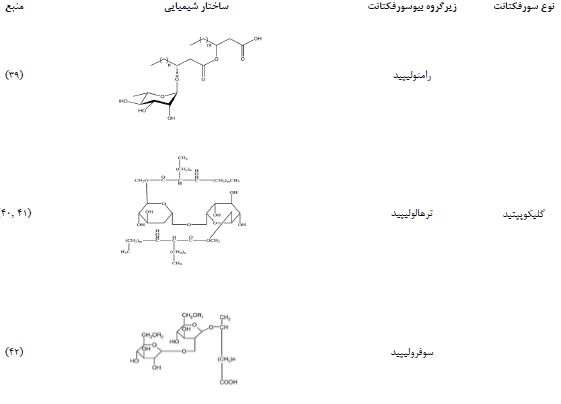
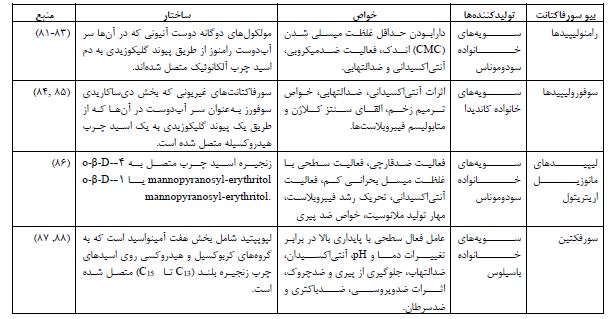
1. انواع سورفکتانتهای میکروبی: سورفاکتانتهای میکروبی را میتوان بر اساس جرم مولکولی به بیوسورفکتانت با وزن مولکولی کم (شامل اسیدهای چرب، فسفولیپیدها، لیپیدهای خنثی، گلیکولیپیدها، لیپوپپتیدها و لیپوپروتئینها) و بیوسورفکتانت با وزن مولکولی بالا (شامل بیوسورفکتانتهای پلیمری) طبقهبندی کرد (22-20). در جدول 1 ساختار دستههای اصلی سورفکتانت های میکروبی ارائه شده است.
1.1 گلیکولیپیدها: گلیکولیپیدها یک کلاس شناختهشده از بیوسورفکتانتها هستند که از ترکیبات کربوهیدرات و اسیدهای چرب تشکیل شدهاند. این دو جزء از طریق پیوندهای اتر یا استر به هم متصل میشوند. گلیکولیپیدها شامل کربوهیدراتهایی مانند رامنوز، سوفرز یا ترهالوز در گروه سر هیدروفیلیک خود هستند. باکتری سودوموناس آئروژینوزا Pseudomonas aeruginosa و مخمر کاندیدا بومبیکولا Candida bombicola (که اکنون بهعنوان Starmerella bombicola شناخته میشود) از شناختهشدهترین سویهها برای تولید بیوسورفکتانتهای گلیکولیپیدی هستند. برخی از گلیکولیپیدهای شناساییشده معمول شامل رامنولیپیدها Rhamnolipids، ترهالولیپیدها Trehalolipids و سوفرولیپیدها Sophorolipids هستند (23).
1.1.1 رامنولیپیدها: رامنولیپیدها بیوسورفکتانتهای مبتنی بر گلیکولیپید هستند که عمدتاً توسط سودوموناس آئروژینوزا تولید میشوند. این ترکیبات به دلیل فعالیت سطحی بالا، بازده تولید مناسب و سهولت کشت میکروارگانیسم تولید کننده آنها، بهطور گستردهای مورد مطالعه قرار گرفتهاند (25, 24).
1.1.2 ترهالولیپیدها: ترهالولیپیدها نوعی دیساکارید هستند که شامل ترهالوز متصل به اسیدهای میکولیک میباشند. این ترکیبات بسته به منبع ارگانیسم خود با تغییرات در تعداد اتمهای کربن و درجه اشباع در اندازه و ساختار متفاوت هستند. در محیط کشت، نشان داده شده است که آنها بهطور قابلتوجهی کشش سطحی و بینسطحی را کاهش میدهند (26). ترهالولیپیدها توسط گونههای مختلف مایکوباکتریوم و نوکاردیا تولید میشوند. بهعنوان مثال، Rhodococcus erythropolis ترهالوز دیمیکولاته را تولید میکند که جزء مهمی از دیواره سلولی در Mycobacterium tuberculosis است (27).
1.1.3 سوفرولیپیدها: سوفرولیپیدها گلیکولیپیدهای خارج سلولی هستند که از یک کربوهیدرات دیمریک (سوفرز) متصل به یک اسید چرب هیدروکسی زنجیره بلند تشکیل شدهاند. این بیوسورفکتانتها ترکیبی از حداقل شش تا نه نوع مختلف سوفرولوساید هیدروفوبیک هستند (28). نشان داده شده است که سوفرولیپیدهای خالص فعالیت سطحی بیشتری دارند، کمتر محلول در آب هستند و اثرات سیتوتوکسیک قویتری دارند. هر دو نوع لاکتونی و اسیدی سوفرولیپیدها نشان دادهاند که تنش بینسطحی را بین ن-هگزادکان و آب کاهش میدهند و ثبات قابلتوجهی در برابر تغییرات pH و دما دارند (29).
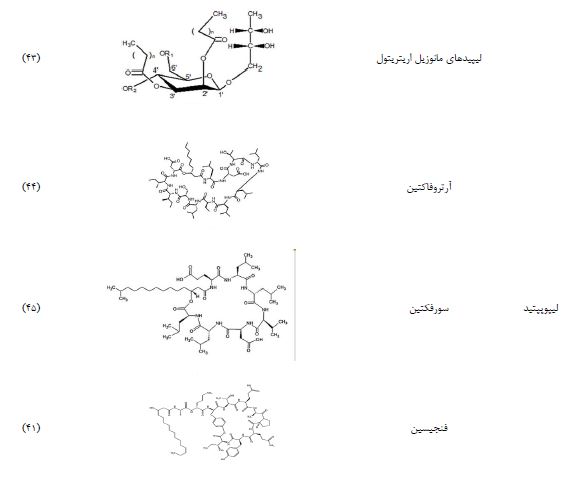
1.2 لیپوپپتیدها: لیپوپپتیدها یکی از کلاسهای مهم بیوسورفکتانتها هستند که توسط میکروارگانیسمها تولید میشوند. یکی از نمونههای قابل توجه در این دسته، سورفکتین Surfactin است که یک بیوسورفکتانت با فعالیت سطحی استثنایی میباشد. سورفکتین متعلق به گروهی از لیپوپپتیدهای حلقوی هپتاپپتیدی است که شامل اسیدهای چرب بتا-هیدروکسیل و بقایای آمینو اسید D-/L- هستند (30). سورفکتین حلقوی توسط گونههای باسیلوس تولید میشود و شامل یک ساختار حلقوی از هفت آمینواسید است که از طریق پیوند لاکتونی به زنجیرهای از اسیدهای چرب متصل شده است (31). گروه لیپوپپتیدها/لیپوپروتئینها یک کلاس متنوع از پپتیدهای فعال بیولوژیکی هستند. فنجیسین Fengycin از این دسته دارای اثرات ضد میکروبی بوده و دو بیوسورفکتانت حلقوی لیپوپپتیدی دیگر آرتروفاکتین Arthrofactin و سورفکتین هستند. سورفکتین یکی از گروههای محبوب بیوسورفکتانتهای لیپوپپتیدی است که شامل یک حلقه از هفت آمینو اسید میباشد. گونههای باسیلوس، نوکاردیا و مایکوباکتریوم از جمله تولیدکنندگان اصلی بیوسورفکتانتهای لیپوپپتیدی و لیپوپروتئینی هستند (32،33). سویههای باسیلوس سابتیلیس به تولید دامنه وسیعی از لیپوپپتیدها معروف هستند.
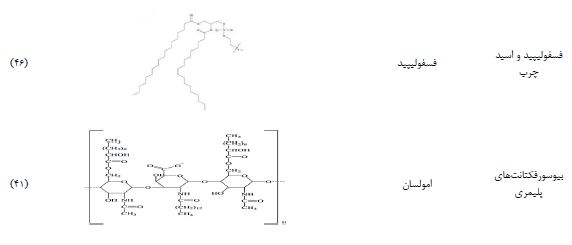
1.3 اسیدهای چرب و فسفولیپیدها: اسیدهای چرب و فسفولیپیدها دو گروه از بیوسورفکتانتها هستند که توسط تعداد زیادی از گونههای مخمر و باکتری تولید میشوند و کاربردهای وسیعی در پزشکی دارند. باکتریها و مخمرهای مختلف مقادیر قابلتوجهی از سورفاکتانتهای اسید چرب و فسفولیپیدی را در حین رشد بر روی ان-آلکانها تولید میکنند. طول زنجیره هیدروکربنی در ساختار این لیپیدهای پیچیده تأثیر دارد. همه آنها شامل اسیدهای چرب هستند که معمولاً یک گروه هیدروکسیل بر روی کربن β یا در بخشهای دیگر زنجیره دارند. یک نمونه قابلتوجه از بیوسورفکتانتهای فسفولیپیدی که به طور گستردهای شناخته شده است، توسط Corynebacterium lepusi سنتز میشود (34،35).
1.4 بیوسورفکتانتهای پلیمری: مواد پلیمری خارجسلولی نقش مهمی در تأثیرگذاری بر هر دو جنبه مثبت و منفی تجمعات میکروبی، از جمله بیوفیلمها دارند. در بیوفیلم، آنها به افزایش مقاومت در برابر اصطکاک و تغییرات در خواص سطحی، مانند هیدروفوبیسیته، زبری و رنگ کمک میکنند (36،37). علاوه بر این، مواد پلیمری خارجسلولی کاربردهای مختلف بیوتکنولوژیکی دارند و از آنها در تنظیم ویسکوزیته در غذاها، رنگها، گلولای حفاری نفت و به دلیل خواص مرطوبکنندگی در لوازم آرایشی و داروسازی استفاده میشود. برخی از معروفترین بیوسورفکتانتهای پلیمری شامل امولسان، لیپوزان، مانوپروتئین و سایر کمپلکسهای پلیساکارید-پروتئینی هستند (38).
جدول 1: ساختار شیمیایی دستههای اصلی سورفکتانتهای میکروبی
2. سورفاکتانتهای میکروبی و مکانیسمهای ضد پیر پوستی آنها: سورفکتانتها مولکولهای دوگانهدوستی هستند که از یک سر آبدوست و یک دم آبگریز تشکیلشده و با کاهش کشش سطحی تشکیل مخلوطهای همگن از فازهای دارای قطبیتهای متفاوت تسهیل میکنند (48،47). از میان انواع متفاوت، سورفاکتانتهای مشتق شده از میکروبها (سورفاکتانتهای میکروبی) به عنوان یک کلاس نوظهور از سورفکتانتها که میتوانند پس از ساخته شدن روی سطوح سلولهای میکروبی قرار گیرند یا به فضای خارج سلولی ترشح شوند، به دلیل کاربردهای بالقوه علمی و صنعتی ویژه مورد توجه قرار گرفتهاند (51-49). افزایش گزارشات پیرامون اثرات نامطلوب و عوارض جانبی (مانند تحریک پوست) توسط سورفکتانتهای شیمیایی، محققان را به ارائه جایگزین های کمتر تهاجمی و در عین حال کارآمد برای جایگزینی سورفاکتانتهای شیمیایی در فرمولاسیونهای آرایشی و بهداشتی تشویق کرده است. به طور کلی، سورفکتانتهای شیمیایی، ترکیبات غیر زیست تجزیهپذیری هستند که از منابع نفتی بهدست می¬آیند. با توجه به اینکه آنها می توانند برای طولانی مدت در بدن باقی مانده و در نتیجه منجر به سمیت شوند، تجمع این مولکولها در بافتهای بدن به عنوان یک مسئله چالشبرانگیز در استفادههای مزمن در نظر گرفته میشود. برخی از مطالعات نشان دادهاند که استفاده از سورفکتانتهای مصنوعی میتواند با سمیتهای بافتی، اختلالات انعقاد خون و همولیز گلبولهای قرمز انسان و همچنین عوارض پوستی ناخوشایند، از جمله تحریک، واکنشهای آلرژیک، و تضعیف عملکرد محافظتی پوست همراه باشد (12،52،53). تا سال 2020، بازار مالی بیوسورفکتانتها تقریباً 4 درصد از کل تجارت سورفکتانتها در جهان را شامل میشد که به دلیل علاقهمندی بسیاری از صنایع به استفاده از مواد طبیعی این سهم در حال افزایش است (54). سورفکتانتهای شیمیایی میتوانند با لیپیدهای بین سلولی برهمکنش داشته باشند و با تضعیف عملکرد این اجزای ساختاری، نفوذ مواد مختلف به لایههای درونی اپیدرم را تسهیلکرده و منجر به از دست دادن بیش از حد آب میانبافتی شود. در مقابل، سورفاکتانتهای میکروبی اساساً فاقد اثرات زیست محیطی مخرب بوده، سازگاری زیستی بالایی را از خود نشان داده و فرآیند تجزیه زیستی آنها نیز در مقایسه با سورفکتانت های مصنوعی بهطور قابلتوجهی آسانتر است (55). از اینرو، دانشمندان از سورفاکتانتهای میکروبی به عنوان جایگزینهایی سازگارتر و مناسبتری برای کاربردهای صنعتی و آرایشی برای همتایان شیمیایی یاد میکنند (56،57). دراین بین، از سورفکتانتهای گلیکولیپیدی به عنوان یکی از پراستنادترین و مورد مطالعهترین انواع سورفاکتانتهای میکروبی در زمینه آرایشی یاد میشود. این مولکول های طبیعی دوگانه دوست میتوانند ویژگیهای بیولوژیکی متفاوتی را از طریق مکانیسمهای مختلف سبب شوند. از جمله محصولات مراقبت از پوست حاوی بیوسورفکتانتهایی گلیکولیپیدی با منشاء میکروبی در بازارهای جهانی میتوان به شوینده بدن SopholianceTM S (فرمولاسیون حاوی گلیکولیپید sophorolipid) و همچنین شویندهی صورت Cryosmetics®(یک فرمولاسیون محتوی گلیکولیپید rhamnolipid) اشاره کرد (58). در محیطهای آبی و از طریق بر همکنشهای خود به خودی بین قسمتهای آبگریز، بیوسورفکتانتها میتوانند در غلظتهای بالاتر از Critical micelle concentration CMC (حداقل غلظت میسلی شدن) بهصورت ساختارهای میسلی یا وزیکولهای دولایه سرهمبندی شده و با تشکیل مجموعههای کروی شکلی مواد مختلف را درون خود محصور کنند (شکل2). بهاینترتیب، ترکیبات بارگیری شده از گزند تخریب توسط محیطهای خشن محافظت شده و ورود آنها به درون سلولها را تسهیل مییابد (59).
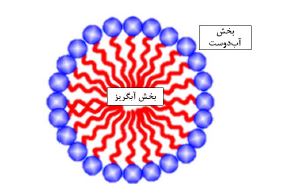
شکل2: آرایش عمومی سورفاکتانتها در بالاتر از غلظت CMC در محیطهای آبی.
3. مکانیسمهای ضد پیری سورفکتانتهای میکروبی: اساسا میکروارگانیسمها به منظور افزایش شانس بقا در برابر تهدیدهای خارجی سورفاکتانتها را تولید میکنند و از این طریق به مزیتهایی همچون افزایش تحرک برای گریز از تهدیدات، تسهیل رشد سلولی و دسترسی آسانتر به مواد مغذی در شرایط محیطی سخت مییابند. شواهد بسیاری این مهم را تایید میکنند که فرآیندهای مرتبط با پیری توسط تنشهای (استرسها) اکسیداتیو تسریع می یابد. از این رو، محافظت از سلول ها در برابر استرس مرتبط با افزایش سن و واکنش های التهابی یک اصل ضروری برای حفظ عملکرد سلولی است. در خلال متابولیسم، سلولها بهطور معمول مقادیری از رادیکالهای آزاد اکسیژن Reactive oxygen species (ROS) که بهطور بالقوه مضر هستند را تولید می کنند. آنتیاکسیدانها موادی هستند که با خنثی کردن رادیکالهای آزاد از سلولها در برابر استرسهای اکسیداتیو محافظت میکنند. این دسته از ترکیبات میتوانند تولید بیش از حد رادیکالهای آزاد در بدن را که در نتیجه وارد آمدن آسیبهای متعدد داخلی (مانند التهاب) یا خارجی (مثلا قرار گرفتن در معرض اشعه ماوراء بنفش) ممکن است رخ دهد را متوقف سازند (60). از دست رفتن تعادل بین عوامل پرواکسیدان (ایجاد کننده استرسهای اکسیداتیو) و آنتی اکسیدان ها ممکن است منجر به ایجاد تنشهای اکسیداتیو شود. در سلولهای بیولوژیکی، سطوح بالای رادیکالهای آزاد اکسیژن قویاً بر عملکرد سلولها تأثیر میگذارد و با اختلال در عملکرد سلولی میتواند منجر به پیری شود (61،62). در صنایع دارویی و آرایشی - بهداشتی، استفاده از آنتیاکسیدانها به دلیل توانایی ذاتی آنها در کاهش تنشهای اکسیداتیو و جلوگیری از واردآمدن آسیبهای سلولی در حفظ سلامت انسان ضروری تلقی میشود. تاکنون ترکیبات بسیاری با اثرات بالقوه آنتیاکسیدانی مورد بررسی قرار گرفتهاند. اگرچه سورفکتانتها عمدتاً برای کاهش کشش سطحی و تشکیل مخلوطهای همگن استفاده میشوند، اخیراً اثرات سودمند برخی از آنها بهعنوان عوامل آنتیاکسیدانی مؤثر و جایگزینهای امیدوارکننده برای همتایان شیمیایی موردمطالعه قرار گرفته است (63،64). به علاوه آنکه، گزارش اثرات مضر و سمی از آنتی اکسیدانهای مصنوعی منجر به افزایش علاقه برای جایگزین کردن آنها با آنتیاکسیدانهای طبیعی شده است (40). سورفاکتانتهای میکروبی میتوانند آسیبهای مرتبط با تولید بیش از حد رادیکالهای آزاد اکسیژن را از طریق مکانیسمهای متعدد کاهش دهند. برای مثال، وجود گروههای هیدروکسیل فراوان در ساختار مولکولی این ترکیبات سبب فراهم آمدن ظرفیت مهاری بالایی خواهد شد. در مطالعاتی بیوسورفکتانت های میکروبی دارای زنجیره اسید چرب خاصیت آنتیاکسیدانی نشان داده اند. براین اساس، افزایش طول زنجیره هیدروکربنی اسید چرب میتواند منجر به بهبود فعالیت آنتیاکسیدانی این ترکیبات شود. همچنین صرفنظر از طول زنجیره، تغییر در تعداد پیوندهای دوگانه نیز میتواند بر ظرفیت مهاری و سرکوب پراکسیداسیون لیپیدی تأثیر گذارد. بدین صورت که که افزایش پیوندهای غیر اشباع در ساختار سورفاکتانتهای میکروبی منجر به افزایش اثر محافظتی آنها در برابر رادیکالهای آزاد اکسیژن می شود. جدای از آن، وجود بخشهای گلیکوزیدی و یا اسیدهای آمینه مختلف (مانند متیونین، لوسین و والین) در ساختار سورفاکتانتهای میکروبی نیز میتواند سبب بهبود ظرفیت محافظتی آنها گردد (65). علاوه بر اثرات آنتی اکسیدان و محافظت کنندگی، گزارش شده است که سورفاکتانتهای میکروبی میتوانند مستقیماً رشد فیبروبلاستها را تحریک کرده و از این طریق سبب افزایش بیوسنتز کلاژن و تکثیر سلولهای اپیتلیال در پوست شوند (66). آن¬ها همچنین میتوانند با سرعت بخشیدن به فرآیند رگزایی و القای کراتینه شدن، بهبود زخم را تسریع کنند (67،68). گوپتا و همکاران (69) نشان دادند که استفاده از سورفاکتانتهای میکروبی به عنوان ترکیباتی با سازگاری سلولی بالا و دارای اثرات بالقوه برای تسریع در روند بهبودی زخمها میتواند منجر به بازسازی سریعتر کلاژن، افزایش تکثیر فیبروبلاستها و رشد مجدد سلولهای اپیتلیال شود. توانایی بالقوه سورفاکتانتهای میکروبی برای سرکوب التهاب و پاسخهای التهابی، مکانیسم پیشنهادی دیگری برای اثرات محافظتی آنها بر ضد پیرپوستی است (68). بر این اساس، آنها می توانند تولید سیتوکین پیش التهابی، بیان ژنهای التهابی (IFN-γ، IL-6، TNFα و IL-12) و مهاجرت IgE Immunoglobulin E را از طریق کاهش تولید پروتئینهای التهابی (مانند TLR-2) کاهش دهند. به علاوه، گزارش شده است که سورفاکتانتهای میکروبی میتوانند فسفولیپاز A2 را مهار کرده و در نتیجه تولید واسطههای التهابی مانند پروستاگلاندینها و لکوترینها را سرکوب کنند. همچنین، محققان موفق به نشان دادن اثرات بالقوه سورفاکتانتهای میکروبی در تعدیل سیستم ایمنی ذاتی و اکتسابی میزبان شدهاند (68،70). بر این اساس، MS سورفاکتانتهای میکروبی میتوانند از طریق تعدیل مسیرهای پیامرسانی مختلف، بیان MAPK Mitogen-activated protein kinases را تنظیم کرده و منجر به فعالسازی NF-Kb Nuclear Factor Kappa B شود. همچنین، میتوانند سبب القای مسیرهای ضد التهابی وابسته به هم اکسیژناز-1 Heme oxygenase-1، تنظیم بیان مولکولهای کمک محرک (CD80، CD40 و MHC II)، افزایش تولید سیتوکینها و القای آپوپتوز در سلولهای معیوب شود (73-71). در( شکل 3) شرح مختصری از مکانیسمهای اصلی پیشنهادی برای اثرات ضد پیری سورفکتانت میکروبی بیان شده است.
4. سورفکتانتهای گلیکولیپیدی مشتق شده از منابع میکروبی: مشابه با سورفاکتانتهای شیمیایی میتوان از سورفکتانتهای میکروبی نیز برای تهیه فرمولاسیونهای ارایشی استفاده کرد. برای مثال، آنها می¬توانند کشش سطحی بین مایعات با قطبیت متفاوت (آب و روغن) را کاهش داده و به عنوان عامل امولسیون کننده به تشکیل امولسیونهای پایدار کمک کنند. همچنین، آنها می توانند به عنوان حل کننده (Solubilizer)، مرطوب کننده (Humectant)، ترکننده (Wetting agent) و کف کننده (Foaming agent) استفاده شوند (20). علاوه بر آن، تاکنون کاربردهای درمانی منحصر به فردی در رابطه با اثرات سورفکتانتهای میکروبی بیولوژیکی گزارش شده است. به عنوان مثال، آنها می توانند به عنوان عوامل ضد میکروبی و ضد ویروسی، آنتی بیوفیلم، ضد تومور، ضد التهاب، آنتی اکسیدان و عوامل القا کننده رگ زایی مورد استفاده قرار گیرند و با مکانیسم های مختلف روند بهبود زخم را تسریع کنند. همچنین، مطالعات بسیاری از اثرات احتمالی آنها به عنوان ترکیباتی با ظرفیت بالقوه ضد پیرپوستی حکایت دارند (74،75). از نظر علمی، بررسی حداقل غلظت میسلی شدن، تعادل آبدوست - چربیدوستی (HLB Hydrophilic–lipophilic balance) و ماهیت یونی ذاتی سورفاکتانتها به عنوان کمیتهای ضروری جهت تهیه فرمولاسیونهای آرایشی مورد تاکید قرار گرفتهاند. از سویی، باید توجه داشت که بیوسورفکتانتهای مشتق شده از میکروارگانیسمها معمولاً دارای مقادیر CMC کمتری در مقایسه با سورفکتانتهای شیمیایی بوده و کاهش حداکثری کشش سطحی را در غلظتهای پایین تر سبب میشوند (76). (شکل 4) شرحی مختصر از کاربردهای بالقوه سورفکتانتهای میکروبی در محصولات آرایشی-بهداشتی را ارائه میدهد. ظاهر کلی پوست به هیدراتاسیون (وجود مقادیر کافی از آب در پوست)، نرمی و کنترل فرایند هایپرپیگمانتاسیون (ایجاد لکه) بستگی دارد. از این نظر، مبارزه با گونههای رادیکال آزاد و ممانعت از تخریب کلاژن بهعنوان گامهایی مهمی برای مبارزه با روند پیری شناخته میشود (77). اگرچه امروز محصولات آرایشی متعددی در بازارهای جهانی به چشم میخورد، اما مشکلات مرتبط با تجزیه زیستی Biodegradation مواد مصنوعی و ناسازگاریهای بیولوژیکی بهخصوص در صورت استفاده طولانیمدت از این مواد ممکن است منجر به پیری پوست شود (78). خواص بالقوه ضد پیری سورفکتانتهای میکروبی در درجه اول به فعالیت آنتیاکسیدانی، اعم از انتقال الکترون و مهار رادیکالهای آزاد و همچنین خواص ضدالتهابی آنها نسبت داده میشود. علاوه بر این، آنها میتوانند در فرایند بیولوژیکی مختلفی از جمله بازسازی فیبروبلاستها، تحریک سنتز کلاژن، کمک به مرطوب کردن سطح پوست و ارتباطات بین سلولی نقش داشته باشند (12،57). اعتقاد بر این است که تعدیل مسیرهای مرتبط با پیرپوستی به منظور فعالسازی فرآیندهای سلولی از جمله اتوفاژی و ترمیم DNA، از بیماریهای مزمن پوستی جلوگیری کرده و با افزایش مقاومت در برابر استرس، خواص ضد پیری بهتر به منسه ظهور می¬رساند. جدای از آن، حفظ ترکیب صحیح میکروبیوم پوست یکی دیگر از مزیتهای احتمالی استفاده از سورفکتانتهای میکروبی است که رویکرد نسبتاً جدیدی را در برابر آسیبهای پوستی نشان میدهد (77). گلیکولیپیدها مشتقات گلیکوزیلی لیپیدها Glycosyl derivatives of lipids هستند که در همه اشکال موجودات زنده، از سلولهای پروکاریوتی تا یوکاریوتی، کشف میشوند. در این ساختارهای دوگانه دوست، بخش لیپیدی آبگریز بهواسطه وجود یک پیوند گلیکوزیدی به گروه قندی (گلیکوزیلی) آبدوست متصل میشود. سورفاکتانتهای گلیکولیپیدی به دلیل عملکردهای بیولوژیکی متنوعشان اخیراً بیشازپیش توجه محققان را برای تهیه فرمولاسیونهای زیستسازگار به خود جلب کردهاند. خواص بالقوه ضد پیر پوستی رامنولیپیدها (Rhamnolipids) و سوفورولیپیدها (Sophorolipids) بهعنوان مهمترین انواع سورفکتانتهای گلیکولیپیدی مشتق شده از منابع میکروبی مورد بحث و بررسی قرار گرفت (جدول 2).
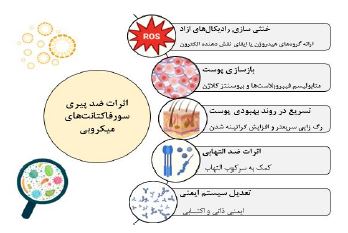
شکل 3: مکانیسمهای اصلی پیشنهادی برای اثرات ضد پیری سورفکتانت میکروبی (58).
شکل 4: برخی از کاربردهای بالقوه سورفکتانتهای میکروبی در محصولات آرایشی – بهداشتی (11،79،80)
جدول 2: خلاصهای از خواص عمومی مهمترین انواع سورفکتانتهای مشتق شده از منابع میکروبی با ظرفیت کاربرد بالقوه در محصولات آرایشی - بهداشتی.
4.1 رامنولیپیدها: رامنولیپیدها به عنوان سورفاکتانتهای گلیکولیپیدی که عمدتاً توسط میکروارگانیسم فرصتطلبی به نام سودوموناس آئروژینوزا Pseudomonas aeruginosa تولید میشود شناخته میشوند. با این حال، تولید رامنولیپیدها توسط برخی از سویه های غیر بیماریزای جنس سودوموناس مانند سودوموناس کلرورافیس Pseudomonas chlororaphis NRRL B-30761 نیز گزارش شده است (89). آسینتوباکتر کالکوستریوس Acinetobacter calcoaceticus BU-03 (82) و مارینوباکتر لیتورالیس Marinobacter litoralis MB15 (83) نمونههایی از سویههای غیر بیماریزای تولیدکننده رامنولیپیدها هستند. این گلیکولیپیدهای آنیونی به طور کلی از یک بخش رامنوز (یک یا دو مولکول) به عنوان سر گلیکوزیلی آبدوست و یک اسید آلکانوئیک (3-(هیدروکسی آلکانوئیلوکسی)) به عنوان دم اسید چرب تشکیل شدهاند. تاکنون، رامنولیپیدها به دلیل خواص منحصر به فرد خود در تعدادی فرمولاسیون آرایشی-بهداشتی، مانند پدهای آکنه، محصولات ضد شوره، دئودورانتها و خمیر دندان استفاده شده اند. از مهمترین خواص این دسته از گلیکولیپیدها میتوان به خاصیت امولسیونکنندگی بالا، فعالیت های سطحی قابل توجه، اثرات ضد میکروبی، اثرات تعدیل کنندگی سیستم ایمنی، خواص آنتی اکسیدانی، فعالیت ضد توموری در برابر سلول های سرطانی اشاره کرد. از اینرو، خواص قابلیت استفاده از این ترکیبات در محصولات ضد پیرپوستی بیش از پیش مورد توجه قرار گرفته است. خواص ضد میکروبی رامنولیپیدها را میتوان با تاثیر مستقیم این مولکولها بر غشای سلولی، اختلال در عملکرد بهینه غشاء، ایجاد منافذ غیرقابل ترمیم و در نهایت نشت محتویات درون سلولی به خارج توجیه کرد (91, 90). در پژوهشی که توسط عبداللهی و همکاران (92) صورت گرفت، خواص آنتیاکسیدانی رامنولیپیدهای مشتق شده از سودوموناس آئروژینوزا MN1 مورد بررسی قرار گرفته و ظرفیت قابلتوجه آنها برای مهار پراکسیداسیون لیپیدی نشان داده شد. بر این اساس، مشخص شد که میتوان از رامنولیپیدها به عنوان جایگزین مناسب برای آنتی¬اکسیدانهای مصنوعی بهره جست. به علاوه، مطالعات متعددی به اثرات ضد التهابی رامنولیپیدها اشاره دارند (58،93). اگرچه که با توجه به تعداد گروههای رامنوز و نوع اسید چرب بهکار رفته در ساختار، رامنولیپیدها به انواع متفاوتی تقسیم میشوند اما در بسیاری از خصوصیات فیزیکوشیمیایی از جمله اندک بودن حداقل غلظت میسلی شدن و بالا بودن مقدار HLB (حدود 9/5) اثرات مشابهای را از خود نشان میدهند. برای مثال، رامنولیپیدهای استخراج شده از سویه سودوموناس DSM 2874 Pseudomonas sp. DSM 2874 بسته به نوع مولکولها بکار رفته ساختارشان مقدار CMC را از 0/005 تا 0/2 گرم در لیتر نشان میدهد (94). یکی دیگر از موارد قابل بحث در رابطه با رامنولیپیدها، پایداری بالا و حفظ فعالیت سطحی در طیف نسبتاً وسیعی از تغییرات pH (از 5 تا 10) است. این مورد بهویژه در مقیاس صنعتی تولید فراوردههای آرایشی-بهداشتی که در آن گسترهای از محیطهای ساخت با pHهای متفاوت مورد نیاز است میتواند بسیار راهگشا باشد. از سوی دیگر، این ترکیبات بر خلاف همتایان شیمیایی و سنتزی میتواند تحت تاثیر تجزیه زیستی در شرایط هوازی یا بیهوازی به متابولیتهای ثانویه تبدیل شده و به آسانی از بدن دفع شوند (95). به علاوه، رامنولیپیدها اثرات سمی بسیار کمتری در مقایسه با سورفکتانتهای مشتق شده از مواد شیمیایی نشان دادند. اینرو، استفاده از رامنولیپیدها در در محصولات مراقبت از پوست امروزه بیش از مورد توجه قرار گرفته است. در اینباره، شرکت Piljac and Piljac یکی از اولین فرمولاسیونهای آرایشی-بهداشتی محتوی رامنولیپید را با اثرات ضد چین و چروک و ضد پیری به ثبت رساندند (96). همچنین، محققان به تازگی اثرات ترمیم کنندگی زخم رامنولیپیدها را در محدوده غلظتی از 0/001 درصد تا 5 درصد گزارش دادهاند (57).
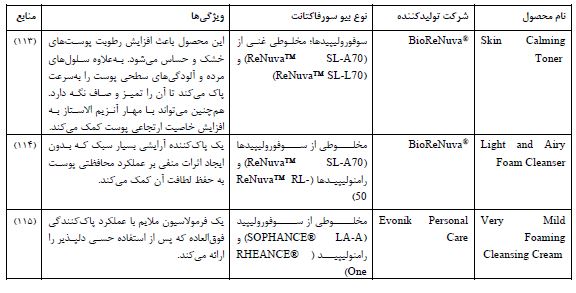
4.2 سوفورولیپیدها: سوفورولیپیدها دستهای از سوفاکتانتهای گلیکولیپیدی هستند که به فراوانی توسط سویههای خانواده کاندیدا مانند کاندیدا فلوریکولا Candida floricola و کاندیدا آپیکولا Candida apicola تولید میشوند. این گلیکولیپیدهای غیریونی از یک بخش دی ساکارید سوفورز Sophorose بهعنوان سر آبدوست که از طریق یک پیوند گلیکوزیدی به یک اسید چرب هیدروکسیله با زنجیره بلند به عنوان دم آبگریز متصل شده است، بوجود میآیند. بسته به نوع ملکولهای بهکار رفته در ساختار، مقادیر HLB این ترکیبات دوگانهدوست بین 13 تا 15 متفاوت بوده و از اینرو میتوان برای مقاصد مختلف آرایشی-بهداشتی از آنها استفاده کرد (97). این ترکیبات میتوانند در غلظت 0/1 گرم در لیتر کشش سطحی آب را از حدود 72 میلی نیوتون بر متر (mN/m) در حالت عادی (دمای 25 درجه سانتیگراد) تا حدود 35 میلی نیوتون بر متر کاهش دهند (58). همچنین، میزان CMC سوفورولیپیدهای دی استیله 18 کربنه، در حالت حلقه لاکتونی، در حدود 0/366گرم در لیتر گزارش شده است (98). اگرچه سوفورولیپیدها در مقایسه با رامنولیپیدها فعالیت امولسیون کنندگی عالی ندارند، اما میتوانند کشش سطحی را به اندازه قابلتوجهای کاهش دهند. از اینرو، استفاده همزمان از سوفورولیپیدها به همراه رامنولیپیدها و سایر ترکیبات موثره در محصولات آرایشی-بهداشتی مانند پاک کنندههای بدن، شامپو و... امری مطلوب به نظر میرسد (99). از سویی، ادعا میشود که مولکولهای فعال سطحی میتوانند به دلیل ماهیت دوگانهدوست خود به صورت سامانههای دارورسانی عمل کرده و دسترسی ترکیبات زیستی آبگریز را به قسمتهای مختلف بدن افزایش دهند (100). در این باره، پنگ و همکاران (101) قابلیت بالقوه استفاده از سوفورولیپیدها به عنوان سامانهای برای افزایش فراهمی زیستی کورکومین (یک آنتیاکسیدان بسیار کم محلول در آب که خواص موضعی بسیاری از جمله مبارزه با چین و چروک را دارد) را گزارش دادهاند. در مطالعهای دیگر، پژوهشگران ظرفیت آنتی اکسیدانی سوفورولیپیدها را مورد ارزیابی قرار داده و استفاده از آنها به عنوان نگهدارنده طبیعی Natural preservatives جهت حفظ پایداری و ارتقای کیفیت فرمولاسیونهای آرایشی-بهداشتی را پیشنهاد دادند. این ترکیبات همچنین میتوانند نرخ زنده ماندنی سلول را در برابر آسیبهای ناشی از مواجه با لیپوپلیساکارید Lipopolysaccharide باکتریهای گرم منفی (که خاصیت بیماریزایی بالایی داشته و به عنوان یک توکسین باکتریایی بهشمار میرود) ارتقا دهند (102). خواص ضدباکتریایی سوفورولیپیدها آنها را به عنوان گزینهای مناسب برای استفاده در فرمولاسیونهای ضد شوره و آکنه مطرح می¬کند (103،104). علاوه بر این، مشخص شده¬است که سوفورولیپیدها می¬تواند سنتز لپتین را در سلولهای چربی تحریک کرده و اثرات مثبت برای درمان سلولیت داشته باشد (105). از دیگر اثرات سودمند استفاده از سوفورولیپیدها در محصولات آرایشی ضد پیرپوستی می¬توان به اثرات آنتی اکسیدانی بالا و پاکسازی رادیکالهای آزاد اکسیژن، تحریک سنتز کلاژن و رشد مجدد فیبروبلاستها اشاره کرد (57). همچنین، گزارش شده است که سوفورولیپیدها می¬توانند از طریق مکانیسمهای مختلف (اختلال در عملکرد غشاء سلولی، القای آپوپتوز و تعدیل مسیرهای میتوکندریایی) علیه سلولهای سرطانی فعالیت کنند (104،106). تولید سوفورولیپیدها توسط مخمرهای غیر بیماریزا سبب شده تا عموماً آنها به عنوان ترکیباتی که سمیت کمی دارند یاد شود. در این¬باره، پژوهشگران با مطالعه اثرات سمی سوفورولیپیدها برروی کراتینوسیتهای انسانی و مقایسه آن با سورفکتانت های صناعی این گزاره را تصدیق کردهاند (107). در مطالعهای دیگر، میزان تجزیه زیستی سوفورولیپیدهای مشتق شده از استارمرلا بومبیکولا Starmerella bombicola ATCC 22214 مورد ارزیابی قرار گرفت و بر این اساس مشخص که این ترکیبات به راحتی زیست تخریب¬پذیر بوده و سمیت کمی دارند (108). یکی از مهم ترین چالشهای استفاده از سوفورولیپیدها در فرمولاسیون های آرایشی، حلالیت ضعیف آنها در شرایط pH اسیدی قلمداد میشود؛ چراکه با توجه به pH نسبتاً اسیدی پوست، بسیاری از فرمولاسیون¬های آرایشی برای سازگاری بهتر با پوست در شرایط اسیدی تهیه می شوند (109). مثالهایی از محصولات تجاریسازی شده محتوی سورفکتانتهای گلیکولیپیدی با منشاء میکروبی با خواص بالقوه مناسب برای مبارزه با مشکلات ناشی از پیرپوستی و افزایش سن در جدول 3 ارائه شده است.
5. سورفکتین: سورفکتین یک بیو سورفاکتانت نوع لیپوپپتید است که از باکتریهای گرم مثبت، بهویژه از جنس باسیلوس، مانند باسیلوس سابتیلیس، استخراج میشود. کاربردهای تجاری این ترکیب به دامنه وسیعی از استفادههای دارویی تا محیط زیستی اشاره دارد. این عامل آمفیفیلیک به دلیل پایداری بالای آن در برابر دامنه وسیعی از دما و شرایط تغییر pH بهعنوان یکی از پرکاربردترین سورفاکتانتهای با منبع میکروبی در فرمولاسیونهای آرایشی شناخته میشود (86).
5.1 کاربردها در صنعت آرایشی و بهداشتی
نمونههایی از کاربرد تجاری سورفکتین در محصولات آرایشی و بهداشتی عبارتاند از:
Eco Tan® Face Tan Water:
یک فرمولاسیون آب برنزه کننده
Oribe Resilience Shampoo:
یک پاککننده فوق مغذی برای موهای ضعیف و شکننده
Scalp Wellness® Shampoo:
شامپویی که پوست سر خشک را تسکین و مرطوب میکند
5.2 خواص بیولوژیکی و فیزیکوشیمیایی: سورفکتین دارای خواص بیولوژیکی و فیزیکوشیمیایی جالبی است که به ساختار منحصر به فرد حلقه لاکتونی آن نسبت داده میشود. این ساختار شامل هفت اسید آمینه است که به گروههای کربوکسیل و هیدروکسیل متصل به اسیدهای چرب زنجیره بلند C13 تا C15 پیوند خوردهاند (110). این ماده اسیدی در آب قلیایی و بسیاری از حلالهای آلی مانند اتانول، متانول، بوتانول و کلروفرم حل میشود (111). این ویژگیها سورفکتین را به یک گزینه جذاب برای استفاده در فرمولاسیونهای آرایشی تبدیل کرده است، جایی که پایداری و کارایی آن در شرایط مختلف بسیار مهم است.
6. لیپیدهای مانوزیل اریتریتول: لیپیدهای مانوزیل اریتریتول (MELs) یک کلاس از بیوسورفاکتانتهای گلیکولیپیدی هستند که با گروههای سر هیدروفیلیک خود مشخص میشوند. این گروهها میتوانند شامل ۴-O-β-D-mannopyranosyl-erythritol یا ۱-O-β-D-mannopyranosyl- erythritol باشند و دارای دمهای اسید چرب هیدروفوبیک هستند. این ترکیبات عمدتاً توسط سویههای مخمری از جنس Pseudozyma، مانند Pseudozyma antarctica، Pseudozyma aphidis و Pseudozyma rugulosa و همچنین برخی سویههای کاندیدا، از جمله Candida sp. SY16 تولید میشوند (86).
6.1 تنوع ساختاری: MELs تنوع ساختاری قابلتوجهی دارند و سه نوع اصلی از آنها شناسایی شده است. این تنوع به دلیل تفاوت در تعداد و اندازه گروههای استیل بر روی مانوز یا اریتریتول، و همچنین تغییرات در زنجیرههای اسید چرب که میتوانند از نظر طول و اشباع متفاوت باشند، به وجود میآید (46،98،99). این تنوع ساختاری به ویژگیها و کاربردهای منحصربهفرد MELs کمک میکند.
6.2 کاربردها و مزایا: MELs به دلیل چندین خاصیت مفید خود برای کاربرد در محصولات مراقبت از پوست موردتوجه قرار گرفتهاند: (112,79, 11)
1. مرطوبکنندگی پوست: ماهیت آمفیفیلیک MELs به آنها اجازه میدهد تا شبیه سرامید عمل کنند و باعث حفظ رطوبت و هیدراتاسیون پوست شوند.
2. تحریک فیبروبلاستها MELs :نشان دادهاند که میتوانند رشد فیبروبلاستها را تحریک کنند که ممکن است به فرآیندهای پیری پوست کمک کند.
3. ترمیم مو: آنها میتوانند به ترمیم موهای آسیبدیده کمک کنند.
4. فعالیت ضدقارچی MELs :دارای خواص ضدقارچی قابلتوجهی هستند که آنها را برای فرمولاسیونهای مختلف آرایشی مناسب میسازد.
5. ظرفیت آنتیاکسیدانی: وجود زنجیرههای اسید چرب در MELs به خواص آنتیاکسیدانی قابلتوجه آنها کمک میکند و از تشکیل رادیکالهای آزاد جلوگیری میکند. بهطورکلی، خواص چندمنظوره لیپیدهای مانوزیل اریتریتول آن¬ها را بهعنوان کاندیداهای امیدوارکننده برای گنجاندن در انواع مختلف فرمولاسیونهای آرایشی و مراقبت از پوست معرفی میکند. توانایی آنها در هیدراته کردن، محافظت و تقویت سلامت پوست، آنها را بهعنوان بیو سورفاکتانتهای ارزشمند در صنعت آرایشی قرار میدهد.
جدول 3: نمونههایی از محصولات تجاری در بازارهای جهانی محتوی سورفاکتانتهای میکروبی با ساختار گلیکولیپیدی با خواص بالقوه ضد پیر پوستی و محافظتکننده در برابر اختلالات مرتبط با افزایش سن.
نتیجهگیری
پوست سالم نقشهای محافظتی متعددی دارد. بهعنوان یک فرایند فیزیولوژیکی پیچیده، پیری پوست توسط عوامل درونی و محیطی متعددی آغاز میگردد و ممکن است باعث تغییرات پیشرونده در ظاهر افراد، مانند افزایش چینوچروک، خشکی بیش از حد و ایجاد لکه شود. در سالهای گذشته، توسعه سورفاکتانتهای میکروبی برای استفاده در محصولات دارویی و آرایشی - بهداشتی به دلیل خواص بیوشیمیایی منحصربهفرد آنها از جمله سازگاری بیولوژیکی بالا، سمیت اندک، زیستتخریبپذیر بودن و قابلیت استحصال از منابع طبیعی و غیر آلودهکننده در مقایسه با همتایان شیمیایی موردتوجه قرار گرفته است. در این مطالعه، کاربردهای بالقوه برخی از سورفکتانتهای گلیکولیپیدی از جمله رامنولیپیدها و سوفورولیپیدها مشتق شده از منابع میکروبی برای مبارزه با پیری پوست در فرمولاسیونهای آرایشی مورد بحث قرار گرفت. برایناساس، باتوجهبه ویژگیهایی همچون خواص آنتیاکسیدانی بالا، اثرات ضدالتهابی و... این ترکیبات میتوانند بهعنوان مواد اولیه جهت مراقبت از پوست و تهیه محصولات ضد پیر پوستی مورداستفاده قرار گیرند. ازاینرو، پژوهشگران امیدوارند تا انجام بررسیهای بیشتر و معرفی ترکیبات جدیدتر با قابلیتهای کاربردی، به معرفی جایگزینهای مناسبی برای سورفاکتانتهای سنتز شده شیمیایی فائق آیند. بااینحال، نیاز به استانداردسازی و معرفی یک روش جداسازی مناسب و خالصسازی ارزان برای استحصال این ترکیبات از منابع طبیعی تجدیدپذیر همچنان بهعنوان یک مسئله مهم پیش از تجاریسازی در مقیاس بالا مطرح است. ازآنجاییکه سورفکتانتهای میکروبی بهدستآمده از محیطهای کشت متفاوت ممکن است ناهمگنیهای جزئی داشته باشند. بهعلاوه، بهبود راندمان تولید موضوع مورد اهمیت دیگری است. ازاینرو، باتوجهبه بازده تولید نسبتاً محدود سورفاکتانتهای میکروبی و هزینهبربودن فراوری نهایی، تلاش برای اکتشاف روشهای تولید مناسب از منابع تجدیدپذیر رقابتی همچنان ادامه دارد. همچنین، توانایی حفظ ثبات و پایداری فرمولاسیونهای تجاری در طول عمر مفید آنها میتواند یک مسئله چالشبرانگیز برای عملکرد محصول باشد که نیاز به رعایت دستورالعملهای تولید بهینه را بیشازپیش برجسته میکند. جدای از آن، انجام مطالعات سمشناسی، بررسی دقیق خصوصیات شیمیایی و ارزیابی فعالیتهای بیولوژیکی احتمالی باید پیش از تولید انبوه محصولات بهمنظور استفاده پایدار از آنها در فرآوردهها صورت گیرد؛ بنابراین، معرفی سویههای جدید میکروبی باقابلیت تولید سورفکتانت ممکن است با ارائه ویژگیهای خاص و نقشهای چندمنظوره احتمالی به کاهش هزینههای تولید و توسعه کاربردهای بالینی از جمله اثرات ضد پیر پوستی منجر شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این پروژه بهصورت مروری بوده و اصول اخلاق در پژوهش از جمله ارجاع مناسب به مطالب استفاده شده رعایت شده است.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
به عنوان بیرونیترین عضو بدن، پوست در حقیقت یک سد محافظتی است که محیط درونی بدن انسان را از محیط خارج جدا کرده و ما را در برابر آسیبهای ناشی از اشعه ماوراء بنفش Ultraviolet radiation ، از دست دادن مایعات حیاتی و نیز نفوذ میکروارگانیسمها مصون نگه میدارد. به علاوه، پوست نقش مهمی در آرایش ظاهری و حفظ مولفههای مربوط به زیبایی شناختی بدن انسان دارد (1،2). پوست به ترتیب از خارج به داخل از سه لایه اصلی به نامهای: اپیدرم Epidermis، درم Dermis و هیپودرم Hypodermis تشکیل میشود. اپیدرم حاوی سلولهایی است که وظیفه ساخت سلولهای لایه شاخی را برعهده دارند. به علاوه، سلولهای این لایه مسئول ساخت ملانوسیتها و مقاومت در برابر اشعه ماوراء بنفش نیز میباشند (3،4). درم حاوی سلولهای فیبروبلاست است که وظیفه سنتز و ترشح پروتئینهای ماتریکس خارج سلولی (مانند کلاژن و الاستین) را بر عهده دارد و خاصیت ارتجاعی و استحکام پوست را سبب میشوند. هیپودرم بافت چربی است که بلافاصله در زیر لایه درم قرار داشته و پوست را به ماهیچهها و استخوانها متصل میکند (5). از نظر بیولوژیکی، پیر پوستی با تجمیع تدریجی نقصهای مربوط به پروتئینهای ساختاری، اختلال در نوسازی بافتها و نیز از دست دادن تدریجی خاصیت ارتجاعی پوست مشخص میشود (6). علاوه بر افزایش سن، تماس مستقیم با اشعه ماوراء بنفش و مواد شیمیایی نیز از جمله مهمترین عوامل تسریع کننده روند پیری پوست بهشمار میآیند (7). پیر پوستی اساساً با ایجاد چین و چروک، کاهش انعطاف پذیری و در نهایت نقصان عملکرد محافظتی و اختلال در جنبه زیبایی شناختی آن همراه است. از اینرو، با توجه به پیشرفت علم و فناوری و نیز ارتقای استانداردهای سطح زندگی ارائه راهکارهای مناسب برای کنترل هرچه بهتر پیر پوستی بیش از پیش مورد توجه قرار گرفته است (8). تا به امروز محصولات مراقبتی بسیاری برای محافظت از پوست، بهبود ظاهر آن و کاهش روند پیری پوست با استفاده از منابع گوناگون طبیعی و شیمیایی فرموله شدهاند (9،10). در این بین، سورفکتانتهای مشتق شده از میکروبها Microbial surfactantsاز جمله محصولات طبیعی هستند که ادعا میشود از طریق مکانیسمهای مختلف از جمله تحریک رشد فیبروبلاستها، ظرفیت آنتیاکسیدان بالا و خواص ضدالتهابی مناسب، میتوانند اثرات ضد پیر پوستی مشخصی را سبب شوند (12,11). در این مطالعه قصد داریم تا به بررسی تأثیرات بالقوه سورفکتانتهای گلیکوپپتیدی مشتق شده از میکروبها به عنوان ترکیبات ضد پیری پوست بپردازیم.
روش بررسی
در این مطالعه که از نوع مطالعات مروری است جستوجوی مقالات از ابتدای سال 2000 تا ماه اکتبر 2024 صورت گرفت. برای این مهم، ابتدا در پایگاه های اطلاعاتی معبتر Scopus, ISC ،PubMed و Google scholar با استفاده از کلید واژههایی همچون: پوست، پیر پوستی، مکانیسم ایجاد پیر پوستی، سورفکتانتهای مشتق شده از میکروبها، سورفکتانتهای گلیکوپپتیدی Glycopeptide surfactants ، فرمولاسیونهای آرایشی، محصولات مراقبت از پوست و کاربردهای بالقوه جستوجو انجام شد. سپس، با توجه به میزان ارتباط محتوایی مقالات یافت شده به هدف مطالعه کنونی، مشخصات مجله و سال انتشار، اعتبار علمی آنها با استفاده از سامانه منبع یاب وزرات بهداشت مورد بررسی قرار گرفته و در نهایت تعداد 106 مقاله مرتبط بر اساس معیارهای ورود و خروج جهت انجام بررسیهای بیشتر انتخاب شدند. ارتباط حداقلی با موضوع پژوهش، انتشار پیش از سال 2000، انتشار مطالعه به زبانی به جز انگلیسی، تکراری بودن و نیز موجود نبودن متن کامل سبب خروج مقالات از روند بررسی گردید تا در نهایت تعداد 78 مقاله جهت نوشتن متن نهایی انتخاب شدند. پس از انجام غربالگری اولیه و حذف مقالات تکراری، موارد یافت مورد بررسی مجدد قرار گرفته و فرآیند نوشتن متن مقاله شده با مشاوره همکاران آغاز گردید. در نهایت، مقاله مروری نوشته شده و تصحیحات لازم بر روی آن صورت گرفت.
نتایج
پیر شدن فرآیندی پیچیده است که طیفی از عوامل ژنتیکی و محیطی در آن دخیل بوده و نقش مهمی در ایجاد بسیاری از اختلالات مرتبط با سلامتی انسان دارد. اگرچه با افزایش سن فرآیندهای زیستی گوناگونی به صورت پیشرونده در اندامها و بافتهای بدن مختلف آشکار میشود اما اساساً واضح نرین شواهد این فرآیند در پوست نمایان می¬شود چراکه قسمتهای داخلی از نظر بصری مشخص نیستند (13،14). قرار گیری بیش از حد در معرض نور و اشعههای یونیزان در کنار آلودگی با مواد شیمیایی یا سموم و تولید افسار گسیختهی گونههای فعال اکسیژن از جمله مهم¬ترین عوامل محیطی آسیب¬زا هستند که می¬توانند منجر به تغییرات فیزیولوژیکی دائمی از جمله تشکیل رنگدانه و چین و چروک در پوست شود (شکل 1) (15). از این رو، انتخاب روشی صحیح جهت مبارزه هرچه بهتر با پیر پوستی از اهمیت ویژه¬ای برخوردار است. در این بین، توجه کلی به وضعیت سلامت، نوع پوست، سبک زندگی فردی و سن شخصی باید قبل از انتخاب روش مبارزه مورد¬توجه قرارگیرد. امروزه، از روشهای درمانی تهاجمی Invasive همچون استفاده از لایهبردارهای شیمیایی، اشعه لیزر، رادیوفرکوئنسی Radiofrequencyو افزایش مصنوعی ضخامت پوست از طریق تزریق مستقیم چربی به عنوان متداول¬ترین روشهای درمان پیر پوستی یاد میشود. در سالهای اخیر، استفاده از راهکارهای غیرتهاجمی برای سرعت بخشیدن به فرآیندهای درون سلولی به منظور تسریع رشد و نمو سلولهای پوستی بر پایه این باور که " افزایش سرعت جایگزینی سلولهای قدیمی با جدید ظاهر پوست را بهبود میبخشد" بیش از پیش مورد توحه قرار گرفته است (16،17). به علاوه، تنظیم تولید الیاف کلاژن و الاستین به عنوان پروتوئینهای ساختاری پوست که نقش تعیین کنندهای در حفظ سلامت و جوانی پوست دارند نیز بهطور گسترده مورد بررسی قرار گرفته است. در اینباره مشخص شده است که تجویز موضعی آنتیاکسیدانها با از بین بردن رادیکالهای آزاد و خنثی کردن واکنشهای التهابی از طریق مکانیسمهای متفاوت میتوانند از تخریب الیاف کلاژن و ایجاد چین و چروکها جلوگیری کنند. برای مثال، عوامل آنتی اکسیدانی میتوانند از طریق مهار تشکیل یونهای فلزی بازسازی غشای سلولی اکسید شده را افزایش داده و نرخ زنده ماندن سلولی را بهبود ببخشند (18). به هر روی، اصلاح سبک زندگی از طریق ترک سیگار، کاهش استرس، تصحیح رژیم غذایی و افزایش فعالیت بدنی در کنار مراقبت روزانه از پوست و دوری حداکثری از اشعه ماورای بنفش خورشیدی همگی در کند کردن روند پیرپوستی ضروری هستند (16،17،19).

شکل 1: برخی از مهمترین عوامل خارجی پیر پوستی.
1. انواع سورفکتانتهای میکروبی: سورفاکتانتهای میکروبی را میتوان بر اساس جرم مولکولی به بیوسورفکتانت با وزن مولکولی کم (شامل اسیدهای چرب، فسفولیپیدها، لیپیدهای خنثی، گلیکولیپیدها، لیپوپپتیدها و لیپوپروتئینها) و بیوسورفکتانت با وزن مولکولی بالا (شامل بیوسورفکتانتهای پلیمری) طبقهبندی کرد (22-20). در جدول 1 ساختار دستههای اصلی سورفکتانت های میکروبی ارائه شده است.
1.1 گلیکولیپیدها: گلیکولیپیدها یک کلاس شناختهشده از بیوسورفکتانتها هستند که از ترکیبات کربوهیدرات و اسیدهای چرب تشکیل شدهاند. این دو جزء از طریق پیوندهای اتر یا استر به هم متصل میشوند. گلیکولیپیدها شامل کربوهیدراتهایی مانند رامنوز، سوفرز یا ترهالوز در گروه سر هیدروفیلیک خود هستند. باکتری سودوموناس آئروژینوزا Pseudomonas aeruginosa و مخمر کاندیدا بومبیکولا Candida bombicola (که اکنون بهعنوان Starmerella bombicola شناخته میشود) از شناختهشدهترین سویهها برای تولید بیوسورفکتانتهای گلیکولیپیدی هستند. برخی از گلیکولیپیدهای شناساییشده معمول شامل رامنولیپیدها Rhamnolipids، ترهالولیپیدها Trehalolipids و سوفرولیپیدها Sophorolipids هستند (23).
1.1.1 رامنولیپیدها: رامنولیپیدها بیوسورفکتانتهای مبتنی بر گلیکولیپید هستند که عمدتاً توسط سودوموناس آئروژینوزا تولید میشوند. این ترکیبات به دلیل فعالیت سطحی بالا، بازده تولید مناسب و سهولت کشت میکروارگانیسم تولید کننده آنها، بهطور گستردهای مورد مطالعه قرار گرفتهاند (25, 24).
1.1.2 ترهالولیپیدها: ترهالولیپیدها نوعی دیساکارید هستند که شامل ترهالوز متصل به اسیدهای میکولیک میباشند. این ترکیبات بسته به منبع ارگانیسم خود با تغییرات در تعداد اتمهای کربن و درجه اشباع در اندازه و ساختار متفاوت هستند. در محیط کشت، نشان داده شده است که آنها بهطور قابلتوجهی کشش سطحی و بینسطحی را کاهش میدهند (26). ترهالولیپیدها توسط گونههای مختلف مایکوباکتریوم و نوکاردیا تولید میشوند. بهعنوان مثال، Rhodococcus erythropolis ترهالوز دیمیکولاته را تولید میکند که جزء مهمی از دیواره سلولی در Mycobacterium tuberculosis است (27).
1.1.3 سوفرولیپیدها: سوفرولیپیدها گلیکولیپیدهای خارج سلولی هستند که از یک کربوهیدرات دیمریک (سوفرز) متصل به یک اسید چرب هیدروکسی زنجیره بلند تشکیل شدهاند. این بیوسورفکتانتها ترکیبی از حداقل شش تا نه نوع مختلف سوفرولوساید هیدروفوبیک هستند (28). نشان داده شده است که سوفرولیپیدهای خالص فعالیت سطحی بیشتری دارند، کمتر محلول در آب هستند و اثرات سیتوتوکسیک قویتری دارند. هر دو نوع لاکتونی و اسیدی سوفرولیپیدها نشان دادهاند که تنش بینسطحی را بین ن-هگزادکان و آب کاهش میدهند و ثبات قابلتوجهی در برابر تغییرات pH و دما دارند (29).
1.2 لیپوپپتیدها: لیپوپپتیدها یکی از کلاسهای مهم بیوسورفکتانتها هستند که توسط میکروارگانیسمها تولید میشوند. یکی از نمونههای قابل توجه در این دسته، سورفکتین Surfactin است که یک بیوسورفکتانت با فعالیت سطحی استثنایی میباشد. سورفکتین متعلق به گروهی از لیپوپپتیدهای حلقوی هپتاپپتیدی است که شامل اسیدهای چرب بتا-هیدروکسیل و بقایای آمینو اسید D-/L- هستند (30). سورفکتین حلقوی توسط گونههای باسیلوس تولید میشود و شامل یک ساختار حلقوی از هفت آمینواسید است که از طریق پیوند لاکتونی به زنجیرهای از اسیدهای چرب متصل شده است (31). گروه لیپوپپتیدها/لیپوپروتئینها یک کلاس متنوع از پپتیدهای فعال بیولوژیکی هستند. فنجیسین Fengycin از این دسته دارای اثرات ضد میکروبی بوده و دو بیوسورفکتانت حلقوی لیپوپپتیدی دیگر آرتروفاکتین Arthrofactin و سورفکتین هستند. سورفکتین یکی از گروههای محبوب بیوسورفکتانتهای لیپوپپتیدی است که شامل یک حلقه از هفت آمینو اسید میباشد. گونههای باسیلوس، نوکاردیا و مایکوباکتریوم از جمله تولیدکنندگان اصلی بیوسورفکتانتهای لیپوپپتیدی و لیپوپروتئینی هستند (32،33). سویههای باسیلوس سابتیلیس به تولید دامنه وسیعی از لیپوپپتیدها معروف هستند.
1.3 اسیدهای چرب و فسفولیپیدها: اسیدهای چرب و فسفولیپیدها دو گروه از بیوسورفکتانتها هستند که توسط تعداد زیادی از گونههای مخمر و باکتری تولید میشوند و کاربردهای وسیعی در پزشکی دارند. باکتریها و مخمرهای مختلف مقادیر قابلتوجهی از سورفاکتانتهای اسید چرب و فسفولیپیدی را در حین رشد بر روی ان-آلکانها تولید میکنند. طول زنجیره هیدروکربنی در ساختار این لیپیدهای پیچیده تأثیر دارد. همه آنها شامل اسیدهای چرب هستند که معمولاً یک گروه هیدروکسیل بر روی کربن β یا در بخشهای دیگر زنجیره دارند. یک نمونه قابلتوجه از بیوسورفکتانتهای فسفولیپیدی که به طور گستردهای شناخته شده است، توسط Corynebacterium lepusi سنتز میشود (34،35).
1.4 بیوسورفکتانتهای پلیمری: مواد پلیمری خارجسلولی نقش مهمی در تأثیرگذاری بر هر دو جنبه مثبت و منفی تجمعات میکروبی، از جمله بیوفیلمها دارند. در بیوفیلم، آنها به افزایش مقاومت در برابر اصطکاک و تغییرات در خواص سطحی، مانند هیدروفوبیسیته، زبری و رنگ کمک میکنند (36،37). علاوه بر این، مواد پلیمری خارجسلولی کاربردهای مختلف بیوتکنولوژیکی دارند و از آنها در تنظیم ویسکوزیته در غذاها، رنگها، گلولای حفاری نفت و به دلیل خواص مرطوبکنندگی در لوازم آرایشی و داروسازی استفاده میشود. برخی از معروفترین بیوسورفکتانتهای پلیمری شامل امولسان، لیپوزان، مانوپروتئین و سایر کمپلکسهای پلیساکارید-پروتئینی هستند (38).
جدول 1: ساختار شیمیایی دستههای اصلی سورفکتانتهای میکروبی



2. سورفاکتانتهای میکروبی و مکانیسمهای ضد پیر پوستی آنها: سورفکتانتها مولکولهای دوگانهدوستی هستند که از یک سر آبدوست و یک دم آبگریز تشکیلشده و با کاهش کشش سطحی تشکیل مخلوطهای همگن از فازهای دارای قطبیتهای متفاوت تسهیل میکنند (48،47). از میان انواع متفاوت، سورفاکتانتهای مشتق شده از میکروبها (سورفاکتانتهای میکروبی) به عنوان یک کلاس نوظهور از سورفکتانتها که میتوانند پس از ساخته شدن روی سطوح سلولهای میکروبی قرار گیرند یا به فضای خارج سلولی ترشح شوند، به دلیل کاربردهای بالقوه علمی و صنعتی ویژه مورد توجه قرار گرفتهاند (51-49). افزایش گزارشات پیرامون اثرات نامطلوب و عوارض جانبی (مانند تحریک پوست) توسط سورفکتانتهای شیمیایی، محققان را به ارائه جایگزین های کمتر تهاجمی و در عین حال کارآمد برای جایگزینی سورفاکتانتهای شیمیایی در فرمولاسیونهای آرایشی و بهداشتی تشویق کرده است. به طور کلی، سورفکتانتهای شیمیایی، ترکیبات غیر زیست تجزیهپذیری هستند که از منابع نفتی بهدست می¬آیند. با توجه به اینکه آنها می توانند برای طولانی مدت در بدن باقی مانده و در نتیجه منجر به سمیت شوند، تجمع این مولکولها در بافتهای بدن به عنوان یک مسئله چالشبرانگیز در استفادههای مزمن در نظر گرفته میشود. برخی از مطالعات نشان دادهاند که استفاده از سورفکتانتهای مصنوعی میتواند با سمیتهای بافتی، اختلالات انعقاد خون و همولیز گلبولهای قرمز انسان و همچنین عوارض پوستی ناخوشایند، از جمله تحریک، واکنشهای آلرژیک، و تضعیف عملکرد محافظتی پوست همراه باشد (12،52،53). تا سال 2020، بازار مالی بیوسورفکتانتها تقریباً 4 درصد از کل تجارت سورفکتانتها در جهان را شامل میشد که به دلیل علاقهمندی بسیاری از صنایع به استفاده از مواد طبیعی این سهم در حال افزایش است (54). سورفکتانتهای شیمیایی میتوانند با لیپیدهای بین سلولی برهمکنش داشته باشند و با تضعیف عملکرد این اجزای ساختاری، نفوذ مواد مختلف به لایههای درونی اپیدرم را تسهیلکرده و منجر به از دست دادن بیش از حد آب میانبافتی شود. در مقابل، سورفاکتانتهای میکروبی اساساً فاقد اثرات زیست محیطی مخرب بوده، سازگاری زیستی بالایی را از خود نشان داده و فرآیند تجزیه زیستی آنها نیز در مقایسه با سورفکتانت های مصنوعی بهطور قابلتوجهی آسانتر است (55). از اینرو، دانشمندان از سورفاکتانتهای میکروبی به عنوان جایگزینهایی سازگارتر و مناسبتری برای کاربردهای صنعتی و آرایشی برای همتایان شیمیایی یاد میکنند (56،57). دراین بین، از سورفکتانتهای گلیکولیپیدی به عنوان یکی از پراستنادترین و مورد مطالعهترین انواع سورفاکتانتهای میکروبی در زمینه آرایشی یاد میشود. این مولکول های طبیعی دوگانه دوست میتوانند ویژگیهای بیولوژیکی متفاوتی را از طریق مکانیسمهای مختلف سبب شوند. از جمله محصولات مراقبت از پوست حاوی بیوسورفکتانتهایی گلیکولیپیدی با منشاء میکروبی در بازارهای جهانی میتوان به شوینده بدن SopholianceTM S (فرمولاسیون حاوی گلیکولیپید sophorolipid) و همچنین شویندهی صورت Cryosmetics®(یک فرمولاسیون محتوی گلیکولیپید rhamnolipid) اشاره کرد (58). در محیطهای آبی و از طریق بر همکنشهای خود به خودی بین قسمتهای آبگریز، بیوسورفکتانتها میتوانند در غلظتهای بالاتر از Critical micelle concentration CMC (حداقل غلظت میسلی شدن) بهصورت ساختارهای میسلی یا وزیکولهای دولایه سرهمبندی شده و با تشکیل مجموعههای کروی شکلی مواد مختلف را درون خود محصور کنند (شکل2). بهاینترتیب، ترکیبات بارگیری شده از گزند تخریب توسط محیطهای خشن محافظت شده و ورود آنها به درون سلولها را تسهیل مییابد (59).

شکل2: آرایش عمومی سورفاکتانتها در بالاتر از غلظت CMC در محیطهای آبی.
3. مکانیسمهای ضد پیری سورفکتانتهای میکروبی: اساسا میکروارگانیسمها به منظور افزایش شانس بقا در برابر تهدیدهای خارجی سورفاکتانتها را تولید میکنند و از این طریق به مزیتهایی همچون افزایش تحرک برای گریز از تهدیدات، تسهیل رشد سلولی و دسترسی آسانتر به مواد مغذی در شرایط محیطی سخت مییابند. شواهد بسیاری این مهم را تایید میکنند که فرآیندهای مرتبط با پیری توسط تنشهای (استرسها) اکسیداتیو تسریع می یابد. از این رو، محافظت از سلول ها در برابر استرس مرتبط با افزایش سن و واکنش های التهابی یک اصل ضروری برای حفظ عملکرد سلولی است. در خلال متابولیسم، سلولها بهطور معمول مقادیری از رادیکالهای آزاد اکسیژن Reactive oxygen species (ROS) که بهطور بالقوه مضر هستند را تولید می کنند. آنتیاکسیدانها موادی هستند که با خنثی کردن رادیکالهای آزاد از سلولها در برابر استرسهای اکسیداتیو محافظت میکنند. این دسته از ترکیبات میتوانند تولید بیش از حد رادیکالهای آزاد در بدن را که در نتیجه وارد آمدن آسیبهای متعدد داخلی (مانند التهاب) یا خارجی (مثلا قرار گرفتن در معرض اشعه ماوراء بنفش) ممکن است رخ دهد را متوقف سازند (60). از دست رفتن تعادل بین عوامل پرواکسیدان (ایجاد کننده استرسهای اکسیداتیو) و آنتی اکسیدان ها ممکن است منجر به ایجاد تنشهای اکسیداتیو شود. در سلولهای بیولوژیکی، سطوح بالای رادیکالهای آزاد اکسیژن قویاً بر عملکرد سلولها تأثیر میگذارد و با اختلال در عملکرد سلولی میتواند منجر به پیری شود (61،62). در صنایع دارویی و آرایشی - بهداشتی، استفاده از آنتیاکسیدانها به دلیل توانایی ذاتی آنها در کاهش تنشهای اکسیداتیو و جلوگیری از واردآمدن آسیبهای سلولی در حفظ سلامت انسان ضروری تلقی میشود. تاکنون ترکیبات بسیاری با اثرات بالقوه آنتیاکسیدانی مورد بررسی قرار گرفتهاند. اگرچه سورفکتانتها عمدتاً برای کاهش کشش سطحی و تشکیل مخلوطهای همگن استفاده میشوند، اخیراً اثرات سودمند برخی از آنها بهعنوان عوامل آنتیاکسیدانی مؤثر و جایگزینهای امیدوارکننده برای همتایان شیمیایی موردمطالعه قرار گرفته است (63،64). به علاوه آنکه، گزارش اثرات مضر و سمی از آنتی اکسیدانهای مصنوعی منجر به افزایش علاقه برای جایگزین کردن آنها با آنتیاکسیدانهای طبیعی شده است (40). سورفاکتانتهای میکروبی میتوانند آسیبهای مرتبط با تولید بیش از حد رادیکالهای آزاد اکسیژن را از طریق مکانیسمهای متعدد کاهش دهند. برای مثال، وجود گروههای هیدروکسیل فراوان در ساختار مولکولی این ترکیبات سبب فراهم آمدن ظرفیت مهاری بالایی خواهد شد. در مطالعاتی بیوسورفکتانت های میکروبی دارای زنجیره اسید چرب خاصیت آنتیاکسیدانی نشان داده اند. براین اساس، افزایش طول زنجیره هیدروکربنی اسید چرب میتواند منجر به بهبود فعالیت آنتیاکسیدانی این ترکیبات شود. همچنین صرفنظر از طول زنجیره، تغییر در تعداد پیوندهای دوگانه نیز میتواند بر ظرفیت مهاری و سرکوب پراکسیداسیون لیپیدی تأثیر گذارد. بدین صورت که که افزایش پیوندهای غیر اشباع در ساختار سورفاکتانتهای میکروبی منجر به افزایش اثر محافظتی آنها در برابر رادیکالهای آزاد اکسیژن می شود. جدای از آن، وجود بخشهای گلیکوزیدی و یا اسیدهای آمینه مختلف (مانند متیونین، لوسین و والین) در ساختار سورفاکتانتهای میکروبی نیز میتواند سبب بهبود ظرفیت محافظتی آنها گردد (65). علاوه بر اثرات آنتی اکسیدان و محافظت کنندگی، گزارش شده است که سورفاکتانتهای میکروبی میتوانند مستقیماً رشد فیبروبلاستها را تحریک کرده و از این طریق سبب افزایش بیوسنتز کلاژن و تکثیر سلولهای اپیتلیال در پوست شوند (66). آن¬ها همچنین میتوانند با سرعت بخشیدن به فرآیند رگزایی و القای کراتینه شدن، بهبود زخم را تسریع کنند (67،68). گوپتا و همکاران (69) نشان دادند که استفاده از سورفاکتانتهای میکروبی به عنوان ترکیباتی با سازگاری سلولی بالا و دارای اثرات بالقوه برای تسریع در روند بهبودی زخمها میتواند منجر به بازسازی سریعتر کلاژن، افزایش تکثیر فیبروبلاستها و رشد مجدد سلولهای اپیتلیال شود. توانایی بالقوه سورفاکتانتهای میکروبی برای سرکوب التهاب و پاسخهای التهابی، مکانیسم پیشنهادی دیگری برای اثرات محافظتی آنها بر ضد پیرپوستی است (68). بر این اساس، آنها می توانند تولید سیتوکین پیش التهابی، بیان ژنهای التهابی (IFN-γ، IL-6، TNFα و IL-12) و مهاجرت IgE Immunoglobulin E را از طریق کاهش تولید پروتئینهای التهابی (مانند TLR-2) کاهش دهند. به علاوه، گزارش شده است که سورفاکتانتهای میکروبی میتوانند فسفولیپاز A2 را مهار کرده و در نتیجه تولید واسطههای التهابی مانند پروستاگلاندینها و لکوترینها را سرکوب کنند. همچنین، محققان موفق به نشان دادن اثرات بالقوه سورفاکتانتهای میکروبی در تعدیل سیستم ایمنی ذاتی و اکتسابی میزبان شدهاند (68،70). بر این اساس، MS سورفاکتانتهای میکروبی میتوانند از طریق تعدیل مسیرهای پیامرسانی مختلف، بیان MAPK Mitogen-activated protein kinases را تنظیم کرده و منجر به فعالسازی NF-Kb Nuclear Factor Kappa B شود. همچنین، میتوانند سبب القای مسیرهای ضد التهابی وابسته به هم اکسیژناز-1 Heme oxygenase-1، تنظیم بیان مولکولهای کمک محرک (CD80، CD40 و MHC II)، افزایش تولید سیتوکینها و القای آپوپتوز در سلولهای معیوب شود (73-71). در( شکل 3) شرح مختصری از مکانیسمهای اصلی پیشنهادی برای اثرات ضد پیری سورفکتانت میکروبی بیان شده است.
4. سورفکتانتهای گلیکولیپیدی مشتق شده از منابع میکروبی: مشابه با سورفاکتانتهای شیمیایی میتوان از سورفکتانتهای میکروبی نیز برای تهیه فرمولاسیونهای ارایشی استفاده کرد. برای مثال، آنها می¬توانند کشش سطحی بین مایعات با قطبیت متفاوت (آب و روغن) را کاهش داده و به عنوان عامل امولسیون کننده به تشکیل امولسیونهای پایدار کمک کنند. همچنین، آنها می توانند به عنوان حل کننده (Solubilizer)، مرطوب کننده (Humectant)، ترکننده (Wetting agent) و کف کننده (Foaming agent) استفاده شوند (20). علاوه بر آن، تاکنون کاربردهای درمانی منحصر به فردی در رابطه با اثرات سورفکتانتهای میکروبی بیولوژیکی گزارش شده است. به عنوان مثال، آنها می توانند به عنوان عوامل ضد میکروبی و ضد ویروسی، آنتی بیوفیلم، ضد تومور، ضد التهاب، آنتی اکسیدان و عوامل القا کننده رگ زایی مورد استفاده قرار گیرند و با مکانیسم های مختلف روند بهبود زخم را تسریع کنند. همچنین، مطالعات بسیاری از اثرات احتمالی آنها به عنوان ترکیباتی با ظرفیت بالقوه ضد پیرپوستی حکایت دارند (74،75). از نظر علمی، بررسی حداقل غلظت میسلی شدن، تعادل آبدوست - چربیدوستی (HLB Hydrophilic–lipophilic balance) و ماهیت یونی ذاتی سورفاکتانتها به عنوان کمیتهای ضروری جهت تهیه فرمولاسیونهای آرایشی مورد تاکید قرار گرفتهاند. از سویی، باید توجه داشت که بیوسورفکتانتهای مشتق شده از میکروارگانیسمها معمولاً دارای مقادیر CMC کمتری در مقایسه با سورفکتانتهای شیمیایی بوده و کاهش حداکثری کشش سطحی را در غلظتهای پایین تر سبب میشوند (76). (شکل 4) شرحی مختصر از کاربردهای بالقوه سورفکتانتهای میکروبی در محصولات آرایشی-بهداشتی را ارائه میدهد. ظاهر کلی پوست به هیدراتاسیون (وجود مقادیر کافی از آب در پوست)، نرمی و کنترل فرایند هایپرپیگمانتاسیون (ایجاد لکه) بستگی دارد. از این نظر، مبارزه با گونههای رادیکال آزاد و ممانعت از تخریب کلاژن بهعنوان گامهایی مهمی برای مبارزه با روند پیری شناخته میشود (77). اگرچه امروز محصولات آرایشی متعددی در بازارهای جهانی به چشم میخورد، اما مشکلات مرتبط با تجزیه زیستی Biodegradation مواد مصنوعی و ناسازگاریهای بیولوژیکی بهخصوص در صورت استفاده طولانیمدت از این مواد ممکن است منجر به پیری پوست شود (78). خواص بالقوه ضد پیری سورفکتانتهای میکروبی در درجه اول به فعالیت آنتیاکسیدانی، اعم از انتقال الکترون و مهار رادیکالهای آزاد و همچنین خواص ضدالتهابی آنها نسبت داده میشود. علاوه بر این، آنها میتوانند در فرایند بیولوژیکی مختلفی از جمله بازسازی فیبروبلاستها، تحریک سنتز کلاژن، کمک به مرطوب کردن سطح پوست و ارتباطات بین سلولی نقش داشته باشند (12،57). اعتقاد بر این است که تعدیل مسیرهای مرتبط با پیرپوستی به منظور فعالسازی فرآیندهای سلولی از جمله اتوفاژی و ترمیم DNA، از بیماریهای مزمن پوستی جلوگیری کرده و با افزایش مقاومت در برابر استرس، خواص ضد پیری بهتر به منسه ظهور می¬رساند. جدای از آن، حفظ ترکیب صحیح میکروبیوم پوست یکی دیگر از مزیتهای احتمالی استفاده از سورفکتانتهای میکروبی است که رویکرد نسبتاً جدیدی را در برابر آسیبهای پوستی نشان میدهد (77). گلیکولیپیدها مشتقات گلیکوزیلی لیپیدها Glycosyl derivatives of lipids هستند که در همه اشکال موجودات زنده، از سلولهای پروکاریوتی تا یوکاریوتی، کشف میشوند. در این ساختارهای دوگانه دوست، بخش لیپیدی آبگریز بهواسطه وجود یک پیوند گلیکوزیدی به گروه قندی (گلیکوزیلی) آبدوست متصل میشود. سورفاکتانتهای گلیکولیپیدی به دلیل عملکردهای بیولوژیکی متنوعشان اخیراً بیشازپیش توجه محققان را برای تهیه فرمولاسیونهای زیستسازگار به خود جلب کردهاند. خواص بالقوه ضد پیر پوستی رامنولیپیدها (Rhamnolipids) و سوفورولیپیدها (Sophorolipids) بهعنوان مهمترین انواع سورفکتانتهای گلیکولیپیدی مشتق شده از منابع میکروبی مورد بحث و بررسی قرار گرفت (جدول 2).

شکل 3: مکانیسمهای اصلی پیشنهادی برای اثرات ضد پیری سورفکتانت میکروبی (58).

شکل 4: برخی از کاربردهای بالقوه سورفکتانتهای میکروبی در محصولات آرایشی – بهداشتی (11،79،80)
جدول 2: خلاصهای از خواص عمومی مهمترین انواع سورفکتانتهای مشتق شده از منابع میکروبی با ظرفیت کاربرد بالقوه در محصولات آرایشی - بهداشتی.

4.1 رامنولیپیدها: رامنولیپیدها به عنوان سورفاکتانتهای گلیکولیپیدی که عمدتاً توسط میکروارگانیسم فرصتطلبی به نام سودوموناس آئروژینوزا Pseudomonas aeruginosa تولید میشود شناخته میشوند. با این حال، تولید رامنولیپیدها توسط برخی از سویه های غیر بیماریزای جنس سودوموناس مانند سودوموناس کلرورافیس Pseudomonas chlororaphis NRRL B-30761 نیز گزارش شده است (89). آسینتوباکتر کالکوستریوس Acinetobacter calcoaceticus BU-03 (82) و مارینوباکتر لیتورالیس Marinobacter litoralis MB15 (83) نمونههایی از سویههای غیر بیماریزای تولیدکننده رامنولیپیدها هستند. این گلیکولیپیدهای آنیونی به طور کلی از یک بخش رامنوز (یک یا دو مولکول) به عنوان سر گلیکوزیلی آبدوست و یک اسید آلکانوئیک (3-(هیدروکسی آلکانوئیلوکسی)) به عنوان دم اسید چرب تشکیل شدهاند. تاکنون، رامنولیپیدها به دلیل خواص منحصر به فرد خود در تعدادی فرمولاسیون آرایشی-بهداشتی، مانند پدهای آکنه، محصولات ضد شوره، دئودورانتها و خمیر دندان استفاده شده اند. از مهمترین خواص این دسته از گلیکولیپیدها میتوان به خاصیت امولسیونکنندگی بالا، فعالیت های سطحی قابل توجه، اثرات ضد میکروبی، اثرات تعدیل کنندگی سیستم ایمنی، خواص آنتی اکسیدانی، فعالیت ضد توموری در برابر سلول های سرطانی اشاره کرد. از اینرو، خواص قابلیت استفاده از این ترکیبات در محصولات ضد پیرپوستی بیش از پیش مورد توجه قرار گرفته است. خواص ضد میکروبی رامنولیپیدها را میتوان با تاثیر مستقیم این مولکولها بر غشای سلولی، اختلال در عملکرد بهینه غشاء، ایجاد منافذ غیرقابل ترمیم و در نهایت نشت محتویات درون سلولی به خارج توجیه کرد (91, 90). در پژوهشی که توسط عبداللهی و همکاران (92) صورت گرفت، خواص آنتیاکسیدانی رامنولیپیدهای مشتق شده از سودوموناس آئروژینوزا MN1 مورد بررسی قرار گرفته و ظرفیت قابلتوجه آنها برای مهار پراکسیداسیون لیپیدی نشان داده شد. بر این اساس، مشخص شد که میتوان از رامنولیپیدها به عنوان جایگزین مناسب برای آنتی¬اکسیدانهای مصنوعی بهره جست. به علاوه، مطالعات متعددی به اثرات ضد التهابی رامنولیپیدها اشاره دارند (58،93). اگرچه که با توجه به تعداد گروههای رامنوز و نوع اسید چرب بهکار رفته در ساختار، رامنولیپیدها به انواع متفاوتی تقسیم میشوند اما در بسیاری از خصوصیات فیزیکوشیمیایی از جمله اندک بودن حداقل غلظت میسلی شدن و بالا بودن مقدار HLB (حدود 9/5) اثرات مشابهای را از خود نشان میدهند. برای مثال، رامنولیپیدهای استخراج شده از سویه سودوموناس DSM 2874 Pseudomonas sp. DSM 2874 بسته به نوع مولکولها بکار رفته ساختارشان مقدار CMC را از 0/005 تا 0/2 گرم در لیتر نشان میدهد (94). یکی دیگر از موارد قابل بحث در رابطه با رامنولیپیدها، پایداری بالا و حفظ فعالیت سطحی در طیف نسبتاً وسیعی از تغییرات pH (از 5 تا 10) است. این مورد بهویژه در مقیاس صنعتی تولید فراوردههای آرایشی-بهداشتی که در آن گسترهای از محیطهای ساخت با pHهای متفاوت مورد نیاز است میتواند بسیار راهگشا باشد. از سوی دیگر، این ترکیبات بر خلاف همتایان شیمیایی و سنتزی میتواند تحت تاثیر تجزیه زیستی در شرایط هوازی یا بیهوازی به متابولیتهای ثانویه تبدیل شده و به آسانی از بدن دفع شوند (95). به علاوه، رامنولیپیدها اثرات سمی بسیار کمتری در مقایسه با سورفکتانتهای مشتق شده از مواد شیمیایی نشان دادند. اینرو، استفاده از رامنولیپیدها در در محصولات مراقبت از پوست امروزه بیش از مورد توجه قرار گرفته است. در اینباره، شرکت Piljac and Piljac یکی از اولین فرمولاسیونهای آرایشی-بهداشتی محتوی رامنولیپید را با اثرات ضد چین و چروک و ضد پیری به ثبت رساندند (96). همچنین، محققان به تازگی اثرات ترمیم کنندگی زخم رامنولیپیدها را در محدوده غلظتی از 0/001 درصد تا 5 درصد گزارش دادهاند (57).
4.2 سوفورولیپیدها: سوفورولیپیدها دستهای از سوفاکتانتهای گلیکولیپیدی هستند که به فراوانی توسط سویههای خانواده کاندیدا مانند کاندیدا فلوریکولا Candida floricola و کاندیدا آپیکولا Candida apicola تولید میشوند. این گلیکولیپیدهای غیریونی از یک بخش دی ساکارید سوفورز Sophorose بهعنوان سر آبدوست که از طریق یک پیوند گلیکوزیدی به یک اسید چرب هیدروکسیله با زنجیره بلند به عنوان دم آبگریز متصل شده است، بوجود میآیند. بسته به نوع ملکولهای بهکار رفته در ساختار، مقادیر HLB این ترکیبات دوگانهدوست بین 13 تا 15 متفاوت بوده و از اینرو میتوان برای مقاصد مختلف آرایشی-بهداشتی از آنها استفاده کرد (97). این ترکیبات میتوانند در غلظت 0/1 گرم در لیتر کشش سطحی آب را از حدود 72 میلی نیوتون بر متر (mN/m) در حالت عادی (دمای 25 درجه سانتیگراد) تا حدود 35 میلی نیوتون بر متر کاهش دهند (58). همچنین، میزان CMC سوفورولیپیدهای دی استیله 18 کربنه، در حالت حلقه لاکتونی، در حدود 0/366گرم در لیتر گزارش شده است (98). اگرچه سوفورولیپیدها در مقایسه با رامنولیپیدها فعالیت امولسیون کنندگی عالی ندارند، اما میتوانند کشش سطحی را به اندازه قابلتوجهای کاهش دهند. از اینرو، استفاده همزمان از سوفورولیپیدها به همراه رامنولیپیدها و سایر ترکیبات موثره در محصولات آرایشی-بهداشتی مانند پاک کنندههای بدن، شامپو و... امری مطلوب به نظر میرسد (99). از سویی، ادعا میشود که مولکولهای فعال سطحی میتوانند به دلیل ماهیت دوگانهدوست خود به صورت سامانههای دارورسانی عمل کرده و دسترسی ترکیبات زیستی آبگریز را به قسمتهای مختلف بدن افزایش دهند (100). در این باره، پنگ و همکاران (101) قابلیت بالقوه استفاده از سوفورولیپیدها به عنوان سامانهای برای افزایش فراهمی زیستی کورکومین (یک آنتیاکسیدان بسیار کم محلول در آب که خواص موضعی بسیاری از جمله مبارزه با چین و چروک را دارد) را گزارش دادهاند. در مطالعهای دیگر، پژوهشگران ظرفیت آنتی اکسیدانی سوفورولیپیدها را مورد ارزیابی قرار داده و استفاده از آنها به عنوان نگهدارنده طبیعی Natural preservatives جهت حفظ پایداری و ارتقای کیفیت فرمولاسیونهای آرایشی-بهداشتی را پیشنهاد دادند. این ترکیبات همچنین میتوانند نرخ زنده ماندنی سلول را در برابر آسیبهای ناشی از مواجه با لیپوپلیساکارید Lipopolysaccharide باکتریهای گرم منفی (که خاصیت بیماریزایی بالایی داشته و به عنوان یک توکسین باکتریایی بهشمار میرود) ارتقا دهند (102). خواص ضدباکتریایی سوفورولیپیدها آنها را به عنوان گزینهای مناسب برای استفاده در فرمولاسیونهای ضد شوره و آکنه مطرح می¬کند (103،104). علاوه بر این، مشخص شده¬است که سوفورولیپیدها می¬تواند سنتز لپتین را در سلولهای چربی تحریک کرده و اثرات مثبت برای درمان سلولیت داشته باشد (105). از دیگر اثرات سودمند استفاده از سوفورولیپیدها در محصولات آرایشی ضد پیرپوستی می¬توان به اثرات آنتی اکسیدانی بالا و پاکسازی رادیکالهای آزاد اکسیژن، تحریک سنتز کلاژن و رشد مجدد فیبروبلاستها اشاره کرد (57). همچنین، گزارش شده است که سوفورولیپیدها می¬توانند از طریق مکانیسمهای مختلف (اختلال در عملکرد غشاء سلولی، القای آپوپتوز و تعدیل مسیرهای میتوکندریایی) علیه سلولهای سرطانی فعالیت کنند (104،106). تولید سوفورولیپیدها توسط مخمرهای غیر بیماریزا سبب شده تا عموماً آنها به عنوان ترکیباتی که سمیت کمی دارند یاد شود. در این¬باره، پژوهشگران با مطالعه اثرات سمی سوفورولیپیدها برروی کراتینوسیتهای انسانی و مقایسه آن با سورفکتانت های صناعی این گزاره را تصدیق کردهاند (107). در مطالعهای دیگر، میزان تجزیه زیستی سوفورولیپیدهای مشتق شده از استارمرلا بومبیکولا Starmerella bombicola ATCC 22214 مورد ارزیابی قرار گرفت و بر این اساس مشخص که این ترکیبات به راحتی زیست تخریب¬پذیر بوده و سمیت کمی دارند (108). یکی از مهم ترین چالشهای استفاده از سوفورولیپیدها در فرمولاسیون های آرایشی، حلالیت ضعیف آنها در شرایط pH اسیدی قلمداد میشود؛ چراکه با توجه به pH نسبتاً اسیدی پوست، بسیاری از فرمولاسیون¬های آرایشی برای سازگاری بهتر با پوست در شرایط اسیدی تهیه می شوند (109). مثالهایی از محصولات تجاریسازی شده محتوی سورفکتانتهای گلیکولیپیدی با منشاء میکروبی با خواص بالقوه مناسب برای مبارزه با مشکلات ناشی از پیرپوستی و افزایش سن در جدول 3 ارائه شده است.
5. سورفکتین: سورفکتین یک بیو سورفاکتانت نوع لیپوپپتید است که از باکتریهای گرم مثبت، بهویژه از جنس باسیلوس، مانند باسیلوس سابتیلیس، استخراج میشود. کاربردهای تجاری این ترکیب به دامنه وسیعی از استفادههای دارویی تا محیط زیستی اشاره دارد. این عامل آمفیفیلیک به دلیل پایداری بالای آن در برابر دامنه وسیعی از دما و شرایط تغییر pH بهعنوان یکی از پرکاربردترین سورفاکتانتهای با منبع میکروبی در فرمولاسیونهای آرایشی شناخته میشود (86).
5.1 کاربردها در صنعت آرایشی و بهداشتی
نمونههایی از کاربرد تجاری سورفکتین در محصولات آرایشی و بهداشتی عبارتاند از:
Eco Tan® Face Tan Water:
یک فرمولاسیون آب برنزه کننده
Oribe Resilience Shampoo:
یک پاککننده فوق مغذی برای موهای ضعیف و شکننده
Scalp Wellness® Shampoo:
شامپویی که پوست سر خشک را تسکین و مرطوب میکند
5.2 خواص بیولوژیکی و فیزیکوشیمیایی: سورفکتین دارای خواص بیولوژیکی و فیزیکوشیمیایی جالبی است که به ساختار منحصر به فرد حلقه لاکتونی آن نسبت داده میشود. این ساختار شامل هفت اسید آمینه است که به گروههای کربوکسیل و هیدروکسیل متصل به اسیدهای چرب زنجیره بلند C13 تا C15 پیوند خوردهاند (110). این ماده اسیدی در آب قلیایی و بسیاری از حلالهای آلی مانند اتانول، متانول، بوتانول و کلروفرم حل میشود (111). این ویژگیها سورفکتین را به یک گزینه جذاب برای استفاده در فرمولاسیونهای آرایشی تبدیل کرده است، جایی که پایداری و کارایی آن در شرایط مختلف بسیار مهم است.
6. لیپیدهای مانوزیل اریتریتول: لیپیدهای مانوزیل اریتریتول (MELs) یک کلاس از بیوسورفاکتانتهای گلیکولیپیدی هستند که با گروههای سر هیدروفیلیک خود مشخص میشوند. این گروهها میتوانند شامل ۴-O-β-D-mannopyranosyl-erythritol یا ۱-O-β-D-mannopyranosyl- erythritol باشند و دارای دمهای اسید چرب هیدروفوبیک هستند. این ترکیبات عمدتاً توسط سویههای مخمری از جنس Pseudozyma، مانند Pseudozyma antarctica، Pseudozyma aphidis و Pseudozyma rugulosa و همچنین برخی سویههای کاندیدا، از جمله Candida sp. SY16 تولید میشوند (86).
6.1 تنوع ساختاری: MELs تنوع ساختاری قابلتوجهی دارند و سه نوع اصلی از آنها شناسایی شده است. این تنوع به دلیل تفاوت در تعداد و اندازه گروههای استیل بر روی مانوز یا اریتریتول، و همچنین تغییرات در زنجیرههای اسید چرب که میتوانند از نظر طول و اشباع متفاوت باشند، به وجود میآید (46،98،99). این تنوع ساختاری به ویژگیها و کاربردهای منحصربهفرد MELs کمک میکند.
6.2 کاربردها و مزایا: MELs به دلیل چندین خاصیت مفید خود برای کاربرد در محصولات مراقبت از پوست موردتوجه قرار گرفتهاند: (112,79, 11)
1. مرطوبکنندگی پوست: ماهیت آمفیفیلیک MELs به آنها اجازه میدهد تا شبیه سرامید عمل کنند و باعث حفظ رطوبت و هیدراتاسیون پوست شوند.
2. تحریک فیبروبلاستها MELs :نشان دادهاند که میتوانند رشد فیبروبلاستها را تحریک کنند که ممکن است به فرآیندهای پیری پوست کمک کند.
3. ترمیم مو: آنها میتوانند به ترمیم موهای آسیبدیده کمک کنند.
4. فعالیت ضدقارچی MELs :دارای خواص ضدقارچی قابلتوجهی هستند که آنها را برای فرمولاسیونهای مختلف آرایشی مناسب میسازد.
5. ظرفیت آنتیاکسیدانی: وجود زنجیرههای اسید چرب در MELs به خواص آنتیاکسیدانی قابلتوجه آنها کمک میکند و از تشکیل رادیکالهای آزاد جلوگیری میکند. بهطورکلی، خواص چندمنظوره لیپیدهای مانوزیل اریتریتول آن¬ها را بهعنوان کاندیداهای امیدوارکننده برای گنجاندن در انواع مختلف فرمولاسیونهای آرایشی و مراقبت از پوست معرفی میکند. توانایی آنها در هیدراته کردن، محافظت و تقویت سلامت پوست، آنها را بهعنوان بیو سورفاکتانتهای ارزشمند در صنعت آرایشی قرار میدهد.
جدول 3: نمونههایی از محصولات تجاری در بازارهای جهانی محتوی سورفاکتانتهای میکروبی با ساختار گلیکولیپیدی با خواص بالقوه ضد پیر پوستی و محافظتکننده در برابر اختلالات مرتبط با افزایش سن.

نتیجهگیری
پوست سالم نقشهای محافظتی متعددی دارد. بهعنوان یک فرایند فیزیولوژیکی پیچیده، پیری پوست توسط عوامل درونی و محیطی متعددی آغاز میگردد و ممکن است باعث تغییرات پیشرونده در ظاهر افراد، مانند افزایش چینوچروک، خشکی بیش از حد و ایجاد لکه شود. در سالهای گذشته، توسعه سورفاکتانتهای میکروبی برای استفاده در محصولات دارویی و آرایشی - بهداشتی به دلیل خواص بیوشیمیایی منحصربهفرد آنها از جمله سازگاری بیولوژیکی بالا، سمیت اندک، زیستتخریبپذیر بودن و قابلیت استحصال از منابع طبیعی و غیر آلودهکننده در مقایسه با همتایان شیمیایی موردتوجه قرار گرفته است. در این مطالعه، کاربردهای بالقوه برخی از سورفکتانتهای گلیکولیپیدی از جمله رامنولیپیدها و سوفورولیپیدها مشتق شده از منابع میکروبی برای مبارزه با پیری پوست در فرمولاسیونهای آرایشی مورد بحث قرار گرفت. برایناساس، باتوجهبه ویژگیهایی همچون خواص آنتیاکسیدانی بالا، اثرات ضدالتهابی و... این ترکیبات میتوانند بهعنوان مواد اولیه جهت مراقبت از پوست و تهیه محصولات ضد پیر پوستی مورداستفاده قرار گیرند. ازاینرو، پژوهشگران امیدوارند تا انجام بررسیهای بیشتر و معرفی ترکیبات جدیدتر با قابلیتهای کاربردی، به معرفی جایگزینهای مناسبی برای سورفاکتانتهای سنتز شده شیمیایی فائق آیند. بااینحال، نیاز به استانداردسازی و معرفی یک روش جداسازی مناسب و خالصسازی ارزان برای استحصال این ترکیبات از منابع طبیعی تجدیدپذیر همچنان بهعنوان یک مسئله مهم پیش از تجاریسازی در مقیاس بالا مطرح است. ازآنجاییکه سورفکتانتهای میکروبی بهدستآمده از محیطهای کشت متفاوت ممکن است ناهمگنیهای جزئی داشته باشند. بهعلاوه، بهبود راندمان تولید موضوع مورد اهمیت دیگری است. ازاینرو، باتوجهبه بازده تولید نسبتاً محدود سورفاکتانتهای میکروبی و هزینهبربودن فراوری نهایی، تلاش برای اکتشاف روشهای تولید مناسب از منابع تجدیدپذیر رقابتی همچنان ادامه دارد. همچنین، توانایی حفظ ثبات و پایداری فرمولاسیونهای تجاری در طول عمر مفید آنها میتواند یک مسئله چالشبرانگیز برای عملکرد محصول باشد که نیاز به رعایت دستورالعملهای تولید بهینه را بیشازپیش برجسته میکند. جدای از آن، انجام مطالعات سمشناسی، بررسی دقیق خصوصیات شیمیایی و ارزیابی فعالیتهای بیولوژیکی احتمالی باید پیش از تولید انبوه محصولات بهمنظور استفاده پایدار از آنها در فرآوردهها صورت گیرد؛ بنابراین، معرفی سویههای جدید میکروبی باقابلیت تولید سورفکتانت ممکن است با ارائه ویژگیهای خاص و نقشهای چندمنظوره احتمالی به کاهش هزینههای تولید و توسعه کاربردهای بالینی از جمله اثرات ضد پیر پوستی منجر شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این پروژه بهصورت مروری بوده و اصول اخلاق در پژوهش از جمله ارجاع مناسب به مطالب استفاده شده رعایت شده است.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- Lee Y, Park J, Choe A, Cho S, Kim J, Ko H. Mimicking Human and Biological Skins for Multifunctional Skin Electronics. Special Issue:Emerging Thin‐Film Transistor Technologies and Applications 2020; 30(20): 1904523.
2- Rente D, Bubalo MC, Panić M, Paiva A, Caprin B, Redovniković IR, et al. Review of Deep Eutectic Systems from Laboratory to Industry, Taking the Application in the Cosmetics Industry as an Example. Journal of Cleaner Production 2022; 380(2): 135147.
3- Wang MZ, Niu J, Ma HJ, Dad HA, Shao HT, Yuan TJ, et al. Transdermal Sirna Delivery by Ph-Switchable Micelles with Targeting Effect Suppress Skin Melanoma Progression. Journal of Controlled Release 2020; 322: 95-107.
4- Kabashima K, Honda T, Ginhoux F, Egawa G. The Immunological Anatomy of the Skin. Nature Reviews Immunology 2019; 19(1): 19-30.
5- Zou Z, Long X, Zhao Q, Zheng Y, Song M, Ma S, et al. A Single-Cell Transcriptomic Atlas of Human Skin Aging. Dev Cell 2021; 56(3): 383-97.
6- Rorteau J, Chevalier FP, Fromy B, Lamartine J. Functional Integrity of Aging Skin, from Cutaneous Biology to Anti-Aging Strategies. Med Sci 2020; 36(12): 1155-62.
7- Gao Z, Wang S, Qi G, Pan H, Zhang L, Zhou X, et al. A Surfactin Cyclopeptide of WH1fungin Used as a Novel Adjuvant for Intramuscular and Subcutaneous Immunization in Mice. Peptides 2012; 38(1): 163-71.
8- Ansary TM, Hossain MR, Kamiya K, Komine M, Ohtsuki M. Inflammatory Molecules Associated with Ultraviolet Radiation-Mediated Skin Aging. Int J Molecular Sci 2021; 22(8): 3974.
9- Chung HU, Rwei AY, Hourlier-Fargette A, Xu S, Lee K, Dunne EC, et al. Skin-Interfaced Biosensors for Advanced Wireless Physiological Monitoring in Neonatal and Pediatric Intensive-Care Units. Nature Medicine 2020; 26(3): 418-29.
10- Bom S, Jorge J, Ribeiro H, Marto J. A Step Forward on Sustainability in the Cosmetics Industry: A Review. Journal of Cleaner Production 2019; 225: 270-90.
11- Adetunji AI, Olaniran AO. Production and Potential Biotechnological Applications of Microbial Surfactants: An Overview. Saudi J Biological Sci 2021; 28(1): 669-79.
12- Adu SA, Naughton PJ, Marchant R, Banat IM. Microbial Biosurfactants in Cosmetic and Personal Skincare Pharmaceutical Formulations. Pharmaceutics 2020; 12(11): 1099.
13- de Miranda RB, Weimer P, Rossi RC. Effects of Hydrolyzed Collagen Supplementation on Skin Aging: A Systematic Review and Meta‐Analysis. Int J Dermatology 2021; 60(12): 1449-61.
14- Rusu ME, Fizeșan I, Vlase L, Popa DS. Antioxidants in Age-Related Diseases and Anti-Aging Strategies. Antioxidants (Basel) MDPI 2022; 11(10):1868.
15- Gendrisch F, Esser PR, Schempp CM, Wölfle U. Luteolin as a Modulator of Skin Aging and Inflammation. Biofactors 2021; 47(2):170-80.
16- Ganceviciene R, Liakou AI, Theodoridis A, Makrantonaki E, Zouboulis CC. Skin Anti-Aging Strategies. Dermato-endocrinology 2012; 4(3): 308-19.
17- Zouboulis CC, Ganceviciene R, Liakou AI, Theodoridis A, Elewa R, Makrantonaki E. Aesthetic Aspects of Skin Aging, Prevention, and Local Treatment. Clin Dermatol 2019; 37(4): 365-72.
18- Mbituyimana B, Mao L, Hu S, Ullah MW, Chen K, Fu L, et al. Bacterial Cellulose/Glycolic Acid/Glycerol Composite Membrane as a System to Deliver Glycolic Acid for Anti-Aging Treatment. Journal of Bioresources and Bioproducts 2021; 6(2): 129-41.
19- Maisel-Campbell AL, Ismail A, Reynolds KA, Poon E, Serrano L, Grushchak S, et al. A Systematic Review of the Safety and Effectiveness of Platelet-Rich Plasma (PRP) for Skin Aging. Arch Dermatol Res 2020; 312(5): 301-15.
20- Falk NA. Surfactants as Antimicrobials: A Brief Overview of Microbial Interfacial Chemistry and Surfactant Antimicrobial Activity. J Surfactants Deterg 2019; 22(5): 1119-27.
21- Madankar CS, Meshram A. Review on Classification, Physicochemical Properties and Applications of Microbial Surfactants. Tenside Surfactants Detergents 2022; 59(1): 1-16.
22- Pandey R, Krishnamurthy B, Singh HP, Batish DR. Evaluation of a Glycolipopepetide Biosurfactant from Aeromonas Hydrophila RP1 for Bioremediation and Enhanced Oil Recovery. J Cleaner Production 2022; 345: 131098.
23- Sajadi Bami M, Raeisi Estabragh MA, Ohadi M, Banat IM, Dehghannoudeh G. Biosurfactants Aided Bioremediation Mechanisms: A Mini-Review. Soil and Sediment Contamination: An Int J 2022; 31(7): 801-17.
24- Sarubbo LA, Silva MdGC, Durval IJB, Bezerra KGO, Ribeiro BG, Silva IA, et al. Biosurfactants: Production, Properties, Applications, Trends, and General Perspectives. Bioch Eng J 2022; 181: 108377.
25- Eslami P, Hajfarajollah H, Bazsefidpar S. Recent Advancements in the Production of Rhamnolipid Biosurfactants by Pseudomonas Aeruginosa. RSC Advances 2020; 10(56): 34014-32.
26- Du K-z, Li J, Wang L, Hao J, Yang Xj, Gao Xm, et al. Biosurfactant Trehalose Lipid-Enhanced Ultrasound-Assisted Micellar Extraction and Determination of the Main Antioxidant Compounds from Functional Plant Tea. J Separation Sci 2020; 43(4): 799-807.
27- Khandare VC, Madankar CS. An Overview on Trehalolipids: A Promising Eco-Friendly Bio-Surfactant 2024; 61(1): 92-104.
28- Vara Prasad R, Arun Kumar R, Sharma D, Sharma A, Nagarajan S. Sophorolipids and Rhamnolipids as a Biosurfactant: Synthesis and Applications. In Inamuddin, Adetunji CO, Asiri AM, editors. Green Sustainable Process for Chemical and Environmental Engineering and Science, The Netherlands, Elsevier; 2021: 423-72.
29- Madankar CS, Borde PK. Review on Sophorolipids – A Promising Microbial Bio-Surfactant. 2023; 60(2): 95-105.
30- Liu JF, Mbadinga SM, Yang SZ, Gu JD, Mu BZ. Chemical Structure, Property and Potential Applications of Biosurfactants Produced by Bacillus Subtilis in Petroleum Recovery and Spill Mitigation. Int J Mol Sci [Internet]. 2015; 16(3): 4814-37.
31- Théatre A, Cano-Prieto C, Bartolini M, Laurin Y, Deleu M, Niehren J, et al. The Surfactin-Like Lipopeptides from Bacillus Spp.: Natural Biodiversity and Synthetic Biology for a Broader Application Range. Front Bioeng Biotech 2021; 9.
32- Ron EZ, Rosenberg E. Natural Roles of Biosurfactants. Environ Micro 2001; 3(4): 229-36.
33- Kowall M, Vater J, Kluge B, Stein T, Franke P, Ziessow D. Separation and Characterization of Surfactin Isoforms Produced by Bacillus Subtilis OKB 105. J Colloid Interface Sci 1998; 204(1): 1-8.
34- Saranraj P, Zayyed R, Sivasakthivelan P, Devi MD, Al—Tawaha ARM, Sivasakthi S. Microbial Biosurfactants Sources, Classification, Properties and Mechanism of Interaction. In: Sayyed RZ, El-Enshasy, editors. Microbial Surfactants: Volume 2: Applications in Food and Agriculture. 1st ed. Boca Raton: CRC Press; 2022; 1-24.
35- Nikolova C, Gutierrez T. Biosurfactants and their Applications in the Oil and Gas Industry: Current State of Knowledge and Future Perspectives. Front Bioeng Biotechnol 2021; 9.
36- Siddharth T, Sridhar P, Vinila V, Tyagi RD. Environmental Applications of Microbial Extracellular Polymeric Substance (EPS): A Review. J Environ Manag 2021; 287: 112307.
37- Ali N, Abbas SAAA, Sharif L, Shafiq M, Kamran Z, Masah, et al. Chapter 13 - Microbial Extracellular Polymeric Substance and Impacts on Soil Aggregation. In: Abd-Elsalam KA, Mohamed HI, editors. Bacterial Secondary Metabolites: Elsevier; 2024: 221-37.
38- Patel RJ, Patel AA, Raval MA, Pandya V, Alexander A, Ajazuddin. Chapter 2 - Optimization and Characterization of Various Biosurfactant and Application in Food Industries. In: Inamuddin, Adetunji CO, editors. Applications of Next Generation Biosurfactants in the Food Sector: Academic Press; 2023: 17-42.
39- Herzog M, Tiso T, Blank LM, Winter R. Interaction of Rhamnolipids wwith Model Biomembranes of Varying Complexity. Biochim Biophys Acta 2020; 1862(11): 183431.
40- Kuyukina MS, Ivshina IB, Baeva TA, Kochina OA, Gein SV, Chereshnev VA. Trehalolipid Biosurfactants from Nonpathogenic Rhodococcus Actinobacteria with Diverse Immunomodulatory Activities. N Biotechnol 2015; 32(6): 559-68.
41- Jimoh AA, Senbadejo TY, Adeleke R, Lin J. Development and Genetic Engineering of Hyper-Producing Microbial Strains for Improved Synthesis of Biosurfactants. Mol Biotech 2021; 63(4): 267-88.
42- Li G, Yi X, Jiang J, Zhang Y, Li Y. Dynamic Surface Properties and Dilational Rheology of Acidic and Lactonic Sophorolipids at the Air-Water Interface. Colloids and Surfaces B: Biointerfaces 2020; 195: 111248.
43- Coelho ALS, Feuser PE, Carciofi BAM, de Andrade CJ, de Oliveira D. Mannosylerythritol Lipids: Antimicrobial and Biomedical Properties. Appl Microb Biotechnol 2020; 104(6): 2297-318.
44- Tong Y, Zhang J, Wang L, Wang Q, Huang H, Chen X, et al. Hyper-Synergistic Antifungal Activity of Rapamycin and Peptide-Like Compounds Against Candida Albicans Orthogonally Via Tor1 Kinase. ACS Infect Dis 2021; 7(10): 2826-35.
45- Nakamoto H, Yokoyama Y, Suzuki T, Miyamoto Y, Fujishiro T, Morikawa M, et al. A Cyclic Lipopeptide Surfactin is a Species-Selective Hsp90 Inhibitor that Suppresses Cyanobacterial Growth. J Biochem 2021; 170(2): 255-64.
46- Rodríguez-López L, Rincón-Fontán M, Vecino X, Cruz JM, Moldes AB. Extraction, Separation and Characterization of Lipopeptides and Phospholipids from Corn Steep Water. Sep Purif Technol 2020; 248: 117076.
47- Raeisi Estabragh MA, Behnam B, Torkzadeh-Mahani M, Pardakhty A. Niosome as a Drug Delivery Carrier for Sorafenib: Preparation, Investigation of Physicochemical Properties, and in Vitro Effects on Hepg2 Cell Line. Adv Pharm Bull 2024; 14(4): 836-45.
48- Raeisi Estabragh MA, Pardakhty A, Ahmadzadeh S, Dabiri S, Malekpour Afshar R, Farajli Abbasi M. Successful Application of Alpha Lipoic Acid Niosomal Formulation in Cerebral Ischemic Reperfusion Injury in Rat Model. Adv Pharm Bull 2022; 12(3): 541-9.
49- Ahmadi Borhanabadi M, Raeisi Estabragh MA, Dehghannoudeh G, Banat IM, Ohadi M, Moshafi MH. Optimization of Calcium Alginate Hydrogel Bioencapsulation of Acinetobacter Junii B6, A Lipopeptide Biosurfactant Producer. Jundishapur J Nat Pharm Prod 2023; 18(2): e134325.
50- Sepehr A, Mohammad Amin Raeisi E, Amirhossein N, Mandana O, Mohammad Hassan M, Ibrahim MB, et al. Preparation and Physicochemical Properties of a Thermosensitive Hydrogel-Based Lipopeptide Biosurfactant. Letters in Drug Design & Discovery 2024; 21(17): 3757-64.[Persian]
51- Bagheri AM, Raeisi Estabragh MA, Pardakhty A, Banat IM, Ohadi M, Amirheidari B. Potential Biomedical Applications of Biosurfactants Derived from Extremophilic Bacteria: A Review. Biocatalysis and Agricultural Biotechnology 2025; 63: 103455.
52- Farage MA, Miller KW, Maibach HI. Textbook of Aging Skin. Springer Berlin, Heidelberg: Springer Science & Business Media; 2009.
53- Fenibo EO, Ijoma GN, Selvarajan R, Chikere CB. Microbial Surfactants: The Next Generation Multifunctional Biomolecules for Applications in the Petroleum Industry and Its Associated Environmental Remediation. Microorganisms 2019; 7(11): 581.
54- Schonhoff A, Stöckigt G, Wulf C, Zapp P, Kuckshinrichs W. Biosurfactants' Production with Substrates from the Sugar Industry–Environmental, Cost, Market, and Social Aspects. RSC Sustainability 2023; 1(7): 1798-813.
55- Jahan R, Bodratti AM, Tsianou M, Alexandridis P. Biosurfactants, Natural Alternatives to Synthetic Surfactants: Physicochemical Properties and Applications. Advances in Colloid and Interface Sci 2020; 275: 102061.
56- Vecino X, Cruz J, Moldes A, Rodrigues L. Biosurfactants in Cosmetic Formulations: Trends and Challenges. Critical reviews in biotechnol 2017; 37(7): 911-23.
57- Ahmadi-Ashtiani H-R, Baldisserotto A, Cesa E, Manfredini S, Sedghi Zadeh H, Ghafori Gorab M, et al. Microbial Biosurfactants as Key Multifunctional Ingredients for Sustainable Cosmetics. Cosmetics 2020; 7(2): 46.
58- Bagheri AM, Mirzahashemi M, Salarpour S, Dehghnnoudeh Y, Banat IM, Ohadi M, et al. Potential Anti-Aging Applications of Microbial-Derived Surfactantsin Cosmetic Formulations. Critical Reviews in Biotechnology 2024; 1-22.
59- Shu Q, Lou H, Wei T, Liu X, Chen Q. Contributions of Glycolipid Biosurfactants and Glycolipid-Modified Materials to Antimicrobial Strategy: A Review. Pharmaceutics 2021;13(2): 227.
60- Xiao F, Xu T, Lu B, Liu R. Guidelines For Antioxidant Assays For Food Components. Food Frontiers 2020; 1(1): 60-9.
61- Rinnerthaler M, Bischof J, Streubel MK, Trost A, Richter K. Oxidative Stress in Aging Human Skin. Biomolecules 2015; 5(2): 545-89.
62- Kageyama H, Waditee-Sirisattha R. Antioxidative, Anti-Inflammatory, And Anti-Aging Properties of Mycosporine-Like Amino Acids: Molecular and Cellular Mechanisms in the Protection of Skin-Aging. Mar Drugs 2019; 17(4): 222.
63- Munteanu IG, Apetrei C. Analytical Methods Used in Determining Antioxidant Activity: A Review. Int J Mol Sci 2021; 22(7): 3380.
64- Apak Ra. Current Issues in Antioxidant Measurement. J Agric Food Chem 2019; 67(33): 9187-202.
65- Tabbene O, Gharbi D, Slimene IB, Elkahoui S, Alfeddy MN, Cosette P, et al. Antioxidative and DNA Protective Effects of Bacillomycin D-Like Lipopeptides Produced by B38 Strain. Applied biochem biotechnol 2012; 168: 2245-56.
66- Pardhi Ds, Panchal Rr, Raval Vh, Joshi Rg, Poczai P, Almalki W, et al. Microbial Surfactants: A Journey from Fundamentals to Recent Advances. Front Microbiol 2022: 2877.
67- Concaix FB inventors. Use of Sophorolipids Comprising Diacetyl Lactones as Agent for Stimulating Skin Fibroblast Metabolism. US6596265B1; 2003-07-22.
68- Ceresa C, Fracchia L, Fedeli E, Porta C, Banat IM. Recent Advances in Biomedical, Therapeutic and Pharmaceutical Applications of Microbial Surfactants. Pharmaceut 2021; 13(4): 466.
69- Gupta S, Raghuwanshi N, Varshney R, Banat IM, Srivastava AK, Pruthi PA, et al. Accelerated in Vivo Wound Healing Evaluation of Microbial Glycolipid Containing Ointment as a Transdermal Substitute. Biomed & Pharm 2017; 94: 1186-96.
70- Kim K, Jung SY, Lee DK, Jung J-K, Park JK, Kim DK, et al. Suppression of Inflammatory Responses by Surfactin, A Selective Inhibitor of Platelet Cytosolic Phospholipase A2. Biochem Pharmacol 1998; 55(7): 975-85.
71- Gan P, Gao Z, Zhao X, Qi G. Surfactin Inducing Mitochondria-Dependent ROS to Activate Mapks, NF-Κb and Inflammasomes in Macrophages for Adjuvant Activity. Sci Rep 2016; 6(1): 39303.
72- Zhang Y, Liu C, Dong B, Ma X, Hou L, Cao X, et al. Anti-Inflammatory Activity and Mechanism of Surfactin in Lipopolysaccharide-Activated Macrophages. Inflam 2015; 38: 756-64.
73- Park SY, Kim YH, Kim E-K, Ryu EY, Lee S-J. Heme Oxygenase-1 Signals are Involved in Preferential Inhibition of Pro-Inflammatory Cytokine Release by Surfactin in Cells Activated with Porphyromonas Gingivalis Lipopolysaccharide. Chemico-biological interaction 2010; 188(3): 437-45.
74- Mehrabani M, Esmaeili-Tarzi M, Forootanfar H, Nematollahi MH, Banat IM, Ohadi M, et al. Lipopeptide Biosurfactant from Acinetobacter Junii B6: A Promising Natural Surfactant for Promoting Angiogenesis. Int J Peptide Res Therapeutics 2021; 27: 1197-203.
75- Guin M, Singh N. Applications of Biosurfactant as Solubilizers and Wetting Agents. Applications of Next Generation Biosurfactants in the Food Sector: Elsevier; 2023; 279-306.
76- Gautam K, Tyagi V. Microbial Surfactants: A Review. J Oleo Sci 2006; 55(4): 155-66.
77- Kwaśniewska D. Biosurfactants as Determinants of the Quality Anti-Aging Products. Tenside Surfactants Detergents 2024; 61(3): 259-64.
78- Bhatt T, Bhimani A, Detroja A, Gevariya D, Sanghvi G. Cosmetic Application of Surfactants from Marine Microbes. Marine Surfactants: CRC Press; 2023: 271-93.
79- Karnwal A, Shrivastava S, Al-Tawaha ARMS, Kumar G, Singh R, Kumar A, et al. Microbial Biosurfactant as an Alternate to Chemical Surfactants for Application in Cosmetics Industries in Personal and Skin Care Products: A Critical Review. BioMed Res Int 2023; 2023(1): 2375223.
80- Adu SA, Naughton PJ, Marchant R, Banat IM. Microbial Biosurfactants in Cosmetic and Personal Skincare Pharmaceutical Formulations. Pharmaceutics 2020; 12(11): 1099.
81- Soberón‐Chávez G, González‐Valdez A, Soto‐Aceves MP, Cocotl‐Yañez M. Rhamnolipids Produced by Pseudomonas: From Molecular Genetics to the Market. Microbial Biotechnol 2021; 14(1): 136-46.
82- Zhu P, Zhang S, Kumar R, Zhang Z, Zhang Z, Wang Y, et al. Rhamnolipids from Non-Pathogenic Acinetobacter Calcoaceticus: Bioreactor-Scale Production, Characterization and Wound Healing Potency. New Biotechnol 2022; 67: 23-31.
83- Haque E, Kayalvizhi K, Hassan S. Biocompatibility, Antioxidant and Anti-Infective Effect of Biosurfactant Produced by Marinobacter Litoralis MB15. Int J Pharm Invest 2020; 10(2).
84- Celligoi MAP, Silveira VA, Hipólito A, Caretta TO, Baldo C. Sophorolipids: A Review on Production and Perspectives of Application in Agriculture. Spanish J Agricultural Res 2020; 18(3): e03R1-eR1.
85- Roelants S, Solaiman DK, Ashby RD, Lodens S, Van Renterghem L, Soetaert W. Production and Applications of Sophorolipids. Biobased Surfactants 2019: 65-119.
86- Ahmadi-Ashtiani HR, Baldisserotto A, Cesa E, Manfredini S, Sedghi Zadeh H, Ghafori Gorab M, et al. Microbial Biosurfactants as Key Multifunctional Ingredients for Sustainable Cosmetics. Cosmetics 2020; 7(2): 46.
87- Wu YS, Ngai SC, Goh BH, Chan KG, Lee LH, Chuah LH. Anticancer Activities of Surfactin and Potential Application of Nanotechnology Assisted Surfactin Delivery. Front Pharmacol 2017; 8: 761.
88- Chen X, Lu Y, Shan M, Zhao H, Lu Z, Lu Y. A Mini-Review: Mechanism of Antimicrobial Action and Application of Surfactin. World J Microbiol Biotechnol 2022; 38(8): 143.
89- Gunther IV NW, Nunez A, Fett W, Solaiman DK. Production of Rhamnolipids by Pseudomonas Chlororaphis, A Nonpathogenic Bacterium. Applied Environ Microbiol 2005; 71(5): 2288-93.
90- Chen J, Wu Q, Hua Y, Chen J, Zhang H, Wang H. Potential Applications of Biosurfactant Rhamnolipids in Agriculture and Biomedicine. Applied Microbiology and Biotech 2017; 101: 8309-19.
91- Twigg MS, Adu SA, Sugiyama S, Marchant R, Banat IM. Mono-Rhamnolipid Biosurfactants Synthesized by Pseudomonas Aeruginosa Detrimentally Affect Colorectal Cancer Cells. Pharm 2022; 14(12): 2799.
92- Abdollahi S, Tofighi Z, Babaee T, Shamsi M, Rahimzadeh G, Rezvanifar H, et al. Evaluation of Anti-Oxidant and Anti-Biofilm Activities of Biogenic Surfactants Derived from Bacillus Amyloliquefaciens And Pseudomonas Aeruginosa. Iran J Pharmaceutical Res: IJPR 2020; 19(2): 115.
93- Zhang B, Chen G, Zhang H, Lan J, Yang C. Effects of Rhamnolipids on Growth Performance and Intestinal Health Parameters in Linnan Yellow Broilers. Poultry Sci 2021; 100(2): 810-9.
94- Syldatk C, Lang S, Wagner F, Wray V, Witte L. Chemical and Physical Characterization of Four Interfacial-Active Rhamnolipids From Pseudomonas Spec. DSM 2874 Grown on N-Alkanes. Z Naturforsch C Biosci 1985; 40(1-2): 51-60.
95- Khaje Bafghi M, Fazaelipoor MH. Application of Rhamnolipid in the Formulation of A Detergent. J Surfactants and Detergents 2012; 15: 679-84.
96- Piljac T, Piljac G. Use of Rhamnolipids in Wound Healing, Treating Burn Shock, Atherosclerosis, Organ Transplants, Depression, Schizophrenia and Cosmetics. WO1999043334A1; 1999.
97- Martinez V, Corsini E, Mitjans M, Pinazo A, Vinardell MP. Evaluation of Eye and Skin Irritation of Arginine-Derivative Surfactants Using Different in Vitro Endpoints as Alternatives to the in Vivo Assays. Toxicol Lett 2006; 164(3): 259-67.
98- Zhang L, Somasundaran P, Singh SK, Felse AP, Gross R. Synthesis and Interfacial Properties of Sophorolipid Derivatives. Colloids and Surfaces A: Physicochemical and Engineering Aspects 2004; 240(1-3): 75-82.
99- Varvaresou A, Iakovou K. Biosurfactants in Cosmetics and Biopharmaceuticals. Letters in Applied Microbiol 2015; 61(3): 214-23.
100- Bidyarani N, Jaiswal J, Shinde P, Kumar U. Recent Developments and Future Prospects of Fungal Sophorolipids. Progress in Mycology: Biology and Biotechnological Applications 2022: 573-91.
101- Peng S, Li Z, Zou L, Liu W, Liu C, McClements DJ. Enhancement of Curcumin Bioavailability by Encapsulation in Sophorolipid-Coated Nanoparticles: An in Vitro and in Vivo Study. J Agricul Food Chem 2018; 66(6): 1488-97.
102- Xu R, Ma L, Chen T, Wang J. Sophorolipid Suppresses LPS-Induced Inflammation in RAW264. 7 Cells Through the NF-Κb Signaling Pathway. Molecul 2022; 27(15): 5037.
103- Inès M, Dhouha G. Glycolipid Biosurfactants: Potential Related Biomedical and Biotechnological Applications. Carbohydrate Res 2015; 416: 59-69.
104- Miceli TR, Corr TD, Barroso MM, Dogra N, Gross AR. Sophorolipids: Anti-Cancer Activities and Mechanisms. Bioorg Med Chem 2022; 65: 116787.
105- Mishra S, Chen S, Bharagava RN. Environmental and Industrial Applications of Biosurfactants. Microbial Biotechnology: Role in Ecological Sustainability and Res 2022; 104(3): 129-41.
106- Callaghan B, Twigg MS, Baccile N, Van Bogaert IN, Marchant R, Mitchell CA, et al. Microbial Sophorolipids Inhibit Colorectal Tumour Cell Growth in Vitro and Restore Haematocrit in Apcmin+/− Mice. App Microbiol Biotechnol 2022; 106(18): 6003-16.
107- Hirata Y, Ryu M, Oda Y, Igarashi K, Nagatsuka A, Furuta T, et al. Novel Characteristics of Sophorolipids, Yeast Glycolipid Biosurfactants, as Biodegradable Low-Foaming Surfactants. J Biosci Bioeng 2009; 108(2): 142-6.
108- Klosowska-Chomiczewska I, Medrzycka K, Karpenko E. Biosurfactants–Biodegradability, Toxicity, Efficiency in Comparison with Synthetic Surfactants. Adv Chem Mech Eng 2011; 2: 1-9.
109- Van Bogaert IN, Zhang J, Soetaert W. Microbial Synthesis of Sophorolipids. Process Biochem 2011; 46(4): 821-33.
110- Zanotto AW, Valério A, de Andrade CJ, Pastore GM. New Sustainable Alternatives to Reduce the Production Costs for Surfactin 50 Years after the Discovery. Applied Microbiology and Biotech 2019; 103(21): 8647-56.
111- Guilmanov V, Ballistreri A, Impallomeni G, Gross RA. Oxygen Transfer Rate and Sophorose Lipid Production by Candida Bombicola. Biotech and Bioeng 2002; 77(5): 489-94.
112- de Andrade CJ, Coelho ALS, Feuser PE, de Andrade LM, Carciofi BAM, de Oliveira D. Mannosylerythritol Lipids: Production, Downstream Processing, and Potential Applications. Current Opinion in Biotechnol 2022; 77: 102769.
113- BioReNuva. Skin Calming Toner (Formula: T197-009) [Internet]. [cited 2024 Nov 5]; Available from: https://biorenuva.com/formulations.
114- BioReNuva. Light and Airy Foam Cleanser (Formula: T197-011) [Internet]. [cited 2024 Nov 5]; Available from: https://biorenuva.com/formulations.
115- Care EP. Very Mild Foaming Cleansing Cream [Internet]. [cited 2024 Nov 5]; Available from: https://personal-care.evonik.com/en/formulation/FORM_2116581?name=Very-mild-foaming-cleansing-cream.
1- Lee Y, Park J, Choe A, Cho S, Kim J, Ko H. Mimicking Human and Biological Skins for Multifunctional Skin Electronics. Special Issue:Emerging Thin‐Film Transistor Technologies and Applications 2020; 30(20): 1904523.
2- Rente D, Bubalo MC, Panić M, Paiva A, Caprin B, Redovniković IR, et al. Review of Deep Eutectic Systems from Laboratory to Industry, Taking the Application in the Cosmetics Industry as an Example. Journal of Cleaner Production 2022; 380(2): 135147.
3- Wang MZ, Niu J, Ma HJ, Dad HA, Shao HT, Yuan TJ, et al. Transdermal Sirna Delivery by Ph-Switchable Micelles with Targeting Effect Suppress Skin Melanoma Progression. Journal of Controlled Release 2020; 322: 95-107.
4- Kabashima K, Honda T, Ginhoux F, Egawa G. The Immunological Anatomy of the Skin. Nature Reviews Immunology 2019; 19(1): 19-30.
5- Zou Z, Long X, Zhao Q, Zheng Y, Song M, Ma S, et al. A Single-Cell Transcriptomic Atlas of Human Skin Aging. Dev Cell 2021; 56(3): 383-97.
6- Rorteau J, Chevalier FP, Fromy B, Lamartine J. Functional Integrity of Aging Skin, from Cutaneous Biology to Anti-Aging Strategies. Med Sci 2020; 36(12): 1155-62.
7- Gao Z, Wang S, Qi G, Pan H, Zhang L, Zhou X, et al. A Surfactin Cyclopeptide of WH1fungin Used as a Novel Adjuvant for Intramuscular and Subcutaneous Immunization in Mice. Peptides 2012; 38(1): 163-71.
8- Ansary TM, Hossain MR, Kamiya K, Komine M, Ohtsuki M. Inflammatory Molecules Associated with Ultraviolet Radiation-Mediated Skin Aging. Int J Molecular Sci 2021; 22(8): 3974.
9- Chung HU, Rwei AY, Hourlier-Fargette A, Xu S, Lee K, Dunne EC, et al. Skin-Interfaced Biosensors for Advanced Wireless Physiological Monitoring in Neonatal and Pediatric Intensive-Care Units. Nature Medicine 2020; 26(3): 418-29.
10- Bom S, Jorge J, Ribeiro H, Marto J. A Step Forward on Sustainability in the Cosmetics Industry: A Review. Journal of Cleaner Production 2019; 225: 270-90.
11- Adetunji AI, Olaniran AO. Production and Potential Biotechnological Applications of Microbial Surfactants: An Overview. Saudi J Biological Sci 2021; 28(1): 669-79.
12- Adu SA, Naughton PJ, Marchant R, Banat IM. Microbial Biosurfactants in Cosmetic and Personal Skincare Pharmaceutical Formulations. Pharmaceutics 2020; 12(11): 1099.
13- de Miranda RB, Weimer P, Rossi RC. Effects of Hydrolyzed Collagen Supplementation on Skin Aging: A Systematic Review and Meta‐Analysis. Int J Dermatology 2021; 60(12): 1449-61.
14- Rusu ME, Fizeșan I, Vlase L, Popa DS. Antioxidants in Age-Related Diseases and Anti-Aging Strategies. Antioxidants (Basel) MDPI 2022; 11(10):1868.
15- Gendrisch F, Esser PR, Schempp CM, Wölfle U. Luteolin as a Modulator of Skin Aging and Inflammation. Biofactors 2021; 47(2):170-80.
16- Ganceviciene R, Liakou AI, Theodoridis A, Makrantonaki E, Zouboulis CC. Skin Anti-Aging Strategies. Dermato-endocrinology 2012; 4(3): 308-19.
17- Zouboulis CC, Ganceviciene R, Liakou AI, Theodoridis A, Elewa R, Makrantonaki E. Aesthetic Aspects of Skin Aging, Prevention, and Local Treatment. Clin Dermatol 2019; 37(4): 365-72.
18- Mbituyimana B, Mao L, Hu S, Ullah MW, Chen K, Fu L, et al. Bacterial Cellulose/Glycolic Acid/Glycerol Composite Membrane as a System to Deliver Glycolic Acid for Anti-Aging Treatment. Journal of Bioresources and Bioproducts 2021; 6(2): 129-41.
19- Maisel-Campbell AL, Ismail A, Reynolds KA, Poon E, Serrano L, Grushchak S, et al. A Systematic Review of the Safety and Effectiveness of Platelet-Rich Plasma (PRP) for Skin Aging. Arch Dermatol Res 2020; 312(5): 301-15.
20- Falk NA. Surfactants as Antimicrobials: A Brief Overview of Microbial Interfacial Chemistry and Surfactant Antimicrobial Activity. J Surfactants Deterg 2019; 22(5): 1119-27.
21- Madankar CS, Meshram A. Review on Classification, Physicochemical Properties and Applications of Microbial Surfactants. Tenside Surfactants Detergents 2022; 59(1): 1-16.
22- Pandey R, Krishnamurthy B, Singh HP, Batish DR. Evaluation of a Glycolipopepetide Biosurfactant from Aeromonas Hydrophila RP1 for Bioremediation and Enhanced Oil Recovery. J Cleaner Production 2022; 345: 131098.
23- Sajadi Bami M, Raeisi Estabragh MA, Ohadi M, Banat IM, Dehghannoudeh G. Biosurfactants Aided Bioremediation Mechanisms: A Mini-Review. Soil and Sediment Contamination: An Int J 2022; 31(7): 801-17.
24- Sarubbo LA, Silva MdGC, Durval IJB, Bezerra KGO, Ribeiro BG, Silva IA, et al. Biosurfactants: Production, Properties, Applications, Trends, and General Perspectives. Bioch Eng J 2022; 181: 108377.
25- Eslami P, Hajfarajollah H, Bazsefidpar S. Recent Advancements in the Production of Rhamnolipid Biosurfactants by Pseudomonas Aeruginosa. RSC Advances 2020; 10(56): 34014-32.
26- Du K-z, Li J, Wang L, Hao J, Yang Xj, Gao Xm, et al. Biosurfactant Trehalose Lipid-Enhanced Ultrasound-Assisted Micellar Extraction and Determination of the Main Antioxidant Compounds from Functional Plant Tea. J Separation Sci 2020; 43(4): 799-807.
27- Khandare VC, Madankar CS. An Overview on Trehalolipids: A Promising Eco-Friendly Bio-Surfactant 2024; 61(1): 92-104.
28- Vara Prasad R, Arun Kumar R, Sharma D, Sharma A, Nagarajan S. Sophorolipids and Rhamnolipids as a Biosurfactant: Synthesis and Applications. In Inamuddin, Adetunji CO, Asiri AM, editors. Green Sustainable Process for Chemical and Environmental Engineering and Science, The Netherlands, Elsevier; 2021: 423-72.
29- Madankar CS, Borde PK. Review on Sophorolipids – A Promising Microbial Bio-Surfactant. 2023; 60(2): 95-105.
30- Liu JF, Mbadinga SM, Yang SZ, Gu JD, Mu BZ. Chemical Structure, Property and Potential Applications of Biosurfactants Produced by Bacillus Subtilis in Petroleum Recovery and Spill Mitigation. Int J Mol Sci [Internet]. 2015; 16(3): 4814-37.
31- Théatre A, Cano-Prieto C, Bartolini M, Laurin Y, Deleu M, Niehren J, et al. The Surfactin-Like Lipopeptides from Bacillus Spp.: Natural Biodiversity and Synthetic Biology for a Broader Application Range. Front Bioeng Biotech 2021; 9.
32- Ron EZ, Rosenberg E. Natural Roles of Biosurfactants. Environ Micro 2001; 3(4): 229-36.
33- Kowall M, Vater J, Kluge B, Stein T, Franke P, Ziessow D. Separation and Characterization of Surfactin Isoforms Produced by Bacillus Subtilis OKB 105. J Colloid Interface Sci 1998; 204(1): 1-8.
34- Saranraj P, Zayyed R, Sivasakthivelan P, Devi MD, Al—Tawaha ARM, Sivasakthi S. Microbial Biosurfactants Sources, Classification, Properties and Mechanism of Interaction. In: Sayyed RZ, El-Enshasy, editors. Microbial Surfactants: Volume 2: Applications in Food and Agriculture. 1st ed. Boca Raton: CRC Press; 2022; 1-24.
35- Nikolova C, Gutierrez T. Biosurfactants and their Applications in the Oil and Gas Industry: Current State of Knowledge and Future Perspectives. Front Bioeng Biotechnol 2021; 9.
36- Siddharth T, Sridhar P, Vinila V, Tyagi RD. Environmental Applications of Microbial Extracellular Polymeric Substance (EPS): A Review. J Environ Manag 2021; 287: 112307.
37- Ali N, Abbas SAAA, Sharif L, Shafiq M, Kamran Z, Masah, et al. Chapter 13 - Microbial Extracellular Polymeric Substance and Impacts on Soil Aggregation. In: Abd-Elsalam KA, Mohamed HI, editors. Bacterial Secondary Metabolites: Elsevier; 2024: 221-37.
38- Patel RJ, Patel AA, Raval MA, Pandya V, Alexander A, Ajazuddin. Chapter 2 - Optimization and Characterization of Various Biosurfactant and Application in Food Industries. In: Inamuddin, Adetunji CO, editors. Applications of Next Generation Biosurfactants in the Food Sector: Academic Press; 2023: 17-42.
39- Herzog M, Tiso T, Blank LM, Winter R. Interaction of Rhamnolipids wwith Model Biomembranes of Varying Complexity. Biochim Biophys Acta 2020; 1862(11): 183431.
40- Kuyukina MS, Ivshina IB, Baeva TA, Kochina OA, Gein SV, Chereshnev VA. Trehalolipid Biosurfactants from Nonpathogenic Rhodococcus Actinobacteria with Diverse Immunomodulatory Activities. N Biotechnol 2015; 32(6): 559-68.
41- Jimoh AA, Senbadejo TY, Adeleke R, Lin J. Development and Genetic Engineering of Hyper-Producing Microbial Strains for Improved Synthesis of Biosurfactants. Mol Biotech 2021; 63(4): 267-88.
42- Li G, Yi X, Jiang J, Zhang Y, Li Y. Dynamic Surface Properties and Dilational Rheology of Acidic and Lactonic Sophorolipids at the Air-Water Interface. Colloids and Surfaces B: Biointerfaces 2020; 195: 111248.
43- Coelho ALS, Feuser PE, Carciofi BAM, de Andrade CJ, de Oliveira D. Mannosylerythritol Lipids: Antimicrobial and Biomedical Properties. Appl Microb Biotechnol 2020; 104(6): 2297-318.
44- Tong Y, Zhang J, Wang L, Wang Q, Huang H, Chen X, et al. Hyper-Synergistic Antifungal Activity of Rapamycin and Peptide-Like Compounds Against Candida Albicans Orthogonally Via Tor1 Kinase. ACS Infect Dis 2021; 7(10): 2826-35.
45- Nakamoto H, Yokoyama Y, Suzuki T, Miyamoto Y, Fujishiro T, Morikawa M, et al. A Cyclic Lipopeptide Surfactin is a Species-Selective Hsp90 Inhibitor that Suppresses Cyanobacterial Growth. J Biochem 2021; 170(2): 255-64.
46- Rodríguez-López L, Rincón-Fontán M, Vecino X, Cruz JM, Moldes AB. Extraction, Separation and Characterization of Lipopeptides and Phospholipids from Corn Steep Water. Sep Purif Technol 2020; 248: 117076.
47- Raeisi Estabragh MA, Behnam B, Torkzadeh-Mahani M, Pardakhty A. Niosome as a Drug Delivery Carrier for Sorafenib: Preparation, Investigation of Physicochemical Properties, and in Vitro Effects on Hepg2 Cell Line. Adv Pharm Bull 2024; 14(4): 836-45.
48- Raeisi Estabragh MA, Pardakhty A, Ahmadzadeh S, Dabiri S, Malekpour Afshar R, Farajli Abbasi M. Successful Application of Alpha Lipoic Acid Niosomal Formulation in Cerebral Ischemic Reperfusion Injury in Rat Model. Adv Pharm Bull 2022; 12(3): 541-9.
49- Ahmadi Borhanabadi M, Raeisi Estabragh MA, Dehghannoudeh G, Banat IM, Ohadi M, Moshafi MH. Optimization of Calcium Alginate Hydrogel Bioencapsulation of Acinetobacter Junii B6, A Lipopeptide Biosurfactant Producer. Jundishapur J Nat Pharm Prod 2023; 18(2): e134325.
50- Sepehr A, Mohammad Amin Raeisi E, Amirhossein N, Mandana O, Mohammad Hassan M, Ibrahim MB, et al. Preparation and Physicochemical Properties of a Thermosensitive Hydrogel-Based Lipopeptide Biosurfactant. Letters in Drug Design & Discovery 2024; 21(17): 3757-64.[Persian]
51- Bagheri AM, Raeisi Estabragh MA, Pardakhty A, Banat IM, Ohadi M, Amirheidari B. Potential Biomedical Applications of Biosurfactants Derived from Extremophilic Bacteria: A Review. Biocatalysis and Agricultural Biotechnology 2025; 63: 103455.
52- Farage MA, Miller KW, Maibach HI. Textbook of Aging Skin. Springer Berlin, Heidelberg: Springer Science & Business Media; 2009.
53- Fenibo EO, Ijoma GN, Selvarajan R, Chikere CB. Microbial Surfactants: The Next Generation Multifunctional Biomolecules for Applications in the Petroleum Industry and Its Associated Environmental Remediation. Microorganisms 2019; 7(11): 581.
54- Schonhoff A, Stöckigt G, Wulf C, Zapp P, Kuckshinrichs W. Biosurfactants' Production with Substrates from the Sugar Industry–Environmental, Cost, Market, and Social Aspects. RSC Sustainability 2023; 1(7): 1798-813.
55- Jahan R, Bodratti AM, Tsianou M, Alexandridis P. Biosurfactants, Natural Alternatives to Synthetic Surfactants: Physicochemical Properties and Applications. Advances in Colloid and Interface Sci 2020; 275: 102061.
56- Vecino X, Cruz J, Moldes A, Rodrigues L. Biosurfactants in Cosmetic Formulations: Trends and Challenges. Critical reviews in biotechnol 2017; 37(7): 911-23.
57- Ahmadi-Ashtiani H-R, Baldisserotto A, Cesa E, Manfredini S, Sedghi Zadeh H, Ghafori Gorab M, et al. Microbial Biosurfactants as Key Multifunctional Ingredients for Sustainable Cosmetics. Cosmetics 2020; 7(2): 46.
58- Bagheri AM, Mirzahashemi M, Salarpour S, Dehghnnoudeh Y, Banat IM, Ohadi M, et al. Potential Anti-Aging Applications of Microbial-Derived Surfactantsin Cosmetic Formulations. Critical Reviews in Biotechnology 2024; 1-22.
59- Shu Q, Lou H, Wei T, Liu X, Chen Q. Contributions of Glycolipid Biosurfactants and Glycolipid-Modified Materials to Antimicrobial Strategy: A Review. Pharmaceutics 2021;13(2): 227.
60- Xiao F, Xu T, Lu B, Liu R. Guidelines For Antioxidant Assays For Food Components. Food Frontiers 2020; 1(1): 60-9.
61- Rinnerthaler M, Bischof J, Streubel MK, Trost A, Richter K. Oxidative Stress in Aging Human Skin. Biomolecules 2015; 5(2): 545-89.
62- Kageyama H, Waditee-Sirisattha R. Antioxidative, Anti-Inflammatory, And Anti-Aging Properties of Mycosporine-Like Amino Acids: Molecular and Cellular Mechanisms in the Protection of Skin-Aging. Mar Drugs 2019; 17(4): 222.
63- Munteanu IG, Apetrei C. Analytical Methods Used in Determining Antioxidant Activity: A Review. Int J Mol Sci 2021; 22(7): 3380.
64- Apak Ra. Current Issues in Antioxidant Measurement. J Agric Food Chem 2019; 67(33): 9187-202.
65- Tabbene O, Gharbi D, Slimene IB, Elkahoui S, Alfeddy MN, Cosette P, et al. Antioxidative and DNA Protective Effects of Bacillomycin D-Like Lipopeptides Produced by B38 Strain. Applied biochem biotechnol 2012; 168: 2245-56.
66- Pardhi Ds, Panchal Rr, Raval Vh, Joshi Rg, Poczai P, Almalki W, et al. Microbial Surfactants: A Journey from Fundamentals to Recent Advances. Front Microbiol 2022: 2877.
67- Concaix FB inventors. Use of Sophorolipids Comprising Diacetyl Lactones as Agent for Stimulating Skin Fibroblast Metabolism. US6596265B1; 2003-07-22.
68- Ceresa C, Fracchia L, Fedeli E, Porta C, Banat IM. Recent Advances in Biomedical, Therapeutic and Pharmaceutical Applications of Microbial Surfactants. Pharmaceut 2021; 13(4): 466.
69- Gupta S, Raghuwanshi N, Varshney R, Banat IM, Srivastava AK, Pruthi PA, et al. Accelerated in Vivo Wound Healing Evaluation of Microbial Glycolipid Containing Ointment as a Transdermal Substitute. Biomed & Pharm 2017; 94: 1186-96.
70- Kim K, Jung SY, Lee DK, Jung J-K, Park JK, Kim DK, et al. Suppression of Inflammatory Responses by Surfactin, A Selective Inhibitor of Platelet Cytosolic Phospholipase A2. Biochem Pharmacol 1998; 55(7): 975-85.
71- Gan P, Gao Z, Zhao X, Qi G. Surfactin Inducing Mitochondria-Dependent ROS to Activate Mapks, NF-Κb and Inflammasomes in Macrophages for Adjuvant Activity. Sci Rep 2016; 6(1): 39303.
72- Zhang Y, Liu C, Dong B, Ma X, Hou L, Cao X, et al. Anti-Inflammatory Activity and Mechanism of Surfactin in Lipopolysaccharide-Activated Macrophages. Inflam 2015; 38: 756-64.
73- Park SY, Kim YH, Kim E-K, Ryu EY, Lee S-J. Heme Oxygenase-1 Signals are Involved in Preferential Inhibition of Pro-Inflammatory Cytokine Release by Surfactin in Cells Activated with Porphyromonas Gingivalis Lipopolysaccharide. Chemico-biological interaction 2010; 188(3): 437-45.
74- Mehrabani M, Esmaeili-Tarzi M, Forootanfar H, Nematollahi MH, Banat IM, Ohadi M, et al. Lipopeptide Biosurfactant from Acinetobacter Junii B6: A Promising Natural Surfactant for Promoting Angiogenesis. Int J Peptide Res Therapeutics 2021; 27: 1197-203.
75- Guin M, Singh N. Applications of Biosurfactant as Solubilizers and Wetting Agents. Applications of Next Generation Biosurfactants in the Food Sector: Elsevier; 2023; 279-306.
76- Gautam K, Tyagi V. Microbial Surfactants: A Review. J Oleo Sci 2006; 55(4): 155-66.
77- Kwaśniewska D. Biosurfactants as Determinants of the Quality Anti-Aging Products. Tenside Surfactants Detergents 2024; 61(3): 259-64.
78- Bhatt T, Bhimani A, Detroja A, Gevariya D, Sanghvi G. Cosmetic Application of Surfactants from Marine Microbes. Marine Surfactants: CRC Press; 2023: 271-93.
79- Karnwal A, Shrivastava S, Al-Tawaha ARMS, Kumar G, Singh R, Kumar A, et al. Microbial Biosurfactant as an Alternate to Chemical Surfactants for Application in Cosmetics Industries in Personal and Skin Care Products: A Critical Review. BioMed Res Int 2023; 2023(1): 2375223.
80- Adu SA, Naughton PJ, Marchant R, Banat IM. Microbial Biosurfactants in Cosmetic and Personal Skincare Pharmaceutical Formulations. Pharmaceutics 2020; 12(11): 1099.
81- Soberón‐Chávez G, González‐Valdez A, Soto‐Aceves MP, Cocotl‐Yañez M. Rhamnolipids Produced by Pseudomonas: From Molecular Genetics to the Market. Microbial Biotechnol 2021; 14(1): 136-46.
82- Zhu P, Zhang S, Kumar R, Zhang Z, Zhang Z, Wang Y, et al. Rhamnolipids from Non-Pathogenic Acinetobacter Calcoaceticus: Bioreactor-Scale Production, Characterization and Wound Healing Potency. New Biotechnol 2022; 67: 23-31.
83- Haque E, Kayalvizhi K, Hassan S. Biocompatibility, Antioxidant and Anti-Infective Effect of Biosurfactant Produced by Marinobacter Litoralis MB15. Int J Pharm Invest 2020; 10(2).
84- Celligoi MAP, Silveira VA, Hipólito A, Caretta TO, Baldo C. Sophorolipids: A Review on Production and Perspectives of Application in Agriculture. Spanish J Agricultural Res 2020; 18(3): e03R1-eR1.
85- Roelants S, Solaiman DK, Ashby RD, Lodens S, Van Renterghem L, Soetaert W. Production and Applications of Sophorolipids. Biobased Surfactants 2019: 65-119.
86- Ahmadi-Ashtiani HR, Baldisserotto A, Cesa E, Manfredini S, Sedghi Zadeh H, Ghafori Gorab M, et al. Microbial Biosurfactants as Key Multifunctional Ingredients for Sustainable Cosmetics. Cosmetics 2020; 7(2): 46.
87- Wu YS, Ngai SC, Goh BH, Chan KG, Lee LH, Chuah LH. Anticancer Activities of Surfactin and Potential Application of Nanotechnology Assisted Surfactin Delivery. Front Pharmacol 2017; 8: 761.
88- Chen X, Lu Y, Shan M, Zhao H, Lu Z, Lu Y. A Mini-Review: Mechanism of Antimicrobial Action and Application of Surfactin. World J Microbiol Biotechnol 2022; 38(8): 143.
89- Gunther IV NW, Nunez A, Fett W, Solaiman DK. Production of Rhamnolipids by Pseudomonas Chlororaphis, A Nonpathogenic Bacterium. Applied Environ Microbiol 2005; 71(5): 2288-93.
90- Chen J, Wu Q, Hua Y, Chen J, Zhang H, Wang H. Potential Applications of Biosurfactant Rhamnolipids in Agriculture and Biomedicine. Applied Microbiology and Biotech 2017; 101: 8309-19.
91- Twigg MS, Adu SA, Sugiyama S, Marchant R, Banat IM. Mono-Rhamnolipid Biosurfactants Synthesized by Pseudomonas Aeruginosa Detrimentally Affect Colorectal Cancer Cells. Pharm 2022; 14(12): 2799.
92- Abdollahi S, Tofighi Z, Babaee T, Shamsi M, Rahimzadeh G, Rezvanifar H, et al. Evaluation of Anti-Oxidant and Anti-Biofilm Activities of Biogenic Surfactants Derived from Bacillus Amyloliquefaciens And Pseudomonas Aeruginosa. Iran J Pharmaceutical Res: IJPR 2020; 19(2): 115.
93- Zhang B, Chen G, Zhang H, Lan J, Yang C. Effects of Rhamnolipids on Growth Performance and Intestinal Health Parameters in Linnan Yellow Broilers. Poultry Sci 2021; 100(2): 810-9.
94- Syldatk C, Lang S, Wagner F, Wray V, Witte L. Chemical and Physical Characterization of Four Interfacial-Active Rhamnolipids From Pseudomonas Spec. DSM 2874 Grown on N-Alkanes. Z Naturforsch C Biosci 1985; 40(1-2): 51-60.
95- Khaje Bafghi M, Fazaelipoor MH. Application of Rhamnolipid in the Formulation of A Detergent. J Surfactants and Detergents 2012; 15: 679-84.
96- Piljac T, Piljac G. Use of Rhamnolipids in Wound Healing, Treating Burn Shock, Atherosclerosis, Organ Transplants, Depression, Schizophrenia and Cosmetics. WO1999043334A1; 1999.
97- Martinez V, Corsini E, Mitjans M, Pinazo A, Vinardell MP. Evaluation of Eye and Skin Irritation of Arginine-Derivative Surfactants Using Different in Vitro Endpoints as Alternatives to the in Vivo Assays. Toxicol Lett 2006; 164(3): 259-67.
98- Zhang L, Somasundaran P, Singh SK, Felse AP, Gross R. Synthesis and Interfacial Properties of Sophorolipid Derivatives. Colloids and Surfaces A: Physicochemical and Engineering Aspects 2004; 240(1-3): 75-82.
99- Varvaresou A, Iakovou K. Biosurfactants in Cosmetics and Biopharmaceuticals. Letters in Applied Microbiol 2015; 61(3): 214-23.
100- Bidyarani N, Jaiswal J, Shinde P, Kumar U. Recent Developments and Future Prospects of Fungal Sophorolipids. Progress in Mycology: Biology and Biotechnological Applications 2022: 573-91.
101- Peng S, Li Z, Zou L, Liu W, Liu C, McClements DJ. Enhancement of Curcumin Bioavailability by Encapsulation in Sophorolipid-Coated Nanoparticles: An in Vitro and in Vivo Study. J Agricul Food Chem 2018; 66(6): 1488-97.
102- Xu R, Ma L, Chen T, Wang J. Sophorolipid Suppresses LPS-Induced Inflammation in RAW264. 7 Cells Through the NF-Κb Signaling Pathway. Molecul 2022; 27(15): 5037.
103- Inès M, Dhouha G. Glycolipid Biosurfactants: Potential Related Biomedical and Biotechnological Applications. Carbohydrate Res 2015; 416: 59-69.
104- Miceli TR, Corr TD, Barroso MM, Dogra N, Gross AR. Sophorolipids: Anti-Cancer Activities and Mechanisms. Bioorg Med Chem 2022; 65: 116787.
105- Mishra S, Chen S, Bharagava RN. Environmental and Industrial Applications of Biosurfactants. Microbial Biotechnology: Role in Ecological Sustainability and Res 2022; 104(3): 129-41.
106- Callaghan B, Twigg MS, Baccile N, Van Bogaert IN, Marchant R, Mitchell CA, et al. Microbial Sophorolipids Inhibit Colorectal Tumour Cell Growth in Vitro and Restore Haematocrit in Apcmin+/− Mice. App Microbiol Biotechnol 2022; 106(18): 6003-16.
107- Hirata Y, Ryu M, Oda Y, Igarashi K, Nagatsuka A, Furuta T, et al. Novel Characteristics of Sophorolipids, Yeast Glycolipid Biosurfactants, as Biodegradable Low-Foaming Surfactants. J Biosci Bioeng 2009; 108(2): 142-6.
108- Klosowska-Chomiczewska I, Medrzycka K, Karpenko E. Biosurfactants–Biodegradability, Toxicity, Efficiency in Comparison with Synthetic Surfactants. Adv Chem Mech Eng 2011; 2: 1-9.
109- Van Bogaert IN, Zhang J, Soetaert W. Microbial Synthesis of Sophorolipids. Process Biochem 2011; 46(4): 821-33.
110- Zanotto AW, Valério A, de Andrade CJ, Pastore GM. New Sustainable Alternatives to Reduce the Production Costs for Surfactin 50 Years after the Discovery. Applied Microbiology and Biotech 2019; 103(21): 8647-56.
111- Guilmanov V, Ballistreri A, Impallomeni G, Gross RA. Oxygen Transfer Rate and Sophorose Lipid Production by Candida Bombicola. Biotech and Bioeng 2002; 77(5): 489-94.
112- de Andrade CJ, Coelho ALS, Feuser PE, de Andrade LM, Carciofi BAM, de Oliveira D. Mannosylerythritol Lipids: Production, Downstream Processing, and Potential Applications. Current Opinion in Biotechnol 2022; 77: 102769.
113- BioReNuva. Skin Calming Toner (Formula: T197-009) [Internet]. [cited 2024 Nov 5]; Available from: https://biorenuva.com/formulations.
114- BioReNuva. Light and Airy Foam Cleanser (Formula: T197-011) [Internet]. [cited 2024 Nov 5]; Available from: https://biorenuva.com/formulations.
115- Care EP. Very Mild Foaming Cleansing Cream [Internet]. [cited 2024 Nov 5]; Available from: https://personal-care.evonik.com/en/formulation/FORM_2116581?name=Very-mild-foaming-cleansing-cream.
نوع مطالعه: مروری |
موضوع مقاله:
فارماسئوتیکس
دریافت: 1403/9/8 | پذیرش: 1403/11/3 | انتشار: 1404/3/15
دریافت: 1403/9/8 | پذیرش: 1403/11/3 | انتشار: 1404/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







