دوره 32، شماره 11 - ( بهمن 1403 )
جلد 32 شماره 11 صفحات 8379-8366 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Fathi F, Zeinoddini M. Phage Therapy: Past، Present and Future. JSSU 2025; 32 (11) :8366-8379
URL: http://jssu.ssu.ac.ir/article-1-6328-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6328-fa.html
فتحی فرزانه، زینالدینی مهدی. فاژتراپی: گذشته، حال و آینده. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (11) :8366-8379
متن کامل [PDF 1107 kb]
(355 دریافت)
| چکیده (HTML) (1033 مشاهده)
References:
1- Gordillo Altamirano FL، Barr JJ. Phage Therapy in the Postantibiotic Era. Clin Microbiol Rev 2019; 32(2): e00066-18.
2- Palma M. Aspects of Phage-Based Vaccines for Protein and Epitope Immunization. Vaccines 2023; 11(2): 436.
3- Anyaegbunam NJ، Anekpo CC، Anyaegbunam ZK، Doowuese Y، Chinaka CB، Odo OJ، et al. The Resurgence of Phage-Based Therapy in the Era of Increasing Antibiotic Resistance: From Research Progress to Challenges and Prospects. Microbiol Res 2022; 264: 127155.
4- Luong T، Salabarria AC، Roach DR. Phage Therapy in the Resistance Era: Where Do We Stand and Where are We Going? Clin Ther 2020; 42(9): 1659-80.
5- Paramasivam K، Shen Y، Yuan J، Waheed I، Mao C، Zhou X. Advances in the Development of Phage-Based Probes for Detection of Bio-Species. Biosensors 2022; 12(1): 30.
6- Kim SM، Heo HR، Kim CS، Shin HH. Genetically Engineered Bacteriophages as Novel Nanomaterials: Applications Beyond Antimicrobial Agents. Ront Bioeng Biotechnol 2024; 12: 1319830.
7- Pirnay JP، Ferry T، Resch G. Recent Progress Toward the Implementation of Phage Therapy in Western Medicine. FEMS Microbiol Rev 2022; 46(1): fuab040.
8- Samaee HR، Eslami G، Rahimzadeh G، Saeedi M، Badabi AD، Asare-Addo K، et al. Inhalation Phage Therapy as a New Approach to Preventing Secondary Bacterial Pneumonia in Patients with Moderate to Severe COVID-19: A Double-Blind Clinical Trial Study. J Drug Deliv Sci Technol 2023; 84: 104486.
9- Ragothaman M، Yoo SY. Engineered Phage-Based Cancer Vaccines: Current Advances and Future Directions. Vaccines (Basel) 2023; 11(5): 919.
10- Nazir A، Song J، Chen Y، Liu Y. Phage-Derived Depolymerase: Its Possible Role for Secondary Bacterial Infections in COVID-19 Patients. Microorganisms 2023; 11(2): 424.
11- Ul Haq I، Krukiewicz K، Yahya G، Haq MU، Maryam S، Mosbah RA، et al. The Breadth of Bacteriophages Contributing to the Development of the Phage-Based Vaccines for COVID-19: An Ideal Platform to Design the Multiplex Vaccine. Int J Mol Sci. 2023; 24(2): 1536.
12- Rehman S، Ali Z، Khan M، Bostan N، Naseem S. The Dawn of Phage Therapy. Rev Med Virol 2019; 29(4): e2041.
13- Fadaie M، Dianat-Moghadam H، Ghafouri E، Naderi S، Darvishali MH، et al. Unraveling the Potential of M13 Phages in Biomedicine: Advancing Drug Nanodelivery and Gene Therapy. Environ Res 2023: 238(Pt 1): 11713.
14- Chang C، Guo W، Yu X، Guo C، Zhou N، Guo X، et al. Engineered M13 Phage as A Novel Therapeutic Bionanomaterial for Clinical Applications: From Tissue Regeneration to Cancer Therapy. Mater Today Bio 2023; 20: 100612.
15- García-Cruz JC، Huelgas-Méndez D، Jiménez-Zúñiga JS، Rebollar-Juárez X، Hernández-Garnica M، Fernández-Presas AM، et al. Myriad Applications of Bacteriophages Beyond Phage Therapy. PeerJ 2023; 11: e15272.
16- Dong X، Pan P، Zheng DW، Bao P، Zeng X، Zhang XZ. Bioinorganic Hybrid Bacteriophage for Modulation of Intestinal Microbiota to Remodel Tumor-Immune Microenvironment Against Colorectal Cancer. Sci Adv 2020; 6(20): eaba1590.
17- Petrenko VA، Gillespie JW، De Plano LM، Shokhen MA. Phage-Displayed Mimotopes of SARS-Cov-2 Spike Protein Targeted to Authentic and Alternative Cellular Receptors. Viruses 2022; 14(2): 384.
18- Balcha FB، Neja SA. CRISPR-Cas9 Mediated Phage Therapy as an Alternative to Antibiotics. Animal Diseases 2023; 3(1): 1-1.
19- Pires DP، Costa AR، Pinto G، Meneses L، Azeredo J. Current Challenges and Future Opportunities of Phage Therapy. FEMS Microbiol Rev 2020; 44(6): 684-700.
20- Young MJ، Hall LM، Merabishvilli M، Pirnay JP، Clark JR، Jones JD. Phage Therapy for Diabetic Foot Infection: A Case Series. Clin Ther 2023; 45(8): 797-801.
21- Melo LD، Oliveira H، Pires DP، Dabrowska K، Azeredo J. Phage Therapy Efficacy: A Review of the Last 10 Years of Preclinical Studies. Crit Rev Microbiol 2020; 46(1): 78-99.
22- Pierzynowska K، Morcinek-Orłowska J، Gaffke L، Jaroszewicz W، Skowron PM، Węgrzyn G. Applications of the Phage Display Technology in Molecular Biology، Biotechnology and Medicine. Crit Rev Microbiol. 2024; 50(4): 450-90.
23- Nilsson AS. Pharmacological Limitations of Phage Therapy. Ups J Med Sci 2019; 124(4): 218-27.
24- Lin J، Du F، Long M، Li P. Limitations of Phage Therapy and Corresponding Optimization Strategies: A Review. Molecules 2022; 27(6): 1857.
25- Nagel T، Musila L، Muthoni M، Nikolich M، Nakavuma JL، Clokie MR. Phage Banks as Potential Tools to Rapidly and Cost-Effectively Manage Antimicrobial Resistance in the Developing World. Curr Opin Virol 2022; 53: 101208.
26- Altamirano FL، Barr JJ. Unlocking the Next Generation of Phage Therapy: The Key is in the Receptors. Curr Opin Virol 2021; 68: 115-23.
27- Jędrusiak A، Fortuna W، Majewska J، Górski A، Jończyk-Matysiak E. Phage Interactions with the Nervous System in Health and Disease. Cells 2023; 12(13): 1720.
28- Gelman D، Yerushalmy O، Alkalay-Oren S، Rakov C، Ben-Porat S، Khalifa L، et al. Clinical Phage Microbiology: A Suggested Framework and Recommendations for the In-Vitro Matching Steps of Phage Therapy. Lancet Microbe 2021; 2(10): e555- 63.
متن کامل: (929 مشاهده)
مقدمه
فاژدرمانی اولین بار توسط Felix d’Herelle بیش از یک قرن پیش کشف شد و از آن زمان بهعنوان یک ابزار مؤثر در توسعه زیستشناسی و درمان عفونتهای باکتریایی مورد توجه قرارگرفته است. استفاده از فاژها بهعنوان تنها عوامل درمانی در طول دوره عفونت باکتریایی به بیمار، فاژدرمانی معمولی گفته میشود (1). باکتریوفاژها، ویروسهایی هستند که بهطور اختصاصی در باکتریها تکثیر میشوند و بهعنوان یکی از اشکال زنده غالب روی این سیاره شناخته میشوند. این ویروسها به سلولهای باکتریایی حمله کرده و در آنها تکثیر میشوند، و به همین دلیل بهعنوان ابزاری مؤثر در درمان عفونتهای باکتریایی مورد توجه قرار گرفتهاند (3،2). فاژدرمانی، بهویژه پروتئینهای مشتقشده از فاژ، به عنوان یک عامل ضدمیکروبی قوی، مدتها قبل از کشف پنیسیلین شناختهشده بود. با کشف پنیسیلین و سایر آنتیبیوتیکها در دهه 1940، فاژدرمانی بهتدریج کنار گذاشته شد. درحالحاضر، فاژدرمانی در ایالاتمتحده برای ضدعفونی کردن مواد غذایی و سطوح، دام و محصولات گیاهی بهکار میرود. در روسیه و گرجستان، محصولات مبتنی بر فاژ برای درمان عفونتهای باکتریایی مقاوم به درمانهای مرسوم در دسترس هستند (3). فاژها، باکتریهای گرم مثبت و منفی را آلوده کرده و معمولاً تحت تأثیر مقاومت آنتیبیوتیکی قرار نمیگیرند، که این ویژگی آنها را به ابزار موثری در مقابله با باکتریهای مقاوم به چند دارو (Multi Drug Resistant ،MDR، and XDR، Extensively Drug Resistant) تبدیل کرده است. فاژهای بدخیم با چرخه لیتیک(lytic cycle) بهدلیل توانایی در ایجاد شکست سلولی و کاهش خطر انتقال ژن افقی از طریق ترانسداکشن(Transduction) ، برای اهداف درمانی ترجیح داده میشوند. فاژدرمانی به دو شکل مونوفاژ (استفاده از یک فاژ) و پلیفاژ (استفاده از چند فاژ، معروف به کوکتل فاژ) انجام میشود (4،3). با توجه به تواناییهای متعدد و کاربردهای گسترده، فاژها نقش کلیدی در آینده تحقیقات و درمانهای زیستپزشکی ایفا خواهند کرد. ما در این مقاله قصد داریم پیشرفتهای اخیر در این زمینه و ظرفیتهای بینظیر فاژها برای توسعه درمانهای جدید و بهبود سلامت انسانها را بررسی کنیم.
روش بررسی
این مطالعه مروری روایتی با استفاده از مقالات مرتبط از پایگاههای علمی معتبر انگلیسی مانند ProQuest، PubMed، Scopus و موتور جستجوی Google Scholar در بازه زمانی 2019 تا 2024 انجام شد. کلیدواژههای phage therapy، Phage vaccine و Phage display و ترکیبات احتمالی آنها برای جستجو استفاده شد. پس از حذف موارد تکراری و ارزیابی عنوان و چکیده، 28 مقاله برای مطالعه انتخاب شدند. ابتدا خلاصهای از کاربردهای غیردرمانی فاژها ارایه میگردد، سپس در بخش کاربردهای درمانی به بیان واکسنهای فاژی، درمان بیماری سرطان و کووید ۱۹ با استفاده از فاژها، نقش فاژها در بازسازی بافت، بهکارگیری فناوری کریسپر در مقابله با باکتریها و درمان عفونتهای باکتریایی اشاره خواهد شد.
نتایج
1.کاربردهای غیردرمانی: فاژها بهعنوان نانومواد در توسعه کاوشگرهای زیستی مبتنی¬بر فاژ برای تشخیص موادی مانند DNA، پروتئینها، باکتریها، قارچها و انگلها استفاده میشوند. بهعنوان مثال، در سال 2017، He و همکاران یک پروب مغناطیسی PAP1 را برای تشخیص سودوموناس آئروژینوزا توسعه دادند. این پروب ابتدا به باکتری متصل شده، سپس با آلوده کردن آن، باکتری لیز شده و ATP آزاد میگردد که بهوسیله سیستم شبتابی لوسیفراز-ATP بیولومینسانس شناسایی شد (شکل۱-الف). در سال 1938، فاژها برای طبقهبندی باکتریها براساس تایپ فاژی مورد استفاده قرارگرفتند. فاژتایپینگ براساس تفاوت حساسیت باکتری¬ها به فاژها امکان شناسایی جنسها و گونهها را فراهم می¬کند. از خواص نوری نانومواد میتوان برای تشخیص سریع و حساس استفاده کرد. بهعنوان مثال، برخی از نانومواد فلزی (نقره یا طلا) دارای اثرات تشدید پلاسمونی قوی هستند، بنابراین میتوانند مستقیماً حضور و کمیت اشیاء کشف شده در نمونهها را هنگامی که کاوشگرهای هیبریدی جذب کرده و با اهداف مورد نظر کمپلکس تشکیل میدهند، منعکس کنند (۵). حسگرهای رنگسنجی توجه قابلتوجهی را در زمینه حسگرهای زیستی مبتنی بر باکتریوفاژ M13 به دلیل مزایایی مانند فرآیندهای ساخت آسان و روشهای تشخیص سریع و مستقیم به خود جلب کردهاند. Moon و همکارانش گزارش کردند که دو نوع حسگر ساختاری مبتنی بر رنگ با استفاده از فاژهای M13 مهندسی شده است. ماتریسهای رنگی ساختاری براساس فاژها به سادگی با کنترل سرعت کشش بستههای فاژ M13 عاملدار ساخته شدند. این سیستم هنگام قرارگرفتن در معرض حلالهای آلی، آنتیبیوتیکها و مواد شیمیایی مضر مانند ترینیتروتولوئن تغییرات رنگ قابلتوجهی را نشان میدهد. از این پتانسیل بهعنوان پلتفرمی برای نظارت بر محیط زیست در زمان واقعی استفاده میشود (6).

شکل1: الف- ترکیب فاژ و مهره مغناطیسی همجوشی بسیار ویژه برای ساخت یک پروب خاص برای غنیسازی سودوموناس آئروژینوزا و آزادسازی ATP از باکتری از طریق لیز فاژ (5). ب- کاربردهای بالینی فاژ M13 در تحویل ژن و دارو، فاژتراپی، کشف دارو، توسعه واکسن و تشخیص گونههای زیستی (13).
2. کاربردهای درمانی: استفاده بیرویه از آنتیبیوتیکها منجر به ظهور پاتوژنهای MDR شده است. فاژها با داشتن مکانیسمهای ضدباکتری متعدد میتوانند عفونتهای مقاوم به دارو را کاهش دهند (4). فاژهای لیتیک بدون تأثیر بر فلور طبیعی بدن و سلولهای یوکاریوتی در محل عفونت تکثیر میشوند و نیازی به تنظیم دقیق دوز ندارند، زیرا تعداد آنها بهصورت خودکار در محل عفونت افزایش مییابد (8،7). پلاستیسیته ژنتیکی فاژها امکان تغییر سطح و استفاده از آنها را برای اهداف پزشکی آیندهنگر فراهم میکند (9). فاژ M13 بهعنوان نانوحامل چندظرفیتی عمل میکند و میتواند پپتیدها یا آنتیبادیهای هدفمند را نمایش دهد تا تحویل دارو را بهبود بخشد و از ساختار نازک نانوالیاف مانند خود برای نفوذ به موانع بهویژه مغز استفاده کند (شکل ۱-ب) (10). این ویژگیها نشاندهنده پتانسیل بالای فاژها در تحویل هدفمند دارو و واکسن و مقابله با مقاومت آنتیبیوتیکی است (11). روش نمایش فاژ، که توسط Smith در سال 1985 معرفی شد، شامل تزئین کپسید فاژ با پپتیدها یا پروتئینها است و بهعنوان ابزار مؤثری در انتقال عوامل درمانی از جمله ژنها، واکسنها و داروها، هدفگیری سلولهای یوکاریوتی، طراحی نانومواد، تحقیقات و درمان سرطان، تصویربرداری زیستی و بسیاری کاربردهای دیگر نقش مهمی ایفا میکند و رویکردی موثر برای شناسایی پروتئینها، اپیتوپها، میموتوپ¬ها (mimotope) و آنتیژنها است (شکل ۲-الف) (12). فرآیند غربالگری کتابخانههای فاژ در برابر پروتئینهای هدف با استفاده از انتخاب میل ترکیبی در شرایط آزمایشگاهی به عنوان بیوپنینگ (biopanning) شناخته میشود. این فرآیند شامل انتخاب میل ترکیبی فاژها با پروتئینهای هدف و بررسی کاربردهای بالقوه آنها است، که ممکن است با توالییابی نسل بعدی (Next Generative Sequencing، NGS) بهبود یابد (13). ۱.2. واکسنهای فاژی در مبارزه با بیماریها: واکسیناسیون یکی از مؤثرترین روشها برای پیشگیری از بیماریهای عفونی است. فناوری واکسنهای مبتنی بر فاژ از فاژها به عنوان حاملهایی برای ارائه آنتیژن به سیستم ایمنی استفاده میکند تا پاسخ ایمنی مناسبی برای محافظت در برابر بیماریهای خاص ایجاد شود. این فناوری شامل سه نوع واکسن اصلی است: واکسنهای نمایشی، واکسنهای DNA و واکسنهای هیبریدی (شکل ۲-ب). در واکسنهای نمایشی، از روش نمایش فاژ برای بیان آنتیژنها استفاده میشود. در این روش، فاژها، پروتئینها یا پپتیدهای آنتیژنی را با پروتئینهای پوششی خود بیان میکنند یا آنتیژنها بهصورت شیمیایی به سطوح فاژ متصل میشوند. واکسنهای DNA مبتنی بر فاژ شامل یک قطعه ژنی کدکننده آنتیژن یا تقلید از اپیتوپ ژنوم فاژ هستند که در یک کاست یوکاریوتی در پلاسمید کلون شده و سپس در ذرات فاژ بستهبندی میشود. این فاژها توسط سلولهای ارائهدهنده آنتیژن مانند ماکروفاژها و سلولهای دندریتیک شناسایی و جذب میشوند، که به نوبه خود آنتیژن را بیان کرده و پاسخ ایمنی تطبیقی را آغاز میکنند (1،2،11). واکسنهای هیبریدی ترکیبی از واکسنهای نمایشی و واکسنهای DNA هستند. برای تولید این واکسنها، از چندین فاژ لیتیک و رشتهای استفاده میشود، بهویژه آن¬هایی که در اشریشیاکلای تکثیر میشوند. فاژهای رایج استفاده¬شده در مطالعات انتخابی شامل لامبدا، M13، AP205، T7، MS2، T4، Qβ و M13KE¬ هستند. ذرات فاژ نمیتوانند در سلولهای یوکاریوتی تکثیر شوند، بنابراین ایمنتر از سایر واکسنهای ویروسی هستند. واکسنهای مبتنی بر فاژ معمولاً نیازی به ادجوانت ندارند، زیرا دی-نوکلئوتید دئوکسی سیتیدیلات-فسفات-دئوکسی گوانیلات غیرمتیله در ژنوم فاژ این اثر کمکی را القا میکند. واکسن مبتنی بر فاژ به نام RBDSARS-PLPs یا RBDSARS-PLPs با تزئین ذرات فاژمانند (Phage-like particle ،PLPs) فاژ لامبدا با دومین اتصال به گیرنده (Receptor binding domain ،RBD) نوترکیب از سندروم تنفسی خاورمیانه ساخته شده است (2). واکسن مبتنیبر فاژ محافظت کافی در برابر چندین بیماری ویروسی مانند ویروس نقص ایمنی انسانی، ویروس هرپس سیمپلکس و ویروس پاپیلومای انسانی نوع شانزده ارائه میکند. همچنین فناوری نمایش فاژ، محافظت ضد ویروسی کافی در برابر ویروس هپاتیت سی انسانی و هپاتیت بی انسانی فراهم میکند (2،11). واکسنهای مبتنی بر فاژ علیه عفونتهای باکتریایی شامل کلامیدیا تراکوماتیس، اشرشیاکلای، ویبریوکلرا، بوردتلاپرتوسیس در مدلهای موشی امتحانشده و اثربخش بودهاند. همچنین، واکسنهای مبتنی بر فاژ علیه عفونتهای انگل ریپیسفالوسمیکروپلاس، فاسیولاهپاتیکا و پلاسمودیوم-فالسیپاروم ساخته و آزمایش شدهاند. واکسنهای مبتنی¬بر فاژ علیه بیماریهای غیرعفونی نیز مورد بررسی قرارگرفتهاند. از جمله این بیماریها میتوان به بیماری آلزایمر، دمانس فرونتوتمپورال (Frontotemporal dementia)، رینیت آلرژیک (Allergic rhinitis) ، فشارخون بالا و بیماریهای قلبی و عروقی اشاره کرد (2).
2.2. سرطان سینه و فاژدرمانی: فاژدرمانی بهعنوان روشی نوین و امیدوارکننده در درمان سرطانها، بهویژه سرطان سینه در حال پیشرفت است. در سال 2004، An و همکارانش پپتید ضدسرطانی F56 را از طریق غربالگری کتابخانه فاژ M13 جداسازی کردند که در موشهای دارای نقص ایمنی شدید که با سلولهای سرطان سینه انسانی کاشتهشده بودند، اثرات ضد رگزایی و ضدمتاستاتیک نشان داد. همچنین، آنتیبادی انسانی scFv 12H7 با اثرات مهاری تومور بر روی سلولهای سرطان سینه سهگانه منفی شناسایی شد که بهطور قابلتوجهی اندازه تومور را کاهش داد. پپتید فاژی LGLRGSL نیز که بهطور خاص به سلولهای گذار اپیتلیال - مزانشیمی متصل میشود، بهعنوان ابزاری برای شناسایی اولیه سرطان سینه متاستاتیک معرفی شده است. همچنین، ذرات فاژ M13 نوترکیب توانستهاند هشت ایمونوژن واکسن را نمایش دهند که استفاده از سه مورد از این واکسنها در مدلهای موش T1 BC4 به مهار واضح رشد تومور منجر شده است (14). گیرنده دو فاکتور رشد اپیدرمی انسانی (Human epidermal growth factor receptor-2 ،HER2) که با پیشآگهی ضعیف سرطان سینه مرتبط است، بهعنوان یک هدف واکسن در برابر این بیماری مورد توجه قرارگرفته است. پلتفرم واکسن مبتنی بر فاژ با نمایش HER2 و نوع D16HER2 بر روی فاژهای M13 ایجاد شده و نشان داده که میتواند پاسخهای ایمنی مؤثری علیه سلولهای سرطانی حاوی HER2 ایجاد کند. فاژدرمانی با استفاده از فاژهای M13 بهعنوان روشی نوآورانه در درمان سرطان مطرح شده است (شکل3) (2).
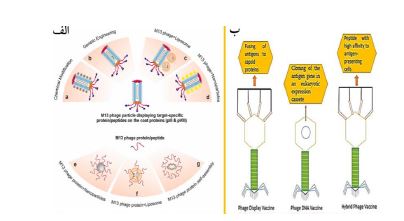
شکل 2: الف- تحویل دارو و ژن با استفاده از ذرات فاژ M13 و پروتئینهای منتقله از فاژ M13(13). ب- تصویری از واکسنهای نمایش فاژ، واکسن های DNA فاژ و واکسنهای فاژ هیبریدی (11).
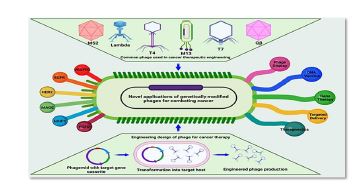
شکل 3: تصویری از مهندسی، کاربرد و انواع فاژهای مورد استفاده در ایمونوتراپی سرطان (2).
3.2. تومور مغزی و فاژدرمانی: گلیوبلاستوما یکی از بدخیمترین تومورهای اولیه مغزی است که بهدلیل رشد سریع و مقاومت به درمانهای مرسوم، درمان آن دشوار است. فاژ M13 بهعنوان یک ابزار کمککننده در افزایش اثربخشی داروهای شیمیدرمانی مطرح شده¬است. در سال 2019، Przystal و همکارانش پیشنهاد کردند که تموزولوماید (Temozolomide)، داروی شیمیدرمانی که قادر به عبور از سد خونی- مغزی است، میتواند با ژندرمانی ترکیب شده و از طریق فاژ M13 بهطور مستقیم به محل گلیوبلاستوما منتقل شود. بیان HSVtk تحت کنترل یک پروموتر ناشی از تجویز TMZقرارگرفت. ناقل، لیگاند RGD4C را در پروتئین پوشش جزئی pIII روی کپسید M13 که گیرنده اینتگرین avβ3 موجود در سلولهای تومور را متصل میکند، دارد. سپس، وکتور هیبریدی درونی شده و ژنوم نوترکیب به هسته تحویل داده می شود تا بیان ژن درمانی به نام HSVtk را ایجاد کند که باعث مرگ سلولی با آپوپتوز می شود (15،14). ترکیب ژندرمانی و شیمیدرمانی از طریق فاژها میتواند بهبود قابل توجهی در اثربخشی درمانها ایجاد کند (2).
4.2. سرطان روده بزرگ و فاژدرمانی: سرطان کولورکتال (Colon Cancer ،CRC) یکی از علل اصلی مرگ و میر ناشی از سرطان در جهان است. رشد بیش از حد فوزوباکتریوم نوکلئاتوم(Fusobacterium Nucleatum ،Fn) در بافت CRC نقش مهمی در ایجاد یک ریز محیط توموری سرکوبکننده ایمنی ایفا میکند. استفاده از فاژ M13 بهعنوان یک راهحل مناسب برای بازسازی ریز محیط ایمنی تومور و فعالسازی سلولهای ایمنی ذاتی مورد بررسی قرارگرفته است. در سال 2019، Dong و همکارانش درمان ترکیبی نانوموادی فاژی را پیشنهاد کردند که شامل سویه فاژ M13 متصل به Fn بود. نانوذرات نقره به سطوح فاژ M13 متصل شدند تا سیستم هیبریداسیون M13@Ag ایجاد شود. این سیستم توانست Fn پروتومورال را حذف کرده، گسترش سلولهای سرکوبگر مشتق از میلوئید را مهار و سلولهای ایمنی ضد تومور را فعال کند (16).
5.2. استفاده از فاژها در مقابله با کووید 19: کروناویروس جدید(Severe Acute Respiratory Syndrome Coronavirus 2،SARS-CoV-2) باعث ایجاد بحران جهانی در بهداشت عمومی شده است. همراه با واکسنها و داروها، محققان استفاده از نانومواد چندظرفیتی مبتنی بر فاژ را برای مقابله با این ویروس بررسی کردهاند. این نانومواد که میموتوپهای ویروسی پروتئینهای اسپایک SARS-CoV-2 را نمایش میدهند، میتوانند به گیرندههای سلولهای انسانی متصل شوند و درک بهتری از مکانیسم عفونت ویروسی ارائه دهند (17).
6.2. نقش فاژهای M13 در بازسازی پوست، استخوان، قلب و عروق، و اعصاب: بازسازی پوست با استفاده از فاژها به دلیل فعالیت ضدباکتریایی آنها در مقابله با عفونتها و مقاومت ضدباکتریایی مؤثر است. در سال 2020، Zhang و همکاران هیدروژل ABgel را تولید کردند که شامل مواد زیستی (مانند اسید هیالورونیک، اکس آلژینات، آنژلاتین)، باکتریوفاژها و فاکتورهای رشد (فاکتور رشد فیبروبلاست اسیدی) برای تقویت بازسازی زخم و مبارزه با باکتریهای مقاوم به آنتیبیوتیک است. این مطالعه، نشان داد که ABgel بهتر از HOGgel (شامل اسید هیالورونیک، اگزالژینات و ژلاتین) عمل میکند. فاژهای مهندسی شده نیز بهعنوان مواد زیستسازگار برای بازسازی استخوان استفاده شدهاند، Wang و همکاران گزارش کرد که آرژنین-گلیسین-اسپارتیک اسید (RGD)-M13 باعث ایجاد استئوتوژنز عروقی در داربست های سه بعدی ازجمله HA/β-TCP و کیتوزان با سلولهای بنیادی مزانشیمی میشود (6). یکی از روشهای مهندسی نانومواد مبتنی بر فاژ، تکنیک الکتروریسی است. الکتروریسی، الیافی را در محدوده نانومتر تا میکرومتر با عبور محلولهای پلیمری از ولتاژ بالا ایجاد میکند. فاژ M13 با استفاده از تکنیک الکتروریسی برای ایجاد بیونانوفیبرها در مهندسی بافت بهکار رفته و نانوالیاف الکتروریسی شده بهدلیل ساختار متخلخل و نسبت سطح به حجم بالا شبیه ماتریکس خارج سلولی بافتهای بومی است و همچنین رطوبت و مواد مغذی را برای محل زخم فراهم کرده و فعالسازی رگزایی و تمایز سلولی را تسهیل میکنند (شکل4). در بازسازی قلب و عروق، فاژ M13 بهعنوان نانوحامل برای افزایش توانایی پیوند و عملکرد سلولهای بنیادی استفاده میشود. Jang و همکاران فاژهای M13 مهندسیشدهای را طراحی کردند که پپتیدهای RGD و SDKP را بهترتیب در pIII و pVIII نمایش میدهند که برای بررسی اثربخشی و ماندگاری پیوند سلولهای پیشساز قلب انسان(human cardiac progenitor cells، Hcpc) در نواحی ایسکمیک قلب طراحی شدند. نتایج نشان داد که فاژهای مهندسی شده رگ-زایی و احتباس hCPC را در ناحیه انفارکتوس میوکارد موش افزایش دادهاند. در بازسازی عصبی در دستگاه عصبی مرکزی شامل رشد مجدد آکسونها از سلولهای عصبی نوزاد بهدنبال آسیب تروماتیک مغزی است. فاژهای M13 میتوانند سلولهای درمانی را حمل کرده و پپتیدهای عملکردی را با نشانههای بیوشیمیایی در امتداد ویریون نانوساختار نمایش دهند. میکروذرات فیبروئین ابریشم از پیلههای کرم ابریشم برای زیستسازگاری تهیهشده و سپس با پلیاتیلن ایمین پوشانده شدند تا امکان اتصال الکترواستاتیکی فاژ به آنها فراهم شود. ترکیب فاژ با میکروذرات فیبروئین ابریشم به بهبود ترمیم بافت مغز آسیبدیده در اثر سکته مغزی کمک کرد و نورونهای غنی از آکسون را در مغز متصل کرده و عملکرد حرکتی اندام حیوانات را بهطور قابلتوجهی بهبود بخشید (14).
7.2. کریسپر ابزاری نوین برای مقابله با باکتریهای مقاوم به دارو: اگرچه کریسپر به عنوان سامانه ایمنی باکتری در برابر باکتریوفاژها معرفی شده است، اما سیستم کریسپر-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats) بهعنوان یک ابزار مولکولی قدرتمند، جایگزینی مؤثر برای آنتیبیوتیکهای معمولی در درمان باکتریهای مقاوم به دارو نیز شناخته شده است. این سیستم توانایی غیرفعال کردن ژنهای مقاوم به آنتیبیوتیک و فاکتورهای بیماریزا باکتریایی را دارد و با برش مکانهای خاص در ژنوم باکتریها، آنها را به باکتریهای حساس تبدیل میکند. فاژها بهدلیل توانایی طبیعی خود در تزریق DNA به باکتریها، بهعنوان حاملهایی مناسب برای انتقال سیستم کریسپر- Cas9 به باکتریها استفاده میشوند. در این روش، کریسپر-Cas9 در ناقلهای فاژمید (phagemid) بستهبندی شده و باکتریهای مقاوم را هدف قرار میدهد. پس از تحویل، سیستم کریسپر-Cas9 توالیهای هدف را از طریق RNA راهنما شناسایی و باعث برش دو رشتهای DNA باکتریایی یا حذف پلاسمید مقاومت دارویی شده که منجر به مرگ سلولی میشود (شکل ۵-الف). مزیت این فناوری این است که میتواند بهگونهای برنامهریزی شود که طیف اثر ضد میکروبی آن در برابر توالیهای DNA خاص یک باکتری خاص تنظیم شود. این ویژگی باعث میشود که تنها باکتریهایی که حاوی DNA هدف هستند از بین بروند، در حالیکه سایر باکتریها تحت تاثیر قرار نمیگیرند. از طریق این فناوری میتوان فاژهای مهندسیشده را مستقیماً تولید کرد (18). از کریسپر همچنین برای ساخت فاژهای نوترکیب و توسعه واکسنها، از جمله واکسن کووید-19، استفاده شده است. استفاده از نوکلئازهای Cas9 و نوع پنج Cas12a با مهندسی ژنوم کریسپر، توالی از درجهای ژن SARS-CoV-2 نوترکیب را در یک فاژ برای توسعه واکسن T4 کووید ۱۹ ایجاد کرد؛ که پاسخهای آنتیبادی گستردهای را علیه اجزای مختلف، مانند آنتیژنهای اختصاصی NP و E تحریک و اثربخشی آن را تأیید کرد (شکل ۵-ب) (11). در مطالعهای، Robert و همکاران یک سیستم IIA CRISPR-Cas9 را برای ایجاد شکستهای دو رشتهای در ژنهای blaSHV-18 یا blaNDM-1 ایجاد کردند که به ترتیب مقاومت در برابر آنتیبیوتیکهای بتالاکتام با طیف گسترده را رمزگذاری میکند. آن¬ها نشان دادند که درمان E.coli EMG2 با یک پلاسمید مبتنی بر M13 حاوی نوکلئاز هدایتشده با RNA منجر به کاهش ۲ تا ۳ برابری در سلولهای زنده میشود (13). باکتریوفاژها مهارکنندههایی را رمزگذاری میکنند که بهعنوان پروتئینهای آنتی کریسپر شناخته میشوند. این بازدارندهها سیستم دفاعی کریسپر- Cas9 باکتریایی را مختل کرده و منجر به توقف رشد و متعاقب آن شکست باکتریایی میشوند. پروتئینهای آنتیکریسپر میتوانند جایگزین خوبی برای پاتوژنهای مقاوم به دارو باشند. کشف این بازدارندهها در سیستم باکتریایی کریسپر دری جدید به روی رویکردهای درمانی جایگزین علیه باکتریهای مقاوم به دارو بازکرده است (3).
8.2. نقش فاژدرمانی در درمان عفونتها: اگرچه کارآزماییهای بالینی هنوز شواهد قطعی برای اثربخشی فاژدرمانی ارائه نکردهاند، اما تعداد مطالعات موردی موفق در استفاده از فاژتراپی برای درمان عفونتهای تهدیدکننده زندگی در حال افزایش است (جدول1) (19). فاژها بهعنوان یک راهحل نوین و مؤثر برای درمان عفونتها، بهویژه در برابر باکتریهای مقاوم به آنتیبیوتیک، مطرح شدهاند. بیماران مبتلا به زخم پای دیابتی به¬دلیل گردش خون ضعیف، ایجاد بیوفیلم روی زخمهای مزمن و مقاومت باکتریایی به آنتیبیوتیکها، در معرض خطر بالای قطع عضو قرار دارند. فاژها، که مستقل از مقاومت آنتیبیوتیکی عمل میکنند، میتوانند بیوفیلمها را تخریب کرده و عفونتهای مزمن را پاکسازی کنند (20). استافیلوکوکوس اورئوس مقاوم به متیسیلین و دیگر پاتوژنها مانند انتروکوک فکالیس و سودوموناس آئروژینوزا میتوانند عفونتهای چشمی ایجاد کنند. استفاده از فاژ KPP12 بهصورت قطره چشمی در درمان کراتیت در موشها، موفق به کنترل عفونت و حفظ ساختار قرنیه شد (15). سودوموناسآئروژینوزا یکی از شایعترین عوامل ایجادکننده اوتیت خارجی و میانی مزمن است. در نواحی غیرقابلدسترس مانند گوش داخلی، استنشاق فاژ میتواند یک مکمل درمانی ارزشمند باشد. مطالعهای نشان داد که پپتیدهای خاصی میتوانند از پرده گوش به گوش میانی منتقل شوند و کارایی درمانهای ژنی یا دارویی را افزایش دهند. در درمان عفونتهای دندان، فرمولاسیون پولوکسامر P407 حاوی فاژهای انتروکوکیEFDG1 و EFLK1 توانست تعداد سلولهای انتروکوک را در کانالهای ریشه موشها تا 99 درصد کاهش دهد (21،22). عفونتهای دستگاه گوارش و ادراری مشکلات شایعی هستند که اثرات زیانباری بر سلامت افراد دارند. فاژدرمانی بهعنوان رویکردی نوین برای درمان این عفونتها بهدلیل توانایی آنها در هدفگیری باکتریهای مقاوم به آنتیبیوتیک و تخریب بیوفیلمها، مورد توجه قرارگرفته است (20). برای درمان هلیکوباکتر پیلوری، عامل اصلی زخم معده، فاژدرمانی میتواند بدون آسیب به تعادل میکروبیوتای روده مؤثر باشد (15). همچنین، فاژها در درمان عفونتهای ادراری ناشی از باکتریهای انتروباکتریاسه، اشرشیاکلای و کلبسیلاپنومونیه نتایج مثبتی داشتهاند (21). علاوه بر این، فاژدرمانی میتواند بهعنوان جایگزینی برای درمان واژینوز ناشی از رشد بیش از حد گاردنرلاواژینالیس استفاده شود و به کاهش نرخ عود این عفونت کمک کند (15).

شکل 4: الف- داربست متعارف مبتنی بر مواد زیستی با پپتیدهای نمایش داده شده توسط فاژ و سلول های بنیادی کاشته شده برای نیچ های مهندسی شده. ب- داربست مبتنی بر فاژ بیومیمتیک با سلولهای بنیادی کاشته شده برای نیچ مهندسی شده (14).
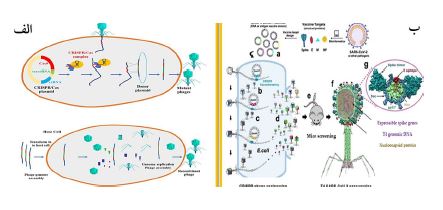
شکل 5: الف- راه اندازی مجدد فاژ و مونتاژ توسط DNA ژنومی، DNA سازواره سلول میزبان فاژ با فاژهای عفونی نوترکیب جدید ترکیب می شود (18). ب- مراحل ساخت نانوواکسن T4-SARS-CoV-2 با استفاده از کریسپر (11).
جدول1: کارآزماییهای بالینی ثبت شده با استفاده از فاژدرمانی در سال های 2018 تا 2020 (7،19).

جدول 2: مزایا، معایب و شباهت های فاژدرمانی در مقایسه با آنتی بیوتیک درمانی (1).

نتیجهگیری
علیرغم نیاز به روشهای جدید برای درمان عفونتهای باکتریایی، فاژتراپی بهطور معمول در کاربردهای بالینی استفاده نمیشود، زیرا فاژها با آنتیبیوتیکهای معمولی بسیار متفاوت هستند (جدول2) (23). همچنین، عدم وجود استاندارد روشن برای جداسازی و خالصسازی فاژها باعث میشود اثربخشی آنها متغیر باشد، لذا توسعه استراتژیهای مناسب برای غلبه بر این محدودیتها ضروری است (24). با توجه به بحران فزاینده مقاومت ضدمیکروبی و پیشبینی افزایش مرگومیر تا سال 2050، نیاز فوری به توسعه درمانهای ضدباکتریایی مانند فاژها احساس میشود. یکی از راهکارها ایجاد بانک فاژ ملی یا منطقهای است (25). شناسایی گیرندههای فاژ میتواند بهبود طراحی کوکتلهای فاژ، کشف ضدمیکروبهای جدید و ترکیب همافزایی فاژها با آنتیبیوتیکها را ممکن سازد (26). تحقیقات جدید نشان میدهند که فاژها ممکن است در ترکیب میکروبیوتای روده برای بهبود فرایندهای شناختی یا درمان بیماریهای باکتریایی سیستم عصبی مانند آنسفالیت مننگوکوکی مؤثر باشند. همچنین، ارتباط باکتریوفاژها با سیستمهای ضدویروسی شبیه کریسپر پیشرفت قابلتوجهی است که میتواند چشمانداز جدیدی در فاژدرمانی ایجاد کند (27). فاژها در تصویربرداری و تشخیص سلولهای سرطانی با استفاده از نانولولههای کربنی و نانوذرات مغناطیسی مورد استفاده قرارگرفتهاند که دقت و کارایی تشخیص و درمان سرطان را بهبود میبخشند (14). در آینده، فاژها ممکن است بهعنوان ابزارهای کلیدی برای حل برخی مشکلات جهانی مانند افزایش تولید غذا با مبارزه با پاتوژنهای باکتریایی، ضعیف کردن حشرات، نماتدها و سایر آفات یوکاریوتی که به میکروبیوتای باکتریایی خود وابسته هستند، کاهش گونههای باکتریایی محرک چاقی در میکروبیوتای روده انسان یا افزایش تکثیر گونههای تقویتکننده لاغری، کاهش جمعیت متانوژنها و درنتیجه کاهش گرمایش جهانی مفید باشند. استفاده از فاژها در صنایع غذایی میتواند برای جلوگیری از آلودگی توسط کرونوباکتر ساکازاکی در شیرخشک نوزاد و کلستریدیوم بوتولینوم در عسل مفید باشد. کشورهای درحالتوسعه باید بهسمت استقلال در تولید و توسعه فاژها پیش بروند تا بتوانند با بحرانهای بهداشتی مقابله کنند (15). تحقیقات در حوزه فاژدرمانی بهسرعت در حال گسترش است و هر روز کاربردهای جدیدی برای این روش درمانی کشف میشود. اگرچه فاژدرمانی هنوز بهطور کامل جایگزین آنتیبیوتیکها نشده¬است، اما پتانسیل بالایی در مقابله با مقاومت دارویی دارد و انتظار میرود در آینده نزدیک نقش مهمی در درمان عفونتهای مقاوم به آنتیبیوتیک ایفا کند. درک تکامل باکتریها در برابر فاژها و مقاومت به فاژدرمانی نیز از اهمیت بالایی برخوردار است. ایجاد مجموعههای جامع دادههای ژنوتیپی و فنوتیپی و استفاده از هوش مصنوعی میتواند به بهبود انتخاب فاژ کمک کند. همچنین، پیشرفتهای فناوری در خالصسازی و مهندسی دقیقتر فاژها پتانسیل بالایی برای بهبود این روش دارند. با وجود اینکه جنبههای بالینی فاژدرمانی هنوز بهطور کامل روشن نشده است، مهندسی ژنتیک امکان طراحی فاژهایی با ویژگیهای مطلوب را فراهم میکند. با تلاشهای مستمر، فاژها میتوانند به یکی از ارکان اصلی درمانهای ضدباکتریایی در آینده تبدیل شوند (3،12،28).
سپاسگزاری
این مطالعات در پژوهشکده علوم و فناوری زیستی دانشگاه صنعتی مالک اشتر، انجام شده است که از مسئولین دانشگاه تشکر می¬گردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
فاژدرمانی اولین بار توسط Felix d’Herelle بیش از یک قرن پیش کشف شد و از آن زمان بهعنوان یک ابزار مؤثر در توسعه زیستشناسی و درمان عفونتهای باکتریایی مورد توجه قرارگرفته است. استفاده از فاژها بهعنوان تنها عوامل درمانی در طول دوره عفونت باکتریایی به بیمار، فاژدرمانی معمولی گفته میشود (1). باکتریوفاژها، ویروسهایی هستند که بهطور اختصاصی در باکتریها تکثیر میشوند و بهعنوان یکی از اشکال زنده غالب روی این سیاره شناخته میشوند. این ویروسها به سلولهای باکتریایی حمله کرده و در آنها تکثیر میشوند، و به همین دلیل بهعنوان ابزاری مؤثر در درمان عفونتهای باکتریایی مورد توجه قرار گرفتهاند (3،2). فاژدرمانی، بهویژه پروتئینهای مشتقشده از فاژ، به عنوان یک عامل ضدمیکروبی قوی، مدتها قبل از کشف پنیسیلین شناختهشده بود. با کشف پنیسیلین و سایر آنتیبیوتیکها در دهه 1940، فاژدرمانی بهتدریج کنار گذاشته شد. درحالحاضر، فاژدرمانی در ایالاتمتحده برای ضدعفونی کردن مواد غذایی و سطوح، دام و محصولات گیاهی بهکار میرود. در روسیه و گرجستان، محصولات مبتنی بر فاژ برای درمان عفونتهای باکتریایی مقاوم به درمانهای مرسوم در دسترس هستند (3). فاژها، باکتریهای گرم مثبت و منفی را آلوده کرده و معمولاً تحت تأثیر مقاومت آنتیبیوتیکی قرار نمیگیرند، که این ویژگی آنها را به ابزار موثری در مقابله با باکتریهای مقاوم به چند دارو (Multi Drug Resistant ،MDR، and XDR، Extensively Drug Resistant) تبدیل کرده است. فاژهای بدخیم با چرخه لیتیک(lytic cycle) بهدلیل توانایی در ایجاد شکست سلولی و کاهش خطر انتقال ژن افقی از طریق ترانسداکشن(Transduction) ، برای اهداف درمانی ترجیح داده میشوند. فاژدرمانی به دو شکل مونوفاژ (استفاده از یک فاژ) و پلیفاژ (استفاده از چند فاژ، معروف به کوکتل فاژ) انجام میشود (4،3). با توجه به تواناییهای متعدد و کاربردهای گسترده، فاژها نقش کلیدی در آینده تحقیقات و درمانهای زیستپزشکی ایفا خواهند کرد. ما در این مقاله قصد داریم پیشرفتهای اخیر در این زمینه و ظرفیتهای بینظیر فاژها برای توسعه درمانهای جدید و بهبود سلامت انسانها را بررسی کنیم.
روش بررسی
این مطالعه مروری روایتی با استفاده از مقالات مرتبط از پایگاههای علمی معتبر انگلیسی مانند ProQuest، PubMed، Scopus و موتور جستجوی Google Scholar در بازه زمانی 2019 تا 2024 انجام شد. کلیدواژههای phage therapy، Phage vaccine و Phage display و ترکیبات احتمالی آنها برای جستجو استفاده شد. پس از حذف موارد تکراری و ارزیابی عنوان و چکیده، 28 مقاله برای مطالعه انتخاب شدند. ابتدا خلاصهای از کاربردهای غیردرمانی فاژها ارایه میگردد، سپس در بخش کاربردهای درمانی به بیان واکسنهای فاژی، درمان بیماری سرطان و کووید ۱۹ با استفاده از فاژها، نقش فاژها در بازسازی بافت، بهکارگیری فناوری کریسپر در مقابله با باکتریها و درمان عفونتهای باکتریایی اشاره خواهد شد.
نتایج
1.کاربردهای غیردرمانی: فاژها بهعنوان نانومواد در توسعه کاوشگرهای زیستی مبتنی¬بر فاژ برای تشخیص موادی مانند DNA، پروتئینها، باکتریها، قارچها و انگلها استفاده میشوند. بهعنوان مثال، در سال 2017، He و همکاران یک پروب مغناطیسی PAP1 را برای تشخیص سودوموناس آئروژینوزا توسعه دادند. این پروب ابتدا به باکتری متصل شده، سپس با آلوده کردن آن، باکتری لیز شده و ATP آزاد میگردد که بهوسیله سیستم شبتابی لوسیفراز-ATP بیولومینسانس شناسایی شد (شکل۱-الف). در سال 1938، فاژها برای طبقهبندی باکتریها براساس تایپ فاژی مورد استفاده قرارگرفتند. فاژتایپینگ براساس تفاوت حساسیت باکتری¬ها به فاژها امکان شناسایی جنسها و گونهها را فراهم می¬کند. از خواص نوری نانومواد میتوان برای تشخیص سریع و حساس استفاده کرد. بهعنوان مثال، برخی از نانومواد فلزی (نقره یا طلا) دارای اثرات تشدید پلاسمونی قوی هستند، بنابراین میتوانند مستقیماً حضور و کمیت اشیاء کشف شده در نمونهها را هنگامی که کاوشگرهای هیبریدی جذب کرده و با اهداف مورد نظر کمپلکس تشکیل میدهند، منعکس کنند (۵). حسگرهای رنگسنجی توجه قابلتوجهی را در زمینه حسگرهای زیستی مبتنی بر باکتریوفاژ M13 به دلیل مزایایی مانند فرآیندهای ساخت آسان و روشهای تشخیص سریع و مستقیم به خود جلب کردهاند. Moon و همکارانش گزارش کردند که دو نوع حسگر ساختاری مبتنی بر رنگ با استفاده از فاژهای M13 مهندسی شده است. ماتریسهای رنگی ساختاری براساس فاژها به سادگی با کنترل سرعت کشش بستههای فاژ M13 عاملدار ساخته شدند. این سیستم هنگام قرارگرفتن در معرض حلالهای آلی، آنتیبیوتیکها و مواد شیمیایی مضر مانند ترینیتروتولوئن تغییرات رنگ قابلتوجهی را نشان میدهد. از این پتانسیل بهعنوان پلتفرمی برای نظارت بر محیط زیست در زمان واقعی استفاده میشود (6).

شکل1: الف- ترکیب فاژ و مهره مغناطیسی همجوشی بسیار ویژه برای ساخت یک پروب خاص برای غنیسازی سودوموناس آئروژینوزا و آزادسازی ATP از باکتری از طریق لیز فاژ (5). ب- کاربردهای بالینی فاژ M13 در تحویل ژن و دارو، فاژتراپی، کشف دارو، توسعه واکسن و تشخیص گونههای زیستی (13).
2. کاربردهای درمانی: استفاده بیرویه از آنتیبیوتیکها منجر به ظهور پاتوژنهای MDR شده است. فاژها با داشتن مکانیسمهای ضدباکتری متعدد میتوانند عفونتهای مقاوم به دارو را کاهش دهند (4). فاژهای لیتیک بدون تأثیر بر فلور طبیعی بدن و سلولهای یوکاریوتی در محل عفونت تکثیر میشوند و نیازی به تنظیم دقیق دوز ندارند، زیرا تعداد آنها بهصورت خودکار در محل عفونت افزایش مییابد (8،7). پلاستیسیته ژنتیکی فاژها امکان تغییر سطح و استفاده از آنها را برای اهداف پزشکی آیندهنگر فراهم میکند (9). فاژ M13 بهعنوان نانوحامل چندظرفیتی عمل میکند و میتواند پپتیدها یا آنتیبادیهای هدفمند را نمایش دهد تا تحویل دارو را بهبود بخشد و از ساختار نازک نانوالیاف مانند خود برای نفوذ به موانع بهویژه مغز استفاده کند (شکل ۱-ب) (10). این ویژگیها نشاندهنده پتانسیل بالای فاژها در تحویل هدفمند دارو و واکسن و مقابله با مقاومت آنتیبیوتیکی است (11). روش نمایش فاژ، که توسط Smith در سال 1985 معرفی شد، شامل تزئین کپسید فاژ با پپتیدها یا پروتئینها است و بهعنوان ابزار مؤثری در انتقال عوامل درمانی از جمله ژنها، واکسنها و داروها، هدفگیری سلولهای یوکاریوتی، طراحی نانومواد، تحقیقات و درمان سرطان، تصویربرداری زیستی و بسیاری کاربردهای دیگر نقش مهمی ایفا میکند و رویکردی موثر برای شناسایی پروتئینها، اپیتوپها، میموتوپ¬ها (mimotope) و آنتیژنها است (شکل ۲-الف) (12). فرآیند غربالگری کتابخانههای فاژ در برابر پروتئینهای هدف با استفاده از انتخاب میل ترکیبی در شرایط آزمایشگاهی به عنوان بیوپنینگ (biopanning) شناخته میشود. این فرآیند شامل انتخاب میل ترکیبی فاژها با پروتئینهای هدف و بررسی کاربردهای بالقوه آنها است، که ممکن است با توالییابی نسل بعدی (Next Generative Sequencing، NGS) بهبود یابد (13). ۱.2. واکسنهای فاژی در مبارزه با بیماریها: واکسیناسیون یکی از مؤثرترین روشها برای پیشگیری از بیماریهای عفونی است. فناوری واکسنهای مبتنی بر فاژ از فاژها به عنوان حاملهایی برای ارائه آنتیژن به سیستم ایمنی استفاده میکند تا پاسخ ایمنی مناسبی برای محافظت در برابر بیماریهای خاص ایجاد شود. این فناوری شامل سه نوع واکسن اصلی است: واکسنهای نمایشی، واکسنهای DNA و واکسنهای هیبریدی (شکل ۲-ب). در واکسنهای نمایشی، از روش نمایش فاژ برای بیان آنتیژنها استفاده میشود. در این روش، فاژها، پروتئینها یا پپتیدهای آنتیژنی را با پروتئینهای پوششی خود بیان میکنند یا آنتیژنها بهصورت شیمیایی به سطوح فاژ متصل میشوند. واکسنهای DNA مبتنی بر فاژ شامل یک قطعه ژنی کدکننده آنتیژن یا تقلید از اپیتوپ ژنوم فاژ هستند که در یک کاست یوکاریوتی در پلاسمید کلون شده و سپس در ذرات فاژ بستهبندی میشود. این فاژها توسط سلولهای ارائهدهنده آنتیژن مانند ماکروفاژها و سلولهای دندریتیک شناسایی و جذب میشوند، که به نوبه خود آنتیژن را بیان کرده و پاسخ ایمنی تطبیقی را آغاز میکنند (1،2،11). واکسنهای هیبریدی ترکیبی از واکسنهای نمایشی و واکسنهای DNA هستند. برای تولید این واکسنها، از چندین فاژ لیتیک و رشتهای استفاده میشود، بهویژه آن¬هایی که در اشریشیاکلای تکثیر میشوند. فاژهای رایج استفاده¬شده در مطالعات انتخابی شامل لامبدا، M13، AP205، T7، MS2، T4، Qβ و M13KE¬ هستند. ذرات فاژ نمیتوانند در سلولهای یوکاریوتی تکثیر شوند، بنابراین ایمنتر از سایر واکسنهای ویروسی هستند. واکسنهای مبتنی بر فاژ معمولاً نیازی به ادجوانت ندارند، زیرا دی-نوکلئوتید دئوکسی سیتیدیلات-فسفات-دئوکسی گوانیلات غیرمتیله در ژنوم فاژ این اثر کمکی را القا میکند. واکسن مبتنی بر فاژ به نام RBDSARS-PLPs یا RBDSARS-PLPs با تزئین ذرات فاژمانند (Phage-like particle ،PLPs) فاژ لامبدا با دومین اتصال به گیرنده (Receptor binding domain ،RBD) نوترکیب از سندروم تنفسی خاورمیانه ساخته شده است (2). واکسن مبتنیبر فاژ محافظت کافی در برابر چندین بیماری ویروسی مانند ویروس نقص ایمنی انسانی، ویروس هرپس سیمپلکس و ویروس پاپیلومای انسانی نوع شانزده ارائه میکند. همچنین فناوری نمایش فاژ، محافظت ضد ویروسی کافی در برابر ویروس هپاتیت سی انسانی و هپاتیت بی انسانی فراهم میکند (2،11). واکسنهای مبتنی بر فاژ علیه عفونتهای باکتریایی شامل کلامیدیا تراکوماتیس، اشرشیاکلای، ویبریوکلرا، بوردتلاپرتوسیس در مدلهای موشی امتحانشده و اثربخش بودهاند. همچنین، واکسنهای مبتنی بر فاژ علیه عفونتهای انگل ریپیسفالوسمیکروپلاس، فاسیولاهپاتیکا و پلاسمودیوم-فالسیپاروم ساخته و آزمایش شدهاند. واکسنهای مبتنی¬بر فاژ علیه بیماریهای غیرعفونی نیز مورد بررسی قرارگرفتهاند. از جمله این بیماریها میتوان به بیماری آلزایمر، دمانس فرونتوتمپورال (Frontotemporal dementia)، رینیت آلرژیک (Allergic rhinitis) ، فشارخون بالا و بیماریهای قلبی و عروقی اشاره کرد (2).
2.2. سرطان سینه و فاژدرمانی: فاژدرمانی بهعنوان روشی نوین و امیدوارکننده در درمان سرطانها، بهویژه سرطان سینه در حال پیشرفت است. در سال 2004، An و همکارانش پپتید ضدسرطانی F56 را از طریق غربالگری کتابخانه فاژ M13 جداسازی کردند که در موشهای دارای نقص ایمنی شدید که با سلولهای سرطان سینه انسانی کاشتهشده بودند، اثرات ضد رگزایی و ضدمتاستاتیک نشان داد. همچنین، آنتیبادی انسانی scFv 12H7 با اثرات مهاری تومور بر روی سلولهای سرطان سینه سهگانه منفی شناسایی شد که بهطور قابلتوجهی اندازه تومور را کاهش داد. پپتید فاژی LGLRGSL نیز که بهطور خاص به سلولهای گذار اپیتلیال - مزانشیمی متصل میشود، بهعنوان ابزاری برای شناسایی اولیه سرطان سینه متاستاتیک معرفی شده است. همچنین، ذرات فاژ M13 نوترکیب توانستهاند هشت ایمونوژن واکسن را نمایش دهند که استفاده از سه مورد از این واکسنها در مدلهای موش T1 BC4 به مهار واضح رشد تومور منجر شده است (14). گیرنده دو فاکتور رشد اپیدرمی انسانی (Human epidermal growth factor receptor-2 ،HER2) که با پیشآگهی ضعیف سرطان سینه مرتبط است، بهعنوان یک هدف واکسن در برابر این بیماری مورد توجه قرارگرفته است. پلتفرم واکسن مبتنی بر فاژ با نمایش HER2 و نوع D16HER2 بر روی فاژهای M13 ایجاد شده و نشان داده که میتواند پاسخهای ایمنی مؤثری علیه سلولهای سرطانی حاوی HER2 ایجاد کند. فاژدرمانی با استفاده از فاژهای M13 بهعنوان روشی نوآورانه در درمان سرطان مطرح شده است (شکل3) (2).

شکل 2: الف- تحویل دارو و ژن با استفاده از ذرات فاژ M13 و پروتئینهای منتقله از فاژ M13(13). ب- تصویری از واکسنهای نمایش فاژ، واکسن های DNA فاژ و واکسنهای فاژ هیبریدی (11).

شکل 3: تصویری از مهندسی، کاربرد و انواع فاژهای مورد استفاده در ایمونوتراپی سرطان (2).
3.2. تومور مغزی و فاژدرمانی: گلیوبلاستوما یکی از بدخیمترین تومورهای اولیه مغزی است که بهدلیل رشد سریع و مقاومت به درمانهای مرسوم، درمان آن دشوار است. فاژ M13 بهعنوان یک ابزار کمککننده در افزایش اثربخشی داروهای شیمیدرمانی مطرح شده¬است. در سال 2019، Przystal و همکارانش پیشنهاد کردند که تموزولوماید (Temozolomide)، داروی شیمیدرمانی که قادر به عبور از سد خونی- مغزی است، میتواند با ژندرمانی ترکیب شده و از طریق فاژ M13 بهطور مستقیم به محل گلیوبلاستوما منتقل شود. بیان HSVtk تحت کنترل یک پروموتر ناشی از تجویز TMZقرارگرفت. ناقل، لیگاند RGD4C را در پروتئین پوشش جزئی pIII روی کپسید M13 که گیرنده اینتگرین avβ3 موجود در سلولهای تومور را متصل میکند، دارد. سپس، وکتور هیبریدی درونی شده و ژنوم نوترکیب به هسته تحویل داده می شود تا بیان ژن درمانی به نام HSVtk را ایجاد کند که باعث مرگ سلولی با آپوپتوز می شود (15،14). ترکیب ژندرمانی و شیمیدرمانی از طریق فاژها میتواند بهبود قابل توجهی در اثربخشی درمانها ایجاد کند (2).
4.2. سرطان روده بزرگ و فاژدرمانی: سرطان کولورکتال (Colon Cancer ،CRC) یکی از علل اصلی مرگ و میر ناشی از سرطان در جهان است. رشد بیش از حد فوزوباکتریوم نوکلئاتوم(Fusobacterium Nucleatum ،Fn) در بافت CRC نقش مهمی در ایجاد یک ریز محیط توموری سرکوبکننده ایمنی ایفا میکند. استفاده از فاژ M13 بهعنوان یک راهحل مناسب برای بازسازی ریز محیط ایمنی تومور و فعالسازی سلولهای ایمنی ذاتی مورد بررسی قرارگرفته است. در سال 2019، Dong و همکارانش درمان ترکیبی نانوموادی فاژی را پیشنهاد کردند که شامل سویه فاژ M13 متصل به Fn بود. نانوذرات نقره به سطوح فاژ M13 متصل شدند تا سیستم هیبریداسیون M13@Ag ایجاد شود. این سیستم توانست Fn پروتومورال را حذف کرده، گسترش سلولهای سرکوبگر مشتق از میلوئید را مهار و سلولهای ایمنی ضد تومور را فعال کند (16).
5.2. استفاده از فاژها در مقابله با کووید 19: کروناویروس جدید(Severe Acute Respiratory Syndrome Coronavirus 2،SARS-CoV-2) باعث ایجاد بحران جهانی در بهداشت عمومی شده است. همراه با واکسنها و داروها، محققان استفاده از نانومواد چندظرفیتی مبتنی بر فاژ را برای مقابله با این ویروس بررسی کردهاند. این نانومواد که میموتوپهای ویروسی پروتئینهای اسپایک SARS-CoV-2 را نمایش میدهند، میتوانند به گیرندههای سلولهای انسانی متصل شوند و درک بهتری از مکانیسم عفونت ویروسی ارائه دهند (17).
6.2. نقش فاژهای M13 در بازسازی پوست، استخوان، قلب و عروق، و اعصاب: بازسازی پوست با استفاده از فاژها به دلیل فعالیت ضدباکتریایی آنها در مقابله با عفونتها و مقاومت ضدباکتریایی مؤثر است. در سال 2020، Zhang و همکاران هیدروژل ABgel را تولید کردند که شامل مواد زیستی (مانند اسید هیالورونیک، اکس آلژینات، آنژلاتین)، باکتریوفاژها و فاکتورهای رشد (فاکتور رشد فیبروبلاست اسیدی) برای تقویت بازسازی زخم و مبارزه با باکتریهای مقاوم به آنتیبیوتیک است. این مطالعه، نشان داد که ABgel بهتر از HOGgel (شامل اسید هیالورونیک، اگزالژینات و ژلاتین) عمل میکند. فاژهای مهندسی شده نیز بهعنوان مواد زیستسازگار برای بازسازی استخوان استفاده شدهاند، Wang و همکاران گزارش کرد که آرژنین-گلیسین-اسپارتیک اسید (RGD)-M13 باعث ایجاد استئوتوژنز عروقی در داربست های سه بعدی ازجمله HA/β-TCP و کیتوزان با سلولهای بنیادی مزانشیمی میشود (6). یکی از روشهای مهندسی نانومواد مبتنی بر فاژ، تکنیک الکتروریسی است. الکتروریسی، الیافی را در محدوده نانومتر تا میکرومتر با عبور محلولهای پلیمری از ولتاژ بالا ایجاد میکند. فاژ M13 با استفاده از تکنیک الکتروریسی برای ایجاد بیونانوفیبرها در مهندسی بافت بهکار رفته و نانوالیاف الکتروریسی شده بهدلیل ساختار متخلخل و نسبت سطح به حجم بالا شبیه ماتریکس خارج سلولی بافتهای بومی است و همچنین رطوبت و مواد مغذی را برای محل زخم فراهم کرده و فعالسازی رگزایی و تمایز سلولی را تسهیل میکنند (شکل4). در بازسازی قلب و عروق، فاژ M13 بهعنوان نانوحامل برای افزایش توانایی پیوند و عملکرد سلولهای بنیادی استفاده میشود. Jang و همکاران فاژهای M13 مهندسیشدهای را طراحی کردند که پپتیدهای RGD و SDKP را بهترتیب در pIII و pVIII نمایش میدهند که برای بررسی اثربخشی و ماندگاری پیوند سلولهای پیشساز قلب انسان(human cardiac progenitor cells، Hcpc) در نواحی ایسکمیک قلب طراحی شدند. نتایج نشان داد که فاژهای مهندسی شده رگ-زایی و احتباس hCPC را در ناحیه انفارکتوس میوکارد موش افزایش دادهاند. در بازسازی عصبی در دستگاه عصبی مرکزی شامل رشد مجدد آکسونها از سلولهای عصبی نوزاد بهدنبال آسیب تروماتیک مغزی است. فاژهای M13 میتوانند سلولهای درمانی را حمل کرده و پپتیدهای عملکردی را با نشانههای بیوشیمیایی در امتداد ویریون نانوساختار نمایش دهند. میکروذرات فیبروئین ابریشم از پیلههای کرم ابریشم برای زیستسازگاری تهیهشده و سپس با پلیاتیلن ایمین پوشانده شدند تا امکان اتصال الکترواستاتیکی فاژ به آنها فراهم شود. ترکیب فاژ با میکروذرات فیبروئین ابریشم به بهبود ترمیم بافت مغز آسیبدیده در اثر سکته مغزی کمک کرد و نورونهای غنی از آکسون را در مغز متصل کرده و عملکرد حرکتی اندام حیوانات را بهطور قابلتوجهی بهبود بخشید (14).
7.2. کریسپر ابزاری نوین برای مقابله با باکتریهای مقاوم به دارو: اگرچه کریسپر به عنوان سامانه ایمنی باکتری در برابر باکتریوفاژها معرفی شده است، اما سیستم کریسپر-Cas9 (Clustered Regularly Interspaced Short Palindromic Repeats) بهعنوان یک ابزار مولکولی قدرتمند، جایگزینی مؤثر برای آنتیبیوتیکهای معمولی در درمان باکتریهای مقاوم به دارو نیز شناخته شده است. این سیستم توانایی غیرفعال کردن ژنهای مقاوم به آنتیبیوتیک و فاکتورهای بیماریزا باکتریایی را دارد و با برش مکانهای خاص در ژنوم باکتریها، آنها را به باکتریهای حساس تبدیل میکند. فاژها بهدلیل توانایی طبیعی خود در تزریق DNA به باکتریها، بهعنوان حاملهایی مناسب برای انتقال سیستم کریسپر- Cas9 به باکتریها استفاده میشوند. در این روش، کریسپر-Cas9 در ناقلهای فاژمید (phagemid) بستهبندی شده و باکتریهای مقاوم را هدف قرار میدهد. پس از تحویل، سیستم کریسپر-Cas9 توالیهای هدف را از طریق RNA راهنما شناسایی و باعث برش دو رشتهای DNA باکتریایی یا حذف پلاسمید مقاومت دارویی شده که منجر به مرگ سلولی میشود (شکل ۵-الف). مزیت این فناوری این است که میتواند بهگونهای برنامهریزی شود که طیف اثر ضد میکروبی آن در برابر توالیهای DNA خاص یک باکتری خاص تنظیم شود. این ویژگی باعث میشود که تنها باکتریهایی که حاوی DNA هدف هستند از بین بروند، در حالیکه سایر باکتریها تحت تاثیر قرار نمیگیرند. از طریق این فناوری میتوان فاژهای مهندسیشده را مستقیماً تولید کرد (18). از کریسپر همچنین برای ساخت فاژهای نوترکیب و توسعه واکسنها، از جمله واکسن کووید-19، استفاده شده است. استفاده از نوکلئازهای Cas9 و نوع پنج Cas12a با مهندسی ژنوم کریسپر، توالی از درجهای ژن SARS-CoV-2 نوترکیب را در یک فاژ برای توسعه واکسن T4 کووید ۱۹ ایجاد کرد؛ که پاسخهای آنتیبادی گستردهای را علیه اجزای مختلف، مانند آنتیژنهای اختصاصی NP و E تحریک و اثربخشی آن را تأیید کرد (شکل ۵-ب) (11). در مطالعهای، Robert و همکاران یک سیستم IIA CRISPR-Cas9 را برای ایجاد شکستهای دو رشتهای در ژنهای blaSHV-18 یا blaNDM-1 ایجاد کردند که به ترتیب مقاومت در برابر آنتیبیوتیکهای بتالاکتام با طیف گسترده را رمزگذاری میکند. آن¬ها نشان دادند که درمان E.coli EMG2 با یک پلاسمید مبتنی بر M13 حاوی نوکلئاز هدایتشده با RNA منجر به کاهش ۲ تا ۳ برابری در سلولهای زنده میشود (13). باکتریوفاژها مهارکنندههایی را رمزگذاری میکنند که بهعنوان پروتئینهای آنتی کریسپر شناخته میشوند. این بازدارندهها سیستم دفاعی کریسپر- Cas9 باکتریایی را مختل کرده و منجر به توقف رشد و متعاقب آن شکست باکتریایی میشوند. پروتئینهای آنتیکریسپر میتوانند جایگزین خوبی برای پاتوژنهای مقاوم به دارو باشند. کشف این بازدارندهها در سیستم باکتریایی کریسپر دری جدید به روی رویکردهای درمانی جایگزین علیه باکتریهای مقاوم به دارو بازکرده است (3).
8.2. نقش فاژدرمانی در درمان عفونتها: اگرچه کارآزماییهای بالینی هنوز شواهد قطعی برای اثربخشی فاژدرمانی ارائه نکردهاند، اما تعداد مطالعات موردی موفق در استفاده از فاژتراپی برای درمان عفونتهای تهدیدکننده زندگی در حال افزایش است (جدول1) (19). فاژها بهعنوان یک راهحل نوین و مؤثر برای درمان عفونتها، بهویژه در برابر باکتریهای مقاوم به آنتیبیوتیک، مطرح شدهاند. بیماران مبتلا به زخم پای دیابتی به¬دلیل گردش خون ضعیف، ایجاد بیوفیلم روی زخمهای مزمن و مقاومت باکتریایی به آنتیبیوتیکها، در معرض خطر بالای قطع عضو قرار دارند. فاژها، که مستقل از مقاومت آنتیبیوتیکی عمل میکنند، میتوانند بیوفیلمها را تخریب کرده و عفونتهای مزمن را پاکسازی کنند (20). استافیلوکوکوس اورئوس مقاوم به متیسیلین و دیگر پاتوژنها مانند انتروکوک فکالیس و سودوموناس آئروژینوزا میتوانند عفونتهای چشمی ایجاد کنند. استفاده از فاژ KPP12 بهصورت قطره چشمی در درمان کراتیت در موشها، موفق به کنترل عفونت و حفظ ساختار قرنیه شد (15). سودوموناسآئروژینوزا یکی از شایعترین عوامل ایجادکننده اوتیت خارجی و میانی مزمن است. در نواحی غیرقابلدسترس مانند گوش داخلی، استنشاق فاژ میتواند یک مکمل درمانی ارزشمند باشد. مطالعهای نشان داد که پپتیدهای خاصی میتوانند از پرده گوش به گوش میانی منتقل شوند و کارایی درمانهای ژنی یا دارویی را افزایش دهند. در درمان عفونتهای دندان، فرمولاسیون پولوکسامر P407 حاوی فاژهای انتروکوکیEFDG1 و EFLK1 توانست تعداد سلولهای انتروکوک را در کانالهای ریشه موشها تا 99 درصد کاهش دهد (21،22). عفونتهای دستگاه گوارش و ادراری مشکلات شایعی هستند که اثرات زیانباری بر سلامت افراد دارند. فاژدرمانی بهعنوان رویکردی نوین برای درمان این عفونتها بهدلیل توانایی آنها در هدفگیری باکتریهای مقاوم به آنتیبیوتیک و تخریب بیوفیلمها، مورد توجه قرارگرفته است (20). برای درمان هلیکوباکتر پیلوری، عامل اصلی زخم معده، فاژدرمانی میتواند بدون آسیب به تعادل میکروبیوتای روده مؤثر باشد (15). همچنین، فاژها در درمان عفونتهای ادراری ناشی از باکتریهای انتروباکتریاسه، اشرشیاکلای و کلبسیلاپنومونیه نتایج مثبتی داشتهاند (21). علاوه بر این، فاژدرمانی میتواند بهعنوان جایگزینی برای درمان واژینوز ناشی از رشد بیش از حد گاردنرلاواژینالیس استفاده شود و به کاهش نرخ عود این عفونت کمک کند (15).

شکل 4: الف- داربست متعارف مبتنی بر مواد زیستی با پپتیدهای نمایش داده شده توسط فاژ و سلول های بنیادی کاشته شده برای نیچ های مهندسی شده. ب- داربست مبتنی بر فاژ بیومیمتیک با سلولهای بنیادی کاشته شده برای نیچ مهندسی شده (14).

شکل 5: الف- راه اندازی مجدد فاژ و مونتاژ توسط DNA ژنومی، DNA سازواره سلول میزبان فاژ با فاژهای عفونی نوترکیب جدید ترکیب می شود (18). ب- مراحل ساخت نانوواکسن T4-SARS-CoV-2 با استفاده از کریسپر (11).
جدول1: کارآزماییهای بالینی ثبت شده با استفاده از فاژدرمانی در سال های 2018 تا 2020 (7،19).

جدول 2: مزایا، معایب و شباهت های فاژدرمانی در مقایسه با آنتی بیوتیک درمانی (1).

نتیجهگیری
علیرغم نیاز به روشهای جدید برای درمان عفونتهای باکتریایی، فاژتراپی بهطور معمول در کاربردهای بالینی استفاده نمیشود، زیرا فاژها با آنتیبیوتیکهای معمولی بسیار متفاوت هستند (جدول2) (23). همچنین، عدم وجود استاندارد روشن برای جداسازی و خالصسازی فاژها باعث میشود اثربخشی آنها متغیر باشد، لذا توسعه استراتژیهای مناسب برای غلبه بر این محدودیتها ضروری است (24). با توجه به بحران فزاینده مقاومت ضدمیکروبی و پیشبینی افزایش مرگومیر تا سال 2050، نیاز فوری به توسعه درمانهای ضدباکتریایی مانند فاژها احساس میشود. یکی از راهکارها ایجاد بانک فاژ ملی یا منطقهای است (25). شناسایی گیرندههای فاژ میتواند بهبود طراحی کوکتلهای فاژ، کشف ضدمیکروبهای جدید و ترکیب همافزایی فاژها با آنتیبیوتیکها را ممکن سازد (26). تحقیقات جدید نشان میدهند که فاژها ممکن است در ترکیب میکروبیوتای روده برای بهبود فرایندهای شناختی یا درمان بیماریهای باکتریایی سیستم عصبی مانند آنسفالیت مننگوکوکی مؤثر باشند. همچنین، ارتباط باکتریوفاژها با سیستمهای ضدویروسی شبیه کریسپر پیشرفت قابلتوجهی است که میتواند چشمانداز جدیدی در فاژدرمانی ایجاد کند (27). فاژها در تصویربرداری و تشخیص سلولهای سرطانی با استفاده از نانولولههای کربنی و نانوذرات مغناطیسی مورد استفاده قرارگرفتهاند که دقت و کارایی تشخیص و درمان سرطان را بهبود میبخشند (14). در آینده، فاژها ممکن است بهعنوان ابزارهای کلیدی برای حل برخی مشکلات جهانی مانند افزایش تولید غذا با مبارزه با پاتوژنهای باکتریایی، ضعیف کردن حشرات، نماتدها و سایر آفات یوکاریوتی که به میکروبیوتای باکتریایی خود وابسته هستند، کاهش گونههای باکتریایی محرک چاقی در میکروبیوتای روده انسان یا افزایش تکثیر گونههای تقویتکننده لاغری، کاهش جمعیت متانوژنها و درنتیجه کاهش گرمایش جهانی مفید باشند. استفاده از فاژها در صنایع غذایی میتواند برای جلوگیری از آلودگی توسط کرونوباکتر ساکازاکی در شیرخشک نوزاد و کلستریدیوم بوتولینوم در عسل مفید باشد. کشورهای درحالتوسعه باید بهسمت استقلال در تولید و توسعه فاژها پیش بروند تا بتوانند با بحرانهای بهداشتی مقابله کنند (15). تحقیقات در حوزه فاژدرمانی بهسرعت در حال گسترش است و هر روز کاربردهای جدیدی برای این روش درمانی کشف میشود. اگرچه فاژدرمانی هنوز بهطور کامل جایگزین آنتیبیوتیکها نشده¬است، اما پتانسیل بالایی در مقابله با مقاومت دارویی دارد و انتظار میرود در آینده نزدیک نقش مهمی در درمان عفونتهای مقاوم به آنتیبیوتیک ایفا کند. درک تکامل باکتریها در برابر فاژها و مقاومت به فاژدرمانی نیز از اهمیت بالایی برخوردار است. ایجاد مجموعههای جامع دادههای ژنوتیپی و فنوتیپی و استفاده از هوش مصنوعی میتواند به بهبود انتخاب فاژ کمک کند. همچنین، پیشرفتهای فناوری در خالصسازی و مهندسی دقیقتر فاژها پتانسیل بالایی برای بهبود این روش دارند. با وجود اینکه جنبههای بالینی فاژدرمانی هنوز بهطور کامل روشن نشده است، مهندسی ژنتیک امکان طراحی فاژهایی با ویژگیهای مطلوب را فراهم میکند. با تلاشهای مستمر، فاژها میتوانند به یکی از ارکان اصلی درمانهای ضدباکتریایی در آینده تبدیل شوند (3،12،28).
سپاسگزاری
این مطالعات در پژوهشکده علوم و فناوری زیستی دانشگاه صنعتی مالک اشتر، انجام شده است که از مسئولین دانشگاه تشکر می¬گردد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- Gordillo Altamirano FL، Barr JJ. Phage Therapy in the Postantibiotic Era. Clin Microbiol Rev 2019; 32(2): e00066-18.
2- Palma M. Aspects of Phage-Based Vaccines for Protein and Epitope Immunization. Vaccines 2023; 11(2): 436.
3- Anyaegbunam NJ، Anekpo CC، Anyaegbunam ZK، Doowuese Y، Chinaka CB، Odo OJ، et al. The Resurgence of Phage-Based Therapy in the Era of Increasing Antibiotic Resistance: From Research Progress to Challenges and Prospects. Microbiol Res 2022; 264: 127155.
4- Luong T، Salabarria AC، Roach DR. Phage Therapy in the Resistance Era: Where Do We Stand and Where are We Going? Clin Ther 2020; 42(9): 1659-80.
5- Paramasivam K، Shen Y، Yuan J، Waheed I، Mao C، Zhou X. Advances in the Development of Phage-Based Probes for Detection of Bio-Species. Biosensors 2022; 12(1): 30.
6- Kim SM، Heo HR، Kim CS، Shin HH. Genetically Engineered Bacteriophages as Novel Nanomaterials: Applications Beyond Antimicrobial Agents. Ront Bioeng Biotechnol 2024; 12: 1319830.
7- Pirnay JP، Ferry T، Resch G. Recent Progress Toward the Implementation of Phage Therapy in Western Medicine. FEMS Microbiol Rev 2022; 46(1): fuab040.
8- Samaee HR، Eslami G، Rahimzadeh G، Saeedi M، Badabi AD، Asare-Addo K، et al. Inhalation Phage Therapy as a New Approach to Preventing Secondary Bacterial Pneumonia in Patients with Moderate to Severe COVID-19: A Double-Blind Clinical Trial Study. J Drug Deliv Sci Technol 2023; 84: 104486.
9- Ragothaman M، Yoo SY. Engineered Phage-Based Cancer Vaccines: Current Advances and Future Directions. Vaccines (Basel) 2023; 11(5): 919.
10- Nazir A، Song J، Chen Y، Liu Y. Phage-Derived Depolymerase: Its Possible Role for Secondary Bacterial Infections in COVID-19 Patients. Microorganisms 2023; 11(2): 424.
11- Ul Haq I، Krukiewicz K، Yahya G، Haq MU، Maryam S، Mosbah RA، et al. The Breadth of Bacteriophages Contributing to the Development of the Phage-Based Vaccines for COVID-19: An Ideal Platform to Design the Multiplex Vaccine. Int J Mol Sci. 2023; 24(2): 1536.
12- Rehman S، Ali Z، Khan M، Bostan N، Naseem S. The Dawn of Phage Therapy. Rev Med Virol 2019; 29(4): e2041.
13- Fadaie M، Dianat-Moghadam H، Ghafouri E، Naderi S، Darvishali MH، et al. Unraveling the Potential of M13 Phages in Biomedicine: Advancing Drug Nanodelivery and Gene Therapy. Environ Res 2023: 238(Pt 1): 11713.
14- Chang C، Guo W، Yu X، Guo C، Zhou N، Guo X، et al. Engineered M13 Phage as A Novel Therapeutic Bionanomaterial for Clinical Applications: From Tissue Regeneration to Cancer Therapy. Mater Today Bio 2023; 20: 100612.
15- García-Cruz JC، Huelgas-Méndez D، Jiménez-Zúñiga JS، Rebollar-Juárez X، Hernández-Garnica M، Fernández-Presas AM، et al. Myriad Applications of Bacteriophages Beyond Phage Therapy. PeerJ 2023; 11: e15272.
16- Dong X، Pan P، Zheng DW، Bao P، Zeng X، Zhang XZ. Bioinorganic Hybrid Bacteriophage for Modulation of Intestinal Microbiota to Remodel Tumor-Immune Microenvironment Against Colorectal Cancer. Sci Adv 2020; 6(20): eaba1590.
17- Petrenko VA، Gillespie JW، De Plano LM، Shokhen MA. Phage-Displayed Mimotopes of SARS-Cov-2 Spike Protein Targeted to Authentic and Alternative Cellular Receptors. Viruses 2022; 14(2): 384.
18- Balcha FB، Neja SA. CRISPR-Cas9 Mediated Phage Therapy as an Alternative to Antibiotics. Animal Diseases 2023; 3(1): 1-1.
19- Pires DP، Costa AR، Pinto G، Meneses L، Azeredo J. Current Challenges and Future Opportunities of Phage Therapy. FEMS Microbiol Rev 2020; 44(6): 684-700.
20- Young MJ، Hall LM، Merabishvilli M، Pirnay JP، Clark JR، Jones JD. Phage Therapy for Diabetic Foot Infection: A Case Series. Clin Ther 2023; 45(8): 797-801.
21- Melo LD، Oliveira H، Pires DP، Dabrowska K، Azeredo J. Phage Therapy Efficacy: A Review of the Last 10 Years of Preclinical Studies. Crit Rev Microbiol 2020; 46(1): 78-99.
22- Pierzynowska K، Morcinek-Orłowska J، Gaffke L، Jaroszewicz W، Skowron PM، Węgrzyn G. Applications of the Phage Display Technology in Molecular Biology، Biotechnology and Medicine. Crit Rev Microbiol. 2024; 50(4): 450-90.
23- Nilsson AS. Pharmacological Limitations of Phage Therapy. Ups J Med Sci 2019; 124(4): 218-27.
24- Lin J، Du F، Long M، Li P. Limitations of Phage Therapy and Corresponding Optimization Strategies: A Review. Molecules 2022; 27(6): 1857.
25- Nagel T، Musila L، Muthoni M، Nikolich M، Nakavuma JL، Clokie MR. Phage Banks as Potential Tools to Rapidly and Cost-Effectively Manage Antimicrobial Resistance in the Developing World. Curr Opin Virol 2022; 53: 101208.
26- Altamirano FL، Barr JJ. Unlocking the Next Generation of Phage Therapy: The Key is in the Receptors. Curr Opin Virol 2021; 68: 115-23.
27- Jędrusiak A، Fortuna W، Majewska J، Górski A، Jończyk-Matysiak E. Phage Interactions with the Nervous System in Health and Disease. Cells 2023; 12(13): 1720.
28- Gelman D، Yerushalmy O، Alkalay-Oren S، Rakov C، Ben-Porat S، Khalifa L، et al. Clinical Phage Microbiology: A Suggested Framework and Recommendations for the In-Vitro Matching Steps of Phage Therapy. Lancet Microbe 2021; 2(10): e555- 63.
نوع مطالعه: مروری |
موضوع مقاله:
میکروبیولوژی
دریافت: 1403/8/24 | پذیرش: 1403/11/15 | انتشار: 1403/11/15
دریافت: 1403/8/24 | پذیرش: 1403/11/15 | انتشار: 1403/11/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







