دوره 32، شماره 12 - ( اسفند 1403 )
جلد 32 شماره 12 صفحات 8522-8512 |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.B.REC.1402.116
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rahmani Chegani S, Roozbahani M, Hosseini S A, Hemat Far A, Moeini M. Effectiveness of a Period High Intensity Interval Training and Bee Pollen Consumption on the Level of Tropomyosin Receptor Kinase B in Hippocampus Rats Exposed to Cadmium. JSSU 2025; 32 (12) :8512-8522
URL: http://jssu.ssu.ac.ir/article-1-6310-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6310-fa.html
رحمانی چگنی سام، روزبهانی مهدی، حسینی سید علی، همت فر احمد، معینی مسعود. اثربخشی یک دوره تمرین تناوبی شدید و مصرف گرده گل بر سطح گیرنده تیروزینکیناز B در هیپوکامپ موشهای آزمایشگاهی در معرض کادمیوم. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (12) :8512-8522
متن کامل [PDF 862 kb]
(310 دریافت)
| چکیده (HTML) (1046 مشاهده)
متن کامل: (272 مشاهده)
مقدمه
مغز به دلیل استفاده زیاد از اکسیژن و فعالیت متابولیکی در برابر استرس اکسیداتیو آسیبپذیر است، فاکتور نوروتروفیک مشتق از مغز یکی از عواملی است که با استرس اکسیداتیو مقابله میکند. فاکتور نوروتروفیک مشتق از مغز (BDNF Brain-Derived Neurotrophic Factor) و گیرنده آن، تیروزینکیناز بتا (TRKb Tropomyosin receptor kinase B)، عضوی از خانواده فاکتورهای نوروتروفیک هستند. تیروزینکیناز آنزیمی است که قادر است یک گروه فسفات را به تیروزین اضافه کند و با اتصال به غشای نورون، TRKb را فعال کند. این آنزیم تحت تاثیر کلسیم باعث اتصال BDNF به TRKb میشود. گیرنده تیروزینکیناز B زیر مجموعهای از گیرندههای تیروزینکینازی غشای سلول است که میل ترکیبی زیادی به BDNF و نوروتروفین-4 (NT-4 Neurotrophin-4) و نوروتروفین-3 (NT-3 Neurotrophin-3) دارد که در نهایت باعث رشد، تمایز و بازسازی نورونی، مسیریابی آکسونی، شکلپذیری سیناپسی و مورفوژنز و بلوغ آستروسیت میشود. BDNF دارای عملکرد ضد اکسیداسیون و ضد آپوپتوز نیز میباشد (1,2). BDNF را در قشر مغز، هیپوکامپ و نواحی قاعدهای پیش مغز میتوان یافت که بر عملکرد بهتر هیپوکامپ در طولانی مدت تاثیر دارد. فلزات سنگین مانند کادمیوم (Cd)، سرب (Pb) و جیوه (Hg) میتوانند اثر کاهشی بر BDNF میشوند. کادمیوم به دلیل شبیه بودن به کلسیم و زینک جایگزین آنها در نورونها (به ویژه کانالهای کلسیمی غشا) میشود که باعث آسیب به سیستم عصبی به ویژه مغز میشود و منجر به کاهش ورود کلسیم و زینک به سلول شود به همین سبب موجب کاهش BDNF و غیرفعال شدن گیرنده TRKb میشود که در انتقال پیام عصبی نقش مهمی دارند و راهکار مغز جهت محافظت از نورونها و ترمیم آنها افزایش تولید BDNF میباشد. در این زمینه رای (Ray) و همکاران دریافتند که مخلوط (آرسنیک، سرب و کادمیوم) سطح بیان BDNF و به تبع آن گیرنده TRKb و آنزیم تیروزینکیناز را در موشها کاهش میدهد (3). در مطالعات اخیر به اثرات کادمیوم بر سیستم عصبی پرداخته شده است (4). کادمیوم یک آلاینده محیطی فراگیر است که در صنعت استفادههای فراوانی (تولید باتریها، رنگها آبکاری فلزات، صنایع نظامی، کودها، مواد ثبات بخش در پلاستیکها) دارد، همچنین در زندگی روزمره میتواند از طریق سیگار کشیدن و گرد و غبار و مصرف آب و غذای آلوده به کادمیوم وارد بدن انسان میشود، که به همین سبب در شهرهای آلوده به مسئله مهمی تبدیل شده است. تجمع کادمیوم در بدن باعث مسمومیت در اندامهایی مانند کبد، ریه، و معده و مغز میشود که عوارض آن شامل اسهال، شکم درد، استفراغ شدید، آسیب بـه سیستم عصبی و DNA و در نهایت سرطان میباشد (5,6). گزارش شده است در مسمومیتهای مزمن با کادمیوم، بیشترین سطح کادمیوم در هیپوکامپ تجمع یافته و باعث دنوروژنراسیون میشود و همچنین در میتوکندری باعث مختل شدن چرخه فسفریلاسیون اکسیداتیو میشود. قرار گرفتن در معرض کادمیوم باعث کاهش ناقل زینک (ZnT3) میشود که منجر به اثرات پایین دستی شامل تغییر در مسیرهای سیگنالینگ مغز میشود و سیگنالدهی گیرنده تیروزینکیناز بی (TRKb) و Erk1/2 (پیامرسانهای درون سلولی که نقش مهمی در شکلپذیری و رشد نورون ایفا میکنند) را کاهش میدهد. فعالسازی TRKb و متعاقب آن BDNF برای انعطافپذیری عصبی ضروری هستند (6, 5). به موادی که دارای خواص محافظتی در برابر استرس اکسیداتیو (Reactive Oxygen Species (ROS)) (ناشی از کادمیوم و رادیکالهای آزاد) باشند آنتیاکسیدان میگویند که به این ویژگی خواص آنتیاکسیدانی گفته میشود و بهصورت مکانیسمهای دفاعی آنزیمی و غیر آنزیمی است (7). اخیراً چندین ترکیب با خواص آنتیاکسیدانی مورد مطالعه قرار گرفتهاند، از جمله لوتئین، زآگزانتین، ویتامین ث و ای، بتاکاروتن، سلنیم، و گرده گل که عملکرد فیزیولوژیکی را در آسیب اکسیداتیو ناشی از کادمیوم و دیگر فلزات سنگین محافظت یا احیا میکنند (8). گرده گل که به دلیل خواص درمانی و تغذیهایی و پزشکی محبوب است، ویژگیهای گرده گل با توجه به منشاء گیاهی و جغرافیایی هر منطقه متفاوت است (9). متابولیتهای گرده گل شامل پروتئینها، اسیدهای آمینه، آنزیمها، کوآنزیمها، کربوهیدراتها، لیپیدها، اسیدهای چرب، ترکیبات فنلی، عناصر زیستی و ویتامینها هستند (10). پروتئین گرده گل 22/7% است که شامل اسیدهای آمینه ضروری بدن (که در رشد و سلامت بدن و بیان ژنها، مسیرهای پیامرسانی سلولی، هضم و جذب مواد مغذی، نقش مهمی دارند) مانند تریپتوفان، فنیلآلانین، متیونین، لوسین، لیزین، ترئونین، هیستیدین، ایزولوسین، و والین میباشد و همچنین دارای اسیدهای نوکلئیک، بهویژه اسید ریبونوکلئیک میباشد. کربوهیدراتهای گرده گل 30/8% هستند که حاوی قندهایی مانند گلوکز و فروکتوز است. لیپیدها 5/1% هستند که به عنوان اسیدهای چرب ضروری مانند اسیدهای آرکائیک، لینولئیک و γ-لینولئیک، فسفولیپیدها، و فیتوسترولها (به ویژه β-سیتوسترول) یافت میشوند. ترکیبات فنلی 1/6% از ترکیبات گرده گل را تشکیل میدهد که شامل لکوترینها، کاتچینها، اسیدهای فنولیک (مانند اسید کلروژنیک)، و فلاونوئیدها (مانند کامفرول، ایزورامنتین و کوئرستین) هستند (11). مقالات خواص ضد التهابی آنتی اکسیدانی ضد میکروبی گرده گل را ثابت کردهاند و بیان شده است که اثر درمانی و پیشگیری کننده ROS گرده گل به دلیل ترکیبات فنلی موجود در آن میباشد. گرده گل به عنوان یک عامل محافظت کننده عصبی مهم عمل میکند (12)، به عنوان مثال در مطالعات مربوط به اختلالات عصبی، ادعا کرده اند که گرده گل سطح اضطراب را کاهش میدهد و اختلالات شناختی را بهبود میبخشد (12). همچنین عبدالعزیز (Abdelaziz) و همکاران در پژوهشی با عنوان سمیت کادمیوم و اثر محافظتی گرده گل، ویتامین C و B کمپلکس به این نتیجه رسیدند که درمان با گرده گل بیشترین تأثیر را در بهبود پارامترهای خونی مدنظر داشته است که ثابت میکند گرده گل باعث کاهش استرس اکسیداتیو ناشی از مسمومیت کادمیوم میشود (13). پرتکرارترین و محبوبترین فعالیت ورزشی تمرین تناوبی با شدت بالا (HIIT) High-intensity interval training (این نوع تمرین به دلیل افزایش متابولیسم، افزایش سوزاندن کالری و چربی، و کاهش زمان تمرین، بسیار محبوب میباشد) است، که پروتکل تمرینی آن شامل یک یا چند دوره تمرین انفجاری کوتاه مدت با ریکاوری کوتاه مدت است که تا رسیدن به خستگی که به صورت متناوب انجام میشود که منجر به سنتز BDNF میشود (14). هانگ Huang و همکاران نشان دادند که ورزش حتی اگر یک جلسه باشد بیان ژن و غلظت BDNF را در هیپوکامپ، جسم مخطط و نواحی مختلف قشر مغز افزایش میدهد. بیان شده است که تمرینHIIT غلظت پراکسید هیدروژن (H2O2) و فاکتور نکروز کننده آلفا (TNF-α) را در مغز افزایش میدهد که این مولکولها میتوانند سنتز BDNF را شروع کند و باعث خودتنظیمی مثبت سنتز BDNF شوند (15). در اکثر مطالعات اثرات گرده گل و تمرینات HIIT به صورت جداگانه بررسی کردهاند اما در مطالعه حاضر سعی بر این بوده است که علاوه بر بررسی اثر کادمیوم، اثر همزمان این دو با هم نیز بررسی شود. سوال اصلی که در این مطالعه مطرح است این است، که اثر بخشی تمرین تناوبی شدید و مصرف گرده گل هر کدام به تنهایی و در تعامل با هم به چه میزان تاثیر معنیدار بر TRKb موشهای آزمایشگاهی در معرض کادمیوم دارد؟
روش بررسی
این مطالعه از نوع مطالعات تجربی بوده است و تلاش شده است تا تمامی متغیر های مزاحم کنترل شود. نخست 25 سر موشهای آزمایشگاهی نر نژاد اسپراگ-داولی، سن 8 هفتگی و وزن 258 گرم از آزمایشگاه حیوانات مرودشت تهیه شد. که در دمای 25 درجه نگهداری شده پس از انتقال به محیط آزمایشگاه به مدت هفت روز جهت سازگاری نگهداری شدند، بهصورت تصادفی در پنج گروه پنجتایی جایگزین شدند که این گروه ها شامل گروه کنترل سالم (HC)، گروه کنترل کادمیوم (CD)، گروه کادمیوم و گرده گل (PO)، گروه کادمیوم و تمرین تناوبی شدید (HIIT)، گروه کادمیوم و گرده گل و تمرین تناوبی شدید (HIIT-PO) بود. کادمیوم بهصورت کادمیوم کلراید که با کد 36629/22 ساخت آلفاایسر آلمان تهیه شده بود بهصورت محلول در آب به میزان ۴۰۰ میلیگرم بر کیلوگرم وزن بدن در لیتر از طریق آب آشامیدنی به موشهای گروههای (/CD /PO HIIT/HIIT-PO ) خورانده شد، ظروف آب حاوی کادمیوم بهطور روزانه و در تمام مدت کنترل و همواره پر میشد بهطوری که موشهای در تمام مدت قادر به مصرف آب به مقدار دلخواه بودند. مکمل گرده گل که از شرکت هانی بال ایران تهیه شده بهصورت روزانه 200 میلیگرم گرده گل در 4/2 سی سی نرمال سالین حل شده و بهصورت گاواژ به موشهای آزمایشگاهی گروه های(PO/ HIIT-PO) داده شد (14,16). پروتکل تمرینی به این صورت بود که تمرین HIIT به مدت هشت هفته به گروههای (HIIT/ HIIT-PO) (سه جلسه دویدن هفتگی روی تردمیل با شدت و مدت زمان مشخص) داده شد. جهت تعیین حداکثر شدت تمرین و حداکثر توان هوازی آزمون vo2max (آزمون افزایشی استاندارد بدفورد) از گروههای HIIT-PO و HIIT گرفته شد. این آزمون شامل 10 مرحله سه دقیقه ای است. سرعت در مرحله اول 0/3 کیلومتر در ساعت و در مراحل بعدی 0/3 کیلومتر در ساعت به سرعت تردمیل افزوده می شد در حالیکه در تمام مراحل شیب صفر بود. که در هر مرحله از آزمون، زمانی که موشها دیگر قادر به ادامه دویدن نبودند معادل حداکثر توان هوازی در نظر گرفته شد (17).
تمرین HIIT شامل سه مرحله: گرم کردن (5 دقیقه)، تمرین اصلی و سرد کردن (5 دقیقه) بود. در این پروتکل، یک تکرار تمرینی به اینگونه بود که تمرین 2 دقیقه ای با شدت بالا انجام میشد سپس ۲ دقیقه استراحت فعال با شدت 50 درصد Vo2max به دنبال داشت (در ادامه کلمه تکرار استفاده شد به این معنی میباشد). موشها نخست روی تردمیل با شدت 50 تا 60 درصد maximum oxygen consumption Vo2max به مدت 5 دقیقه گرم شدند سپس در هفته اول دو تکرار 2 دقیقهای با شدت 80% Vo2max داشتند، در هفته دوم چهار تکرار با شدت 90% Vo2max داشتند ،در هفته سوم شش تکرار با شدت 100% Vo2max داشتند و از شروع هفته چهارم به بعد هشت تکرار با شدت 110% Vo2max داشتند. پس از آخرین تکرار، به مدت پنج دقیقه موشها سردکردن را با شدت 50 تا 60 درصد Vo2max انجام دادند (17).
تشریح و نمونهبرداری: 48 ساعت پس از آخرین جلسه تمرین و مکملدهی، در حالت 12 ساعت ناشتایی موشهای آزمایشگاهی با استفاده از کتامین (50 میلیگرم بر کیلوگرم) و زایلوزین (20 میلیگرم بر کیلوگرم) بی هوش شدند. پس از بیهوشی کامل بافت هیپوکامپ مغز به دقت استخراج شد و بلافاصله پس از توزین و شست و شو به مدت 10 دقیقه در تانک ازت غوطهور شد و سپس به دمای 70 – انتقال داده شد (18).
اندازه گیری کادمیوم درون بافت هیپوکامپ مغز: برای اندازهگیری کادمیوم درون بافت هیپوکامپ مغز محلول استاندارد تک عنصری کادمیوم (1 میلیگرم در میلیلیتر) از Reagecon (شانون، ایرلند) خریداری شد که 1 گرم بافت مغز را با 8 میلیلیتر اسید نیتریک غلیظ و 2 میلیلیتر اسید پرکلریک مخلوط شد و در طول شب در هود بخار قرار گرفت. روز دوم، محلول روی حرارت گذاشته شد تا شفاف و بی¬رنگ شود سپس آب مقطر به 5 میلیلیتر از محلول اضافه و حل شد در نهایت، غلظت Cd در نمونه توسط اسپکتروفتومتری جذب اتمی در طول موج پارامتر را روی 228/8 نانومتر (طیفسنج جذب اتمی iCE™ 3500 AAS، Thermo Fisher Scientific، ایالات متحده آمریکا) تعیین شد (به جدول 1 مراجعه شود).
اندازهگیری TRKb : مقادیر پروتئینی با استفاده از کیت الایزای TRKb ((Persongen BG-E30615 کشور آلمان کمپانی FN تهیه شده و بررسی شد. بر اساس دستورالعمل کیت بافت هیپوکمپ مغز در بافری حاوی ۱۳۷ میلیمول Nacl، ۲۰ میلیمول تریس هیدروکلرید ( Tris-HCL ۱% و گلیسرول ۱۰% ، ۱ میلیمول (Phenyl PMSF methyl sulfonyl fluoride)، 0/5 میلیمول سدیم واندانت و igepal ۱% قرار داده شد و کاملاً هموژن شدند. به مدت ۲۰ دقیقه در دستگاه سانتریفیوژ با دور ۲۰۰۰ rpm و دمای ۴ درجه سانتیگراد سانتریفیوژ شدند پس از رقیق کردن سوپرنانت با بافر نمونه چاهکها به مدت ۳۰ دقیقه در دستگاه انکوباتور انکوبه شدند جذب در طول موج ۴۵۰ نانومتر خوانده شد منحنی استاندارد در دامنهای بین ۵ تا ۱۰۰ نانوگرم به ازای هر لیتر برای BDNF رسم شد (19).
تجزیه و تحلیل آماری
پس از جمعآوری دادهها از آزمون های شاپیرو-ویلک و لیون به ترتیب برای بررسی نرمالیته و از همگنی دادهها استفاده شد و جهت تحلیل دادهها از آزمونهای تی مستقل و تحلیل واریانس دو راهه بهره برده شد. تجزیه و تحلیل دادهها با استفاده از نرمافزارversion 16 SPSS و سطح معنیداری 05/0 انجام شد.
نتایج
نتایج حاصل از توصیف داده در جدول 1 ارائه شده است که شامل میانگین و انحراف استاندارد کادمیوم درون بافت هیپومکامپ میباشد.
همانگونه که در جدول 2 مشاهده میشود گروه کنترل سالم بیشتر میزان TRKb را به خود اختصاص داده پس از این گروه، گروه کادمیوم+تمرین+مصرف مکمل گرده گل داشته قرار گرفته، و سپس به ترتیب گروه کادمیوم+مصرف گرده گل، گروه کادمیوم+تمرین و در نهایت گروه مصرف کادمیوم قرار گرفته است. گروهی که تنها کادمیوم مصرف کرده است میزان TRKb کمتر از بقیه داشته است. پیش فرضهای نرمالیته با استفاده از آزمون شاپیرو- ویلک و همگنی واریانسها با استفاده از آزمون لیون مورد بررسی قرار گرفت که نتایج نشاندهنده رعایت پیش فرضها بود (P≥0.05). مقایسه گروه کنترل سالم با گروه کنترل مصرف کادمیوم با استفاده از آزمون تی مستقل نشان داد که مصرف کادمیوم سبب کاهش معنادار میانگین TRKb شده است که نتایج این مقایسه در جدول 3 ارائه شده است. نتایج جدول 3 نمایش میدهد، گروهی که تنها کادمیوم استفاده کرده است (گروه کنترل با مصرف کادمیوم) نسبت به گروه کنترل (گروه کنترل سالم) به شکل معناداری از میانگین TRKb کمتری برخودار بوده است که نشاندهنده این است که کادمیوم سبب کاهش معنادار TRKb شده است. جهت بررسی اثر اصلی تمرین و اثر اصلی مکمل گرده گل و همچنین اثر تعاملی تمرین و گرده گل بر میانگین گروههایی که کادمیوم مصرف کرده بودند، از آزمون تحلیل واریانس دو راهه استفاده شد که نتایج آن در جدول 4 و نمودار 1 ارائه شده است. نتایج جدول 4 نشان میدهد، اثر اصلی تمرینات HIIT بر میانگین TRKb گروههایی که کادمیوم استفاده کردهاند باعث افزایش معنادار TRKb شده است، به عبارت دیگر انجام تمرینات HIIT سبب افزایش بیان TRKb شده است. اثر اصلی مصرف مکمل گرده گل نیز بر میانگین TRKb گروههایی که کادمیوم استفاده کردهاند باعث افزایش معنادار TRKb شده است، به عبارت دیگر مصرف گرده گل نیز سبب افزایش بیان TRKb شده است. اثر تعاملی تمرین و مکمل گرده گل معنادار بود که نشان میدهد اثر سطوح مختلف تمرین (داشتن تمرین یا نداشتن تمرین) بر سطوح مختلف مکملدهی (خوردن مکمل یا نخوردن مکمل) متفاوت عمل کرده است، به عبارت دیگر زمانی که گروهها تمرین داشتند اثر مکملدهی قابل مشاهده نیست و گروهها عملکرد تقریبا مشابه هم داشتند اما زمانی که گروهها تمرین نداشتند اثر مکملدهی قابل مشاهده است و گروهی که مکمل مصرف کرده است TRKb در آن افزایش داشته است (مراجعه شود به نمودار 1).
جدول1: کادمیوم درون بافت هیپومکامپ ( میکروگرم بر کیلوگرم)
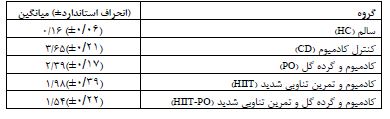
جدول 2: میانگین مقدار TRKb (پیکوگرم در میلی لیتر) در گروه های مورد مطالعه
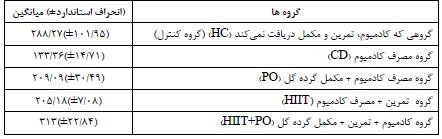
جدول 3: نتایج آزمون تی مستقل برای مقایسه میانگین TRKb در گروه های کادمیوم و کنترل

جدول 4: آزمون تحلیل واریانس دو راهه جهت بررسی اثرات اصلی و تعاملی تمرین و مکمل گرده گل بر میزان TRKb
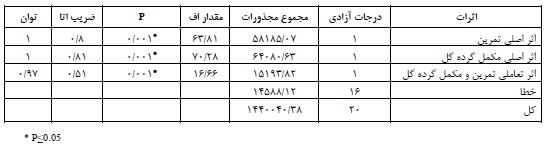

نمودار1: تعامل اثر تمرین و مکمل کرده گل بر میزان TRKb
بحث
کادمیوم یکی از عناصر سمی است که در محیط اطراف مـا وجـود دارد و با توجه به نیمه عمر طولانی آن اثرات مخربی بر بدن انسان میگذارد. کادمیوم از طریق مواد مصرفی مانند غذا، آب، هوا، و دخانیات وارد بدن انسان شود. کادمیوم در صنعت استفادههای فراوانی دارد که می¬توان به تولید باتریها، رنگها، آبکاری فلزات، صنایع نظامی، کودها، پلاستیکها (PVC) اشاره نمود (20). تجمع کادمیوم در بدن با تولید اکسیژن فعال (ROS) باعث مسمومیت میشود و به ارگان هایی مانند کبد و ریه آسیب میرساند، که عوارض آن شامل اسهال شکم درد، استفراغ شدید میباشد، همچنین باعث آسیب بـه سیستم عصبی مرکزی و DNA Deoxyribonucleic acid و در نهایت سرطان میشود. گزارش شده است در مسمومیت با کادمیوم، بیشترین مقدار کادمیوم در هیپوکامپ مغز تجمع یافته و در این منطقه باعث دنوروژنراسیون (از بین رفتن نورونها) میشود (21) کادمیوم در میتوکندری با ورود به ساختار آنزیمهای چرخه فسفریلاسیون اکسیداتیو، چرخه تولید انرژی را مختل میکند. کادمیوم در بدن جایگزین زینک و کلسیم میشود که در کانال های کلسیمی نقش دارند و اختلالاتی در الگوی سنتز BDNF به وجود میآورد که عمدتاً به عنوان تغییرات در غلظت سرمی BDNF و گیرنده TRKb شناسایی شده است (22). راداک (Radak) و همکاران در مقالهای با عنوان اثر ورزش و نقش رادیکال های آزاد بر عملکرد مغز، به بررسی نقش رادیکالهای آزاد تولید شده توسط کادمیوم پرداختند و بیان کردند که رادیکالهای آزاد بر عملکرد نروتروفینهای مغز تاثیر منفی دارند (23). گرده گل منبع آنتیاکسیدانهای طبیعی است که حاوی آنتیاکسیدانهایی به شکل پلیفنولها و فلاونوئیدها است که از نورونها در برابر آسیب اکسیداتیو محافظت میکنند. بیان شده است که گرده گل از سمیت عصبی ناشی از فلزات سنگین مانند کادمیوم جلوگیری میکند و آسیب اکسیداتیو ناشی از فلزات سنگین را بهبود میبخشد، مقالات ثابت کردهاند که گرده گل باعث افزایش BDNF و به تبع آن تاثیر بر گیرنده TRKb میشود (27-24). تأثیر فعالیت بدنی بر فلزات سنگین اخیرا مورد بحث قرار گرفته است، در این رابطه لیرنا (Llerena) و همکاران بیان کردند که غلظت فلزات سنگین سمی در ادرار افراد ورزشکار کمتر از گروه کنترل بود (28). مطالعهای نشان داد که ورزشکاران غلظت پلاسمایی Cd و Pb کمتری نسبت به افراد غیر ورزشکار داشتند. ماینار (Mainar) و همکاران در مطالعهای با عنوان غلظت سرم خونی گروهی از مردان کمتحرک در مقایسه با ورزشکاران سطح بالا در رشتههای ورزشی متفاوت گزارش کردند که گروه افراد کمتحرک نسبت به گروه ورزشکاران میزان بیشتری از Cd و Pb را در سرم خونی نشان دادهاند (29) و زمانی که گروه کم تحرک، تمرین تا رسیدن به خستگی را انجام دادند، میزان Cd و Pb در خون کاهش یافت (30). این مطالعات این فرضیه شکل میدهد که فعالیت بدنی منظم میتواند تغییرات سازگارانه را برای جلوگیری از سمیت ناشی از قرار گرفتن در معرض این فلزات سنگین ایجاد کند. به نظر میرسد نتایج این مطالعه نیز در راستای مقالات فوق باشد، اما از آنجایی که مطالعه انجام پذیرفته در این زمینه در مسیر ابتدایی می¬باشد، انجام مطالعات تکمیلی ضروری به نظر میرسد.
نتیجهگیری
پژوهش حاضر نشان داد، کادمیوم سبب کاهش معنیدار در سطح گیرندههای TRKb در هیپوکامپ مغز موشها میشود. گرده گل بهتنهایی با اثرات آنتیاکسیدانی باعث افزایش معنادار TRKb در تمام گروههایی که گرده گل مصرف کرده بودند نسبت به گروه کنترل کادمیوم شد. همچنین تمرین HIIT نیز بهتنهایی با تاثیر مثبت بر غلظت پراکسید هیدروژن (H2O2) و فاکتور نکروز کننده آلفا (TNF-α) باعث افزایش معنی دار TRKb در تمام گروههایی که تمرین HIIT داشتند نسبت به گروه کنترل کادمیوم شد.
سپاسگزاری
این مقاله از رساله دوره دکتری تخصصی سام رحمانی چگنی مصوب در دانشگاه آزاد اسلامی واحد بروجرد استخراج شده است و نویسندگان بر خود لازم میدانند مراتب تشکر صمیمانه خود را از دانشگاه آزاد اسلامی واحد بروجرد، مسئولان پژوهشی آزمایشگاه علوم دامی دانشگاه آزاد اسلامی واحد مرودشت، و هیئت داوران که ارتقاء کیفی این گزارش نویسندگان را یاری دادند، اعلام مینمایند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
محدودیتهای مطالعه: محدودیت های مالی اجازه گسترش این طرح مطالعاتی را به پژوهشگران نداد، به شکلی که این مطالعه با تعداد سر موش های محدود به انجام رسید، از سوی دیگر به علت این که کادمیوم در آب موش های حل شده بود، ممکن است، همه موش ها به یک میزان کادمیوم استفاده نکرده باشند.
پیشنهاد: توصیه می شود در مطالعات آتی پژوهشگران مدت زمان بیشتری نمونههای آزمایشگاهی را در معرض کادمیوم قرار دهند، و اثرات اشکال مختلف تمرین و مکمل دهی را مورد مطالعه قرار دهند.
ملاحظات اخلاقی
این مقاله دارای کد اخلاق از معاونت علوم پزشکی دانشگاه آزاد بروجرد به شماره IR.IAU.B.REC.1402.116 است که در تاریخ 1402/12/23 اخذ شده است.
مشارکت نویسندگان
در ارائه ایده، طراحی مطالعه، در جمعآوری دادهها، و در تجزیه و تحلیل دادهها تمامی نویسندگان به یک نسبت مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
مغز به دلیل استفاده زیاد از اکسیژن و فعالیت متابولیکی در برابر استرس اکسیداتیو آسیبپذیر است، فاکتور نوروتروفیک مشتق از مغز یکی از عواملی است که با استرس اکسیداتیو مقابله میکند. فاکتور نوروتروفیک مشتق از مغز (BDNF Brain-Derived Neurotrophic Factor) و گیرنده آن، تیروزینکیناز بتا (TRKb Tropomyosin receptor kinase B)، عضوی از خانواده فاکتورهای نوروتروفیک هستند. تیروزینکیناز آنزیمی است که قادر است یک گروه فسفات را به تیروزین اضافه کند و با اتصال به غشای نورون، TRKb را فعال کند. این آنزیم تحت تاثیر کلسیم باعث اتصال BDNF به TRKb میشود. گیرنده تیروزینکیناز B زیر مجموعهای از گیرندههای تیروزینکینازی غشای سلول است که میل ترکیبی زیادی به BDNF و نوروتروفین-4 (NT-4 Neurotrophin-4) و نوروتروفین-3 (NT-3 Neurotrophin-3) دارد که در نهایت باعث رشد، تمایز و بازسازی نورونی، مسیریابی آکسونی، شکلپذیری سیناپسی و مورفوژنز و بلوغ آستروسیت میشود. BDNF دارای عملکرد ضد اکسیداسیون و ضد آپوپتوز نیز میباشد (1,2). BDNF را در قشر مغز، هیپوکامپ و نواحی قاعدهای پیش مغز میتوان یافت که بر عملکرد بهتر هیپوکامپ در طولانی مدت تاثیر دارد. فلزات سنگین مانند کادمیوم (Cd)، سرب (Pb) و جیوه (Hg) میتوانند اثر کاهشی بر BDNF میشوند. کادمیوم به دلیل شبیه بودن به کلسیم و زینک جایگزین آنها در نورونها (به ویژه کانالهای کلسیمی غشا) میشود که باعث آسیب به سیستم عصبی به ویژه مغز میشود و منجر به کاهش ورود کلسیم و زینک به سلول شود به همین سبب موجب کاهش BDNF و غیرفعال شدن گیرنده TRKb میشود که در انتقال پیام عصبی نقش مهمی دارند و راهکار مغز جهت محافظت از نورونها و ترمیم آنها افزایش تولید BDNF میباشد. در این زمینه رای (Ray) و همکاران دریافتند که مخلوط (آرسنیک، سرب و کادمیوم) سطح بیان BDNF و به تبع آن گیرنده TRKb و آنزیم تیروزینکیناز را در موشها کاهش میدهد (3). در مطالعات اخیر به اثرات کادمیوم بر سیستم عصبی پرداخته شده است (4). کادمیوم یک آلاینده محیطی فراگیر است که در صنعت استفادههای فراوانی (تولید باتریها، رنگها آبکاری فلزات، صنایع نظامی، کودها، مواد ثبات بخش در پلاستیکها) دارد، همچنین در زندگی روزمره میتواند از طریق سیگار کشیدن و گرد و غبار و مصرف آب و غذای آلوده به کادمیوم وارد بدن انسان میشود، که به همین سبب در شهرهای آلوده به مسئله مهمی تبدیل شده است. تجمع کادمیوم در بدن باعث مسمومیت در اندامهایی مانند کبد، ریه، و معده و مغز میشود که عوارض آن شامل اسهال، شکم درد، استفراغ شدید، آسیب بـه سیستم عصبی و DNA و در نهایت سرطان میباشد (5,6). گزارش شده است در مسمومیتهای مزمن با کادمیوم، بیشترین سطح کادمیوم در هیپوکامپ تجمع یافته و باعث دنوروژنراسیون میشود و همچنین در میتوکندری باعث مختل شدن چرخه فسفریلاسیون اکسیداتیو میشود. قرار گرفتن در معرض کادمیوم باعث کاهش ناقل زینک (ZnT3) میشود که منجر به اثرات پایین دستی شامل تغییر در مسیرهای سیگنالینگ مغز میشود و سیگنالدهی گیرنده تیروزینکیناز بی (TRKb) و Erk1/2 (پیامرسانهای درون سلولی که نقش مهمی در شکلپذیری و رشد نورون ایفا میکنند) را کاهش میدهد. فعالسازی TRKb و متعاقب آن BDNF برای انعطافپذیری عصبی ضروری هستند (6, 5). به موادی که دارای خواص محافظتی در برابر استرس اکسیداتیو (Reactive Oxygen Species (ROS)) (ناشی از کادمیوم و رادیکالهای آزاد) باشند آنتیاکسیدان میگویند که به این ویژگی خواص آنتیاکسیدانی گفته میشود و بهصورت مکانیسمهای دفاعی آنزیمی و غیر آنزیمی است (7). اخیراً چندین ترکیب با خواص آنتیاکسیدانی مورد مطالعه قرار گرفتهاند، از جمله لوتئین، زآگزانتین، ویتامین ث و ای، بتاکاروتن، سلنیم، و گرده گل که عملکرد فیزیولوژیکی را در آسیب اکسیداتیو ناشی از کادمیوم و دیگر فلزات سنگین محافظت یا احیا میکنند (8). گرده گل که به دلیل خواص درمانی و تغذیهایی و پزشکی محبوب است، ویژگیهای گرده گل با توجه به منشاء گیاهی و جغرافیایی هر منطقه متفاوت است (9). متابولیتهای گرده گل شامل پروتئینها، اسیدهای آمینه، آنزیمها، کوآنزیمها، کربوهیدراتها، لیپیدها، اسیدهای چرب، ترکیبات فنلی، عناصر زیستی و ویتامینها هستند (10). پروتئین گرده گل 22/7% است که شامل اسیدهای آمینه ضروری بدن (که در رشد و سلامت بدن و بیان ژنها، مسیرهای پیامرسانی سلولی، هضم و جذب مواد مغذی، نقش مهمی دارند) مانند تریپتوفان، فنیلآلانین، متیونین، لوسین، لیزین، ترئونین، هیستیدین، ایزولوسین، و والین میباشد و همچنین دارای اسیدهای نوکلئیک، بهویژه اسید ریبونوکلئیک میباشد. کربوهیدراتهای گرده گل 30/8% هستند که حاوی قندهایی مانند گلوکز و فروکتوز است. لیپیدها 5/1% هستند که به عنوان اسیدهای چرب ضروری مانند اسیدهای آرکائیک، لینولئیک و γ-لینولئیک، فسفولیپیدها، و فیتوسترولها (به ویژه β-سیتوسترول) یافت میشوند. ترکیبات فنلی 1/6% از ترکیبات گرده گل را تشکیل میدهد که شامل لکوترینها، کاتچینها، اسیدهای فنولیک (مانند اسید کلروژنیک)، و فلاونوئیدها (مانند کامفرول، ایزورامنتین و کوئرستین) هستند (11). مقالات خواص ضد التهابی آنتی اکسیدانی ضد میکروبی گرده گل را ثابت کردهاند و بیان شده است که اثر درمانی و پیشگیری کننده ROS گرده گل به دلیل ترکیبات فنلی موجود در آن میباشد. گرده گل به عنوان یک عامل محافظت کننده عصبی مهم عمل میکند (12)، به عنوان مثال در مطالعات مربوط به اختلالات عصبی، ادعا کرده اند که گرده گل سطح اضطراب را کاهش میدهد و اختلالات شناختی را بهبود میبخشد (12). همچنین عبدالعزیز (Abdelaziz) و همکاران در پژوهشی با عنوان سمیت کادمیوم و اثر محافظتی گرده گل، ویتامین C و B کمپلکس به این نتیجه رسیدند که درمان با گرده گل بیشترین تأثیر را در بهبود پارامترهای خونی مدنظر داشته است که ثابت میکند گرده گل باعث کاهش استرس اکسیداتیو ناشی از مسمومیت کادمیوم میشود (13). پرتکرارترین و محبوبترین فعالیت ورزشی تمرین تناوبی با شدت بالا (HIIT) High-intensity interval training (این نوع تمرین به دلیل افزایش متابولیسم، افزایش سوزاندن کالری و چربی، و کاهش زمان تمرین، بسیار محبوب میباشد) است، که پروتکل تمرینی آن شامل یک یا چند دوره تمرین انفجاری کوتاه مدت با ریکاوری کوتاه مدت است که تا رسیدن به خستگی که به صورت متناوب انجام میشود که منجر به سنتز BDNF میشود (14). هانگ Huang و همکاران نشان دادند که ورزش حتی اگر یک جلسه باشد بیان ژن و غلظت BDNF را در هیپوکامپ، جسم مخطط و نواحی مختلف قشر مغز افزایش میدهد. بیان شده است که تمرینHIIT غلظت پراکسید هیدروژن (H2O2) و فاکتور نکروز کننده آلفا (TNF-α) را در مغز افزایش میدهد که این مولکولها میتوانند سنتز BDNF را شروع کند و باعث خودتنظیمی مثبت سنتز BDNF شوند (15). در اکثر مطالعات اثرات گرده گل و تمرینات HIIT به صورت جداگانه بررسی کردهاند اما در مطالعه حاضر سعی بر این بوده است که علاوه بر بررسی اثر کادمیوم، اثر همزمان این دو با هم نیز بررسی شود. سوال اصلی که در این مطالعه مطرح است این است، که اثر بخشی تمرین تناوبی شدید و مصرف گرده گل هر کدام به تنهایی و در تعامل با هم به چه میزان تاثیر معنیدار بر TRKb موشهای آزمایشگاهی در معرض کادمیوم دارد؟
روش بررسی
این مطالعه از نوع مطالعات تجربی بوده است و تلاش شده است تا تمامی متغیر های مزاحم کنترل شود. نخست 25 سر موشهای آزمایشگاهی نر نژاد اسپراگ-داولی، سن 8 هفتگی و وزن 258 گرم از آزمایشگاه حیوانات مرودشت تهیه شد. که در دمای 25 درجه نگهداری شده پس از انتقال به محیط آزمایشگاه به مدت هفت روز جهت سازگاری نگهداری شدند، بهصورت تصادفی در پنج گروه پنجتایی جایگزین شدند که این گروه ها شامل گروه کنترل سالم (HC)، گروه کنترل کادمیوم (CD)، گروه کادمیوم و گرده گل (PO)، گروه کادمیوم و تمرین تناوبی شدید (HIIT)، گروه کادمیوم و گرده گل و تمرین تناوبی شدید (HIIT-PO) بود. کادمیوم بهصورت کادمیوم کلراید که با کد 36629/22 ساخت آلفاایسر آلمان تهیه شده بود بهصورت محلول در آب به میزان ۴۰۰ میلیگرم بر کیلوگرم وزن بدن در لیتر از طریق آب آشامیدنی به موشهای گروههای (/CD /PO HIIT/HIIT-PO ) خورانده شد، ظروف آب حاوی کادمیوم بهطور روزانه و در تمام مدت کنترل و همواره پر میشد بهطوری که موشهای در تمام مدت قادر به مصرف آب به مقدار دلخواه بودند. مکمل گرده گل که از شرکت هانی بال ایران تهیه شده بهصورت روزانه 200 میلیگرم گرده گل در 4/2 سی سی نرمال سالین حل شده و بهصورت گاواژ به موشهای آزمایشگاهی گروه های(PO/ HIIT-PO) داده شد (14,16). پروتکل تمرینی به این صورت بود که تمرین HIIT به مدت هشت هفته به گروههای (HIIT/ HIIT-PO) (سه جلسه دویدن هفتگی روی تردمیل با شدت و مدت زمان مشخص) داده شد. جهت تعیین حداکثر شدت تمرین و حداکثر توان هوازی آزمون vo2max (آزمون افزایشی استاندارد بدفورد) از گروههای HIIT-PO و HIIT گرفته شد. این آزمون شامل 10 مرحله سه دقیقه ای است. سرعت در مرحله اول 0/3 کیلومتر در ساعت و در مراحل بعدی 0/3 کیلومتر در ساعت به سرعت تردمیل افزوده می شد در حالیکه در تمام مراحل شیب صفر بود. که در هر مرحله از آزمون، زمانی که موشها دیگر قادر به ادامه دویدن نبودند معادل حداکثر توان هوازی در نظر گرفته شد (17).
تمرین HIIT شامل سه مرحله: گرم کردن (5 دقیقه)، تمرین اصلی و سرد کردن (5 دقیقه) بود. در این پروتکل، یک تکرار تمرینی به اینگونه بود که تمرین 2 دقیقه ای با شدت بالا انجام میشد سپس ۲ دقیقه استراحت فعال با شدت 50 درصد Vo2max به دنبال داشت (در ادامه کلمه تکرار استفاده شد به این معنی میباشد). موشها نخست روی تردمیل با شدت 50 تا 60 درصد maximum oxygen consumption Vo2max به مدت 5 دقیقه گرم شدند سپس در هفته اول دو تکرار 2 دقیقهای با شدت 80% Vo2max داشتند، در هفته دوم چهار تکرار با شدت 90% Vo2max داشتند ،در هفته سوم شش تکرار با شدت 100% Vo2max داشتند و از شروع هفته چهارم به بعد هشت تکرار با شدت 110% Vo2max داشتند. پس از آخرین تکرار، به مدت پنج دقیقه موشها سردکردن را با شدت 50 تا 60 درصد Vo2max انجام دادند (17).
تشریح و نمونهبرداری: 48 ساعت پس از آخرین جلسه تمرین و مکملدهی، در حالت 12 ساعت ناشتایی موشهای آزمایشگاهی با استفاده از کتامین (50 میلیگرم بر کیلوگرم) و زایلوزین (20 میلیگرم بر کیلوگرم) بی هوش شدند. پس از بیهوشی کامل بافت هیپوکامپ مغز به دقت استخراج شد و بلافاصله پس از توزین و شست و شو به مدت 10 دقیقه در تانک ازت غوطهور شد و سپس به دمای 70 – انتقال داده شد (18).
اندازه گیری کادمیوم درون بافت هیپوکامپ مغز: برای اندازهگیری کادمیوم درون بافت هیپوکامپ مغز محلول استاندارد تک عنصری کادمیوم (1 میلیگرم در میلیلیتر) از Reagecon (شانون، ایرلند) خریداری شد که 1 گرم بافت مغز را با 8 میلیلیتر اسید نیتریک غلیظ و 2 میلیلیتر اسید پرکلریک مخلوط شد و در طول شب در هود بخار قرار گرفت. روز دوم، محلول روی حرارت گذاشته شد تا شفاف و بی¬رنگ شود سپس آب مقطر به 5 میلیلیتر از محلول اضافه و حل شد در نهایت، غلظت Cd در نمونه توسط اسپکتروفتومتری جذب اتمی در طول موج پارامتر را روی 228/8 نانومتر (طیفسنج جذب اتمی iCE™ 3500 AAS، Thermo Fisher Scientific، ایالات متحده آمریکا) تعیین شد (به جدول 1 مراجعه شود).
اندازهگیری TRKb : مقادیر پروتئینی با استفاده از کیت الایزای TRKb ((Persongen BG-E30615 کشور آلمان کمپانی FN تهیه شده و بررسی شد. بر اساس دستورالعمل کیت بافت هیپوکمپ مغز در بافری حاوی ۱۳۷ میلیمول Nacl، ۲۰ میلیمول تریس هیدروکلرید ( Tris-HCL ۱% و گلیسرول ۱۰% ، ۱ میلیمول (Phenyl PMSF methyl sulfonyl fluoride)، 0/5 میلیمول سدیم واندانت و igepal ۱% قرار داده شد و کاملاً هموژن شدند. به مدت ۲۰ دقیقه در دستگاه سانتریفیوژ با دور ۲۰۰۰ rpm و دمای ۴ درجه سانتیگراد سانتریفیوژ شدند پس از رقیق کردن سوپرنانت با بافر نمونه چاهکها به مدت ۳۰ دقیقه در دستگاه انکوباتور انکوبه شدند جذب در طول موج ۴۵۰ نانومتر خوانده شد منحنی استاندارد در دامنهای بین ۵ تا ۱۰۰ نانوگرم به ازای هر لیتر برای BDNF رسم شد (19).
تجزیه و تحلیل آماری
پس از جمعآوری دادهها از آزمون های شاپیرو-ویلک و لیون به ترتیب برای بررسی نرمالیته و از همگنی دادهها استفاده شد و جهت تحلیل دادهها از آزمونهای تی مستقل و تحلیل واریانس دو راهه بهره برده شد. تجزیه و تحلیل دادهها با استفاده از نرمافزارversion 16 SPSS و سطح معنیداری 05/0 انجام شد.
نتایج
نتایج حاصل از توصیف داده در جدول 1 ارائه شده است که شامل میانگین و انحراف استاندارد کادمیوم درون بافت هیپومکامپ میباشد.
همانگونه که در جدول 2 مشاهده میشود گروه کنترل سالم بیشتر میزان TRKb را به خود اختصاص داده پس از این گروه، گروه کادمیوم+تمرین+مصرف مکمل گرده گل داشته قرار گرفته، و سپس به ترتیب گروه کادمیوم+مصرف گرده گل، گروه کادمیوم+تمرین و در نهایت گروه مصرف کادمیوم قرار گرفته است. گروهی که تنها کادمیوم مصرف کرده است میزان TRKb کمتر از بقیه داشته است. پیش فرضهای نرمالیته با استفاده از آزمون شاپیرو- ویلک و همگنی واریانسها با استفاده از آزمون لیون مورد بررسی قرار گرفت که نتایج نشاندهنده رعایت پیش فرضها بود (P≥0.05). مقایسه گروه کنترل سالم با گروه کنترل مصرف کادمیوم با استفاده از آزمون تی مستقل نشان داد که مصرف کادمیوم سبب کاهش معنادار میانگین TRKb شده است که نتایج این مقایسه در جدول 3 ارائه شده است. نتایج جدول 3 نمایش میدهد، گروهی که تنها کادمیوم استفاده کرده است (گروه کنترل با مصرف کادمیوم) نسبت به گروه کنترل (گروه کنترل سالم) به شکل معناداری از میانگین TRKb کمتری برخودار بوده است که نشاندهنده این است که کادمیوم سبب کاهش معنادار TRKb شده است. جهت بررسی اثر اصلی تمرین و اثر اصلی مکمل گرده گل و همچنین اثر تعاملی تمرین و گرده گل بر میانگین گروههایی که کادمیوم مصرف کرده بودند، از آزمون تحلیل واریانس دو راهه استفاده شد که نتایج آن در جدول 4 و نمودار 1 ارائه شده است. نتایج جدول 4 نشان میدهد، اثر اصلی تمرینات HIIT بر میانگین TRKb گروههایی که کادمیوم استفاده کردهاند باعث افزایش معنادار TRKb شده است، به عبارت دیگر انجام تمرینات HIIT سبب افزایش بیان TRKb شده است. اثر اصلی مصرف مکمل گرده گل نیز بر میانگین TRKb گروههایی که کادمیوم استفاده کردهاند باعث افزایش معنادار TRKb شده است، به عبارت دیگر مصرف گرده گل نیز سبب افزایش بیان TRKb شده است. اثر تعاملی تمرین و مکمل گرده گل معنادار بود که نشان میدهد اثر سطوح مختلف تمرین (داشتن تمرین یا نداشتن تمرین) بر سطوح مختلف مکملدهی (خوردن مکمل یا نخوردن مکمل) متفاوت عمل کرده است، به عبارت دیگر زمانی که گروهها تمرین داشتند اثر مکملدهی قابل مشاهده نیست و گروهها عملکرد تقریبا مشابه هم داشتند اما زمانی که گروهها تمرین نداشتند اثر مکملدهی قابل مشاهده است و گروهی که مکمل مصرف کرده است TRKb در آن افزایش داشته است (مراجعه شود به نمودار 1).
جدول1: کادمیوم درون بافت هیپومکامپ ( میکروگرم بر کیلوگرم)

جدول 2: میانگین مقدار TRKb (پیکوگرم در میلی لیتر) در گروه های مورد مطالعه

جدول 3: نتایج آزمون تی مستقل برای مقایسه میانگین TRKb در گروه های کادمیوم و کنترل

جدول 4: آزمون تحلیل واریانس دو راهه جهت بررسی اثرات اصلی و تعاملی تمرین و مکمل گرده گل بر میزان TRKb


نمودار1: تعامل اثر تمرین و مکمل کرده گل بر میزان TRKb
بحث
کادمیوم یکی از عناصر سمی است که در محیط اطراف مـا وجـود دارد و با توجه به نیمه عمر طولانی آن اثرات مخربی بر بدن انسان میگذارد. کادمیوم از طریق مواد مصرفی مانند غذا، آب، هوا، و دخانیات وارد بدن انسان شود. کادمیوم در صنعت استفادههای فراوانی دارد که می¬توان به تولید باتریها، رنگها، آبکاری فلزات، صنایع نظامی، کودها، پلاستیکها (PVC) اشاره نمود (20). تجمع کادمیوم در بدن با تولید اکسیژن فعال (ROS) باعث مسمومیت میشود و به ارگان هایی مانند کبد و ریه آسیب میرساند، که عوارض آن شامل اسهال شکم درد، استفراغ شدید میباشد، همچنین باعث آسیب بـه سیستم عصبی مرکزی و DNA Deoxyribonucleic acid و در نهایت سرطان میشود. گزارش شده است در مسمومیت با کادمیوم، بیشترین مقدار کادمیوم در هیپوکامپ مغز تجمع یافته و در این منطقه باعث دنوروژنراسیون (از بین رفتن نورونها) میشود (21) کادمیوم در میتوکندری با ورود به ساختار آنزیمهای چرخه فسفریلاسیون اکسیداتیو، چرخه تولید انرژی را مختل میکند. کادمیوم در بدن جایگزین زینک و کلسیم میشود که در کانال های کلسیمی نقش دارند و اختلالاتی در الگوی سنتز BDNF به وجود میآورد که عمدتاً به عنوان تغییرات در غلظت سرمی BDNF و گیرنده TRKb شناسایی شده است (22). راداک (Radak) و همکاران در مقالهای با عنوان اثر ورزش و نقش رادیکال های آزاد بر عملکرد مغز، به بررسی نقش رادیکالهای آزاد تولید شده توسط کادمیوم پرداختند و بیان کردند که رادیکالهای آزاد بر عملکرد نروتروفینهای مغز تاثیر منفی دارند (23). گرده گل منبع آنتیاکسیدانهای طبیعی است که حاوی آنتیاکسیدانهایی به شکل پلیفنولها و فلاونوئیدها است که از نورونها در برابر آسیب اکسیداتیو محافظت میکنند. بیان شده است که گرده گل از سمیت عصبی ناشی از فلزات سنگین مانند کادمیوم جلوگیری میکند و آسیب اکسیداتیو ناشی از فلزات سنگین را بهبود میبخشد، مقالات ثابت کردهاند که گرده گل باعث افزایش BDNF و به تبع آن تاثیر بر گیرنده TRKb میشود (27-24). تأثیر فعالیت بدنی بر فلزات سنگین اخیرا مورد بحث قرار گرفته است، در این رابطه لیرنا (Llerena) و همکاران بیان کردند که غلظت فلزات سنگین سمی در ادرار افراد ورزشکار کمتر از گروه کنترل بود (28). مطالعهای نشان داد که ورزشکاران غلظت پلاسمایی Cd و Pb کمتری نسبت به افراد غیر ورزشکار داشتند. ماینار (Mainar) و همکاران در مطالعهای با عنوان غلظت سرم خونی گروهی از مردان کمتحرک در مقایسه با ورزشکاران سطح بالا در رشتههای ورزشی متفاوت گزارش کردند که گروه افراد کمتحرک نسبت به گروه ورزشکاران میزان بیشتری از Cd و Pb را در سرم خونی نشان دادهاند (29) و زمانی که گروه کم تحرک، تمرین تا رسیدن به خستگی را انجام دادند، میزان Cd و Pb در خون کاهش یافت (30). این مطالعات این فرضیه شکل میدهد که فعالیت بدنی منظم میتواند تغییرات سازگارانه را برای جلوگیری از سمیت ناشی از قرار گرفتن در معرض این فلزات سنگین ایجاد کند. به نظر میرسد نتایج این مطالعه نیز در راستای مقالات فوق باشد، اما از آنجایی که مطالعه انجام پذیرفته در این زمینه در مسیر ابتدایی می¬باشد، انجام مطالعات تکمیلی ضروری به نظر میرسد.
نتیجهگیری
پژوهش حاضر نشان داد، کادمیوم سبب کاهش معنیدار در سطح گیرندههای TRKb در هیپوکامپ مغز موشها میشود. گرده گل بهتنهایی با اثرات آنتیاکسیدانی باعث افزایش معنادار TRKb در تمام گروههایی که گرده گل مصرف کرده بودند نسبت به گروه کنترل کادمیوم شد. همچنین تمرین HIIT نیز بهتنهایی با تاثیر مثبت بر غلظت پراکسید هیدروژن (H2O2) و فاکتور نکروز کننده آلفا (TNF-α) باعث افزایش معنی دار TRKb در تمام گروههایی که تمرین HIIT داشتند نسبت به گروه کنترل کادمیوم شد.
سپاسگزاری
این مقاله از رساله دوره دکتری تخصصی سام رحمانی چگنی مصوب در دانشگاه آزاد اسلامی واحد بروجرد استخراج شده است و نویسندگان بر خود لازم میدانند مراتب تشکر صمیمانه خود را از دانشگاه آزاد اسلامی واحد بروجرد، مسئولان پژوهشی آزمایشگاه علوم دامی دانشگاه آزاد اسلامی واحد مرودشت، و هیئت داوران که ارتقاء کیفی این گزارش نویسندگان را یاری دادند، اعلام مینمایند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
محدودیتهای مطالعه: محدودیت های مالی اجازه گسترش این طرح مطالعاتی را به پژوهشگران نداد، به شکلی که این مطالعه با تعداد سر موش های محدود به انجام رسید، از سوی دیگر به علت این که کادمیوم در آب موش های حل شده بود، ممکن است، همه موش ها به یک میزان کادمیوم استفاده نکرده باشند.
پیشنهاد: توصیه می شود در مطالعات آتی پژوهشگران مدت زمان بیشتری نمونههای آزمایشگاهی را در معرض کادمیوم قرار دهند، و اثرات اشکال مختلف تمرین و مکمل دهی را مورد مطالعه قرار دهند.
ملاحظات اخلاقی
این مقاله دارای کد اخلاق از معاونت علوم پزشکی دانشگاه آزاد بروجرد به شماره IR.IAU.B.REC.1402.116 است که در تاریخ 1402/12/23 اخذ شده است.
مشارکت نویسندگان
در ارائه ایده، طراحی مطالعه، در جمعآوری دادهها، و در تجزیه و تحلیل دادهها تمامی نویسندگان به یک نسبت مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Woo D, Seo Y, Jung H, Kim S, Kim N, Park S-M, et al. Locally Activating Trkb Receptor Generates Actin Waves and Specifies Axonal Fate. Cell Chem Biol 2019; 26(12): 1652-63. e4.
2- Bazzari AH, Bazzari FH. BDNF Therapeutic Mechanisms in Neuropsychiatric Disorders. Int J Mol Sci 2022; 23(15): 8417.
3- Rai NK, Ashok A, Rai A, Tripathi S, Nagar GK, Mitra K, et al. Exposure to As, Cd and Pb-Mixture Impairs Myelin and Axon Development in Rat Brain, Optic Nerve and Retina. Toxicol Appl Pharmacol 2013; 273(2): 242-58.
4- Bloom AJ. Metal Regulation of Metabolism. Current Opinion in Chemical Biology 2019; 49: 33-8.
5- Wang T, Zhu Q, Cao B, Cai Y, Wen S, Bian J, et al. Ca 2+ Transfer Via the ER-Mitochondria Tethering Complex in Neuronal Cells Contribute to Cadmium-Induced Autophagy. Cell Biol Toxicol 2022; 38(3): 469-85.
6- Treviño S, Pulido G, Fuentes E, Handal-Silva A, Moreno-Rodríguez A, Venegas B, et al. Effect of Cadmium Administration on the Antioxidant System and Neuronal Death in the Hippocampus of Rats. Synapse 2022; 76(9-10): 1-16.
7- El Shater AE, Ali RA, FR A. Effect of Selenium and Bee Pollen Against Immunotoxicity and Hepatotoxicity Induced by Cadmium in Male Albino Rats. Egyptian Academic Journal of Biological Sciences. C, Physiology and Molecular Biology 2019; 11(2): 1-19.
8- Shen J, Griffiths PT, Campbell SJ, Utinger B, Kalberer M, Paulson SE. Ascorbate Oxidation by Iron, Copper and Reactive Oxygen Species: Review, Model Development, and Derivation of Key Rate Constants. Sci Rep 2021; 11(1): 7417.
9- Lu B, Nagappan G, Guan X, Nathan PJ, Wren P. BDNF-Based Synaptic Repair as a Disease-Modifying Strategy for Neurodegenerative Diseases. Nature Reviews Neuroscience 2013; 14(6): 401-16.
10- Thakur M, Nanda V. Composition and Functionality of Bee Pollen: A Review. Trends in Food Science & Technology 2020; 98: 82-106.
11- Hou Y, Yin Y, Wu G. Dietary Essentiality of “Nutritionally Non-Essential Amino Acids” for Animals and Humans. Experimental Biology and Medicine 2015; 240(8): 997-1007.
12- Forlenza OV, Miranda AS, Guimar I, Talib LL, Diniz BS, Gattaz WF, et al. Decreased Neurotrophic Support is Associated with Cognitive Decline in Non-Demented Subjects. Journal of Alzheimer's Disease 2015; 46(2): 423-9.
13- Abdelaziz I, Elhabiby MI, Ashour AA. Toxicity of Cadmium and Protective Effect of Bee Honey, Vitamins C and B Complex. Hum Exp Toxicol 2013; 32(4): 362-70.
14- Ojo OA, Rotimi DE, Ojo AB, Ogunlakin AD, Ajiboye BO. Gallic Acid Abates Cadmium Chloride Toxicity via Alteration of Neurotransmitters and Modulation of Inflammatory Markers in Wistar Rats. Sci Rep 2023; 13(1): 1577.
15- Freitas DA, Soares BA, Nonato LF, Fonseca SR, Martins JB, Mendonça VA, et al. High Intensity Interval Training Modulates Hippocampal Oxidative Stress, BDNF and Inflammatory Mediators in Rats. Physiol Behav 2018; 184: 6-11.
16- Naseri L, Khazaei MR, Khazaei M. Synergic Effect of Bee Pollen and Metformin on Proliferation and Apoptosis of Granulosa Cells: Rat Model of Polycystic Ovary Syndrome. J Food Biochem 2022; 46(3): e13635. [Persian]
17- Momeni L, Moghadam HF, Hosseini SA, Nikbakht M. Interactive Effects of Endurance Training and Selenium Consumption on the Intrinsic Apoptosis Pathway in the Liver Tissue of Cadmium-Exposed Rats. J Nutritional Sci and Dietetics 2019; 5(3/4). [Persian]
18- Wilbur S, Wohlers D, Paikoff S, Keith L, Faroon O. ATSDR Evaluation of Health Effects of Benzene and Relevance to Public Health. Toxicology and Industrial Health 2008; 24(5-6): 263-398.
19- Shafia S, Vafaei AA, RashidRy-Pour A. Effects of Moderate Treadmill Exercise and Fluoxetine on Spatial Memory and Serum BDNF Levels in an Animal Model of Post-Traumatic Stress Disorder. J Mazandaran Univ Med Sci 2019; 29(179): 1-17. [Persian]
20- Muntau H, Baudo R. Sources of Cadmium, Its Distribution and Turnover in the Freshwater Environment. IARC Sci Publ 1992(118): 133-48.
21- Michalke B, Halbach S, Nischwitz V. JEM Spotlight: Metal Speciation Related to Neurotoxicity in Humans. Journal of Environ Monit 2009; 11(5): 939-54.
22- Karim Y, Siddique AE, Hossen F, Rahman M, Mondal V, Banna HU, et al. Dose-Dependent Relationships between Chronic Arsenic Exposure and Cognitive Impairment and Serum Brain-Derived Neurotrophic Factor. Environ Int 2019; 131: 105029.
23- Flora S, Pande M, Kannan G, Mehta A. Lead Induced Oxidative Stress and Its Recovery Following Co-Administration of Melatonin or N-Acetylcysteine during Chelation with Succimer in Male Rats. Cell Mol Biol (Noisy-le-grand) 2004; 50 Online Pub: OL543-51.
24- Saral Ö, Şahin H, Saral S, Alkanat M, Akyıldız K, Topçu A, et al. Bee Pollen Increases Hippocampal Brain-Derived Neurotrophic Factor and Suppresses Neuroinflammation in Adult Rats with Chronic Immobilization Stress. Neurosci Lett. 2022; 766: 136342.
25- Khalifa SA, Elashal MH, Yosri N, Du M, Musharraf SG, Nahar L, et al. Bee Pollen: Current Status and Therapeutic Potential. Nutrients 2021; 13(6): 1876.
26- Zakaria FH, Samhani I, Mustafa MZ, Shafin N. Pathophysiology of Depression: Stingless Bee Honey Promising as an Antidepressant. Molecules 2022; 27(16): 5091.
27- Rodríguez-Pólit C, Gonzalez-Pastor R, Heredia-Moya J, Carrera-Pacheco SE, Castillo-Solis F, Vallejo-Imbaquingo R, et al. Chemical Properties and Biological Activity of Bee Pollen. Molecules 2023; 28(23): 7768.
28- Llerena F, Maynar M, Barrientos G, Palomo R, Robles M, Caballero M. Comparison of Urine Toxic Metals Concentrations in Athletes and in Sedentary Subjects Living in the Same Area of Extremadura (Spain). Eur J Appl Physiol 2012; 112(8): 3027-31
29- Maynar-Mariño M, Llerena F, Bartolomé I, Crespo C, Muñoz D, Robles M-C, et al. Effect of Long-Term Aerobic, Anaerobic and Aerobic-Anaerobic Physical Training in Seric Toxic Minerals Concentrations. J Trace Elem Med Biol 2018; 45: 136-41.
30- Maynar M, Llerena F, Bartolomé I, Alves J, Grijota F, Robles M, et al. Influence of an Exercise Until Exhaustion in Serum and Urinary Concentrations of Toxic Minerals among Professional Athletes, A Preliminary Approach. J Trace Elem Med Biol 2018; 50: 312-9.
1- Woo D, Seo Y, Jung H, Kim S, Kim N, Park S-M, et al. Locally Activating Trkb Receptor Generates Actin Waves and Specifies Axonal Fate. Cell Chem Biol 2019; 26(12): 1652-63. e4.
2- Bazzari AH, Bazzari FH. BDNF Therapeutic Mechanisms in Neuropsychiatric Disorders. Int J Mol Sci 2022; 23(15): 8417.
3- Rai NK, Ashok A, Rai A, Tripathi S, Nagar GK, Mitra K, et al. Exposure to As, Cd and Pb-Mixture Impairs Myelin and Axon Development in Rat Brain, Optic Nerve and Retina. Toxicol Appl Pharmacol 2013; 273(2): 242-58.
4- Bloom AJ. Metal Regulation of Metabolism. Current Opinion in Chemical Biology 2019; 49: 33-8.
5- Wang T, Zhu Q, Cao B, Cai Y, Wen S, Bian J, et al. Ca 2+ Transfer Via the ER-Mitochondria Tethering Complex in Neuronal Cells Contribute to Cadmium-Induced Autophagy. Cell Biol Toxicol 2022; 38(3): 469-85.
6- Treviño S, Pulido G, Fuentes E, Handal-Silva A, Moreno-Rodríguez A, Venegas B, et al. Effect of Cadmium Administration on the Antioxidant System and Neuronal Death in the Hippocampus of Rats. Synapse 2022; 76(9-10): 1-16.
7- El Shater AE, Ali RA, FR A. Effect of Selenium and Bee Pollen Against Immunotoxicity and Hepatotoxicity Induced by Cadmium in Male Albino Rats. Egyptian Academic Journal of Biological Sciences. C, Physiology and Molecular Biology 2019; 11(2): 1-19.
8- Shen J, Griffiths PT, Campbell SJ, Utinger B, Kalberer M, Paulson SE. Ascorbate Oxidation by Iron, Copper and Reactive Oxygen Species: Review, Model Development, and Derivation of Key Rate Constants. Sci Rep 2021; 11(1): 7417.
9- Lu B, Nagappan G, Guan X, Nathan PJ, Wren P. BDNF-Based Synaptic Repair as a Disease-Modifying Strategy for Neurodegenerative Diseases. Nature Reviews Neuroscience 2013; 14(6): 401-16.
10- Thakur M, Nanda V. Composition and Functionality of Bee Pollen: A Review. Trends in Food Science & Technology 2020; 98: 82-106.
11- Hou Y, Yin Y, Wu G. Dietary Essentiality of “Nutritionally Non-Essential Amino Acids” for Animals and Humans. Experimental Biology and Medicine 2015; 240(8): 997-1007.
12- Forlenza OV, Miranda AS, Guimar I, Talib LL, Diniz BS, Gattaz WF, et al. Decreased Neurotrophic Support is Associated with Cognitive Decline in Non-Demented Subjects. Journal of Alzheimer's Disease 2015; 46(2): 423-9.
13- Abdelaziz I, Elhabiby MI, Ashour AA. Toxicity of Cadmium and Protective Effect of Bee Honey, Vitamins C and B Complex. Hum Exp Toxicol 2013; 32(4): 362-70.
14- Ojo OA, Rotimi DE, Ojo AB, Ogunlakin AD, Ajiboye BO. Gallic Acid Abates Cadmium Chloride Toxicity via Alteration of Neurotransmitters and Modulation of Inflammatory Markers in Wistar Rats. Sci Rep 2023; 13(1): 1577.
15- Freitas DA, Soares BA, Nonato LF, Fonseca SR, Martins JB, Mendonça VA, et al. High Intensity Interval Training Modulates Hippocampal Oxidative Stress, BDNF and Inflammatory Mediators in Rats. Physiol Behav 2018; 184: 6-11.
16- Naseri L, Khazaei MR, Khazaei M. Synergic Effect of Bee Pollen and Metformin on Proliferation and Apoptosis of Granulosa Cells: Rat Model of Polycystic Ovary Syndrome. J Food Biochem 2022; 46(3): e13635. [Persian]
17- Momeni L, Moghadam HF, Hosseini SA, Nikbakht M. Interactive Effects of Endurance Training and Selenium Consumption on the Intrinsic Apoptosis Pathway in the Liver Tissue of Cadmium-Exposed Rats. J Nutritional Sci and Dietetics 2019; 5(3/4). [Persian]
18- Wilbur S, Wohlers D, Paikoff S, Keith L, Faroon O. ATSDR Evaluation of Health Effects of Benzene and Relevance to Public Health. Toxicology and Industrial Health 2008; 24(5-6): 263-398.
19- Shafia S, Vafaei AA, RashidRy-Pour A. Effects of Moderate Treadmill Exercise and Fluoxetine on Spatial Memory and Serum BDNF Levels in an Animal Model of Post-Traumatic Stress Disorder. J Mazandaran Univ Med Sci 2019; 29(179): 1-17. [Persian]
20- Muntau H, Baudo R. Sources of Cadmium, Its Distribution and Turnover in the Freshwater Environment. IARC Sci Publ 1992(118): 133-48.
21- Michalke B, Halbach S, Nischwitz V. JEM Spotlight: Metal Speciation Related to Neurotoxicity in Humans. Journal of Environ Monit 2009; 11(5): 939-54.
22- Karim Y, Siddique AE, Hossen F, Rahman M, Mondal V, Banna HU, et al. Dose-Dependent Relationships between Chronic Arsenic Exposure and Cognitive Impairment and Serum Brain-Derived Neurotrophic Factor. Environ Int 2019; 131: 105029.
23- Flora S, Pande M, Kannan G, Mehta A. Lead Induced Oxidative Stress and Its Recovery Following Co-Administration of Melatonin or N-Acetylcysteine during Chelation with Succimer in Male Rats. Cell Mol Biol (Noisy-le-grand) 2004; 50 Online Pub: OL543-51.
24- Saral Ö, Şahin H, Saral S, Alkanat M, Akyıldız K, Topçu A, et al. Bee Pollen Increases Hippocampal Brain-Derived Neurotrophic Factor and Suppresses Neuroinflammation in Adult Rats with Chronic Immobilization Stress. Neurosci Lett. 2022; 766: 136342.
25- Khalifa SA, Elashal MH, Yosri N, Du M, Musharraf SG, Nahar L, et al. Bee Pollen: Current Status and Therapeutic Potential. Nutrients 2021; 13(6): 1876.
26- Zakaria FH, Samhani I, Mustafa MZ, Shafin N. Pathophysiology of Depression: Stingless Bee Honey Promising as an Antidepressant. Molecules 2022; 27(16): 5091.
27- Rodríguez-Pólit C, Gonzalez-Pastor R, Heredia-Moya J, Carrera-Pacheco SE, Castillo-Solis F, Vallejo-Imbaquingo R, et al. Chemical Properties and Biological Activity of Bee Pollen. Molecules 2023; 28(23): 7768.
28- Llerena F, Maynar M, Barrientos G, Palomo R, Robles M, Caballero M. Comparison of Urine Toxic Metals Concentrations in Athletes and in Sedentary Subjects Living in the Same Area of Extremadura (Spain). Eur J Appl Physiol 2012; 112(8): 3027-31
29- Maynar-Mariño M, Llerena F, Bartolomé I, Crespo C, Muñoz D, Robles M-C, et al. Effect of Long-Term Aerobic, Anaerobic and Aerobic-Anaerobic Physical Training in Seric Toxic Minerals Concentrations. J Trace Elem Med Biol 2018; 45: 136-41.
30- Maynar M, Llerena F, Bartolomé I, Alves J, Grijota F, Robles M, et al. Influence of an Exercise Until Exhaustion in Serum and Urinary Concentrations of Toxic Minerals among Professional Athletes, A Preliminary Approach. J Trace Elem Med Biol 2018; 50: 312-9.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/7/30 | پذیرش: 1403/10/2 | انتشار: 1403/12/15
دریافت: 1403/7/30 | پذیرش: 1403/10/2 | انتشار: 1403/12/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







