دوره 33، شماره 2 - ( اردیبهشت 1404 )
جلد 33 شماره 2 صفحات 8742-8729 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Dehati M, Honari H, Sadeghi D, Aghaie S M. Investigating the Immunogenicity of the BLF1 Antigen from Burkhordria Pseudomallei with PLGA Nanoparticle in Mice. JSSU 2025; 33 (2) :8729-8742
URL: http://jssu.ssu.ac.ir/article-1-6295-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6295-fa.html
دهاتی کهنهشهری مهدی، هنری حسین، صادقی داود، آقایی سیدمجتبی. بررسی ایمنیزایی آنتی ژن BLF1 بورخوردریا سودومالئی با نانوذره PLGA در موش سوری. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (2) :8729-8742
متن کامل [PDF 1090 kb]
(239 دریافت)
| چکیده (HTML) (870 مشاهده)
ایمنسازی حیوانات آزمایشگاهی: مجوز کد اخلاق این پروژه در خصوص کار با حیوانات آزمایشگاهی طی کد اخلاق شماره 15-04-1401 . REC. IHU. IRمورخ 15/4/1401 صادر گردیده است. موشهای سوری ماده با وزن 22 الی 25 گرم به 4 گروه 5 تایی شامل،گروهای نانوذرات PLGA حاوی پروتئین و بدون پروتئین، PBS به عنوان شاهد و پروتئین همراه با ادجوانت تقسیم شدند. تزریقات درگروههای ادجوانتی و شاهد (PBS) در 4 نوبت با فاصله زمانی 14 روز بهصورت صفاقی انجام گرفت. در تزریق پروتئین همراه با ادجوانت، طی مرحله اول 20 میکروگرم آنتیژن با ادجوانت کامل فروند ترکیب شد و در مراحل بعدی هم این عمل تکرار شد. پس از هر بار خونگیری به منظور بررسی تیتر آنتیبادی، از تکنیک الایزای غیر مستقیم استفاده شد (15).
تجزیه و تحلیل آماری
جهت بررسی آماری دادههای بهدست آمده از تیتر آنتیبادی توسط الایزای غیر مستقیم، از آزمونهای ANOVA، T-tes ، Normality و با استفاده از نرمافزار SPSS version 16 انجام گرفت.
نتایج
تایید حضور قطعه ژن نوترکیب بوسیله PCR و بررسی بیان پروتئین نوترکیب: جهت تایید کلنیهای کشت داده شده، PCR انجام گرفت. الکتروفورز محصولات PCR بر روی ژل آگارز انجام شد (شکل 1).
جهت بیان پروتئین با القای IPTG، لیز سلولی با کمک بافر دناتوره انجام گرفت و نتیجه حاصل روی ژل الکتروفورز 12% بررسی شد. وزن مولکولی پروتئین BLF1 حدود 23 کیلودالتون بود (شکل 2).
پس از تخلیص پروتئین با استفاده از کروماتوگرافی میل ترکیبی نیکل (Ni-NTA) و رهاسازی توسط شیب غلظتی ایمیدازول، باند پروتئین تخلیص شده، خلوص قابلتوجهی را نمایش میدهد (شکل 3).
تایید پروتئین نوترکیب: به منظور تایید محصول پروتئین نوترکیب از روش وسترنبلات استفاده شد. در این تکنیک از آنتیبادی پلیکلونال موشی استفاده گردید (شکل 4).
بررسی اندازه نانوذرات با استفاده از پراش نور پویا (DLS): پس از آمادهسازی نمونه، نانوذرات PLGA تولید شده با پروتئین و بدون پروتئین BLF1 از نظر اندازه نانوذرات بهوسیله دستگاه DLS مورد بررسی قرار گرفتند. نتایج بدست آمده شامل، نانوذرات فاقد پروتئین دارای اندازه 217 نانومتر و 0/940= PDI و نانوذراتی حاوی پروتئین دارای اندازه 286 نانومتر و 0/852=PDI (شکل 5) بودند.
بررسی پتانسیل زتا نانوذرات PLGA حاوی پروتئین نوترکیب BLF1: این آزمون نیز از نمونههای نانوذرات PLGA که توزیع اندازه ذرات آنها در مراحل قبلی مورد بررسی قرار گرفته بود تهیه شد. نتایج نشاندهنده این بود که پتانسیل زتا نانوذرات PLGA فاقد پروتئین دارای یک پیک میانگین در محدوده 31/3- میلیولت و نانوذرات PLGA دارای پروتئین BLF1 دارای یک پیک میانگین 33/6- میلیولت بود (شکل 6).
بررسی خصوصیات ظاهری نانوذرات توسط میکروسکوپ الکترونی: پس از تولید نانوذرات PLGA، نانوذرات بر روی یک سطح آلومینیومی پخش و سپس توسط لایه نازکی از طلا پوشش داده شدند. تصاویر میکروسکوپ الکترونی کروی بودن سطح ذرات حاصل از فرایند تولید نانوذرات در شرایط بهینه را مطلوب نشان داد (شکل 7).
بررسی بازده وزنی تولید نانوذرات، راندمان احتباس و ظرفیت احتباس نانوذرات به روش غیرمستقیم: نتایج بهدستآمده از فرمولهای برسی بازده وزنی، راندمان احتباس و ظرفیت احتباس نانوذرات حاوی و فاقد پروتئین BLF1 از روش غیرمستقیم محاسبه گردید (جدول 2).
ارزیابی تیتر IgG در سرم موشهای ایمن شده: به منظور ارزیابی آنتیبادی تولید شده و محاسبه میزان آن در هر مرحله تزریق از روش الایزای غیرمستقیم استفاده شد. نمودار میانگین تیتر آنتیبادی در هر مرحله شامل موشهایی که آنتیژن BLF1 همراه با نانوذره را به صورت تزریقی داخل صفاقی دریافت کردند (شکل 8) و موش¬هایی که آنتی¬ژن BLF1 همراه با ادجوانت را بهصورت تزریقی داخل صفاقی دریافت نمودند (شکل 9) میباشد. آنالیز آماری حاصل از بررسی تیتر آنتیبادی تولیدی توسط الایزای غیرمستقیم در قالب گروههای تست و شاهد به کمک نرمافزارversion 16 SPSS صورت پذیرفت. به جهت انجام آنالیز آماری گروههای مختلف شماره-گذاری شدند (جدول 3). مقایسه بین گروههای مختلف توسط آزمون دانکن (جدول 4) در سطح خطای پنج درصد (P<0.05) صورت پذیرفت. آنالیز واریانس آنوا یک طرفه آزمون دانکن در بررسی تیتر IgG سرم خونی، اختلاف بین گروهها را نشان می دهد (جدول شماره3). گروههای موجود در ستونها در سطح خطای پنج درصد دارای اختلاف معنیدار هستند (0/05>P).
نتایج چالش موشهای ایمنشده توسط پروتئین BLF1: 60 روز پس از آخرین تجویز آنتیژن جهت ایمنیزایی و پس از تائید تیتر آنتیبادی در سرم موشهای ایمنشده علیه سم BLF1 توسط روش الایزا، موشهای تست و شاهد در گروههای 4 تایی دستهبندی و به هر گروه از موشهای تست و شاهد غلظت 50 میکروگرم از سم بهصورت تزریقی تجویز گردید. نتایج به این صورت بود که موشهای ایمنشده با نانوذره حامل پروتئین، حفاظت 50 % و موشهای ایمنشده با پروتئین همراه ادجوانت حفاظت قابل قبول 75 % را ایجاد میکنند (شکل 10).

شکل 1: الکتروفورز ژل اگارز 1 درصد تکثیر قطعه 636 جفت بازی ژن Blf1 توسط PCR
ردیف 1: نشانگر مولکولی DNA. ردیف 2: قطعه DNA

شکل 2: نتیجه بیان پروتئین بر روی ژل SDS-PAGE 12%، ستون 1- نمونه القاء شده توسط IPTG 1 میلی مولار، ستون 2 و 3- نمونه القاء نشده (کنترل منفی)، ستون 4- نشانگر مولکولی پروتئین سینا کلون، ستون 5-نمونه تخلیص شده
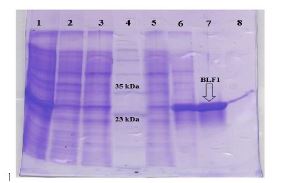
شکل 3: تصویر الکتروفورز حاصل ازتخلیص پروتئین BLF1 از ستون نیکل. با استفاده از ژل 12% SDS-PAGE
ستون 1: flow قبل از ستون، ستون 2: flow ستون، ستون 3: بافر C، ستون 4: مارکر شماره 310003 SM، ستون 5: بافر D، ستون 6: بافر E، ستون 7: بافر E250، ستون 8: بافر MES
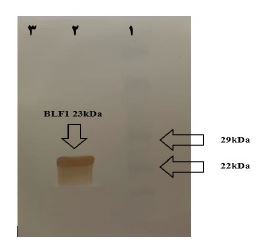
شکل 4: الگوی آنالیز وسترنبلات تائید آنتیژن BLF1. ردیف 1: نشانگر مولکولی پروتئین، ردیف 2: باند متعلق به آنتیژن BLF1 تخلیص شده از روی ژل، باند رنگ گرفته در ردیف 2 متناظر با باند محدوده 23 کیلودالتون نشانگر مولکولی پروتئین میباشد، ردیف 3: BSA به عنوان شاهد منفی.
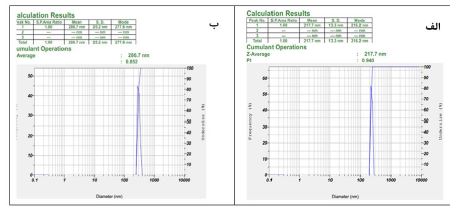
شکل 5: الف. نمودار بررسی بازه توزیع اندازه نانوذرات PLGA فاقد پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS،
ب. نمودار بررسی بازه توزیع اندازه نانوذرات PLGA حاوی پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS.

شکل 6: الف. نمودار بررسی پتانسیل زتای نانوذرات PLGA فاقد پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS
ب. نمودار بررسی پتانسیل زتای نانوذرات PLGA دارای پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS.

شکل 7: تصویر میکروسکوپ الکترونی FESEM از نانوذرات PLGA حاوی BLF1 (نانوذرات خشک شده بر روی سطح شیشهای، روی گرید قرار گرفته و پس از پوشش دهی با طلا، تصویربرداری شد)
جدول 2: نتایج فرمولهای بررسی بازده وزنی، راندمان احتباس و ظرفیت احتباس


شکل 8: تیترآنتیبادی تولید شده علیه BLF1 کپسوله شده با PLGA تزریقی بهصورت داخل صفاقی در سرم موشهای ایمن و مقایسه آن با شاهد. محور عمودی: جذب نوری در طول موج 495 و محور افقی سریال رقت را نشان میدهد.

شکل 9: تیترآنتیبادی تولید شده علیه BLF1 همراه با ادجوانت تزریقی بصورتداخل صفاقی در سرم موشهای ایمن و مقایسه آن با شاهد. محور عمودی جذب نوری در طول موج 495 و محور افقی سریال رقت را نشان میدهد.
جدول 3: گروه های مختلف جهت بررسی آماری.

جدول 4: مقایسه بین گروههای مختلف توسط آزمون دانکن بر روی تیتر IgG در سرم موشهای ایمنشده در سطح خطای پنج درصد.

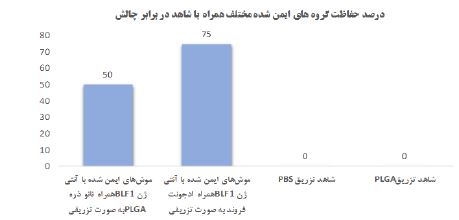
شکل 10: حفاظت گروههای ایمن شده مختلف همراه با شاهد در برابر چالش
بحث
بورخورلدریا یکی از خطرناکترین عواملی میباشد که در حال حاظر هیچ واکسنی برای آن تولید نشده است (22). میزان مرگ و میر ناشی از بیماری میلوئیدوزیس از اهمیت بسیاری برخوردار است، بهطوری که به یک بیماری واگیر در حال ظهور تبدیل شده است (23,24). محققان بر این باور هستند که یک میزبان جونده به عنوان یک عامل مشترک بین انسان¬ها و حیوانات عمل میکند (25). تنوع بالینی بسیار زیاد میلوئیدوز، مشکل تشخیص آزمایشگاهی و درمان، آن را به یک بیماری نگران کننده در سراسر جهان تبدیل کرده است (26). عفونت ایجاد شده میتواند از طریق تلقیح پوستی، استنشاقی یا بلع بورخورلدریا موجود در آب آشامیدنی آلوده یا به ندرت از فرد به فرد منتقل شود (27). علی¬رغم افزایش شناخت وسیع بورخوردریا سودومالئ، تقریبا تمام موارد ابتلا مربوط به اقامت یا سفر به مناطق بومی بیماری میباشد (28). برای شناسایی یک کاندید مناسب واکسن، مهندسی بیشتر بر روی توکسین BLF1 مورد نیاز میباشد (29). مهار کنندههای سنتز پروتئین (از جمله مهار کنندههای eIF4A) را میتوان به عنوان عوامل ضد سرطان استفاده نمود (7). پروتئین BLF1 (به عنوان یک مهار کننده قوی (eIF4A، ممکن است به عنوان یک عامل ضد سرطان قوی مورد استفاده قرار گیرد. ژن blf1 در بورخولدریا سودومالئی در بیماری¬زایی نقش دارد. با کلون و بیان ژن blf1 و بررسی روشهای مختلف ارائه دارو به علاوه ارزیابی تیترآنتیبادی پروتئین BLF1 میتوان کاندید واکسنی علیه این باکتری تولید کرد و همچنین با توجه به مکانیسم، BLF1 میتواند کاندیدی برای از بین بردن سلولهای سرطانی باشد (2). در این تحقیق با توجه به مزایای سیستمهای نانوذرات در کاهش خطرات احتمالی پروتئین BLF1 و همچنین احتمال افزایش ایمنیزایی آن به عنوان سیستمهای تحویل نوین واکسنهای پروتئینی، از نانوذرات بر پایه پلیمرهای طبیعی و سنتزی استفاده شد (30). نانوذرات PLGA تا حدی از طریق پینوسیتوز فاز مایع و همچنین از طریق اندوسیتوز با واسطه کلاترین در سلولها وارد میشوند (14). استفاده از PLGA برای تحویل داروها و کاربردهای زیستپزشکی با کمترین سمیت سیستمیک همراه است (30). درصد محصورسازی دارو در فرمولاسیون حاضر برای آنتیژن BLF1 در حد 75% بوده بود. با توجه به اینکه اندازه ذرات کوچک میباشند و کاهش اندازه ذرهای و افزایش نسبت سطح به حجم منجر به کاهش بارگذاری دارو می¬گردد، بنابراین درصد محصورسازی بالا است و میتواند میزان قابلتوجهی از دارو را با استفاده از مقدار کمتری از ماتریکس پلیمری به بافت هدف بر¬ساند. در تحقیق انجام شده توسط هالایکا و همکاران، کلورپرومازین هیدروکلراید (CPZ-HCl) و پرفنازین (PPH) در نانوذرات PLGA با روش امولسیون دوگانه تبخیر حلال بارگذاری شدند. میانگین اندازه نانوذرات PLGA حاوی CPZ-HCl و PPH به ترتیب برابر 347 و 325 نانومتر بود. در تحقیق آقای هالایکا از پلیوینیلالکل 0/3 تا 0/07 استفاده شده است (31). در این مطالعه از پلیوینیلالکل 2/5% استفاده شد که میتوان چنین نتیجه گرفت که افزایش پلیوینیلالکل در مطالعه حاضر خود یکی از عوامل کاهش سایز نانوذرات PLGA میباشد. در مطالعه دیگری توسط نظریان و همکاران، یک پروتئین نوترکیب کایمر با استفاده از روش امولسیون دوگانه تبخیر حلال در نانوذرات PLGA بارگذاری شد که اندازه نانوذرات تولید شده در این مطالعه در محدوده 170 نانومتر گزارش گردید (32). مقایسه نتایج این مطالعه و مطالعات دیگر نشان¬دهنده اندازه مناسب نانوذرات تولید شده میباشد با توجه به رهایش نانوذره PLGA، در این تحقیق تعداد تزریقات برای ایجاد ایمنیزایی به دو بار کاهش پیدا کرد. در مجموع بررسی شکل و اندازه نانوذرات هر سه پروتئین توسط میکروسکوپ الکترونی SEM نشان دهنده این واقعیت بود که شکل نانوذرات قابل قبول بود. همچنین نتایج بررسی اندازه نانوذرات توسط SEM تائیدکننده نتایج بهدست آمده از توزیع اندازه دستگاه DLS بود. پتانسیل نانوذرات PLGA نیز منفی و برای نانوذرات حاوی و فاقد پروتئین در محدوده 31/3- و 33/6- بود. در مقالات مشابه نیز نانوذرات PLGA تولید شده با روش امولسیون دوگانه تبخیر حلال، دارای مقدار منفی بود. برای مثال سمیعی و همکاران با این روش، نانوذرات PLGA حاوی آنتیژن را سنتز نمودند که پتانسیل زتا این نانوذرات برابر 21/6- میلیولت بود (20). در مجموع با مشاهده تغییرات پتانسیل زتا در نانوذرات می¬توان استنباط نمود که تغییرات قابل ملاحظه¬ای در میزان پتانسیل زتا بین ذرات فاقد آنتیژن و ذرات حاوی آنتیژن رخ نداده است و در هر دو حالت، نانوذرات در محدوده پایداری قرار دارند که مانع از اتصال ذرات و تشکیل ذرات به هم چسبیده می¬شود. البته این نکته نیز حائز اهمیت است که پتانسیل زتا نانوذرات PLGA منفی بود و این بار سطحی نانوذرات، در حذف آنها از بدن موثر است.
نتیجهگیری
بر اساس نتایج مطالعات انجام شده، استفاده از واکسن برای پیشگیری از بیماری میلوئیدوزیس بهترین روش مبارزه با این بیماری است. نتایج حاصل از این پژوهش نشان داد که فرمولاسیون نانو واکسن حاصلشده با تجویز داخل صفاقی، از توانایی خوبی در تحریک سیستم ایمنی حیوان آزمایشگاهی برخوردار است. در نتیجه میتوان فرمولاسیون نانویی حاصل را بهعنوان حاملی مناسب جهت تولید واکسن پایدار، ایمن، زیستسازگار و بدون اثرات سمی و جانبی نسبت به ادجوانتهای معمول، جهت بررسیهای بیشتر پیشنهاد نمود. با توجه به عیار آنتیبادی تولید شده میتوان نتیجه گرفت که با افزایش تیتر آنتیبادی ضریب ایمنی افزایش مییابد. باتوجه بهنتایج بهدست آمده، پروتئین نوترکیب BLF1 میتواند بهعنوان کاندیدای واکسن علیه باکتری بورخولدریا سودومالئی مطرح شود.
سپاسگزاری
نویسندگان از معاونت پژوهش دانشگاه جامع امام حسین(ع) تهران تشکر میکنند. مقاله حاضر بخشی از نتایج حاصل از پایان نامه کارشناسی ارشد گرایش سلولی مولکولی در دانشکده علوم پایه دانشگاه جامع امام حسین(ع) تهران است.
حامی مالی: این مطالعه با حمایت مالی دانشگاه جامع امام حسین(ع) تهران انجام شده است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه جامع امام حسین(ع) تایید شده است (کد اخلاق به شماره : 15-04-1401 . REC. IHU. .(IR
مشارکت نویسندگان
مقاله، حاصل پایاننامه بوده که دکتر حسین هنری در ارائه ایده، و در طراحی تحقیق، و آقایان دکتر داود صادقی، سید مجتبی آقایی بعنوان همکار و مهدی دهاتی بهعنوان دانشجو در انجام کار آزمایشگاهی و در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
متن کامل: (300 مشاهده)
مقدمه
باکتری بورخولدریا سودومالئی یک باسیل گرم منفی بیماریزا است که در سراسر جهان در خاکهای مرطوب، گرمسیری و نیمه گرمسیری یافت میشود (1). این باکتری میتواند در شرایط نامساعد محیطی مانند pH پایین، دمای بالا و کمبود مواد غذایی، زنده بماند (2،3). باکتری بورخولدریا سودومالئی باعث ایجاد بیماری عفونی در انسان، حیوان و بعضی گیاهان میشود (4). تماس با عامل عفونی در انسان میتواند به صورت ذاتالریه شدید، سپتمیسمی و عفونتهای پوستی ظاهر شود (1). این باکتری در سال 2009، جز عوامل رده B بیولوژیک قرار گرفته است (5). دوره نهفتگی میلوئیدوزیس در حدود 3-2 روز تا چندین ماه و یا سال متغیر است (6). توالییابی ژنوم باکتری بورخولدریا سودومالئی در سال 2004 کامل گردید. در سال 2011 گروهی از محققان بینالمللی توسط گروه ویلسون Wilsonو گروه رایس Rice در دانشگاه شفلید، اولین فاکتور سیتوتوکسین کشنده در باکتری بورخولدریا سودومالئی که باعث غیر فعالسازی سنتز پروتئین در میزبان میشود را شناسایی کردند (7). انتقال ارگانیسم از راههای مختلفی می¬تواند انجام شود. منبع عفونت انسانی از راه خوراکی، استنشاقی و یا آلودگی از طریق خراش پوستی به بدن بیمار منتقل می¬شود (8). تشخیص زودهنگام و شروع درمان بسیار مهم است. در مکانهایی که امکانات پیشرفته برای تشخیص و درمان وجود دارد، مرگ و میر حدود 10% است، ولی در مناطق محروم، بالاتر از40% میباشد (9). آنالیز پروتئوم باکتری بورخولدریا سودومالئی مشخص نمود که 14 پروتئین با عملکرد نامشخص در باکتری بیان میشوند (10). در سایر مطالعات، بررسی برخی از این پروتئینهای ناشناخته با استفاده از کریستالوگرافی اشعه ایکس انجام گردید که سبب تعیین ساختار پروتئین BPSL1545 شد و این پروتئین، اولین سم باکتری بورخولدریا سودومالئی میباشد که آن را به BLF1 تغییر نام دادند (7). پروتئین BLF1 بهصورت اختصاصی دآمیناسیونGln339 از eIF4A.Eukaryotic initiation factor 4A را به گلوتامیک اسید انجام میدهد (11). این تغییر فعالیت هلیکازی مورد نیاز برای باز کردن رشته دوتایی mRNA را برای شروع ترجمه، غیر فعال میکند، اما فعالیت ATPase را از eIF4A تحت تاثیر قرار نمیدهد (12). PLGA یا (پلی لاکتیک-کو-گلیکولیک اسید) یکی از توسعه یافتهترین پلیمرهای زیست تخریبپذیر است (13). نانوذرات پلیمری زیست تخریبپذیر همانند نانوذرات PLGA به دلیل ویژگی-هایی که در زمینه دارورسانی و نانو واکسنها دارند، بر انواع دیگر حاملها ترجیح داده میشوند. این نانوذرات، ویژگی رهاسازی کنترلشده، ممتد و اندازهای در ابعاد سلولی داشته و با بافتها و سلولها، زیستسازگاری دارند. علاوه بر این، نانوداروها در خون پایدار و غیرسمی بوده و از فاقد مضراتی چون لخته کردن خون، تحریک غیرطبیعی سیستم ایمنی، التهابزایی و فعالکردن نوتروفیلها هستند و برای حمل انواع مولکولهای دارویی، پروتئینی، پپتیدی و نوکلوئیک اسیدی مناسب هستند سیستمهای نوین دارورسانی در واقع حاملهای دارویی جدیدی هستند که جهت کاهش دوز مصرفی، کاهش عوارض جانبی و افزایش کارایی داروها بهکار میروند. با توجه به فقدان واکسن برای این بیماری، با کلون و بیان ژن BLF1 و بررسی روش های مختلف ارائه دارو و مشاهده تیتر آنتیبادی میتوان کاندید واکسنی علیه این باکتری تولید کرد (14,11). هدف از این تحقیق استفاده از نانوذرات پلیمیری PLGA جهت بارگذاری آنتی ژن BLF1 و بررسی ایمنیزایی وحفاظت آن در مقایسه با نمونه فاقد نانوذره است.
روش بررسی
بررسی بیان پروتئین نوترکیب: وکتور PET28 حاوی ژن BLF1 از مرکز زیستشناسی دانشگاه جامع امام حسین (ع) تهیه گردید (15). وکتورهای بیانی PET28(+) دارای ژن نوترکیب BLF1 با روش شوک حرارتی به سلولهای مستعد E.coli Bl21DE3 تراریخت شدند (16).کلنی¬های نوترکیب با غربالگری بهوسیله کانامایسین جدا گردید و با PCR مورد تایید قرار گرفت (16). برای این منظور مخلوط واکنش به شکلی که در (جدول 1) ذکر شده تهیه گردید. برای القاء بیان پروتئین نوترکیب BLF1 از ماده IPTG با غلظت 1 میلی-مولار استفاده و به مدت 4 ساعت در دمای 37 درجه سانتیگراد انکوبه شد (15,17). نمونه¬های قبل و بعد از القای IPTG تحت شرایط دناتوره، الکتروفورز شدند (18). بیان پروتئین روی ژل SDS-PAGE 12% مورد بررسی قرار گرفت (15). برای مشاهده باندهای پروتئینی، از روش رنگ¬آمیزی با کوماسی بلو استفاده گردید (18).
جدول 1: ترکیب واکنش PCR

تایید و تخلیص پروتئین نوترکیب: برای تایید پروتینهای نوترکیب، از روش وسترن بلات استفاده شد (18). پروتئین حاصل تحت شرایط دناتوره با استفاده از ستون کروماتوگرافی میل ترکیبی (NI-NTA) جداسازی شد. پس از تخلیص پروتئین مدنظر بر روی ژل 12% الکتروفورز شد (19,20). غلظت پروتئین نوترکیب با تکنیک برادفورد و با استفاده از BSA (آلبومین سرم گاوی) به عنوان استاندارد انجام شد (19).
تهیه نانوذرات پلیمری PLGA حاوی پروتئین نوترکیب: برای تهیه نانوکپسولها از روش امولسیون دوگانه تبخیر حلال استفاده شد. این روش بر خلاف روش امولسیون ساده یا یگانه که برای داروهای نامحلول در آب مناسب است، روشی مبتنی بر امولسیون آب-روغن-آب (Water/Oil/Water w/o/w) میباشد و یکی از مناسبترین راهها برای بارگذاری¬ داروهای آبدوست نظیر پپتیدها، پروتئینها و واکسنها است. در این روش، محلول بافری دارو به فاز آلی شامل پلیمر اضافه و تشکیل امولسیون اولیه (w/o) را میدهد. جهت بررسی اندازه نانوذرات تولید شده و بررسی پتانسیل زتا (Zeta Potential) از دستگاه DLS مدل Malvern ساخت کشور انگلستان متعلق به دانشکده داروسازی دانشگاه تهران استفاده شد. جهت بررسی خصوصیات ظاهری نانوذرات از میکروسکوپ الکترونی روبشی گسیل میدانی (FESEM) مدل Quanta FEI 200 ساخت شرکت FEI استفاده شد.
بررسی بازده وزنی تولید نانوذرات، راندمان احتباس و ظرفیت احتباس نانوذرات به روش غیر مستقیم
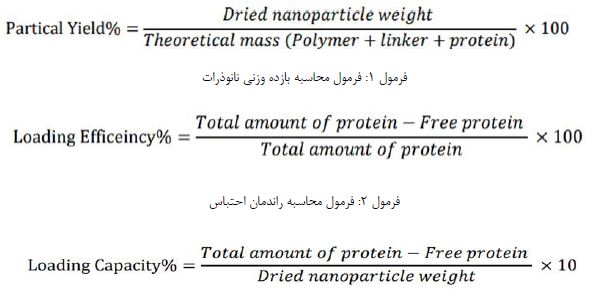
به منظور بررسی بازده وزنی تولید نانوذرات پس از تهیه نانوذرات، از فرمول 1 استفاده شد (21).
همچنین در این تحقیق برای تعیین مقدار پروتئین محبوس شده در نانوذرات از روش غیر مستقیم استفاده شد؛ و سپس با استفاده از دو فرمول 2 و 3 راندمان احتباس (LE %) و ظرفیت احتباس (LC %) نانوذرات محاسبه شد. این¬کار هم برای نانوذرات حاوی BSA و هم نانوذرات حاوی پروتئین نوترکیب انجام پذیرفت.
باکتری بورخولدریا سودومالئی یک باسیل گرم منفی بیماریزا است که در سراسر جهان در خاکهای مرطوب، گرمسیری و نیمه گرمسیری یافت میشود (1). این باکتری میتواند در شرایط نامساعد محیطی مانند pH پایین، دمای بالا و کمبود مواد غذایی، زنده بماند (2،3). باکتری بورخولدریا سودومالئی باعث ایجاد بیماری عفونی در انسان، حیوان و بعضی گیاهان میشود (4). تماس با عامل عفونی در انسان میتواند به صورت ذاتالریه شدید، سپتمیسمی و عفونتهای پوستی ظاهر شود (1). این باکتری در سال 2009، جز عوامل رده B بیولوژیک قرار گرفته است (5). دوره نهفتگی میلوئیدوزیس در حدود 3-2 روز تا چندین ماه و یا سال متغیر است (6). توالییابی ژنوم باکتری بورخولدریا سودومالئی در سال 2004 کامل گردید. در سال 2011 گروهی از محققان بینالمللی توسط گروه ویلسون Wilsonو گروه رایس Rice در دانشگاه شفلید، اولین فاکتور سیتوتوکسین کشنده در باکتری بورخولدریا سودومالئی که باعث غیر فعالسازی سنتز پروتئین در میزبان میشود را شناسایی کردند (7). انتقال ارگانیسم از راههای مختلفی می¬تواند انجام شود. منبع عفونت انسانی از راه خوراکی، استنشاقی و یا آلودگی از طریق خراش پوستی به بدن بیمار منتقل می¬شود (8). تشخیص زودهنگام و شروع درمان بسیار مهم است. در مکانهایی که امکانات پیشرفته برای تشخیص و درمان وجود دارد، مرگ و میر حدود 10% است، ولی در مناطق محروم، بالاتر از40% میباشد (9). آنالیز پروتئوم باکتری بورخولدریا سودومالئی مشخص نمود که 14 پروتئین با عملکرد نامشخص در باکتری بیان میشوند (10). در سایر مطالعات، بررسی برخی از این پروتئینهای ناشناخته با استفاده از کریستالوگرافی اشعه ایکس انجام گردید که سبب تعیین ساختار پروتئین BPSL1545 شد و این پروتئین، اولین سم باکتری بورخولدریا سودومالئی میباشد که آن را به BLF1 تغییر نام دادند (7). پروتئین BLF1 بهصورت اختصاصی دآمیناسیونGln339 از eIF4A.Eukaryotic initiation factor 4A را به گلوتامیک اسید انجام میدهد (11). این تغییر فعالیت هلیکازی مورد نیاز برای باز کردن رشته دوتایی mRNA را برای شروع ترجمه، غیر فعال میکند، اما فعالیت ATPase را از eIF4A تحت تاثیر قرار نمیدهد (12). PLGA یا (پلی لاکتیک-کو-گلیکولیک اسید) یکی از توسعه یافتهترین پلیمرهای زیست تخریبپذیر است (13). نانوذرات پلیمری زیست تخریبپذیر همانند نانوذرات PLGA به دلیل ویژگی-هایی که در زمینه دارورسانی و نانو واکسنها دارند، بر انواع دیگر حاملها ترجیح داده میشوند. این نانوذرات، ویژگی رهاسازی کنترلشده، ممتد و اندازهای در ابعاد سلولی داشته و با بافتها و سلولها، زیستسازگاری دارند. علاوه بر این، نانوداروها در خون پایدار و غیرسمی بوده و از فاقد مضراتی چون لخته کردن خون، تحریک غیرطبیعی سیستم ایمنی، التهابزایی و فعالکردن نوتروفیلها هستند و برای حمل انواع مولکولهای دارویی، پروتئینی، پپتیدی و نوکلوئیک اسیدی مناسب هستند سیستمهای نوین دارورسانی در واقع حاملهای دارویی جدیدی هستند که جهت کاهش دوز مصرفی، کاهش عوارض جانبی و افزایش کارایی داروها بهکار میروند. با توجه به فقدان واکسن برای این بیماری، با کلون و بیان ژن BLF1 و بررسی روش های مختلف ارائه دارو و مشاهده تیتر آنتیبادی میتوان کاندید واکسنی علیه این باکتری تولید کرد (14,11). هدف از این تحقیق استفاده از نانوذرات پلیمیری PLGA جهت بارگذاری آنتی ژن BLF1 و بررسی ایمنیزایی وحفاظت آن در مقایسه با نمونه فاقد نانوذره است.
روش بررسی
بررسی بیان پروتئین نوترکیب: وکتور PET28 حاوی ژن BLF1 از مرکز زیستشناسی دانشگاه جامع امام حسین (ع) تهیه گردید (15). وکتورهای بیانی PET28(+) دارای ژن نوترکیب BLF1 با روش شوک حرارتی به سلولهای مستعد E.coli Bl21DE3 تراریخت شدند (16).کلنی¬های نوترکیب با غربالگری بهوسیله کانامایسین جدا گردید و با PCR مورد تایید قرار گرفت (16). برای این منظور مخلوط واکنش به شکلی که در (جدول 1) ذکر شده تهیه گردید. برای القاء بیان پروتئین نوترکیب BLF1 از ماده IPTG با غلظت 1 میلی-مولار استفاده و به مدت 4 ساعت در دمای 37 درجه سانتیگراد انکوبه شد (15,17). نمونه¬های قبل و بعد از القای IPTG تحت شرایط دناتوره، الکتروفورز شدند (18). بیان پروتئین روی ژل SDS-PAGE 12% مورد بررسی قرار گرفت (15). برای مشاهده باندهای پروتئینی، از روش رنگ¬آمیزی با کوماسی بلو استفاده گردید (18).
جدول 1: ترکیب واکنش PCR

تایید و تخلیص پروتئین نوترکیب: برای تایید پروتینهای نوترکیب، از روش وسترن بلات استفاده شد (18). پروتئین حاصل تحت شرایط دناتوره با استفاده از ستون کروماتوگرافی میل ترکیبی (NI-NTA) جداسازی شد. پس از تخلیص پروتئین مدنظر بر روی ژل 12% الکتروفورز شد (19,20). غلظت پروتئین نوترکیب با تکنیک برادفورد و با استفاده از BSA (آلبومین سرم گاوی) به عنوان استاندارد انجام شد (19).
تهیه نانوذرات پلیمری PLGA حاوی پروتئین نوترکیب: برای تهیه نانوکپسولها از روش امولسیون دوگانه تبخیر حلال استفاده شد. این روش بر خلاف روش امولسیون ساده یا یگانه که برای داروهای نامحلول در آب مناسب است، روشی مبتنی بر امولسیون آب-روغن-آب (Water/Oil/Water w/o/w) میباشد و یکی از مناسبترین راهها برای بارگذاری¬ داروهای آبدوست نظیر پپتیدها، پروتئینها و واکسنها است. در این روش، محلول بافری دارو به فاز آلی شامل پلیمر اضافه و تشکیل امولسیون اولیه (w/o) را میدهد. جهت بررسی اندازه نانوذرات تولید شده و بررسی پتانسیل زتا (Zeta Potential) از دستگاه DLS مدل Malvern ساخت کشور انگلستان متعلق به دانشکده داروسازی دانشگاه تهران استفاده شد. جهت بررسی خصوصیات ظاهری نانوذرات از میکروسکوپ الکترونی روبشی گسیل میدانی (FESEM) مدل Quanta FEI 200 ساخت شرکت FEI استفاده شد.
بررسی بازده وزنی تولید نانوذرات، راندمان احتباس و ظرفیت احتباس نانوذرات به روش غیر مستقیم
به منظور بررسی بازده وزنی تولید نانوذرات پس از تهیه نانوذرات، از فرمول 1 استفاده شد (21).
همچنین در این تحقیق برای تعیین مقدار پروتئین محبوس شده در نانوذرات از روش غیر مستقیم استفاده شد؛ و سپس با استفاده از دو فرمول 2 و 3 راندمان احتباس (LE %) و ظرفیت احتباس (LC %) نانوذرات محاسبه شد. این¬کار هم برای نانوذرات حاوی BSA و هم نانوذرات حاوی پروتئین نوترکیب انجام پذیرفت.

فرمول 3: فرمول محاسبه ظرفیت احتباس
ایمنسازی حیوانات آزمایشگاهی: مجوز کد اخلاق این پروژه در خصوص کار با حیوانات آزمایشگاهی طی کد اخلاق شماره 15-04-1401 . REC. IHU. IRمورخ 15/4/1401 صادر گردیده است. موشهای سوری ماده با وزن 22 الی 25 گرم به 4 گروه 5 تایی شامل،گروهای نانوذرات PLGA حاوی پروتئین و بدون پروتئین، PBS به عنوان شاهد و پروتئین همراه با ادجوانت تقسیم شدند. تزریقات درگروههای ادجوانتی و شاهد (PBS) در 4 نوبت با فاصله زمانی 14 روز بهصورت صفاقی انجام گرفت. در تزریق پروتئین همراه با ادجوانت، طی مرحله اول 20 میکروگرم آنتیژن با ادجوانت کامل فروند ترکیب شد و در مراحل بعدی هم این عمل تکرار شد. پس از هر بار خونگیری به منظور بررسی تیتر آنتیبادی، از تکنیک الایزای غیر مستقیم استفاده شد (15).
تجزیه و تحلیل آماری
جهت بررسی آماری دادههای بهدست آمده از تیتر آنتیبادی توسط الایزای غیر مستقیم، از آزمونهای ANOVA، T-tes ، Normality و با استفاده از نرمافزار SPSS version 16 انجام گرفت.
نتایج
تایید حضور قطعه ژن نوترکیب بوسیله PCR و بررسی بیان پروتئین نوترکیب: جهت تایید کلنیهای کشت داده شده، PCR انجام گرفت. الکتروفورز محصولات PCR بر روی ژل آگارز انجام شد (شکل 1).
جهت بیان پروتئین با القای IPTG، لیز سلولی با کمک بافر دناتوره انجام گرفت و نتیجه حاصل روی ژل الکتروفورز 12% بررسی شد. وزن مولکولی پروتئین BLF1 حدود 23 کیلودالتون بود (شکل 2).
پس از تخلیص پروتئین با استفاده از کروماتوگرافی میل ترکیبی نیکل (Ni-NTA) و رهاسازی توسط شیب غلظتی ایمیدازول، باند پروتئین تخلیص شده، خلوص قابلتوجهی را نمایش میدهد (شکل 3).
تایید پروتئین نوترکیب: به منظور تایید محصول پروتئین نوترکیب از روش وسترنبلات استفاده شد. در این تکنیک از آنتیبادی پلیکلونال موشی استفاده گردید (شکل 4).
بررسی اندازه نانوذرات با استفاده از پراش نور پویا (DLS): پس از آمادهسازی نمونه، نانوذرات PLGA تولید شده با پروتئین و بدون پروتئین BLF1 از نظر اندازه نانوذرات بهوسیله دستگاه DLS مورد بررسی قرار گرفتند. نتایج بدست آمده شامل، نانوذرات فاقد پروتئین دارای اندازه 217 نانومتر و 0/940= PDI و نانوذراتی حاوی پروتئین دارای اندازه 286 نانومتر و 0/852=PDI (شکل 5) بودند.
بررسی پتانسیل زتا نانوذرات PLGA حاوی پروتئین نوترکیب BLF1: این آزمون نیز از نمونههای نانوذرات PLGA که توزیع اندازه ذرات آنها در مراحل قبلی مورد بررسی قرار گرفته بود تهیه شد. نتایج نشاندهنده این بود که پتانسیل زتا نانوذرات PLGA فاقد پروتئین دارای یک پیک میانگین در محدوده 31/3- میلیولت و نانوذرات PLGA دارای پروتئین BLF1 دارای یک پیک میانگین 33/6- میلیولت بود (شکل 6).
بررسی خصوصیات ظاهری نانوذرات توسط میکروسکوپ الکترونی: پس از تولید نانوذرات PLGA، نانوذرات بر روی یک سطح آلومینیومی پخش و سپس توسط لایه نازکی از طلا پوشش داده شدند. تصاویر میکروسکوپ الکترونی کروی بودن سطح ذرات حاصل از فرایند تولید نانوذرات در شرایط بهینه را مطلوب نشان داد (شکل 7).
بررسی بازده وزنی تولید نانوذرات، راندمان احتباس و ظرفیت احتباس نانوذرات به روش غیرمستقیم: نتایج بهدستآمده از فرمولهای برسی بازده وزنی، راندمان احتباس و ظرفیت احتباس نانوذرات حاوی و فاقد پروتئین BLF1 از روش غیرمستقیم محاسبه گردید (جدول 2).
ارزیابی تیتر IgG در سرم موشهای ایمن شده: به منظور ارزیابی آنتیبادی تولید شده و محاسبه میزان آن در هر مرحله تزریق از روش الایزای غیرمستقیم استفاده شد. نمودار میانگین تیتر آنتیبادی در هر مرحله شامل موشهایی که آنتیژن BLF1 همراه با نانوذره را به صورت تزریقی داخل صفاقی دریافت کردند (شکل 8) و موش¬هایی که آنتی¬ژن BLF1 همراه با ادجوانت را بهصورت تزریقی داخل صفاقی دریافت نمودند (شکل 9) میباشد. آنالیز آماری حاصل از بررسی تیتر آنتیبادی تولیدی توسط الایزای غیرمستقیم در قالب گروههای تست و شاهد به کمک نرمافزارversion 16 SPSS صورت پذیرفت. به جهت انجام آنالیز آماری گروههای مختلف شماره-گذاری شدند (جدول 3). مقایسه بین گروههای مختلف توسط آزمون دانکن (جدول 4) در سطح خطای پنج درصد (P<0.05) صورت پذیرفت. آنالیز واریانس آنوا یک طرفه آزمون دانکن در بررسی تیتر IgG سرم خونی، اختلاف بین گروهها را نشان می دهد (جدول شماره3). گروههای موجود در ستونها در سطح خطای پنج درصد دارای اختلاف معنیدار هستند (0/05>P).
نتایج چالش موشهای ایمنشده توسط پروتئین BLF1: 60 روز پس از آخرین تجویز آنتیژن جهت ایمنیزایی و پس از تائید تیتر آنتیبادی در سرم موشهای ایمنشده علیه سم BLF1 توسط روش الایزا، موشهای تست و شاهد در گروههای 4 تایی دستهبندی و به هر گروه از موشهای تست و شاهد غلظت 50 میکروگرم از سم بهصورت تزریقی تجویز گردید. نتایج به این صورت بود که موشهای ایمنشده با نانوذره حامل پروتئین، حفاظت 50 % و موشهای ایمنشده با پروتئین همراه ادجوانت حفاظت قابل قبول 75 % را ایجاد میکنند (شکل 10).

شکل 1: الکتروفورز ژل اگارز 1 درصد تکثیر قطعه 636 جفت بازی ژن Blf1 توسط PCR
ردیف 1: نشانگر مولکولی DNA. ردیف 2: قطعه DNA

شکل 2: نتیجه بیان پروتئین بر روی ژل SDS-PAGE 12%، ستون 1- نمونه القاء شده توسط IPTG 1 میلی مولار، ستون 2 و 3- نمونه القاء نشده (کنترل منفی)، ستون 4- نشانگر مولکولی پروتئین سینا کلون، ستون 5-نمونه تخلیص شده

شکل 3: تصویر الکتروفورز حاصل ازتخلیص پروتئین BLF1 از ستون نیکل. با استفاده از ژل 12% SDS-PAGE
ستون 1: flow قبل از ستون، ستون 2: flow ستون، ستون 3: بافر C، ستون 4: مارکر شماره 310003 SM، ستون 5: بافر D، ستون 6: بافر E، ستون 7: بافر E250، ستون 8: بافر MES

شکل 4: الگوی آنالیز وسترنبلات تائید آنتیژن BLF1. ردیف 1: نشانگر مولکولی پروتئین، ردیف 2: باند متعلق به آنتیژن BLF1 تخلیص شده از روی ژل، باند رنگ گرفته در ردیف 2 متناظر با باند محدوده 23 کیلودالتون نشانگر مولکولی پروتئین میباشد، ردیف 3: BSA به عنوان شاهد منفی.

شکل 5: الف. نمودار بررسی بازه توزیع اندازه نانوذرات PLGA فاقد پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS،
ب. نمودار بررسی بازه توزیع اندازه نانوذرات PLGA حاوی پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS.

شکل 6: الف. نمودار بررسی پتانسیل زتای نانوذرات PLGA فاقد پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS
ب. نمودار بررسی پتانسیل زتای نانوذرات PLGA دارای پروتئین BLF1 در شرایط بهینه توسط دستگاه DLS.

شکل 7: تصویر میکروسکوپ الکترونی FESEM از نانوذرات PLGA حاوی BLF1 (نانوذرات خشک شده بر روی سطح شیشهای، روی گرید قرار گرفته و پس از پوشش دهی با طلا، تصویربرداری شد)
جدول 2: نتایج فرمولهای بررسی بازده وزنی، راندمان احتباس و ظرفیت احتباس


شکل 8: تیترآنتیبادی تولید شده علیه BLF1 کپسوله شده با PLGA تزریقی بهصورت داخل صفاقی در سرم موشهای ایمن و مقایسه آن با شاهد. محور عمودی: جذب نوری در طول موج 495 و محور افقی سریال رقت را نشان میدهد.

شکل 9: تیترآنتیبادی تولید شده علیه BLF1 همراه با ادجوانت تزریقی بصورتداخل صفاقی در سرم موشهای ایمن و مقایسه آن با شاهد. محور عمودی جذب نوری در طول موج 495 و محور افقی سریال رقت را نشان میدهد.
جدول 3: گروه های مختلف جهت بررسی آماری.

جدول 4: مقایسه بین گروههای مختلف توسط آزمون دانکن بر روی تیتر IgG در سرم موشهای ایمنشده در سطح خطای پنج درصد.


شکل 10: حفاظت گروههای ایمن شده مختلف همراه با شاهد در برابر چالش
بحث
بورخورلدریا یکی از خطرناکترین عواملی میباشد که در حال حاظر هیچ واکسنی برای آن تولید نشده است (22). میزان مرگ و میر ناشی از بیماری میلوئیدوزیس از اهمیت بسیاری برخوردار است، بهطوری که به یک بیماری واگیر در حال ظهور تبدیل شده است (23,24). محققان بر این باور هستند که یک میزبان جونده به عنوان یک عامل مشترک بین انسان¬ها و حیوانات عمل میکند (25). تنوع بالینی بسیار زیاد میلوئیدوز، مشکل تشخیص آزمایشگاهی و درمان، آن را به یک بیماری نگران کننده در سراسر جهان تبدیل کرده است (26). عفونت ایجاد شده میتواند از طریق تلقیح پوستی، استنشاقی یا بلع بورخورلدریا موجود در آب آشامیدنی آلوده یا به ندرت از فرد به فرد منتقل شود (27). علی¬رغم افزایش شناخت وسیع بورخوردریا سودومالئ، تقریبا تمام موارد ابتلا مربوط به اقامت یا سفر به مناطق بومی بیماری میباشد (28). برای شناسایی یک کاندید مناسب واکسن، مهندسی بیشتر بر روی توکسین BLF1 مورد نیاز میباشد (29). مهار کنندههای سنتز پروتئین (از جمله مهار کنندههای eIF4A) را میتوان به عنوان عوامل ضد سرطان استفاده نمود (7). پروتئین BLF1 (به عنوان یک مهار کننده قوی (eIF4A، ممکن است به عنوان یک عامل ضد سرطان قوی مورد استفاده قرار گیرد. ژن blf1 در بورخولدریا سودومالئی در بیماری¬زایی نقش دارد. با کلون و بیان ژن blf1 و بررسی روشهای مختلف ارائه دارو به علاوه ارزیابی تیترآنتیبادی پروتئین BLF1 میتوان کاندید واکسنی علیه این باکتری تولید کرد و همچنین با توجه به مکانیسم، BLF1 میتواند کاندیدی برای از بین بردن سلولهای سرطانی باشد (2). در این تحقیق با توجه به مزایای سیستمهای نانوذرات در کاهش خطرات احتمالی پروتئین BLF1 و همچنین احتمال افزایش ایمنیزایی آن به عنوان سیستمهای تحویل نوین واکسنهای پروتئینی، از نانوذرات بر پایه پلیمرهای طبیعی و سنتزی استفاده شد (30). نانوذرات PLGA تا حدی از طریق پینوسیتوز فاز مایع و همچنین از طریق اندوسیتوز با واسطه کلاترین در سلولها وارد میشوند (14). استفاده از PLGA برای تحویل داروها و کاربردهای زیستپزشکی با کمترین سمیت سیستمیک همراه است (30). درصد محصورسازی دارو در فرمولاسیون حاضر برای آنتیژن BLF1 در حد 75% بوده بود. با توجه به اینکه اندازه ذرات کوچک میباشند و کاهش اندازه ذرهای و افزایش نسبت سطح به حجم منجر به کاهش بارگذاری دارو می¬گردد، بنابراین درصد محصورسازی بالا است و میتواند میزان قابلتوجهی از دارو را با استفاده از مقدار کمتری از ماتریکس پلیمری به بافت هدف بر¬ساند. در تحقیق انجام شده توسط هالایکا و همکاران، کلورپرومازین هیدروکلراید (CPZ-HCl) و پرفنازین (PPH) در نانوذرات PLGA با روش امولسیون دوگانه تبخیر حلال بارگذاری شدند. میانگین اندازه نانوذرات PLGA حاوی CPZ-HCl و PPH به ترتیب برابر 347 و 325 نانومتر بود. در تحقیق آقای هالایکا از پلیوینیلالکل 0/3 تا 0/07 استفاده شده است (31). در این مطالعه از پلیوینیلالکل 2/5% استفاده شد که میتوان چنین نتیجه گرفت که افزایش پلیوینیلالکل در مطالعه حاضر خود یکی از عوامل کاهش سایز نانوذرات PLGA میباشد. در مطالعه دیگری توسط نظریان و همکاران، یک پروتئین نوترکیب کایمر با استفاده از روش امولسیون دوگانه تبخیر حلال در نانوذرات PLGA بارگذاری شد که اندازه نانوذرات تولید شده در این مطالعه در محدوده 170 نانومتر گزارش گردید (32). مقایسه نتایج این مطالعه و مطالعات دیگر نشان¬دهنده اندازه مناسب نانوذرات تولید شده میباشد با توجه به رهایش نانوذره PLGA، در این تحقیق تعداد تزریقات برای ایجاد ایمنیزایی به دو بار کاهش پیدا کرد. در مجموع بررسی شکل و اندازه نانوذرات هر سه پروتئین توسط میکروسکوپ الکترونی SEM نشان دهنده این واقعیت بود که شکل نانوذرات قابل قبول بود. همچنین نتایج بررسی اندازه نانوذرات توسط SEM تائیدکننده نتایج بهدست آمده از توزیع اندازه دستگاه DLS بود. پتانسیل نانوذرات PLGA نیز منفی و برای نانوذرات حاوی و فاقد پروتئین در محدوده 31/3- و 33/6- بود. در مقالات مشابه نیز نانوذرات PLGA تولید شده با روش امولسیون دوگانه تبخیر حلال، دارای مقدار منفی بود. برای مثال سمیعی و همکاران با این روش، نانوذرات PLGA حاوی آنتیژن را سنتز نمودند که پتانسیل زتا این نانوذرات برابر 21/6- میلیولت بود (20). در مجموع با مشاهده تغییرات پتانسیل زتا در نانوذرات می¬توان استنباط نمود که تغییرات قابل ملاحظه¬ای در میزان پتانسیل زتا بین ذرات فاقد آنتیژن و ذرات حاوی آنتیژن رخ نداده است و در هر دو حالت، نانوذرات در محدوده پایداری قرار دارند که مانع از اتصال ذرات و تشکیل ذرات به هم چسبیده می¬شود. البته این نکته نیز حائز اهمیت است که پتانسیل زتا نانوذرات PLGA منفی بود و این بار سطحی نانوذرات، در حذف آنها از بدن موثر است.
نتیجهگیری
بر اساس نتایج مطالعات انجام شده، استفاده از واکسن برای پیشگیری از بیماری میلوئیدوزیس بهترین روش مبارزه با این بیماری است. نتایج حاصل از این پژوهش نشان داد که فرمولاسیون نانو واکسن حاصلشده با تجویز داخل صفاقی، از توانایی خوبی در تحریک سیستم ایمنی حیوان آزمایشگاهی برخوردار است. در نتیجه میتوان فرمولاسیون نانویی حاصل را بهعنوان حاملی مناسب جهت تولید واکسن پایدار، ایمن، زیستسازگار و بدون اثرات سمی و جانبی نسبت به ادجوانتهای معمول، جهت بررسیهای بیشتر پیشنهاد نمود. با توجه به عیار آنتیبادی تولید شده میتوان نتیجه گرفت که با افزایش تیتر آنتیبادی ضریب ایمنی افزایش مییابد. باتوجه بهنتایج بهدست آمده، پروتئین نوترکیب BLF1 میتواند بهعنوان کاندیدای واکسن علیه باکتری بورخولدریا سودومالئی مطرح شود.
سپاسگزاری
نویسندگان از معاونت پژوهش دانشگاه جامع امام حسین(ع) تهران تشکر میکنند. مقاله حاضر بخشی از نتایج حاصل از پایان نامه کارشناسی ارشد گرایش سلولی مولکولی در دانشکده علوم پایه دانشگاه جامع امام حسین(ع) تهران است.
حامی مالی: این مطالعه با حمایت مالی دانشگاه جامع امام حسین(ع) تهران انجام شده است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه جامع امام حسین(ع) تایید شده است (کد اخلاق به شماره : 15-04-1401 . REC. IHU. .(IR
مشارکت نویسندگان
مقاله، حاصل پایاننامه بوده که دکتر حسین هنری در ارائه ایده، و در طراحی تحقیق، و آقایان دکتر داود صادقی، سید مجتبی آقایی بعنوان همکار و مهدی دهاتی بهعنوان دانشجو در انجام کار آزمایشگاهی و در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Moran CL, Debowski A, Vrielink A, Stubbs K, Sarkar-Tyson M. N-Acetyl-Β-Hexosaminidase Activity Is Important for Chitooligosaccharide Metabolism and Biofilm Formation in Burkholderia Pseudomallei. Environ Microbiol 2024; 26(1): e16571.
2- Lee SH, Chong Ch, Lim BS, Chai SJ, Sam KK, Mohamed R, et al. Burkholderia Pseudomallei Animal and Human Isolates from Malaysia Exhibit Different Phenotypic Characteristics. Diagnostic Microbiology and Infectious Disease 2007; 58(3); 263-70.
3- Dejsirilert S. et al. Growth and Survival of Pseudomonas Pseudomallei in Acidic Environments. Jpn J Med Sci Biol 1991; 44(2): 63-74.
4- Nandi T, Ong C, Singh AP, Boddey J, Atkins T, Sarkar-Tyson M, et al. A Genomic Survey of Positive Selection in Burkholderia Pseudomallei Provides Insights Into the Evolution of Accidental Virulence. PLoS Pathogens 2010; 6(4): e1000845.
5- Coenye T, Vandamme P. Diversity and Significance of Burkholderia Species Occupying Diverse Ecological Niches. Environ Microbiol 2003; 5(9): 719-29.
6- Currie BJ, Ward L, Cheng AC. The Epidemiology and Clinical Spectrum of Melioidosis: 540 Cases from the 20 Year Darwin Prospective Study. PLoS Negl Trop Dis 2010; 4(11): e900.
7- Cruz-Migoni A, Hautbergue GM, Artymiuk PJ, Baker PJ, Bokori-Brown M, Chang CT, et al. A Burkholderia Pseudomallei Toxin Inhibits Helicase Activity of Translation Factor Eif4a .Science 2011; 334(6057): 821-4.
8- Kanaphun P, Thirawattanasuk N, Suputtamongkol Y, Naigowit P, Dance DA, Smith MD, et al. Serology and Carriage of Pseudomonas Pseudomallei: A Prospective Study in 1000 Hospitalized Children in Northeast Thailand. J Infect Dis 1993; 167(1): 30-3.
9- Wiersinga WJ, Virk HS, Torres AG, Currie BJ, Peacock SJ, Dance DAB, et al. Melioidosis. Nat Rev Dis Primers 2018; 4: 17107.
10- Wongtrakoongate P, Mongkoldhumrongkul N, Chaijan S, Kamchonwongpaisan S, Tungpradabkul S. Comparative Proteomic Profiles and the Potential Markers Between Burkholderia Pseudomallei and Burkholderia Thailandensis. Mol Cell Probes 2007; 21(2): 81-91.
11- Caruthers JM, Johnson ER, McKay DB. Crystal Structure of Yeast Initiation Factor 4A, A DEAD-Box RNA Helicase. Proc Natl Acad Sci USA 2000; 97(24): 13080-5.
12- Howe C, Sampath A, Spotnitz M. The Pseudomallei Group: A Review. J Infect Dis 1971; 124(6): 598-606.
13- Marintchev A. Roles of Helicases in Translation Initiation: A Mechanistic View. Biochim Biophys Acta 2013; 1829(8): 799-809.
14- Danhier F, Ansorena E, Silva JM, Coco R, Le Breton A, Préat V. PLGA-Based Nanoparticles: An Overview of Biomedical Applications. J Control Release 2012; 161(2): 505-22.
15- Masoudi Kerahroudi M, Honari H, abdollahi M. Expression of Blf1-Stx B Gene Cassette in E. Coli and Investigation Antibody Titer in Mice. SSU_Journals 2017; 24(11): 876-86.
16- Russell DW, Sambrook J. Molecular Cloning: A Laboratory Manual. 4th ed. Molecular Cloning, A Laboratory Manual, 4th ed. Available at: www.molecularcloning.org Cold Spring Harbor Protocols, www.cshprotocols.org, 2001. Accessed April 21, 2025.
17- Ahmadi AH, Honari H, Ebrahim Minaei M. Cloning, Fusion, and Expression of Domain A-1 Protective Antigen (PA20) of Bacillus Anthracis and N-Terminal Ipad Gene of Shigella in E. Coli. Qom Univ Med Sci J 2015; 9(4): 20-9. [persian]
18- Tonello F, Pellizzari R, Pasqualato S, Grandi G, Peggion E, Montecucco C. Recombinant and Truncated Tetanus Neurotoxin Light Chain: Cloning, Expression, Purification, and Proteolytic Activity. Protein Expr Purif 1999; 15(2): 221-27.
19- Bollag DM., Rozycki MD, Edelstein SJ. Protein Methods, 1996. 2th ed, John Wiley & Sons, New York; 1996.
20- Samiei A, Bianeh H, Nazarian S, Sadeghi D, Hojjati Razgi AS, Zafarmand Samarin M. PLGA Nanoparticles Containing Intimin-Flagellin Fusion Protein for E. Coli O157:H7 Nano-Vaccine. Journal of Immunological Methods 2023; 520 (113517): 1-8.
21- Tsolou A, Angelou E, Didaskalou S, Bikiaris D, Avgoustakis K, Agianian B, et al. Folate and Pegylated Aliphatic Polyester Nanoparticles for Targeted Anticancer Drug Delivery. International Journal of Nanomedicine 2020; 15: 4899-918.
22- Rotz LD, Khan AS, Lillibridge SR, Ostroff SM, Hughes JM. Public Health Assessment of Potential Biological Terrorism Agents. Emerg Infect Dis 2002; 8(2): 225-30.
23- Limmathurotsakul D, Wongratanacheewin S, Teerawattanasook N, Wongsuvan G, Chaisuksant S, Chetchotisakd P, et al. Increasing Incidence of Human Melioidosis in Northeast Thailand. Am J Trop Med Hyg 2010; 82(6): 1113-7.
24- Dance DA. Melioidosis as an Emerging Global Problem. Acta tropica 2000; 74(2-3): 115-9.
25- Gassiep I, Armstrong M, Norton R. Human Melioidosis. Clin Microbiol Rev 2020; 33(2): e00006-19.
26- Currie BJ. Melioidosis and Burkholderia Pseudomallei: Progress in Epidemiology, Diagnosis, Treatment and Vaccination. Curr Opin Infect Dis 2022; 35(6): 517-23.
27- Alhatmi H, Alharbi A, Bosaeed M, Aldosary O, Aljohani S, Alalwan B, et al. Melioidosis: Case Reports of Confirmed Burkholderia Pseudomallei in Saudi Arabia. J Infect Public Health 2020; 13(5): 824-6.
28- Dawson P, Duwell MM, Elrod MG, Thompson RJ, Crum DA, Jacobs RM, et al. Human Melioidosis Caused by Novel Transmission of Burkholderia Pseudomallei from Freshwater Home Aquarium, United States. Emerging Infectious Diseases 2021; 27(12): 3030.
29- Malina A, Cencic R, Pelletier J. Targeting Translation Dependence in Cancer. Oncotarget 2011; 2(1-2): 76-88.
30- Shakya AK, Al-Sulaibi M, Naik RR, Nsairat H, Suboh S, Abulaila A. Review on PLGA Polymer Based Nanoparticles with Antimicrobial Properties and their Application in Various Medical Conditions or Infections. Polymers 2023; 15(17): 3597.
31- Rezvantalab S, Mihandoost S, Rezaiee M. Machine Learning Assisted Exploration of the Influential Parameters on the PLGA Nanoparticles. Sci Rep 2024; 14(1): 1114.
32- Nazarian S, Mousavi Gargari L. Immunogenicity Evaluation of PLGA Nanoparticles Contains Recombinant Cfab Protein from Enterotoxigenic Escherichia Coli. J Babol Univ Med Sci 2017; 19(9): 39-44.
1- Moran CL, Debowski A, Vrielink A, Stubbs K, Sarkar-Tyson M. N-Acetyl-Β-Hexosaminidase Activity Is Important for Chitooligosaccharide Metabolism and Biofilm Formation in Burkholderia Pseudomallei. Environ Microbiol 2024; 26(1): e16571.
2- Lee SH, Chong Ch, Lim BS, Chai SJ, Sam KK, Mohamed R, et al. Burkholderia Pseudomallei Animal and Human Isolates from Malaysia Exhibit Different Phenotypic Characteristics. Diagnostic Microbiology and Infectious Disease 2007; 58(3); 263-70.
3- Dejsirilert S. et al. Growth and Survival of Pseudomonas Pseudomallei in Acidic Environments. Jpn J Med Sci Biol 1991; 44(2): 63-74.
4- Nandi T, Ong C, Singh AP, Boddey J, Atkins T, Sarkar-Tyson M, et al. A Genomic Survey of Positive Selection in Burkholderia Pseudomallei Provides Insights Into the Evolution of Accidental Virulence. PLoS Pathogens 2010; 6(4): e1000845.
5- Coenye T, Vandamme P. Diversity and Significance of Burkholderia Species Occupying Diverse Ecological Niches. Environ Microbiol 2003; 5(9): 719-29.
6- Currie BJ, Ward L, Cheng AC. The Epidemiology and Clinical Spectrum of Melioidosis: 540 Cases from the 20 Year Darwin Prospective Study. PLoS Negl Trop Dis 2010; 4(11): e900.
7- Cruz-Migoni A, Hautbergue GM, Artymiuk PJ, Baker PJ, Bokori-Brown M, Chang CT, et al. A Burkholderia Pseudomallei Toxin Inhibits Helicase Activity of Translation Factor Eif4a .Science 2011; 334(6057): 821-4.
8- Kanaphun P, Thirawattanasuk N, Suputtamongkol Y, Naigowit P, Dance DA, Smith MD, et al. Serology and Carriage of Pseudomonas Pseudomallei: A Prospective Study in 1000 Hospitalized Children in Northeast Thailand. J Infect Dis 1993; 167(1): 30-3.
9- Wiersinga WJ, Virk HS, Torres AG, Currie BJ, Peacock SJ, Dance DAB, et al. Melioidosis. Nat Rev Dis Primers 2018; 4: 17107.
10- Wongtrakoongate P, Mongkoldhumrongkul N, Chaijan S, Kamchonwongpaisan S, Tungpradabkul S. Comparative Proteomic Profiles and the Potential Markers Between Burkholderia Pseudomallei and Burkholderia Thailandensis. Mol Cell Probes 2007; 21(2): 81-91.
11- Caruthers JM, Johnson ER, McKay DB. Crystal Structure of Yeast Initiation Factor 4A, A DEAD-Box RNA Helicase. Proc Natl Acad Sci USA 2000; 97(24): 13080-5.
12- Howe C, Sampath A, Spotnitz M. The Pseudomallei Group: A Review. J Infect Dis 1971; 124(6): 598-606.
13- Marintchev A. Roles of Helicases in Translation Initiation: A Mechanistic View. Biochim Biophys Acta 2013; 1829(8): 799-809.
14- Danhier F, Ansorena E, Silva JM, Coco R, Le Breton A, Préat V. PLGA-Based Nanoparticles: An Overview of Biomedical Applications. J Control Release 2012; 161(2): 505-22.
15- Masoudi Kerahroudi M, Honari H, abdollahi M. Expression of Blf1-Stx B Gene Cassette in E. Coli and Investigation Antibody Titer in Mice. SSU_Journals 2017; 24(11): 876-86.
16- Russell DW, Sambrook J. Molecular Cloning: A Laboratory Manual. 4th ed. Molecular Cloning, A Laboratory Manual, 4th ed. Available at: www.molecularcloning.org Cold Spring Harbor Protocols, www.cshprotocols.org, 2001. Accessed April 21, 2025.
17- Ahmadi AH, Honari H, Ebrahim Minaei M. Cloning, Fusion, and Expression of Domain A-1 Protective Antigen (PA20) of Bacillus Anthracis and N-Terminal Ipad Gene of Shigella in E. Coli. Qom Univ Med Sci J 2015; 9(4): 20-9. [persian]
18- Tonello F, Pellizzari R, Pasqualato S, Grandi G, Peggion E, Montecucco C. Recombinant and Truncated Tetanus Neurotoxin Light Chain: Cloning, Expression, Purification, and Proteolytic Activity. Protein Expr Purif 1999; 15(2): 221-27.
19- Bollag DM., Rozycki MD, Edelstein SJ. Protein Methods, 1996. 2th ed, John Wiley & Sons, New York; 1996.
20- Samiei A, Bianeh H, Nazarian S, Sadeghi D, Hojjati Razgi AS, Zafarmand Samarin M. PLGA Nanoparticles Containing Intimin-Flagellin Fusion Protein for E. Coli O157:H7 Nano-Vaccine. Journal of Immunological Methods 2023; 520 (113517): 1-8.
21- Tsolou A, Angelou E, Didaskalou S, Bikiaris D, Avgoustakis K, Agianian B, et al. Folate and Pegylated Aliphatic Polyester Nanoparticles for Targeted Anticancer Drug Delivery. International Journal of Nanomedicine 2020; 15: 4899-918.
22- Rotz LD, Khan AS, Lillibridge SR, Ostroff SM, Hughes JM. Public Health Assessment of Potential Biological Terrorism Agents. Emerg Infect Dis 2002; 8(2): 225-30.
23- Limmathurotsakul D, Wongratanacheewin S, Teerawattanasook N, Wongsuvan G, Chaisuksant S, Chetchotisakd P, et al. Increasing Incidence of Human Melioidosis in Northeast Thailand. Am J Trop Med Hyg 2010; 82(6): 1113-7.
24- Dance DA. Melioidosis as an Emerging Global Problem. Acta tropica 2000; 74(2-3): 115-9.
25- Gassiep I, Armstrong M, Norton R. Human Melioidosis. Clin Microbiol Rev 2020; 33(2): e00006-19.
26- Currie BJ. Melioidosis and Burkholderia Pseudomallei: Progress in Epidemiology, Diagnosis, Treatment and Vaccination. Curr Opin Infect Dis 2022; 35(6): 517-23.
27- Alhatmi H, Alharbi A, Bosaeed M, Aldosary O, Aljohani S, Alalwan B, et al. Melioidosis: Case Reports of Confirmed Burkholderia Pseudomallei in Saudi Arabia. J Infect Public Health 2020; 13(5): 824-6.
28- Dawson P, Duwell MM, Elrod MG, Thompson RJ, Crum DA, Jacobs RM, et al. Human Melioidosis Caused by Novel Transmission of Burkholderia Pseudomallei from Freshwater Home Aquarium, United States. Emerging Infectious Diseases 2021; 27(12): 3030.
29- Malina A, Cencic R, Pelletier J. Targeting Translation Dependence in Cancer. Oncotarget 2011; 2(1-2): 76-88.
30- Shakya AK, Al-Sulaibi M, Naik RR, Nsairat H, Suboh S, Abulaila A. Review on PLGA Polymer Based Nanoparticles with Antimicrobial Properties and their Application in Various Medical Conditions or Infections. Polymers 2023; 15(17): 3597.
31- Rezvantalab S, Mihandoost S, Rezaiee M. Machine Learning Assisted Exploration of the Influential Parameters on the PLGA Nanoparticles. Sci Rep 2024; 14(1): 1114.
32- Nazarian S, Mousavi Gargari L. Immunogenicity Evaluation of PLGA Nanoparticles Contains Recombinant Cfab Protein from Enterotoxigenic Escherichia Coli. J Babol Univ Med Sci 2017; 19(9): 39-44.
نوع مطالعه: پژوهشي |
موضوع مقاله:
ایمونولوژی
دریافت: 1403/7/18 | پذیرش: 1403/11/2 | انتشار: 1404/2/15
دریافت: 1403/7/18 | پذیرش: 1403/11/2 | انتشار: 1404/2/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







