دوره 33، شماره 1 - ( فروردین 1404 )
جلد 33 شماره 1 صفحات 8616-8604 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rastegari Nasab Ravari F, Moflehi D, Aminizadeh S, Behrouzi Z. Effect of Swimming Exercise Training and Advanced Antioxidant Supplementation on the TWEAK/TRAF2/ERK1/Ap-1 Signaling Pathway in Skeletal Muscle of Male Mice with Spinal Cord Injury. JSSU 2025; 33 (1) :8604-8616
URL: http://jssu.ssu.ac.ir/article-1-6272-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6272-fa.html
رستگارینسب راوری فاطمه، مفلحی داریوش، امینی زاده سهیل، بهروزی زهرا. تاثیر تمرین ورزشی شنا و مکمل آنتیاکسیدانی پیشرفته (MitoQ) بر مسیر سیگنالینگ TWEAK/TRAF2/ERK1/Ap-1 در عضله اسکلتی موش های نر دارای آسیب نخاعی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (1) :8604-8616
متن کامل [PDF 923 kb]
(250 دریافت)
| چکیده (HTML) (946 مشاهده)
References:
1- Meng Q, Chen Z, Gao Q, Hu L, Li Q, Li S, et al. Rosiglitazone Ameliorates Spinal Cord Injury Via Inhibiting Mitophagy and Inflammation of Neural Stem Cells. Oxid Med Cell Longev 2022; 2022(1): 5583512.
2- Liu Y, Yang X, He Z, Li J, Li Y, Wu Y, et al. Spinal Cord Injury: Global Burden from 1990 to 2019 and Projections Up to 2030 Using Bayesian Age-Period-Cohort Analysis. Front Neurol 2023; 14: 1304153.
3- Safdarian M, Trinka E, Rahimi-Movaghar V, Thomschewski A, Aali A, Abady GG, et al. Global, Regional, and National Burden of Spinal Cord Injury, 1990–2019: A Systematic Analysis for the Global Burden of Disease Study 2019. Lancet Neurol 2023; 22(11): 1026-47.
4- Tian T, Zhang S, Yang M. Recent Progress and Challenges in the Treatment of Spinal Cord Injury. Protein Cell 2023; 14(9): 635-52.
5- Ji LL, Yeo D, Kang C, Zhang T. The Role of Mitochondria in Redox Signaling of Muscle Homeostasis. J Sport Health Sci 2020; 9(5): 386-93.
6- P. Drasites K, Shams R, Zaman V, Matzelle DC. Shields DP. Garner D, et al. Pathophysiology, Biomarkers, And Therapeutic Modalities Associated with Skeletal Muscle Loss Following Spinal Cord Injury. Brain Sci 2020; 10(12): 933.
7- Fu J, Wang H, Deng L, Li J. Exercise Training Promotes Functional Recovery after Spinal Cord Injury. Neural Plast 2016; 2016(1): 4039580.
8- Huang T, Shen J, Bao B, Hu W, Sun Y, Zhu T, et al. Mitochondrial-Targeting Antioxidant Mitoq Modulates Angiogenesis and Promotes Functional Recovery after Spinal Cord Injury. Brain Res 2022; 1786: 147902.
9- Sato S, Ogura Y, Kumar A. TWEAK/Fn14 Signaling Axis Mediates Skeletal Muscle Atrophy and Metabolic Dysfunction. Front Immunol 2014; 5: 18.
10- Xu X, Talifu Z, Zhang CJ, Gao F, Ke H, Pan YZ, et al. Mechanism of Skeletal Muscle Atrophy after Spinal Cord Injury: A Narrative Review. Front Nutrit 2023; 10: 1099143.
11- Webster JM, Kempen LJ, Hardy RS, Langen RC. Inflammation and Skeletal Muscle Wasting During Cachexia. Front physiol 2020; 11: 597675.
12- Ji Y, Li M, Chang M, Liu R, Qiu J, Wang K, et al. Inflammation: Roles in Skeletal Muscle Atrophy. Antioxidants 2022; 11(9): 1686.
13- Huang L, Li M, Deng C, Qiu J, Wang K, Chang M, et al. Potential Therapeutic Strategies for Skeletal Muscle Atrophy. Antioxidants (Basel) 2022; 12(1): 44.
14- Liao CF, Yang TY, Chen YH, Yao CH, Way TD, Chen YS. Effects of Swimming Exercise on Nerve Regeneration in a Rat Sciatic Nerve Transection Model. BioMedicine 2017; 7(1): 3.
15- Andrade IR, Nakachima LR, Fernandes M, Fernandes CH, Santos JB, Valente SG. Assessment of the Effects of Swimming as a Postoperative Rehabilitation on Nerve Regeneration of Wistar Rats Submitted to Grafting of Autologous Nerves after Injury to the Sciatic Nerve. Rev Bras Ortop (Sao Paulo) 2020; 55(3): 323-28.
16- Coyoy-Salgado A, Segura-Uribe JJ, Guerra-Araiza C, Orozco-Suárez S, Salgado-Ceballos H, Feria-Romero IA, et al. The Importance of Natural Antioxidants in the Treatment of Spinal Cord Injury in Animal Models: An Overview. Oxid Med Cell Longev 2019; 2019: 3642491.
17- Hashem R, Arshadi S, Banaei Far A, Haji Rasouli M. The Effect of 12-Week Aerobic Trainings on Mitochondrial Biogenesis Indicators in Skeletal Muscle among Male Rats. Med J Tabriz Uni Med Sciences Health Services 2020; 42(3): 348-55. [Persian]
18- Morgan DW, Stevens SL. Use of Water-And Land-Based Gait Training to Improve Walking Capacity in Adults with Complete Spinal Cord Injury: A Pilot Study. J Spinal Cord Med 2024; 47(3): 404-11.
19- Sharifi M, Moflehi D, Aminizadeh S, Aveseh M. Effect of Endurance Training and MitoQ on Expression of PGC-1α, ERR-α, MCAD, and CPT-1α Genes in Skeletal Muscle of Male Wistar Rats. J Mazandaran Univ Med Sci 2022; 32(215): 14-25. [Persian]
20- Afrooz S, Moflahi D, Aminizadeh S. Effect of 4 Weeks of Endurance Swimming Training and Mitoq Supplementation on TLR4/NF-Κb/Tnfα Signaling Pathway in the Spinal Cord of Male Wistar Rats with Spinal Cord Injury. JPRS 2023; 2(15): 175-63. [Persian]
21- Huang L, Li M, Deng C, Qiu J, Wang K, Chang M, et al. Potential Therapeutic Strategies for Skeletal Muscle Atrophy. Antioxidants 2022; 12(1): 44.
22- Shafahi MJ, Salesi M, Rezaei R, Daryanoosh F. The Effect of Eight-Weeks of Resistance Training a Long with Coenzyme Q10 Supplementation on Some Factors of Mitochondrial Biogenesis in Young Male Rats. Journal of Practical Studies of Biosciences in Sport 2022; 10(23): 54-63. [Persian]
23- Kuang J, McGinley C, Lee MJ, Saner NJ, Garnham A, Bishop DJ. Interpretation of Exercise-Induced Changes in Human Skeletal Muscle Mrna Expression Depends on the Timing of the Post-Exercise Biopsies. PeerJ 2022; 10: e12856.
24- Sulaimon LA, Afolabi LO, Adisa RA, Ayankojo AG, Afolabi MO, Adewolu AM. Pharmacological Significance of Mitoq in Ameliorating Mitochondria-Related Diseases. Advances in Redox Research 2022; 5: 100037.
25- Huang T, Shen J, Bao B, Hu W, Sun Y, Zhu T, et al. Mitochondrial-Targeting Antioxidant Mitoq Modulates Angiogenesis and Promotes Functional Recovery after Spinal Cord Injury. Brain Research 2022; 1786: 147902.
26- Gutierrez-Mariscal FM, Arenas-de Larriva AP, Limia-Perez L, Romero-Cabrera JL, Yubero-Serrano EM, López-Miranda J. Coenzyme Q10 Supplementation for The Reduction of Oxidative Stress: Clinical Implications in the Treatment of Chronic Diseases. Int J Mol Sci 2020; 21(21): 7870.
27- Rostamzadeh F, Najafipour H, Aminizadeh S, Jafari E. Therapeutic Effects of the Combination of Moderate-Intensity Endurance Training and Mitoq Supplementation in Rats with Isoproterenol-Induced Myocardial Injury: The Role of Mitochondrial Fusion, Fission, and Mitophagy. Biomed Pharmacother 2024; 170: 116020. [Persian]
28- Baligand C, Chen YW, Ye F, Pandey SN, Lai SH, Liu M, et al. Transcriptional Pathways Associated with Skeletal Muscle Changes after Spinal Cord Injury and Treadmill Locomotor Training. Biomed Res Int 2015; 2015: 387090.
29- Higashino K, Matsuura T, Suganuma K, Yukata K, Nishisho T, Yasui N. Early Changes in Muscle Atrophy and Muscle Fiber Type Conversion after Spinal Cord Transection and Peripheral Nerve Transection in Rats. J Neuroeng Rehabil 2013; 10: 46.
30- Otzel DM, Lee J, Ye F, Borst SE, Yarrow JF. Activity-Based Physical Rehabilitation with Adjuvant Testosterone to Promote Neuromuscular Recovery after Spinal Cord Injury. Int J Mol Sci 2018; 19(6): 1701
31- Lin S, Zhou Z, Zhao H, Xu C, Guo Y, Gao S, et al. TNF Promotes M1 Polarization Through Mitochondrial Metabolism in Injured Spinal Cord. Free Radic Biol Med 2021; 172: 622-32.
32- Yarar-Fisher C, Bickel CS, Kelly NA, Stec MJ, Windham ST, McLain AB, et al. Heightened TWEAK-NF-Κb Signaling and Inflammation-Associated Fibrosis in Paralyzed Muscles of Men with Chronic Spinal Cord Injury. Am J Physiol Endocrinol Metab 2016; 310(9): E754-61.
33- Howard EE, Pasiakos SM, Blesso CN, Fussell MA, Rodriguez NR. Divergent Roles of Inflammation in Skeletal Muscle Recovery from Injury. Front Physiol 2020; 11: 87.
34- Invernizzi M, De Sire A, Renò F, Cisari C, Runza L, Baricich A, et al. Spinal Cord Injury as a Model of Bone-Muscle Interactions: Therapeutic Implications from in Vitro and in Vivo Studies. Front Endocrinol (Lausanne) 2020; 11: 204.
35- Stratos I, Behrendt AK, Anselm C, Gonzalez A, Mittlmeier T, Vollmar B. Inhibition of TNF-Α Restores Muscle Force, Inhibits Inflammation, and Reduces Apoptosis of Traumatized Skeletal Muscles. Cells 2022; 11(15): 2397.
36- Pascoe AL, Johnston AJ, Murphy RM. Controversies in TWEAK-Fn14 Signaling in Skeletal Muscle Atrophy and Regeneration. Cell Mol Life Sci 2020; 77(17): 3369-81.
37- Baehr LM, Hughes DC, Waddell DS, Bodine SC. Snapshot: Skeletal Muscle Atrophy. Cell 2022; 185(9): 1618.
38- Mittal A, Bhatnagar S, Kumar A, Lach-Trifilieff E, Wauters S, Li H, et al. The TWEAK–Fn14 System Is a Critical Regulator of Denervation-Induced Skeletal Muscle Atrophy in Mice. J cell Biology 2010; 188(6): 833-46.
39- Marzetti E, Calvani R, Cesari M, Buford TW, Lorenzi M, Behnke BJ, et al. Mitochondrial Dysfunction and Sarcopenia of Aging: From Signaling Pathways to Clinical Trials. Int J Biochem Cell Biol 2013; 45(10): 2288-301.
40- Bernacchioni C, Ghini V, Squecco R, Idrizaj E, Garella R, Puliti E, et al. Role of Sphingosine 1-Phosphate Signalling Axis in Muscle Atrophy Induced by Tnfα in C2C12 Myotubes. Int J Mol Sci 2021; 22(3): 1280.
41- Abrigo J, Simon F, Cabrera D, Vilos C, Cabello-Verrugio C. Mitochondrial Dysfunction in Skeletal Muscle Pathologies. Curr Protein Pept Sci 2019; 20(6): 536-46.
42- Savikj M, Kostovski E, Lundell LS, Iversen PO, Massart J, Widegren U. Altered Oxidative Stress and Antioxidant Defence in Skeletal Muscle During the First Year Following Spinal Cord Injury. Physiol Rep 2019; 7(16): e14218.
43- Wang D, Yang Y, Zou X, Zhang J, Zheng Z, Wang Z. Antioxidant Apigenin Relieves Age-Related Muscle Atrophy by Inhibiting Oxidative Stress and Hyperactive Mitophagy and Apoptosis in Skeletal Muscle of Mice. J Gerontol a Biol Sci Med Sci 2020; 75(11): 2081-8.
44- Liu T, Sun L, Zhang Y, Wang Y, Zheng J. Imbalanced GSH/ROS And Sequential Cell Death. J Biochem Mol Toxicol 2022; 36(1): e22942.
45- Sakellariou GK, Pearson T, Lightfoot AP, Nye GA, Wells N, Giakoumaki II, et al. Long-Term Administration of the Mitochondria-Targeted Antioxidant Mitoquinone Mesylate Fails to Attenuate Age-Related Oxidative Damage or Rescue the Loss of Muscle Mass and Function Associated with Aging of Skeletal Muscle. FASEB J 2016; 30(11): 3771-85.
46- Ghosh A, Chandran K, Kalivendi SV, Joseph J, Antholine WE, Hillard CJ, et al. Neuroprotection by a Mitochondria-Targeted Drug in a Parkinson's Disease Model. Free Radic Biol Med 2010; 49(11): 1674-84
47- You-Mi Kim, Jun-Jang Jin, Sam-Jun Lee, Tae-Beom Seo, Eun-Sang Ji. Treadmil Exercise with Bone Marrow Stromal Celles Transplantation Facilitates Neuroprotective Effect Through BDNF-ERK1/2 Pathway in Spinal Cord Injury Rats. J Exerc Rehabil 2018; 14(3): 335-40.
48- Sandri M, Lin J, Handschin C, Yang W, Arany ZP, Lecker SH, et al. PGC-1α Protects Skeletal Muscle from Atrophy by Suppressing Foxo3 Action and Atrophy-Specific Gene Transcription. Proc Natl Acad Sci USA 2006; 103(44): 16260-5.
متن کامل: (317 مشاهده)
مقدمه
آسیب نخاعی Spinal Cord Injury (SCI) یک بیماری تخریب کنندۀ عصبی است که در اثر از دست دادن نورونها یا غلاف میلین ایجاد و منجر به اختلال در سیستم عصبی-عضلانی میشود (1). میزان بروز سالانه آسیب نخاعی از یازده تا پنجاه و سه مورد در هر میلیون نفر متغیر است (2). همچنین، هزینه سیستمهای مراقبتی و بهداشتی ناشی از SCI در آمریکا، بالغ بر نه میلیارد دلار برآورد شده است (3). در بیماری آسیب نخاعی، اختلالات حسی- حرکتی (4) و متعاقب آن اختلال در انقباض عضلانی و افزایش استرس اکسیداتیو رخ میدهد (5،6). از طرفی، اختلال در عملکرد میتوکندری موجب افزایش نشانگرهای التهابی و گیرندههای آن میگردد که افزایش پروتئولیز را از طریق سیستم یوبی کوئیتین-پروتئازم به دنبال دارد (7). بنابراین، افزایش استرس اکسیداتیو، التهاب و کاهش عملکرد میتوکندری به عنوان سیگنالهای محرک بروز آتروفی عضلات اسکلتی پس از ایجاد SCI گزارش شده است (8). افزایش تولید گونههای اکسیژنی فعال (ROS) نشان داده شده است که یک مولکول سیگنالینگ قدرتمند در فعال کردن مسیرهای سیگنالینگ است. نکته مهم این است که افزایش تولید ROS به عنوان یک سیگنال قدرتمند برای فعالسازی فاکتورهای رونویسی عمل میکند که پروتئینهای آنتیاکسیدانی درونزا را افزایش میدهد (5،6). در واقع، شواهد کنونی نشان میدهد که استرس اکسیداتیو حاد که با ورزش رخ میدهد ممکن است برای سازگاریهای عضلات اسکلتی مورد نیاز باشد و افزایش بیش از حد ROS در عضله اسکلتی میتواند منجر به راهاندازی مسیر های آتروفی عضلانی باشد (۵). در این بین، فاکتور القا کنندۀ ضعیف آپوپتوز شبه فاکتور نکروز تومور آلفا (Tweak) و گیرندۀ آن فاکتور رشد فیبروبلاست 14 (Fn14) به عنوان شاخصهای محرک آتروفی عضله اسکلتی ناشی از SCI شناخته شدهاند (9). Tweak، مسیرهای پاتولوژیک زیادی از جمله کاهش میتوکندری و افزایش پروتئولیز در عضلات اسکلتی را سیگنالدهی میکند (10). همچنین فعالیت Tweak و Fn14 با فعالیت MAPK و فاکتورهای رونویسی پاییندستی از جمله ERk1 و AP-1 همراه است (9،11). مهار مسیرهای سیگنالینگ مرتبط با فرآیندهای التهابی میتواند بهطور قابلتوجهی پاسخ¬های التهابی ناشی از تخریب عصبی- عضلانی را سرکوب کند و منجر به کاهش التهاب و آتروفی عضله اسکلتی شود (12). بنابراین، مهار مسیرهای بروز آتروفی در بیماران SCI، میتواند یکی از کلیدهای اصلی مدیریت و درمان عوارض ناشی از این بیماری باشد. فعالیت ورزشی یکی از استراتژیهای درمانی برای مهار آتروفی عضله اسکلتی است (13). ورزش با افزایش جریان خون و اکسیژنرسانی میتواند استرس اکسیداتیو و پاسخهای التهابی در عضلات اسکلتی را تعدیل کند (7)، در این بین، ورزش شنا بهطور موثری با تعدیل پاسخهای التهابی میتواند اثر درمانی و توانبخشی در بیماران داشته باشد (14). شنا در محیط آبی با مسدود کردن سیگنال¬های حسی درد، موجب بهبود در ادراک حسی و کاهش آستانۀ درد و در نهایت افزایش پاسخهای بازسازی عصبی میگردد (15،16). علاوه بر این، مطالعات نشان میدهد که ورزش شنا با افزایش رشد آکسون، بازسازی عصبی را پس از آسیب بهبود میبخشد (17،18). امروزه، استفاده از مکملهای مختلف چه در حیطه ورزشی و چه در زندگی روزمره روایج زیادی یافته است و تحقیقات مختلف تجویز مکمل¬های آنتیاکسیدانی همراه با فعالیت ورزشی را به عنوان یک راهکار اثربخش معرفی کردهاند (19،20،21). MitoQ یک مکمل آنتی اکسیدانی پیشرفته است که متشکل از آنزیم Q10و یک کاتیون TPP است که میتواند حدود ۷۰۰ تا ۸۰۰ برابر بیشتر از مکمل Q10 در سطح ماتریکس میتوکندریایی تجمع کند و از این طریق با استرس اکسیداتیو میتوکندریایی که ناشی از بیماریها است مقابله کند (24-22). برخی از مطالعات فواید درمانی آنتیاکسیدانMitoQ از جمله مهار تولید بیش از حد گونه های اکسیژنی فعال (ROS) را گزارش کردهاند. (25،26). با توجه به عارضه آسیب نخاعی و مطالب ذکر شده، بهنظر میآید که بسیاری از مسیرهای سیگنالینگی فعال شده در عضله اسکلتی که میتواند منجر به آتروفی عضله اسکلتی شوند در ارتباط با ROS تولیدی در میتوکندریها هستند و این امر میتواند به وخیمتر شدن شرایط در این بیماران سرعت ببخشد. همچنین، مطالعات در زمینه اثر ورزش شنا به همراه مکملهای آنتیاکسیدانی بهویژه MitoQ بسیار محدود است. بنابراین در تحقیق حاضر دو هدف اصلی را دنبال میکنیم. در وهله اول به دنبال اثر ورزش شنا بر مسیر آتروفی عضله اسکلتی (TWEAK/TRAF2/ERK1/Ap-1) بلافاصله متعاقب آسیب نخاعی و در وهله بعدی به دنبال بررسی اثر مکمل مایتوکیو و ترکیب آن با ورزش شنا بر این فرآیند هستیم.
روش بررسی
تهیه و نگهداری حیوانات: در مطالعه تجربی حاضر، 4۰ سر موش صحرایی نر بالغ نژاد ویستار با محدوده وزنی 190 تا 210 گرم و سن تقریبی 6 تا 8 هفته از مرکز پرورش و تکثیر حیوانات آزمایشگاهی دانشگاه علوم پزشکی کرمان تهیه گردید. حیوانات در تمام دوره تحقیق تحت شرایط استاندارد کار با حیوانات، شامل آب و غذای سالم و در دسترس، دمای هوای 22 تا 24 درجه سانتیگراد، رطوبت نسبی 55 تا 60 درصد، چرخه روشنایی و تاریکی 12 به 12 ساعت در قفسهای پلیاتیلن ساخت شرکت تجهیز گستر ایرانیان (تعداد 5 سر در هر قفس) در حیوان خانه مرکز تحقیقات فیزیولوژی کرمان نگهداری شدند. تمام اصول اخلاقی کار با حیوانات آزمایشگاهی در این تحقیق تحت نظارت کمیته اخلاق دانشگاه علوم پزشکی کرمان رعایت گردید.
القا بیماری و طرح پژوهش: پس از آشناسازی با محیط آزمایشگاه، حیوانات با استفاده از تزریق درون صفاقی کتامین (100 میلیگرم در کیلوگرم) و زایلازین (10 میلیگرم در کیلوگرم) بیهوش شدند. سپس حیوانات بر روی شکم قرار داده شدند و پوست ناحیه پشت تراشیده و با بتادین ضدعفونی گردید. پس از آن برشی در سطح T11 تا T12 ایجاد و لامینکتومی در محل اتصال مهرههای T11 و T12 بدون آسیب رساندن به سخت شامه انجام گردید (19). پس از تایید SCI، بهوسیله تست BBB (در محدوده ۰ تا ۵) حیوانات به روش تصادفی در ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
پروتکل ورزش شنا: حیوانات پس از آشنایی با محیط آب، به مدت 4 هفته، هر هفته 5 جلسه و هر جلسه به مدت 30 دقیقه در قالب ۶ ست ۵ دقیقهای در استخر شنا ورزش، تمرین شنا را انجام دادند. در هفته ابتدایی تعداد ستهای تمرینی ۳ ست، ۵ دقیقه یا بود و بتدریج به تعداد ستهای تمرینی با توجه به وضعیت تمرینی موشها اضافه شد. حین انجام تمرینات ورزشی شنا سعی شد که اضافه بار با دقت زیادی اعمال شود تا با توجه به محدودیت جسمانی موشها، تلفات ناشی از غرق شدگی در آب استخر به حداقل برسد. دمای آب برای تمرین شنا ۲۵ تا ۳۳ درجه سانتیگراد در نظر گرفته شد (19).
پروتکل مصرف مکمل MitoQ: طی مطالعه حاضر، حیوانات، مکمل مایتوکیو با برند تجاری MitoQساخت کشور نیوزلند را به مدت 4 هفته به صورت محلول در آب خوراکی با دوز۲۵۰ میکرومولار دریافت کردند (27).
تشریح و نمونهبرداری: پس از پایان 4 هفته تمرین شنا و مکمل دهی، حیوانات با استفاده از کتامین (۷۵ میلیگرم/کیلوگرم) و زایلازین (۱۰ میلی گرم/کیلوگرم) بیهوش شدند و سپس عضله دو قلوی میانی حیوانات جدا گردید و در نیتروژن مایع قرار داده شد و به منظور انجام روش بیان ژن در تیوب ها به فریزر 70- منتقل شد.
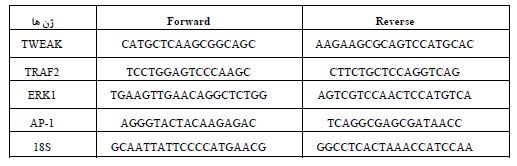
اندازهگیری بیان ژن: استخراج RNA تام مطابق با پروتکل کیت شرکت سیناکلون انجام شد. برای ارزیابی بیان ژن،50 میلیگرم از بافت عضله اسکلتی دوقلو برداشته شد. بافتها بـه روش هاونکوبی در نیتروژن مایع بهطور کامل پودر شدند. به منظور جدا کردن ساختارهای پروتئینی، بافت هموژن شده در دمای ۴ درجه سانتیگراد در دور ۱۲۰۰۰ به مدت ۱۰ دقیقه سانتریفیوژ (سانتیرفیوژ یخچال دار-اپندورف آلمان) شد و سوپرناتانت برداشته و با نسبت 1 به 0/5 با بافر مخصوص کیت مخلوط و به مدّت 15 ثانیـه به شدت تکـان داده شـد. سپس محلول مورد نظر در دمای ۴ درجه سانتیگراد، به مدت ۱۵ دقیقه در ۱۲۰۰۰ دور سانتریفیوژ و بخش معدنی و آبـی از هم جدا گردید. بخش محتوی RNA برداشته و با نسـبت 1 بـه 0/5 با بافر شستوشو مخلوط و سـپس در دمای ۴ درجه سانتیگراد، به مدت ۱۰ دقیقه در ۱۲۰۰۰ دور سـانتریفیوژ شـدند. سپس پلت حــاوی RNA در اتــانول شستشــو و در ۲۰ لاندا آب مقطر حل گردید. غلظت RNA با استفاده از دستگاه ترموسایکلر (Nanodrop) سنجیده و نسبت 260 به 280 بـین 1/8 تـا 2 بهعنوان تخلیص مطلوب تعریف گردید. سنتز cDNA با استفاده از یک لاندا RNA و با استفاده از Random hexamer primer و آنزیم Mulv Reverse transcriptase انجام گرفت. Real time–PCR با استفاده از غلظت Premix syber green II (امپلیکون-دانمارک) و با استفاده از غلظت ۱۰۰ نانوگرم از cDNA انجـام گرفـت. از 18S بهعنوان ژن کنترل استفاده گردید. کارایی پرایمرهای تحقیـق در قیـاس بـا پرایمر ژن کنترل با انجام Real time-PCR (دستگاه ریل تایم- ABI آمریکا) با غلظتهای سریالی از cDNA هر ژن بهصورت جداگانـه سـنجیده شـد. برنامه مورد استفاده در Real time شامل: 95 درجه سانتیگراد به مدّت 10 دقیقه، 95 درجه سانتیگراد به مدت 15 ثانیه، 60 درجه سانتیگراد به مدت 1 دقیقه (تکرار چرخه 40) بود. میزان بیان ژنهـای TWEAK، TRAF2، ERK1 و AP-1 بـا روش-∆∆CT ۲ اندازهگیری شد (جدول ۱) (19،27).
جدول 1: توالی پرایم های متغیرهای پژوهش
تجزیه و تحلیل آماری
در پژوهش حاضر، طبیعی بودن توزیع داده ها از طریق آزمون کولموگروف-اسمیرنف بررسی گردید. سپس از آنالیز آماری آنالیز واریانس یک راهه و آزمون پیگیری جهت مقایسه بیان mRNA در گروههای پژوهش استفاده گردید. همه آنالیزها با استفاده نرمافزار SPSS version 16در سطح معنیداری P < 0.05 اجرا گردید.
نتایج
یافتههای حاصل از آزمون آماری one-way ANOVA نشان داد که به دنبال 4 هفته تمرین استقامتی شنا و مصرف مکمل MitoQ تغییرات معنیداری در mRNA TWEAK
(0/001=P؛ 23/294=F)، TRAF2 (P=0/001؛ 57/158=F) و Ap-1 (P=0/001؛ 99/434=F)در عضله اسکلتی رتهای نر دچار آسیب نخاعی مشاهده گردید (p<0.05). نتایج آزمون پیگیری نشان میدهد بین سطوح mRNA TWEAK گروه شم با گروه آسیب، گروه آسیب +تمرین با گروه آسیب، گروه آسیب+مکمل با گروه آسیب و گروه آسیب+تمرین+مکمل با گروه آسیب تفاوت معنیداری مشاهده میشود (p<0.05). همچنین بین مقادیر mRNA TARF2 گروه شم با گروه آسیب، گروه آسیب+تمرین با گروه آسیب، گروه آسیب+ مکمل با گروه آسیب و گروه آسیب+تمرین+مکمل با گروه آسیب تفاوت معنیداری مشاهده میشود (p<0.05). بهعلاوه بین مقادیر mRNA AP-1 گروه شم با گروه آسیب، گروه آسیب+تمرین با گروه آسیب و گروه آسیب+مکمل با گروه آسیب و گروه آسیب+تمرین+مکمل با گروه آسیب تفاوت معنیداری وجود دارد (P<0.05)(نمودار 1،3،4). از طرف دیگر یافتههای پژوهش نشان داد که تغییرات معنیداری در mRNA ERK1 به دنبال تمرین استقامتی شنا و مصرف مکمل MitoQ در عضله اسکلتی رتهای نر دچار آسیب نخاعی مشاهده نگردید(P=0/001؛ 23/294=F) (نمودار 2). با این حال نتایج آزمون پیگیری نشان داد که بین مقادیر mRNA ERK1 گروه آسیب+تمرین با گروه شم تفاوت معنی داری وجود دارد (P<0.05).
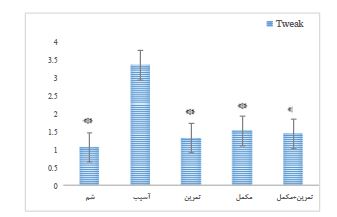
نمودار 1: بیان نسبی ژن TWEAK در گروههای مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
* تفاوت معنیدار نسبت به گروه آسیب نخاعی.
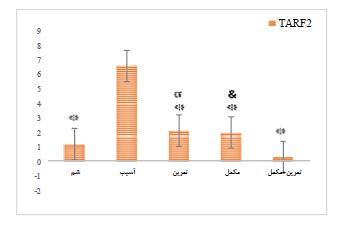
نمودار 2: بیان نسبی ژن TARF2 در گروه های مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
* تفاوت معنیدار نسبت به گروه آسیب نخاعی. α تفاوت معنیدار نسبت به گروه تمرین + مکمل. & تفاوت معنیدار نسبت به گروه تمرین + مکمل.
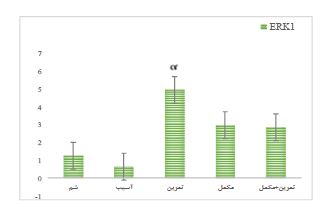
نمودار ۳: بیان نسبی ژن ERK1 در گروههای مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند. α تفاوت معنیدار نسبت به گروه آسیب نخاعی.
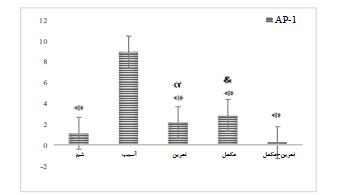
نمودار ۳: بیان نسبی ژن AP-1 در گروه های مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
* تفاوت معنیدار نسبت به گروه آسیب نخاعی. α تفاوت معنیدار نسبت به گروه تمرین + مکمل. & تفاوت معنیدار نسبت به گروه تمرین +مکمل.
بحث
نتایج تحقیق حاضر نشان میدهد پس از وقوع SCI میزان بیان ژن شاخصهای TWEAK، TRAF2 وAp-1 بهطور معنیداری در گروه آسیب نخاعی در مقایسه با گروه کنترل افزایش مییابد و این تغییرات احتمالا نشاندهنده شروع فرآیندهای آتروفی عضلانی است. در مقابل، یافتههای پژوهش حاضر نشان داد که تمرین ورزشی شنا و مصرف مکمل MitoQ میتواند منجر به کاهش بیان ژنهای TWEAK، TRAF2 و AP-1 در عضله دوقلوی میانی موشهای نر دچار آسیب نخاعی گردد. به دنبال آسیب نخاعی و قطع ارتباط عصبی با توجه به شدت آسیب، تخریب عصب سوماتیک و قطع عصبدهی عضله اسکلتی صورت میگیرد و با بروز تغییرات فیزیولوژیکی، بیوشیمیایی و بیومکانیکی، عملکرد حرکتی در بیماران مختل میگردد (28). آسیب نخاعی و به دنبال آن مهار نورونهای حرکتی α باعث تسریع فرآیند آتروفی عضلات اسکلتی میگردد (29). مطالعه روی موشها نشان میدهد که SCI منجر به کاهش قابلتوجهی در سطح مقطع عضلانی، وزن عضلانی و قدرت عضلانی در 7 تا 21 روز پس از بیحرکتی میشود و این تغییرات نشان میدهد که ورودی عصبی و بار مکانیکی اثر ترکیبی بر جرم و قدرت عضله اسکلتی پس از SCI دارند (30). یکی از مسیرهایی که نقش اساسی در آتروفی عضله اسکلتی پس از آسیب نخاعی دارد القا کننده ضعیف آپوپتوز شبه فاکتور نکروز تومور آلفا TWEAK)) و گیرنده آن از فاکتور رشد فیبروبلاستFn14 است (31،32). در واقع TWEAK بهعنوان یکی از شاخصهای بالادستی، یک واسطه ضروری التهاب مزمن و تغییرات فیبروتیک در عضله اسکلتی پس از آسیب نخاعی است (33). از یک طرف، TWEAK فرایند متابولیک اکسیداتیو طبیعی در عضله اسکلتی را با فعال کردن NF-κb مهار می کند، بنابراین باعث آسیب استرس اکسیداتیو میشود (34). از سوی دیگر، TWEAK می تواند سیگنالینگ NF-κB و سایر مسیرهای پروتئولیتیک را فعالکند و مسیر اتوفاژی را فعال کند، پروتئولیز عضلانی را القا کند و مانع از تکثیر میوبلاستها شود، در نتیجه مانع بازسازی فیبرهای عضلانی اسکلتی میشود (35). علاوه بر این، TWEAKتوانایی سلولهای عضلانی اسکلتی را برای مقاومت در برابر استرس اکسیداتیو تضعیف میکند (9)، و باعث اختلال متابولیک در سلولهای عضلانی اسکلتی می شود (36). TWEAK و NF-κB هر دو به صورت ترکیبی در مسیر سیگنالینگ TARF1/6، TAK1، TAB2/3، ERK1/2 و در نهایت AP1 و NK-κB در فرایند اتروفی عضله اسکلتی عمل میکنند (37). در این راستا، یارار-فیشر در سال 2016 نشان دادند که سطح بیانTWEAK ، Fn14 و NK-κB در عضله اسکلتی بیماران مبتلا به SCI بهطور قابلتوجهی افزایش یافته است و به دنبال آن درجه فیبروز عضلانی نیز به طور قابل توجهی افزایش یافته است، که نشاندهنده ارتباط نزدیک این دو عامل است (38، ۳2). یافته های تحقیق حاضر نشان میدهد که آسیب نخاعی می تواند مسیرهای مرتبط با آتروفی عضلانی را تحریک کند و در مقابل تمرینات ورزشی شنا به طور معنیداری میزان بیان ژن TWEAK، TRAF2 و Ap-1 را در گروههای تمرین در مقایسه با گروه SCI کاهش داد و 4 هفته تمرین ورزشی شنا میزان این ژنها را بهطور معنیداری کاهش میدهد. همچنین مصرف مکمل آنتیاکسیدانی مایتوکیو میتواند میزان بیان ژنهای درگیر در آتروفی عضلانی را کاهش دهد. به نظر میرسد در مطالعه حاضر بهبود ظرفیت بیوژنتیک میتوکندری و افزایش بیان PGC-1α/β به دنبال تمرینات استفامتی و فعالسازی ظرفیت آنتیاکسیدانی ناشی از تمرین ورزشی میتواند منجر به کاهش بیان ژنهای مسیر سیگنالینگ TWEAK/TRAF2/Ap-1 گردد. مطالعات اخیر نشان میدهد بهدنبال بروز SCI، بیان PGC-1β و بیان پروتئین زنجیره سنگین میوزین نیز کاهش مییابد (29). بهعلاوه این مطالعات نشان میدهد که TWEAK با سرکوب PGC-1α/β محتوای میتوکندری و ظرفیت فسفریلاسیون اکسیداتیو را در عضله اسکلتی و سایر سلولها کاهش میدهد. PGC-1α دارای یک اثر مهاری بر روی FoxO3 مرتبط با آتروفی عضلانی است که بیان آن پس از SCI افزایش مییابد و بهطور غیر مستقیم باعث بیان Atrogin-1 و MuRF1 میشود و در نتیجه منجر به آتروفی عضلانی میگردد (39). از طرف دیگر، مطالعات نشان دادند که آتروفی باعث افزایش تولید گونههای اکسیژن فعال (ROS) در عضله اسکلتی میشود (40،41). این افزایش با کاهش بیان پروتئینهای میتوکندری و کاهش تنفس میتوکندری (یعنی تولید ATP) همراه است. افزایش تولید ROS سیگنالینگ ردوکس را در فیبرهای عضلانی تغییر میدهد که میتواند پروتئولیز را افزایش دهد و سنتز پروتئین را کاهش دهد (42). همچنین، آتروفی عضلانی با کاهش کلی ظرفیت آنتیاکسیدانی در عضله اسکلتی همراه است (43). این کاهش در ظرفیت آنتیاکسیدانی احتمالا به دلیل کاهش توانایی مهار آنتیاکسیدان و نه کاهش محتوای آنزیمهای آنتیاکسیدان است (44). بهخوبی ثابت شده است که ورزش استقامتی استرس اکسیداتیو را در عضله اسکلتی افزایش میدهد. انقباض عضلانی بهطور قابلتوجهی میزان تولید ROS را در مقایسه با عضله اسکلتی در حالت استراحت افزایش میدهد (45). افزایش تولید ROS نشان داده شده است که یک مولکول سیگنالینگ قدرتمند در فعال کردن مسیرهای سیگنالینگ است. از دیگر یافتههای پژوهش حاضر، کاهش معنیدار میزان بیان ژن های TWEAK، TRAF2 و Ap-1 در گروههای مکمل در مقایسه با گروهSCI بود که نشان میدهد گروههایی که مکمل آنتیاکسیدانی مایتوکیو را مصرف کردند میزان بیان ژنهای درگیر در آتروفی عضلانی به طور معنیداری کاهش یافت که این امر خود نشان دهنده اثرات آنتیاکسیدانی این مکمل و کاهش میزان تولید ROS به عنوان یکی از محرکهای اصلی آتروفی در عضله اسکلتی است و احتمالاً این امر میتواند این مکمل را به عنوان یکی از محرکهای قوی در کاهش آتروفی عضله اسکلتی متعاقب آسیب نخاعی معرفی کند (41). لذا، حذف ROS و کاهش آسیب استرس اکسیداتیو بخشی جداییناپذیر از درمان آتروفی عضله اسکلتی پس از SCI باشد. علاوه بر این، مطالعات آزمایشگاهی ثابت کردهاند که MitoQ از مدلهای عصبی بیماری پارکینسون (PD) در برابر از دست دادن نورون مثبت، تخلیه دوپامین استریاتال، آپوپتوز عصبی و مرگ سلولی محافظت میکند (46). از یافتههای جالب توجه در پژوهش حاضر، افزایش بیان ژن ERK1 در عضله اسکلتی رتهای نر دارای آسیب نخاعی پس از 4 هفته تمرین ورزشی شنا بود. اگرچه در خصوص افزایش ERK1 ناشی از ورزش به دنبال آسیب نخاعی مکانیسم مشخصی شناسایی نشده است، اما در این راستا یو می کیم و همکاران در سال 2018 گزارش کردند که اثر همافزایی ورزش بر اثر بازسازی عصبی پیوند BMSCs از طریق فعالسازی مسیرERK1/2 در آسیب نخاعی ظاهر میشود (47). همچنین لیو و همکاران در سال 2016 گزارش کردند که فعالیت بدنی، تکثیر و تمایز سلولهای بنیادی عصبی درونزا را در هیپوکامپ موشهای مبتلا به انفارکتوس مغزی از طریق مسیر سیگنالینگ ERK افزایش میدهد (7). جیانگ و همکاران در سال 2015 نیز نشان دادند که آسیب عضلاتی، پروتئین لپین-17 یکی از عوامل بالادستی مسیر پیامدهـی ERK را فعال میکند. بارزترین مکانیسم مرتبط با نتایج مطالعه حاضر میتوان به نقش مهم سیگنالینگ ERK در مهار مرگ سلولی و کاهش تعداد و محتوی میتوکندریایی و همچنین در مهار FOXO3 و در نهایت پروتئولیز یا تخریب پروتئینی میگردد (48). از محدودیتهای مطالعه حاضر میتوان به نبود اطلاعات در مورد میزان استرس اکسیداتیو و سطوح آنتیاکسیدانهای درونزا، بایوژنز میتوکندریایی و سطوح PGC-1α/β و یا سایر عوامل آتروفیک در عضله اسکلتی و همچنین اندازهگیریهای نورشیمیایی اشاره کرد.
نتیجهگیری
تمرین ورزشی شنا و مصرف مکمل MitoQ هر کدام به تنهایی میتوانند اثرات مثبتی بر کاهش آتروفی عضله اسکلتی ناشی از آسیب نخاعی داشته باشند. تعامل 4 هفته تمرین استقامتی شنا و مصرف مکمل MitoQ شاید بتواند تاثیر بیشتری بر این فرآیند داشته باشد و به نحوی آتروفی عضلانی را در موشهای دارای آسیب نخاعی کاهش دهد. با توجه به اثرات مثبت مکمل MitoQ بهنظر میآید نیاز بیشتری به انجام تحقیقات در این زمینه وجود دارد تا مکانسیمهای احتمالی مشخص شوند.
سپاسگزاری
از پرسنل مرکز تحقیقات فیزیولوژی کرمان به خاطر حمایت های بی دریغ شان نهایت تشکر را داریم.
حامی مالی: از دانشگاه باهنر کرمان برای حمایت از پایان نامه نهایت تشکر را داریم.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شهید باهنر کرمان و دانشگاه علوم پزشکی کرمان تایید شده است (کد اخلاق IR.KMU.AEC.1402.020).
مشارکت نویسندگان
داریوش مفلحی و سهیل امینیزاده در ارائه ایده، سهیل امینیزاده و زهرا بهروزی در طراحی مطالعه، فاطمه رستگاری نسب در جمعآوری دادهها، سهیل امینیزاده و داریوش مفلحی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
آسیب نخاعی Spinal Cord Injury (SCI) یک بیماری تخریب کنندۀ عصبی است که در اثر از دست دادن نورونها یا غلاف میلین ایجاد و منجر به اختلال در سیستم عصبی-عضلانی میشود (1). میزان بروز سالانه آسیب نخاعی از یازده تا پنجاه و سه مورد در هر میلیون نفر متغیر است (2). همچنین، هزینه سیستمهای مراقبتی و بهداشتی ناشی از SCI در آمریکا، بالغ بر نه میلیارد دلار برآورد شده است (3). در بیماری آسیب نخاعی، اختلالات حسی- حرکتی (4) و متعاقب آن اختلال در انقباض عضلانی و افزایش استرس اکسیداتیو رخ میدهد (5،6). از طرفی، اختلال در عملکرد میتوکندری موجب افزایش نشانگرهای التهابی و گیرندههای آن میگردد که افزایش پروتئولیز را از طریق سیستم یوبی کوئیتین-پروتئازم به دنبال دارد (7). بنابراین، افزایش استرس اکسیداتیو، التهاب و کاهش عملکرد میتوکندری به عنوان سیگنالهای محرک بروز آتروفی عضلات اسکلتی پس از ایجاد SCI گزارش شده است (8). افزایش تولید گونههای اکسیژنی فعال (ROS) نشان داده شده است که یک مولکول سیگنالینگ قدرتمند در فعال کردن مسیرهای سیگنالینگ است. نکته مهم این است که افزایش تولید ROS به عنوان یک سیگنال قدرتمند برای فعالسازی فاکتورهای رونویسی عمل میکند که پروتئینهای آنتیاکسیدانی درونزا را افزایش میدهد (5،6). در واقع، شواهد کنونی نشان میدهد که استرس اکسیداتیو حاد که با ورزش رخ میدهد ممکن است برای سازگاریهای عضلات اسکلتی مورد نیاز باشد و افزایش بیش از حد ROS در عضله اسکلتی میتواند منجر به راهاندازی مسیر های آتروفی عضلانی باشد (۵). در این بین، فاکتور القا کنندۀ ضعیف آپوپتوز شبه فاکتور نکروز تومور آلفا (Tweak) و گیرندۀ آن فاکتور رشد فیبروبلاست 14 (Fn14) به عنوان شاخصهای محرک آتروفی عضله اسکلتی ناشی از SCI شناخته شدهاند (9). Tweak، مسیرهای پاتولوژیک زیادی از جمله کاهش میتوکندری و افزایش پروتئولیز در عضلات اسکلتی را سیگنالدهی میکند (10). همچنین فعالیت Tweak و Fn14 با فعالیت MAPK و فاکتورهای رونویسی پاییندستی از جمله ERk1 و AP-1 همراه است (9،11). مهار مسیرهای سیگنالینگ مرتبط با فرآیندهای التهابی میتواند بهطور قابلتوجهی پاسخ¬های التهابی ناشی از تخریب عصبی- عضلانی را سرکوب کند و منجر به کاهش التهاب و آتروفی عضله اسکلتی شود (12). بنابراین، مهار مسیرهای بروز آتروفی در بیماران SCI، میتواند یکی از کلیدهای اصلی مدیریت و درمان عوارض ناشی از این بیماری باشد. فعالیت ورزشی یکی از استراتژیهای درمانی برای مهار آتروفی عضله اسکلتی است (13). ورزش با افزایش جریان خون و اکسیژنرسانی میتواند استرس اکسیداتیو و پاسخهای التهابی در عضلات اسکلتی را تعدیل کند (7)، در این بین، ورزش شنا بهطور موثری با تعدیل پاسخهای التهابی میتواند اثر درمانی و توانبخشی در بیماران داشته باشد (14). شنا در محیط آبی با مسدود کردن سیگنال¬های حسی درد، موجب بهبود در ادراک حسی و کاهش آستانۀ درد و در نهایت افزایش پاسخهای بازسازی عصبی میگردد (15،16). علاوه بر این، مطالعات نشان میدهد که ورزش شنا با افزایش رشد آکسون، بازسازی عصبی را پس از آسیب بهبود میبخشد (17،18). امروزه، استفاده از مکملهای مختلف چه در حیطه ورزشی و چه در زندگی روزمره روایج زیادی یافته است و تحقیقات مختلف تجویز مکمل¬های آنتیاکسیدانی همراه با فعالیت ورزشی را به عنوان یک راهکار اثربخش معرفی کردهاند (19،20،21). MitoQ یک مکمل آنتی اکسیدانی پیشرفته است که متشکل از آنزیم Q10و یک کاتیون TPP است که میتواند حدود ۷۰۰ تا ۸۰۰ برابر بیشتر از مکمل Q10 در سطح ماتریکس میتوکندریایی تجمع کند و از این طریق با استرس اکسیداتیو میتوکندریایی که ناشی از بیماریها است مقابله کند (24-22). برخی از مطالعات فواید درمانی آنتیاکسیدانMitoQ از جمله مهار تولید بیش از حد گونه های اکسیژنی فعال (ROS) را گزارش کردهاند. (25،26). با توجه به عارضه آسیب نخاعی و مطالب ذکر شده، بهنظر میآید که بسیاری از مسیرهای سیگنالینگی فعال شده در عضله اسکلتی که میتواند منجر به آتروفی عضله اسکلتی شوند در ارتباط با ROS تولیدی در میتوکندریها هستند و این امر میتواند به وخیمتر شدن شرایط در این بیماران سرعت ببخشد. همچنین، مطالعات در زمینه اثر ورزش شنا به همراه مکملهای آنتیاکسیدانی بهویژه MitoQ بسیار محدود است. بنابراین در تحقیق حاضر دو هدف اصلی را دنبال میکنیم. در وهله اول به دنبال اثر ورزش شنا بر مسیر آتروفی عضله اسکلتی (TWEAK/TRAF2/ERK1/Ap-1) بلافاصله متعاقب آسیب نخاعی و در وهله بعدی به دنبال بررسی اثر مکمل مایتوکیو و ترکیب آن با ورزش شنا بر این فرآیند هستیم.
روش بررسی
تهیه و نگهداری حیوانات: در مطالعه تجربی حاضر، 4۰ سر موش صحرایی نر بالغ نژاد ویستار با محدوده وزنی 190 تا 210 گرم و سن تقریبی 6 تا 8 هفته از مرکز پرورش و تکثیر حیوانات آزمایشگاهی دانشگاه علوم پزشکی کرمان تهیه گردید. حیوانات در تمام دوره تحقیق تحت شرایط استاندارد کار با حیوانات، شامل آب و غذای سالم و در دسترس، دمای هوای 22 تا 24 درجه سانتیگراد، رطوبت نسبی 55 تا 60 درصد، چرخه روشنایی و تاریکی 12 به 12 ساعت در قفسهای پلیاتیلن ساخت شرکت تجهیز گستر ایرانیان (تعداد 5 سر در هر قفس) در حیوان خانه مرکز تحقیقات فیزیولوژی کرمان نگهداری شدند. تمام اصول اخلاقی کار با حیوانات آزمایشگاهی در این تحقیق تحت نظارت کمیته اخلاق دانشگاه علوم پزشکی کرمان رعایت گردید.
القا بیماری و طرح پژوهش: پس از آشناسازی با محیط آزمایشگاه، حیوانات با استفاده از تزریق درون صفاقی کتامین (100 میلیگرم در کیلوگرم) و زایلازین (10 میلیگرم در کیلوگرم) بیهوش شدند. سپس حیوانات بر روی شکم قرار داده شدند و پوست ناحیه پشت تراشیده و با بتادین ضدعفونی گردید. پس از آن برشی در سطح T11 تا T12 ایجاد و لامینکتومی در محل اتصال مهرههای T11 و T12 بدون آسیب رساندن به سخت شامه انجام گردید (19). پس از تایید SCI، بهوسیله تست BBB (در محدوده ۰ تا ۵) حیوانات به روش تصادفی در ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
پروتکل ورزش شنا: حیوانات پس از آشنایی با محیط آب، به مدت 4 هفته، هر هفته 5 جلسه و هر جلسه به مدت 30 دقیقه در قالب ۶ ست ۵ دقیقهای در استخر شنا ورزش، تمرین شنا را انجام دادند. در هفته ابتدایی تعداد ستهای تمرینی ۳ ست، ۵ دقیقه یا بود و بتدریج به تعداد ستهای تمرینی با توجه به وضعیت تمرینی موشها اضافه شد. حین انجام تمرینات ورزشی شنا سعی شد که اضافه بار با دقت زیادی اعمال شود تا با توجه به محدودیت جسمانی موشها، تلفات ناشی از غرق شدگی در آب استخر به حداقل برسد. دمای آب برای تمرین شنا ۲۵ تا ۳۳ درجه سانتیگراد در نظر گرفته شد (19).
پروتکل مصرف مکمل MitoQ: طی مطالعه حاضر، حیوانات، مکمل مایتوکیو با برند تجاری MitoQساخت کشور نیوزلند را به مدت 4 هفته به صورت محلول در آب خوراکی با دوز۲۵۰ میکرومولار دریافت کردند (27).
تشریح و نمونهبرداری: پس از پایان 4 هفته تمرین شنا و مکمل دهی، حیوانات با استفاده از کتامین (۷۵ میلیگرم/کیلوگرم) و زایلازین (۱۰ میلی گرم/کیلوگرم) بیهوش شدند و سپس عضله دو قلوی میانی حیوانات جدا گردید و در نیتروژن مایع قرار داده شد و به منظور انجام روش بیان ژن در تیوب ها به فریزر 70- منتقل شد.
اندازهگیری بیان ژن: استخراج RNA تام مطابق با پروتکل کیت شرکت سیناکلون انجام شد. برای ارزیابی بیان ژن،50 میلیگرم از بافت عضله اسکلتی دوقلو برداشته شد. بافتها بـه روش هاونکوبی در نیتروژن مایع بهطور کامل پودر شدند. به منظور جدا کردن ساختارهای پروتئینی، بافت هموژن شده در دمای ۴ درجه سانتیگراد در دور ۱۲۰۰۰ به مدت ۱۰ دقیقه سانتریفیوژ (سانتیرفیوژ یخچال دار-اپندورف آلمان) شد و سوپرناتانت برداشته و با نسبت 1 به 0/5 با بافر مخصوص کیت مخلوط و به مدّت 15 ثانیـه به شدت تکـان داده شـد. سپس محلول مورد نظر در دمای ۴ درجه سانتیگراد، به مدت ۱۵ دقیقه در ۱۲۰۰۰ دور سانتریفیوژ و بخش معدنی و آبـی از هم جدا گردید. بخش محتوی RNA برداشته و با نسـبت 1 بـه 0/5 با بافر شستوشو مخلوط و سـپس در دمای ۴ درجه سانتیگراد، به مدت ۱۰ دقیقه در ۱۲۰۰۰ دور سـانتریفیوژ شـدند. سپس پلت حــاوی RNA در اتــانول شستشــو و در ۲۰ لاندا آب مقطر حل گردید. غلظت RNA با استفاده از دستگاه ترموسایکلر (Nanodrop) سنجیده و نسبت 260 به 280 بـین 1/8 تـا 2 بهعنوان تخلیص مطلوب تعریف گردید. سنتز cDNA با استفاده از یک لاندا RNA و با استفاده از Random hexamer primer و آنزیم Mulv Reverse transcriptase انجام گرفت. Real time–PCR با استفاده از غلظت Premix syber green II (امپلیکون-دانمارک) و با استفاده از غلظت ۱۰۰ نانوگرم از cDNA انجـام گرفـت. از 18S بهعنوان ژن کنترل استفاده گردید. کارایی پرایمرهای تحقیـق در قیـاس بـا پرایمر ژن کنترل با انجام Real time-PCR (دستگاه ریل تایم- ABI آمریکا) با غلظتهای سریالی از cDNA هر ژن بهصورت جداگانـه سـنجیده شـد. برنامه مورد استفاده در Real time شامل: 95 درجه سانتیگراد به مدّت 10 دقیقه، 95 درجه سانتیگراد به مدت 15 ثانیه، 60 درجه سانتیگراد به مدت 1 دقیقه (تکرار چرخه 40) بود. میزان بیان ژنهـای TWEAK، TRAF2، ERK1 و AP-1 بـا روش-∆∆CT ۲ اندازهگیری شد (جدول ۱) (19،27).
جدول 1: توالی پرایم های متغیرهای پژوهش

تجزیه و تحلیل آماری
در پژوهش حاضر، طبیعی بودن توزیع داده ها از طریق آزمون کولموگروف-اسمیرنف بررسی گردید. سپس از آنالیز آماری آنالیز واریانس یک راهه و آزمون پیگیری جهت مقایسه بیان mRNA در گروههای پژوهش استفاده گردید. همه آنالیزها با استفاده نرمافزار SPSS version 16در سطح معنیداری P < 0.05 اجرا گردید.
نتایج
یافتههای حاصل از آزمون آماری one-way ANOVA نشان داد که به دنبال 4 هفته تمرین استقامتی شنا و مصرف مکمل MitoQ تغییرات معنیداری در mRNA TWEAK
(0/001=P؛ 23/294=F)، TRAF2 (P=0/001؛ 57/158=F) و Ap-1 (P=0/001؛ 99/434=F)در عضله اسکلتی رتهای نر دچار آسیب نخاعی مشاهده گردید (p<0.05). نتایج آزمون پیگیری نشان میدهد بین سطوح mRNA TWEAK گروه شم با گروه آسیب، گروه آسیب +تمرین با گروه آسیب، گروه آسیب+مکمل با گروه آسیب و گروه آسیب+تمرین+مکمل با گروه آسیب تفاوت معنیداری مشاهده میشود (p<0.05). همچنین بین مقادیر mRNA TARF2 گروه شم با گروه آسیب، گروه آسیب+تمرین با گروه آسیب، گروه آسیب+ مکمل با گروه آسیب و گروه آسیب+تمرین+مکمل با گروه آسیب تفاوت معنیداری مشاهده میشود (p<0.05). بهعلاوه بین مقادیر mRNA AP-1 گروه شم با گروه آسیب، گروه آسیب+تمرین با گروه آسیب و گروه آسیب+مکمل با گروه آسیب و گروه آسیب+تمرین+مکمل با گروه آسیب تفاوت معنیداری وجود دارد (P<0.05)(نمودار 1،3،4). از طرف دیگر یافتههای پژوهش نشان داد که تغییرات معنیداری در mRNA ERK1 به دنبال تمرین استقامتی شنا و مصرف مکمل MitoQ در عضله اسکلتی رتهای نر دچار آسیب نخاعی مشاهده نگردید(P=0/001؛ 23/294=F) (نمودار 2). با این حال نتایج آزمون پیگیری نشان داد که بین مقادیر mRNA ERK1 گروه آسیب+تمرین با گروه شم تفاوت معنی داری وجود دارد (P<0.05).

نمودار 1: بیان نسبی ژن TWEAK در گروههای مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
* تفاوت معنیدار نسبت به گروه آسیب نخاعی.

نمودار 2: بیان نسبی ژن TARF2 در گروه های مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
* تفاوت معنیدار نسبت به گروه آسیب نخاعی. α تفاوت معنیدار نسبت به گروه تمرین + مکمل. & تفاوت معنیدار نسبت به گروه تمرین + مکمل.

نمودار ۳: بیان نسبی ژن ERK1 در گروههای مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند. α تفاوت معنیدار نسبت به گروه آسیب نخاعی.

نمودار ۳: بیان نسبی ژن AP-1 در گروه های مختلف. ۵ گروه (8n=) 1) شم، 2) آسیب نخاعی (Spinal Cord Injury: SCI)، 3) آسیب نخاعی و مکمل MitoQ، 4) آسیب نخاعی و ورزش شنا و 5) آسیب نخاعی و شنا و مکمل MitoQ تقسیم شدند.
* تفاوت معنیدار نسبت به گروه آسیب نخاعی. α تفاوت معنیدار نسبت به گروه تمرین + مکمل. & تفاوت معنیدار نسبت به گروه تمرین +مکمل.
بحث
نتایج تحقیق حاضر نشان میدهد پس از وقوع SCI میزان بیان ژن شاخصهای TWEAK، TRAF2 وAp-1 بهطور معنیداری در گروه آسیب نخاعی در مقایسه با گروه کنترل افزایش مییابد و این تغییرات احتمالا نشاندهنده شروع فرآیندهای آتروفی عضلانی است. در مقابل، یافتههای پژوهش حاضر نشان داد که تمرین ورزشی شنا و مصرف مکمل MitoQ میتواند منجر به کاهش بیان ژنهای TWEAK، TRAF2 و AP-1 در عضله دوقلوی میانی موشهای نر دچار آسیب نخاعی گردد. به دنبال آسیب نخاعی و قطع ارتباط عصبی با توجه به شدت آسیب، تخریب عصب سوماتیک و قطع عصبدهی عضله اسکلتی صورت میگیرد و با بروز تغییرات فیزیولوژیکی، بیوشیمیایی و بیومکانیکی، عملکرد حرکتی در بیماران مختل میگردد (28). آسیب نخاعی و به دنبال آن مهار نورونهای حرکتی α باعث تسریع فرآیند آتروفی عضلات اسکلتی میگردد (29). مطالعه روی موشها نشان میدهد که SCI منجر به کاهش قابلتوجهی در سطح مقطع عضلانی، وزن عضلانی و قدرت عضلانی در 7 تا 21 روز پس از بیحرکتی میشود و این تغییرات نشان میدهد که ورودی عصبی و بار مکانیکی اثر ترکیبی بر جرم و قدرت عضله اسکلتی پس از SCI دارند (30). یکی از مسیرهایی که نقش اساسی در آتروفی عضله اسکلتی پس از آسیب نخاعی دارد القا کننده ضعیف آپوپتوز شبه فاکتور نکروز تومور آلفا TWEAK)) و گیرنده آن از فاکتور رشد فیبروبلاستFn14 است (31،32). در واقع TWEAK بهعنوان یکی از شاخصهای بالادستی، یک واسطه ضروری التهاب مزمن و تغییرات فیبروتیک در عضله اسکلتی پس از آسیب نخاعی است (33). از یک طرف، TWEAK فرایند متابولیک اکسیداتیو طبیعی در عضله اسکلتی را با فعال کردن NF-κb مهار می کند، بنابراین باعث آسیب استرس اکسیداتیو میشود (34). از سوی دیگر، TWEAK می تواند سیگنالینگ NF-κB و سایر مسیرهای پروتئولیتیک را فعالکند و مسیر اتوفاژی را فعال کند، پروتئولیز عضلانی را القا کند و مانع از تکثیر میوبلاستها شود، در نتیجه مانع بازسازی فیبرهای عضلانی اسکلتی میشود (35). علاوه بر این، TWEAKتوانایی سلولهای عضلانی اسکلتی را برای مقاومت در برابر استرس اکسیداتیو تضعیف میکند (9)، و باعث اختلال متابولیک در سلولهای عضلانی اسکلتی می شود (36). TWEAK و NF-κB هر دو به صورت ترکیبی در مسیر سیگنالینگ TARF1/6، TAK1، TAB2/3، ERK1/2 و در نهایت AP1 و NK-κB در فرایند اتروفی عضله اسکلتی عمل میکنند (37). در این راستا، یارار-فیشر در سال 2016 نشان دادند که سطح بیانTWEAK ، Fn14 و NK-κB در عضله اسکلتی بیماران مبتلا به SCI بهطور قابلتوجهی افزایش یافته است و به دنبال آن درجه فیبروز عضلانی نیز به طور قابل توجهی افزایش یافته است، که نشاندهنده ارتباط نزدیک این دو عامل است (38، ۳2). یافته های تحقیق حاضر نشان میدهد که آسیب نخاعی می تواند مسیرهای مرتبط با آتروفی عضلانی را تحریک کند و در مقابل تمرینات ورزشی شنا به طور معنیداری میزان بیان ژن TWEAK، TRAF2 و Ap-1 را در گروههای تمرین در مقایسه با گروه SCI کاهش داد و 4 هفته تمرین ورزشی شنا میزان این ژنها را بهطور معنیداری کاهش میدهد. همچنین مصرف مکمل آنتیاکسیدانی مایتوکیو میتواند میزان بیان ژنهای درگیر در آتروفی عضلانی را کاهش دهد. به نظر میرسد در مطالعه حاضر بهبود ظرفیت بیوژنتیک میتوکندری و افزایش بیان PGC-1α/β به دنبال تمرینات استفامتی و فعالسازی ظرفیت آنتیاکسیدانی ناشی از تمرین ورزشی میتواند منجر به کاهش بیان ژنهای مسیر سیگنالینگ TWEAK/TRAF2/Ap-1 گردد. مطالعات اخیر نشان میدهد بهدنبال بروز SCI، بیان PGC-1β و بیان پروتئین زنجیره سنگین میوزین نیز کاهش مییابد (29). بهعلاوه این مطالعات نشان میدهد که TWEAK با سرکوب PGC-1α/β محتوای میتوکندری و ظرفیت فسفریلاسیون اکسیداتیو را در عضله اسکلتی و سایر سلولها کاهش میدهد. PGC-1α دارای یک اثر مهاری بر روی FoxO3 مرتبط با آتروفی عضلانی است که بیان آن پس از SCI افزایش مییابد و بهطور غیر مستقیم باعث بیان Atrogin-1 و MuRF1 میشود و در نتیجه منجر به آتروفی عضلانی میگردد (39). از طرف دیگر، مطالعات نشان دادند که آتروفی باعث افزایش تولید گونههای اکسیژن فعال (ROS) در عضله اسکلتی میشود (40،41). این افزایش با کاهش بیان پروتئینهای میتوکندری و کاهش تنفس میتوکندری (یعنی تولید ATP) همراه است. افزایش تولید ROS سیگنالینگ ردوکس را در فیبرهای عضلانی تغییر میدهد که میتواند پروتئولیز را افزایش دهد و سنتز پروتئین را کاهش دهد (42). همچنین، آتروفی عضلانی با کاهش کلی ظرفیت آنتیاکسیدانی در عضله اسکلتی همراه است (43). این کاهش در ظرفیت آنتیاکسیدانی احتمالا به دلیل کاهش توانایی مهار آنتیاکسیدان و نه کاهش محتوای آنزیمهای آنتیاکسیدان است (44). بهخوبی ثابت شده است که ورزش استقامتی استرس اکسیداتیو را در عضله اسکلتی افزایش میدهد. انقباض عضلانی بهطور قابلتوجهی میزان تولید ROS را در مقایسه با عضله اسکلتی در حالت استراحت افزایش میدهد (45). افزایش تولید ROS نشان داده شده است که یک مولکول سیگنالینگ قدرتمند در فعال کردن مسیرهای سیگنالینگ است. از دیگر یافتههای پژوهش حاضر، کاهش معنیدار میزان بیان ژن های TWEAK، TRAF2 و Ap-1 در گروههای مکمل در مقایسه با گروهSCI بود که نشان میدهد گروههایی که مکمل آنتیاکسیدانی مایتوکیو را مصرف کردند میزان بیان ژنهای درگیر در آتروفی عضلانی به طور معنیداری کاهش یافت که این امر خود نشان دهنده اثرات آنتیاکسیدانی این مکمل و کاهش میزان تولید ROS به عنوان یکی از محرکهای اصلی آتروفی در عضله اسکلتی است و احتمالاً این امر میتواند این مکمل را به عنوان یکی از محرکهای قوی در کاهش آتروفی عضله اسکلتی متعاقب آسیب نخاعی معرفی کند (41). لذا، حذف ROS و کاهش آسیب استرس اکسیداتیو بخشی جداییناپذیر از درمان آتروفی عضله اسکلتی پس از SCI باشد. علاوه بر این، مطالعات آزمایشگاهی ثابت کردهاند که MitoQ از مدلهای عصبی بیماری پارکینسون (PD) در برابر از دست دادن نورون مثبت، تخلیه دوپامین استریاتال، آپوپتوز عصبی و مرگ سلولی محافظت میکند (46). از یافتههای جالب توجه در پژوهش حاضر، افزایش بیان ژن ERK1 در عضله اسکلتی رتهای نر دارای آسیب نخاعی پس از 4 هفته تمرین ورزشی شنا بود. اگرچه در خصوص افزایش ERK1 ناشی از ورزش به دنبال آسیب نخاعی مکانیسم مشخصی شناسایی نشده است، اما در این راستا یو می کیم و همکاران در سال 2018 گزارش کردند که اثر همافزایی ورزش بر اثر بازسازی عصبی پیوند BMSCs از طریق فعالسازی مسیرERK1/2 در آسیب نخاعی ظاهر میشود (47). همچنین لیو و همکاران در سال 2016 گزارش کردند که فعالیت بدنی، تکثیر و تمایز سلولهای بنیادی عصبی درونزا را در هیپوکامپ موشهای مبتلا به انفارکتوس مغزی از طریق مسیر سیگنالینگ ERK افزایش میدهد (7). جیانگ و همکاران در سال 2015 نیز نشان دادند که آسیب عضلاتی، پروتئین لپین-17 یکی از عوامل بالادستی مسیر پیامدهـی ERK را فعال میکند. بارزترین مکانیسم مرتبط با نتایج مطالعه حاضر میتوان به نقش مهم سیگنالینگ ERK در مهار مرگ سلولی و کاهش تعداد و محتوی میتوکندریایی و همچنین در مهار FOXO3 و در نهایت پروتئولیز یا تخریب پروتئینی میگردد (48). از محدودیتهای مطالعه حاضر میتوان به نبود اطلاعات در مورد میزان استرس اکسیداتیو و سطوح آنتیاکسیدانهای درونزا، بایوژنز میتوکندریایی و سطوح PGC-1α/β و یا سایر عوامل آتروفیک در عضله اسکلتی و همچنین اندازهگیریهای نورشیمیایی اشاره کرد.
نتیجهگیری
تمرین ورزشی شنا و مصرف مکمل MitoQ هر کدام به تنهایی میتوانند اثرات مثبتی بر کاهش آتروفی عضله اسکلتی ناشی از آسیب نخاعی داشته باشند. تعامل 4 هفته تمرین استقامتی شنا و مصرف مکمل MitoQ شاید بتواند تاثیر بیشتری بر این فرآیند داشته باشد و به نحوی آتروفی عضلانی را در موشهای دارای آسیب نخاعی کاهش دهد. با توجه به اثرات مثبت مکمل MitoQ بهنظر میآید نیاز بیشتری به انجام تحقیقات در این زمینه وجود دارد تا مکانسیمهای احتمالی مشخص شوند.
سپاسگزاری
از پرسنل مرکز تحقیقات فیزیولوژی کرمان به خاطر حمایت های بی دریغ شان نهایت تشکر را داریم.
حامی مالی: از دانشگاه باهنر کرمان برای حمایت از پایان نامه نهایت تشکر را داریم.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه شهید باهنر کرمان و دانشگاه علوم پزشکی کرمان تایید شده است (کد اخلاق IR.KMU.AEC.1402.020).
مشارکت نویسندگان
داریوش مفلحی و سهیل امینیزاده در ارائه ایده، سهیل امینیزاده و زهرا بهروزی در طراحی مطالعه، فاطمه رستگاری نسب در جمعآوری دادهها، سهیل امینیزاده و داریوش مفلحی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Meng Q, Chen Z, Gao Q, Hu L, Li Q, Li S, et al. Rosiglitazone Ameliorates Spinal Cord Injury Via Inhibiting Mitophagy and Inflammation of Neural Stem Cells. Oxid Med Cell Longev 2022; 2022(1): 5583512.
2- Liu Y, Yang X, He Z, Li J, Li Y, Wu Y, et al. Spinal Cord Injury: Global Burden from 1990 to 2019 and Projections Up to 2030 Using Bayesian Age-Period-Cohort Analysis. Front Neurol 2023; 14: 1304153.
3- Safdarian M, Trinka E, Rahimi-Movaghar V, Thomschewski A, Aali A, Abady GG, et al. Global, Regional, and National Burden of Spinal Cord Injury, 1990–2019: A Systematic Analysis for the Global Burden of Disease Study 2019. Lancet Neurol 2023; 22(11): 1026-47.
4- Tian T, Zhang S, Yang M. Recent Progress and Challenges in the Treatment of Spinal Cord Injury. Protein Cell 2023; 14(9): 635-52.
5- Ji LL, Yeo D, Kang C, Zhang T. The Role of Mitochondria in Redox Signaling of Muscle Homeostasis. J Sport Health Sci 2020; 9(5): 386-93.
6- P. Drasites K, Shams R, Zaman V, Matzelle DC. Shields DP. Garner D, et al. Pathophysiology, Biomarkers, And Therapeutic Modalities Associated with Skeletal Muscle Loss Following Spinal Cord Injury. Brain Sci 2020; 10(12): 933.
7- Fu J, Wang H, Deng L, Li J. Exercise Training Promotes Functional Recovery after Spinal Cord Injury. Neural Plast 2016; 2016(1): 4039580.
8- Huang T, Shen J, Bao B, Hu W, Sun Y, Zhu T, et al. Mitochondrial-Targeting Antioxidant Mitoq Modulates Angiogenesis and Promotes Functional Recovery after Spinal Cord Injury. Brain Res 2022; 1786: 147902.
9- Sato S, Ogura Y, Kumar A. TWEAK/Fn14 Signaling Axis Mediates Skeletal Muscle Atrophy and Metabolic Dysfunction. Front Immunol 2014; 5: 18.
10- Xu X, Talifu Z, Zhang CJ, Gao F, Ke H, Pan YZ, et al. Mechanism of Skeletal Muscle Atrophy after Spinal Cord Injury: A Narrative Review. Front Nutrit 2023; 10: 1099143.
11- Webster JM, Kempen LJ, Hardy RS, Langen RC. Inflammation and Skeletal Muscle Wasting During Cachexia. Front physiol 2020; 11: 597675.
12- Ji Y, Li M, Chang M, Liu R, Qiu J, Wang K, et al. Inflammation: Roles in Skeletal Muscle Atrophy. Antioxidants 2022; 11(9): 1686.
13- Huang L, Li M, Deng C, Qiu J, Wang K, Chang M, et al. Potential Therapeutic Strategies for Skeletal Muscle Atrophy. Antioxidants (Basel) 2022; 12(1): 44.
14- Liao CF, Yang TY, Chen YH, Yao CH, Way TD, Chen YS. Effects of Swimming Exercise on Nerve Regeneration in a Rat Sciatic Nerve Transection Model. BioMedicine 2017; 7(1): 3.
15- Andrade IR, Nakachima LR, Fernandes M, Fernandes CH, Santos JB, Valente SG. Assessment of the Effects of Swimming as a Postoperative Rehabilitation on Nerve Regeneration of Wistar Rats Submitted to Grafting of Autologous Nerves after Injury to the Sciatic Nerve. Rev Bras Ortop (Sao Paulo) 2020; 55(3): 323-28.
16- Coyoy-Salgado A, Segura-Uribe JJ, Guerra-Araiza C, Orozco-Suárez S, Salgado-Ceballos H, Feria-Romero IA, et al. The Importance of Natural Antioxidants in the Treatment of Spinal Cord Injury in Animal Models: An Overview. Oxid Med Cell Longev 2019; 2019: 3642491.
17- Hashem R, Arshadi S, Banaei Far A, Haji Rasouli M. The Effect of 12-Week Aerobic Trainings on Mitochondrial Biogenesis Indicators in Skeletal Muscle among Male Rats. Med J Tabriz Uni Med Sciences Health Services 2020; 42(3): 348-55. [Persian]
18- Morgan DW, Stevens SL. Use of Water-And Land-Based Gait Training to Improve Walking Capacity in Adults with Complete Spinal Cord Injury: A Pilot Study. J Spinal Cord Med 2024; 47(3): 404-11.
19- Sharifi M, Moflehi D, Aminizadeh S, Aveseh M. Effect of Endurance Training and MitoQ on Expression of PGC-1α, ERR-α, MCAD, and CPT-1α Genes in Skeletal Muscle of Male Wistar Rats. J Mazandaran Univ Med Sci 2022; 32(215): 14-25. [Persian]
20- Afrooz S, Moflahi D, Aminizadeh S. Effect of 4 Weeks of Endurance Swimming Training and Mitoq Supplementation on TLR4/NF-Κb/Tnfα Signaling Pathway in the Spinal Cord of Male Wistar Rats with Spinal Cord Injury. JPRS 2023; 2(15): 175-63. [Persian]
21- Huang L, Li M, Deng C, Qiu J, Wang K, Chang M, et al. Potential Therapeutic Strategies for Skeletal Muscle Atrophy. Antioxidants 2022; 12(1): 44.
22- Shafahi MJ, Salesi M, Rezaei R, Daryanoosh F. The Effect of Eight-Weeks of Resistance Training a Long with Coenzyme Q10 Supplementation on Some Factors of Mitochondrial Biogenesis in Young Male Rats. Journal of Practical Studies of Biosciences in Sport 2022; 10(23): 54-63. [Persian]
23- Kuang J, McGinley C, Lee MJ, Saner NJ, Garnham A, Bishop DJ. Interpretation of Exercise-Induced Changes in Human Skeletal Muscle Mrna Expression Depends on the Timing of the Post-Exercise Biopsies. PeerJ 2022; 10: e12856.
24- Sulaimon LA, Afolabi LO, Adisa RA, Ayankojo AG, Afolabi MO, Adewolu AM. Pharmacological Significance of Mitoq in Ameliorating Mitochondria-Related Diseases. Advances in Redox Research 2022; 5: 100037.
25- Huang T, Shen J, Bao B, Hu W, Sun Y, Zhu T, et al. Mitochondrial-Targeting Antioxidant Mitoq Modulates Angiogenesis and Promotes Functional Recovery after Spinal Cord Injury. Brain Research 2022; 1786: 147902.
26- Gutierrez-Mariscal FM, Arenas-de Larriva AP, Limia-Perez L, Romero-Cabrera JL, Yubero-Serrano EM, López-Miranda J. Coenzyme Q10 Supplementation for The Reduction of Oxidative Stress: Clinical Implications in the Treatment of Chronic Diseases. Int J Mol Sci 2020; 21(21): 7870.
27- Rostamzadeh F, Najafipour H, Aminizadeh S, Jafari E. Therapeutic Effects of the Combination of Moderate-Intensity Endurance Training and Mitoq Supplementation in Rats with Isoproterenol-Induced Myocardial Injury: The Role of Mitochondrial Fusion, Fission, and Mitophagy. Biomed Pharmacother 2024; 170: 116020. [Persian]
28- Baligand C, Chen YW, Ye F, Pandey SN, Lai SH, Liu M, et al. Transcriptional Pathways Associated with Skeletal Muscle Changes after Spinal Cord Injury and Treadmill Locomotor Training. Biomed Res Int 2015; 2015: 387090.
29- Higashino K, Matsuura T, Suganuma K, Yukata K, Nishisho T, Yasui N. Early Changes in Muscle Atrophy and Muscle Fiber Type Conversion after Spinal Cord Transection and Peripheral Nerve Transection in Rats. J Neuroeng Rehabil 2013; 10: 46.
30- Otzel DM, Lee J, Ye F, Borst SE, Yarrow JF. Activity-Based Physical Rehabilitation with Adjuvant Testosterone to Promote Neuromuscular Recovery after Spinal Cord Injury. Int J Mol Sci 2018; 19(6): 1701
31- Lin S, Zhou Z, Zhao H, Xu C, Guo Y, Gao S, et al. TNF Promotes M1 Polarization Through Mitochondrial Metabolism in Injured Spinal Cord. Free Radic Biol Med 2021; 172: 622-32.
32- Yarar-Fisher C, Bickel CS, Kelly NA, Stec MJ, Windham ST, McLain AB, et al. Heightened TWEAK-NF-Κb Signaling and Inflammation-Associated Fibrosis in Paralyzed Muscles of Men with Chronic Spinal Cord Injury. Am J Physiol Endocrinol Metab 2016; 310(9): E754-61.
33- Howard EE, Pasiakos SM, Blesso CN, Fussell MA, Rodriguez NR. Divergent Roles of Inflammation in Skeletal Muscle Recovery from Injury. Front Physiol 2020; 11: 87.
34- Invernizzi M, De Sire A, Renò F, Cisari C, Runza L, Baricich A, et al. Spinal Cord Injury as a Model of Bone-Muscle Interactions: Therapeutic Implications from in Vitro and in Vivo Studies. Front Endocrinol (Lausanne) 2020; 11: 204.
35- Stratos I, Behrendt AK, Anselm C, Gonzalez A, Mittlmeier T, Vollmar B. Inhibition of TNF-Α Restores Muscle Force, Inhibits Inflammation, and Reduces Apoptosis of Traumatized Skeletal Muscles. Cells 2022; 11(15): 2397.
36- Pascoe AL, Johnston AJ, Murphy RM. Controversies in TWEAK-Fn14 Signaling in Skeletal Muscle Atrophy and Regeneration. Cell Mol Life Sci 2020; 77(17): 3369-81.
37- Baehr LM, Hughes DC, Waddell DS, Bodine SC. Snapshot: Skeletal Muscle Atrophy. Cell 2022; 185(9): 1618.
38- Mittal A, Bhatnagar S, Kumar A, Lach-Trifilieff E, Wauters S, Li H, et al. The TWEAK–Fn14 System Is a Critical Regulator of Denervation-Induced Skeletal Muscle Atrophy in Mice. J cell Biology 2010; 188(6): 833-46.
39- Marzetti E, Calvani R, Cesari M, Buford TW, Lorenzi M, Behnke BJ, et al. Mitochondrial Dysfunction and Sarcopenia of Aging: From Signaling Pathways to Clinical Trials. Int J Biochem Cell Biol 2013; 45(10): 2288-301.
40- Bernacchioni C, Ghini V, Squecco R, Idrizaj E, Garella R, Puliti E, et al. Role of Sphingosine 1-Phosphate Signalling Axis in Muscle Atrophy Induced by Tnfα in C2C12 Myotubes. Int J Mol Sci 2021; 22(3): 1280.
41- Abrigo J, Simon F, Cabrera D, Vilos C, Cabello-Verrugio C. Mitochondrial Dysfunction in Skeletal Muscle Pathologies. Curr Protein Pept Sci 2019; 20(6): 536-46.
42- Savikj M, Kostovski E, Lundell LS, Iversen PO, Massart J, Widegren U. Altered Oxidative Stress and Antioxidant Defence in Skeletal Muscle During the First Year Following Spinal Cord Injury. Physiol Rep 2019; 7(16): e14218.
43- Wang D, Yang Y, Zou X, Zhang J, Zheng Z, Wang Z. Antioxidant Apigenin Relieves Age-Related Muscle Atrophy by Inhibiting Oxidative Stress and Hyperactive Mitophagy and Apoptosis in Skeletal Muscle of Mice. J Gerontol a Biol Sci Med Sci 2020; 75(11): 2081-8.
44- Liu T, Sun L, Zhang Y, Wang Y, Zheng J. Imbalanced GSH/ROS And Sequential Cell Death. J Biochem Mol Toxicol 2022; 36(1): e22942.
45- Sakellariou GK, Pearson T, Lightfoot AP, Nye GA, Wells N, Giakoumaki II, et al. Long-Term Administration of the Mitochondria-Targeted Antioxidant Mitoquinone Mesylate Fails to Attenuate Age-Related Oxidative Damage or Rescue the Loss of Muscle Mass and Function Associated with Aging of Skeletal Muscle. FASEB J 2016; 30(11): 3771-85.
46- Ghosh A, Chandran K, Kalivendi SV, Joseph J, Antholine WE, Hillard CJ, et al. Neuroprotection by a Mitochondria-Targeted Drug in a Parkinson's Disease Model. Free Radic Biol Med 2010; 49(11): 1674-84
47- You-Mi Kim, Jun-Jang Jin, Sam-Jun Lee, Tae-Beom Seo, Eun-Sang Ji. Treadmil Exercise with Bone Marrow Stromal Celles Transplantation Facilitates Neuroprotective Effect Through BDNF-ERK1/2 Pathway in Spinal Cord Injury Rats. J Exerc Rehabil 2018; 14(3): 335-40.
48- Sandri M, Lin J, Handschin C, Yang W, Arany ZP, Lecker SH, et al. PGC-1α Protects Skeletal Muscle from Atrophy by Suppressing Foxo3 Action and Atrophy-Specific Gene Transcription. Proc Natl Acad Sci USA 2006; 103(44): 16260-5.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/6/19 | پذیرش: 1404/1/15 | انتشار: 1404/1/15
دریافت: 1403/6/19 | پذیرش: 1404/1/15 | انتشار: 1404/1/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







