دوره 32، شماره 12 - ( اسفند 1403 )
جلد 32 شماره 12 صفحات 8511-8498 |
برگشت به فهرست نسخه ها
Ethics code: IR. UMAREC.1402.88
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
PourRahim Ghouroghchi A, Valizadeh Orange A. Effect of Eight Weeks of Combined (Resistance - Endurance) Training and Taurine Supplementation on Protein Expression of LXR Receptors and Total Cholesterol Serum Level in Diabetic Male Wistar Rats. JSSU 2025; 32 (12) :8498-8511
URL: http://jssu.ssu.ac.ir/article-1-6260-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6260-fa.html
پوررحیم قورقچی آمنه، ولیزاده اورنج آیدین. اثر هشت هفته تمرین ترکیبی (مقاومتی- استقامتی) و مصرف مکمل تورین بر بیان پروتئین گیرندههای LXR و سطح سرمی کلسترول تام در موشهای صحرایی نر ویستار دیابتی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (12) :8498-8511
واژههای کلیدی: تمرین مقاومتی- استقامتی، مکمل تورین، بیان پروتئین گیرنده LXR کبدی، کلسترول تام سرمی، موشهای دیابتی
متن کامل [PDF 899 kb]
(284 دریافت)
| چکیده (HTML) (1197 مشاهده)
متن کامل: (241 مشاهده)
مقدمه
بیماری دیابت نوعی سندروم متابولیک است که با هایپرگلیسمی، کاهش حساسیت به انسولین و افزایش مقاومت به انسولین مشخص میشود (1). انجام تمرینهای ورزشی ترکیبی (مقاومتی- استقامتی) و مکمل تورین سبب بهبود متابولیسم گلوکز و چربی شده و انتقال بهتر گلوکز به عضلات را به همراه دارد (5-2). گیرندههای ایکس کبدی (LXRs) نقش مهمی را در متابولیسم گلوکز، هموستاز کلسترول، متابولیسم اسیدهای صفراوی و لیپوژنز در هپاتوسیتها بر عهده دارد (6). فعالسازی LXR باعث افزایش بیان ژنهای درگیر در هموستاز کلسترول از جمله ABCA1 میشود که نقش مهمی در افزایش بازسازی HDL دارد، بهطوریکه ABCA1، کلسترول و فسفولیپیدها را از غشای پلاسما به آپو لیپوپروتئین A1 (ApoA1) انتقال میدهد. این انتقال دهندهها نقش مهمی در تشکیل ذرات HDL نابالغ کبدی ایفا میکنند (10-7). فعالسازی LXR اثرات مفیدی بر کنترل اختلالات متابولیک دارد؛ بهطوریکه در مدلهای حیوانی دیابت، تحمل گلوکز را بهبود میبخشد (15-11). با توجه به اثرات مفید، LXR به عنوان یک هدف دارویی برای کنترل اختلالات متابولیک از جمله دیابت نوع دو؛ شناسایی، تقویت و بهبود عوامل درگیر در درمان و پیشگیری از پیشرفت بیماری دیابت و اختلالات ناشی از آن و همچنین کاهش هزینه¬های درمانی اهمیت فراوانی دارد (6،7،15). کالج پزشکی- ورزشی آمریکا تأیید کرده است که برنامههای توانبخشی برای بیماران دیابتی بهتر است ترکیبی از تمرینات مقاومتی و استقامتی باشد که اثرات مفید هر دو نوع تمرین را نیز دربر دارد (17،16). تمرین ترکیبی مقاومتی- استقامتی منجر به کاهش قابلتوجهی در مقاومت انسولینی و بهبود تحمل گلوکز، کاهش سطوح شاخص توده بدنی و نسبت دور کمر به لگن میشود و میتواند اثرات مفیدی بر کاهش نیمرخ لیپیدی، کلسترول و LDL در بیماران دیابتی داشته باشد (17). تورین (2- آمینو اتان سولفونیک اسید) یک اسید آمینه نیمه ضروری است که در تنظیم مکانیزمهای درگیر در افزایش مصرف انرژی، مسیرهای علامتدهی انسولین، و متابولیسم کربوهیدرات دخیل است (18). سطح اسیدآمینه تورین در بیماران دیابتی کمتر از افراد غیر دیابتی میباشد. تورین در تنظیم متابولیسم گلوکز و چربی و بهبود وضعیت سلولی در دیابت رویکرد دارویی دارد (19). تورین کلسترول سرمی را از طریق تنظیم بیان ژن را تنظیم بیان LXR و ژنهای مسئول تحریک آن، کاهش میدهد. فعالسازی LXR جریان کلسترول را بهبود میدهد، انتقال معکوس (RCT) را در ماکروفاژها تحریک میکند، و مانع تجمع کلسترول در هپاتوسیتها در شرایط طبیعی و آزمایشگاهی می¬شود (19، 18). نتایج تحقیقات انجام شده در خصوص اثر تمرین و مکمل بر بیان ژنهای LXR و کلسترول تام سرمی متناقض است. در این راستا، حسینی و همکاران در سال 2024 نشان دادند که تمرین استقامتی + مصرف ویتامین D بیان پروتئین LXR کبدی را در موشهای نر نژاد ویستار تنظیم بالادستی میکند (9). نوری و همکاران در سال 2022 نشان دادند که فعالیت ورزشی به همراه مصرف مکمل رزوراترول منجر به افزایش بیان ژن LXR و نیز بهبود پروفایل لیپیدی در رتهای ویستار دیابتی شده با استروپتوزوسین شد. آنها همچنین نشان دادند که دیابتی کردن منجر به افزایش بیان پروتئین گیرندههای LXR کبدی شد (20). حاجی قاسم و همکاران در سال 2018 نشان دادند که هشت هفته تمرین هوازی مداوم و اینتروال و مکمل رزورتراول به صورت ترکیبی و مجزا، بیان ژن گیرنده¬های LXR و پروفایل چربی خون را در کبد موشهای مسن مبتلا به کبد چرب غیرالکلی بهبود داد (21). پینتو و همکاران در سال 2015 نشان دادند که 6 هفته تمرین هوازی روی تریدمیل (15 متر بر دقیقه، 30 دقیقه در روز، 5 روز در هفته)، LXR کبدی را بهطور معنیداری افزایش داد (22). در حالیکه، گایینی و همکاران در سال 1398 نشان دادند که هشت هفته تمرین هوازی بر تغییرات بیان ژنهای LXR، انتقال دهنده 2 گلوکز کبدی و شاخص مقاومت به انسولین در موش های صحرایی نر دیابتی نوع2 تأثیر معنیداری ندارد (23). در مقابل، رحمتی احمدآباد و همکاران در سال 1395 نشان دادند که یک دوره تمرین تناوبی شدید و مکملسازی روغن بذر کتان، بیان ژنهای LXR را در موشهای صحرایی نر بهطور معنیداری کاهش داد، اما بر کلسترول تام سرمی تأثیر معنیداری نداشت (24). همچنین، تحقیقات بسیار کمی، اثر مصرف تورین را در سازوکارهای کبدی و کلسترولی افراد دیابتی بررسی کردهاند (26، 25). لذا در تحقیق حاضر اثر تعاملی هشت هفته تمرین ترکیبی و مصرف تورین بر بیان پروتئین LXR کبدی و کلسترول تام سرمی در موشهای نر ویستار دیابتی شده با استروپتوزوسین بررسی شد.
روش بررسی
آزمودنیهای تحقیق تجربی حاضر، 50 سر موش صحرایی نر نژاد ویستار بالغ بودند که با دامنه وزنی 300-250 گرم و سن 6 هفتهای از مرکز پرورش حیوانات آزمایشگاهی دانشگاه علوم پزشکی ارومیه تهیه شد. موش نر نژاد ویستار بالغ با دامنه وزنی و سن ذکر شده بودن به عنوان معیارهای ورود و در صورت بروز هر گونه عفونت و بیماری در طی تحقیق به عنوان معیارهای خروج از تحقیق در نظر گرفته شد. موشهای صحرایی در تمام مراحل آزمون تحت شرایط کنترل دقیق و کامل از نظر رژیم غذایی، درجه حرارت محیط (2 ± 22 درجه سانتیگراد) و رطوبت (5±55 درصد)، استرس و نور قرار داشتند. شرایط نوری 12 ساعت تاریکی و 12 ساعت روشنایی بود. حیوانات به صورت گروههای 5 تایی در قفسهای مجزا از جنس پلاکسی گلاس نگهداری شدند. نمونهها با استفاده از فرمول تعیین حجم نمونه در مطالعات تجربی، با در نظر گرفتن خطای نوع اول مساوی با 0/05، 10 موش صحرایی در هر گروه تعیین شد. تعداد اندازه نمونه از طریق فرمول زیر برآورد شد که در آن 14=S (انحراف استاندارد) و 8=D (دقت احتمالی) از منابع قبلی و Z از جدول ارزشهای بحرانی تعیین شد.
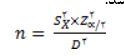
(28، 27).
جهت دیابتی کردن 40 سر موش صحرایی، در پایان هشت هفتگی، مقدار 55 میلیگرم به ازای هر کیلوگرم از وزن بدن Streptozocin (ساخت شرکت Sigma کشور آمریکا، حل شده در بافر سیترات تازه mol/L 0/5، 4/5=PH) موش¬های صحرایی با روش درون صفاقی تزریق شد. سه روز پس از تزریق جهت اطمینان از دیابتی شدن، با ایجاد یک جراحت کوچک توسط لانست بر روی ورید دم، یک قطره خون بر روی نوار گلوکومتری قرار گرفت و غلظت گلوکز خون از نمونههای خونی سیاهرگ دمی موشهای صحرایی توسط گلوکومتر (مدل Auto-coding infopiaEasy Gluco، ساخت کشور کره جنوبی) با دامنه سنجش 700-5 میلیگرم در دسیلیتر و حساسیت 10 میلیگرم در دسیلیتر قبل از شروع هشت هفته پروتکل تمرینی اندازهگیری شد. موشهایی که قند خون آنها بالاتر از 250 میلیگرم بر دسیلیتر بود، به عنوان دیابتی در نظر گرفته شدند. سپس موشهای صحرایی دیابتی شده بهطور تصادفی به گروههای 10 تایی تمرین ترکیبی، مصرف مکمل تورین، تمرین ترکیبی+ مصرف مکمل تورین و کنترل دیابتی تقسیم شدند. گروهی از موشهای صحرایی سالم که دیابتی نشده بودند و میزان قند خون آنها طبیعی (کمتر از 150 میلیگرم بر دسیلیتر) بود به عنوان گروه کنترل سالم در نظر گرفته شدند (27). تمرین ترکیبی به مدت 8 هفته، 5 روز در هفته به صورت صعود و بالا رفتن از پلههای نردبان انجام شد. تمرین مقاومتی در هفته اول 8 بار بدون وزنه در هفتههای دوم و سوم به ترتیب 10 و 12 بار صعود در هر جلسه با حمل وزنهای به اندازه یک درصد وزن بدن که به دم حیوان متصل بود، و از هفته چهارم تا پایان هفته هشتم، 15 بار صعود در هفته با حمل وزنههایی به اندازه 3 درصد کل وزن بدن که به دم حیوان متصل بود (جدول 1)(29، 27)، توسط موشهای صحرایی اجرا شد. تمرین استقامتی نیز با 5 دقیقه فاصله استراحت بعد از تمرین مقاومتی اجرا شد. در هفته¬های اول و دوم و سوم، تمرین استقامتی با سرعت 15 متر بر دقیقه به مدت 15 دقیقه بر روی نوارگردان با شیب صفر درجه آغاز شد. در ابتدای هفته چهارم به سرعت 17 متر بر دقیقه و مدت 40 دقیقه افزایش یافت. سرعت و مدت تمرین در پایان هفته چهارم تا هفته هشتم، ثابت و به ترتیب 20 متر بر دقیقه و 40 دقیقه، با شب صفر درجه تا پایان جلسات تمرینی اعمال شد (جدول 1) (29، 27). موشهای صحرایی برای سرد کردن، در انتهای تمرین ترکیبی 5 دقیقه (شدت 10 متر در دقیقه و با کاهش تدریجی شدت به کمترین مقدار) فعالیت کردند (27،30). در گروه مکمل، تورین تهیه شده از شرکت سیگمای کشور آمریکا (St.Louis)، بهصورت محلول 1% در آب آشامیدنی روزانه (500 میلیلیتر) در دسترس موشها قرار گرفت و جهت اطمینان از میزان مصرف مکمل، آب مصرفی موشهای گروه مکمل بهصورت یک روزانه ثبت شد. در گروه تمرین ترکیبی+ مصرف مکمل تورین هر تمرین ترکیبی و مکمل مصرف اعمال شد (27).
جدول 1: پروتکل تمرین ترکیبی مقاومتی- استقامتی
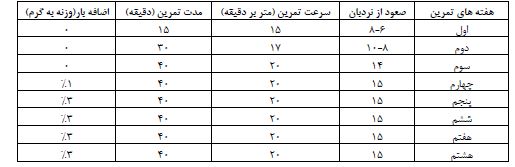
برگرفته از (27،29).
وزن موشها دو بار در هفته در ساعت 11- 9 صبح اندازهگیری شد و میانگین دو اندازهگیری به عنوان وزن هفتگی حیوان در نظر گرفته شد. قد حیوان در حالت بی¬هوشی کامل از نوک بینی تا مقعد توسط متر نواری اندازهگیری و شاخص توده بدنی از تقسیم کردن وزن بر مجذور قد بر حسب گرم بر سانتیمتر مربع محاسبه شد (29). تمامی موشهای صحرایی 40 ساعت پس از آخرین جلسه تمرین و پایدار شدن وضعیت بدن بعد از یک دوره تمرین و نیز پس از یک شب ناشتایی 12 ساعته با تزریق درون صفاقی کتامین 10% تولیدی شرکت Rotex Medica کشور آلمان و زایلازین 2% تولیدی شرکت Alfasan کشور هلند، بیهوش شدند و خون سیاهرگی از ورید اجوف تحتانی جمع¬آوری و به مدت 15 دقیقه با سرعت 3000 دور بر دقیقه سانتریفیوژ شد. سپس سرم خون جدا شد و در دمای 80- درجه سانتیگراد نگهداری و به آزمایشگاه تخصصی سارای تبریز منتقل شد (27،28). خونگیری در تمام مراحل بین ساعات 11- 9 صبح انجام شد. بیان پروتئین LXR کبدی به روش وسترن بلات (Santa Cruz Biotechnology, INC. LXRα/β (H-7): sc-377260) و سطح سرمی کلسترول تام به روش الایزا با کیت مخصوص موش دارای ضریب تغییرات درونسنجی 99 درصد و برونسنجی 99 درصد، ساخت شرکت Sigma-Aldrich کشور آمریکا در آزمایشگاه سارا تبریز اندازهگیری شد.
وسترن بلات: در ابتدای روش اجرا، نمونهها از فریز خارج و بر روی قطعات یخ به محل اجرای پروتکل منتقل شدند. 200 میکرولیتر lysis buffer به هر نمونه اضافه شد و سه مرتبه در طول یک ساعت انکوبه شدند. بلافاصله، نمونه به مدت 20 دقیقه با 1300 دور (rpm) و در دمای 4 درجه سانتیگراد سانتریفیوژ شدند. Supernatant، به یک میکروتیوپcc 1 منتقل شد وμl 0/5 آن برای تعیین غلظت پروتئین در یک میکروتیوپ دیگر ریخته شد. مقدار cc 50 بافر RIPA با lµ 5 protein inhibitor cocktail حل شد. برای تعیین غلظت پروتئین، از سه استاندارد، یک Blank و نهایتاً نمونه-های اصلی استفاده شد. هر یک از نمونهها بهصورت جداگانه تهیه و چند دقیقه در محیط آزمایشگاه انکوبه شدند و سپس به داخل کروتهای مربوطه ریخته شدند و با استفاده از دستگاه اسپکتروفتومتر میزان غلظت پروتئین ثبت شد. قبل از الکتروفروز، نمونهها برای load شدن بهتر با Loading buffer: 2X Laemmli solution به نسبت یک به یک حل شدند. پس از آماده کردن Stacking gel solution 10 درصد، مطابق با دستور داده شده، با استفاده از سمپلر به داخل فضای مربوطه ریخته شد. شانه، قبل از بسته شدن ژن داخل آن قرار گرفت تا چاهکها جهت ریختن نمونه ایجاد شود. سپس شانهها به آرامی خارج شدند. با استفاده از سر سمپلر نمونههای آماده شده با دقت کامل، در چاهکها ریخته شد. بافر الکتروفورز 5X به نسبت یک به چهار یا آب مقطر حل شد. در مرحله اول وسترن بلات، پس از آنکه بافر مورد نظر آماده شد، نمونه های پروتئینی با بافر مخلوط میشود و به مدت 3 تا 5 دقیقه در دمای 95 درجه جوشانده میشود. سپس روی ژل پلی آکریل آمید به مدت 2 تا 3 ساعت در ولتاژ 100 run می شود. بافر بلاکینگ را به آنتیبادی اولیه LXR، جهت رقیق کردن آنتی بادی اضافه شد (با رقت 1 در 1000) و سپس به مدت دو ساعت در دمای اتاق قرار داده شد. پس از آن کاغذ نیترو سلولز در بافر TBST چندین بار شستشو داده شد. بعد از آن، بافر بلاکینگ را با آنتیبادی ثانویه ضد آنتیبادی اولیه اضافه شد و کاغذ نیتروسلولز به مدت یک ساعت در دمای اتاق قرار داده شد، کاغذ نیتروسلولز با بافر TBST چندین بار شستشو داده شد. در این مرحله کاغذ نیتروسلولز یا DAB به مدت دو ساعت در دمای اتاق انکوبه شد تا باند مورد نظر نمایان شود. در مرحله آخر کاغذ با آب مقطر شستشو داده شد. بعد از مشخص شدن باند، اسکن شد و با استفاده از نرمافزارLab Work آنالیز شد (23).
تجزیه و تحلیل آماری
در تجزیه و تحلیل آماری، برای بررسی طبیعی بودن توزیع دادهها از آزمون Shapiro-Wilk، برای توصیف یافتههای توصیفی از انحراف استاندارد ±میانگین، و برای مقایسه تفاوت میانگین متغیرها بین پنج گروه تمرین، تورین، تمرین- مکمل، کنترل و کنترل سالم از آزمون Anova دوطرفه و آزمون تعقیبی LSD استفاده شد. سطح معنیداری آزمونها 0/05>P در نظر گرفته شد. دادهها با استفاده از نرمافزار آماری version 16 SPSS تحلیل شد.
نتایج
آزمون Shapiro-Wilk نشان داد که تمامی دادهها از توزیع نرمال برخوردار است (0/05 نتایج آزمون Anova دوراهه نشان داد که بین میانگین وزن بدن(P=0/216، F=1/507(، (P=0/216، F=1/507)، ، BMI ، غذای مصرفی(P=0/909، F=0/248) گروهها در شروع مطالعه اختلاف معنیداری وجود ندارد.
جدول2: میانگین و انحراف معیار متغیرهای پژوهش قبل و بعد از هشت هفته تمرین ترکیبی و مصرف مکمل تورین درگروههای تمرین (10=n)، تورین (10=n)، تمرین – مکمل (10=n)، کنترل (10=n) و کنترل سالم (10=n)
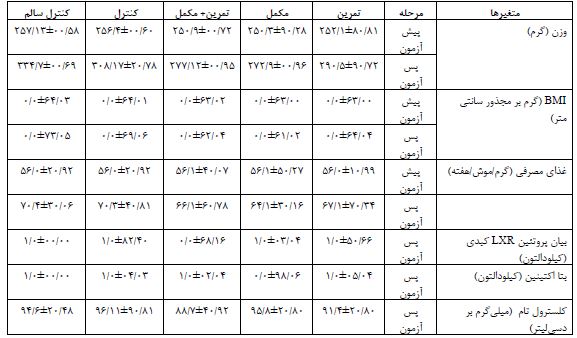
BMI: شاخص توده بدنی، LXR: گیرنده ایکس کبدی، CT: کلسترول تام.
جدول3: نتایج آزمون تحلیل واریانس برای میانگین متغیرهای پژوهش قبل و پس ازهشت هفته تمرین ترکیبی مقاومتی- استقامتی در گروههای تمرین (10=n)، تورین (10=n)، تمرین + مکمل (10=n)، کنترل (10=n) و کنترل سالم (10=n)
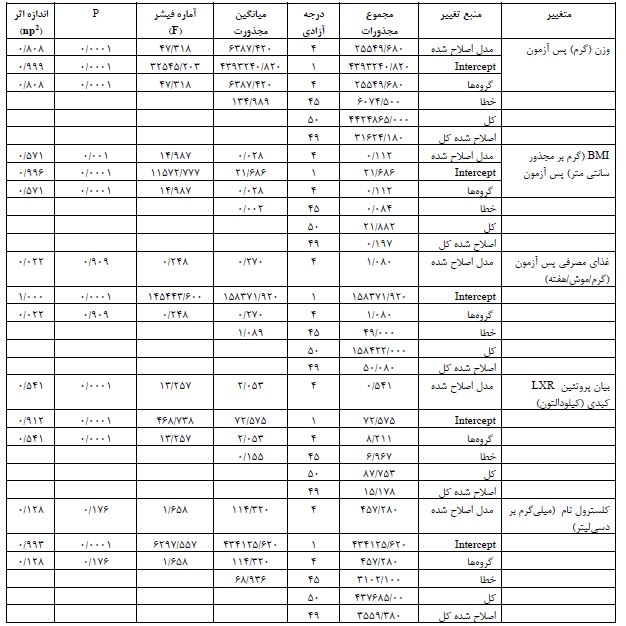
* تفاوت معنیدار با پیش آزمون در سطح 0/05≥P
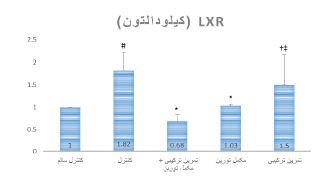
شکل 1: مقایسه بیان پروتئین LXR کبدی موشهای صحرایی پس از هشت هفته ترکیبی مقاومتی- استقامتی و مصرف مکمل تورین در گروههای مختلف
* نشانه تفاوت معنیدار در مقایسه با گروه کنترل؛ † نشانه تفاوت معنیدار در مقایسه با گروه مکمل تورین؛ ‡ نشانه تفاوت معنیدار در مقایسه با گروه تمرین ترکیبی + مکمل تورین؛ # نشانه تفاوت معنیدار در مقایسه با گروه کنترل سالم
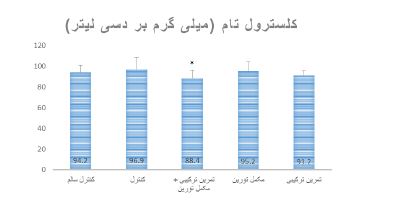
شکل 2: مقایسه کلسترول تام سرمی موشهای صحرایی پس از هشت هفته تمرین ترکیبی مقاومتی- استقامتی و مصرف مکمل تورین در گروههای مختلف
* نشانه تفاوت معنیدار در مقایسه با گروه کنترل
همانطور که در جدول 3 مشاهده میشود، نتایج آزمون Anova دو راهه نشان داد در پایان هشت هفته، بین وزن بدن (0/0001=P)، BMI (P=0/001)، و بیان پروتئین گیرنده ایکس کبدی (0/0001=P) گروههای تمرین، مکمل، تمرین+ مکمل، کنترل و کنترل سالم تفاوت معنیداری وجود دارد، در حالیکه بین کلسترول تام سرمی (0/176=P) گروههای مختلف تفاوت معنیداری وجود ندارد (جدول 3). نتایج آزمون تعقیبی LSD نشان داد که بیان پروتئین LXR کبدی بعد از هشت هفته در گروههای مکمل (0/0001=P) و تمرین+ مکمل (0/0001=P) در مقایسه با گروه کنترل، به ترتیب 43/41 درصد و 62/64 درصد بهطور معنیداری کاهش یافت. همچنین، بیان پروتئین LXR کبدی در گروههای تمرین + مکمل (0/0001=P) و مکمل (0/011=P) در مقایسه با گروه تمرین به ترتیب 120/59 درصد و 45/63 درصد بهطور معنیداری کاهش یافت. بیان پروتئین LXR کبدی در گروه کنترل در مقایسه با گروه کنترل سالم (0/0001=P)، 82 درصد بهطور معنیداری افزایش یافت (جدول3، شکل1). سطح سرمی کلسترول تام بعد از هشت هفته در گروه تمرین + مکمل (0/027=P) در مقایسه با گروه کنترل، 8/85 درصد بهطور معنیداری کاهش یافت (جدول3، شکل2). وزن بدن بعد از هشت هفته در گروه¬های تمرین (0/002=P)، مکمل (0/0001=P) و تمرین + مکمل (0/0001=P) در مقایسه با گروه کنترل بهطور معنیداری کمتر بود. در حالیکه در گروه تمرین در مقایسه با گروه مکمل (0/001=P) و در مقایسه با گروه تمرین + مکمل (0/010=P) بهطور معنیداری بیشتر بود. وزن بدن بعد از هشت هفته در گروه کنترل در مقایسه با گروه کنترل سالم (0/0001=P) بهطور معنیداری کمتر بود. BMI بعد از هشت هفته در گروههای تمرین (0/016=P)، مکمل (0/0001=P) و تمرین + مکمل (0/0001=P) در مقایسه با گروه کنترل بهطور معنیداری کمتر بود. BMI بعد از هشت هفته در گروه کنترل در مقایسه با گروه کنترل سالم (0/029=P) بهطور معنیداری کمتر بود. غذای مصرفی بعد از هشت هفته در گروههای تمرین (0/032=P)، مکمل (0/0001=P) و تمرین + مکمل (0/003=P) در مقایسه با گروه کنترل بهطور معنیداری بیشتر بود. در حالیکه، در گروه تمرین دیابتی در مقایسه با گروههای مکمل (0/008=P) بهطور معنیداری بیشتر بود.
بحث
یافتههای تحقیق حاضر نشان داد که هشت هفته مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی)، بیان پروتئین گیرندههای LXR کبدی در موش صحرایی نر ویستار دیابتی را بهطور معنیداری کاهش داد. در حالیکه، دیابت منجر به افزایش معنیدار بیان پروتئین گیرندههای LXR کبدی در موشهای نر ویستار دیابتی شد. فعال¬شدن گیرنده¬های LXR کبدی در موشهای دیابتی میزان قند خون را طبیعی میکند و حساسیت به انسولین و مقاومت به انسولین را بهبود میبخشد (31، 15، 10). مطالعات نشان دادهاند که LXR اثرات مفیدی بر کنترل اختلالات متابولیک دارد، بهطوریکه در مدلهای حیوانی دیابت، تحمل گلوکز را بهبود میبخشد (32). در واقع، هشت هفته مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی)، بیان پروتئین گیرندههای LXR کبدی را در تحقیق حاضر بهطور معنیداری کاهش داد. با توجه به عدم تغییر معنیدار این گیرنده در گروه تمرین ترکیبی (مقاومتی- استقامتی) میتوان گفت علت احتمالی کاهش گیرنده LXR در گروههای مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی)، ناشی از مصرف مکمل تورین بوده است. یافتههای تحقیق حاضر در خصوص کاهش بیان پروتئین گیرندههای LXR کبدی پس از مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی) و نیز افزایش این گیرندهها پس از هشت هفته دیابتی¬کردن موشها با یافتههای نوری و همکاران در سال 2022 (20) و حاجیقاسم و همکاران در سال 2018 (21)، پینتو و همکاران در سال 2015 (22) و گایینی و همکاران در سال 1398 (23) همخوانی ندارد. علت احتمالی ناهمخوانیها در تحقیقات انجام شده، تناقضات در شدت، مدت، نوع تمرین، نوع مکمل، تعداد نمونه در هر گروه، سن آزمودنی-ها و نیز نوع بیماری بود. تمرین مقاومتی- استقامتی در تحقیق حاضر به مدت هشت هفته انجام شد، در حالیکه در تحقیق نوری و همکاران در سال 2022 یک جلسه تمرین اینتروال و یک جلسه تمرین مداوم بود. روش اندازهگیری بیان پروتئین گیرندههای LXR کبدی در تحقیق حاضر روش وسترنبلات و در تحقیق نوری و همکاران RealTime-PCR بود. همچنین تعداد نمونه در هر گروه در تحقیق حاضر 10 سر موش در هر گروه و در تحقیق نوری و همکاران در سال 2022، 7 سر موش در هر گروه بود. مکمل مصرف شده در تحقیق حاضر تورین و در تحقیق نوری و همکاران رزوراترول بود. تمرین مقاومتی- استقامتی در تحقیق حاضر به مدت هشت هفته انجام شد، در حالیکه در تحقیق حاجی قاسم و همکاران در سال 2018 هشت هفته تمرینات اینتروال و مداوم بود. روش اندازهگیری بیان پروتئین گیرندههای LXR کبدی در تحقیق حاضر روش وسترنبلات و در تحقیق حاجیقاسم و همکاران در سال 2018 و همکاران RealTime-PCR بود. همچنین تعداد نمونه در تحقیق حاجیقاسم و همکاران در سال 2018، 7 سر موش مسن در هر گروه بود. تمرین ترکیبی در تحقیق حاضر به مدت هشت هفته انجام شد، در حالیکه در تحقیق حاجی پینتو و همکاران در سال 2015 هشت هفته تمرینات هوازی بود. موشهای تحقیق حاضر دیابتی شده بودند ولی در تحقیق پینتو و همکاران در سال 2015 موشهای سالم بودند. هم-چنین تعداد نمونه در هر گروه در تحقیق حاضر 10 سر موش در هر گروه و در تحقیق پینتو و همکاران در سال 2015، 6 سر موش در هر گروه بود. علت احتمالی کاهش بیان پروتئین گیرندههای LXR کبدی پس از هشت هفته مصرف مکمل با و بدون تمرین ترکیبی در تحقیق حاضر این است که مکمل تورین احتمالاً تعداد ماکروفاژها را در مونوسیتها کاهش داد که این امر منجر به کاهش ABCA1، APoA1 و CYP7A1 و در نهایت کاهش بیان گیرندههای LXR کبدی شد (35-32). این امر نیازمند بررسی بیشتر میباشد. در تحقیق حاضر، هشت هفته تمرین ترکیبی (مقاومتی- استقامتی)، زمان کافی برای اعمال تغییرات معنیدار در بیان پروتئین گیرندههای LXR کبدی نبود. یافتههای تحقیق حاضر در خصوص عدم تغییر معنیدار بیان پروتئین گیرندههای LXR کبدی پس از هشت هفته تمرین ترکیبی با یافته¬های گایینی و همکاران در سال 1398 (23) و کوراچ آندره و همکاران در سال 2015 (32)، نگو ساک و همکاران در سال 2015 (34)، کوته و همکاران در سال 2013 (35)، کاظمی نسب و همکاران در سال 1399 (6)، رحمتی احمد آباد و همکاران در سال 1395 (24) همخوانی دارد. یکی دیگر از یافتههای تحقیق حاضر نشان داد که هشت هفته تمرین ترکیبی + مصرف مکمل تورین منجر به کاهش معنیدار سطح سرمی کلسترول تام در موشهای نر ویستار دیابتی شد. هشت تمرین ترکیبی و مصرف مکمل تورین هر یک به تنهایی تغییر معنیداری در سطح سرمی کلسترول تام در موشهای صحرایی نر ویستار دیابتی ایجاد نکرد. بنابراین میتوان گفت که هشت هفته تمرین ترکیبی + مصرف مکمل دیابتی در مقایسه با هریک به تنهایی اثر فزاینده بر کاهش سطح سرمی کلسترول تام در موشهای نر ویستار دیابتی دارد. یافتههای تحقیق حاضر در خصوص کاهش سطح سرمی کلسترول تام پس از هشت هفته تمرین ترکیبی + مصرف مکمل تورین با یافتههای نوری و همکاران در سال 2022 (20)، صمدپور و همکاران در سال 2021 (25)، حاجی قاسم و همکاران در سال 2018 (21)، پینتو و همکاران در سال 2015 (22)، نگو ساک و همکاران در سال 2015 (34) و کوته و همکاران در سال 2013 (35) همخوانی دارد؛ در حالیکه با یافتههای تحقیق رحمتی احمد آباد و همکاران در سال 1395 (24) همخوانی ندارد. رحمتی احمدآباد و همکاران در سال 1395 نشان دادند هشت هفته مدت تمرین تناوبی شدید و مکمل سازی روغن بذر کتان بر کلسترول تام سرمی اثر معنیداری نداشت (24). یکی از دلایل احتمالی این ناهمخوانی، مصرف مکمل تورین در مقابل روغن بذر کتان بود. تمرینات تحقیق حاضر تمرین ترکیبی و در تحقیق رحمتی احمدآباد و همکاران در سال 1395 تمرین هوازی بود. هم-چنین تعداد نمونه در هر گروه در تحقیق حاضر 10 سر موش در هر گروه و در تحقیق رحمتی احمدآباد و همکاران در سال 1395، 5 سر موش در هر گروه بود. علت احتمالی عدم تغییر معنیدار سطح سرمی کلسترول تام پس از هشت هفته تمرین ترکیبی + مصرف مکمل تورین به تنهایی کافی نبودن شدت و مدت تمرینات و کوتاه بودن طول دوره مصرف و دوز مصرفی مکمل تورین بوده است. تورین بر LXR، CYP7A1 و کلسترول تأثیر دارد. CYP7A1سطح کلسترول را کاهش میدهد چون کلسترول تام را در کبد به اسیدهای صفراوی تبدیل میکند (34،36). احتمالاً تمرین ترکیبی و تورین با هم سطح کلسترول تام را کاهش میدهند. در تحقیق حاضر، هشت هفته مصرف مکمل تورین با و بدون تمرین ترکیبی، وزن بدن و BMI را بهطور معنیداری کاهش داد. علت کاهش وزن بدن احتمالاً ناشی از کاهش بیشتر چربی در اثر تمرین به تنهایی است. با توجه به افزایش غذای مصرفی در گروه تمرین در مقایسه با گروههای مصرف مکمل تورین با و بدون تمرین ترکیبی می¬توان گفت که تمرین باعث سوختن بیشتری چربی-ها شده است، اما توده عضلانی در مدت زمان هشت هفته تمرین ترکیبی مقاومتی+ استقامتی افزایش معنیداری نداشته است. یافتههای تحقیق حاضر در خصوص کاهش وزن و BMI با یافتههای بابایی و همکاران در سال 2015 (29) و سانگ سیرسوان و همکاران در سال 2009 (37) همخوانی دارد، در حالیکه با یافتههای زوث و همکاران در سال 2012 (38) و ایشی کورا و همکاران در سال 2011 (39) همخوانی ندارد. بابایی و همکاران در سال 2015 نشان دادند که هشت هفته تمرین ترکیبی استقامتی - مقاومتی و استروژن درمانی جایگزینی، وزن بدن و BMI را در موشهای ماده اوارکتومی شده بهطور معنیداری کاهش داد (29). سانگ سیرسوان و همکاران در سال 2009 نشان دادند که تمرین ورزشی، وزن بدن و BMI را در موشهای تمرین کرده کاهش داد (37). در حالیکه، زوث و همکاران در سال 2012 (38) و ایشی کورا و همکاران در سال 2011 (39) تفاوت معنیداری در وزن موشهای دریافت کننده 3 هفته مکمل تورین بعد از ورزش مشاهده نکردند.
نتیجهگیری
در کل، مصرف هشت هفته مکمل تورین با و بدون تمرین ترکیبی موجب کاهش معنیدار بیان پروتئین گیرندههای LXR کبدی، کلس ترول تام سرمی، وزن بدن و BMI در موشهای صحرایی نر ویستار دیابتی شد. هشت هفته تمرین ترکیبی + مصرف مکمل تورین منجر به کاهش معنیدار سطح سرمی کلسترول تام در موشهای نر ویستار دیابتی شد.
سپاسگزاری
بدینوسیله از کلیه پرسنل محترم دانشگاه علوم پزشکی اردبیل و حوزه معاونت پژوهشی دانشگاه محقق اردبیلی که با همکاری خود امکان اجرای تحقیق حاضر را فراهم کردند، تشکر و قدردانی می¬شود. همچنین، کد طرح تحقیقاتی مصوب دانشگاه محقق اردبیلی 23142/20/د/1402 میباشد.
حامی مالی: مقاله با حمایت مالی دانشگاه محقق اردبیلی انجام شده است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این مطالعه کلیه قوانین و مقررات بینالمللی کار با حیوانات آزمایشگاهی را رعایت و توسط کمیته اخلاق کار با حیوانات دانشگاه محقق اردبیلی تأیید شد و دارای کد اخلاق (IR.UMAREC.1402.088) می باشد.
مشارکت نویسندگان
آمنه پوررحیم قورقچی در ارائه ایده، آمنه پوررحیم قورقچی در طراحی مطالعه، آمنه پوررحیم قورقچی و آیدین ولیزاده اورنج در جمعآوری دادهها، آمنه پوررحیم قورقچی و آیدین ولیزاده اورنج در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
بیماری دیابت نوعی سندروم متابولیک است که با هایپرگلیسمی، کاهش حساسیت به انسولین و افزایش مقاومت به انسولین مشخص میشود (1). انجام تمرینهای ورزشی ترکیبی (مقاومتی- استقامتی) و مکمل تورین سبب بهبود متابولیسم گلوکز و چربی شده و انتقال بهتر گلوکز به عضلات را به همراه دارد (5-2). گیرندههای ایکس کبدی (LXRs) نقش مهمی را در متابولیسم گلوکز، هموستاز کلسترول، متابولیسم اسیدهای صفراوی و لیپوژنز در هپاتوسیتها بر عهده دارد (6). فعالسازی LXR باعث افزایش بیان ژنهای درگیر در هموستاز کلسترول از جمله ABCA1 میشود که نقش مهمی در افزایش بازسازی HDL دارد، بهطوریکه ABCA1، کلسترول و فسفولیپیدها را از غشای پلاسما به آپو لیپوپروتئین A1 (ApoA1) انتقال میدهد. این انتقال دهندهها نقش مهمی در تشکیل ذرات HDL نابالغ کبدی ایفا میکنند (10-7). فعالسازی LXR اثرات مفیدی بر کنترل اختلالات متابولیک دارد؛ بهطوریکه در مدلهای حیوانی دیابت، تحمل گلوکز را بهبود میبخشد (15-11). با توجه به اثرات مفید، LXR به عنوان یک هدف دارویی برای کنترل اختلالات متابولیک از جمله دیابت نوع دو؛ شناسایی، تقویت و بهبود عوامل درگیر در درمان و پیشگیری از پیشرفت بیماری دیابت و اختلالات ناشی از آن و همچنین کاهش هزینه¬های درمانی اهمیت فراوانی دارد (6،7،15). کالج پزشکی- ورزشی آمریکا تأیید کرده است که برنامههای توانبخشی برای بیماران دیابتی بهتر است ترکیبی از تمرینات مقاومتی و استقامتی باشد که اثرات مفید هر دو نوع تمرین را نیز دربر دارد (17،16). تمرین ترکیبی مقاومتی- استقامتی منجر به کاهش قابلتوجهی در مقاومت انسولینی و بهبود تحمل گلوکز، کاهش سطوح شاخص توده بدنی و نسبت دور کمر به لگن میشود و میتواند اثرات مفیدی بر کاهش نیمرخ لیپیدی، کلسترول و LDL در بیماران دیابتی داشته باشد (17). تورین (2- آمینو اتان سولفونیک اسید) یک اسید آمینه نیمه ضروری است که در تنظیم مکانیزمهای درگیر در افزایش مصرف انرژی، مسیرهای علامتدهی انسولین، و متابولیسم کربوهیدرات دخیل است (18). سطح اسیدآمینه تورین در بیماران دیابتی کمتر از افراد غیر دیابتی میباشد. تورین در تنظیم متابولیسم گلوکز و چربی و بهبود وضعیت سلولی در دیابت رویکرد دارویی دارد (19). تورین کلسترول سرمی را از طریق تنظیم بیان ژن را تنظیم بیان LXR و ژنهای مسئول تحریک آن، کاهش میدهد. فعالسازی LXR جریان کلسترول را بهبود میدهد، انتقال معکوس (RCT) را در ماکروفاژها تحریک میکند، و مانع تجمع کلسترول در هپاتوسیتها در شرایط طبیعی و آزمایشگاهی می¬شود (19، 18). نتایج تحقیقات انجام شده در خصوص اثر تمرین و مکمل بر بیان ژنهای LXR و کلسترول تام سرمی متناقض است. در این راستا، حسینی و همکاران در سال 2024 نشان دادند که تمرین استقامتی + مصرف ویتامین D بیان پروتئین LXR کبدی را در موشهای نر نژاد ویستار تنظیم بالادستی میکند (9). نوری و همکاران در سال 2022 نشان دادند که فعالیت ورزشی به همراه مصرف مکمل رزوراترول منجر به افزایش بیان ژن LXR و نیز بهبود پروفایل لیپیدی در رتهای ویستار دیابتی شده با استروپتوزوسین شد. آنها همچنین نشان دادند که دیابتی کردن منجر به افزایش بیان پروتئین گیرندههای LXR کبدی شد (20). حاجی قاسم و همکاران در سال 2018 نشان دادند که هشت هفته تمرین هوازی مداوم و اینتروال و مکمل رزورتراول به صورت ترکیبی و مجزا، بیان ژن گیرنده¬های LXR و پروفایل چربی خون را در کبد موشهای مسن مبتلا به کبد چرب غیرالکلی بهبود داد (21). پینتو و همکاران در سال 2015 نشان دادند که 6 هفته تمرین هوازی روی تریدمیل (15 متر بر دقیقه، 30 دقیقه در روز، 5 روز در هفته)، LXR کبدی را بهطور معنیداری افزایش داد (22). در حالیکه، گایینی و همکاران در سال 1398 نشان دادند که هشت هفته تمرین هوازی بر تغییرات بیان ژنهای LXR، انتقال دهنده 2 گلوکز کبدی و شاخص مقاومت به انسولین در موش های صحرایی نر دیابتی نوع2 تأثیر معنیداری ندارد (23). در مقابل، رحمتی احمدآباد و همکاران در سال 1395 نشان دادند که یک دوره تمرین تناوبی شدید و مکملسازی روغن بذر کتان، بیان ژنهای LXR را در موشهای صحرایی نر بهطور معنیداری کاهش داد، اما بر کلسترول تام سرمی تأثیر معنیداری نداشت (24). همچنین، تحقیقات بسیار کمی، اثر مصرف تورین را در سازوکارهای کبدی و کلسترولی افراد دیابتی بررسی کردهاند (26، 25). لذا در تحقیق حاضر اثر تعاملی هشت هفته تمرین ترکیبی و مصرف تورین بر بیان پروتئین LXR کبدی و کلسترول تام سرمی در موشهای نر ویستار دیابتی شده با استروپتوزوسین بررسی شد.
روش بررسی
آزمودنیهای تحقیق تجربی حاضر، 50 سر موش صحرایی نر نژاد ویستار بالغ بودند که با دامنه وزنی 300-250 گرم و سن 6 هفتهای از مرکز پرورش حیوانات آزمایشگاهی دانشگاه علوم پزشکی ارومیه تهیه شد. موش نر نژاد ویستار بالغ با دامنه وزنی و سن ذکر شده بودن به عنوان معیارهای ورود و در صورت بروز هر گونه عفونت و بیماری در طی تحقیق به عنوان معیارهای خروج از تحقیق در نظر گرفته شد. موشهای صحرایی در تمام مراحل آزمون تحت شرایط کنترل دقیق و کامل از نظر رژیم غذایی، درجه حرارت محیط (2 ± 22 درجه سانتیگراد) و رطوبت (5±55 درصد)، استرس و نور قرار داشتند. شرایط نوری 12 ساعت تاریکی و 12 ساعت روشنایی بود. حیوانات به صورت گروههای 5 تایی در قفسهای مجزا از جنس پلاکسی گلاس نگهداری شدند. نمونهها با استفاده از فرمول تعیین حجم نمونه در مطالعات تجربی، با در نظر گرفتن خطای نوع اول مساوی با 0/05، 10 موش صحرایی در هر گروه تعیین شد. تعداد اندازه نمونه از طریق فرمول زیر برآورد شد که در آن 14=S (انحراف استاندارد) و 8=D (دقت احتمالی) از منابع قبلی و Z از جدول ارزشهای بحرانی تعیین شد.
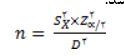
(28، 27).
جهت دیابتی کردن 40 سر موش صحرایی، در پایان هشت هفتگی، مقدار 55 میلیگرم به ازای هر کیلوگرم از وزن بدن Streptozocin (ساخت شرکت Sigma کشور آمریکا، حل شده در بافر سیترات تازه mol/L 0/5، 4/5=PH) موش¬های صحرایی با روش درون صفاقی تزریق شد. سه روز پس از تزریق جهت اطمینان از دیابتی شدن، با ایجاد یک جراحت کوچک توسط لانست بر روی ورید دم، یک قطره خون بر روی نوار گلوکومتری قرار گرفت و غلظت گلوکز خون از نمونههای خونی سیاهرگ دمی موشهای صحرایی توسط گلوکومتر (مدل Auto-coding infopiaEasy Gluco، ساخت کشور کره جنوبی) با دامنه سنجش 700-5 میلیگرم در دسیلیتر و حساسیت 10 میلیگرم در دسیلیتر قبل از شروع هشت هفته پروتکل تمرینی اندازهگیری شد. موشهایی که قند خون آنها بالاتر از 250 میلیگرم بر دسیلیتر بود، به عنوان دیابتی در نظر گرفته شدند. سپس موشهای صحرایی دیابتی شده بهطور تصادفی به گروههای 10 تایی تمرین ترکیبی، مصرف مکمل تورین، تمرین ترکیبی+ مصرف مکمل تورین و کنترل دیابتی تقسیم شدند. گروهی از موشهای صحرایی سالم که دیابتی نشده بودند و میزان قند خون آنها طبیعی (کمتر از 150 میلیگرم بر دسیلیتر) بود به عنوان گروه کنترل سالم در نظر گرفته شدند (27). تمرین ترکیبی به مدت 8 هفته، 5 روز در هفته به صورت صعود و بالا رفتن از پلههای نردبان انجام شد. تمرین مقاومتی در هفته اول 8 بار بدون وزنه در هفتههای دوم و سوم به ترتیب 10 و 12 بار صعود در هر جلسه با حمل وزنهای به اندازه یک درصد وزن بدن که به دم حیوان متصل بود، و از هفته چهارم تا پایان هفته هشتم، 15 بار صعود در هفته با حمل وزنههایی به اندازه 3 درصد کل وزن بدن که به دم حیوان متصل بود (جدول 1)(29، 27)، توسط موشهای صحرایی اجرا شد. تمرین استقامتی نیز با 5 دقیقه فاصله استراحت بعد از تمرین مقاومتی اجرا شد. در هفته¬های اول و دوم و سوم، تمرین استقامتی با سرعت 15 متر بر دقیقه به مدت 15 دقیقه بر روی نوارگردان با شیب صفر درجه آغاز شد. در ابتدای هفته چهارم به سرعت 17 متر بر دقیقه و مدت 40 دقیقه افزایش یافت. سرعت و مدت تمرین در پایان هفته چهارم تا هفته هشتم، ثابت و به ترتیب 20 متر بر دقیقه و 40 دقیقه، با شب صفر درجه تا پایان جلسات تمرینی اعمال شد (جدول 1) (29، 27). موشهای صحرایی برای سرد کردن، در انتهای تمرین ترکیبی 5 دقیقه (شدت 10 متر در دقیقه و با کاهش تدریجی شدت به کمترین مقدار) فعالیت کردند (27،30). در گروه مکمل، تورین تهیه شده از شرکت سیگمای کشور آمریکا (St.Louis)، بهصورت محلول 1% در آب آشامیدنی روزانه (500 میلیلیتر) در دسترس موشها قرار گرفت و جهت اطمینان از میزان مصرف مکمل، آب مصرفی موشهای گروه مکمل بهصورت یک روزانه ثبت شد. در گروه تمرین ترکیبی+ مصرف مکمل تورین هر تمرین ترکیبی و مکمل مصرف اعمال شد (27).
جدول 1: پروتکل تمرین ترکیبی مقاومتی- استقامتی

برگرفته از (27،29).
وزن موشها دو بار در هفته در ساعت 11- 9 صبح اندازهگیری شد و میانگین دو اندازهگیری به عنوان وزن هفتگی حیوان در نظر گرفته شد. قد حیوان در حالت بی¬هوشی کامل از نوک بینی تا مقعد توسط متر نواری اندازهگیری و شاخص توده بدنی از تقسیم کردن وزن بر مجذور قد بر حسب گرم بر سانتیمتر مربع محاسبه شد (29). تمامی موشهای صحرایی 40 ساعت پس از آخرین جلسه تمرین و پایدار شدن وضعیت بدن بعد از یک دوره تمرین و نیز پس از یک شب ناشتایی 12 ساعته با تزریق درون صفاقی کتامین 10% تولیدی شرکت Rotex Medica کشور آلمان و زایلازین 2% تولیدی شرکت Alfasan کشور هلند، بیهوش شدند و خون سیاهرگی از ورید اجوف تحتانی جمع¬آوری و به مدت 15 دقیقه با سرعت 3000 دور بر دقیقه سانتریفیوژ شد. سپس سرم خون جدا شد و در دمای 80- درجه سانتیگراد نگهداری و به آزمایشگاه تخصصی سارای تبریز منتقل شد (27،28). خونگیری در تمام مراحل بین ساعات 11- 9 صبح انجام شد. بیان پروتئین LXR کبدی به روش وسترن بلات (Santa Cruz Biotechnology, INC. LXRα/β (H-7): sc-377260) و سطح سرمی کلسترول تام به روش الایزا با کیت مخصوص موش دارای ضریب تغییرات درونسنجی 99 درصد و برونسنجی 99 درصد، ساخت شرکت Sigma-Aldrich کشور آمریکا در آزمایشگاه سارا تبریز اندازهگیری شد.
وسترن بلات: در ابتدای روش اجرا، نمونهها از فریز خارج و بر روی قطعات یخ به محل اجرای پروتکل منتقل شدند. 200 میکرولیتر lysis buffer به هر نمونه اضافه شد و سه مرتبه در طول یک ساعت انکوبه شدند. بلافاصله، نمونه به مدت 20 دقیقه با 1300 دور (rpm) و در دمای 4 درجه سانتیگراد سانتریفیوژ شدند. Supernatant، به یک میکروتیوپcc 1 منتقل شد وμl 0/5 آن برای تعیین غلظت پروتئین در یک میکروتیوپ دیگر ریخته شد. مقدار cc 50 بافر RIPA با lµ 5 protein inhibitor cocktail حل شد. برای تعیین غلظت پروتئین، از سه استاندارد، یک Blank و نهایتاً نمونه-های اصلی استفاده شد. هر یک از نمونهها بهصورت جداگانه تهیه و چند دقیقه در محیط آزمایشگاه انکوبه شدند و سپس به داخل کروتهای مربوطه ریخته شدند و با استفاده از دستگاه اسپکتروفتومتر میزان غلظت پروتئین ثبت شد. قبل از الکتروفروز، نمونهها برای load شدن بهتر با Loading buffer: 2X Laemmli solution به نسبت یک به یک حل شدند. پس از آماده کردن Stacking gel solution 10 درصد، مطابق با دستور داده شده، با استفاده از سمپلر به داخل فضای مربوطه ریخته شد. شانه، قبل از بسته شدن ژن داخل آن قرار گرفت تا چاهکها جهت ریختن نمونه ایجاد شود. سپس شانهها به آرامی خارج شدند. با استفاده از سر سمپلر نمونههای آماده شده با دقت کامل، در چاهکها ریخته شد. بافر الکتروفورز 5X به نسبت یک به چهار یا آب مقطر حل شد. در مرحله اول وسترن بلات، پس از آنکه بافر مورد نظر آماده شد، نمونه های پروتئینی با بافر مخلوط میشود و به مدت 3 تا 5 دقیقه در دمای 95 درجه جوشانده میشود. سپس روی ژل پلی آکریل آمید به مدت 2 تا 3 ساعت در ولتاژ 100 run می شود. بافر بلاکینگ را به آنتیبادی اولیه LXR، جهت رقیق کردن آنتی بادی اضافه شد (با رقت 1 در 1000) و سپس به مدت دو ساعت در دمای اتاق قرار داده شد. پس از آن کاغذ نیترو سلولز در بافر TBST چندین بار شستشو داده شد. بعد از آن، بافر بلاکینگ را با آنتیبادی ثانویه ضد آنتیبادی اولیه اضافه شد و کاغذ نیتروسلولز به مدت یک ساعت در دمای اتاق قرار داده شد، کاغذ نیتروسلولز با بافر TBST چندین بار شستشو داده شد. در این مرحله کاغذ نیتروسلولز یا DAB به مدت دو ساعت در دمای اتاق انکوبه شد تا باند مورد نظر نمایان شود. در مرحله آخر کاغذ با آب مقطر شستشو داده شد. بعد از مشخص شدن باند، اسکن شد و با استفاده از نرمافزارLab Work آنالیز شد (23).
تجزیه و تحلیل آماری
در تجزیه و تحلیل آماری، برای بررسی طبیعی بودن توزیع دادهها از آزمون Shapiro-Wilk، برای توصیف یافتههای توصیفی از انحراف استاندارد ±میانگین، و برای مقایسه تفاوت میانگین متغیرها بین پنج گروه تمرین، تورین، تمرین- مکمل، کنترل و کنترل سالم از آزمون Anova دوطرفه و آزمون تعقیبی LSD استفاده شد. سطح معنیداری آزمونها 0/05>P در نظر گرفته شد. دادهها با استفاده از نرمافزار آماری version 16 SPSS تحلیل شد.
نتایج
آزمون Shapiro-Wilk نشان داد که تمامی دادهها از توزیع نرمال برخوردار است (0/05
جدول2: میانگین و انحراف معیار متغیرهای پژوهش قبل و بعد از هشت هفته تمرین ترکیبی و مصرف مکمل تورین درگروههای تمرین (10=n)، تورین (10=n)، تمرین – مکمل (10=n)، کنترل (10=n) و کنترل سالم (10=n)

BMI: شاخص توده بدنی، LXR: گیرنده ایکس کبدی، CT: کلسترول تام.
جدول3: نتایج آزمون تحلیل واریانس برای میانگین متغیرهای پژوهش قبل و پس ازهشت هفته تمرین ترکیبی مقاومتی- استقامتی در گروههای تمرین (10=n)، تورین (10=n)، تمرین + مکمل (10=n)، کنترل (10=n) و کنترل سالم (10=n)

* تفاوت معنیدار با پیش آزمون در سطح 0/05≥P

شکل 1: مقایسه بیان پروتئین LXR کبدی موشهای صحرایی پس از هشت هفته ترکیبی مقاومتی- استقامتی و مصرف مکمل تورین در گروههای مختلف
* نشانه تفاوت معنیدار در مقایسه با گروه کنترل؛ † نشانه تفاوت معنیدار در مقایسه با گروه مکمل تورین؛ ‡ نشانه تفاوت معنیدار در مقایسه با گروه تمرین ترکیبی + مکمل تورین؛ # نشانه تفاوت معنیدار در مقایسه با گروه کنترل سالم

شکل 2: مقایسه کلسترول تام سرمی موشهای صحرایی پس از هشت هفته تمرین ترکیبی مقاومتی- استقامتی و مصرف مکمل تورین در گروههای مختلف
* نشانه تفاوت معنیدار در مقایسه با گروه کنترل
همانطور که در جدول 3 مشاهده میشود، نتایج آزمون Anova دو راهه نشان داد در پایان هشت هفته، بین وزن بدن (0/0001=P)، BMI (P=0/001)، و بیان پروتئین گیرنده ایکس کبدی (0/0001=P) گروههای تمرین، مکمل، تمرین+ مکمل، کنترل و کنترل سالم تفاوت معنیداری وجود دارد، در حالیکه بین کلسترول تام سرمی (0/176=P) گروههای مختلف تفاوت معنیداری وجود ندارد (جدول 3). نتایج آزمون تعقیبی LSD نشان داد که بیان پروتئین LXR کبدی بعد از هشت هفته در گروههای مکمل (0/0001=P) و تمرین+ مکمل (0/0001=P) در مقایسه با گروه کنترل، به ترتیب 43/41 درصد و 62/64 درصد بهطور معنیداری کاهش یافت. همچنین، بیان پروتئین LXR کبدی در گروههای تمرین + مکمل (0/0001=P) و مکمل (0/011=P) در مقایسه با گروه تمرین به ترتیب 120/59 درصد و 45/63 درصد بهطور معنیداری کاهش یافت. بیان پروتئین LXR کبدی در گروه کنترل در مقایسه با گروه کنترل سالم (0/0001=P)، 82 درصد بهطور معنیداری افزایش یافت (جدول3، شکل1). سطح سرمی کلسترول تام بعد از هشت هفته در گروه تمرین + مکمل (0/027=P) در مقایسه با گروه کنترل، 8/85 درصد بهطور معنیداری کاهش یافت (جدول3، شکل2). وزن بدن بعد از هشت هفته در گروه¬های تمرین (0/002=P)، مکمل (0/0001=P) و تمرین + مکمل (0/0001=P) در مقایسه با گروه کنترل بهطور معنیداری کمتر بود. در حالیکه در گروه تمرین در مقایسه با گروه مکمل (0/001=P) و در مقایسه با گروه تمرین + مکمل (0/010=P) بهطور معنیداری بیشتر بود. وزن بدن بعد از هشت هفته در گروه کنترل در مقایسه با گروه کنترل سالم (0/0001=P) بهطور معنیداری کمتر بود. BMI بعد از هشت هفته در گروههای تمرین (0/016=P)، مکمل (0/0001=P) و تمرین + مکمل (0/0001=P) در مقایسه با گروه کنترل بهطور معنیداری کمتر بود. BMI بعد از هشت هفته در گروه کنترل در مقایسه با گروه کنترل سالم (0/029=P) بهطور معنیداری کمتر بود. غذای مصرفی بعد از هشت هفته در گروههای تمرین (0/032=P)، مکمل (0/0001=P) و تمرین + مکمل (0/003=P) در مقایسه با گروه کنترل بهطور معنیداری بیشتر بود. در حالیکه، در گروه تمرین دیابتی در مقایسه با گروههای مکمل (0/008=P) بهطور معنیداری بیشتر بود.
بحث
یافتههای تحقیق حاضر نشان داد که هشت هفته مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی)، بیان پروتئین گیرندههای LXR کبدی در موش صحرایی نر ویستار دیابتی را بهطور معنیداری کاهش داد. در حالیکه، دیابت منجر به افزایش معنیدار بیان پروتئین گیرندههای LXR کبدی در موشهای نر ویستار دیابتی شد. فعال¬شدن گیرنده¬های LXR کبدی در موشهای دیابتی میزان قند خون را طبیعی میکند و حساسیت به انسولین و مقاومت به انسولین را بهبود میبخشد (31، 15، 10). مطالعات نشان دادهاند که LXR اثرات مفیدی بر کنترل اختلالات متابولیک دارد، بهطوریکه در مدلهای حیوانی دیابت، تحمل گلوکز را بهبود میبخشد (32). در واقع، هشت هفته مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی)، بیان پروتئین گیرندههای LXR کبدی را در تحقیق حاضر بهطور معنیداری کاهش داد. با توجه به عدم تغییر معنیدار این گیرنده در گروه تمرین ترکیبی (مقاومتی- استقامتی) میتوان گفت علت احتمالی کاهش گیرنده LXR در گروههای مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی)، ناشی از مصرف مکمل تورین بوده است. یافتههای تحقیق حاضر در خصوص کاهش بیان پروتئین گیرندههای LXR کبدی پس از مصرف مکمل تورین با و بدون تمرین ترکیبی (مقاومتی- استقامتی) و نیز افزایش این گیرندهها پس از هشت هفته دیابتی¬کردن موشها با یافتههای نوری و همکاران در سال 2022 (20) و حاجیقاسم و همکاران در سال 2018 (21)، پینتو و همکاران در سال 2015 (22) و گایینی و همکاران در سال 1398 (23) همخوانی ندارد. علت احتمالی ناهمخوانیها در تحقیقات انجام شده، تناقضات در شدت، مدت، نوع تمرین، نوع مکمل، تعداد نمونه در هر گروه، سن آزمودنی-ها و نیز نوع بیماری بود. تمرین مقاومتی- استقامتی در تحقیق حاضر به مدت هشت هفته انجام شد، در حالیکه در تحقیق نوری و همکاران در سال 2022 یک جلسه تمرین اینتروال و یک جلسه تمرین مداوم بود. روش اندازهگیری بیان پروتئین گیرندههای LXR کبدی در تحقیق حاضر روش وسترنبلات و در تحقیق نوری و همکاران RealTime-PCR بود. همچنین تعداد نمونه در هر گروه در تحقیق حاضر 10 سر موش در هر گروه و در تحقیق نوری و همکاران در سال 2022، 7 سر موش در هر گروه بود. مکمل مصرف شده در تحقیق حاضر تورین و در تحقیق نوری و همکاران رزوراترول بود. تمرین مقاومتی- استقامتی در تحقیق حاضر به مدت هشت هفته انجام شد، در حالیکه در تحقیق حاجی قاسم و همکاران در سال 2018 هشت هفته تمرینات اینتروال و مداوم بود. روش اندازهگیری بیان پروتئین گیرندههای LXR کبدی در تحقیق حاضر روش وسترنبلات و در تحقیق حاجیقاسم و همکاران در سال 2018 و همکاران RealTime-PCR بود. همچنین تعداد نمونه در تحقیق حاجیقاسم و همکاران در سال 2018، 7 سر موش مسن در هر گروه بود. تمرین ترکیبی در تحقیق حاضر به مدت هشت هفته انجام شد، در حالیکه در تحقیق حاجی پینتو و همکاران در سال 2015 هشت هفته تمرینات هوازی بود. موشهای تحقیق حاضر دیابتی شده بودند ولی در تحقیق پینتو و همکاران در سال 2015 موشهای سالم بودند. هم-چنین تعداد نمونه در هر گروه در تحقیق حاضر 10 سر موش در هر گروه و در تحقیق پینتو و همکاران در سال 2015، 6 سر موش در هر گروه بود. علت احتمالی کاهش بیان پروتئین گیرندههای LXR کبدی پس از هشت هفته مصرف مکمل با و بدون تمرین ترکیبی در تحقیق حاضر این است که مکمل تورین احتمالاً تعداد ماکروفاژها را در مونوسیتها کاهش داد که این امر منجر به کاهش ABCA1، APoA1 و CYP7A1 و در نهایت کاهش بیان گیرندههای LXR کبدی شد (35-32). این امر نیازمند بررسی بیشتر میباشد. در تحقیق حاضر، هشت هفته تمرین ترکیبی (مقاومتی- استقامتی)، زمان کافی برای اعمال تغییرات معنیدار در بیان پروتئین گیرندههای LXR کبدی نبود. یافتههای تحقیق حاضر در خصوص عدم تغییر معنیدار بیان پروتئین گیرندههای LXR کبدی پس از هشت هفته تمرین ترکیبی با یافته¬های گایینی و همکاران در سال 1398 (23) و کوراچ آندره و همکاران در سال 2015 (32)، نگو ساک و همکاران در سال 2015 (34)، کوته و همکاران در سال 2013 (35)، کاظمی نسب و همکاران در سال 1399 (6)، رحمتی احمد آباد و همکاران در سال 1395 (24) همخوانی دارد. یکی دیگر از یافتههای تحقیق حاضر نشان داد که هشت هفته تمرین ترکیبی + مصرف مکمل تورین منجر به کاهش معنیدار سطح سرمی کلسترول تام در موشهای نر ویستار دیابتی شد. هشت تمرین ترکیبی و مصرف مکمل تورین هر یک به تنهایی تغییر معنیداری در سطح سرمی کلسترول تام در موشهای صحرایی نر ویستار دیابتی ایجاد نکرد. بنابراین میتوان گفت که هشت هفته تمرین ترکیبی + مصرف مکمل دیابتی در مقایسه با هریک به تنهایی اثر فزاینده بر کاهش سطح سرمی کلسترول تام در موشهای نر ویستار دیابتی دارد. یافتههای تحقیق حاضر در خصوص کاهش سطح سرمی کلسترول تام پس از هشت هفته تمرین ترکیبی + مصرف مکمل تورین با یافتههای نوری و همکاران در سال 2022 (20)، صمدپور و همکاران در سال 2021 (25)، حاجی قاسم و همکاران در سال 2018 (21)، پینتو و همکاران در سال 2015 (22)، نگو ساک و همکاران در سال 2015 (34) و کوته و همکاران در سال 2013 (35) همخوانی دارد؛ در حالیکه با یافتههای تحقیق رحمتی احمد آباد و همکاران در سال 1395 (24) همخوانی ندارد. رحمتی احمدآباد و همکاران در سال 1395 نشان دادند هشت هفته مدت تمرین تناوبی شدید و مکمل سازی روغن بذر کتان بر کلسترول تام سرمی اثر معنیداری نداشت (24). یکی از دلایل احتمالی این ناهمخوانی، مصرف مکمل تورین در مقابل روغن بذر کتان بود. تمرینات تحقیق حاضر تمرین ترکیبی و در تحقیق رحمتی احمدآباد و همکاران در سال 1395 تمرین هوازی بود. هم-چنین تعداد نمونه در هر گروه در تحقیق حاضر 10 سر موش در هر گروه و در تحقیق رحمتی احمدآباد و همکاران در سال 1395، 5 سر موش در هر گروه بود. علت احتمالی عدم تغییر معنیدار سطح سرمی کلسترول تام پس از هشت هفته تمرین ترکیبی + مصرف مکمل تورین به تنهایی کافی نبودن شدت و مدت تمرینات و کوتاه بودن طول دوره مصرف و دوز مصرفی مکمل تورین بوده است. تورین بر LXR، CYP7A1 و کلسترول تأثیر دارد. CYP7A1سطح کلسترول را کاهش میدهد چون کلسترول تام را در کبد به اسیدهای صفراوی تبدیل میکند (34،36). احتمالاً تمرین ترکیبی و تورین با هم سطح کلسترول تام را کاهش میدهند. در تحقیق حاضر، هشت هفته مصرف مکمل تورین با و بدون تمرین ترکیبی، وزن بدن و BMI را بهطور معنیداری کاهش داد. علت کاهش وزن بدن احتمالاً ناشی از کاهش بیشتر چربی در اثر تمرین به تنهایی است. با توجه به افزایش غذای مصرفی در گروه تمرین در مقایسه با گروههای مصرف مکمل تورین با و بدون تمرین ترکیبی می¬توان گفت که تمرین باعث سوختن بیشتری چربی-ها شده است، اما توده عضلانی در مدت زمان هشت هفته تمرین ترکیبی مقاومتی+ استقامتی افزایش معنیداری نداشته است. یافتههای تحقیق حاضر در خصوص کاهش وزن و BMI با یافتههای بابایی و همکاران در سال 2015 (29) و سانگ سیرسوان و همکاران در سال 2009 (37) همخوانی دارد، در حالیکه با یافتههای زوث و همکاران در سال 2012 (38) و ایشی کورا و همکاران در سال 2011 (39) همخوانی ندارد. بابایی و همکاران در سال 2015 نشان دادند که هشت هفته تمرین ترکیبی استقامتی - مقاومتی و استروژن درمانی جایگزینی، وزن بدن و BMI را در موشهای ماده اوارکتومی شده بهطور معنیداری کاهش داد (29). سانگ سیرسوان و همکاران در سال 2009 نشان دادند که تمرین ورزشی، وزن بدن و BMI را در موشهای تمرین کرده کاهش داد (37). در حالیکه، زوث و همکاران در سال 2012 (38) و ایشی کورا و همکاران در سال 2011 (39) تفاوت معنیداری در وزن موشهای دریافت کننده 3 هفته مکمل تورین بعد از ورزش مشاهده نکردند.
نتیجهگیری
در کل، مصرف هشت هفته مکمل تورین با و بدون تمرین ترکیبی موجب کاهش معنیدار بیان پروتئین گیرندههای LXR کبدی، کلس ترول تام سرمی، وزن بدن و BMI در موشهای صحرایی نر ویستار دیابتی شد. هشت هفته تمرین ترکیبی + مصرف مکمل تورین منجر به کاهش معنیدار سطح سرمی کلسترول تام در موشهای نر ویستار دیابتی شد.
سپاسگزاری
بدینوسیله از کلیه پرسنل محترم دانشگاه علوم پزشکی اردبیل و حوزه معاونت پژوهشی دانشگاه محقق اردبیلی که با همکاری خود امکان اجرای تحقیق حاضر را فراهم کردند، تشکر و قدردانی می¬شود. همچنین، کد طرح تحقیقاتی مصوب دانشگاه محقق اردبیلی 23142/20/د/1402 میباشد.
حامی مالی: مقاله با حمایت مالی دانشگاه محقق اردبیلی انجام شده است.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
این مطالعه کلیه قوانین و مقررات بینالمللی کار با حیوانات آزمایشگاهی را رعایت و توسط کمیته اخلاق کار با حیوانات دانشگاه محقق اردبیلی تأیید شد و دارای کد اخلاق (IR.UMAREC.1402.088) می باشد.
مشارکت نویسندگان
آمنه پوررحیم قورقچی در ارائه ایده، آمنه پوررحیم قورقچی در طراحی مطالعه، آمنه پوررحیم قورقچی و آیدین ولیزاده اورنج در جمعآوری دادهها، آمنه پوررحیم قورقچی و آیدین ولیزاده اورنج در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Chawla A, Chawla R, Jaggi S. Microvasular and Macrovascular Complications in Diabetes Mellitus: Distinct or Continuum?. Indian J Endocrinol Metab 2016; 20(4): 546-51.
2- Cremona A, OGorman C, Cotter A, Saunders J, Donnelly A. Effect of Exercise Modality on Markers of Insulin Sensitivity and Blood Glucose Control in Pregnancies Complicated with Gestational Diabetes Mellitus: A Systematic Review. Obesit Sci Pract 2018; 4(5): 455-467.
3- Askari R, Haghighi AH, Badri B. The Effect of Combined Training (Endurance- Resistance) and Ginger Supplementation on Cardiorespiratory Endurance, Body Composition and Insulin Resistance among Obese Females with Type 2 Diabetes. Journal of Health 2020; 10(4): 489-503. [Persian]
4- Teixeira-Lemos E, Nunes S, Teixeira F, Reis F. Regular Physical Exercise Training Assists in Preventing Type 2 Diabetes Development: Focus on Its Antioxidant and Anti-Inflammatory Properties. Cardiovascular Diabetology 2011; 10(12): 1-15.
5- Batitucci G, Terrazas S, Nóbrega M, Carvalho E, Papoti M, Marchini J, et al. Effects of Taurine Supplementation in Elite Swimmers Performance. Motriz, Rio Claro 2018; 24(1): e1018137.
6- Kazemi Nasab F, Marandi SM, Shirkhani S, Sheikhanian Poor A, Ghaedi K. The Effect of 8 Weeks Aerobic Exercise on Lxra, PEPCK, and G6PC2 Mrna in Obese Prediabetic Mice. Sport Physiology 2021; 12(48): 17-38. [Persian]
7- Ding J, Nguyen AT, Lohman K, Hensley MT, Parker D, Hou L, et al. LXR Signaling Pathways Link Cholesterol Metabolism with Risk for Prediabetes and Diabetes. J Clin Invest. 2024; 134(10): e173278.
8- Dixon ED, Nardo AD, Claudel T, Trauner M. Review: The Role of Lipid Sensing Nuclear Receptors (PPARs and LXR) and Metabolic Lipases in Obesity, Diabetes and NAFLD. Genes 2021; 12(5): 645.
9- Hoseini Z, Behpour N, Hoseini R. Aerobic Training with Moderate or High Doses of Vitamin D Improve Liver Enzymes, Lxrα and PGC‑1α Levels in Rats with T2DM. Sci Rep 2024; 14(1): 6409.
10- Kazeminasab F, Marandi M, Ghaedi K, Esfarjani F, Moshtaghian J. Endurance Training Enhances Lxrα Gene Expression in Wistar Male Rats. Eur J Appl Physiol 2013; 113(9): 2285-90.
11- Cao G, Liang Y, Broderick CL, Oldham BA, Beyer TP, Schmidt RJ, et al. Antidiabetic Action of a Liver X Receptor Agonist Mediated by Inhibition of Hepatic Gluconeogenesis. J Biol Chem 2003; 278(2): 1131-6
12- Laffitte BA, Chao LC, Li J, Walczak R, Hummasti S, Joseph SB, et al. Activation of Liver X Receptor Improves Glucose Tolerance through Coordinate Regulation of Glucose Metabolism in Liver and Adipose Tissue. Proc Natl Acad Sci USA 2003; 100(9): 5419-24.
13- Kratzer A, Buchebner M, Pfeifer T, Becker TM, Uray G, Miyazaki M, et al. Synthetic LXR Agonist Attenuates Plaque Formation in Apoe-/-Mice without Inducing Liver Steatosis and Hypertriglyceridemia. J Lipid Res 2009; 50(2): 312-26.
14- Fernandez-Veledo S, Nieto-Vazquez I, Rondinone C, Lorenzo M. Liver X Receptor Agonists Ameliorate Tnfα-Induced Insulin Resistance in Murine Brown Adipocytes by Downregulating Protein Tyrosine Phosphatase-1B Gene Expression. Diabetologia 2006; 49(12): 3038-48.
15- Balasubramaniana B, Kimb HJ, Mothanac RA, Kimd YO, Siddiqui NA. Role of LXR Alpha in Regulating Expression of Glucose Transporter4 in Adipocytes - Investigation on Improvement of Health of Diabetic Patients. J Infect Public Health 2020; 13(1): 244-52.
16- Ghayyem Alaee N, Pourrahim Ghouroghchi A, Anoushirvani S. The Effect of Eight Weeks of Aerobic-Yoga Training on Serum Irisin Level, Lipid Profile and Body Composition of Obese Women. Metabolism and Exercise 2021; 11(1): 59-74. [Persian]
17- Pahlevani M, Bashiri J, Pouzesh-Jadidi R, Hashem Kandi Asadi R, Dadkhah M. The Effect of Eight Weeks of Simultaneous Endurance-Resistance Exercise on the Serum Levels of BDNF, CRP and IL-6 in Type1 Diabetic Male Wistar Rats. Journal of Sport in Biomotor Sciences 2023; 14(28): 105-13. [Persian]
18- Schaffer S, Kim HW. Effects and Mechanisms of Taurine as a Therapeutic Agent. Biomol Ther 2018; 26(3): 225-41.
19- Hoang MH, Jia Y, Jun HJ, Lee JH, Hwang KY, Cho DW. Taurine Is a Liver X Receptor-Ligand and Activates Transcription of Key Genes in the Reverse Cholesterol Transport without Inducing Hepatic Lipogenesis. Molecular Nutrition and. Food Research 2012; 56(6): 900-11.
20- Nouri A, Farzanegi P, Azarbayjani MA. Effects Of Resveratrol Supplementation and Exercise on Apoptosis, Lipid Profile, and Expression of Farnesoid X Receptor, Liver X Receptor and Sirtuin 1 Genes in the Liver of Type 1 Diabetic Rats. Mljgoums 2022; 16(4): 39-46.
21- Hajighasem A, Farzanegi P, Mazaheri Z, Naghizadeh M, Salehi G. Effects of Resveratrol, Exercises and their Combination on Farnesoid X Receptor, Liver X Receptor and Sirtuin 1 Gene Expression and Apoptosis in the Liver of Elderly Rats with Nonalcoholic Fatty Liver. Peer J 2018; 6: 5522.
22- Pinto PR, Débora Moura Rocco DDF, Okuda LS, Machado-Lima A, Castilho G, da Silva KS, et al. Aerobic Exercise Training Enhances the in Vivo Cholesterol Trafficking from Macrophages to the Liver Independently of Changes in the Expression of Genes Involved in Lipid Flux in Macrophages and Aorta. Lipids Health Dis 2015; 14: 109.
23- Gaeini A, Ramezani N, Shafiei L. Changes of LXR Α, GLUT2 Genes Expression in Liver and Insulin Resistance after Aerobic Training in Type 2 Diabetic Rats. Metabolism and Exercise 2019; 9(1): 1-13. [Persian]
24- Rahmati-Ahmadabad S, Azarbayjani M, Nasehi M. The Effects of High-Intensity Interval Training with Supplementation of Flaxseed Oil on BDNF Mrna Expression and Pain Feeling in Male Rats. Ann Appl Sport Sci 2017; 5(4): 1-12.
25- Samadpour Masouleh SH, Bagheri R, Ashtary-Larky D, Cheraghloo N, Wong A, Yousefi Bilesvar O. et al. The Effects of TRX Suspension Training Combined with Taurine Supplementation on Body Composition, Glycemic and Lipid Markers in Women with Type 2 Diabetes. Nutrients 2021; 13(3958): 1-15.
26- Maclaren D, Morton J. Biochemistry for Sport and Exercise Metabolism. Eftekhar E, Daryanoosh F, Amir Azodi M, Mahbodi M, translator. Second publication. Tehran: Hatmi; 2012: 100-250.
27- Sedaghat M, Choobineh S. Ravasi AA. Taurine with Combined Aerobic and Resistance Exercise Training Alleviates Myocardium Apoptosis in STZ-Induced Diabetes Rats Via Akt Signaling Pathway. Life Sci 2020; 258: 118225.
28- Sadighi A, Abdi A, Azarbayjani MA, Barari AR. Response of Some Apoptotic Indices to Six Weeks of Aerobic Training in Streptozotocin-Induced Diabetic Rats. Medical Laboratory Journal 2021; 15(1): 33-9. [Persian]
29- Babaei P, Pourrahim Ghouroghchi A, Damirchi A, Soltani Tehrani B. The Interactive Effect of Aerobic-Resistance Training and Estrogen Therapy on Metabolic Syndrome Indices and Omentin-1. Physiol Pharmacol 2015; 19(3): 200-7.
30- Biglari S, Gaeini AA, Kordi MR, Ghardashi Afousi AR. The Effect of 8 Weeks High-Intensity Interval Training on Myostatin and Follistatin Gene Expression in Gastrocnemius Muscle of the Rats. J Arak Uni Med Sci 2018; 21(130): 1-10. [Persian]
31- Lu K, Wang L, Wang C, Yang Y, Hu D, Ding R. Effects of High-Intensity Interval Versus Continuous Moderate‑Intensity Aerobic Exercise on Apoptosis, Oxidative Stress and Metabolism of the Infarcted Myocardium in a Rat Model. Mol Med Reports 2015; 12(2): 2374-82.
32- Korach-André M, Gustafsson J-Å. Liver X Receptors as Regulators of Metabolism. Biomol Concepts 2015; 6(3): 177-90.
33- Meng L, Lu C, Wu B, Lan CH, Mo L, Chen CH, at al. Taurine Antagonizes Macrophages M1 Polarization by Mitophagy – Glycolysis Switch Blockage Via Dragging SAM-PP2Ac Transmethylation. Front Immunol 2021; 12: 648913.
34- Ngo Sock ET, Farahnak Z, Lavoie JM. Exercise Training Decreases Gene Expression of Endo-and Xeno-Sensors in Rat Small Intestine. Appl Physiol Nutr Metab 2014; 39(10): 1098-103
35- Cote I, Sock ET, Levy E, Lavoie JM. An Atherogenic Diet Decreases Liver FXR Gene Expression and Causes Severe Hepatic Steatosis and Hepatic Cholesterol Accumulation: Effect of Endurance Training. Eur J Nutr. 2013; 52(5): 1523-32.
36- Guo J, Gao Y, Cao X, Zhang J, Chen W. Cholesterol-Lowing Effect of Taurine in Hepg2 Cell. Lipids Health Dis 2017; 16: 56.
37- Saengsirisuwan V, Pongseeda S, Prasannarong M, Vichaiwong K, Toskulkao C. Modulation of Insulin Resistance in Ovariectomized Rats by Endurance Exercise Training and Estrogen Replacement. Metabolism 2009; 58(1): 38-47.
38- Zoth N, Weigt C, Zengin S, Selder O, Selke N, Kalicinski M, et al. Metabolic Effects of Estrogen Substitution in Combination with Targeted Exercise Training on the Therapy of Obesity in Ovariectomized Wistar Rats. The Journal of Steroid Biochemistry and Molecular Biology 2012; 130(1-2): 64-72.
39- Ishikura K, Miyazaki T, Ra SG, Endo S, Nakamura Y, Matsuzaka T, et al. Effect of Supplementation on the Alterations in Amino Acid Content in Skeletal Muscle with Exercise in Rat. J Sports Sci Med 2011; 10(2): 306-14
1- Chawla A, Chawla R, Jaggi S. Microvasular and Macrovascular Complications in Diabetes Mellitus: Distinct or Continuum?. Indian J Endocrinol Metab 2016; 20(4): 546-51.
2- Cremona A, OGorman C, Cotter A, Saunders J, Donnelly A. Effect of Exercise Modality on Markers of Insulin Sensitivity and Blood Glucose Control in Pregnancies Complicated with Gestational Diabetes Mellitus: A Systematic Review. Obesit Sci Pract 2018; 4(5): 455-467.
3- Askari R, Haghighi AH, Badri B. The Effect of Combined Training (Endurance- Resistance) and Ginger Supplementation on Cardiorespiratory Endurance, Body Composition and Insulin Resistance among Obese Females with Type 2 Diabetes. Journal of Health 2020; 10(4): 489-503. [Persian]
4- Teixeira-Lemos E, Nunes S, Teixeira F, Reis F. Regular Physical Exercise Training Assists in Preventing Type 2 Diabetes Development: Focus on Its Antioxidant and Anti-Inflammatory Properties. Cardiovascular Diabetology 2011; 10(12): 1-15.
5- Batitucci G, Terrazas S, Nóbrega M, Carvalho E, Papoti M, Marchini J, et al. Effects of Taurine Supplementation in Elite Swimmers Performance. Motriz, Rio Claro 2018; 24(1): e1018137.
6- Kazemi Nasab F, Marandi SM, Shirkhani S, Sheikhanian Poor A, Ghaedi K. The Effect of 8 Weeks Aerobic Exercise on Lxra, PEPCK, and G6PC2 Mrna in Obese Prediabetic Mice. Sport Physiology 2021; 12(48): 17-38. [Persian]
7- Ding J, Nguyen AT, Lohman K, Hensley MT, Parker D, Hou L, et al. LXR Signaling Pathways Link Cholesterol Metabolism with Risk for Prediabetes and Diabetes. J Clin Invest. 2024; 134(10): e173278.
8- Dixon ED, Nardo AD, Claudel T, Trauner M. Review: The Role of Lipid Sensing Nuclear Receptors (PPARs and LXR) and Metabolic Lipases in Obesity, Diabetes and NAFLD. Genes 2021; 12(5): 645.
9- Hoseini Z, Behpour N, Hoseini R. Aerobic Training with Moderate or High Doses of Vitamin D Improve Liver Enzymes, Lxrα and PGC‑1α Levels in Rats with T2DM. Sci Rep 2024; 14(1): 6409.
10- Kazeminasab F, Marandi M, Ghaedi K, Esfarjani F, Moshtaghian J. Endurance Training Enhances Lxrα Gene Expression in Wistar Male Rats. Eur J Appl Physiol 2013; 113(9): 2285-90.
11- Cao G, Liang Y, Broderick CL, Oldham BA, Beyer TP, Schmidt RJ, et al. Antidiabetic Action of a Liver X Receptor Agonist Mediated by Inhibition of Hepatic Gluconeogenesis. J Biol Chem 2003; 278(2): 1131-6
12- Laffitte BA, Chao LC, Li J, Walczak R, Hummasti S, Joseph SB, et al. Activation of Liver X Receptor Improves Glucose Tolerance through Coordinate Regulation of Glucose Metabolism in Liver and Adipose Tissue. Proc Natl Acad Sci USA 2003; 100(9): 5419-24.
13- Kratzer A, Buchebner M, Pfeifer T, Becker TM, Uray G, Miyazaki M, et al. Synthetic LXR Agonist Attenuates Plaque Formation in Apoe-/-Mice without Inducing Liver Steatosis and Hypertriglyceridemia. J Lipid Res 2009; 50(2): 312-26.
14- Fernandez-Veledo S, Nieto-Vazquez I, Rondinone C, Lorenzo M. Liver X Receptor Agonists Ameliorate Tnfα-Induced Insulin Resistance in Murine Brown Adipocytes by Downregulating Protein Tyrosine Phosphatase-1B Gene Expression. Diabetologia 2006; 49(12): 3038-48.
15- Balasubramaniana B, Kimb HJ, Mothanac RA, Kimd YO, Siddiqui NA. Role of LXR Alpha in Regulating Expression of Glucose Transporter4 in Adipocytes - Investigation on Improvement of Health of Diabetic Patients. J Infect Public Health 2020; 13(1): 244-52.
16- Ghayyem Alaee N, Pourrahim Ghouroghchi A, Anoushirvani S. The Effect of Eight Weeks of Aerobic-Yoga Training on Serum Irisin Level, Lipid Profile and Body Composition of Obese Women. Metabolism and Exercise 2021; 11(1): 59-74. [Persian]
17- Pahlevani M, Bashiri J, Pouzesh-Jadidi R, Hashem Kandi Asadi R, Dadkhah M. The Effect of Eight Weeks of Simultaneous Endurance-Resistance Exercise on the Serum Levels of BDNF, CRP and IL-6 in Type1 Diabetic Male Wistar Rats. Journal of Sport in Biomotor Sciences 2023; 14(28): 105-13. [Persian]
18- Schaffer S, Kim HW. Effects and Mechanisms of Taurine as a Therapeutic Agent. Biomol Ther 2018; 26(3): 225-41.
19- Hoang MH, Jia Y, Jun HJ, Lee JH, Hwang KY, Cho DW. Taurine Is a Liver X Receptor-Ligand and Activates Transcription of Key Genes in the Reverse Cholesterol Transport without Inducing Hepatic Lipogenesis. Molecular Nutrition and. Food Research 2012; 56(6): 900-11.
20- Nouri A, Farzanegi P, Azarbayjani MA. Effects Of Resveratrol Supplementation and Exercise on Apoptosis, Lipid Profile, and Expression of Farnesoid X Receptor, Liver X Receptor and Sirtuin 1 Genes in the Liver of Type 1 Diabetic Rats. Mljgoums 2022; 16(4): 39-46.
21- Hajighasem A, Farzanegi P, Mazaheri Z, Naghizadeh M, Salehi G. Effects of Resveratrol, Exercises and their Combination on Farnesoid X Receptor, Liver X Receptor and Sirtuin 1 Gene Expression and Apoptosis in the Liver of Elderly Rats with Nonalcoholic Fatty Liver. Peer J 2018; 6: 5522.
22- Pinto PR, Débora Moura Rocco DDF, Okuda LS, Machado-Lima A, Castilho G, da Silva KS, et al. Aerobic Exercise Training Enhances the in Vivo Cholesterol Trafficking from Macrophages to the Liver Independently of Changes in the Expression of Genes Involved in Lipid Flux in Macrophages and Aorta. Lipids Health Dis 2015; 14: 109.
23- Gaeini A, Ramezani N, Shafiei L. Changes of LXR Α, GLUT2 Genes Expression in Liver and Insulin Resistance after Aerobic Training in Type 2 Diabetic Rats. Metabolism and Exercise 2019; 9(1): 1-13. [Persian]
24- Rahmati-Ahmadabad S, Azarbayjani M, Nasehi M. The Effects of High-Intensity Interval Training with Supplementation of Flaxseed Oil on BDNF Mrna Expression and Pain Feeling in Male Rats. Ann Appl Sport Sci 2017; 5(4): 1-12.
25- Samadpour Masouleh SH, Bagheri R, Ashtary-Larky D, Cheraghloo N, Wong A, Yousefi Bilesvar O. et al. The Effects of TRX Suspension Training Combined with Taurine Supplementation on Body Composition, Glycemic and Lipid Markers in Women with Type 2 Diabetes. Nutrients 2021; 13(3958): 1-15.
26- Maclaren D, Morton J. Biochemistry for Sport and Exercise Metabolism. Eftekhar E, Daryanoosh F, Amir Azodi M, Mahbodi M, translator. Second publication. Tehran: Hatmi; 2012: 100-250.
27- Sedaghat M, Choobineh S. Ravasi AA. Taurine with Combined Aerobic and Resistance Exercise Training Alleviates Myocardium Apoptosis in STZ-Induced Diabetes Rats Via Akt Signaling Pathway. Life Sci 2020; 258: 118225.
28- Sadighi A, Abdi A, Azarbayjani MA, Barari AR. Response of Some Apoptotic Indices to Six Weeks of Aerobic Training in Streptozotocin-Induced Diabetic Rats. Medical Laboratory Journal 2021; 15(1): 33-9. [Persian]
29- Babaei P, Pourrahim Ghouroghchi A, Damirchi A, Soltani Tehrani B. The Interactive Effect of Aerobic-Resistance Training and Estrogen Therapy on Metabolic Syndrome Indices and Omentin-1. Physiol Pharmacol 2015; 19(3): 200-7.
30- Biglari S, Gaeini AA, Kordi MR, Ghardashi Afousi AR. The Effect of 8 Weeks High-Intensity Interval Training on Myostatin and Follistatin Gene Expression in Gastrocnemius Muscle of the Rats. J Arak Uni Med Sci 2018; 21(130): 1-10. [Persian]
31- Lu K, Wang L, Wang C, Yang Y, Hu D, Ding R. Effects of High-Intensity Interval Versus Continuous Moderate‑Intensity Aerobic Exercise on Apoptosis, Oxidative Stress and Metabolism of the Infarcted Myocardium in a Rat Model. Mol Med Reports 2015; 12(2): 2374-82.
32- Korach-André M, Gustafsson J-Å. Liver X Receptors as Regulators of Metabolism. Biomol Concepts 2015; 6(3): 177-90.
33- Meng L, Lu C, Wu B, Lan CH, Mo L, Chen CH, at al. Taurine Antagonizes Macrophages M1 Polarization by Mitophagy – Glycolysis Switch Blockage Via Dragging SAM-PP2Ac Transmethylation. Front Immunol 2021; 12: 648913.
34- Ngo Sock ET, Farahnak Z, Lavoie JM. Exercise Training Decreases Gene Expression of Endo-and Xeno-Sensors in Rat Small Intestine. Appl Physiol Nutr Metab 2014; 39(10): 1098-103
35- Cote I, Sock ET, Levy E, Lavoie JM. An Atherogenic Diet Decreases Liver FXR Gene Expression and Causes Severe Hepatic Steatosis and Hepatic Cholesterol Accumulation: Effect of Endurance Training. Eur J Nutr. 2013; 52(5): 1523-32.
36- Guo J, Gao Y, Cao X, Zhang J, Chen W. Cholesterol-Lowing Effect of Taurine in Hepg2 Cell. Lipids Health Dis 2017; 16: 56.
37- Saengsirisuwan V, Pongseeda S, Prasannarong M, Vichaiwong K, Toskulkao C. Modulation of Insulin Resistance in Ovariectomized Rats by Endurance Exercise Training and Estrogen Replacement. Metabolism 2009; 58(1): 38-47.
38- Zoth N, Weigt C, Zengin S, Selder O, Selke N, Kalicinski M, et al. Metabolic Effects of Estrogen Substitution in Combination with Targeted Exercise Training on the Therapy of Obesity in Ovariectomized Wistar Rats. The Journal of Steroid Biochemistry and Molecular Biology 2012; 130(1-2): 64-72.
39- Ishikura K, Miyazaki T, Ra SG, Endo S, Nakamura Y, Matsuzaka T, et al. Effect of Supplementation on the Alterations in Amino Acid Content in Skeletal Muscle with Exercise in Rat. J Sports Sci Med 2011; 10(2): 306-14
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/5/16 | پذیرش: 1403/7/29 | انتشار: 1403/12/15
دریافت: 1403/5/16 | پذیرش: 1403/7/29 | انتشار: 1403/12/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







