دوره 32، شماره 9 - ( آذر 1403 )
جلد 32 شماره 9 صفحات 8269-8256 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shafaie E, Salehi Z, Eghbali S. Green Synthesis of Silver Nanoparticles Using Sclerorhachis Leptoclada Rech. F. Leaf Extract: Characterization and Investigation of Antibacterial Activities. JSSU 2024; 32 (9) :8256-8269
URL: http://jssu.ssu.ac.ir/article-1-6243-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6243-fa.html
شفائی ابراهیم، صالحی زهرا، اقبالی سمیرا. سنتز سبز نانوذرات نقره با استفاده از عصاره برگ مستار: ویژگییابی و بررسی اثرات ضد باکتریایی (Sclerorhachis leptoclada Rech.f.). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (9) :8256-8269
متن کامل [PDF 1193 kb]
(416 دریافت)
| چکیده (HTML) (1344 مشاهده)
References:
1- Mirmohammadi ST, Eghbali S, Mohammadparast-Tabas P, Yousefi M. Green Synthesis of Silver Nanoparticles Using Plantago Lanceolata Seed Extract: Characterization and Investigation of Antibacterial Activities. J Birjand Univ Med Sci 2024; 31(2): 127-39. [Persian]
2- Bafana A, Kumar SV, Temizel-Sekeryan S, Dahoumane SA, Haselbach L, Jeffryes CS. Evaluating Microwave-Synthesized Silver Nanoparticles from Silver Nitrate with Life Cycle Assessment Techniques. Sci Total Environ 2018; 636: 936-43.
3- Marturano V, Kozlowska J, Bajek A, Giamberini M, Ambrogi V, Cerruti P, et al. Photo-Triggered Capsules Based on Lanthanide-Doped Upconverting Nanoparticles for Medical Applications. Coord Chem Rev 2019; 398: 213013.
4- Bhushan B. Introduction to Nanotechnology. 4th Edition. Springer Handbook of Nanotechnology: Springer; 2017; 1-19.
5- Keyhanfar M, Mansouri HA. The Role of Plant Antioxidants in the Synthesis of Metal Nanoparticles. J Plant Process Fun 2022; 1(1): 67-76. [Persian]
6- Campos S, Salazar R, Arancibia-Miranda N, Rubio M, Aranda M, García A, et al. Nafcillin Degradation by Heterogeneous Electro-Fenton Process Using Fe, Cu and Fe/Cu Nanoparticles. Chemosphere 2020; 247: 125813.
7- Ebrahimzadeh MA, Naghizadeh A, Amiri O, Shirzadi-Ahodashti M, Mortazavi-Derazkola S. Green and Facile Synthesis of Ag Nanoparticles Using Crataegus Pentagyna Fruit Extract (CP-Agnps) for Organic Pollution Dyes Degradation and Antibacterial Application. Bioorganic Chem 2020; 94: 103425.
8- Kaplan Ö, Tosun NG, Özgür A, Tayhan SE, Bilgin S, Türkekul İ, et al. Microwave-Assisted Green Synthesis of Silver Nanoparticles Using Crude Extracts of Boletus Edulis and Coriolus Versicolor: Characterization, Anticancer, Antimicrobial and Wound Healing Activities. J Drug Deliv Sci Technol 2021; 64: 102641.
9- Téllez-de-Jesús DG, Flores-Lopez N, Cervantes-Chávez J, Hernández-Martínez A. Antibacterial and Antifungal Activities of Encapsulated au and Ag Nanoparticles Synthesized Using Argemone Mexicana L Extract, Against Antibiotic-Resistant Bacteria and Candida Albicans. Surf Interface 2021; 27: 101456.
10- Rana A, Yadav K, Jagadevan S. A Comprehensive Review on Green Synthesis of Nature-Inspired Metal Nanoparticles: Mechanism, Application and Toxicity. J Clean Prod 2020; 272: 122880.
11- Jafari-Sales A, Rasi-Bonab F, Sayyahi J. The Survey on Antimicrobial Effects of Methanolic Extract of Carum Copticum L. on Staphylococcus Aureus, Bacillus Cereus, Escherichia Coli and Pseudomonas Aeruginosa in Laboratory Conditions. Paramedical Sci Milit Health 2019; 13(4): 19-25.
12- Sonboli A, Mirjalili MH, Hadian J, Yousefzadi M. The Biological Activity and Composition of the Essential Oil of Sclerorhachis Leptoclada (Asteraceae-Anthemideae) from Iran. Iran J Pharm Res: IJPR. 2014; 13(3): 1097-104.
13- Ghafoorian Eshghi O, Tehranipour M, Baharara J, Amintaheri N. Effect of Sclerorhachis Leptoclada Hydroalcoholic Extract on Glucose and Cholesterol Levels, Triglyceride, as Well as Serum HDL and LDL in Male Diabetic Rats. J Birjand Univ Med Sci 2020; 27(4): 344-54.
14- Mohammadi T, Pirani A, Vaezi J, Moazzeni H. A Contribution to Ethnobotany and Review of Phytochemistry and Biological Activities of the Iranian Local Endemic Species Sclerorhachis Leptoclada Rech. f. Ethnobot Res Appl 2020; 20: 1-18.
15- Tahmasebi A, Andi S, Ahmadi MR, Alavi BS. Inhibitory Effect of Essential Oils of Sclerorhachis Platyrachis and Sclerorhachis Leptoclada on Phytopathogenic Fungi. Int J Agric Sci 2012; 2(1): 48-53.
16- Shafaie E, Taleghani A, Sahebkar A, Eghbali S. The Essential Oil of Sclerorhachis Leptoclada Rech.F.: Chemical Composition and Biological Activity. Nat Prod Commun 2023; 18(11); 1-6.
17- Sahu N, Soni D, Chandrashekhar B, Satpute DB, Saravanadevi S, Sarangi BK, Pandey RA. Synthesis of Silver Nanoparticles Using Flavonoids: Hesperidin, Naringin and Diosmin, and their Antibacterial Effects and Cytotoxicity. Int Nano Lett 2016; 6: 173-81.
18- Rahmani AF, Ghanavati-Behbahan F, Moradi Y. Antimicrobial Effects of Ethanol Extract of Eremurus Persicus Leaves on Staphylococcus Aureus Under Laboratory Conditions. Int J Adv Biol Biomed Res 2021; 9(1): 58-63.
19- Gomathi M, Prakasam A, Rajkumar PV, Rajeshkumar S, Chandrasekaran R, Anbarasan PM. Green Synthesis of Silver Nanoparticles Using Gymnema Sylvestre Leaf Extract and Evaluation of Its Antibacterial Activity. S Afr J Chem Eng 2020; 32: 1-4.
20- Wayne PA. CLSI (Clinical and Labboratory Standards Institute): Performance Standards for Antimicrobial Susceptibility Testing. 30th ed. CLSI supplement M10. January 2020.
21- Zare-Bidaki M, Mohammadparast-Tabas P, Khorashadizade M, Mohammadparast-Tabas P, Alemzadeh E, Saberi A, et al. Bio-Synthesized AGS@ Agnps for Wound Healing, Antioxidant Support, Antibacterial Defense, and Anticancer Intervention. Biocatal Agric Biotechnol 2024; 61: 103402.
22- Aktepe N, Baran A, Atalar MN, Baran MF, Keskin C, Düz MZ, et al. Biosynthesis of Black Mulberry Leaf Extract and Silver Nanoparticles (Agnps): Characterization, Antimicrobial and Cytotoxic Activity Applications. MAS J Applied Sci 2021; 6(3): 685-700.
23- Abbas Widatalla H, Fathi Yassin L, Ahmed Alrasheid A, Abdel Rahman S, Osman Widdatallah M, Hussein Eltilib S, et al. Green Synthesis of Silver Nanoparticles Using Green Tea Leaf Extract, Characterization and Evaluation of Antimicrobial Activity. Nanoscale Adv 2022; 4: 911-15.
24- Singla S, Jana A, Thakur R, Kumari C, Goyal S, Pradhan J. Green Synthesis of Silver Nanoparticles Using Oxalis Griffithii Extract and Assessing their Antimicrobial Activity. Open Nano 2022; 7: 100047.
25- Arya A, Gupta K, Chundawat TS, Vaya D. Biogenic Synthesis of Copper and Silver Nanoparticles Using Green Alga Botryococcus Braunii and Its Antimicrobial Activity. Bioinorg Chem Appl 2018; 2018: 7879403.
26- Hemmati S, Rashtiani A, Zangeneh MM, Mohammadi P, Zangeneh A, Veisi H. Green Synthesis and Characterization of Silver Nanoparticles Using Fritillaria Flower Extract and their Antibacterial Activity Against Some Human Pathogens. Polyhedron 2019; 158: 8-14.
27- Zabihi MM, Eghbaliferiz S, Khorashadizadeh M, Mortazavi-Derazkola S, Yousefi M. Green Synthesis of Non-Toxic Silver Nanoparticles Using Salvia Tebesana Bunge Extract: Optimization, Cytotoxicity, and Antibacterial Activities. Results Chem 2024; 7: 101510.
28- Hajizadeh M, Sarayan MS, Taleghani A, Shafaei E, Sahebkar A, Eghbali S, Nasirizadeh S. Evaluation of Antimicrobial and Antioxidant Effects of Silver Nanoparticles Synthesized with Leaves of Lepidium Draba L. J Radiat Res Appl Sci 2024; 17(3): 101004.
29- Hamelian M, Zangeneh MM, Shahmohammadi A, Varmira K, Veisi H. Pistacia Atlantica Leaf Extract Mediated Synthesis of Silver Nanoparticles and their Antioxidant, Cytotoxicity, And Antibacterial Effects Under in Vitro Condition. Appl Organomet Chem 2020; 34(1): e5278.
30- Bagherzade G, Tavakoli MM, Namaei MH. Green Synthesis of Silver Nanoparticles Using Aqueous Extract of Saffron (Crocus Sativus L.) Wastages and Its Antibacterial Activity Against Six Bacteria. Asian Pac J Trop Biomed 2017; 7(3): 227-33.
31- Bhakya S, Muthukrishnan S, Sukumaran M, Muthukumar M. Biogenic Synthesis of Silver Nanoparticles and their Antioxidant and Antibacterial Activity. Appl Nanosci 2016; 6(5): 755-66.
32- Lourthuraj AA, Selvam MM, Hussain MS, Abdel-Warith A-WA, Younis EM, Al-Asgah NA. Dye Degradation, Antimicrobial and Larvicidal Activity of Silver Nanoparticles Biosynthesized From Cleistanthus Collinus. Saudi J Biol Sci 2020; 27(7): 1753-9.
33- Roy A, Bulut O, Some S, Mandal AK, Yilmaz MD. Green Synthesis of Silver Nanoparticles: Biomolecule-Nanoparticle Organizations Targeting Antimicrobial Activity. RSC Adv 2019; 9(5): 2673-702.
34- Rodríguez-Félix F, López-Cota AG, Moreno-Vásquez MJ, Graciano-Verdugo AZ, Quintero-Reyes IE, Del-Toro-Sánchez CL, et al. Sustainable-Green Synthesis of Silver Nanoparticles Using Safflower (Carthamus Tinctorius L.) Waste Extract and Its Antibacterial Activity. Heliyon 2021; 7(4): e06923.
35- Alkhulaifi MM, Alshehri JH, Alwehaibi MA, Awad MA, Al-Enazi NM, Aldosari NS, et al. Green Synthesis of Silver Nanoparticles Using Citrus Limon Peels and Evaluation of their Antibacterial and Cytotoxic Properties. Saudi J Biol Sci 2020; 27(12): 3434-41.
متن کامل: (1139 مشاهده)
مقدمه
فناوری نانو یکی از فناوریهای جدید با کاربرد وسیع در زمینههای مختلف میباشد که به مطالعه و بررسی مواد در مقیاس نانو میپردازد. مواد نانو در صنایع مختلفی کاریرد دارند که از جمله آنها میتوان به قطعات الکترونیکی، تصفیه آب، تبدیل انرژی خورشیدی، حسگرهای شیمیایی، بستهبندی مواد غذایی، کاتالیزورها، تصویربرداری، داروسازی و پزشکی اشاره کرد. این کاربرد وسیع به دلیل خصوصیات فیزیکی و شیمیایی منحصربهفرد مواد نانو میباشد که ناشی از نسبت سطح به حجم بالای آنها است (4-1). برای سنتز نانوذرات از فلزات گوناگونی از جمله مس، آهن، پالادیوم، پالادیوم دی سولفید، مس اکسید، روی اکسید و نقره استفاده میشود (5،6). در بین انواع فلزات مورد استفاده، نقره از دیرباز برای جلوگیری از عفونتهای میکروبی استفاده شده است. نانوذره نقره (AgNP) نیز همانند نقره به عنوان یکی از مهمترین نانوذرات دارای خاصیت آنتیباکتریال شناخته میشود (7). نانوذرات نقره دارای هدایت الکتریکی و حرارتی بالا، اندازه کوچک، پایداری مناسب و خواص بیولوژیکی فراوانی میباشند و برای درمان عفونتهای متعددی مورد استفاده قرار گرفته است. علاوه بر خاصیت آنتیباکتریال نانوذرات نقره دارای خواص ضدقارچی، آنتیاکسیدانی، تسریع کننده ترمیم زخم، ضد سرطانی و ... میباشند (8،9). استفاده از عصارههای گیاهی به منظور سنتز نانوذرات به دلیل سرعت بیشتر در کاهش یونهای فلزی و پایداری بیشتر نانوذرات، نسبت به میکروارگانیسمها ترجیح داده میشوند. همچنین عصارههای گیاهی فاقد ترکیبات سمی و دارای متابولیتهای ثانویه میباشند که در عمل احیای زیستی یون شرکت دارند (10). گیاهان دارویی یکی از منابع مهم عوامل ضدمیکروبی در کشورهای مختلف و به عنوان منبعی از مواد شیمیایی بالقوه مفید بوده که تنها بخشی از آن مورد بهرهبرداری قرار گرفته است. این مواد شیمیایی بالقوه مفید را میتوان نه تنها به عنوان دارو بلکه به عنوان الگوی بینظیر بهصورت نقطه شروعی برای ساخت آنالوگهای دارویی بهکار برد (11). گیاه مستار با نام علمی Sclerorhachis leptoclada متعلق به تیره کاسنی، گیاهی معطر و بسیار خوشبو میباشد. گونههایSclerorhachis محدود به خشکترین مناطق مرتفع ایران میشوند (12). از کاربردهای معمول گیاه مستار میتوان به درمان اختلالات گوارشی، افزایش شیردهی، تصفیهخون، تسکین سردرد و دردهای بدن، درمان تبخال و سرماخوردگی اشاره کرد (13). اسانس آبی قسمتهای گلدهی هوایی گیاه مستار دارای 57 ترکیب مختلف میباشد که استات بورنیل، کافور وδ- cadinene بیشترین مقدار آن را تشکیل دادهاند (14). همچنین در مطالعه طهماسبی و همکاران اسانسهای بهدست آمده با تقطیر آبی از قسمتهای گلدهی هوایی گیاه مستار اثرات قوی ضدقارچی از خود نشان داده است (15). گیاه مستار حاوی دو دسته مهم از متابولیتهای گیاهی شامل فلاونوئیدها و ترکیبات فنلی بوده که این ترکیبات به دلیل داشتن گروه پلی هیدروکسی مسئول فعالیت آنتیاکسیدانی و خاصیت مهار رادیکالهای آزاد میباشد و همچنین نقش عمده ای در کاهش یونهای فلز و تبدیل به نانو ذرات دارد (16،17). بررسی مطالعات نشان میدهند که سنتز سبز ذرات نقره با استفاده از عصاره مستار کمتر شناخته شده است از اینرو در این تحقیق سنتز سبز نانوذره نقره توسط این گیاه و خواص ضدمیکروبی آن مورد بررسی قرار داده شد تا شاید نتایج این بررسی بتواند نقش مهمی در تحقیقات مربوط به پزشکی و داروسازی ایفا کند.
روش بررسی
تهیه عصاره گیاه مستار: گیاه مستار (Sclorhachis leptoclada) در فصل بهار از نواحی اطراف بیرجند در خراسان جنوبی (35° 24´N, 61° 31´ E, 1018 m) جمعآوری گردید و توسط گیاهشناس با کد هرباریوم 42610 مورد تایید قرار گرفت. گیاه مستار پس از شستوشو به کمک آب مقطر در سایه خشک گردید. پس از خشک کردن به منظور عصارهگیری، 20 گرم از پودر خشک شده گیاه مستار در 200 سیسی متانول به مدت 72 ساعت بر روی شیکر با دور 1500 RPM قرار دادهشد. سپس به کمک کاغذ واتمن شماره یک صاف گردید و در ادامه به کمک دستگاه روتاری، تغلیظ گردید. عصاره حاصل در پایان به منظور جدا کردن تمامی متانول، در درون انکوباتور با دمای 37 درجه سانتیگراد قرار داده شد تا زمانی که کاملا خشک گردد. پودر بهدست آمده در دمای 4 درجه برای استفادههای بعدی ذخیره شد (18).
سنتز نانوذره نقره: به منظور سنتز، 24 میلیگرم نیترات نقره در بشری حاوی 10 سیسی آب مقطر دیونیزه بر روی استیرر تحت همزدن شدید در دمای محیط (25 درجه سانتیگراد) قرار گرفت. همزمان 100 میلیگرم از عصاره گیاه مستار درون بشر دیگری به همراه 10 سیسی آب مقطر دیونیزه به مدت 5 دقیقه در دمای محیط سونیک شد و سپس از کاغذ صافی واتمن شماره یک عبور داده شد و PH سوسپانسیون حاصل با استفاده از سدیم هیدروکساید 2 مولار به 12 رسانده شد. عصاره گیاه با PH=12، پس از حل شدن کامل نیترات نقره درون آب مقطر، به صورت قطره قطره به درون بشر تحت همزدن شدید اضافه گردید (7). پس از اضافه کردن اولین قطرات عصاره، رنگ سوسپانسیون به قهوهای تیره بدل شد که این تغییر رنگ تاییدی بر کاهش یونهای نقره و سنتز نانوذرات نقره بود. سوسپانسیون فوق به مدت زمان 30 دقیقه بر روی استیرر هم زده شد. به منظور مطالعه بیشتر، نمودار جذب سوسپانسیون حاصل با استفاده از دستگاه UV-Vis (NanoDrop, BioTek model Epoch, USA) و در طول موج 500-300 نانومتر اندازهگیری شد (19).
شرایط اپتیموم نانوذرات نقره: به منظور بهدست آوردن بهترین شرایط برای سنتز نانوذرات نقره به کمک عصاره گیاه مستار، سه پارامتر شامل غلظت نقره، زمان و دما، مورد آزمایش قرار گرفت. در هر مرحله سوسپانسیون حاصل در طیف جذبی 500-300 نانومتر توسط دستگاه UV–Vis خوانش گردید که ایدهآل ترین شرایط برای سنتز نانوذرات مشخص شود. به منظور بررسی ایدهآل ترین شرایط در سنتز نانوذرات نقره، غلظت گیاه مستار ثابت فرض شد و سپس ابتدا غلظتهای 5، 10، 15، 20 و 25 میلیمولار نیترات نقره مورد آزمایش قرار گرفت و در ادامه پس از تعیین ایدهآلترین غلظت نیترات نقره به کمک بررسی طیف جذبی در هر غلظت، سنتز نانوذرات با استفاده از ایدهآلترین غلظت نیترات نقره در زمانهای مختلف شامل 15، 30، 45 و 60 دقیقه ادامه یافت. در پایان نیز در غلظتهای ایدهآلی از نیترات نقره به همراه زمان ایدهآل برای انجام واکنش، سنتز نانوذرات در دماهای مختلف شامل دمای اتاق، 55 درجه سانتی گراد و 85 درجه سانتیگراد انجام شد و بهینهترین شرایط سنتز نانوذرات نقره به کمک عصاره متانولی گیاه مستار تعیین گردید.
تعیین مشخصات نانوذرات نقره: در مطالعه حاضر برای تعیین خصوصیات نانوذرات نقره از دستگاه UV-Vis در طول موج 300-500 نانومتر استفاده گردید. اندازهگیری سایز و پتانسیل زتا نانوذرات با استفاده از دستگاه زتاسایزر دانشگاه علوم پزشکی بیرجند بود. شناسایی گروههای عاملی نانوذرات نقره با استفاده از FT-IR (PerkinElmer Spectrum Two IR spectrometer; Model L160000U)، تعیین اندازه و مشاهده ویژگیهای مورفولوژیکی ترکیبات با استفاده از میکروسکوپ الکترون TEM (Zeiss-EM10C-100 KV) و تعیین قطر هیدرودینامیکی نانوذرات نقره با استفاده از DLS (NanoBrook 90Plus-Brookhaven Instruments, model 18051; USA) انجام شد.
بررسی خاصیت آنتیباکتریال: در این مطالعه از پنج سویه استاندارد از گونههای مختلف باکتریایی، شامل دو گونه باکتری گرم مثبت: استافیلوکوکوس اورئوس (ATCC 25923) و انتروکوکوس فکالیس (ATCC 29212) و سه گونه باکتری گرم منفی: کلبسیلا پنومونیه (ATCC 9997)، سودوموناس آئروژینوزا (ATCC 27853) و اشریشیاکلای (ATCC 25922) موجود در آزمایشگاه میکروبشناسی دانشکده پزشکی بیرجند استفاده شد. باکتریهای مورد نظر پس از کشت بر روی محیط بلاد آگار به مدت 18-24 ساعت در انکوباتور با دمای 37 درجه انکوبه شدند تا باکتریهای تازه تکثیر یابند ( به منظور رشد بهینه انتروکوکوکوس فکالیس به منظور ایجاد اتمسفر کم هوازی از کندل جار استفاده شد) از کلنیهای ظهور یافته بر سطح محیط کشت، جهت تهیه محلول نیممکفارلند استفاده شد (20). به این صورت که در پلیت 96 خانه استریل رقتهای متوالی دو برابری از هر یک از ترکیبات مورد بررسی در محیط مولر هینتون براث با حجم نهایی 100 میکرولیتر تهیه شد. سپس به هر چاهک میزان 100 میکرولیتر از سوسپانسیون باکتریایی با غلظت نهایی 105× 5 CFU/mL اضافه شد. پلیتها به مدت 24-18 ساعت و در درمای 37 درجه سانتیگراد انکوبه شدند. از سوسپانسیون باکتریایی مولر هینتون براث به عنوان کنترل مثبت و از محیط کشت به تنهایی به عنوان کنترل منفی استفاده گردید. در مطالعه حاضر از آنتیبیوتیک تتراسایکلین نیز به عنوان کنترل استفاده شد (21).
نتایج
تعیین مشخصات نانوذرات سنتز شده: در این مطالعه به منظور تایید تشکیل نانوذرات نقره و تعیین تاثیر پارامترهای مختلف در تشکیل نانوذرات از طیف UV-Vis در طول موج 300-500 نانومتر استفاده گردید. به منظور تعیین بهینهترین غلظت نیترات نقره برای تشکیل نانوذرات به کمک عصاره گیاه، غلظتهای 25-5 میلی مولار نیترات نقره مورد بررسی قرار گرفت. مطالعات گذشته نشان داده است که با افزایش غلظت نیترات نقره، نانوذرات بیشتری تشکیل میشود. بررسیهای طیف جذبی نانوذرات (تصویر1-الف) نشان دهنده افزایش شدت نوار جذبی با افزایش غلظت نیترات نقره تا غلظت 10 میلیمولار می باشد اما در غلظتهای 15، 20 و 25 میلی مولار به دلیل چسبندگی نانوذرات طیف جذبی کاهش یافته است. در نتیجه غلظت 10 میلیمولار نیترات نقره به عنوان بهترین غلظت نقره در نظر گرفته شد. در غلظت 10 میلیمولار نقره، طیف جذبی نانوذرات در زمانهای گوناگون (تصویر1-ب) مورد بررسی قرار گرفت. مشخص شد که با افزایش زمان واکنش از 15 دقیقه به 30 دقیقه، شدت جذب افزایش مییابد و پس از آن تغییر محسوسی در شدت جذب مشاهده نمیشود. برای اندازه گیری ایدهآلترین دما برای انجام واکنش، واکنش در دماهای مختلف مورد بررسی قرار گرفت. دمای اتاق، 55 و 85 درجه سانتیگراد، دماهای مورد استفاده در این واکنش بوده است. نمودار جذب یووی نشان داد که با افزایش دمای واکنش، میزان جذب کاهش مییابد. در دماهای پایین، پیک جذبی به سمت طول موجهای کوتاه تر شیفت پیدا کرده است که نشان دهنده کاهش در سایز نانوذرات سنتز شده است. بنابراین دما 25 درجه سانتیگراد برای انجام این واکنش به عنوان بهترین دما در نظر گرفته شد (تصویر1-ج).
آنالیز XRD: به منظور تعیین ساختار کریستالی و خلوص نانوذرات سنتز شده، از آنالیز XRD استفاده شد. نتایج آنالیز XRD در تصویر 2 قابل مشاهده است. همانطور که در تصویر 2 نشان داده شده است هیچگونه ناخالصیای در طیف XRD مشاهده نمیشود و تمامی پیکها مربوط به نانوذرات نقره سنتز شده میباشد که نشان دهنده خلوص بالای نانوذرات سنتز شده است و مطابق با پراش استاندارد نقره میباشد (JCPDS 01-087-0717). نتایج XRD پیکهایی در زوایای 38.2، 44.4، 64.8 و 77.8 نشان میدهد که به ترتیب مربوط به 111، 200، 220 و 311 صفحات براگ میباشد. سایز نانوذرات سنتز شده با استفاده از معادله دبای-شرر (D= n𝜆/βcosθ) 20-15 نانومتر بهدست آمد که در این معادله، D سایز نانوذرات بر اساس نانومتر، λ طول موج پرتو ،β پهنای پیک در نیمه ارتفاع و θ زاویه پراش پرتو ایکس میباشد.
آنالیز DLS و پتانسیل زتا: تجزیه و تحلیل DLS یک تکنیک اساسی است که برای تعیین اندازه ذرات استفاده میشود. در طی این تجزیه و تحلیل، ذرات از یک پرتو نور که توسط دستگاه ساطع میشود عبور میکنند و اندازه آنها با اندازهگیری میزان پراکندگی نور تعیین می شود. اندازه به دست آمده از این تجزیه و تحلیل مطابق با قطر هیدرودینامیکی ذرات است. قطر هیدرودینامیکی به قطر یک ذره به همراه مولکولهای آب اطراف آن اشاره دارد که در نتیجه منجر به اندازه بزرگتر در مقایسه با ذره واقعی است. تصویر 3-الف هیستوگرام DLS را نشان میدهد، که با توجه به این نمودار اندازه قطر هیدرودینامیکی نانوذرات نقره در حدود 130 نانومتر میباشد. در این مطالعه، از آنالیز پتانسیل زتا برای ارزیابی پایداری SLL@AgNPsبا اندازهگیری میزان سطح استفاده شد. شارژ بار سطحی بالاتر نشان دهنده افزایش دافعه بین ذرات دارای بار مشابه است که منجر به پایداری بیشتر ذرات می شود. با توجه به تصویر 3-ب پتانسیل زتا نانوذرات سنتز شده 38/82- میلیولت می باشد که نشان دهنده بار سطحی منفی در نانوذرات سنتز شده به کمک عصاره است. این بار منفی بالا از تجمع NPs جلوگیری می کند و در نتیجه یک تعلیق پایدار ایجاد میکند (22).
آنالیز طیف FT-IR: نتایج آنالیز FT-IR مربوط به عصاره گیاه و نانوذرات سنتز شده در تصویر4 و 5 به ترتیب قابل مشاهده است. آنالیز FT-IR نشاندهنده گروههای عملکردی موجود در عصاره گیاه و همچنین نانوذرات سنتز شده است. طیف FT-IR عصاره گیاه (تصویر4) باندهای جذبی در 3466.2، 2924.6، 1627.7، نشان میدهد که به ترتیب مربوط به ارتعاشات کششی گروه OH در الکل ها، ارتعاشات کششی C-H، کشش گروه کتون C=O بوده که نشان میدهد این گروه کتونی هم به عنوان عامل کاهنده و پوشش دهنده میتواند استفاده گردد. پیکهای جذبی مشاهده شده در نواحی 1406/6، 1263/3، 1072/2 و 862/2 مربوط به گروههای آروماتیک C-H، C-O، C-O-C و C-H مربوط به گروه آلکنها میباشد. علاوه بر این تصویر5 طیف FT-IR مربوط به نانوذرات سنتز شده با استفاده از عصاره گیاه را نشان میدهد. پیکهای جذبی مشاهده شده در طیف FT-IR نانوذرات سنتز شده شباهت زیادی به عصاره گیاه دارد با اینحال، تغییرات جزئی و کاهش کشش در پیکهای نانوذرات نسبت به عصاره گیاه وجود دارد. این نشان میدهد که گروههای عاملی موجود در عصاره گیاه نقش مهمی در تشکیل نانوذرات ایفا میکند. از طرفی طیفسنجی FT-IR نشان داد که گروههای کربونیل و هیدروکسیل موجود در عصاره برگ گیاه مستار نقش مهمی در پوشش نانوذرات نقره و همچنین نقش کلیدی در کاهش یونهای نقره دارند (23).
4-1-1-5 آنالیز TEM: از آنالیز TEM به منظور بررسی دقیق اندازه و مورفولوژی نانوذرات استفاده میشود. اندازه و مورفولوژی نانوذرات سنتز شده از طریق روش سبز تحت تأثیر عصاره مورد استفاده در فرآیند سنتز قرار میگیرد. تصاویر TEM (تصویر 6) نانوذرات سنتز شده نشان میدهد که نانوذرات سنتز شده ساختاری کروی و اندازهای در حدود 5/077±18/87 نانومتر دارند.
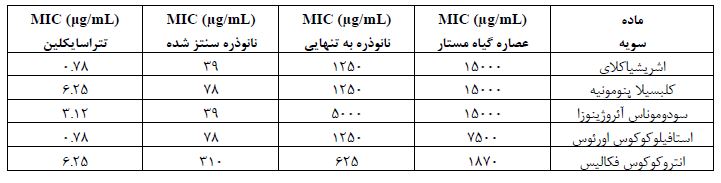
نتایج تست آنتیباکتریال: با توجه به جدول 1 عصاره گیاه مستار به تنهایی اثرات ضد باکتریایی قابلتوجهی بر باکتریهای مورد مطالعه ندارد و بیشترین اثر آنتیباکتریالی خود را بر باکتری انتروکوکوس فکالیس (MIC= 1870 µg/ml) دارا بود و بهطور کلی نیز این عصاره دارای اثرات آنتیباکتریال بییشتری بر باکتریهای گرم مثبت استافیلوکوکوس اورئوس و انتروکوکوس فکالیس نسبت به باکتریهای گرم منفی بود. نتایج MIC حاصل از نانوذره نقره بهتنهایی نشان داد که نانوذره نقره بهتنهایی در غلظتهای کمتری نسبت به عصاره گیاهی دارای اثرات آنتیباکتریال است بهطوری که بر باکتری انتروکوکوس فکالیس بیشترین اثر را گذاشته و رشد آن را در غلظت 625 µg/ml مهار کرده است و استافیلوکوکوس اورئوس، اشرشیاکلی و کلبسیلا پنومونیه با MIC= 1250 µg/ml و سودوموناس آئروژینوزا با MIC= 5000 µg/ml در رتبههای بعدی قرار دارند. در میان سه ترکیب استفاده شده، نانوذره نقره سنتز شده به روش سبز به کمک گیاه مستار دارای بیشترین خاصیت آنتیباکتریال بود. نانوذره سنتز شده بر خلاف گیاه مستار و نانوذره نقره بهتنهایی بیشترین تاثیر را بر باکتریهای گرم منفی داشته است بهطوری که در غلظت 39 µg/mlمانع از رشد باکتریهای اشریشیاکلای و سودوموناس آئروژینوزا شده است و کمترین تاثیر را با باکتری گرم مثبت انتروکوکوس فکالیس (MIC= 310 µg/ml) داشته است. نانوذره نقره سنتز شده به کمک عصاره گیاه مستار نسبت به نانوذره نقره بهتنهایی و عصاره گیاه مستار دارای MIC کمتر و در نتیجه عملکرد آنتیباکتریالی بهتری بود. در نتیجه، استفاده از عصاره گیاه مستار و نانوذرات نقره به منظور سنتز سبز نانوذرات نقره، موجب اثرات سینرژیسمی و افزایش چشمگیر خاصیت آنتیباکتریال نانوذرات سبز شده است.
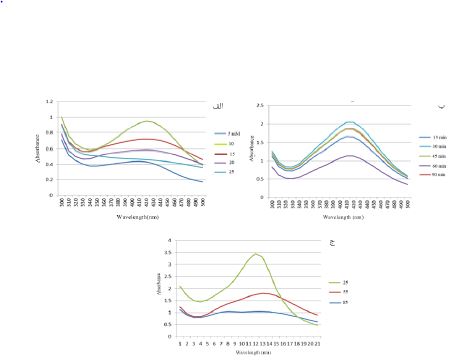
تصویر 1: طیف UV-Vis نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار در غلظتهای مختلف نیترات نقره (الف) غلظت های متفاوت، (ب)، دماهای مختلف (ج) بازه زمانی متفاوت

تصویر 2: الگوی پراش اشعه ایکس نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار
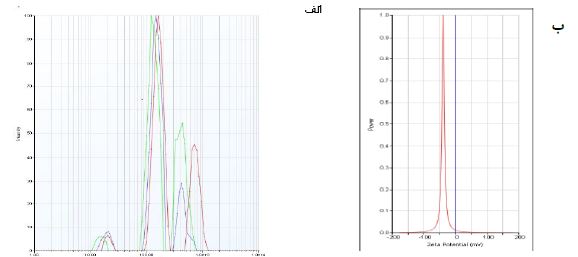
تصویر3: آنالیز DLS (الف) و پتانسیل زتا (ب) نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار
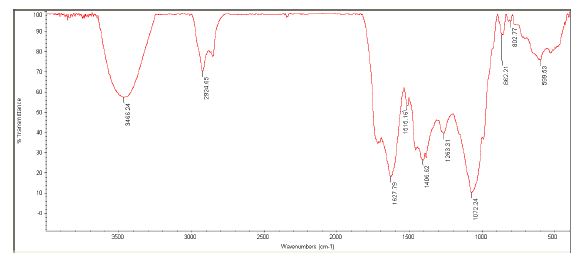
تصویر4: طیف FTIR عصاره گیاه مستار
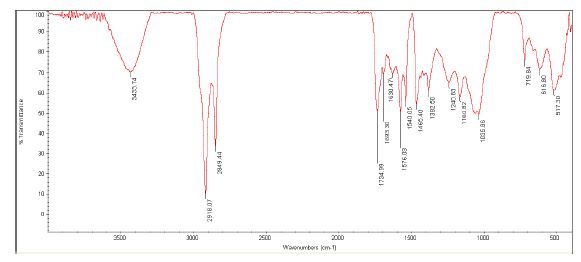
تصویر5: طیف FTIR نانوذرات نقره سنتز شده
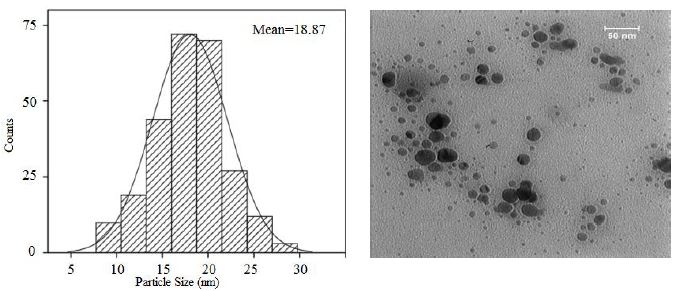
تصویر6: تصویر TEM نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار
جدول 1: نتایج آنتیباکتریال نانوذره سنتز شده، نانوذره به تنهایی و عصاره گیاه مستار
بحث
امروزه مقاومت باکتریها به آنتیبیوتیکها به یک تهدید جدی برای سلامت انسان بدل شده است و بایستی به کمک روشهای مختلف از جمله کمک گرفتن از مواد موجود در طبیعت بر آن غلبه کرد (1). در این راستا، نانوذرات نقره به روش سبز به کمک عصاره گیاه مستار (Sclerorhachis leptoclada) سنتز شد و خواص آنتیباکتریال نانوذرات سنتز شده به کمک عصاره گیاه مستار با نانوذرات نقره به تنهایی و عصاره گیاه مستار مقایسه شد. تشدید پلاسمون سطحی نقره در طی واکنش منجر به تغییر رنگ محلول به قهوه تیره میشود و این تشدید پلاسمون سطحی باعث ایجاد باند جذبی در طول موج 500-300 نانومتر می شود. نتایج گذشته نشان داد که افزایش میزان جذب نانو ذرات با افزایش تشکیل نانو ذرات سنتز شده رابطه مستقیمی دارد. بر این اساس غلظت 10 میلی مولار نیترات نقره و زمان 30 دقیقه و دمای 25 درجه دارای بیشترین جذب در طول موج 500-300 نانومتر میباشند. در طیف FT-IR مربوط به نانوذرات نقره سنتز شده با عصاره مستار، قلههای جذبی مشابه قله های جذب عصاره گیاه اما با جابجایی و شدت کمتر نسبت به عصاره گیاه مشاهده گردید. نتایج طیف FT-IR مربوط به نانوذرات نشان دهنده مولکولهای زیستی موجود در عصاره میباشد که عامل احیاء یونهای نقره میباشند. این نشان میدهد که گروههای عاملی موجود در عصاره گیاه در تشکیل نانوذرات نقش دارند (1). نتایج XRD مربوط به نانوذرات نقره سنتز شده با عصاره مستار در مطالعه حاضر نشان داد که ترکیب سنتز شده فاقد ناخالصی بوده و تمامی پیکها مربوط به نقره و مطابق با پراش استاندارد نقره میباشد (JCPDS 01-087-0717). این الگویXRD نشان میدهد که نانوذرات نقرهای که در اثر کاهش یونهای نقره با استفاده از عصاره مستار تشکیل میشوند، ماهیت کریستالی دارند. نتایج مطالعه حاضر در راستای یافتههای ارائه شده در سایر مطالعات بوده و عدم وجود قله اضافی در آنالیز XRD نشان دهنده عدم وجود ناخالصی در نانوذرات سنتز شده میباشد (24). بر اساس نتایج تصاویر TEM نانوذرات سنتز شده مورفولوژی کروی و بیضوی با اندازه ای در حدود 5/077±18/87 نانومتر دارند. همچنین در برخی مناطق نانوذرات روی هم چسبیده شده و ساختار نامنظم دارند که می توان به چسبندگی عصارههای موجود در سطح نانو ذرات نسبت داد. وجود سایههای تیره بر روی سطح نانوذرات در تصاویر TEM نشان دهنده قرارگیری ترکیبات زیستی موجود در عصاره گیاه بر سطح نانو ذرات نقره میباشد. اندازه کوچک، مورفولوژی کروی و ساختارهای منظم از ویژگیهای برجسته نانوذرات سنتز شده با استفاده از عصاره مستار میباشد که این ترکیبات را نسبت به نانو ذرات سنتز شده در تحقیقات گذشته متمایز نموده است. بار سطحی موجود در نانوذرات نقش اساسی در جلوگیری از تجمع و افزایش ثبات نانوذرات را داراست. بهطوری که در صورت داشتن بار سطحی بالا (مثبت یا منفی) نانوذرات یکدیگر را دفع کرده و تجمع نمییابند با توجه به نمودار 3 پتانسیل زتا نانوذرات سنتز شده 38/82- میلی ولت میباشد. با توجه به نتایج حاصل از بررسی خواص آنتیباکتریال نانوذرات سنتز شده، نانوذرات نقره به تنهایی و عصاره گیاه مستار مشخص شد (جدول1). که استفاده از عصاره گیاه مستار به منظور سنتز نانوذرات بهطور چشمگیری موجب افزایش خواص آنتیباکتریالی نانوذرات سنتز شده شد که با سایر مطالعات مشابهت دارد. در مطالعه Arya A و همکاران که به بررسی خاصیت آنتیباکتریال نانوذرات نقره سنتز شده به کمک عصاره گیاه Alga Botryococcus braunii به روش میکروبراث دایلوشن پرداخته شده بود، نانوذرات سنتز شده دارای خواص آنتیباکتریال بر باکتریهای اشریشیاکلای، کلبسیلا پنومونیه، سودوموناس آئروژینوزا و استافیلوکوکوس اورئوس به ترتیب با MIC برابر با 100، 62.5، 62.5 و 200 میکروگرم بر میلیلیتر بودند که نتایج مطالعه انجام شده با مطالعه حال حاضر مشابهت دارد (25). در مطالعه Hemmati S و همکاران نانوذرات سنتزشده به کمک گل گیاهFritillaria دارای اثرات آنتیباکتریال بر باکتریهای استافیلوکوکوس اورئوس و انتروکوکوس فکالیس به ترتیب با MIC 4 و 1 میلیگرم بر میلیلیتر بود که نشان دهنده خاصیت آنتیباکتریالی بیشتر نانوذرات سنتز شده در مطالعه حال حاضر میباشد. در مطالعه Hemmati و همکاران و مطالعه حاضر از سویههای باکتریایی یکسانی استفاده شده است، پس شاید بتوان علت این تفاوت را به تاثیر عصاره گیاه بر سنتز نانوذراتی با مورفولوژی و اندازههای مختلف و درنتیجه خواص آنتیباکتریال متفاوت مرتبط دانست (26). در مطالعه دیگری که توسط میرمحمدی و همکاران انجام گرفت نانوذرات نقره سنتز شده با عصاره بارهنگ Plantago lanceolata فعالیت ضد باکتریایی قابلتوجهی بر باکتریهای استافیلوکوکوس اورئوس و انتروکوکوس فکالیس با میزان MIC برابر 125 میکروگرم بر میلیلیتر دارند در صورتیکه عصاره بارهنگ و نانوذرات نقره شیمیایی اثر ضدباکتریایی قابل توجهی نداشتند (1). همچنین در مطالعه انجام شده توسط صالحی و همکاران نانوذرات نقره بیوسنتز شده با عصارهSalvia tebesana Bunge ، دارای پیکربندی کروی با اندازه متوسط در محدوده 15-10 نانومتر بود. نانوذرات سنتز شده زیستی در مقایسه با نانوذرات شیمیایی، بهویژه در برابر باکتری P. aeruginosa بالاترین فعالیت ضد باکتریایی را در مقدار MIC برابر با 36/06 میکروگرم بر میلیلیتر نشان دادند. یافتهها نشان می دهد که عصاره S. tebesana Bunge خواص ضد باکتریاییAgNP ها را افزایش میدهد و همچنین نشان دهنده یک گزینهای مناسب و زیست سازگار برای سنتز این نانوذرات است (27). بهطور کلی در مطالعات انجام شده توسط محققان دیگر نانوذرات نقره سنتز شده توسط عصاره گیاه نسبت به نانوذرات شیمیایی و عصاره گیاه به تنهایی اثرات ضد باکتریایی قابل توجهای را اعمال نمودهاند که این اثر را میتوان به مواد موثره موجود در گیاهان به خصوص ترکیبات فنلی و قلاونوئیدها که عامل پوشش دهنده و کاهنده یون نقره میباشد نسبت داد (21،28،29). با توجه به نتایج، خاصیت ضد باکتریایی نانوذره نقره سنتز شده به کمک عصاره گیاه مستار بیشتر از عصاره گیاه مستار و نانوذره نقره به تنهایی بوده است. بنابراین استفاده از عصاره گیاه مستار به منظور سنتز نانوذرات موجب اثرات همافزایی در خاصیت آنتیباکتریال عصاره گیاهی و نانوذرات نقره به تنهایی شده است. نتایج مشابهی در مطالعه باقرزاده و همکاران بهدست آمده است (30). نانوذرات نقره سنتز شده به کمک گیاه مستار بر روی باکتریهای گرم منفی بیشتر از باکتریهای گرم مثبت اثر گذاشتهاند، بهطور مشابه در اکثر مطالعات اثرات بازدارندگی نانوذرات نقره سنتز شده با عصاره گیاهی بر باکتریهای گرم منفی بیشتر از باکتریهای گرم مثبت گزارش شده بود، که احتمالا به دلیل تفاوت در ساختار دیواره سلولی آنهاست. باکتریهای گرم منفی دیواره سلولی نازک تری دارند و دارای لیپوپلیساکارید میباشند که باعث ایجاد بارالکتریکی منفی بر روی سطح آنها میشود و وجود این بار منفی بر روی سطح باکتریهای گرم منفی موجب جذب بیشتر نانوپارتتیکلها و در نتیجه تاثیر بیشتر آنها بر باکتریهای گرم منفی میشود (31). مکانیسمهای متعددی برای توجیه خاصیت ضدمیکروبی نانوذرات نقره مطرح شده است اما همچنان فرایند دقیق آن مشخص نیست. یکی از مکانیسمهای مطرح شده، چسبیدن نانوذره نقره بر دیواره و غشای سلولی ارگانیسم، القاء تغییرات مورفولوژیک در غشای سلول، اختلال در نفوذپذیری و تنفس سلولی و نهایتاً مرگ سلول است (33،32). همچنین یون نقره آزادشده از نانوذره میتواند با پروتئینهای حاوی سولفور و DNA واکنش دهد، به DNA آسیب برساند و باعث اختلال در عملکرد آنزیمهای پروتئینی سلول شود (34). مکانیسم مهم دیگری که مطرح شده است، تولید رادیکالهای آزاد اکسیژن (ROS) است. رادیکالهای آزاد اکسیژن باعث القای استرس اکسیداتیو و آسیب به پروتئینها، لیپیدها، RNA و DNA سلول و نهایتاً مرگ سلولی میشوند (35).
نتیجهگیری
سنتز سبز نانوذرات نقره به کمک عصاره برگ گیاه مستار یک روش ساده، کم هزینه و دوستدار محیطزیست میباشد. نتایج نشان داد که غلظت نیترات نقره، دما و زمان واکنش نقش مهمی در اندازه و سایز نانوذرات تشکیل شده دارد. علاوه بر این مشخص شد که نانوذرات نقره سنتز شده خاصیت آنتیباکتریال عصاره گیاه مستار را بسیار بهبود بخشیده است و نانوذرات نقره سنتز شده خاصیت آنتیباکتریال بالایی علیه باکتریهای گرم مثبت و منفی دار است و باکتریهای گرم منفی نسبت به نانوذرات سنتز شده حساستر میباشند.
سپاس گزاری
از معاونت تحقیقات و فناوری دانشگاه علوم پزشکی بیرجند برای حمایتهای مالی (کد پایان نامه: 456480) و پرسنل محترم آزمایشگاه جامع تحقیقات دانشگاه علوم پزشکی بیرجند قدردانی میگردد.
حامی مالی: پژوهش حاضر با حمایت مالی دانشگاه علوم پزشکی بیرجند با کد پایان نامه 456480 به انجام رسید.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
در ابتدا طرح در کمیته اخلاق دانشگاه علوم پزشکی بیرجند ثبت و با کد IR.BUMS.REC1400.178 مورد تاییدکمیته اخلاق دانشگاه علوم پزشکی بیرجند قرار گرفت.
مشارکت نویسندگان
ابراهیم شفائی و سمیرا اقبالی در ارائه ایده، سمیرا اقبالی در طراحی مطالعه، زهرا صالحی در جمعآوری دادهها، ابراهیم شفائی و سمیرا اقبالی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
فناوری نانو یکی از فناوریهای جدید با کاربرد وسیع در زمینههای مختلف میباشد که به مطالعه و بررسی مواد در مقیاس نانو میپردازد. مواد نانو در صنایع مختلفی کاریرد دارند که از جمله آنها میتوان به قطعات الکترونیکی، تصفیه آب، تبدیل انرژی خورشیدی، حسگرهای شیمیایی، بستهبندی مواد غذایی، کاتالیزورها، تصویربرداری، داروسازی و پزشکی اشاره کرد. این کاربرد وسیع به دلیل خصوصیات فیزیکی و شیمیایی منحصربهفرد مواد نانو میباشد که ناشی از نسبت سطح به حجم بالای آنها است (4-1). برای سنتز نانوذرات از فلزات گوناگونی از جمله مس، آهن، پالادیوم، پالادیوم دی سولفید، مس اکسید، روی اکسید و نقره استفاده میشود (5،6). در بین انواع فلزات مورد استفاده، نقره از دیرباز برای جلوگیری از عفونتهای میکروبی استفاده شده است. نانوذره نقره (AgNP) نیز همانند نقره به عنوان یکی از مهمترین نانوذرات دارای خاصیت آنتیباکتریال شناخته میشود (7). نانوذرات نقره دارای هدایت الکتریکی و حرارتی بالا، اندازه کوچک، پایداری مناسب و خواص بیولوژیکی فراوانی میباشند و برای درمان عفونتهای متعددی مورد استفاده قرار گرفته است. علاوه بر خاصیت آنتیباکتریال نانوذرات نقره دارای خواص ضدقارچی، آنتیاکسیدانی، تسریع کننده ترمیم زخم، ضد سرطانی و ... میباشند (8،9). استفاده از عصارههای گیاهی به منظور سنتز نانوذرات به دلیل سرعت بیشتر در کاهش یونهای فلزی و پایداری بیشتر نانوذرات، نسبت به میکروارگانیسمها ترجیح داده میشوند. همچنین عصارههای گیاهی فاقد ترکیبات سمی و دارای متابولیتهای ثانویه میباشند که در عمل احیای زیستی یون شرکت دارند (10). گیاهان دارویی یکی از منابع مهم عوامل ضدمیکروبی در کشورهای مختلف و به عنوان منبعی از مواد شیمیایی بالقوه مفید بوده که تنها بخشی از آن مورد بهرهبرداری قرار گرفته است. این مواد شیمیایی بالقوه مفید را میتوان نه تنها به عنوان دارو بلکه به عنوان الگوی بینظیر بهصورت نقطه شروعی برای ساخت آنالوگهای دارویی بهکار برد (11). گیاه مستار با نام علمی Sclerorhachis leptoclada متعلق به تیره کاسنی، گیاهی معطر و بسیار خوشبو میباشد. گونههایSclerorhachis محدود به خشکترین مناطق مرتفع ایران میشوند (12). از کاربردهای معمول گیاه مستار میتوان به درمان اختلالات گوارشی، افزایش شیردهی، تصفیهخون، تسکین سردرد و دردهای بدن، درمان تبخال و سرماخوردگی اشاره کرد (13). اسانس آبی قسمتهای گلدهی هوایی گیاه مستار دارای 57 ترکیب مختلف میباشد که استات بورنیل، کافور وδ- cadinene بیشترین مقدار آن را تشکیل دادهاند (14). همچنین در مطالعه طهماسبی و همکاران اسانسهای بهدست آمده با تقطیر آبی از قسمتهای گلدهی هوایی گیاه مستار اثرات قوی ضدقارچی از خود نشان داده است (15). گیاه مستار حاوی دو دسته مهم از متابولیتهای گیاهی شامل فلاونوئیدها و ترکیبات فنلی بوده که این ترکیبات به دلیل داشتن گروه پلی هیدروکسی مسئول فعالیت آنتیاکسیدانی و خاصیت مهار رادیکالهای آزاد میباشد و همچنین نقش عمده ای در کاهش یونهای فلز و تبدیل به نانو ذرات دارد (16،17). بررسی مطالعات نشان میدهند که سنتز سبز ذرات نقره با استفاده از عصاره مستار کمتر شناخته شده است از اینرو در این تحقیق سنتز سبز نانوذره نقره توسط این گیاه و خواص ضدمیکروبی آن مورد بررسی قرار داده شد تا شاید نتایج این بررسی بتواند نقش مهمی در تحقیقات مربوط به پزشکی و داروسازی ایفا کند.
روش بررسی
تهیه عصاره گیاه مستار: گیاه مستار (Sclorhachis leptoclada) در فصل بهار از نواحی اطراف بیرجند در خراسان جنوبی (35° 24´N, 61° 31´ E, 1018 m) جمعآوری گردید و توسط گیاهشناس با کد هرباریوم 42610 مورد تایید قرار گرفت. گیاه مستار پس از شستوشو به کمک آب مقطر در سایه خشک گردید. پس از خشک کردن به منظور عصارهگیری، 20 گرم از پودر خشک شده گیاه مستار در 200 سیسی متانول به مدت 72 ساعت بر روی شیکر با دور 1500 RPM قرار دادهشد. سپس به کمک کاغذ واتمن شماره یک صاف گردید و در ادامه به کمک دستگاه روتاری، تغلیظ گردید. عصاره حاصل در پایان به منظور جدا کردن تمامی متانول، در درون انکوباتور با دمای 37 درجه سانتیگراد قرار داده شد تا زمانی که کاملا خشک گردد. پودر بهدست آمده در دمای 4 درجه برای استفادههای بعدی ذخیره شد (18).
سنتز نانوذره نقره: به منظور سنتز، 24 میلیگرم نیترات نقره در بشری حاوی 10 سیسی آب مقطر دیونیزه بر روی استیرر تحت همزدن شدید در دمای محیط (25 درجه سانتیگراد) قرار گرفت. همزمان 100 میلیگرم از عصاره گیاه مستار درون بشر دیگری به همراه 10 سیسی آب مقطر دیونیزه به مدت 5 دقیقه در دمای محیط سونیک شد و سپس از کاغذ صافی واتمن شماره یک عبور داده شد و PH سوسپانسیون حاصل با استفاده از سدیم هیدروکساید 2 مولار به 12 رسانده شد. عصاره گیاه با PH=12، پس از حل شدن کامل نیترات نقره درون آب مقطر، به صورت قطره قطره به درون بشر تحت همزدن شدید اضافه گردید (7). پس از اضافه کردن اولین قطرات عصاره، رنگ سوسپانسیون به قهوهای تیره بدل شد که این تغییر رنگ تاییدی بر کاهش یونهای نقره و سنتز نانوذرات نقره بود. سوسپانسیون فوق به مدت زمان 30 دقیقه بر روی استیرر هم زده شد. به منظور مطالعه بیشتر، نمودار جذب سوسپانسیون حاصل با استفاده از دستگاه UV-Vis (NanoDrop, BioTek model Epoch, USA) و در طول موج 500-300 نانومتر اندازهگیری شد (19).
شرایط اپتیموم نانوذرات نقره: به منظور بهدست آوردن بهترین شرایط برای سنتز نانوذرات نقره به کمک عصاره گیاه مستار، سه پارامتر شامل غلظت نقره، زمان و دما، مورد آزمایش قرار گرفت. در هر مرحله سوسپانسیون حاصل در طیف جذبی 500-300 نانومتر توسط دستگاه UV–Vis خوانش گردید که ایدهآل ترین شرایط برای سنتز نانوذرات مشخص شود. به منظور بررسی ایدهآل ترین شرایط در سنتز نانوذرات نقره، غلظت گیاه مستار ثابت فرض شد و سپس ابتدا غلظتهای 5، 10، 15، 20 و 25 میلیمولار نیترات نقره مورد آزمایش قرار گرفت و در ادامه پس از تعیین ایدهآلترین غلظت نیترات نقره به کمک بررسی طیف جذبی در هر غلظت، سنتز نانوذرات با استفاده از ایدهآلترین غلظت نیترات نقره در زمانهای مختلف شامل 15، 30، 45 و 60 دقیقه ادامه یافت. در پایان نیز در غلظتهای ایدهآلی از نیترات نقره به همراه زمان ایدهآل برای انجام واکنش، سنتز نانوذرات در دماهای مختلف شامل دمای اتاق، 55 درجه سانتی گراد و 85 درجه سانتیگراد انجام شد و بهینهترین شرایط سنتز نانوذرات نقره به کمک عصاره متانولی گیاه مستار تعیین گردید.
تعیین مشخصات نانوذرات نقره: در مطالعه حاضر برای تعیین خصوصیات نانوذرات نقره از دستگاه UV-Vis در طول موج 300-500 نانومتر استفاده گردید. اندازهگیری سایز و پتانسیل زتا نانوذرات با استفاده از دستگاه زتاسایزر دانشگاه علوم پزشکی بیرجند بود. شناسایی گروههای عاملی نانوذرات نقره با استفاده از FT-IR (PerkinElmer Spectrum Two IR spectrometer; Model L160000U)، تعیین اندازه و مشاهده ویژگیهای مورفولوژیکی ترکیبات با استفاده از میکروسکوپ الکترون TEM (Zeiss-EM10C-100 KV) و تعیین قطر هیدرودینامیکی نانوذرات نقره با استفاده از DLS (NanoBrook 90Plus-Brookhaven Instruments, model 18051; USA) انجام شد.
بررسی خاصیت آنتیباکتریال: در این مطالعه از پنج سویه استاندارد از گونههای مختلف باکتریایی، شامل دو گونه باکتری گرم مثبت: استافیلوکوکوس اورئوس (ATCC 25923) و انتروکوکوس فکالیس (ATCC 29212) و سه گونه باکتری گرم منفی: کلبسیلا پنومونیه (ATCC 9997)، سودوموناس آئروژینوزا (ATCC 27853) و اشریشیاکلای (ATCC 25922) موجود در آزمایشگاه میکروبشناسی دانشکده پزشکی بیرجند استفاده شد. باکتریهای مورد نظر پس از کشت بر روی محیط بلاد آگار به مدت 18-24 ساعت در انکوباتور با دمای 37 درجه انکوبه شدند تا باکتریهای تازه تکثیر یابند ( به منظور رشد بهینه انتروکوکوکوس فکالیس به منظور ایجاد اتمسفر کم هوازی از کندل جار استفاده شد) از کلنیهای ظهور یافته بر سطح محیط کشت، جهت تهیه محلول نیممکفارلند استفاده شد (20). به این صورت که در پلیت 96 خانه استریل رقتهای متوالی دو برابری از هر یک از ترکیبات مورد بررسی در محیط مولر هینتون براث با حجم نهایی 100 میکرولیتر تهیه شد. سپس به هر چاهک میزان 100 میکرولیتر از سوسپانسیون باکتریایی با غلظت نهایی 105× 5 CFU/mL اضافه شد. پلیتها به مدت 24-18 ساعت و در درمای 37 درجه سانتیگراد انکوبه شدند. از سوسپانسیون باکتریایی مولر هینتون براث به عنوان کنترل مثبت و از محیط کشت به تنهایی به عنوان کنترل منفی استفاده گردید. در مطالعه حاضر از آنتیبیوتیک تتراسایکلین نیز به عنوان کنترل استفاده شد (21).
نتایج
تعیین مشخصات نانوذرات سنتز شده: در این مطالعه به منظور تایید تشکیل نانوذرات نقره و تعیین تاثیر پارامترهای مختلف در تشکیل نانوذرات از طیف UV-Vis در طول موج 300-500 نانومتر استفاده گردید. به منظور تعیین بهینهترین غلظت نیترات نقره برای تشکیل نانوذرات به کمک عصاره گیاه، غلظتهای 25-5 میلی مولار نیترات نقره مورد بررسی قرار گرفت. مطالعات گذشته نشان داده است که با افزایش غلظت نیترات نقره، نانوذرات بیشتری تشکیل میشود. بررسیهای طیف جذبی نانوذرات (تصویر1-الف) نشان دهنده افزایش شدت نوار جذبی با افزایش غلظت نیترات نقره تا غلظت 10 میلیمولار می باشد اما در غلظتهای 15، 20 و 25 میلی مولار به دلیل چسبندگی نانوذرات طیف جذبی کاهش یافته است. در نتیجه غلظت 10 میلیمولار نیترات نقره به عنوان بهترین غلظت نقره در نظر گرفته شد. در غلظت 10 میلیمولار نقره، طیف جذبی نانوذرات در زمانهای گوناگون (تصویر1-ب) مورد بررسی قرار گرفت. مشخص شد که با افزایش زمان واکنش از 15 دقیقه به 30 دقیقه، شدت جذب افزایش مییابد و پس از آن تغییر محسوسی در شدت جذب مشاهده نمیشود. برای اندازه گیری ایدهآلترین دما برای انجام واکنش، واکنش در دماهای مختلف مورد بررسی قرار گرفت. دمای اتاق، 55 و 85 درجه سانتیگراد، دماهای مورد استفاده در این واکنش بوده است. نمودار جذب یووی نشان داد که با افزایش دمای واکنش، میزان جذب کاهش مییابد. در دماهای پایین، پیک جذبی به سمت طول موجهای کوتاه تر شیفت پیدا کرده است که نشان دهنده کاهش در سایز نانوذرات سنتز شده است. بنابراین دما 25 درجه سانتیگراد برای انجام این واکنش به عنوان بهترین دما در نظر گرفته شد (تصویر1-ج).
آنالیز XRD: به منظور تعیین ساختار کریستالی و خلوص نانوذرات سنتز شده، از آنالیز XRD استفاده شد. نتایج آنالیز XRD در تصویر 2 قابل مشاهده است. همانطور که در تصویر 2 نشان داده شده است هیچگونه ناخالصیای در طیف XRD مشاهده نمیشود و تمامی پیکها مربوط به نانوذرات نقره سنتز شده میباشد که نشان دهنده خلوص بالای نانوذرات سنتز شده است و مطابق با پراش استاندارد نقره میباشد (JCPDS 01-087-0717). نتایج XRD پیکهایی در زوایای 38.2، 44.4، 64.8 و 77.8 نشان میدهد که به ترتیب مربوط به 111، 200، 220 و 311 صفحات براگ میباشد. سایز نانوذرات سنتز شده با استفاده از معادله دبای-شرر (D= n𝜆/βcosθ) 20-15 نانومتر بهدست آمد که در این معادله، D سایز نانوذرات بر اساس نانومتر، λ طول موج پرتو ،β پهنای پیک در نیمه ارتفاع و θ زاویه پراش پرتو ایکس میباشد.
آنالیز DLS و پتانسیل زتا: تجزیه و تحلیل DLS یک تکنیک اساسی است که برای تعیین اندازه ذرات استفاده میشود. در طی این تجزیه و تحلیل، ذرات از یک پرتو نور که توسط دستگاه ساطع میشود عبور میکنند و اندازه آنها با اندازهگیری میزان پراکندگی نور تعیین می شود. اندازه به دست آمده از این تجزیه و تحلیل مطابق با قطر هیدرودینامیکی ذرات است. قطر هیدرودینامیکی به قطر یک ذره به همراه مولکولهای آب اطراف آن اشاره دارد که در نتیجه منجر به اندازه بزرگتر در مقایسه با ذره واقعی است. تصویر 3-الف هیستوگرام DLS را نشان میدهد، که با توجه به این نمودار اندازه قطر هیدرودینامیکی نانوذرات نقره در حدود 130 نانومتر میباشد. در این مطالعه، از آنالیز پتانسیل زتا برای ارزیابی پایداری SLL@AgNPsبا اندازهگیری میزان سطح استفاده شد. شارژ بار سطحی بالاتر نشان دهنده افزایش دافعه بین ذرات دارای بار مشابه است که منجر به پایداری بیشتر ذرات می شود. با توجه به تصویر 3-ب پتانسیل زتا نانوذرات سنتز شده 38/82- میلیولت می باشد که نشان دهنده بار سطحی منفی در نانوذرات سنتز شده به کمک عصاره است. این بار منفی بالا از تجمع NPs جلوگیری می کند و در نتیجه یک تعلیق پایدار ایجاد میکند (22).
آنالیز طیف FT-IR: نتایج آنالیز FT-IR مربوط به عصاره گیاه و نانوذرات سنتز شده در تصویر4 و 5 به ترتیب قابل مشاهده است. آنالیز FT-IR نشاندهنده گروههای عملکردی موجود در عصاره گیاه و همچنین نانوذرات سنتز شده است. طیف FT-IR عصاره گیاه (تصویر4) باندهای جذبی در 3466.2، 2924.6، 1627.7، نشان میدهد که به ترتیب مربوط به ارتعاشات کششی گروه OH در الکل ها، ارتعاشات کششی C-H، کشش گروه کتون C=O بوده که نشان میدهد این گروه کتونی هم به عنوان عامل کاهنده و پوشش دهنده میتواند استفاده گردد. پیکهای جذبی مشاهده شده در نواحی 1406/6، 1263/3، 1072/2 و 862/2 مربوط به گروههای آروماتیک C-H، C-O، C-O-C و C-H مربوط به گروه آلکنها میباشد. علاوه بر این تصویر5 طیف FT-IR مربوط به نانوذرات سنتز شده با استفاده از عصاره گیاه را نشان میدهد. پیکهای جذبی مشاهده شده در طیف FT-IR نانوذرات سنتز شده شباهت زیادی به عصاره گیاه دارد با اینحال، تغییرات جزئی و کاهش کشش در پیکهای نانوذرات نسبت به عصاره گیاه وجود دارد. این نشان میدهد که گروههای عاملی موجود در عصاره گیاه نقش مهمی در تشکیل نانوذرات ایفا میکند. از طرفی طیفسنجی FT-IR نشان داد که گروههای کربونیل و هیدروکسیل موجود در عصاره برگ گیاه مستار نقش مهمی در پوشش نانوذرات نقره و همچنین نقش کلیدی در کاهش یونهای نقره دارند (23).
4-1-1-5 آنالیز TEM: از آنالیز TEM به منظور بررسی دقیق اندازه و مورفولوژی نانوذرات استفاده میشود. اندازه و مورفولوژی نانوذرات سنتز شده از طریق روش سبز تحت تأثیر عصاره مورد استفاده در فرآیند سنتز قرار میگیرد. تصاویر TEM (تصویر 6) نانوذرات سنتز شده نشان میدهد که نانوذرات سنتز شده ساختاری کروی و اندازهای در حدود 5/077±18/87 نانومتر دارند.
نتایج تست آنتیباکتریال: با توجه به جدول 1 عصاره گیاه مستار به تنهایی اثرات ضد باکتریایی قابلتوجهی بر باکتریهای مورد مطالعه ندارد و بیشترین اثر آنتیباکتریالی خود را بر باکتری انتروکوکوس فکالیس (MIC= 1870 µg/ml) دارا بود و بهطور کلی نیز این عصاره دارای اثرات آنتیباکتریال بییشتری بر باکتریهای گرم مثبت استافیلوکوکوس اورئوس و انتروکوکوس فکالیس نسبت به باکتریهای گرم منفی بود. نتایج MIC حاصل از نانوذره نقره بهتنهایی نشان داد که نانوذره نقره بهتنهایی در غلظتهای کمتری نسبت به عصاره گیاهی دارای اثرات آنتیباکتریال است بهطوری که بر باکتری انتروکوکوس فکالیس بیشترین اثر را گذاشته و رشد آن را در غلظت 625 µg/ml مهار کرده است و استافیلوکوکوس اورئوس، اشرشیاکلی و کلبسیلا پنومونیه با MIC= 1250 µg/ml و سودوموناس آئروژینوزا با MIC= 5000 µg/ml در رتبههای بعدی قرار دارند. در میان سه ترکیب استفاده شده، نانوذره نقره سنتز شده به روش سبز به کمک گیاه مستار دارای بیشترین خاصیت آنتیباکتریال بود. نانوذره سنتز شده بر خلاف گیاه مستار و نانوذره نقره بهتنهایی بیشترین تاثیر را بر باکتریهای گرم منفی داشته است بهطوری که در غلظت 39 µg/mlمانع از رشد باکتریهای اشریشیاکلای و سودوموناس آئروژینوزا شده است و کمترین تاثیر را با باکتری گرم مثبت انتروکوکوس فکالیس (MIC= 310 µg/ml) داشته است. نانوذره نقره سنتز شده به کمک عصاره گیاه مستار نسبت به نانوذره نقره بهتنهایی و عصاره گیاه مستار دارای MIC کمتر و در نتیجه عملکرد آنتیباکتریالی بهتری بود. در نتیجه، استفاده از عصاره گیاه مستار و نانوذرات نقره به منظور سنتز سبز نانوذرات نقره، موجب اثرات سینرژیسمی و افزایش چشمگیر خاصیت آنتیباکتریال نانوذرات سبز شده است.

تصویر 1: طیف UV-Vis نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار در غلظتهای مختلف نیترات نقره (الف) غلظت های متفاوت، (ب)، دماهای مختلف (ج) بازه زمانی متفاوت

تصویر 2: الگوی پراش اشعه ایکس نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار

تصویر3: آنالیز DLS (الف) و پتانسیل زتا (ب) نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار

تصویر4: طیف FTIR عصاره گیاه مستار

تصویر5: طیف FTIR نانوذرات نقره سنتز شده

تصویر6: تصویر TEM نانوذرات نقره سنتز شده با عصاره برگ گیاه مستار
جدول 1: نتایج آنتیباکتریال نانوذره سنتز شده، نانوذره به تنهایی و عصاره گیاه مستار

بحث
امروزه مقاومت باکتریها به آنتیبیوتیکها به یک تهدید جدی برای سلامت انسان بدل شده است و بایستی به کمک روشهای مختلف از جمله کمک گرفتن از مواد موجود در طبیعت بر آن غلبه کرد (1). در این راستا، نانوذرات نقره به روش سبز به کمک عصاره گیاه مستار (Sclerorhachis leptoclada) سنتز شد و خواص آنتیباکتریال نانوذرات سنتز شده به کمک عصاره گیاه مستار با نانوذرات نقره به تنهایی و عصاره گیاه مستار مقایسه شد. تشدید پلاسمون سطحی نقره در طی واکنش منجر به تغییر رنگ محلول به قهوه تیره میشود و این تشدید پلاسمون سطحی باعث ایجاد باند جذبی در طول موج 500-300 نانومتر می شود. نتایج گذشته نشان داد که افزایش میزان جذب نانو ذرات با افزایش تشکیل نانو ذرات سنتز شده رابطه مستقیمی دارد. بر این اساس غلظت 10 میلی مولار نیترات نقره و زمان 30 دقیقه و دمای 25 درجه دارای بیشترین جذب در طول موج 500-300 نانومتر میباشند. در طیف FT-IR مربوط به نانوذرات نقره سنتز شده با عصاره مستار، قلههای جذبی مشابه قله های جذب عصاره گیاه اما با جابجایی و شدت کمتر نسبت به عصاره گیاه مشاهده گردید. نتایج طیف FT-IR مربوط به نانوذرات نشان دهنده مولکولهای زیستی موجود در عصاره میباشد که عامل احیاء یونهای نقره میباشند. این نشان میدهد که گروههای عاملی موجود در عصاره گیاه در تشکیل نانوذرات نقش دارند (1). نتایج XRD مربوط به نانوذرات نقره سنتز شده با عصاره مستار در مطالعه حاضر نشان داد که ترکیب سنتز شده فاقد ناخالصی بوده و تمامی پیکها مربوط به نقره و مطابق با پراش استاندارد نقره میباشد (JCPDS 01-087-0717). این الگویXRD نشان میدهد که نانوذرات نقرهای که در اثر کاهش یونهای نقره با استفاده از عصاره مستار تشکیل میشوند، ماهیت کریستالی دارند. نتایج مطالعه حاضر در راستای یافتههای ارائه شده در سایر مطالعات بوده و عدم وجود قله اضافی در آنالیز XRD نشان دهنده عدم وجود ناخالصی در نانوذرات سنتز شده میباشد (24). بر اساس نتایج تصاویر TEM نانوذرات سنتز شده مورفولوژی کروی و بیضوی با اندازه ای در حدود 5/077±18/87 نانومتر دارند. همچنین در برخی مناطق نانوذرات روی هم چسبیده شده و ساختار نامنظم دارند که می توان به چسبندگی عصارههای موجود در سطح نانو ذرات نسبت داد. وجود سایههای تیره بر روی سطح نانوذرات در تصاویر TEM نشان دهنده قرارگیری ترکیبات زیستی موجود در عصاره گیاه بر سطح نانو ذرات نقره میباشد. اندازه کوچک، مورفولوژی کروی و ساختارهای منظم از ویژگیهای برجسته نانوذرات سنتز شده با استفاده از عصاره مستار میباشد که این ترکیبات را نسبت به نانو ذرات سنتز شده در تحقیقات گذشته متمایز نموده است. بار سطحی موجود در نانوذرات نقش اساسی در جلوگیری از تجمع و افزایش ثبات نانوذرات را داراست. بهطوری که در صورت داشتن بار سطحی بالا (مثبت یا منفی) نانوذرات یکدیگر را دفع کرده و تجمع نمییابند با توجه به نمودار 3 پتانسیل زتا نانوذرات سنتز شده 38/82- میلی ولت میباشد. با توجه به نتایج حاصل از بررسی خواص آنتیباکتریال نانوذرات سنتز شده، نانوذرات نقره به تنهایی و عصاره گیاه مستار مشخص شد (جدول1). که استفاده از عصاره گیاه مستار به منظور سنتز نانوذرات بهطور چشمگیری موجب افزایش خواص آنتیباکتریالی نانوذرات سنتز شده شد که با سایر مطالعات مشابهت دارد. در مطالعه Arya A و همکاران که به بررسی خاصیت آنتیباکتریال نانوذرات نقره سنتز شده به کمک عصاره گیاه Alga Botryococcus braunii به روش میکروبراث دایلوشن پرداخته شده بود، نانوذرات سنتز شده دارای خواص آنتیباکتریال بر باکتریهای اشریشیاکلای، کلبسیلا پنومونیه، سودوموناس آئروژینوزا و استافیلوکوکوس اورئوس به ترتیب با MIC برابر با 100، 62.5، 62.5 و 200 میکروگرم بر میلیلیتر بودند که نتایج مطالعه انجام شده با مطالعه حال حاضر مشابهت دارد (25). در مطالعه Hemmati S و همکاران نانوذرات سنتزشده به کمک گل گیاهFritillaria دارای اثرات آنتیباکتریال بر باکتریهای استافیلوکوکوس اورئوس و انتروکوکوس فکالیس به ترتیب با MIC 4 و 1 میلیگرم بر میلیلیتر بود که نشان دهنده خاصیت آنتیباکتریالی بیشتر نانوذرات سنتز شده در مطالعه حال حاضر میباشد. در مطالعه Hemmati و همکاران و مطالعه حاضر از سویههای باکتریایی یکسانی استفاده شده است، پس شاید بتوان علت این تفاوت را به تاثیر عصاره گیاه بر سنتز نانوذراتی با مورفولوژی و اندازههای مختلف و درنتیجه خواص آنتیباکتریال متفاوت مرتبط دانست (26). در مطالعه دیگری که توسط میرمحمدی و همکاران انجام گرفت نانوذرات نقره سنتز شده با عصاره بارهنگ Plantago lanceolata فعالیت ضد باکتریایی قابلتوجهی بر باکتریهای استافیلوکوکوس اورئوس و انتروکوکوس فکالیس با میزان MIC برابر 125 میکروگرم بر میلیلیتر دارند در صورتیکه عصاره بارهنگ و نانوذرات نقره شیمیایی اثر ضدباکتریایی قابل توجهی نداشتند (1). همچنین در مطالعه انجام شده توسط صالحی و همکاران نانوذرات نقره بیوسنتز شده با عصارهSalvia tebesana Bunge ، دارای پیکربندی کروی با اندازه متوسط در محدوده 15-10 نانومتر بود. نانوذرات سنتز شده زیستی در مقایسه با نانوذرات شیمیایی، بهویژه در برابر باکتری P. aeruginosa بالاترین فعالیت ضد باکتریایی را در مقدار MIC برابر با 36/06 میکروگرم بر میلیلیتر نشان دادند. یافتهها نشان می دهد که عصاره S. tebesana Bunge خواص ضد باکتریاییAgNP ها را افزایش میدهد و همچنین نشان دهنده یک گزینهای مناسب و زیست سازگار برای سنتز این نانوذرات است (27). بهطور کلی در مطالعات انجام شده توسط محققان دیگر نانوذرات نقره سنتز شده توسط عصاره گیاه نسبت به نانوذرات شیمیایی و عصاره گیاه به تنهایی اثرات ضد باکتریایی قابل توجهای را اعمال نمودهاند که این اثر را میتوان به مواد موثره موجود در گیاهان به خصوص ترکیبات فنلی و قلاونوئیدها که عامل پوشش دهنده و کاهنده یون نقره میباشد نسبت داد (21،28،29). با توجه به نتایج، خاصیت ضد باکتریایی نانوذره نقره سنتز شده به کمک عصاره گیاه مستار بیشتر از عصاره گیاه مستار و نانوذره نقره به تنهایی بوده است. بنابراین استفاده از عصاره گیاه مستار به منظور سنتز نانوذرات موجب اثرات همافزایی در خاصیت آنتیباکتریال عصاره گیاهی و نانوذرات نقره به تنهایی شده است. نتایج مشابهی در مطالعه باقرزاده و همکاران بهدست آمده است (30). نانوذرات نقره سنتز شده به کمک گیاه مستار بر روی باکتریهای گرم منفی بیشتر از باکتریهای گرم مثبت اثر گذاشتهاند، بهطور مشابه در اکثر مطالعات اثرات بازدارندگی نانوذرات نقره سنتز شده با عصاره گیاهی بر باکتریهای گرم منفی بیشتر از باکتریهای گرم مثبت گزارش شده بود، که احتمالا به دلیل تفاوت در ساختار دیواره سلولی آنهاست. باکتریهای گرم منفی دیواره سلولی نازک تری دارند و دارای لیپوپلیساکارید میباشند که باعث ایجاد بارالکتریکی منفی بر روی سطح آنها میشود و وجود این بار منفی بر روی سطح باکتریهای گرم منفی موجب جذب بیشتر نانوپارتتیکلها و در نتیجه تاثیر بیشتر آنها بر باکتریهای گرم منفی میشود (31). مکانیسمهای متعددی برای توجیه خاصیت ضدمیکروبی نانوذرات نقره مطرح شده است اما همچنان فرایند دقیق آن مشخص نیست. یکی از مکانیسمهای مطرح شده، چسبیدن نانوذره نقره بر دیواره و غشای سلولی ارگانیسم، القاء تغییرات مورفولوژیک در غشای سلول، اختلال در نفوذپذیری و تنفس سلولی و نهایتاً مرگ سلول است (33،32). همچنین یون نقره آزادشده از نانوذره میتواند با پروتئینهای حاوی سولفور و DNA واکنش دهد، به DNA آسیب برساند و باعث اختلال در عملکرد آنزیمهای پروتئینی سلول شود (34). مکانیسم مهم دیگری که مطرح شده است، تولید رادیکالهای آزاد اکسیژن (ROS) است. رادیکالهای آزاد اکسیژن باعث القای استرس اکسیداتیو و آسیب به پروتئینها، لیپیدها، RNA و DNA سلول و نهایتاً مرگ سلولی میشوند (35).
نتیجهگیری
سنتز سبز نانوذرات نقره به کمک عصاره برگ گیاه مستار یک روش ساده، کم هزینه و دوستدار محیطزیست میباشد. نتایج نشان داد که غلظت نیترات نقره، دما و زمان واکنش نقش مهمی در اندازه و سایز نانوذرات تشکیل شده دارد. علاوه بر این مشخص شد که نانوذرات نقره سنتز شده خاصیت آنتیباکتریال عصاره گیاه مستار را بسیار بهبود بخشیده است و نانوذرات نقره سنتز شده خاصیت آنتیباکتریال بالایی علیه باکتریهای گرم مثبت و منفی دار است و باکتریهای گرم منفی نسبت به نانوذرات سنتز شده حساستر میباشند.
سپاس گزاری
از معاونت تحقیقات و فناوری دانشگاه علوم پزشکی بیرجند برای حمایتهای مالی (کد پایان نامه: 456480) و پرسنل محترم آزمایشگاه جامع تحقیقات دانشگاه علوم پزشکی بیرجند قدردانی میگردد.
حامی مالی: پژوهش حاضر با حمایت مالی دانشگاه علوم پزشکی بیرجند با کد پایان نامه 456480 به انجام رسید.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
در ابتدا طرح در کمیته اخلاق دانشگاه علوم پزشکی بیرجند ثبت و با کد IR.BUMS.REC1400.178 مورد تاییدکمیته اخلاق دانشگاه علوم پزشکی بیرجند قرار گرفت.
مشارکت نویسندگان
ابراهیم شفائی و سمیرا اقبالی در ارائه ایده، سمیرا اقبالی در طراحی مطالعه، زهرا صالحی در جمعآوری دادهها، ابراهیم شفائی و سمیرا اقبالی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Mirmohammadi ST, Eghbali S, Mohammadparast-Tabas P, Yousefi M. Green Synthesis of Silver Nanoparticles Using Plantago Lanceolata Seed Extract: Characterization and Investigation of Antibacterial Activities. J Birjand Univ Med Sci 2024; 31(2): 127-39. [Persian]
2- Bafana A, Kumar SV, Temizel-Sekeryan S, Dahoumane SA, Haselbach L, Jeffryes CS. Evaluating Microwave-Synthesized Silver Nanoparticles from Silver Nitrate with Life Cycle Assessment Techniques. Sci Total Environ 2018; 636: 936-43.
3- Marturano V, Kozlowska J, Bajek A, Giamberini M, Ambrogi V, Cerruti P, et al. Photo-Triggered Capsules Based on Lanthanide-Doped Upconverting Nanoparticles for Medical Applications. Coord Chem Rev 2019; 398: 213013.
4- Bhushan B. Introduction to Nanotechnology. 4th Edition. Springer Handbook of Nanotechnology: Springer; 2017; 1-19.
5- Keyhanfar M, Mansouri HA. The Role of Plant Antioxidants in the Synthesis of Metal Nanoparticles. J Plant Process Fun 2022; 1(1): 67-76. [Persian]
6- Campos S, Salazar R, Arancibia-Miranda N, Rubio M, Aranda M, García A, et al. Nafcillin Degradation by Heterogeneous Electro-Fenton Process Using Fe, Cu and Fe/Cu Nanoparticles. Chemosphere 2020; 247: 125813.
7- Ebrahimzadeh MA, Naghizadeh A, Amiri O, Shirzadi-Ahodashti M, Mortazavi-Derazkola S. Green and Facile Synthesis of Ag Nanoparticles Using Crataegus Pentagyna Fruit Extract (CP-Agnps) for Organic Pollution Dyes Degradation and Antibacterial Application. Bioorganic Chem 2020; 94: 103425.
8- Kaplan Ö, Tosun NG, Özgür A, Tayhan SE, Bilgin S, Türkekul İ, et al. Microwave-Assisted Green Synthesis of Silver Nanoparticles Using Crude Extracts of Boletus Edulis and Coriolus Versicolor: Characterization, Anticancer, Antimicrobial and Wound Healing Activities. J Drug Deliv Sci Technol 2021; 64: 102641.
9- Téllez-de-Jesús DG, Flores-Lopez N, Cervantes-Chávez J, Hernández-Martínez A. Antibacterial and Antifungal Activities of Encapsulated au and Ag Nanoparticles Synthesized Using Argemone Mexicana L Extract, Against Antibiotic-Resistant Bacteria and Candida Albicans. Surf Interface 2021; 27: 101456.
10- Rana A, Yadav K, Jagadevan S. A Comprehensive Review on Green Synthesis of Nature-Inspired Metal Nanoparticles: Mechanism, Application and Toxicity. J Clean Prod 2020; 272: 122880.
11- Jafari-Sales A, Rasi-Bonab F, Sayyahi J. The Survey on Antimicrobial Effects of Methanolic Extract of Carum Copticum L. on Staphylococcus Aureus, Bacillus Cereus, Escherichia Coli and Pseudomonas Aeruginosa in Laboratory Conditions. Paramedical Sci Milit Health 2019; 13(4): 19-25.
12- Sonboli A, Mirjalili MH, Hadian J, Yousefzadi M. The Biological Activity and Composition of the Essential Oil of Sclerorhachis Leptoclada (Asteraceae-Anthemideae) from Iran. Iran J Pharm Res: IJPR. 2014; 13(3): 1097-104.
13- Ghafoorian Eshghi O, Tehranipour M, Baharara J, Amintaheri N. Effect of Sclerorhachis Leptoclada Hydroalcoholic Extract on Glucose and Cholesterol Levels, Triglyceride, as Well as Serum HDL and LDL in Male Diabetic Rats. J Birjand Univ Med Sci 2020; 27(4): 344-54.
14- Mohammadi T, Pirani A, Vaezi J, Moazzeni H. A Contribution to Ethnobotany and Review of Phytochemistry and Biological Activities of the Iranian Local Endemic Species Sclerorhachis Leptoclada Rech. f. Ethnobot Res Appl 2020; 20: 1-18.
15- Tahmasebi A, Andi S, Ahmadi MR, Alavi BS. Inhibitory Effect of Essential Oils of Sclerorhachis Platyrachis and Sclerorhachis Leptoclada on Phytopathogenic Fungi. Int J Agric Sci 2012; 2(1): 48-53.
16- Shafaie E, Taleghani A, Sahebkar A, Eghbali S. The Essential Oil of Sclerorhachis Leptoclada Rech.F.: Chemical Composition and Biological Activity. Nat Prod Commun 2023; 18(11); 1-6.
17- Sahu N, Soni D, Chandrashekhar B, Satpute DB, Saravanadevi S, Sarangi BK, Pandey RA. Synthesis of Silver Nanoparticles Using Flavonoids: Hesperidin, Naringin and Diosmin, and their Antibacterial Effects and Cytotoxicity. Int Nano Lett 2016; 6: 173-81.
18- Rahmani AF, Ghanavati-Behbahan F, Moradi Y. Antimicrobial Effects of Ethanol Extract of Eremurus Persicus Leaves on Staphylococcus Aureus Under Laboratory Conditions. Int J Adv Biol Biomed Res 2021; 9(1): 58-63.
19- Gomathi M, Prakasam A, Rajkumar PV, Rajeshkumar S, Chandrasekaran R, Anbarasan PM. Green Synthesis of Silver Nanoparticles Using Gymnema Sylvestre Leaf Extract and Evaluation of Its Antibacterial Activity. S Afr J Chem Eng 2020; 32: 1-4.
20- Wayne PA. CLSI (Clinical and Labboratory Standards Institute): Performance Standards for Antimicrobial Susceptibility Testing. 30th ed. CLSI supplement M10. January 2020.
21- Zare-Bidaki M, Mohammadparast-Tabas P, Khorashadizade M, Mohammadparast-Tabas P, Alemzadeh E, Saberi A, et al. Bio-Synthesized AGS@ Agnps for Wound Healing, Antioxidant Support, Antibacterial Defense, and Anticancer Intervention. Biocatal Agric Biotechnol 2024; 61: 103402.
22- Aktepe N, Baran A, Atalar MN, Baran MF, Keskin C, Düz MZ, et al. Biosynthesis of Black Mulberry Leaf Extract and Silver Nanoparticles (Agnps): Characterization, Antimicrobial and Cytotoxic Activity Applications. MAS J Applied Sci 2021; 6(3): 685-700.
23- Abbas Widatalla H, Fathi Yassin L, Ahmed Alrasheid A, Abdel Rahman S, Osman Widdatallah M, Hussein Eltilib S, et al. Green Synthesis of Silver Nanoparticles Using Green Tea Leaf Extract, Characterization and Evaluation of Antimicrobial Activity. Nanoscale Adv 2022; 4: 911-15.
24- Singla S, Jana A, Thakur R, Kumari C, Goyal S, Pradhan J. Green Synthesis of Silver Nanoparticles Using Oxalis Griffithii Extract and Assessing their Antimicrobial Activity. Open Nano 2022; 7: 100047.
25- Arya A, Gupta K, Chundawat TS, Vaya D. Biogenic Synthesis of Copper and Silver Nanoparticles Using Green Alga Botryococcus Braunii and Its Antimicrobial Activity. Bioinorg Chem Appl 2018; 2018: 7879403.
26- Hemmati S, Rashtiani A, Zangeneh MM, Mohammadi P, Zangeneh A, Veisi H. Green Synthesis and Characterization of Silver Nanoparticles Using Fritillaria Flower Extract and their Antibacterial Activity Against Some Human Pathogens. Polyhedron 2019; 158: 8-14.
27- Zabihi MM, Eghbaliferiz S, Khorashadizadeh M, Mortazavi-Derazkola S, Yousefi M. Green Synthesis of Non-Toxic Silver Nanoparticles Using Salvia Tebesana Bunge Extract: Optimization, Cytotoxicity, and Antibacterial Activities. Results Chem 2024; 7: 101510.
28- Hajizadeh M, Sarayan MS, Taleghani A, Shafaei E, Sahebkar A, Eghbali S, Nasirizadeh S. Evaluation of Antimicrobial and Antioxidant Effects of Silver Nanoparticles Synthesized with Leaves of Lepidium Draba L. J Radiat Res Appl Sci 2024; 17(3): 101004.
29- Hamelian M, Zangeneh MM, Shahmohammadi A, Varmira K, Veisi H. Pistacia Atlantica Leaf Extract Mediated Synthesis of Silver Nanoparticles and their Antioxidant, Cytotoxicity, And Antibacterial Effects Under in Vitro Condition. Appl Organomet Chem 2020; 34(1): e5278.
30- Bagherzade G, Tavakoli MM, Namaei MH. Green Synthesis of Silver Nanoparticles Using Aqueous Extract of Saffron (Crocus Sativus L.) Wastages and Its Antibacterial Activity Against Six Bacteria. Asian Pac J Trop Biomed 2017; 7(3): 227-33.
31- Bhakya S, Muthukrishnan S, Sukumaran M, Muthukumar M. Biogenic Synthesis of Silver Nanoparticles and their Antioxidant and Antibacterial Activity. Appl Nanosci 2016; 6(5): 755-66.
32- Lourthuraj AA, Selvam MM, Hussain MS, Abdel-Warith A-WA, Younis EM, Al-Asgah NA. Dye Degradation, Antimicrobial and Larvicidal Activity of Silver Nanoparticles Biosynthesized From Cleistanthus Collinus. Saudi J Biol Sci 2020; 27(7): 1753-9.
33- Roy A, Bulut O, Some S, Mandal AK, Yilmaz MD. Green Synthesis of Silver Nanoparticles: Biomolecule-Nanoparticle Organizations Targeting Antimicrobial Activity. RSC Adv 2019; 9(5): 2673-702.
34- Rodríguez-Félix F, López-Cota AG, Moreno-Vásquez MJ, Graciano-Verdugo AZ, Quintero-Reyes IE, Del-Toro-Sánchez CL, et al. Sustainable-Green Synthesis of Silver Nanoparticles Using Safflower (Carthamus Tinctorius L.) Waste Extract and Its Antibacterial Activity. Heliyon 2021; 7(4): e06923.
35- Alkhulaifi MM, Alshehri JH, Alwehaibi MA, Awad MA, Al-Enazi NM, Aldosari NS, et al. Green Synthesis of Silver Nanoparticles Using Citrus Limon Peels and Evaluation of their Antibacterial and Cytotoxic Properties. Saudi J Biol Sci 2020; 27(12): 3434-41.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فارماکوگنوزی
دریافت: 1403/4/20 | پذیرش: 1403/7/29 | انتشار: 1403/9/15
دریافت: 1403/4/20 | پذیرش: 1403/7/29 | انتشار: 1403/9/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







