دوره 32، شماره 10 - ( دی 1403 )
جلد 32 شماره 10 صفحات 8365-8355 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Naghipour D, Arminfar A, Sahraneshin Samani Z, Sepanloo L, Babaei H, Hasani M H et al . Investigation of Kidney Histopathology in Rats Receiving Methamphetamine Simultaneously with Berberine Hydrochloride and Aerobic Exercise. JSSU 2025; 32 (10) :8355-8365
URL: http://jssu.ssu.ac.ir/article-1-6232-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6232-fa.html
نقی پور دانیال، آرمینفر عارف، صحرانشین سامانی زهرا، سپانلو لیدا، بابایی حسامالدین، حسنی محمدحسین و همکاران.. بررسی هیستوپاتولوژی کلیه در موش های صحرایی دریافت کننده متامفتامین همزمان با مصرف بربرین هیدروکلراید و فعالیت هوازی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (10) :8355-8365
دانیال نقی پور 

 ، عارف آرمینفر
، عارف آرمینفر 

 ، زهرا صحرانشین سامانی
، زهرا صحرانشین سامانی 

 ، لیدا سپانلو
، لیدا سپانلو 

 ، حسامالدین بابایی
، حسامالدین بابایی 

 ، محمدحسین حسنی
، محمدحسین حسنی 

 ، بهروز یحیایی*
، بهروز یحیایی* 




 ، عارف آرمینفر
، عارف آرمینفر 

 ، زهرا صحرانشین سامانی
، زهرا صحرانشین سامانی 

 ، لیدا سپانلو
، لیدا سپانلو 

 ، حسامالدین بابایی
، حسامالدین بابایی 

 ، محمدحسین حسنی
، محمدحسین حسنی 

 ، بهروز یحیایی*
، بهروز یحیایی* 


متن کامل [PDF 1057 kb]
(365 دریافت)
| چکیده (HTML) (1190 مشاهده)
References:
1- Courtney KE, Ray LA. Methamphetamine: An Update on Epidemiology, Pharmacology, Clinical Phenomenology, and Treatment Literature. Drug Alcohol Depend 2014; 143: 11-21.
2- Stoneberg D, Shukla R, Magness M. Global Methamphetamine Trends: An Evolving Problem. International Criminal Justice Review 2017; 28(2): 105756771773010.
3- Azizi S, Kheirandish R, Dabiri S, Lakzaee M. Adverse Effects of Methamphetamine on Vital Organs of Male Rats: Histopathological and Immunohistochemical Investigations. Iran J Basic Med Sci 2023; 26(5): 549-57.
4- Yoosefi Lebni J, Ziapour A, Qorbani M, Baygi F, Mirzaei A, Safari O, et al. The Consequences of Regular Methamphetamine Use in Tehran: Qualitative Content Analysis. Subst Abuse Treat Prev Policy 2020; 15(1): 33.
5- Han B, Compton WM, Jones CM, Einstein EB, Volkow ND. Methamphetamine Use, Methamphetamine Use Disorder, and Associated Overdose Deaths among US Adults. JAMA Psychiatry 2021; 78(12): 1329-42.
6- Mokhtari T, Sheikhazadi A, Hassanzadeh G, Safari M, Sheikhbahaei F, Faghir-Ghanesefat H, et al. Potential Adverse Effects of Amphetamines on Kidney; A Narrative Review on Current Knowledge. J Renal INJ Prev 2018; 7(4): 218-23.
7- Lewis D, Kenneally M, van denHeuvel C, Byard RW. Methamphetamine Deaths: Changing Trends and Diagnostic Issues. Med Sci Law 2021; 61(2): 130-7.
8- Cruickshank CC, Dyer KR. A Review of the Clinical Pharmacology of Methamphetamine. Addiction 2009; 104(7): 1085-99.
9- Radi ZA. Kidney Pathophysiology, Toxicology, and Drug-Induced Injury in Drug Development. Int J Toxicol 2019; 38(3): 215-27.
10- Kwiatkowska E, Domański L, Dziedziejko V, Kajdy A, Stefańska K, Kwiatkowski S. The Mechanism of Drug Nephrotoxicity and the Methods for Preventing Kidney Damage. Int J Mol Sci 2021; 22(11): 6109.
11- Bull FC, Al-Ansari SS, Biddle S, Borodulin K, Buman MP, Cardon G, et al. World Health Organization 2020 Guidelines on Physical Activity and Sedentary Behaviour. Br J Sports Med 2020; 54(24): 1451-62.
12- Scheffer DDL, Latini A. Exercise-Induced Immune System Response: Anti-Inflammatory Status on Peripheral and Central Organs. Biochim Biophys Acta Mol Basis Dis 2020; 1866(10): 165823.
13- Tian E, Sharma G, Dai C. Neuroprotective Properties of Berberine: Molecular Mechanisms and Clinical Implications. Antioxidants (Basel) 2023; 12(10): 1883.
14- Fan D, Liu L, Wu Z, Cao M. Combating Neurodegenerative Diseases with the Plant Alkaloid Berberine: Molecular Mechanisms and Therapeutic Potential. Curr Neuropharmacol 2019; 17(6): 563-79.
15- Zhang S, Xu P, Zhu Z, Zhou L, Li J, Zhou R, et al. Acetylation of P65(Lys310) by P300 in Macrophages Mediates Anti-Inflammatory Property of Berberine. Redox Biol 2023; 62: 102704.
16- Alavijeh MM, Vaezi G, Khaksari M, Hojati V. Berberine Hydrochloride Attenuates Voluntary Methamphetamine Consumption and Anxiety-Like Behaviors Via Modulation of Oxytocin Receptors In Methamphetamine Addicted Rats. Physiol Behav 2019; 206: 157-65.
17- Abdullah M, Huang LC, Lin SH, Yang YK. Dopaminergic and Glutamatergic Biomarkers Disruption in Addiction and Regulation by Exercise: A Mini Review. Biomarkers 2022; 27(4): 306-18.
18- Park M, Levine H, Toborek M. Exercise Protects Against Methamphetamine-Induced Aberrant Neurogenesis. Sci Rep 2016; 6: 34111.
19- Shahrabadi H, Haghighi AH, Askari R, Asadi-Shekaari M, Souza DC, Gentil P. Effect of High-Intensity Interval Training on Cardiac Apoptosis Markers in Methamphetamine-Dependent Rats. Curr Issues Mol Biol 2022; 44(7): 3030-8.
20- Azizi S, Saghebjoo M, Mohiti-Ardakani J. Reducing Effects of Aerobic Exercise Training Combined with Berberine Chloride Supplementation on the Apoptotic Markers of Kidney in Streptozotocin-Induced Diabetic Male Rats. Middle East Journal of Rehabilitation and Health Studies 2019; 6(4): e96483.
متن کامل: (359 مشاهده)
مقدمه
متامفتامین که با نامهای متیلآمفتامین و دزوکسی افدرین نیز شناخته میشود، یک محرک روانی قوی و اعتیادآور از مشتقات گروه فنتیلآمین و آمفتامین است (1). امروزه متامفتامین که دومین ماده مخدر غیرقانونی پرمصرف در جهان است، مورد سوء استفاده گستردهای قرار میگیرد، لذا مصرف متامفتامین به علت پیامدهای زیانبار آن از جمله افزایش جرم و جنایت، هزینه درمان، عوارض روانپزشکی و اقتصادی به عنوان یک معضل اجتماعی در ابعاد جهانی شناخته میشود (3، 2). همچنین براساس گزارش ها در مورد افزایش احتمالی مصرف متامفتامین در آبنده، علیرغم افزایش دو برابری مرگ و میر مرتبط با مصرف آن در دهه گذشته (1،4) بررسی این ماده و آسیبهای ناشی از آن بر بافت های بدن ضروری به نظر میرسد (5). اثرات اصلی متامفتامین به دلیل تحریک ترشح کاتکولآمینهایی مانند سروتونین، نوراپینفرین و بهویژه دوپامین از پایانههای عصبی و جلوگیری از جذب مجدد انتقال دهنده های عصبی و ایجاد حالت هیپرآدرنرژیک است (6). بنابراین مواردی مانند برانگیختگی، خلق مثبت و بهبود در حوزه های شناختی مانند توجه، هماهنگی روانی حرکتی، افزایش اعتماد به نفس و بهبود قدرت جنسی که در مصرف دوزهای پایین متامفتامین بروز میکنند، منجر به تمایل بیشتر به ادامه مصرف میشوند، اگرچه در مصرف دوزهای پایین احتمال بروز عوارض جانبی مانند ریسکپذیری و رفتار خشونتآمیز نیز وجود دارد (8،7). مصرف متامفتامین در دوزهای بالاتر و یا بهصورت مکرر میتواند منجر به روان پریشی یا آشکار شدن اختلالات روانپزشکی زمینهای شود (8، 1). همچنین احتمال ایجاد عوارض جانبی سیستمیک مانند هیپرترمی، رابدومیولیز و نارساییهای قلبی-عروقی، گوارشی، کبدی و ادراری تناسلی در سوء مصرف آن وجود دارد (3،8). همانطور که گفته شد متامفتامین میتواند اثرات مضری بر بسیاری از سیستمهای بدن از جمله کلیهها داشته باشد. کلیهها اندامهای دفعی پرعروقی هستند که در خلف صفاق قرار دارند و به حفظ هموستاز، حذف سموم و مواد زائد متابولیک از خون کمک میکنند. مصرف زیاد اکسیژن در کلیهها و جریان خون بالا به آنها باعث میشود بیشتر در معرض غلظت بالای مواد شیمیایی موجود در گردش خون قرار بگیرند (9). همچنین دفع مواد زائد متابولیکی که یکی از وظایف اصلی کلیهها میباشد، از طریق یکی از دو مسیر فیلتراسیون گلومرولی یا ترشح توبولار انجام میشود. در هرکدام از این دو مسیر لولهها و بافت بینابینی اطراف آنها در معرض مواد سمی قرار میگیرند (10). دلیل استفاده از دو فاکتور اثرات ورزش هوازی و بربرین هیدروکلراید در پژوهش حال حاضر، بررسی نتایج حاصل از مطالعاتی است که به چگونگی اثرات مثبت بافتی ورزش هوازی و بربرین هیدروکلراید پرداخته اند که در ذیل به تفصیل ذکر شده اند: ورزش هوازی (Aerobic exercise) فعالیتی است که در آن عضلات بزرگ بدن برای مدت زمان طولانی به صورت ریتمیک حرکت می کنند (11). ورزش هوازی با بهبود عملکرد اسکلتی- عضلانی، سلامت قلبی- تنفسی، متابولیک، خواب، مدیریت درد و موارد دیگر، یک ابزار بالینی اولیه غیردارویی برای پیشگیری از بسیاری از بیماریهایی است که فیزیوپاتولوژی آنها با فعال شدن حاد یا تقویت سیستم ایمنی مرتبط است (12). بهطور کلی ورزش مکرر با شدت متوسط، پاسخ عملکرد ایمنی را افزایش میدهد و ظرفیت آنتیاکسیدانی را تقویت می کند. همچنین استرس اکسیداتیو را کاهش و بازده تولید انرژی را افزایش داده و در نتیجه بروز بیماریهای التهابی را کاهش میدهد (12). بربرین هیدروکلراید (BBR) یک محصول طبیعی آلکالوئید ایزوکینولین، عمدتاً از Coptis chinensis و سایر گیاهان Berberis منشا گرفته است. بربرین دارای فعالیتهای زیستی مختلفی از جمله فعالیتهای آنتیاکسیدانی، ضد التهابی، ضد سرطانی، تنظیم کننده سیستم ایمنی و فعالیتهای ضد میکروبی است (13). علاوه بر این، بربرین از نظر بالینی در درمان اسهال، اختلالات متابولیک، بیماریهای قلبی عروقی، دیابت نوع 2، سندرم تخمدان پلیکیستیک، کلسترول بالا، چربی خون و بیماری کبد چرب غیر الکلی مورد آزمایش قرار گرفته است و بهطور کلی در دوزهای بالینی مورد استفاده، بدون هیچگونه فعالیت سیتوتوکسیک، ژنوتوکسیک یا میوتوژنیک، موثر و ایمن در نظر گرفته میشود (14). باور بر این است که بربرین نقش ضدالتهابی دارد که این مهم عمدتاً متمرکز بر روی ماکروفاژها و تنظیم مسیرهای سیگنالینگ التهابی، شامل مسیر فاکتور هستهای ( κB NF-kB) و کاهش تولید سایتوکاینهای التهابی مانند TNF-α، 6 IL-، β 1IL- و IFN-γ است (15). طبق بررسیهای انجام شده، مطالعاتی که به بررسی اثرات متامفتامین بر بافت کلیه پرداخته باشند محدود بوده است و مطالعه مورفومتریک بافت کلیه پس از مصرف متامفتامین نیازمند مطالعات گستردهتری میباشد، از اینرو ضرورت انجام پژوهشهای این چنینی بیش از پیش احساس میشود. بنابراین برآن شدیم تا در ایـن پژوهش به اثرات داروی متامفتامین همزمان با مصرف بربرین هیدروکلراید و فعالیت ورزشی هوازی بر بافت کلیه موشهای صحرایی بپردازیم.
روش بررسی
این پژوهش از نوع آزمایش تجربی و تصادفی است. معیار ورود به مطالعه محدوده وزنی و سلامت موش و معیار خروج مرگ حیوان بوده است و باتوجه به بررسی مطالعات انجام شده میزان شیوع استفاده از متامفتامین در جنس مونث بیشتر بوده است، از اینرو در این مطالعه از موش های صحرایی ویستار جنس ماده استفاده شده است.
در این مطالعه ابتدا ۴۰ سر موش صحرایی ماده نژاد ویستار با دامنه وزنی ۱۴۰تا ۱۶۰ گرم از انستیتو پاستور، خریداری و به مدت یک هفته در سالن قرنطینه آزمایشگاه فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد شاهرود جهت تطبیق و عادت و حذف عوامل تاثیرگذار محیطی در قفسهای فلزی مجزا به ابعاد ۳۵×۳۰×۱۵ سانتیمتر نگهداری شدند. موشهای صحرایی در شرایط یکسان تغذیه شدند. برای تغذیه حیوانات از غذای مخصوص موش (از شرکت خوراک دام پارس تهران) استفاده شد و آب لولهکشی شاهرود توسط شیشههای آب خوری در اختیارشان قرار گرفت. موشهای صحرایی در قفسهای مجزا و شرایط مناسب با درجه حرارت ۲۲ درجه سانتیگراد و سیکل نوری ۱۲ ساعت روشنایی و ۱۲ ساعت تاریکی و رطوبت نسبی 6۰-40 درصد نگهداری شدهاند. بهطور کلی شرایط نگهداری برای تمامی موشهای صحرایی در مدت زمان انجام پژوهش یکسان لحاظ شده است. نمونه آماری این تحقیق، به روش نمونهگیری انتخابی هدفدار با توجه به شرایط وزنی و محدوده سنی حدود 2 ماه انجام شد. در ادامه با توجه به وزن، حیوانات بهصورت کاملاً تصادفی در ۵ گروه ۸ تایی کنترل سالم، دریافت متامفتامین، متافتامین همراه با فعالیت هوازی، متامفتامین همراه با بربرین هیدروکلراید، متافتامین همراه با فعالیت هوازی و بربرین هیدروکلراید تقسیمبندی شدند. القاء متامفتامین به صورت درون صفاقی بهمیزان ۱۵ میلیگرم بر کیلوگرم به مدت ۴ روز و هر ۱۲ ساعت به موشهای صحرایی انجام گرفت. بربرین هیدروکلراید نیز به میزان ۱۰۰ میلیگرم بر کیلوگرم بهصورت درون صفاقی به مدت ۴ هفته و هر روزه به گروههای دریافت کننده تزریق شد. پروتکل تمرین هوازی که بهصورت تمرین روی تردمیل مخصوص جوندگان انجام شد، شامل یک برنامه دویدن ۸ هفتهای با شدت فزاینده بوده که کل زمان اجرای تمرین از ۱۵ دقیقه به ۵۰ دقیقه افزایش یافته است. در تمرین مذکور حداکثر سرعت روزانه از ۱۲ سانتیمتر بر ثانیه به ۵۴ سانتیمتر بر ثانیه افزایش و در هفته چهارم شیب ۵ درصد در نظر گرفته شده است. در ادامه ۲۴ ساعت پس از پایان دوره و دریافت بربرین هیدروکلراید، بر اساس دستورالعمل های کمیته اخلاق، حیوانات آزمایشگاهی با دریافت داروی کتامین به میزان mg/kg70 و زایلازین mg/kg10، به منظور ایجاد بیهوشی و بیدردی بهصورت درون صفاقی، بیهوش شدند. بافت مورد مطالعه، که کلیه بود، استخراج شد و نمونههای جداشده از تمامی موشهای صحرایی بلافاصله جهت تثبیت بافت درون ظرف حاوی محلول فرمالین ۱۰ درصد قرار داده شد و بعد از ۲۴ ساعت جهت آمادهسازی بر روی نمونهها به ترتیب پس از ثبوت تکنیک های شفافسازی، آبگیری، قالبگیری و رنگآمیزی صورت گرفت. در نهایت نمونهها توسط رنگ هماتوکسیلین و ائوزین رنگآمیزی شدند و توسط میکروسکوپ نوری با بزرگنماییهای ۴۰ و ۱۰۰ مورد ارزیابی قرار گرفتند. نتایج این مطالعه پس از جمعآوری آزمایشگاهی میدانی به صورت کیفی و رتبه ای با استفاده از میکروسکوپ نوریOlympus CX 21 مورد آنالیز قرار گرفت.
نتایج
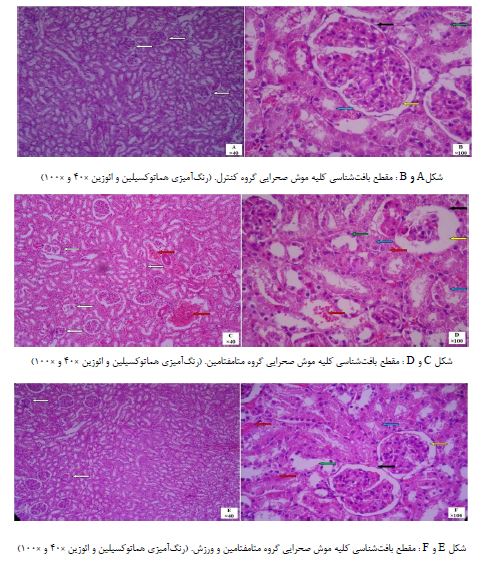
نتایج بافتشناسی بهدست آمده از نمونههای بافت کلیه: گروه کنترل: همان طور که در تصاویر A و B رویت میشود، در مقاطع تهیه شده از گروه کنترل در بافت کلیه تمامی ویژگیهای ساختاری و بافتی قابل رویت در نواحی قشری و مرکزی طبیعی بوده و نظم و انسجام بافتی برقرار است و تغییری در هیچ ناحیه وجود ندارد. در بخش قشری تعداد و اندازه گلومرولها مناسب است و گلومرولها دارای قطر و شکل یکسان همراه با سلولهای طبیعی قابل گزارش میباشند. در اطراف هر گلومرول ساختار محافظی بهنام کپسول بومن دیده میشود که از سلولهای سنگفرشی ساده همراه با هستههای تیره و کشیده و سیتوپلاسم یکنواخت تشکیل شده است. در ناحیه زیر کپسول بومن، فضایی به نام فضای ادراری وجود دارد که ترشحات را دریافت میکند و این فضا در گلومرولها بهصورت یکنواخت و با اندازه مناسب رویت میشود. لولههای مختلف موجود در ناحیه قشری و مرکزی کلیه همگی دارای لومن و دیواره سلولی طبیعی هستند و تغییر خاصی در آنها مشاهده نمیشود. لولههای پیچیده پروگزیمال دارای سلولهای اندک و بزرگی بوده و با هستههای روشن و بزرگ در میانه سلول وجود دارد و سیتوپلاسم پررنگ سلولها مشهود است و فضای لومن کوچک دیده میشود. لولههای پیچیده دیستال نیز دارای سلولهای بیشتر و کوتاه همراه با فضای لومن بزرگ در مقاطع عرضی دیده میشوند. در قسمت مرکزی نیز لولههای جمع کننده ادراری و اجزای مربوط به قوس هنله بهصورت سالم همراه با سلولهای روشن و هستههای گرد و مشخص دیده شده و اثری از تغییرات سلولی و بافتی وجود ندارد(تصاویر A و B).
گروه متامفتامین: همانطور که در تصاویر Cو D مشاهده می شود، در مقاطع تهیه شده از گروه دریافت کننده متامفتامین در بافت کلیه مشخصات گلومرولها نشان دهنده تغییراتی بوده که شامل کوچکشدگی قطر، پرخونی، اندازههای متفاوت و فواصل نامنظم میباشد و همچنین فضای ادراری نیز بزرگ شده و اندازه غیرطبیعی را نشان میدهد. در کپسول بومن سلولهای مزانشیمی با هستههای کوچک و با فواصل نامنظم دیده میشود. لولههای پیچیده پروگزیمال با لومن نامشخص و سلولهای تحلیل رفته همراه است و لولههای پیچیده دیستال نیز سلولهای اندک و کوتاه داشته و هستههای تیره و سیتوپلاسم پررنگ در آنها مشهود است. در برخی نواحی بافتی و بین لولهای و همچنین فضای داخل گلومرولی پرخونی و اتساع عروقی مشاهده میشود(تصاویر C و D).
گروه متامفتامین و ورزش: همانطور که در تصاویر E و F مشاهده می گردد، در مقاطع تهیه شده از گروه دریافت کننده متامفتامین و تمرینات ورزشی در بافت کلیه اندکی تغییرات سلولی و ساختاری وجود دارد بهطوری که در برخی از گلومرولها اندکی کاهش قطر و جمعشدگی دیده میشود و متعاقباً فضای ادراری در این گلومرولها افزایش پیدا کرده است. کپسول بومن دارای سلولهای پهن و کشیده و هستههای طبیعی میباشد. لولههای پیچیده پروگزیمال اندکی تغییر رنگ سیتوپلاسم و هسته را نشان داده و لولههای پیچیده دیستال نیز دارای لومن بزرگ و سیتوپلاسم نامتعارف میباشند. همچنان اندکی پرخونی در فضای داخل گلومرول و فضای بین بافتی مشهود است(تصاویر E و F).
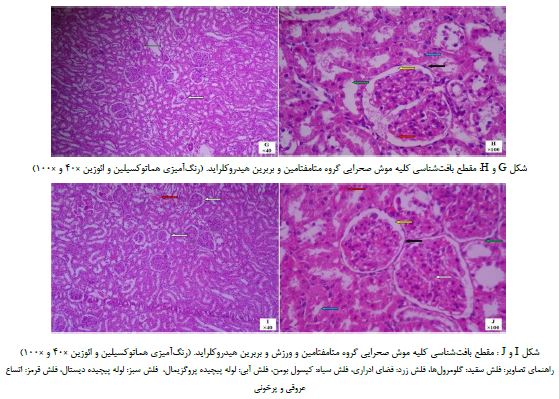
گروه متامفتامین و بربرین هیدروکلراید: همانطور که در تصاویر G و H مشاهده می گردد، در مقاطع تهیه شده از گروه دریافت کننده متامفتامین و بربرین هیدروکلراید در بافت کلیه اندکی تغییرات از جمله کوچک شدگی گلومرولی همراه با فشردگی مویرگی و افزایش فضای ادراری دیده می شود. کپسول بومن دارای سلولهای کشیده با هستههای تیره و سیتوپلاسم منظم میباشد. لولههای پیچیده پروگزیمال و لولههای پیچیده دیستال دارای سلولهای طبیعی با هستههای مشخص بوده و اندکی تغییرات فضای لومن مشاهده میشود. همچنین اندکی پرخونی در برخی نواحی بافتی و داخل گلومرولی گزارش می گردد (تصاویر G و H).
گروه متامفتامین و ورزش و بربرین هیدروکلراید: همانطور که در تصاویر I و J مشاهده میکنید در مقاطع تهیه شده از گروه دریافت کننده متامفتامین و تمرینات ورزشی و بربرین هیدروکلراید در بافت کلیه و ناحیه قشری تعداد و اندازه گلومرولها و فواصل بین آنها طبیعی و بدون تغییر و بینظمی بوده و متعاقب آن فضای ادراری نیز با اندازهای طبیعی و مشخص و یکنواخت قابل مشاهده میباشد. کپسول بومن با سلولهای کشیده و هستههای تیره و منظم دیده میشود. لولههای پیچیده پروگزیمال با مشخصات طبیعی و لولههای پیچیده دیستال دارای اندکی تغییر سلولی و کاهش سیتوپلاسم میباشند. همچنان اندکی اتساع عروقی و تجمع خونی در بافت مشهود است (تصاویر I و J).
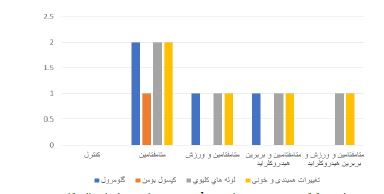
نمودار 1: تفکیک و درجهبندی تغییرات پدید آمده در متغیرهای مورد ارزیابی بافت کلیه
بحث
نتایج پژوهش حال حاضر نشان داد که در گروه دریافت کننده متامفتامین گلومرولها دچار کوچکشدگی قطر، پرخونی و بی نظمی شدند، فضای ادراری بزرگ شده و لوله پیچیده نزدیک و دور سلولهای تحلیل رفته دارند. این تغییرات مشابه تغییراتی است که در نتایج پژوهشی که توسط Azizi و همکاران در سال 2023 با هدف بررسی اثرات نامطلوب متامفتامین بر اندامهای حیاتی موشهای صحرایی نر انجام شد ذکر شده است. در این مطالعه تغییرات هیستوپاتولوژیک متامفتامین روی کلیه بهصورت آتروفی گلومرولی، اتساع فضای ادراری کپسول بومن، دژنراسیون واکوئلار، نکروز توبولار، کست هیالن در لومن توبولها، کاهش سلولهای اپیتلیال و نفریت بینابینی گزارش شد. در مطالعه حال حاضر گرچه در بافت کلیه نفریت مشاهده نشد اما تغییرات ساختاری مشابه همچون آتروفی گلومرولی، نکروز توبولار و کاهش سلولهای اپیتلیالی دیده شد (3). در مقاطع گروه متامفتامین و بربرین هیدروکلراید تغییرات اندکی از جمله کوچکشدگی گلومرولی همراه با فشردگی مویرگ و افزایش فضای ادراری دیده شد. لولههای پیچیده پروگزیمال و دیستال دارای سلولهای طبیعی با هستههای مشخص بوده و تغییرات اندکی در فضای لومن رویت شد، همچنین اندکی پرخونی در برخی نواحی بافتی ثبت گردید. این موارد اثبات کننده کاهش تغییرات بافتی نسبت به گروه دریافتکننده متامفتامین بهتنهایی است. این نتایج بهدست آمده با تحقیق Alavijeh و همکاران در سال 2019 که در مطالعه خود به بررسی تغییرات بافتشناسی مغز پس از تجویز بربرین به موشهای صحرایی معتاد به متامفتامین پرداخته است، مطابقت دارد. بر اساس این پژوهش بربرین با جلوگیری از افزایش واسطههای التهابی اختلالات بافتی را کاهش میدهد. این پژوهش همچنین بیان میکند آپوپتوز بهطور قابلتوجهی در نورونهای هیپوکامپ موشهای صحرایی معتاد به متامفتامین که با بربرین درمان شدند، کاهش یافت. علیرغم تفاوت در بافت هدف در پژوهش ذکر شده و پژوهش ما این دو مطالعه از نظر اثرات حفاطتی بربرین بر بافت و کاهش تغییرات ناشی از متامفتامین با یکدیگر همسو میباشند (16). در باب گروه مصرف کننده متامفتامین همزمان با اعمال ورزش، در مورد چگونگی تاثیر ورزش بر اثرات مخرب متامفتامین طبق مطالعه انجام شده در سال2022 ورزش از طریق معکوس کردن آسیب های مولکولی ناشی از سیستم های دوپامینرژیک و گلوتاماترژیک برای اعتیاد به تمام انواع مواد مخدر مفید است که نتایج مطالعه ما نیز اثبات کننده این موضوع می باشد (17). همچنین براساس نتایج حاصل از مطالعه Park و همکاران در سال 2016 که با هدف ارزیابی تأثیر ورزش بر نوروژنز نابجای ناشی از متامفتامین در موش انجام شد، یک رژیم ورزشی 2 هفتهای به طور قابل ملاحظهای اثرات قرار گرفتن مزمن در معرض متامفتامین که شامل افزایش سطح سیتوکینهای التهابی در پلاسما و هیپوکامپ و ایجاد فرآیندهای التهابی و آسیب بافتی است، را کاهش داد. ورزش سطوح سیتوکینهای التهابی ناشی از متامفتامین را به غلظت در گروه کنترل رساند و متعاقبا باعث کاهش آسیب سلولی شد. اگرچه این پژوهش با تمرکز بر روی بافت عصبی انجام شده است و از این نظر با پژوهش حال حاضر متفاوت است اما از جهت بیان اثرات محافظتی ورزش در برابر فرآیندهای التهابی و آسیب بافتی نتایج آن مطابق نتایج حاصل از گروه مصرف کننده متامفتامین همزمان با اعمال ورزش در پژوهش حال حاضراست که بیان میکند ورزش هوازی میتواند اثرات مخرب متامفتامین بر روی بافت کلیه را کاهش دهد و این مهم با بهبود وضعیت هیستولوژی و مورفولوژی سلولهای گلومرول، توبولار و کپسول بومن و فضای همبند و کاهش اتساع و پرخونی بافت است (18). نتایج حاصل از تجزیه و تحلیل مولکولی در مطالعه Shahrabadi و همکاران در سال 2022 نشان داد که تمرینات وزشی شدید و متناوب می تواند یک روش غیر دارویی برای کاهش آپوپتوز ناشی از متامفتامین باشد. این پژوهش که با هدف بررسی تغییرات نشانگرهای آپوپتوز قلبی در موش های صحرایی وابسته به متامفتامین پس از هشت هفته تمرین تناوبی با شدت بالا انجام شد، نشان داد که بیست و یک روز قرار گرفتن در معرض متامفتامین باعث افزایش نشانگرهای آپوپتوز مانند بیان پروتئین مرتبط با آپوپتوز، انتشار عوامل آپوپتوژنیک میتوکندری و تغییرات در گونههای فعال اکسیژن (ROS) و وضعیت آنتیاکسیدانی در بافت قلب موش شد. کاهش آپوپتوز ناشی از تمرینات ورزشی ممکن است مربوط به سرکوب بیان پروتئین پرو آپوپتوز و افزایش بیان پروتئین ضد آپوپتوز و جلوگیری از آزاد شدن پروتئین های محرک آپوپتوز از میتوکندری باشد. با وجود اینکه پژوهش فوق با تمرکز بر روی آپوپتوز بافت قلب انجام شده است اما در نتایج تأیید کنندهی اثر حفاظتی ورزش در برابر آسیبهای ناشی از متامفتامین مطابق با نتایج پژوهش حال حاضر یعنی کاهش آپوپتوز سلولهای گلومرولی و توبولار و کپسول بومن است (19). در مقاطع تهیه شده از گروه دریافتکننده متامفتامین و تمرینات ورزشی و بربرین هیدروکلراید در بافت کلیه لولههای پیچیده دیستال دارای اندکی تغییر سلولی و کاهش سیتوپلاسم میباشند، همچنین اندکی اتساع عروقی و تجمع خونی در بافت نیز مشهود است. ورزش و بربرین هیدروکلراید هر دو میتوانند اثرات مخرب متامفتامین بر روی بافت کلیه را با بهبود وضعیت هیستولوژی و مورفولوژی سلولهای گلومرول، توبولار و کپسول بومن و فضای همبند و کاهش اتساع و پرخونی بافت کاهش دهند اما وقتی این دو فاکتور یعنی ورزش هوازی و بربرین هیدروکلراید با هم لحاظ گردند اثرات محافظتی ملموستر خواهد بود. این واقعیت که ترکیب بربرین هیدروکلراید و ورزش هوازی منجر به اثرات محافظتی ملموستر نسبت به سایر گروهها شد، نشان می دهد که این دو فاکتور به روش های متفاوت و مکمل هم عمل میکنند. یافته همسو با پژوهش ما در مطالعه Azizi و همکاران در سال 2019 که تغییر شاخصهای آپوپتوتیک در بافت کلیه موشهای دیابتی را پس از شش هفته ورزش و در ترکیب با دوزهای مختلف بربرین مورد بررسی قرار میدهد، وجود دارد. نتایج این مطالعه بیان میکند که ترکیب ورزش با دوزهای بالاتر بربرین باعث کاهش سطح پروتئینهای پرو آپوپتوز میشود و مسیر آپوپتوز با واسطه میتوکندری را در بافت کلیه موشهای دیابتی مهار میکند. این نتایج با نتایج استخراج شدهی پژوهش ما از گروه دریافت کننده متافتامین، ورزش و بربرین از جمله کاهش آپوپتوز و کاهش تغییرات هیستوپاتولوژی و مورفولوژی سلولی در بافت کلیه مطابقت دارد (20).
نتیجهگیری
در پژوهش ما گروه مواجهه یافته با متامفتامین دچار تغییرات هیستوپاتولوژیکی و مورفولوژیکی گردید. بهطوری که گلومرولها دچار کوچک شدگی قطر، پرخونی و بینظمی شدند. همچنین فضای ادراری متسع گردیده و لوله پیچیده پروگزیمال لومن نامشخص و سلولهای تحلیل رفته دارد و لوله پیچیده دیستال نیز سلولهای تحلیل رفته و اندک دارد. در گروه مواجهه یافته با متامفتامین که تحت ورزش هوازی قرار گرفتند، میزان این تغییرات بافتی در تمامی بخشها به نسبت گروه صرفا مواجهه یافته با متامفتامین کاهش یافته بود. در مقاطع بافتی گروه مواجهه یافته با متامفتامین و بربرین هیدروکلراید نیز میزان این تغییرات بافتی در تمامی بخشها به نسبت گروه صرفاً مواجهه یافته با متامفتامین کاهش یافته بود. مقاطع تهیه شده از گروه دریافت کننده متامفتامین، تمرینات ورزشی و بربرین هیدروکلراید کمترین تغییرات بافتی و مورفولوژیکی را به نسبت سه گروه قبلی داشتند و صرفا لوله های پیچیده دیستال دارای اندکی تغییر سلولی بودند و اندکی اتساع عروقی و تجمع خونی در بافت کلیه مشهود بود. با توجه به نتایج فوق میتوان اینگونه استنباط کرد که مواجهه با متامفتامین میتواند باعث تغییرات سلولهای کلیوی گلومرولی و توبولی شود. ورزش و بربرین هیدروکلراید هر دو به تنهایی میتوانند اثرات مخرب متامفتامین بر روی بافت کلیه را کاهش دهند. اما وقتی این دو فاکتور یعنی ورزش هوازی و بربرین هیدروکلراید با هم لحاظ گردند اثرات محافظتی آنها ملموس تر خواهد بود. بدین ترتیب با توجه به مصرف روزافزون متامفتامین در جوامع مختلف و اثرات مخرب آن بر بافت کلیه بهتر است اقدامات مناسبی جهت کنترل اثرات ناشی از سوءمصرف آن اتخاذ گردد.
ملاحظات اخلاقی
در طول اجرای این طرح تمامی حقوق مرتبط با کار با حیوانات آزمایشگاهی بهصورت دقیق و مطابق با چکلیست مربوطه رعایت گردید. همچنین در طول مطالعه کمترین آسیب ممکن و احتمالی متحمل موشهای صحرایی شد. برای استخراج بافت نیز با استفاده از کتامین و زایلازین بیدردی لحاظ گردید. این مطالعه با کد IR.IAU.DAMGHAN.REC.1402.022 در کمیته اخلاق دانشگاه آزاد اسلامی واحد دامغان تصویب شده است.
سپاسگزاری
بدین وسیله از حمایت کمیته تحقیقات دانشجویی دانشگاه آزاد اسلامی واحد شاهرود و سایر بزرگوارانی که ما را در این طرح یاری کردند، تشکر و قدردانی میکنیم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
دکتر بهروز یحیایی و دکتر محمدحسین حسنی در ارائه ایده و انجام تحقیق و نظارت و جمع آوری داده ها و نوشتن مقاله اولیه، دانیال نقی پور و عارف آرمینفر در طراحی ایده، زهرا صحرانشین و لیدا سپانلو و حسام الدین بابایی در تجزیه تحلیل دادهها نقش داشتند. همچنین دکتر بهروز یحیایی، عارف آرمینفر، زهرا صحرانشین و لیدا سپانلو در ویرایش و بازبینی نهایی مقاله سهیم بودند.
متامفتامین که با نامهای متیلآمفتامین و دزوکسی افدرین نیز شناخته میشود، یک محرک روانی قوی و اعتیادآور از مشتقات گروه فنتیلآمین و آمفتامین است (1). امروزه متامفتامین که دومین ماده مخدر غیرقانونی پرمصرف در جهان است، مورد سوء استفاده گستردهای قرار میگیرد، لذا مصرف متامفتامین به علت پیامدهای زیانبار آن از جمله افزایش جرم و جنایت، هزینه درمان، عوارض روانپزشکی و اقتصادی به عنوان یک معضل اجتماعی در ابعاد جهانی شناخته میشود (3، 2). همچنین براساس گزارش ها در مورد افزایش احتمالی مصرف متامفتامین در آبنده، علیرغم افزایش دو برابری مرگ و میر مرتبط با مصرف آن در دهه گذشته (1،4) بررسی این ماده و آسیبهای ناشی از آن بر بافت های بدن ضروری به نظر میرسد (5). اثرات اصلی متامفتامین به دلیل تحریک ترشح کاتکولآمینهایی مانند سروتونین، نوراپینفرین و بهویژه دوپامین از پایانههای عصبی و جلوگیری از جذب مجدد انتقال دهنده های عصبی و ایجاد حالت هیپرآدرنرژیک است (6). بنابراین مواردی مانند برانگیختگی، خلق مثبت و بهبود در حوزه های شناختی مانند توجه، هماهنگی روانی حرکتی، افزایش اعتماد به نفس و بهبود قدرت جنسی که در مصرف دوزهای پایین متامفتامین بروز میکنند، منجر به تمایل بیشتر به ادامه مصرف میشوند، اگرچه در مصرف دوزهای پایین احتمال بروز عوارض جانبی مانند ریسکپذیری و رفتار خشونتآمیز نیز وجود دارد (8،7). مصرف متامفتامین در دوزهای بالاتر و یا بهصورت مکرر میتواند منجر به روان پریشی یا آشکار شدن اختلالات روانپزشکی زمینهای شود (8، 1). همچنین احتمال ایجاد عوارض جانبی سیستمیک مانند هیپرترمی، رابدومیولیز و نارساییهای قلبی-عروقی، گوارشی، کبدی و ادراری تناسلی در سوء مصرف آن وجود دارد (3،8). همانطور که گفته شد متامفتامین میتواند اثرات مضری بر بسیاری از سیستمهای بدن از جمله کلیهها داشته باشد. کلیهها اندامهای دفعی پرعروقی هستند که در خلف صفاق قرار دارند و به حفظ هموستاز، حذف سموم و مواد زائد متابولیک از خون کمک میکنند. مصرف زیاد اکسیژن در کلیهها و جریان خون بالا به آنها باعث میشود بیشتر در معرض غلظت بالای مواد شیمیایی موجود در گردش خون قرار بگیرند (9). همچنین دفع مواد زائد متابولیکی که یکی از وظایف اصلی کلیهها میباشد، از طریق یکی از دو مسیر فیلتراسیون گلومرولی یا ترشح توبولار انجام میشود. در هرکدام از این دو مسیر لولهها و بافت بینابینی اطراف آنها در معرض مواد سمی قرار میگیرند (10). دلیل استفاده از دو فاکتور اثرات ورزش هوازی و بربرین هیدروکلراید در پژوهش حال حاضر، بررسی نتایج حاصل از مطالعاتی است که به چگونگی اثرات مثبت بافتی ورزش هوازی و بربرین هیدروکلراید پرداخته اند که در ذیل به تفصیل ذکر شده اند: ورزش هوازی (Aerobic exercise) فعالیتی است که در آن عضلات بزرگ بدن برای مدت زمان طولانی به صورت ریتمیک حرکت می کنند (11). ورزش هوازی با بهبود عملکرد اسکلتی- عضلانی، سلامت قلبی- تنفسی، متابولیک، خواب، مدیریت درد و موارد دیگر، یک ابزار بالینی اولیه غیردارویی برای پیشگیری از بسیاری از بیماریهایی است که فیزیوپاتولوژی آنها با فعال شدن حاد یا تقویت سیستم ایمنی مرتبط است (12). بهطور کلی ورزش مکرر با شدت متوسط، پاسخ عملکرد ایمنی را افزایش میدهد و ظرفیت آنتیاکسیدانی را تقویت می کند. همچنین استرس اکسیداتیو را کاهش و بازده تولید انرژی را افزایش داده و در نتیجه بروز بیماریهای التهابی را کاهش میدهد (12). بربرین هیدروکلراید (BBR) یک محصول طبیعی آلکالوئید ایزوکینولین، عمدتاً از Coptis chinensis و سایر گیاهان Berberis منشا گرفته است. بربرین دارای فعالیتهای زیستی مختلفی از جمله فعالیتهای آنتیاکسیدانی، ضد التهابی، ضد سرطانی، تنظیم کننده سیستم ایمنی و فعالیتهای ضد میکروبی است (13). علاوه بر این، بربرین از نظر بالینی در درمان اسهال، اختلالات متابولیک، بیماریهای قلبی عروقی، دیابت نوع 2، سندرم تخمدان پلیکیستیک، کلسترول بالا، چربی خون و بیماری کبد چرب غیر الکلی مورد آزمایش قرار گرفته است و بهطور کلی در دوزهای بالینی مورد استفاده، بدون هیچگونه فعالیت سیتوتوکسیک، ژنوتوکسیک یا میوتوژنیک، موثر و ایمن در نظر گرفته میشود (14). باور بر این است که بربرین نقش ضدالتهابی دارد که این مهم عمدتاً متمرکز بر روی ماکروفاژها و تنظیم مسیرهای سیگنالینگ التهابی، شامل مسیر فاکتور هستهای ( κB NF-kB) و کاهش تولید سایتوکاینهای التهابی مانند TNF-α، 6 IL-، β 1IL- و IFN-γ است (15). طبق بررسیهای انجام شده، مطالعاتی که به بررسی اثرات متامفتامین بر بافت کلیه پرداخته باشند محدود بوده است و مطالعه مورفومتریک بافت کلیه پس از مصرف متامفتامین نیازمند مطالعات گستردهتری میباشد، از اینرو ضرورت انجام پژوهشهای این چنینی بیش از پیش احساس میشود. بنابراین برآن شدیم تا در ایـن پژوهش به اثرات داروی متامفتامین همزمان با مصرف بربرین هیدروکلراید و فعالیت ورزشی هوازی بر بافت کلیه موشهای صحرایی بپردازیم.
روش بررسی
این پژوهش از نوع آزمایش تجربی و تصادفی است. معیار ورود به مطالعه محدوده وزنی و سلامت موش و معیار خروج مرگ حیوان بوده است و باتوجه به بررسی مطالعات انجام شده میزان شیوع استفاده از متامفتامین در جنس مونث بیشتر بوده است، از اینرو در این مطالعه از موش های صحرایی ویستار جنس ماده استفاده شده است.
در این مطالعه ابتدا ۴۰ سر موش صحرایی ماده نژاد ویستار با دامنه وزنی ۱۴۰تا ۱۶۰ گرم از انستیتو پاستور، خریداری و به مدت یک هفته در سالن قرنطینه آزمایشگاه فیزیولوژی ورزشی دانشگاه آزاد اسلامی واحد شاهرود جهت تطبیق و عادت و حذف عوامل تاثیرگذار محیطی در قفسهای فلزی مجزا به ابعاد ۳۵×۳۰×۱۵ سانتیمتر نگهداری شدند. موشهای صحرایی در شرایط یکسان تغذیه شدند. برای تغذیه حیوانات از غذای مخصوص موش (از شرکت خوراک دام پارس تهران) استفاده شد و آب لولهکشی شاهرود توسط شیشههای آب خوری در اختیارشان قرار گرفت. موشهای صحرایی در قفسهای مجزا و شرایط مناسب با درجه حرارت ۲۲ درجه سانتیگراد و سیکل نوری ۱۲ ساعت روشنایی و ۱۲ ساعت تاریکی و رطوبت نسبی 6۰-40 درصد نگهداری شدهاند. بهطور کلی شرایط نگهداری برای تمامی موشهای صحرایی در مدت زمان انجام پژوهش یکسان لحاظ شده است. نمونه آماری این تحقیق، به روش نمونهگیری انتخابی هدفدار با توجه به شرایط وزنی و محدوده سنی حدود 2 ماه انجام شد. در ادامه با توجه به وزن، حیوانات بهصورت کاملاً تصادفی در ۵ گروه ۸ تایی کنترل سالم، دریافت متامفتامین، متافتامین همراه با فعالیت هوازی، متامفتامین همراه با بربرین هیدروکلراید، متافتامین همراه با فعالیت هوازی و بربرین هیدروکلراید تقسیمبندی شدند. القاء متامفتامین به صورت درون صفاقی بهمیزان ۱۵ میلیگرم بر کیلوگرم به مدت ۴ روز و هر ۱۲ ساعت به موشهای صحرایی انجام گرفت. بربرین هیدروکلراید نیز به میزان ۱۰۰ میلیگرم بر کیلوگرم بهصورت درون صفاقی به مدت ۴ هفته و هر روزه به گروههای دریافت کننده تزریق شد. پروتکل تمرین هوازی که بهصورت تمرین روی تردمیل مخصوص جوندگان انجام شد، شامل یک برنامه دویدن ۸ هفتهای با شدت فزاینده بوده که کل زمان اجرای تمرین از ۱۵ دقیقه به ۵۰ دقیقه افزایش یافته است. در تمرین مذکور حداکثر سرعت روزانه از ۱۲ سانتیمتر بر ثانیه به ۵۴ سانتیمتر بر ثانیه افزایش و در هفته چهارم شیب ۵ درصد در نظر گرفته شده است. در ادامه ۲۴ ساعت پس از پایان دوره و دریافت بربرین هیدروکلراید، بر اساس دستورالعمل های کمیته اخلاق، حیوانات آزمایشگاهی با دریافت داروی کتامین به میزان mg/kg70 و زایلازین mg/kg10، به منظور ایجاد بیهوشی و بیدردی بهصورت درون صفاقی، بیهوش شدند. بافت مورد مطالعه، که کلیه بود، استخراج شد و نمونههای جداشده از تمامی موشهای صحرایی بلافاصله جهت تثبیت بافت درون ظرف حاوی محلول فرمالین ۱۰ درصد قرار داده شد و بعد از ۲۴ ساعت جهت آمادهسازی بر روی نمونهها به ترتیب پس از ثبوت تکنیک های شفافسازی، آبگیری، قالبگیری و رنگآمیزی صورت گرفت. در نهایت نمونهها توسط رنگ هماتوکسیلین و ائوزین رنگآمیزی شدند و توسط میکروسکوپ نوری با بزرگنماییهای ۴۰ و ۱۰۰ مورد ارزیابی قرار گرفتند. نتایج این مطالعه پس از جمعآوری آزمایشگاهی میدانی به صورت کیفی و رتبه ای با استفاده از میکروسکوپ نوریOlympus CX 21 مورد آنالیز قرار گرفت.
نتایج
نتایج بافتشناسی بهدست آمده از نمونههای بافت کلیه: گروه کنترل: همان طور که در تصاویر A و B رویت میشود، در مقاطع تهیه شده از گروه کنترل در بافت کلیه تمامی ویژگیهای ساختاری و بافتی قابل رویت در نواحی قشری و مرکزی طبیعی بوده و نظم و انسجام بافتی برقرار است و تغییری در هیچ ناحیه وجود ندارد. در بخش قشری تعداد و اندازه گلومرولها مناسب است و گلومرولها دارای قطر و شکل یکسان همراه با سلولهای طبیعی قابل گزارش میباشند. در اطراف هر گلومرول ساختار محافظی بهنام کپسول بومن دیده میشود که از سلولهای سنگفرشی ساده همراه با هستههای تیره و کشیده و سیتوپلاسم یکنواخت تشکیل شده است. در ناحیه زیر کپسول بومن، فضایی به نام فضای ادراری وجود دارد که ترشحات را دریافت میکند و این فضا در گلومرولها بهصورت یکنواخت و با اندازه مناسب رویت میشود. لولههای مختلف موجود در ناحیه قشری و مرکزی کلیه همگی دارای لومن و دیواره سلولی طبیعی هستند و تغییر خاصی در آنها مشاهده نمیشود. لولههای پیچیده پروگزیمال دارای سلولهای اندک و بزرگی بوده و با هستههای روشن و بزرگ در میانه سلول وجود دارد و سیتوپلاسم پررنگ سلولها مشهود است و فضای لومن کوچک دیده میشود. لولههای پیچیده دیستال نیز دارای سلولهای بیشتر و کوتاه همراه با فضای لومن بزرگ در مقاطع عرضی دیده میشوند. در قسمت مرکزی نیز لولههای جمع کننده ادراری و اجزای مربوط به قوس هنله بهصورت سالم همراه با سلولهای روشن و هستههای گرد و مشخص دیده شده و اثری از تغییرات سلولی و بافتی وجود ندارد(تصاویر A و B).
گروه متامفتامین: همانطور که در تصاویر Cو D مشاهده می شود، در مقاطع تهیه شده از گروه دریافت کننده متامفتامین در بافت کلیه مشخصات گلومرولها نشان دهنده تغییراتی بوده که شامل کوچکشدگی قطر، پرخونی، اندازههای متفاوت و فواصل نامنظم میباشد و همچنین فضای ادراری نیز بزرگ شده و اندازه غیرطبیعی را نشان میدهد. در کپسول بومن سلولهای مزانشیمی با هستههای کوچک و با فواصل نامنظم دیده میشود. لولههای پیچیده پروگزیمال با لومن نامشخص و سلولهای تحلیل رفته همراه است و لولههای پیچیده دیستال نیز سلولهای اندک و کوتاه داشته و هستههای تیره و سیتوپلاسم پررنگ در آنها مشهود است. در برخی نواحی بافتی و بین لولهای و همچنین فضای داخل گلومرولی پرخونی و اتساع عروقی مشاهده میشود(تصاویر C و D).
گروه متامفتامین و ورزش: همانطور که در تصاویر E و F مشاهده می گردد، در مقاطع تهیه شده از گروه دریافت کننده متامفتامین و تمرینات ورزشی در بافت کلیه اندکی تغییرات سلولی و ساختاری وجود دارد بهطوری که در برخی از گلومرولها اندکی کاهش قطر و جمعشدگی دیده میشود و متعاقباً فضای ادراری در این گلومرولها افزایش پیدا کرده است. کپسول بومن دارای سلولهای پهن و کشیده و هستههای طبیعی میباشد. لولههای پیچیده پروگزیمال اندکی تغییر رنگ سیتوپلاسم و هسته را نشان داده و لولههای پیچیده دیستال نیز دارای لومن بزرگ و سیتوپلاسم نامتعارف میباشند. همچنان اندکی پرخونی در فضای داخل گلومرول و فضای بین بافتی مشهود است(تصاویر E و F).
گروه متامفتامین و بربرین هیدروکلراید: همانطور که در تصاویر G و H مشاهده می گردد، در مقاطع تهیه شده از گروه دریافت کننده متامفتامین و بربرین هیدروکلراید در بافت کلیه اندکی تغییرات از جمله کوچک شدگی گلومرولی همراه با فشردگی مویرگی و افزایش فضای ادراری دیده می شود. کپسول بومن دارای سلولهای کشیده با هستههای تیره و سیتوپلاسم منظم میباشد. لولههای پیچیده پروگزیمال و لولههای پیچیده دیستال دارای سلولهای طبیعی با هستههای مشخص بوده و اندکی تغییرات فضای لومن مشاهده میشود. همچنین اندکی پرخونی در برخی نواحی بافتی و داخل گلومرولی گزارش می گردد (تصاویر G و H).
گروه متامفتامین و ورزش و بربرین هیدروکلراید: همانطور که در تصاویر I و J مشاهده میکنید در مقاطع تهیه شده از گروه دریافت کننده متامفتامین و تمرینات ورزشی و بربرین هیدروکلراید در بافت کلیه و ناحیه قشری تعداد و اندازه گلومرولها و فواصل بین آنها طبیعی و بدون تغییر و بینظمی بوده و متعاقب آن فضای ادراری نیز با اندازهای طبیعی و مشخص و یکنواخت قابل مشاهده میباشد. کپسول بومن با سلولهای کشیده و هستههای تیره و منظم دیده میشود. لولههای پیچیده پروگزیمال با مشخصات طبیعی و لولههای پیچیده دیستال دارای اندکی تغییر سلولی و کاهش سیتوپلاسم میباشند. همچنان اندکی اتساع عروقی و تجمع خونی در بافت مشهود است (تصاویر I و J).



نمودار 1: تفکیک و درجهبندی تغییرات پدید آمده در متغیرهای مورد ارزیابی بافت کلیه
بحث
نتایج پژوهش حال حاضر نشان داد که در گروه دریافت کننده متامفتامین گلومرولها دچار کوچکشدگی قطر، پرخونی و بی نظمی شدند، فضای ادراری بزرگ شده و لوله پیچیده نزدیک و دور سلولهای تحلیل رفته دارند. این تغییرات مشابه تغییراتی است که در نتایج پژوهشی که توسط Azizi و همکاران در سال 2023 با هدف بررسی اثرات نامطلوب متامفتامین بر اندامهای حیاتی موشهای صحرایی نر انجام شد ذکر شده است. در این مطالعه تغییرات هیستوپاتولوژیک متامفتامین روی کلیه بهصورت آتروفی گلومرولی، اتساع فضای ادراری کپسول بومن، دژنراسیون واکوئلار، نکروز توبولار، کست هیالن در لومن توبولها، کاهش سلولهای اپیتلیال و نفریت بینابینی گزارش شد. در مطالعه حال حاضر گرچه در بافت کلیه نفریت مشاهده نشد اما تغییرات ساختاری مشابه همچون آتروفی گلومرولی، نکروز توبولار و کاهش سلولهای اپیتلیالی دیده شد (3). در مقاطع گروه متامفتامین و بربرین هیدروکلراید تغییرات اندکی از جمله کوچکشدگی گلومرولی همراه با فشردگی مویرگ و افزایش فضای ادراری دیده شد. لولههای پیچیده پروگزیمال و دیستال دارای سلولهای طبیعی با هستههای مشخص بوده و تغییرات اندکی در فضای لومن رویت شد، همچنین اندکی پرخونی در برخی نواحی بافتی ثبت گردید. این موارد اثبات کننده کاهش تغییرات بافتی نسبت به گروه دریافتکننده متامفتامین بهتنهایی است. این نتایج بهدست آمده با تحقیق Alavijeh و همکاران در سال 2019 که در مطالعه خود به بررسی تغییرات بافتشناسی مغز پس از تجویز بربرین به موشهای صحرایی معتاد به متامفتامین پرداخته است، مطابقت دارد. بر اساس این پژوهش بربرین با جلوگیری از افزایش واسطههای التهابی اختلالات بافتی را کاهش میدهد. این پژوهش همچنین بیان میکند آپوپتوز بهطور قابلتوجهی در نورونهای هیپوکامپ موشهای صحرایی معتاد به متامفتامین که با بربرین درمان شدند، کاهش یافت. علیرغم تفاوت در بافت هدف در پژوهش ذکر شده و پژوهش ما این دو مطالعه از نظر اثرات حفاطتی بربرین بر بافت و کاهش تغییرات ناشی از متامفتامین با یکدیگر همسو میباشند (16). در باب گروه مصرف کننده متامفتامین همزمان با اعمال ورزش، در مورد چگونگی تاثیر ورزش بر اثرات مخرب متامفتامین طبق مطالعه انجام شده در سال2022 ورزش از طریق معکوس کردن آسیب های مولکولی ناشی از سیستم های دوپامینرژیک و گلوتاماترژیک برای اعتیاد به تمام انواع مواد مخدر مفید است که نتایج مطالعه ما نیز اثبات کننده این موضوع می باشد (17). همچنین براساس نتایج حاصل از مطالعه Park و همکاران در سال 2016 که با هدف ارزیابی تأثیر ورزش بر نوروژنز نابجای ناشی از متامفتامین در موش انجام شد، یک رژیم ورزشی 2 هفتهای به طور قابل ملاحظهای اثرات قرار گرفتن مزمن در معرض متامفتامین که شامل افزایش سطح سیتوکینهای التهابی در پلاسما و هیپوکامپ و ایجاد فرآیندهای التهابی و آسیب بافتی است، را کاهش داد. ورزش سطوح سیتوکینهای التهابی ناشی از متامفتامین را به غلظت در گروه کنترل رساند و متعاقبا باعث کاهش آسیب سلولی شد. اگرچه این پژوهش با تمرکز بر روی بافت عصبی انجام شده است و از این نظر با پژوهش حال حاضر متفاوت است اما از جهت بیان اثرات محافظتی ورزش در برابر فرآیندهای التهابی و آسیب بافتی نتایج آن مطابق نتایج حاصل از گروه مصرف کننده متامفتامین همزمان با اعمال ورزش در پژوهش حال حاضراست که بیان میکند ورزش هوازی میتواند اثرات مخرب متامفتامین بر روی بافت کلیه را کاهش دهد و این مهم با بهبود وضعیت هیستولوژی و مورفولوژی سلولهای گلومرول، توبولار و کپسول بومن و فضای همبند و کاهش اتساع و پرخونی بافت است (18). نتایج حاصل از تجزیه و تحلیل مولکولی در مطالعه Shahrabadi و همکاران در سال 2022 نشان داد که تمرینات وزشی شدید و متناوب می تواند یک روش غیر دارویی برای کاهش آپوپتوز ناشی از متامفتامین باشد. این پژوهش که با هدف بررسی تغییرات نشانگرهای آپوپتوز قلبی در موش های صحرایی وابسته به متامفتامین پس از هشت هفته تمرین تناوبی با شدت بالا انجام شد، نشان داد که بیست و یک روز قرار گرفتن در معرض متامفتامین باعث افزایش نشانگرهای آپوپتوز مانند بیان پروتئین مرتبط با آپوپتوز، انتشار عوامل آپوپتوژنیک میتوکندری و تغییرات در گونههای فعال اکسیژن (ROS) و وضعیت آنتیاکسیدانی در بافت قلب موش شد. کاهش آپوپتوز ناشی از تمرینات ورزشی ممکن است مربوط به سرکوب بیان پروتئین پرو آپوپتوز و افزایش بیان پروتئین ضد آپوپتوز و جلوگیری از آزاد شدن پروتئین های محرک آپوپتوز از میتوکندری باشد. با وجود اینکه پژوهش فوق با تمرکز بر روی آپوپتوز بافت قلب انجام شده است اما در نتایج تأیید کنندهی اثر حفاظتی ورزش در برابر آسیبهای ناشی از متامفتامین مطابق با نتایج پژوهش حال حاضر یعنی کاهش آپوپتوز سلولهای گلومرولی و توبولار و کپسول بومن است (19). در مقاطع تهیه شده از گروه دریافتکننده متامفتامین و تمرینات ورزشی و بربرین هیدروکلراید در بافت کلیه لولههای پیچیده دیستال دارای اندکی تغییر سلولی و کاهش سیتوپلاسم میباشند، همچنین اندکی اتساع عروقی و تجمع خونی در بافت نیز مشهود است. ورزش و بربرین هیدروکلراید هر دو میتوانند اثرات مخرب متامفتامین بر روی بافت کلیه را با بهبود وضعیت هیستولوژی و مورفولوژی سلولهای گلومرول، توبولار و کپسول بومن و فضای همبند و کاهش اتساع و پرخونی بافت کاهش دهند اما وقتی این دو فاکتور یعنی ورزش هوازی و بربرین هیدروکلراید با هم لحاظ گردند اثرات محافظتی ملموستر خواهد بود. این واقعیت که ترکیب بربرین هیدروکلراید و ورزش هوازی منجر به اثرات محافظتی ملموستر نسبت به سایر گروهها شد، نشان می دهد که این دو فاکتور به روش های متفاوت و مکمل هم عمل میکنند. یافته همسو با پژوهش ما در مطالعه Azizi و همکاران در سال 2019 که تغییر شاخصهای آپوپتوتیک در بافت کلیه موشهای دیابتی را پس از شش هفته ورزش و در ترکیب با دوزهای مختلف بربرین مورد بررسی قرار میدهد، وجود دارد. نتایج این مطالعه بیان میکند که ترکیب ورزش با دوزهای بالاتر بربرین باعث کاهش سطح پروتئینهای پرو آپوپتوز میشود و مسیر آپوپتوز با واسطه میتوکندری را در بافت کلیه موشهای دیابتی مهار میکند. این نتایج با نتایج استخراج شدهی پژوهش ما از گروه دریافت کننده متافتامین، ورزش و بربرین از جمله کاهش آپوپتوز و کاهش تغییرات هیستوپاتولوژی و مورفولوژی سلولی در بافت کلیه مطابقت دارد (20).
نتیجهگیری
در پژوهش ما گروه مواجهه یافته با متامفتامین دچار تغییرات هیستوپاتولوژیکی و مورفولوژیکی گردید. بهطوری که گلومرولها دچار کوچک شدگی قطر، پرخونی و بینظمی شدند. همچنین فضای ادراری متسع گردیده و لوله پیچیده پروگزیمال لومن نامشخص و سلولهای تحلیل رفته دارد و لوله پیچیده دیستال نیز سلولهای تحلیل رفته و اندک دارد. در گروه مواجهه یافته با متامفتامین که تحت ورزش هوازی قرار گرفتند، میزان این تغییرات بافتی در تمامی بخشها به نسبت گروه صرفا مواجهه یافته با متامفتامین کاهش یافته بود. در مقاطع بافتی گروه مواجهه یافته با متامفتامین و بربرین هیدروکلراید نیز میزان این تغییرات بافتی در تمامی بخشها به نسبت گروه صرفاً مواجهه یافته با متامفتامین کاهش یافته بود. مقاطع تهیه شده از گروه دریافت کننده متامفتامین، تمرینات ورزشی و بربرین هیدروکلراید کمترین تغییرات بافتی و مورفولوژیکی را به نسبت سه گروه قبلی داشتند و صرفا لوله های پیچیده دیستال دارای اندکی تغییر سلولی بودند و اندکی اتساع عروقی و تجمع خونی در بافت کلیه مشهود بود. با توجه به نتایج فوق میتوان اینگونه استنباط کرد که مواجهه با متامفتامین میتواند باعث تغییرات سلولهای کلیوی گلومرولی و توبولی شود. ورزش و بربرین هیدروکلراید هر دو به تنهایی میتوانند اثرات مخرب متامفتامین بر روی بافت کلیه را کاهش دهند. اما وقتی این دو فاکتور یعنی ورزش هوازی و بربرین هیدروکلراید با هم لحاظ گردند اثرات محافظتی آنها ملموس تر خواهد بود. بدین ترتیب با توجه به مصرف روزافزون متامفتامین در جوامع مختلف و اثرات مخرب آن بر بافت کلیه بهتر است اقدامات مناسبی جهت کنترل اثرات ناشی از سوءمصرف آن اتخاذ گردد.
ملاحظات اخلاقی
در طول اجرای این طرح تمامی حقوق مرتبط با کار با حیوانات آزمایشگاهی بهصورت دقیق و مطابق با چکلیست مربوطه رعایت گردید. همچنین در طول مطالعه کمترین آسیب ممکن و احتمالی متحمل موشهای صحرایی شد. برای استخراج بافت نیز با استفاده از کتامین و زایلازین بیدردی لحاظ گردید. این مطالعه با کد IR.IAU.DAMGHAN.REC.1402.022 در کمیته اخلاق دانشگاه آزاد اسلامی واحد دامغان تصویب شده است.
سپاسگزاری
بدین وسیله از حمایت کمیته تحقیقات دانشجویی دانشگاه آزاد اسلامی واحد شاهرود و سایر بزرگوارانی که ما را در این طرح یاری کردند، تشکر و قدردانی میکنیم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
مشارکت نویسندگان
دکتر بهروز یحیایی و دکتر محمدحسین حسنی در ارائه ایده و انجام تحقیق و نظارت و جمع آوری داده ها و نوشتن مقاله اولیه، دانیال نقی پور و عارف آرمینفر در طراحی ایده، زهرا صحرانشین و لیدا سپانلو و حسام الدین بابایی در تجزیه تحلیل دادهها نقش داشتند. همچنین دکتر بهروز یحیایی، عارف آرمینفر، زهرا صحرانشین و لیدا سپانلو در ویرایش و بازبینی نهایی مقاله سهیم بودند.
References:
1- Courtney KE, Ray LA. Methamphetamine: An Update on Epidemiology, Pharmacology, Clinical Phenomenology, and Treatment Literature. Drug Alcohol Depend 2014; 143: 11-21.
2- Stoneberg D, Shukla R, Magness M. Global Methamphetamine Trends: An Evolving Problem. International Criminal Justice Review 2017; 28(2): 105756771773010.
3- Azizi S, Kheirandish R, Dabiri S, Lakzaee M. Adverse Effects of Methamphetamine on Vital Organs of Male Rats: Histopathological and Immunohistochemical Investigations. Iran J Basic Med Sci 2023; 26(5): 549-57.
4- Yoosefi Lebni J, Ziapour A, Qorbani M, Baygi F, Mirzaei A, Safari O, et al. The Consequences of Regular Methamphetamine Use in Tehran: Qualitative Content Analysis. Subst Abuse Treat Prev Policy 2020; 15(1): 33.
5- Han B, Compton WM, Jones CM, Einstein EB, Volkow ND. Methamphetamine Use, Methamphetamine Use Disorder, and Associated Overdose Deaths among US Adults. JAMA Psychiatry 2021; 78(12): 1329-42.
6- Mokhtari T, Sheikhazadi A, Hassanzadeh G, Safari M, Sheikhbahaei F, Faghir-Ghanesefat H, et al. Potential Adverse Effects of Amphetamines on Kidney; A Narrative Review on Current Knowledge. J Renal INJ Prev 2018; 7(4): 218-23.
7- Lewis D, Kenneally M, van denHeuvel C, Byard RW. Methamphetamine Deaths: Changing Trends and Diagnostic Issues. Med Sci Law 2021; 61(2): 130-7.
8- Cruickshank CC, Dyer KR. A Review of the Clinical Pharmacology of Methamphetamine. Addiction 2009; 104(7): 1085-99.
9- Radi ZA. Kidney Pathophysiology, Toxicology, and Drug-Induced Injury in Drug Development. Int J Toxicol 2019; 38(3): 215-27.
10- Kwiatkowska E, Domański L, Dziedziejko V, Kajdy A, Stefańska K, Kwiatkowski S. The Mechanism of Drug Nephrotoxicity and the Methods for Preventing Kidney Damage. Int J Mol Sci 2021; 22(11): 6109.
11- Bull FC, Al-Ansari SS, Biddle S, Borodulin K, Buman MP, Cardon G, et al. World Health Organization 2020 Guidelines on Physical Activity and Sedentary Behaviour. Br J Sports Med 2020; 54(24): 1451-62.
12- Scheffer DDL, Latini A. Exercise-Induced Immune System Response: Anti-Inflammatory Status on Peripheral and Central Organs. Biochim Biophys Acta Mol Basis Dis 2020; 1866(10): 165823.
13- Tian E, Sharma G, Dai C. Neuroprotective Properties of Berberine: Molecular Mechanisms and Clinical Implications. Antioxidants (Basel) 2023; 12(10): 1883.
14- Fan D, Liu L, Wu Z, Cao M. Combating Neurodegenerative Diseases with the Plant Alkaloid Berberine: Molecular Mechanisms and Therapeutic Potential. Curr Neuropharmacol 2019; 17(6): 563-79.
15- Zhang S, Xu P, Zhu Z, Zhou L, Li J, Zhou R, et al. Acetylation of P65(Lys310) by P300 in Macrophages Mediates Anti-Inflammatory Property of Berberine. Redox Biol 2023; 62: 102704.
16- Alavijeh MM, Vaezi G, Khaksari M, Hojati V. Berberine Hydrochloride Attenuates Voluntary Methamphetamine Consumption and Anxiety-Like Behaviors Via Modulation of Oxytocin Receptors In Methamphetamine Addicted Rats. Physiol Behav 2019; 206: 157-65.
17- Abdullah M, Huang LC, Lin SH, Yang YK. Dopaminergic and Glutamatergic Biomarkers Disruption in Addiction and Regulation by Exercise: A Mini Review. Biomarkers 2022; 27(4): 306-18.
18- Park M, Levine H, Toborek M. Exercise Protects Against Methamphetamine-Induced Aberrant Neurogenesis. Sci Rep 2016; 6: 34111.
19- Shahrabadi H, Haghighi AH, Askari R, Asadi-Shekaari M, Souza DC, Gentil P. Effect of High-Intensity Interval Training on Cardiac Apoptosis Markers in Methamphetamine-Dependent Rats. Curr Issues Mol Biol 2022; 44(7): 3030-8.
20- Azizi S, Saghebjoo M, Mohiti-Ardakani J. Reducing Effects of Aerobic Exercise Training Combined with Berberine Chloride Supplementation on the Apoptotic Markers of Kidney in Streptozotocin-Induced Diabetic Male Rats. Middle East Journal of Rehabilitation and Health Studies 2019; 6(4): e96483.
نوع مطالعه: پژوهشي |
موضوع مقاله:
علوم تشریح
دریافت: 1403/4/5 | پذیرش: 1403/7/29 | انتشار: 1403/10/15
دریافت: 1403/4/5 | پذیرش: 1403/7/29 | انتشار: 1403/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




