دوره 32، شماره 5 - ( مرداد 1403 )
جلد 32 شماره 5 صفحات 7860-7847 |
برگشت به فهرست نسخه ها
Ethics code: IR.US.REC.1401.025
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghani Dehkordi S, Shabkhiz F, Soori R, Amirshaghaghi F. Effect of Resistance Training with Coenzyme Q10 Supplementation on the Intracellular Content of NRF2 and NQO1 Proteins in the Hippocampal Tissue of Male Sprague-Dawley Rats. JSSU 2024; 32 (5) :7847-7860
URL: http://jssu.ssu.ac.ir/article-1-6192-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6192-fa.html
قانی دهکردی شکیبا، شب خیز فاطمه، سوری رحمان، امیرشقاقی فرحناز. تأثیر تمرین مقاومتی همراه با مکملیاری کوآنزیم Q10 بر محتوای درون سلولی پروتئینهای NRF2 و NQO1در بافت هیپوکمپ موشهای صحرایی نر نژاد اسپراگداولی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (5) :7847-7860
متن کامل [PDF 985 kb]
(464 دریافت)
| چکیده (HTML) (1321 مشاهده)
متن کامل: (742 مشاهده)
مقدمه
بدن انسان در شرایط نرمال میتواند هموستاز را در شرایط تعادل نگه دارد و باعث ثبات بین اکسیدانها و آنتیاکسیدانها در محیط داخل سلولی شود (1). بیشتر مکانیسمهای بدن به اکسیژن نیازمند است و هنگامی که کنترل نشود منجر به بینظمی و اختلال در تعادلهای سلولی میشود، که میتواند عواملی مانند گونههای فعال اکسیژن (ROS) reactive oxygen species و گونههای فعال نیتروژن (RNS) reactive nitrogen species را درون سلول افزایش دهد (2). تولید بیش از حد این گونههای اکسیژنی/نیتروژنی میتواند به ساختارهای سلولی مانند میتوکندریها، لیپیدها، پروتئین¬ها و DNA آسیب برساند. همچنین میتواند در تعادل مسیرهای سلولیملکولی مهمی مانند اتوفاژی، آپوپتوز، بیان ژن سلول و حفظ هموستاز اختلال ایجاد کند (3).
یکی از این عوامل بسیار مهم عامل رونویسی یعنی فاکتور 2 مربوط به فاکتور هستهای اریتروئید 2 (NRF2) Nuclear factor erythroid 2-related factor 2 است؛ این عامل مهم متعلق به خانواده پروتئینی زیپلوسین است، که توسط ژن NFE2L2 در انسان کُدگذاری میشود (4). نشانداده شده است موشهایی که کمبود NRF2 دارند مستعد تشکیل تومور هستند؛ بنابراین مشخص میشود که NRF2 دارای یک نقش حفاظتی در بدن است. NRF2را میتوان به عنوان یک تنظیمکُننده اصلی در پاسخ به استرس اُکسیداتیو در نظر گرفت (5). این عامل رونویسی در بافتهایی مانند کلیه، عضلات، ریه، قلب، کبد و از همه مهمتر در مغز بیشتر است (6). فاکتور NRF2 با بیان بیش از 200 ژن محافظتی باعث سَمزدایی سلولی و دفاع آنتیاکسیدانی میگردد. همچنین NRF2، نخستین تنظیمکُننده رونویسی در اغلب آنتیاکسیدانها مانند سوپراکسیددیسموتاز-1 (SOD1) Super oxicide desmotase 1، NAD(P)H و کوینناکسیدوردوکتاز-1 (NQO1) NAD(P)H dehydrogenase quinone 1، است (7). در این بین NRF2 با آنزیم NQO1 ارتباط نزدیکی دارد. فاکتور NQO1 یک فلاوآنزیم است، که اهمیت بسیاری در محافظت سلولهای بدن از فرایند اُکسیداسیون احیای ناشی از کوئینن¬ها دارد. فاکتور NQO1 یک آنزیم سیتوزولی است که تنظیم آن توسط مسیر Keep1-NRF2-ARE انجام می¬شود؛ این ژن رُدوکتاز دو الکترونی، کوئینون فعال را به هیدروکوئینون تبدیل میکند. عملکرد کلیدی این آنزیم که در فاز دوم مسیر آنتیاکسیدانی قرار دارد، کاهش تشکیل ROS و سمیت کوئینون است (8). مطالعات انجام شده حکایت از آن دارد که افزایش یا کاهش این آنزیم با افزایش و کاهش حساسیت به استرس اُکسیداتیو مرتبط است (9).
مکملهای آنتیاکسیدانی به عنوان عاملی در خنثیسازی آسیبهای سلولیمولکولی ناشی از تمرینهای ورزشی و برخی از بیماریها استفاده میشود. یکی از مکملهای رایج در این رابطه مکمل کوآنزیم Q10 است. کوآنزیم Q10 یک آنتیاکسیدان محلول در چربی است که بهطور طبیعی در بدن انسان تولید و موجب افزایش متابولیسم سلول میشود. کوآنزیم Q10 انرژی سلول را تامین میکند و سلول را زنده و شاداب نگه میدارد. در واقع کوآنزیم Q10 یکی از مَلزومات اساسی سلولهای بدن برای زندهماندن میباشد (10). کوآنزیمQ10 معمولترین شکل یوبیکینون در بدن است، که به عنوان یک کوفاکتور اگزوژنز آنزیمی در تمام سلولهای زنده تولید میشود و به عنوان یک کاتالیزور در جابجایی پروتونالکترون در میتوکندری و لیزوزومها نقش ایفا میکند و از میتوکندری در مقابل آسیب رادیکالهای آزاد حفاظت میکند. کوآنزیم Q10 بهطور عمده توسط لیپوپروتئینها در خون حمل میشود و میتواند نقش آنتی اکسیدانی داشته باشد (11).
از میان مناطق مختلف مغزی، هیپوکمپ یکی از حساسترین نواحی است که دستخوش تغییرات نوروفیزیولوژیکی، ساختاری و مولکولی خواهد شد (12). هیپوکمپ بخش قدرتمندی از مغز در انسانها محسوب میشود. هیپوکمپ نقش اساسی در تقویت اطلاعات بین حافظه کوتاهمدت و حافظه بلندمدت دارد (13). با توجه به توانایی آن در کاهش اثرات استرس اکسیداتیو، بسیاری از گروههای تحقیقاتی نشان دادند که تجویز کوآنزیمQ10 میتواند اثرات بیماریهای عصبی مانند آلزایمر، پارکینسون، هانتینگتون، اسکلروز جانبی آمیوتروفیک و آتاکسی فریدریچ را درمان کند (11،14). مشخص شده است که تمرینهای ورزشی میتواند جنبههای فیزیولوژیکی گوناگونی از فعالیتهای سلول عصبی را فعال کند و ممکن است از بسیاری از عوارض مغزی مانند مرگ سلولهای عصبی جلوگیری کنند (15). نشان داده شده است که تمرینهای ورزشی موجب تقویت عملکردهای اِدراکی و شناختی، افزایش حافظه و یادگیری و همچنین کاهش اِختلالات شناختی ناشی از آسیبهای مغزی میگردد (12). شواهد نشان میدهد که تمرینهای ورزشی مُنظم باعث افزایش فعالیت آنزیمهای آنتیاکسیدانی، افزایش مقاومت در برابر استرس اُکسیداتیو و در نتیجه کاهش آسیبهای استرس اکسیداتیو میشود (16). تمرینها و فعالیتهای ورزشی همچنین میتواند باعث تنظیم افزایشی تولید عوامل مهم سلولیملکولی در هیپوکمپ موشهای صحرایی شود. این عوامل میتوانند در بقای سلولهای عصبی، تمایز، اِتصال و شکلپذیری سیناپسی درگیر باشند (14). به نظر میرسد که تمرینهای ورزشی مقاومتی در یک دوره طولانی میتواند از طریق افزایش آنتیاکسیدانها و فعالشدن مسیرهای دفاع آنتیاکسیدانی NRF2/NQO1 در جلوگیری از استرس اکسیداتیو سلولی در هنگام فعالیتهای ورزشی حاد دخیل باشد. در تحقیقی رفعتی و همکاران در سال 2021 به بررسی تاثیر تمرین تناوبی باشدت بالا همراه با مصرف مکمل کوآنزیم Q10 برمحتوای پروتئین NRF2 پرداختند. تمرین ورزشی منجر به افزایش محتوای پروتئین NRF2 شده بود؛ اما مکمل کوآنزیم Q10 تغییر معنیداری را ایجاد نکرد (17). در تحقیقی دیگر آوندی و همکاران در سال 2018 به بررسی تأثیر هشت هفته تمرین مقاومتی بر سطوح پلاسمایی NRF2 در مردان جوان پرداختند. نتایج نشان داد که هشت هفته تمرین مقاومتی منجر به افزایش سطوح پلاسمایی NRF2 میشود. این محققان اعلام کردند به نظر میرسد که افزایش سطوح NRF2 در اثر تمرین مقاومتی، منجر به سرکوبشدن رادیکالهای آزاد و افزایش ظرفیت ضداکسایشی بدن میشود (18). فعالیتهای ورزشی یک وسیله مطمئن برای مقابله با وضعیت¬های مزمن التهابزا است؛ اما سازوکارهای آن بهطور دقیق مشخص نیست بهخصوص هنگامی که تمرکز بر مسیر پیامرسانی NRF2 باشد. هماکنون اِجماع نظر کاملی در مورد تنظیم NRF2 و NQO1 و همچنین مصرف مکمل کوآنزیم Q10 ناشی از فعالیت ورزشی بهویژه تمرین مقاومتی بین محققان وجود ندارد و این به دلیل تحقیقات کمی است که در مورد اثر فعالیت ورزشی و بهویژه تمرین مقاومتی و مکمل کوآنزیم Q10 بر شاخص¬های آنتیاکسیدانی است. تحقیق حاضر به بررسی نحوه تأثیر تمرین مقاومتی و مکمل کوآنزیم Q10 بر مسیر آنتیاکسیدانی انجام میشود تا سازوکارهای دقیق تاثیرگذاری تمرین مقاومتی بر مسیر آنتیاکسیدانی بیشتر شناخته شود. همچنین با توجه به تاثیرگذاری NRF2 و NQO1 بر روی یکدیگر و تاثیر مکمل کوآنزیم Q10 بر برخی از عوامل آنتیاکسیدانی، پژوهشی که تاثیر تمرین مقاومتی همراه با مصرف مکمل کوآنزیم Q10 بر فاکتورهای NRF2 و NQO1 را در هیپوکمپ مغز موشها بررسی کرده باشد، مشاهده نشد. لذا، پژوهش حاضر در جهت پاسخ به این سوال که آیا هشت هفته تمرین مقاومتی همراه با مصرف مکمل کوآنزیم Q10 بر مقادیر آنتیاکسیدانی NRF2 وNQO1 هیپوکمپ موشهای نر نژاد اسپراگداولی تأثیر دارد؟ طراحی گردیده است.
روش بررسی
پژوهش حاضر با در نظر گرفتن هدف بنیادیتوسعهای و از لحاظ روش، تجربیآزمایشگاهی است که با سه گروه مداخله و یک گروه کنترل انجام شد. معیار ورود موشهای صحرایی، سالم بودن، نر از نوع نژاد اسپراگداولی، در دامنه سنی 2 ماهه بود. موشهای صحرایی زخمی یا بیمار و بالاتر از سن 2 ماهه از مطالعه حذف شدند. در این پژوهش، 32 سر موش صحرایی نر 2 ماهه از نژاد اسپراگداولی با میانگین وزن 20±200 گرم انتخاب شدند. موشهای صحرایی در حیوان خانه دانشگاه شیراز با دمای 2±22 درجه سانتیگراد، رطوبت 50-40 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری شدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه شیراز تهیه شد. همچنین آب مورد نیاز حیوانات به صورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. موشهای صحرایی به طور تصادفی به چهار گروه 1-کنترل (8 سر) 2-تمرین مقاومتی (8 سر) 3-گروه تمرین مقاومتی+مکمل Q10 (8 سر) 4-گروه مکمل Q10 تنها تقسیم شدند.
پروتکل تمرین: دستورالعمل تمرینی در این تحقیق شامل بالا رفتن از نردبان فلزی با طول یک متر و ارتفاع پله 4 سانتیمتری بود. یک هفته صرف آشناسازی موشها با روش تمرین شد. در این دوره موشها بدون هیچ بار اضافهای یاد گرفتند که چطور از نردبان بالا بروند. پس از دوره آشناسازی، تمرین مقاومتی شامل 8 هفته و هفتهای 3 جلسه صعود از یک نردبان عمودی یک متری با 26 پله با شیب (85 درجه) انجام شد. در حین دوران تمرین با توجه به شدت مورد نظر پروتکل و وزن آزمودنیها از وزنههایی در قسمت دُم موشها استفاده میشد. هــر جلســه تمرین شــامل 3 ست بــا 5 تکــرار بود، کــه در فاصلــه هــر تکــرار یــک دقیقــه استراحت و در فاصلـه بیـن هـر ست 2 دقیقـه اسـتراحت در نظـر گرفتــه شد. در هفتــه اول میــزان وزنههــای بســته شــده بــه دُم موشها 30 درصــد وزن بـدن آن¬هـا بود کـه بـه تدریـج در هـر هفتـه 10 درصـد افزایـش یافت تا در نهایت به 100 درصـد وزن بـدن آنهـا در هفتـه هشتم رسید (19).
نحوه مکملیاری کوآنزیم Q10: جهت آمادهسازی مکمل کوآنزیم Q10، ابتدا 400 میلیگرم از پودر مکمل کوآنزیم Q10 از شرکت بولک ساپلمنت آمریکا Bulk supplements را با ترازو وزن کرده و در یک ظرف مدرج قرار داده شد. سپس 10 سیسی روغن زیتون به عنوان حلال به آن اضافه شد. تهیه مکمل به صورت هفتگی بود تا از تخریب مکمل بر اثر عواملی مانند گرما (بیش از 40 درجه سانتیگراد) و قرار گرفتن در معرض نور مستقیم آفتاب، مِمانعت شود. سپس میزان مکمل مصرفی روزانه هر موش را مَخلوط میشد که یک دست شود. در ادامه توسط سرنگ انسولین و سوزن گاواژ، مکمل به معده موشها گاواژ می¬گردید. میزان مصرف روزانه مکمل Q10، به میزان 200 mg/kg از وزن بدن موشها بود، که در ابتدای هر هفته محاسبه و به صورت گاواژ و به مدت 8 هفته همزمان با انجام پروتکل تمرینی به دو گروه تمرین مقاومتی+مکمل Q10 و گروه مکمل Q10 خورانده شد (20).
روش بافتبرداری: برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل اِسترس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 48 ساعت پس از آخرین جلسه تمرین و گاواژ مکمل، موشها با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کِتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زِایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس بافت هیپوکمپ مغز از بدن حیوان برداشته شد و در یک پتری دیش حاوی نرمال سالین شستهشده و سپس توسط یک گاز آبگیری شد؛ در نهایت درون یک کرایوتیوپ گذاشته و سریعاً به تانک ازت مایع منتقل و برای سنجشهای بعدی با دمای منفی 80 فریزر شد (21).
روش آزمایشگاهی وسترنبلات
از روش وسترنبلات برای سنجش میزان NRF2 و NQO1 در بافت هیپوکمپ مغز استفاده شد که شامل مراحل زیر بود (22):
1. لیز کردن بافت: برای لیز کردن بافت¬ها از Lysis buffer با ترکیب زیر استفاده شد و سپس نمونهها در سانتریفیوژ مدل Eppendorph 5415 R در دمای چهار درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند. مایع شفاف (Supernatant) حاوی پروتئین استخراج و در فریزر منفی 20 نگهداری شد.
2. تعیین غلظت پروتئین بهوسیله برد فورد: برای ساخت محلول بردفورد کوماسی بلو کاملاً در الکل به مدت 20 دقیقه حل گردید، سپس اسیدفسفوریک قطرهقطره به آن اضافه شد. سپس آب را قطرهقطره اضافه کرده تا محلول حاصل به حجم 50 میلیلیتر رسید. محلول تهیهشده با کاغذ صافی دو بار صافشده و در بطری تیره داخل یخچال نگهداری شد.
3. تهیه غلظتهای مختلف BSAبرای کشیدن منحنی استاندارد: ازBSA به عنوان پروتئین استاندارد برای اندازهگیری میزان پروتئین استفاده میشود. غلظتهای 0/25، 0/5، 1، 0/15، 0/3، 0/6، 0/125 از پروتئین استاندارد با افزودن نصف حجم آب به غلظت قبلی ساخته شد.
4. آمادهسازی نمونه: نمونههای پروتئینی تهیهشده قبل از ریختهشدن در چاهک میبایست هم غلظتشده و با بافر نمونه مخلوط و به مدت 5 تا 10 دقیقه در آب 100 درجه سانتیگراد جوشانده شود. این بافر موجب سنگینشدن، احیا و خطیشدن پروتئینها میشود علاوه برآن برموفنول بلو موجود در بافر طریقه حرکت پروتئینها را در ژل نشان میدهد.
5. ساخت الکتروفورز بر روی ژل SDS page: ژل SDS page از پلیمرآکریل آمید ساخته شده است که بیس آکریلآمید این پلیمر را بهصورت عرضی به هم مرتبط کرده است. بهگونهای که منافذ با قطر معین و یکسان در ژل حاصل میشود. پلیمریزاسیون ژل با افزودن آمونیوم پرسولفات (APS) شروعشده و با اضافهکردن تترامتیاتیلندیآمین (TEMED) tetramethyethylenediamine موجب تشکیل رادیکالهای آزاد از APS شده که این رادیکالها باعث پلیمریزاسیون میشود.
6. روش انجام آزمایش و ساختن ژل پایین و بالا: برای دورگیری ژل، 1000 میکرولیتر از ژل پایین کاملاً فاقد تمد را برداشته و به آن 4 میکرولیتر تمد اضافه شد. سپس محلول حاصل را به سرعت از گوشههایی از فضایی دو ژل ریخته شد، بعد از دورگیری 15 دقیقه، فرصت داده شد تا کاملاً بگیرد و سپس محلول ژل کامل به همراه تمد را برداشته بهوسیله سمپلر در فضایی بین دو شیشه ریخته بهطوری که تا دوسوم شیشهها پر شد. سپس مقداری اتانول اشباع شده اسپری کرده تا مانع خشک شدن ژل شود و به علت سنگینی حاصل از آن سطح ژل صاف شد. حدود 45 دقیقه برای پلیمریزاسیون ژل پایین لازم است و در این مرحله ژل بالا 5 درصد آماده شد.
7. الکتروفورز بر ژِل SDS page: شیشههای حاوی ژِل، درون تانک الکتروفورز قرار داده شدند. بافرالکتروفورز اضافه گردیدوسپس ابتدا مارکر پروتئین رنگی (دارای پروتئینهایی با وزن مولکولی مشخص است که رنگی میباشد و از ژل به کاغذ منتقل میشود) به میزان دو میکرولیتر در چاهک اول و نمونهها در سایر چاهکها به میزان 12 میکرولیتر توسط سرنگ همیلتون لود شد. سپس الکترودها را به دستگاه مولد جریان وصل کرده و تا رسیدن پروتئینها به ژل پایین، حدود 45 دقیقه جریان با ولتاژ 120 برقرار شد.
8. وسترن بلات یا ایمنوبلاتینگ: ایﻤﻨﻮﺑﻼﺗﯿﻨﮓ روﺷﯽ اﺳﺖ ﮐﻪ ﻃﯽ آن ﺑﺎﻧﺪﻫﺎی ﭘﺮوﺗﺌﯿﻨﯽ ﺟﺪا ﺷﺪه ﺗﻮﺳﻂ ژل اﻟﮑﺘﺮوﻓﻮرز به ﻏﺸﺎیﯽ از ﺟﻨﺲ ﻧﯿﺘﺮو ﺳﻠﻮﻟﻮز یﺎ PVDF اﻧﺘﻘﺎل یﺎﻓﺘﻪ و ﺳﭙﺲ ﺑﻪوﺳﯿﻠﻪ آﻧﺘﯽﺑﺎدی اﺧﺘﺼﺎﺻﯽ ﭘﺮوﺗﺌﯿﻦﻫﺎی روی آن ﺷﻨﺎﺳﺎیﯽ ﻣﯽﺷﻮد. اﻧﺘﻘﺎل ﻧﻤﻮﻧﻪﻫﺎ از ژل ﺑﻪ ﮐﺎﻏﺬ ﺗﻮﺳﻂ ﺟﺮیﺎن اﻟﮑﺘﺮیﮑﯽ صورت گرفت. بعد از اتمام الکتروفورز ژل به آرامی از شیشه¬ها جداشده و در بافر انتقال قرار گرفت. سپس کاغذ PVDF به اندازه ژل بریدهشده و برای فعالشدن به مدت 1 دقیقه در متانول شیکشده و با آب مقطر شسته شد و درون بافر انتقال قرار گرفت. در حین قرار دادن کاغذ صافی روی کاغذ PVDF و کاغذ PVDF روی ژل، حبابهایی ایجادشده توسط حرکت آهسته اسپیسر روی کاغذ صافی خارج گردید. در نهایت دستگاه با ولتاژ 120 میلی ولت به مدت یک ونیم ساعت به منبع مولد جریان متصل گشته و پروتئینهای موجود در ژل به کاغذ منتقل گردید.
9. مرحله بلاکینگ: در مرحله بلاکینگ، محلول بلاکینک به منظور پوشاندن کاغذ برای جلوگیری از واکنش غیراختصاصی آنتیبادی اولیه به کار میرود.
10. مرحله انکوبه کردن با آنتیبادی اولیه و ثانویه: پس از پایان یافتن زمان بلاکینگ کاغذ با آنتیبادی اولیهای که با محلول بلاکینگ به مقدار معین آنتیبادی اولیه بتا-اکتین (anti-β-Actin (C4) (sc-47778)) مخلوط و رقیق شده، به مدت 16 تا 18 ساعت انکوبه گردید. سپس کاغذ با آنتیبادی ثانویه با غلظت (1:1000) برای تمام آنتیبادی های اولیه به مدت یک ساعت و 15 دقیقه در دمای اتاق شیک شد.
11. مرحله آشکارسازی: پس از شستوشوی نهایی مرحله قبل آب اضافی کاغذ PVDF روی سلفون قرار گرفت و محلول کمولومینسانس با سمپلر روی نواحی باند مورد نظر ریخته شد. کاغذ در سلفون گذاشته شد و درون کاست فیلم قرار داده شد. برای مشاهده باند پروتئینی مورد نظر فیلم عکاسی را بر کاغذ دارای پوشش نایلونی گذاشته و در کاست بسته شد. مدت زمان باقی ماندن فیلم در کاست به نوع آنتیبادی و شدت نور دیده شده از باند پروتئینی بستگی داشت. در مورد آنتیبادیهای anti-NRF2 (A-10) (sc-365949) ساخت شرکت Santa-Cruz و (Sc-56053) anti-NQO1 ساخت شرکت البساینسElabscience ، 60 تا 80 ثانیه و در مورد آنتیبادی بتا-اکتین 10، ثانیه زمان مناسبی بود. سپس در تشتک آب فیلم را به مدت 20 ثانیه شسته و بعد از آن به مدت 20 ثانیه در محلول ثبوت تکان داده شد. سپس مجدداً فیلم را با آب جاری شسته و با گیره آویزان کرده تا خشک شدند.
تجزیه و تحلیل آماری
نرمال بودن دادهها از طریق آزمون آماری شاپیروویلک بررسی شد. با توجه به نرمال بودن دادهها، از آزمون پارامتریک آنوای یکطرفه و در صورت معنیداری از آزمون تعقیبی توکی جهت بررسی میانگینها و جهت گزارش اندازه اثر (Effect Size) از آزمون مربع اِتا (Eta Squared) استفاده شد. بررسی دادهها، با استفاده از نرمافزارهای version 16 SPSS و گرافپد پریسم نسخه 3/2/10 انجام گرفت. سطح معناداری پژوهش حاضر، P≤0/05در نظر گرفته شده است. نمودارها از طریق نرمافزار گرافپد پریسم نسخه 3/2/10 طراحی شد.
نتایج
بعد از تجزیه و تحلیل دادهها، نتایج نشان داد که 8 هفته تمرین مقاومتی همراه با مصرف مکمل Q10 منجر به تغییر معنیداری در محتوای پروتئین NRF2 میشود (0/64=ƞ2، P≤0/03،4/80=F). نتایج آماری تعقیبی توکی نشان داد این تغییر معنیدار بین جفت گروههای تمرین مقاومتی و گروه مکمل Q10 است (0/04≥p) (شکل 1، A و B). در مقابل بین جفتگروههای تمرین مقاومتی (0/23≥p)، تمرین مقاومتی+مکمل Q10 (P≤0/32) و گروه مکمل Q10 (P≤0/65) نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل Q10 (P≤0/99) و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل Q10 تفاوت معنیداری مشاهده نشد (0/06≥p) (شکل 1، A و B). آزمون مربع اِتا (ƞ2) برای اندازهگیری اندازه اثر محتوای پروتئین NRF2، اثری متوسط را نشان داد (0/64=ƞ2)؛ با توجه به اندازه اثر به دست آمده میتوان گفت که انجام تمرینهای مقاومتی همراه با مصرف Q10 تفاوت معنیداری متوسطی بین گروهها دارد و این تفاوت فقط بین گروه تمرین مقاومتی و گروه مکمل Q10 بود (شکل 1، A و B).
از طرفی نتایج نشان داد که 8 هفته تمرین مقاومتی همراه با مصرف Q10 منجر به تغییر معنیداری در محتوای پروتئین NQO1 نمیشود (ƞ2= 0/33، 0/09≥p، F=3/01). نتایج آماری تعقیبی توکی بین جفتگروههای تمرین مقاومتی (0/34≥p)، تمرین مقاومتی+مکمل (0/64≥p)، Q10 و گروه مکمل (0/76≥p)، Q10 نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل (0/93≥p) Q10 ، بین جفت گروههای تمرین مقاومتی و گروه مکمل(0/09≥p) Q10 و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل(0/21≥p) Q10 تفاوت معنیداری مشاهده نشد (شکل 2، A و B). آزمون مربع اِتا (ƞ2) برای اندازهگیری اندازه اثر محتوای پروتئین NQO1، اثری ضعیفی را نشان داد (0/33=ƞ2)؛ با توجه به اینکه اندازه اثر به دستآمده میتوان گفت که انجام تمرینهای مقاومتی همراه با مصرف Q10 تفاوت معنیداری ضعیفی بین گروهها دارد و این تفاوت بین همه جفت گروه ها قابل مشاهده است (شکل 2، A و B).
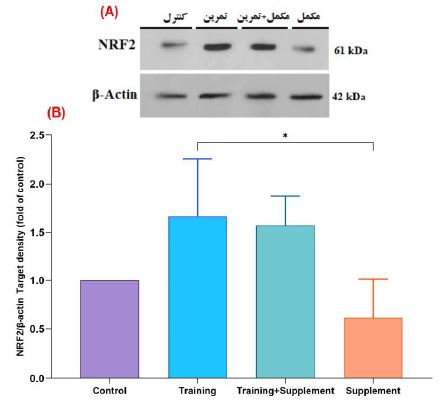
شکل 1: مقایسه محتوای پروتئین NRF2 در گروههای مختلف پژوهش.
A، تصاویر وسترنبلات محتوای پروتئین NRF2 و β-actin به عنوان لودینگ کنترل (کنترل داخلی) در بافت هیپوکمپ مغز. B، نمودار ستونی نشان دهنده مقادیرکمی شده باندهای پروتئین NRF2 در مقابل لودینگ کنترل.
( وجود تفاوت معنیدار بین گروه مکمل Q10 نسبت به گروه تمرین مقاومتی)
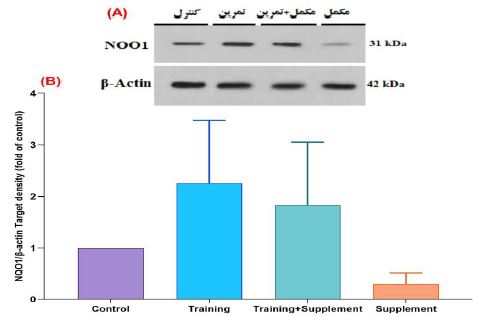
شکل 2: مقایسه محتوای پروتئین NQO1 در گروههای مختلف پژوهش. A، تصاویر وسترنبلات محتوای پروتئین NQO1 و β-actin به عنوان لودینگ کنترل (کنترل داخلی) در بافت هیپوکمپ مغز. B، نمودار ستونی نشان دهندهی مقادیرکمی شده باندهای پروتئین NQO1 در مقابل لودینگ کنترل.
بحث
این مطالعه با هدف بررسی تأثیر تمرین مقاومتی همراه با مکملیاری کوآنزیم Q10 بر محتوای درون سلولی پروتئینهای NRF2 و NQO1در بافت هیپوکمپ موشهای صحرایی نر نژاد اسپراگداولی انجام شد؛ نتایج نشان داد که 8 هفته تمرین مقاومتی همراه با مصرف مکمل Q10 منجر به تغییر معنیداری در محتوای پروتئین NRF2 میشود. این تغییر معنیدار تنها بین جفت گروههای تمرین مقاومتی و گروه مکمل Q10 بود. در مقابل بین جفتگروههای تمرین مقاومتی، تمرین مقاومتی+مکمل Q10 و گروه مکمل Q10 نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل Q10 و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل Q10 تفاوت معنیداری مشاهده نشد. همچنین تغییر معنیداری در محتوای پروتئین NQO1 بین گروهها مشاهده نشد. بین جفتگروههای تمرین مقاومتی، تمرین مقاومتی+مکمل Q10 و گروه مکمل Q10 نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل Q10، بین جفت گروههای تمرین مقاومتی و گروه مکمل Q10 و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل Q10 تفاوت معنیداری مشاهده نشد. سیستم سلولیملکولی NRF2/NQO1 بهطور گسترده در دستگاه عصبی مرکزی بیان میشود و در پاسخ به بیماریهای حاد مغزی و بیماریهای مزمن عصبی تعدیل میشود. فاکتورهای NRF2 و NQO1، تنظیمکنندههای مهم التهاب در مغز هستند. اختلال در تنظیم این مکانیسمها به آسیب مغزی کمک میکند (23). تمرین ورزشی منظم منجر به اثرات مفیدی بر سیستم عصبی مرکزی میشود. در این راستا در مطالعهای Monir و همکاران درسال 2020 تاثیر فعالیت ورزشی بر مسیر NRF2 در موشهای مبتلا به پارکینسون مورد بررسی قرار دادند. در این تحقیق مشخص گردید که فعالیت ورزشی بیان برخی از ژنهای مسیر NRF2 از قبیلTFAM ، NRF2 و NQO1 را افزایش میدهد. این محققان بیان کردند فعالیت ورزشی توانست اکثر جنبه¬های رفتاری بیماری پارکینسون، نحوه صحیح راه رفتن، حافظه کوتاهمدت و هماهنگی حرکتی را اصلاح کند و فعالیت ورزشی با فعالکردن مسیر NRF2 باعث بهبود ویژگی¬های بیماران پارکینسونی میشود (24). همچنین در تحقیقی دیگر Xie و همکاران در سال 2024 نشان دادند که تمرین ورزشی روی تردمیل باعث افزایش بیان فاکتور هستهای NRF2 و NQO1 در هیپوکامپ موشهای صحرایی میشود. این محققان بیان کردند که تمرین ورزشی هوازی پتانسیل جلوگیری از استرس اکسیداتیو و مرگ سلولی در میتوکندری را از طریق مدولاسیون مسیر سیگنالینگ NRF2/GSK3β دارد؛ بنابراین اختلالشناختی مشاهدهشده در مدل موشهای صحرایی پیر را بهبود میبخشد. همچنین بیان کردند بهنظر میرسد که تمرین ورزشی هوازی میتواند بهطور بالقوه به عنوان یک رویکرد درمانی موثر برای کاهش پیری مغز و بیماریهای عصبی ناشی از استرس اکسیداتیو باشد (25). نتایج دو تحقیق (Monir و همکاران و Xie و همکاران) نشان میدهد که بیان ژن NRF2 و NQO1 به دنبال انجام تمرینهای ورزشی هوازی افزایش مییابد و این افزایش را به بهبود عملکردهای مغزی مانند حافظه کوتاهمدت و هماهنگی حرکتی نسبت دادهاند. نتایج تحقیق حاضر یک افزایش غیرمعنادار را به دنبال انجام تمرین مقاومتی نشان داد. از تفاوتهای تحقیق حاضر با ویژگیهای دو تحقیق گزارششده در بالا میتوان به نوع تمرین اشاره کرد و آن را یکی از شرایط مهم این تفاوت در معنیداری و غیرمعنیداری افزایش NRF2 و NQO1 دانست. ماهیت تمرینهای مقاومتی با تمرینهای هوازی در بحث فیزیولوژیایی بسیار متفاوت است و این تفاوت میتواند بر مسیرهای سلولیملکولی تاثیرگذار باشد. از عوامل مهم دیگر نوع روش اندازهگیری پروتئینهای NRF2 و NQO1 میباشد. در راستای این تفاوت در نوع تمرین، در تحقیقی دیگر Tutakhail و همکاران در سال 2018 نشان دادند که تمرین هوازی شدید و طولانی، محتوای NRF2 را در هیپوکمپ افزایش میدهد. تمرینهای ورزشی شامل دویدن روی تردمیل با سه شدت مختلف بود. این محققان بیان کردند که تمرین ورزشی با اِلقای مسیر سیگنالینگ آنتیاکسیدانی NRF2/HO-1، درد و التهاب را کاهش میدهد (26). همچنین در تحقیقی Done و همکاران (2016) به بررسی سیگنالینگ NRF2 و NQO1 به دنبال انجام تمرین ورزشی هوازی دوچرخهسواری 30 دقیقه با 70 درصد VO2max در افراد جوان و مسن پرداختند. افزایش قابلتوجهی در بیان NRF2 و NQO1 مشاهده شد. این محققان بر اساس نتایج خود گزارش کردند که یک جلسه تمرین هوازی زیربیشینه برای فعالکردن NRF2 در سطح کل سلول در بزرگسالان جوان و مسن کافی است؛ همچنین بیان کردند محلیسازی هستهای NRF2 منجر به افزایش محتوای پروتئینهای مربوط به پاییندست، از جمله HO-1 و NQO1 میشود (27). همانطور که گزارش شد ما شاهد افزایش محتوای پروتئینهای NRF2 و NQO1 بودیم، اما این افزایش معنیدار نبود و این در حالی است که در نتایج تحقیقهایTutakhail و همکاران و Done و همکاران محتوای پروتئینهای NRF2 و NQO1 افزایش معنیداری را نشان دادند. علاوه بر تفاوت در نوع تمرینهای گزارش شده در مطالعات بالا، دیگر شرایط تمرینی مانند شدت، مدت، تعداد تکرارها، ستها و زمان ریکاوری میتواند در نتایج تحقیقها نسبت به تحقیق حاضر تاثیرگذار باشد. در تحقیق حاضر تمرین ورزشی به صورت مقاومتی و بالا رفتن از پله توسط موشهای صحرایی بود و در تحقیقهای دیگر شامل دویدن رتها روی تردمیل به صورت تداومی و تناوبی و همچنین انجام تمرینهای ورزشی روی آزمودنیهای انسانی بهصورت کار بر روی دوچرخه ارگونومتر با شدت متوسط بود. شرایطهای تمرینی بر روی مسیرهای سلولی میتواند نتایج متناقضی را نشان دهد و نتایج مطالعات گزارششده نشان میدهد که تمرینهای هوازی میل به افزایش محتوا و بیان ژن NRF2 و NQO1 دارد. شواهد در حال رشد اثرات مثبت فعالیتهای ورزشی حاد و مزمن بر سیستم ردوکس و اثرات مفید آنها بر سلامت را نشان دادهاند (23). مطالعات متعددی پیشنهاد کردهاند که هم تمرینهای مقاومتی و هم تمرینهای استقامتی میتواند با افزایش تشکیل گونههای واکنشی (ROS/NRS) منجر به اِختلال در هُموستاز ردوکس سلولی شود. با این وجود اگرچه نشان دادهشده است که فعالیتهای ورزشی NRF2 را نیز فعال میکنند؛ اما تفاوتهای بسیاری در شرایط آزمودنیها و همچنین نوع، شدت و مدت زمان تمرین ورزشی وجود دارد (23،28،29). علاوه بر این، در تحقیقی دیگر نشان داده شده است که میزان فعالسازی NRF2 نیز به شدت فعالیتهای ورزشی بستگی دارد (30). در اِرتباط با مِکانیسمهای سلولی مرتبط با پروتئین NRF2 در مغز میتوان گفت، استرس و آسیباکسیداتیو با تخریب نورونی منجر به بیماریهای متعددی شامل بیماری آلزایمر، پارکینسون و هانتینگتون میشوند (31). مسیر سلولی NRF2-ARE یک مسیر تنظیمکننده اصلی برای استرسهای اکسیداتیو میباشد، که توانایی تعدیل بیان ژنهای آنتیاکسیدان و سمزدایی را دارد. این مسیر در تنظیم حالت ردوکس سلولی نقش کلیدی دارد. تحت شرایط هوموستاتیک طبیعی، فاکتور رونویسی NRF2 در سیتوپلاسم به وسیله عامل سلولی Keapl مهار میشود، که به محض برخورد با ROS، فاکتور NRF2 از مهارکننده Keap1 جداشده و به درون هسته انتقال مییابد و در آنجا به ARE در ناحیه پروموتور ژنهای کدکننده آنزیمهای آنتیاکسیدان متصل میشود؛ این فرآیند منجر به تولید آنزیمهای آنتیاکسیدانی درونی میشود (32). آنزیمهای آنتیاکسیدانی فعالشده توسط پروتئین NRF2 میتواند شامل سوپراکسید دسموتاز (SOD)، کاتالاز، پراکسیردوکسین و غیره باشند که در مقابله با ROS نقش مهمی دارند (33). از سوی دیگر بررسی رابطه فعالیت ورزشی و استرس اکسیداتیو مشخص کرده است که فعالیتهای ورزشی منظم سبب کاهش استرس اکسیداتیو و افزایش آنتیاکسیدانها میشود و در مجموع التهاب کاهش مییابد. از مباحث مهم در علوم ورزشی استفاده از آنتیاکسیدانهای رژیم غذایی بهخصوص در شکل مکمل است که با هدف کاهش استرس اکسیداتیو در فعالیتهای ورزشی مورد استفاده قرار میگیرد. عدم وضوح یافتههای تحقیقاتی میتواند این سؤال را ایجاد کند که آیا مکمل آنتیاکسیدانی در هنگام فعالیت¬های ورزشی یا منظم به تنهایی اثرات مثبت یا منفی دارد؟ (34). در این راستا در پژوهشی توسطPala و همکاران در سال 2016 تاثیر شش هفته فعالیت ورزشی و مکمل کوآنزیم Q10 بر مسیرهای NRF2 بررسی شد و مشخص گردید که Q10 بیان NRF2 و دیگر عوامل مرتبط را از طریق فعالیت ورزشی افرایش میدهد که این نشاندهنده اثر ضد التهابی Q10 است و بر نقش آن در دفاع آنتیاکسیدانی تأکید دارد (20). در تحقیقی بالینی صمیمی و همکاران در سال 2024 به بررسی مکمل Q10 بر مسیر سیگنالینگ NRF2/Keap1/HO-1/NQO1 در کبد موشهای دیابتی پرداختند. بیان NRF2 وNQO1 در گروه دیابتی+ مکمل Q10 نسبت به گروه کنترل دیابتی افزایش معنیداری را نشان داد، اما نسبت به گروه کنترل سالم کاهش (غیرمعیندار) یافته بود. این محققان براساس نتایج خود بیان کردند مکمل Q10 میتواند ظرفیت آنتیاکسیدانی بافت کبد در موشهای دیابتی را با تعدیل مسیر سیگنالینگ Nrf2/Keap1/HO-1/NQO1 افزایش دهد (35). در تحقیقی دیگر Zou و همکاران در سال 2023 به بررسی تریمتیل آمین N-اکسید (TMAO) Trimethylamine N-oxide بر بیان NRF2 و NQO1 در موشهای صحرایی نر به دنبال انجام تمرین ورزشی شنا پرداختند. نتایج نشان میدهد که TMAO با افزایش بیان NRF2 و NQO1 بهطور قابلتوجهی از میوبلاستها در برابر آسیب ناشی از استرس اکسیداتیو محافظت میکند. این تحقیق بینش جدیدی در مورد توانایی عوامل مهم برای کاهش استرس اکسیداتیو ناشی از تمرینهای ورزشی از طریق مسیر سیگنالینگ NRF2 ارائه میدهد و چارچوبی ارزشمند برای توسعه مکملهای غذایی ورزشی با هدف کاهش استرس اکسیداتیو ارائه میدهد (36). نتایج هر سه تحقیق بالا در حوزه فیزیولوژی ورزشی و بالینی نشان میدهد که مصرف مکمل آنتیاکسیدانی Q10 میتواند سطوح NRF2 و NQO1 را افزایش دهد. نتایج تحقیق حاضر یک افزایش غیرمعنیدار را در گروه تمرین مقاومتی+مکمل Q10 در محتوای پروتئینهای NRF2 و NQO1 نشان میدهد. البته شایان ذکر است که ما شاهد افزایش در گروه مکمل نسبت به دیگر گروهها نیستم و نتایج تحقیق حاضر یک افزایش معنیدار را بین گروه تمرینی مقاومتی نسبت به گروه مکمل Q10 در محتوای پروتئین NRF2 نشان داد. بر اساس نتایج تحقیق حاضر انجام تمرین مقاومتی همراه با مصرف مکمل Q10 بهصورت ترکیبی یا به تنهایی نمیتواند محتوای پروتئینهای NRF2 و NQO1 را در هیپوکمپ مغز تغییر معنیداری دهد. علاوه بر شرایط تمرینی که در بالا ذکر شد مانند تفاوت در نوع تمرین، شدت، مدت، تعداد تکرارها، ستها و زمان ریکاوری و همچنین نوع روشهای اندازهگیری آزمایشگاهی، مکان بافت مورد هدف برای سنجش میزان پروتئینها میتواند در نتایج تاثیرگذار باشد. با این حال نشان داده شده است که مکمل Q10 با تنظیم پروتئین NQO1 میتواند از آسیبهای سلولی جلوگیری کند. به عبارتی دیگر مکمل Q10 میتواند پروتئین NQO1 را فعال کند (37). با این حال در ارتباط با تاثیرگذاری مصرف مکمل Q10 در مغز مشخصشده است که مکمل Q10 با توجه به خاصیت آنتیاکسیدانی که دارد در درمان و کاهش بسیاری از بیماریهای مرتبط با مغز مانند بیماری آلزایمر، بیماری پارکینسون، بیماری هانتینگتون، اسکلروز جانبی آمیوتروفیک و ... مفید است (38).
نتیجهگیری
نتایج تحقیق حاضر تفاوت معنیدار قابلتوجهی بین گروهها نشان نداد و فقط یک افزایش معنیدار بین گروه تمرین مقاومتی نسبت به گروه مکمل Q10 مشاهده شد؛ بنابراین بر اساس نتایج تحقیق حاضر میتوان گفت که انجام تمرین مقاومتی همراه با مصرف مکمل Q10 به مدت 8 هفته به تنهایی یا به صورت ترکیبی نمیتواند تاثیر بسزایی بر محتوای پروتئینهای NRF2 و NQO1 در بافت هیپوکمپ موشهای صحرایی داشته باشد. با این وجود روش وسترنبلات، یک روش کیفی مرتبط با گزارش تصویر است و در این قبیل مطالعات نمیتوان به تنهایی بر اساس نتایج آماری به تفسیر و مقایسه پرداخت. برای روشنشدن مکانیسم تاثیرگذاری تمرین مقاومتی باید شرایط برنامه تمرینی مانند شدت، مدت، تکرار، ستها و دیگر شرایط برنامه تمرینی را مد نظر قرار داد؛ همچنین باید دیگر دوزهای استاندارد مصرف مکمل کوآنزیم Q10 مورد بررسی بیشتر قرار گیرد.
سپاسگزاری
نتایج این تحقیق حاصل انجام رساله دکتری در گروه فیزیولوژی ورزش پردیس بینالمللی ارس دانشگاه تهران بوده است و از تمامی افرادیکه در این امر مهم مارا پشتیبانی کردند، کمال تشکر را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط گروه فیزیولوژی پردیس بینالمللی ارس دانشگاه تهران تایید شده است و دارای کد اخلاق IR.IAU.B.REC.1401.030 می باشد.
مشارکت نویسندگان
تمامی نویسندگان در ارائه ایده، طراحی مطالعه، جمعآوری دادهها، تجزیه و تحلیل دادهها به یک اندازه مشارکت داشته و همچنین در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سئوالات مرتبط با مقاله سهیم می باشند.
بدن انسان در شرایط نرمال میتواند هموستاز را در شرایط تعادل نگه دارد و باعث ثبات بین اکسیدانها و آنتیاکسیدانها در محیط داخل سلولی شود (1). بیشتر مکانیسمهای بدن به اکسیژن نیازمند است و هنگامی که کنترل نشود منجر به بینظمی و اختلال در تعادلهای سلولی میشود، که میتواند عواملی مانند گونههای فعال اکسیژن (ROS) reactive oxygen species و گونههای فعال نیتروژن (RNS) reactive nitrogen species را درون سلول افزایش دهد (2). تولید بیش از حد این گونههای اکسیژنی/نیتروژنی میتواند به ساختارهای سلولی مانند میتوکندریها، لیپیدها، پروتئین¬ها و DNA آسیب برساند. همچنین میتواند در تعادل مسیرهای سلولیملکولی مهمی مانند اتوفاژی، آپوپتوز، بیان ژن سلول و حفظ هموستاز اختلال ایجاد کند (3).
یکی از این عوامل بسیار مهم عامل رونویسی یعنی فاکتور 2 مربوط به فاکتور هستهای اریتروئید 2 (NRF2) Nuclear factor erythroid 2-related factor 2 است؛ این عامل مهم متعلق به خانواده پروتئینی زیپلوسین است، که توسط ژن NFE2L2 در انسان کُدگذاری میشود (4). نشانداده شده است موشهایی که کمبود NRF2 دارند مستعد تشکیل تومور هستند؛ بنابراین مشخص میشود که NRF2 دارای یک نقش حفاظتی در بدن است. NRF2را میتوان به عنوان یک تنظیمکُننده اصلی در پاسخ به استرس اُکسیداتیو در نظر گرفت (5). این عامل رونویسی در بافتهایی مانند کلیه، عضلات، ریه، قلب، کبد و از همه مهمتر در مغز بیشتر است (6). فاکتور NRF2 با بیان بیش از 200 ژن محافظتی باعث سَمزدایی سلولی و دفاع آنتیاکسیدانی میگردد. همچنین NRF2، نخستین تنظیمکُننده رونویسی در اغلب آنتیاکسیدانها مانند سوپراکسیددیسموتاز-1 (SOD1) Super oxicide desmotase 1، NAD(P)H و کوینناکسیدوردوکتاز-1 (NQO1) NAD(P)H dehydrogenase quinone 1، است (7). در این بین NRF2 با آنزیم NQO1 ارتباط نزدیکی دارد. فاکتور NQO1 یک فلاوآنزیم است، که اهمیت بسیاری در محافظت سلولهای بدن از فرایند اُکسیداسیون احیای ناشی از کوئینن¬ها دارد. فاکتور NQO1 یک آنزیم سیتوزولی است که تنظیم آن توسط مسیر Keep1-NRF2-ARE انجام می¬شود؛ این ژن رُدوکتاز دو الکترونی، کوئینون فعال را به هیدروکوئینون تبدیل میکند. عملکرد کلیدی این آنزیم که در فاز دوم مسیر آنتیاکسیدانی قرار دارد، کاهش تشکیل ROS و سمیت کوئینون است (8). مطالعات انجام شده حکایت از آن دارد که افزایش یا کاهش این آنزیم با افزایش و کاهش حساسیت به استرس اُکسیداتیو مرتبط است (9).
مکملهای آنتیاکسیدانی به عنوان عاملی در خنثیسازی آسیبهای سلولیمولکولی ناشی از تمرینهای ورزشی و برخی از بیماریها استفاده میشود. یکی از مکملهای رایج در این رابطه مکمل کوآنزیم Q10 است. کوآنزیم Q10 یک آنتیاکسیدان محلول در چربی است که بهطور طبیعی در بدن انسان تولید و موجب افزایش متابولیسم سلول میشود. کوآنزیم Q10 انرژی سلول را تامین میکند و سلول را زنده و شاداب نگه میدارد. در واقع کوآنزیم Q10 یکی از مَلزومات اساسی سلولهای بدن برای زندهماندن میباشد (10). کوآنزیمQ10 معمولترین شکل یوبیکینون در بدن است، که به عنوان یک کوفاکتور اگزوژنز آنزیمی در تمام سلولهای زنده تولید میشود و به عنوان یک کاتالیزور در جابجایی پروتونالکترون در میتوکندری و لیزوزومها نقش ایفا میکند و از میتوکندری در مقابل آسیب رادیکالهای آزاد حفاظت میکند. کوآنزیم Q10 بهطور عمده توسط لیپوپروتئینها در خون حمل میشود و میتواند نقش آنتی اکسیدانی داشته باشد (11).
از میان مناطق مختلف مغزی، هیپوکمپ یکی از حساسترین نواحی است که دستخوش تغییرات نوروفیزیولوژیکی، ساختاری و مولکولی خواهد شد (12). هیپوکمپ بخش قدرتمندی از مغز در انسانها محسوب میشود. هیپوکمپ نقش اساسی در تقویت اطلاعات بین حافظه کوتاهمدت و حافظه بلندمدت دارد (13). با توجه به توانایی آن در کاهش اثرات استرس اکسیداتیو، بسیاری از گروههای تحقیقاتی نشان دادند که تجویز کوآنزیمQ10 میتواند اثرات بیماریهای عصبی مانند آلزایمر، پارکینسون، هانتینگتون، اسکلروز جانبی آمیوتروفیک و آتاکسی فریدریچ را درمان کند (11،14). مشخص شده است که تمرینهای ورزشی میتواند جنبههای فیزیولوژیکی گوناگونی از فعالیتهای سلول عصبی را فعال کند و ممکن است از بسیاری از عوارض مغزی مانند مرگ سلولهای عصبی جلوگیری کنند (15). نشان داده شده است که تمرینهای ورزشی موجب تقویت عملکردهای اِدراکی و شناختی، افزایش حافظه و یادگیری و همچنین کاهش اِختلالات شناختی ناشی از آسیبهای مغزی میگردد (12). شواهد نشان میدهد که تمرینهای ورزشی مُنظم باعث افزایش فعالیت آنزیمهای آنتیاکسیدانی، افزایش مقاومت در برابر استرس اُکسیداتیو و در نتیجه کاهش آسیبهای استرس اکسیداتیو میشود (16). تمرینها و فعالیتهای ورزشی همچنین میتواند باعث تنظیم افزایشی تولید عوامل مهم سلولیملکولی در هیپوکمپ موشهای صحرایی شود. این عوامل میتوانند در بقای سلولهای عصبی، تمایز، اِتصال و شکلپذیری سیناپسی درگیر باشند (14). به نظر میرسد که تمرینهای ورزشی مقاومتی در یک دوره طولانی میتواند از طریق افزایش آنتیاکسیدانها و فعالشدن مسیرهای دفاع آنتیاکسیدانی NRF2/NQO1 در جلوگیری از استرس اکسیداتیو سلولی در هنگام فعالیتهای ورزشی حاد دخیل باشد. در تحقیقی رفعتی و همکاران در سال 2021 به بررسی تاثیر تمرین تناوبی باشدت بالا همراه با مصرف مکمل کوآنزیم Q10 برمحتوای پروتئین NRF2 پرداختند. تمرین ورزشی منجر به افزایش محتوای پروتئین NRF2 شده بود؛ اما مکمل کوآنزیم Q10 تغییر معنیداری را ایجاد نکرد (17). در تحقیقی دیگر آوندی و همکاران در سال 2018 به بررسی تأثیر هشت هفته تمرین مقاومتی بر سطوح پلاسمایی NRF2 در مردان جوان پرداختند. نتایج نشان داد که هشت هفته تمرین مقاومتی منجر به افزایش سطوح پلاسمایی NRF2 میشود. این محققان اعلام کردند به نظر میرسد که افزایش سطوح NRF2 در اثر تمرین مقاومتی، منجر به سرکوبشدن رادیکالهای آزاد و افزایش ظرفیت ضداکسایشی بدن میشود (18). فعالیتهای ورزشی یک وسیله مطمئن برای مقابله با وضعیت¬های مزمن التهابزا است؛ اما سازوکارهای آن بهطور دقیق مشخص نیست بهخصوص هنگامی که تمرکز بر مسیر پیامرسانی NRF2 باشد. هماکنون اِجماع نظر کاملی در مورد تنظیم NRF2 و NQO1 و همچنین مصرف مکمل کوآنزیم Q10 ناشی از فعالیت ورزشی بهویژه تمرین مقاومتی بین محققان وجود ندارد و این به دلیل تحقیقات کمی است که در مورد اثر فعالیت ورزشی و بهویژه تمرین مقاومتی و مکمل کوآنزیم Q10 بر شاخص¬های آنتیاکسیدانی است. تحقیق حاضر به بررسی نحوه تأثیر تمرین مقاومتی و مکمل کوآنزیم Q10 بر مسیر آنتیاکسیدانی انجام میشود تا سازوکارهای دقیق تاثیرگذاری تمرین مقاومتی بر مسیر آنتیاکسیدانی بیشتر شناخته شود. همچنین با توجه به تاثیرگذاری NRF2 و NQO1 بر روی یکدیگر و تاثیر مکمل کوآنزیم Q10 بر برخی از عوامل آنتیاکسیدانی، پژوهشی که تاثیر تمرین مقاومتی همراه با مصرف مکمل کوآنزیم Q10 بر فاکتورهای NRF2 و NQO1 را در هیپوکمپ مغز موشها بررسی کرده باشد، مشاهده نشد. لذا، پژوهش حاضر در جهت پاسخ به این سوال که آیا هشت هفته تمرین مقاومتی همراه با مصرف مکمل کوآنزیم Q10 بر مقادیر آنتیاکسیدانی NRF2 وNQO1 هیپوکمپ موشهای نر نژاد اسپراگداولی تأثیر دارد؟ طراحی گردیده است.
روش بررسی
پژوهش حاضر با در نظر گرفتن هدف بنیادیتوسعهای و از لحاظ روش، تجربیآزمایشگاهی است که با سه گروه مداخله و یک گروه کنترل انجام شد. معیار ورود موشهای صحرایی، سالم بودن، نر از نوع نژاد اسپراگداولی، در دامنه سنی 2 ماهه بود. موشهای صحرایی زخمی یا بیمار و بالاتر از سن 2 ماهه از مطالعه حذف شدند. در این پژوهش، 32 سر موش صحرایی نر 2 ماهه از نژاد اسپراگداولی با میانگین وزن 20±200 گرم انتخاب شدند. موشهای صحرایی در حیوان خانه دانشگاه شیراز با دمای 2±22 درجه سانتیگراد، رطوبت 50-40 درصد و چرخه تاریکی-روشنایی 12-12 نگهداری شدند. غذای حیوانات بهصورت آزادانه و استاندارد مخصوص حیوانات آزمایشگاهی از دانشگاه شیراز تهیه شد. همچنین آب مورد نیاز حیوانات به صورت آزاد در بطری 500 میلیلیتری ویژه حیوانات آزمایشگاهی، در اختیار آنها قرار داده شد. موشهای صحرایی به طور تصادفی به چهار گروه 1-کنترل (8 سر) 2-تمرین مقاومتی (8 سر) 3-گروه تمرین مقاومتی+مکمل Q10 (8 سر) 4-گروه مکمل Q10 تنها تقسیم شدند.
پروتکل تمرین: دستورالعمل تمرینی در این تحقیق شامل بالا رفتن از نردبان فلزی با طول یک متر و ارتفاع پله 4 سانتیمتری بود. یک هفته صرف آشناسازی موشها با روش تمرین شد. در این دوره موشها بدون هیچ بار اضافهای یاد گرفتند که چطور از نردبان بالا بروند. پس از دوره آشناسازی، تمرین مقاومتی شامل 8 هفته و هفتهای 3 جلسه صعود از یک نردبان عمودی یک متری با 26 پله با شیب (85 درجه) انجام شد. در حین دوران تمرین با توجه به شدت مورد نظر پروتکل و وزن آزمودنیها از وزنههایی در قسمت دُم موشها استفاده میشد. هــر جلســه تمرین شــامل 3 ست بــا 5 تکــرار بود، کــه در فاصلــه هــر تکــرار یــک دقیقــه استراحت و در فاصلـه بیـن هـر ست 2 دقیقـه اسـتراحت در نظـر گرفتــه شد. در هفتــه اول میــزان وزنههــای بســته شــده بــه دُم موشها 30 درصــد وزن بـدن آن¬هـا بود کـه بـه تدریـج در هـر هفتـه 10 درصـد افزایـش یافت تا در نهایت به 100 درصـد وزن بـدن آنهـا در هفتـه هشتم رسید (19).
نحوه مکملیاری کوآنزیم Q10: جهت آمادهسازی مکمل کوآنزیم Q10، ابتدا 400 میلیگرم از پودر مکمل کوآنزیم Q10 از شرکت بولک ساپلمنت آمریکا Bulk supplements را با ترازو وزن کرده و در یک ظرف مدرج قرار داده شد. سپس 10 سیسی روغن زیتون به عنوان حلال به آن اضافه شد. تهیه مکمل به صورت هفتگی بود تا از تخریب مکمل بر اثر عواملی مانند گرما (بیش از 40 درجه سانتیگراد) و قرار گرفتن در معرض نور مستقیم آفتاب، مِمانعت شود. سپس میزان مکمل مصرفی روزانه هر موش را مَخلوط میشد که یک دست شود. در ادامه توسط سرنگ انسولین و سوزن گاواژ، مکمل به معده موشها گاواژ می¬گردید. میزان مصرف روزانه مکمل Q10، به میزان 200 mg/kg از وزن بدن موشها بود، که در ابتدای هر هفته محاسبه و به صورت گاواژ و به مدت 8 هفته همزمان با انجام پروتکل تمرینی به دو گروه تمرین مقاومتی+مکمل Q10 و گروه مکمل Q10 خورانده شد (20).
روش بافتبرداری: برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل اِسترس آزمودنیها در زمان اجرای برنامه تمرینی، بعد از 48 ساعت پس از آخرین جلسه تمرین و گاواژ مکمل، موشها با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیبی از کِتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زِایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس بافت هیپوکمپ مغز از بدن حیوان برداشته شد و در یک پتری دیش حاوی نرمال سالین شستهشده و سپس توسط یک گاز آبگیری شد؛ در نهایت درون یک کرایوتیوپ گذاشته و سریعاً به تانک ازت مایع منتقل و برای سنجشهای بعدی با دمای منفی 80 فریزر شد (21).
روش آزمایشگاهی وسترنبلات
از روش وسترنبلات برای سنجش میزان NRF2 و NQO1 در بافت هیپوکمپ مغز استفاده شد که شامل مراحل زیر بود (22):
1. لیز کردن بافت: برای لیز کردن بافت¬ها از Lysis buffer با ترکیب زیر استفاده شد و سپس نمونهها در سانتریفیوژ مدل Eppendorph 5415 R در دمای چهار درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند. مایع شفاف (Supernatant) حاوی پروتئین استخراج و در فریزر منفی 20 نگهداری شد.
2. تعیین غلظت پروتئین بهوسیله برد فورد: برای ساخت محلول بردفورد کوماسی بلو کاملاً در الکل به مدت 20 دقیقه حل گردید، سپس اسیدفسفوریک قطرهقطره به آن اضافه شد. سپس آب را قطرهقطره اضافه کرده تا محلول حاصل به حجم 50 میلیلیتر رسید. محلول تهیهشده با کاغذ صافی دو بار صافشده و در بطری تیره داخل یخچال نگهداری شد.
3. تهیه غلظتهای مختلف BSAبرای کشیدن منحنی استاندارد: ازBSA به عنوان پروتئین استاندارد برای اندازهگیری میزان پروتئین استفاده میشود. غلظتهای 0/25، 0/5، 1، 0/15، 0/3، 0/6، 0/125 از پروتئین استاندارد با افزودن نصف حجم آب به غلظت قبلی ساخته شد.
4. آمادهسازی نمونه: نمونههای پروتئینی تهیهشده قبل از ریختهشدن در چاهک میبایست هم غلظتشده و با بافر نمونه مخلوط و به مدت 5 تا 10 دقیقه در آب 100 درجه سانتیگراد جوشانده شود. این بافر موجب سنگینشدن، احیا و خطیشدن پروتئینها میشود علاوه برآن برموفنول بلو موجود در بافر طریقه حرکت پروتئینها را در ژل نشان میدهد.
5. ساخت الکتروفورز بر روی ژل SDS page: ژل SDS page از پلیمرآکریل آمید ساخته شده است که بیس آکریلآمید این پلیمر را بهصورت عرضی به هم مرتبط کرده است. بهگونهای که منافذ با قطر معین و یکسان در ژل حاصل میشود. پلیمریزاسیون ژل با افزودن آمونیوم پرسولفات (APS) شروعشده و با اضافهکردن تترامتیاتیلندیآمین (TEMED) tetramethyethylenediamine موجب تشکیل رادیکالهای آزاد از APS شده که این رادیکالها باعث پلیمریزاسیون میشود.
6. روش انجام آزمایش و ساختن ژل پایین و بالا: برای دورگیری ژل، 1000 میکرولیتر از ژل پایین کاملاً فاقد تمد را برداشته و به آن 4 میکرولیتر تمد اضافه شد. سپس محلول حاصل را به سرعت از گوشههایی از فضایی دو ژل ریخته شد، بعد از دورگیری 15 دقیقه، فرصت داده شد تا کاملاً بگیرد و سپس محلول ژل کامل به همراه تمد را برداشته بهوسیله سمپلر در فضایی بین دو شیشه ریخته بهطوری که تا دوسوم شیشهها پر شد. سپس مقداری اتانول اشباع شده اسپری کرده تا مانع خشک شدن ژل شود و به علت سنگینی حاصل از آن سطح ژل صاف شد. حدود 45 دقیقه برای پلیمریزاسیون ژل پایین لازم است و در این مرحله ژل بالا 5 درصد آماده شد.
7. الکتروفورز بر ژِل SDS page: شیشههای حاوی ژِل، درون تانک الکتروفورز قرار داده شدند. بافرالکتروفورز اضافه گردیدوسپس ابتدا مارکر پروتئین رنگی (دارای پروتئینهایی با وزن مولکولی مشخص است که رنگی میباشد و از ژل به کاغذ منتقل میشود) به میزان دو میکرولیتر در چاهک اول و نمونهها در سایر چاهکها به میزان 12 میکرولیتر توسط سرنگ همیلتون لود شد. سپس الکترودها را به دستگاه مولد جریان وصل کرده و تا رسیدن پروتئینها به ژل پایین، حدود 45 دقیقه جریان با ولتاژ 120 برقرار شد.
8. وسترن بلات یا ایمنوبلاتینگ: ایﻤﻨﻮﺑﻼﺗﯿﻨﮓ روﺷﯽ اﺳﺖ ﮐﻪ ﻃﯽ آن ﺑﺎﻧﺪﻫﺎی ﭘﺮوﺗﺌﯿﻨﯽ ﺟﺪا ﺷﺪه ﺗﻮﺳﻂ ژل اﻟﮑﺘﺮوﻓﻮرز به ﻏﺸﺎیﯽ از ﺟﻨﺲ ﻧﯿﺘﺮو ﺳﻠﻮﻟﻮز یﺎ PVDF اﻧﺘﻘﺎل یﺎﻓﺘﻪ و ﺳﭙﺲ ﺑﻪوﺳﯿﻠﻪ آﻧﺘﯽﺑﺎدی اﺧﺘﺼﺎﺻﯽ ﭘﺮوﺗﺌﯿﻦﻫﺎی روی آن ﺷﻨﺎﺳﺎیﯽ ﻣﯽﺷﻮد. اﻧﺘﻘﺎل ﻧﻤﻮﻧﻪﻫﺎ از ژل ﺑﻪ ﮐﺎﻏﺬ ﺗﻮﺳﻂ ﺟﺮیﺎن اﻟﮑﺘﺮیﮑﯽ صورت گرفت. بعد از اتمام الکتروفورز ژل به آرامی از شیشه¬ها جداشده و در بافر انتقال قرار گرفت. سپس کاغذ PVDF به اندازه ژل بریدهشده و برای فعالشدن به مدت 1 دقیقه در متانول شیکشده و با آب مقطر شسته شد و درون بافر انتقال قرار گرفت. در حین قرار دادن کاغذ صافی روی کاغذ PVDF و کاغذ PVDF روی ژل، حبابهایی ایجادشده توسط حرکت آهسته اسپیسر روی کاغذ صافی خارج گردید. در نهایت دستگاه با ولتاژ 120 میلی ولت به مدت یک ونیم ساعت به منبع مولد جریان متصل گشته و پروتئینهای موجود در ژل به کاغذ منتقل گردید.
9. مرحله بلاکینگ: در مرحله بلاکینگ، محلول بلاکینک به منظور پوشاندن کاغذ برای جلوگیری از واکنش غیراختصاصی آنتیبادی اولیه به کار میرود.
10. مرحله انکوبه کردن با آنتیبادی اولیه و ثانویه: پس از پایان یافتن زمان بلاکینگ کاغذ با آنتیبادی اولیهای که با محلول بلاکینگ به مقدار معین آنتیبادی اولیه بتا-اکتین (anti-β-Actin (C4) (sc-47778)) مخلوط و رقیق شده، به مدت 16 تا 18 ساعت انکوبه گردید. سپس کاغذ با آنتیبادی ثانویه با غلظت (1:1000) برای تمام آنتیبادی های اولیه به مدت یک ساعت و 15 دقیقه در دمای اتاق شیک شد.
11. مرحله آشکارسازی: پس از شستوشوی نهایی مرحله قبل آب اضافی کاغذ PVDF روی سلفون قرار گرفت و محلول کمولومینسانس با سمپلر روی نواحی باند مورد نظر ریخته شد. کاغذ در سلفون گذاشته شد و درون کاست فیلم قرار داده شد. برای مشاهده باند پروتئینی مورد نظر فیلم عکاسی را بر کاغذ دارای پوشش نایلونی گذاشته و در کاست بسته شد. مدت زمان باقی ماندن فیلم در کاست به نوع آنتیبادی و شدت نور دیده شده از باند پروتئینی بستگی داشت. در مورد آنتیبادیهای anti-NRF2 (A-10) (sc-365949) ساخت شرکت Santa-Cruz و (Sc-56053) anti-NQO1 ساخت شرکت البساینسElabscience ، 60 تا 80 ثانیه و در مورد آنتیبادی بتا-اکتین 10، ثانیه زمان مناسبی بود. سپس در تشتک آب فیلم را به مدت 20 ثانیه شسته و بعد از آن به مدت 20 ثانیه در محلول ثبوت تکان داده شد. سپس مجدداً فیلم را با آب جاری شسته و با گیره آویزان کرده تا خشک شدند.
تجزیه و تحلیل آماری
نرمال بودن دادهها از طریق آزمون آماری شاپیروویلک بررسی شد. با توجه به نرمال بودن دادهها، از آزمون پارامتریک آنوای یکطرفه و در صورت معنیداری از آزمون تعقیبی توکی جهت بررسی میانگینها و جهت گزارش اندازه اثر (Effect Size) از آزمون مربع اِتا (Eta Squared) استفاده شد. بررسی دادهها، با استفاده از نرمافزارهای version 16 SPSS و گرافپد پریسم نسخه 3/2/10 انجام گرفت. سطح معناداری پژوهش حاضر، P≤0/05در نظر گرفته شده است. نمودارها از طریق نرمافزار گرافپد پریسم نسخه 3/2/10 طراحی شد.
نتایج
بعد از تجزیه و تحلیل دادهها، نتایج نشان داد که 8 هفته تمرین مقاومتی همراه با مصرف مکمل Q10 منجر به تغییر معنیداری در محتوای پروتئین NRF2 میشود (0/64=ƞ2، P≤0/03،4/80=F). نتایج آماری تعقیبی توکی نشان داد این تغییر معنیدار بین جفت گروههای تمرین مقاومتی و گروه مکمل Q10 است (0/04≥p) (شکل 1، A و B). در مقابل بین جفتگروههای تمرین مقاومتی (0/23≥p)، تمرین مقاومتی+مکمل Q10 (P≤0/32) و گروه مکمل Q10 (P≤0/65) نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل Q10 (P≤0/99) و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل Q10 تفاوت معنیداری مشاهده نشد (0/06≥p) (شکل 1، A و B). آزمون مربع اِتا (ƞ2) برای اندازهگیری اندازه اثر محتوای پروتئین NRF2، اثری متوسط را نشان داد (0/64=ƞ2)؛ با توجه به اندازه اثر به دست آمده میتوان گفت که انجام تمرینهای مقاومتی همراه با مصرف Q10 تفاوت معنیداری متوسطی بین گروهها دارد و این تفاوت فقط بین گروه تمرین مقاومتی و گروه مکمل Q10 بود (شکل 1، A و B).
از طرفی نتایج نشان داد که 8 هفته تمرین مقاومتی همراه با مصرف Q10 منجر به تغییر معنیداری در محتوای پروتئین NQO1 نمیشود (ƞ2= 0/33، 0/09≥p، F=3/01). نتایج آماری تعقیبی توکی بین جفتگروههای تمرین مقاومتی (0/34≥p)، تمرین مقاومتی+مکمل (0/64≥p)، Q10 و گروه مکمل (0/76≥p)، Q10 نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل (0/93≥p) Q10 ، بین جفت گروههای تمرین مقاومتی و گروه مکمل(0/09≥p) Q10 و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل(0/21≥p) Q10 تفاوت معنیداری مشاهده نشد (شکل 2، A و B). آزمون مربع اِتا (ƞ2) برای اندازهگیری اندازه اثر محتوای پروتئین NQO1، اثری ضعیفی را نشان داد (0/33=ƞ2)؛ با توجه به اینکه اندازه اثر به دستآمده میتوان گفت که انجام تمرینهای مقاومتی همراه با مصرف Q10 تفاوت معنیداری ضعیفی بین گروهها دارد و این تفاوت بین همه جفت گروه ها قابل مشاهده است (شکل 2، A و B).

شکل 1: مقایسه محتوای پروتئین NRF2 در گروههای مختلف پژوهش.
A، تصاویر وسترنبلات محتوای پروتئین NRF2 و β-actin به عنوان لودینگ کنترل (کنترل داخلی) در بافت هیپوکمپ مغز. B، نمودار ستونی نشان دهنده مقادیرکمی شده باندهای پروتئین NRF2 در مقابل لودینگ کنترل.
( وجود تفاوت معنیدار بین گروه مکمل Q10 نسبت به گروه تمرین مقاومتی)

شکل 2: مقایسه محتوای پروتئین NQO1 در گروههای مختلف پژوهش. A، تصاویر وسترنبلات محتوای پروتئین NQO1 و β-actin به عنوان لودینگ کنترل (کنترل داخلی) در بافت هیپوکمپ مغز. B، نمودار ستونی نشان دهندهی مقادیرکمی شده باندهای پروتئین NQO1 در مقابل لودینگ کنترل.
بحث
این مطالعه با هدف بررسی تأثیر تمرین مقاومتی همراه با مکملیاری کوآنزیم Q10 بر محتوای درون سلولی پروتئینهای NRF2 و NQO1در بافت هیپوکمپ موشهای صحرایی نر نژاد اسپراگداولی انجام شد؛ نتایج نشان داد که 8 هفته تمرین مقاومتی همراه با مصرف مکمل Q10 منجر به تغییر معنیداری در محتوای پروتئین NRF2 میشود. این تغییر معنیدار تنها بین جفت گروههای تمرین مقاومتی و گروه مکمل Q10 بود. در مقابل بین جفتگروههای تمرین مقاومتی، تمرین مقاومتی+مکمل Q10 و گروه مکمل Q10 نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل Q10 و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل Q10 تفاوت معنیداری مشاهده نشد. همچنین تغییر معنیداری در محتوای پروتئین NQO1 بین گروهها مشاهده نشد. بین جفتگروههای تمرین مقاومتی، تمرین مقاومتی+مکمل Q10 و گروه مکمل Q10 نسبت به گروه کنترل تفاوت معنیداری مشاهده نشد؛ همچنین بین گروههای تمرین مقاومتی نسبت به گروه تمرین مقاومتی+مکمل Q10، بین جفت گروههای تمرین مقاومتی و گروه مکمل Q10 و بین جفتگروههای تمرین مقاومتی+مکمل Q10 نسبت به گروه مکمل Q10 تفاوت معنیداری مشاهده نشد. سیستم سلولیملکولی NRF2/NQO1 بهطور گسترده در دستگاه عصبی مرکزی بیان میشود و در پاسخ به بیماریهای حاد مغزی و بیماریهای مزمن عصبی تعدیل میشود. فاکتورهای NRF2 و NQO1، تنظیمکنندههای مهم التهاب در مغز هستند. اختلال در تنظیم این مکانیسمها به آسیب مغزی کمک میکند (23). تمرین ورزشی منظم منجر به اثرات مفیدی بر سیستم عصبی مرکزی میشود. در این راستا در مطالعهای Monir و همکاران درسال 2020 تاثیر فعالیت ورزشی بر مسیر NRF2 در موشهای مبتلا به پارکینسون مورد بررسی قرار دادند. در این تحقیق مشخص گردید که فعالیت ورزشی بیان برخی از ژنهای مسیر NRF2 از قبیلTFAM ، NRF2 و NQO1 را افزایش میدهد. این محققان بیان کردند فعالیت ورزشی توانست اکثر جنبه¬های رفتاری بیماری پارکینسون، نحوه صحیح راه رفتن، حافظه کوتاهمدت و هماهنگی حرکتی را اصلاح کند و فعالیت ورزشی با فعالکردن مسیر NRF2 باعث بهبود ویژگی¬های بیماران پارکینسونی میشود (24). همچنین در تحقیقی دیگر Xie و همکاران در سال 2024 نشان دادند که تمرین ورزشی روی تردمیل باعث افزایش بیان فاکتور هستهای NRF2 و NQO1 در هیپوکامپ موشهای صحرایی میشود. این محققان بیان کردند که تمرین ورزشی هوازی پتانسیل جلوگیری از استرس اکسیداتیو و مرگ سلولی در میتوکندری را از طریق مدولاسیون مسیر سیگنالینگ NRF2/GSK3β دارد؛ بنابراین اختلالشناختی مشاهدهشده در مدل موشهای صحرایی پیر را بهبود میبخشد. همچنین بیان کردند بهنظر میرسد که تمرین ورزشی هوازی میتواند بهطور بالقوه به عنوان یک رویکرد درمانی موثر برای کاهش پیری مغز و بیماریهای عصبی ناشی از استرس اکسیداتیو باشد (25). نتایج دو تحقیق (Monir و همکاران و Xie و همکاران) نشان میدهد که بیان ژن NRF2 و NQO1 به دنبال انجام تمرینهای ورزشی هوازی افزایش مییابد و این افزایش را به بهبود عملکردهای مغزی مانند حافظه کوتاهمدت و هماهنگی حرکتی نسبت دادهاند. نتایج تحقیق حاضر یک افزایش غیرمعنادار را به دنبال انجام تمرین مقاومتی نشان داد. از تفاوتهای تحقیق حاضر با ویژگیهای دو تحقیق گزارششده در بالا میتوان به نوع تمرین اشاره کرد و آن را یکی از شرایط مهم این تفاوت در معنیداری و غیرمعنیداری افزایش NRF2 و NQO1 دانست. ماهیت تمرینهای مقاومتی با تمرینهای هوازی در بحث فیزیولوژیایی بسیار متفاوت است و این تفاوت میتواند بر مسیرهای سلولیملکولی تاثیرگذار باشد. از عوامل مهم دیگر نوع روش اندازهگیری پروتئینهای NRF2 و NQO1 میباشد. در راستای این تفاوت در نوع تمرین، در تحقیقی دیگر Tutakhail و همکاران در سال 2018 نشان دادند که تمرین هوازی شدید و طولانی، محتوای NRF2 را در هیپوکمپ افزایش میدهد. تمرینهای ورزشی شامل دویدن روی تردمیل با سه شدت مختلف بود. این محققان بیان کردند که تمرین ورزشی با اِلقای مسیر سیگنالینگ آنتیاکسیدانی NRF2/HO-1، درد و التهاب را کاهش میدهد (26). همچنین در تحقیقی Done و همکاران (2016) به بررسی سیگنالینگ NRF2 و NQO1 به دنبال انجام تمرین ورزشی هوازی دوچرخهسواری 30 دقیقه با 70 درصد VO2max در افراد جوان و مسن پرداختند. افزایش قابلتوجهی در بیان NRF2 و NQO1 مشاهده شد. این محققان بر اساس نتایج خود گزارش کردند که یک جلسه تمرین هوازی زیربیشینه برای فعالکردن NRF2 در سطح کل سلول در بزرگسالان جوان و مسن کافی است؛ همچنین بیان کردند محلیسازی هستهای NRF2 منجر به افزایش محتوای پروتئینهای مربوط به پاییندست، از جمله HO-1 و NQO1 میشود (27). همانطور که گزارش شد ما شاهد افزایش محتوای پروتئینهای NRF2 و NQO1 بودیم، اما این افزایش معنیدار نبود و این در حالی است که در نتایج تحقیقهایTutakhail و همکاران و Done و همکاران محتوای پروتئینهای NRF2 و NQO1 افزایش معنیداری را نشان دادند. علاوه بر تفاوت در نوع تمرینهای گزارش شده در مطالعات بالا، دیگر شرایط تمرینی مانند شدت، مدت، تعداد تکرارها، ستها و زمان ریکاوری میتواند در نتایج تحقیقها نسبت به تحقیق حاضر تاثیرگذار باشد. در تحقیق حاضر تمرین ورزشی به صورت مقاومتی و بالا رفتن از پله توسط موشهای صحرایی بود و در تحقیقهای دیگر شامل دویدن رتها روی تردمیل به صورت تداومی و تناوبی و همچنین انجام تمرینهای ورزشی روی آزمودنیهای انسانی بهصورت کار بر روی دوچرخه ارگونومتر با شدت متوسط بود. شرایطهای تمرینی بر روی مسیرهای سلولی میتواند نتایج متناقضی را نشان دهد و نتایج مطالعات گزارششده نشان میدهد که تمرینهای هوازی میل به افزایش محتوا و بیان ژن NRF2 و NQO1 دارد. شواهد در حال رشد اثرات مثبت فعالیتهای ورزشی حاد و مزمن بر سیستم ردوکس و اثرات مفید آنها بر سلامت را نشان دادهاند (23). مطالعات متعددی پیشنهاد کردهاند که هم تمرینهای مقاومتی و هم تمرینهای استقامتی میتواند با افزایش تشکیل گونههای واکنشی (ROS/NRS) منجر به اِختلال در هُموستاز ردوکس سلولی شود. با این وجود اگرچه نشان دادهشده است که فعالیتهای ورزشی NRF2 را نیز فعال میکنند؛ اما تفاوتهای بسیاری در شرایط آزمودنیها و همچنین نوع، شدت و مدت زمان تمرین ورزشی وجود دارد (23،28،29). علاوه بر این، در تحقیقی دیگر نشان داده شده است که میزان فعالسازی NRF2 نیز به شدت فعالیتهای ورزشی بستگی دارد (30). در اِرتباط با مِکانیسمهای سلولی مرتبط با پروتئین NRF2 در مغز میتوان گفت، استرس و آسیباکسیداتیو با تخریب نورونی منجر به بیماریهای متعددی شامل بیماری آلزایمر، پارکینسون و هانتینگتون میشوند (31). مسیر سلولی NRF2-ARE یک مسیر تنظیمکننده اصلی برای استرسهای اکسیداتیو میباشد، که توانایی تعدیل بیان ژنهای آنتیاکسیدان و سمزدایی را دارد. این مسیر در تنظیم حالت ردوکس سلولی نقش کلیدی دارد. تحت شرایط هوموستاتیک طبیعی، فاکتور رونویسی NRF2 در سیتوپلاسم به وسیله عامل سلولی Keapl مهار میشود، که به محض برخورد با ROS، فاکتور NRF2 از مهارکننده Keap1 جداشده و به درون هسته انتقال مییابد و در آنجا به ARE در ناحیه پروموتور ژنهای کدکننده آنزیمهای آنتیاکسیدان متصل میشود؛ این فرآیند منجر به تولید آنزیمهای آنتیاکسیدانی درونی میشود (32). آنزیمهای آنتیاکسیدانی فعالشده توسط پروتئین NRF2 میتواند شامل سوپراکسید دسموتاز (SOD)، کاتالاز، پراکسیردوکسین و غیره باشند که در مقابله با ROS نقش مهمی دارند (33). از سوی دیگر بررسی رابطه فعالیت ورزشی و استرس اکسیداتیو مشخص کرده است که فعالیتهای ورزشی منظم سبب کاهش استرس اکسیداتیو و افزایش آنتیاکسیدانها میشود و در مجموع التهاب کاهش مییابد. از مباحث مهم در علوم ورزشی استفاده از آنتیاکسیدانهای رژیم غذایی بهخصوص در شکل مکمل است که با هدف کاهش استرس اکسیداتیو در فعالیتهای ورزشی مورد استفاده قرار میگیرد. عدم وضوح یافتههای تحقیقاتی میتواند این سؤال را ایجاد کند که آیا مکمل آنتیاکسیدانی در هنگام فعالیت¬های ورزشی یا منظم به تنهایی اثرات مثبت یا منفی دارد؟ (34). در این راستا در پژوهشی توسطPala و همکاران در سال 2016 تاثیر شش هفته فعالیت ورزشی و مکمل کوآنزیم Q10 بر مسیرهای NRF2 بررسی شد و مشخص گردید که Q10 بیان NRF2 و دیگر عوامل مرتبط را از طریق فعالیت ورزشی افرایش میدهد که این نشاندهنده اثر ضد التهابی Q10 است و بر نقش آن در دفاع آنتیاکسیدانی تأکید دارد (20). در تحقیقی بالینی صمیمی و همکاران در سال 2024 به بررسی مکمل Q10 بر مسیر سیگنالینگ NRF2/Keap1/HO-1/NQO1 در کبد موشهای دیابتی پرداختند. بیان NRF2 وNQO1 در گروه دیابتی+ مکمل Q10 نسبت به گروه کنترل دیابتی افزایش معنیداری را نشان داد، اما نسبت به گروه کنترل سالم کاهش (غیرمعیندار) یافته بود. این محققان براساس نتایج خود بیان کردند مکمل Q10 میتواند ظرفیت آنتیاکسیدانی بافت کبد در موشهای دیابتی را با تعدیل مسیر سیگنالینگ Nrf2/Keap1/HO-1/NQO1 افزایش دهد (35). در تحقیقی دیگر Zou و همکاران در سال 2023 به بررسی تریمتیل آمین N-اکسید (TMAO) Trimethylamine N-oxide بر بیان NRF2 و NQO1 در موشهای صحرایی نر به دنبال انجام تمرین ورزشی شنا پرداختند. نتایج نشان میدهد که TMAO با افزایش بیان NRF2 و NQO1 بهطور قابلتوجهی از میوبلاستها در برابر آسیب ناشی از استرس اکسیداتیو محافظت میکند. این تحقیق بینش جدیدی در مورد توانایی عوامل مهم برای کاهش استرس اکسیداتیو ناشی از تمرینهای ورزشی از طریق مسیر سیگنالینگ NRF2 ارائه میدهد و چارچوبی ارزشمند برای توسعه مکملهای غذایی ورزشی با هدف کاهش استرس اکسیداتیو ارائه میدهد (36). نتایج هر سه تحقیق بالا در حوزه فیزیولوژی ورزشی و بالینی نشان میدهد که مصرف مکمل آنتیاکسیدانی Q10 میتواند سطوح NRF2 و NQO1 را افزایش دهد. نتایج تحقیق حاضر یک افزایش غیرمعنیدار را در گروه تمرین مقاومتی+مکمل Q10 در محتوای پروتئینهای NRF2 و NQO1 نشان میدهد. البته شایان ذکر است که ما شاهد افزایش در گروه مکمل نسبت به دیگر گروهها نیستم و نتایج تحقیق حاضر یک افزایش معنیدار را بین گروه تمرینی مقاومتی نسبت به گروه مکمل Q10 در محتوای پروتئین NRF2 نشان داد. بر اساس نتایج تحقیق حاضر انجام تمرین مقاومتی همراه با مصرف مکمل Q10 بهصورت ترکیبی یا به تنهایی نمیتواند محتوای پروتئینهای NRF2 و NQO1 را در هیپوکمپ مغز تغییر معنیداری دهد. علاوه بر شرایط تمرینی که در بالا ذکر شد مانند تفاوت در نوع تمرین، شدت، مدت، تعداد تکرارها، ستها و زمان ریکاوری و همچنین نوع روشهای اندازهگیری آزمایشگاهی، مکان بافت مورد هدف برای سنجش میزان پروتئینها میتواند در نتایج تاثیرگذار باشد. با این حال نشان داده شده است که مکمل Q10 با تنظیم پروتئین NQO1 میتواند از آسیبهای سلولی جلوگیری کند. به عبارتی دیگر مکمل Q10 میتواند پروتئین NQO1 را فعال کند (37). با این حال در ارتباط با تاثیرگذاری مصرف مکمل Q10 در مغز مشخصشده است که مکمل Q10 با توجه به خاصیت آنتیاکسیدانی که دارد در درمان و کاهش بسیاری از بیماریهای مرتبط با مغز مانند بیماری آلزایمر، بیماری پارکینسون، بیماری هانتینگتون، اسکلروز جانبی آمیوتروفیک و ... مفید است (38).
نتیجهگیری
نتایج تحقیق حاضر تفاوت معنیدار قابلتوجهی بین گروهها نشان نداد و فقط یک افزایش معنیدار بین گروه تمرین مقاومتی نسبت به گروه مکمل Q10 مشاهده شد؛ بنابراین بر اساس نتایج تحقیق حاضر میتوان گفت که انجام تمرین مقاومتی همراه با مصرف مکمل Q10 به مدت 8 هفته به تنهایی یا به صورت ترکیبی نمیتواند تاثیر بسزایی بر محتوای پروتئینهای NRF2 و NQO1 در بافت هیپوکمپ موشهای صحرایی داشته باشد. با این وجود روش وسترنبلات، یک روش کیفی مرتبط با گزارش تصویر است و در این قبیل مطالعات نمیتوان به تنهایی بر اساس نتایج آماری به تفسیر و مقایسه پرداخت. برای روشنشدن مکانیسم تاثیرگذاری تمرین مقاومتی باید شرایط برنامه تمرینی مانند شدت، مدت، تکرار، ستها و دیگر شرایط برنامه تمرینی را مد نظر قرار داد؛ همچنین باید دیگر دوزهای استاندارد مصرف مکمل کوآنزیم Q10 مورد بررسی بیشتر قرار گیرد.
سپاسگزاری
نتایج این تحقیق حاصل انجام رساله دکتری در گروه فیزیولوژی ورزش پردیس بینالمللی ارس دانشگاه تهران بوده است و از تمامی افرادیکه در این امر مهم مارا پشتیبانی کردند، کمال تشکر را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط گروه فیزیولوژی پردیس بینالمللی ارس دانشگاه تهران تایید شده است و دارای کد اخلاق IR.IAU.B.REC.1401.030 می باشد.
مشارکت نویسندگان
تمامی نویسندگان در ارائه ایده، طراحی مطالعه، جمعآوری دادهها، تجزیه و تحلیل دادهها به یک اندازه مشارکت داشته و همچنین در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سئوالات مرتبط با مقاله سهیم می باشند.
References:
1- Gulcin İ. Antioxidants and Antioxidant Methods: an Updated Overview. Arch Toxicol 2020; 94(3):651-715.
2- Forman HJ, Ursini F, Maiorino M. An Overview of Mechanisms of Redox Signaling. J Mole Cell Cardiol 2014; 73: 2-9.
3- Zhou S, Sun W, Zhang Z, Zheng Y. The Role of Nrf2-Mediated Pathway in Cardiac Remodeling and Heart Failure. Oxid Med Cell Longev 2014; 2014: 260429.
4- Avandi, S., Hagh Shenas, R., Abbasi, S. The Effects of Eight Weeks of Concurrent Training on Plasma Levels of NRF2 in Young Men. J Appl Health Studi Sport Physiol 2018; 5(2): 78-83.
5- Bellezza I, Giambanco I, Minelli A, Donato R. Nrf2-Keap1 Signaling in Oxidative and Reductive Stress. Biochim Biophys Acta Mol Cell Res 2018; 1865(5):721-33.
6- Vargas-Mendoza N, Morales-González Á, Madrigal-Santillán EO, Madrigal-Bujaidar E, Álvarez-González I, García-Melo LF, et al. Antioxidant and Adaptative Response Mediated by Nrf2 During Physical Exercise. Antioxidants 2019; 8(6): 196.
7- Narasimhan M, Rajasekaran NS. Exercise, Nrf2 and Antioxidant Signaling in Cardiac Aging. Front Physiol 2016; 7: 241.
8- Dinkova-Kostova AT, Talalay P. NAD (P) H: Quinone Acceptor Oxidoreductase 1 (NQO1), A Multifunctional Antioxidant Enzyme and Exceptionally Versatile Cytoprotector. Arch Biochem Biophys 2010; 501(1): 116-23.
9- Ross D, Siegel D. The Diverse Functionality of NQO1 and Its Roles in Redox Control. Redox Biol 2021; 41: 101950.
10- Navas P, Cascajo MV, Alcázar‐Fabra M, Hernández‐Camacho JD, Sánchez‐Cuesta A, Rodríguez AB, et al. Secondary Coq10 Deficiency, Bioenergetics Unbalance in Disease and Aging. Biofactors 2021; 47(4): 551-69.
11- Saeed A, Qusti SY, Almarwani RH, Jambi EJ, Alshammari EM, Gusty NF, et al. Effects of Aluminum Chloride and Coenzyme Q10 on the Molecular Structure of Lipids and the Morphology of The Brain Hippocampus Cells. RSC Adv 2021; 11(48): 29925-33.
12- Kashef M, Salehpour M, Shahidi F, Sadegh Ghomi M. The Effect of Eight-Week Resistance Training on BAX and BCL2 of Hippocampus Tissue in Male Rats. Daneshvar Med 2021; 29(4): 11-21.
13- Preston AR, Eichenbaum H. Interplay of Hippocampus and Prefrontal Cortex in Memory. Curr Biol 2013; 23(17):764-73.
14- Wang Y, Chen S, Liu J, Lv P, Cai D, Zhao G. Efficient production of coenzyme Q 10 from acid hydrolysate of sweet sorghum juice by Rhodobacter sphaeroides. RSC Adv 2019; 9(39):22336-42.
15- Kim BK, Shin MS, Kim CJ, Baek SB, Ko YC, Kim YP. Treadmill Exercise Improves Short-Term Memory by Enhancing Neurogenesis in Amyloid Beta-Induced Alzheimer Disease Rats. J Exerc Rehabil 2014; 10(1): 2-8.
16- Mazzola PN, Terra M, Rosa AP, Mescka CP, Moraes TB, Piccoli B, et al. Regular Exercise Prevents Oxidative Stress in the Brain of Hyperphenylalaninemic Rats. Metab Brain Dis 2011; 26(4): 291-7.
17- Rafati Bonab M, Bashiri J, Poozesh Jadidi R, Pourrazi H. Effect of HIIT and Q10 Supplementation on Soleus Muscle PGC-1α Level Citrate Synthase Activity in Obese Male Rats. Sport Physiol 2021; 13(50): 111-36.
18- Avandi S, Hagh Shenas R, Abbasi S. The Effects of Eight Weeks of Concurrent Training on Plasma Levels of NRF2 in Young Men. J Appl Health Stu Sport Physiol 2018; 5(2): 78-83.
19- Ahmadi F, Ghanbar Zadeh M, Habibi AH, Karimi F. Effect of Resistance Training with Spirulina Platensis on PI3K/Akt/Mtor/P70s6k Signaling Pathway in Cardiac Muscle. Sci Sports 2020; 35(2):91-8.
20- Pala R, Orhan C, Tuzcu M, Sahin N, Ali S, Cinar V, et al. Coenzyme Q10 Supplementation Modulates Nfκb and Nrf2 Pathways in Exercise Training. J Sports Sci Med 2016; 15(1): 196-203.
21- Sherafati Moghadam M, Salesi M, Daryanoosh F, Hemati Nafar M, Fallahi A. The Effect of 4 Weeks of High Intensity Interval Training on the Content of AKT1, Mtor, P70S6K1 and 4E-BP1 in Soleus Skeletal Muscle of Rats with Type 2 Diabetes: An Experimental Study. J Rafsanjan Univ Med Sci 2018; 17(9): 843-54.
22- Shadmehri S, Sherafati Moghadam M, Daryanoosh F, Jahani Golbar SH, Tanideh N. The Effect 8 Weeks of Endurance Exercise on the Content of Total and Phosphorylated AKT1, Mtor, P70S6K1 and 4E-BP1 in Skeletal Muscle FHL of Rats with Type 2 Diabetes. J Shahid Sadoughi Uni Med Sci 2019; 26(9): 1059-70.
23- Souza J, da Silva RA, da Luz Scheffer D, Penteado R, Solano A, et al. Physical-Exercise-Induced Antioxidant Effects on the Brain and Skeletal Muscle. Antioxidants 2022; 11(5): 826.
24- Monir DM, Mahmoud ME, Ahmed OG, Rehan IF, Abdelrahman A. Forced Exercise Activates The Nrf2 Pathway in the Striatum and Ameliorates Motor and Behavioral Manifestations of Parkinson's disease in Rotenone-Treated Rats. Behav Brain Funct 2020; 16(1): 1-9.
25- Xie G, Xu Z, Li F, Kong M, Wang P, Shao Y. Aerobic Exercise Ameliorates Cognitive Disorder and Declined Oxidative Stress Via Modulating the Nrf2 Signaling Pathway in D-Galactose Induced Aging Mouse Model. Neurochem Res 2024:1-5.
26- Tutakhail A, Nazary QA, Lebsir D, Kerdine-Romer S, Coudore F. Induction of Brain Nrf2-HO-1 Pathway and Antinociception after Different Physical Training Paradigms in Mice. Life Sci 2018; 209:149-56.
27- Done AJ, Newell MJ, Traustadóttir T. Effect of Exercise Intensity on Nrf2 Signalling in Young Men. Free Radic Res 2017; 51(6): 646-55.
28- Merry TL, Ristow M. Nuclear Factor Erythroid‐Derived 2‐Like 2 (NFE2L2, Nrf2) Mediates Exercise‐Induced Mitochondrial Biogenesis and the Anti‐Oxidant Response in Mice. J physiol 2016; 594(18): 5195-207.
29- Scheffer DL, Silva LA, Tromm CB, da Rosa GL, Silveira PC, de Souza CT, et al. Impact of Different Resistance Training Protocols on Muscular Oxidative Stress Parameters. Appl Physiol Nutr Metab 2012; 37(6):1239-46.
30- Done AJ, Gage MJ, Nieto NC, Traustadóttir T. Exercise-Induced Nrf2-Signaling is Impaired in Aging. Free Radic Biol Med 2016; 96: 130-8.
31- Lichtenthaler SF, Haass C, Steiner H. Regulated Intramembrane Proteolysis--Lessons from Amyloid Precursor Protein Processing. J Neurochem 2011; 117(5): 779-96.
32- Abraki SB, Chavoshi-Nezhad S. Alzheimer’s Disease: The Effect of Nrf2 Signaling Pathway on Cell Death Caused by Oxidative Stress. Neur J Shefaye Khatam 2014; 3: 145-56.
33- Gan L, Johnson JA. Oxidative Damage and the Nrf2-ARE Pathway in Neurodegenerative Diseases. Biochim Biophys Acta 2014; 1842(8): 1208-18.
34- Taherkhani S, Valaei K, Arazi H, Suzuki K. An Overview of Physical Exercise and Antioxidant Supplementation Influences on Skeletal Muscle Oxidative Stress. Antioxidants 2021; 10(10):1528.
35- Samimi F, Baazm M, Nadi Z, Dastghaib S, Rezaei M, Jalali-Mashayekhi F. Evaluation of Antioxidant Effects of Coenzyme Q10 against Hyperglycemia-Mediated Oxidative Stress by Focusing on Nrf2/Keap1/HO-1 Signaling Pathway in the Liver of Diabetic Rats. Iranian J Med Sci 2024; 1-13.
36- Zou H, Zhou Y, Gong L, Huang C, Liu X, Lu R, et al. Trimethylamine N-Oxide Improves Exercise Performance by Reducing Oxidative Stress through Activation of the Nrf2 Signaling Pathway. Mol 2024; 29(4): 759.
37- Ross D, Siegel D. Functions of NQO1 in Cellular Protection and Coq10 Metabolism and Its Potential Role as a Redox Sensitive Molecular Switch. Fron Physiol 2017; 8: 595.
38- Pradhan N, Singh C, Singh A. Coenzyme Q10 a Mitochondrial Restorer for Various Brain Disorders. Naunyn Schmiedebergs Arch Pharmacol 2021; 394(11): 2197-222.
1- Gulcin İ. Antioxidants and Antioxidant Methods: an Updated Overview. Arch Toxicol 2020; 94(3):651-715.
2- Forman HJ, Ursini F, Maiorino M. An Overview of Mechanisms of Redox Signaling. J Mole Cell Cardiol 2014; 73: 2-9.
3- Zhou S, Sun W, Zhang Z, Zheng Y. The Role of Nrf2-Mediated Pathway in Cardiac Remodeling and Heart Failure. Oxid Med Cell Longev 2014; 2014: 260429.
4- Avandi, S., Hagh Shenas, R., Abbasi, S. The Effects of Eight Weeks of Concurrent Training on Plasma Levels of NRF2 in Young Men. J Appl Health Studi Sport Physiol 2018; 5(2): 78-83.
5- Bellezza I, Giambanco I, Minelli A, Donato R. Nrf2-Keap1 Signaling in Oxidative and Reductive Stress. Biochim Biophys Acta Mol Cell Res 2018; 1865(5):721-33.
6- Vargas-Mendoza N, Morales-González Á, Madrigal-Santillán EO, Madrigal-Bujaidar E, Álvarez-González I, García-Melo LF, et al. Antioxidant and Adaptative Response Mediated by Nrf2 During Physical Exercise. Antioxidants 2019; 8(6): 196.
7- Narasimhan M, Rajasekaran NS. Exercise, Nrf2 and Antioxidant Signaling in Cardiac Aging. Front Physiol 2016; 7: 241.
8- Dinkova-Kostova AT, Talalay P. NAD (P) H: Quinone Acceptor Oxidoreductase 1 (NQO1), A Multifunctional Antioxidant Enzyme and Exceptionally Versatile Cytoprotector. Arch Biochem Biophys 2010; 501(1): 116-23.
9- Ross D, Siegel D. The Diverse Functionality of NQO1 and Its Roles in Redox Control. Redox Biol 2021; 41: 101950.
10- Navas P, Cascajo MV, Alcázar‐Fabra M, Hernández‐Camacho JD, Sánchez‐Cuesta A, Rodríguez AB, et al. Secondary Coq10 Deficiency, Bioenergetics Unbalance in Disease and Aging. Biofactors 2021; 47(4): 551-69.
11- Saeed A, Qusti SY, Almarwani RH, Jambi EJ, Alshammari EM, Gusty NF, et al. Effects of Aluminum Chloride and Coenzyme Q10 on the Molecular Structure of Lipids and the Morphology of The Brain Hippocampus Cells. RSC Adv 2021; 11(48): 29925-33.
12- Kashef M, Salehpour M, Shahidi F, Sadegh Ghomi M. The Effect of Eight-Week Resistance Training on BAX and BCL2 of Hippocampus Tissue in Male Rats. Daneshvar Med 2021; 29(4): 11-21.
13- Preston AR, Eichenbaum H. Interplay of Hippocampus and Prefrontal Cortex in Memory. Curr Biol 2013; 23(17):764-73.
14- Wang Y, Chen S, Liu J, Lv P, Cai D, Zhao G. Efficient production of coenzyme Q 10 from acid hydrolysate of sweet sorghum juice by Rhodobacter sphaeroides. RSC Adv 2019; 9(39):22336-42.
15- Kim BK, Shin MS, Kim CJ, Baek SB, Ko YC, Kim YP. Treadmill Exercise Improves Short-Term Memory by Enhancing Neurogenesis in Amyloid Beta-Induced Alzheimer Disease Rats. J Exerc Rehabil 2014; 10(1): 2-8.
16- Mazzola PN, Terra M, Rosa AP, Mescka CP, Moraes TB, Piccoli B, et al. Regular Exercise Prevents Oxidative Stress in the Brain of Hyperphenylalaninemic Rats. Metab Brain Dis 2011; 26(4): 291-7.
17- Rafati Bonab M, Bashiri J, Poozesh Jadidi R, Pourrazi H. Effect of HIIT and Q10 Supplementation on Soleus Muscle PGC-1α Level Citrate Synthase Activity in Obese Male Rats. Sport Physiol 2021; 13(50): 111-36.
18- Avandi S, Hagh Shenas R, Abbasi S. The Effects of Eight Weeks of Concurrent Training on Plasma Levels of NRF2 in Young Men. J Appl Health Stu Sport Physiol 2018; 5(2): 78-83.
19- Ahmadi F, Ghanbar Zadeh M, Habibi AH, Karimi F. Effect of Resistance Training with Spirulina Platensis on PI3K/Akt/Mtor/P70s6k Signaling Pathway in Cardiac Muscle. Sci Sports 2020; 35(2):91-8.
20- Pala R, Orhan C, Tuzcu M, Sahin N, Ali S, Cinar V, et al. Coenzyme Q10 Supplementation Modulates Nfκb and Nrf2 Pathways in Exercise Training. J Sports Sci Med 2016; 15(1): 196-203.
21- Sherafati Moghadam M, Salesi M, Daryanoosh F, Hemati Nafar M, Fallahi A. The Effect of 4 Weeks of High Intensity Interval Training on the Content of AKT1, Mtor, P70S6K1 and 4E-BP1 in Soleus Skeletal Muscle of Rats with Type 2 Diabetes: An Experimental Study. J Rafsanjan Univ Med Sci 2018; 17(9): 843-54.
22- Shadmehri S, Sherafati Moghadam M, Daryanoosh F, Jahani Golbar SH, Tanideh N. The Effect 8 Weeks of Endurance Exercise on the Content of Total and Phosphorylated AKT1, Mtor, P70S6K1 and 4E-BP1 in Skeletal Muscle FHL of Rats with Type 2 Diabetes. J Shahid Sadoughi Uni Med Sci 2019; 26(9): 1059-70.
23- Souza J, da Silva RA, da Luz Scheffer D, Penteado R, Solano A, et al. Physical-Exercise-Induced Antioxidant Effects on the Brain and Skeletal Muscle. Antioxidants 2022; 11(5): 826.
24- Monir DM, Mahmoud ME, Ahmed OG, Rehan IF, Abdelrahman A. Forced Exercise Activates The Nrf2 Pathway in the Striatum and Ameliorates Motor and Behavioral Manifestations of Parkinson's disease in Rotenone-Treated Rats. Behav Brain Funct 2020; 16(1): 1-9.
25- Xie G, Xu Z, Li F, Kong M, Wang P, Shao Y. Aerobic Exercise Ameliorates Cognitive Disorder and Declined Oxidative Stress Via Modulating the Nrf2 Signaling Pathway in D-Galactose Induced Aging Mouse Model. Neurochem Res 2024:1-5.
26- Tutakhail A, Nazary QA, Lebsir D, Kerdine-Romer S, Coudore F. Induction of Brain Nrf2-HO-1 Pathway and Antinociception after Different Physical Training Paradigms in Mice. Life Sci 2018; 209:149-56.
27- Done AJ, Newell MJ, Traustadóttir T. Effect of Exercise Intensity on Nrf2 Signalling in Young Men. Free Radic Res 2017; 51(6): 646-55.
28- Merry TL, Ristow M. Nuclear Factor Erythroid‐Derived 2‐Like 2 (NFE2L2, Nrf2) Mediates Exercise‐Induced Mitochondrial Biogenesis and the Anti‐Oxidant Response in Mice. J physiol 2016; 594(18): 5195-207.
29- Scheffer DL, Silva LA, Tromm CB, da Rosa GL, Silveira PC, de Souza CT, et al. Impact of Different Resistance Training Protocols on Muscular Oxidative Stress Parameters. Appl Physiol Nutr Metab 2012; 37(6):1239-46.
30- Done AJ, Gage MJ, Nieto NC, Traustadóttir T. Exercise-Induced Nrf2-Signaling is Impaired in Aging. Free Radic Biol Med 2016; 96: 130-8.
31- Lichtenthaler SF, Haass C, Steiner H. Regulated Intramembrane Proteolysis--Lessons from Amyloid Precursor Protein Processing. J Neurochem 2011; 117(5): 779-96.
32- Abraki SB, Chavoshi-Nezhad S. Alzheimer’s Disease: The Effect of Nrf2 Signaling Pathway on Cell Death Caused by Oxidative Stress. Neur J Shefaye Khatam 2014; 3: 145-56.
33- Gan L, Johnson JA. Oxidative Damage and the Nrf2-ARE Pathway in Neurodegenerative Diseases. Biochim Biophys Acta 2014; 1842(8): 1208-18.
34- Taherkhani S, Valaei K, Arazi H, Suzuki K. An Overview of Physical Exercise and Antioxidant Supplementation Influences on Skeletal Muscle Oxidative Stress. Antioxidants 2021; 10(10):1528.
35- Samimi F, Baazm M, Nadi Z, Dastghaib S, Rezaei M, Jalali-Mashayekhi F. Evaluation of Antioxidant Effects of Coenzyme Q10 against Hyperglycemia-Mediated Oxidative Stress by Focusing on Nrf2/Keap1/HO-1 Signaling Pathway in the Liver of Diabetic Rats. Iranian J Med Sci 2024; 1-13.
36- Zou H, Zhou Y, Gong L, Huang C, Liu X, Lu R, et al. Trimethylamine N-Oxide Improves Exercise Performance by Reducing Oxidative Stress through Activation of the Nrf2 Signaling Pathway. Mol 2024; 29(4): 759.
37- Ross D, Siegel D. Functions of NQO1 in Cellular Protection and Coq10 Metabolism and Its Potential Role as a Redox Sensitive Molecular Switch. Fron Physiol 2017; 8: 595.
38- Pradhan N, Singh C, Singh A. Coenzyme Q10 a Mitochondrial Restorer for Various Brain Disorders. Naunyn Schmiedebergs Arch Pharmacol 2021; 394(11): 2197-222.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1403/1/21 | پذیرش: 1403/3/9 | انتشار: 1403/5/15
دریافت: 1403/1/21 | پذیرش: 1403/3/9 | انتشار: 1403/5/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







