دوره 32، شماره 5 - ( مرداد 1403 )
جلد 32 شماره 5 صفحات 7826-7817 |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.PIAU.REC.1400.002
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Davoudi E, Nezhadali M, Taheri S. Serum Resistin Levels in Patients with Nonalcoholic Fatty Liver Disease in an Iranian Population. JSSU 2024; 32 (5) :7817-7826
URL: http://jssu.ssu.ac.ir/article-1-6177-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6177-fa.html
داوودی الهه، نژادعلی معصومه، طاهری صبا. سطح سرمی رزیستین در بیماران مبتلا به بیماری کبد چرب غیرالکلی در یک جمعیت ایرانی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (5) :7817-7826
متن کامل [PDF 725 kb]
(422 دریافت)
| چکیده (HTML) (1226 مشاهده)
References:
1- Tabaeian SP, Mahmoudi T, Rezamand G, Nobakht H, Dabiri R, Farahani H, et al. Resistin Gene Polymorphism and Nonalcoholic Fatty Liver Disease Risk. Arquivos De Gastroenterologia 2022; 14(59): 483-7.
2- Rizzo M, Colletti A, Penson PE, Katsiki N, Mikhailidis DP, Toth PP, et al. Nutraceutical Approaches to Non-Alcoholic Fatty Liver Disease (NAFLD): A Position Paper from the International Lipid Expert Panel (ILEP). Pharmacol Res 2023; 189: 106679.
3- Shi T, Wu L, Ma W, Ju L, Bai M, Chen X, et al. Nonalcoholic Fatty Liver Disease: Pathogenesis and Treatment in Traditional Chinese Medicine and Western Medicine. Evid Based Complement Alternat Med 2020; 2020: 8749564.
4- Han D, Chen J, Liu S, Zhang Z, Zhao Z, Jin W, et al. Serum Resistin Levels in Adult Patients with Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. J transl Hepatol 2021; 9(4): 484.
5- Hashemi M, Bojd HH, Nasab EE, Bahari A, Hashemzehi NA, Shafieipour S, et al. Association of Adiponectin Rs1501299 and Rs266729 Gene Polymorphisms with Nonalcoholic Fatty Liver Disease. Hepat Mon 2013; 13(5): e9527.
6- Younossi ZM, Golabi P, Paik JM, Henry A, Van Dongen C, Henry L. The Global Epidemiology of Nonalcoholic Fatty Liver Disease (NAFLD) and Nonalcoholic Steatohepatitis (NASH): A Systematic Review. Hepatology 2023; 77(4): 1335-47.
7- Leoni S, Tovoli F, Napoli L, Serio I, Ferri S, Bolondi L. Current Guidelines for the Management of Non-Alcoholic Fatty Liver Disease: A Systematic Review with Comparative Analysis. World J Gastroenterol 2018; 24(30): 3361-73.
8- Francisco V, Sanz MJ, Real JT, Marques P, Capuozzo M, Ait Eldjoudi D, et al. Adipokines in Non-Alcoholic Fatty Liver Disease: Are We on the Road Toward New Biomarkers and Therapeutic Targets? Biology 2022; 11(8): 1237.
9- Boutari C, Perakakis N, Mantzoros CS. Association of Adipokines with Development and Progression of Nonalcoholic Fatty Liver Disease. Endocrinol Metab 2018; 33(1): 33-43.
10- Zhang J, KHO P, Kuliesh OV, Chenghe Sh. Adiponectin, Resistin and Leptin: Possible Markers of Metabolic Syndrome. Endocrinol Metab Syndr 2015; 4(4): 1-4.
11- Abdel Monem SM, Fathy T, Shalaby SM, Wahab EA. Serum Resistin Level as a Diagnostic Marker in Non-Alcoholic Steatohepatitis. Afro Egypt J Infect Enem Dis 2018; 8(3): 140-8.
12- El-Sayed MM, Hamdy SM, Abo-Agwa SH, Sayed ON. The Influence of Resistin (Rs1862513) Gene Single Nucleotide Polymorphism in Egyptian Patients with Nonalcoholic Fatty Liver Disease. Egypt Journal Chem 2024; 67(2): 295-310.
13- Bednarska-Makaruk M, Graban A, Wiśniewska A, Łojkowska W, Bochyńska A, Gugała-Iwaniuk M, et al. Association of Adiponectin, Leptin and Resistin with Inflammatory Markers and Obesity in Dementia. Biogerontology 2017;18(4): 561-80.
14- Zare Z, Meshkibaf M, Hamaitkhah V, Ranjbaran R, Takhshid M. Positive Correlation of Resistin with Blood Lipids in Gestational Diabetes. JABS 2013; 3(4): 330-5.
15- Pangaribuan B, Yusuf I, Mansyur M, Wijaya A. Serum Adiponectin and Resistin in Relation to Insulin Resistance and Markers of Hyperandrogenism in Lean and Obese Women with Polycystic Ovary Syndrome. Ther Adv Endocrinol Metab 2011; 2(6): 235-45.
16- Sayar N, Nezhadali M, Hedayati M, Mahdavi M, Akbarzadeh M, Zarkesh M. Correlation of Serum Resistin Level with Insulin Resistance and Metabolic Parameters in Patients with Type 2 Diabetes and Prediabetes. I JABS 2020, 10(2): 2362-70. [Persian]
17- Marjani S, Nezhadali M, Hekmat A, Yeganeh MZ. Investigating Visfatin Gene Polymorphism Rs4730153 with Insulin Resistance and Non-Alcoholic Fatty Liver Diseases in Iranian Population. Iran J Public Health 2022; 51(5): 1143-51.
18- Hosseini M, Nezhadali M, Hedayati M. Association of Vaspin Rs2236242 Gene Polymorphism with Serum Vaspin Level, Insulin Resistance and Diabetes in an Iranian Diabetic/Pre-Diabetic Population. J Med Biochem 2021; 40(1): 33-40.
19- Qu H-Q, Li Q, Rentfro AR, Fisher-Hoch SP, McCormick JB. The Definition of Insulin Resistance Using HOMA-IR for Americans of Mexican Descent Using Machine Learning. PloS one 2011; 6(6): e21041.
20- Shen C, Zhao CY, Wang W, Wang YD, Sun H, Cao W, et al. The Relationship between Hepatic Resistin Overexpression and Inflammation in Patients with Nonalcoholic Steatohepatitis. BMC Gastroenterol 2014; 14:1-8.
21- Al-Jiffri OH, Alsharif FM. Levels of Circulating Adipokines and their Relation with Glycemic Control and Insulin Resistance in Saudi Patients with Non-Alcoholic Fatty Liver Disease. European Journal of General Medicine 2017; 14(4): 99-102.
22- Pagano C, Soardo G, Pilon C, Milocco C, Basan L, Milan G, et al. Increased Serum Resistin in Nonalcoholic Fatty Liver Disease is Related to Liver Disease Severity and Not to Insulin Resistance. J Clin Endocrinol Metab 2006; 91(3): 1081-86.
23- Cho YK, Lee WY, Oh SY, Park JH, Kim HJ, Park DI, et al. Factors Affecting The Serum Levels of Adipokines in Korean Male Patients with Nonalcoholic Fatty Liver Disease. Hepatogastroenterology 2007; 54(77): 1512-6.
24- Perseghin G, Lattuada G, De Cobelli F, Ntali G, Esposito A, Burska A, et al. Serum Resistin and Hepatic Fat Content in Nondiabetic Individuals. J Clin Endocrinol Metab 2006; 91(12): 5122-5.
25- Magalhães GC, Feitoza FM, Moreira SB, Carmo AV, Souto FJ, Reis SR, et al. Hypoadiponectinaemia in Nonalcoholic Fatty Liver Disease Obese Women is Associated with Infrequent Intake of Dietary Sucrose and Fatty Foods. J Hum Nutr Diet 2014; 27(Suppl 2): 301-12.
26- Gierej P, Gierej B, Kalinowski P, Wróblewski T, Paluszkiewicz R, Kobryń K, et al. Expression of Resistin in the Liver of Patients with Non-Alcoholic Fatty Liver Disease. Pol J Pathol 2017; 68(3): 225-33.
27- Musso G, Bo S, Cassader M, De Michieli F, Gambino R. Impact of Sterol Regulatory Element-Binding Factor-1c Polymorphism on Incidence of Nonalcoholic Fatty Liver Disease and on the Severity of Liver Disease and of Glucose and Lipid Dysmetabolism. Am J Clin Nutr 2013; 98: 895-906.
28- Fitri C, Siregar GA, Lindarto D. The Relationship between Resistin Level and the Degree of Non-Alcoholic Fatty Liver Disease. Int J Res Rev 2021; 8(7): 192-98.
29- Shen C, Zhao CY, Wang W, Wang YD, Sun H, Cao W, et al. The Relationship between Hepatic Resistin Overexpression and Inflammation in Patients with Nonalcoholic Steatohepatitis. BMC Gastroenterol 2014; 14(39): 1-8.
30- Ajmera V, Perito ER, Bass NM, Terrault NA, Yates KP, Gill R, et al. Novel Plasma Biomarkers Associated with Liver Disease Severity in Adults with Nonalcoholic Fatty Liver Disease. Hepatol 2017; 65: 65-77.
متن کامل: (738 مشاهده)
مقدمه
بیماری کبدچرب غیرالکلی (NAFLD) یک بیماری مزمن کبدی است که در غیاب مصرف بیش از حد الکل، میزان چربی کبد از 5 درصد سلولهای کبدی فراتر میرود (1). کبد در متابولیسم کربوهیدرات، لیپید و لیپوپروتئینها نقش کلیدی دارد (2). مقاومت به انسولین و دیسلیپیدمی مهمترین ترین عواملی هستند که منجر به تجمع بیش از حد تریگلیسیرید در سلولهای کبدی میشود (3). NAFLD خطر ابتلا به دیابت نوع 2، بیماریهای قلبی عروقی و بیماری مزمن کلیوی را افزایش میدهد (4). بیماری کبدچربغیرالکلی یک بیماری متابولیک کبدی است که در بسیاری از کشورها همه گیر است (5). اخیراً یک مطالعه متاآنالیز براساس دادههای 1989 تا 2020، شیوع NAFLD را در جهان 30/9% گزارش کرده است، که بیشترین شیوع آن 42/6% در شمال آفریقا و مناطق خاورمیانه، سپس آمریکای لاتین با 34/5% و آسیا با 30/8 درصد است (6). پیشبینی میشود که شیوع NAFLD در دهه آینده بیشتر شود (4). NAFLD، طیف وسیعی از اختلالات کبدی را شامل میشود که از استئاتوز ساده (SS) تا استئاتوهپاتیت غیرالکلی (NASH) را شامل میشود و ممکن است به سیروز تبدیل شود (7 ،1). علت NAFLD هنوز بهطور کامل مشخص نشده است اما مطالعات نشان میدهد مقاومت به انسولین (IR) و چاقی در پاتوژنز NAFLD نقش دارند (4). اصلیترین راه برای تشخیصNAFLD بیوپسی کبد است که یک روش تهاجمی است، از اینرو توسعه نشانگر زیستی جدید برای پیشبینی و تشخیص دقیق NAFLD نیاز فوری و ضروری است (4). بافت چربی سفید خانوادهای از پپتیدهای زیستفعال (آدیپوکینها) با وزن مولکولی کم و دارای عملکرد متنوع را ترشح میکند که دارای فعالیت های پرو و ضد التهابی هستند، همچنین نقش اساسی در متابولیسم انرژی، لیپوژنز کبدی و حساسیت به انسولین دارند. رزیستین یکی از سیتوکینهاست که دارای اثرات پلیوتروپیک از جمله تنظیم سطح گلوکز خون، متابولیسم لیپید و القای ترشح سیتوکینهای پیشالتهابی است (8). رزیستین عمدتا توسط بافت چربی، سلولهای التهابی مانند ماکروفاژها و مونوسیتها و سلولهای ستارهای کبدی تولید میشود (4)، این پروتئین اثرات پیشالتهابی دارد و باعث آزاد شدن بسیاری از سیتوکینها میشود (9). رزیستین توسط سیتوکینهای پیشالتهابی از جمله TNF-α،IL-6، IL-1β تنظیم میشود و مسیر سیگنالینگ فاکتورکاپا B هستهای (NF-kB) را فعال و سنتز TNF-α، IL-6 و سایر عوامل پیشالتهابی را تقویت میکند (4). رزیستین نقش کلیدی در هموستاز انرژی، التهاب و پاتوژنز NAFLD دارد. رزیستین با حساسیتزدایی سلولهای چربی، سلولهای ماهیچهای اسکلتی و سلولهای کبدی به انسولین، IR کبدی را القا را میکند (1) و مقاومت به انسولین و اختلال در پاسخ به تزریق انسولین را افزایش میدهد (10،11). ژن انسانی رمزکننده رزیستین (RETN) بر روی کروموزوم شماره 19 (19p13.2) قرار دارد و شامل 4 اگزون و 3 اینترون است که 108 اسید آمینه را کد میکند (12). در برخی جمعیت ها ارتباط معنیدار بین رزیستین با متغیرهای HDL(High-density lipoprotein)، LDL (low-density lipoprotein) (14, 13) تریگلیسرید، کلسترول و نمایه تودهبدنی مشاهده شده است (10). همبستگی رزیستین با مقاومت به انسولین در برخی مطالعات دیده میشود (11) اما در برخی پژوهشها ارتباطی بین رزیستین با مقاومت به انسولین یافت نشده است (15،16). در زمینه ارتباط سطح سرمی رزیستین با NAFLD یافتههای متناقضی ارائه شده است. بر اساس برخی مطالعات سطح سرمی رزیستین در بیماران مبتلا به SS یا NASH بالاتر از گروه شاهد است، در حالیکه در مطالعات دیگر هیچ تفاوتی در سطوح رزیستین بین افراد مبتلا به SS، NASH و افراد سالم یافت نشد، همچنین ارتباطی بین سطوح رزیستین با توسعه و پیشرفت NAFLD مشاهده نشده است. در مجموع از پژوهشهای انجام شده بر روی ارتباط رزیستین و متغیرهای بیوشیمیایی و آنزیمهای کبدی در افراد مبتلا به NAFLD نتایج متفاوتی گزارش شده است (9). مطالعه حاضر جهت بررسی ارتباط سطح رزیستین با متغیرهای بیوشیمیایی و آنزیمهای کبدی و مقاومت به انسولین در جمعیت ایرانی انجام شد.
روش بررسی
این پژوهش به روش مقطعی تحلیلی انجام شد. در این مطالعه 160 نفر شرکت کردند که 80 بیمار مبتلا به بیماری کبدچرب غیرالکلی بودند که بیماری آنان با سونوگرافی تائید شده بود، همچنین 80 نفر که سونوگرافی، کبد آنان را در وضعیت طبیعی نشان داد و به عنوان فرد سالم در گروه کنترل قرار گرفتند. داوطلبان از مراجعه کنندگان به بیمارستان بوعلی و بیمارستان امیرالمومنین شهر تهران انتخاب شدند. شرط ورود در این مطالعه عدم مصرف الکل و داروهای متابولیکی بود، معیار خروج از مطالعه سـابقه مصـرف داروی متـابولیکی، مصـرف الکل، مصرف مواد مخـدر، بیمـاری حـاد، حـاملگی، بیمـاری کلیـوی، سـایر بیماریهـای کبـد، بیمـاری قلبـی، سـرطان، بیماریهــای ایمنــی، عفونــت و فشــارخون بــالا و ســایر بیماریهای شناخته شده بود. ابتدا، اهداف طرح برای داوطلبان توضیح داده شد و پس از رضایت کتبی پرسشنامه در مورد اطلاعات شخصی، رژیم غذایی، فعالیت بدنی و اطلاعات دیگر توسط هر فرد پر شد. پس از رضایت کتبی، قد و وزن هر فرد اندازهگیری شد ونمایه توده بدنی (BMI) از طریق تقسیم وزن (کیلوگرم ) به قد (بر اساس متر مربع، در حالت ایستاده بدون کفش) محاسبه شد. افراد بعد از 14-12 ساعت ناشتایی به آزمایشگاه مراجعه کردند و نمونههای خونی (5 میلیلیتر) از ورید مدین کوبیتال دست در حالت نشسته گرفته شد. نمونههای خونی گرفته شده به لوله بدون EDTA (Ethylenediaminetetraacetic acid) برای تهیه سرم منتقل شدند، حدود ۵ دقیقه بعد از لخته شدن خون در دمای اتاق، لوله فاقد ضد انعقاد خون سانتریفوژ (۱۰دقیقه ۳۰۰rpm) و سرم جدا شد و در دمای ۸۰- نگهداری شد.
بررسی فاکتورهای بیوشیمیایی: برای اندازهگیری گلوکز ناشتا (FBS)، مولکول گلوکز توسط آنزیم گلوکزاکسیداز، به اسید گلوکورونیک و H2O2 اکسید شد. برای اندازهگیری کلسترول تام (TC)، استرکلسترول توسط آنزیم کلسترولاسترهیدرولاز به کلسترول و اسید چرب آزاد تبدیل گردید سپس کلسترول توسط آنزیم کلسترولاکسیداز به cholest-4-en-3-one و H2O2 تبدیل شود. سطح تریگلیسیرید (TG) نیز با استفاده از روش رنگسنجی آنزیمی اندازهگیری شد. برای اندازهگیری تریگلیسرید، آنزیم لیپوپروتئینلیپاز تریگلیسرید را به گلیسرول و اسیدهای چرب آزاد تبدیل میکند، سپس آنزیم گلیسروکیناز، گلیسرول را به گلیسرولفسفات تبدیل کرده و آنزیم گلیسرولفسفاتاکسیداز، گلیسرولفسفات را به دیهیدروکسیاستونفسفات و H2O2 تبدیل میکند. مقدار C HDL- با استفاده از روش رنگسنجی آنزیمی تعیین شد. قبل از اندازهگیری لیپوپروتئین با چگالی بالا (HDL) آپولیپوپروتئین B توسط یونهای منیزم و اسید فسفوتنگستنیک رسوب داده و جدا شد. شاخص رنگسنجی در کلیه آنالیزهای فوق کینونئیمین بود که از H2O2 ، چهار آمینو آنتی پیرین و فنل تهیه شده و در 546 نانومتر اندازهگیری گردید. غلظت LDL-C (لیپوپروتئین – کلسترول با چگالی پایین) با استفاده از معادله Friedewald محاسبه شد (17،18) .اندازهگیری هورمون انسولین نیز توسط کیتهای ELISA (مرکودیا، سوئد) انجام و توسط الایزا ریدر خوانده شد. مقاومت به انسولین(HOMA-IR) بر اساس فرمول HOMA-IR=گلوکز ناشتا سرم (mmol/L) × انسولین ناشتا سرم (mU/L )/ 22/5 محاسبه گردید (19). مقدار آنزیمهای آسپارتات آمینوترانسفراز (AST) و آلانین آمینوترانسفراز(ALT) به روش فتومتریک توسط کیت شرکت پارس آزمون اندازهگیری شد. اندازهگیری سطح رزیستین با استفاده از کیت الایزا ZellBio آلمان انجام و نتیجه توسط الایزا ریدر در 450 نانومتر خوانده شد.
تجزیه و تحلیل آماری
در مطالعه حاضر از نرمافزار آماری version 16 SPSS برای تجزیه و تحلیل دادههای آماری استفاده شد. ابتدا نرمال بودن متغیرهای کمی با استفاده از آزمون کلموگروف اسمیرنوف بررسی شد. در بررسی متغیرها میان دو گروه مورد و شاهد در حالت نرمال بودن توزیع دادهها از آزمون تی مستقل و ANOVA و در صورت عدم پیروی دادهها از توزیع نرمال از آزمون منویتنی و کراسکال والیس استفاده شد. ارتباط رزیستین با متغیرها با استفاده از آنالیز اسپیرمن بررسی شد.
نتایج
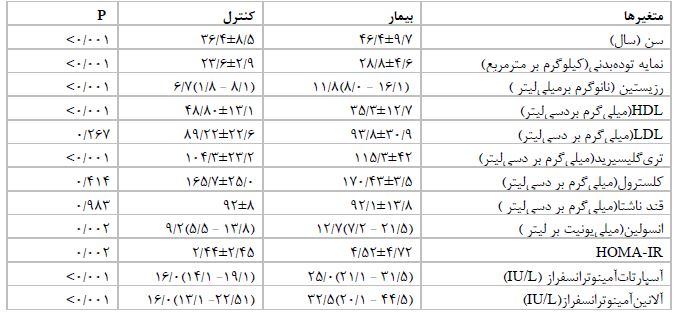
مشخصات بیوشیمیایی، آنتروپومتریک و آنزیمهای کبدی افراد مبتلا به NAFLD و افراد سالم در جدول 1 آمده است. مقایسه متغیرها در دو گروه بیمار و کنترل با استفاده از آزمونهای تی مستقل و من ویتنی انجام شد.
بر اساس نتایج میانگین سنی بیماران 9/7±46/4 سال و افراد سالم 8/5± 36/4 سال بود که اختلاف معنیدارشده است (P<0/000). شرکتکنندگان در گروه بیمار شامل 37 زن (46/2 %) و 43 مرد (53/8 %) و گروه سالم شامل 48 زن (60%) و 32 مرد (40%) بود، که تفاوت معنیدار در فراوانی زن و مرد بین دو گروه سالم و بیمار یافت نشد. مقایسه متغیرها در دو گروه سالم و بیمار نشان داد که سن (P<0/001)، نمایه توده بدنی (P<0/001) سطوح رزیستین (P<0/001)، HDL (P<0/001). ، تریگلیسرید (P<0/001). ، انسولین (P=0/002) ، HOMA-IR (P=0/002) و آنزیمهای کبدی (P<0/001) در دو گروه بیماران مبتلا به کبد چربغیرالکلی و سالم با هم تفاوت معنیدار دارند اما LDL، کلسترول و قند ناشتا اختلاف معنیداری نشان نداد (P≥0/05).
جدول 1: مقایسه میانگینها در بیماران مبتلا به کبد چرب غیر الکلی و سالم
مدل هموستاز ارزیابی مقاومت به انسولین (Homeostasis Model Assessment Insulin Resistance)
برای مقایسه میانگین دادههای نرمال از tمستقل و دادههای غیرنرمال از آزمون من ویتنی استفاده شد.
سطح معنیداری (p<0/05) در نظر گرفته شد.
همبستگی رزیستین با متغیرهای بیوشیمیایی، آنتروپومتریک و آنزیمهای کبدی در افراد سالم و بیمار با استفاده از آزمون اسپیرمن انجام شد، نتایج در جدول2 آمده است. یافته ها نشان میدهد ارتباط معنی دار فقط در گروه بیمار بین رزیستین و تریگلیسرید وجود دارد و ارتباطی بین رزیستین با سایر متغیرها در افراد سالم یافت نشد.
جدول 2: ارتباط رزیستین با متغیرهای بیوشیمیایی در افراد سالم و بیمار

سطح معنیداری (p<0/05) در نظر گرفته شد.
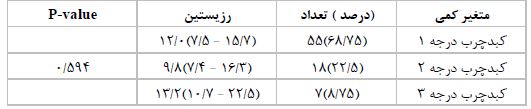
جدول 3: ارتباط رزیستین با درجات مختلف کبدچرب
برای مقایسه میانگین سطح رزیستین در درجات کبدچرب از آزمون کراسکالولیس استفاده شد.
سطح معنیداری (p<0/05) در نظر گرفته شد.
نتایج مربوط به درجه بنـدی(گریدبنـدی) کبدچربغیرالکلی که از سونوگرافی بدست آمد، در جـدول 3 آمده است. در مطالعه حاضر 55 نفــر دارای کبـد چـرب گریـد یـک، 18 نفردارای کبـد چـرب گرید دو و 7 نفر دارای گرید سه بودنـد. مقایسه سطح رزیستین در سـه گروه طبقهبندی گرید بـا اسـتفاده از آزمون کراسکال والیس انجام شد که تفاوت معنـیداری در سطح رزیستین بـین سه گروه یافت نشد (P≥0/05)
جدول 4: تحلیل رگرسیونی رزیستین و متغیرهای بیوشیمیایی با بیماری کبدچربغیرالکلی
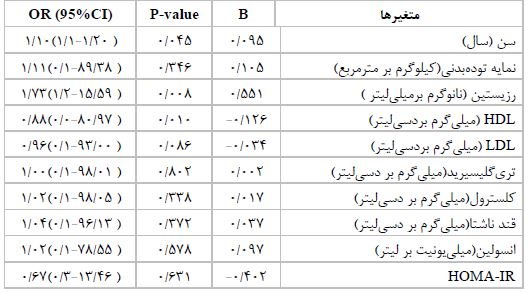
نتایج تحلیل رگرسیونی نشان داد نسبت شانس (OR) سن، رزیستین و HDL با بیماری کبدچربغیرالکلی معنیدار است (p<0/05). نسبت شانس سن و رزیستین بزرگتر از 1 و به ترتیب1/10 و 1/73 است، که این نسبت شانس نشان میدهد سن و رزیستین موجب افزایش ریسک کبدچربغیرالکلی می شود. OR متغیر HDL کمتر از 1 و مساوی 88/0 و مقدار B منفی است که نشان میدهد افزایش سطح HDL باعث کاهش بروز بیماری کبدچرب غیرالکلی می شود وHDL نقش محافظتکنندگی برای بیماری کبدچرب غیرالکلی دارد.
بحث
رزیستین یک آدیپوکین پیشالتهابی است که نقش آن در بیماران مبتلا به NAFLD بحث برانگیز است (4). در مطالعه حاضر اختلاف معنیدار درسطح رزیستین، سن، نمایه تودهبدنی، HDL، تریگلیسرید، انسولین، HOMA-IR، آنزیمهای کبدی بین دو گروه سالم و مبتلا بهNAFLD یافت شد. مطالعات El-Sayed MM و همکاران در سال 2024، در جمعیت مصر و بر روی 126 نفر (63 سالم، 63 نفر مبتلا بهNAFLD) انجام شد و مشابه نتایج ما افزایش معنیدار در سطح متغیرهای ALT، AST TG ، FBS، انسولین و HOMA-IR در بیماران مبتلا به NAFLD نسبت به گروه کنترل مشاهده شد (12). پژوهشی در افراد مبتلا به NASH و استئاتوز ساده در جمعیت چین انجام شد که سطحALT، AST، گلوکز، انسولین، HOMA-IR، تریگلیسرید و LDL-C بهطور معنیداری افزایش داشت و HLD-C بهطور قابلتوجهی در افراد مبتلا به NASH واستئاتوز ساده در مقایسه با گروه کنترل کاهش نشان داد و مشابه پژوهش ما تفاوت معنیداری در کلسترول سرم یافت نشد (20). همچنین نتایج مشابه در عربستان یافت شد که سطح گلوکز سرم، انسولین، آسپارتاتآمینوترانسفراز ، آلانینآمینوترانسفراز، سطح سرمی کلسترول تام، تریگلیسیرید و کلسترول لیپوپروتئین با چگالی کم (LDL-C)، در بیماران مبتلا به NAFLD در مقایسه با گروه کنترل بهطور قابلتوجهی بالاتر و سظح HDL-C کمتر بود (21). بررسی سطح رزیستین در جمعیتهای مختلف بر روی بیماران کبدی انجام شد که نتایج متناقضی بهدست آمد. برخی پژوهشها مشابه یافته ما در بیماران مبتلا به SS، NASH و NAFLD سطح سرمی رزیستین بالاتری را نسبت به گروه شاهد نشان داد (22،4،9) اما محققان دیگر هیچ تفاوتی بین سطوح رزیستین در افراد مبتلا به SS، NASH در مقایسه با افراد سالم مشاهده نکردند (23، 9). درمطالعات دیگر سطوح سرمی رزیستین در بیماران مبتلا به NAFLD کمتر از افراد سالم بود (24)، Magalhaes و همکاران سطوح سرمی رزیستین را در بیماران چاق مبتلا به NAFLD و گروه کنترل بررسی نمودند و گزارش کردند سطوح سرمی رزیستین با خطر ابتلا به NAFLD ارتباط منفی داشته یعنی سطح رزیستین سرم در بیماران NAFLD در مقایسه با کنترل پایینتر بوده است (25). به جز گزارشهای فوق، بسیاری تحقیقات یافتههایی را گزارش کردند که مانع از نتیجهگیری قطعی در مورد ارتباط رزیستین با کبدچرب غیرالکلی میشود (4). در مطالعه حاضر تفاوت معنیدار در سطح انسولین و شاخص مقاومت به انسولین در افراد بیمار مبتلا بهNAFLD نسبت به شاهد مشاهده شد اما همبستگی بین رزیستین و مقاومت به انسولین یافت نشد. بسیاری از مطالعات نشان داده است رزیستین در پاتوژنز مقاومت به انسولین کبدی نقش داشته و تغییرات پاتولوژیک در کبد بیماران مبتلا به NAFLD را تشدید میکند (26). رزیستین سرکوب کننده سیگنالینگ انسولین، در سلولهای چربی است. همبستگی مثبت بین رزیستین وIR (Insulin resistance)، در مدلهای موش و سلولی ثابت شده است. (27)، اگرچه دادهها در بیماران مبتلا به NAFLD انسانی متناقض است (9). در پژوهش حاضر در بررسی همبستگی رزیستین با متغیرها فقط همبستگی رزیستین و تریگلیسرید در بیماران دیده شد، در تحقیقات دیگر همبستگی رزیستین با سطح AST، ALT، شاخص HOMA گلوکز، HbA1c، انسولین، تریگلیسیرید (26،8) و BMI گزارش شده است (8). در پژوهش حاضر ارتباطی بین رزیستین و درجات کبدچرب یافت نشدکه مشابه نتایج ما مطالعه آینده نگر 7 ساله Musso و همکاران نیز نشان داد سطح رزیستین با توسعه و پیشرفت NAFLD مرتبط نیست (27، 9). اما در جمعیت سوماترا بین سطح رزیستین و درجاتNAFLD و همچنین بین سطوح رزیستین و درجه نمره فیبروز NAFLD ارتباط معنیداری یافت شد (28). برخی گزارش کردهاند هر چه پیشرفت درجه NAFLD بالاتر باشد، سطح رزیستین بالاتر است در این راستا پاگانو و همکاران تفاوت معنیدار در سطوح رزیستین در بیماران با زیرگروه NAFLD مشاهده کردند که در آن بیماران NASH رزیستین بالاتری نسبت به بیماران غیر NASH داشتند (22) برخلاف نتایج پژوهش پاگانو و همکاران در پژوهش Shen و همکاران، سطح رزیستین در گروه NASH بیشتر از گروه NAFLD بود، اما تفاوت معنیداری در زیرگروه NAFLD وجود نداشت (29). در پژوهشی بر روی جمعیت 648 نفری مبتلا به NAFLD سطح رزیستین در بیماران با تشخیص قطعی NASH نسبت به افراد سالم مشابه بود، اما سطح رزیستین در بیماران مبتلا به فیبروز مرحله 2 تا 4 بالاتر بود (9). دلیل نتایج متفاوت در مطالعات، حجم نمونه، تفاوت در BMI افراد شرکت کننده (28)، عدم بیوپسی کبد برای تشخیص قطعی (30)، جنسیت افراد (12) معرفی شده است. اندازهگیری نشانگرهای زیستی در سرم، ممکن است در تشخیص درجات و گرید NAFLD و انتخاب روش درمانی موثر باشد (30). از محدودیت های مطالعه حاضر، حجم کم نمونه و همسان نبودنهای نمونههای مورد بررسی از نظر سن و جنس، شاخص تودهبدنی و درجات کبدچرب، بود. علیرغم تحقیقات گستردهای که تاکنون انجام شده است، بسیاری از نتایج بحث برانگیز باقی مانده است، از اینرو مطالعات بیشتر و در حجم های بزرگتر مورد نیاز است تا شناخت ابزارهای تشخیصی و درمانی غیرتهاجمی فراهم شود.
نتیجهگیری
با توجه به یافتههای مطالعه حاضر سطح رزیستین در بین افراد سالم و بیمار تفاوت معنیدار داشت. سطح رزیستین با تریگلیسرید در افراد بیمار ارتباط معنیدار نشان داد. ارتباطی بین سطح رزیستین با درجات کبدچرب مشاهده نشد.
سپاسگزاری
این مقاله برگرفته از پایاننامه کارشناسی ارشد است که منابع مالی آن توسط دانشجو تامین شده است. از تمام داوطلبانی که در این مطالعه شرکت کردند کمال تشکر را دارم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه واحد پرند بررسی و با شناسه اخلاق IR.IAU.PIAU.REC.1400.002 مصوب گردید
مشارکت نویسندگان
معصومه نژادعلی در ارائه ایده و طراحی مطالعه و الهه داوودی در جمعآوری دادهها، صبا طاهری در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
بیماری کبدچرب غیرالکلی (NAFLD) یک بیماری مزمن کبدی است که در غیاب مصرف بیش از حد الکل، میزان چربی کبد از 5 درصد سلولهای کبدی فراتر میرود (1). کبد در متابولیسم کربوهیدرات، لیپید و لیپوپروتئینها نقش کلیدی دارد (2). مقاومت به انسولین و دیسلیپیدمی مهمترین ترین عواملی هستند که منجر به تجمع بیش از حد تریگلیسیرید در سلولهای کبدی میشود (3). NAFLD خطر ابتلا به دیابت نوع 2، بیماریهای قلبی عروقی و بیماری مزمن کلیوی را افزایش میدهد (4). بیماری کبدچربغیرالکلی یک بیماری متابولیک کبدی است که در بسیاری از کشورها همه گیر است (5). اخیراً یک مطالعه متاآنالیز براساس دادههای 1989 تا 2020، شیوع NAFLD را در جهان 30/9% گزارش کرده است، که بیشترین شیوع آن 42/6% در شمال آفریقا و مناطق خاورمیانه، سپس آمریکای لاتین با 34/5% و آسیا با 30/8 درصد است (6). پیشبینی میشود که شیوع NAFLD در دهه آینده بیشتر شود (4). NAFLD، طیف وسیعی از اختلالات کبدی را شامل میشود که از استئاتوز ساده (SS) تا استئاتوهپاتیت غیرالکلی (NASH) را شامل میشود و ممکن است به سیروز تبدیل شود (7 ،1). علت NAFLD هنوز بهطور کامل مشخص نشده است اما مطالعات نشان میدهد مقاومت به انسولین (IR) و چاقی در پاتوژنز NAFLD نقش دارند (4). اصلیترین راه برای تشخیصNAFLD بیوپسی کبد است که یک روش تهاجمی است، از اینرو توسعه نشانگر زیستی جدید برای پیشبینی و تشخیص دقیق NAFLD نیاز فوری و ضروری است (4). بافت چربی سفید خانوادهای از پپتیدهای زیستفعال (آدیپوکینها) با وزن مولکولی کم و دارای عملکرد متنوع را ترشح میکند که دارای فعالیت های پرو و ضد التهابی هستند، همچنین نقش اساسی در متابولیسم انرژی، لیپوژنز کبدی و حساسیت به انسولین دارند. رزیستین یکی از سیتوکینهاست که دارای اثرات پلیوتروپیک از جمله تنظیم سطح گلوکز خون، متابولیسم لیپید و القای ترشح سیتوکینهای پیشالتهابی است (8). رزیستین عمدتا توسط بافت چربی، سلولهای التهابی مانند ماکروفاژها و مونوسیتها و سلولهای ستارهای کبدی تولید میشود (4)، این پروتئین اثرات پیشالتهابی دارد و باعث آزاد شدن بسیاری از سیتوکینها میشود (9). رزیستین توسط سیتوکینهای پیشالتهابی از جمله TNF-α،IL-6، IL-1β تنظیم میشود و مسیر سیگنالینگ فاکتورکاپا B هستهای (NF-kB) را فعال و سنتز TNF-α، IL-6 و سایر عوامل پیشالتهابی را تقویت میکند (4). رزیستین نقش کلیدی در هموستاز انرژی، التهاب و پاتوژنز NAFLD دارد. رزیستین با حساسیتزدایی سلولهای چربی، سلولهای ماهیچهای اسکلتی و سلولهای کبدی به انسولین، IR کبدی را القا را میکند (1) و مقاومت به انسولین و اختلال در پاسخ به تزریق انسولین را افزایش میدهد (10،11). ژن انسانی رمزکننده رزیستین (RETN) بر روی کروموزوم شماره 19 (19p13.2) قرار دارد و شامل 4 اگزون و 3 اینترون است که 108 اسید آمینه را کد میکند (12). در برخی جمعیت ها ارتباط معنیدار بین رزیستین با متغیرهای HDL(High-density lipoprotein)، LDL (low-density lipoprotein) (14, 13) تریگلیسرید، کلسترول و نمایه تودهبدنی مشاهده شده است (10). همبستگی رزیستین با مقاومت به انسولین در برخی مطالعات دیده میشود (11) اما در برخی پژوهشها ارتباطی بین رزیستین با مقاومت به انسولین یافت نشده است (15،16). در زمینه ارتباط سطح سرمی رزیستین با NAFLD یافتههای متناقضی ارائه شده است. بر اساس برخی مطالعات سطح سرمی رزیستین در بیماران مبتلا به SS یا NASH بالاتر از گروه شاهد است، در حالیکه در مطالعات دیگر هیچ تفاوتی در سطوح رزیستین بین افراد مبتلا به SS، NASH و افراد سالم یافت نشد، همچنین ارتباطی بین سطوح رزیستین با توسعه و پیشرفت NAFLD مشاهده نشده است. در مجموع از پژوهشهای انجام شده بر روی ارتباط رزیستین و متغیرهای بیوشیمیایی و آنزیمهای کبدی در افراد مبتلا به NAFLD نتایج متفاوتی گزارش شده است (9). مطالعه حاضر جهت بررسی ارتباط سطح رزیستین با متغیرهای بیوشیمیایی و آنزیمهای کبدی و مقاومت به انسولین در جمعیت ایرانی انجام شد.
روش بررسی
این پژوهش به روش مقطعی تحلیلی انجام شد. در این مطالعه 160 نفر شرکت کردند که 80 بیمار مبتلا به بیماری کبدچرب غیرالکلی بودند که بیماری آنان با سونوگرافی تائید شده بود، همچنین 80 نفر که سونوگرافی، کبد آنان را در وضعیت طبیعی نشان داد و به عنوان فرد سالم در گروه کنترل قرار گرفتند. داوطلبان از مراجعه کنندگان به بیمارستان بوعلی و بیمارستان امیرالمومنین شهر تهران انتخاب شدند. شرط ورود در این مطالعه عدم مصرف الکل و داروهای متابولیکی بود، معیار خروج از مطالعه سـابقه مصـرف داروی متـابولیکی، مصـرف الکل، مصرف مواد مخـدر، بیمـاری حـاد، حـاملگی، بیمـاری کلیـوی، سـایر بیماریهـای کبـد، بیمـاری قلبـی، سـرطان، بیماریهــای ایمنــی، عفونــت و فشــارخون بــالا و ســایر بیماریهای شناخته شده بود. ابتدا، اهداف طرح برای داوطلبان توضیح داده شد و پس از رضایت کتبی پرسشنامه در مورد اطلاعات شخصی، رژیم غذایی، فعالیت بدنی و اطلاعات دیگر توسط هر فرد پر شد. پس از رضایت کتبی، قد و وزن هر فرد اندازهگیری شد ونمایه توده بدنی (BMI) از طریق تقسیم وزن (کیلوگرم ) به قد (بر اساس متر مربع، در حالت ایستاده بدون کفش) محاسبه شد. افراد بعد از 14-12 ساعت ناشتایی به آزمایشگاه مراجعه کردند و نمونههای خونی (5 میلیلیتر) از ورید مدین کوبیتال دست در حالت نشسته گرفته شد. نمونههای خونی گرفته شده به لوله بدون EDTA (Ethylenediaminetetraacetic acid) برای تهیه سرم منتقل شدند، حدود ۵ دقیقه بعد از لخته شدن خون در دمای اتاق، لوله فاقد ضد انعقاد خون سانتریفوژ (۱۰دقیقه ۳۰۰rpm) و سرم جدا شد و در دمای ۸۰- نگهداری شد.
بررسی فاکتورهای بیوشیمیایی: برای اندازهگیری گلوکز ناشتا (FBS)، مولکول گلوکز توسط آنزیم گلوکزاکسیداز، به اسید گلوکورونیک و H2O2 اکسید شد. برای اندازهگیری کلسترول تام (TC)، استرکلسترول توسط آنزیم کلسترولاسترهیدرولاز به کلسترول و اسید چرب آزاد تبدیل گردید سپس کلسترول توسط آنزیم کلسترولاکسیداز به cholest-4-en-3-one و H2O2 تبدیل شود. سطح تریگلیسیرید (TG) نیز با استفاده از روش رنگسنجی آنزیمی اندازهگیری شد. برای اندازهگیری تریگلیسرید، آنزیم لیپوپروتئینلیپاز تریگلیسرید را به گلیسرول و اسیدهای چرب آزاد تبدیل میکند، سپس آنزیم گلیسروکیناز، گلیسرول را به گلیسرولفسفات تبدیل کرده و آنزیم گلیسرولفسفاتاکسیداز، گلیسرولفسفات را به دیهیدروکسیاستونفسفات و H2O2 تبدیل میکند. مقدار C HDL- با استفاده از روش رنگسنجی آنزیمی تعیین شد. قبل از اندازهگیری لیپوپروتئین با چگالی بالا (HDL) آپولیپوپروتئین B توسط یونهای منیزم و اسید فسفوتنگستنیک رسوب داده و جدا شد. شاخص رنگسنجی در کلیه آنالیزهای فوق کینونئیمین بود که از H2O2 ، چهار آمینو آنتی پیرین و فنل تهیه شده و در 546 نانومتر اندازهگیری گردید. غلظت LDL-C (لیپوپروتئین – کلسترول با چگالی پایین) با استفاده از معادله Friedewald محاسبه شد (17،18) .اندازهگیری هورمون انسولین نیز توسط کیتهای ELISA (مرکودیا، سوئد) انجام و توسط الایزا ریدر خوانده شد. مقاومت به انسولین(HOMA-IR) بر اساس فرمول HOMA-IR=گلوکز ناشتا سرم (mmol/L) × انسولین ناشتا سرم (mU/L )/ 22/5 محاسبه گردید (19). مقدار آنزیمهای آسپارتات آمینوترانسفراز (AST) و آلانین آمینوترانسفراز(ALT) به روش فتومتریک توسط کیت شرکت پارس آزمون اندازهگیری شد. اندازهگیری سطح رزیستین با استفاده از کیت الایزا ZellBio آلمان انجام و نتیجه توسط الایزا ریدر در 450 نانومتر خوانده شد.
تجزیه و تحلیل آماری
در مطالعه حاضر از نرمافزار آماری version 16 SPSS برای تجزیه و تحلیل دادههای آماری استفاده شد. ابتدا نرمال بودن متغیرهای کمی با استفاده از آزمون کلموگروف اسمیرنوف بررسی شد. در بررسی متغیرها میان دو گروه مورد و شاهد در حالت نرمال بودن توزیع دادهها از آزمون تی مستقل و ANOVA و در صورت عدم پیروی دادهها از توزیع نرمال از آزمون منویتنی و کراسکال والیس استفاده شد. ارتباط رزیستین با متغیرها با استفاده از آنالیز اسپیرمن بررسی شد.
نتایج
مشخصات بیوشیمیایی، آنتروپومتریک و آنزیمهای کبدی افراد مبتلا به NAFLD و افراد سالم در جدول 1 آمده است. مقایسه متغیرها در دو گروه بیمار و کنترل با استفاده از آزمونهای تی مستقل و من ویتنی انجام شد.
بر اساس نتایج میانگین سنی بیماران 9/7±46/4 سال و افراد سالم 8/5± 36/4 سال بود که اختلاف معنیدارشده است (P<0/000). شرکتکنندگان در گروه بیمار شامل 37 زن (46/2 %) و 43 مرد (53/8 %) و گروه سالم شامل 48 زن (60%) و 32 مرد (40%) بود، که تفاوت معنیدار در فراوانی زن و مرد بین دو گروه سالم و بیمار یافت نشد. مقایسه متغیرها در دو گروه سالم و بیمار نشان داد که سن (P<0/001)، نمایه توده بدنی (P<0/001) سطوح رزیستین (P<0/001)، HDL (P<0/001). ، تریگلیسرید (P<0/001). ، انسولین (P=0/002) ، HOMA-IR (P=0/002) و آنزیمهای کبدی (P<0/001) در دو گروه بیماران مبتلا به کبد چربغیرالکلی و سالم با هم تفاوت معنیدار دارند اما LDL، کلسترول و قند ناشتا اختلاف معنیداری نشان نداد (P≥0/05).
جدول 1: مقایسه میانگینها در بیماران مبتلا به کبد چرب غیر الکلی و سالم

مدل هموستاز ارزیابی مقاومت به انسولین (Homeostasis Model Assessment Insulin Resistance)
برای مقایسه میانگین دادههای نرمال از tمستقل و دادههای غیرنرمال از آزمون من ویتنی استفاده شد.
سطح معنیداری (p<0/05) در نظر گرفته شد.
همبستگی رزیستین با متغیرهای بیوشیمیایی، آنتروپومتریک و آنزیمهای کبدی در افراد سالم و بیمار با استفاده از آزمون اسپیرمن انجام شد، نتایج در جدول2 آمده است. یافته ها نشان میدهد ارتباط معنی دار فقط در گروه بیمار بین رزیستین و تریگلیسرید وجود دارد و ارتباطی بین رزیستین با سایر متغیرها در افراد سالم یافت نشد.
جدول 2: ارتباط رزیستین با متغیرهای بیوشیمیایی در افراد سالم و بیمار

سطح معنیداری (p<0/05) در نظر گرفته شد.
جدول 3: ارتباط رزیستین با درجات مختلف کبدچرب

برای مقایسه میانگین سطح رزیستین در درجات کبدچرب از آزمون کراسکالولیس استفاده شد.
سطح معنیداری (p<0/05) در نظر گرفته شد.
نتایج مربوط به درجه بنـدی(گریدبنـدی) کبدچربغیرالکلی که از سونوگرافی بدست آمد، در جـدول 3 آمده است. در مطالعه حاضر 55 نفــر دارای کبـد چـرب گریـد یـک، 18 نفردارای کبـد چـرب گرید دو و 7 نفر دارای گرید سه بودنـد. مقایسه سطح رزیستین در سـه گروه طبقهبندی گرید بـا اسـتفاده از آزمون کراسکال والیس انجام شد که تفاوت معنـیداری در سطح رزیستین بـین سه گروه یافت نشد (P≥0/05)
جدول 4: تحلیل رگرسیونی رزیستین و متغیرهای بیوشیمیایی با بیماری کبدچربغیرالکلی

نتایج تحلیل رگرسیونی نشان داد نسبت شانس (OR) سن، رزیستین و HDL با بیماری کبدچربغیرالکلی معنیدار است (p<0/05). نسبت شانس سن و رزیستین بزرگتر از 1 و به ترتیب1/10 و 1/73 است، که این نسبت شانس نشان میدهد سن و رزیستین موجب افزایش ریسک کبدچربغیرالکلی می شود. OR متغیر HDL کمتر از 1 و مساوی 88/0 و مقدار B منفی است که نشان میدهد افزایش سطح HDL باعث کاهش بروز بیماری کبدچرب غیرالکلی می شود وHDL نقش محافظتکنندگی برای بیماری کبدچرب غیرالکلی دارد.
بحث
رزیستین یک آدیپوکین پیشالتهابی است که نقش آن در بیماران مبتلا به NAFLD بحث برانگیز است (4). در مطالعه حاضر اختلاف معنیدار درسطح رزیستین، سن، نمایه تودهبدنی، HDL، تریگلیسرید، انسولین، HOMA-IR، آنزیمهای کبدی بین دو گروه سالم و مبتلا بهNAFLD یافت شد. مطالعات El-Sayed MM و همکاران در سال 2024، در جمعیت مصر و بر روی 126 نفر (63 سالم، 63 نفر مبتلا بهNAFLD) انجام شد و مشابه نتایج ما افزایش معنیدار در سطح متغیرهای ALT، AST TG ، FBS، انسولین و HOMA-IR در بیماران مبتلا به NAFLD نسبت به گروه کنترل مشاهده شد (12). پژوهشی در افراد مبتلا به NASH و استئاتوز ساده در جمعیت چین انجام شد که سطحALT، AST، گلوکز، انسولین، HOMA-IR، تریگلیسرید و LDL-C بهطور معنیداری افزایش داشت و HLD-C بهطور قابلتوجهی در افراد مبتلا به NASH واستئاتوز ساده در مقایسه با گروه کنترل کاهش نشان داد و مشابه پژوهش ما تفاوت معنیداری در کلسترول سرم یافت نشد (20). همچنین نتایج مشابه در عربستان یافت شد که سطح گلوکز سرم، انسولین، آسپارتاتآمینوترانسفراز ، آلانینآمینوترانسفراز، سطح سرمی کلسترول تام، تریگلیسیرید و کلسترول لیپوپروتئین با چگالی کم (LDL-C)، در بیماران مبتلا به NAFLD در مقایسه با گروه کنترل بهطور قابلتوجهی بالاتر و سظح HDL-C کمتر بود (21). بررسی سطح رزیستین در جمعیتهای مختلف بر روی بیماران کبدی انجام شد که نتایج متناقضی بهدست آمد. برخی پژوهشها مشابه یافته ما در بیماران مبتلا به SS، NASH و NAFLD سطح سرمی رزیستین بالاتری را نسبت به گروه شاهد نشان داد (22،4،9) اما محققان دیگر هیچ تفاوتی بین سطوح رزیستین در افراد مبتلا به SS، NASH در مقایسه با افراد سالم مشاهده نکردند (23، 9). درمطالعات دیگر سطوح سرمی رزیستین در بیماران مبتلا به NAFLD کمتر از افراد سالم بود (24)، Magalhaes و همکاران سطوح سرمی رزیستین را در بیماران چاق مبتلا به NAFLD و گروه کنترل بررسی نمودند و گزارش کردند سطوح سرمی رزیستین با خطر ابتلا به NAFLD ارتباط منفی داشته یعنی سطح رزیستین سرم در بیماران NAFLD در مقایسه با کنترل پایینتر بوده است (25). به جز گزارشهای فوق، بسیاری تحقیقات یافتههایی را گزارش کردند که مانع از نتیجهگیری قطعی در مورد ارتباط رزیستین با کبدچرب غیرالکلی میشود (4). در مطالعه حاضر تفاوت معنیدار در سطح انسولین و شاخص مقاومت به انسولین در افراد بیمار مبتلا بهNAFLD نسبت به شاهد مشاهده شد اما همبستگی بین رزیستین و مقاومت به انسولین یافت نشد. بسیاری از مطالعات نشان داده است رزیستین در پاتوژنز مقاومت به انسولین کبدی نقش داشته و تغییرات پاتولوژیک در کبد بیماران مبتلا به NAFLD را تشدید میکند (26). رزیستین سرکوب کننده سیگنالینگ انسولین، در سلولهای چربی است. همبستگی مثبت بین رزیستین وIR (Insulin resistance)، در مدلهای موش و سلولی ثابت شده است. (27)، اگرچه دادهها در بیماران مبتلا به NAFLD انسانی متناقض است (9). در پژوهش حاضر در بررسی همبستگی رزیستین با متغیرها فقط همبستگی رزیستین و تریگلیسرید در بیماران دیده شد، در تحقیقات دیگر همبستگی رزیستین با سطح AST، ALT، شاخص HOMA گلوکز، HbA1c، انسولین، تریگلیسیرید (26،8) و BMI گزارش شده است (8). در پژوهش حاضر ارتباطی بین رزیستین و درجات کبدچرب یافت نشدکه مشابه نتایج ما مطالعه آینده نگر 7 ساله Musso و همکاران نیز نشان داد سطح رزیستین با توسعه و پیشرفت NAFLD مرتبط نیست (27، 9). اما در جمعیت سوماترا بین سطح رزیستین و درجاتNAFLD و همچنین بین سطوح رزیستین و درجه نمره فیبروز NAFLD ارتباط معنیداری یافت شد (28). برخی گزارش کردهاند هر چه پیشرفت درجه NAFLD بالاتر باشد، سطح رزیستین بالاتر است در این راستا پاگانو و همکاران تفاوت معنیدار در سطوح رزیستین در بیماران با زیرگروه NAFLD مشاهده کردند که در آن بیماران NASH رزیستین بالاتری نسبت به بیماران غیر NASH داشتند (22) برخلاف نتایج پژوهش پاگانو و همکاران در پژوهش Shen و همکاران، سطح رزیستین در گروه NASH بیشتر از گروه NAFLD بود، اما تفاوت معنیداری در زیرگروه NAFLD وجود نداشت (29). در پژوهشی بر روی جمعیت 648 نفری مبتلا به NAFLD سطح رزیستین در بیماران با تشخیص قطعی NASH نسبت به افراد سالم مشابه بود، اما سطح رزیستین در بیماران مبتلا به فیبروز مرحله 2 تا 4 بالاتر بود (9). دلیل نتایج متفاوت در مطالعات، حجم نمونه، تفاوت در BMI افراد شرکت کننده (28)، عدم بیوپسی کبد برای تشخیص قطعی (30)، جنسیت افراد (12) معرفی شده است. اندازهگیری نشانگرهای زیستی در سرم، ممکن است در تشخیص درجات و گرید NAFLD و انتخاب روش درمانی موثر باشد (30). از محدودیت های مطالعه حاضر، حجم کم نمونه و همسان نبودنهای نمونههای مورد بررسی از نظر سن و جنس، شاخص تودهبدنی و درجات کبدچرب، بود. علیرغم تحقیقات گستردهای که تاکنون انجام شده است، بسیاری از نتایج بحث برانگیز باقی مانده است، از اینرو مطالعات بیشتر و در حجم های بزرگتر مورد نیاز است تا شناخت ابزارهای تشخیصی و درمانی غیرتهاجمی فراهم شود.
نتیجهگیری
با توجه به یافتههای مطالعه حاضر سطح رزیستین در بین افراد سالم و بیمار تفاوت معنیدار داشت. سطح رزیستین با تریگلیسرید در افراد بیمار ارتباط معنیدار نشان داد. ارتباطی بین سطح رزیستین با درجات کبدچرب مشاهده نشد.
سپاسگزاری
این مقاله برگرفته از پایاننامه کارشناسی ارشد است که منابع مالی آن توسط دانشجو تامین شده است. از تمام داوطلبانی که در این مطالعه شرکت کردند کمال تشکر را دارم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه واحد پرند بررسی و با شناسه اخلاق IR.IAU.PIAU.REC.1400.002 مصوب گردید
مشارکت نویسندگان
معصومه نژادعلی در ارائه ایده و طراحی مطالعه و الهه داوودی در جمعآوری دادهها، صبا طاهری در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Tabaeian SP, Mahmoudi T, Rezamand G, Nobakht H, Dabiri R, Farahani H, et al. Resistin Gene Polymorphism and Nonalcoholic Fatty Liver Disease Risk. Arquivos De Gastroenterologia 2022; 14(59): 483-7.
2- Rizzo M, Colletti A, Penson PE, Katsiki N, Mikhailidis DP, Toth PP, et al. Nutraceutical Approaches to Non-Alcoholic Fatty Liver Disease (NAFLD): A Position Paper from the International Lipid Expert Panel (ILEP). Pharmacol Res 2023; 189: 106679.
3- Shi T, Wu L, Ma W, Ju L, Bai M, Chen X, et al. Nonalcoholic Fatty Liver Disease: Pathogenesis and Treatment in Traditional Chinese Medicine and Western Medicine. Evid Based Complement Alternat Med 2020; 2020: 8749564.
4- Han D, Chen J, Liu S, Zhang Z, Zhao Z, Jin W, et al. Serum Resistin Levels in Adult Patients with Nonalcoholic Fatty Liver Disease: A Systematic Review and Meta-Analysis. J transl Hepatol 2021; 9(4): 484.
5- Hashemi M, Bojd HH, Nasab EE, Bahari A, Hashemzehi NA, Shafieipour S, et al. Association of Adiponectin Rs1501299 and Rs266729 Gene Polymorphisms with Nonalcoholic Fatty Liver Disease. Hepat Mon 2013; 13(5): e9527.
6- Younossi ZM, Golabi P, Paik JM, Henry A, Van Dongen C, Henry L. The Global Epidemiology of Nonalcoholic Fatty Liver Disease (NAFLD) and Nonalcoholic Steatohepatitis (NASH): A Systematic Review. Hepatology 2023; 77(4): 1335-47.
7- Leoni S, Tovoli F, Napoli L, Serio I, Ferri S, Bolondi L. Current Guidelines for the Management of Non-Alcoholic Fatty Liver Disease: A Systematic Review with Comparative Analysis. World J Gastroenterol 2018; 24(30): 3361-73.
8- Francisco V, Sanz MJ, Real JT, Marques P, Capuozzo M, Ait Eldjoudi D, et al. Adipokines in Non-Alcoholic Fatty Liver Disease: Are We on the Road Toward New Biomarkers and Therapeutic Targets? Biology 2022; 11(8): 1237.
9- Boutari C, Perakakis N, Mantzoros CS. Association of Adipokines with Development and Progression of Nonalcoholic Fatty Liver Disease. Endocrinol Metab 2018; 33(1): 33-43.
10- Zhang J, KHO P, Kuliesh OV, Chenghe Sh. Adiponectin, Resistin and Leptin: Possible Markers of Metabolic Syndrome. Endocrinol Metab Syndr 2015; 4(4): 1-4.
11- Abdel Monem SM, Fathy T, Shalaby SM, Wahab EA. Serum Resistin Level as a Diagnostic Marker in Non-Alcoholic Steatohepatitis. Afro Egypt J Infect Enem Dis 2018; 8(3): 140-8.
12- El-Sayed MM, Hamdy SM, Abo-Agwa SH, Sayed ON. The Influence of Resistin (Rs1862513) Gene Single Nucleotide Polymorphism in Egyptian Patients with Nonalcoholic Fatty Liver Disease. Egypt Journal Chem 2024; 67(2): 295-310.
13- Bednarska-Makaruk M, Graban A, Wiśniewska A, Łojkowska W, Bochyńska A, Gugała-Iwaniuk M, et al. Association of Adiponectin, Leptin and Resistin with Inflammatory Markers and Obesity in Dementia. Biogerontology 2017;18(4): 561-80.
14- Zare Z, Meshkibaf M, Hamaitkhah V, Ranjbaran R, Takhshid M. Positive Correlation of Resistin with Blood Lipids in Gestational Diabetes. JABS 2013; 3(4): 330-5.
15- Pangaribuan B, Yusuf I, Mansyur M, Wijaya A. Serum Adiponectin and Resistin in Relation to Insulin Resistance and Markers of Hyperandrogenism in Lean and Obese Women with Polycystic Ovary Syndrome. Ther Adv Endocrinol Metab 2011; 2(6): 235-45.
16- Sayar N, Nezhadali M, Hedayati M, Mahdavi M, Akbarzadeh M, Zarkesh M. Correlation of Serum Resistin Level with Insulin Resistance and Metabolic Parameters in Patients with Type 2 Diabetes and Prediabetes. I JABS 2020, 10(2): 2362-70. [Persian]
17- Marjani S, Nezhadali M, Hekmat A, Yeganeh MZ. Investigating Visfatin Gene Polymorphism Rs4730153 with Insulin Resistance and Non-Alcoholic Fatty Liver Diseases in Iranian Population. Iran J Public Health 2022; 51(5): 1143-51.
18- Hosseini M, Nezhadali M, Hedayati M. Association of Vaspin Rs2236242 Gene Polymorphism with Serum Vaspin Level, Insulin Resistance and Diabetes in an Iranian Diabetic/Pre-Diabetic Population. J Med Biochem 2021; 40(1): 33-40.
19- Qu H-Q, Li Q, Rentfro AR, Fisher-Hoch SP, McCormick JB. The Definition of Insulin Resistance Using HOMA-IR for Americans of Mexican Descent Using Machine Learning. PloS one 2011; 6(6): e21041.
20- Shen C, Zhao CY, Wang W, Wang YD, Sun H, Cao W, et al. The Relationship between Hepatic Resistin Overexpression and Inflammation in Patients with Nonalcoholic Steatohepatitis. BMC Gastroenterol 2014; 14:1-8.
21- Al-Jiffri OH, Alsharif FM. Levels of Circulating Adipokines and their Relation with Glycemic Control and Insulin Resistance in Saudi Patients with Non-Alcoholic Fatty Liver Disease. European Journal of General Medicine 2017; 14(4): 99-102.
22- Pagano C, Soardo G, Pilon C, Milocco C, Basan L, Milan G, et al. Increased Serum Resistin in Nonalcoholic Fatty Liver Disease is Related to Liver Disease Severity and Not to Insulin Resistance. J Clin Endocrinol Metab 2006; 91(3): 1081-86.
23- Cho YK, Lee WY, Oh SY, Park JH, Kim HJ, Park DI, et al. Factors Affecting The Serum Levels of Adipokines in Korean Male Patients with Nonalcoholic Fatty Liver Disease. Hepatogastroenterology 2007; 54(77): 1512-6.
24- Perseghin G, Lattuada G, De Cobelli F, Ntali G, Esposito A, Burska A, et al. Serum Resistin and Hepatic Fat Content in Nondiabetic Individuals. J Clin Endocrinol Metab 2006; 91(12): 5122-5.
25- Magalhães GC, Feitoza FM, Moreira SB, Carmo AV, Souto FJ, Reis SR, et al. Hypoadiponectinaemia in Nonalcoholic Fatty Liver Disease Obese Women is Associated with Infrequent Intake of Dietary Sucrose and Fatty Foods. J Hum Nutr Diet 2014; 27(Suppl 2): 301-12.
26- Gierej P, Gierej B, Kalinowski P, Wróblewski T, Paluszkiewicz R, Kobryń K, et al. Expression of Resistin in the Liver of Patients with Non-Alcoholic Fatty Liver Disease. Pol J Pathol 2017; 68(3): 225-33.
27- Musso G, Bo S, Cassader M, De Michieli F, Gambino R. Impact of Sterol Regulatory Element-Binding Factor-1c Polymorphism on Incidence of Nonalcoholic Fatty Liver Disease and on the Severity of Liver Disease and of Glucose and Lipid Dysmetabolism. Am J Clin Nutr 2013; 98: 895-906.
28- Fitri C, Siregar GA, Lindarto D. The Relationship between Resistin Level and the Degree of Non-Alcoholic Fatty Liver Disease. Int J Res Rev 2021; 8(7): 192-98.
29- Shen C, Zhao CY, Wang W, Wang YD, Sun H, Cao W, et al. The Relationship between Hepatic Resistin Overexpression and Inflammation in Patients with Nonalcoholic Steatohepatitis. BMC Gastroenterol 2014; 14(39): 1-8.
30- Ajmera V, Perito ER, Bass NM, Terrault NA, Yates KP, Gill R, et al. Novel Plasma Biomarkers Associated with Liver Disease Severity in Adults with Nonalcoholic Fatty Liver Disease. Hepatol 2017; 65: 65-77.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







