دوره 33، شماره 2 - ( اردیبهشت 1404 )
جلد 33 شماره 2 صفحات 8717-8705 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hajizadeh M R, Jafari Kakhki A M, Nabavinia M, Nabavinia M S. Cloning and Optimization of Formate Dehydrogenase Gene Expression in E. COLI. JSSU 2025; 33 (2) :8705-8717
URL: http://jssu.ssu.ac.ir/article-1-6174-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6174-fa.html
حاجی زاده محمدرضا، جعفری کاخکی امیرمحمد، نبوی نیا محبوبه، نبوی نیا مریم. کلونینگ و بهینهسازی بیان ژن آنزیم فورمات دهیدروژناز در اشرشیاکلی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1404; 33 (2) :8705-8717
متن کامل [PDF 927 kb]
(227 دریافت)
| چکیده (HTML) (789 مشاهده)
References:
1- Moua PS, Gonzalez A, Oshiro KT, Tam V, Li ZH, Chang J, et al. Differential Secretion Pathways of Proteins Fused to the Escherichia Coli Maltose Binding Protein (MBP) in Pichia Pastoris. Protein Expr Purif 2016; 124: 1-9.
2- Fargione J, Hill J, Tilman D, Polasky S, Hawthorne P. Land clearing the biofuel carbon debt. Science 2008; 319(5867): 1235-8.
3- Takacs M, Makhlynets OV, Tolbert PL, Korendovych IV. Secretion of Functional Formate Dehydrogenase in Pichia Pastoris. Protein Eng Des Sel 2017; 30(3): 279-84.
4- Fargione J, Hill J, Tilman D, Polasky S, Hawthorne P. Land Clearing and the Biofuel Carbon Debt. Science 2008; 319(5867): 1235-8.
5- Hanson RL, Goldberg SL, Brzozowski DB, Tully TP, Cazzulino D, Parker WL, et al. Preparation of an Amino Acid Intermediate for the Dipeptidyl Peptidase IV Inhibitor, Saxagliptin, Using a Modified Phenylalanine Dehydrogenase. Advanced Synthesis & Catalysis 2007; 349(8‐9): 1369-78.
6- Hoelsch K, Sührer I, Heusel M, Weuster-Botz D. Engineering of Formate Dehydrogenase: Synergistic Effect of Mutations Affecting Cofactor Specificity and Chemical Stability. Appl microbiol biotechnol 2013; 97: 2473-81.
7- Brown TA. Gene Cloning and DNA Analysis: an Introduction. 6 ed. John Wiley & Sons; 2010.
8- Uhoraningoga A, Kinsella GK, Henehan GT, Ryan BJ. The Goldilocks Approach: A Review of Employing Design of Experiments in Prokaryotic Recombinant Protein Production. Bioengineering 2018; 5(4): 89.
9- Rao RS, Kumar CG, Prakasham RS, Hobbs PJ. The Taguchi Methodology as a Statistical Tool for Biotechnological Applications: A Critical Appraisal. Biotechnol J 2008; 3(4): 510-23.
10- Vera A, González‐Montalbán N, Arís A, Villaverde A. The Conformational Quality of Insoluble Recombinant Proteins is Enhanced at Low Growth Temperatures. Biotechnol bioeng 2007; 96(6): 1101-6.
11- Gopal GJ, Kumar A. Strategies for the Production of Recombinant Protein in Escherichia Coli. Protein J 2013; 32(6): 419-25.
12- Papaneophytou C. Design of Experiments as a Tool for Optimization in Recombinant Protein Biotechnology: From Constructs to Crystals. Mol Biotechnol 2019; 61(12): 873-91.
13- Mosrati R, Nancib N, Boudrant J. Variation and Modeling of the Probability of Plasmid Loss as a Function of Growth Rate of Plasmid‐Bearing Cells of Escherichia Coli during Continuous Cultures. Biotechnol bioeng 1993; 41(4): 395-404.
14- Betiku E. Molecular Chaperones Involved in Heterologous Protein Folding in Escherichia Coli. Biotechnol Molecular Biology Reviews 2006; 1(2): 66-75.
15- Horii T, Ogawa T, Ogawa H. Organization of the Reca Gene of Escherichia Coli. Proc Natl Acad Sci 1980; 77(1): 313-7.
16- Berrow NS, Büssow K, Coutard B, Diprose J, Ekberg M, Folkers G, et al. Recombinant Protein Expression and Solubility Screening in Escherichia Coli: A Comparative Study. Acta Acta Crystallogr D Biol Crystallogr 2006; 62(Pt 10): 1218-26.
17- Antoniou G, Papakyriacou I, Papaneophytou C. Optimization of Soluble Expression and Purification of Recombinant Human Rhinovirus Type-14 3C Protease Using Statistically Designed Experiments: Isolation and Characterization of the Enzyme. Mol Biotechnol 2017; 59(9-10): 407-24.
18- Yan F, Qian M, Yang F, Cai F, Yuan Z, Lai S, et al. A Novel Pro-Apoptosis Protein PNAS-4 From Xenopus Laevis: Cloning, Expression, Purification, and Polyclonal Antibody Production. Biochemistry (Moscow) 2007; 72(6): 664-71.
19- Kram KE, Finkel SE. Rich Medium Composition Affects Escherichia Coli Survival, Glycation, and Mutation Frequency during Long-Term Batch Culture. Appl Environ Microbiol 2015; 81(13): 4442-50.
20- Tseng C-L, Leng C-H. Influence of Medium Components on the Expression of Recombinant Lipoproteins in Escherichia Coli. Appl Microbiol Biotechnol 2012; 93(4): 1539-52
21- Zhang H, Li Y, Chen X, Sheng H, An L. Optimization of Electroporation Conditions for Arthrobacter with Plasmid PART2. J Microbiol Methods 2011; 84(1): 114-20.
22- Lebendiker M, Danieli T. Production of Prone-to-Aggregate Proteins. FEBS Letters 2014; 588(2): 236-46.
متن کامل: (244 مشاهده)
مقدمه
افزایش غلظت گازهای گلخانهای و عوارض ناشی از آن و بهویژه گرم شدن تدریجی زمین باعث توجه جهانی در اصلاح این پدیده و انتقال سیستمهای انرژی از سوختهای فسیلی به منابع قابل تجدید گردیده است. این سوختها که شامل بیواتانول، بیومتانول، بیوهیدروژن و بیودیزل میباشد، میتواند به عنوان جایگزینی برای سوخت های فسیلی بهکار گرفته شود. هر چند سوختن سوختهای زیستی باعث کاهش تولیدCO2 Carbon dioxide و آلودگی کمتر محیط زیست میشوند اما در فرآیند تولید آنها حذف فلور میکروبی نرمال از روی پیش ساز این سوختها ضروری است و همین امر باعث میشود در فرایند آماده سازی و تولید آنها مقدار زیادی CO2 تولید شود. بنابراین یافتن راههای جایگزین برای تولید آنها به منظور کاهش تولید CO2 مهم است (3-1). آنزیم فورمات دهیدروژناز قادر به کاهش الکتروشیمیایی CO2 در تبدیل آن به فورمات بوده که در نهایت توسط آنزیم الکل دهیدروژناز می تواند به متانول تبدیل شود. که این امر می تواند تولید سوختهای زیستی مانند متانول را با کاهش تولید CO2 و کاهش آلودگی محیط زیست همراه کند (4). علاوه براین این آنزیم از آنزیمهای کلیدی در بیوسنتر داروی ساکساگلیپتین می باشد. در طول واکنش انجام شده برای تولید ماده حد واسط داروی ساکساگلیپتین، فورماتدهیدروژناز NAD بهNADH Nicotinamide adenine dinucleotide تبدیل میکند تا مجددا در واکنش بعدی مورد استفاده قرار گیرد، که برای انجام اینکار به فورمات آمونیوم و بافر فسفات نیاز دارد (5،6). در کلونسازی ژنها می توان ژن یک پروتئین با اهمیت جانوری یا گیاهی را از میزبان طبیعی جدا کرد، درون یک حامل قرار داد و به درون باکتری فرستاد. اگر مراحل به درستی صورت پذیرفته باشد، پروتئین نوترکیب توسط سلول باکتری ساخته میشود. در چنین حالتی میتوان مقادیر زیادی پروتئین بهدست آورد (7). تولید یک پروتئین در شرایط مختلف داخل باکتری متفاوت است. زمانی استفاده از یک آنزیم در فرآیندهای صنعتی از نظر اقتصادی توجیهپذیر است که بتوان این آنزیم را به مقدار زیاد در محیط کشت تولید و خالص کرد. فاکتورهای مهمی در بیان پروتئینهای نوترکیب در E.coli نقش دارند از این فاکتورها میتوان به سرعت همزدن محیط، زمان القا بیان، مدت بیان، غلظت القا کننده، نوع پروموتور، دما، ترکیبات محیط کشت، pH و نوع منبع کربن اشاره کرد، روشهای سنتی بهینهسازی بهدلیل اینکه بیان هر فاکتور را جداگانه بررسی میکرد اما بهدلیل عدم محاسبه تاثیر فاکتورها بر هم معمولاً کار آمد نبوده و بسیار وقتگیر میباشند. امروزه روشهای طراحی آزمایش میتوانند سرعت آزمایشهای بهینهسازی بیان را کاهش داده و تاثیر عوامل مختلف بر یگدیگر را مشخص کنند و شرایط بهینه تولید بیان هر پروتئین را مشخص میکند (8). یکی از روشهایی که میتوان برای طراحی آزمایش استفاده کرد استفاده از روش تاکوچی است مزیت این روش کاهش تعداد آزمایشات، امکان بررسی تاثیر عوامل مختلف بر یکدیگر و تعیین سطوح بهینه آزمایش میباشد (9). هدف این تحقیق کلونینگ و بهینهسازی بیان ژن آنزیم فورمات دهیدروژناز در باکتری E.coliو همچنین ارزیـابی اثـر غلظتهای مختلف IPGT، اصلاح کننده، زمان القا و محیط کشت بر بیان آنزیم فورمات دهیدروژناز و بهینهسازی میباشد.
روش بررسی
پس از انتخاب توالی ژن آنزیم فورمات دهیدروژناز و بهینهسازی کدون، این ژن برای سنتز به شرکت پیشگامان انتقال ژن ارسال و در داخل وکتور pET28α کلون گردید. به منظور مستعد کردن باکتریها برای دریافت وکتور نوترکیب از محلول کلرید کلسیم 100میلیمولار استفاده شد و ترانسفورم کردن باکتریها با استفاده از شوک حرارتی در دمای 42 درجه سانتیگراد به مدت 90 ثانیه انجام شد. و باکتریها به محیط کشت آگار حاوی آنتیبیوتیک کانامایسین کشت شد و به مدت 18 ساعت داخل انکوباتور 37 درجه سانتیگراد قرار گرفت. به منظور تایید وجود قطعه ژن آنزیم فورمات دهیدروژناز در کلونیهای تشکیل شده از روش Colony-PCR استفاده شد. ابتدا کلونیهایی بهدست آمده از مرحله قبل با استفاده از آنس استریل در کنار شعله روی محیط LB جامد حاوی کانامایسین مجدداً کشت داده شد و به مدت 18ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت. برای انجامPCR از پرایمرهای اختصاصی که با نرم افزار Gene Runer ورژن 6 طراحی شده بودند استفاده شد. مخلوط PCR با استفاده از 2/5 ماکرولیتر بافر 10X، 0/5 ماکرولیتر از پرایمر مستقیم (GGATCC ATGAAAATCGTTCT) و معکوس (AAGCTTTCATTAAGCAAC) با غلظت 10 پیکومولار و 1/5 ماکرولیتر MgCl2 با غلظت 50 میلی مولار همراه با 20 ماکرولیتر آب فاقد DNase تهیه شد. به جای استفاده از DNA الگو سر سمپلر را به کلونیهای تشکیل شده تماس مختصری داده و در درون مخلوط PCR قرار داده شد. یک کنترل منفی (فاقد باکتری) و یک کنترل مثبت (پلاسمید حاوی ژن آنزیم فورمات دهیدروژناز) تهیه شد. یکی از کلون های مثبت کشت داده شد و پلاسمید آن با استفاده از کیت تخلیص پلاسمید شرکت اینویتروژن طبق پروتکل شرکت تخلیص گردید و از این پلاسمید بهدست آمده برای تراسفرم باکتری E.coli استفاده شد. به منظور تایید نتیجه Colony-PCR همچنین بررسی پلاسمید تخلیص شده نمونهها داخل ژل اگاروز 1/5 % الکتروفورز شد. آگارز در بافر TBE 1X حل شد و درون ماکروویو تا انحلال کامل اگارز و شفاف شدن محلول حرارت داده شد. سپس مقدار 0/5میکرولیتر رنگ DNA safe stain داخل آن زده شد و این محلول داخل کاست ژل حاوی شانه ریخته شد. بعد از بستن ژل نمونه ها به همراه بافر لودینگ 6x در کنار DNA size marker به مدت یک ساعت با ولتاژ 80 درون بافرTBE 1xالکتروفورز شد. بـه منظـور انتخـاب کلونی که بیشترین توانایی تولید پروتئین را دارد، بیان کلی پـروتئین در کلـونیها باکتری E.coli که در تست PCR از نظر وجود ژن فورمات دهیدروژنلز مثبت بودند به محیط کشت LB حاوی کانامایسین منتقل و پس از رسیدن OD رشد باکتری به 6/0 در طول موج 600 توسط IPTG القا شدند. و نتایج بـا استفاده از SDS-PAGE آنالیز شد. به نمونه کلونیهای مختلف، 70 میکرولیتر بافر لیز که بـاPMSF 90 میلیمولار (2 میکرولیتر به ازای هر میلیلیتر بافر لیز) و آنزیم لیزوزیم 125 میکروگرم بر میلیلیتر (4 میکرولیتر به ازای هر میلیلیتر بافر لیز) ترکیب شده است اضافه شد و رسوب داخل آن کـاملاً حل گردید. سپس به مدت 30 دقیقه روی یـخ انکوبـه شد. پس از لیز کامل نمونهها به روش فریز - دفریز، سانتریفیوژ با دور g16000 به مدت 5 دقیقه انجام و رسوب از سوپرناتانت جدا شد. در مرحله بعـد بـا اسـتفاده از منحنـی اسـتاندارد برادفـورد غلظـت نمونهها برای بررسی میزان بیان در فاز محلول محاسبه شد. در این مرحله به منظـور مقایسـه صـحیح میزان پروتئین بیانی در فاز محلول باکتریها غلظت یکسان از نمونهها برداشته شد و با بافر نمونه X2 مخلوط گردید. نمونهها به مدت 5 دقیقه در دمای 95 درجه سانتیگراد حرارت داده شد. نمونهها با توجه به حجمهای محاسبه شده به روشSDS -PAGE الکتروفورز گردید. با توجه به تاثیر دما و غلظت و نوع محیط کشت بر میزان بیان پروتئین، به منظور بررسی دقیقتـر این 3 فاکتور بر بیان پروتئین از طراحی آزمایش به روش تاکوچی . با آرایه متعامد ارتوگونال L8 استفاده شده است. فاکتورهای انتخابی شامل زمان، غلظت ITPG، نوع محیط کشت و نوع القا کننده همگی در دو سطح و طبق جدول 1 بررسی شد.
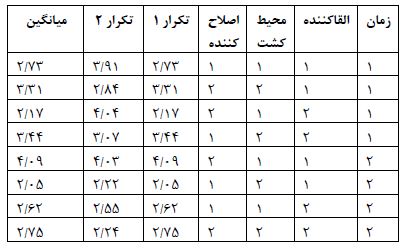
جدول 1 طراحی آزمایش.A نشان دهنده محیط کشت LB و B نشاندهنده محیط کشت 2YT، عدد 1 نشاندهنده کمترین و عدد 2 نشان دهنده بیشترین مقدار متغیر که برای زمان 24 و 48 ساعت بعد القا بیان پروتئین و برای غلظت IPTG برابر 0/1 و 1 میلیمولار میباشد. برای دمای25 درجه سانتیگراد نیز مراحل فوق به همین شکل انجام شد با این تفـاوت که بعد از رسیدن به OD= 0/6 نمونهها به مدت 20 دقیقه در دمای 25درجه سانتیگراد قـرار گرفتنـد و پس از رسیدن به این دما القاگر اضافه شد.
تجزیه و تحلیل آماری
به منظور مقایسه بیان پروتئین در نمونههای مختلف ژل SDS-PAGE پس از اسکن با استفاده از نسخه چهار نرمافزار ImageJ آنالیز گردید. در نهایت آنالیز روی دادههـای حاصـل با استفاده از نرم افزار mini tab انجـام شد.
برای تعیین غلظت پروتئین یک محلول به روش برادفورد، ابتدا باید منحنی استاندارد رسم شـود. برای تهیه منحنی استاندارد ابتدا 1 میلیگرم BSA در یک میلیلیتر آب مقطر حل گردید سپس بهصورت سریالی غلظتهای مختلف از این استوک ساخته شد. برای تخلیص پروتئین از محیط کشت از ستون رزین کروماتوگرافی Ni-NTA استفاده شد.
جدول 1: طراحی آزمایش به روش تاکوچی
نتایج
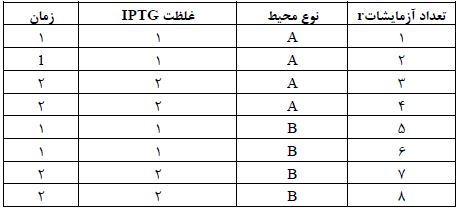
نتایج حاصل از Colony-PCR کلنیهای رشد یافته بر روی محیط حاوی آنتیبیوتیک کانامایسین نشان داد کلنیهای شماره 1،2 و 4 حاوی ژن فوزمات دهیدروژناز میباشند (شکل1). شکل 1 نتایج Colony-PCR وکتور نوترکیـب را نشـان مـیدهـد. نتـایج نشان داد کلونی های تشکیل شده بر روی محیط کانامایسین از نظر وجـود ژن فورمات دهیدروژناز مثبـت هستند. چاهک ها به ترتیب از راست به چپ شامل. کنترل منفی، کنترل مثبت، سایز مارکر DNA، 4 کلنی بعد ترانسفرم
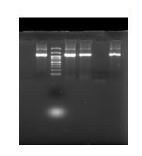
بررسی بیان پروتئین در دمای 15، 25 و 37 درجه سانتیگراد انجام شد. در دمای 15 درجه سانتیگراد آنزیم فرمات دهیدروژناز بیان نشد (دادهها نشان داده نشده است). (در شکل 2) بررسی بیان در دمای 37 و 25 درجه سانتیگراد بر روی ژل SDS PAGE نشان میدهد در مقایسه با نمونه کنترل (نمونه حاوی پلاسمید فاقد القاکننده IPTG) حاوی باند پروتئین کمتر از 60 کیلو دالتن در مقایسه با پروتئین آلبومین میباشد. بنابراین دو دمای 25 و 37 درجه سانتیگراد برای طراحی آزمایش در نظر گرفته شد.
پس از بررسیهای انجام شده با توجه به اینکه بیان آنزیم فورمات دهیدروژناز در دمای 37 درجه سانتیگراد بهصورت نامحلول بود از دمای 25 درجه سانتیگراد برای بهینهسازی بیان استفاده شد.
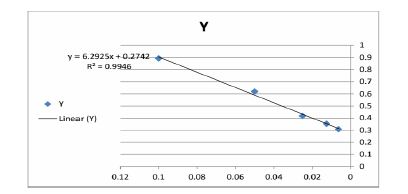
برای تعیین غلظت ژن آنزیم فورمات دهیدروژناز از تست برادفورد استفاده شد. ابتدا نمـودار اسـتاندارد بـا اسـتفاده از سریال رقت پروتئین BSA رسم شد. معادله بهدست آمده از این نمودار برای محاسبه غلظت نمونهها استفاده شد نمودار1. به منظور بررسی و بهینه سازی بیان پروتئین طراحی آزمایش به روش فول فاکتوریل انجام شد. چهار فاکتور به عنوان متغیرهای موثر در بیان پروتئین در نظر گرفته شد. متغیر غلظت IPTG با دو غلظت 1/0 و 1 میلیمولار، متغیر زمان در 24و 48 ساعت، متغیر محیط کشت با استفاده از 2 محیط کشت2YT و LB و متغیر اصلاح کننده سوربیتول بود که مورد بررسی قرار گرفت. نتایج حاصل از تولید پروتئین طبق مدلهای آزمایش در جدول 2 آورده شده است.
مدت زمان انکوباسیون پس القا به عنوان یک فاکتور مهم در تولید ژن آنزیم فورمات دهیدروژناز در نظر گرفته میشود. در این مطالعه بیان در زمانهای 24 و 48 ساعت پس از القا در دمای 25 درجه سانتیگراد (در غلظتهای متفاوت القاگر) جهت تولیـد پـروتئین نوترکیـب در فاز محلول بررسی شد. )شکلهای 3 تا 6). بیان پروتئین نوترکیب در هر 2 زمان 24 ساعت و 48 ساعت پس از القا تفاوت ندارد. نوع محیط کشت تاثیر چندانی در بیان پروتئین ندارد. حضور سوربیتول بیان در فاز مایع را افزایش میدهد. کاهش غلظت IPTG باعث کاهش تولید پروتئین میشود (نمودار 2 و 3). تخلیص پروتئین در دمای 25 درجه سانتیگراد، در محیط کشت LB به همراه 0/1 میکرومولار IPTG و یک سیسی سوربیتول طی 24 ساعت انجام پذیرفت. پس از انجام فرایند تخلیص پروتئین نوترکیب بهوسیله ستون رزین Ni NTA برای محیط کشت و بیدهای مگنتی Ni NTA برای لیز باکتری، نمونـه پـروتئین خـالص شده توسط PAGE-SDS ارزیابی شد (شکل 7). تخلیص پروتئین در دمای به منظور تایید بیان آنزیم فورمات دهیدروژناز، نمونههای کنترل مثبت و منفی بعد از الکتروفورز در ژل پلیآکریلآمید به کاغذ نیتروسلولز منتقل شدند و با استفاده از آنتیبادی آنتیهیستیدین بیان پروتئین بیان پروتئین به اثبات رسید (شکل 8).
شکل 1 نتایج Colony-PCR کلنیهای رشد یافته بر روی محیط حاوی کانامایسین
شکل 2: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت LB در دمای 25 و 37 درجه سانتیگراد
A. سایز مارکر پروتئین آلبومین. B. کنترل منفی. C. محیط کشت باکتری. D. بیان باکتری دمای 37 درجه سانتیگراد. E. بیان باکتری دمای 25 درجهسانتیگراد
نمودار 1: بررسی اثر محیط کشت، زمان القا، اصلاح کننده وغلظت القاگر بر بیان پروتئین نوترکیب
جدول2: نتایج حاصل از تولید پروتئین طبق مدلهای مختلف طراحی آزمایشات بهینهسازی تولید پروتئین
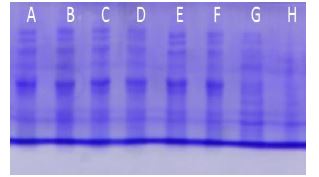
شکل 3: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت 2YT در دمای 25 درجه سانتیگراد با غلطتهای 0/1 و 1 میکرومولار از IPTG پس از 24 ساعت از القا
A و E: محیط کشت 2YT و غلظت M1µ IPTG پس از 24 ساعت از القا
B و F: محیط کشت 2YT و غلظتM µ0/1 IPTG پس از 24 ساعت از القا
C: محیط کشت 2YT و غلظت M1µ IPTG به همراه 4/39 میلی مولار سوربیتول پس از 24 ساعت از القا
D: محیط کشت 2YT و غلظتMµ0/1 IPTG به همراه 4/39 میلی مولار سوربیتول پس از 24 ساعت از القا
G: محیط کشت 2YT (کنترل منفی) پس از 24 ساعت از القا- H: سایز مارکر پروتئین

شکل 4: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت 2YT در دمای 25 درجه سانتیگراد با غلظتهای 0/1 و 1 میکرومولار از IPTG پس از 48 ساعت از القا
A و E: محیط کشت 2YT و غلظت M1µ IPTG پس از 48 ساعت از القا
B و F: محیط کشت 2YT و غلظتM µ0/1 IPTG پس از 48 ساعت از القا
C: محیط کشت 2YT و غلظت M1µ IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا
D: محیط کشت 2YT و غلظتM 1µ/0 IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا
G: پروائین آلبومین به عنوان. H: محیط کشت 2YT (کنترل منفی) پس از 48 ساعت از القا
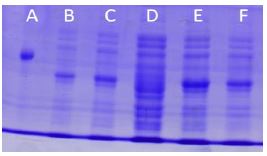
شکل 5: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت LB در دمای 25 درجه سانتیگراد با غلظتهای 1/0 و 1 میکرومولار از IPTG پس از 24 ساعت از القا
A: پروائین آلبومین به عنوان سایز مارکر پروتئین
B: محیط کشت LB و غلظت M1µ IPTG به همراه 4/39 میلیمولار سوربیتول پس از 24 ساعت از القا
C وF: محیط کشت LB و غلظتM µ0/1 IPTG به همراه 4/39 میلیمولار سوربیتول پس از 24 ساعت از القا
D: محیط کشت LB (کنترل منفی) پس از 24 ساعت از القا
E: محیط کشت LB و غلظت M1µ IPTG پس از 24 ساعت از القا

شکل 6: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت LB در دمای 25 درجه سانتیگراد با غلظت های 1/0 و 1 میکرومولار از IPTG پس از 48 ساعت از القا
A: پروائین آلبومین به عنوان سایز مارکر پروتئین
B: محیط کشت LB (کنترل منفی) پس از 48 ساعت از القا
C وG: محیط کشت LB و غلظت M µ0/1 IPTG پس از 48 ساعت از القا
H وD: محیط کشت LB و غلظت M1µ IPTG پس از 48 ساعت از القا
E: محیط کشت LB و غلظت M1µ IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا
F: محیط کشت LB و غلظت M µ0/1 IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا
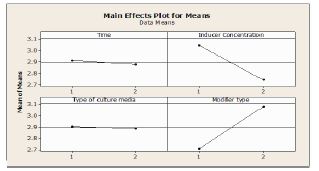
نمودار2: بررسی اثر محیط کشت، زمان القا، اصلاح کننده وغلظت القاگر بر بیان پروتئین نوترکیب
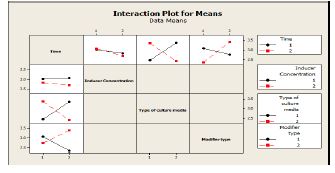
نمودار 3: بررسی اثر اصلاح کننده، زمان، غلظت القاگر و محیط کشت بر یک دیگر

شکل7: مراحل تخلیص پروتئین محیط کشت
A. -
B. نمونه Elusoin.
C. نمونه شست و شو بار دوم
D. نمونه شست و شو بار اول
E. نمونه مرحله اتصال
F. نمونه بعد لیز باکتری
G. نمونه جمع آوری شده قبل از لیز باکتری
H. سایز مارکر پروتئین

شکل8: تایید اختصاصیت پروتئین با استفاده از وسترن بلات
A. سایز مارکر پروتئینی B . نمونه لیز یاکتری حاوی پلاسمید نوترکیب .Cکنترل منفی
بحث
یکی از مهمترین مراحل در تولید آنزیمها برای استفاده در شزایط صنعتی مقدار تولید و تولید آنزیم با تاخوردگی مناسب داخل میزبان میباشد. تاخوردگی وپیچش نادرست پروتئینها مشکل مهمی در تولید پروتئین نوترکیب درباکتری میباشد. پلیپپتیدهای خارجی مخصوصاً وقتی که به میزان زیاد تولید میشوند بهصورت اینکلوژن بادیها در سلول تجمع مییابند به همین دلیل از طریق مهندسی پروتئین و شرایط استراتژیهایی برای افزایش محلولیت پروتئینها در باکتری E.coli معرفی شدهاند (10). یکی از استراتژیهای افزایش بیان پروتئین تغییر وکتور می باشد و به معنی تغییر پروموتور همراه ژن مدنظری که کون میشود و یا تغییر فیوژن تگ fusion tagکه بر محلولیت پروتئین نوترکیب بیانی تاثیر میگذارد میباشد (11). بهینهسازی شرایط تولید پروتئین نوترکیب تولید آن را از لحـاظ اقتصـادی بـه صـرفه مـیکنـد؛ پارامترهایی نظیر نوع میزبان، نوع محیط کشت، pH، دمای محیط کشت، مدت زمان انکوباسیون پـس از القا و غلظت IPTG در آن دخیل میباشد و تاکنون بررسیهای قابلتوجهی در زمینه افزایش بیـان و حلالیت پروتئین نوترکیب صورت گرفته است (12). اکثر روشهایی که در بیوتکنولوژی پروتئین نوترکیب استفاده میشود با استفاده از رویکرد یک فاکتور در زمان (OFAT one-factor-at-a-time) انجام شده و متعاقباً بهینهسازی میشود کـه تـأثیر تنهـا یک عامل در زمان یک عامل را در یک زمان بررسی میکند (13). با اینحال، برخی از فرآیند بیوشیمیایی تحتتأثیر فعـل و انفعالات متغیرهای آزمایشی بر هم قرار میگیرند. بهترین روش برای بررسی تـأثیر عوامـل متعـدد و همچنین تأثیر فعل و انفعالات آنها بر فرآیند آزمایش، روش طراحـی آمـاری آزمایشـات است. از این روشهای آماری برای ارزیابی متغیرهایی که بیشـترین تـأثیر را در تولید پروتئین نوترکیب مورد بررسی از نظر عملکرد، کیفیت محصول، خلـوص و حلالیـت دارنـد استفاده شده است. (13،14). با توجه به سـاختار آنزیم فورمات دهیدروژناز و افزوده شدن دنباله وکتور به پروتئین نوترکیب بیانی وزن آن حـدود 48 کیلودالتون تخمین زده میشود کـه وزن آن روی ژل SDS-PAGEپـس از رنـگآمیـزی حـدود 48 کیلودالتون بود. که با پیشبینی انجام شده مطابقت داشت. دمای بالا میتواند رشد سلول را افزایش دهد، اما برای بیان پروتئین مضر است زیرا سرعت رشد بالاتر منجر به احتمال بیشتر از دست دادن پلاسمید میشود و باعث تقسیم نادرست حامل بیان و عـدم بیان ژن نوترکیب میشود، به خصوص در بیان سلول حامـل پلاسـمید دمـای اپتـیمم در زمـان القای پروتئین بین 15-25 درجه سانتیگراد در نظر گرفته میشود (15،16). از آنجا که این دما بـرای پـروتئینهای مختلف متفاوت میباشد بنابراین دمای مناسب برای تولید یک پروتئین نوترکیب توسط میزبـان باید بهدست آید. از این رو مطالعه حاضر نشان داد بیشترین بیان پروتئین در فاز محلول در دمای 25 درجـه سانتیگراد بعـد از گذشـت 24 ساعت از زمان القا اتفاق میافتد. القا معمولاً در فاز اولیه یا میانه فاز لگاریتمی اتفاق میافتد. هرچند گزارشها نشان میدهند که القـا در انتهای فاز لگاریتمی یا حتی در فاز سکون نیز میتواند بر محلولیت پروتئین و بیـان کلـی پـروتئین تاثیرگذار باشد. بهطورکلی القا در زمان ابتدای فاز لگاریتمی بهترین نتیجه را دارد. القـا در فـاز سـکون کاملا اثر منفی دارد و موجب از دست رفتن بیان کلی برای بسیاری از پروتئینها میشود. همچنین بـر محلولیت پروتئین نیز تاثیر منفی دارد (17). در این مطالعه زمان القا با توجه به بررسیهای اولیه ثابت در نظر گرفته شد. غلظت معمـول IPTG بـرای بیـان پـروتئین نوترکیـب بطـور معمـول بـین 1-0/1 میلیمولار است. هرچند غلظت IPTG بین 0 تا 1 میلیمولار بر سرعت رشـد خـاص باکتری E.coli تـأثیر نمـیگذارد اما مقدار بیشـتر القـا کننـده در محـیط منجـر بـه بیـان مقـادیر بـالاتری از پـروتئین نوترکیـب میشود (15،18). در مطالعه حاضر کاهش غلظت IPTG باعث افزایش تولید پروتئین در فاز محلول شـد و غلظت 0/1 میلیمولار IPTG تاثیر بیشتری در بیان پروتئین به صورت محلول داشت که نشان میدهـد بـرای هـر نـوع پروتیین نیاز به بررسی غلظت بهینه IPTG داریم. غلظت برخی نمکها، پپتون و مخمرعصاره میتوانـد غلظـت پـروتئین نوترکیـب مـوردنظـر را افزایش دهد. محیطهای مختلف نظیر LB،TB و2YT میتوانند جهت بهینـهسـازی بیـان پـروتئین مورد استفاده قرار بگیرد (19،20). مطالعات نشان میدهد هر دو ترکیب محیط کشت و شـرایط کشـت بـرای بیـان پـروتئین مهـم هستند. محیط Luria broth (LB) به راحتی ساخته میشود و حاوی بیشترین مـاده مـورد نیـاز بـرای کشت باکتری E.coli است. با اینحال، رشد باکتری E.coli درLB با تراکم نسبتاً کمـی متوقـف میشود، زیـرا حاوی مقادیر کم کربوهیدرات و کاتیونهای دو ظرفیتی است (10). در این مطالعه برای بررسی اثر نوع محیط کشت بر بیان پروتئین نوترکیب از دو محـیط LBو 2YT استفاده شد. نتایج نشان داد محیط LB که از تریپتون (مسـئول تـامین پپتیـدهـا و آمینواسید)، عصاره مخمر (مسئول تامین ویتامینها و مواد ضروری) و سدیم کلراید (تـامین سـدیم و بالانس اسمتیک) تشکیل شده است، مناسب ترین محیط برای بیان آنزیم فورمات دهیدروژناز در باکتری است. مطالعات نشان داده وجود مقادیری از سوربیتول سبب افزایش بازده و ثبات نتایج در محیط الکتروپوراسیون میشود. علاوه بر این، چاپرونهای شیمیایی اسمولیت مانند گلیسرول، پرولین و سوربیتول، هنگامیکه در غلظتهای کم به محیط رشد اضافه میشوند، ممکن است محیط میکرو مناسبتری را برای تاخوردگی بهتر پروتئین فراهم کند (21،22). طی این مطالعه نیز مشاهده شد وجود سوربیتول سبب افزایش بیان آنزیم فورمات دهیدروژناز میشود. مقدار ژن آنزیم فورمات دهیدروژناز تولیدی در تحقیق حاضر برابر 0/2059 میکروگرم بر میلیلیتر از میلیلیتر محـیط کشـت بود، هر چند با توجه به خصوصیت یک ژن بیان آن در میزبانهای مختلف متفـاوت اسـت مطالعه حاضر نشان داد روش فول فاکتوریل نیز میتواند برای بررسی نقطه بهینه بیان آنزیم فورمات دهیدروژناز مناسب باشد. بدیهی است که استفاده از روش فول فاکتوریل برای طراحی آزمایش نهتنها تعداد دفعات آزمایش را کاهش میدهد بلکه می تواند با بررسی همزمان فاکتورهای مختلف تاثیر فاکتورهای مختلف بر یکدیگر را محاسبه کند و به این ترتیب نقطه بهینه بیان پروتئین را حساب کند. و این روش در مقایسه با روش های قدیمی که در هر زمان فقط یک فاکتور بررسی میشود میتواند در زمان کوتاهتری انجام شود و در نتیجه دفعات آزمایش و کاهش مواد مصرفی را به همراه خواهد داشت.
نتیجهگیری
در این مطالعه اثر اصلاح کننده، غلظت القا کننده، مدت زمان پس از القا و نوع محیط کشت بر میزان بیـان ژن آنزیم فورمات دهیدروژناز مورد بررسی قرار گرفت. طراحی آزمـایش بـا کمـک روش فـول فاکتوریـل انجـام گرفت که در مقایسه با روشهای سنتی با کم کردن تعداد آزمایشات و ادغام فاکتورها توانسـت تمـام حالتهای آزمایش و تاثیر فاکتورها بر یکدیگر را در نظر بگیرد. نتایج نشـان داد وجود سوربیتول و کاهش غلظت IPTG) 0/1 میلیمولار) بر بیان آنزیم فورمات دهیدروژناز تاثیر مثبت میگذارد و در زمان 24 ساعت پس از القا بیشترین مقـدار ژن آنزیم فورمات دهیدروژناز تولید شد. همچنین محیط LB بهعنوان بهترین محیط برای بیان بهینه ژن آنزیم فورمات دهیدروژناز شناسایی شد.
سپاسگزاری
مطالعه حاضر حاصل از.طرح شماره 8912 تصویب شده در دانشگاه علوم پزشکی شهید صدوقی یزد میباشد.
حامی مالی:از معاونت تحقیقات و فناوری دانشگاه علوم پزشکی شهید صدوقی یزد برای حمایت مالی از این طرح تشکر و قدردانی میشود.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد مورد تایید قرار گرفته است. (کد اخلاق: IR.SSU.MEDICINE.REC.1399.156)
مشارکت نویسندگان
مریمالسادات نبوینیا در ارائه ایده، محبوبه نبوینیا. در طراحی مطالعه، محمدرضا حاجیزاده در جمعآوری دادهها، محمد جعفری کاخکی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
افزایش غلظت گازهای گلخانهای و عوارض ناشی از آن و بهویژه گرم شدن تدریجی زمین باعث توجه جهانی در اصلاح این پدیده و انتقال سیستمهای انرژی از سوختهای فسیلی به منابع قابل تجدید گردیده است. این سوختها که شامل بیواتانول، بیومتانول، بیوهیدروژن و بیودیزل میباشد، میتواند به عنوان جایگزینی برای سوخت های فسیلی بهکار گرفته شود. هر چند سوختن سوختهای زیستی باعث کاهش تولیدCO2 Carbon dioxide و آلودگی کمتر محیط زیست میشوند اما در فرآیند تولید آنها حذف فلور میکروبی نرمال از روی پیش ساز این سوختها ضروری است و همین امر باعث میشود در فرایند آماده سازی و تولید آنها مقدار زیادی CO2 تولید شود. بنابراین یافتن راههای جایگزین برای تولید آنها به منظور کاهش تولید CO2 مهم است (3-1). آنزیم فورمات دهیدروژناز قادر به کاهش الکتروشیمیایی CO2 در تبدیل آن به فورمات بوده که در نهایت توسط آنزیم الکل دهیدروژناز می تواند به متانول تبدیل شود. که این امر می تواند تولید سوختهای زیستی مانند متانول را با کاهش تولید CO2 و کاهش آلودگی محیط زیست همراه کند (4). علاوه براین این آنزیم از آنزیمهای کلیدی در بیوسنتر داروی ساکساگلیپتین می باشد. در طول واکنش انجام شده برای تولید ماده حد واسط داروی ساکساگلیپتین، فورماتدهیدروژناز NAD بهNADH Nicotinamide adenine dinucleotide تبدیل میکند تا مجددا در واکنش بعدی مورد استفاده قرار گیرد، که برای انجام اینکار به فورمات آمونیوم و بافر فسفات نیاز دارد (5،6). در کلونسازی ژنها می توان ژن یک پروتئین با اهمیت جانوری یا گیاهی را از میزبان طبیعی جدا کرد، درون یک حامل قرار داد و به درون باکتری فرستاد. اگر مراحل به درستی صورت پذیرفته باشد، پروتئین نوترکیب توسط سلول باکتری ساخته میشود. در چنین حالتی میتوان مقادیر زیادی پروتئین بهدست آورد (7). تولید یک پروتئین در شرایط مختلف داخل باکتری متفاوت است. زمانی استفاده از یک آنزیم در فرآیندهای صنعتی از نظر اقتصادی توجیهپذیر است که بتوان این آنزیم را به مقدار زیاد در محیط کشت تولید و خالص کرد. فاکتورهای مهمی در بیان پروتئینهای نوترکیب در E.coli نقش دارند از این فاکتورها میتوان به سرعت همزدن محیط، زمان القا بیان، مدت بیان، غلظت القا کننده، نوع پروموتور، دما، ترکیبات محیط کشت، pH و نوع منبع کربن اشاره کرد، روشهای سنتی بهینهسازی بهدلیل اینکه بیان هر فاکتور را جداگانه بررسی میکرد اما بهدلیل عدم محاسبه تاثیر فاکتورها بر هم معمولاً کار آمد نبوده و بسیار وقتگیر میباشند. امروزه روشهای طراحی آزمایش میتوانند سرعت آزمایشهای بهینهسازی بیان را کاهش داده و تاثیر عوامل مختلف بر یگدیگر را مشخص کنند و شرایط بهینه تولید بیان هر پروتئین را مشخص میکند (8). یکی از روشهایی که میتوان برای طراحی آزمایش استفاده کرد استفاده از روش تاکوچی است مزیت این روش کاهش تعداد آزمایشات، امکان بررسی تاثیر عوامل مختلف بر یکدیگر و تعیین سطوح بهینه آزمایش میباشد (9). هدف این تحقیق کلونینگ و بهینهسازی بیان ژن آنزیم فورمات دهیدروژناز در باکتری E.coliو همچنین ارزیـابی اثـر غلظتهای مختلف IPGT، اصلاح کننده، زمان القا و محیط کشت بر بیان آنزیم فورمات دهیدروژناز و بهینهسازی میباشد.
روش بررسی
پس از انتخاب توالی ژن آنزیم فورمات دهیدروژناز و بهینهسازی کدون، این ژن برای سنتز به شرکت پیشگامان انتقال ژن ارسال و در داخل وکتور pET28α کلون گردید. به منظور مستعد کردن باکتریها برای دریافت وکتور نوترکیب از محلول کلرید کلسیم 100میلیمولار استفاده شد و ترانسفورم کردن باکتریها با استفاده از شوک حرارتی در دمای 42 درجه سانتیگراد به مدت 90 ثانیه انجام شد. و باکتریها به محیط کشت آگار حاوی آنتیبیوتیک کانامایسین کشت شد و به مدت 18 ساعت داخل انکوباتور 37 درجه سانتیگراد قرار گرفت. به منظور تایید وجود قطعه ژن آنزیم فورمات دهیدروژناز در کلونیهای تشکیل شده از روش Colony-PCR استفاده شد. ابتدا کلونیهایی بهدست آمده از مرحله قبل با استفاده از آنس استریل در کنار شعله روی محیط LB جامد حاوی کانامایسین مجدداً کشت داده شد و به مدت 18ساعت در انکوباتور 37 درجه سانتیگراد قرار گرفت. برای انجامPCR از پرایمرهای اختصاصی که با نرم افزار Gene Runer ورژن 6 طراحی شده بودند استفاده شد. مخلوط PCR با استفاده از 2/5 ماکرولیتر بافر 10X، 0/5 ماکرولیتر از پرایمر مستقیم (GGATCC ATGAAAATCGTTCT) و معکوس (AAGCTTTCATTAAGCAAC) با غلظت 10 پیکومولار و 1/5 ماکرولیتر MgCl2 با غلظت 50 میلی مولار همراه با 20 ماکرولیتر آب فاقد DNase تهیه شد. به جای استفاده از DNA الگو سر سمپلر را به کلونیهای تشکیل شده تماس مختصری داده و در درون مخلوط PCR قرار داده شد. یک کنترل منفی (فاقد باکتری) و یک کنترل مثبت (پلاسمید حاوی ژن آنزیم فورمات دهیدروژناز) تهیه شد. یکی از کلون های مثبت کشت داده شد و پلاسمید آن با استفاده از کیت تخلیص پلاسمید شرکت اینویتروژن طبق پروتکل شرکت تخلیص گردید و از این پلاسمید بهدست آمده برای تراسفرم باکتری E.coli استفاده شد. به منظور تایید نتیجه Colony-PCR همچنین بررسی پلاسمید تخلیص شده نمونهها داخل ژل اگاروز 1/5 % الکتروفورز شد. آگارز در بافر TBE 1X حل شد و درون ماکروویو تا انحلال کامل اگارز و شفاف شدن محلول حرارت داده شد. سپس مقدار 0/5میکرولیتر رنگ DNA safe stain داخل آن زده شد و این محلول داخل کاست ژل حاوی شانه ریخته شد. بعد از بستن ژل نمونه ها به همراه بافر لودینگ 6x در کنار DNA size marker به مدت یک ساعت با ولتاژ 80 درون بافرTBE 1xالکتروفورز شد. بـه منظـور انتخـاب کلونی که بیشترین توانایی تولید پروتئین را دارد، بیان کلی پـروتئین در کلـونیها باکتری E.coli که در تست PCR از نظر وجود ژن فورمات دهیدروژنلز مثبت بودند به محیط کشت LB حاوی کانامایسین منتقل و پس از رسیدن OD رشد باکتری به 6/0 در طول موج 600 توسط IPTG القا شدند. و نتایج بـا استفاده از SDS-PAGE آنالیز شد. به نمونه کلونیهای مختلف، 70 میکرولیتر بافر لیز که بـاPMSF 90 میلیمولار (2 میکرولیتر به ازای هر میلیلیتر بافر لیز) و آنزیم لیزوزیم 125 میکروگرم بر میلیلیتر (4 میکرولیتر به ازای هر میلیلیتر بافر لیز) ترکیب شده است اضافه شد و رسوب داخل آن کـاملاً حل گردید. سپس به مدت 30 دقیقه روی یـخ انکوبـه شد. پس از لیز کامل نمونهها به روش فریز - دفریز، سانتریفیوژ با دور g16000 به مدت 5 دقیقه انجام و رسوب از سوپرناتانت جدا شد. در مرحله بعـد بـا اسـتفاده از منحنـی اسـتاندارد برادفـورد غلظـت نمونهها برای بررسی میزان بیان در فاز محلول محاسبه شد. در این مرحله به منظـور مقایسـه صـحیح میزان پروتئین بیانی در فاز محلول باکتریها غلظت یکسان از نمونهها برداشته شد و با بافر نمونه X2 مخلوط گردید. نمونهها به مدت 5 دقیقه در دمای 95 درجه سانتیگراد حرارت داده شد. نمونهها با توجه به حجمهای محاسبه شده به روشSDS -PAGE الکتروفورز گردید. با توجه به تاثیر دما و غلظت و نوع محیط کشت بر میزان بیان پروتئین، به منظور بررسی دقیقتـر این 3 فاکتور بر بیان پروتئین از طراحی آزمایش به روش تاکوچی . با آرایه متعامد ارتوگونال L8 استفاده شده است. فاکتورهای انتخابی شامل زمان، غلظت ITPG، نوع محیط کشت و نوع القا کننده همگی در دو سطح و طبق جدول 1 بررسی شد.
جدول 1 طراحی آزمایش.A نشان دهنده محیط کشت LB و B نشاندهنده محیط کشت 2YT، عدد 1 نشاندهنده کمترین و عدد 2 نشان دهنده بیشترین مقدار متغیر که برای زمان 24 و 48 ساعت بعد القا بیان پروتئین و برای غلظت IPTG برابر 0/1 و 1 میلیمولار میباشد. برای دمای25 درجه سانتیگراد نیز مراحل فوق به همین شکل انجام شد با این تفـاوت که بعد از رسیدن به OD= 0/6 نمونهها به مدت 20 دقیقه در دمای 25درجه سانتیگراد قـرار گرفتنـد و پس از رسیدن به این دما القاگر اضافه شد.
تجزیه و تحلیل آماری
به منظور مقایسه بیان پروتئین در نمونههای مختلف ژل SDS-PAGE پس از اسکن با استفاده از نسخه چهار نرمافزار ImageJ آنالیز گردید. در نهایت آنالیز روی دادههـای حاصـل با استفاده از نرم افزار mini tab انجـام شد.
برای تعیین غلظت پروتئین یک محلول به روش برادفورد، ابتدا باید منحنی استاندارد رسم شـود. برای تهیه منحنی استاندارد ابتدا 1 میلیگرم BSA در یک میلیلیتر آب مقطر حل گردید سپس بهصورت سریالی غلظتهای مختلف از این استوک ساخته شد. برای تخلیص پروتئین از محیط کشت از ستون رزین کروماتوگرافی Ni-NTA استفاده شد.
جدول 1: طراحی آزمایش به روش تاکوچی

نتایج
نتایج حاصل از Colony-PCR کلنیهای رشد یافته بر روی محیط حاوی آنتیبیوتیک کانامایسین نشان داد کلنیهای شماره 1،2 و 4 حاوی ژن فوزمات دهیدروژناز میباشند (شکل1). شکل 1 نتایج Colony-PCR وکتور نوترکیـب را نشـان مـیدهـد. نتـایج نشان داد کلونی های تشکیل شده بر روی محیط کانامایسین از نظر وجـود ژن فورمات دهیدروژناز مثبـت هستند. چاهک ها به ترتیب از راست به چپ شامل. کنترل منفی، کنترل مثبت، سایز مارکر DNA، 4 کلنی بعد ترانسفرم
بررسی بیان پروتئین در دمای 15، 25 و 37 درجه سانتیگراد انجام شد. در دمای 15 درجه سانتیگراد آنزیم فرمات دهیدروژناز بیان نشد (دادهها نشان داده نشده است). (در شکل 2) بررسی بیان در دمای 37 و 25 درجه سانتیگراد بر روی ژل SDS PAGE نشان میدهد در مقایسه با نمونه کنترل (نمونه حاوی پلاسمید فاقد القاکننده IPTG) حاوی باند پروتئین کمتر از 60 کیلو دالتن در مقایسه با پروتئین آلبومین میباشد. بنابراین دو دمای 25 و 37 درجه سانتیگراد برای طراحی آزمایش در نظر گرفته شد.
پس از بررسیهای انجام شده با توجه به اینکه بیان آنزیم فورمات دهیدروژناز در دمای 37 درجه سانتیگراد بهصورت نامحلول بود از دمای 25 درجه سانتیگراد برای بهینهسازی بیان استفاده شد.
برای تعیین غلظت ژن آنزیم فورمات دهیدروژناز از تست برادفورد استفاده شد. ابتدا نمـودار اسـتاندارد بـا اسـتفاده از سریال رقت پروتئین BSA رسم شد. معادله بهدست آمده از این نمودار برای محاسبه غلظت نمونهها استفاده شد نمودار1. به منظور بررسی و بهینه سازی بیان پروتئین طراحی آزمایش به روش فول فاکتوریل انجام شد. چهار فاکتور به عنوان متغیرهای موثر در بیان پروتئین در نظر گرفته شد. متغیر غلظت IPTG با دو غلظت 1/0 و 1 میلیمولار، متغیر زمان در 24و 48 ساعت، متغیر محیط کشت با استفاده از 2 محیط کشت2YT و LB و متغیر اصلاح کننده سوربیتول بود که مورد بررسی قرار گرفت. نتایج حاصل از تولید پروتئین طبق مدلهای آزمایش در جدول 2 آورده شده است.
مدت زمان انکوباسیون پس القا به عنوان یک فاکتور مهم در تولید ژن آنزیم فورمات دهیدروژناز در نظر گرفته میشود. در این مطالعه بیان در زمانهای 24 و 48 ساعت پس از القا در دمای 25 درجه سانتیگراد (در غلظتهای متفاوت القاگر) جهت تولیـد پـروتئین نوترکیـب در فاز محلول بررسی شد. )شکلهای 3 تا 6). بیان پروتئین نوترکیب در هر 2 زمان 24 ساعت و 48 ساعت پس از القا تفاوت ندارد. نوع محیط کشت تاثیر چندانی در بیان پروتئین ندارد. حضور سوربیتول بیان در فاز مایع را افزایش میدهد. کاهش غلظت IPTG باعث کاهش تولید پروتئین میشود (نمودار 2 و 3). تخلیص پروتئین در دمای 25 درجه سانتیگراد، در محیط کشت LB به همراه 0/1 میکرومولار IPTG و یک سیسی سوربیتول طی 24 ساعت انجام پذیرفت. پس از انجام فرایند تخلیص پروتئین نوترکیب بهوسیله ستون رزین Ni NTA برای محیط کشت و بیدهای مگنتی Ni NTA برای لیز باکتری، نمونـه پـروتئین خـالص شده توسط PAGE-SDS ارزیابی شد (شکل 7). تخلیص پروتئین در دمای به منظور تایید بیان آنزیم فورمات دهیدروژناز، نمونههای کنترل مثبت و منفی بعد از الکتروفورز در ژل پلیآکریلآمید به کاغذ نیتروسلولز منتقل شدند و با استفاده از آنتیبادی آنتیهیستیدین بیان پروتئین بیان پروتئین به اثبات رسید (شکل 8).

شکل 1 نتایج Colony-PCR کلنیهای رشد یافته بر روی محیط حاوی کانامایسین

شکل 2: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت LB در دمای 25 و 37 درجه سانتیگراد
A. سایز مارکر پروتئین آلبومین. B. کنترل منفی. C. محیط کشت باکتری. D. بیان باکتری دمای 37 درجه سانتیگراد. E. بیان باکتری دمای 25 درجهسانتیگراد

نمودار 1: بررسی اثر محیط کشت، زمان القا، اصلاح کننده وغلظت القاگر بر بیان پروتئین نوترکیب
جدول2: نتایج حاصل از تولید پروتئین طبق مدلهای مختلف طراحی آزمایشات بهینهسازی تولید پروتئین


شکل 3: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت 2YT در دمای 25 درجه سانتیگراد با غلطتهای 0/1 و 1 میکرومولار از IPTG پس از 24 ساعت از القا
A و E: محیط کشت 2YT و غلظت M1µ IPTG پس از 24 ساعت از القا
B و F: محیط کشت 2YT و غلظتM µ0/1 IPTG پس از 24 ساعت از القا
C: محیط کشت 2YT و غلظت M1µ IPTG به همراه 4/39 میلی مولار سوربیتول پس از 24 ساعت از القا
D: محیط کشت 2YT و غلظتMµ0/1 IPTG به همراه 4/39 میلی مولار سوربیتول پس از 24 ساعت از القا
G: محیط کشت 2YT (کنترل منفی) پس از 24 ساعت از القا- H: سایز مارکر پروتئین

شکل 4: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت 2YT در دمای 25 درجه سانتیگراد با غلظتهای 0/1 و 1 میکرومولار از IPTG پس از 48 ساعت از القا
A و E: محیط کشت 2YT و غلظت M1µ IPTG پس از 48 ساعت از القا
B و F: محیط کشت 2YT و غلظتM µ0/1 IPTG پس از 48 ساعت از القا
C: محیط کشت 2YT و غلظت M1µ IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا
D: محیط کشت 2YT و غلظتM 1µ/0 IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا
G: پروائین آلبومین به عنوان. H: محیط کشت 2YT (کنترل منفی) پس از 48 ساعت از القا

شکل 5: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت LB در دمای 25 درجه سانتیگراد با غلظتهای 1/0 و 1 میکرومولار از IPTG پس از 24 ساعت از القا
A: پروائین آلبومین به عنوان سایز مارکر پروتئین
B: محیط کشت LB و غلظت M1µ IPTG به همراه 4/39 میلیمولار سوربیتول پس از 24 ساعت از القا
C وF: محیط کشت LB و غلظتM µ0/1 IPTG به همراه 4/39 میلیمولار سوربیتول پس از 24 ساعت از القا
D: محیط کشت LB (کنترل منفی) پس از 24 ساعت از القا
E: محیط کشت LB و غلظت M1µ IPTG پس از 24 ساعت از القا

شکل 6: بیان ژن آنزیم فورمات دهیدروژناز در محیط کشت LB در دمای 25 درجه سانتیگراد با غلظت های 1/0 و 1 میکرومولار از IPTG پس از 48 ساعت از القا
A: پروائین آلبومین به عنوان سایز مارکر پروتئین
B: محیط کشت LB (کنترل منفی) پس از 48 ساعت از القا
C وG: محیط کشت LB و غلظت M µ0/1 IPTG پس از 48 ساعت از القا
H وD: محیط کشت LB و غلظت M1µ IPTG پس از 48 ساعت از القا
E: محیط کشت LB و غلظت M1µ IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا
F: محیط کشت LB و غلظت M µ0/1 IPTG به همراه 4/39 میلی مولار سوربیتول پس از 48 ساعت از القا

نمودار2: بررسی اثر محیط کشت، زمان القا، اصلاح کننده وغلظت القاگر بر بیان پروتئین نوترکیب

نمودار 3: بررسی اثر اصلاح کننده، زمان، غلظت القاگر و محیط کشت بر یک دیگر

شکل7: مراحل تخلیص پروتئین محیط کشت
A. -
B. نمونه Elusoin.
C. نمونه شست و شو بار دوم
D. نمونه شست و شو بار اول
E. نمونه مرحله اتصال
F. نمونه بعد لیز باکتری
G. نمونه جمع آوری شده قبل از لیز باکتری
H. سایز مارکر پروتئین

شکل8: تایید اختصاصیت پروتئین با استفاده از وسترن بلات
A. سایز مارکر پروتئینی B . نمونه لیز یاکتری حاوی پلاسمید نوترکیب .Cکنترل منفی
بحث
یکی از مهمترین مراحل در تولید آنزیمها برای استفاده در شزایط صنعتی مقدار تولید و تولید آنزیم با تاخوردگی مناسب داخل میزبان میباشد. تاخوردگی وپیچش نادرست پروتئینها مشکل مهمی در تولید پروتئین نوترکیب درباکتری میباشد. پلیپپتیدهای خارجی مخصوصاً وقتی که به میزان زیاد تولید میشوند بهصورت اینکلوژن بادیها در سلول تجمع مییابند به همین دلیل از طریق مهندسی پروتئین و شرایط استراتژیهایی برای افزایش محلولیت پروتئینها در باکتری E.coli معرفی شدهاند (10). یکی از استراتژیهای افزایش بیان پروتئین تغییر وکتور می باشد و به معنی تغییر پروموتور همراه ژن مدنظری که کون میشود و یا تغییر فیوژن تگ fusion tagکه بر محلولیت پروتئین نوترکیب بیانی تاثیر میگذارد میباشد (11). بهینهسازی شرایط تولید پروتئین نوترکیب تولید آن را از لحـاظ اقتصـادی بـه صـرفه مـیکنـد؛ پارامترهایی نظیر نوع میزبان، نوع محیط کشت، pH، دمای محیط کشت، مدت زمان انکوباسیون پـس از القا و غلظت IPTG در آن دخیل میباشد و تاکنون بررسیهای قابلتوجهی در زمینه افزایش بیـان و حلالیت پروتئین نوترکیب صورت گرفته است (12). اکثر روشهایی که در بیوتکنولوژی پروتئین نوترکیب استفاده میشود با استفاده از رویکرد یک فاکتور در زمان (OFAT one-factor-at-a-time) انجام شده و متعاقباً بهینهسازی میشود کـه تـأثیر تنهـا یک عامل در زمان یک عامل را در یک زمان بررسی میکند (13). با اینحال، برخی از فرآیند بیوشیمیایی تحتتأثیر فعـل و انفعالات متغیرهای آزمایشی بر هم قرار میگیرند. بهترین روش برای بررسی تـأثیر عوامـل متعـدد و همچنین تأثیر فعل و انفعالات آنها بر فرآیند آزمایش، روش طراحـی آمـاری آزمایشـات است. از این روشهای آماری برای ارزیابی متغیرهایی که بیشـترین تـأثیر را در تولید پروتئین نوترکیب مورد بررسی از نظر عملکرد، کیفیت محصول، خلـوص و حلالیـت دارنـد استفاده شده است. (13،14). با توجه به سـاختار آنزیم فورمات دهیدروژناز و افزوده شدن دنباله وکتور به پروتئین نوترکیب بیانی وزن آن حـدود 48 کیلودالتون تخمین زده میشود کـه وزن آن روی ژل SDS-PAGEپـس از رنـگآمیـزی حـدود 48 کیلودالتون بود. که با پیشبینی انجام شده مطابقت داشت. دمای بالا میتواند رشد سلول را افزایش دهد، اما برای بیان پروتئین مضر است زیرا سرعت رشد بالاتر منجر به احتمال بیشتر از دست دادن پلاسمید میشود و باعث تقسیم نادرست حامل بیان و عـدم بیان ژن نوترکیب میشود، به خصوص در بیان سلول حامـل پلاسـمید دمـای اپتـیمم در زمـان القای پروتئین بین 15-25 درجه سانتیگراد در نظر گرفته میشود (15،16). از آنجا که این دما بـرای پـروتئینهای مختلف متفاوت میباشد بنابراین دمای مناسب برای تولید یک پروتئین نوترکیب توسط میزبـان باید بهدست آید. از این رو مطالعه حاضر نشان داد بیشترین بیان پروتئین در فاز محلول در دمای 25 درجـه سانتیگراد بعـد از گذشـت 24 ساعت از زمان القا اتفاق میافتد. القا معمولاً در فاز اولیه یا میانه فاز لگاریتمی اتفاق میافتد. هرچند گزارشها نشان میدهند که القـا در انتهای فاز لگاریتمی یا حتی در فاز سکون نیز میتواند بر محلولیت پروتئین و بیـان کلـی پـروتئین تاثیرگذار باشد. بهطورکلی القا در زمان ابتدای فاز لگاریتمی بهترین نتیجه را دارد. القـا در فـاز سـکون کاملا اثر منفی دارد و موجب از دست رفتن بیان کلی برای بسیاری از پروتئینها میشود. همچنین بـر محلولیت پروتئین نیز تاثیر منفی دارد (17). در این مطالعه زمان القا با توجه به بررسیهای اولیه ثابت در نظر گرفته شد. غلظت معمـول IPTG بـرای بیـان پـروتئین نوترکیـب بطـور معمـول بـین 1-0/1 میلیمولار است. هرچند غلظت IPTG بین 0 تا 1 میلیمولار بر سرعت رشـد خـاص باکتری E.coli تـأثیر نمـیگذارد اما مقدار بیشـتر القـا کننـده در محـیط منجـر بـه بیـان مقـادیر بـالاتری از پـروتئین نوترکیـب میشود (15،18). در مطالعه حاضر کاهش غلظت IPTG باعث افزایش تولید پروتئین در فاز محلول شـد و غلظت 0/1 میلیمولار IPTG تاثیر بیشتری در بیان پروتئین به صورت محلول داشت که نشان میدهـد بـرای هـر نـوع پروتیین نیاز به بررسی غلظت بهینه IPTG داریم. غلظت برخی نمکها، پپتون و مخمرعصاره میتوانـد غلظـت پـروتئین نوترکیـب مـوردنظـر را افزایش دهد. محیطهای مختلف نظیر LB،TB و2YT میتوانند جهت بهینـهسـازی بیـان پـروتئین مورد استفاده قرار بگیرد (19،20). مطالعات نشان میدهد هر دو ترکیب محیط کشت و شـرایط کشـت بـرای بیـان پـروتئین مهـم هستند. محیط Luria broth (LB) به راحتی ساخته میشود و حاوی بیشترین مـاده مـورد نیـاز بـرای کشت باکتری E.coli است. با اینحال، رشد باکتری E.coli درLB با تراکم نسبتاً کمـی متوقـف میشود، زیـرا حاوی مقادیر کم کربوهیدرات و کاتیونهای دو ظرفیتی است (10). در این مطالعه برای بررسی اثر نوع محیط کشت بر بیان پروتئین نوترکیب از دو محـیط LBو 2YT استفاده شد. نتایج نشان داد محیط LB که از تریپتون (مسـئول تـامین پپتیـدهـا و آمینواسید)، عصاره مخمر (مسئول تامین ویتامینها و مواد ضروری) و سدیم کلراید (تـامین سـدیم و بالانس اسمتیک) تشکیل شده است، مناسب ترین محیط برای بیان آنزیم فورمات دهیدروژناز در باکتری است. مطالعات نشان داده وجود مقادیری از سوربیتول سبب افزایش بازده و ثبات نتایج در محیط الکتروپوراسیون میشود. علاوه بر این، چاپرونهای شیمیایی اسمولیت مانند گلیسرول، پرولین و سوربیتول، هنگامیکه در غلظتهای کم به محیط رشد اضافه میشوند، ممکن است محیط میکرو مناسبتری را برای تاخوردگی بهتر پروتئین فراهم کند (21،22). طی این مطالعه نیز مشاهده شد وجود سوربیتول سبب افزایش بیان آنزیم فورمات دهیدروژناز میشود. مقدار ژن آنزیم فورمات دهیدروژناز تولیدی در تحقیق حاضر برابر 0/2059 میکروگرم بر میلیلیتر از میلیلیتر محـیط کشـت بود، هر چند با توجه به خصوصیت یک ژن بیان آن در میزبانهای مختلف متفـاوت اسـت مطالعه حاضر نشان داد روش فول فاکتوریل نیز میتواند برای بررسی نقطه بهینه بیان آنزیم فورمات دهیدروژناز مناسب باشد. بدیهی است که استفاده از روش فول فاکتوریل برای طراحی آزمایش نهتنها تعداد دفعات آزمایش را کاهش میدهد بلکه می تواند با بررسی همزمان فاکتورهای مختلف تاثیر فاکتورهای مختلف بر یکدیگر را محاسبه کند و به این ترتیب نقطه بهینه بیان پروتئین را حساب کند. و این روش در مقایسه با روش های قدیمی که در هر زمان فقط یک فاکتور بررسی میشود میتواند در زمان کوتاهتری انجام شود و در نتیجه دفعات آزمایش و کاهش مواد مصرفی را به همراه خواهد داشت.
نتیجهگیری
در این مطالعه اثر اصلاح کننده، غلظت القا کننده، مدت زمان پس از القا و نوع محیط کشت بر میزان بیـان ژن آنزیم فورمات دهیدروژناز مورد بررسی قرار گرفت. طراحی آزمـایش بـا کمـک روش فـول فاکتوریـل انجـام گرفت که در مقایسه با روشهای سنتی با کم کردن تعداد آزمایشات و ادغام فاکتورها توانسـت تمـام حالتهای آزمایش و تاثیر فاکتورها بر یکدیگر را در نظر بگیرد. نتایج نشـان داد وجود سوربیتول و کاهش غلظت IPTG) 0/1 میلیمولار) بر بیان آنزیم فورمات دهیدروژناز تاثیر مثبت میگذارد و در زمان 24 ساعت پس از القا بیشترین مقـدار ژن آنزیم فورمات دهیدروژناز تولید شد. همچنین محیط LB بهعنوان بهترین محیط برای بیان بهینه ژن آنزیم فورمات دهیدروژناز شناسایی شد.
سپاسگزاری
مطالعه حاضر حاصل از.طرح شماره 8912 تصویب شده در دانشگاه علوم پزشکی شهید صدوقی یزد میباشد.
حامی مالی:از معاونت تحقیقات و فناوری دانشگاه علوم پزشکی شهید صدوقی یزد برای حمایت مالی از این طرح تشکر و قدردانی میشود.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد مورد تایید قرار گرفته است. (کد اخلاق: IR.SSU.MEDICINE.REC.1399.156)
مشارکت نویسندگان
مریمالسادات نبوینیا در ارائه ایده، محبوبه نبوینیا. در طراحی مطالعه، محمدرضا حاجیزاده در جمعآوری دادهها، محمد جعفری کاخکی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Moua PS, Gonzalez A, Oshiro KT, Tam V, Li ZH, Chang J, et al. Differential Secretion Pathways of Proteins Fused to the Escherichia Coli Maltose Binding Protein (MBP) in Pichia Pastoris. Protein Expr Purif 2016; 124: 1-9.
2- Fargione J, Hill J, Tilman D, Polasky S, Hawthorne P. Land clearing the biofuel carbon debt. Science 2008; 319(5867): 1235-8.
3- Takacs M, Makhlynets OV, Tolbert PL, Korendovych IV. Secretion of Functional Formate Dehydrogenase in Pichia Pastoris. Protein Eng Des Sel 2017; 30(3): 279-84.
4- Fargione J, Hill J, Tilman D, Polasky S, Hawthorne P. Land Clearing and the Biofuel Carbon Debt. Science 2008; 319(5867): 1235-8.
5- Hanson RL, Goldberg SL, Brzozowski DB, Tully TP, Cazzulino D, Parker WL, et al. Preparation of an Amino Acid Intermediate for the Dipeptidyl Peptidase IV Inhibitor, Saxagliptin, Using a Modified Phenylalanine Dehydrogenase. Advanced Synthesis & Catalysis 2007; 349(8‐9): 1369-78.
6- Hoelsch K, Sührer I, Heusel M, Weuster-Botz D. Engineering of Formate Dehydrogenase: Synergistic Effect of Mutations Affecting Cofactor Specificity and Chemical Stability. Appl microbiol biotechnol 2013; 97: 2473-81.
7- Brown TA. Gene Cloning and DNA Analysis: an Introduction. 6 ed. John Wiley & Sons; 2010.
8- Uhoraningoga A, Kinsella GK, Henehan GT, Ryan BJ. The Goldilocks Approach: A Review of Employing Design of Experiments in Prokaryotic Recombinant Protein Production. Bioengineering 2018; 5(4): 89.
9- Rao RS, Kumar CG, Prakasham RS, Hobbs PJ. The Taguchi Methodology as a Statistical Tool for Biotechnological Applications: A Critical Appraisal. Biotechnol J 2008; 3(4): 510-23.
10- Vera A, González‐Montalbán N, Arís A, Villaverde A. The Conformational Quality of Insoluble Recombinant Proteins is Enhanced at Low Growth Temperatures. Biotechnol bioeng 2007; 96(6): 1101-6.
11- Gopal GJ, Kumar A. Strategies for the Production of Recombinant Protein in Escherichia Coli. Protein J 2013; 32(6): 419-25.
12- Papaneophytou C. Design of Experiments as a Tool for Optimization in Recombinant Protein Biotechnology: From Constructs to Crystals. Mol Biotechnol 2019; 61(12): 873-91.
13- Mosrati R, Nancib N, Boudrant J. Variation and Modeling of the Probability of Plasmid Loss as a Function of Growth Rate of Plasmid‐Bearing Cells of Escherichia Coli during Continuous Cultures. Biotechnol bioeng 1993; 41(4): 395-404.
14- Betiku E. Molecular Chaperones Involved in Heterologous Protein Folding in Escherichia Coli. Biotechnol Molecular Biology Reviews 2006; 1(2): 66-75.
15- Horii T, Ogawa T, Ogawa H. Organization of the Reca Gene of Escherichia Coli. Proc Natl Acad Sci 1980; 77(1): 313-7.
16- Berrow NS, Büssow K, Coutard B, Diprose J, Ekberg M, Folkers G, et al. Recombinant Protein Expression and Solubility Screening in Escherichia Coli: A Comparative Study. Acta Acta Crystallogr D Biol Crystallogr 2006; 62(Pt 10): 1218-26.
17- Antoniou G, Papakyriacou I, Papaneophytou C. Optimization of Soluble Expression and Purification of Recombinant Human Rhinovirus Type-14 3C Protease Using Statistically Designed Experiments: Isolation and Characterization of the Enzyme. Mol Biotechnol 2017; 59(9-10): 407-24.
18- Yan F, Qian M, Yang F, Cai F, Yuan Z, Lai S, et al. A Novel Pro-Apoptosis Protein PNAS-4 From Xenopus Laevis: Cloning, Expression, Purification, and Polyclonal Antibody Production. Biochemistry (Moscow) 2007; 72(6): 664-71.
19- Kram KE, Finkel SE. Rich Medium Composition Affects Escherichia Coli Survival, Glycation, and Mutation Frequency during Long-Term Batch Culture. Appl Environ Microbiol 2015; 81(13): 4442-50.
20- Tseng C-L, Leng C-H. Influence of Medium Components on the Expression of Recombinant Lipoproteins in Escherichia Coli. Appl Microbiol Biotechnol 2012; 93(4): 1539-52
21- Zhang H, Li Y, Chen X, Sheng H, An L. Optimization of Electroporation Conditions for Arthrobacter with Plasmid PART2. J Microbiol Methods 2011; 84(1): 114-20.
22- Lebendiker M, Danieli T. Production of Prone-to-Aggregate Proteins. FEBS Letters 2014; 588(2): 236-46.
نوع مطالعه: پژوهشي |
موضوع مقاله:
میکروبیولوژی
دریافت: 1402/11/27 | پذیرش: 1403/3/9 | انتشار: 1404/2/15
دریافت: 1402/11/27 | پذیرش: 1403/3/9 | انتشار: 1404/2/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







