دوره 32، شماره 3 - ( خرداد 1403 )
جلد 32 شماره 3 صفحات 7625-7613 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ghadiri S, Ghasemian S O, Derakhshan L. Impact of Eight Weeks of Supplementation with Vitamins C and E on the Expression of CP Protein and the HSP70 Gene in the Brain Tissue of Rats with Alzheimer’s Disease. JSSU 2024; 32 (3) :7613-7625
URL: http://jssu.ssu.ac.ir/article-1-6156-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6156-fa.html
قدیری شاهین، قاسمیان سیده امالبنین، درخشان لیلا. اثر هشت هفته مکمل دهی ویتامین C و ویتامین E بر پروتئین CP و بیان ژن HSP70 در بافت مغز موش های صحرایی مبتلا به آلزایمر. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (3) :7613-7625
متن کامل [PDF 1009 kb]
(494 دریافت)
| چکیده (HTML) (1362 مشاهده)
متن کامل: (782 مشاهده)
مقدمه
بیماری آلزایمر یک بیماری نورودژنراتیو است که موجب تخریب بیشتر قسمتهای مغز و بهویژه هیپوکامپ بهعنوان جایگاه تدوین حافظه و یادگیری می شود. این بیماری بسیار شایع است، بهطوریکه بیش از نیمیاز افراد سالمند بالای 65 سال از این بیماری رنج میبرند. این بیماری بهعنوان دومین عامل مرگ و میر بیماریهای سالمندی و اولین بیماری منجر به مرگ از میان اختلالات عصبی شناخته شدهاست. بیماری آلزایمر حاصل دخالت عوامل مختلفی است که عمدتا بهدلیل اختلالات بیوشیمیایی در تولید پروتئین ها، فعالیت الکتریکی غیرکنترل شده نورونی و تغییر در میزان برخی نوروترانسمیترها بهوجود میآیند (1). مغز یکی از بافتهای بسیار آسیبپذیر در برابر استرس اکسیداتیو بهشمار می رود (2). استرس اکسیداتیو به دنبال افزایش تولید گونه های فعال اکسیژن (Reactive Oxygen Species) یا ROS مثل پراکسیدهیدروژن، رادیکالهای سوپراکسید و هیدروکسیل و کاهش دفاع آنتیاکسیدانی انجام میشود. این گونه ها می توانند باعث آسیب به DNA، اکسیداسیون پروتئینها، پراکسیداسیون لیپیدها و در نهایت آپوپتوز سلول های عصبی گردند (3). ROS میتواند به همه مولکولهای زیستی شامل لیپیدها، پروتئینها و اسیدهای نوکلئیک حمله کند. پروتئین کربونیلها (CP: Carbonyl Protein) یکی از مهمترین بیومارکرهای اکسیداسیون پروتئینها بوده و از نظر شیمیایی پایدار میباشد. گروههای پروتئین کربونیل از طریـق اکسیداسیون مستقیم اسیدهای آمینه یا در اثر واکنش ثانویه با محصولات اکسیداسیون اولیه قندها و لیپیدها ایجاد میشوند (4). همچنین، افزایش استرس اکسیداتیو منجر به تخریب غشای سلول، شکست DNA، افزایش پروتئین کربونیل، کاهش مکانیسمهای محافظتی و نشانگرهای آن مانند پروتئینهای شوک حرارتی (Heat shock protein) یا HSPها (بهویژه HSP72 و HSP70) در بافت مغز شده و در نهایت آپوپتوز میشود (5). پروتئینهای شوک حرارتی اثرات آنتیاکسیدانی و ضد التهابی دارند و در تاخوردگی اولیه و مجدد پروتئین مؤثر هستند و باعث محافظت هسته سلولها و غشای لیپیدی در مقابل آسیب میشوند و از آپوپتوز جلوگیری میکنند (6). در سیستم عصبی، بیان HSP70 در انواعی از شرایط پاتولوژیک مثل بیماری¬های نورودژنراتیو، ایسکمیمغزی، ضربه و صرع افزایش مییابد (5). ویتامین C از نورونهای گلوتاماترژیک بهعنوان قسمتی از روند برداشت مجدد گلوتامات، آزاد میشود و بهعنوان یک ویتامین آنتیاکسیدان از طریق جریان خون وارد مغز شده و در آنجا تجمع مییابد. این ویتامین علاوهبر نقش کوفاکتوری در واکنشهای مختلف شیمیایی و آنزیمی، نقـش نوروترانسمیتری در سیستم عصبی مرکزی (CNS: Central Nervous System) پستانداران را نیز دارا میباشد. همچنین، ویتامین E یکی از مهمترین مواد در سیستمهای دفاعی بدن است که باعث خنثیکردن استرس اکسیداتیو در مقابل رادیکالهای آزاد میشود و بهعنوان یک آنتیاکسیدان طبیعی شناخته شدهاست. ترکیبات حاوی گوکرد و ویتامین هایی نظیر E و C و فلاونوئیدها با خاصیت به داماندازی رادیکالهای آزاد، میتوانند منجر به حذف اثر مولکولهای فعال و آسیبرسان به ماکرومولکول¬های حیاتی مانند DNA و پروتئین ها شوند (6). بررسی ادبیات تحقیق نشانداده¬است که مصرف ویتامین C به مدت چند هفته توسط موش های دارای استرس اکسایش منجر به افزایش عامل نروتروفیک مشتق از مغز میگردد (7) و میتواند پوشش محافظتی قدرتمندی را برای مغز ایجاد کند (8). یک مطالعه مروری نشانداده است که ویتامین C منجر به بهبود اختلالات روانی در مدلهای حیوانی مانند اسکیزوفرنی، اضطراب و بیماری آلزایمر می شود (9). سایر مطالعات، نقش ویتامین E را در کاهش پروتئین کربونیل و افزایش HSP70 تایید نمودهاند (10). مطالعه Wang و همکاران نشان داد افرادی که دوز بالاتری از ویتامین E را از طریق رژیم غذایی دریافت میکنند کمتر در معرض ابتلا به آلزایمر قرار دارند (11). همچنین، مطالعه رضایی و همکاران حاکی از کاهش میزان مالوندی آلدئید و کربونیل پروتئین ها پس از مصرف ویتامین E و ویتامین D بود (6). مطالعه Arlt و همکاران نیز نشان داد که استفاده از مکملهای ویتامین C و E منجر به افزایش ویتامین های آنتیاکسیدانی CSF میگردد (12). اگرچه مطالعاتی در ارتباط با بررسی نقش ویتامین E به تنهایی و ویتامین C به تنهایی بر مکانیسم سلولی مولکولی استرس اکسیداتیو و در مقابل پروتئینهای محافظتی سلول انجام شدهاست؛ هنوز تفاوت بین این دو آنتیاکسیدان در مهار آسیبهای اکسایشی به خوبی شناخته نشدهاست. مطالعه¬ حاضر با هدف مقایسه دو آنتیاکسیدانE و C و بررسی اثر همزمان آنها بر پروتئین کربونیل و بیان ژن HSP70 صورت گرفت.
روش بررسی
مطالعه حاضر یک تحقیق تجربی - آزمایشگاه بود که روی نمونه های حیوانی انجام شد. در این مطالعه، 35 سر موش صحرایی سالمند ماده با سن تقریبی 14 الی 16 ماه و محدوده وزنی 270 تا 320 گرم انتخاب شدند. راهنمای مراقبت و استفاده از حیوانات آزمایشگاهی بهطور دقیق خوانده شده و تمامی مراحل به صورت کاملا استاندارد در نظر گرفته شد. نمونههای مورد بررسی از مرکز نگهداری حیوانات وابسته به دانشگاه آزاد مرودشت خریداری گردیدند. جهت سازگاری با محیط به مدت یک هفته در شرایط استاندارد شامل شرایط کنترل شده نور (12 ساعت روشنایی و 12 ساعت تاریکی، شروع روشنایی 6 صبح و شروع خاموشی 6 عصر) و تحت دمای 22±3 سانتیگراد و رطوبت 50 درصد نگهداری شدند. در ابتدا، از 35 سر موش صحرایی سالمند، 7 مورد در گروه کنترل سالم قرا گرفتند و 28 سر موش صحرایی با استفاده از تزریق صفاقی تک دوز 10 میلیگرم بر کیلوگرم تریمتیلتین کلراید (TMT: Trimethyltin) (شرکت سیگما آلدریچ، آمریکا) به بیماری آلزایمر مبتلا شدند (13). این 28 موش در چهار گروه، کنترل بیمار، گروه دریافت کننده مکمل ویتامین C، گروه دریافت مکمل ویتامین E و گروه دریافت حلال ویتامین E (شم) تقسیم شدند. چهارده روز پس از تزریق TMT، بیماری آلزایمر با مشاهده علائم بالینی شامل اضطراب، افسردگی، پرخاشگری، پیچ و تاب های دمی و خونریزی اطراف چشم، آزمون حافظه و یادگیری توسط شاتل باکس و ماز Y ارزیابی و تایید شد (14). تست حافظه و یادگیری، توسط ماز Y جهت بررسی رفتار تناوبی بهکار رفت و شاتل باکس جهت بررسی یادگیری اجتنابی غیرفعال و تاخیر اولیه و تاخیر ثانویه در آن صورت گرفت.
مکملدهی ویتامین E و ویتامین C: در طول دوره تحقیق، مکمل ویتامین E به میزان 120 میلیگرم (شرکت SolarBio، چین) بهصورت روزانه در 1/5 میلیلیتر دکستروز حل میگردید و بهصورت خوراکی به موشهایی که در گروه ویتامینE قرار داشتند، خورانده شد. با توجه به مکملدهی طولانیمدت، مکمل ویتامین E (روزانه mg/kg 30) بهصورت خوراکی و با در نظر گرفتن وزن موشها اندازهگیری شد (15). مکمل ویتامین C (اسکوربیک اسید) (شرکت سیگما آلدریچ) روزانه به صورت خوراکی در طعم دهنده غذا حل شد و به صورت 4 میلیگرم به ازای هر کیلوگرم وزن موشها به آنها خورانده شد (16). جهت تعیین دوز ویتامین C و E موشها هر هفته وزنگیری شدند (ترازوی ویژه اندازهگیری با قابلیت اندازهگیری 0/001 گرم، ساخت شرکت کرن، آلمان).
تشریح و نمونهبرداری: 48 ساعت پس از آخرین جلسه و در حالت 12 ساعت ناشتا موشهای صحرایی با ترکیب کتامین (70 میلیگرم به ازای هر کیلوگرم از وزن بدن) و زایلازین (25 میلیگرم بر کیلوگرم) با نسبت سه به دو و با تزریق صفاقی بیهوش شدند (ساخت شرکت آلفاسان، هلند). پس از اطمینان از بیهوشی کامل بافت مغز موشهای صحرایی استخراج و پس از شست و شو و توزین در دمای 70- فریز شد. متغیرهای تحقیق با استفاده از روش الایزا و Real Time PCR اندازهگیری شدند (شرکت StepOne کشور ایتالیا).
شیوه اندازهگیری متغیرهای تحقیق:
مقادیر پروتئین کربونیل با استفاده از کیت ویژه الایزا (شرکت ZellBio ، آلمان) با مقیاس نانو مول بر میلیگرم (nmol/mg) اندازهگیری شد. بیان ژنی HSP70 در بافت هیپوکامپ با استفاده از روش qReal Time PCR اندازهگیری و سپس بر اساس مقیاس فولد چنج گزارش شد. مقدار 750 میکرولیتر از محلول تجاری ترایزول سرد شده، حدود 100 میلی¬گرم از هر نمونه بافت به مدت 10 ثانیه توسط دستگاه، هموژنایز شده RNA با استفاده از کیت شرکت سازنده (ترایزول ایران، شرکت یکتا تجهیز) به روش اسپکتروفتومتری غلظت نمونه RNA، با استفاده از تعیین جذب نوری در طول موج 260 نانومتر اندازهگیری شد. برای تعیین خلوص RNA از محاسبه نسبت A260/A280 استفاده شد.
C (µg/µl) = A260× ɛ× d/1000
پس از استخراج RNA، مراحل سنتز cDNA طبق پروتکل شرکت سازنده (Biofact، کره جنوبی) انجام و سپس cDNA سنتز شده جهت انجام واکنش رونویسی معکوس مورد استفاده قرار گرفت. بیان ژنها با استفاده از روش کمی q-RT PCR صورت گرفت. توالی پرایمرهای تحقیق با استفاده از سایت NCBI به دست آمد و با بکار گیری امکانات موجود در این سایت، پرایمرهای اختصاصی برای هر کدام از ژنها طراحی شدند (جدول 1). سپس با نرم¬افزارهای دیگر پرایمرهای طراحی شده بررسی شدند. در طراحی این پرایمرها نهایت دقت به عمل آمد و خصوصیات لازم برای استفاده از آنها در Real-time PCR نیز لحاظ شد. پس از اتمام فعالیت دستگاه و مشاهده نمودارها مبنی بر افزایش تعداد قطعه مورد نظر و میزان نشرفلورسانس با محاسبه ΔΔCt میزان تغییر در بیان ژن مورد نظر نسبت به ژن کنترل داخلی و حالت کنترل که فاقد محیطهای تمایزی است، سنجیده شد و در آخر داده¬های میزان بیان ژن استفاد از فرمول ΔΔCt-2 محاسبه شد.
تجزیه و تحلیل آماری
دادههای تحقیق در نرمافزارversion 16 SPSS وارد و تجزیه و تحلیل گردید. جهت بررسی نرمالیتی توزیع یافتهها از آزمون شاپیرو- ویلک استفاده شد. بررسی اثر مکمل ویتامین E و ویتامین C با استفاده از آنالیز وارایانس یک راهه صورت گرفت. همچنین، برای بررسی نوع اثر متغیرها از آزمون تعقیبی توکی استفاده شد. سطح معنیداری برای تمام تجزیه و تحلیلها 0/05 در نظر گرفته شد.
نتایج
میانگین متغیرهای پروتئین کربونیل و بیان نسبی HSP70 در گروههای مورد مطالعه در جدول 2 نمایش داده شدهاست.
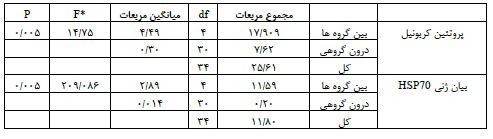
مقادیر پروتئین کربونیل (0/005>P و 14/75=F) و بیان ژنی HSP70 (P<0/005 و 209/08=F) در گروههای مورد بررسی بهطور معنیداری متفاوت بود. بررسی تاثیر هشت هفته مکملدهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل و بیان ژنی HSP70 در بافت هیپوکامپ موشهای صحرایی مبتلابه بیماری آلزایمر در جدول 3 نمایش داده شدهاست.
مقادیر پروتئین کربونیل در گروه کنترل بیمار و حلال ویتامین E بهطور معنیداری بیشتر از گروه کنترل سالم بود (0/005>P). مقادیر پروتئین کربونیل در گروههای ویتامین C (P= 0/007) و ویتامین E (P= 0/02) بهطور معنیداری کمتر از گروه کنترل بیمار بود. همچنین تفاوت معنیداری در گروههای ویتامین C و ویتامین E مشاهده نشد (0/97=P). همچنین، مقادیر بیان ژنی HSP70 در گروه کنترل بیمار و حلال ویتامین E بهطور معنیداری کمتر از گروه کنترل سالم بود (001/0>P). بیان ژنی HSP70 در گروههای ویتامین C (P= 0/001) و ویتامین E (P= 0/001) بهطور معنیداری بیشتر از گروه کنترل بیمار بود. تفاوت معنیداری در گروههای ویتامین C و ویتامین E از نظر بیان ژنی HSP70 مشاهده نشد (0/74=P). نتایج آزمون تعقیبی در خصوص اثر مکملدهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل و بیان ژنی HSP70 بافت هیپوکامپ موشهای صحرایی مبتلابه بیماری آلزایمر در نمودارهای 1 و 2 نمایش داده شدهاست.
جدول 1: پرایمر طراحی شده برای ژن HSP70

جدول 2: میانگین متغیرهای پروتئین کربونیل و بیان نسبی HSP70 در گروه¬های مورد مداخله و کنترل

جدول3: بررسی تاثیر هشت هفته مکملدهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل و بیان ژنی HSP70 در بافت هیپوکامپ موشهای صحرایی مبتلابه بیماری آلزایمر با استفاده از آزمون آنالیز واریانس یک راهه
*آنالیز واریانس یکراهه

نمودار 1: بررسی اثر مکملدهی ویتامین C و ویتامین E بر مقادیر بیان ژنی HSP70 بافت هیپوکامپ موشهای مبتلا به بیماری آلزایمر با استفاده از آزمون تعقیبی توکی
*** (0/001=P) کاهش معنی دار نسبت به گروه کنترل سالم ### (0/001=P) افزایش معنیدار نسبت به گروه کنترل بیمار

نمودار 2: نمودار 1. بررسی اثر مکمل دهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل بافت هیپوکامپ موش¬های مبتلا به بیماری آلزایمر با استفاده از آزمون تعقیبی توکی
*** (0/001=P) افزایش معنی دار نسبت به گروه کنترل سالم ## (0/01=P) و # (0/05=P) کاهش معنیدار نسبت به گروه کنترل بیمار
بحث
از بین آنتیاکسیدانهای موثر در پیشگیری و درمان بیماری آلزایمر، ویتامینهای محلول در آب و چربی مانند ویتامین C و E، مواد معدنی مانند سلنیوم، منگنز، مس و روی، پروتئین هایی مانند آلبومین، سرولوپلاسمین، ترانسفرین، هاپتوگلوبولین، فلاونوئیدها و فیتوکمیکالها قابل توجه میباشند (17,18). بهطور خلاصه، یافته های مطالعه حاضر نشان داد که هشت هفته مکمل دهی ویتامین C و ویتامین E منجر به کاهش پروتئین کربونیل و افزایش HSP70 گردید. همچنین، مکمل دهی ویتامین C تفاوتی با مکمل ویتامین E از نظر تاثیر بر پروتئین کربونیل و بیان ژنی HSP70 در موشهای صحرایی مبتلا به آلزایمر نداشت. مشابه با یافته های مطالعه حاضر، مطالعه Cansev و همکاران نشان داد که ویتامین C و ویتامین E جهت اثرگذاری پیشسازهای فسفولیپید بر افزایش سطوح فسفولیپیدهای غشایی و پروتئین های سیناپسی، که شاخص های غیرمستقیم سیناپتوژنز هستند، ضروری هستند. عرضه همزمان آنها ممکن است در بیماران مبتلا به آلزایمر مفید باشد، زیرا این بیماری با از دست دادن سیناپس و کاهش سطوح پلاسمایی و مغزی پیشسازهای فسفولیپید و آنتیاکسیدانها مشخص میشود (19). مطالعه Sil و همکاران نشان داد که تجویز ویتامین C (200 و 400 میلیگرم بر کیلوگرم وزن بدن) در موشهای آلزایمری منجر به بهبود اختلالات حافظه، جلوگیری از تخریب عصبی و التهاب عصبی در هیپوکامپ میگردد. التهاب عصبی در هیپوکامپ همچنین بر پاسخهای ایمنی محیطی و التهاب در سرم موش¬های آلزایمری تأثیر گذاشت و همه این پارامترها نیز با دوز 200 و 400 میلیگرم ویتامین C بازیابی شدند (20). یافتههای مطالعه Rai و همکاران نشان داد که مصرف ویتامین C به مدت 4 هفته توسط موشهای دارای استرس اکسایش منجر به افزایش عامل نروتروفیک مشتق از مغز می گردد (7). یافتههای یک مطالعه دیگر حاکی از آن بود که ویتامین C میتواند پوشش محافظتی قدرتمندی را برای مغز ایجاد کند (8). یک مطالعه مروری نشان داده است که ویتامین C منجر به بهبود اختلالات روانی در مدلهای حیوانی مانند اسکیزوفرنی، اضطراب و بیماری آلزایمر میشود (9). ویتامین C به هنگام فشار اکسایشی از طریق تولید و ترشح عامل نروتروفیک مشتق از مغز اثر محافظتی در عامل عصبی و مغز دارد. در این خصوص، یافتههای یک مطالعه دیگر نشانداد که مصرف دو هفته مکمل ویتامین C منجر به کاهش مالوندی آلدئید (MDA: Malondialdehyde) و افزایش بیان ژنی HSP70 میگردد (21). این یافته با نتایج مطالعه حاضر هم راستا بود. یافتههای یک مطالعه دیگر روی نمونههای حیوانی نشانداد که استفاده از مکمل ویتامین C به مدت 6 ماه منجر به کاهش رفتاری در یک مدل موش آلزایمری گردید. براساس یافتهها، کاهش الیگومریزاسیون Aβ با کاهش قابل توجه آسیب اکسیداتیو مغز و در نسبت Aβ42 محلول به Aβ40، (بهعنوان یک شاخص معمولی از پیشرفت آلزایمر) همراه بود. علاوه بر این، مصرف ویتامین C باعث کاهش سیناپتوفیزین و فسفوریلاسیون تاو در Ser396 شد (12). این یافته، نتایج مطالعه حاضر را مورد تایید قرار میدهد. ویتامین C به وفور در سیتوزول و مایع خارج سلولی یافت میشود و میتواند با پراکسید هیدروژن ترکیب گردد و بهعنوان یک ماده احیا کننده عمل¬کند (22). ویتامینC میتواند اثر شیمیایی موادی را که به بافتهای بدن آسیب میرسانند، خنثی کند. این ویتامین از طریق ایجاد یک پوشش محافظتی برای مغز، در کاهش علائم برخی بیماری¬ها و اختلالات مغزی همچون پارکینسون کمک میکند. برخی یافتهها نشان داده است که مصرف مکمل ویتامینC منجر به افزایش بقا و حفظ نورون¬های عصبی در مغز میانی می¬گردد (8,23). همچنین، افزایش عامل نروتروفیک مشتق از مغز در پی مصرف ویتامین C مشاهده شده است. دیگر یافته این مطالعه، نقش ویتامین E را در کاهش پروتئین کربونیل و افزایش HSP70 تایید کرد. در خصوص اثر بخشی مکمل ویتامین E بر آلزایمر، مطالعه Foudah و همکاران با هدف بررسی چگونگی تاثیر ویتامین E بر موشهای صحرایی مبتلا به آلزایمر صورت گرفت. یافتهها حاکی از تایید اثر نوتروپیک مصرف رسوراترول و ویتامین E بود (24). اگرچه مطالعات تجربی نشانداده است که ویتامین E اثرات مفیدی در مدلهای حیوانی آلزایمر دارد، اثربخشی آن در بیماران مبتلا به آلزایمر هنوز مورد بحث است، حتی اگر بیماران مبتلا به آلزایمر سطوح کمتر ویتامین E در پلاسما و مایع مغزی نخاعی داشته باشند (25). برخی یافتهها نشانداده است که سطوح بالاتر ویتامین E در پلاسما با کاهش خطر آلزایمر همراه است (26). با اینحال، این یافته¬ها دال بر اثبات اثر درمانی ویتامین E نیست. در واقع، فقط برخی از مطالعات مزایای مکمل ویتامین E را نشاندادند. در همین راستا، مطالعه Sano و همکاران نشانداد که ویتامین E (2000 واحد در روز) پیشرفت آلزایمر را در بیماران آلزایمری شدید به تاخیر میاندازد (27). مطالعه دیگری در بیماران مبتلا به آلزایمری خفیف تا متوسط نشانداد که ویتامین E (2000 واحد در روز) زوال عملکرد مغز و بار مراقب را کاهش میدهد (28). برخلاف این دادهها، گزارشهای دیگر نتایج متضادی را نشاندادند. در واقع شواهد قانعکنندهای نشان نمیدهند که درمان با ویتامین E میتواند اثرات مثبتی در آلزایمر داشته باشد (29). یک مطالعه دیگر نشانداد که تجویز ویتامین E اثرات مفیدی در بیماران مبتلا به اختلال شناختی خفیف ندارد. در این مطالعه، سرعت پیشرفت از اختلال شناختی به آلزایمر ارزیابی شد، اما درمان ویتامین E بر احتمال پیشرفت به آلزایمر تأثیری نداشت (30). یک بررسی سیستماتیک نشانداد که ویتامین E عملکرد شناختی را بهبود نمیبخشد و از پیشرفت زوال عقل جلوگیری نمیکند، اما ممکن است فرایند کاهش عملکردی در آلزایمر را کاهش دهد. همچنین، یافتهها نشانداد که ویتامین E خطر ابتلا به عوارض جانبی جدی یا مرگ و میر را افزایش نمیدهد (29). یکی از نگرانیهای اصلی در مورد درمان ویتامین E این بود که دوزهای بالا ممکن است مرگ و میر را افزایش دهد. در همین راستا، یک متاآنالیز، هیچ ارتباطی بین دوز ویتامین E و خطر مرگ و میر نشان نداد. به ویژه ویتامین E تأثیری بر مرگ و میر ناشی از همه علل در دوزهای تا 5500 واحد در روز نداشت (31). همچنین، یافته¬های یک مطالعه نشانداد افرادی که دوز بالاتری از ویتامین E را از طریق رژیم غذایی دریافت میکنند کمتر در معرض ابتلا به آلزایمر قرار دارند (11). مشابه یافتههای مطالعه حاضر، مطالعه Khorami و همکاران نشانداد اثر کلی ترکیبات ویتامین E باعث کاهش افزایش بیان HSP70 میشود (32). یک مطالعه دیگر نشانداده است که مصرف همزمان با کورستین یا ویتامین E آپوپتوز و سطح پروتئین استرس را نسبت به گروه شاهد کاهش میدهد. این یافتهها نشان می¬دهد که ویتامین E ممکن است اثر محافظتی در برابر آپوپتوز ناشی از استرس اکسیداتیو داشته باشد (33). ویتامین E با خاصیت آنتی-اکسیدانی خود، اولین سد دفاعی در برابر پراکسیداسیون اسیدهای چرب اشباع نشده موجود در فسفولیپیدهای غشای سلولی و تحت سلولی است. این ویتامین از طریق تبدیل رادیکال آزاد اسید چرب پراکسیل به هیدروپراکسی سبب توقف انتشار آسیب ناشی از رادیکال آزاد میشود (10). ویتــامین E با اتصال به لییوپروتئینهای غشاء سلول، از اکسیداسیون اسـیدهای چـرب غیر اشباع در برابر رادیکـالهـای آزاد و پراکسیداسیون ممانعت کرده و باعث پایداری غشای سـلول میشود (34). همچنین، ویتامین E بهطور مستقیم منجر به پاکسازی سلول از کراتین کیناز و لاکتات دهیدروژناز پروتئین واکنشگر C، مالون دیآلدئید و در عین حال افزایش فسفوریلاسیون پروتئین کینازها، بهبود متابولیسم سلولی، افزایش بیوژنز میتوکندریایی و ظرفیت متابولیکی سلول عضلانی میگردد (35,36). ویتامینE همچنین دارای اثرات ضد التهابی، ضد آپوپتوزی و آنتی اکسیدانی میباشد و در کاهش اضطراب و افسردگی نقش¬دارد (37, 16). در ارتباط با بررسی و مقایسه اثر ویتامین E و C محققین نشاندادند تجویز ویتامین های E و C باعث افزایش فعالیت آنزیمهای سوپراکسید دیسموتاز، کاتالاز و گلوتاتیون S- ترانسفراز, افزایش غلظت مالون دیآلدئید و کاهش فعالیت لاکتات دهیدروژناز و غلظت گلوتاتیون در قلب موش¬های صحرایی میگردد (38). با توجه به یافتههای بهدست آمده از مطالعات قبلی به نظر میرسد که پایبندی به رژیم غذایی مدیترانهای حاوی مقادیر بالای ویتامین C و E (مصرف بالاتر ماهی، میوه و سبزیجات غنی از آنتی اکسیدانها) بـا کاهش خطر بیماری آلزایمر همراه است (39). همچنین، مشابه مطالعه حاضر، رضایی و همکاران نشاندادند مصرف ویتامین E و ویتامین D موجب کاهش میزان مالون دیآلدئید و کربونیل پروتئینها در شرایط آزمایشگاهی گردید (6). در تناقض با یافتههای مطالعه حاضر، مطالعه Fillenbaum و همکاران با هدف تاثیر مکمل ویتامین C و/یا E در یک نمونه مبتنی بر جامعه از افراد مسن، بهجهت به تاخیر افتادن زوال عقل یا بیماری آلزایمر صورت گرفت. یافتهها حاکی از آن بود که استفاده از هیچ ویتامین C و/یا E حتی در دوز بالا زمان زوال عقل یا بیماری آلزایمر را کاهش-نداد (40). مطالعه دیگر توسط Arlt و همکاران که روی نمونههای انسانی انجام شد، نشاندادند که استفاده از مکمل-های ویتامین C (1000 میلیگرم در روز) و E (400 واحد در روز) منجر به افزایش ویتامینهای آنتی اکسیدانی CSF پس از 1 ماه و 1 سال گردید، در حالیکه لیپیدهای CSF تنها پس از 1 سال استفاده از مکمل کاهش یافت. با این حال، سیر بالینی آلزایمر بین گروه استفاده از ویتامین و گروه کنترل تفاوت معنیداری نداشت (12). با این حال، این یافتهها این تاثیرات پیشگیرانه احتمالی ویتامین C و ویتامین E را بر آلزایمر رد نمیکند. ذکر این نکته حائز اهمیت است که مطالعه حاضر بر روی نمونههای حیوانی انجام شد که بیماری الزایمر آن¬ها به تازگی ایجاد شده بود و موشها در مراحل اولیه ابتلا بودند.
محدودیتهای تحقیق
عدم ارزیابی همافزایی اثر ویتامین C و E یکی از ضعفهای مطالعه حاضر میباشد. همچنین، عدم ارایه دادههای حاصل از ایجاد صحیح مدل آلزایمر با تستهای رفتاری دیگر از محدودیتهای این مطالعه است.
نتبجهگیری
تعداد افراد مبتلا به آلزایمر به طور مداوم در حال افزایش است و به همین دلیل، بررسی درمانهای تکمیلی که بتواند از پیشرفت بیماری جلوگیری کند یا آن را به تأخیر بیندازد، اهمیت فراوانی دارد. شواهد نشانداد که استرس اکسیداتیو نقش اصلی را در آسیبشناسی آلزایمر ایفا میکند. ویتامین E و C جزء مهمترین آنتیاکسیدانها میباشند و برخی دادهها نشان میدهند که میتواند با استرس اکسیداتیو ناشی از آمیلوئید-β مقابله کند و حافظه و نقصهای شناختی را نیز بهبود بخشند. بهطور خلاصه یافتههای بدست آمده از مطالعه حاضر حاکی از آن بود که هر دو ویتامین C و ویتامین E دارای اثرات یکسان آنتیاکسیدانی و محافظت سلولی در بافت مغز موشهای مبتلا به آلزایمر میباشند. با توجه به تأثیر ویتامین C و E بر کاهش پروتئین کربونیل و افزایش HSP70 در بافت هیپوکامپ موشهای صحرایی، پیشنهاد میگردد در مطالعات بعدی اثر این ویتامینها بر دیگر اختلالات نورودژنراتیو مورد بررسی قرار گیرد. همچنین، پیشنهاد میشود در مطالعات آینده اثرات آنتیاکسیدانهای آنزیمی و غیر آنزیمی این ویتامینها نیز ارزیابی شود.
سپاسگزاری
از کلیهکارشناسان خانه حیوانات دانشگاه آزاد مرودشت که در کار تکنیکی همکاری نمودهاند، تشکر به عمل آید و مقاله نیز بر گرفته از پایاننامه دکتری عمومی دامپزشکی است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی- واحد بهبهان تصویب شده است (کد اخلاق : IR.IAU.BEHBAHAN.REC.1402.014).
مشارکت نویسندگان
تمامی نویسندگان در ارائه ایده، در طراحی مطالعه، در جمعآوری دادهها، در تجزیه و تحلیل دادهها به یک اندازه مشارکت داشته و همچنین در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
بیماری آلزایمر یک بیماری نورودژنراتیو است که موجب تخریب بیشتر قسمتهای مغز و بهویژه هیپوکامپ بهعنوان جایگاه تدوین حافظه و یادگیری می شود. این بیماری بسیار شایع است، بهطوریکه بیش از نیمیاز افراد سالمند بالای 65 سال از این بیماری رنج میبرند. این بیماری بهعنوان دومین عامل مرگ و میر بیماریهای سالمندی و اولین بیماری منجر به مرگ از میان اختلالات عصبی شناخته شدهاست. بیماری آلزایمر حاصل دخالت عوامل مختلفی است که عمدتا بهدلیل اختلالات بیوشیمیایی در تولید پروتئین ها، فعالیت الکتریکی غیرکنترل شده نورونی و تغییر در میزان برخی نوروترانسمیترها بهوجود میآیند (1). مغز یکی از بافتهای بسیار آسیبپذیر در برابر استرس اکسیداتیو بهشمار می رود (2). استرس اکسیداتیو به دنبال افزایش تولید گونه های فعال اکسیژن (Reactive Oxygen Species) یا ROS مثل پراکسیدهیدروژن، رادیکالهای سوپراکسید و هیدروکسیل و کاهش دفاع آنتیاکسیدانی انجام میشود. این گونه ها می توانند باعث آسیب به DNA، اکسیداسیون پروتئینها، پراکسیداسیون لیپیدها و در نهایت آپوپتوز سلول های عصبی گردند (3). ROS میتواند به همه مولکولهای زیستی شامل لیپیدها، پروتئینها و اسیدهای نوکلئیک حمله کند. پروتئین کربونیلها (CP: Carbonyl Protein) یکی از مهمترین بیومارکرهای اکسیداسیون پروتئینها بوده و از نظر شیمیایی پایدار میباشد. گروههای پروتئین کربونیل از طریـق اکسیداسیون مستقیم اسیدهای آمینه یا در اثر واکنش ثانویه با محصولات اکسیداسیون اولیه قندها و لیپیدها ایجاد میشوند (4). همچنین، افزایش استرس اکسیداتیو منجر به تخریب غشای سلول، شکست DNA، افزایش پروتئین کربونیل، کاهش مکانیسمهای محافظتی و نشانگرهای آن مانند پروتئینهای شوک حرارتی (Heat shock protein) یا HSPها (بهویژه HSP72 و HSP70) در بافت مغز شده و در نهایت آپوپتوز میشود (5). پروتئینهای شوک حرارتی اثرات آنتیاکسیدانی و ضد التهابی دارند و در تاخوردگی اولیه و مجدد پروتئین مؤثر هستند و باعث محافظت هسته سلولها و غشای لیپیدی در مقابل آسیب میشوند و از آپوپتوز جلوگیری میکنند (6). در سیستم عصبی، بیان HSP70 در انواعی از شرایط پاتولوژیک مثل بیماری¬های نورودژنراتیو، ایسکمیمغزی، ضربه و صرع افزایش مییابد (5). ویتامین C از نورونهای گلوتاماترژیک بهعنوان قسمتی از روند برداشت مجدد گلوتامات، آزاد میشود و بهعنوان یک ویتامین آنتیاکسیدان از طریق جریان خون وارد مغز شده و در آنجا تجمع مییابد. این ویتامین علاوهبر نقش کوفاکتوری در واکنشهای مختلف شیمیایی و آنزیمی، نقـش نوروترانسمیتری در سیستم عصبی مرکزی (CNS: Central Nervous System) پستانداران را نیز دارا میباشد. همچنین، ویتامین E یکی از مهمترین مواد در سیستمهای دفاعی بدن است که باعث خنثیکردن استرس اکسیداتیو در مقابل رادیکالهای آزاد میشود و بهعنوان یک آنتیاکسیدان طبیعی شناخته شدهاست. ترکیبات حاوی گوکرد و ویتامین هایی نظیر E و C و فلاونوئیدها با خاصیت به داماندازی رادیکالهای آزاد، میتوانند منجر به حذف اثر مولکولهای فعال و آسیبرسان به ماکرومولکول¬های حیاتی مانند DNA و پروتئین ها شوند (6). بررسی ادبیات تحقیق نشانداده¬است که مصرف ویتامین C به مدت چند هفته توسط موش های دارای استرس اکسایش منجر به افزایش عامل نروتروفیک مشتق از مغز میگردد (7) و میتواند پوشش محافظتی قدرتمندی را برای مغز ایجاد کند (8). یک مطالعه مروری نشانداده است که ویتامین C منجر به بهبود اختلالات روانی در مدلهای حیوانی مانند اسکیزوفرنی، اضطراب و بیماری آلزایمر می شود (9). سایر مطالعات، نقش ویتامین E را در کاهش پروتئین کربونیل و افزایش HSP70 تایید نمودهاند (10). مطالعه Wang و همکاران نشان داد افرادی که دوز بالاتری از ویتامین E را از طریق رژیم غذایی دریافت میکنند کمتر در معرض ابتلا به آلزایمر قرار دارند (11). همچنین، مطالعه رضایی و همکاران حاکی از کاهش میزان مالوندی آلدئید و کربونیل پروتئین ها پس از مصرف ویتامین E و ویتامین D بود (6). مطالعه Arlt و همکاران نیز نشان داد که استفاده از مکملهای ویتامین C و E منجر به افزایش ویتامین های آنتیاکسیدانی CSF میگردد (12). اگرچه مطالعاتی در ارتباط با بررسی نقش ویتامین E به تنهایی و ویتامین C به تنهایی بر مکانیسم سلولی مولکولی استرس اکسیداتیو و در مقابل پروتئینهای محافظتی سلول انجام شدهاست؛ هنوز تفاوت بین این دو آنتیاکسیدان در مهار آسیبهای اکسایشی به خوبی شناخته نشدهاست. مطالعه¬ حاضر با هدف مقایسه دو آنتیاکسیدانE و C و بررسی اثر همزمان آنها بر پروتئین کربونیل و بیان ژن HSP70 صورت گرفت.
روش بررسی
مطالعه حاضر یک تحقیق تجربی - آزمایشگاه بود که روی نمونه های حیوانی انجام شد. در این مطالعه، 35 سر موش صحرایی سالمند ماده با سن تقریبی 14 الی 16 ماه و محدوده وزنی 270 تا 320 گرم انتخاب شدند. راهنمای مراقبت و استفاده از حیوانات آزمایشگاهی بهطور دقیق خوانده شده و تمامی مراحل به صورت کاملا استاندارد در نظر گرفته شد. نمونههای مورد بررسی از مرکز نگهداری حیوانات وابسته به دانشگاه آزاد مرودشت خریداری گردیدند. جهت سازگاری با محیط به مدت یک هفته در شرایط استاندارد شامل شرایط کنترل شده نور (12 ساعت روشنایی و 12 ساعت تاریکی، شروع روشنایی 6 صبح و شروع خاموشی 6 عصر) و تحت دمای 22±3 سانتیگراد و رطوبت 50 درصد نگهداری شدند. در ابتدا، از 35 سر موش صحرایی سالمند، 7 مورد در گروه کنترل سالم قرا گرفتند و 28 سر موش صحرایی با استفاده از تزریق صفاقی تک دوز 10 میلیگرم بر کیلوگرم تریمتیلتین کلراید (TMT: Trimethyltin) (شرکت سیگما آلدریچ، آمریکا) به بیماری آلزایمر مبتلا شدند (13). این 28 موش در چهار گروه، کنترل بیمار، گروه دریافت کننده مکمل ویتامین C، گروه دریافت مکمل ویتامین E و گروه دریافت حلال ویتامین E (شم) تقسیم شدند. چهارده روز پس از تزریق TMT، بیماری آلزایمر با مشاهده علائم بالینی شامل اضطراب، افسردگی، پرخاشگری، پیچ و تاب های دمی و خونریزی اطراف چشم، آزمون حافظه و یادگیری توسط شاتل باکس و ماز Y ارزیابی و تایید شد (14). تست حافظه و یادگیری، توسط ماز Y جهت بررسی رفتار تناوبی بهکار رفت و شاتل باکس جهت بررسی یادگیری اجتنابی غیرفعال و تاخیر اولیه و تاخیر ثانویه در آن صورت گرفت.
مکملدهی ویتامین E و ویتامین C: در طول دوره تحقیق، مکمل ویتامین E به میزان 120 میلیگرم (شرکت SolarBio، چین) بهصورت روزانه در 1/5 میلیلیتر دکستروز حل میگردید و بهصورت خوراکی به موشهایی که در گروه ویتامینE قرار داشتند، خورانده شد. با توجه به مکملدهی طولانیمدت، مکمل ویتامین E (روزانه mg/kg 30) بهصورت خوراکی و با در نظر گرفتن وزن موشها اندازهگیری شد (15). مکمل ویتامین C (اسکوربیک اسید) (شرکت سیگما آلدریچ) روزانه به صورت خوراکی در طعم دهنده غذا حل شد و به صورت 4 میلیگرم به ازای هر کیلوگرم وزن موشها به آنها خورانده شد (16). جهت تعیین دوز ویتامین C و E موشها هر هفته وزنگیری شدند (ترازوی ویژه اندازهگیری با قابلیت اندازهگیری 0/001 گرم، ساخت شرکت کرن، آلمان).
تشریح و نمونهبرداری: 48 ساعت پس از آخرین جلسه و در حالت 12 ساعت ناشتا موشهای صحرایی با ترکیب کتامین (70 میلیگرم به ازای هر کیلوگرم از وزن بدن) و زایلازین (25 میلیگرم بر کیلوگرم) با نسبت سه به دو و با تزریق صفاقی بیهوش شدند (ساخت شرکت آلفاسان، هلند). پس از اطمینان از بیهوشی کامل بافت مغز موشهای صحرایی استخراج و پس از شست و شو و توزین در دمای 70- فریز شد. متغیرهای تحقیق با استفاده از روش الایزا و Real Time PCR اندازهگیری شدند (شرکت StepOne کشور ایتالیا).
شیوه اندازهگیری متغیرهای تحقیق:
مقادیر پروتئین کربونیل با استفاده از کیت ویژه الایزا (شرکت ZellBio ، آلمان) با مقیاس نانو مول بر میلیگرم (nmol/mg) اندازهگیری شد. بیان ژنی HSP70 در بافت هیپوکامپ با استفاده از روش qReal Time PCR اندازهگیری و سپس بر اساس مقیاس فولد چنج گزارش شد. مقدار 750 میکرولیتر از محلول تجاری ترایزول سرد شده، حدود 100 میلی¬گرم از هر نمونه بافت به مدت 10 ثانیه توسط دستگاه، هموژنایز شده RNA با استفاده از کیت شرکت سازنده (ترایزول ایران، شرکت یکتا تجهیز) به روش اسپکتروفتومتری غلظت نمونه RNA، با استفاده از تعیین جذب نوری در طول موج 260 نانومتر اندازهگیری شد. برای تعیین خلوص RNA از محاسبه نسبت A260/A280 استفاده شد.
C (µg/µl) = A260× ɛ× d/1000
پس از استخراج RNA، مراحل سنتز cDNA طبق پروتکل شرکت سازنده (Biofact، کره جنوبی) انجام و سپس cDNA سنتز شده جهت انجام واکنش رونویسی معکوس مورد استفاده قرار گرفت. بیان ژنها با استفاده از روش کمی q-RT PCR صورت گرفت. توالی پرایمرهای تحقیق با استفاده از سایت NCBI به دست آمد و با بکار گیری امکانات موجود در این سایت، پرایمرهای اختصاصی برای هر کدام از ژنها طراحی شدند (جدول 1). سپس با نرم¬افزارهای دیگر پرایمرهای طراحی شده بررسی شدند. در طراحی این پرایمرها نهایت دقت به عمل آمد و خصوصیات لازم برای استفاده از آنها در Real-time PCR نیز لحاظ شد. پس از اتمام فعالیت دستگاه و مشاهده نمودارها مبنی بر افزایش تعداد قطعه مورد نظر و میزان نشرفلورسانس با محاسبه ΔΔCt میزان تغییر در بیان ژن مورد نظر نسبت به ژن کنترل داخلی و حالت کنترل که فاقد محیطهای تمایزی است، سنجیده شد و در آخر داده¬های میزان بیان ژن استفاد از فرمول ΔΔCt-2 محاسبه شد.
تجزیه و تحلیل آماری
دادههای تحقیق در نرمافزارversion 16 SPSS وارد و تجزیه و تحلیل گردید. جهت بررسی نرمالیتی توزیع یافتهها از آزمون شاپیرو- ویلک استفاده شد. بررسی اثر مکمل ویتامین E و ویتامین C با استفاده از آنالیز وارایانس یک راهه صورت گرفت. همچنین، برای بررسی نوع اثر متغیرها از آزمون تعقیبی توکی استفاده شد. سطح معنیداری برای تمام تجزیه و تحلیلها 0/05 در نظر گرفته شد.
نتایج
میانگین متغیرهای پروتئین کربونیل و بیان نسبی HSP70 در گروههای مورد مطالعه در جدول 2 نمایش داده شدهاست.
مقادیر پروتئین کربونیل (0/005>P و 14/75=F) و بیان ژنی HSP70 (P<0/005 و 209/08=F) در گروههای مورد بررسی بهطور معنیداری متفاوت بود. بررسی تاثیر هشت هفته مکملدهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل و بیان ژنی HSP70 در بافت هیپوکامپ موشهای صحرایی مبتلابه بیماری آلزایمر در جدول 3 نمایش داده شدهاست.
مقادیر پروتئین کربونیل در گروه کنترل بیمار و حلال ویتامین E بهطور معنیداری بیشتر از گروه کنترل سالم بود (0/005>P). مقادیر پروتئین کربونیل در گروههای ویتامین C (P= 0/007) و ویتامین E (P= 0/02) بهطور معنیداری کمتر از گروه کنترل بیمار بود. همچنین تفاوت معنیداری در گروههای ویتامین C و ویتامین E مشاهده نشد (0/97=P). همچنین، مقادیر بیان ژنی HSP70 در گروه کنترل بیمار و حلال ویتامین E بهطور معنیداری کمتر از گروه کنترل سالم بود (001/0>P). بیان ژنی HSP70 در گروههای ویتامین C (P= 0/001) و ویتامین E (P= 0/001) بهطور معنیداری بیشتر از گروه کنترل بیمار بود. تفاوت معنیداری در گروههای ویتامین C و ویتامین E از نظر بیان ژنی HSP70 مشاهده نشد (0/74=P). نتایج آزمون تعقیبی در خصوص اثر مکملدهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل و بیان ژنی HSP70 بافت هیپوکامپ موشهای صحرایی مبتلابه بیماری آلزایمر در نمودارهای 1 و 2 نمایش داده شدهاست.
جدول 1: پرایمر طراحی شده برای ژن HSP70

جدول 2: میانگین متغیرهای پروتئین کربونیل و بیان نسبی HSP70 در گروه¬های مورد مداخله و کنترل

جدول3: بررسی تاثیر هشت هفته مکملدهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل و بیان ژنی HSP70 در بافت هیپوکامپ موشهای صحرایی مبتلابه بیماری آلزایمر با استفاده از آزمون آنالیز واریانس یک راهه

*آنالیز واریانس یکراهه

نمودار 1: بررسی اثر مکملدهی ویتامین C و ویتامین E بر مقادیر بیان ژنی HSP70 بافت هیپوکامپ موشهای مبتلا به بیماری آلزایمر با استفاده از آزمون تعقیبی توکی
*** (0/001=P) کاهش معنی دار نسبت به گروه کنترل سالم ### (0/001=P) افزایش معنیدار نسبت به گروه کنترل بیمار

نمودار 2: نمودار 1. بررسی اثر مکمل دهی ویتامین C و ویتامین E بر مقادیر پروتئین کربونیل بافت هیپوکامپ موش¬های مبتلا به بیماری آلزایمر با استفاده از آزمون تعقیبی توکی
*** (0/001=P) افزایش معنی دار نسبت به گروه کنترل سالم ## (0/01=P) و # (0/05=P) کاهش معنیدار نسبت به گروه کنترل بیمار
بحث
از بین آنتیاکسیدانهای موثر در پیشگیری و درمان بیماری آلزایمر، ویتامینهای محلول در آب و چربی مانند ویتامین C و E، مواد معدنی مانند سلنیوم، منگنز، مس و روی، پروتئین هایی مانند آلبومین، سرولوپلاسمین، ترانسفرین، هاپتوگلوبولین، فلاونوئیدها و فیتوکمیکالها قابل توجه میباشند (17,18). بهطور خلاصه، یافته های مطالعه حاضر نشان داد که هشت هفته مکمل دهی ویتامین C و ویتامین E منجر به کاهش پروتئین کربونیل و افزایش HSP70 گردید. همچنین، مکمل دهی ویتامین C تفاوتی با مکمل ویتامین E از نظر تاثیر بر پروتئین کربونیل و بیان ژنی HSP70 در موشهای صحرایی مبتلا به آلزایمر نداشت. مشابه با یافته های مطالعه حاضر، مطالعه Cansev و همکاران نشان داد که ویتامین C و ویتامین E جهت اثرگذاری پیشسازهای فسفولیپید بر افزایش سطوح فسفولیپیدهای غشایی و پروتئین های سیناپسی، که شاخص های غیرمستقیم سیناپتوژنز هستند، ضروری هستند. عرضه همزمان آنها ممکن است در بیماران مبتلا به آلزایمر مفید باشد، زیرا این بیماری با از دست دادن سیناپس و کاهش سطوح پلاسمایی و مغزی پیشسازهای فسفولیپید و آنتیاکسیدانها مشخص میشود (19). مطالعه Sil و همکاران نشان داد که تجویز ویتامین C (200 و 400 میلیگرم بر کیلوگرم وزن بدن) در موشهای آلزایمری منجر به بهبود اختلالات حافظه، جلوگیری از تخریب عصبی و التهاب عصبی در هیپوکامپ میگردد. التهاب عصبی در هیپوکامپ همچنین بر پاسخهای ایمنی محیطی و التهاب در سرم موش¬های آلزایمری تأثیر گذاشت و همه این پارامترها نیز با دوز 200 و 400 میلیگرم ویتامین C بازیابی شدند (20). یافتههای مطالعه Rai و همکاران نشان داد که مصرف ویتامین C به مدت 4 هفته توسط موشهای دارای استرس اکسایش منجر به افزایش عامل نروتروفیک مشتق از مغز می گردد (7). یافتههای یک مطالعه دیگر حاکی از آن بود که ویتامین C میتواند پوشش محافظتی قدرتمندی را برای مغز ایجاد کند (8). یک مطالعه مروری نشان داده است که ویتامین C منجر به بهبود اختلالات روانی در مدلهای حیوانی مانند اسکیزوفرنی، اضطراب و بیماری آلزایمر میشود (9). ویتامین C به هنگام فشار اکسایشی از طریق تولید و ترشح عامل نروتروفیک مشتق از مغز اثر محافظتی در عامل عصبی و مغز دارد. در این خصوص، یافتههای یک مطالعه دیگر نشانداد که مصرف دو هفته مکمل ویتامین C منجر به کاهش مالوندی آلدئید (MDA: Malondialdehyde) و افزایش بیان ژنی HSP70 میگردد (21). این یافته با نتایج مطالعه حاضر هم راستا بود. یافتههای یک مطالعه دیگر روی نمونههای حیوانی نشانداد که استفاده از مکمل ویتامین C به مدت 6 ماه منجر به کاهش رفتاری در یک مدل موش آلزایمری گردید. براساس یافتهها، کاهش الیگومریزاسیون Aβ با کاهش قابل توجه آسیب اکسیداتیو مغز و در نسبت Aβ42 محلول به Aβ40، (بهعنوان یک شاخص معمولی از پیشرفت آلزایمر) همراه بود. علاوه بر این، مصرف ویتامین C باعث کاهش سیناپتوفیزین و فسفوریلاسیون تاو در Ser396 شد (12). این یافته، نتایج مطالعه حاضر را مورد تایید قرار میدهد. ویتامین C به وفور در سیتوزول و مایع خارج سلولی یافت میشود و میتواند با پراکسید هیدروژن ترکیب گردد و بهعنوان یک ماده احیا کننده عمل¬کند (22). ویتامینC میتواند اثر شیمیایی موادی را که به بافتهای بدن آسیب میرسانند، خنثی کند. این ویتامین از طریق ایجاد یک پوشش محافظتی برای مغز، در کاهش علائم برخی بیماری¬ها و اختلالات مغزی همچون پارکینسون کمک میکند. برخی یافتهها نشان داده است که مصرف مکمل ویتامینC منجر به افزایش بقا و حفظ نورون¬های عصبی در مغز میانی می¬گردد (8,23). همچنین، افزایش عامل نروتروفیک مشتق از مغز در پی مصرف ویتامین C مشاهده شده است. دیگر یافته این مطالعه، نقش ویتامین E را در کاهش پروتئین کربونیل و افزایش HSP70 تایید کرد. در خصوص اثر بخشی مکمل ویتامین E بر آلزایمر، مطالعه Foudah و همکاران با هدف بررسی چگونگی تاثیر ویتامین E بر موشهای صحرایی مبتلا به آلزایمر صورت گرفت. یافتهها حاکی از تایید اثر نوتروپیک مصرف رسوراترول و ویتامین E بود (24). اگرچه مطالعات تجربی نشانداده است که ویتامین E اثرات مفیدی در مدلهای حیوانی آلزایمر دارد، اثربخشی آن در بیماران مبتلا به آلزایمر هنوز مورد بحث است، حتی اگر بیماران مبتلا به آلزایمر سطوح کمتر ویتامین E در پلاسما و مایع مغزی نخاعی داشته باشند (25). برخی یافتهها نشانداده است که سطوح بالاتر ویتامین E در پلاسما با کاهش خطر آلزایمر همراه است (26). با اینحال، این یافته¬ها دال بر اثبات اثر درمانی ویتامین E نیست. در واقع، فقط برخی از مطالعات مزایای مکمل ویتامین E را نشاندادند. در همین راستا، مطالعه Sano و همکاران نشانداد که ویتامین E (2000 واحد در روز) پیشرفت آلزایمر را در بیماران آلزایمری شدید به تاخیر میاندازد (27). مطالعه دیگری در بیماران مبتلا به آلزایمری خفیف تا متوسط نشانداد که ویتامین E (2000 واحد در روز) زوال عملکرد مغز و بار مراقب را کاهش میدهد (28). برخلاف این دادهها، گزارشهای دیگر نتایج متضادی را نشاندادند. در واقع شواهد قانعکنندهای نشان نمیدهند که درمان با ویتامین E میتواند اثرات مثبتی در آلزایمر داشته باشد (29). یک مطالعه دیگر نشانداد که تجویز ویتامین E اثرات مفیدی در بیماران مبتلا به اختلال شناختی خفیف ندارد. در این مطالعه، سرعت پیشرفت از اختلال شناختی به آلزایمر ارزیابی شد، اما درمان ویتامین E بر احتمال پیشرفت به آلزایمر تأثیری نداشت (30). یک بررسی سیستماتیک نشانداد که ویتامین E عملکرد شناختی را بهبود نمیبخشد و از پیشرفت زوال عقل جلوگیری نمیکند، اما ممکن است فرایند کاهش عملکردی در آلزایمر را کاهش دهد. همچنین، یافتهها نشانداد که ویتامین E خطر ابتلا به عوارض جانبی جدی یا مرگ و میر را افزایش نمیدهد (29). یکی از نگرانیهای اصلی در مورد درمان ویتامین E این بود که دوزهای بالا ممکن است مرگ و میر را افزایش دهد. در همین راستا، یک متاآنالیز، هیچ ارتباطی بین دوز ویتامین E و خطر مرگ و میر نشان نداد. به ویژه ویتامین E تأثیری بر مرگ و میر ناشی از همه علل در دوزهای تا 5500 واحد در روز نداشت (31). همچنین، یافته¬های یک مطالعه نشانداد افرادی که دوز بالاتری از ویتامین E را از طریق رژیم غذایی دریافت میکنند کمتر در معرض ابتلا به آلزایمر قرار دارند (11). مشابه یافتههای مطالعه حاضر، مطالعه Khorami و همکاران نشانداد اثر کلی ترکیبات ویتامین E باعث کاهش افزایش بیان HSP70 میشود (32). یک مطالعه دیگر نشانداده است که مصرف همزمان با کورستین یا ویتامین E آپوپتوز و سطح پروتئین استرس را نسبت به گروه شاهد کاهش میدهد. این یافتهها نشان می¬دهد که ویتامین E ممکن است اثر محافظتی در برابر آپوپتوز ناشی از استرس اکسیداتیو داشته باشد (33). ویتامین E با خاصیت آنتی-اکسیدانی خود، اولین سد دفاعی در برابر پراکسیداسیون اسیدهای چرب اشباع نشده موجود در فسفولیپیدهای غشای سلولی و تحت سلولی است. این ویتامین از طریق تبدیل رادیکال آزاد اسید چرب پراکسیل به هیدروپراکسی سبب توقف انتشار آسیب ناشی از رادیکال آزاد میشود (10). ویتــامین E با اتصال به لییوپروتئینهای غشاء سلول، از اکسیداسیون اسـیدهای چـرب غیر اشباع در برابر رادیکـالهـای آزاد و پراکسیداسیون ممانعت کرده و باعث پایداری غشای سـلول میشود (34). همچنین، ویتامین E بهطور مستقیم منجر به پاکسازی سلول از کراتین کیناز و لاکتات دهیدروژناز پروتئین واکنشگر C، مالون دیآلدئید و در عین حال افزایش فسفوریلاسیون پروتئین کینازها، بهبود متابولیسم سلولی، افزایش بیوژنز میتوکندریایی و ظرفیت متابولیکی سلول عضلانی میگردد (35,36). ویتامینE همچنین دارای اثرات ضد التهابی، ضد آپوپتوزی و آنتی اکسیدانی میباشد و در کاهش اضطراب و افسردگی نقش¬دارد (37, 16). در ارتباط با بررسی و مقایسه اثر ویتامین E و C محققین نشاندادند تجویز ویتامین های E و C باعث افزایش فعالیت آنزیمهای سوپراکسید دیسموتاز، کاتالاز و گلوتاتیون S- ترانسفراز, افزایش غلظت مالون دیآلدئید و کاهش فعالیت لاکتات دهیدروژناز و غلظت گلوتاتیون در قلب موش¬های صحرایی میگردد (38). با توجه به یافتههای بهدست آمده از مطالعات قبلی به نظر میرسد که پایبندی به رژیم غذایی مدیترانهای حاوی مقادیر بالای ویتامین C و E (مصرف بالاتر ماهی، میوه و سبزیجات غنی از آنتی اکسیدانها) بـا کاهش خطر بیماری آلزایمر همراه است (39). همچنین، مشابه مطالعه حاضر، رضایی و همکاران نشاندادند مصرف ویتامین E و ویتامین D موجب کاهش میزان مالون دیآلدئید و کربونیل پروتئینها در شرایط آزمایشگاهی گردید (6). در تناقض با یافتههای مطالعه حاضر، مطالعه Fillenbaum و همکاران با هدف تاثیر مکمل ویتامین C و/یا E در یک نمونه مبتنی بر جامعه از افراد مسن، بهجهت به تاخیر افتادن زوال عقل یا بیماری آلزایمر صورت گرفت. یافتهها حاکی از آن بود که استفاده از هیچ ویتامین C و/یا E حتی در دوز بالا زمان زوال عقل یا بیماری آلزایمر را کاهش-نداد (40). مطالعه دیگر توسط Arlt و همکاران که روی نمونههای انسانی انجام شد، نشاندادند که استفاده از مکمل-های ویتامین C (1000 میلیگرم در روز) و E (400 واحد در روز) منجر به افزایش ویتامینهای آنتی اکسیدانی CSF پس از 1 ماه و 1 سال گردید، در حالیکه لیپیدهای CSF تنها پس از 1 سال استفاده از مکمل کاهش یافت. با این حال، سیر بالینی آلزایمر بین گروه استفاده از ویتامین و گروه کنترل تفاوت معنیداری نداشت (12). با این حال، این یافتهها این تاثیرات پیشگیرانه احتمالی ویتامین C و ویتامین E را بر آلزایمر رد نمیکند. ذکر این نکته حائز اهمیت است که مطالعه حاضر بر روی نمونههای حیوانی انجام شد که بیماری الزایمر آن¬ها به تازگی ایجاد شده بود و موشها در مراحل اولیه ابتلا بودند.
محدودیتهای تحقیق
عدم ارزیابی همافزایی اثر ویتامین C و E یکی از ضعفهای مطالعه حاضر میباشد. همچنین، عدم ارایه دادههای حاصل از ایجاد صحیح مدل آلزایمر با تستهای رفتاری دیگر از محدودیتهای این مطالعه است.
نتبجهگیری
تعداد افراد مبتلا به آلزایمر به طور مداوم در حال افزایش است و به همین دلیل، بررسی درمانهای تکمیلی که بتواند از پیشرفت بیماری جلوگیری کند یا آن را به تأخیر بیندازد، اهمیت فراوانی دارد. شواهد نشانداد که استرس اکسیداتیو نقش اصلی را در آسیبشناسی آلزایمر ایفا میکند. ویتامین E و C جزء مهمترین آنتیاکسیدانها میباشند و برخی دادهها نشان میدهند که میتواند با استرس اکسیداتیو ناشی از آمیلوئید-β مقابله کند و حافظه و نقصهای شناختی را نیز بهبود بخشند. بهطور خلاصه یافتههای بدست آمده از مطالعه حاضر حاکی از آن بود که هر دو ویتامین C و ویتامین E دارای اثرات یکسان آنتیاکسیدانی و محافظت سلولی در بافت مغز موشهای مبتلا به آلزایمر میباشند. با توجه به تأثیر ویتامین C و E بر کاهش پروتئین کربونیل و افزایش HSP70 در بافت هیپوکامپ موشهای صحرایی، پیشنهاد میگردد در مطالعات بعدی اثر این ویتامینها بر دیگر اختلالات نورودژنراتیو مورد بررسی قرار گیرد. همچنین، پیشنهاد میشود در مطالعات آینده اثرات آنتیاکسیدانهای آنزیمی و غیر آنزیمی این ویتامینها نیز ارزیابی شود.
سپاسگزاری
از کلیهکارشناسان خانه حیوانات دانشگاه آزاد مرودشت که در کار تکنیکی همکاری نمودهاند، تشکر به عمل آید و مقاله نیز بر گرفته از پایاننامه دکتری عمومی دامپزشکی است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی- واحد بهبهان تصویب شده است (کد اخلاق : IR.IAU.BEHBAHAN.REC.1402.014).
مشارکت نویسندگان
تمامی نویسندگان در ارائه ایده، در طراحی مطالعه، در جمعآوری دادهها، در تجزیه و تحلیل دادهها به یک اندازه مشارکت داشته و همچنین در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, et al. Alzheimer's disease. The Lancet 2021; 397(10284): 1577-90.
2- Lee SW, Chung SS. A review of the effects of vitamins and other dietary supplements on seizure activity. Epilepsy & Behavior 2010; 18(3): 139-50.
3- Jellinger KA. Basic mechanisms of neurodegeneration: a critical update. J cellular and molecular med 2010; 14(3): 457-87.
4- Pradeep AR, Ramchandraprasad M, Bajaj P, Rao NS, Agarwal E. Protein carbonyl: An oxidative stress marker in gingival crevicular fluid in healthy, gingivitis, and chronic periodontitis subjects. Contemporary Clin Dent 2013; 4(1) 27-31.
5- Airoldi C, La Ferla B, D'Orazio G, Ciaramelli C, Palmioli A. Flavonoids in the treatment of Alzheimer's and other neurodegenerative diseases. Curr med chem 2018; 25(27): 3228-46.
6- Rezaei Tireh Shabankareh S, Mohiti Ardakani J, Fallah R, Karimi M, Pourrajab F, Ehsani R, et al. Effect of Vitamin E on Oxidative Stress Markers of Proteins and Lipids in Children with Idiopathic Epilepsy. SSU_Journals 2016; 23(11): 1108-15.[persian]
7- Rai AR, Madhyastha S, Rao GM, Rai R, Sahu SS. A Comparison of Resveratrol and Vitamin C Therapy on Expression of BDNF in Stressed Rat Brain Homogenate. IOSRJ Pharm 2013; 3(10): 22-7.
8- May JM. Vitamin C transport and its role in the central nervous system. Water Soluble Vitamins: Clinical Research and Future Application. In: Stanger, O. (eds) Water Soluble Vitamins. Subcellular Biochemistry, vol 56. Springer, Dordrecht.
9- Han Q-q, Shen T-t, Wang F, Wu P-f, Chen J-g. Preventive and therapeutic potential of vitamin C in mental disorders. Curr med sci 2018; 38(1): 1-10.
10- Najafzadeh H, Razijalali M, Morovvati H, Navvabi L. Evaluation the effect of cimetidine, estradiol and vitamin E on myoglobinuric renal toxicity in rats. Am Eurasian J Toxicol Sci 2011; 3(3): 177-83.
11- Wang W, Li J, Zhang H, Wang X, Zhang X. Effects of Vitamin E Supplementation on the Risk and Progression of AD: A Systematic Review and Meta-Analysis. Nutritional Neuroscience 2021; 24(1): 13-22.
12- Arlt S, Müller-Thomsen T, Beisiegel U, Kontush A. Effect of One-Year Vitamin C-And E-Supplementation on Cerebrospinal Fluid Oxidation Parameters and Clinical Course in Alzheimer’s Disease. Neurochemical Res 2012; 37(12): 2706-14.
13- Hosseini SA, Salehi OR, Farzanegi P, Farkhaie F, Darvishpour AR, Roozegar S. Interactive Effects of Endurance Training and Royal Jelly Consumption on Motor Balance and Pain Threshold in Animal Model of the Alzheimer Disease. Archives of Neuroscience 2020;7(2): e91857.
14- Liu S, Cao X-L, Liu G-Q, Zhou T, Yang X-L, Ma B-X. The in silico and in vivo evaluation of puerarin against Alzheimer's disease. Food & function 2019;10(2):799-813.
15- Nouri H, Sheikholeslami-Vatani D, Moloudi MR. Changes in UPR-PERK pathway and muscle hypertrophy following resistance training and creatine supplementation in rats. Journal of physiol biochem 2021; 77(2): 331-9.
16- Lee G, Kim Y, Jang J-H, Lee C, Yoon J, Ahn N, et al. Effects of an exercise program combining aerobic and resistance training on protein expressions of neurotrophic factors in obese rats injected with beta-amyloid. International Journal of Environmental Research and Public Health 2022;19(13):7921.
17- Sinbad OO, Folorunsho AA, Olabisi OL, Ayoola OA, Temitope EJ. Vitamins as antioxidants. Journal of Food Science and Nutrition Research 2019; 2(3): 214-35.
18- Gomes EC, Silva AN, Oliveira MRd. Oxidants, antioxidants, and the beneficial roles of exercise-induced production of reactive species. Oxidative medicine and cellular longevity 2012; 2012: 756132.
19- Cansev M, Turkyilmaz M, Sijben JW, Sevinc C, Broersen LM, van Wijk N. Synaptic Membrane Synthesis in Rats Depends on Dietary Sufficiency of Vitamin C, Vitamin E, and Selenium: Relevance for Alzheimer’s Disease. J Alzheimer's Dis 2017; 59(1): 301-11.
20- Sil S, Ghosh T, Gupta P, Ghosh R, Kabir SN, Roy A. Dual Role of Vitamin C on the Neuroinflammation Mediated Neurodegeneration and Memory Impairments in Colchicine Induced Rat Model of Alzheimer Disease. Journal of Molecular Neurosc 2016; 60(4): 421-35.
21- Namani F. The Effects of 14 Days Vitamin C Supplementation on Oxidant and Antioxidant Factors after One Bout Acute Exercise Training in Active Girls. Journal of Applied Health Studies in Sport Physiol 2016; 3(2): 47-55.
22- Jourkesh M, Sadri I, Sahranavard A, Ojagil A, Dehganpoori M. The Effects of two different doses of Antioxidant Vitamin C Supplementation on bioenergetics index in male college student. Journal of American Science 2011;6(1):852-8.
23- Ferrada L, Barahona MJ, Salazar K, Vandenabeele P, Nualart F. Vitamin C controls neuronal necroptosis under oxidative stress. Redox biol 2020; 29: 101408.
24- Foudah AI, Devi S, Alam A, Salkini MA, Ross SA. Anticholinergic effect of resveratrol with vitamin E on scopolamine-induced Alzheimer’s disease in rats: Mechanistic approach to prevent inflammation. Frontiers Pharmacol 2023; 14: 1115721.
25- Dong Y, Chen X, Liu Y, Shu Y, Chen T, Xu L, et al. Do low‐serum vitamin E levels increase the risk of Alzheimer disease in older people? Evidence from a meta‐analysis of case‐control studies. Internat J geriat psychiatry 2018; 33(2): e257-e63.
26- Mangialasche F, Kivipelto M, Mecocci P, Rizzuto D, Palmer K, Winblad B, et al. High Plasma Levels of Vitamin E forms and Reduced Alzheimer's Disease Risk in Advanced Age. J Alzheimer's Dis 2010; 20(4): 1029-37.
27- Sano M, Ernesto C, Thomas RG, Klauber MR, Schafer K, Grundman M, et al. A Controlled Trial of Selegiline, Alpha-Tocopherol, or both as Treatment for Alzheimer's Disease. N Engl J Med 1997; 336(17): 1216-22.
28- Dysken MW, Sano M, Asthana S, Vertrees JE, Pallaki M, Llorente M, et al. Effect of Vitamin E and Memantine on Functional Decline in Alzheimer Disease: The TEAM-AD VA Cooperative Randomized Trial. Jama 2014; 311(1): 33-44.
29- Farina N, Llewellyn D, Isaac MGEKN, Tabet N. Vitamin E for Alzheimer's dementia and mild cognitive impairment. Cochrane Database of Systematic Rev 2017; 1(1): CD002854.
30- Petersen RC, Thomas RG, Grundman M, Bennett D, Doody R, Ferris S, et al. Vitamin E and donepezil for the treatment of mild cognitive impairment. New England J Med 2005; 352(23): 2379-88.
31- Abner E, Schmitt F, Mendiondo M, Marcum J, Kryscio R. Vitamin E and all-cause mortality: a meta-analysis. Curr Aging Sci 2011; 4(2): 158–17.
32- Hoseini Khorami SA, Abd Mutalib MS, Khaza’ai H. Comparative Effect of Vitamin E Compounds on HSP70 Expression in Response to Acute Redox Imbalance in Chang Liver Cells. Reseaerch Square 2020; 1-16.
33- Ebokaiwe AP, Mathur PP, Farombi EO. Quercetin and Vitamin E Attenuate Bonny Light Crude Oil-Induced Alterations in Testicular Apoptosis, Stress Proteins and Steroidogenic Acute Regulatory Protein in Wistar Rats. Drug and Chemical Toxicology 2016; 39(4): 424-31.
34- Naghizadeh H, Salehikia A. Effect of One Course Exercise with Consumption Vitamin E on Antioxidant Status and Cardiovascular Risk Factors. Zahedan J Res in Medical Sci 2010;12(1): e94350.
35- Kim M, Eo H, Lim JG, Lim H, Lim Y. Can Low-Dose of Dietary Vitamin E Supplementation Reduce Exercise-Induced Muscle Damage and Oxidative Stress? A Meta-Analysis of Randomized Controlled Trials. Nutrients 2022; 14(8): 1599.
36- Alghadir AH, Gabr SA, Iqbal ZA, Al-Eisa E. Association of Physical Activity, Vitamin E Levels, and Total Antioxidant Capacity with Academic Performance and Executive Functions of Adolescents. BMC pediatrics 2019; 19: 1-8.
37- Zhang M, An C, Gao Y, Leak RK, Chen J, Zhang F. Emerging roles of Nrf2 and phase II antioxidant enzymes in neuroprotection. Progress in neurobiology 2013; 100: 30-47.
38- Tahmasebi K, Jafari M, Ahmadi A. Evaluation of oxidative stress biomarkers in rat heart exposed to diazinon and vitamns E and C. Quarterly of the Horizon of Medical Sciences 2015; 21(1): 13-9.
39- Hakimeh Z, Sadat SS, Pour AR, Tavirani MR. Epidemiology and etiology of Alzheimer's disease. Koomesh 2015;16(2); 119-27.[persian]
40- Fillenbaum GG, Kuchibhatla MN, Hanlon JT, Artz MB, Pieper CF, Schmader KE, et al. Dementia and Alzheimer's disease in community-dwelling elders taking vitamin C and/or vitamin E. Annals of Pharmacotherapy 2005; 39(12): 2009-14.
1- Scheltens P, De Strooper B, Kivipelto M, Holstege H, Chételat G, Teunissen CE, et al. Alzheimer's disease. The Lancet 2021; 397(10284): 1577-90.
2- Lee SW, Chung SS. A review of the effects of vitamins and other dietary supplements on seizure activity. Epilepsy & Behavior 2010; 18(3): 139-50.
3- Jellinger KA. Basic mechanisms of neurodegeneration: a critical update. J cellular and molecular med 2010; 14(3): 457-87.
4- Pradeep AR, Ramchandraprasad M, Bajaj P, Rao NS, Agarwal E. Protein carbonyl: An oxidative stress marker in gingival crevicular fluid in healthy, gingivitis, and chronic periodontitis subjects. Contemporary Clin Dent 2013; 4(1) 27-31.
5- Airoldi C, La Ferla B, D'Orazio G, Ciaramelli C, Palmioli A. Flavonoids in the treatment of Alzheimer's and other neurodegenerative diseases. Curr med chem 2018; 25(27): 3228-46.
6- Rezaei Tireh Shabankareh S, Mohiti Ardakani J, Fallah R, Karimi M, Pourrajab F, Ehsani R, et al. Effect of Vitamin E on Oxidative Stress Markers of Proteins and Lipids in Children with Idiopathic Epilepsy. SSU_Journals 2016; 23(11): 1108-15.[persian]
7- Rai AR, Madhyastha S, Rao GM, Rai R, Sahu SS. A Comparison of Resveratrol and Vitamin C Therapy on Expression of BDNF in Stressed Rat Brain Homogenate. IOSRJ Pharm 2013; 3(10): 22-7.
8- May JM. Vitamin C transport and its role in the central nervous system. Water Soluble Vitamins: Clinical Research and Future Application. In: Stanger, O. (eds) Water Soluble Vitamins. Subcellular Biochemistry, vol 56. Springer, Dordrecht.
9- Han Q-q, Shen T-t, Wang F, Wu P-f, Chen J-g. Preventive and therapeutic potential of vitamin C in mental disorders. Curr med sci 2018; 38(1): 1-10.
10- Najafzadeh H, Razijalali M, Morovvati H, Navvabi L. Evaluation the effect of cimetidine, estradiol and vitamin E on myoglobinuric renal toxicity in rats. Am Eurasian J Toxicol Sci 2011; 3(3): 177-83.
11- Wang W, Li J, Zhang H, Wang X, Zhang X. Effects of Vitamin E Supplementation on the Risk and Progression of AD: A Systematic Review and Meta-Analysis. Nutritional Neuroscience 2021; 24(1): 13-22.
12- Arlt S, Müller-Thomsen T, Beisiegel U, Kontush A. Effect of One-Year Vitamin C-And E-Supplementation on Cerebrospinal Fluid Oxidation Parameters and Clinical Course in Alzheimer’s Disease. Neurochemical Res 2012; 37(12): 2706-14.
13- Hosseini SA, Salehi OR, Farzanegi P, Farkhaie F, Darvishpour AR, Roozegar S. Interactive Effects of Endurance Training and Royal Jelly Consumption on Motor Balance and Pain Threshold in Animal Model of the Alzheimer Disease. Archives of Neuroscience 2020;7(2): e91857.
14- Liu S, Cao X-L, Liu G-Q, Zhou T, Yang X-L, Ma B-X. The in silico and in vivo evaluation of puerarin against Alzheimer's disease. Food & function 2019;10(2):799-813.
15- Nouri H, Sheikholeslami-Vatani D, Moloudi MR. Changes in UPR-PERK pathway and muscle hypertrophy following resistance training and creatine supplementation in rats. Journal of physiol biochem 2021; 77(2): 331-9.
16- Lee G, Kim Y, Jang J-H, Lee C, Yoon J, Ahn N, et al. Effects of an exercise program combining aerobic and resistance training on protein expressions of neurotrophic factors in obese rats injected with beta-amyloid. International Journal of Environmental Research and Public Health 2022;19(13):7921.
17- Sinbad OO, Folorunsho AA, Olabisi OL, Ayoola OA, Temitope EJ. Vitamins as antioxidants. Journal of Food Science and Nutrition Research 2019; 2(3): 214-35.
18- Gomes EC, Silva AN, Oliveira MRd. Oxidants, antioxidants, and the beneficial roles of exercise-induced production of reactive species. Oxidative medicine and cellular longevity 2012; 2012: 756132.
19- Cansev M, Turkyilmaz M, Sijben JW, Sevinc C, Broersen LM, van Wijk N. Synaptic Membrane Synthesis in Rats Depends on Dietary Sufficiency of Vitamin C, Vitamin E, and Selenium: Relevance for Alzheimer’s Disease. J Alzheimer's Dis 2017; 59(1): 301-11.
20- Sil S, Ghosh T, Gupta P, Ghosh R, Kabir SN, Roy A. Dual Role of Vitamin C on the Neuroinflammation Mediated Neurodegeneration and Memory Impairments in Colchicine Induced Rat Model of Alzheimer Disease. Journal of Molecular Neurosc 2016; 60(4): 421-35.
21- Namani F. The Effects of 14 Days Vitamin C Supplementation on Oxidant and Antioxidant Factors after One Bout Acute Exercise Training in Active Girls. Journal of Applied Health Studies in Sport Physiol 2016; 3(2): 47-55.
22- Jourkesh M, Sadri I, Sahranavard A, Ojagil A, Dehganpoori M. The Effects of two different doses of Antioxidant Vitamin C Supplementation on bioenergetics index in male college student. Journal of American Science 2011;6(1):852-8.
23- Ferrada L, Barahona MJ, Salazar K, Vandenabeele P, Nualart F. Vitamin C controls neuronal necroptosis under oxidative stress. Redox biol 2020; 29: 101408.
24- Foudah AI, Devi S, Alam A, Salkini MA, Ross SA. Anticholinergic effect of resveratrol with vitamin E on scopolamine-induced Alzheimer’s disease in rats: Mechanistic approach to prevent inflammation. Frontiers Pharmacol 2023; 14: 1115721.
25- Dong Y, Chen X, Liu Y, Shu Y, Chen T, Xu L, et al. Do low‐serum vitamin E levels increase the risk of Alzheimer disease in older people? Evidence from a meta‐analysis of case‐control studies. Internat J geriat psychiatry 2018; 33(2): e257-e63.
26- Mangialasche F, Kivipelto M, Mecocci P, Rizzuto D, Palmer K, Winblad B, et al. High Plasma Levels of Vitamin E forms and Reduced Alzheimer's Disease Risk in Advanced Age. J Alzheimer's Dis 2010; 20(4): 1029-37.
27- Sano M, Ernesto C, Thomas RG, Klauber MR, Schafer K, Grundman M, et al. A Controlled Trial of Selegiline, Alpha-Tocopherol, or both as Treatment for Alzheimer's Disease. N Engl J Med 1997; 336(17): 1216-22.
28- Dysken MW, Sano M, Asthana S, Vertrees JE, Pallaki M, Llorente M, et al. Effect of Vitamin E and Memantine on Functional Decline in Alzheimer Disease: The TEAM-AD VA Cooperative Randomized Trial. Jama 2014; 311(1): 33-44.
29- Farina N, Llewellyn D, Isaac MGEKN, Tabet N. Vitamin E for Alzheimer's dementia and mild cognitive impairment. Cochrane Database of Systematic Rev 2017; 1(1): CD002854.
30- Petersen RC, Thomas RG, Grundman M, Bennett D, Doody R, Ferris S, et al. Vitamin E and donepezil for the treatment of mild cognitive impairment. New England J Med 2005; 352(23): 2379-88.
31- Abner E, Schmitt F, Mendiondo M, Marcum J, Kryscio R. Vitamin E and all-cause mortality: a meta-analysis. Curr Aging Sci 2011; 4(2): 158–17.
32- Hoseini Khorami SA, Abd Mutalib MS, Khaza’ai H. Comparative Effect of Vitamin E Compounds on HSP70 Expression in Response to Acute Redox Imbalance in Chang Liver Cells. Reseaerch Square 2020; 1-16.
33- Ebokaiwe AP, Mathur PP, Farombi EO. Quercetin and Vitamin E Attenuate Bonny Light Crude Oil-Induced Alterations in Testicular Apoptosis, Stress Proteins and Steroidogenic Acute Regulatory Protein in Wistar Rats. Drug and Chemical Toxicology 2016; 39(4): 424-31.
34- Naghizadeh H, Salehikia A. Effect of One Course Exercise with Consumption Vitamin E on Antioxidant Status and Cardiovascular Risk Factors. Zahedan J Res in Medical Sci 2010;12(1): e94350.
35- Kim M, Eo H, Lim JG, Lim H, Lim Y. Can Low-Dose of Dietary Vitamin E Supplementation Reduce Exercise-Induced Muscle Damage and Oxidative Stress? A Meta-Analysis of Randomized Controlled Trials. Nutrients 2022; 14(8): 1599.
36- Alghadir AH, Gabr SA, Iqbal ZA, Al-Eisa E. Association of Physical Activity, Vitamin E Levels, and Total Antioxidant Capacity with Academic Performance and Executive Functions of Adolescents. BMC pediatrics 2019; 19: 1-8.
37- Zhang M, An C, Gao Y, Leak RK, Chen J, Zhang F. Emerging roles of Nrf2 and phase II antioxidant enzymes in neuroprotection. Progress in neurobiology 2013; 100: 30-47.
38- Tahmasebi K, Jafari M, Ahmadi A. Evaluation of oxidative stress biomarkers in rat heart exposed to diazinon and vitamns E and C. Quarterly of the Horizon of Medical Sciences 2015; 21(1): 13-9.
39- Hakimeh Z, Sadat SS, Pour AR, Tavirani MR. Epidemiology and etiology of Alzheimer's disease. Koomesh 2015;16(2); 119-27.[persian]
40- Fillenbaum GG, Kuchibhatla MN, Hanlon JT, Artz MB, Pieper CF, Schmader KE, et al. Dementia and Alzheimer's disease in community-dwelling elders taking vitamin C and/or vitamin E. Annals of Pharmacotherapy 2005; 39(12): 2009-14.
نوع مطالعه: پژوهشي |
موضوع مقاله:
بیوشیمی
دریافت: 1402/10/18 | پذیرش: 1402/12/27 | انتشار: 1403/3/15
دریافت: 1402/10/18 | پذیرش: 1402/12/27 | انتشار: 1403/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







