دوره 32، شماره 3 - ( خرداد 1403 )
جلد 32 شماره 3 صفحات 7659-7645 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Owlia F, Heidari M M, Khatami M, Ziaei E, Broomand M A. Studying the Pathogenic Effect of New Nucleotide Changes in the Promoter Region of the TERT Gene in Patients with Glioblastoma Brain Tumor. JSSU 2024; 32 (3) :7645-7659
URL: http://jssu.ssu.ac.ir/article-1-6151-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6151-fa.html
اولیا فرزانه، حیدری محمد مهدی، خاتمی مهری، ضیایی احسان، برومند محمدعلی. مطالعه اثر پاتوژنسیتی تغییرات نوکلئوتیدی جدید در ناحیه پروموتری ژن TERT در بیماران مبتلا به تومور مغزی از نوع گلیوبلاستوما. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (3) :7645-7659
متن کامل [PDF 1124 kb]
(438 دریافت)
| چکیده (HTML) (1405 مشاهده)
متن کامل: (711 مشاهده)
مقدمه
تومور مغزی، تودهای از سلولها (نئوپلاسم: Neoplasm) با رشد غیرطبیعی است (1). تومورهای مغزی میتوانند سرطانی (بدخیم: Malignant) یا غیرسرطانی (خوشخیم: Benign) باشند. توموهای مغزی به دو گروه اولیه (از سلولهای بافت مغز منشاء میگیرند.) و ثانویه (منشاءگرفته از سایر ارگانها مانند ریه و سینه) تقسیمبندی میشوند (2,3). علایم تومور مغزی، شامل علائم عصبی فوکال (مربوط به یک بخش خاص در مغز) یا ژنرالیزه (مربوط به کل بافت مغز) میباشد. علائم عصبی فوکال، مانند فلج عضلانی ضعیف در یک سمت بدن و یا از دستدادن قدرت تکلم است که بستگی زیادی به محل تومور درون جمجمه دارد. علائم ژنرالیزه، شامل تشنج (80-50 درصد) و سردرد (بیش از 30 درصد) میباشند. در ۱۵% موارد، بهعلت افزایش فشار درون جمجمه، علائمی ازجمله استفراغ و تهوع نیز مشاهده میشود (2,4). تومورهای مغزی اولیه، دو درصد از کل سرطانهای جهان را با نرخ شیوع سالیانه ۲۲ در هر ۱۰۰ هزار نفر تشکیل میدهند. نرخ شیوع با بالارفتن سن، افزایش مییابد و در افراد بالای ۸۵ سال به بالاترین میزان خود میرسد. شیوع تومورهای مغزی اولیه، با فاکتورهایی چون سن، جنسیت و نژاد تغییر میکند. تومورهای مغزی بدخیم، مانند گلیوماها بیشتر در مردان رخ میدهد، اگرچه بهطور کلی، تومورهای مغزی (بهخصوص مننژیوماها و تومورهای غده هیپوفیز) بیشتر زنان را درگیر میکنند (5, 2). براساس یک تخمین آماری، بر اثر ابتلا به تومورهای مغزی بدخیم از نوع گلیوبلاستوما، در جهان بیش از 100 هزار نفر در سال میمیرند (6 , 2-4). از پرتوهای یونیزهکننده به عنوان تنها ریسک فاکتور محیطی این نوع تومور میتوان نام برد. تحقیقات اپیدمیولوژیک گسترده نشان میدهند که ابتلا به بیماریهای آلرژیک، مانند آسم، نیز خطر ابتلا به انواع مختلف سرطان دستگاه عصبی مرکزی، از جمله گلیوما را افزایش میدهد (7). استفاده از تلفنهای همراه، رنگ مو، ضربه به سر و رژیمهای غذایی، حاوی N-nitro-soures بهعنوان عواملی که موجب افزایش خطر ابتلا به تومورهای مغزی میشوند معرفی شدند، اما این دادهها هنوز اثبات شده و قانعکننده نیستند (10-2,4,8). گلیوماها معمولترین تومورهای مغزی اولیه هستند که در بیماران و در سنین مختلف، از لحاظ جایگاه تومور، ویژگیهای بافتشناسی، تغییرات ژنتیکی، و پاسخ به درمان، بسیار متنوع میباشند (11). تاکنون 25 جایگاه ژنی پرخطر برای گلیوماها و چندین جهش ارثی نادر در برخی خانوادهها که ممکن است منجر به ایجاد تومور مغزی گلیوما شود، مشخص شدهاست (9,12). در سالهای اخیر نیز مطالعات بر روی موارد گلیوماها، منجر به کشف تغییرات مولکولی متعددی در این تومورها شدهاست. از بین این تغییرات مولکولی، جهشهای نوکلئوتیدی در ناحیه پروموتری ژن TERT (Telomerase Reverse Transcriptase)که نتیجه آنها، افزایش فعالیت تلومراز است، به عنوان عوامل خطر کاندید در بیش از 80 درصد از گلیوبلاستوماها مطرح است. تلومرها کمپلکسهای نوکلئوپروتئینی هستند که در انتهای کروموزومها قرار دارند و برای یکپارچگی کروموزومها موردنیاز هستند. این جهشها تاکنون، در بدخیمترین گلیوماها (گلیوبلاستوما) و همچنین گلیوماهای خوشخیم (الیگودندروگلیوما) گزارش شدهاند. این مشاهدات موجب میشود تا بقاء تلومر به عنوان یک رخداد اساسی و اولیه در ایجاد تومورهای مغزی مورد توجه قرار گیرد (13). تلومرها در هر چرخهسلولی کوتاه میشوند و در نهایت منجر به مرگ یا پیری سلول میگردند. سلولهای سرطانی، مانند همه سلولهایی که فعالانه رشد میکنند و نامیرا هستند، باید توانایی حفظ تلومر خود را دارا باشند. تلومراز مسئول ترمیم تلومرها برای حفظ طول آنها و جلوگیری از مرگ سلولی است. افزایش طول تلومر برای دستیابی به تکثیر بینهایت سلولهای سرطانی لازم است. بنابراین، فعالیت تلومراز بهعنوان یک مکانیسم بالقوه برای رشد سرطان مورد بررسی قرار گرفته است. گلیوبلاستومای مولتیفرم (Glioblastoma multiform: GBM)، شایعترین و بدخیمترین نوع تومور اولیه مغز است که حدود 17 درصد از تومورهای درونجمجمهای را شامل میشود. بیش از 67% از بیماران بزرگسالی که به این نوع تومور مبتلا میشوند، حداکثر تا دوسال پس از تشخیص، زنده میمانند که این میزان، پایینترین نرخ رشد بقای بیماران، در بین تومورهای مغزی بدخیم، محسوب میشود (15, 14). با وجود اینکه هنوز مکانیسم دقیق فعالشدن ژن TERT در سلولهای سرطانی و غیرفعالشدن آن در حین تمایز، کاملاً مشخص نیست، پژوهشهای اخیر نشان دادند که جهشها در پروموتر این ژن و همچنین بازآراییهای کروموزومی، در فعالشدن تلومراز سلولها نقش دارند. این نتایج منجر به تحقیقات جدیدی بر روی روشهای درمانی، مبتنی بر هدف قراردادن فعالیت تلومراز شده است (16). ژن TERT از 40 هزار جفتباز تشکیل شده و دارای 16 اگزون و 15 اینترون میباشد. این ژن بر روی بازوی کوتاه کروموزوم شماره 5 (5p15.33) واقع است و تقریباً 1/2 مگاباز دورتر از تلومر کروموزوم قرار دارد (18, 17). هسته پروموتر ژن TERT از 37 جفتباز پاییندست نقطه شروع رونویسی ژن تا 330 جفتباز بالادست آن گسترده است. ناحیه پروموتر این ژن، همانند ژنهای خانهدار، غنی از GC و فاقد TATA box و CAAT box میباشد. این پروموتر دارای موتیفها و جایگاههای متعددی جهت اتصال انواع فاکتورهای رونویسی، از جمله انکوژن c-Myc (E-box) و فاکتورهای فعالکننده رونویسی EST و MECP2 و همچنین فاکتور مهاری SP1 (GC box) میباشد. پروموتر ژن TERT در سلولهای تمایزیافته، خاموش و غیرمتیله است. طی تحقیقات اخیر، دو جهش نقطهای پرتکرار در انواع سرطانها، بر روی هستهی پروموتر TERT یافت شده است. بهطور دقیقتر، جهشها در دو نقطه داغ (Hotspot)، واقع در 124- جفت باز و 146- جفت باز بالادست محل شروع ترجمه TERT رخ میدهند: (C228T) 5p15.33: 1,295,228 C > T و (C250T) 1,295,250 C > T. ثابت شده است که این جهشها تغییراتی هستند که منجر به تنظیم مثبت بیان TERT مورد نیاز برای فعالسازی تلومراز میشوند. هدف از پژوهش حاضر نیز شناسایی و بررسی جهشهای ناحیه هسته پروموتر ژن TERT در بیماران ایرانی مبتلا به تومور مغزی بدخیم ، از نوع گلیوبلاستوما و همچنین ارزیابی بیوانفورماتیکی اثرات جهشهای این ناحیه از ژن است.
روش بررسی
در این مطالعه که به روش مورد - شاهدی انجام گرفته است، تعداد 35 نمونه خون از افراد مبتلا به تومور مغزی (گلیوبلاستومای مولتیفرم) از بیمارستانهای شهید رهنمون یزد، بیمارستان دکتر مرتاض یزد و مرکز پرتودرمانی شهید رمضانزاده یزد جمعآوری شد. پس از تکمیل پرسشنامه و اخذ رضایتنامه از همه شرکتکنندگان در تحقیق، 5 میلیلیتر خون، از افراد مبتلا به تومور مغزی گرفته شد و به لولههای استریل 150 میلیلیتری، حاوی 200 میکرولیتر EDTA، منتقل شد و تا زمان آزمایشات بعدی، در دمای 20- درجه سانتیگراد نگهداری گردید. براساس تشخیص پزشکان متخصص و مشاوران ژنتیک، 35 بیمار، شامل 24 مرد (در محدوده سنی 24 تا 63 سال، میانگین سن در زمان تشخیص 43/6) و 11 زن (در محدوده سنی 35 تا 50 سال، میانگین سن در زمان تشخیص 40/8) جهت مطالعه جهشهای ناحیه هسته پروموتر ژن TERT انتخاب شدند و مورد بررسی قرار گرفتند. همچنین، یک گروه 40 نفره غیرخویشاوند با بیماران، به عنوان نمونههای کنترل و سالم استفاده شدند که سابقه خانوادگی شناختهشدهای از هیچ نوع سرطانی نداشتند و از همان منطقه جغرافیایی بیماران انتخاب شدند. افراد کنترل از نظر سن و جنسیت با گروه بیماران، اختلاف آماری مهم و معناداری نداشتند (25 تا 60 سال: 0/008=P و 21 مرد و 19 زن: 0/01=P). در مطالعه حاضر، تمام متغیرهای انتخاب گروههای بیمار و کنترل، بهخوبی توزیع شده بودند، بنابراین از نظر یک تحلیل آماری، معتبر و قابل قبول در نظر گرفته شدند. استخراج DNA با استفاده از کیت استخراج DNA pure، طی روش استاندارد انجام شد. پس از استخراج DNA جهت تکثیر ناحیه ژنی موردنظر، از تکنیک Touchdown PCR استفاده شد. در PCR معمولی و استاندارد، از یک دمای اتصال ثابت، برای تکثیر توالی استفاده میشود، اما در تکنیک Touchdown PCR، برای انتخاب بهترین درجه حرارت اتصال پرایمرها به توالی هدف و جهت جلوگیری از اتصال غیراختصاصی پرایمرها، ابتدا در سیکلهای اولیه، درجهحرارت اتصال، بالا انتخاب میشود و در سیکلهای بعدی، درجهحرارت اتصال، بهتدریج کاهش مییابد. برای انجام واکنش، ابتدا با استفاده از نرمافزار Gene Runner یک جفت پرایمر طراحی شد و سپس با استفاده از نرمافزار Oligo Analyzer خصوصیات هر پرایمر و اتصالات احتمالی پرایمرها با یکدیگر، بررسی و سپس توسط شرکت پیشگام ساخته شد. با استفاده از برنامه BLAST (http://www.ncbi.nlm.nih.gov/blast) توالی پرایمرها از نظر همولوژی با کل ژنوم انسان همردیف شدند. طول قطعه نهایی سنترشده توسط این پرایمرها 262 جفت باز محاسبه شد (جدول 1).
برای انجام روش Touchdown PCR، واکنش PCR در حجم نهایی 20 میکرولیتری، شامل 10 میکرولیتر مخلوط بهینه PCR (Master Mix-Amplicon-Pishgam) بود که شامل Buffer 1X، 200 میکرولیتر از هر یک از dNTPها، 1/5-1 واحد آنزیم Taq DNA polymerase، 1 تا 4 میلیمولار MgCl2، به همراه 2 میکرولیتر از هر پرایمر Forward و Reverse با غلظت 25/0 میکرومولار، 2/5 میکرولیتر DNA الگو و 5/5 میکرولیتر آب دیونیزه استریل، آماده شد و با کمک دستگاه PCR (شرکت یکتا تجهیز آزما) واکنش تکثیر DNA انجام گرفت. برنامه زمانی و دمایی واکنش Touchdown PCR به اینصورت انجام گرفت: دناتوراسیون اولیه در دمای 95 درجه سانتیگراد به مدت 5 دقیقه و به دنبال آن 30 سیکل دمایی، متشکل از دمای دناتوراسیون 95 درجه سانتیگراد به مدت 30 ثانیه، دمای اتصال از درجه حرارت 53 تا 68 درجه سانتیگراد (به صورت کاهشی 0/5 درجه سانتیگراد به ازای هر سیکل) به مدت 1 دقیقه، مرحله گسترش به مدت 30 ثانیه در درجه حرارت 72 درجه سانتیگراد و مرحله گسترش نهایی به مدت 5 دقیقه در درجه حرارت 72 درجه سانتیگراد صورت گرفت. در نهایت برای اطمینان از تکثیر قطعه مورد نظر، 5 میکرولیتر از محصول PCR روی ژل آگاروز 1/5 درصد حاوی اتیدیوم بروماید، بارگذاری و الکتروفورز شد. ژل آگارز به مدت 30 دقیقه و با ولتاژ 100 ولت الکتروفورز گردید و پس از آن با استفاده از دستگاه Gel Doc نمونهها مشاهده شد و تصویربرداری از آنها صورت گرفت. پس از تایید صحت فرآیند PCR، نمونهها جهت تعیینتوالی مستقیم به شرکتهای پیشگام و نورژن (تهران) ارسال شدند.
جدول 1: پرایمرهای طراحیشده برای تکثیر ناحیه پروموتر ژن TERT
آنالیزهای بیوانفورماتیک: در این پژوهش، جهت بررسی و تحلیل نتایج و پیشبینی اثر تغییرات نوکلئوتیدی، بر جایگاه اتصال فاکتورهای رونویسی به پروموتر و عملکرد آنها، از برنامهی MEGAX (جهت آنالیز فیلوژنتیکی توالیهای DNA و پروتئینی) و پایگاه دادههای NCBI (جهت یافتن توالی پروموتر ژن به فرمت FASTA و یافتن پلیمورفیسمهای ناحیه موردنظر)، Swiss Regulon Portal (برای تفسیر و بررسی جایگاههای تنطیمی در ژنوم)، PROMO (جهت شناسایی فاکتورهای رونویسی متصلشونده به توالی پروموتر)، UCSC (جهت بررسی توالی ناحیه پروموتری)، ePOSSUM2 (برای پیشبینی اثر جهشها بر روی نقاط اتصال فاکتورهای رونویسی)، Regulationspotter (جهت بررسی و تفسیر جهشهای خارج از ناحیه کدکننده ژن)،Softberry (جهت شناسایی موتیفها و نقاط اتصال فاکتورهای رونویسی)، AliBaba2.1 (برای یافتن نقاط اتصال فاکتورهای رونویسی احتمالی)، miRDB (جهت پیشبینی نقاط احتمالی اتصال microRNAها) و EMBOSS Cpgplot (برای تشخیص تغییرات در نواحی غنی از GC پروموتر ژن TERT) استفاده شد.
تجزیه و تحلیل آماری
در این مطالعه برای آنالیزهای آماری و تعیین ارتباط یا تفاوت معنادار تغییرات نوکلئوتیدی با تومور گلیوبلاستوما، در دو گروه کنترل و بیمار، از آزمون آماری فیشر (Fisher’s exact) و تست SPSS version 16 برای Windows استفاده شد. محاسبات با استفاده از نرمافزار GraphPad انجام شد و سطح معنیداری کمتر از 0/05 (P<0.05) از نظر آماری مهم در نظر گرفته شد.
نتایج
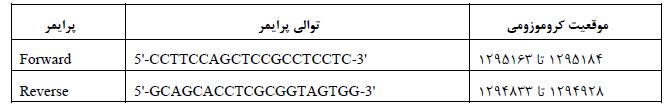
بر اساس پایگاه داده NCBI، ژن TERT در موقعیت کروموزومی 5p15.33 قرار دارد و دارای 16 اگزون میباشد. پروتئین این ژن دارای دو ایزوفرم است. بهعلاوه، طبق جدیدترین رکورد توالی (NG_009265.1)، موقعیت کروموزومی ژن TERT از 1253148 تا 1295068 و بر روی رشته معکوس (Minus Strand) میباشد. با بررسی صفحه GenBank این ژن، مشخص شد که ژن دارای 41881 جفت باز است. در این مطالعه، با بررسی نتایج تعیین توالی و کروماتوگرام 35 نمونه بیمار و 40 مورد شاهد، با استفاده از نرمافزار MEGAX و برنامه کروماس (chromas)، 3 جهش و تغییر نوکلئوتیدی (2 جهش جدید و 1 جهش بهعنوان Hotspot) مشاهده شد. نتایج حاصل از این بررسیها به شرح زیر است: جهش c.*143G>C: g.1295247G>C: مقایسه کروماتوگرام نمونه نرمال با نمونه مرد بیماری 51 ساله، نشاندهنده یک جایگزینی تک نوکلئوتیدی، بهصورت هتروزیگوت، در موقعیت 143 جفت باز بالادست ژن میباشد که سیتوزین جایگزین گوانین شدهاست. این تغییر نوکلئوتیدی جدید است و تاکنون گزارش نشده است (شکل 2 و 1).
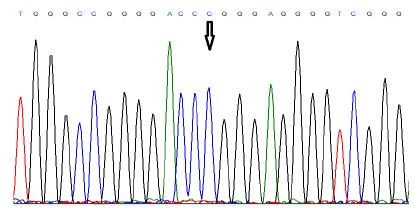
جهش c.*144C>G: g.1295248C>G: مقایسه کروماتوگرام نمونه نرمال با نمونه مرد بیماری 46 ساله، نشاندهنده یک جایگزینی هتروزیگوت در موقعیت 144 جفتباز بالادست ژن میباشد که گوانین جایگزین سیتونین شدهاست. همچنین این جهش در سه بیمار دیگر (2 مرد و 1 زن) مشاهده شد. این تغییر نوکلئوتیدی نیز جدید است و تاکنون گزارش نشده است (شکل 4 و 3).
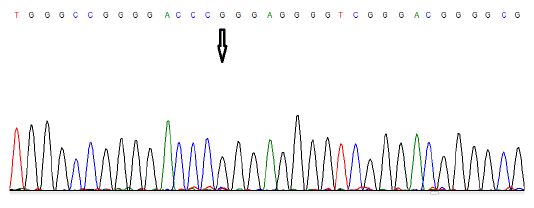
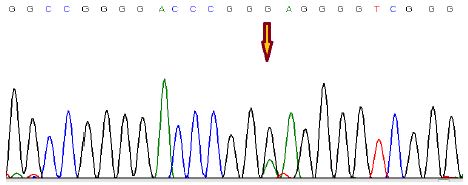
جهش c.*146C>T :g.1295250C>T: مقایسه کروماتوگرام نمونه نرمال با نمونه مرد بیماری 44 ساله، نشاندهنده یک جایگزینی هتروزیگوت در موقعیت 146 جفتباز بالادست ژن میباشد که تیمین جایگزین آدنین شدهاست. همچنین این جهش در ده بیمار مرد دیگر و یک بیمار زن (51 ساله) نیز مشاهده شد. این تغییر نوکلئوتیدی به عنوان یک جهش نقطهای داغ، در انواع سرطانها گزارش شده است و ارتباط آن با افزایش بیان ژن TERT تایید شده است (شکل6 و 5).
نتایج بررسیهای بیوانفورماتیکی: از پایگاه داده UCSC به منظور بهدستآوردن اطلاعات کلی، از نقاط اتصال فاکتورهای رونویسی، Cpg Islands و نقاط برش توسط DNAase (که نشانگر میزان فشردگی کروماتین در ناحیه پروموتر ژن میباشد) استفاده گردید. پس از واردکردن توالی پروموتر در قسمت BLAT، میتوان توالی را بهصورت گرافیکی و نموداری مشاهده کرد. سپس با انتخاب گزینههای مدنظر جهت بررسی پروموتر که در قسمت Regulatory قابل انتخاب هستند، ناحیه پروموتر ژن مورد بررسی قرارگرفت (شکل 7).
شکل 1: تصویر کروماتوگرام حاصل از تعیین توالی نمونه فرد نرمال (از رشته ریورس) که نشان میدهد، در موقعیت 143- نوکلئوتید G قرار دارد.

شکل 2: تصویر کروماتوگرام حاصل از تعیین توالی نمونه بیمار که جایگزینی هتروزیگوت G>C را در موقعیت 143- نشان میدهد.
شکل 3: تصویر کروماتوگرام حاصل از تعیین توالی نمونه فرد نرمال (از روی ریورس) که نشان میدهد، در موقعیت 144- نوکلئوتید C قرار دارد.

شکل 4: تصویر کروماتوگرام حاصل از تعیین توالی نمونه بیمار که جایگزینی هتروزیگوت C>G را در موقعیت 144- نشان میدهد.
شکل 5: تصویر کروماتوگرام حاصل از تعیین توالی نمونه فرد نرمال (از رشته ریورس) که نشان میدهد، در موقعیت 146- نوکلئوتید C قرار دارد.
کل 6: تصویر کروماتوگرام حاصل از تعیین توالی بیمارکه جایگزینی تک نوکلئوتیدی C>T را در موقعیت 146- نشان میدهد.

شکل 7: نتایج بهدستآمده از پایگاهداده UCSC در فرمت فشرده، اطلاعات کلی ناحیه پروموتر ژن TERTرا نشان میدهد.
:Swiss Regulon Portal این پایگاه داده به منظور بررسی نقاط اتصال فاکتورهای رونویسی در توالی 262 جفتبازی موردنظر استفاده شد. براساس نتایج این سایت، فاکتور رونویسی MECP2 (با 0.778442 Score=) به ناحیهای از پروموتر ژن متصل میشود (1295240-1295155) که هر سه جهش یافت شده، در آن ناحیه واقع هستند، بنابراین، وقوع این تغییرات نوکلئوتیدی، احتمالا باعث اختلال در اتصال این فاکتور رونویسی میگردد.
PROMO: این پایگاه داده، بهمنظور بررسی و مقایسه نقاط اتصال احتمالی فاکتورهای رونویسی در نمونه نرمال و جهشیافته مورد استفاده قرار گرفت. طبق نتایج، پیشبینی شد که فاکتورهای رونویسی متصلشونده به پروموتر، در ناحیه 140- تا 150- (محدوده جهشهای مشاهدهشده در این مطالعه)، در حالت نرمال (غیرموتانت)، شامل فاکتورهای رونویسیGR-alpha, Pax-5, p53 و Sp1و در حالت موتانت، تنها Pax-5 و GR-alpha هستند و بنابراین، وقوع جهشهای گزارششده، اتصال دو فاکتور دیگر را به ناحیه پروموتری ژن مختل میکنند.
ePOSSUM2: از این پایگاهداده، بهمنظور بررسی جداگانه هر 3 جهش شناساییشده از لحاظ اتصال فاکتورهای رونویسی استفاده شد. این سایت، امکان انتخاب بین فاکتورهای رونویسی که امکان اتصال به محل توالی را دارند را به کاربر میدهد. در این پژوهش، گزینه فاکتورهای شناختهشده برای این ناحیه پروموتری، انتخاب شد. نتایج پیشبینیهای این سایت نشان داد که برای هر سه جهش مشاهده شده، کاهش میزان اتصال فاکتورهای رونویسی، مانند MECP2 (از 72/8% برای جهش c.*143G>C تا 96/4% برای دو جهش دیگر) تایید میشود.
RegulationSpotter: پس از واردکردن هر جهش بهصورت جداگانه، این پایگاهداده پیشبینیهایی در رابطه با تغییرات ایجادشده در پروموتر ژن ارائه میدهد. پیشبینی این سایت برای سه جهش یافت شده در پژوهش، با عبارت Functional Region (Much Evidenc) مشخص شده است. این عبارت بهاین معناست که جهشهای موردنظر در جایگاه تنطیمی ژن واقع شده و طبق بررسیهای آماری سایت، با احتمال بالایی موجب تغییر در بیان ژن میشوند، اما برای اثبات این مهم، به شواهد بیشتری نیاز است.
Softberry: در این پایگاهداده نیز با واردکردن اطلاعات مرتبط با توالی نرمال و جهشیافته، به بررسی تغییرات در نواحی اتصال فاکتورهای رونویسی پرداختهشد. این سایت برای توالی نرمال، سه جایگاه اتصال برای فاکتورهای رونویسی HIF-1، ETS2 و SP1/SP3 و برای توالیهای موتانت، تنها فاکتور فعالکننده رونویسی ETS2 را پیشبینی کرده است. این بدان معنا است که جایگاه اتصال سایر فاکتورهای رونویسی، با وقوع جهشها، تخریب شده است.
Alibaba2.1: با واردکردن اطلاعات مربوط به توالی نرمال و جهشیافته موردنظر بهصورت جداگانه، این سایت نواحی اتصال فاکتورهای رونویسی در توالی نرمال و توالیهای موتانت را پیشبینی کرد. طبق نتایج این نرمافزار، با بررسی توالی 131- تا 158- ناحیه پروموتری ژن، در حالت نرمال، اتصال فاکتورهای رونویسی SP1، ETF، EGR-1، NF-1 و USF تایید شد، ولی در حالت موتانت و بروز جهشهای مشاهدهشده، تنها اتصال فاکتورهای رونویسی EGR-1 و NF-1پیشبینی شد، بدین ترتیب، این نرمافزار، اتصال فاکتورهای رونویسی دیگر را در حالتهای موتانت تایید نکرد.
:mirdb از این پایگاهداده، جهت بررسی جایگاههای اتصال microRNAهای احتمالی در ناحیه 5'-UTR ژن و ناحیه پروموتری موردنظر استفادهشد. در این سایت، ابتدا توالی نرمال و سپس توالی حاوی جهشهای مشاهدهشده در این پژوهش، وارد و مورد بررسی قرار گرفتند. طبق نتایج ما، احتمال اتصال یک miRNA (has-mir-6887-3p) به توالی موردنظر پروموتری وجود دارد که با واردکردن سه توالی جهش یافته، بهصورت جداگانه، پیشبینی شد که این miRNA با وقوع این جهشها، دیگر به این ناحیه متصل نخواهدشد.
بحث
تکثیر بیحد و حصر سلولهای سرطانی، یکی از ویژگیهای اساسی رشد سرطان است. تلومرها که انتهای هر کروموزوم را تشکیل میدهند، توالیهای DNA تکراری هستند که انتهای کروموزومها را از تشخیص شکستگی دورشتهای DNA محافظت میکنند و بنابراین توسط سیستم پاسخ آسیب DNA از بین میروند (19). تلومرها در هر چرخه کوتاه میشوند و در نهایت منجر به مرگ سلولی می شوند. توصیف تغییرات ژنومی در سرطانهای انسان، منجر به کشف طیف وسیعی از ژنهای جهش یافته شده است که به پیشرفت تومور کمک میکنند (20). Nonoguchi و همکاران، جهشهای ناحیه پروموتری ژن TERT را با توالییابی مستقیم DNA در جمعیتی مشتمل بر 358 نمونه گلیوبلاستوما بررسی کردند و جهشهای پروموتری ژنTERT (C228T, C250T) را در 55 درصد گلیوبلاستوماهای آنالیز شده شناسایی کردند. از این نمونه بیمار، 73 درصد دارای جهش C228T و 27 درصد دارای جهش C250T بودند. تنها یک بیمار گلیوبلاستوما دارای هر دو جهش C228T و C250T بود. آنها به این نتیجه رسیدند که در 55% از کل نمونهها، جهش در مناطق غنی از GC پروموتر ژن TERT مشاهده میشود. همچنین آنها به این نکته دستیافتند که جهش در پروموتر ژن TERT بهوضوح در گلیوبلاستوماهای اولیه، فراوانتر از گلیوبلاستوماهای ثانویه است (21). Simonو همکارانش نیز با آزمایش بر روی بیماران مبتلا به گلیوبلاستومای مولتیفرم، جهشهای ناحیه هسته پروموتر TERT را از طریق تعیین توالی بررسی کردند و جهشهای پروموتری-124C>T و -146C>T را در 80/3% گلیوبلاستوماهای اولیه و 28/6% موارد ثانویه شناسایی کردند (P < 0.001) آنها دریافتند که حضور جهشهای TERT با بقا و طول عمر کوتاهتری در بیماران همراه است. تاثیر پیشآگهی جهشهای TERT در بیماران، منجر به انتخاب صحیح روشهای درمانی توسط متخصصین بالینی میشود. بهنظر میرسد وقوع جهشهای TERT، تومورهایی را مشخص میکنند که نیاز به درمان تهاجمیتری در بیماران دارند (22). Mosrati و همکاران، 128 بیمار گلیوبلاستومای اولیه را از نظر پلیمورفیسمهای تک نوکلئوتیدی در ناحیه کدینگ ژن TERT و 92 مورد را برای جهشهای ناحیه پروموتری TERT مورد بررسی قرار دادند. جهشهای ناحیه پروموتر TERT در 86 درصد بیماران مشاهده شد و از این میان، C228T(124- جفت باز بالادست کدون شروع) در 75 درصد بیماران و C250T (146- جفت باز) در 25 درصد موارد مشاهده شد. جهشهای پروموتر TERT با بقای کوتاهتر زندگی در بیماران همراه بود (23). Arita و همکاران، منشأ سوماتیک جهشهای TERT را با تعیین توالی نمونههای توموری گلیوبلاستوما و DNA نرمال از گلبولهای سفیدخون محیطی تأیید کردند. آنها نشان دادند که جهش در مناطق غنی از GC ناحیه پروموتری ژن TERT، منجر به ایجاد محلهای اتصال فاکتورهای رونویسی میشود که موجب فعالشدن مجدد تلومراز در سلولهای توموری میگردد (24). همچنین، سطح بیان TERT در تومورهایی که حامل جهش ناحیه پروموتری ژن بودند، بهطور متوسط 6 برابر بیشتر از تومورهایی بدون این جهشها بود، که نشان میدهد پروموتر جهشیافته، منجر به تنظیم مثبت ژن TERT میشود. بهطور کلی، به نظر میرسد حفظ طول تلومر از طریق فعالیت تلومراز، ناشی از جهشهای ناحیه پروموتری ژن TERT، یک رویداد مهم در گلیوماژنز باشد (25). در مطالعهای دیگری نیز بر روی بیماران گلیومای بالغ که اکثر آنها گلیوبلاستوما بودند، Killela جهشهای ناحیه پروموتری ژن TERT را مورد مطالعه قرار داد و دریافت که این جهشها، میزان بقای کمتری را برای بیماران گلیوبلاستوماها پیشبینی میکند (26). اما برای تعیین اینکه آیا ژنوم سلولهای توموری گلیوبلاستوما در بیماران ایرانی نیز دارای جهشهای نوکلئوتیدی در خارج از مناطق کدکننده پروتئین هستند، ما در این مطالعه، جهشهای سوماتیک غیرکدکننده در ناحیه پروموتری ژن TERT را با استفاده از نتایج توالییابی ناحیه پروموتری ژن TERT بررسی کردیم. این پژوهش بر روی 35 نمونه خون از بیماران مبتلا به تومور مغزی از نوع گلیوبلاستومای مولتیفرم و 40 نمونه شاهد انجام شد. 68/57 درصد از بیماران را مردان و 31/42 درصد آنان را زنان تشکیل دادند. میانگین سنی بیماران در این تحقیق 41 سال بود. تجزیه و تحلیل دادههای توالییابی این ژن، از بیماران با گلیوبلاستومای مولتیفرم، سه جهش در پروموتر این ژن را در 28 مورد از 35 مورد (80%) بیماران تحتمطالعه نشان داد. دو تا از این جهشها جدید هستند (c.*143G>C و c.*144C>G) و تاکنون در هیچ تحقیقی گزارش نشدهاند ولی یکی از آنها (c.*146C>T) قبلا به عنوان یک جهش شایع و بیماریزا در چندین سرطان گزارش شده است. هیچکدام از این جهشهای هتروزیگوت، در نتیجه توالییابی سانگر از افراد کنترل و سالم موردمطالعه مشاهده نشدند. هر یک از این جهشهای پروموتری منجر به جابجایی نوکلئوتیدهای گوانین و سیتیدین در موتیفهای دینوکلئوتیدی CG و یا GG شدند که نشاندهنده آسیب به توالیهای ناحیه CpG پروموتر ژن TERT هستند. هر سه جهش، دقیقاً در نقاط داغ ژن، در ناحیه 140 تا 150 جفت بازی (bp) بالادست جایگاه شروع رونویسی ژن TERT واقع شدند.(شکل 8)
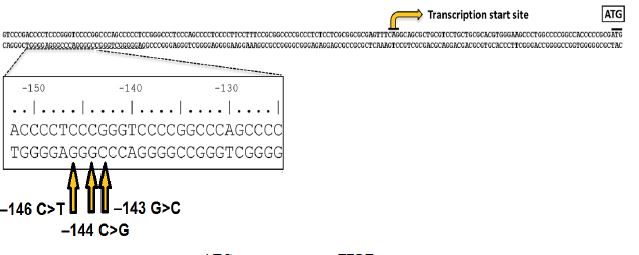
شکل 8: موقعیت جهشهای مشاهده شده در ناحیه پروموتری ژن TERT. کدون شروع ترجمه (ATG) و جایگاه شروع رونویسی با فلش نشان داده شده است.
نتایج پایگاه داده UCSC و Regulation Spotter از ناحیه پروموتر ژن نیز نشان داد که در توالی موردنظر ما، یک ناحیه غنی از CG (جزیره CpG) قرار دارد که طول این ناحیه کمتر از ۳۰۰ جفت باز است و هر سه جهش این مطالعه، در این ناحیه رخ میدهند، همچنین پیشبینی شد که ناحیه مورد بررسی، حاوی توالیهای حساس به آنزیم است که این خاصیت معمولاً در پروموتر ژنها وجود دارد. علاوه براین، در این ناحیه، متیلاسیون و استیلاسیون هیستونها نیز پیشبینی شد که میتواند به بازشدن ساختار کروماتین و در دسترس قرارگرفتن ناحیه پروموتری ژن، برای فاکتورهای رونویسی موثر باشد. بنابراین وقوع جهشها در این ناحیه، میتوانند بر میزان اتصال فاکتورهای رونویسی، بسیار مهم و اثرگذار باشند. نتایج پایگاههای اینترنتی نشان داد که هر سه جهش (c.*146C>T، c.*144C>G و c.*143G>C) در یک توالی نوکلئوتیدی 12 جفتبازی قرار دارند که حاوی یک محل اتصال توافقی برای فاکتور رونویسی MECP2 در ناحیه پروموتر ژن TERT است (CCCCTGGGCCCT-3ʹ-5ʹ). از آنجا که این فاکتور رونویسی، نقش مهارکنندگی در مسیر سیگنالینگ پروتئین کیناز فعالشده با میتوژن (MAP کیناز) در سلول نرمال را دارد، بنابراین فرض میشود که این جهشهای پروموتری در سلولهای توموری مغز، منجر به عدم اتصال این فاکتور رونویسی و در نتیجه افزایش فعالیت رونویسی از پروموتر ژن TERT در مسیر تومورزایی شوند (16). همچنین، پیشبینی شد که فاکتورهای رونویسی متصلشونده به ناحیه پروموتر ژن، در ناحیه 140- تا 150- (محدوده جهشهای مشاهدهشده)، در حالت نرمال (غیرموتانت)، شامل فاکتورهای رونویسی GR-alpha, Pax-5, p53 و Sp1و در حالت موتانت، تنها Pax-5 و GR-alpha هستند، فاکتورهای رونویسی Pax-5 و GR-alpha، نقش فعالکننده رونویسی و سایر فاکتورها، نقش مهارکننده رونویسی این ژن را دارند و بنابراین، پیشبینی میشود، وقوع جهشهای گزارششده، اتصال فاکتورهای مهاری را به ناحیه پروموتری ژن مختل میکنند تا رونویسی از ژن TERT در سلولهای توموری افزایش یابد. پایگاه داده Softberry نیز برای توالی نرمال، سه جایگاه اتصال برای فاکتورهای رونویسی HIF-1، ETS2 و SP1/SP3 و برای توالیهای موتانت، تنها اتصال فاکتور رونویسی ETS2 (یک فعالکننده رونویسی) را پیشبینی کرد. این بدان معنا است که از اتصال فاکتورهای رونویسی مهاری، با وقوع جهشها، جلوگیری میشود که در راستای اهداف تومورزایی سلول است. برای بررسی اینکه آیا جهشهای ناحیه پروموتر TERT در سایر انواع سرطانها نیز رخ میدهد یا خیر، ما نتایج تحقیقات گذشته را درمورد چندین سرطان بررسی کردیم. مطالعات متعددی وقوع جهشهای ناحیه پروموتر TERT را در طیف وسیعی از انواع سرطان نشان میدهند. همگی آنها از این فرضیه حمایت میکنند که این جهشهای پروموتری، ممکن است بهعنوان رویدادهای محرکی عمل کنند که از طریق اختلال در تنظیم TERT، به فعالیت انکوژنی آن در روند تومورزایی کمک میکنند و حداقل در گلیوبلاستومای مولتیفرم انسان، تحت انتخاب مثبت قرار میگیرند. Vallarelli و همکارانش تایید کردند که جهشهای سوماتیک منحصربهفردی همچون C>T در پروموتر TERT در موقعیتهای 124- (1295228) و 146- (1295250) جفت باز، منجر به ایجاد یک موتیف اتصال جدیدی برای فاکتور فعالکننده رونویسی ETS میگردند و با افزایش بیان TERT در سلولهای توموری همراه هستند. با اینحال، اگرچه نقش تلومراز در تومورزایی بهخوبی مشخص شده است، اما جزئیات مربوط به اختلال در تنظیم آن در سلولهای سرطانی، بهویژه در گلیوبلاستوما کاملاً شناختهشده نیست. جهشهای پروموتری TERT شناساییشده در این مطالعه، ممکن است به تنظیم بیان ژن تلومراز و فعالسازی روند تومورزایی در این بدخیمی مرتبط باشند. بهویژه، شیوع بالای جهش -146C>T در بیماران گلیوبلاستوما، نشان میدهد که این جهش در ناحیه پروموتری TERT ممکن است جزو رویدادهای ژنتیکی اولیه در پیدایش این تومور مغزی و یا سایر انواع سرطان ها باشد. Huang و همکارانش، با مطالعه بر روی پروموتر ژن TERT در بیماران چینی مبتلا به انواع سرطآنها، دریافتند که جهشها در ناحیه پروموتر ژن TERT اغلب در گلیوبلاستوما (83/9%)، الیگودندروگلیوما (70%)، سرطان مجاری ادراری (Urinary tract cancers) (4/64%)، کارسینومای سلولهای کبدی (31/4%) و مدولوبلاستوما (33/3%) رخ میدهد (27). اگرچه افزایش بیان TERT بهتنهایی، برای دورزدن روند پیری، ناشی از فعالیت انکوژنی تلومراز کافی نیست، ولی فعالشدن بیش از حد TERT ژنومی، ممکن است مکانیسمهایی را تقویت کند که توسط آن، سلولهای توموری همراه با جهشهای انکوژنی دیگر، خاصیت نامیرایی پیدا کنند (28). بنابراین چنین نتایجی پیشنهاد میکند که برای درمان موثرتر بیماران سرطانی، تلاشها باید بیشتر معطوف به ایجاد مهارکنندههای موثر بالینی آنزیم تلومراز باشد. Juratli و همکارانش با تحقیق بر روی تومورهای مغزی از نوع مننژیومای بدخیم و مقاوم به درمانهای رایج، به این نتیجه رسیدند که جهشها در ناحیه پروموتر ژن TERT در عود مجدد سرطان و مقاومت به شیمیدرمانی این نوع تومورها دخیل است (29). در عینحال، جهشهای پروموتری، احتمالاً یک مکانیسم بالقوه برای فعالسازی ژن TERT در طیف متنوعی از سرطآنهای انسانی است.
نتیجهگیری
مکانیسمهای حفظ تلومر در طول تکثیر DNA در سلولهای توموری گلیوبلاستوما بسیار مهم هستند. جهشهای ناحیه پروموتر ژن TERT مهمترین تغییرات نوکلئوتیدی در گلیوبلاستوما هستند که نقش محوری در تومورزایی آن دارند. بنابراین، شناسایی جهشهای ناحیه پروموتر ژن TERT ضروری است که در حالحاضر در کنار روشهای تشخیصی گلیوبلاستوما، جهت انتخاب بهترین روش درمان هدفمند کاربرد دارد. در این پژوهش با مطالعه بر روی 35 نمونه خون از بیماران ایرانی مبتلا به تومور مغزی بدخیم، از نوع گلیوبلاستومای مولتیفرم، 3 جهش هتروزیگوت در ناحیه حساس و داغ، در هسته پروموتر ژن TERT شناسایی شد. اگرچه فعالسازی تلومراز در سلولهای توموری، نقش کلیدی در فرآیند نامیرایی آنها دارد، اما هنوز مکانیسم زیربنایی روند فعالسازی آن، در سرطانها مبهم باقی مانده است. با اینحال، کشف جهشهای تکرارپذیر، در پروموتر TERTیک مکانیسم احتمالی را برای افزایش بیان آنزیم تلومراز، در سلولهای سرطانی آشکار میکند. مطالعات عملکردی متعددی نیز نشان دادهاند که وجود جهشهای ناحیه پروموتر TERT ، منجر به جلوگیری از مهار رونویسی آن و آغاز روند تومورزایی میشود.
سپاسگزاری
نویسندگان مقاله از حمایتهای دانشگاه یزد در انجام این پایاننامه کارشناسیارشد تشکر و قدرانی میکنند. از بیمارستانهای شهید رهنمون یزد، بیمارستان دکتر مرتاض یزد و مرکز پرتودرمانی شهید رمضانزاده یزد که بیمـاران را جهـت ایـن مطالعـه ارجـاع دادهانـد تـشکر و قـدردانی مـیشـود. همچنین از همکاری ارزشمند تمام بیماران سپاسگزاریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این مطالعه توسط کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد مورد تایید قرار گرفت (IR.SSU.REC.1398.011) و تمامی رویهها مطابق با اعلامیه هلسینکی (Declaration of Helsinki 1975)، اصلاح شده در سال 2008 و استانداردهای اخلاقی انجام شد.
مشارکت نویسندگان
محمد مهدی حیدری در ارائه ایده، محمد مهدی حیدری و مهری خاتمی در طراحی مطالعه، فرزانه اولیا در جمعآوری دادهها، احسان ضیائی و محمدعلی برومند در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
تومور مغزی، تودهای از سلولها (نئوپلاسم: Neoplasm) با رشد غیرطبیعی است (1). تومورهای مغزی میتوانند سرطانی (بدخیم: Malignant) یا غیرسرطانی (خوشخیم: Benign) باشند. توموهای مغزی به دو گروه اولیه (از سلولهای بافت مغز منشاء میگیرند.) و ثانویه (منشاءگرفته از سایر ارگانها مانند ریه و سینه) تقسیمبندی میشوند (2,3). علایم تومور مغزی، شامل علائم عصبی فوکال (مربوط به یک بخش خاص در مغز) یا ژنرالیزه (مربوط به کل بافت مغز) میباشد. علائم عصبی فوکال، مانند فلج عضلانی ضعیف در یک سمت بدن و یا از دستدادن قدرت تکلم است که بستگی زیادی به محل تومور درون جمجمه دارد. علائم ژنرالیزه، شامل تشنج (80-50 درصد) و سردرد (بیش از 30 درصد) میباشند. در ۱۵% موارد، بهعلت افزایش فشار درون جمجمه، علائمی ازجمله استفراغ و تهوع نیز مشاهده میشود (2,4). تومورهای مغزی اولیه، دو درصد از کل سرطانهای جهان را با نرخ شیوع سالیانه ۲۲ در هر ۱۰۰ هزار نفر تشکیل میدهند. نرخ شیوع با بالارفتن سن، افزایش مییابد و در افراد بالای ۸۵ سال به بالاترین میزان خود میرسد. شیوع تومورهای مغزی اولیه، با فاکتورهایی چون سن، جنسیت و نژاد تغییر میکند. تومورهای مغزی بدخیم، مانند گلیوماها بیشتر در مردان رخ میدهد، اگرچه بهطور کلی، تومورهای مغزی (بهخصوص مننژیوماها و تومورهای غده هیپوفیز) بیشتر زنان را درگیر میکنند (5, 2). براساس یک تخمین آماری، بر اثر ابتلا به تومورهای مغزی بدخیم از نوع گلیوبلاستوما، در جهان بیش از 100 هزار نفر در سال میمیرند (6 , 2-4). از پرتوهای یونیزهکننده به عنوان تنها ریسک فاکتور محیطی این نوع تومور میتوان نام برد. تحقیقات اپیدمیولوژیک گسترده نشان میدهند که ابتلا به بیماریهای آلرژیک، مانند آسم، نیز خطر ابتلا به انواع مختلف سرطان دستگاه عصبی مرکزی، از جمله گلیوما را افزایش میدهد (7). استفاده از تلفنهای همراه، رنگ مو، ضربه به سر و رژیمهای غذایی، حاوی N-nitro-soures بهعنوان عواملی که موجب افزایش خطر ابتلا به تومورهای مغزی میشوند معرفی شدند، اما این دادهها هنوز اثبات شده و قانعکننده نیستند (10-2,4,8). گلیوماها معمولترین تومورهای مغزی اولیه هستند که در بیماران و در سنین مختلف، از لحاظ جایگاه تومور، ویژگیهای بافتشناسی، تغییرات ژنتیکی، و پاسخ به درمان، بسیار متنوع میباشند (11). تاکنون 25 جایگاه ژنی پرخطر برای گلیوماها و چندین جهش ارثی نادر در برخی خانوادهها که ممکن است منجر به ایجاد تومور مغزی گلیوما شود، مشخص شدهاست (9,12). در سالهای اخیر نیز مطالعات بر روی موارد گلیوماها، منجر به کشف تغییرات مولکولی متعددی در این تومورها شدهاست. از بین این تغییرات مولکولی، جهشهای نوکلئوتیدی در ناحیه پروموتری ژن TERT (Telomerase Reverse Transcriptase)که نتیجه آنها، افزایش فعالیت تلومراز است، به عنوان عوامل خطر کاندید در بیش از 80 درصد از گلیوبلاستوماها مطرح است. تلومرها کمپلکسهای نوکلئوپروتئینی هستند که در انتهای کروموزومها قرار دارند و برای یکپارچگی کروموزومها موردنیاز هستند. این جهشها تاکنون، در بدخیمترین گلیوماها (گلیوبلاستوما) و همچنین گلیوماهای خوشخیم (الیگودندروگلیوما) گزارش شدهاند. این مشاهدات موجب میشود تا بقاء تلومر به عنوان یک رخداد اساسی و اولیه در ایجاد تومورهای مغزی مورد توجه قرار گیرد (13). تلومرها در هر چرخهسلولی کوتاه میشوند و در نهایت منجر به مرگ یا پیری سلول میگردند. سلولهای سرطانی، مانند همه سلولهایی که فعالانه رشد میکنند و نامیرا هستند، باید توانایی حفظ تلومر خود را دارا باشند. تلومراز مسئول ترمیم تلومرها برای حفظ طول آنها و جلوگیری از مرگ سلولی است. افزایش طول تلومر برای دستیابی به تکثیر بینهایت سلولهای سرطانی لازم است. بنابراین، فعالیت تلومراز بهعنوان یک مکانیسم بالقوه برای رشد سرطان مورد بررسی قرار گرفته است. گلیوبلاستومای مولتیفرم (Glioblastoma multiform: GBM)، شایعترین و بدخیمترین نوع تومور اولیه مغز است که حدود 17 درصد از تومورهای درونجمجمهای را شامل میشود. بیش از 67% از بیماران بزرگسالی که به این نوع تومور مبتلا میشوند، حداکثر تا دوسال پس از تشخیص، زنده میمانند که این میزان، پایینترین نرخ رشد بقای بیماران، در بین تومورهای مغزی بدخیم، محسوب میشود (15, 14). با وجود اینکه هنوز مکانیسم دقیق فعالشدن ژن TERT در سلولهای سرطانی و غیرفعالشدن آن در حین تمایز، کاملاً مشخص نیست، پژوهشهای اخیر نشان دادند که جهشها در پروموتر این ژن و همچنین بازآراییهای کروموزومی، در فعالشدن تلومراز سلولها نقش دارند. این نتایج منجر به تحقیقات جدیدی بر روی روشهای درمانی، مبتنی بر هدف قراردادن فعالیت تلومراز شده است (16). ژن TERT از 40 هزار جفتباز تشکیل شده و دارای 16 اگزون و 15 اینترون میباشد. این ژن بر روی بازوی کوتاه کروموزوم شماره 5 (5p15.33) واقع است و تقریباً 1/2 مگاباز دورتر از تلومر کروموزوم قرار دارد (18, 17). هسته پروموتر ژن TERT از 37 جفتباز پاییندست نقطه شروع رونویسی ژن تا 330 جفتباز بالادست آن گسترده است. ناحیه پروموتر این ژن، همانند ژنهای خانهدار، غنی از GC و فاقد TATA box و CAAT box میباشد. این پروموتر دارای موتیفها و جایگاههای متعددی جهت اتصال انواع فاکتورهای رونویسی، از جمله انکوژن c-Myc (E-box) و فاکتورهای فعالکننده رونویسی EST و MECP2 و همچنین فاکتور مهاری SP1 (GC box) میباشد. پروموتر ژن TERT در سلولهای تمایزیافته، خاموش و غیرمتیله است. طی تحقیقات اخیر، دو جهش نقطهای پرتکرار در انواع سرطانها، بر روی هستهی پروموتر TERT یافت شده است. بهطور دقیقتر، جهشها در دو نقطه داغ (Hotspot)، واقع در 124- جفت باز و 146- جفت باز بالادست محل شروع ترجمه TERT رخ میدهند: (C228T) 5p15.33: 1,295,228 C > T و (C250T) 1,295,250 C > T. ثابت شده است که این جهشها تغییراتی هستند که منجر به تنظیم مثبت بیان TERT مورد نیاز برای فعالسازی تلومراز میشوند. هدف از پژوهش حاضر نیز شناسایی و بررسی جهشهای ناحیه هسته پروموتر ژن TERT در بیماران ایرانی مبتلا به تومور مغزی بدخیم ، از نوع گلیوبلاستوما و همچنین ارزیابی بیوانفورماتیکی اثرات جهشهای این ناحیه از ژن است.
روش بررسی
در این مطالعه که به روش مورد - شاهدی انجام گرفته است، تعداد 35 نمونه خون از افراد مبتلا به تومور مغزی (گلیوبلاستومای مولتیفرم) از بیمارستانهای شهید رهنمون یزد، بیمارستان دکتر مرتاض یزد و مرکز پرتودرمانی شهید رمضانزاده یزد جمعآوری شد. پس از تکمیل پرسشنامه و اخذ رضایتنامه از همه شرکتکنندگان در تحقیق، 5 میلیلیتر خون، از افراد مبتلا به تومور مغزی گرفته شد و به لولههای استریل 150 میلیلیتری، حاوی 200 میکرولیتر EDTA، منتقل شد و تا زمان آزمایشات بعدی، در دمای 20- درجه سانتیگراد نگهداری گردید. براساس تشخیص پزشکان متخصص و مشاوران ژنتیک، 35 بیمار، شامل 24 مرد (در محدوده سنی 24 تا 63 سال، میانگین سن در زمان تشخیص 43/6) و 11 زن (در محدوده سنی 35 تا 50 سال، میانگین سن در زمان تشخیص 40/8) جهت مطالعه جهشهای ناحیه هسته پروموتر ژن TERT انتخاب شدند و مورد بررسی قرار گرفتند. همچنین، یک گروه 40 نفره غیرخویشاوند با بیماران، به عنوان نمونههای کنترل و سالم استفاده شدند که سابقه خانوادگی شناختهشدهای از هیچ نوع سرطانی نداشتند و از همان منطقه جغرافیایی بیماران انتخاب شدند. افراد کنترل از نظر سن و جنسیت با گروه بیماران، اختلاف آماری مهم و معناداری نداشتند (25 تا 60 سال: 0/008=P و 21 مرد و 19 زن: 0/01=P). در مطالعه حاضر، تمام متغیرهای انتخاب گروههای بیمار و کنترل، بهخوبی توزیع شده بودند، بنابراین از نظر یک تحلیل آماری، معتبر و قابل قبول در نظر گرفته شدند. استخراج DNA با استفاده از کیت استخراج DNA pure، طی روش استاندارد انجام شد. پس از استخراج DNA جهت تکثیر ناحیه ژنی موردنظر، از تکنیک Touchdown PCR استفاده شد. در PCR معمولی و استاندارد، از یک دمای اتصال ثابت، برای تکثیر توالی استفاده میشود، اما در تکنیک Touchdown PCR، برای انتخاب بهترین درجه حرارت اتصال پرایمرها به توالی هدف و جهت جلوگیری از اتصال غیراختصاصی پرایمرها، ابتدا در سیکلهای اولیه، درجهحرارت اتصال، بالا انتخاب میشود و در سیکلهای بعدی، درجهحرارت اتصال، بهتدریج کاهش مییابد. برای انجام واکنش، ابتدا با استفاده از نرمافزار Gene Runner یک جفت پرایمر طراحی شد و سپس با استفاده از نرمافزار Oligo Analyzer خصوصیات هر پرایمر و اتصالات احتمالی پرایمرها با یکدیگر، بررسی و سپس توسط شرکت پیشگام ساخته شد. با استفاده از برنامه BLAST (http://www.ncbi.nlm.nih.gov/blast) توالی پرایمرها از نظر همولوژی با کل ژنوم انسان همردیف شدند. طول قطعه نهایی سنترشده توسط این پرایمرها 262 جفت باز محاسبه شد (جدول 1).
برای انجام روش Touchdown PCR، واکنش PCR در حجم نهایی 20 میکرولیتری، شامل 10 میکرولیتر مخلوط بهینه PCR (Master Mix-Amplicon-Pishgam) بود که شامل Buffer 1X، 200 میکرولیتر از هر یک از dNTPها، 1/5-1 واحد آنزیم Taq DNA polymerase، 1 تا 4 میلیمولار MgCl2، به همراه 2 میکرولیتر از هر پرایمر Forward و Reverse با غلظت 25/0 میکرومولار، 2/5 میکرولیتر DNA الگو و 5/5 میکرولیتر آب دیونیزه استریل، آماده شد و با کمک دستگاه PCR (شرکت یکتا تجهیز آزما) واکنش تکثیر DNA انجام گرفت. برنامه زمانی و دمایی واکنش Touchdown PCR به اینصورت انجام گرفت: دناتوراسیون اولیه در دمای 95 درجه سانتیگراد به مدت 5 دقیقه و به دنبال آن 30 سیکل دمایی، متشکل از دمای دناتوراسیون 95 درجه سانتیگراد به مدت 30 ثانیه، دمای اتصال از درجه حرارت 53 تا 68 درجه سانتیگراد (به صورت کاهشی 0/5 درجه سانتیگراد به ازای هر سیکل) به مدت 1 دقیقه، مرحله گسترش به مدت 30 ثانیه در درجه حرارت 72 درجه سانتیگراد و مرحله گسترش نهایی به مدت 5 دقیقه در درجه حرارت 72 درجه سانتیگراد صورت گرفت. در نهایت برای اطمینان از تکثیر قطعه مورد نظر، 5 میکرولیتر از محصول PCR روی ژل آگاروز 1/5 درصد حاوی اتیدیوم بروماید، بارگذاری و الکتروفورز شد. ژل آگارز به مدت 30 دقیقه و با ولتاژ 100 ولت الکتروفورز گردید و پس از آن با استفاده از دستگاه Gel Doc نمونهها مشاهده شد و تصویربرداری از آنها صورت گرفت. پس از تایید صحت فرآیند PCR، نمونهها جهت تعیینتوالی مستقیم به شرکتهای پیشگام و نورژن (تهران) ارسال شدند.
جدول 1: پرایمرهای طراحیشده برای تکثیر ناحیه پروموتر ژن TERT

آنالیزهای بیوانفورماتیک: در این پژوهش، جهت بررسی و تحلیل نتایج و پیشبینی اثر تغییرات نوکلئوتیدی، بر جایگاه اتصال فاکتورهای رونویسی به پروموتر و عملکرد آنها، از برنامهی MEGAX (جهت آنالیز فیلوژنتیکی توالیهای DNA و پروتئینی) و پایگاه دادههای NCBI (جهت یافتن توالی پروموتر ژن به فرمت FASTA و یافتن پلیمورفیسمهای ناحیه موردنظر)، Swiss Regulon Portal (برای تفسیر و بررسی جایگاههای تنطیمی در ژنوم)، PROMO (جهت شناسایی فاکتورهای رونویسی متصلشونده به توالی پروموتر)، UCSC (جهت بررسی توالی ناحیه پروموتری)، ePOSSUM2 (برای پیشبینی اثر جهشها بر روی نقاط اتصال فاکتورهای رونویسی)، Regulationspotter (جهت بررسی و تفسیر جهشهای خارج از ناحیه کدکننده ژن)،Softberry (جهت شناسایی موتیفها و نقاط اتصال فاکتورهای رونویسی)، AliBaba2.1 (برای یافتن نقاط اتصال فاکتورهای رونویسی احتمالی)، miRDB (جهت پیشبینی نقاط احتمالی اتصال microRNAها) و EMBOSS Cpgplot (برای تشخیص تغییرات در نواحی غنی از GC پروموتر ژن TERT) استفاده شد.
تجزیه و تحلیل آماری
در این مطالعه برای آنالیزهای آماری و تعیین ارتباط یا تفاوت معنادار تغییرات نوکلئوتیدی با تومور گلیوبلاستوما، در دو گروه کنترل و بیمار، از آزمون آماری فیشر (Fisher’s exact) و تست SPSS version 16 برای Windows استفاده شد. محاسبات با استفاده از نرمافزار GraphPad انجام شد و سطح معنیداری کمتر از 0/05 (P<0.05) از نظر آماری مهم در نظر گرفته شد.
نتایج
بر اساس پایگاه داده NCBI، ژن TERT در موقعیت کروموزومی 5p15.33 قرار دارد و دارای 16 اگزون میباشد. پروتئین این ژن دارای دو ایزوفرم است. بهعلاوه، طبق جدیدترین رکورد توالی (NG_009265.1)، موقعیت کروموزومی ژن TERT از 1253148 تا 1295068 و بر روی رشته معکوس (Minus Strand) میباشد. با بررسی صفحه GenBank این ژن، مشخص شد که ژن دارای 41881 جفت باز است. در این مطالعه، با بررسی نتایج تعیین توالی و کروماتوگرام 35 نمونه بیمار و 40 مورد شاهد، با استفاده از نرمافزار MEGAX و برنامه کروماس (chromas)، 3 جهش و تغییر نوکلئوتیدی (2 جهش جدید و 1 جهش بهعنوان Hotspot) مشاهده شد. نتایج حاصل از این بررسیها به شرح زیر است: جهش c.*143G>C: g.1295247G>C: مقایسه کروماتوگرام نمونه نرمال با نمونه مرد بیماری 51 ساله، نشاندهنده یک جایگزینی تک نوکلئوتیدی، بهصورت هتروزیگوت، در موقعیت 143 جفت باز بالادست ژن میباشد که سیتوزین جایگزین گوانین شدهاست. این تغییر نوکلئوتیدی جدید است و تاکنون گزارش نشده است (شکل 2 و 1).
جهش c.*144C>G: g.1295248C>G: مقایسه کروماتوگرام نمونه نرمال با نمونه مرد بیماری 46 ساله، نشاندهنده یک جایگزینی هتروزیگوت در موقعیت 144 جفتباز بالادست ژن میباشد که گوانین جایگزین سیتونین شدهاست. همچنین این جهش در سه بیمار دیگر (2 مرد و 1 زن) مشاهده شد. این تغییر نوکلئوتیدی نیز جدید است و تاکنون گزارش نشده است (شکل 4 و 3).
جهش c.*146C>T :g.1295250C>T: مقایسه کروماتوگرام نمونه نرمال با نمونه مرد بیماری 44 ساله، نشاندهنده یک جایگزینی هتروزیگوت در موقعیت 146 جفتباز بالادست ژن میباشد که تیمین جایگزین آدنین شدهاست. همچنین این جهش در ده بیمار مرد دیگر و یک بیمار زن (51 ساله) نیز مشاهده شد. این تغییر نوکلئوتیدی به عنوان یک جهش نقطهای داغ، در انواع سرطانها گزارش شده است و ارتباط آن با افزایش بیان ژن TERT تایید شده است (شکل6 و 5).
نتایج بررسیهای بیوانفورماتیکی: از پایگاه داده UCSC به منظور بهدستآوردن اطلاعات کلی، از نقاط اتصال فاکتورهای رونویسی، Cpg Islands و نقاط برش توسط DNAase (که نشانگر میزان فشردگی کروماتین در ناحیه پروموتر ژن میباشد) استفاده گردید. پس از واردکردن توالی پروموتر در قسمت BLAT، میتوان توالی را بهصورت گرافیکی و نموداری مشاهده کرد. سپس با انتخاب گزینههای مدنظر جهت بررسی پروموتر که در قسمت Regulatory قابل انتخاب هستند، ناحیه پروموتر ژن مورد بررسی قرارگرفت (شکل 7).

شکل 1: تصویر کروماتوگرام حاصل از تعیین توالی نمونه فرد نرمال (از رشته ریورس) که نشان میدهد، در موقعیت 143- نوکلئوتید G قرار دارد.

شکل 2: تصویر کروماتوگرام حاصل از تعیین توالی نمونه بیمار که جایگزینی هتروزیگوت G>C را در موقعیت 143- نشان میدهد.

شکل 3: تصویر کروماتوگرام حاصل از تعیین توالی نمونه فرد نرمال (از روی ریورس) که نشان میدهد، در موقعیت 144- نوکلئوتید C قرار دارد.

شکل 4: تصویر کروماتوگرام حاصل از تعیین توالی نمونه بیمار که جایگزینی هتروزیگوت C>G را در موقعیت 144- نشان میدهد.

شکل 5: تصویر کروماتوگرام حاصل از تعیین توالی نمونه فرد نرمال (از رشته ریورس) که نشان میدهد، در موقعیت 146- نوکلئوتید C قرار دارد.

کل 6: تصویر کروماتوگرام حاصل از تعیین توالی بیمارکه جایگزینی تک نوکلئوتیدی C>T را در موقعیت 146- نشان میدهد.

شکل 7: نتایج بهدستآمده از پایگاهداده UCSC در فرمت فشرده، اطلاعات کلی ناحیه پروموتر ژن TERTرا نشان میدهد.
:Swiss Regulon Portal این پایگاه داده به منظور بررسی نقاط اتصال فاکتورهای رونویسی در توالی 262 جفتبازی موردنظر استفاده شد. براساس نتایج این سایت، فاکتور رونویسی MECP2 (با 0.778442 Score=) به ناحیهای از پروموتر ژن متصل میشود (1295240-1295155) که هر سه جهش یافت شده، در آن ناحیه واقع هستند، بنابراین، وقوع این تغییرات نوکلئوتیدی، احتمالا باعث اختلال در اتصال این فاکتور رونویسی میگردد.
PROMO: این پایگاه داده، بهمنظور بررسی و مقایسه نقاط اتصال احتمالی فاکتورهای رونویسی در نمونه نرمال و جهشیافته مورد استفاده قرار گرفت. طبق نتایج، پیشبینی شد که فاکتورهای رونویسی متصلشونده به پروموتر، در ناحیه 140- تا 150- (محدوده جهشهای مشاهدهشده در این مطالعه)، در حالت نرمال (غیرموتانت)، شامل فاکتورهای رونویسیGR-alpha, Pax-5, p53 و Sp1و در حالت موتانت، تنها Pax-5 و GR-alpha هستند و بنابراین، وقوع جهشهای گزارششده، اتصال دو فاکتور دیگر را به ناحیه پروموتری ژن مختل میکنند.
ePOSSUM2: از این پایگاهداده، بهمنظور بررسی جداگانه هر 3 جهش شناساییشده از لحاظ اتصال فاکتورهای رونویسی استفاده شد. این سایت، امکان انتخاب بین فاکتورهای رونویسی که امکان اتصال به محل توالی را دارند را به کاربر میدهد. در این پژوهش، گزینه فاکتورهای شناختهشده برای این ناحیه پروموتری، انتخاب شد. نتایج پیشبینیهای این سایت نشان داد که برای هر سه جهش مشاهده شده، کاهش میزان اتصال فاکتورهای رونویسی، مانند MECP2 (از 72/8% برای جهش c.*143G>C تا 96/4% برای دو جهش دیگر) تایید میشود.
RegulationSpotter: پس از واردکردن هر جهش بهصورت جداگانه، این پایگاهداده پیشبینیهایی در رابطه با تغییرات ایجادشده در پروموتر ژن ارائه میدهد. پیشبینی این سایت برای سه جهش یافت شده در پژوهش، با عبارت Functional Region (Much Evidenc) مشخص شده است. این عبارت بهاین معناست که جهشهای موردنظر در جایگاه تنطیمی ژن واقع شده و طبق بررسیهای آماری سایت، با احتمال بالایی موجب تغییر در بیان ژن میشوند، اما برای اثبات این مهم، به شواهد بیشتری نیاز است.
Softberry: در این پایگاهداده نیز با واردکردن اطلاعات مرتبط با توالی نرمال و جهشیافته، به بررسی تغییرات در نواحی اتصال فاکتورهای رونویسی پرداختهشد. این سایت برای توالی نرمال، سه جایگاه اتصال برای فاکتورهای رونویسی HIF-1، ETS2 و SP1/SP3 و برای توالیهای موتانت، تنها فاکتور فعالکننده رونویسی ETS2 را پیشبینی کرده است. این بدان معنا است که جایگاه اتصال سایر فاکتورهای رونویسی، با وقوع جهشها، تخریب شده است.
Alibaba2.1: با واردکردن اطلاعات مربوط به توالی نرمال و جهشیافته موردنظر بهصورت جداگانه، این سایت نواحی اتصال فاکتورهای رونویسی در توالی نرمال و توالیهای موتانت را پیشبینی کرد. طبق نتایج این نرمافزار، با بررسی توالی 131- تا 158- ناحیه پروموتری ژن، در حالت نرمال، اتصال فاکتورهای رونویسی SP1، ETF، EGR-1، NF-1 و USF تایید شد، ولی در حالت موتانت و بروز جهشهای مشاهدهشده، تنها اتصال فاکتورهای رونویسی EGR-1 و NF-1پیشبینی شد، بدین ترتیب، این نرمافزار، اتصال فاکتورهای رونویسی دیگر را در حالتهای موتانت تایید نکرد.
:mirdb از این پایگاهداده، جهت بررسی جایگاههای اتصال microRNAهای احتمالی در ناحیه 5'-UTR ژن و ناحیه پروموتری موردنظر استفادهشد. در این سایت، ابتدا توالی نرمال و سپس توالی حاوی جهشهای مشاهدهشده در این پژوهش، وارد و مورد بررسی قرار گرفتند. طبق نتایج ما، احتمال اتصال یک miRNA (has-mir-6887-3p) به توالی موردنظر پروموتری وجود دارد که با واردکردن سه توالی جهش یافته، بهصورت جداگانه، پیشبینی شد که این miRNA با وقوع این جهشها، دیگر به این ناحیه متصل نخواهدشد.
بحث
تکثیر بیحد و حصر سلولهای سرطانی، یکی از ویژگیهای اساسی رشد سرطان است. تلومرها که انتهای هر کروموزوم را تشکیل میدهند، توالیهای DNA تکراری هستند که انتهای کروموزومها را از تشخیص شکستگی دورشتهای DNA محافظت میکنند و بنابراین توسط سیستم پاسخ آسیب DNA از بین میروند (19). تلومرها در هر چرخه کوتاه میشوند و در نهایت منجر به مرگ سلولی می شوند. توصیف تغییرات ژنومی در سرطانهای انسان، منجر به کشف طیف وسیعی از ژنهای جهش یافته شده است که به پیشرفت تومور کمک میکنند (20). Nonoguchi و همکاران، جهشهای ناحیه پروموتری ژن TERT را با توالییابی مستقیم DNA در جمعیتی مشتمل بر 358 نمونه گلیوبلاستوما بررسی کردند و جهشهای پروموتری ژنTERT (C228T, C250T) را در 55 درصد گلیوبلاستوماهای آنالیز شده شناسایی کردند. از این نمونه بیمار، 73 درصد دارای جهش C228T و 27 درصد دارای جهش C250T بودند. تنها یک بیمار گلیوبلاستوما دارای هر دو جهش C228T و C250T بود. آنها به این نتیجه رسیدند که در 55% از کل نمونهها، جهش در مناطق غنی از GC پروموتر ژن TERT مشاهده میشود. همچنین آنها به این نکته دستیافتند که جهش در پروموتر ژن TERT بهوضوح در گلیوبلاستوماهای اولیه، فراوانتر از گلیوبلاستوماهای ثانویه است (21). Simonو همکارانش نیز با آزمایش بر روی بیماران مبتلا به گلیوبلاستومای مولتیفرم، جهشهای ناحیه هسته پروموتر TERT را از طریق تعیین توالی بررسی کردند و جهشهای پروموتری-124C>T و -146C>T را در 80/3% گلیوبلاستوماهای اولیه و 28/6% موارد ثانویه شناسایی کردند (P < 0.001) آنها دریافتند که حضور جهشهای TERT با بقا و طول عمر کوتاهتری در بیماران همراه است. تاثیر پیشآگهی جهشهای TERT در بیماران، منجر به انتخاب صحیح روشهای درمانی توسط متخصصین بالینی میشود. بهنظر میرسد وقوع جهشهای TERT، تومورهایی را مشخص میکنند که نیاز به درمان تهاجمیتری در بیماران دارند (22). Mosrati و همکاران، 128 بیمار گلیوبلاستومای اولیه را از نظر پلیمورفیسمهای تک نوکلئوتیدی در ناحیه کدینگ ژن TERT و 92 مورد را برای جهشهای ناحیه پروموتری TERT مورد بررسی قرار دادند. جهشهای ناحیه پروموتر TERT در 86 درصد بیماران مشاهده شد و از این میان، C228T(124- جفت باز بالادست کدون شروع) در 75 درصد بیماران و C250T (146- جفت باز) در 25 درصد موارد مشاهده شد. جهشهای پروموتر TERT با بقای کوتاهتر زندگی در بیماران همراه بود (23). Arita و همکاران، منشأ سوماتیک جهشهای TERT را با تعیین توالی نمونههای توموری گلیوبلاستوما و DNA نرمال از گلبولهای سفیدخون محیطی تأیید کردند. آنها نشان دادند که جهش در مناطق غنی از GC ناحیه پروموتری ژن TERT، منجر به ایجاد محلهای اتصال فاکتورهای رونویسی میشود که موجب فعالشدن مجدد تلومراز در سلولهای توموری میگردد (24). همچنین، سطح بیان TERT در تومورهایی که حامل جهش ناحیه پروموتری ژن بودند، بهطور متوسط 6 برابر بیشتر از تومورهایی بدون این جهشها بود، که نشان میدهد پروموتر جهشیافته، منجر به تنظیم مثبت ژن TERT میشود. بهطور کلی، به نظر میرسد حفظ طول تلومر از طریق فعالیت تلومراز، ناشی از جهشهای ناحیه پروموتری ژن TERT، یک رویداد مهم در گلیوماژنز باشد (25). در مطالعهای دیگری نیز بر روی بیماران گلیومای بالغ که اکثر آنها گلیوبلاستوما بودند، Killela جهشهای ناحیه پروموتری ژن TERT را مورد مطالعه قرار داد و دریافت که این جهشها، میزان بقای کمتری را برای بیماران گلیوبلاستوماها پیشبینی میکند (26). اما برای تعیین اینکه آیا ژنوم سلولهای توموری گلیوبلاستوما در بیماران ایرانی نیز دارای جهشهای نوکلئوتیدی در خارج از مناطق کدکننده پروتئین هستند، ما در این مطالعه، جهشهای سوماتیک غیرکدکننده در ناحیه پروموتری ژن TERT را با استفاده از نتایج توالییابی ناحیه پروموتری ژن TERT بررسی کردیم. این پژوهش بر روی 35 نمونه خون از بیماران مبتلا به تومور مغزی از نوع گلیوبلاستومای مولتیفرم و 40 نمونه شاهد انجام شد. 68/57 درصد از بیماران را مردان و 31/42 درصد آنان را زنان تشکیل دادند. میانگین سنی بیماران در این تحقیق 41 سال بود. تجزیه و تحلیل دادههای توالییابی این ژن، از بیماران با گلیوبلاستومای مولتیفرم، سه جهش در پروموتر این ژن را در 28 مورد از 35 مورد (80%) بیماران تحتمطالعه نشان داد. دو تا از این جهشها جدید هستند (c.*143G>C و c.*144C>G) و تاکنون در هیچ تحقیقی گزارش نشدهاند ولی یکی از آنها (c.*146C>T) قبلا به عنوان یک جهش شایع و بیماریزا در چندین سرطان گزارش شده است. هیچکدام از این جهشهای هتروزیگوت، در نتیجه توالییابی سانگر از افراد کنترل و سالم موردمطالعه مشاهده نشدند. هر یک از این جهشهای پروموتری منجر به جابجایی نوکلئوتیدهای گوانین و سیتیدین در موتیفهای دینوکلئوتیدی CG و یا GG شدند که نشاندهنده آسیب به توالیهای ناحیه CpG پروموتر ژن TERT هستند. هر سه جهش، دقیقاً در نقاط داغ ژن، در ناحیه 140 تا 150 جفت بازی (bp) بالادست جایگاه شروع رونویسی ژن TERT واقع شدند.(شکل 8)

شکل 8: موقعیت جهشهای مشاهده شده در ناحیه پروموتری ژن TERT. کدون شروع ترجمه (ATG) و جایگاه شروع رونویسی با فلش نشان داده شده است.
نتایج پایگاه داده UCSC و Regulation Spotter از ناحیه پروموتر ژن نیز نشان داد که در توالی موردنظر ما، یک ناحیه غنی از CG (جزیره CpG) قرار دارد که طول این ناحیه کمتر از ۳۰۰ جفت باز است و هر سه جهش این مطالعه، در این ناحیه رخ میدهند، همچنین پیشبینی شد که ناحیه مورد بررسی، حاوی توالیهای حساس به آنزیم است که این خاصیت معمولاً در پروموتر ژنها وجود دارد. علاوه براین، در این ناحیه، متیلاسیون و استیلاسیون هیستونها نیز پیشبینی شد که میتواند به بازشدن ساختار کروماتین و در دسترس قرارگرفتن ناحیه پروموتری ژن، برای فاکتورهای رونویسی موثر باشد. بنابراین وقوع جهشها در این ناحیه، میتوانند بر میزان اتصال فاکتورهای رونویسی، بسیار مهم و اثرگذار باشند. نتایج پایگاههای اینترنتی نشان داد که هر سه جهش (c.*146C>T، c.*144C>G و c.*143G>C) در یک توالی نوکلئوتیدی 12 جفتبازی قرار دارند که حاوی یک محل اتصال توافقی برای فاکتور رونویسی MECP2 در ناحیه پروموتر ژن TERT است (CCCCTGGGCCCT-3ʹ-5ʹ). از آنجا که این فاکتور رونویسی، نقش مهارکنندگی در مسیر سیگنالینگ پروتئین کیناز فعالشده با میتوژن (MAP کیناز) در سلول نرمال را دارد، بنابراین فرض میشود که این جهشهای پروموتری در سلولهای توموری مغز، منجر به عدم اتصال این فاکتور رونویسی و در نتیجه افزایش فعالیت رونویسی از پروموتر ژن TERT در مسیر تومورزایی شوند (16). همچنین، پیشبینی شد که فاکتورهای رونویسی متصلشونده به ناحیه پروموتر ژن، در ناحیه 140- تا 150- (محدوده جهشهای مشاهدهشده)، در حالت نرمال (غیرموتانت)، شامل فاکتورهای رونویسی GR-alpha, Pax-5, p53 و Sp1و در حالت موتانت، تنها Pax-5 و GR-alpha هستند، فاکتورهای رونویسی Pax-5 و GR-alpha، نقش فعالکننده رونویسی و سایر فاکتورها، نقش مهارکننده رونویسی این ژن را دارند و بنابراین، پیشبینی میشود، وقوع جهشهای گزارششده، اتصال فاکتورهای مهاری را به ناحیه پروموتری ژن مختل میکنند تا رونویسی از ژن TERT در سلولهای توموری افزایش یابد. پایگاه داده Softberry نیز برای توالی نرمال، سه جایگاه اتصال برای فاکتورهای رونویسی HIF-1، ETS2 و SP1/SP3 و برای توالیهای موتانت، تنها اتصال فاکتور رونویسی ETS2 (یک فعالکننده رونویسی) را پیشبینی کرد. این بدان معنا است که از اتصال فاکتورهای رونویسی مهاری، با وقوع جهشها، جلوگیری میشود که در راستای اهداف تومورزایی سلول است. برای بررسی اینکه آیا جهشهای ناحیه پروموتر TERT در سایر انواع سرطانها نیز رخ میدهد یا خیر، ما نتایج تحقیقات گذشته را درمورد چندین سرطان بررسی کردیم. مطالعات متعددی وقوع جهشهای ناحیه پروموتر TERT را در طیف وسیعی از انواع سرطان نشان میدهند. همگی آنها از این فرضیه حمایت میکنند که این جهشهای پروموتری، ممکن است بهعنوان رویدادهای محرکی عمل کنند که از طریق اختلال در تنظیم TERT، به فعالیت انکوژنی آن در روند تومورزایی کمک میکنند و حداقل در گلیوبلاستومای مولتیفرم انسان، تحت انتخاب مثبت قرار میگیرند. Vallarelli و همکارانش تایید کردند که جهشهای سوماتیک منحصربهفردی همچون C>T در پروموتر TERT در موقعیتهای 124- (1295228) و 146- (1295250) جفت باز، منجر به ایجاد یک موتیف اتصال جدیدی برای فاکتور فعالکننده رونویسی ETS میگردند و با افزایش بیان TERT در سلولهای توموری همراه هستند. با اینحال، اگرچه نقش تلومراز در تومورزایی بهخوبی مشخص شده است، اما جزئیات مربوط به اختلال در تنظیم آن در سلولهای سرطانی، بهویژه در گلیوبلاستوما کاملاً شناختهشده نیست. جهشهای پروموتری TERT شناساییشده در این مطالعه، ممکن است به تنظیم بیان ژن تلومراز و فعالسازی روند تومورزایی در این بدخیمی مرتبط باشند. بهویژه، شیوع بالای جهش -146C>T در بیماران گلیوبلاستوما، نشان میدهد که این جهش در ناحیه پروموتری TERT ممکن است جزو رویدادهای ژنتیکی اولیه در پیدایش این تومور مغزی و یا سایر انواع سرطان ها باشد. Huang و همکارانش، با مطالعه بر روی پروموتر ژن TERT در بیماران چینی مبتلا به انواع سرطآنها، دریافتند که جهشها در ناحیه پروموتر ژن TERT اغلب در گلیوبلاستوما (83/9%)، الیگودندروگلیوما (70%)، سرطان مجاری ادراری (Urinary tract cancers) (4/64%)، کارسینومای سلولهای کبدی (31/4%) و مدولوبلاستوما (33/3%) رخ میدهد (27). اگرچه افزایش بیان TERT بهتنهایی، برای دورزدن روند پیری، ناشی از فعالیت انکوژنی تلومراز کافی نیست، ولی فعالشدن بیش از حد TERT ژنومی، ممکن است مکانیسمهایی را تقویت کند که توسط آن، سلولهای توموری همراه با جهشهای انکوژنی دیگر، خاصیت نامیرایی پیدا کنند (28). بنابراین چنین نتایجی پیشنهاد میکند که برای درمان موثرتر بیماران سرطانی، تلاشها باید بیشتر معطوف به ایجاد مهارکنندههای موثر بالینی آنزیم تلومراز باشد. Juratli و همکارانش با تحقیق بر روی تومورهای مغزی از نوع مننژیومای بدخیم و مقاوم به درمانهای رایج، به این نتیجه رسیدند که جهشها در ناحیه پروموتر ژن TERT در عود مجدد سرطان و مقاومت به شیمیدرمانی این نوع تومورها دخیل است (29). در عینحال، جهشهای پروموتری، احتمالاً یک مکانیسم بالقوه برای فعالسازی ژن TERT در طیف متنوعی از سرطآنهای انسانی است.
نتیجهگیری
مکانیسمهای حفظ تلومر در طول تکثیر DNA در سلولهای توموری گلیوبلاستوما بسیار مهم هستند. جهشهای ناحیه پروموتر ژن TERT مهمترین تغییرات نوکلئوتیدی در گلیوبلاستوما هستند که نقش محوری در تومورزایی آن دارند. بنابراین، شناسایی جهشهای ناحیه پروموتر ژن TERT ضروری است که در حالحاضر در کنار روشهای تشخیصی گلیوبلاستوما، جهت انتخاب بهترین روش درمان هدفمند کاربرد دارد. در این پژوهش با مطالعه بر روی 35 نمونه خون از بیماران ایرانی مبتلا به تومور مغزی بدخیم، از نوع گلیوبلاستومای مولتیفرم، 3 جهش هتروزیگوت در ناحیه حساس و داغ، در هسته پروموتر ژن TERT شناسایی شد. اگرچه فعالسازی تلومراز در سلولهای توموری، نقش کلیدی در فرآیند نامیرایی آنها دارد، اما هنوز مکانیسم زیربنایی روند فعالسازی آن، در سرطانها مبهم باقی مانده است. با اینحال، کشف جهشهای تکرارپذیر، در پروموتر TERTیک مکانیسم احتمالی را برای افزایش بیان آنزیم تلومراز، در سلولهای سرطانی آشکار میکند. مطالعات عملکردی متعددی نیز نشان دادهاند که وجود جهشهای ناحیه پروموتر TERT ، منجر به جلوگیری از مهار رونویسی آن و آغاز روند تومورزایی میشود.
سپاسگزاری
نویسندگان مقاله از حمایتهای دانشگاه یزد در انجام این پایاننامه کارشناسیارشد تشکر و قدرانی میکنند. از بیمارستانهای شهید رهنمون یزد، بیمارستان دکتر مرتاض یزد و مرکز پرتودرمانی شهید رمضانزاده یزد که بیمـاران را جهـت ایـن مطالعـه ارجـاع دادهانـد تـشکر و قـدردانی مـیشـود. همچنین از همکاری ارزشمند تمام بیماران سپاسگزاریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این مطالعه توسط کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد مورد تایید قرار گرفت (IR.SSU.REC.1398.011) و تمامی رویهها مطابق با اعلامیه هلسینکی (Declaration of Helsinki 1975)، اصلاح شده در سال 2008 و استانداردهای اخلاقی انجام شد.
مشارکت نویسندگان
محمد مهدی حیدری در ارائه ایده، محمد مهدی حیدری و مهری خاتمی در طراحی مطالعه، فرزانه اولیا در جمعآوری دادهها، احسان ضیائی و محمدعلی برومند در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Schaff LR, Mellinghoff IK. Glioblastoma and Other Primary Brain Malignancies in Adults: A Review. JAMA 2023; 329(7): 574-87.
2- Lapointe S, Perry A, Butowski NAJTL. Primary brain tumours in adults. Seminar 2018; 392 (10145): 432-46.
3- Manoj L, Kalyani M, Jyothi K, Bhavani GG, Govardhani V, Srinivasan RJIJoP, et al. Review of Brain and Brain Cancer Treatment 2011; 2: 468-77.
4- DeAngelis LM. Brain Tumors. New England J medicine 2001; 344 (2): 114-23.
5- Lim L, Rosenthal M, Maartens N, Ryan GJImj. Management of Brain Metastases. Journal of neurology 2004; 34 (5): 270-8.
6- Wen PY, Loeffler JSJO. Management of Brain Metastases. 1999; 13 (7): :941-54.
7- Barnholtz-Sloan JS, Ostrom QT, Cote DJNc. Epidemiology of Brain Tumors. Neurologic clinics 2018; 36 (3): 395-419.
8- Sauvageot CM, Kesari S, Stiles CDJNc. Molecular Pathogenesis of Adult Brain Tumors and the Role of Stem Cells. Neurologic Clinics 2007; 25 (4): 891-924.
9- Louis DN, Perry A, Reifenberger G, Von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: A Summary. Acta Neuropathologica 2016; 131 (6): 803-20.
10- Huse JT, Holland ECJNrc. Targeting Brain Cancer: Advances in the Molecular Pathology of Malignant Glioma and Medulloblastoma. Nature reviews cancer 2010; 10(5): 319.
11- Vega JE, Brat DJ. Incorporating Advances In Molecular Pathology Into Brain Tumor Diagnostics. Advances in Anatomic Pathology 2018; 25(3): 143-71.
12- Molinaro AM, Taylor JW, Wiencke JK, Wrensch MR. Genetic and Molecular Epidemiology of Adult Diffuse Glioma. Nature Reviews Neurology 2019; 15(7): 405-17.
13- Eckel-Passow JE, Lachance DH, Molinaro AM, Walsh KM, Decker PA, Sicotte H, et al. Glioma groups based on 1p/19q, IDH, and TERT promoter mutations in tumors. New England J Medicine 2015; 372 (26): 2499-508.
14- Shergalis A, Bankhead A, Luesakul U, Muangsin N, Neamati NJPr. Current Challenges and Opportunities in Treating Glioblastoma. Pharmacological Reviews 2018; 70(3): 412-45.
15- Szopa W, Burley TA, Kramer-Marek G, Kaspera WJBri. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed research international 2017; 2017.
16- Ramlee MK, Wang J, Toh WX, Li SJG. Transcription Regulation of the Human Telomerase Reverse Transcriptase(Htert)Gene. Genes 2016; 7(8): 50.
17- Cong Y-S, Wen J, Bacchetti SJHmg. The Human Telomerase Catalytic Subunit Htert: Organization of the Gene and Characterization of the Promoter. Human Molecular Genetics 1999; 8(1): 137-42.
18- Jafri MA, Ansari SA, Alqahtani MH, Shay JW. Roles of Telomeres and Telomerase in Cancer, and Advances in Telomerase-Targeted Therapies. Genome Medicine 2016; 8(1): 69.
19- Sethi G. Telomerase and Hallmarks of Cancer: An Intricate Interplay Governing Cancer Cell Evolution. Cancer Letters 2023; 578: 216459.
20- Saretzki G. Role of Telomeres and Telomerase in Cancer and Aging. International Journal of Molecular Sciences 2023: 24(12): 9932.
21- Nonoguchi N, Ohta T, Oh JE, Kim YH, Kleihues P, Ohgaki H. TERT Promoter Mutations in Primary and Secondary Glioblastomas. Acta Neuropathologica 2013; 126: 931-7.
22- Simon M, Hosen I, Gousias K, Rachakonda S, Heidenreich B, Gessi M, et al. Tert Promoter Mutations: A Novel Independent Prognostic Factor in Primary Glioblastomas. Neuro-oncology 2015; 17(1): 45-52.
23- Mosrati MA, Malmström A, Lysiak M, Krysztofiak A, Hallbeck M, Milos P, et al. TERT Promoter Mutations and Polymorphisms as Prognostic Factors in Primary Glioblastoma. Oncotarget 2015; 6(18): 16663.
24- Arita H, Yamasaki K, Matsushita Y, Nakamura T, Shimokawa A, Takami H, et al. A Combination of Tert Promoter Mutation and Mgmt Methylation Status Predicts Clinically Relevant Subgroups of Newly Diagnosed Glioblastomas. Acta Neuropathologica Communications 2016; 4: 1-14.
25- Yuan Y, Qi C, Maling G, Xiang W, Yanhui L, Ruofei L, et al. TERT Mutation in Glioma: Frequency, Prognosis and Risk. Journal of Clinical Neuroscience 2016; 26: 57-62.
26- Killela PJ, Reitman ZJ, Jiao Y, Bettegowda C, Agrawal N, Diaz Jr LA, et al. TERT Promoter Mutations Occur Frequently in Gliomas and a Subset of Tumors Derived from Cells with Low Rates of Self-Renewal. Proceedings of the National Academy of Sciences 2013; 110(15): 6021-6.
27- Huang D-S, Wang Z, He X-J, Diplas BH, Yang R, Killela PJ, et al. Recurrent TERT Promoter Mutations Identified in a Large-Scale Study of Multiple Tumour Types are Associated with Increased TERT Expression and Telomerase Activation. European J Cancer 2015; 51 (8): 969-76.
28- Arita H, Ichimura K. Prognostic Significance of TERT Promoter Mutations in Adult-Type Diffuse Gliomas. Brain Tumor Pathology 2022; 39(3): 121-9.
29- Juratli TA, Thiede C, Krex D, Brastianos PK, Wakimoto H, Schackert G, et al. TERT Promoter Mutations in Progressive Treatment-Resistant Meningiomas. American Society of Clinical Oncology 2017; 64(CN_suppl_1): 236-7.
1- Schaff LR, Mellinghoff IK. Glioblastoma and Other Primary Brain Malignancies in Adults: A Review. JAMA 2023; 329(7): 574-87.
2- Lapointe S, Perry A, Butowski NAJTL. Primary brain tumours in adults. Seminar 2018; 392 (10145): 432-46.
3- Manoj L, Kalyani M, Jyothi K, Bhavani GG, Govardhani V, Srinivasan RJIJoP, et al. Review of Brain and Brain Cancer Treatment 2011; 2: 468-77.
4- DeAngelis LM. Brain Tumors. New England J medicine 2001; 344 (2): 114-23.
5- Lim L, Rosenthal M, Maartens N, Ryan GJImj. Management of Brain Metastases. Journal of neurology 2004; 34 (5): 270-8.
6- Wen PY, Loeffler JSJO. Management of Brain Metastases. 1999; 13 (7): :941-54.
7- Barnholtz-Sloan JS, Ostrom QT, Cote DJNc. Epidemiology of Brain Tumors. Neurologic clinics 2018; 36 (3): 395-419.
8- Sauvageot CM, Kesari S, Stiles CDJNc. Molecular Pathogenesis of Adult Brain Tumors and the Role of Stem Cells. Neurologic Clinics 2007; 25 (4): 891-924.
9- Louis DN, Perry A, Reifenberger G, Von Deimling A, Figarella-Branger D, Cavenee WK, et al. The 2016 World Health Organization Classification of Tumors of the Central Nervous System: A Summary. Acta Neuropathologica 2016; 131 (6): 803-20.
10- Huse JT, Holland ECJNrc. Targeting Brain Cancer: Advances in the Molecular Pathology of Malignant Glioma and Medulloblastoma. Nature reviews cancer 2010; 10(5): 319.
11- Vega JE, Brat DJ. Incorporating Advances In Molecular Pathology Into Brain Tumor Diagnostics. Advances in Anatomic Pathology 2018; 25(3): 143-71.
12- Molinaro AM, Taylor JW, Wiencke JK, Wrensch MR. Genetic and Molecular Epidemiology of Adult Diffuse Glioma. Nature Reviews Neurology 2019; 15(7): 405-17.
13- Eckel-Passow JE, Lachance DH, Molinaro AM, Walsh KM, Decker PA, Sicotte H, et al. Glioma groups based on 1p/19q, IDH, and TERT promoter mutations in tumors. New England J Medicine 2015; 372 (26): 2499-508.
14- Shergalis A, Bankhead A, Luesakul U, Muangsin N, Neamati NJPr. Current Challenges and Opportunities in Treating Glioblastoma. Pharmacological Reviews 2018; 70(3): 412-45.
15- Szopa W, Burley TA, Kramer-Marek G, Kaspera WJBri. Diagnostic and Therapeutic Biomarkers in Glioblastoma: Current Status and Future Perspectives. BioMed research international 2017; 2017.
16- Ramlee MK, Wang J, Toh WX, Li SJG. Transcription Regulation of the Human Telomerase Reverse Transcriptase(Htert)Gene. Genes 2016; 7(8): 50.
17- Cong Y-S, Wen J, Bacchetti SJHmg. The Human Telomerase Catalytic Subunit Htert: Organization of the Gene and Characterization of the Promoter. Human Molecular Genetics 1999; 8(1): 137-42.
18- Jafri MA, Ansari SA, Alqahtani MH, Shay JW. Roles of Telomeres and Telomerase in Cancer, and Advances in Telomerase-Targeted Therapies. Genome Medicine 2016; 8(1): 69.
19- Sethi G. Telomerase and Hallmarks of Cancer: An Intricate Interplay Governing Cancer Cell Evolution. Cancer Letters 2023; 578: 216459.
20- Saretzki G. Role of Telomeres and Telomerase in Cancer and Aging. International Journal of Molecular Sciences 2023: 24(12): 9932.
21- Nonoguchi N, Ohta T, Oh JE, Kim YH, Kleihues P, Ohgaki H. TERT Promoter Mutations in Primary and Secondary Glioblastomas. Acta Neuropathologica 2013; 126: 931-7.
22- Simon M, Hosen I, Gousias K, Rachakonda S, Heidenreich B, Gessi M, et al. Tert Promoter Mutations: A Novel Independent Prognostic Factor in Primary Glioblastomas. Neuro-oncology 2015; 17(1): 45-52.
23- Mosrati MA, Malmström A, Lysiak M, Krysztofiak A, Hallbeck M, Milos P, et al. TERT Promoter Mutations and Polymorphisms as Prognostic Factors in Primary Glioblastoma. Oncotarget 2015; 6(18): 16663.
24- Arita H, Yamasaki K, Matsushita Y, Nakamura T, Shimokawa A, Takami H, et al. A Combination of Tert Promoter Mutation and Mgmt Methylation Status Predicts Clinically Relevant Subgroups of Newly Diagnosed Glioblastomas. Acta Neuropathologica Communications 2016; 4: 1-14.
25- Yuan Y, Qi C, Maling G, Xiang W, Yanhui L, Ruofei L, et al. TERT Mutation in Glioma: Frequency, Prognosis and Risk. Journal of Clinical Neuroscience 2016; 26: 57-62.
26- Killela PJ, Reitman ZJ, Jiao Y, Bettegowda C, Agrawal N, Diaz Jr LA, et al. TERT Promoter Mutations Occur Frequently in Gliomas and a Subset of Tumors Derived from Cells with Low Rates of Self-Renewal. Proceedings of the National Academy of Sciences 2013; 110(15): 6021-6.
27- Huang D-S, Wang Z, He X-J, Diplas BH, Yang R, Killela PJ, et al. Recurrent TERT Promoter Mutations Identified in a Large-Scale Study of Multiple Tumour Types are Associated with Increased TERT Expression and Telomerase Activation. European J Cancer 2015; 51 (8): 969-76.
28- Arita H, Ichimura K. Prognostic Significance of TERT Promoter Mutations in Adult-Type Diffuse Gliomas. Brain Tumor Pathology 2022; 39(3): 121-9.
29- Juratli TA, Thiede C, Krex D, Brastianos PK, Wakimoto H, Schackert G, et al. TERT Promoter Mutations in Progressive Treatment-Resistant Meningiomas. American Society of Clinical Oncology 2017; 64(CN_suppl_1): 236-7.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







