دوره 32، شماره 3 - ( خرداد 1403 )
جلد 32 شماره 3 صفحات 7672-7660 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shafabakhsh S R, Kazemzadeh Y, Shirvani H, Mirzaiyan Shanjani S, Sedaghati S. Investigating the Impact of Resistance Training on Myokines Gene Expression in the Skeletal Muscle of Rats. JSSU 2024; 32 (3) :7660-7672
URL: http://jssu.ssu.ac.ir/article-1-6142-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6142-fa.html
شفابخش کلور سیدرفیع، کاظمزاده یاسر، شیروانی حسین، میرزایان شانجانی ساناز، صداقتی سعید. بررسی تاثیر تمرین مقاومتی بر بیان ژن مایوکاینها در عضله اسکلتی موشهای صحرایی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (3) :7660-7672
متن کامل [PDF 1241 kb]
(496 دریافت)
| چکیده (HTML) (1566 مشاهده)
References:
1- Hody S, Croisier JL, Bury T, Rogister B, Leprince P. Eccentric Muscle Contractions: Risks and Benefits. Front Physiol 2019; 10: 536.
2- Bay ML, Pedersen BK. Muscle-Organ Crosstalk: Focus on Immunometabolism. Front Physiol 2020; 11: 567881.
3- Laurens C, Bergouignan A, Moro C. Exercise-Released Myokines in the Control of Energy Metabolism. Front Physiol 2020; 11:91.
4- Hoffmann C, Weigert C. Skeletal Muscle as an Endocrine Organ: The Role of Myokines in Exercise Adaptations. Cold Spring Harb Perspect Med 2017; 7(11): a029793.
5- Lee JH, Jun HS. Role of Myokines in Regulating Skeletal Muscle Mass and Function. Front Physiol 2019; 10:42.
6- Bilski J, Pinkas M, Wojcik-Grzybek D, Magierowski M, Korbut E, Mazur-Bialy A, et al. Role of Obesity, Physical Exercise, Adipose Tissue-Skeletal Muscle Crosstalk and Molecular Advances in Barrett’s Esophagus and Esophageal Adenocarcinoma. Int J Mol Sci 2022; 23(7): 3942.
7- Thomas G, Moffatt P, Salois P, Gaumond M-H, Gingras R, Godin E, et al. Osteocrin, A Novel Bone-Specific Secreted Protein that Modulates the Osteoblast Phenotype. J Biol Chem 2003; 278(50): 50563-71.
8- Potter LR, Abbey-Hosch S, Dickey DM. Natriuretic peptides, their receptors, and cyclic guanosine monophosphate-dependent signaling functions. Endocr Rev 2006; 27(1): 47-72.
9- Miyazaki T, Otani K, Chiba A, Nishimura H, Tokudome T, Takano-Watanabe H, et al. A new secretory peptide of natriuretic peptide family, osteocrin, suppresses the progression of congestive heart failure after myocardial infarction. Circ Res 2018; 122(5): 742-51.
10- Moffatt P, Thomas G, Sellin K, Bessette M-C, Lafreniere F, Akhouayri O, et al. Osteocrin is a specific ligand of the natriuretic Peptide clearance receptor that modulates bone growth. J Biol Chem 2007; 282(50): 36454-62.
11- Re Cecconi AD, Forti M, Chiappa M, Zhu Z, Zingman LV, Cervo L, et al. Musclin, a myokine induced by aerobic exercise, retards muscle atrophy during cancer cachexia in mice. Cancers 2019; 11(10): 1541.
12- Subbotina E, Sierra A, Zhu Z, Gao Z, Koganti SRK, Reyes S, et al. Musclin is an activity-stimulated myokine that enhances physical endurance. Proc Natl Acad Sci 2015; 112(52): 16042-7.
13- Yu J, Zheng J, Liu X, Feng Z, Zhang X, Cao L, et al. Exercise improved lipid metabolism and insulin sensitivity in rats fed a high-fat diet by regulating glucose transporter 4 (GLUT4) and musclin expression. Braz J Med Biol Res 2016;49.
14- Shimomura M, Horii N, Fujie S, Inoue K, Hasegawa N, Iemitsu K, et al. Decreased muscle‐derived musclin by chronic resistance exercise is associated with improved insulin resistance in rats with type 2 diabetes. Physiol Rep 2021; 9(9): e14823.
15- Bertrand C, Valet P, Castan-Laurell I. Apelin and energy metabolism. Front Physiol 2015; 6: 115.
16- Wysocka MB, Pietraszek-Gremplewicz K, Nowak D. The role of apelin in cardiovascular diseases, obesity and cancer. Front Physiol 2018; 9: 557.
17- Kwon K-S. Molecular Mechanisms of Exercise Providing Therapeutic Rationale to Counter Sarcopenia. Sarcopenia: Elsevier 2021; 159-69.
18- Jang S-H, Paik I-Y, Ryu J-H, Lee T-H, Kim D-E. Effects of Aerobic And Resistance Exercises on Circulating Apelin-12 and Apelin-36 Concentrations in Obese Middle-Aged Women: A Randomized Controlled Trial. BMC Womens Health 2019; 19(1): 1-8.
19- Mohammad M, Karim D, Mehdi M, Marziyeh S, Hadi S, Shila N. The Combinatory Effect of Spirulina Supplementation and Resistance Exercise on Plasma Contents of Adipolin, Apelin, Ghrelin, and Glucose in Overweight and Obese Men. Mediators Inflamm 2022; 2022: 9539286.
20- Kanzleiter T, Rath M, Görgens SW, Jensen J, Tangen DS, Kolnes AJ, et al. The Myokine Decorin is Regulated by Contraction and Involved in Muscle Hypertrophy. Biochem Biophys Res Commun 2014; 450(2): 1089-94.
21- Zandvoort A, Postma DS, Jonker MR, Noordhoek JA, Vos JT, van der Geld YM, et al. Altered Expression of the Smad Signalling Pathway: Implications for COPD Pathogenesis. Eur Respir J 2006; 28(3): 533-41.
22- Baghy K, Iozzo RV, Kovalszky I. Decorin–Tgfβ Axis in Hepatic Fibrosis and Cirrhosis. J Histochem Cytochem 2012; 60(4): 262-8.
23- Huttenlocher A, Werb Z, Tremble P, Huhtala P, Rosenberg L, Damsky CH. Decorin Regulates Collagenase Gene Expression in Fibroblasts Adhering to Vitronectin. Matrix Biol 1996; 15(4): 239-50.
24- Bugera EM, Duhamel TA, Peeler JD, Cornish SM. The Systemic Myokine Response of Decorin, Interleukin-6 (IL-6) and Interleukin-15 (IL-15) to an Acute Bout of Blood Flow Restricted Exercise. Eur J Appl Physiol 2018; 118(12): 2679-86.
25- Al-Jarrah M, Matalka I, Al Aseri H, Mohtaseb A, Smirnova IV, Novikova L, et al. Exercise Training Prevents Endometrial Hyperplasia and Biomarkers for Endometrial Cancer in Rat Model of Type 1 Diabetes. J Clin Med Res 2010; 2(5): 207.
26- Cholewa J, Guimarães‐Ferreira L, da Silva Teixeira T, Naimo MA, Zhi X, de Sá RBDP, et al. Basic Models Modeling Resistance Training: An Update for Basic Scientists Interested in Study Skeletal Muscle Hypertrophy. J Cell Physiol 2014; 229(9): 1148-56.
27- Neto WK, Silva WDA, Ciena AP, Anaruma CA, Gama EF. Vertical Climbing for Rodent Resistance Training: a Discussion about Training Parameters. Int J Sports Sci 2016; 6: 36-49.
28- Deschenes MR, Sherman EG, Roby MA, Glass EK, Harris MB. Effect of Resistance Training in Neuromuscular Junctions of Young and Aged Muscles Featuring Different Recruitment Patterns. J Neurosci Res 2015; 93(3): 504-13.
29- Krause Neto W, Gonçalves L, Nascimento V, Maifrino L, de Souza R, Gama E. Quantitative Morphological Analysis Revealed Muscular Hypertrophy in Different Skeletal Muscle Types Induced by Anabolic Steroid and Resistance Training in Rats. Aust J Basic Appl Sci 2013; 7(14): 591-8.
30- Re Cecconi AD, Forti M, Chiappa M, et al. Musclin, A Myokine Induced by Aerobic Exercise, Retards Muscle Atrophy during Cancer Cachexia in Mice. Cancers (Basel) 2019; 11(10): 1541.
31- Zhu S, Sun F, Li W, Cao Y, Wang C, Wang Y, et al. Apelin Stimulates Glucose Uptake through the PI3K/Akt Pathway and Improves Insulin Resistance in 3T3-L1 Adipocytes. Molecular and cellular biochemistry 2011; 353(1-2): 305-13.
32- Tatemoto K, Takayama K, Zou M-X, Kumaki I, Zhang W, Kumano K, et al. The Novel Peptide Apelin Lowers Blood Pressure Via a Nitric Oxide-Dependent Mechanism. Regulatory Peptides 2001; 99(2-3): 87-92.
33- Quazi R, Palaniswamy C, Frishman WH. The Emerging Role of Apelin in Cardiovascular Disease and Health. Cardiol Rev 2009; 17(6): 283-6.
34- Besse-Patin A, Montastier E, Vinel C, et al. Effect of Endurance Training on Skeletal Muscle Myokine Expression in Obese Men: Identification of Apelin as a Novel Myokine. Int J Obes (Lond) 2014; 38(5): 707-13.
35- Kadoglou N, Sailer N, Moumtzouoglou A. Novel markers of carotid atherosclerosis in patients with type 2 diabetes. Exp Clin Endocrin Diab 2008; 35: 661-8.
36- Tasci I, Erdem G, Ozgur G, Tapan S, Dogru T, Genc H, et al. LDL-Cholesterol Lowering Increases Plasma Apelin in Isolated Hypercholesterolemia. Atherosclerosis 2009; 204(1): 222-8.
37- Ghosh MC, Zhang D-L, Jeong SY, Kovtunovych G, Ollivierre-Wilson H, Noguchi A, et al. Deletion of Iron Regulatory Protein 1 Causes Polycythemia and Pulmonary Hypertension in Mice through Translational Derepression of HIF2α. Cell Metab 2013; 17(2): 271-81.
38- Pedersen BK, Febbraio MA. Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6. Physiol Rev 2008; 88(4): 1379-406.
39- Vinel C, Lukjanenko L, Batut A, Deleruyelle S, Pradere J-P, Le Gonidec S, et al. The Exerkine Apelin Reverses Age-Associated Sarcopenia. Nat Med 2018; 24(9): 1360-71.
40- Sheibani SH, Hanachi P, Refahiat M. Effect of Aerobic Exercise on Serum Concentration of Apelin, Tnfα and Insulin in Obese Women. Iranian Journal of Basic Medical Sciences 2012: 15(6): 1196-201.
41- Miura T, Kishioka Y, Wakamatsu J-i, Hattori A, Hennebry A, Berry CJ, et al. Decorin Binds Myostatin and Modulates its Activity to Muscle Cells. Biochem Biophys Res Commun 2006; 340(2): 675-80.
42- Kishioka Y, Thomas M, Wakamatsu Ji, Hattori A, Sharma M, Kambadur R, et al. Decorin Enhances the Proliferation and Differentiation of Myogenic Cells Through Suppressing Myostatin Activity. J Cell Physiol 2008; 215(3):856-67.
43- Ferguson B. ACSM’s Guidelines for Exercise Testing and Prescription 9th Ed. 2014. The Journal of the Canadian Chiropractic Association 2014; 58(3): 328.
متن کامل: (1277 مشاهده)
مقدمه
استرس مکانیکی و متابولیک ناشی از انقباضهای مکرر فیبرهای عضلانی، باعث اختلال در سارکولما و ماتریکس خارج سلولی، تورم میتوکندری، گشاد شدن سیستم لوله عرضی، افزایش التهاب و در نهایت تخریب هموستاز عضله می شود (1). علاوه بر این، تغییرات در بیش از 650 مایوکاین در پاسخ به انقباض و تمایز عضلانی، با اقدامات اتوکرین (Autocrine)، پاراکرین (Paracrine) و اندوکرین (Endocrine) مشاهده شده است (2،3). منبع سلولی مایوکاینها شامل میوسیتها، سلولهای ماهوارهای، سلولهای اندوتلیال، ماکروفاژها و فیبروبلاستها هستند (4). بسیاری از این مایوکاینها عملکردهای بیولوژیکی پاراکرینی در سنتز یا تخریب پروتئین ماهیچهها، تکثیر و تمایز میوبلاستها، فعالسازی سلولهای ماهوارهای، سازماندهی و بازسازی ماتریکسخارج سلولی و همچنین تعدیل تحلیل، ترمیم و بازسازی عضلات را دارند (3،5). این در حالی است که مایوکاینها با تاثیرات اندوکرین بر بافت های دور دست متابولیکی تاثیرات مثبت گذاشته و میتوانند یک هدف درمانی در بیماریهای مرتبط با سبک زندگی باشند (6). ماسلین یک مایوکاین ناشی از ورزش است، که ابتدا در سال 2003 به عنوان یک پپتید مشتق از استخوان (استئوکرین) شناسایی شد، با این وجود این مایوکاین در عضله اسکلتی بیش از 10 برابر بیشتر از استخوان، بافت چرب قهوهای، بیضه و طحال بیان میشود (7). دامنه C ترمینال این مایوکین مشابه با پپتیدهای ناتریورتیک (NPs) است. لذا بر بافتهای قلب و عضله اسکلتی تاثیرگذار است (8). بیان شده که ماسلین در نارسایی قلبی پس از انفارکتوس میوکارد (9)، تعدیل رشد استخوان موش و همچنین در کنترل اندازه ماهیچههای اسکلتی نیز نقش دارد (10). کاسونی و همکاران در رابطه با آثار ورزش بر این مایوکاین بیان کردند که ماسلین افزایش یافته با تمرین ورزشی هوازی، آتروفی عضلانی را در طول کاشکسی ناشی از سرطان در نمونه حیوانی به تاخیر میاندازد (11). سابوتینا و همکاران نیز بیان کردند که ماسلین یک مایوکاین تحریک شده با فعالیت بدنی است که استقامت عضلانی را افزایش میدهد (12). یو و همکاران نشان دادند که انجام 8 هفته تمرین شنا متابولیسم لیپید و حساسیت به انسولین را در موشهایی که از رژیم غذایی پرچرب تغذیه کرده بودند، با تنظیم ناقل گلوکز (GLUT4) و بیان ماسلین بهبود بخشید (13). شیمورا و همکاران نیز بیان کردند که کاهش تولید ماسلین مشتق از عضله دوقلویی توسط تمرینات مقاومتی مزمن (8 هفته، سه روز در هفته) ممکن است در بهبود مقاومت به انسولین در موشهای مبتلا به دیابت نوع 2 نقش داشته باشد (14). تحیقات محدودی نقش تمرین مقاومتی بر این مایوکاین را بررسی کردهاند. آپلین یک پپتید درون زا است که به عنوان لیگاند گیرنده APJ جفت شده با پروتئین G شناسایی شده است. آپلین متعلق به خانواده آدیپوکینها می باشد. آدیپوکاینها واسطههای زیست فعالی هستند که توسط بافت چربی آزاد میشوند. آپلین همچنین به مقدار زیادی از بافت عضلانی بهویژه با افزایش انقباض، ترشح و وارد جریان خون میشود (15). توزیع گسترده بافتی آپلین و گیرنده آن نشان میدهد که این فاکتور میتواند در بسیاری از فرآیندهای فیزیولوژیکی از جمله تنظیم فشارخون، هموستاز مایعات بدن، پاسخ استرسی غدد درونریز، انقباض قلبی، رگزایی و متابولیسم انرژی نقش داشته باشد (15). علاوه بر این، این پپتید در فرآیندهای پاتولوژیک مانند نارسایی قلبی، چاقی، دیابت و سرطان شرکت میکند (16). با این وجود در شرایط فیزیولوژیک تاثیرات مفیدی میتواند داشته باشد. نشان داده شده که سطح آپلین و IL-15 با انجام تمرینات ورزشی منظم توسط انسان و جوندگان افزایش مییابد (17). آپلین، پروتئینکیناز فعال شده باAMP (Adenosine monophosphate) را فعال میکند، بنابراین حساسیت به انسولین را از طریق افزایش جذب گلوکز در عضله اسکلتی بهبود میبخشد، این فاکتور همچنین بیوژنز میتوکندری، اتوفاژی و مسیرهای ضد التهابی را در میوفیبریلها ترویج میدهد (17). مطالعات در رابطه با تغییرات آپلین در تمرین ورزشی ضد و نقیض است. جانگ و همکاران نشان دادند که 8 هفته تمرین هوازی و مقاومتی در نمونه انسانی چاق تغییرات مثبت و معنیداری را در سطح آپلین 12 ایجاد کرد (18). مالکانه و همکاران نشان دادند که هشت هفته تمرین مقاومتی دایرهای و مصرف مکمل اسپیرولینا می تواند منجر به کاهش وزن و سطوح آپلین و FBS و همچنین افزایش غلظت آدیپولین و گرلین در مردان دارای اضافه وزن و چاق شود (19). با این وجود این فاکتور نیز همانند سایر فاکتورها تحت شرایط فیزیولوژیک و پاتولوژیک اعمال متنوعی دارد. دکورین نیز بخشی از ماتریکس خارج سلولی است و توسط عضله اسکلتی ترشح میشود. به بیان دیگر دکورین به عنوان یک پروتئوگلیکان کوچک غنی از لوسین شناخته می شود (20). مشخص شده است که بیان دکورین در بیماران مبتلا به بیماری فیبروپرولیفراتیو، از جمله بیماری انسدادی مزمن ریه، گلومرولوسکلروزیس سگمنتال کانونی و لوپوس اریتماتوز سیستمیک کاهش مییابد (21). دکورین همچنین در کنترل فیبروز کبدی نقش دارد (22). روند بهبودی این فاکتور با مهار فعالیت زیستیTGF-β و القای بیان ماتریکس متالوپروتئیناز کلاژناز-1 میباشد (22،23). علاوه بر این، اخیرا گزارش شده است که دکورین با مهار مایوستاتین، به عنوان تنظیم کننده منفی سنتز پروتئین عضلانی، هیپرتروفی فیبر عضلانی را افزایش می دهد (20). کامزلیتر و همکاران بیان کردند که دکورین با انقباض ناشی از تمرین ورزشی تنظیم می شود و در هیپرتروفی عضلانی نیز نقش دارد (20). بوگرا و همکاران نشان دادند که انجام تمرین مقاومتی با محدودیت جریان خون تاثیرات قابل توجی بر برخی فاکتورهای ضد التهابی و دکورین ندارد (24). با این وجود با توجه به اینکه ترشح و بیان بسیاری از مایوکاینها بوسیله انواع خاصی از فعالیتهای بدنی با شدتهای متفاوت در نوع خاصی از تارهای عضلانی در عضله اسکلتی دقیقا مشخص نشده است و ناشناخته میباشد. حتی گزارشهای نتایج برخی تحقیقات در زمینه ترشح و بیان مایوکاینهای هدف (ماسلین، دکورین، آپلین) ضمن اینکه اندک میباشد، در برخی مواقع ضد و نقیض نیز میباشد. بر این اساس، گسترش درک ما در مورد اینکه کدام یک از روش-های تمرینی میتوانند در ترشح و بویژه بیان مایوکاینهای خاص در عضله نقش داشته باشند، میتواند در تنظیم سوخت و ساز، تولید و هموستاز انرژی در بدن موثر بوده و در پیشگیری یا درمان برخی از بیماریهای خاص یا داروهای مبتنی بر مایوکاینها نیز میتواند مفید و موثر باشد، بنابراین بررسی بیشتر در این زمینه ضروری به نظر می رسد. اهمیت و ضرورت انجام پژوهشهای جدید در این راستا را دو چندان کرده است. لذا هدف از مطالعه حاضر بررسی تاثیر چهار هفته تمرین مقاومتی بر بیان ژن مایوکاینهای ماسلین، آپلین و دکورین در عضله سولئوس موشهای صحرایی نر نژاد ویستار میباشد.
روش بررسی
حیوان: تحقیق حاضر از نوع بنیادی و تجربی می باشد. این پژوهش به روش آزمایشگاهی و کنترل شده انجام شد با عنایت به اینکه از لحاظ محدودیت های مکانی، اخلاقی و زمانی دسترسی به آزمودنی های انسان مقدور نبوده است لذا از آزمودنیهای حیوان (موش صحرایی نر نژاد ویستار) استفاده شد. در ابتدا به کسب مجوزهای لازم اقدام شد. جامعه آماری شامل موشهای صحرایی نرنژاد ویستار با سن تقریبی 8 هفته و با محدوده وزن 220-200 گرم که از مرکز پرورش و تکثیر حیوانات آزمایشگاهی پاستور (تهران، ایران) تهیه و سپس به آزمایشگاه حیوانی مرکز فیزیولوژی ورزشی دانشگاه علوم پزشکی بقیه اله منتقل شدند. و بهصورت تصادفی و به تعداد مساوی (شامل هشت سر موش صحرایی نر نژاد ویستار) به دو گروه کنترل سالم (Con) بدون هیچ گونه فعالیتی و گروه تمرین مقاومتی (RT) تقسیم شدند. و بهصورت جداگانه در قفسهای پلی کربنات شفاف (هر 4 موش در یک قفس) تحت شرایط آزمایشگاهی2± 22 درجه سانتیگراد و رطوبت نسبی40±10 درصد و چرخه روشنایی- تاریکی 12:12 ساعت نگهداری شدند. غذای استاندارد پلت و آب بهصورت آزاد در اختیار موشها قرار داشت. حجم نمونه با نرمافزارG POWER بر اساس روش آماری تحلیل واریانس و سطح خطای آلفای 0/05 و توان 0/85 برابر با 16 موش تعیین شد.
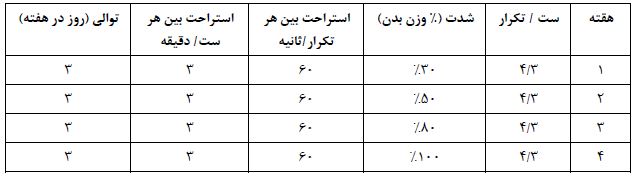
تمرین مقاومتی: گروه تمرین مقاومتی ابتدا به مدت یک هفته قبل از اجرای پروتکل تمرینی، با نحوه بالا رفتن از نردبان آشنا شدند. برنامه تمرینی شامل بالا رفتن از یک نردبان به ابعاد 18*100 سانتی متر با دو سانتیمتر فاصله بین پلهها، یک محفظه استراحت در قسمت بالای آن، با ارتفاع 1 متر، با شیب 85 درجه با بستن ابزار وزنه بدون گذاشتن هیچ گونه وزنه ای به قاعده دم موش بود. این پروتکل در مدت 4 هفته با شدت تمرین (وزنه جابجا شده) در هفته اول تا چهارم به ترتیب، 30، 50، 80 و 100 درصد وزن بدن (اصل اضافه بار) با بستن وزنه به قاعده دم موشها در 3 ست با 4 تکرار بصورت بالا رفتن از نردبان اجرا شد (25). درجدول 1 برنامه تمرین مقاومتی قرار داده شده است. استخراج RNA و ساخت cDNA: جهت استخراج RNA total به نسبت 1 به 10 در Isol RNA- reagent Lysisمطابق با دستور کار کیت (کیاژن، آلمان) هموژن شد. به منظور برداشتن اجزای پروتئینی محصول حاصل درC ْ4, 10 دقیقه با دور 12000 سانتریفیوژ گردید. سوپرناتانت برداشته و با نسبت 1 به 5/ 0 با Isol اولیه با کلروفورم مخلوط گردید. محصول درC ْ4، 15دقیقه با دور 12000 سانتریفیوژ و بخش معدنی و آبی از هم جدا شدند، بخش محتوی RNA برداشته و با نسبت 1به 0/5 با ایزوپروپانل مخلوط و به مدت 10 دقیقه در دمای اتاق رها و سپس درC ْ4، 10دقیقه با دور 12000سانتریفیوژ شد. پلیت حاوی RNA در µL 20 آب Free-RNAs حل شد. غلظ RNA با استفاده از دستگاه nono dropسنجیده و نسبت 260 به 280 بین 1/8 تا 2 به عنوان تخلیص مطلوب تعریف گردید. پس از استخراج RNA با خلوص و غلظت بالا از تمامی نمونههای مورد مطالعه، مراحل سنتزcDNA طبق پروتکل شرکت سازنده (Fermentas, USA) انجام شد و سپس cDNA سنتز شده جهت انجام واکنش رونویسی معکوس مورد استفاده قرارگرفت.
طراحی پرایمرها و بررسی بیان ژنهای ماسلین، آپلین و دکورین: وزنکشی موشهای صحرایی بهصورت هفتگی انجام شد. 48 ساعت پس از آخرین جلسه تمرین و نگهداری، موشها به آزمایشگاه برده شدند و با ترکیبی از زایلازین (2 درصد و با دوز 10 میلیگرم بر کیلوگرم) و کتامین (10 درصد با دوز 50 میلیگرم بر کیلوگرم) بیهوش شدند. با جراحی عضله نعلی موشها جهت بررسی بیان ژنها برداشته شدند. پس از شستشو در ازت مایع فریز و در دمای 80- درجه نگهداری شدند. برای آمادهسازی پرایمرها از آب مقطر حاوی پرایمر لیوفیلیزه10 میکرولیتر، پرایمر جلویی (Primer Forward) و پرایمر معکوس (Primer Revers) 5/0 میکرولیتر، cDNA 1 و آب دپس (DEPC Water) 8 میکرولیتر استفاده شد. برای بیان ژن با تکنیک q RT-PCR با استفاده از محلول کیازول، RNA کل سلولها طبق پروتکل سیناژن استخراج گردید. کیفیت RNA های استخراج شده با دستگاه اسپکترفتومتری مورد ارزیابی قرار گرفت. جهت تهیه cDNA تک رشتهای از پرایمرOligo dt و آنزیم نسخهبرداری معکوس براساس پروتکل مربوطه انجام شد. هر واکنش PCR در دستگاه ABI Step One طبق پروتکل شرکت سازنده انجام گرفت. چرخههای واکنشی Real-Time PCR برای ژنهای ماسلین، آپلین و دکورین با سه دمای 94، 60 و 72 درجه سانتیگراد انجام شد. نمودار ذوب (Melting) جهت بررسی صحت واکنشهای PCR انجام شد. از GAPDH (Glyceraldehyde-3-phosphate dehydrogenase) به عنوان ژن مرجع ماسلین، آپلین و دکورین استفاده گردید. میزان بیان ژنهای کنترل و تمرین بهصورت توامان با هم اندازهگیری شد. جهت کمیسازی بیانApelin mRNA ، Musclin mRNA وDecorin mRNA از روش ΔΔCt مقایسهای استفاده گردید. در این روش ΔΔCt از رابطه زیر استفاده گردید:
ΔΔCt = ΔCt sample – ΔCt control
در این رابطه ΔCt sample، اختلاف میان سیکلهای آستانه ژن مورد نظر و خانهنگهدار در نمونه مورد آزمایش (بیمار) و ΔCt control، اختلاف میان سیکلهای آستانه ژن مورد نظر و خانهنگهدار در نمونه کنترل (سالم) میباشد. عدد حاصل از آن، در رابطه 2-ΔΔCt قرار داده میشود که نتیجه بهدست آمده اختلاف میزان بیان در نمونه کنترل و مورد آزمایش را نشان میدهد.
جدول 1: پروتکل تمرین مقاومتی
جدول 2: توالی پرایمرهای مورد استفاده برای ژن های ماسلین، آپلین و دکورین و ژن مرجع در Real-time
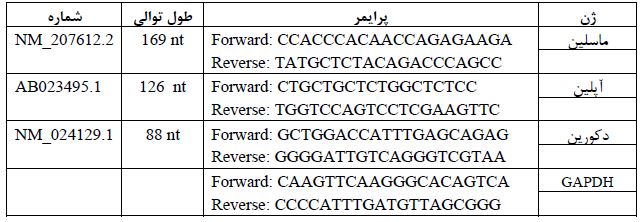
GAPDH: Glyceraldehyde-3-phosphate dehydrogenase
تجزیه و تحلیل آماری
از آزمون کولموگروف اسمیرنف برای بررسی نرمال بودن توزیع دادهها استفاده شد. سطح آمار توصیفی از شاخصهایی نظیر میانگین، انحراف معیار، جداول توزیع فراوانی و سپس در بخش آمار استنباطی برای آنالیز دادها از تی مستقل استفاده گردید. سطح آلفای کوچکتر از 0/05 به عنوان سطح معنیداری در نظر گرفته شد. تجزیه و تحلیل دادهها با استفاده از نرمافزار آماری SPSS version 16 انجام گرفت.
نتایج
تغییرات بیان ژن ماسلین، دکورین و اپلین عضله سولئوس موشهای صحرایی نر نژاد ویستار دو گروه کنترل و تمرین مقاومتی بهصورت انحراف معیار± میانگین در جدول 3 نشان داده شده است.
بیان ژن ماسلین: تغییرات بیان ژن ماسلین عضله سولئوس موشهای صحرایی دو گروه کنترل و تمرین مقاومتی در نمودار 1 نشان داده شده است. نتایج آزمون تی مستقل نشان داد که بین گروه کنترل و تمرین مقاومتی تفاوت معنیداری در بیان ژن ماسلین وجود دارد (t=4.664, df=14, p=0.0004). به بیان دیگر تمرین مقاومتی بهطور معنیداری سبب افزایش بیان ژن ماسلین در عضله سولئوس شد (نمودار 1).
بیان ژن آپلین: تغییرات بیان ژن آپلین عضله سولئوس موشهای صحرایی دو گروه کنترل و تمرین مقاومتی در نمودار 2 نشان داده شده است. همانند ماسلین نتایج آزمون تی مستقل نشان داد که بین گروه کنترل و تمرین مقاومتی تفاوت معنی داری در بیان ژن آپلین وجود دارد (t=10.23, df=14, p<0.0001). به بیان دیگر تمرین مقاومتی بهطور معنیداری سبب افزایش بیان ژن آپلین در عضله سولئوس شد (نمودار 2). بیان ژن دکورین: تغییرات بیان ژن دکورین عضله سولئوس موشهای صحرایی دو گروه کنترل و تمرین مقاومتی در نمودار 3 نشان داده شده است. همانند دو ژن ماسلین و آپلین، نتایج آزمون تی مستقل نشان داد که بین گروه کنترل و تمرین مقاومتی تفاوت معنیداری در بیان ژن دکورین وجود دارد (t=3.100, df=14, p=0.0078). به بیان دیگر تمرین مقاومتی بهطور معنیداری سبب افزایش بیان ژن دکورین در عضله سولئوس شد (نمودار 3).
جدول 3: میزان بیان ژن ماسلین، دکورین و آپلین درگروههای پژوهش (انحراف معیار± میانگین).
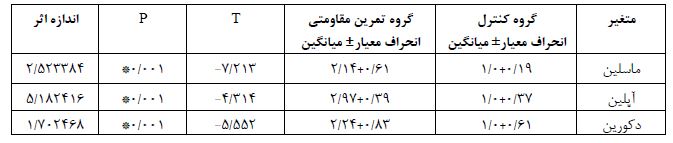
*تفاوت معنیدار
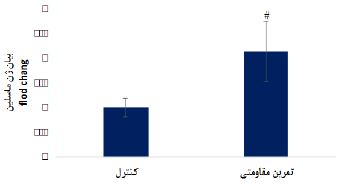
نمودار1: سطوح بیان ژن ماسلین در عضله سولئوس موشهای نر نژاد ویستار گروه کنترل و گروه تمرین مقاومتی.
دادهها بهصورتانحراف معیار± میانگین نشان داده شده است. سطح معنی داری p<0.05 در نظر گرفته شده است. # نشانه تفاوت معنیدار با گروه کنترل.
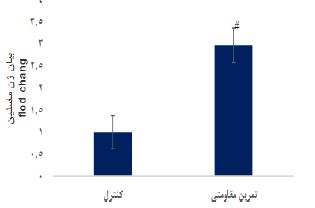
نمودار2: سطوح بیان ژن آپلین در عضله سولئوس موشهای نر نژاد ویستار گروه کنترل و گروه تمرین مقاومتی.
دادهها بهصورت انحراف معیار± میانگین نشان داده شده است. سطح معنی داری p<0.05 در نظر گرفته شده است. # نشانه تفاوت معنیدار با گروه کنترل.
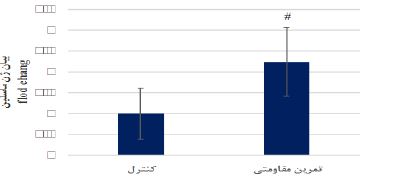
نمودار3: سطوح بیان ژن آپلین در عضله سولئوس موشهای نر نژاد ویستار گروه کنترل و گروه تمرین مقاومتی.
دادهها بهصورت انحراف معیار± میانگین نشان داده شده است. سطح معنیداری p<0.05 در نظر گرفته شده است. # نشانه تفاوت معنیدار با گروه کنترل
بحث
در سه دهه گذشته، روشها و تجهیزات مختلفی برای تمرین مقاومتی حیوانات توسعه داده شده است (26). نتو و همکاران نشان داد که بسیاری از محققان از تجهیزات نردبان برای تمرین مقاومتی استفاده کردهاند و این نوع تمرین در نمونه حیوانی ممکن است پاسخ بیولوژیکی مشابه تمرینات قدرتی انسان را نشاندهد (27). در این نوع تمرین مقاومتی برای نمونه حیوانی، ماهیچههای سولئوس و پلانتاریس بهطور گسترده مورد تحقیق قرار گرفته اند. این ماهیچهها به میزان زیادی در حرکت بالا رفتن از نردبان به کار گرفته میشوند (27،28). از سوی دیگر، عضلات اسکلتی مانند EDL و تیبیالیس انتریور در این نوع تمرینات حرکت دهنده اصلی نیستند. با اینحال، برخی از مطالعات هیپرتروفی هر دو عضله سولئوس و EDL را گزارش کردند (29). این واقعیت جالب است، زیرا عضله سولئوس یک محرک اصلی در تمرین نردبان است. در حالیکه برای EDL اینگونه نیست. هنگامی که خم شدن کف پا بهطور واضح از طریق فعالیت بالا رفتن نردبان انجام شود فعالیت سولئوس شروع میشود. این در حالی است که در ادامه حرکت بالا رفتن ممکن است باعث استرس اضافی به عضلات ثانویه مانندEDL شود (29). با این وجود، عضلات اندام فوقانی نیز در طول حرکت بالا رفتن به کار گرفته میشوند که مقالات بسیار کمی در مورد تجزیه و تحلیل این عضلات منتشر شده است. لذا در این مطالعه به مانند بسیاری از مقالات، عضله سولئوس مورد بررسی قرار گرفت. نتایج مطالعه حاضر نشان داد که 4 هفته تمرین مقاومتی افزایش معنیداری را در بیان ژن ماسلین در عضله کند انقباض سولئوس ایجاد کرد.که بر اهمیت تنظیم افزایشی این مایوکاین در القای تاثیرات مثبت تمرین ورزشی بر بافت عضلانی تاکید دارد (12). گرچه نتایج برخی پژوهشها در رابطه با ترشح و بیان ماسلین تحت تاثیر تمرینات ورزشی ضد و نقیض میباشد، ضمنا اطلاعات زیادی نیز در دست نیست. سوبوتینا و همکاران در پژوهشی بر روی موشهای صحرایی گزارشکردند که پنج روز تمرین هوازی روی تردمیل، در سربالایی (45 دقیقه در هر جلسه) در موشها، به افزایش معنیدار بیان ماسلین در عضله دوقلو منجر شده است. بهنظر میرسد از آنجاییکه در دویدنهای سربالایی نمونه حیوانی، فشار بالاتری به عضلات اندام تحتانی وارد میشود میتواند مانند تمرین مقاومتی بافت عضله سولئوس را تحتتاثیر قرار دهد. در این پژوهش افزایش بیان عضلانی ماسلین با افزایش سطوح این مایوکاین در پلاسما همراه بود (12). این محققان عنوان کردند که ماسلین با افزایش PGC-1a وابسته به ANP و افزایش بیوژنز میتوکندری میتواند به بهبود استقامت جسمانی منجر گردد که اهمیت ماسلین را در بهبود عملکرد هوازی و القای سازگاری¬های ناشی از تمرین هوازی در عضلات اسکلتی را نشان میدهد (12). متاسفانه در مطالعه حاضر تغییرات ماسلین گردش خون بررسی نشده است، هرچند باتوجه به افزایش بیان عضلانی آن، افزایش سطوح سرمی ماسلین نیز دور از انتظار نیست. در مطالعه دیگری ری و همکاران بر روی موش¬های سرطانی با تایید افزایش بیان ژن ماسلین با تمرین هوازی در عضله دوقلو عنوان کردند که افزایش بیان این مایوکاین ناشی از تحریک PGC-1α است که افزایش بیان آن نیز در بافت عضلانی گروه تمرین کرده نشان داده شد (30).که متاسفانه بیان ژن PGC-1α در مطالعه حاضر مورد بررسی قرار نگرفته است. نتایج این تحقیقات با یافتههای پژوهش حاضر همسو میباشد. از طرفی، زو و همکاران کاهش سطوح ماسلین را بعد از تمرینات تناوبی شدید در بیماران مبتلا به سندرم متابولیک بهعنوان یکی از مسیرهای بالقوه بهبود مقاومت به انسولین عنوان کردهاند (31). در پژوهش دیگری شیمورا و همکاران بیان کردند که کاهش بیان ماسلین مشتق از عضله دوقلویی توسط تمرینات مقاومتی مزمن (8 هفته، سه روز در هفته) ممکن است از طریق فسفوریلاسیون Akt وافزایشGLUT-4 عضلانی در بهبود مقاومت به انسولین موشهای مبتلا به دیابت نوع 2 نقش داشته باشد (14). که نتایج این تحقیقات با یافتههای پژوهش حاضر ناهمسو می باشد. اختلاف در نتایج مطالعات میتواند به دلیل تفاوت درنوع حیوان (سالم و دیابتی)، عضله انتخابی (سولئوس و دوقلو)، شدت، مدت و حجم پروتکل تمرینی مورد استفاده در پژوهشها عنوان کرد. با توجه به نتایج تحقیقات باید توجه داشت که افزایش ماسلین عضله در شرایط فیزیولوژیک تمرین ورزشی و پاتولوژیک، پاسخهای متفاوتی را القا میکند. و تنظیم کاهشی بیان و سطوح ماسلین در نمونههای پاتولوژیک به نظر میرسد یک سازکار جبرانی برای حفظ عملکرد و یک مکانیسم هموستازی در بدن باشد که نیازمند بررسی و مطالعه بیشتر است (31). همانند ماسلین، مقادیر آپلین نیز با انجام 4 هفته تمرین مقاومتی افزایش معنیداری نسبت به گروه کنترل نشان داد. تعدادی از مطالعات در مورد نقش پروتئین جدید آپلین، شناسایی شده در سال 1998، در بهبود عملکرد و ساختار عضلانی در اندامهای مختلف انسان، و همچنین در مورد چگونگی درگیر شدن آن در فرآیندهای پاتولوژیک بحث کردهاند. همانند ماسلین، آپلین نیز میتواند در شرایط فیزیولوژیک و پاتولوژیک پاسخهای مختلفی را القا کند. همچنین میتواند در اندامهای مختلف از جمله، قلب، عروق، بویژه سلولهای اندوتلیال، بافت چربی و سلولهای عضلانی بیان شود. و آثار خود را بهصورت اتوکرین (Autocrine) بر فیزیولوژی عضله، اندوکرین (Endocrine) و پاراکرین (Paracrine) بر دیگر سلولها و بافتها اعمال کند (2،3). و به نظر میرسد آپلین نقش کلیدی در افزایش حساسیت به انسولین و تنظیم تون عروق و عملکرد قلب و عروق دارد (32). مطالعات نشان دادند که آپلین بیان شده در اثر انقباضات عضلانی پس از اتصال به گیرنده خود (APJ)، مسیرهای سیگنالینگ PI3K/AKT را فعال کرده و از این طریق میتواند در بهبود مصرف گلوکز و افزایش حساسیت به انسولین نقش داشته باشد (33). بس پتین و همکاران در پژوهشی بر روی مردان چاق گزارش کردند که هشت هفته تمرین استقامتی باعث افزایش معنیدار APJ mRNA آپلین در عضله پهن جانبی شده است اما در سطح پلاسما، افزایشی مشاهده نشده است (34). این محققان عنوان کردهاند که آپلین پس از اتصال به گیرنده خود (APJ) و فعالکردن مسیر AMPK وکلسیم میتواند به بهبود مقاومت به انسولین کمک کند (34). در مطالعه دیگری، جی و همکاران بر روی موشهای چاق با تایید افزایش بیان و پروتئین آپلین و گیرنده آن در بافت عضلانی، یکی از سازوکارهای احتمالی آنرا، افزایش همزمان در بیان HIF1و کاهش وزن بدن موشها عنوان کردند. برخی مطالعات ارتباط غلظت کم آپلین با عوارض آترواسکلروتیک را نشان داده اند (35). بنابراین، افزایش آپلین مشاهده شده پس از تمرین از این فرضیه پشتیبانی میکند که افزایش آپلین ناشی از تمرین ورزشی ممکن است به اثرات مفید تمرین ورزشی در پیشگیری از خطر بیماری قلبی عروقی نیز کمک کند. در مطالعه دیگری تاسکی و همکاران افزایش تقریباً 4 برابری سطح آپلین را پس از یک برنامه 12 هفتهای تمرین ورزشی گزارش کردند (36). افزایش آپلین بر خود بافت عضله نیز میتواند تاثیرات مثبت داشته باشد. بسیاری از مطالعات قبلی نشان داده اند که آپلین یک مایوکاین ناشی از ورزش است که می تواند یکپارچگی میوفیبرهای اسکلتی را بهبود بخشد (37،38). از آنجایی که آپلین جذب گلوکز و ظرفیت اکسیداتیو میتوکندری را در عضله اسکلتی افزایش میدهد، میتواند بر عملکرد بافت عضلانی تاثیر مثبت داشته باشد. این فاکتور همچنین متابولیسم سلولهای عضلانی و عملکرد سلولهای بنیادی را افزایش میدهد و از این رو، نقش اساسی در مهار آتروفی و یا حتی کاهش سارکوپنی دارد (39). لذا تغییرات افزایشی آپلین مطالعه حاضر با تمرین مقاومتی میتواند عملکرد و متابولیسم عضله سولئوس را تحتتاثیر قرار دهد. نتایج این تحقیقات با یافتههای پژوهش حاضر همسو میباشد. از طرفی شیبانی و همکاران کاهش سطح آپلین پلاسما بعد از تمرین هوازی در زنان چاق را به دنبال کاهش سطوح TNF گزارش کردند و علت آنرا کاهش همزمان توده چربی و وزن بدن دانستهاند (40). تناقض با یافتههای حاضر را صرف نظر از نوع و ویژگی متفاوت نمونههای مورد بررسی میتوان به جایگاه متفاوت بررسی تغییرات آپلین (بیان عضلانی به جای سطوح سرمی) مرتبط دانست. پروتئوگلیکانها اجزای ماتریکس خارج سلولی و تعدیل کننده فعالیتهای فاکتور رشد هستند (41). دکورین به عنوان عامل ضد مایوستاتین شناخته شده است که قویترین مهار کننده رشد عضلانی میباشد که از طریق مسدود کردن مسیرAKT/FoXo یا فعال کردن مسیر سیگنالینگ Smad2,3/Smad4 در داخل هسته سلول بر روی ژنهای هدف تاثیر گذاشته و میتواند در افزایش یا کاهش توده عضلات موثر باشد (41). کیشیوکا و همکاران نشان داد که دکورین با سرکوب فعالیت مایوستاتین، تکثیر و تمایز مایوبلاستهای C2C12 را افزایش میدهد (42). از آنجا که ورزش باعث رشد عضلانی میشود، نتایج مطالعه حاضر نیز موید افزایش رشد عضله با افزایش دکورین پس از تمرین مقاومتی میباشد. مطالعات کمی غلظت دکورین را در بافت عضله پس از تمرین مقاومتی بررسی کردهاند. نتایج مطالعه حاضر با نتایج منتشر شده توسط کانزلیتر و همکاران نیز مطابقت دارد (20). هر دو آزمایش افزایش معنیدار دکورین را با انقباض عضلانی گزارش کردند که پس از تمرین، اندازهگیری شد. کانزلیتر و همکاران از هفت تمرین طراحی شده برای کل بدن استفاده کردند. هر تمرین با سه ست از هشت تکرار و تقریباً 1RM80٪-75٪ انجام شد (20). در مقابل، این پروژه تنها از یک تمرین (بالا رفتن نردبان) در نمونه حیوانی استفاده کرد. این امکان وجود دارد که تمرین مقاومتی با شدتهای مختلف در نمونه انسانی و حیوانی ممکن است آزادسازی دکورین مشابهی را ایجاد کند. علاوه بر این، کانزلیتر و همکاران یک همبستگی بین آزادسازی دکورین و وزن کل بدن در حرکت پرس پا مشاهده کردند (20). وزن بدن نیز به عنوان وزنه میتواند با انقباض بیشتر، ترشح دکورین را تحت تاثیر قرار دهد. تمام این اتفاقات و افزایش دکورین عامل مهمی در جهت افزایش هایپرترفی عضلانی هستند. که از طریق کاهش لیپازهای یوبیکوتین، آتروژین و MuRF1 و افزایش myod1 و فولستاتین اتفاق میافتد (20). هم راستا با مطالعه حاضر در مطالعه دیگری فرگوسون و همکاران افزایش معنیدار بیان ژن و سطوح دکورین را در هر دو نمونه (موشها و نمونههای انسانی) با تمرین هوازی، نشان دادند. این محققان عنوان کردند که دکورین با مهار مایوستاتین و اکتیوین و همچنین افزایش myod1 و فولستاتین میتواند منجر به تکثیر سلولهای ماهوارهای شده و نهایتاً هایپرتروفی عضلانی را تحریک نماید.که اهمیت دکورین در پیشگیری از آتروفی عضلات ناشی از تمرینات ورزشی در عضلات اسکلتی را نشان میدهد (43). اگرچه افزایش سطوح سرمی دکورین در مطالعه حاضر نیز محتمل است اما مقادیر سرمی این مایوکاین در این پژوهش اندازهگیری نشده است. تحریک این عوامل توسط دکورین میتواند بخشی از مسیر تاثیرگذاری مثبت ورزشی در رشد عضلانی باشد.
نتیجهگیری
بهنظر میرسد تمرین ورزشی بهصورت مقاومتی نقش مهمی در تنظیم افزایشی بیان مایوکاین¬های مختلف شامل ماسلین، آپلین و دکورین در عضله اسکلتی داشته باشد. از این رو میتوان چنین برداشت کرد که تاثیرات مثبت تمرینات مقاومتی بر عضله اسکلتی و دیگر اندامها، از جمله حفظ هموستاز انرژی در بخشی، ناشی از تنظیم افزایشی بیان این مایوکاینها است.
سپاسگزاری
این مقاله مستخرج از رساله دوره دکتری رشته فیزیولوژی ورزشی میباشد. محققین بدینوسیله از زحمات تمام کسانی که ما را در این پروژه یاری رساندند تقدیر و تشکر میکنند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد اسلامشهر تایید شده است. (کد اخلاق IR.IAU.PIAU.REC.1400.000)
مشارکت نویسندگان
آقای دکترکاظمزاده و آقای دکترشیروانی در ایده پژوهشی، طراحی مطالعه، نوشتن نسخه اولیه و مراحل اجرای تمرین و جمعآوری، تفسیر دادهها و ویرایش اولیه و نهایی مقاله مشارکت داشتند. خانم دکتر میرزایان و آقای دکتر صداقتی در ایده پژوهشی، طراحی مطالعه و هم چنین اصلاحات و بازبینی متن از لحاظ محتوای علمی و ویرایش نهایی مقاله قبل از انتشار بر عهده داشتند.
استرس مکانیکی و متابولیک ناشی از انقباضهای مکرر فیبرهای عضلانی، باعث اختلال در سارکولما و ماتریکس خارج سلولی، تورم میتوکندری، گشاد شدن سیستم لوله عرضی، افزایش التهاب و در نهایت تخریب هموستاز عضله می شود (1). علاوه بر این، تغییرات در بیش از 650 مایوکاین در پاسخ به انقباض و تمایز عضلانی، با اقدامات اتوکرین (Autocrine)، پاراکرین (Paracrine) و اندوکرین (Endocrine) مشاهده شده است (2،3). منبع سلولی مایوکاینها شامل میوسیتها، سلولهای ماهوارهای، سلولهای اندوتلیال، ماکروفاژها و فیبروبلاستها هستند (4). بسیاری از این مایوکاینها عملکردهای بیولوژیکی پاراکرینی در سنتز یا تخریب پروتئین ماهیچهها، تکثیر و تمایز میوبلاستها، فعالسازی سلولهای ماهوارهای، سازماندهی و بازسازی ماتریکسخارج سلولی و همچنین تعدیل تحلیل، ترمیم و بازسازی عضلات را دارند (3،5). این در حالی است که مایوکاینها با تاثیرات اندوکرین بر بافت های دور دست متابولیکی تاثیرات مثبت گذاشته و میتوانند یک هدف درمانی در بیماریهای مرتبط با سبک زندگی باشند (6). ماسلین یک مایوکاین ناشی از ورزش است، که ابتدا در سال 2003 به عنوان یک پپتید مشتق از استخوان (استئوکرین) شناسایی شد، با این وجود این مایوکاین در عضله اسکلتی بیش از 10 برابر بیشتر از استخوان، بافت چرب قهوهای، بیضه و طحال بیان میشود (7). دامنه C ترمینال این مایوکین مشابه با پپتیدهای ناتریورتیک (NPs) است. لذا بر بافتهای قلب و عضله اسکلتی تاثیرگذار است (8). بیان شده که ماسلین در نارسایی قلبی پس از انفارکتوس میوکارد (9)، تعدیل رشد استخوان موش و همچنین در کنترل اندازه ماهیچههای اسکلتی نیز نقش دارد (10). کاسونی و همکاران در رابطه با آثار ورزش بر این مایوکاین بیان کردند که ماسلین افزایش یافته با تمرین ورزشی هوازی، آتروفی عضلانی را در طول کاشکسی ناشی از سرطان در نمونه حیوانی به تاخیر میاندازد (11). سابوتینا و همکاران نیز بیان کردند که ماسلین یک مایوکاین تحریک شده با فعالیت بدنی است که استقامت عضلانی را افزایش میدهد (12). یو و همکاران نشان دادند که انجام 8 هفته تمرین شنا متابولیسم لیپید و حساسیت به انسولین را در موشهایی که از رژیم غذایی پرچرب تغذیه کرده بودند، با تنظیم ناقل گلوکز (GLUT4) و بیان ماسلین بهبود بخشید (13). شیمورا و همکاران نیز بیان کردند که کاهش تولید ماسلین مشتق از عضله دوقلویی توسط تمرینات مقاومتی مزمن (8 هفته، سه روز در هفته) ممکن است در بهبود مقاومت به انسولین در موشهای مبتلا به دیابت نوع 2 نقش داشته باشد (14). تحیقات محدودی نقش تمرین مقاومتی بر این مایوکاین را بررسی کردهاند. آپلین یک پپتید درون زا است که به عنوان لیگاند گیرنده APJ جفت شده با پروتئین G شناسایی شده است. آپلین متعلق به خانواده آدیپوکینها می باشد. آدیپوکاینها واسطههای زیست فعالی هستند که توسط بافت چربی آزاد میشوند. آپلین همچنین به مقدار زیادی از بافت عضلانی بهویژه با افزایش انقباض، ترشح و وارد جریان خون میشود (15). توزیع گسترده بافتی آپلین و گیرنده آن نشان میدهد که این فاکتور میتواند در بسیاری از فرآیندهای فیزیولوژیکی از جمله تنظیم فشارخون، هموستاز مایعات بدن، پاسخ استرسی غدد درونریز، انقباض قلبی، رگزایی و متابولیسم انرژی نقش داشته باشد (15). علاوه بر این، این پپتید در فرآیندهای پاتولوژیک مانند نارسایی قلبی، چاقی، دیابت و سرطان شرکت میکند (16). با این وجود در شرایط فیزیولوژیک تاثیرات مفیدی میتواند داشته باشد. نشان داده شده که سطح آپلین و IL-15 با انجام تمرینات ورزشی منظم توسط انسان و جوندگان افزایش مییابد (17). آپلین، پروتئینکیناز فعال شده باAMP (Adenosine monophosphate) را فعال میکند، بنابراین حساسیت به انسولین را از طریق افزایش جذب گلوکز در عضله اسکلتی بهبود میبخشد، این فاکتور همچنین بیوژنز میتوکندری، اتوفاژی و مسیرهای ضد التهابی را در میوفیبریلها ترویج میدهد (17). مطالعات در رابطه با تغییرات آپلین در تمرین ورزشی ضد و نقیض است. جانگ و همکاران نشان دادند که 8 هفته تمرین هوازی و مقاومتی در نمونه انسانی چاق تغییرات مثبت و معنیداری را در سطح آپلین 12 ایجاد کرد (18). مالکانه و همکاران نشان دادند که هشت هفته تمرین مقاومتی دایرهای و مصرف مکمل اسپیرولینا می تواند منجر به کاهش وزن و سطوح آپلین و FBS و همچنین افزایش غلظت آدیپولین و گرلین در مردان دارای اضافه وزن و چاق شود (19). با این وجود این فاکتور نیز همانند سایر فاکتورها تحت شرایط فیزیولوژیک و پاتولوژیک اعمال متنوعی دارد. دکورین نیز بخشی از ماتریکس خارج سلولی است و توسط عضله اسکلتی ترشح میشود. به بیان دیگر دکورین به عنوان یک پروتئوگلیکان کوچک غنی از لوسین شناخته می شود (20). مشخص شده است که بیان دکورین در بیماران مبتلا به بیماری فیبروپرولیفراتیو، از جمله بیماری انسدادی مزمن ریه، گلومرولوسکلروزیس سگمنتال کانونی و لوپوس اریتماتوز سیستمیک کاهش مییابد (21). دکورین همچنین در کنترل فیبروز کبدی نقش دارد (22). روند بهبودی این فاکتور با مهار فعالیت زیستیTGF-β و القای بیان ماتریکس متالوپروتئیناز کلاژناز-1 میباشد (22،23). علاوه بر این، اخیرا گزارش شده است که دکورین با مهار مایوستاتین، به عنوان تنظیم کننده منفی سنتز پروتئین عضلانی، هیپرتروفی فیبر عضلانی را افزایش می دهد (20). کامزلیتر و همکاران بیان کردند که دکورین با انقباض ناشی از تمرین ورزشی تنظیم می شود و در هیپرتروفی عضلانی نیز نقش دارد (20). بوگرا و همکاران نشان دادند که انجام تمرین مقاومتی با محدودیت جریان خون تاثیرات قابل توجی بر برخی فاکتورهای ضد التهابی و دکورین ندارد (24). با این وجود با توجه به اینکه ترشح و بیان بسیاری از مایوکاینها بوسیله انواع خاصی از فعالیتهای بدنی با شدتهای متفاوت در نوع خاصی از تارهای عضلانی در عضله اسکلتی دقیقا مشخص نشده است و ناشناخته میباشد. حتی گزارشهای نتایج برخی تحقیقات در زمینه ترشح و بیان مایوکاینهای هدف (ماسلین، دکورین، آپلین) ضمن اینکه اندک میباشد، در برخی مواقع ضد و نقیض نیز میباشد. بر این اساس، گسترش درک ما در مورد اینکه کدام یک از روش-های تمرینی میتوانند در ترشح و بویژه بیان مایوکاینهای خاص در عضله نقش داشته باشند، میتواند در تنظیم سوخت و ساز، تولید و هموستاز انرژی در بدن موثر بوده و در پیشگیری یا درمان برخی از بیماریهای خاص یا داروهای مبتنی بر مایوکاینها نیز میتواند مفید و موثر باشد، بنابراین بررسی بیشتر در این زمینه ضروری به نظر می رسد. اهمیت و ضرورت انجام پژوهشهای جدید در این راستا را دو چندان کرده است. لذا هدف از مطالعه حاضر بررسی تاثیر چهار هفته تمرین مقاومتی بر بیان ژن مایوکاینهای ماسلین، آپلین و دکورین در عضله سولئوس موشهای صحرایی نر نژاد ویستار میباشد.
روش بررسی
حیوان: تحقیق حاضر از نوع بنیادی و تجربی می باشد. این پژوهش به روش آزمایشگاهی و کنترل شده انجام شد با عنایت به اینکه از لحاظ محدودیت های مکانی، اخلاقی و زمانی دسترسی به آزمودنی های انسان مقدور نبوده است لذا از آزمودنیهای حیوان (موش صحرایی نر نژاد ویستار) استفاده شد. در ابتدا به کسب مجوزهای لازم اقدام شد. جامعه آماری شامل موشهای صحرایی نرنژاد ویستار با سن تقریبی 8 هفته و با محدوده وزن 220-200 گرم که از مرکز پرورش و تکثیر حیوانات آزمایشگاهی پاستور (تهران، ایران) تهیه و سپس به آزمایشگاه حیوانی مرکز فیزیولوژی ورزشی دانشگاه علوم پزشکی بقیه اله منتقل شدند. و بهصورت تصادفی و به تعداد مساوی (شامل هشت سر موش صحرایی نر نژاد ویستار) به دو گروه کنترل سالم (Con) بدون هیچ گونه فعالیتی و گروه تمرین مقاومتی (RT) تقسیم شدند. و بهصورت جداگانه در قفسهای پلی کربنات شفاف (هر 4 موش در یک قفس) تحت شرایط آزمایشگاهی2± 22 درجه سانتیگراد و رطوبت نسبی40±10 درصد و چرخه روشنایی- تاریکی 12:12 ساعت نگهداری شدند. غذای استاندارد پلت و آب بهصورت آزاد در اختیار موشها قرار داشت. حجم نمونه با نرمافزارG POWER بر اساس روش آماری تحلیل واریانس و سطح خطای آلفای 0/05 و توان 0/85 برابر با 16 موش تعیین شد.
تمرین مقاومتی: گروه تمرین مقاومتی ابتدا به مدت یک هفته قبل از اجرای پروتکل تمرینی، با نحوه بالا رفتن از نردبان آشنا شدند. برنامه تمرینی شامل بالا رفتن از یک نردبان به ابعاد 18*100 سانتی متر با دو سانتیمتر فاصله بین پلهها، یک محفظه استراحت در قسمت بالای آن، با ارتفاع 1 متر، با شیب 85 درجه با بستن ابزار وزنه بدون گذاشتن هیچ گونه وزنه ای به قاعده دم موش بود. این پروتکل در مدت 4 هفته با شدت تمرین (وزنه جابجا شده) در هفته اول تا چهارم به ترتیب، 30، 50، 80 و 100 درصد وزن بدن (اصل اضافه بار) با بستن وزنه به قاعده دم موشها در 3 ست با 4 تکرار بصورت بالا رفتن از نردبان اجرا شد (25). درجدول 1 برنامه تمرین مقاومتی قرار داده شده است. استخراج RNA و ساخت cDNA: جهت استخراج RNA total به نسبت 1 به 10 در Isol RNA- reagent Lysisمطابق با دستور کار کیت (کیاژن، آلمان) هموژن شد. به منظور برداشتن اجزای پروتئینی محصول حاصل درC ْ4, 10 دقیقه با دور 12000 سانتریفیوژ گردید. سوپرناتانت برداشته و با نسبت 1 به 5/ 0 با Isol اولیه با کلروفورم مخلوط گردید. محصول درC ْ4، 15دقیقه با دور 12000 سانتریفیوژ و بخش معدنی و آبی از هم جدا شدند، بخش محتوی RNA برداشته و با نسبت 1به 0/5 با ایزوپروپانل مخلوط و به مدت 10 دقیقه در دمای اتاق رها و سپس درC ْ4، 10دقیقه با دور 12000سانتریفیوژ شد. پلیت حاوی RNA در µL 20 آب Free-RNAs حل شد. غلظ RNA با استفاده از دستگاه nono dropسنجیده و نسبت 260 به 280 بین 1/8 تا 2 به عنوان تخلیص مطلوب تعریف گردید. پس از استخراج RNA با خلوص و غلظت بالا از تمامی نمونههای مورد مطالعه، مراحل سنتزcDNA طبق پروتکل شرکت سازنده (Fermentas, USA) انجام شد و سپس cDNA سنتز شده جهت انجام واکنش رونویسی معکوس مورد استفاده قرارگرفت.
طراحی پرایمرها و بررسی بیان ژنهای ماسلین، آپلین و دکورین: وزنکشی موشهای صحرایی بهصورت هفتگی انجام شد. 48 ساعت پس از آخرین جلسه تمرین و نگهداری، موشها به آزمایشگاه برده شدند و با ترکیبی از زایلازین (2 درصد و با دوز 10 میلیگرم بر کیلوگرم) و کتامین (10 درصد با دوز 50 میلیگرم بر کیلوگرم) بیهوش شدند. با جراحی عضله نعلی موشها جهت بررسی بیان ژنها برداشته شدند. پس از شستشو در ازت مایع فریز و در دمای 80- درجه نگهداری شدند. برای آمادهسازی پرایمرها از آب مقطر حاوی پرایمر لیوفیلیزه10 میکرولیتر، پرایمر جلویی (Primer Forward) و پرایمر معکوس (Primer Revers) 5/0 میکرولیتر، cDNA 1 و آب دپس (DEPC Water) 8 میکرولیتر استفاده شد. برای بیان ژن با تکنیک q RT-PCR با استفاده از محلول کیازول، RNA کل سلولها طبق پروتکل سیناژن استخراج گردید. کیفیت RNA های استخراج شده با دستگاه اسپکترفتومتری مورد ارزیابی قرار گرفت. جهت تهیه cDNA تک رشتهای از پرایمرOligo dt و آنزیم نسخهبرداری معکوس براساس پروتکل مربوطه انجام شد. هر واکنش PCR در دستگاه ABI Step One طبق پروتکل شرکت سازنده انجام گرفت. چرخههای واکنشی Real-Time PCR برای ژنهای ماسلین، آپلین و دکورین با سه دمای 94، 60 و 72 درجه سانتیگراد انجام شد. نمودار ذوب (Melting) جهت بررسی صحت واکنشهای PCR انجام شد. از GAPDH (Glyceraldehyde-3-phosphate dehydrogenase) به عنوان ژن مرجع ماسلین، آپلین و دکورین استفاده گردید. میزان بیان ژنهای کنترل و تمرین بهصورت توامان با هم اندازهگیری شد. جهت کمیسازی بیانApelin mRNA ، Musclin mRNA وDecorin mRNA از روش ΔΔCt مقایسهای استفاده گردید. در این روش ΔΔCt از رابطه زیر استفاده گردید:
ΔΔCt = ΔCt sample – ΔCt control
در این رابطه ΔCt sample، اختلاف میان سیکلهای آستانه ژن مورد نظر و خانهنگهدار در نمونه مورد آزمایش (بیمار) و ΔCt control، اختلاف میان سیکلهای آستانه ژن مورد نظر و خانهنگهدار در نمونه کنترل (سالم) میباشد. عدد حاصل از آن، در رابطه 2-ΔΔCt قرار داده میشود که نتیجه بهدست آمده اختلاف میزان بیان در نمونه کنترل و مورد آزمایش را نشان میدهد.
جدول 1: پروتکل تمرین مقاومتی

جدول 2: توالی پرایمرهای مورد استفاده برای ژن های ماسلین، آپلین و دکورین و ژن مرجع در Real-time

GAPDH: Glyceraldehyde-3-phosphate dehydrogenase
تجزیه و تحلیل آماری
از آزمون کولموگروف اسمیرنف برای بررسی نرمال بودن توزیع دادهها استفاده شد. سطح آمار توصیفی از شاخصهایی نظیر میانگین، انحراف معیار، جداول توزیع فراوانی و سپس در بخش آمار استنباطی برای آنالیز دادها از تی مستقل استفاده گردید. سطح آلفای کوچکتر از 0/05 به عنوان سطح معنیداری در نظر گرفته شد. تجزیه و تحلیل دادهها با استفاده از نرمافزار آماری SPSS version 16 انجام گرفت.
نتایج
تغییرات بیان ژن ماسلین، دکورین و اپلین عضله سولئوس موشهای صحرایی نر نژاد ویستار دو گروه کنترل و تمرین مقاومتی بهصورت انحراف معیار± میانگین در جدول 3 نشان داده شده است.
بیان ژن ماسلین: تغییرات بیان ژن ماسلین عضله سولئوس موشهای صحرایی دو گروه کنترل و تمرین مقاومتی در نمودار 1 نشان داده شده است. نتایج آزمون تی مستقل نشان داد که بین گروه کنترل و تمرین مقاومتی تفاوت معنیداری در بیان ژن ماسلین وجود دارد (t=4.664, df=14, p=0.0004). به بیان دیگر تمرین مقاومتی بهطور معنیداری سبب افزایش بیان ژن ماسلین در عضله سولئوس شد (نمودار 1).
بیان ژن آپلین: تغییرات بیان ژن آپلین عضله سولئوس موشهای صحرایی دو گروه کنترل و تمرین مقاومتی در نمودار 2 نشان داده شده است. همانند ماسلین نتایج آزمون تی مستقل نشان داد که بین گروه کنترل و تمرین مقاومتی تفاوت معنی داری در بیان ژن آپلین وجود دارد (t=10.23, df=14, p<0.0001). به بیان دیگر تمرین مقاومتی بهطور معنیداری سبب افزایش بیان ژن آپلین در عضله سولئوس شد (نمودار 2). بیان ژن دکورین: تغییرات بیان ژن دکورین عضله سولئوس موشهای صحرایی دو گروه کنترل و تمرین مقاومتی در نمودار 3 نشان داده شده است. همانند دو ژن ماسلین و آپلین، نتایج آزمون تی مستقل نشان داد که بین گروه کنترل و تمرین مقاومتی تفاوت معنیداری در بیان ژن دکورین وجود دارد (t=3.100, df=14, p=0.0078). به بیان دیگر تمرین مقاومتی بهطور معنیداری سبب افزایش بیان ژن دکورین در عضله سولئوس شد (نمودار 3).
جدول 3: میزان بیان ژن ماسلین، دکورین و آپلین درگروههای پژوهش (انحراف معیار± میانگین).

*تفاوت معنیدار

نمودار1: سطوح بیان ژن ماسلین در عضله سولئوس موشهای نر نژاد ویستار گروه کنترل و گروه تمرین مقاومتی.
دادهها بهصورتانحراف معیار± میانگین نشان داده شده است. سطح معنی داری p<0.05 در نظر گرفته شده است. # نشانه تفاوت معنیدار با گروه کنترل.

نمودار2: سطوح بیان ژن آپلین در عضله سولئوس موشهای نر نژاد ویستار گروه کنترل و گروه تمرین مقاومتی.
دادهها بهصورت انحراف معیار± میانگین نشان داده شده است. سطح معنی داری p<0.05 در نظر گرفته شده است. # نشانه تفاوت معنیدار با گروه کنترل.

نمودار3: سطوح بیان ژن آپلین در عضله سولئوس موشهای نر نژاد ویستار گروه کنترل و گروه تمرین مقاومتی.
دادهها بهصورت انحراف معیار± میانگین نشان داده شده است. سطح معنیداری p<0.05 در نظر گرفته شده است. # نشانه تفاوت معنیدار با گروه کنترل
بحث
در سه دهه گذشته، روشها و تجهیزات مختلفی برای تمرین مقاومتی حیوانات توسعه داده شده است (26). نتو و همکاران نشان داد که بسیاری از محققان از تجهیزات نردبان برای تمرین مقاومتی استفاده کردهاند و این نوع تمرین در نمونه حیوانی ممکن است پاسخ بیولوژیکی مشابه تمرینات قدرتی انسان را نشاندهد (27). در این نوع تمرین مقاومتی برای نمونه حیوانی، ماهیچههای سولئوس و پلانتاریس بهطور گسترده مورد تحقیق قرار گرفته اند. این ماهیچهها به میزان زیادی در حرکت بالا رفتن از نردبان به کار گرفته میشوند (27،28). از سوی دیگر، عضلات اسکلتی مانند EDL و تیبیالیس انتریور در این نوع تمرینات حرکت دهنده اصلی نیستند. با اینحال، برخی از مطالعات هیپرتروفی هر دو عضله سولئوس و EDL را گزارش کردند (29). این واقعیت جالب است، زیرا عضله سولئوس یک محرک اصلی در تمرین نردبان است. در حالیکه برای EDL اینگونه نیست. هنگامی که خم شدن کف پا بهطور واضح از طریق فعالیت بالا رفتن نردبان انجام شود فعالیت سولئوس شروع میشود. این در حالی است که در ادامه حرکت بالا رفتن ممکن است باعث استرس اضافی به عضلات ثانویه مانندEDL شود (29). با این وجود، عضلات اندام فوقانی نیز در طول حرکت بالا رفتن به کار گرفته میشوند که مقالات بسیار کمی در مورد تجزیه و تحلیل این عضلات منتشر شده است. لذا در این مطالعه به مانند بسیاری از مقالات، عضله سولئوس مورد بررسی قرار گرفت. نتایج مطالعه حاضر نشان داد که 4 هفته تمرین مقاومتی افزایش معنیداری را در بیان ژن ماسلین در عضله کند انقباض سولئوس ایجاد کرد.که بر اهمیت تنظیم افزایشی این مایوکاین در القای تاثیرات مثبت تمرین ورزشی بر بافت عضلانی تاکید دارد (12). گرچه نتایج برخی پژوهشها در رابطه با ترشح و بیان ماسلین تحت تاثیر تمرینات ورزشی ضد و نقیض میباشد، ضمنا اطلاعات زیادی نیز در دست نیست. سوبوتینا و همکاران در پژوهشی بر روی موشهای صحرایی گزارشکردند که پنج روز تمرین هوازی روی تردمیل، در سربالایی (45 دقیقه در هر جلسه) در موشها، به افزایش معنیدار بیان ماسلین در عضله دوقلو منجر شده است. بهنظر میرسد از آنجاییکه در دویدنهای سربالایی نمونه حیوانی، فشار بالاتری به عضلات اندام تحتانی وارد میشود میتواند مانند تمرین مقاومتی بافت عضله سولئوس را تحتتاثیر قرار دهد. در این پژوهش افزایش بیان عضلانی ماسلین با افزایش سطوح این مایوکاین در پلاسما همراه بود (12). این محققان عنوان کردند که ماسلین با افزایش PGC-1a وابسته به ANP و افزایش بیوژنز میتوکندری میتواند به بهبود استقامت جسمانی منجر گردد که اهمیت ماسلین را در بهبود عملکرد هوازی و القای سازگاری¬های ناشی از تمرین هوازی در عضلات اسکلتی را نشان میدهد (12). متاسفانه در مطالعه حاضر تغییرات ماسلین گردش خون بررسی نشده است، هرچند باتوجه به افزایش بیان عضلانی آن، افزایش سطوح سرمی ماسلین نیز دور از انتظار نیست. در مطالعه دیگری ری و همکاران بر روی موش¬های سرطانی با تایید افزایش بیان ژن ماسلین با تمرین هوازی در عضله دوقلو عنوان کردند که افزایش بیان این مایوکاین ناشی از تحریک PGC-1α است که افزایش بیان آن نیز در بافت عضلانی گروه تمرین کرده نشان داده شد (30).که متاسفانه بیان ژن PGC-1α در مطالعه حاضر مورد بررسی قرار نگرفته است. نتایج این تحقیقات با یافتههای پژوهش حاضر همسو میباشد. از طرفی، زو و همکاران کاهش سطوح ماسلین را بعد از تمرینات تناوبی شدید در بیماران مبتلا به سندرم متابولیک بهعنوان یکی از مسیرهای بالقوه بهبود مقاومت به انسولین عنوان کردهاند (31). در پژوهش دیگری شیمورا و همکاران بیان کردند که کاهش بیان ماسلین مشتق از عضله دوقلویی توسط تمرینات مقاومتی مزمن (8 هفته، سه روز در هفته) ممکن است از طریق فسفوریلاسیون Akt وافزایشGLUT-4 عضلانی در بهبود مقاومت به انسولین موشهای مبتلا به دیابت نوع 2 نقش داشته باشد (14). که نتایج این تحقیقات با یافتههای پژوهش حاضر ناهمسو می باشد. اختلاف در نتایج مطالعات میتواند به دلیل تفاوت درنوع حیوان (سالم و دیابتی)، عضله انتخابی (سولئوس و دوقلو)، شدت، مدت و حجم پروتکل تمرینی مورد استفاده در پژوهشها عنوان کرد. با توجه به نتایج تحقیقات باید توجه داشت که افزایش ماسلین عضله در شرایط فیزیولوژیک تمرین ورزشی و پاتولوژیک، پاسخهای متفاوتی را القا میکند. و تنظیم کاهشی بیان و سطوح ماسلین در نمونههای پاتولوژیک به نظر میرسد یک سازکار جبرانی برای حفظ عملکرد و یک مکانیسم هموستازی در بدن باشد که نیازمند بررسی و مطالعه بیشتر است (31). همانند ماسلین، مقادیر آپلین نیز با انجام 4 هفته تمرین مقاومتی افزایش معنیداری نسبت به گروه کنترل نشان داد. تعدادی از مطالعات در مورد نقش پروتئین جدید آپلین، شناسایی شده در سال 1998، در بهبود عملکرد و ساختار عضلانی در اندامهای مختلف انسان، و همچنین در مورد چگونگی درگیر شدن آن در فرآیندهای پاتولوژیک بحث کردهاند. همانند ماسلین، آپلین نیز میتواند در شرایط فیزیولوژیک و پاتولوژیک پاسخهای مختلفی را القا کند. همچنین میتواند در اندامهای مختلف از جمله، قلب، عروق، بویژه سلولهای اندوتلیال، بافت چربی و سلولهای عضلانی بیان شود. و آثار خود را بهصورت اتوکرین (Autocrine) بر فیزیولوژی عضله، اندوکرین (Endocrine) و پاراکرین (Paracrine) بر دیگر سلولها و بافتها اعمال کند (2،3). و به نظر میرسد آپلین نقش کلیدی در افزایش حساسیت به انسولین و تنظیم تون عروق و عملکرد قلب و عروق دارد (32). مطالعات نشان دادند که آپلین بیان شده در اثر انقباضات عضلانی پس از اتصال به گیرنده خود (APJ)، مسیرهای سیگنالینگ PI3K/AKT را فعال کرده و از این طریق میتواند در بهبود مصرف گلوکز و افزایش حساسیت به انسولین نقش داشته باشد (33). بس پتین و همکاران در پژوهشی بر روی مردان چاق گزارش کردند که هشت هفته تمرین استقامتی باعث افزایش معنیدار APJ mRNA آپلین در عضله پهن جانبی شده است اما در سطح پلاسما، افزایشی مشاهده نشده است (34). این محققان عنوان کردهاند که آپلین پس از اتصال به گیرنده خود (APJ) و فعالکردن مسیر AMPK وکلسیم میتواند به بهبود مقاومت به انسولین کمک کند (34). در مطالعه دیگری، جی و همکاران بر روی موشهای چاق با تایید افزایش بیان و پروتئین آپلین و گیرنده آن در بافت عضلانی، یکی از سازوکارهای احتمالی آنرا، افزایش همزمان در بیان HIF1و کاهش وزن بدن موشها عنوان کردند. برخی مطالعات ارتباط غلظت کم آپلین با عوارض آترواسکلروتیک را نشان داده اند (35). بنابراین، افزایش آپلین مشاهده شده پس از تمرین از این فرضیه پشتیبانی میکند که افزایش آپلین ناشی از تمرین ورزشی ممکن است به اثرات مفید تمرین ورزشی در پیشگیری از خطر بیماری قلبی عروقی نیز کمک کند. در مطالعه دیگری تاسکی و همکاران افزایش تقریباً 4 برابری سطح آپلین را پس از یک برنامه 12 هفتهای تمرین ورزشی گزارش کردند (36). افزایش آپلین بر خود بافت عضله نیز میتواند تاثیرات مثبت داشته باشد. بسیاری از مطالعات قبلی نشان داده اند که آپلین یک مایوکاین ناشی از ورزش است که می تواند یکپارچگی میوفیبرهای اسکلتی را بهبود بخشد (37،38). از آنجایی که آپلین جذب گلوکز و ظرفیت اکسیداتیو میتوکندری را در عضله اسکلتی افزایش میدهد، میتواند بر عملکرد بافت عضلانی تاثیر مثبت داشته باشد. این فاکتور همچنین متابولیسم سلولهای عضلانی و عملکرد سلولهای بنیادی را افزایش میدهد و از این رو، نقش اساسی در مهار آتروفی و یا حتی کاهش سارکوپنی دارد (39). لذا تغییرات افزایشی آپلین مطالعه حاضر با تمرین مقاومتی میتواند عملکرد و متابولیسم عضله سولئوس را تحتتاثیر قرار دهد. نتایج این تحقیقات با یافتههای پژوهش حاضر همسو میباشد. از طرفی شیبانی و همکاران کاهش سطح آپلین پلاسما بعد از تمرین هوازی در زنان چاق را به دنبال کاهش سطوح TNF گزارش کردند و علت آنرا کاهش همزمان توده چربی و وزن بدن دانستهاند (40). تناقض با یافتههای حاضر را صرف نظر از نوع و ویژگی متفاوت نمونههای مورد بررسی میتوان به جایگاه متفاوت بررسی تغییرات آپلین (بیان عضلانی به جای سطوح سرمی) مرتبط دانست. پروتئوگلیکانها اجزای ماتریکس خارج سلولی و تعدیل کننده فعالیتهای فاکتور رشد هستند (41). دکورین به عنوان عامل ضد مایوستاتین شناخته شده است که قویترین مهار کننده رشد عضلانی میباشد که از طریق مسدود کردن مسیرAKT/FoXo یا فعال کردن مسیر سیگنالینگ Smad2,3/Smad4 در داخل هسته سلول بر روی ژنهای هدف تاثیر گذاشته و میتواند در افزایش یا کاهش توده عضلات موثر باشد (41). کیشیوکا و همکاران نشان داد که دکورین با سرکوب فعالیت مایوستاتین، تکثیر و تمایز مایوبلاستهای C2C12 را افزایش میدهد (42). از آنجا که ورزش باعث رشد عضلانی میشود، نتایج مطالعه حاضر نیز موید افزایش رشد عضله با افزایش دکورین پس از تمرین مقاومتی میباشد. مطالعات کمی غلظت دکورین را در بافت عضله پس از تمرین مقاومتی بررسی کردهاند. نتایج مطالعه حاضر با نتایج منتشر شده توسط کانزلیتر و همکاران نیز مطابقت دارد (20). هر دو آزمایش افزایش معنیدار دکورین را با انقباض عضلانی گزارش کردند که پس از تمرین، اندازهگیری شد. کانزلیتر و همکاران از هفت تمرین طراحی شده برای کل بدن استفاده کردند. هر تمرین با سه ست از هشت تکرار و تقریباً 1RM80٪-75٪ انجام شد (20). در مقابل، این پروژه تنها از یک تمرین (بالا رفتن نردبان) در نمونه حیوانی استفاده کرد. این امکان وجود دارد که تمرین مقاومتی با شدتهای مختلف در نمونه انسانی و حیوانی ممکن است آزادسازی دکورین مشابهی را ایجاد کند. علاوه بر این، کانزلیتر و همکاران یک همبستگی بین آزادسازی دکورین و وزن کل بدن در حرکت پرس پا مشاهده کردند (20). وزن بدن نیز به عنوان وزنه میتواند با انقباض بیشتر، ترشح دکورین را تحت تاثیر قرار دهد. تمام این اتفاقات و افزایش دکورین عامل مهمی در جهت افزایش هایپرترفی عضلانی هستند. که از طریق کاهش لیپازهای یوبیکوتین، آتروژین و MuRF1 و افزایش myod1 و فولستاتین اتفاق میافتد (20). هم راستا با مطالعه حاضر در مطالعه دیگری فرگوسون و همکاران افزایش معنیدار بیان ژن و سطوح دکورین را در هر دو نمونه (موشها و نمونههای انسانی) با تمرین هوازی، نشان دادند. این محققان عنوان کردند که دکورین با مهار مایوستاتین و اکتیوین و همچنین افزایش myod1 و فولستاتین میتواند منجر به تکثیر سلولهای ماهوارهای شده و نهایتاً هایپرتروفی عضلانی را تحریک نماید.که اهمیت دکورین در پیشگیری از آتروفی عضلات ناشی از تمرینات ورزشی در عضلات اسکلتی را نشان میدهد (43). اگرچه افزایش سطوح سرمی دکورین در مطالعه حاضر نیز محتمل است اما مقادیر سرمی این مایوکاین در این پژوهش اندازهگیری نشده است. تحریک این عوامل توسط دکورین میتواند بخشی از مسیر تاثیرگذاری مثبت ورزشی در رشد عضلانی باشد.
نتیجهگیری
بهنظر میرسد تمرین ورزشی بهصورت مقاومتی نقش مهمی در تنظیم افزایشی بیان مایوکاین¬های مختلف شامل ماسلین، آپلین و دکورین در عضله اسکلتی داشته باشد. از این رو میتوان چنین برداشت کرد که تاثیرات مثبت تمرینات مقاومتی بر عضله اسکلتی و دیگر اندامها، از جمله حفظ هموستاز انرژی در بخشی، ناشی از تنظیم افزایشی بیان این مایوکاینها است.
سپاسگزاری
این مقاله مستخرج از رساله دوره دکتری رشته فیزیولوژی ورزشی میباشد. محققین بدینوسیله از زحمات تمام کسانی که ما را در این پروژه یاری رساندند تقدیر و تشکر میکنند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد اسلامشهر تایید شده است. (کد اخلاق IR.IAU.PIAU.REC.1400.000)
مشارکت نویسندگان
آقای دکترکاظمزاده و آقای دکترشیروانی در ایده پژوهشی، طراحی مطالعه، نوشتن نسخه اولیه و مراحل اجرای تمرین و جمعآوری، تفسیر دادهها و ویرایش اولیه و نهایی مقاله مشارکت داشتند. خانم دکتر میرزایان و آقای دکتر صداقتی در ایده پژوهشی، طراحی مطالعه و هم چنین اصلاحات و بازبینی متن از لحاظ محتوای علمی و ویرایش نهایی مقاله قبل از انتشار بر عهده داشتند.
References:
1- Hody S, Croisier JL, Bury T, Rogister B, Leprince P. Eccentric Muscle Contractions: Risks and Benefits. Front Physiol 2019; 10: 536.
2- Bay ML, Pedersen BK. Muscle-Organ Crosstalk: Focus on Immunometabolism. Front Physiol 2020; 11: 567881.
3- Laurens C, Bergouignan A, Moro C. Exercise-Released Myokines in the Control of Energy Metabolism. Front Physiol 2020; 11:91.
4- Hoffmann C, Weigert C. Skeletal Muscle as an Endocrine Organ: The Role of Myokines in Exercise Adaptations. Cold Spring Harb Perspect Med 2017; 7(11): a029793.
5- Lee JH, Jun HS. Role of Myokines in Regulating Skeletal Muscle Mass and Function. Front Physiol 2019; 10:42.
6- Bilski J, Pinkas M, Wojcik-Grzybek D, Magierowski M, Korbut E, Mazur-Bialy A, et al. Role of Obesity, Physical Exercise, Adipose Tissue-Skeletal Muscle Crosstalk and Molecular Advances in Barrett’s Esophagus and Esophageal Adenocarcinoma. Int J Mol Sci 2022; 23(7): 3942.
7- Thomas G, Moffatt P, Salois P, Gaumond M-H, Gingras R, Godin E, et al. Osteocrin, A Novel Bone-Specific Secreted Protein that Modulates the Osteoblast Phenotype. J Biol Chem 2003; 278(50): 50563-71.
8- Potter LR, Abbey-Hosch S, Dickey DM. Natriuretic peptides, their receptors, and cyclic guanosine monophosphate-dependent signaling functions. Endocr Rev 2006; 27(1): 47-72.
9- Miyazaki T, Otani K, Chiba A, Nishimura H, Tokudome T, Takano-Watanabe H, et al. A new secretory peptide of natriuretic peptide family, osteocrin, suppresses the progression of congestive heart failure after myocardial infarction. Circ Res 2018; 122(5): 742-51.
10- Moffatt P, Thomas G, Sellin K, Bessette M-C, Lafreniere F, Akhouayri O, et al. Osteocrin is a specific ligand of the natriuretic Peptide clearance receptor that modulates bone growth. J Biol Chem 2007; 282(50): 36454-62.
11- Re Cecconi AD, Forti M, Chiappa M, Zhu Z, Zingman LV, Cervo L, et al. Musclin, a myokine induced by aerobic exercise, retards muscle atrophy during cancer cachexia in mice. Cancers 2019; 11(10): 1541.
12- Subbotina E, Sierra A, Zhu Z, Gao Z, Koganti SRK, Reyes S, et al. Musclin is an activity-stimulated myokine that enhances physical endurance. Proc Natl Acad Sci 2015; 112(52): 16042-7.
13- Yu J, Zheng J, Liu X, Feng Z, Zhang X, Cao L, et al. Exercise improved lipid metabolism and insulin sensitivity in rats fed a high-fat diet by regulating glucose transporter 4 (GLUT4) and musclin expression. Braz J Med Biol Res 2016;49.
14- Shimomura M, Horii N, Fujie S, Inoue K, Hasegawa N, Iemitsu K, et al. Decreased muscle‐derived musclin by chronic resistance exercise is associated with improved insulin resistance in rats with type 2 diabetes. Physiol Rep 2021; 9(9): e14823.
15- Bertrand C, Valet P, Castan-Laurell I. Apelin and energy metabolism. Front Physiol 2015; 6: 115.
16- Wysocka MB, Pietraszek-Gremplewicz K, Nowak D. The role of apelin in cardiovascular diseases, obesity and cancer. Front Physiol 2018; 9: 557.
17- Kwon K-S. Molecular Mechanisms of Exercise Providing Therapeutic Rationale to Counter Sarcopenia. Sarcopenia: Elsevier 2021; 159-69.
18- Jang S-H, Paik I-Y, Ryu J-H, Lee T-H, Kim D-E. Effects of Aerobic And Resistance Exercises on Circulating Apelin-12 and Apelin-36 Concentrations in Obese Middle-Aged Women: A Randomized Controlled Trial. BMC Womens Health 2019; 19(1): 1-8.
19- Mohammad M, Karim D, Mehdi M, Marziyeh S, Hadi S, Shila N. The Combinatory Effect of Spirulina Supplementation and Resistance Exercise on Plasma Contents of Adipolin, Apelin, Ghrelin, and Glucose in Overweight and Obese Men. Mediators Inflamm 2022; 2022: 9539286.
20- Kanzleiter T, Rath M, Görgens SW, Jensen J, Tangen DS, Kolnes AJ, et al. The Myokine Decorin is Regulated by Contraction and Involved in Muscle Hypertrophy. Biochem Biophys Res Commun 2014; 450(2): 1089-94.
21- Zandvoort A, Postma DS, Jonker MR, Noordhoek JA, Vos JT, van der Geld YM, et al. Altered Expression of the Smad Signalling Pathway: Implications for COPD Pathogenesis. Eur Respir J 2006; 28(3): 533-41.
22- Baghy K, Iozzo RV, Kovalszky I. Decorin–Tgfβ Axis in Hepatic Fibrosis and Cirrhosis. J Histochem Cytochem 2012; 60(4): 262-8.
23- Huttenlocher A, Werb Z, Tremble P, Huhtala P, Rosenberg L, Damsky CH. Decorin Regulates Collagenase Gene Expression in Fibroblasts Adhering to Vitronectin. Matrix Biol 1996; 15(4): 239-50.
24- Bugera EM, Duhamel TA, Peeler JD, Cornish SM. The Systemic Myokine Response of Decorin, Interleukin-6 (IL-6) and Interleukin-15 (IL-15) to an Acute Bout of Blood Flow Restricted Exercise. Eur J Appl Physiol 2018; 118(12): 2679-86.
25- Al-Jarrah M, Matalka I, Al Aseri H, Mohtaseb A, Smirnova IV, Novikova L, et al. Exercise Training Prevents Endometrial Hyperplasia and Biomarkers for Endometrial Cancer in Rat Model of Type 1 Diabetes. J Clin Med Res 2010; 2(5): 207.
26- Cholewa J, Guimarães‐Ferreira L, da Silva Teixeira T, Naimo MA, Zhi X, de Sá RBDP, et al. Basic Models Modeling Resistance Training: An Update for Basic Scientists Interested in Study Skeletal Muscle Hypertrophy. J Cell Physiol 2014; 229(9): 1148-56.
27- Neto WK, Silva WDA, Ciena AP, Anaruma CA, Gama EF. Vertical Climbing for Rodent Resistance Training: a Discussion about Training Parameters. Int J Sports Sci 2016; 6: 36-49.
28- Deschenes MR, Sherman EG, Roby MA, Glass EK, Harris MB. Effect of Resistance Training in Neuromuscular Junctions of Young and Aged Muscles Featuring Different Recruitment Patterns. J Neurosci Res 2015; 93(3): 504-13.
29- Krause Neto W, Gonçalves L, Nascimento V, Maifrino L, de Souza R, Gama E. Quantitative Morphological Analysis Revealed Muscular Hypertrophy in Different Skeletal Muscle Types Induced by Anabolic Steroid and Resistance Training in Rats. Aust J Basic Appl Sci 2013; 7(14): 591-8.
30- Re Cecconi AD, Forti M, Chiappa M, et al. Musclin, A Myokine Induced by Aerobic Exercise, Retards Muscle Atrophy during Cancer Cachexia in Mice. Cancers (Basel) 2019; 11(10): 1541.
31- Zhu S, Sun F, Li W, Cao Y, Wang C, Wang Y, et al. Apelin Stimulates Glucose Uptake through the PI3K/Akt Pathway and Improves Insulin Resistance in 3T3-L1 Adipocytes. Molecular and cellular biochemistry 2011; 353(1-2): 305-13.
32- Tatemoto K, Takayama K, Zou M-X, Kumaki I, Zhang W, Kumano K, et al. The Novel Peptide Apelin Lowers Blood Pressure Via a Nitric Oxide-Dependent Mechanism. Regulatory Peptides 2001; 99(2-3): 87-92.
33- Quazi R, Palaniswamy C, Frishman WH. The Emerging Role of Apelin in Cardiovascular Disease and Health. Cardiol Rev 2009; 17(6): 283-6.
34- Besse-Patin A, Montastier E, Vinel C, et al. Effect of Endurance Training on Skeletal Muscle Myokine Expression in Obese Men: Identification of Apelin as a Novel Myokine. Int J Obes (Lond) 2014; 38(5): 707-13.
35- Kadoglou N, Sailer N, Moumtzouoglou A. Novel markers of carotid atherosclerosis in patients with type 2 diabetes. Exp Clin Endocrin Diab 2008; 35: 661-8.
36- Tasci I, Erdem G, Ozgur G, Tapan S, Dogru T, Genc H, et al. LDL-Cholesterol Lowering Increases Plasma Apelin in Isolated Hypercholesterolemia. Atherosclerosis 2009; 204(1): 222-8.
37- Ghosh MC, Zhang D-L, Jeong SY, Kovtunovych G, Ollivierre-Wilson H, Noguchi A, et al. Deletion of Iron Regulatory Protein 1 Causes Polycythemia and Pulmonary Hypertension in Mice through Translational Derepression of HIF2α. Cell Metab 2013; 17(2): 271-81.
38- Pedersen BK, Febbraio MA. Muscle as an Endocrine Organ: Focus on Muscle-Derived Interleukin-6. Physiol Rev 2008; 88(4): 1379-406.
39- Vinel C, Lukjanenko L, Batut A, Deleruyelle S, Pradere J-P, Le Gonidec S, et al. The Exerkine Apelin Reverses Age-Associated Sarcopenia. Nat Med 2018; 24(9): 1360-71.
40- Sheibani SH, Hanachi P, Refahiat M. Effect of Aerobic Exercise on Serum Concentration of Apelin, Tnfα and Insulin in Obese Women. Iranian Journal of Basic Medical Sciences 2012: 15(6): 1196-201.
41- Miura T, Kishioka Y, Wakamatsu J-i, Hattori A, Hennebry A, Berry CJ, et al. Decorin Binds Myostatin and Modulates its Activity to Muscle Cells. Biochem Biophys Res Commun 2006; 340(2): 675-80.
42- Kishioka Y, Thomas M, Wakamatsu Ji, Hattori A, Sharma M, Kambadur R, et al. Decorin Enhances the Proliferation and Differentiation of Myogenic Cells Through Suppressing Myostatin Activity. J Cell Physiol 2008; 215(3):856-67.
43- Ferguson B. ACSM’s Guidelines for Exercise Testing and Prescription 9th Ed. 2014. The Journal of the Canadian Chiropractic Association 2014; 58(3): 328.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1402/9/24 | پذیرش: 1402/10/24 | انتشار: 1403/3/15
دریافت: 1402/9/24 | پذیرش: 1402/10/24 | انتشار: 1403/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







