دوره 31، شماره 10 - ( دی 1402 )
جلد 31 شماره 10 صفحات 7178-7169 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Asadi S, Moradkhani S. THE STUDY of SOME BIOLOGICAL ACTIVITIES of CUSCUTA CHINENSIS and ITS TWO HOSTS. JSSU 2024; 31 (10) :7169-7178
URL: http://jssu.ssu.ac.ir/article-1-6099-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6099-fa.html
اسدی سمانه، مرادخانی شیرین. مطالعه برخی فعالیت های بیولوژیک کاسکوتا چایننسیس و دو میزبان آن. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (10) :7169-7178
متن کامل [PDF 767 kb]
(520 دریافت)
| چکیده (HTML) (1460 مشاهده)
References:
1- Wang J, Tan D, Wei G, Guo Y, Chen C, Zhu H, et al. Studies on the Chemical Constituents of Cuscuta Chinensis. Chem Nat Compd 2016; 52(6): 1133-6.
2- Naseri M, Shekarchi M, Kondri BM, Mehdipour HH, Abdi L, pour Farzib M, et al. Finger Printing and Quantitative Analysis of Cuscuta Chinensis Flavonoid Contents from Different Hosts by RP-HPLC. Food Sci Nutr 2014; 5(10): 914-21.
3- Guo C, Qin L, Ma Y. et al. Integrated metabolomic and transcriptomic analyses of the parasitic plant Cuscuta japonica Choisy on host and non-host plants. BMC Plant Biol 2022; 22: 393.
4- Donnapee S, Li J, Yang X, Ge AH, Donkor PO, Gao XM, et al. Cuscuta Chinensis Lam.: A Systematic Review on Ethnopharmacology, Phytochemistry and Pharmacology of an Important Traditional Herbal Medicine. J Ethnopharmacol 2014; 157: 292-308.
5- Canivenc-Lavier M-C, Bennetau-Pelissero C. Phytoestrogens and Health Effects. Nutrients 2023; 15(2): 317.
6- Mobli M, Qaraaty M, Amin G, Haririan I, Hajimahmoodi M, Rahimi R. Scientific Evaluation of Medicinal Plants Used for the Treatment of Abnormal Uterine Bleeding by Avicenna. Arch Gynecol Obstet 2015; 292(1): 21-35.
7- Cosme P, Rodríguez AB, Espino J, Garrido M. Plant Phenolics: Bioavailability as a Key Determinant of Their Potential Health-Promoting Applications. Antioxidants 2020; 9(12):1263.
8- Banjarnahor SD, Artanti N. Antioxidant Properties of Flavonoids. Med J Indones 2014; 23(4): 239-44.
9- Shu J, Li L, Yu H, Zhang D. Fertility-Enhancing Potential of Ethanol Extract of Cuscuta Chinensis Seeds in a Rat Model of Unilateral Cryptorchidism. Trop J Pharm Res 2021; 20(5): 995-1002.
10- Brunetti C, Di Ferdinando M, Fini A, Pollastri S, Tattini M. Flavonoids as Antioxidants and Developmental Regulators: Relative Significance in Plants and Humans. Int J Mol Sci 2013; 14(2): 3540-55.
11- Barreca MM, Alessandro R, Corrado C. Effects of Flavonoids on Cancer, Cardiovascular and Neurodegenerative Diseases: Role of NF-Κb Signaling Pathway. Int J Mol Sci 2022; 24(11); 9236.
12- Yang L, Chen Q, Wang F, Zhang G. Antiosteoporotic Compounds from Seeds of Cuscuta Chinensis. J ethnopharmacol 2011; 135(2): 553-60.
13- Zeraati F, Zamani AR, Goudarzi M, Malakouti HS, Razaghi K. In Vitro Cytotoxic Effects of Cuscuta Chinensis Whole Extract on Human Acute Lymphoblastic Leukemia Cell Line. IJMS 2015; 35(4): 310-4.
14- Singh A, Kukreti R, Saso L, Kukreti S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules 2018; 24(8): 1583.
15- Bahramloo M, Moradkhani S, Sedaghat Hamedani M. Phytochemical Evaluation and Antioxidant Effects of the Essential Oil and Distillates of Nepeta Crispa Willd. JMP 2023; 22(86): 27-43.
16- Motaghed M, Nili-Ahmadabadi A, Moradkhani S. Assessment of the Antioxidative Potential of Nepeta Crispa Willd. (Lamiaceae) and its Effects on Oxidative Stability of Virgin Sunflower Oil Under Accelerated Storage Conditions. JMP 2022; 21(82): 13-27.
17- Alijaniha F, Emadi F, Naseri M, Bahaedin Z. Preliminary Phytochemical and Physicochemical Study of Cuscuta Chinensis L. Aqueous Extract Compared with Previous Studies. Complement Med J 2023; 13(1): 3-9.
18- Jafarian AB, Ghannadi A, Mohebi B. Cytotoxic Effects of Chloroform and Hydroalcoholic Extracts of Aerial Parts of Cuscuta Chinensisand Cuscuta Epithymumon Hela, HT29 and MDA-MB-468 Tumor Cells. Res Pharm Sci 2014; 9(2): 115-22.
19- Lin MK, Lee MS, Huang HC, Cheng TJ, Cheng YD, Wu CR. Cuscuta Chinensis and C. Campestris Attenuate Scopolamine-Induced Memory Deficit and Oxidative Damage in Mice. Molecules 2018; 23(12): 3060.
20- Ranjbaran P, Moradkhani S. Iron Chelating Activity of Nepeta Crispa Willd., an Endemic Plant in the West of Iran. Avicenna J Med Biochem 2022; 10(1): 65-70.
21- Yazici SO, Ozmen I, Celikoglu U, Ozcelik H, Genc H. In Vitro Antioxidant Activities of Extracts from Some Nepeta Species. Int J Health Nutr 2012; 3(1): 8-12.
22- Soleimani Shadvar M, Moradkhani S. Chemical Composition of the Essential Oils and Antioxidant Capacity Evaluation of Echinophora Platyloba DC. And Falcaria Vulgaris Bernh. Growing in Hamadan Province of Iran. JMP 2022; 21(83): 19-34.
23- Ražná K, Sawinska Z, Ivanišová E, Vukovic N, Terentjeva M, Stričík M, et al. Properties of Ginkgo Biloba L.: Antioxidant Characterization, Antimicrobial Activities, and Genomic Microrna Based Marker Fingerprints. Int J Mol Sci 2020; 21(9): 3087.
24- Tewari LM, Upreti BM, Tewari G, Singh MK, Nailwal T. Comparative in Vitro Antioxidant Activity of Extracts of Aerial Parts of Ginkgo Biloba L. From Kumaun Himalaya. World J Pharm Res 2017; 6(13): 654-66.
25- Kumar K, Amir R. The Effect of a Host on the Primary Metabolic Profiling of Cuscuta Campestris’ Main Organs, Haustoria,Stem and Flower. Plants 2021; 10(10): 2098.
26- Amin G, Kondori BM, Vazirian M, Abdi L, Arabshahi G. Evaluation of Chemical Composition and Antioxidant Activity of Total Extract of Cuscuta Chinensis Lam. Used In Traditional Medicine. Planta Med 2010; 76(12): 147.
27- Dermani FK, Saidijam M, Najafi R, Moradkhani S, Mohammadzaheri Z, Beiranvand N, et al. Cytotoxic Effects of Hydroalcoholic Extract of Cuscuta Chinensis on PC3 and MCF7 Cancer Cell Lines. Avicenna J Phytomed 2021; 11(3): 258-68.
متن کامل: (1354 مشاهده)
مقدمه
Cuscuta chinensis با نام فارسی سس، بهطور گسترده-ای در مناطق گرم و معتدل جهان مثل آفریقا، استرالیا و آسیا بهویژه آسیای جنوب شرقی وجود دارد (1،2). گیاه سس یک انگل سالیانه است که توسط دانه تولیدمثل میکند. سس هیچگونه ریشه، برگ یا کلروفیل ندارد که از طریق آنها بتواند غذای خود را تولید کند بلکه توسط زوائد خاصی به گیاه میزبان متصل شده و مواد مورد نیاز خود را از میزبان استخراج میکند (3). این جنس بیشتر حاوی ترکیبات فنولی و فلاونوئیدی مانند کامپفرول، کوئرستین، هایپروزید و آستراگالین است. از ترکیبات دیگر گیاه میتوان به پلیساکاریدها، گلیکوزیدها، روغنهای فرار و لیگنانها اشاره کردکه نقش مهمی در فعالیت فارماکولوژیکی گیاه دارند (4،5). علیرغم ماهیت انگلی گیاه سس که میتواند برای گیاهانی که پایه رشد آن هستند مخرب و آسیبزا باشد، به-عنوان یک گیاه دارویی مهم در پزشکی باستان مطرح است. مصرف خوراکی دانههای آن در طب سنتی چینی گزارش شده است. گیاه سس برای درمان بیماریهای خود ایمنی، بهبود تمایز و تکثیر سلولهای استئوبلاست، پیشگیری و درمان بیماریهای قلبی و عروقی کاربرد داشته است (1). گیاه سس کاهش قابل توجهی را در سلولهای سرطانی گردن رحم نشان داده است. دانه گیاه از طریق کاهش در سایتوکاینهای التهابی و استرس اکسیداتیو، اثر ضددردی و ضدالتهابی در مدل حیوانی نشان دادند (6). فنولها از بزرگترین گروههای متابولیت ثانویه گیاهان به شمار میآیند که در اکثر ترکیبات طبیعی یافت میشوند. همچنین در صنایع غذایی از آنها بهعنوان عطردهنده، طعمدهنده و رنگدهنده میتوان بهره گرفت. فنولها شامل چند دسته مهم مانند ترکیبات فنولی ساده، تانن، کومارین، آنتراکینون، نفتوکینون، فلاون و فلاونوئید، آنتوسیانین، لیگنان و لیگنین هستند (7). فلاونوئیدها هم به صورت آزاد و هم به فرم گلیکوزید، بزرگترین گروه فنولها هستند (8). مطالعات قبلی نشان دادهاند که فلاونوئیدهای جدا شده از بذر گیاه سس عملکرد غدد درون ریز تخمدان در موشها را بهبود بخشیدند (9). فلاونوئیدها فعالیت آنتیاکسیدانی بالایی را از خود نشان دادهاند (10). همچنین از فلاونوئیدها، اثرات درمانی دیگری از جمله جلوگیری از سقط جنین (11)، اثر ضد پوکی استخوان (12) و اثر بر سلولهای سرطانی و تومور دیده شده است (12،13). فلاونوئیدها از اجزای اصلی گیاه سس میباشند. بررسی میزان ترکیبات فلاونوئیدی سس رویش یافته بر گیاهان مختلف مانند رازیانه، گلرنگ، داتوره و ... نشان میدهد که میزان این ترکیبات باتوجه به میزبان متفاوت میباشد (2،4). از طرفی فلاونوئیدها ترکیباتی با پتانسیل بالای آنتیاکسیدانی میباشند. از آﻧﺠﺎﻳﻲکه آنتی¬اﻛﺴﻴﺪانﻫﺎ در ﭘﻴﺸﮕﻴﺮی از ﺑﺴﻴﺎری از ﺑﻴﻤﺎریﻫﺎ ﻧﻈﻴﺮ دﻳﺎﺑﺖ، ﭘﻴﺮی، اﻟﺘﻬﺎب، ﺳﺮﻃﺎن، آﺗﺮواﺳﻜﻠﺮوز، ﺻﺪﻣﺎت ﻛﺒﺪی، آﻟﺰاﻳﻤﺮ، ﭘﺎرﻛﻴﻨﺴﻮن و ﺑﻴﻤﺎریﻫﺎی ﻋﺮوق ﻛﺮوﻧﺮ ﻗﻠﺐ ﻣﺆﺛﺮ ﻣﻲباشند (14). ﻳﺎﻓﺘﻦ ﮔﻴﺎﻫﺎﻧﻲ ﺑﺎ اﺛﺮات آنتیاﻛﺴﻴﺪاﻧﻲ ﻗﻮی میﺗﻮاﻧﺪ در ﻛﺎﻫﺶ ﺳﻴﺮ ﺑﺴﻴﺎر ﺑﻴﻤﺎریها میتوانند ﻣﺆﺛﺮ ﺑﺎﺷﺪ. گیاه بادرنجبویه با نام علمی Melissa officinalis متعلق به خانواده نعناعیان و گیاه خارشتر با نام علمی Alhagi murarum از خانواده کاسنی است. با توجه به ماهیت گیاه انگلی سس، کاشت و پرورش آن برروی بعضی پایهها مشکل میباشد. با توجه به اینکه برروی سس رویش یافته بر روی پایههای بادرنجبویه و خارشتر مطالعاتی در این خصوص صورت نگرفته، در این مطالعه ابتدا محتوای تام فنولی و فلاونوئیدی گیاه سس و دو گیاه میزبان و سپس فعالیت آنتیاکسیدانی آنها به دو روش Ferric Reducing Antioxidant Power Assay (FRAP) و 2,2-Diphenyl-1-picrylhydrazyl (DPPH) مورد ارزیابی قرار گرفت.
روشبررسی
مواد شیمیایی و معرف¬ها: پودر DPPH، معرف آلومینیوم کلراید، سدیم استات، پودر TPTZ، سولفات آهن هفت آبه، متانول، اتانول، روتین، پودر آسکوربیک اسید فریک کلراید 6 آبه، معرف فولین - سیوکالتئو تولید شرکت مرک آلمان خریداری شد. سدیم بیکربنات، استیک انیدرید، اسید سولفوریک، استیک اسید گلاسیال از شرکت پارس شیمی ایران تهیه شدند. اسید کلریدیک نیز از شرکت کیان کاوه ایران خریداری شد.
دستگاه¬ها: دستگاه های مورد استفاده به این شرح میباشند: دستگاه الایزا مارک synergy HDX (ساخت آلمان)، دستگاه روتاری مارک Laborta 4003 control-Heidolph (ساخت شرکت Heidolph آلمان)، ترازوی دیجیتالی مارکSartorius CPA2245 (ساخت شرکت Sartorius آلمان)، بن ماری (ساخت شرکت Schutzart آلمان)، دستگاه فریز درایر (Operon Korea)، دستگاه سونیکاتور مارک Bandelin (ساخت شرکت فراز طب تجهیزات ایران).
تهیه و جمعآوری گیاه: گیاهان انگلی سس رویش یافته روی بادرنجبویه و خارشتر (به ترتیب: سس بادرنجبویه و سس خارشتر) به همراه دو پایهای که روی آن رشد میکند (گیاه بادرنجبویه و خارشتر) در مجموعه تحقیقاتی گیاهان دارویی دانشگاه ... کاشت و برداشت شد. همه گیاهان در دمای اتاق خشک گردیدند و تا زمان عصارهگیری در دمای اتاق نگهداری شدند. وزن کل نمونههای گیاهان سس بادرنجبویه، سس خارشتر، بادرنجبویه و خارشتر به ترتیب 20، 80، 85 و80 گرم تعیین شد. کاشت و پرورش سس بر روی پایه خارشتر پیش از این هم در مقالات کار شده است ولی کاشت بر روی پایه بادرنجبویه مشکل بوده و همچنین در بررسی مقالات قبلی گزارشی از آن یافت نشد.
عصاره گیری
تهیه عصاره هیدروالکلی: برای عصارهگیری از گیاه سس و دو پایهای که روی آن روی رشد می¬کند، ابتدا گیاه انگلی و پایه آن را پاک کرده و از هم جدا میکنیم؛ گیاه و پایه را به وسیله آسیاب پودر میکنیم. سپس به ترتیب 20، 80، 85 و 80 گرم ازگیاهان سس بادرنجبویه، سس خارشتر، بادرنجبویه و خارشتر پودر شده را به وسیله ترازو توزین کرده و در ارلن میریزیم. محلول 80:20 از آب: اتانول تهیه شد و سپس 500 سی سی از محلول تهیه شده به گیاهان موجود در ارلنها اضافه شد. ارلن حاوی محلول، با فویل آلومینیومی و پارافیلم پوشانده شد. پس از 3 روز، محلول رویی ابتدا توسط کاغذ صافی صاف گردید و سپس بهوسیله دستگاه روتاری تغلیظ شد، این عمل 3 بار تکرار شد. در نهایت عصاره تغلیظ شده در کریستالیزور ریخته و بر روی بنماری قرار داده شد تا حلال آن کاملا خارج گردد، سپس عصاره خشک شده تا زمان مصرف در یخچال آزمایشگاه نگهداری شد (15).
تهیه عصاره آبی: عصارهگیری آبی از 10 گرم پودر گیاه سس بادرنجبویه و 10 گرم پودر گیاه سس خارشتر انجام شد. با توجه به روشهای عصارهگیری سنتی و همچنین تسریعروند عصارهگیری و جلوگیری از کپک زدن، عصاره آبی به روش دمکردن تهیه شد. سپس برروی شیکر قرار داده شد، عصاره حاصل 3 مرتبه از کاغذ صافی عبور داده شد و در آخر در دستگاه فریز درایر در خلا و بهوسیله سرما خشک شد و در شیشه محافظ نور و کاملاً بسته تا زمان استفاده در دمای یخچال 2 تا 8 درجه سانتیگراد نگهداری شد.
ﺑﺮرﺳﻲ ﻣﺤﺘﻮای ﺗﺎم فنولی ﮔﻴﺎه (Total Phenol): غلظتهای سریالی از روتین (استاندارد) و عصاره گیاه تهیه گردید. معرف فولین - سیوکالتئو به نسبت 1 به 10 رقیق شد. سپس 150µL از هر رقت عصاره به (از 62/5 تا 8000 میکروگرم بر میلیلیتر) به 750 میکرولیتر از معرف فولین سیوکالتئو در میکروتیوبهای جداگانه اضافه شد. بعد از 10 دقیقه 600 میکرولیتر از سدیم کربنات 2 درصد به هر میکروتیوب اضافه شد. پس از گذشت 30دقیقه، میزان جذب در طول موج 765 نانومتر دستگاه الایزا ریدر خوانده شد. برای هر غلظت سه مرتبه تکرار شد و نتایج برحسب انحراف معیار ± میانگین گزارش گردید. در نهایت محتوای تام فنولی گیاه بر حسب مقدار معادل میکروگرم روتین /گرم گیاه خشک اندازهگیری شد (15).
ﺑﺮرﺳﻲ ﻣﺤﺘﻮای ﺗﺎم فلاونوئیدی ﮔﻴﺎه (Total Flavonoid): بهطور خلاصه، غلظتهای سریالی از کوئرستین (استاندارد) و عصاره گیاه تهیه گردید، هر غلظت سه مرتبه تکرار شد. نیم میلیلیتر از سدیم استات یک مولار، 0/1 میلیلیتر از محلول آلومینیم کلراید 10درصد و 2/8 میلیلیتر آب مقطر به نیم میلیلیتر از غلظتهای مختلف عصاره و استاندارد اضافه گردید. جذب مخلوط حاصل پس از 40 دقیقه در طول موج 415 نانومتر دستگاه الایزا ریدر خوانده شد. در پایان، محتوای تام فلاونوئیدی گیاه بر حسب مقدار معادل میکروگرم کوئرستین/گرم گیاه خشک محاسبه شد و بر حسب میانگین ± انحراف معیار گزارش گردید (15).
بررسی اثرات آنتیاکسیدانی عصاره گیاه
بررسی فعالیت آنتیاکسیدانی گیاه در روش FRAP: برای انجام این تست از معرف FRAP استفاده شد. این معرف از طریق مخلوط کردن 25 میلیلیتر بافر استات 300 میلیمولار (با pH=3.6) با 2/5 میلیلیتر TPTZده میلیمولار در هیدروکلریک اسید 40 میلیمولار و 2/5 میلی لیتر آهن کلراید 6 آبه بیست میلی مولار تهیه شد. به عنوان محلول استاندارد از سولفات آهن 7 آبه 7H2O). FeSO4) استفاده شد. ساخت معرف و رقتسازی در روز انجام آزمایش انجام شد. پنجاه میکرولیتر از رقتهای مختلف عصاره و همچنین استاندارد به صورت جداگانه به 1/5 میلی لیتر از معرف FRAP اضافه شد. این مخلوط به مدت 30دقیقه در دمای 37 درجه قرار داده شد. در نهایت جذب پلیت در طول موج 593 نانومتر توسط دستگاه الایزا ریدر خوانده شد. مراحل کار برای هر غلظت سه مرتبه تکرا شد و نتایج بر حسب میانگین ± انحراف معیار گزارش گردید (16).
بررسی فعالیت آنتیاکسیدانی گیاه در روش DPPH: جهت سنجش توانایی مهار رادیکالهای آزاد DPPH، 750 میکرولیتر از غلظتهای مختلف عصاره و ترکیب استاندارد (ویتامین ث) بهصورت جداگانه به 300 میکرولیتر از محلول 0/3 میلیمولار رادیکالهای آزاد DPPH اضافه شد. مخلوط 30 دقیقه در دمای اتاق نگهداری شد و سپس جذب در طول موج 520 نانومتر دستگاه الایزا ریدر خوانده شد. مراحل کار برای هر غلظت سه مرتبه تکرار شد و نتایج به صورت میانگین ± انحراف معیار گزارش گردید.
برای محاسبه درصد مهار DPPH موجود در هر یک از چاهک¬ها از فرمولی که در پایین ذکر شده استفاده گردید:
درصد مهار رادیکال DPPH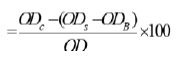
- ODC: میزان جذب کنترل (Control)
- ODB: میزان جذب بلانک (Blank)
- ODS: میزان جذب نمونه (Sample)
پس از بهدست آوردن درصد مهار رادیکالی DPPH، مقدار IC50 عصاره و آسکوربیک اسید نیز تعیین شد. IC50 بیانگر غلظتی از نمونه است که موجب 50 درصد بازدارندگی در ظرفیت رادیکالی میشود و مقدار آن از طریق رسم مقادیر مختلف درصد مهار رادیکال DPPH بر حسب غلظتهای مختلف نمونه و محاسبه معادله خط رگرسیون به دست می-آید. نهایتاً نتایج IC50 به صورت میانگین ± انحراف معیار گزارش گردید (16).
تجزیه و تحلیل آماری
برای هر دو تست انجام شده، آزمایش 3 بار تکرار شد. نتایج بهدست آمده میانگین 3 تکرار ± انحراف معیار بودند. منحنی کالیبراسیون ترکیبات استاندارد با برنامه Excel Microsoft رسم گردید و محاسبات IC50 با استفاده از نرم افزار GraphPad. Prism8 انجام شد (16).
نتایج
نتایج بازده عصارهگیری، محتوای تام فنولی و محتوای تام فلاونوئیدی گیاه در جدول 1 آورده شده است.
اثرات آنتیاکسیدانی عصاره گیاه: نتایج بررسی توانایی مهار رادیکال های آزاد DPPH و همچنین سنجش توانایی آنتیاکسیدانی از طریق احیاکنندگی یون آهن عصارههای هیدروالکلی گیاهان پایه (بادرنجبویه- خارشتر) و سس رویش یافته بر روی این دو پایه به شرح جدول2 می باشد.
جدول 1: بازده عصارهگیری، محتوای تام فنلی و فلاونوئیدی
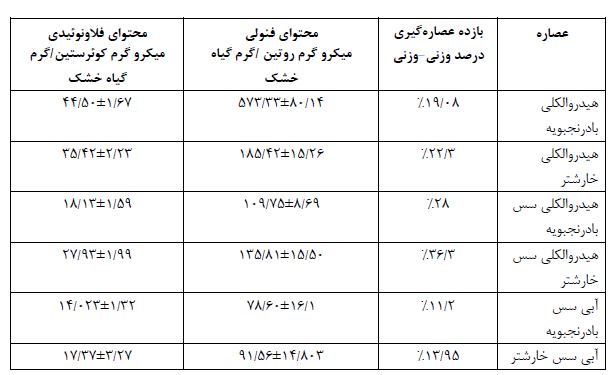
٭مقادیر بر اساس Mean±SEM بیان شده است. هر غلظت سه مرتبه تکرار شد.
جدول 2: میزان توانایی احیاکنندگی یون آهن و مهار کنندگی رادیکالهای آزاد DPPH عصاره هیدرالکلی گیاهان بادرنجبویه ، خارشتر، سس رویش یافته بر روی پایه بادرنجبویه و سس رویش یافته بر روی پایه خارشتر

*مقادیر به صورت Mean±SEM بیان شده است. هر غلظت سه مرتبه تکرار شد.
بحث
در این مطالعه گیاهان بادرنجبویه، خارشتر به عنوان گیاهان پایه و گیاه انگلی سس که جداگانه بر روی هر یک از دو پایه رشد داده شده بود، از نظر محتوای فنلی، فلاونوئیدی و ظرفیت آنتیاکسیدانی به روش FRAP و مهار رادیکالهای آزاد DPPH بررسی شدند. فنلها، فلاونوئیدها، فنولیک اسیدها و تاننها ترکیاتی دارای پتانسیل آنتیاکسیدانی میباشند. از طرفی این آنتیاکسیدانها با اثرات بیولوژیکی مانن اثرات ضدالتهابی و آنتیاسکلروزیس در ارتباط میباشند (15). به همین دلیل بررسی اثرات انتیاکسیدانی و محتوای تام ترکیبات فنلی و فلاونوئیدی گیاه سس در این مطالعه انجام شده است. از طرفی، با توجه به ماهیت انگلی گیاه سس و و ابستگی ترکیبات آن به گیاه میزبانی که برروی آن رشد مینماید، مطالعات برروی گیاهان پایه هم صورت گرفته است. در این مطالعه ابتدا به تعیین محتوای فنولی و فلاونوئیدی عصاره¬های آبی و هیدروالکلی گیاه سس و عصاره هیدروالکلی بادرنجبویه و خارشتر پرداخته شد. مقادیر فنول با استفاده از معرف فولین-سیوکالتئو و مقادیر فلاونوئید با معرف آلومینیوم کلراید مشخص شد. همانگونه که از نتایج این مطالعه پیداست، عصارههای هیدروالکلی دارای محتوای فنلی و فلاونوئیدی بالاتری نسبت به عصارههای آبی هستند. با توجه به ماهیت عصارههای هیدروالکلی توانایی استخراج طیف وسیعتری از ترکیبات فنلی و فلاونوئیدی را دارا هستند. دلیل استفاده وسیعتر عصارههای هیدروالکلی نسبت به سایر عصارهها هم همین مطلب میباشد. با توجه به این که بهصورت سنتی از عصارههای آبی گیاهان استفاده میشود، در این مطالعه هم عصاره آبی گیاه سس بررسی شد. نتایج این بررسی موید محتوای فنلی و فلاونوئیدی بالاتر عصارههای هیدروالکلی میباشد. از طرفی عصاره هیدروالکلی گیاهان پایه یا میزبان نسبت به عصاره انگل سس که روی آنها رشد یافته است، دارای محتوای تام فنلی و فلاونوئیدی بالاتری میباشد. هم چنین گیاه بادرنجبویه نسبت به گیاه خارشتر محتوای فنلی و فلاونوئیدی بالاتری را داراست. بادرنجبویه از گیاهان خانواده نعنا و خارشتر متعلق به خانواده کاسنی میباشد. در مطالعات مختلف مشخص شده است که نعناعیان غنی از ترکیبات فنلی می باشند (15،16). مطالعات انجام شده در این خصوص اندک میباشد و در ادامه به تعدادی از آنها اشاره شده است. علیجانیها و همکاران در سال 2018، عصاره آبی گیاه سس را بررسی نمودند. در این مطالعه عصاره آبی به طریق دم کردن با آب جوش تهیه شد. محتوای فنلی و فلاونوئیدی در این مطالعه به ترتیب 9/02 ±55/61 میلیگرم گالیک اسید بر گرم و 1/2±25/27 میلی گرم کاتشین بر گرم میباشد (17). جعفریان و همکاران نیز در سال 2014، عصاره هیدروالکلی و کلروفرمی گیاه سس را بررسی نمودند. محتوای تام فنلی گزارش شده برای عصاره هیدروالکلی و کلروفرمی به ترتیب 4/11±56/08 و 0/38±4/81 میلیگرم گالیک اسید بر گرم عصاره خشک میباشد (18). در مطالعهای در کشور تایوان، مینگ کوئن و همکاران در سال 2018، عصاره متانولی گیاه سس را با استفاده از سونیکاتور تهیه نموده و میزان ترکیبات فنلی و فلاونوئیدی آن را به ترتیب 1/58±76/ 78 میلیگرم گالیک اسید بر گرم و 0/22±20/07 میلیگرم کوئرستین بر گرم گزارش نمودند (19). آنتیاکسیدانها موادی هستند که بهصورت مستقیم و غیرمستقیم سلولها را در برابر عوارض جانبی زنوبیوتیکها، داروها، مواد کارسینوژن و واکنشهای رادیکالی محافظت میکنند (20). آﻧﺘﻲاﻛﺴﻴﺪانﻫﺎی ﻃﺒﻴﻌﻲ ﺑﻴﺸﺘﺮ در ﮔﻴﺎﻫﺎﻧﻲ ﻣﻮﺟﻮد میﺑﺎﺷﻨﺪ ﻛﻪ ﺣﺎوی ﺗﺮﻛﻴﺒﺎت فنولی ﻫﺴﺘﻨﺪ. محتوای فنولی و ترکیبات گیاه به فاکتورهای ژنتیکی و محیطی وابسته میباشند. ترکیبات آنتیاکسیدان فراوانی در گیاهان موجود میباشند و شناسایی تک تک آنها کاری دشوار میباشد بنابراین ظرفیت آنتیاکسیدانی عصارهها با سنجش-های متعددی ارزیابی میشود (21). جهت مطالعه و بررسی اثرات آنتیاکسیدانی و توانایی به دام انداختن رادیکالهای آزاد عصارهها و اسانسهای گیاهی در آزمایشگاه، متدها و روشهای مختلفی طراحی شده است زیرا آنتیاکسیدانها با مکانیسمهای مختلفی عمل میکنند از این رو انتخاب یک روش به عنوان مناسبترین روش کار دشواری است و تنها یک متد نمیتواند جنبههای گوناگون عملکرد یک آنتیاکسیدان را نشان دهد (22). با توجه به نتایج مطالعات قبلی و گزارش شده در اسکوپوس، تستهای DPPH و FRAP دو متد پذیرفته شده پرکاربرد برای بررسی اثرات آنتی اکسیدانی میباشند. در این تحقیق نیز علاوه بر اندازه¬گیری محتوای تام فنولی و فلاونوئیدی گیاه به روش رنگسنجی، ظرفیت آنتیاکسیدانی عصاره گیاه به وسیله متدهای FRAP و DPPH مورد ارزیابی قرار گرفت. در این مطالعه جهت ارزیابی ظرفیت آنتیاکسیدانی عصارهها متد FRAP مورد استفاده قرار گرفت. یافتههای مطالعه حاضر نشان میدهد عصاره گیاهان میزبان نسبت به انگل سس دارای ظرفیت آنتیاکسیدانی بالاتری میباشند. هم چنین عصاره هیدروالکلی گیاه بادرنجبویه در مقایسه با تمامی عصاره¬ها در تست FRAP هم دارای بالاترین میزان ظرفیت آنتیاکسیدانی میباشد. در این روش ترکیب استاندارد ویتامین ث دارای بالاترین اثر مهاری رادیکالهای آزاد میباشد و عصاره گیاهان میزبان نسبت به انگل سس دارای ویژگی آنتیاکسیدانی بهتری میباشند. همچنین گیاه میزبان بادرنجبویه بهترین اثر آنتیاکسیدانی را داراست (23،24). نکته حائز اهمیت دیگر این است که گرچه عصاره گیاه بادرنجبویه نسبت به خارشتر از نظر هر چهار متغیر مورد مطالعه یعنی محتوای تام فنلی، فلاونوئیدی، ظرفیت آنتیاکسیدانی و فعالیت مهارکنندگی رادیکالهای آزاد وضعیت بهتری دارد، اما در مورد گیاه انگلی سس وضعیت برعکس می باشد. عصاره گیاه سس رویش یافته بر روی گیاه خارشتر از نظر هر چهار متغیر نسبت به عصاره سس رویش یافته بر بادرنجبویه بهتر است. این مطلب علاوه بر این که تفاوت میزبانها را در تفاوت پروفایل متابولیک انگل سس نشان می دهد، همچنین نشان میدهد که انگل بسته به میزبان میتواند دارای فرایند خودتنظیمی باشد. این یافته در مطالعه انجام شده توسط کومار و همکاران نیز گزارش شده است (25). گرچه مطالعات متعدد دیگری در این خصوص انجام شده و همه موید این مطلب است که ترکیبات گیاه سس بسته به میزبان متفاوت میباشد (4). مینگ کوئن و همکاران نیز در خصوص اثر آنتیاکسیدانی عصاره متانولی گیاه سس به روش DPPH، 11/0±18/46 میکروگرم بر میلیلیتر را گزارش نمودهاند (19). امین و همکاران هم در بررسی گیاه سس IC50 235 میکروگرم بر میلیلیتر را گزارش نمودند (26). از محدودیت های مطالعه حاضر در مرحله انجام، مشکل بودن پرورش گیاه بر روی گیاهان پایه به ویژه گیاه بادرنجبویه میباشد. این مطلب واضحا از میزان گیاهان ذکر شده در روش انجام کار در این مطالعه پیداست. بهنظر میرسد از طرفی مطالعات مختلف وابستگی ترکیبات و اثرات گیاه سس را به گیاه میزبان قویا تایید می نمایند (2،17). بنابراین هر مطالعهای بر روی این گیاه باید با ذکر پایه رویش آن باشد تا مقایسه نتایج و یافته های مطالعات با هم امکانپذیر باشد. در هیچ یک از مطالعات ذکر شده در فوق، به پایه رویش گیاه اشارهای نشده است. همچنین استانداردهای مورد استفاده مطالعات فوق با مطالعه حاضر متفاوت میباشد که خود دلیل دیگری بر محدود نمودن امکان مقایسه نتایج با یکدیگر میباشد. محدودیت دیگر، تعداد اندک مطالعات انجام شده در این خصوص میباشد. در مطالعه حاضر، اثرات آنتیاکسیدانی و محتوای تام فنلی و فلاونوئیدی گیاه سس و گیاهان میزبان گزارش شده است. در تمامی موارد گیاه سس نسبت به پایه ضعیفتر بوده است. این یافته متناقض با طیف وسیع اثرات گیاه انگلی سس نمیباشد. در تایید این مطلب، میتوان به مطالعه کریمی درمانی و همکاران اشاره نمود. در این مطالعه که در سال 2021 انجام شد، عصاره هیدروالکلی گیاه سس واجد اثرات سمیت سلولی بر روی ردههای سلولهای سرطانی MCF7 (سرطان پستان) و PC3 ( سرطان پروستات) میباشد که مکانیسم آن از طریق القای آپوپتوز و فعالیت لاکتات دهیدروژناز میباشد (27). هم چنین در مطالعه دیگری زراعتی و همکاران اثر عصاره تام گیاه سس را بر روی رده سلولی لوسمی لنفوبلاستیک با IC50معادل 2/5 میکروگرم بر میلیلیتر گزارش نمودند (13).
نتیجهگیری
در مطالعهای که انجام شد، مشخص گردید عصارههای مورد مطالعه حاوی محتوی فنولی بیشتری در مقایسه با محتوی فلاونوئیدی می¬باشند. همچنین عصاره هیدروالکلی در مقایسه با عصاره آبی غنی تر از ترکیبات فنلی می باشد. عصاره گیاهان میزبان (بادرنجبویه- خارشتر) نسبت به گیاه انگلی سس دارای محتوای فنلی و فلاونوئیدی بیشتری میباشند. از نقاط قوت این مطالعه بررسی همزمان اثرات گیاه به همراه گیاهان میزبان میباشد. در نتیجه از این گیاهان می توان به عنوان منابع ترکیبات فلاونوئیدی، منابع آنتی اکسیدان طبیعی استفاده نمود مثلاً در صنایع غذایی به خصوص روغنها به عنوان ماده محافظ و در صنایع دارویی، آرایشی - بهداشتی به عنوان آنتی کسیدان بهره جست.
سپاسگزاری
مقاله حاضر حاصل پایان نامه دانشجو سمانه اسدی میباشد. نویسندگان از حمایت های مالی معاونت محترم تحقیقات و فناوری دانشگاه علوم پزشکی همدان مراتب قدردانی و تشکر را اعلام میدارد. (شماره قرارداد طرح تحقیقاتی: 9511267182)
حامی مالی: معاونت محترم تحقیقات و فناوری دانشگاه علوم پزشکی همدان
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی همدان تایید شده است (شماره :7094/1/35/16/پ)
مشارکت نویسندگان
شیرین مرادخانی در ارائه ایده ،طراحی مطالعه، تجزیه و تحلیل دادهها و سمانه اسدی در جمعآوری دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
Cuscuta chinensis با نام فارسی سس، بهطور گسترده-ای در مناطق گرم و معتدل جهان مثل آفریقا، استرالیا و آسیا بهویژه آسیای جنوب شرقی وجود دارد (1،2). گیاه سس یک انگل سالیانه است که توسط دانه تولیدمثل میکند. سس هیچگونه ریشه، برگ یا کلروفیل ندارد که از طریق آنها بتواند غذای خود را تولید کند بلکه توسط زوائد خاصی به گیاه میزبان متصل شده و مواد مورد نیاز خود را از میزبان استخراج میکند (3). این جنس بیشتر حاوی ترکیبات فنولی و فلاونوئیدی مانند کامپفرول، کوئرستین، هایپروزید و آستراگالین است. از ترکیبات دیگر گیاه میتوان به پلیساکاریدها، گلیکوزیدها، روغنهای فرار و لیگنانها اشاره کردکه نقش مهمی در فعالیت فارماکولوژیکی گیاه دارند (4،5). علیرغم ماهیت انگلی گیاه سس که میتواند برای گیاهانی که پایه رشد آن هستند مخرب و آسیبزا باشد، به-عنوان یک گیاه دارویی مهم در پزشکی باستان مطرح است. مصرف خوراکی دانههای آن در طب سنتی چینی گزارش شده است. گیاه سس برای درمان بیماریهای خود ایمنی، بهبود تمایز و تکثیر سلولهای استئوبلاست، پیشگیری و درمان بیماریهای قلبی و عروقی کاربرد داشته است (1). گیاه سس کاهش قابل توجهی را در سلولهای سرطانی گردن رحم نشان داده است. دانه گیاه از طریق کاهش در سایتوکاینهای التهابی و استرس اکسیداتیو، اثر ضددردی و ضدالتهابی در مدل حیوانی نشان دادند (6). فنولها از بزرگترین گروههای متابولیت ثانویه گیاهان به شمار میآیند که در اکثر ترکیبات طبیعی یافت میشوند. همچنین در صنایع غذایی از آنها بهعنوان عطردهنده، طعمدهنده و رنگدهنده میتوان بهره گرفت. فنولها شامل چند دسته مهم مانند ترکیبات فنولی ساده، تانن، کومارین، آنتراکینون، نفتوکینون، فلاون و فلاونوئید، آنتوسیانین، لیگنان و لیگنین هستند (7). فلاونوئیدها هم به صورت آزاد و هم به فرم گلیکوزید، بزرگترین گروه فنولها هستند (8). مطالعات قبلی نشان دادهاند که فلاونوئیدهای جدا شده از بذر گیاه سس عملکرد غدد درون ریز تخمدان در موشها را بهبود بخشیدند (9). فلاونوئیدها فعالیت آنتیاکسیدانی بالایی را از خود نشان دادهاند (10). همچنین از فلاونوئیدها، اثرات درمانی دیگری از جمله جلوگیری از سقط جنین (11)، اثر ضد پوکی استخوان (12) و اثر بر سلولهای سرطانی و تومور دیده شده است (12،13). فلاونوئیدها از اجزای اصلی گیاه سس میباشند. بررسی میزان ترکیبات فلاونوئیدی سس رویش یافته بر گیاهان مختلف مانند رازیانه، گلرنگ، داتوره و ... نشان میدهد که میزان این ترکیبات باتوجه به میزبان متفاوت میباشد (2،4). از طرفی فلاونوئیدها ترکیباتی با پتانسیل بالای آنتیاکسیدانی میباشند. از آﻧﺠﺎﻳﻲکه آنتی¬اﻛﺴﻴﺪانﻫﺎ در ﭘﻴﺸﮕﻴﺮی از ﺑﺴﻴﺎری از ﺑﻴﻤﺎریﻫﺎ ﻧﻈﻴﺮ دﻳﺎﺑﺖ، ﭘﻴﺮی، اﻟﺘﻬﺎب، ﺳﺮﻃﺎن، آﺗﺮواﺳﻜﻠﺮوز، ﺻﺪﻣﺎت ﻛﺒﺪی، آﻟﺰاﻳﻤﺮ، ﭘﺎرﻛﻴﻨﺴﻮن و ﺑﻴﻤﺎریﻫﺎی ﻋﺮوق ﻛﺮوﻧﺮ ﻗﻠﺐ ﻣﺆﺛﺮ ﻣﻲباشند (14). ﻳﺎﻓﺘﻦ ﮔﻴﺎﻫﺎﻧﻲ ﺑﺎ اﺛﺮات آنتیاﻛﺴﻴﺪاﻧﻲ ﻗﻮی میﺗﻮاﻧﺪ در ﻛﺎﻫﺶ ﺳﻴﺮ ﺑﺴﻴﺎر ﺑﻴﻤﺎریها میتوانند ﻣﺆﺛﺮ ﺑﺎﺷﺪ. گیاه بادرنجبویه با نام علمی Melissa officinalis متعلق به خانواده نعناعیان و گیاه خارشتر با نام علمی Alhagi murarum از خانواده کاسنی است. با توجه به ماهیت گیاه انگلی سس، کاشت و پرورش آن برروی بعضی پایهها مشکل میباشد. با توجه به اینکه برروی سس رویش یافته بر روی پایههای بادرنجبویه و خارشتر مطالعاتی در این خصوص صورت نگرفته، در این مطالعه ابتدا محتوای تام فنولی و فلاونوئیدی گیاه سس و دو گیاه میزبان و سپس فعالیت آنتیاکسیدانی آنها به دو روش Ferric Reducing Antioxidant Power Assay (FRAP) و 2,2-Diphenyl-1-picrylhydrazyl (DPPH) مورد ارزیابی قرار گرفت.
روشبررسی
مواد شیمیایی و معرف¬ها: پودر DPPH، معرف آلومینیوم کلراید، سدیم استات، پودر TPTZ، سولفات آهن هفت آبه، متانول، اتانول، روتین، پودر آسکوربیک اسید فریک کلراید 6 آبه، معرف فولین - سیوکالتئو تولید شرکت مرک آلمان خریداری شد. سدیم بیکربنات، استیک انیدرید، اسید سولفوریک، استیک اسید گلاسیال از شرکت پارس شیمی ایران تهیه شدند. اسید کلریدیک نیز از شرکت کیان کاوه ایران خریداری شد.
دستگاه¬ها: دستگاه های مورد استفاده به این شرح میباشند: دستگاه الایزا مارک synergy HDX (ساخت آلمان)، دستگاه روتاری مارک Laborta 4003 control-Heidolph (ساخت شرکت Heidolph آلمان)، ترازوی دیجیتالی مارکSartorius CPA2245 (ساخت شرکت Sartorius آلمان)، بن ماری (ساخت شرکت Schutzart آلمان)، دستگاه فریز درایر (Operon Korea)، دستگاه سونیکاتور مارک Bandelin (ساخت شرکت فراز طب تجهیزات ایران).
تهیه و جمعآوری گیاه: گیاهان انگلی سس رویش یافته روی بادرنجبویه و خارشتر (به ترتیب: سس بادرنجبویه و سس خارشتر) به همراه دو پایهای که روی آن رشد میکند (گیاه بادرنجبویه و خارشتر) در مجموعه تحقیقاتی گیاهان دارویی دانشگاه ... کاشت و برداشت شد. همه گیاهان در دمای اتاق خشک گردیدند و تا زمان عصارهگیری در دمای اتاق نگهداری شدند. وزن کل نمونههای گیاهان سس بادرنجبویه، سس خارشتر، بادرنجبویه و خارشتر به ترتیب 20، 80، 85 و80 گرم تعیین شد. کاشت و پرورش سس بر روی پایه خارشتر پیش از این هم در مقالات کار شده است ولی کاشت بر روی پایه بادرنجبویه مشکل بوده و همچنین در بررسی مقالات قبلی گزارشی از آن یافت نشد.
عصاره گیری
تهیه عصاره هیدروالکلی: برای عصارهگیری از گیاه سس و دو پایهای که روی آن روی رشد می¬کند، ابتدا گیاه انگلی و پایه آن را پاک کرده و از هم جدا میکنیم؛ گیاه و پایه را به وسیله آسیاب پودر میکنیم. سپس به ترتیب 20، 80، 85 و 80 گرم ازگیاهان سس بادرنجبویه، سس خارشتر، بادرنجبویه و خارشتر پودر شده را به وسیله ترازو توزین کرده و در ارلن میریزیم. محلول 80:20 از آب: اتانول تهیه شد و سپس 500 سی سی از محلول تهیه شده به گیاهان موجود در ارلنها اضافه شد. ارلن حاوی محلول، با فویل آلومینیومی و پارافیلم پوشانده شد. پس از 3 روز، محلول رویی ابتدا توسط کاغذ صافی صاف گردید و سپس بهوسیله دستگاه روتاری تغلیظ شد، این عمل 3 بار تکرار شد. در نهایت عصاره تغلیظ شده در کریستالیزور ریخته و بر روی بنماری قرار داده شد تا حلال آن کاملا خارج گردد، سپس عصاره خشک شده تا زمان مصرف در یخچال آزمایشگاه نگهداری شد (15).
تهیه عصاره آبی: عصارهگیری آبی از 10 گرم پودر گیاه سس بادرنجبویه و 10 گرم پودر گیاه سس خارشتر انجام شد. با توجه به روشهای عصارهگیری سنتی و همچنین تسریعروند عصارهگیری و جلوگیری از کپک زدن، عصاره آبی به روش دمکردن تهیه شد. سپس برروی شیکر قرار داده شد، عصاره حاصل 3 مرتبه از کاغذ صافی عبور داده شد و در آخر در دستگاه فریز درایر در خلا و بهوسیله سرما خشک شد و در شیشه محافظ نور و کاملاً بسته تا زمان استفاده در دمای یخچال 2 تا 8 درجه سانتیگراد نگهداری شد.
ﺑﺮرﺳﻲ ﻣﺤﺘﻮای ﺗﺎم فنولی ﮔﻴﺎه (Total Phenol): غلظتهای سریالی از روتین (استاندارد) و عصاره گیاه تهیه گردید. معرف فولین - سیوکالتئو به نسبت 1 به 10 رقیق شد. سپس 150µL از هر رقت عصاره به (از 62/5 تا 8000 میکروگرم بر میلیلیتر) به 750 میکرولیتر از معرف فولین سیوکالتئو در میکروتیوبهای جداگانه اضافه شد. بعد از 10 دقیقه 600 میکرولیتر از سدیم کربنات 2 درصد به هر میکروتیوب اضافه شد. پس از گذشت 30دقیقه، میزان جذب در طول موج 765 نانومتر دستگاه الایزا ریدر خوانده شد. برای هر غلظت سه مرتبه تکرار شد و نتایج برحسب انحراف معیار ± میانگین گزارش گردید. در نهایت محتوای تام فنولی گیاه بر حسب مقدار معادل میکروگرم روتین /گرم گیاه خشک اندازهگیری شد (15).
ﺑﺮرﺳﻲ ﻣﺤﺘﻮای ﺗﺎم فلاونوئیدی ﮔﻴﺎه (Total Flavonoid): بهطور خلاصه، غلظتهای سریالی از کوئرستین (استاندارد) و عصاره گیاه تهیه گردید، هر غلظت سه مرتبه تکرار شد. نیم میلیلیتر از سدیم استات یک مولار، 0/1 میلیلیتر از محلول آلومینیم کلراید 10درصد و 2/8 میلیلیتر آب مقطر به نیم میلیلیتر از غلظتهای مختلف عصاره و استاندارد اضافه گردید. جذب مخلوط حاصل پس از 40 دقیقه در طول موج 415 نانومتر دستگاه الایزا ریدر خوانده شد. در پایان، محتوای تام فلاونوئیدی گیاه بر حسب مقدار معادل میکروگرم کوئرستین/گرم گیاه خشک محاسبه شد و بر حسب میانگین ± انحراف معیار گزارش گردید (15).
بررسی اثرات آنتیاکسیدانی عصاره گیاه
بررسی فعالیت آنتیاکسیدانی گیاه در روش FRAP: برای انجام این تست از معرف FRAP استفاده شد. این معرف از طریق مخلوط کردن 25 میلیلیتر بافر استات 300 میلیمولار (با pH=3.6) با 2/5 میلیلیتر TPTZده میلیمولار در هیدروکلریک اسید 40 میلیمولار و 2/5 میلی لیتر آهن کلراید 6 آبه بیست میلی مولار تهیه شد. به عنوان محلول استاندارد از سولفات آهن 7 آبه 7H2O). FeSO4) استفاده شد. ساخت معرف و رقتسازی در روز انجام آزمایش انجام شد. پنجاه میکرولیتر از رقتهای مختلف عصاره و همچنین استاندارد به صورت جداگانه به 1/5 میلی لیتر از معرف FRAP اضافه شد. این مخلوط به مدت 30دقیقه در دمای 37 درجه قرار داده شد. در نهایت جذب پلیت در طول موج 593 نانومتر توسط دستگاه الایزا ریدر خوانده شد. مراحل کار برای هر غلظت سه مرتبه تکرا شد و نتایج بر حسب میانگین ± انحراف معیار گزارش گردید (16).
بررسی فعالیت آنتیاکسیدانی گیاه در روش DPPH: جهت سنجش توانایی مهار رادیکالهای آزاد DPPH، 750 میکرولیتر از غلظتهای مختلف عصاره و ترکیب استاندارد (ویتامین ث) بهصورت جداگانه به 300 میکرولیتر از محلول 0/3 میلیمولار رادیکالهای آزاد DPPH اضافه شد. مخلوط 30 دقیقه در دمای اتاق نگهداری شد و سپس جذب در طول موج 520 نانومتر دستگاه الایزا ریدر خوانده شد. مراحل کار برای هر غلظت سه مرتبه تکرار شد و نتایج به صورت میانگین ± انحراف معیار گزارش گردید.
برای محاسبه درصد مهار DPPH موجود در هر یک از چاهک¬ها از فرمولی که در پایین ذکر شده استفاده گردید:
درصد مهار رادیکال DPPH
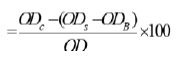
- ODC: میزان جذب کنترل (Control)
- ODB: میزان جذب بلانک (Blank)
- ODS: میزان جذب نمونه (Sample)
پس از بهدست آوردن درصد مهار رادیکالی DPPH، مقدار IC50 عصاره و آسکوربیک اسید نیز تعیین شد. IC50 بیانگر غلظتی از نمونه است که موجب 50 درصد بازدارندگی در ظرفیت رادیکالی میشود و مقدار آن از طریق رسم مقادیر مختلف درصد مهار رادیکال DPPH بر حسب غلظتهای مختلف نمونه و محاسبه معادله خط رگرسیون به دست می-آید. نهایتاً نتایج IC50 به صورت میانگین ± انحراف معیار گزارش گردید (16).
تجزیه و تحلیل آماری
برای هر دو تست انجام شده، آزمایش 3 بار تکرار شد. نتایج بهدست آمده میانگین 3 تکرار ± انحراف معیار بودند. منحنی کالیبراسیون ترکیبات استاندارد با برنامه Excel Microsoft رسم گردید و محاسبات IC50 با استفاده از نرم افزار GraphPad. Prism8 انجام شد (16).
نتایج
نتایج بازده عصارهگیری، محتوای تام فنولی و محتوای تام فلاونوئیدی گیاه در جدول 1 آورده شده است.
اثرات آنتیاکسیدانی عصاره گیاه: نتایج بررسی توانایی مهار رادیکال های آزاد DPPH و همچنین سنجش توانایی آنتیاکسیدانی از طریق احیاکنندگی یون آهن عصارههای هیدروالکلی گیاهان پایه (بادرنجبویه- خارشتر) و سس رویش یافته بر روی این دو پایه به شرح جدول2 می باشد.
جدول 1: بازده عصارهگیری، محتوای تام فنلی و فلاونوئیدی

٭مقادیر بر اساس Mean±SEM بیان شده است. هر غلظت سه مرتبه تکرار شد.
جدول 2: میزان توانایی احیاکنندگی یون آهن و مهار کنندگی رادیکالهای آزاد DPPH عصاره هیدرالکلی گیاهان بادرنجبویه ، خارشتر، سس رویش یافته بر روی پایه بادرنجبویه و سس رویش یافته بر روی پایه خارشتر

*مقادیر به صورت Mean±SEM بیان شده است. هر غلظت سه مرتبه تکرار شد.
بحث
در این مطالعه گیاهان بادرنجبویه، خارشتر به عنوان گیاهان پایه و گیاه انگلی سس که جداگانه بر روی هر یک از دو پایه رشد داده شده بود، از نظر محتوای فنلی، فلاونوئیدی و ظرفیت آنتیاکسیدانی به روش FRAP و مهار رادیکالهای آزاد DPPH بررسی شدند. فنلها، فلاونوئیدها، فنولیک اسیدها و تاننها ترکیاتی دارای پتانسیل آنتیاکسیدانی میباشند. از طرفی این آنتیاکسیدانها با اثرات بیولوژیکی مانن اثرات ضدالتهابی و آنتیاسکلروزیس در ارتباط میباشند (15). به همین دلیل بررسی اثرات انتیاکسیدانی و محتوای تام ترکیبات فنلی و فلاونوئیدی گیاه سس در این مطالعه انجام شده است. از طرفی، با توجه به ماهیت انگلی گیاه سس و و ابستگی ترکیبات آن به گیاه میزبانی که برروی آن رشد مینماید، مطالعات برروی گیاهان پایه هم صورت گرفته است. در این مطالعه ابتدا به تعیین محتوای فنولی و فلاونوئیدی عصاره¬های آبی و هیدروالکلی گیاه سس و عصاره هیدروالکلی بادرنجبویه و خارشتر پرداخته شد. مقادیر فنول با استفاده از معرف فولین-سیوکالتئو و مقادیر فلاونوئید با معرف آلومینیوم کلراید مشخص شد. همانگونه که از نتایج این مطالعه پیداست، عصارههای هیدروالکلی دارای محتوای فنلی و فلاونوئیدی بالاتری نسبت به عصارههای آبی هستند. با توجه به ماهیت عصارههای هیدروالکلی توانایی استخراج طیف وسیعتری از ترکیبات فنلی و فلاونوئیدی را دارا هستند. دلیل استفاده وسیعتر عصارههای هیدروالکلی نسبت به سایر عصارهها هم همین مطلب میباشد. با توجه به این که بهصورت سنتی از عصارههای آبی گیاهان استفاده میشود، در این مطالعه هم عصاره آبی گیاه سس بررسی شد. نتایج این بررسی موید محتوای فنلی و فلاونوئیدی بالاتر عصارههای هیدروالکلی میباشد. از طرفی عصاره هیدروالکلی گیاهان پایه یا میزبان نسبت به عصاره انگل سس که روی آنها رشد یافته است، دارای محتوای تام فنلی و فلاونوئیدی بالاتری میباشد. هم چنین گیاه بادرنجبویه نسبت به گیاه خارشتر محتوای فنلی و فلاونوئیدی بالاتری را داراست. بادرنجبویه از گیاهان خانواده نعنا و خارشتر متعلق به خانواده کاسنی میباشد. در مطالعات مختلف مشخص شده است که نعناعیان غنی از ترکیبات فنلی می باشند (15،16). مطالعات انجام شده در این خصوص اندک میباشد و در ادامه به تعدادی از آنها اشاره شده است. علیجانیها و همکاران در سال 2018، عصاره آبی گیاه سس را بررسی نمودند. در این مطالعه عصاره آبی به طریق دم کردن با آب جوش تهیه شد. محتوای فنلی و فلاونوئیدی در این مطالعه به ترتیب 9/02 ±55/61 میلیگرم گالیک اسید بر گرم و 1/2±25/27 میلی گرم کاتشین بر گرم میباشد (17). جعفریان و همکاران نیز در سال 2014، عصاره هیدروالکلی و کلروفرمی گیاه سس را بررسی نمودند. محتوای تام فنلی گزارش شده برای عصاره هیدروالکلی و کلروفرمی به ترتیب 4/11±56/08 و 0/38±4/81 میلیگرم گالیک اسید بر گرم عصاره خشک میباشد (18). در مطالعهای در کشور تایوان، مینگ کوئن و همکاران در سال 2018، عصاره متانولی گیاه سس را با استفاده از سونیکاتور تهیه نموده و میزان ترکیبات فنلی و فلاونوئیدی آن را به ترتیب 1/58±76/ 78 میلیگرم گالیک اسید بر گرم و 0/22±20/07 میلیگرم کوئرستین بر گرم گزارش نمودند (19). آنتیاکسیدانها موادی هستند که بهصورت مستقیم و غیرمستقیم سلولها را در برابر عوارض جانبی زنوبیوتیکها، داروها، مواد کارسینوژن و واکنشهای رادیکالی محافظت میکنند (20). آﻧﺘﻲاﻛﺴﻴﺪانﻫﺎی ﻃﺒﻴﻌﻲ ﺑﻴﺸﺘﺮ در ﮔﻴﺎﻫﺎﻧﻲ ﻣﻮﺟﻮد میﺑﺎﺷﻨﺪ ﻛﻪ ﺣﺎوی ﺗﺮﻛﻴﺒﺎت فنولی ﻫﺴﺘﻨﺪ. محتوای فنولی و ترکیبات گیاه به فاکتورهای ژنتیکی و محیطی وابسته میباشند. ترکیبات آنتیاکسیدان فراوانی در گیاهان موجود میباشند و شناسایی تک تک آنها کاری دشوار میباشد بنابراین ظرفیت آنتیاکسیدانی عصارهها با سنجش-های متعددی ارزیابی میشود (21). جهت مطالعه و بررسی اثرات آنتیاکسیدانی و توانایی به دام انداختن رادیکالهای آزاد عصارهها و اسانسهای گیاهی در آزمایشگاه، متدها و روشهای مختلفی طراحی شده است زیرا آنتیاکسیدانها با مکانیسمهای مختلفی عمل میکنند از این رو انتخاب یک روش به عنوان مناسبترین روش کار دشواری است و تنها یک متد نمیتواند جنبههای گوناگون عملکرد یک آنتیاکسیدان را نشان دهد (22). با توجه به نتایج مطالعات قبلی و گزارش شده در اسکوپوس، تستهای DPPH و FRAP دو متد پذیرفته شده پرکاربرد برای بررسی اثرات آنتی اکسیدانی میباشند. در این تحقیق نیز علاوه بر اندازه¬گیری محتوای تام فنولی و فلاونوئیدی گیاه به روش رنگسنجی، ظرفیت آنتیاکسیدانی عصاره گیاه به وسیله متدهای FRAP و DPPH مورد ارزیابی قرار گرفت. در این مطالعه جهت ارزیابی ظرفیت آنتیاکسیدانی عصارهها متد FRAP مورد استفاده قرار گرفت. یافتههای مطالعه حاضر نشان میدهد عصاره گیاهان میزبان نسبت به انگل سس دارای ظرفیت آنتیاکسیدانی بالاتری میباشند. هم چنین عصاره هیدروالکلی گیاه بادرنجبویه در مقایسه با تمامی عصاره¬ها در تست FRAP هم دارای بالاترین میزان ظرفیت آنتیاکسیدانی میباشد. در این روش ترکیب استاندارد ویتامین ث دارای بالاترین اثر مهاری رادیکالهای آزاد میباشد و عصاره گیاهان میزبان نسبت به انگل سس دارای ویژگی آنتیاکسیدانی بهتری میباشند. همچنین گیاه میزبان بادرنجبویه بهترین اثر آنتیاکسیدانی را داراست (23،24). نکته حائز اهمیت دیگر این است که گرچه عصاره گیاه بادرنجبویه نسبت به خارشتر از نظر هر چهار متغیر مورد مطالعه یعنی محتوای تام فنلی، فلاونوئیدی، ظرفیت آنتیاکسیدانی و فعالیت مهارکنندگی رادیکالهای آزاد وضعیت بهتری دارد، اما در مورد گیاه انگلی سس وضعیت برعکس می باشد. عصاره گیاه سس رویش یافته بر روی گیاه خارشتر از نظر هر چهار متغیر نسبت به عصاره سس رویش یافته بر بادرنجبویه بهتر است. این مطلب علاوه بر این که تفاوت میزبانها را در تفاوت پروفایل متابولیک انگل سس نشان می دهد، همچنین نشان میدهد که انگل بسته به میزبان میتواند دارای فرایند خودتنظیمی باشد. این یافته در مطالعه انجام شده توسط کومار و همکاران نیز گزارش شده است (25). گرچه مطالعات متعدد دیگری در این خصوص انجام شده و همه موید این مطلب است که ترکیبات گیاه سس بسته به میزبان متفاوت میباشد (4). مینگ کوئن و همکاران نیز در خصوص اثر آنتیاکسیدانی عصاره متانولی گیاه سس به روش DPPH، 11/0±18/46 میکروگرم بر میلیلیتر را گزارش نمودهاند (19). امین و همکاران هم در بررسی گیاه سس IC50 235 میکروگرم بر میلیلیتر را گزارش نمودند (26). از محدودیت های مطالعه حاضر در مرحله انجام، مشکل بودن پرورش گیاه بر روی گیاهان پایه به ویژه گیاه بادرنجبویه میباشد. این مطلب واضحا از میزان گیاهان ذکر شده در روش انجام کار در این مطالعه پیداست. بهنظر میرسد از طرفی مطالعات مختلف وابستگی ترکیبات و اثرات گیاه سس را به گیاه میزبان قویا تایید می نمایند (2،17). بنابراین هر مطالعهای بر روی این گیاه باید با ذکر پایه رویش آن باشد تا مقایسه نتایج و یافته های مطالعات با هم امکانپذیر باشد. در هیچ یک از مطالعات ذکر شده در فوق، به پایه رویش گیاه اشارهای نشده است. همچنین استانداردهای مورد استفاده مطالعات فوق با مطالعه حاضر متفاوت میباشد که خود دلیل دیگری بر محدود نمودن امکان مقایسه نتایج با یکدیگر میباشد. محدودیت دیگر، تعداد اندک مطالعات انجام شده در این خصوص میباشد. در مطالعه حاضر، اثرات آنتیاکسیدانی و محتوای تام فنلی و فلاونوئیدی گیاه سس و گیاهان میزبان گزارش شده است. در تمامی موارد گیاه سس نسبت به پایه ضعیفتر بوده است. این یافته متناقض با طیف وسیع اثرات گیاه انگلی سس نمیباشد. در تایید این مطلب، میتوان به مطالعه کریمی درمانی و همکاران اشاره نمود. در این مطالعه که در سال 2021 انجام شد، عصاره هیدروالکلی گیاه سس واجد اثرات سمیت سلولی بر روی ردههای سلولهای سرطانی MCF7 (سرطان پستان) و PC3 ( سرطان پروستات) میباشد که مکانیسم آن از طریق القای آپوپتوز و فعالیت لاکتات دهیدروژناز میباشد (27). هم چنین در مطالعه دیگری زراعتی و همکاران اثر عصاره تام گیاه سس را بر روی رده سلولی لوسمی لنفوبلاستیک با IC50معادل 2/5 میکروگرم بر میلیلیتر گزارش نمودند (13).
نتیجهگیری
در مطالعهای که انجام شد، مشخص گردید عصارههای مورد مطالعه حاوی محتوی فنولی بیشتری در مقایسه با محتوی فلاونوئیدی می¬باشند. همچنین عصاره هیدروالکلی در مقایسه با عصاره آبی غنی تر از ترکیبات فنلی می باشد. عصاره گیاهان میزبان (بادرنجبویه- خارشتر) نسبت به گیاه انگلی سس دارای محتوای فنلی و فلاونوئیدی بیشتری میباشند. از نقاط قوت این مطالعه بررسی همزمان اثرات گیاه به همراه گیاهان میزبان میباشد. در نتیجه از این گیاهان می توان به عنوان منابع ترکیبات فلاونوئیدی، منابع آنتی اکسیدان طبیعی استفاده نمود مثلاً در صنایع غذایی به خصوص روغنها به عنوان ماده محافظ و در صنایع دارویی، آرایشی - بهداشتی به عنوان آنتی کسیدان بهره جست.
سپاسگزاری
مقاله حاضر حاصل پایان نامه دانشجو سمانه اسدی میباشد. نویسندگان از حمایت های مالی معاونت محترم تحقیقات و فناوری دانشگاه علوم پزشکی همدان مراتب قدردانی و تشکر را اعلام میدارد. (شماره قرارداد طرح تحقیقاتی: 9511267182)
حامی مالی: معاونت محترم تحقیقات و فناوری دانشگاه علوم پزشکی همدان
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی همدان تایید شده است (شماره :7094/1/35/16/پ)
مشارکت نویسندگان
شیرین مرادخانی در ارائه ایده ،طراحی مطالعه، تجزیه و تحلیل دادهها و سمانه اسدی در جمعآوری دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Wang J, Tan D, Wei G, Guo Y, Chen C, Zhu H, et al. Studies on the Chemical Constituents of Cuscuta Chinensis. Chem Nat Compd 2016; 52(6): 1133-6.
2- Naseri M, Shekarchi M, Kondri BM, Mehdipour HH, Abdi L, pour Farzib M, et al. Finger Printing and Quantitative Analysis of Cuscuta Chinensis Flavonoid Contents from Different Hosts by RP-HPLC. Food Sci Nutr 2014; 5(10): 914-21.
3- Guo C, Qin L, Ma Y. et al. Integrated metabolomic and transcriptomic analyses of the parasitic plant Cuscuta japonica Choisy on host and non-host plants. BMC Plant Biol 2022; 22: 393.
4- Donnapee S, Li J, Yang X, Ge AH, Donkor PO, Gao XM, et al. Cuscuta Chinensis Lam.: A Systematic Review on Ethnopharmacology, Phytochemistry and Pharmacology of an Important Traditional Herbal Medicine. J Ethnopharmacol 2014; 157: 292-308.
5- Canivenc-Lavier M-C, Bennetau-Pelissero C. Phytoestrogens and Health Effects. Nutrients 2023; 15(2): 317.
6- Mobli M, Qaraaty M, Amin G, Haririan I, Hajimahmoodi M, Rahimi R. Scientific Evaluation of Medicinal Plants Used for the Treatment of Abnormal Uterine Bleeding by Avicenna. Arch Gynecol Obstet 2015; 292(1): 21-35.
7- Cosme P, Rodríguez AB, Espino J, Garrido M. Plant Phenolics: Bioavailability as a Key Determinant of Their Potential Health-Promoting Applications. Antioxidants 2020; 9(12):1263.
8- Banjarnahor SD, Artanti N. Antioxidant Properties of Flavonoids. Med J Indones 2014; 23(4): 239-44.
9- Shu J, Li L, Yu H, Zhang D. Fertility-Enhancing Potential of Ethanol Extract of Cuscuta Chinensis Seeds in a Rat Model of Unilateral Cryptorchidism. Trop J Pharm Res 2021; 20(5): 995-1002.
10- Brunetti C, Di Ferdinando M, Fini A, Pollastri S, Tattini M. Flavonoids as Antioxidants and Developmental Regulators: Relative Significance in Plants and Humans. Int J Mol Sci 2013; 14(2): 3540-55.
11- Barreca MM, Alessandro R, Corrado C. Effects of Flavonoids on Cancer, Cardiovascular and Neurodegenerative Diseases: Role of NF-Κb Signaling Pathway. Int J Mol Sci 2022; 24(11); 9236.
12- Yang L, Chen Q, Wang F, Zhang G. Antiosteoporotic Compounds from Seeds of Cuscuta Chinensis. J ethnopharmacol 2011; 135(2): 553-60.
13- Zeraati F, Zamani AR, Goudarzi M, Malakouti HS, Razaghi K. In Vitro Cytotoxic Effects of Cuscuta Chinensis Whole Extract on Human Acute Lymphoblastic Leukemia Cell Line. IJMS 2015; 35(4): 310-4.
14- Singh A, Kukreti R, Saso L, Kukreti S. Oxidative Stress: A Key Modulator in Neurodegenerative Diseases. Molecules 2018; 24(8): 1583.
15- Bahramloo M, Moradkhani S, Sedaghat Hamedani M. Phytochemical Evaluation and Antioxidant Effects of the Essential Oil and Distillates of Nepeta Crispa Willd. JMP 2023; 22(86): 27-43.
16- Motaghed M, Nili-Ahmadabadi A, Moradkhani S. Assessment of the Antioxidative Potential of Nepeta Crispa Willd. (Lamiaceae) and its Effects on Oxidative Stability of Virgin Sunflower Oil Under Accelerated Storage Conditions. JMP 2022; 21(82): 13-27.
17- Alijaniha F, Emadi F, Naseri M, Bahaedin Z. Preliminary Phytochemical and Physicochemical Study of Cuscuta Chinensis L. Aqueous Extract Compared with Previous Studies. Complement Med J 2023; 13(1): 3-9.
18- Jafarian AB, Ghannadi A, Mohebi B. Cytotoxic Effects of Chloroform and Hydroalcoholic Extracts of Aerial Parts of Cuscuta Chinensisand Cuscuta Epithymumon Hela, HT29 and MDA-MB-468 Tumor Cells. Res Pharm Sci 2014; 9(2): 115-22.
19- Lin MK, Lee MS, Huang HC, Cheng TJ, Cheng YD, Wu CR. Cuscuta Chinensis and C. Campestris Attenuate Scopolamine-Induced Memory Deficit and Oxidative Damage in Mice. Molecules 2018; 23(12): 3060.
20- Ranjbaran P, Moradkhani S. Iron Chelating Activity of Nepeta Crispa Willd., an Endemic Plant in the West of Iran. Avicenna J Med Biochem 2022; 10(1): 65-70.
21- Yazici SO, Ozmen I, Celikoglu U, Ozcelik H, Genc H. In Vitro Antioxidant Activities of Extracts from Some Nepeta Species. Int J Health Nutr 2012; 3(1): 8-12.
22- Soleimani Shadvar M, Moradkhani S. Chemical Composition of the Essential Oils and Antioxidant Capacity Evaluation of Echinophora Platyloba DC. And Falcaria Vulgaris Bernh. Growing in Hamadan Province of Iran. JMP 2022; 21(83): 19-34.
23- Ražná K, Sawinska Z, Ivanišová E, Vukovic N, Terentjeva M, Stričík M, et al. Properties of Ginkgo Biloba L.: Antioxidant Characterization, Antimicrobial Activities, and Genomic Microrna Based Marker Fingerprints. Int J Mol Sci 2020; 21(9): 3087.
24- Tewari LM, Upreti BM, Tewari G, Singh MK, Nailwal T. Comparative in Vitro Antioxidant Activity of Extracts of Aerial Parts of Ginkgo Biloba L. From Kumaun Himalaya. World J Pharm Res 2017; 6(13): 654-66.
25- Kumar K, Amir R. The Effect of a Host on the Primary Metabolic Profiling of Cuscuta Campestris’ Main Organs, Haustoria,Stem and Flower. Plants 2021; 10(10): 2098.
26- Amin G, Kondori BM, Vazirian M, Abdi L, Arabshahi G. Evaluation of Chemical Composition and Antioxidant Activity of Total Extract of Cuscuta Chinensis Lam. Used In Traditional Medicine. Planta Med 2010; 76(12): 147.
27- Dermani FK, Saidijam M, Najafi R, Moradkhani S, Mohammadzaheri Z, Beiranvand N, et al. Cytotoxic Effects of Hydroalcoholic Extract of Cuscuta Chinensis on PC3 and MCF7 Cancer Cell Lines. Avicenna J Phytomed 2021; 11(3): 258-68.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فارماکوگنوزی
دریافت: 1402/7/15 | پذیرش: 1402/9/5 | انتشار: 1402/10/15
دریافت: 1402/7/15 | پذیرش: 1402/9/5 | انتشار: 1402/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







