دوره 32، شماره 5 - ( مرداد 1403 )
جلد 32 شماره 5 صفحات 7835-7827 |
برگشت به فهرست نسخه ها
Ethics code: IR.IAU.SHAHROOD.REC.1397.050
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Yahyaei B, Gholipour F, Khojasteh L, Gilak Hakimabadi M, Bahoosh Feyzabadi F, Dankoub F et al . Evaluating the Histopathological Effects of Short-term and Long-term Doses of Ketamine Injection on Heart Tissue of Male and Female Rats. JSSU 2024; 32 (5) :7827-7835
URL: http://jssu.ssu.ac.ir/article-1-6098-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6098-fa.html
یحیایی بهروز، قلیپور فائزه، خجسته لیلا، گیلک حکیمآبادی محمدباقر، باهوش فیضآبادی فاطمه، دنکوب فاطمه و همکاران.. ارزیابی اثرات هیستوپاتولوژیک دوزهای کوتاهمدت و بلندمدت تزریق کتامین بر بافت قلب موشهای صحرایی نر و ماده. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (5) :7827-7835
بهروز یحیایی 

 ، فائزه قلیپور
، فائزه قلیپور 

 ، لیلا خجسته
، لیلا خجسته 

 ، محمدباقر گیلک حکیمآبادی
، محمدباقر گیلک حکیمآبادی 

 ، فاطمه باهوش فیضآبادی
، فاطمه باهوش فیضآبادی 

 ، فاطمه دنکوب
، فاطمه دنکوب 

 ، ملیکا ناصحی*
، ملیکا ناصحی* 




 ، فائزه قلیپور
، فائزه قلیپور 

 ، لیلا خجسته
، لیلا خجسته 

 ، محمدباقر گیلک حکیمآبادی
، محمدباقر گیلک حکیمآبادی 

 ، فاطمه باهوش فیضآبادی
، فاطمه باهوش فیضآبادی 

 ، فاطمه دنکوب
، فاطمه دنکوب 

 ، ملیکا ناصحی*
، ملیکا ناصحی* 


واژههای کلیدی: کتامین، هیستوپاتولوژی، قلب، موشهای صحرایی نر، موشهای صحرایی ماده، دوز کوتاهمدت، دوز بلندمدت
متن کامل [PDF 872 kb]
(455 دریافت)
| چکیده (HTML) (1404 مشاهده)
متن کامل: (792 مشاهده)
مقدمه
اولین عمل جراحی موفقیتآمیز با بیهوشی عمومی در سال 1846 بهواسطه گاز اتر انجام شد و بدین صورت نگرانی بشر از درد جراحی از میان رفت (1). کتامین یکی از داروهای بیهوشی است که از دهه 1960 به منظور بیهوشی عمومی مورد استفاده قرار گرفت. کتامین در واقع یک آنالوگ از داروی Phencyclidine با قدرت یک دهم برابر آن میباشد (2). این دارو ترکیبی از 2 ایزومر نوری یا انانتیومر محلول در آب S-کتامین و R-کتامین است. مکانیسم عمل بهصورت بلاک کردن گیرندههای N-متیل D-آسپارتات (NMDARs) میباشد. کانالهای یونی NMDA نوعی از گیرنده های گلوتامات میباشند (3). کتامین با ورود به این کانال های یونی و جذب شدن در منافذ کانال مانع از عملکرد آن میشود. هر دو ایزومر این توانایی را دارند با این تفاوت که S-کتامین قدرت بیشتری در بلاک کردن NMDARs دارد لذا اغلب در بیهوشی عمومی ترجیح داده میشود (4،5). کانال NMDA از اجزای مهم انتقال عصبی تحریکی و تشکیل حافظه است (6). همین مکانیسم باعث اثرات تجزیه ای کتامین میشود(7) به این معنا که ادراکات حسی فرد در عین هوشیاری مختل میشود بهطوری که با افزایش دوز این تجربه عمیق تر شده و به سمت حالتهای رویا مانند بصری حتی با چشم باز و آشفتگی فکری میرود (5). دوزهای بالای کتامین منجر به یک حالت تفکیک عمیق همراه با از دست دادن هوشیاری و فراموشی میشود (6). کتامین در کبد متابولیزه شده و متابولیت هایی همچون نورکتامین (با قدرت اثر 3/1 الی 5/1 کتامین)، دهیدرونورکتامین، هیدروکسی کتامین، هیدروکسی نورکتامین (HNK) تشکیل میدهد (8). امروزه کاربرد کتامین به بیهوشی جنرال محدود نمیشود بلکه در درمان درد در ترکیب با سایر داروها و افسردگی موثر میباشد (9،10). همچنین مطالعات اثرات مثبتی از کتامین در درمان Post-traumatic stress disorder (PTSD) نشان داده است (11). امروزه با توجه به اثرات سایکومیمتیک این دارو، سوءاستفاده از آن در حال افزایش است بهطوری که در سال 2015 ، 58 کشور مصرف غیرقانونی آن را گزارش کردهاند (12). گیرنده NMDA در سرتاسر سیستم عصبی مرکزی وجود دارد و بدینصورت کتامین اثرات گستردهای در اکثر ارگانهای بدن دارد (13). از ویژگیهای مطلوب کتامین در بیهوشی، عدم سرکوب تنفسی و حفظ رفلکسهای حلقی-حنجرهای ست همچنین کتامین بر کاهش التهاب ریه موثر است و اثرات حفاظتی بر آسیب های ریوی و بیماران تحت ونتیلاسیون دارد (14،15). همچون سایر داروها کتامین نیز در کنار فوائد، عوارض جانبی دارد. تجویز مزمن کتامین میتواند منجر به آسیب کبدی و کلیوی، فیبروز بافتها و پروتئینوری و دژنره شدن سلولها شود (16) همچنین کتامین با افزایش متابولیسم مغزی میتواند باعث افزایش فشار داخل جمجمه میشود (2). از جمله مهمترین اثرات آن بر سیستم قلبی عروقی میباشد بهطوری که منجر به منع مصرف کتامین جهت بیهوشی از سوی FDA در بیمارانی که افزایش فشارخون میتواند سلامتی آنها را به خطر اندازد، شده است (17). مطالعات متعدد حاکی از آن است که کتامین با اثرات سمپاتومیمتیک خود روی سیستم قلبی عروقی اثر گذاشته و موجب افزایش فشارخون، ضربان قلب و افزایش برونده قلبی میشود. در افرادی که در شوک هستند نیز به علت درماندگی نوروترانسمیترهای آدرنرژیک ممکن است ضعف عضله میوکارد رخ دهد (13،14،17). همچنین در پژوهشی تجویز طولانیمدت کتامین در موشها منجر به تغییر در نوار قلب بهصورت بلند شدن ST و افزایش تروپونین سرم و نیز افزایش لاکتاتدهیدروژناز در سلولهای قلبی شده است (18). حال آنکه مطالعات انجام شده جهت بررسی تاثیر کتامین بر همودینامیک کودکان مبتلا به بیماریهای مادرزادی قلب تغییر معناداری را نشان نداده است (19). با توجه به کاربردهای روزافزون کتامین و نیز سوءاستفاده از آن ،مطالعات بیشتر بر روی عوارض قلبی - عروقی این دارو را میطلبد. پژوهش حاضر به اثرات تزریق کتامین بهصورت کوتاهمدت و بلندمدت بر روی بافت قلب موشهای صحرایی نر و ماده پرداخته است.
روشبررسی
مطالعه حاضر بهصورت تجربی و کاملاً تصادفی انجام پذیرفت. در این پژوهش ۳۰ سر موش صحرایی بالغ نژاد ویستار شامل ۱۵ موش صحرایی ماده ۱۵ موش صحرایی نر و در بازه وزنی ۲۲۰-۱۸۰ گرم ، انتخاب شدند و پس از انتقال به آزمایشگاه از نظر فعالیت قلبی عروقی همچون ضربان قلب و فشارخون مورد بررسی قرار گرفتند. سپس به مدت دو هفته در قفسهای جنس PVC شفاف در شرایط یکسان با درجه حرارت اتاق و رطوبت 60 % و با روزی 12 ساعت روشنایی و 12 تاریکی و بدون شرایط استرسزا قرار گرفتند تا عوامل محیطی که احتمال خطا در مطالعه را ایجاد میکردند حذف گردند. پس از این مدت موشها بهصورت جداگانه در قفسهای استاندارد قرار گرفته و بهصورت تصادفی به شش گروه کنترل نر سالم (MC) و کنترل ماده سالم (FC) و موشهای نر بیهوش شده با کتامین بلندمدت ((ML و موش های ماده بیهوش شده با کتامین بلندمدت ((FL و موش های نر بیهوش شده با کتامین کوتاهمدت مکرر ((MS و گروه موشهای ماده بیهوش شده با کتامین کوتاهمدت مکرر (FS) تقسیم شدند. تزریق کتامین در همه موشها به جز گروههای کنترل در عضله خلفی ران و به مدت ۴ هفته صورت گرفت. گروهی که تحت بیهوشی بلندمدت با کتامین قرار میگرفتند یک بار در هفته کتامین با دوز ۷۵ میلیگرم دریافت میکردند و گروهی که تحت بیهوشی کوتاهمدت مکرر با کتامین قرار گرفتند ۳ بار در هفته کتامین با دوز ۲۵ میلیگرم دریافت میکردند. پس از گذشت چهار هفته موشها با استفاده از کلروفرم آسانکشی شدند و از ناحیه قفسه سینه مورد کالبد شکافی قرار گرفتند. قلب و عروق جدا شده و در محلول فرمالین ۱۰ درصد قرار گرفتند. پس از ۲۴ ساعت از تثبیت نمونه توسط فرمالین، لام هیستوپاتولوژیک از بافتها تهیه شده و نمونه ها توسط هماتوکسیلین و ائوزین رنگآمیزی شدند و توسط میکروسکوپ نوری مورد ارزیابی قرار گرفتند.
نتایج
در مطالعه حاضر 30 راس موش به 6 گروه تقسیم شدند: گروه کنترل نر سالم و گروه کنترل ماده سالم و گروه موش نر بیهوش شده با کتامین بلندمدت و گروه موش ماده بیهوش شده با کتامین بلندمدت و گروه موش نر بیهوش شده با کتامین کوتاهمدت مکرر و گروه موش ماده بیهوش شده با کتامین کوتاهمدت مکرر. تزریق ماده بیهوشی بهصورت عضلانی در داخل عضله خلفی ران به مدت 4 هفته صورت گرفت که در بیهوشی کوتاهمدت مکرر تزریق 3 بار در هفته، هر بار mg25 کتامین و در بیهوشی بلندمدت یکبار در هفته با دوز mg75 صورت گرفت که پس از 4 هفته تمامی موشها بیهوش و قلب و عروق جدا شد.
نتایج بافتشناسی بهدست آمده از نمونههای قلب گروههای مورد آزمایش بدین صورت بوده است:
1- گروه کنترل موشهای نر سالم (MC): در بررسی نمونههای بافتی گروه MC بافت قلب با مشخصات طبیعی بافتی و همراه با نظم کامل رویت شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) بافت مشخص و منظم بودند (تصویر 1-A ). سلول های قلبی دارای سیتوپلاسم اسیدیوفیل و هسته های بازوفیلیک (فلش سبز) و حاشیه مشخص بودند. دوشاخگی (فلش زرد) در اغلب نواحی بافتی و مسیر سلولی دیده شد. هیچ نوع تغییری از جمله خونریزی، التهاب و پراکندگی در بافت دیده نشد(تصویر 1-B ).
2- گروه کنترل موشهای صحرایی ماده سالم (FC): در نمونههای گروه FC بافت قلب دارای مشخصات طبیعی بافتی و همراه با نظم بوده است. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) بافت مشخص بوده (تصویر 1-C ) و سلولهای بافت قلب دارای سیتوپلاسم اسیدوفیل و هستههای بازوفیلیک (فلش سبز) بودند. دوشاخگی (فلش زرد) در اغلب نواحی بافت دیده شد (تصویر 1-D ). هیچ نوع تغییری از جمله خونریزی، التهاب و پراکندگی در بافت رویت نشد.
3- دوزهای کوتاهمدت کتامین در موشهای صحرایی نر (MS): در نمونههای بافت قلب موشهای صحرایی نر تیمار شده با دوز کوتاهمدت کتامین بافت قلبی با ظاهر و مشخصات طبیعی دیده شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) مشخص و منظم بودند (تصویر 2-A ). ویژگیهای سلولی، سیتوپلاسم، هستهها (فلش سبز)، دوشاخگی سلولی (فلش زرد) دارای نظم و شکل نرمال بودند (تصویر 2-B ). اثری از تغییرات بافتی همانند هیپرتروفی و تجمع خونی و سلولهای التهابی مشاهده نشد و بهطور کل در مقایسه با گروه کنترل تغییر خاصی در این گروه وجود نداشت.
4- دوز کوتاهمدت کتامین در موش های صحرایی ماده (FS): در نمونه های بافتی موش های صحرایی ماده تیمار شده با دوزهای کوتاهمدت کتامین مانند گروههای کنترل و نیز نرهای تیمار شده با دوزهای کوتاهمدت بافت قلبی ظاهر و مشخصات طبیعی داشته است. مقاطع عرضی(فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) منظم بوده (تصویر 2-C ) و ویژگیهای سلولی، سیتوپلاسم، هستهها (فلش سبز)، دوشاخگی سلولی (فلش زرد) در حالت طبیعی بودند (تصویر 2-D ). تغییرات بافتی از جمله هیپرتروفی و تجمع خون و سلولهای التهابی مشاهده نگردید.
5- دوز بلندمدت کتامین در موش های صحرایی نر (ML): در نمونه های بافتی قلب موش های صحرایی تیمار شده با دوز بلندمدت کتامین میزانی از تجمعات بافتی (فلش قرمز) همراه با فضاهای خالی و فواصل بین سلولی (فلش آبی) دیده شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) منظم و مشخص بودهاند. سایر تغییرات سلولی از جمله تغییرات سیتوپلاسم، هسته (فلش سبز)، پرخونی و التهاب قابل رویت نشد. (تصویر 3 – A،B)
6- دوز بلندمدت کتامین در موشهای صحرایی ماده: در نمونههای بافتی موشهای صحرایی ماده تیمار شده با دوز بلندمدت کتامین در مقایسه با نرهای تیمار شده با دوز بلندمدت در بافت قلب شواهدی از تجمعات بافتی وجود نداشته اما اندکی فضاهای خالی و فواصل بین سلولی (فلش آبی) دیده شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) منظم و مشخص بودهاند. سایر تغییرات سلولی از جمله تغییرات سیتوپلاسم، هسته (فلش سبز)، پرخونی و التهاب همانند گروه دوز بلندمدت نر، وجود نداشت. (تصویر 3 – C،D)
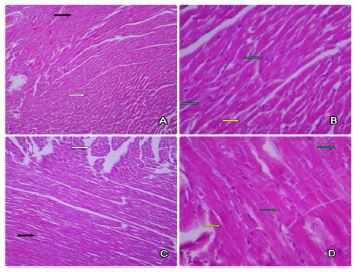
تصویر 1 : A) مقطع بافت شناسی قلب موش صحرایی گروه MC. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
B) مقطع بافت شناسی قلب موش صحرایی گروه MC. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
C) مقطع بافت شناسی قلب موش صحرایی گروه FC. (رنگ آمیزی هماتوکسیلین و ائوزین ×100).
D) مقطع بافت شناسی قلب موش صحرایی گروه FC. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
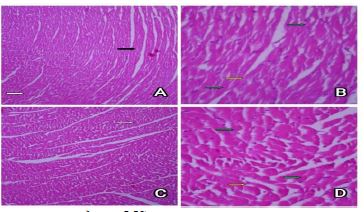
تصویر 2 : A) مقطع بافت شناسی قلب موش صحرایی گروه MS. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
B) مقطع بافت شناسی قلب موش صحرایی گروه MS. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
C) مقطع بافت شناسی قلب موش صحرایی گروه FS. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
D) مقطع بافت شناسی قلب موش صحرایی گروه FS. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
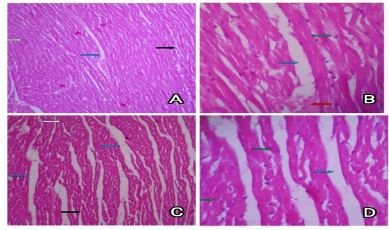
تصویر 3 : A) مقطع بافت شناسی قلب موش صحرایی گروه ML. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
B) مقطع بافت شناسی قلب موش صحرایی گروه ML. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
C) مقطع بافت شناسی قلب موش صحرایی گروه FL. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
D) مقطع بافت شناسی قلب موش صحرایی گروه FL. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
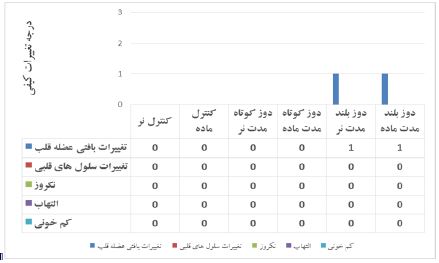
نمودار 1: تفکیک و درجه بندی تغییرات کیفی پدید آمده در متغیرهای مورد ارزیابی بافت قلب
تغییرات کیفی پدید آمده و مشاهده شده در بافت قلب هر گروه به صورت زیر تفکیک و درجه بندی شده است. بدین صورت که درجه 0 بیانگر عدم مشاهده تغییر، درجه 1 بیانگر تغییرات خفیف، درجه 2 بیانگر تغییرات متوسط و درجه 3 بیانگر تغییرات شدید میباشند.
بحث
کتامین آنتاگونیست غیر رقابتی گیرنده NMDA، از اجزای مهم انتقال عصبی تحریکی و تشکیل حافظه، میباشد. مطالعات گذشته عوارض قلبی - عروقی متعددی از جمله افزایش مارکرهای قلبی، مختل شدن همودینامیک و تغییرات بافتی و سلولی را بیان داشتند (13،14،17،18). مطالعه حاضر به منظور بررسی اثرات بیهوشی کوتاهمدت مکرر و بلندمدت با کتامین بر روی تغییرات هیستوپاتولوژیک بافت قلب در موش های صحرایی نر و ماده انجام شد.براساس نتایج هیستوپاتولوژیک پژوهش حاضر، تزریق بلندمدت کتامین موجب تجمعات بافتی در بافت قلب موش های نر و افزایش فواصل بین سلولی در موش های نر و ماده میشود. در مقاطع بافتشناسی قلب موشهای دریافتکننده دوزهای کوتاهمدت، تغییرات کیفی مشاهده نمیشود. مطالعهای بر روی رتها و خرگوشها به منظور بررسی اثرات تزریق کتامین بر روی بطن و نیز اثرات حفاظتی متوپرولول انجام شد. تزریق بهصورت داخل صفاقی و 40mg/kg روزانه به مدت 12 هفته در موشها و 8 هفته در خرگوشها انجام شد. در بررسی هیستوپاتولوژیک با رنگآمیزی H&E کاردیومیوسیتهای هایپرتروفیک وادماتو با هستههای تحریف شده و با اندازههای متفاوت هم در خرگوشها و هم در موشها مشاهده شد. کتامین باعث افزایش سلولهای آپوپتوتیک شد بهطوری که تعداد این سلولها در گروه کتامین در هر HPF تقریباً 30 برابر نسبت به بافت قلب گروه کنترل بوده است (20). نتایج مشابهی در مطالعه لی و همکاران بهدست آمد. پس از 14 روز مواجهه موشها با کتامین با داشتن حق انتخاب به این صورت که با انتخاب سوراخ فعال 0.5mg/kg کتامین تزریق میشده بافت قلب و کلیه دچار آسیب شدند از جمله هایپرتروفی و افزایش وزن ارگان نسبت به وزن بدن، چینش نامنظم سلولها و هستههای نامنظم و تحریف شده و نیز افزایش چشمگیر درصد سلولهای آپوپتوتیک در قلب (21). پژوهشی دیگر فیبروز میوکارد متعاقب تزریق داخل عضلانی دوز بالای کتامین (175mg) به همراه دوز پایینتری از زایلازین (35mg)، دارویی بیهوشی مورد استفاده در دامپزشکی، 8_10 مرتبه طی یکسال را بیان داشته است (22). کاراکورت و همکاران در بررسی هیستوپاتولوژیک قلب موشهای نر بعد از تزریق 30mg/kg/daily به مدت 30 روز شاهد دژنراسیون شدید کاردیومیوسیتها و انفیلتراسیون سلولهای تک هستهای و نیز خونریزی در بافت بودند (23). در مطالعه ما تغییرات هیستوپاتولوژیک در دوزهای طولانیمدت محدود به تجمعات بافتی و افزایش فواصل بین سلولی است و تغییرات سلولی مشاهده نمیشود. این تفاوت با توجه به کوتاهتر بودن مدت درمان و یا دوز در مطالعه حاضر نسبت به مطالعات ذکر شده میتواند قابلتوجیه باشد. در مطالعه دیگری اثرات دورههای زمانی متفاوت تزریق کتامین داخل صفاقی بر بافت قلب رتهای نر بررسی شده است. کتامین با دوز 30mg/kg روزانه تزریق شد. از نظر هیستوپاتولوژی گروهی از رتها که 6 هفته مواجهه داشتند Score1 دریافت کردند به این معنا که دژنراسیون سلولها (لیز و وزیکوله شدن سیتوپلاسم) تنها در نوک بطن مشاهده شد. گروهی که کتامین را به مدت 16 هفته دریافت کردندScore2 به این معنا که دژنراسیون سلول ها در همه جای بطن مشاهده شد و گروه سوم که 28 هفته کتامین دریافت کردند Score3 به این معنا که دژنراسیون سلولی در کل بافت قلب قابل رویت بوده. تغییرات هیستوپاتولوژی مشابه مطالعه حاضر بوده از این جهت که تغییرات وابسته به دوز بوده است و در دوز های بالا تغییرات بیشتری رویت شده است. در مطالعه حاضر نیز تغییرات بافتی تنها در دوزهای طولانیمدت مشاهده میشود. تفاوت در شدت تغییرات را میتوان به تفاوت در بازههای مواجهه در دو مطالعه نسبت داد (18). در مطالعه حاضر، تغییرات هیستوپاتولوژیک اعم از تجمعات سلولی و افزایش فواصل سلولی در تجویز یک ماهه کتامین در موشها به تفکیک جنس مشاهده شد. تفاوت معناداری در تغییرات هیستوپاتولوژیک به تفکیک جنس مشاهده نشد. با ادامه تجویز کتامین به مدت بیشتر، امکان پی بردن به تغییرات بیشتر سلولی و هیستوپاتولوژیک احتمالی و نیز تاثیر جنسیت بر عوارض قلبی کتامین میتوانست فراهم شود که از محدودیتهای مطالعه حاضر بوده است. لذا مطالعات بیشتر با دوزهای بالای کتامین به تفکیک جنس میتواند به این پرسش پاسخ دهد که آیا جنسیت از فاکتور های تاثیرگذار بر اثرات قلبی کتامین است یا خیر.
نتیجهگیری
در مطالعه حاضر تغییرات هستوپاتولوژیک بافت قلب بهصورت تجمعات سلولی و افزایش فواصل سلولی در دوزهای بلندمدت کتامین در موشهای صحرایی مشاهده شد. تغییرات در دو جنس نر و ماده تفاوت معناداری نداشت. این نتایج در راستای نتایج مطالعات پیشین بوده و تناقض فاحشی بهدست نیامد.
سپاسگزاری
این مطالعه بخشی از پایاننامه دانشجویی میباشد. بدینوسیله از حمایتهای حوزه پژوهش و کمیته تحقیقات دانشکده پزشکی دانشگاه آزاد اسلامی واحد شاهرود کمال تشکر و قدردانی را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
در مطالعه پیش رو کلیه موازین اخلاقی در مورد نحوه کار با حیوانات آزمایشگاهی طبق پروتکل رعایت شده و با کد IR.IAU.SHAHROOD.REC.1397.050 به تایید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد شاهرود رسیده است.
مشارکت نویسندگان
دکتر بهروز یحیایی، محمدباقر گیلک حکیم آبادی و دکتر لیلا خجسته در ارائه ایده، دکتر بهروز یحیایی، ملیکا ناصحی و فائزه فلی پور در طراحی مطالعه، محمدباقر گیلک حکیم آبادی، فاطمه باهوش فیض آبادی و فاطمه دنکوب در جمعآوری دادهها، دکتر بهروز یحیایی و ملیکا ناصحی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
اولین عمل جراحی موفقیتآمیز با بیهوشی عمومی در سال 1846 بهواسطه گاز اتر انجام شد و بدین صورت نگرانی بشر از درد جراحی از میان رفت (1). کتامین یکی از داروهای بیهوشی است که از دهه 1960 به منظور بیهوشی عمومی مورد استفاده قرار گرفت. کتامین در واقع یک آنالوگ از داروی Phencyclidine با قدرت یک دهم برابر آن میباشد (2). این دارو ترکیبی از 2 ایزومر نوری یا انانتیومر محلول در آب S-کتامین و R-کتامین است. مکانیسم عمل بهصورت بلاک کردن گیرندههای N-متیل D-آسپارتات (NMDARs) میباشد. کانالهای یونی NMDA نوعی از گیرنده های گلوتامات میباشند (3). کتامین با ورود به این کانال های یونی و جذب شدن در منافذ کانال مانع از عملکرد آن میشود. هر دو ایزومر این توانایی را دارند با این تفاوت که S-کتامین قدرت بیشتری در بلاک کردن NMDARs دارد لذا اغلب در بیهوشی عمومی ترجیح داده میشود (4،5). کانال NMDA از اجزای مهم انتقال عصبی تحریکی و تشکیل حافظه است (6). همین مکانیسم باعث اثرات تجزیه ای کتامین میشود(7) به این معنا که ادراکات حسی فرد در عین هوشیاری مختل میشود بهطوری که با افزایش دوز این تجربه عمیق تر شده و به سمت حالتهای رویا مانند بصری حتی با چشم باز و آشفتگی فکری میرود (5). دوزهای بالای کتامین منجر به یک حالت تفکیک عمیق همراه با از دست دادن هوشیاری و فراموشی میشود (6). کتامین در کبد متابولیزه شده و متابولیت هایی همچون نورکتامین (با قدرت اثر 3/1 الی 5/1 کتامین)، دهیدرونورکتامین، هیدروکسی کتامین، هیدروکسی نورکتامین (HNK) تشکیل میدهد (8). امروزه کاربرد کتامین به بیهوشی جنرال محدود نمیشود بلکه در درمان درد در ترکیب با سایر داروها و افسردگی موثر میباشد (9،10). همچنین مطالعات اثرات مثبتی از کتامین در درمان Post-traumatic stress disorder (PTSD) نشان داده است (11). امروزه با توجه به اثرات سایکومیمتیک این دارو، سوءاستفاده از آن در حال افزایش است بهطوری که در سال 2015 ، 58 کشور مصرف غیرقانونی آن را گزارش کردهاند (12). گیرنده NMDA در سرتاسر سیستم عصبی مرکزی وجود دارد و بدینصورت کتامین اثرات گستردهای در اکثر ارگانهای بدن دارد (13). از ویژگیهای مطلوب کتامین در بیهوشی، عدم سرکوب تنفسی و حفظ رفلکسهای حلقی-حنجرهای ست همچنین کتامین بر کاهش التهاب ریه موثر است و اثرات حفاظتی بر آسیب های ریوی و بیماران تحت ونتیلاسیون دارد (14،15). همچون سایر داروها کتامین نیز در کنار فوائد، عوارض جانبی دارد. تجویز مزمن کتامین میتواند منجر به آسیب کبدی و کلیوی، فیبروز بافتها و پروتئینوری و دژنره شدن سلولها شود (16) همچنین کتامین با افزایش متابولیسم مغزی میتواند باعث افزایش فشار داخل جمجمه میشود (2). از جمله مهمترین اثرات آن بر سیستم قلبی عروقی میباشد بهطوری که منجر به منع مصرف کتامین جهت بیهوشی از سوی FDA در بیمارانی که افزایش فشارخون میتواند سلامتی آنها را به خطر اندازد، شده است (17). مطالعات متعدد حاکی از آن است که کتامین با اثرات سمپاتومیمتیک خود روی سیستم قلبی عروقی اثر گذاشته و موجب افزایش فشارخون، ضربان قلب و افزایش برونده قلبی میشود. در افرادی که در شوک هستند نیز به علت درماندگی نوروترانسمیترهای آدرنرژیک ممکن است ضعف عضله میوکارد رخ دهد (13،14،17). همچنین در پژوهشی تجویز طولانیمدت کتامین در موشها منجر به تغییر در نوار قلب بهصورت بلند شدن ST و افزایش تروپونین سرم و نیز افزایش لاکتاتدهیدروژناز در سلولهای قلبی شده است (18). حال آنکه مطالعات انجام شده جهت بررسی تاثیر کتامین بر همودینامیک کودکان مبتلا به بیماریهای مادرزادی قلب تغییر معناداری را نشان نداده است (19). با توجه به کاربردهای روزافزون کتامین و نیز سوءاستفاده از آن ،مطالعات بیشتر بر روی عوارض قلبی - عروقی این دارو را میطلبد. پژوهش حاضر به اثرات تزریق کتامین بهصورت کوتاهمدت و بلندمدت بر روی بافت قلب موشهای صحرایی نر و ماده پرداخته است.
روشبررسی
مطالعه حاضر بهصورت تجربی و کاملاً تصادفی انجام پذیرفت. در این پژوهش ۳۰ سر موش صحرایی بالغ نژاد ویستار شامل ۱۵ موش صحرایی ماده ۱۵ موش صحرایی نر و در بازه وزنی ۲۲۰-۱۸۰ گرم ، انتخاب شدند و پس از انتقال به آزمایشگاه از نظر فعالیت قلبی عروقی همچون ضربان قلب و فشارخون مورد بررسی قرار گرفتند. سپس به مدت دو هفته در قفسهای جنس PVC شفاف در شرایط یکسان با درجه حرارت اتاق و رطوبت 60 % و با روزی 12 ساعت روشنایی و 12 تاریکی و بدون شرایط استرسزا قرار گرفتند تا عوامل محیطی که احتمال خطا در مطالعه را ایجاد میکردند حذف گردند. پس از این مدت موشها بهصورت جداگانه در قفسهای استاندارد قرار گرفته و بهصورت تصادفی به شش گروه کنترل نر سالم (MC) و کنترل ماده سالم (FC) و موشهای نر بیهوش شده با کتامین بلندمدت ((ML و موش های ماده بیهوش شده با کتامین بلندمدت ((FL و موش های نر بیهوش شده با کتامین کوتاهمدت مکرر ((MS و گروه موشهای ماده بیهوش شده با کتامین کوتاهمدت مکرر (FS) تقسیم شدند. تزریق کتامین در همه موشها به جز گروههای کنترل در عضله خلفی ران و به مدت ۴ هفته صورت گرفت. گروهی که تحت بیهوشی بلندمدت با کتامین قرار میگرفتند یک بار در هفته کتامین با دوز ۷۵ میلیگرم دریافت میکردند و گروهی که تحت بیهوشی کوتاهمدت مکرر با کتامین قرار گرفتند ۳ بار در هفته کتامین با دوز ۲۵ میلیگرم دریافت میکردند. پس از گذشت چهار هفته موشها با استفاده از کلروفرم آسانکشی شدند و از ناحیه قفسه سینه مورد کالبد شکافی قرار گرفتند. قلب و عروق جدا شده و در محلول فرمالین ۱۰ درصد قرار گرفتند. پس از ۲۴ ساعت از تثبیت نمونه توسط فرمالین، لام هیستوپاتولوژیک از بافتها تهیه شده و نمونه ها توسط هماتوکسیلین و ائوزین رنگآمیزی شدند و توسط میکروسکوپ نوری مورد ارزیابی قرار گرفتند.
نتایج
در مطالعه حاضر 30 راس موش به 6 گروه تقسیم شدند: گروه کنترل نر سالم و گروه کنترل ماده سالم و گروه موش نر بیهوش شده با کتامین بلندمدت و گروه موش ماده بیهوش شده با کتامین بلندمدت و گروه موش نر بیهوش شده با کتامین کوتاهمدت مکرر و گروه موش ماده بیهوش شده با کتامین کوتاهمدت مکرر. تزریق ماده بیهوشی بهصورت عضلانی در داخل عضله خلفی ران به مدت 4 هفته صورت گرفت که در بیهوشی کوتاهمدت مکرر تزریق 3 بار در هفته، هر بار mg25 کتامین و در بیهوشی بلندمدت یکبار در هفته با دوز mg75 صورت گرفت که پس از 4 هفته تمامی موشها بیهوش و قلب و عروق جدا شد.
نتایج بافتشناسی بهدست آمده از نمونههای قلب گروههای مورد آزمایش بدین صورت بوده است:
1- گروه کنترل موشهای نر سالم (MC): در بررسی نمونههای بافتی گروه MC بافت قلب با مشخصات طبیعی بافتی و همراه با نظم کامل رویت شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) بافت مشخص و منظم بودند (تصویر 1-A ). سلول های قلبی دارای سیتوپلاسم اسیدیوفیل و هسته های بازوفیلیک (فلش سبز) و حاشیه مشخص بودند. دوشاخگی (فلش زرد) در اغلب نواحی بافتی و مسیر سلولی دیده شد. هیچ نوع تغییری از جمله خونریزی، التهاب و پراکندگی در بافت دیده نشد(تصویر 1-B ).
2- گروه کنترل موشهای صحرایی ماده سالم (FC): در نمونههای گروه FC بافت قلب دارای مشخصات طبیعی بافتی و همراه با نظم بوده است. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) بافت مشخص بوده (تصویر 1-C ) و سلولهای بافت قلب دارای سیتوپلاسم اسیدوفیل و هستههای بازوفیلیک (فلش سبز) بودند. دوشاخگی (فلش زرد) در اغلب نواحی بافت دیده شد (تصویر 1-D ). هیچ نوع تغییری از جمله خونریزی، التهاب و پراکندگی در بافت رویت نشد.
3- دوزهای کوتاهمدت کتامین در موشهای صحرایی نر (MS): در نمونههای بافت قلب موشهای صحرایی نر تیمار شده با دوز کوتاهمدت کتامین بافت قلبی با ظاهر و مشخصات طبیعی دیده شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) مشخص و منظم بودند (تصویر 2-A ). ویژگیهای سلولی، سیتوپلاسم، هستهها (فلش سبز)، دوشاخگی سلولی (فلش زرد) دارای نظم و شکل نرمال بودند (تصویر 2-B ). اثری از تغییرات بافتی همانند هیپرتروفی و تجمع خونی و سلولهای التهابی مشاهده نشد و بهطور کل در مقایسه با گروه کنترل تغییر خاصی در این گروه وجود نداشت.
4- دوز کوتاهمدت کتامین در موش های صحرایی ماده (FS): در نمونه های بافتی موش های صحرایی ماده تیمار شده با دوزهای کوتاهمدت کتامین مانند گروههای کنترل و نیز نرهای تیمار شده با دوزهای کوتاهمدت بافت قلبی ظاهر و مشخصات طبیعی داشته است. مقاطع عرضی(فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) منظم بوده (تصویر 2-C ) و ویژگیهای سلولی، سیتوپلاسم، هستهها (فلش سبز)، دوشاخگی سلولی (فلش زرد) در حالت طبیعی بودند (تصویر 2-D ). تغییرات بافتی از جمله هیپرتروفی و تجمع خون و سلولهای التهابی مشاهده نگردید.
5- دوز بلندمدت کتامین در موش های صحرایی نر (ML): در نمونه های بافتی قلب موش های صحرایی تیمار شده با دوز بلندمدت کتامین میزانی از تجمعات بافتی (فلش قرمز) همراه با فضاهای خالی و فواصل بین سلولی (فلش آبی) دیده شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) منظم و مشخص بودهاند. سایر تغییرات سلولی از جمله تغییرات سیتوپلاسم، هسته (فلش سبز)، پرخونی و التهاب قابل رویت نشد. (تصویر 3 – A،B)
6- دوز بلندمدت کتامین در موشهای صحرایی ماده: در نمونههای بافتی موشهای صحرایی ماده تیمار شده با دوز بلندمدت کتامین در مقایسه با نرهای تیمار شده با دوز بلندمدت در بافت قلب شواهدی از تجمعات بافتی وجود نداشته اما اندکی فضاهای خالی و فواصل بین سلولی (فلش آبی) دیده شد. مقاطع عرضی (فلش سفید) و ستونهای مقاطع طولی (فلش سیاه) منظم و مشخص بودهاند. سایر تغییرات سلولی از جمله تغییرات سیتوپلاسم، هسته (فلش سبز)، پرخونی و التهاب همانند گروه دوز بلندمدت نر، وجود نداشت. (تصویر 3 – C،D)

تصویر 1 : A) مقطع بافت شناسی قلب موش صحرایی گروه MC. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
B) مقطع بافت شناسی قلب موش صحرایی گروه MC. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
C) مقطع بافت شناسی قلب موش صحرایی گروه FC. (رنگ آمیزی هماتوکسیلین و ائوزین ×100).
D) مقطع بافت شناسی قلب موش صحرایی گروه FC. (رنگ آمیزی هماتوکسیلین و ائوزین×400).

تصویر 2 : A) مقطع بافت شناسی قلب موش صحرایی گروه MS. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
B) مقطع بافت شناسی قلب موش صحرایی گروه MS. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
C) مقطع بافت شناسی قلب موش صحرایی گروه FS. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
D) مقطع بافت شناسی قلب موش صحرایی گروه FS. (رنگ آمیزی هماتوکسیلین و ائوزین×400).

تصویر 3 : A) مقطع بافت شناسی قلب موش صحرایی گروه ML. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
B) مقطع بافت شناسی قلب موش صحرایی گروه ML. (رنگ آمیزی هماتوکسیلین و ائوزین×400).
C) مقطع بافت شناسی قلب موش صحرایی گروه FL. (رنگ آمیزی هماتوکسیلین و ائوزین×100).
D) مقطع بافت شناسی قلب موش صحرایی گروه FL. (رنگ آمیزی هماتوکسیلین و ائوزین×400).

نمودار 1: تفکیک و درجه بندی تغییرات کیفی پدید آمده در متغیرهای مورد ارزیابی بافت قلب
تغییرات کیفی پدید آمده و مشاهده شده در بافت قلب هر گروه به صورت زیر تفکیک و درجه بندی شده است. بدین صورت که درجه 0 بیانگر عدم مشاهده تغییر، درجه 1 بیانگر تغییرات خفیف، درجه 2 بیانگر تغییرات متوسط و درجه 3 بیانگر تغییرات شدید میباشند.
بحث
کتامین آنتاگونیست غیر رقابتی گیرنده NMDA، از اجزای مهم انتقال عصبی تحریکی و تشکیل حافظه، میباشد. مطالعات گذشته عوارض قلبی - عروقی متعددی از جمله افزایش مارکرهای قلبی، مختل شدن همودینامیک و تغییرات بافتی و سلولی را بیان داشتند (13،14،17،18). مطالعه حاضر به منظور بررسی اثرات بیهوشی کوتاهمدت مکرر و بلندمدت با کتامین بر روی تغییرات هیستوپاتولوژیک بافت قلب در موش های صحرایی نر و ماده انجام شد.براساس نتایج هیستوپاتولوژیک پژوهش حاضر، تزریق بلندمدت کتامین موجب تجمعات بافتی در بافت قلب موش های نر و افزایش فواصل بین سلولی در موش های نر و ماده میشود. در مقاطع بافتشناسی قلب موشهای دریافتکننده دوزهای کوتاهمدت، تغییرات کیفی مشاهده نمیشود. مطالعهای بر روی رتها و خرگوشها به منظور بررسی اثرات تزریق کتامین بر روی بطن و نیز اثرات حفاظتی متوپرولول انجام شد. تزریق بهصورت داخل صفاقی و 40mg/kg روزانه به مدت 12 هفته در موشها و 8 هفته در خرگوشها انجام شد. در بررسی هیستوپاتولوژیک با رنگآمیزی H&E کاردیومیوسیتهای هایپرتروفیک وادماتو با هستههای تحریف شده و با اندازههای متفاوت هم در خرگوشها و هم در موشها مشاهده شد. کتامین باعث افزایش سلولهای آپوپتوتیک شد بهطوری که تعداد این سلولها در گروه کتامین در هر HPF تقریباً 30 برابر نسبت به بافت قلب گروه کنترل بوده است (20). نتایج مشابهی در مطالعه لی و همکاران بهدست آمد. پس از 14 روز مواجهه موشها با کتامین با داشتن حق انتخاب به این صورت که با انتخاب سوراخ فعال 0.5mg/kg کتامین تزریق میشده بافت قلب و کلیه دچار آسیب شدند از جمله هایپرتروفی و افزایش وزن ارگان نسبت به وزن بدن، چینش نامنظم سلولها و هستههای نامنظم و تحریف شده و نیز افزایش چشمگیر درصد سلولهای آپوپتوتیک در قلب (21). پژوهشی دیگر فیبروز میوکارد متعاقب تزریق داخل عضلانی دوز بالای کتامین (175mg) به همراه دوز پایینتری از زایلازین (35mg)، دارویی بیهوشی مورد استفاده در دامپزشکی، 8_10 مرتبه طی یکسال را بیان داشته است (22). کاراکورت و همکاران در بررسی هیستوپاتولوژیک قلب موشهای نر بعد از تزریق 30mg/kg/daily به مدت 30 روز شاهد دژنراسیون شدید کاردیومیوسیتها و انفیلتراسیون سلولهای تک هستهای و نیز خونریزی در بافت بودند (23). در مطالعه ما تغییرات هیستوپاتولوژیک در دوزهای طولانیمدت محدود به تجمعات بافتی و افزایش فواصل بین سلولی است و تغییرات سلولی مشاهده نمیشود. این تفاوت با توجه به کوتاهتر بودن مدت درمان و یا دوز در مطالعه حاضر نسبت به مطالعات ذکر شده میتواند قابلتوجیه باشد. در مطالعه دیگری اثرات دورههای زمانی متفاوت تزریق کتامین داخل صفاقی بر بافت قلب رتهای نر بررسی شده است. کتامین با دوز 30mg/kg روزانه تزریق شد. از نظر هیستوپاتولوژی گروهی از رتها که 6 هفته مواجهه داشتند Score1 دریافت کردند به این معنا که دژنراسیون سلولها (لیز و وزیکوله شدن سیتوپلاسم) تنها در نوک بطن مشاهده شد. گروهی که کتامین را به مدت 16 هفته دریافت کردندScore2 به این معنا که دژنراسیون سلول ها در همه جای بطن مشاهده شد و گروه سوم که 28 هفته کتامین دریافت کردند Score3 به این معنا که دژنراسیون سلولی در کل بافت قلب قابل رویت بوده. تغییرات هیستوپاتولوژی مشابه مطالعه حاضر بوده از این جهت که تغییرات وابسته به دوز بوده است و در دوز های بالا تغییرات بیشتری رویت شده است. در مطالعه حاضر نیز تغییرات بافتی تنها در دوزهای طولانیمدت مشاهده میشود. تفاوت در شدت تغییرات را میتوان به تفاوت در بازههای مواجهه در دو مطالعه نسبت داد (18). در مطالعه حاضر، تغییرات هیستوپاتولوژیک اعم از تجمعات سلولی و افزایش فواصل سلولی در تجویز یک ماهه کتامین در موشها به تفکیک جنس مشاهده شد. تفاوت معناداری در تغییرات هیستوپاتولوژیک به تفکیک جنس مشاهده نشد. با ادامه تجویز کتامین به مدت بیشتر، امکان پی بردن به تغییرات بیشتر سلولی و هیستوپاتولوژیک احتمالی و نیز تاثیر جنسیت بر عوارض قلبی کتامین میتوانست فراهم شود که از محدودیتهای مطالعه حاضر بوده است. لذا مطالعات بیشتر با دوزهای بالای کتامین به تفکیک جنس میتواند به این پرسش پاسخ دهد که آیا جنسیت از فاکتور های تاثیرگذار بر اثرات قلبی کتامین است یا خیر.
نتیجهگیری
در مطالعه حاضر تغییرات هستوپاتولوژیک بافت قلب بهصورت تجمعات سلولی و افزایش فواصل سلولی در دوزهای بلندمدت کتامین در موشهای صحرایی مشاهده شد. تغییرات در دو جنس نر و ماده تفاوت معناداری نداشت. این نتایج در راستای نتایج مطالعات پیشین بوده و تناقض فاحشی بهدست نیامد.
سپاسگزاری
این مطالعه بخشی از پایاننامه دانشجویی میباشد. بدینوسیله از حمایتهای حوزه پژوهش و کمیته تحقیقات دانشکده پزشکی دانشگاه آزاد اسلامی واحد شاهرود کمال تشکر و قدردانی را داریم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
در مطالعه پیش رو کلیه موازین اخلاقی در مورد نحوه کار با حیوانات آزمایشگاهی طبق پروتکل رعایت شده و با کد IR.IAU.SHAHROOD.REC.1397.050 به تایید کمیته اخلاق در پژوهش دانشگاه آزاد اسلامی واحد شاهرود رسیده است.
مشارکت نویسندگان
دکتر بهروز یحیایی، محمدباقر گیلک حکیم آبادی و دکتر لیلا خجسته در ارائه ایده، دکتر بهروز یحیایی، ملیکا ناصحی و فائزه فلی پور در طراحی مطالعه، محمدباقر گیلک حکیم آبادی، فاطمه باهوش فیض آبادی و فاطمه دنکوب در جمعآوری دادهها، دکتر بهروز یحیایی و ملیکا ناصحی در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Robinson DH, Toledo AH. Historical Development of Modern Anesthesia. J Invest Surg 2012; 25(3): 141-9.
2- Li L, Vlisides PE. Ketamine: 50 Years of Modulating the Mind. Front Hum Neurosci 2016; 10: 612.
3- Hansen KB, Yi F, Perszyk RE, Furukawa H, Wollmuth LP, Gibb AJ, et al. Structure, Function, and Allosteric Modulation of NMDA Receptors. J Gen Physiol 2018; 150(8): 1081-1105.
4- Bonaventura J, Lam S, Carlton M, Boehm MA, Gomez JL, Solís O, et al. Pharmacological and Behavioral Divergence of Ketamine Enantiomers: Implications for Abuse Liability. Mol Psychiatry 2021; 26(11): 6704-22.
5- Kohtala S. Ketamine—50 Years in Use: From Anesthesia to Rapid Antidepressant Effects and Neurobiological Mechanisms. Pharmacol Rep 2021; 73(2): 323-45.
6- Mathew CA, Mathew SJ, Zarate Jr CA. Ketamine for Treatment-Resistant Depression: Adis; 2016.
7- Sinner B, Graf BM. Ketamine. In: Schüttler J, Schwilden H, editors. Modern Anesthetics. Berlin, Heidelberg: Springer Berlin Heidelberg; 2008; 313-33.
8- Zanos P, Moaddel R, Morris PJ, Riggs LM, Highland JN, Georgiou P, et al. Ketamine and Ketamine Metabolite Pharmacology: Insights into Therapeutic Mechanisms. Pharmacological reviews 2018; 70(3): 621-60.
9- Ahern TL, Herring AA, Stone MB, Frazee BW. Effective Analgesia with Low-Dose Ketamine and Reduced Dose Hydromorphone in ED Patients with Severe Pain. The American Journal of Emergency Medicine 2013; 31(5): 847-51.
10- Chen MH, Lin WC, Tu PC, Li CT, Bai YM, Tsai SJ, et al. Antidepressant and Antisuicidal Effects of Ketamine on the Functional Connectivity of Prefrontal Cortex-Related Circuits in Treatment-Resistant Depression: A Double-Blind, Placebo-Controlled, Randomized, Longitudinal Resting Fmri Study. Journal of Affective Disorders 2019; 259: 15-20.
11- Feder A, Parides MK, Murrough JW, Perez AM, Morgan JE, Saxena S, et al. Efficacy of Intravenous Ketamine for Treatment of Chronic Posttraumatic Stress Disorder: A Randomized Clinical Trial. JAMA Psychiatry 2014; 71(6): 681-8.
12- Orhurhu VJ, Orhurhu VJ, Vashisht R, Claus LE, Cohen SP. Ketamine Toxicity. In: StatPearls. StatPearls Publishing, Treasure Island (FL); 2023.
13- Gorlin AW, Rosenfeld DM, Ramakrishna H. Intravenous Sub-Anesthetic Ketamine for Perioperative Analgesia. J Anaesthesiol Clin Pharmacol 2016; 32(2): 160-7.
14- Kurdi MS, Theerth KA, Deva RS. Ketamine: Current Applications in Anesthesia,Pain, and Critical Care. Anesth Essays Res 2014; 8(3): 283-90.
15- Wang W, Liu S, Xu B. A Study of the Protective Effect and Mechanism of Ketamine on Acute Lung Injury Induced by Mechanical Ventilation. Eur Rev Med Pharmacol Sci 2017; 21(6):1362-7.
16- Wai MSM, Chan WM, Zhang AQ, Wu Y, Yew DT. Long-Term Ketamine and Ketamine Plus Alcohol Treatments Produced Damages in Liver and Kidney. Hum Exp Toxicol 2012; 31(9): 877-86.
17- Behlke LM, Lenze EJ, Carney RM. The Cardiovascular Effects of Newer Antidepressants in Older Adults and Those with or at High Risk for Cardiovascular Diseases. CNS Drugs 2020; 34(11): 1133-47.
18- Chan WM, Liang Y, Wai MSM, Hung ASM, Yew DT. Cardiotoxicity Induced In Mice By Long Term Ketamine And Ketamine Plus Alcohol Treatment. Toxicol Lett 2011; 207(2): 191-6.
19- Loomba RS, Gray SB, Flores S. Hemodynamic Effects of Ketamine in Children with Congenital Heart Disease and/or Pulmonary Hypertension. Congenit Heart Dis 2018; 13(5): 646-54.
20- Li Y, Shi J, Yang B, Liu L, Han C, Li W, et al. Ketamine-Induced Ventricular Structural, Sympathetic and Electrophysiological Remodelling: Pathological Consequences and Protective Effects of Metoprolol . Br J Pharmacol 2012; 165(6): 1748-56.
21- Li X, Li S, Zheng W, Pan J, Huang K, Chen R, et al. Environmental Enrichment and Abstinence Attenuate Ketamine-Induced Cardiac and Renal Toxicity. Sci Rep 2015; 5(1): 11611.
22- Marini RP, Li X, Harpster NK, Dangler C. Cardiovascular Pathology Possibly Associated with Ketamine/Xylazine Anesthesia in Dutch Belted Rabbits. Comparative Medicine 1999; 49(2):153-60.
23- Ölmeztürk Karakurt TC, Emir İ, Bedir Z, Ozkaloglu Erdem KT, Süleyman H, Sarıgül C,et al. Effects of Carvacrol on Ketamine-Induced Cardiac Injury in Rats: An Experimental Study. Drug Chem Toxicol 2024; 47(2): 166-171
1- Robinson DH, Toledo AH. Historical Development of Modern Anesthesia. J Invest Surg 2012; 25(3): 141-9.
2- Li L, Vlisides PE. Ketamine: 50 Years of Modulating the Mind. Front Hum Neurosci 2016; 10: 612.
3- Hansen KB, Yi F, Perszyk RE, Furukawa H, Wollmuth LP, Gibb AJ, et al. Structure, Function, and Allosteric Modulation of NMDA Receptors. J Gen Physiol 2018; 150(8): 1081-1105.
4- Bonaventura J, Lam S, Carlton M, Boehm MA, Gomez JL, Solís O, et al. Pharmacological and Behavioral Divergence of Ketamine Enantiomers: Implications for Abuse Liability. Mol Psychiatry 2021; 26(11): 6704-22.
5- Kohtala S. Ketamine—50 Years in Use: From Anesthesia to Rapid Antidepressant Effects and Neurobiological Mechanisms. Pharmacol Rep 2021; 73(2): 323-45.
6- Mathew CA, Mathew SJ, Zarate Jr CA. Ketamine for Treatment-Resistant Depression: Adis; 2016.
7- Sinner B, Graf BM. Ketamine. In: Schüttler J, Schwilden H, editors. Modern Anesthetics. Berlin, Heidelberg: Springer Berlin Heidelberg; 2008; 313-33.
8- Zanos P, Moaddel R, Morris PJ, Riggs LM, Highland JN, Georgiou P, et al. Ketamine and Ketamine Metabolite Pharmacology: Insights into Therapeutic Mechanisms. Pharmacological reviews 2018; 70(3): 621-60.
9- Ahern TL, Herring AA, Stone MB, Frazee BW. Effective Analgesia with Low-Dose Ketamine and Reduced Dose Hydromorphone in ED Patients with Severe Pain. The American Journal of Emergency Medicine 2013; 31(5): 847-51.
10- Chen MH, Lin WC, Tu PC, Li CT, Bai YM, Tsai SJ, et al. Antidepressant and Antisuicidal Effects of Ketamine on the Functional Connectivity of Prefrontal Cortex-Related Circuits in Treatment-Resistant Depression: A Double-Blind, Placebo-Controlled, Randomized, Longitudinal Resting Fmri Study. Journal of Affective Disorders 2019; 259: 15-20.
11- Feder A, Parides MK, Murrough JW, Perez AM, Morgan JE, Saxena S, et al. Efficacy of Intravenous Ketamine for Treatment of Chronic Posttraumatic Stress Disorder: A Randomized Clinical Trial. JAMA Psychiatry 2014; 71(6): 681-8.
12- Orhurhu VJ, Orhurhu VJ, Vashisht R, Claus LE, Cohen SP. Ketamine Toxicity. In: StatPearls. StatPearls Publishing, Treasure Island (FL); 2023.
13- Gorlin AW, Rosenfeld DM, Ramakrishna H. Intravenous Sub-Anesthetic Ketamine for Perioperative Analgesia. J Anaesthesiol Clin Pharmacol 2016; 32(2): 160-7.
14- Kurdi MS, Theerth KA, Deva RS. Ketamine: Current Applications in Anesthesia,Pain, and Critical Care. Anesth Essays Res 2014; 8(3): 283-90.
15- Wang W, Liu S, Xu B. A Study of the Protective Effect and Mechanism of Ketamine on Acute Lung Injury Induced by Mechanical Ventilation. Eur Rev Med Pharmacol Sci 2017; 21(6):1362-7.
16- Wai MSM, Chan WM, Zhang AQ, Wu Y, Yew DT. Long-Term Ketamine and Ketamine Plus Alcohol Treatments Produced Damages in Liver and Kidney. Hum Exp Toxicol 2012; 31(9): 877-86.
17- Behlke LM, Lenze EJ, Carney RM. The Cardiovascular Effects of Newer Antidepressants in Older Adults and Those with or at High Risk for Cardiovascular Diseases. CNS Drugs 2020; 34(11): 1133-47.
18- Chan WM, Liang Y, Wai MSM, Hung ASM, Yew DT. Cardiotoxicity Induced In Mice By Long Term Ketamine And Ketamine Plus Alcohol Treatment. Toxicol Lett 2011; 207(2): 191-6.
19- Loomba RS, Gray SB, Flores S. Hemodynamic Effects of Ketamine in Children with Congenital Heart Disease and/or Pulmonary Hypertension. Congenit Heart Dis 2018; 13(5): 646-54.
20- Li Y, Shi J, Yang B, Liu L, Han C, Li W, et al. Ketamine-Induced Ventricular Structural, Sympathetic and Electrophysiological Remodelling: Pathological Consequences and Protective Effects of Metoprolol . Br J Pharmacol 2012; 165(6): 1748-56.
21- Li X, Li S, Zheng W, Pan J, Huang K, Chen R, et al. Environmental Enrichment and Abstinence Attenuate Ketamine-Induced Cardiac and Renal Toxicity. Sci Rep 2015; 5(1): 11611.
22- Marini RP, Li X, Harpster NK, Dangler C. Cardiovascular Pathology Possibly Associated with Ketamine/Xylazine Anesthesia in Dutch Belted Rabbits. Comparative Medicine 1999; 49(2):153-60.
23- Ölmeztürk Karakurt TC, Emir İ, Bedir Z, Ozkaloglu Erdem KT, Süleyman H, Sarıgül C,et al. Effects of Carvacrol on Ketamine-Induced Cardiac Injury in Rats: An Experimental Study. Drug Chem Toxicol 2024; 47(2): 166-171
نوع مطالعه: کارآزمایی بالینی |
موضوع مقاله:
بیهوشی
دریافت: 1402/7/12 | پذیرش: 1402/10/27 | انتشار: 1403/5/15
دریافت: 1402/7/12 | پذیرش: 1402/10/27 | انتشار: 1403/5/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




