دوره 32، شماره 3 - ( خرداد 1403 )
جلد 32 شماره 3 صفحات 7595-7578 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Moghiseh M, Banaifar A A, Mirzayan Shanjani S, Mehrabi M. A Review on the Effects of Physical Activity and Curcumin Supplementation on the Toxicity of Disease Caused by Anthracyclines with a Review of Doxorubicin. JSSU 2024; 32 (3) :7578-7595
URL: http://jssu.ssu.ac.ir/article-1-6085-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6085-fa.html
مقیسه مجید، بنائیفر عبدالعلی، میرزایان شانجانی ساناز، مهرابی معصومه. مروری بر تاثیرات فعالیت بدنی و مکمل کورکومین بر سمیت قلبی ناشی از آنتراسایکلینها با تأکید بر دوکسوروبیسین. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (3) :7578-7595
متن کامل [PDF 1111 kb]
(515 دریافت)
| چکیده (HTML) (1507 مشاهده)
متن کامل: (1263 مشاهده)
مقدمه
سرطان یکی از رایجترین علل مرگ ومیر در جهان است. پیشبینی شده است در سال 2030 حدود 10 میلیون نفر به علت سرطان خواهند مرد. واژه سرطان به دستهای از بیماریها گفته میشود که با رشد غیرطبیعی سلولها همراه با احتمال گسترش آن به سایر نقاط بدن همراه است. درمانهای مختلفی از جمله جراحی، رادیوتراپی، ژندرمانی، هورموندرمانی و شیمیدرمانی برای سرطان وجود دارند. شیمیدرمانی به معنی بهکارگیری داروهای آنتینئوبلاستیمک به تنهایی و یا به صورت ترکیبی است. با اینحال، این داروها میتوانند به سلولهای سالم نیز آسیب برسانند و عوارض جانبی متعددی ایجاد کنند که سمیت قلبی از جمله این عوارض است. یکی ازانواع آنتیبیوتیک های مورد استفاده در درمان سرطانها آنتراسایکلینها(Anthracyclines) هستند که دوکسوروبیسین (Doxorubicin) شناخته شدهترین آنهاست که بیش از 30 سال است برای درمان انواع سرطان مورد استفاده قرار میگیرد، دوکسوروبیسین (DOX) یا آدریامایسین (Adriamycin ) به عنوان یکی از اصلیترین و مؤثرترین داروهای این خانواده شناخته شده است (1).
آنتراسایکلینها: چهار آنتراسایکلین رایج عبارتند از دوکسوروبیسین، دانوروبیسین Daunorubicin اپیروبیسین (Epirubicin) و ایداروبیسین (Idarubicin) (شکل1). دوکسوروبیسین و دانوروبیسین اولین داروهایی بودند که در بالین مورد استفاده قرار گرفتند. اپیروبیسین حجم توزیع بیشتر و همچنین نیمهعمر طولانیتری از دوکسوروبیسین دارد. نیمهعمر دوکسوروبیسین یک تا سه ساعت است در صورتیکه اپیروبیسین 31 و 35 ساعت نیمهعمر دارد. آیداروبیسین از دانوروبیسین لیپوفیلتر است و جذب سلولی بالاتری نسبت به آن دارد. دوکسوروبیسین و داونوروبیسین در زنجیرههای کوتاه خود متفاوت هستند.دوکسوروبیسین دارای یک الکل اولیه است، در حالیکه دانوروبیسین دارای یک گروه متیل است. در این بین دوکسوروبیسن (با نام تجاری آدریامایسین (Adriamycin) و دانوروبیسین با جزئیات بیشتر مورد بررسی قرار گرفتهاند، زیرا این ترکیبات فعالیت ضد توموری قویتری دارند (2).
دوکسوروبیسین به عنوان یک دارو شیمیدرمانی: دوکسوروبیسین از ترکیبات طبیعی anthracycline است که در درمان انواع بدخیمیها مانند سرطان پستان، سرطان ریه و... کاربرد دارد. این دارو در سال 1960 شناسایی شد. از نظر ساختار شیمیایی دوکسوروبیسین، حلقه B به خاطر تولید رادیکالهای آزاد که از این بخش ازاهمیت زیادی برخورد دار است. یک کاهش الکترون از حلقه B باعث شکلگیری رادیکالهای آزاد شبه کینون میشود (4).
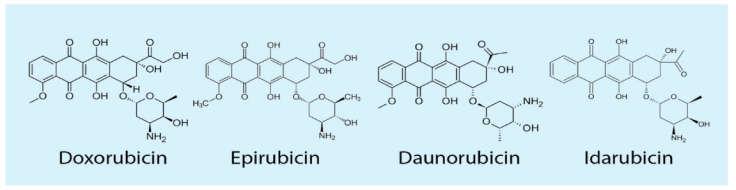
شکل 1: ساختمان بیوشیمیایی متداولترین آنتراسایکلینها (3)
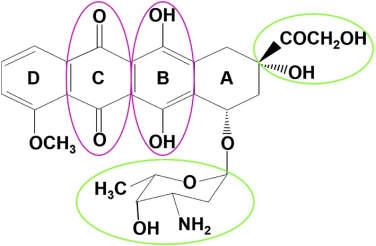
شکل 2: ساختمان دوکسوروبسین (5)
مکانیسمهای آنتیتوموری دوکسوروبیسین
•تولید رادیکالهای آزاد که باعث آسیب DNA بهوسیله لیپید پراکسیداسیون میشوند.
•اتصال به DNA وآلکیلاسیون (Alkylation)
•اتصال DNA به یکدیگر (cross-linking)
•القا آپوپتوز (Apoptosis)
•ممانعت از همانندسازی DNA از طریق مهار سنتز ماکرو مولکولها
•اثرات مستقیم غشایی
•آسیب به DNA به علت مهار توپوایزومرازII. (6).
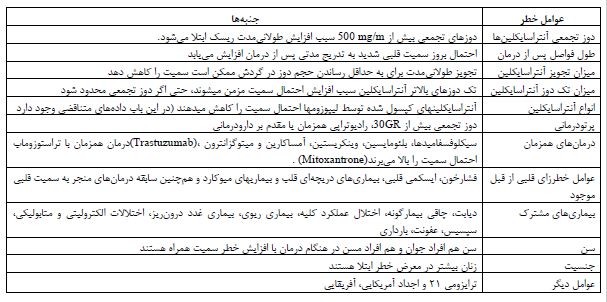
کاردیومیوپاتی ناشی از دوکسوروبیسین: عوارض قلبی این دارو شامل: نارساییهای، آریتمی، تغییرات ECG و کاردیومیوپاتی برگشت ناپذیر می شود. مطالعات نشان میدهد که 92% از کسانی که این دارو را دریافت کردهاند به عوارض قلبی پیشرفت های دچار شدهاند (7). این عارضه ممکن است به صورت حاد یا مزمن بروز کند یکی از اصلیترین دلایل پیشرفت نارسایی قلبی ناشی از دوکسوروبیسین دوز تجمعی بالای این داروست (550 mg/m²) افزایش دوز تجمعی آنتراسیکلینها یکی از فاکتورهای بالینی است که احتمال نارسایی قلبی را بیشتر میکند که برای کاهش پیشرفت نارسایی قلبی دوزهای دارو بهصورت منقسم داده میشود. در اثر مصرف آنتراسایکلینها میزان خروجی بطن چپ نیز به صورت برگشت ناپذیری کاهش مییابد. این سمیت قلبی ممکن است به صورت حاد یا مزمن بروز کند (8).
سمیت قلبی: سمیت قلبی ناشی از داروهای شیمیدرمانی دو نوع است. در نوع اول نکروز و آپوپتوز رخ میدهد و سمیت قلبی با مرگ سلولهای قلبی ایجاد و برگشتناپذیر است و در نوع دوم اختلال عملکرد سلولهای قلبی رخ میدهد که البته این نوع برگشتپذیر میباشد. سمیت قلبی مزمنی که با آنتراسیکلینها رخ میدهد از نوع یک بوده و باعث مرگ سلولهای قلبی میشود. مکانیسمهایی که مسئول اثرگذاری دوکسوروبیسین در کشتن سریع سلولهای سرطانی میباشد در ارتباط با آسیب DNA هستند. سمیت قلبی دوکسوروبیسین به علت تولید رادیکالهای آزادی است که با متابولیسم دوکسوروبیسین در ارتباط است. همچنین کمپلکسهای آهن دوکسوروبیسین ممکن است که باعث شکلگیری گونههای اکسیژن فعال میشود. اینطور بهنظر میرسد که کاردیومیوسیتها به استرس اکسیداتیو ناشی از دوکسوروبیسین حساستر هستند (7). در حقیقت غلظت بالای دوکسوروبیسین باعث آسیب اکسیداتیو در سلولهای توموری میشود. گونههای اکسیژن فعال که طی متابولیسم Doxorubicin (DOX) در سلولهای قلبی تولید میشود باعث مرگ سلولی از طریق مسیر آپوپتوز میشود و خصوصاً درمان با DOX در کاردیومیوسیتها باعث میشود که caspase9 و caspase3 فعال شوند و آزادسازی سیتوکروم C به سیتوزول را به دنبال دارند. همچنین DOX بهطور مستقیم به فسفولیپیدهای میتوکندری متصل میشود که باعث مختل شدن پروتئینهای دیواره داخل میتوکندری به همراه کاردیولیپینها میشود که میتواند باعث افزایش آزادسازی سیتوکروم C در پاسخ به استرس اکسیداتیو شود. فعالسازی آپوپتوز در بخشی از فعالسازی P38 MAPK با واسطهDOX است.PPAR ها (Peraxisome Proliferator Activated Receptor) فاکتورهای رونویسی فعال شونده هستند که باعث تنظیم ژنهای می شوند که در متابولیسم چربی ها و التهاب نقش دارند (8). PPARα نسبتاً در بافتی با گنجایش زیاد اکسیداتیو مثل کبد و کلیه (در درجهی اول بافتهای چرب) فراوان است. بیان PPARγ در کاتابولیسم لیپیدها افزایش مییابد.PPARα مسئول عملکرد اینوتروپیک و اثرات متابولیکی که برای کاردیومیوسیتها حیاتیاند، میباشد. حذف PPARα قلبی که همراه با کاهش انقباض، افزایش فشار انتهای دیاستولیک بطن چپ و کم شدن برونده قلب میباشد، باعث کاهش انقباض و افزایش پیشرفت نارسایی قلبی میشود. از آنجا که در مطالعات قبلی بر روی عضله قلب نشان دادهاند که کاردیومیوپاتی تیپ یک همراه با کاهش بیان PPARα میباشد، تحقیقات جدید نشان داده است که بیان PPARα در سمیت قلبی ناشی از دوکسوروبیسین کاهش مییابد (9).
انواع سمیت قلبی: Shenو همکارانش سمیت قلبی ناشی از دوکسوروبیسین را به دو دسته حاد و مزمن تقسیم کردند. نوع حاد طی دوره درمان و یا به سرعت پس از اتمام دوره درمان آشکار میشود و التهاب پریکارد، التهاب میوکارد و یا آریتمیها را به همراه دارد. این نوع سمیت قلبی در حالت عادی برگشتپذیر و بهطور عمومی قابل مدیریت و کنترل میباشد (10). سمیت قلبی مزمن نتیجه قرار گرفتن مکرر کاردیومیوسیتها در معرض آنتیبیوتیکهای آنتراسایکلین است که در بیماران تحت درمان با این آنتیبیوتیکها مشاهده میشود. چند هفته یا چند ماه پس از شیمیدرمانی، نارسایی احتقانی شدید قلب ایجاد میشود. کنترل و مدیریت سمیت قلبی مزمن سختتر است و ممکن است گاهی اوقات با ادم ریوی یا شوک قلبی همراه شود. سمیت قلبی مزمن ممکن است تا چند دهه پس از اتمام دوره درمان بروز کند. نوع مزمن اساساً خطرناک بوده و از نظر بالینی جدی و مهم است.
جدول 1: عوامل خطر برای سمیت قلبی القا شده توسط آنتراسیکلینها (11)
روش بررسی
در مطالعه مروری روایتی حاضر کلمات کلیدی شامل فعالیت بدنی، کورکومین، شیمیدرمانی، آنترسایکلینها، دوکسوربیسین، سرطان، سمیت قلبی با استفاده از موتور جستجوی Google Scholar جستجو شدند و مقالات ثبت شده پژوهشی و مروری بدون مدنظر قراردادن محدودیت زمانی تا تاریخ اگوست 2023 در پایگاههای الکترونیکی SienceDirect PubMed IranMedex, Scopus, وSID که چاپ شده بودند، جستجو شدند. در این مطالعه مقالاتی مورد برررسی قرار گرفتند که مرتبط با شیمیدرمانی بیماران سرطانی و انواع داروها در طیفهای مختلف شیمیدرمانی بودند و یا اشاره به تاثیرات مداخلههای همچون فعالیت بدنی و گیاهان داروئی مانند زردچوبه (کورکومین) در طی درمان با داروهای شیمیدرمانی بهخصوص دوکسوربیسین پرداخته بودند. در جست جوی اولیه 514 مقاله استخراج شد که پس از حذف موارد تکراری و ارزیابی عنوان و چکیده، 53 مقاله با شرایط لازم در مرور حاضر انتخاب شدند و اطلاعات مدنظر برای مقاله استخراج شدند.
مکانیسم القای سمیت قلبی به واسطه دوکسوروبیسین: Serrano و همکارانش بیان کردند که در مورد مکانیسم القای سمیت قلبی توسط دوکسوروبیسین اختلاف نظر وجود دارد و فرضیههای زیادی در سالهای گذشته برای توجیه آن مطرح شده است. در ابتدا باید اشاره کرد که اثرات سمیت قلبی دوکسوروبیسین بیارتباط با اثرات ضد توموری آن است زیرا این حقیقت پذیرفته شده است که سلولهای قلبی تمایز یافته هستند و تقسیم نمیشوند، بدین ترتیب اثرات ضدتوموری دوکسوربیسین که در ارتباط با مهار رونویسی DNAمیباشد، اثری بر سلولهای قلبی ندارد (12).
اهمیت استرس اکسیداتیو در سمیت قلبی: مکانیسمهای سمیت قلبی توسط آنتراسایکلینها همواره موضوع بحث و مجادله بوده است و دهها مسیر مختلف بالقوه برای آن ارائه و مطالعه شده است. با این وجود تشکیل ROSبا واسطه آهن و افزایش استرس اکسیداتیو، میوکارد تاکنون مهمترین مکانیسمی است که پیشنهاد شده است میتوکندری مکانی است که معمولاً گونههای فعال اکسیژن به دنبال خروج الکترون از چرخه انتقال الکترون و به دام افتادن آن توسط اکسیژن تولید میشوند. به این ترتیب میتوکندری به محلی جهت تولید محصولات سوپراکسید تبدیل میشود. در نقص عملکرد میتوکندری رادیکالهای آزاد بیشتری امکان رها شدن در محیط را پیدا میکنند. آنزیمهای درون میتوکندری با گرفتن یک الکترون در حلقه Cدوکسوروبیسین از حالت پایدار به حالت نیمه پایدار تبدیل میشوند. این حالتهای نیمه پایدار در واکنش با اکسیژن به حالت پایدار برمیگردند. این چرخه احیا به تولید محصولات استرس اکسیداتیو کمک میکند. استرس اکسیداتیو همچنین به عنوان القاکننده آپوپتوز از مسیر افزایش پیامهای التهابی و پیش آپوپتوزی شناخته شده است که در قلب سبب اتساع بطن در هر دو مدل انسانی و حیوانی میشود استرس اکسیداتیو به عنوان فعالکننده مسیر P38MAPK شناخته شده است که مسیر اصلی القا اسیب توسط آن در قلب میباشد (12). دادهها نشان میدهند که DOX با میتوکندری از طریق اختلال در عملکرد اصلی میتوکندریایی برهمکنش دارند و این ویژگی میتوکندریایی DOX قابلتوجه است که شباهت زیاد آن را با کاردیولیپین که یک فسفولیپید ویژه در لایه داخلی میتوکندری است، را نشان میدهد (13). همراه کاردیولیپین اتصال کراتینکیناز به غشاء داخلی میتوکندریایی را بلوکه میکند و فعالیت آنزیمهای مهم میتوکندریایی وابسته به کاردیولیپین را کاهش میدهد. احتمال دارد که تجمع DOX در میتوکندری با مجموعه از زنجیره انتقال الکترون (جایی که یک الکترون به DOX انتقال مییابد) منجر به وقوع چرخه ردوکس شود DOX (Doxorubicin) وارد میتوکندری شده و برای تشکیل شکل رادیکال واسطه نیمه کوئینون با مجموعه میتوکندریایی واکنش میدهد این شکل نیمه کوئینون DOX یک متابولیت سمی با عمر کوتاه است که به نوبه خود میتواند با O 2 واکنش دهد و ROS (14). را تولید کند ROS سپس میتواند با بیومولکولهای ROS تولید کند میتوکندریایی مجاورش که شامل چربیها، پروتئینها و نوکلئیک اسیدها میشود واکنش نشان دهد با توجه به ماهیت پروکسید آنتی DOX رابطه بین مسمومیت این دارو و کانالهای نفوذپذیر انتقالی میتواند قابل انتظار باشد (15). طبق تحقیق Oliveira و همکاران درمان با DOXباعث افزایش در مقدار تیولهای اکسید شده باقیمانده در پروتئینهای مجموعه کانالهای نفوذپذیر انتقالی شد. این محققان همچنین یک کاهش در ویتامین E و سطوح گلوتاتیون (به عنوان دو نوع آنتیاکسیدان کلیدی سلول که به کاهش حفاظت علیه تولید ROS در طول چرخه ردوکس DOXمنجر میشوند) مشاهده کردند DOX همچنین باعث تغییراتی در سیگنالهای آپوپتوزیس سلول میشود. در حیواناتی که تحت درمان DOX قرار گرفتند، یک افزایش در سطح BAX و یک کاهش در 2Bcl مشاهده شد (16). تغییر در نسبت Bcl2/BAX به صورت افزایش این نسبت در جهت موافق رهایی سیتوکروم Cموجب رهایی سیتوکروم Cاز میتوکندری میشود.DOX به عنوان عامل مسمومیت ژنی، اتصال DNA-53P را فعال میکند، این فرایند واسطه فعالسازی NF-KB میشود NF-KB یک فاکتور رونویسی است که ژن را در رابطه با پاسخهای استرسی از قبیل التهاب، استرس اکسایشی و آپوپتوزیس تنظیم میکند. گزارشات حاکی از آن است که53P دلیل آبشار کاسپاز و فعالسازی 2 مسیر: الف) 53P فعال شده توسط. DOXتولید ROS میکند ب) تجمع 53P باعث بیان ژن گیرنده APO-1 /FAS/CD95 باعث مرگ سلول، مرگ غشاء فاکتور نکروز دهنده توموری (TNF)و فاکتور رشد عصب (NGF) میشود. زمانی که CD95L به این گیرنده اتصال مییابد، باعث یک سیگنال قوی آپوپتوزیس میشود که آبشار کاسپاز را فعال کرده و منجر به مرگ سلولی میشود (17). سمیت قلبی شامل افزایش استرس اکسیداتیو در بافت قلبی میشود که افزایش تولید گونههای واکنشگر اکسیژن و افزایش پراکسیداسیون لیپیدی تأیید کننده آن است. گونههای فعال اکسیژن (ROS) تحت شرایط استرس اکسیداتیو القا شده توسط دوکسوروبیسین به وجود میآیند. همچنین قلب آنزیمهای لازم برای پاکسازی این رادیکالهای آزاد را ندارد. این عدم هماهنگی بین رادیکالهای آزاد و آنزیمهای پاکسازی کننده و نیاز بالای قلب سبب میشود پراکسیداسیون لیپیدها صورت بگیرد که نتیجه آن آسیب قلبی ناشی از دوکسوروبیسین است (18). لذا حذف و کاهش این عوامـل مخرب، توسط یک سـازوکـار محـافظتی بـه نـام سیستم دفاع ضداکسایشی صـورت مـیگیـرد؛ کـه ترکیبــی از آنتــیاکســیدانهــای آنزیمــی و غیرآنزیمی نظیر گلوتاتیون پراکسیداز(GPX) ، کاتالاز (Cat) و سوپراکسیددیسموتاز (SOD) ست که با همدیگر با اثرات مسمومیت ناشی از داروی دوکسوروبیسین مقابله میکنند (19). همانطور که ذکر شد. مهمترین عارضه جانبی دوکسوروبیسین سمیت سلولی است که در قلب سمیت قلبی نامیده میشود. سمیت قلبی به دو نوع حاد و مزمن دستهبندی میشود و عوارض آن ممکن است در نهایت به نارسایی قلبی منجر شود. مکانسیمهای مختلفی برای سمیت قلبی مطرح شده است از جمله استرس اکسیداتیو، التهاب و آپوپتوز بهنظر میرسد با کنترل این مکانیسمها توسط درمانهای کمکی بتوان سمیت قلبی ناشی از آنتراسایکلینها را کاهش داد (20). لذا تاکنون روش مورد تأیید برای مقابله با سمیت ناشی از DOX از نظر بالینی وجود ندارد. با اینحال فعالیت بدنی به عنوان یک درمان غیر دارویی و مکملهای کورکومین و کروسین به عنوان یک آنتیاکسیدان خارجی پس از تشخیص سرطان توصیه میشود در واقع نشان داده شده است که فعالیت بدنی و مکملهای کورکومین و کروسین اثرات محافظت کنندهای در برابر سمیت ناشی ازDOX دارد و ممکن است یک ابزار حیاتی در توسعه اقدامات متقابل برای محافظت در برابر اثرات سمی ازDOX باشد. در زیر شواهدی که نشان میدهد فعالیت بدنی و مکملهای کورکومین و کروسین در مقابل سمیت ناشی از DOX تأثیر محافظت کنندهای دارد را نشان میدهد (21) .
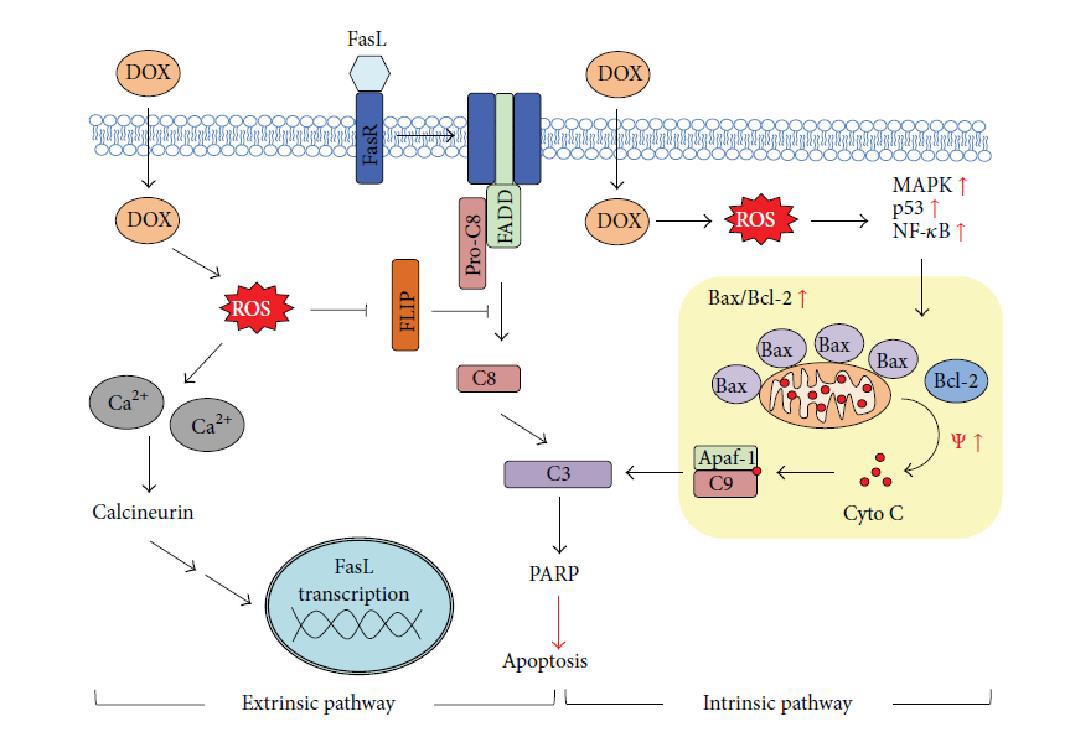
شکل 3: مکانیزم و عمل سمی دوکسوروبیسین (19)
تأثیر محافظتی فعالیت بدنی در برابر سمیت ناشی از ازDOX: ورزش می تواند اثرات جانبی DOX را کاهش دهد و منجر به چندین کارآزمایی بالینی با هدف ارزیابی ایمنی و اثربخشی آن به عنوان یک درمان کمکی برای بیماران سرطانی شده است که شیمیدرمانی DOX را دریافت میکنند. در بخشهای زیر برخی از موارد جالب توجه در بین جمعیت بیمار و جزئیات آنچه در حال حاضر در مورد مکانیسمهای محافظت از ورزش شناخته شده است، مطرح میشود. در حال حاضر، مکانیزمهای مسئول محافظت از سلولهای قلب در برابر آسیب سلولی ناشی از داروی DOX توسط تمرینات ورزش هوازی بهطور کامل شناخته نشده است. با اینحال، بر اساس آگاهی از مؤلفه های کلیدی از آسیب سلولی، چند مکانیزم میتواند اثر تمرین استقامتی بر قلب را توضیح دهد، که شامل تغییرات آناتومیک در عروق کرونر، القای پروتئینهای شوک گرمایی قلب، بهبود ظرفیت آنتیاکسیدانی سلولهای قلبی، ترمیم و نگهداری همئوستاز کلسیم سلولی و احتمالاً افزایش در سایر پروتئینهای حفاظتی قلب میشوند (22) Ascensao و همکاران به بررسی این فرضیه پرداختند که تمرین استقامتی ممکن است از طریق مکانیزم واسطه شده توسط میتوکندری باعث حفاظت قلب در برابر بیماری قلبی ناشی از القای DOX در بدن شود. گروههای تمرینی به مدت 14 هفته روزانه 60 تا 90 دقیقه روی نوارگردان تمرین انجام دادند. نتیجه نشان داد،که تمرین ورزشی باعث مهار افزایش سمیت ناشی از DOX در مقادیر مالوندیآلدئید (Malondialdehyde) شد. تمرین همچنین باعث افزایش تقریبأ دو برابری پروتئین شوک گرمایی Heat shock proteins;HSP70 و افزایش تقریبأ 5/1 برابری فعالیت سوپراکسید دیسموتاز (Superoxidedismutase; SOD) شد. این محققان به این نتیجه رسیدند تمرین ورزشی استقامتی احتمالأ از طریق بهبود دستگاه دفاع سلولی و کاهش استرس اکسایشی سلول باعث جلوگیری از اثرات سمی DOX میشود (23). مطالعات گذشته بهطور خاص، پیش درمان تمرین حاد و مزمن را نشان داده است که اختلال عملکرد قلبی ناشی از DOX را بهبود میبخشد، در حالیکه ورزش هوازی همزمان با درمان DOX میتواند عملکرد قلب را حفظ کند. تاکنون، بیشترگزارشها اثرات مفید تمرینات استقامتی برای کاهش کاردیومیوپاتی ناشی از DOX بیان کردهاند. با اینحال، Pfannenstiel و همکاران به تازگی نشان دادهاند که 12 هفته تمرین مقاومتی فزآینده قبل از درمان DOX باعث کاهش استرس اکسیداتیو در قلب و حفظ عملکرد قلبی میشود (24). این یافته حائز اهمیت است زیرا تمرین مقاومتی برای افزایش قدرت عضلانی و کاهش فشار درک شده از مؤلفههای مهم توانبخشی برای بیماران مبتلا به بیماری عروق کرونر است نتایج گروهی از تحقیقات نشان داد بیمارانیکه در طول دوره درمان در تمرینات مقاومتی شرکت کرده بودند، بیشترین پیشرفت و تحمل در کیفیت زندگی نسبت به تمرین استقامتی نشان دادند همچنین نجاتیافتهگان از سرطان که از پروتکلهای ورزشی 10 هفتهای استفاده کرده بودند، خستگی و استرس اکسیداتیو سیستمیک درآنها کاهش یافته است از سوی دیگر ورزش با افزایش بیان پروتئین آلفای فعال شده با تکثیرکننده پراکسیزوم proliferator-activated receptorgamma coactivator 1- alpha) Peroxisome ( PGC- 1α همراه است و نشان داده شده است که سازگاریهای میتوکندریای شامل افزایش میتوکندری، بیوانرژی، دینامیک و ظرفیت اکسیداتیو عضله را تسهیل میکند. علاوه بر این، فعالیت ورزشی میتواند منجر به تحریک بیوژنز برای افزایش محتوی و کیفیت میتوکندری شود. نتایج مطالعات نشان داده است که تمرین ورزشی میتواند منجر به تغییرات در رمودلینگ (افزایش ظرفیت هوازی) میتوکندریایی شود سرانجام، تحقیقات در حال انجام است و همچنان به ارزیابی مداخلات ورزشی در پیشگیری از سمیت ناشی از DOX میپردازد (27-25).
تأثیر محافظتی کورکومین در برابر سمیت ناشی ازDOX : در مورد اثر کورکومین بر سمیت قلبی ناشی از DOX نظرات ضد و نقیضی وجود دارد. با این وجود اثرات درمانی کورکومین در نتیجه احتباس کوتاه آن در گردش خون محدود میگردد. برای رفع این نقیصه در پژوهش حاضر از نانوکورکومین استفاده شد. مطالعات اخیر فعالیتهای ضد توموری کورکومین و مکانیسم آن را گزارش کردهاند، یکی از آنها توانایی ایجاد آپوپتوز در سلولهای سرطانی است. مطالعات متعدد سلولی و پیشبالینی نشان داد که کورکومین با مهار رادیکالهای آزاد و گونههای فعال اکسیژن موجب مهار آسیبهای DNA ناشی از عوامل اکسیداتیو مانند پرتوهای یونیزان میشود بنابراین ممکن است به عنوان یک عامل محافظتی بالقوه در برابر آپوپتوز ناشی از DOX در بافت قلب بهکار رود. همچنین به تازگی نشان داده شده است کورکومین، اثر محافظتی در مقابل سمیت قلبی ناشی از دوکسوروبیسین دارد و دارای پتانسیل درمانی برای بیماریهای قلبی عروقی است پژوهشگران از نتایج مطالعه خود استنتاج کردند که استفاده همزمان عصاره زردچوبه با دوکسوروبیسین در برابر سمیت قلبی حاد ناشی از DOX از طریق بهبود آنزیمهای قلب و تنظیم مسیرهایی که آپوپتوز قلبی را به راه میاندازند مانند کاهش سطح گلوتاتیون (GSH) افزایش کلسیم و تولید بیش از حد رادیکالهای اکسید کننده و در نهایت، طبیعی کردن آنزیمهای آنتیاکسیدان محافظت میکند. (28). همچنین گزارش شده کورکومین از قلب در برابر سمیت قلبی ناشی از DOXبهوسیله القاء اتوفاژی و کاهش آپوپتوز کاردیومیوسیتها محافظت میکند که مکانیزم آن شامل تغییر متابولیسم JNK است که منجر به کاهش آپوپتوز میشود. به علاوه فیبروبلاستهای طبیعی به دنبال درمان کورکومین دندروزومی (نانوکورکومین) متحمل آپوپتوز نمیشوند. اما، هدف قرار دادن 53p توسط دخالت RNA حساسیت فیبروبلاستها را به آپوپتوز ناشی از کورکومین دندروزومی افزایش میدهد اثرات محافظتی مشابه ایجاد شده توسط 53p در فیبروبلاستهای طبیعی در برابر اشعه ماوراء بنفش و عوامل شیمیدرمانی متعدد مانند کربوپلاتین، دوکسوروبیسین و غیره گزارش شده است. توضیحات چندگانه برای این مشاهدات وجود دارد. (29). پروتئین 53p نقش مهمی در تنظیم آپوپتوز ناشی از آسیب DNA در بسیاری از انواع سلولها دارد. تعدادی از مطالعات قبلی، بهویژه آنهایی که از سلولهای سرطانی استفاده کردند، نشان دادهاند که عملکرد 53p موجب افزایش مقاومت به عوامل شیمیدرمانی میشود همچنین در مقابل، ثابت شده است که 53p دارای فعالیت ضد آپوپتوزی است و مطالعات متعدد افزایش سمیت سلولی را به انواع مختلفی از داروها در ابتدا که سلولهای غیر مبدل فاقد53p هستند را نشان دادهاند. این نتایج متناقض نشان میدهد که غیرفعالسازی53p در غیاب سایر تغییرات ژنتیکی، منجر به افزایش حساسیت و نه مقاومت در برابر عوامل شیمیدرمانی متعدد میشود. این موضوع به خاطر این واقعیت است که مقاومت در برابر دارو در سلولهای تومور ممکن است ناشی از چندین اختلال ژنتیکی باشد. علاوه بر این، نقش 53p در حساسیت دارو ممکن است وابسته به نوع عامل شیمیدرمانی باشد پتانسیل آنتیاکسیدان کورکومین تولید رادیکالهای آزاد سیتوتوکسیک در اثر آسیبهای قلبی ناشی از DOX را خنثی میکند، از اینرو در مقابل از بین رفتن تمامیت غشاء محافظت میکند، ثبات غشاء را در نتیجه مهار نشت آنزیمها محافظت میکند (33-30). همچنین مکانیزمهای مربوط به کورکومین ممکن است شامل حفاظت تقویت شده توسط کورکومین به علت خواص آنتیاکسیدانی موثر آن باشد. خواص آنتیاکسیدانی کورکومین انتشار 2H2O از DOX را مهار میکند که منجر به سرکوب فعالسازی سیگنال آپوپتوزی میشود. نشان داده شده است که دوکسوروبیسین فعالیت 53p و ATM را افزایش داده و نسبت 2Bax/Bcl- را افزایش میدهد و موجب آسیب DNA و آپوپتوز سلولی میشود. از طرفی، نانوکورکومین از مرگ کاردیو میوسیتها با واسطه کاسپاز محافظت کرده و از آسیب DNA جلوگیری میکند. همچنین کورکومین مسئول ترمیم و نگهداری یکپارچگی ساختاری و معماری طبیعی میوسیتهای قلبی است که میتواند به دلیل خاصیت کورکومین در تثبیتکنندگی غشاء به حساب آید (34). بعضی از مطالعات بر باز شدن بیش از حد منفذ انتقال نفوذپذیری میتوکندری MPTP)) به عنوان عامل کلیدی برای آپوپتوز ناشی از دوکسوروبیسین دلالت دارند. با توجه به اینکه حامل فسفات میتوکندری (Pic) یک مؤلفه کلیدی MPTP است و تنظیم مثبت آن آپوپتوز را افزایش میدهد،Katamura و همکاران نشان دادند که دوکسوروبیسین PiC را تنظیم مثبت میکند و کورکومین PiC را تنظیم منفی میکند و از آپوپتوز سلولی محافظت میکند احتمال دارد که کورکومین بیان حامل فسفات میتوکندری را کاهش دهد و بالقوه آسیب استرس اکسیداتیو میتوکندری را بهبود بخشیده، میزان آپوپتوز سلولهای قلب را کاهش دهد و بنابراین سلولهای قلب را محافظت کند. این مورد ممکن است یک روش دیگر حفاظت کورکومین در برابر سمیت آنتراسایکلین علاوه بر مکانیزمهای شناخته شده مانند تخلیه یا خنثیسازی رادیکالهای آزاد، مهار آنزیمهای اکسیدانی مانند سیتوکروم 450P فرو نشاندن اکسیژن و آن را کمتر برای واکنش اکسیداتیو در دسترس قرار دادن، اثر متقابل با آبشار اکسیداتیو و جلوگیری از نتایج آن و خلع سلاح کردن خواص اکسیداتیو یونهای فلزی مانند آهن باشد (35). نتایج مطالعه دیگری نشان داد که استفاده همزمان عصاره زردچوبه با دوکسوروبیسین در برابر سمیت قلبی حاد ناشی از DOXاز طریق بهبود آنزیمهای قلب و تنظیم مسیرهایی که آپوپتوز قلبی را به راه میاندازند مانند کاهش سطح گلوتاتیون (GSH) افزایش کلسیم و تولید بیش از حد رادیکالهای اکسیدکننده و در نهایت، طبیعی،کردن آنزیمهای آنتیاکسیدان محافظت میکند. همچنین کورکومین از قلب در برابر سمیت قلبی ناشی از DOX بهوسیله القاء اتوفاگی و کاهش آپوپتوز کاردیومیوسیتها محافظت میکند که منجر به کاهش آپوپتوز میشود. از آنجا که DOX باعث کاهش معنیدار در میزان NO و آلبومین سرم میشود اما در مقابل عصاره زردچوبه با فعالیتهای درمانی متعدد اثر محافظتی و رفع مؤثر بر سمیت قلبی و کبدی ناشی از DOXرا دارد اثر محافظتی عصاره زردچوبه با خواص آنتیاکسیدانی و زدودن رادیکال آزاد آن همراه است (36،37) .
مکانیسم محافظتی فعایت بدنی و کورکومین در برابر سمیت ناشی از DOX: در حالیکه به خوبی مشخص شده است که فعالیت بدنی و کورکومین، سازگاریهای سلولی لازم را برای جلوگیری از سمیت ناشی از DOX ایجاد میکنند، اما مکانیسمهای مسئول این محافظت در برابر سمزدایی ناشناخته ماندهاند. بسیاری از مسیرها برای کاهش سمیت بافت غیر سرطانی ناشی از فعالیت بدنی و کورکومین فرض شده است. شرح کاملی از درک فعلی نقش محافظتی فعالیت بدنی و کورکومین و به خصوص فعالیت بدنی در برابر سمیت ناشی از DOX به شرح زیر بیان میگردد.
آنتی اکسیدانهای درونزا، پروتئینهای شوک گرمایی: درزمینۀ پاسخ آنزیمهای ضد اکسایشی نسبت به فعالیتهای بدنی باید گفت احتمالاً همراه با افزایش تولید رادیکالهای آزاد، سازگاریهایی در میزان تولید و فعالیت سیستم آنتیاکسیدانی آنزیمی سلولها رخ میدهد که اثرات نامطلوب آنرا خنثی میکند. از طرف دیگر، مطالعات نشان میدهد افزایش فعالیت آنزیمهای اکسایشی یک سازگاری شناخته شده نسبت به تمرینات استقامتی و کورکومین است که موجب استفاده بیشتر گلوتاتیون در سیستم دفاعی آنتیاکسیدانی بدن میشود. مکانیزمهای این دو سازگاری هنوز شناسایی نشدهاند، اما این سازگاریهای به ظاهر متناقض، تغییراتی هستند که با تمرین رخ میدهند (38) شواهد نشان میدهد که کاهش استرس اکسیداتیو ممکن است فعالسازی سیگنال آپوپتوزی را محدود کند. در میان مکانیزمهایی که تمرین ورزشی و کورکومین، آپوپتوز ناشی از DOX را در قلب موش محدود میکند میتوان به افزایش بیان HSP و فعالیت در اثر تمرین، اشاره کرد. نقش محافظتی این پروتئینهای مهم بهوسیله پیشگیری از مرگ سلولی آپوپتوزی مشخص شده است ممکن است که تمرینات ورزشی بیشتر موجب افزایش آنزیمهای آنتیاکسیدان میتوکندری قلبی شود که میتواند نقش مهمی در پیشگیری از انتشار ROS میتوکندریایی ناشی از DOX ایجاد کند و بنابراین از فعال شدن پروتئازهای قلب ناشی از DOXکه باعث آسیب قلبی و آپوپتوز میشود جلوگیری کند مکانیزمهای احتمالی که پروتئینهای شوک گرمایی میتوانند از کاردیومیوسیتها محافظت کنند شامل کنترل تاخوردن پروتئین، جلوگیری از دناتوره شدن و تجمع پروتئینهای داخل سلولی و شتاب شکست پروتئینهای آسیب دیده است. از سوی دیگر، ورزش محدودیتهای خاصی را به بافت قلبی تحمیل میکند که در نتیجه استرس مکانیکی و متابولیک ناشی از تقاضای انرژی و عملکرد افزایش یافته است. به علاوه این افزایش فشارهای فیزیولوژیک، همراه با پاسخ التهابی سیستمیک ناشی از ورزش، باعث فعالشدن آبشارهای سیگنالینگ داخل سلولی میشود، بنابراین برخی از مکانیزمهای با واسطه میتوکندری در این فرایند را مورد هدف قرار میدهند که شامل سیگنالینگ مرتبط به اکسایش-کاهش و یا آسیب سلولی و حوادث بخش بخش زیرسلولی، مسیرهای مرگ و نوسازی همچنین سیگنالینگ کنترل کیفیت و پویایی است که در این پدیده تحمل متقابل ورزش که رهایی دهنده از سمیت DOX است، شبکهای میتوکندری را درگیر میکند علاوه بر این نقش پیشگیری کننده مشاهده شده ورزش مزمن، میتواند مرتبط با افزایش مقاومت میتوکندریها باشد که دستخوش تحول نفوذپذیری و فعال شدن سیگنالینگ آپوپتوز میشود (40،39). فعالیت بدنی دارای توان بالقوه برای کاهش آپوپتوز با تنظیم مثبت مقادیر پروتئینهای حساس به استرس محافظتی ازجمله فاکتور هستهای کاپا(NF-kB) B و فاکتور رشد شبه انسولین1 IGF- است. ورزش باعث جلوگیری از پراکسیداسیون لیپیدی قلب بهطور عمده از طریق تنظیم مثبت سیستم گلوتاتیون میشود ورزش هوازی، سازگاری مطلوب در اداره کلسیم قلب ایجاد میکند که با جلوگیری از اضافه بار کلسیم در میوسیت میتواند مسمومیت قلبی را محدود کند. همچنین تمرین هوازی ممکن است موجب بسیج و لانهگزینی CPC (cardiac progenitor cells) پس از تجویز دوکسوروبیسین شود و در نتیجه میزان تغییر و تبدیل مایوسیتها را محدود کند.گزارش شده است که افزایش بیان زنجیره سنگین میوزین (MHC) وATPase شبکه سارکواندوپلاسمی (SERCA2a) بهطور مستقل یا جمعی، در حفاظت قلبی حاصل از ورزش شرکت میکنند. بهطور خاص، بیان پروتئینSERCA2a پس از قرار گرفتن در معرض DOX کاهش مییابد. کاهشSERCA2a موجب اختلال در اداره + 2 Ca و عملکرد قلب میشود. با اینحال، گزارش شده است که ورزش محتوای پروتئینSERCA2a را افزایش میدهد و عملکرد قلبی را بهبود میبخشد. بنابراین محتمل است که حفظ بیان پروتئین SERCA2a حاصل از ورزش، ممکن است محافظت کننده قلبی در برابر سمیت قلبی DOX باشد. دیگر مکانیزمهای پیشنهادی محافظت قلبی ناشی از ورزش در برابر سمیت DOX عبارتند از: تضعیف سیگنالینگ اوتوفاگی قلب، کاهش تجمع دارو و کاهش بیان RNA پیک و رونویسی ژنهای آتروفیFoxO از طرفی از نظر بیولوژیکی قابل قبول به نظر میرسد که ورزش هوازی، به عنوان یک فعالکننده قوی AMPK قلب، ممکن است سلولهای قلب را در برابر سمیت ناشی از دوکسوروبیسین محافظت کند، اگر چه هیچ مطالعهای تا به امروز این موضوع را مورد بررسی قرار نداده است (43-41). آسیب گونههای اکسیژن واکنشپذیر و پروتئینهای شوک گرمایی: نقش مرکزی ROS ناشی از دوکسوروبیسین در فعالشدن مسیرهای اصلی که منجر به آسیب قلبی میشود، پیشنهاد میدهد که استخراج قابلیت تولید ویا فعالیت ROS نویدهای قابلتوجه درمان را متوقف میکند. تمرین هوازی قلب را در برابر ROS با افزایش دستگاههای محافظتی آنتیاکسیدان درونزا محافظت میکند ورزش همچنین برای کاهش انتشار ROS ناشی از دوکسوروبیسین مستدل شده است. در واقع، دویدن بر روی نوارگردان با شدت متوسط قبل از تزریق دوکسوروبیسین، نه تنها تولید ROS از میتوکندری قلب را در مدلهای موشی کاهش میدهد، بلکه باعث افزایش بیان آنزیمهای آنتیاکسیدانی مانند گلوتاتیون پراکسیداز، کاتالاز و سوپراکسید دیسموتاز منگنز در بافت قلب میشود افزایش میزان فعالیت پروتئینهای شوک گرمایی 60 و 72 ناشی از ورزش میتواند حداقل تا حدی به حفاظت از قلب در برابر دوکسوروبیسین کمک کند. مکانیزمهای احتمالی که پروتئینهای شوک گرما میتوانند از کاردیومیوسیتها محافظت کنند شامل کنترل تاخوردن پروتئین، جلوگیری از دناتوره شدن و تجمع پروتئینهای داخل سلولی و شتاب شکست پروتئینهای آسیب دیده است (45،44).
آپوپتوز تارهای عضلانی قلب: تمرین هوازی ممکن است با تنظیم سیگنالینگ پروآپوپتوزی، محافظ قلبی باشد. Asançao و همکاران Chico و همکاران گزارش دادند که ورزش باعث جلوگیری از افزایش ناشی ازدوکسوروبیسین در فعالیت واسطههای پروآپوپتوز Bax و کاسپاز 3 بافت قلبی میشود. در مطالعههای Werner و همکارانش نشان دادند که دویدن کوتاهمدت (21) روز باعث کاهش بیان قلبی 53p (یک میانجی آپوپتوز) توسط نیمی از موشهای تحت درمان با دوکسوروبیسین شد و به میزان 5 برابر کاردیومیوسیتهای آپوپتوتیک را کاهش داد (46).
سرکوب شدن سنتز پروتئین تارهای عضلانی قلب: تمرین هوازی ممکن است موجب بسیج و لانهگزینی CPCها پس از تجویز دوکسوروبیسین شود و در نتیجه میزان تغییر و تبدیل مایوسیتها را محدود کند. این نظریه در آپوپتوز کاردیومیوسیتها مورد بررسی قرار نگرفته است. تکثیر CPC به میزان 200% افزایش یافت و با حضور سلولهای KIT (یک عامل مهم سلولهای بنیادی برای بسیج سلولهای پیشساز به محل آسیب) در قلب تکمیل شد که روی هم رفته منجر به فراوانی بیشتر کاردیومیوسیتها در حیوانات تمرین کرده نسبت به حیوانات بیتحرکت شد. بنابراین، ورزش هوازی میتواند آزادسازی، بسیج و تعقیب CPCها پس از تضعیف شدن با دوکسوروبیسین را افزایش دهد تا واکنش جبرانی را تسهیل کند. شناسایی عمل کنندههای هستهای ورزش ممکن است بینشی نسبت به مسیرهای تنظیمی رهاسازی CPC و بقای مایوسیت ایجاد کند. جالب توجه اینکه، افزایش ژنتیکی یا دارویی4GATA- مانع از آپوپتوز کاردیومیوسیت و سمیت قلبی ناشی از دارو میشود. محتمل شده است که سطح 4GATA- توسط آگونیستهای آدرنرژیک 1α - تنظیم میشود که توسط ورزش تعدیل میشوند (45). مطلوب در اداره کلسیم قلب ایجاد میکند که با جلوگیری از اضافه بار کلسیم در میوسیت میتواند مسمومیت قلبی را محدود کند. در واقع تمرین، اختلالات سیستولی و دیاستولی را با بهبود اداره کلسیم (انتشار کلسیم شبکه سارکوپلاسمی، ترشح کلسیم شبکه سارکوپلاسمی دیاستولی و تجزیه کلسیم شبکه سارکوپلاسمی) بهبود میبخشد. تنظیم فعالسازی کالپاین نیز ممکن است در این فرآیند درگیر باشد (47).
تغییرات در متابولیسم انرژی قلب: AMPK در پاسخ به تغییرات انرژی سلولی، در درجه اول با افزایشAMP و کاهش ATP یا فسفوکراتین فعال میشود. ورزش یک فعالکننده قوی فعالیت AMPK در ماهیچه اسکلتی است که از طریق فسفوریلاسیون ACC و کاهش متعاقب مالونیل CoA- منجر به تحریک حاد اکسیداسیون اسیدهای چرب میشود. تمرین هوازی همچنین یک تنظیم کننده قوی فعالیت AMPK در بافت قلب است. از نظر بیولوژیکی، قابل قبول به نظر میرسد که ورزش هوازی، به عنوان یک فعالکننده قوی AMPK قلب، ممکن است سلولهای قلب را در برابر سمیت ناشی از دوکسوروبیسین محافظت کند، اگر چه مطالعهای تا به امروز این موضوع را مورد بررسی قرار نداده است (48).
نتیجهگیری
با توجه به اثربخشی DOX در برابر طیف گستردهای از تومورها و بدخیمیها یافتن یک راهکار متقابل برای محافظت از سمیت سلولی ناشی از DOX مهم است. نتایج تحقیقات مختلف نشان میدهد که فعالیت بدنی و مکمل کورکومین استراتژیهای امیدوار کنندهای برای جلوگیری و یا درمان آسیبهای قلبی ناشی از دوکسوروبیسین است. همه مطالعات بهطور مثبت فعالیت بدنی و مکمل کورکومین را به عنوان روشهای برای تقلیل دادن سمیت قلبی از طریق افزایش عملکرد قلب، کاهش عوامل پیشبرنده آپوپتوزی، کاهش آسیب استرس اکسیداتیو، افزایش ظرفیت آنتیاکسیدانی و بهبود هموستاز کلسیم میشناسند. اما در حال حاضر نیز مناسبترین و مؤثرترین نسخه شامل فعالیت بدنی و مکمل کورکومین برای پیشگیری و یا درمان بیماری قلبی عروقی ناشی از آنتراسایکلین معرفی نشده است. اگر چه در تعدادی از مطالعات نشان داده شده است که فعالیت بدنی و مکمل کورکومین بر سمیت قلبی ناشی از DOX مفید است، ولی با توجه به بررسیهای انجام شده هیچ آزمایش بالینی انسانی منتشر شده برای ارزیابی فعالیت بدنی و مکمل کورکومین به عنوان مداخلهای برای جلوگیری و یا درمان سمیت ناشی از DOX در بیماران مبتلا به سرطان وجود ندارد و مطالعات حیوانی نیز در ابتدای راه شناخت این مکانیزمها هستند. مطالعات آینده برای تشریح بیشتر مکانیزمهای مولکولی به واسطه خاصیت محافظتی قلبی فعالیت بدنی و مکمل کورکومین در قبل، در طول و بعد از قرار گرفتن در معرض دکسوروبیسین مورد نیاز است. همچنین با توجه به این که فعالیت بدنی و مکمل کورکومین سازگارهای مفیدی را در سیستمهای مختلف بدن ایجاد میکنند، طراحی پروتکل فعالیت بدنی و نیز میزان دوزهای مصرفی برای بیمارانی که شیمیدرمانی DOX دریافت میکنند ضروری است. علاوه بر این، برای روشن شدن مکانسیمهای مربوط به محافظت سلول ناشی از فعالیت بدنی و مکمل کورکومین باید این مداخلات بهصورت مداوم انجام شود تا به توسعه درمانهای دارویی مقابله با اثرات سمی ناشی از DOXکمک کند (شکل4).
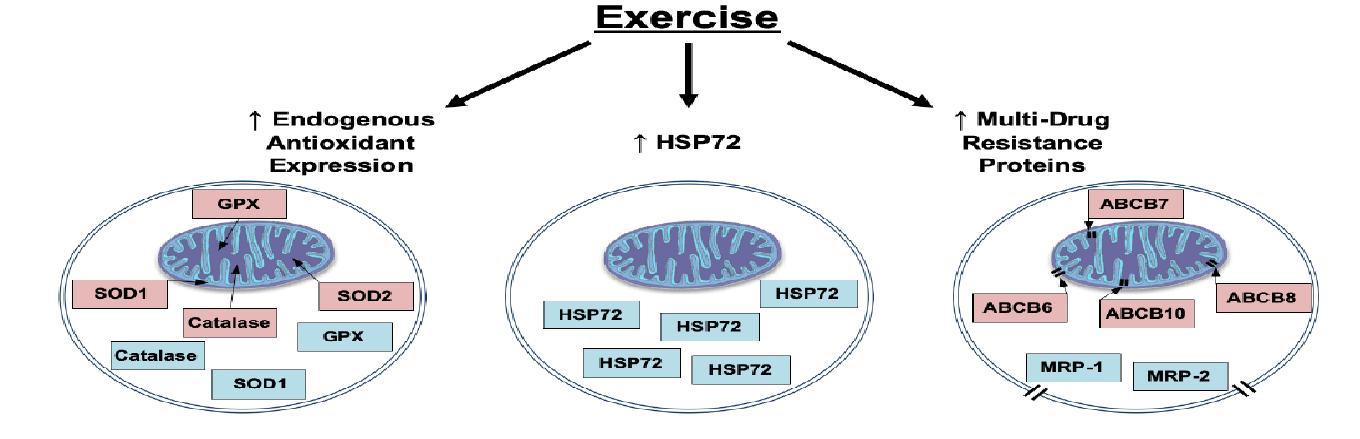
شکل 4: بهطور کلی تمرینات ورزشی باعث افزایش آنتیاکسیدانهای درون سلولی و پروتئینهای شوک گرمایی به ویژه 72 مقاوم به دارو در سلولهای تمرین کرده میشود (49)
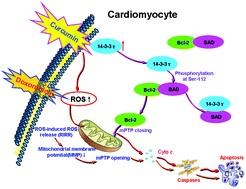
شکل 5: کورکومین از مرگ کاردیومیوسیتها با واسطه کاسپاز محافظت کرده و از آسیب DNA جلوگیری میکند. همچنین کورکومین مسئول تعمیر و نگهداری یکپارچگی ساختاری و معماری طبیعی میوسیتهای قلبی است که میتواند به دلیل خاصیت کورکومین در تثبیتکنندگی غشاء بهحساب آید (49)
سپاسگزاری
نویسندگان از دانشگاه علامه طباطبایی و پردیس شهید چمران دانشگاه فرهنگیان و دانشگاه آزاد اسلامی واحد اسلامشهر جهت حمایتهای مالی و معنوی از این مقاله تشکر میکنند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد پرند تائید شده است (کد اخلاق : IR.IAU.PIAU.REC.1400.005).
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
سرطان یکی از رایجترین علل مرگ ومیر در جهان است. پیشبینی شده است در سال 2030 حدود 10 میلیون نفر به علت سرطان خواهند مرد. واژه سرطان به دستهای از بیماریها گفته میشود که با رشد غیرطبیعی سلولها همراه با احتمال گسترش آن به سایر نقاط بدن همراه است. درمانهای مختلفی از جمله جراحی، رادیوتراپی، ژندرمانی، هورموندرمانی و شیمیدرمانی برای سرطان وجود دارند. شیمیدرمانی به معنی بهکارگیری داروهای آنتینئوبلاستیمک به تنهایی و یا به صورت ترکیبی است. با اینحال، این داروها میتوانند به سلولهای سالم نیز آسیب برسانند و عوارض جانبی متعددی ایجاد کنند که سمیت قلبی از جمله این عوارض است. یکی ازانواع آنتیبیوتیک های مورد استفاده در درمان سرطانها آنتراسایکلینها(Anthracyclines) هستند که دوکسوروبیسین (Doxorubicin) شناخته شدهترین آنهاست که بیش از 30 سال است برای درمان انواع سرطان مورد استفاده قرار میگیرد، دوکسوروبیسین (DOX) یا آدریامایسین (Adriamycin ) به عنوان یکی از اصلیترین و مؤثرترین داروهای این خانواده شناخته شده است (1).
آنتراسایکلینها: چهار آنتراسایکلین رایج عبارتند از دوکسوروبیسین، دانوروبیسین Daunorubicin اپیروبیسین (Epirubicin) و ایداروبیسین (Idarubicin) (شکل1). دوکسوروبیسین و دانوروبیسین اولین داروهایی بودند که در بالین مورد استفاده قرار گرفتند. اپیروبیسین حجم توزیع بیشتر و همچنین نیمهعمر طولانیتری از دوکسوروبیسین دارد. نیمهعمر دوکسوروبیسین یک تا سه ساعت است در صورتیکه اپیروبیسین 31 و 35 ساعت نیمهعمر دارد. آیداروبیسین از دانوروبیسین لیپوفیلتر است و جذب سلولی بالاتری نسبت به آن دارد. دوکسوروبیسین و داونوروبیسین در زنجیرههای کوتاه خود متفاوت هستند.دوکسوروبیسین دارای یک الکل اولیه است، در حالیکه دانوروبیسین دارای یک گروه متیل است. در این بین دوکسوروبیسن (با نام تجاری آدریامایسین (Adriamycin) و دانوروبیسین با جزئیات بیشتر مورد بررسی قرار گرفتهاند، زیرا این ترکیبات فعالیت ضد توموری قویتری دارند (2).
دوکسوروبیسین به عنوان یک دارو شیمیدرمانی: دوکسوروبیسین از ترکیبات طبیعی anthracycline است که در درمان انواع بدخیمیها مانند سرطان پستان، سرطان ریه و... کاربرد دارد. این دارو در سال 1960 شناسایی شد. از نظر ساختار شیمیایی دوکسوروبیسین، حلقه B به خاطر تولید رادیکالهای آزاد که از این بخش ازاهمیت زیادی برخورد دار است. یک کاهش الکترون از حلقه B باعث شکلگیری رادیکالهای آزاد شبه کینون میشود (4).

شکل 1: ساختمان بیوشیمیایی متداولترین آنتراسایکلینها (3)

شکل 2: ساختمان دوکسوروبسین (5)
مکانیسمهای آنتیتوموری دوکسوروبیسین
•تولید رادیکالهای آزاد که باعث آسیب DNA بهوسیله لیپید پراکسیداسیون میشوند.
•اتصال به DNA وآلکیلاسیون (Alkylation)
•اتصال DNA به یکدیگر (cross-linking)
•القا آپوپتوز (Apoptosis)
•ممانعت از همانندسازی DNA از طریق مهار سنتز ماکرو مولکولها
•اثرات مستقیم غشایی
•آسیب به DNA به علت مهار توپوایزومرازII. (6).
کاردیومیوپاتی ناشی از دوکسوروبیسین: عوارض قلبی این دارو شامل: نارساییهای، آریتمی، تغییرات ECG و کاردیومیوپاتی برگشت ناپذیر می شود. مطالعات نشان میدهد که 92% از کسانی که این دارو را دریافت کردهاند به عوارض قلبی پیشرفت های دچار شدهاند (7). این عارضه ممکن است به صورت حاد یا مزمن بروز کند یکی از اصلیترین دلایل پیشرفت نارسایی قلبی ناشی از دوکسوروبیسین دوز تجمعی بالای این داروست (550 mg/m²) افزایش دوز تجمعی آنتراسیکلینها یکی از فاکتورهای بالینی است که احتمال نارسایی قلبی را بیشتر میکند که برای کاهش پیشرفت نارسایی قلبی دوزهای دارو بهصورت منقسم داده میشود. در اثر مصرف آنتراسایکلینها میزان خروجی بطن چپ نیز به صورت برگشت ناپذیری کاهش مییابد. این سمیت قلبی ممکن است به صورت حاد یا مزمن بروز کند (8).
سمیت قلبی: سمیت قلبی ناشی از داروهای شیمیدرمانی دو نوع است. در نوع اول نکروز و آپوپتوز رخ میدهد و سمیت قلبی با مرگ سلولهای قلبی ایجاد و برگشتناپذیر است و در نوع دوم اختلال عملکرد سلولهای قلبی رخ میدهد که البته این نوع برگشتپذیر میباشد. سمیت قلبی مزمنی که با آنتراسیکلینها رخ میدهد از نوع یک بوده و باعث مرگ سلولهای قلبی میشود. مکانیسمهایی که مسئول اثرگذاری دوکسوروبیسین در کشتن سریع سلولهای سرطانی میباشد در ارتباط با آسیب DNA هستند. سمیت قلبی دوکسوروبیسین به علت تولید رادیکالهای آزادی است که با متابولیسم دوکسوروبیسین در ارتباط است. همچنین کمپلکسهای آهن دوکسوروبیسین ممکن است که باعث شکلگیری گونههای اکسیژن فعال میشود. اینطور بهنظر میرسد که کاردیومیوسیتها به استرس اکسیداتیو ناشی از دوکسوروبیسین حساستر هستند (7). در حقیقت غلظت بالای دوکسوروبیسین باعث آسیب اکسیداتیو در سلولهای توموری میشود. گونههای اکسیژن فعال که طی متابولیسم Doxorubicin (DOX) در سلولهای قلبی تولید میشود باعث مرگ سلولی از طریق مسیر آپوپتوز میشود و خصوصاً درمان با DOX در کاردیومیوسیتها باعث میشود که caspase9 و caspase3 فعال شوند و آزادسازی سیتوکروم C به سیتوزول را به دنبال دارند. همچنین DOX بهطور مستقیم به فسفولیپیدهای میتوکندری متصل میشود که باعث مختل شدن پروتئینهای دیواره داخل میتوکندری به همراه کاردیولیپینها میشود که میتواند باعث افزایش آزادسازی سیتوکروم C در پاسخ به استرس اکسیداتیو شود. فعالسازی آپوپتوز در بخشی از فعالسازی P38 MAPK با واسطهDOX است.PPAR ها (Peraxisome Proliferator Activated Receptor) فاکتورهای رونویسی فعال شونده هستند که باعث تنظیم ژنهای می شوند که در متابولیسم چربی ها و التهاب نقش دارند (8). PPARα نسبتاً در بافتی با گنجایش زیاد اکسیداتیو مثل کبد و کلیه (در درجهی اول بافتهای چرب) فراوان است. بیان PPARγ در کاتابولیسم لیپیدها افزایش مییابد.PPARα مسئول عملکرد اینوتروپیک و اثرات متابولیکی که برای کاردیومیوسیتها حیاتیاند، میباشد. حذف PPARα قلبی که همراه با کاهش انقباض، افزایش فشار انتهای دیاستولیک بطن چپ و کم شدن برونده قلب میباشد، باعث کاهش انقباض و افزایش پیشرفت نارسایی قلبی میشود. از آنجا که در مطالعات قبلی بر روی عضله قلب نشان دادهاند که کاردیومیوپاتی تیپ یک همراه با کاهش بیان PPARα میباشد، تحقیقات جدید نشان داده است که بیان PPARα در سمیت قلبی ناشی از دوکسوروبیسین کاهش مییابد (9).
انواع سمیت قلبی: Shenو همکارانش سمیت قلبی ناشی از دوکسوروبیسین را به دو دسته حاد و مزمن تقسیم کردند. نوع حاد طی دوره درمان و یا به سرعت پس از اتمام دوره درمان آشکار میشود و التهاب پریکارد، التهاب میوکارد و یا آریتمیها را به همراه دارد. این نوع سمیت قلبی در حالت عادی برگشتپذیر و بهطور عمومی قابل مدیریت و کنترل میباشد (10). سمیت قلبی مزمن نتیجه قرار گرفتن مکرر کاردیومیوسیتها در معرض آنتیبیوتیکهای آنتراسایکلین است که در بیماران تحت درمان با این آنتیبیوتیکها مشاهده میشود. چند هفته یا چند ماه پس از شیمیدرمانی، نارسایی احتقانی شدید قلب ایجاد میشود. کنترل و مدیریت سمیت قلبی مزمن سختتر است و ممکن است گاهی اوقات با ادم ریوی یا شوک قلبی همراه شود. سمیت قلبی مزمن ممکن است تا چند دهه پس از اتمام دوره درمان بروز کند. نوع مزمن اساساً خطرناک بوده و از نظر بالینی جدی و مهم است.
جدول 1: عوامل خطر برای سمیت قلبی القا شده توسط آنتراسیکلینها (11)

روش بررسی
در مطالعه مروری روایتی حاضر کلمات کلیدی شامل فعالیت بدنی، کورکومین، شیمیدرمانی، آنترسایکلینها، دوکسوربیسین، سرطان، سمیت قلبی با استفاده از موتور جستجوی Google Scholar جستجو شدند و مقالات ثبت شده پژوهشی و مروری بدون مدنظر قراردادن محدودیت زمانی تا تاریخ اگوست 2023 در پایگاههای الکترونیکی SienceDirect PubMed IranMedex, Scopus, وSID که چاپ شده بودند، جستجو شدند. در این مطالعه مقالاتی مورد برررسی قرار گرفتند که مرتبط با شیمیدرمانی بیماران سرطانی و انواع داروها در طیفهای مختلف شیمیدرمانی بودند و یا اشاره به تاثیرات مداخلههای همچون فعالیت بدنی و گیاهان داروئی مانند زردچوبه (کورکومین) در طی درمان با داروهای شیمیدرمانی بهخصوص دوکسوربیسین پرداخته بودند. در جست جوی اولیه 514 مقاله استخراج شد که پس از حذف موارد تکراری و ارزیابی عنوان و چکیده، 53 مقاله با شرایط لازم در مرور حاضر انتخاب شدند و اطلاعات مدنظر برای مقاله استخراج شدند.
مکانیسم القای سمیت قلبی به واسطه دوکسوروبیسین: Serrano و همکارانش بیان کردند که در مورد مکانیسم القای سمیت قلبی توسط دوکسوروبیسین اختلاف نظر وجود دارد و فرضیههای زیادی در سالهای گذشته برای توجیه آن مطرح شده است. در ابتدا باید اشاره کرد که اثرات سمیت قلبی دوکسوروبیسین بیارتباط با اثرات ضد توموری آن است زیرا این حقیقت پذیرفته شده است که سلولهای قلبی تمایز یافته هستند و تقسیم نمیشوند، بدین ترتیب اثرات ضدتوموری دوکسوربیسین که در ارتباط با مهار رونویسی DNAمیباشد، اثری بر سلولهای قلبی ندارد (12).
اهمیت استرس اکسیداتیو در سمیت قلبی: مکانیسمهای سمیت قلبی توسط آنتراسایکلینها همواره موضوع بحث و مجادله بوده است و دهها مسیر مختلف بالقوه برای آن ارائه و مطالعه شده است. با این وجود تشکیل ROSبا واسطه آهن و افزایش استرس اکسیداتیو، میوکارد تاکنون مهمترین مکانیسمی است که پیشنهاد شده است میتوکندری مکانی است که معمولاً گونههای فعال اکسیژن به دنبال خروج الکترون از چرخه انتقال الکترون و به دام افتادن آن توسط اکسیژن تولید میشوند. به این ترتیب میتوکندری به محلی جهت تولید محصولات سوپراکسید تبدیل میشود. در نقص عملکرد میتوکندری رادیکالهای آزاد بیشتری امکان رها شدن در محیط را پیدا میکنند. آنزیمهای درون میتوکندری با گرفتن یک الکترون در حلقه Cدوکسوروبیسین از حالت پایدار به حالت نیمه پایدار تبدیل میشوند. این حالتهای نیمه پایدار در واکنش با اکسیژن به حالت پایدار برمیگردند. این چرخه احیا به تولید محصولات استرس اکسیداتیو کمک میکند. استرس اکسیداتیو همچنین به عنوان القاکننده آپوپتوز از مسیر افزایش پیامهای التهابی و پیش آپوپتوزی شناخته شده است که در قلب سبب اتساع بطن در هر دو مدل انسانی و حیوانی میشود استرس اکسیداتیو به عنوان فعالکننده مسیر P38MAPK شناخته شده است که مسیر اصلی القا اسیب توسط آن در قلب میباشد (12). دادهها نشان میدهند که DOX با میتوکندری از طریق اختلال در عملکرد اصلی میتوکندریایی برهمکنش دارند و این ویژگی میتوکندریایی DOX قابلتوجه است که شباهت زیاد آن را با کاردیولیپین که یک فسفولیپید ویژه در لایه داخلی میتوکندری است، را نشان میدهد (13). همراه کاردیولیپین اتصال کراتینکیناز به غشاء داخلی میتوکندریایی را بلوکه میکند و فعالیت آنزیمهای مهم میتوکندریایی وابسته به کاردیولیپین را کاهش میدهد. احتمال دارد که تجمع DOX در میتوکندری با مجموعه از زنجیره انتقال الکترون (جایی که یک الکترون به DOX انتقال مییابد) منجر به وقوع چرخه ردوکس شود DOX (Doxorubicin) وارد میتوکندری شده و برای تشکیل شکل رادیکال واسطه نیمه کوئینون با مجموعه میتوکندریایی واکنش میدهد این شکل نیمه کوئینون DOX یک متابولیت سمی با عمر کوتاه است که به نوبه خود میتواند با O 2 واکنش دهد و ROS (14). را تولید کند ROS سپس میتواند با بیومولکولهای ROS تولید کند میتوکندریایی مجاورش که شامل چربیها، پروتئینها و نوکلئیک اسیدها میشود واکنش نشان دهد با توجه به ماهیت پروکسید آنتی DOX رابطه بین مسمومیت این دارو و کانالهای نفوذپذیر انتقالی میتواند قابل انتظار باشد (15). طبق تحقیق Oliveira و همکاران درمان با DOXباعث افزایش در مقدار تیولهای اکسید شده باقیمانده در پروتئینهای مجموعه کانالهای نفوذپذیر انتقالی شد. این محققان همچنین یک کاهش در ویتامین E و سطوح گلوتاتیون (به عنوان دو نوع آنتیاکسیدان کلیدی سلول که به کاهش حفاظت علیه تولید ROS در طول چرخه ردوکس DOXمنجر میشوند) مشاهده کردند DOX همچنین باعث تغییراتی در سیگنالهای آپوپتوزیس سلول میشود. در حیواناتی که تحت درمان DOX قرار گرفتند، یک افزایش در سطح BAX و یک کاهش در 2Bcl مشاهده شد (16). تغییر در نسبت Bcl2/BAX به صورت افزایش این نسبت در جهت موافق رهایی سیتوکروم Cموجب رهایی سیتوکروم Cاز میتوکندری میشود.DOX به عنوان عامل مسمومیت ژنی، اتصال DNA-53P را فعال میکند، این فرایند واسطه فعالسازی NF-KB میشود NF-KB یک فاکتور رونویسی است که ژن را در رابطه با پاسخهای استرسی از قبیل التهاب، استرس اکسایشی و آپوپتوزیس تنظیم میکند. گزارشات حاکی از آن است که53P دلیل آبشار کاسپاز و فعالسازی 2 مسیر: الف) 53P فعال شده توسط. DOXتولید ROS میکند ب) تجمع 53P باعث بیان ژن گیرنده APO-1 /FAS/CD95 باعث مرگ سلول، مرگ غشاء فاکتور نکروز دهنده توموری (TNF)و فاکتور رشد عصب (NGF) میشود. زمانی که CD95L به این گیرنده اتصال مییابد، باعث یک سیگنال قوی آپوپتوزیس میشود که آبشار کاسپاز را فعال کرده و منجر به مرگ سلولی میشود (17). سمیت قلبی شامل افزایش استرس اکسیداتیو در بافت قلبی میشود که افزایش تولید گونههای واکنشگر اکسیژن و افزایش پراکسیداسیون لیپیدی تأیید کننده آن است. گونههای فعال اکسیژن (ROS) تحت شرایط استرس اکسیداتیو القا شده توسط دوکسوروبیسین به وجود میآیند. همچنین قلب آنزیمهای لازم برای پاکسازی این رادیکالهای آزاد را ندارد. این عدم هماهنگی بین رادیکالهای آزاد و آنزیمهای پاکسازی کننده و نیاز بالای قلب سبب میشود پراکسیداسیون لیپیدها صورت بگیرد که نتیجه آن آسیب قلبی ناشی از دوکسوروبیسین است (18). لذا حذف و کاهش این عوامـل مخرب، توسط یک سـازوکـار محـافظتی بـه نـام سیستم دفاع ضداکسایشی صـورت مـیگیـرد؛ کـه ترکیبــی از آنتــیاکســیدانهــای آنزیمــی و غیرآنزیمی نظیر گلوتاتیون پراکسیداز(GPX) ، کاتالاز (Cat) و سوپراکسیددیسموتاز (SOD) ست که با همدیگر با اثرات مسمومیت ناشی از داروی دوکسوروبیسین مقابله میکنند (19). همانطور که ذکر شد. مهمترین عارضه جانبی دوکسوروبیسین سمیت سلولی است که در قلب سمیت قلبی نامیده میشود. سمیت قلبی به دو نوع حاد و مزمن دستهبندی میشود و عوارض آن ممکن است در نهایت به نارسایی قلبی منجر شود. مکانسیمهای مختلفی برای سمیت قلبی مطرح شده است از جمله استرس اکسیداتیو، التهاب و آپوپتوز بهنظر میرسد با کنترل این مکانیسمها توسط درمانهای کمکی بتوان سمیت قلبی ناشی از آنتراسایکلینها را کاهش داد (20). لذا تاکنون روش مورد تأیید برای مقابله با سمیت ناشی از DOX از نظر بالینی وجود ندارد. با اینحال فعالیت بدنی به عنوان یک درمان غیر دارویی و مکملهای کورکومین و کروسین به عنوان یک آنتیاکسیدان خارجی پس از تشخیص سرطان توصیه میشود در واقع نشان داده شده است که فعالیت بدنی و مکملهای کورکومین و کروسین اثرات محافظت کنندهای در برابر سمیت ناشی ازDOX دارد و ممکن است یک ابزار حیاتی در توسعه اقدامات متقابل برای محافظت در برابر اثرات سمی ازDOX باشد. در زیر شواهدی که نشان میدهد فعالیت بدنی و مکملهای کورکومین و کروسین در مقابل سمیت ناشی از DOX تأثیر محافظت کنندهای دارد را نشان میدهد (21) .

شکل 3: مکانیزم و عمل سمی دوکسوروبیسین (19)
تأثیر محافظتی فعالیت بدنی در برابر سمیت ناشی از ازDOX: ورزش می تواند اثرات جانبی DOX را کاهش دهد و منجر به چندین کارآزمایی بالینی با هدف ارزیابی ایمنی و اثربخشی آن به عنوان یک درمان کمکی برای بیماران سرطانی شده است که شیمیدرمانی DOX را دریافت میکنند. در بخشهای زیر برخی از موارد جالب توجه در بین جمعیت بیمار و جزئیات آنچه در حال حاضر در مورد مکانیسمهای محافظت از ورزش شناخته شده است، مطرح میشود. در حال حاضر، مکانیزمهای مسئول محافظت از سلولهای قلب در برابر آسیب سلولی ناشی از داروی DOX توسط تمرینات ورزش هوازی بهطور کامل شناخته نشده است. با اینحال، بر اساس آگاهی از مؤلفه های کلیدی از آسیب سلولی، چند مکانیزم میتواند اثر تمرین استقامتی بر قلب را توضیح دهد، که شامل تغییرات آناتومیک در عروق کرونر، القای پروتئینهای شوک گرمایی قلب، بهبود ظرفیت آنتیاکسیدانی سلولهای قلبی، ترمیم و نگهداری همئوستاز کلسیم سلولی و احتمالاً افزایش در سایر پروتئینهای حفاظتی قلب میشوند (22) Ascensao و همکاران به بررسی این فرضیه پرداختند که تمرین استقامتی ممکن است از طریق مکانیزم واسطه شده توسط میتوکندری باعث حفاظت قلب در برابر بیماری قلبی ناشی از القای DOX در بدن شود. گروههای تمرینی به مدت 14 هفته روزانه 60 تا 90 دقیقه روی نوارگردان تمرین انجام دادند. نتیجه نشان داد،که تمرین ورزشی باعث مهار افزایش سمیت ناشی از DOX در مقادیر مالوندیآلدئید (Malondialdehyde) شد. تمرین همچنین باعث افزایش تقریبأ دو برابری پروتئین شوک گرمایی Heat shock proteins;HSP70 و افزایش تقریبأ 5/1 برابری فعالیت سوپراکسید دیسموتاز (Superoxidedismutase; SOD) شد. این محققان به این نتیجه رسیدند تمرین ورزشی استقامتی احتمالأ از طریق بهبود دستگاه دفاع سلولی و کاهش استرس اکسایشی سلول باعث جلوگیری از اثرات سمی DOX میشود (23). مطالعات گذشته بهطور خاص، پیش درمان تمرین حاد و مزمن را نشان داده است که اختلال عملکرد قلبی ناشی از DOX را بهبود میبخشد، در حالیکه ورزش هوازی همزمان با درمان DOX میتواند عملکرد قلب را حفظ کند. تاکنون، بیشترگزارشها اثرات مفید تمرینات استقامتی برای کاهش کاردیومیوپاتی ناشی از DOX بیان کردهاند. با اینحال، Pfannenstiel و همکاران به تازگی نشان دادهاند که 12 هفته تمرین مقاومتی فزآینده قبل از درمان DOX باعث کاهش استرس اکسیداتیو در قلب و حفظ عملکرد قلبی میشود (24). این یافته حائز اهمیت است زیرا تمرین مقاومتی برای افزایش قدرت عضلانی و کاهش فشار درک شده از مؤلفههای مهم توانبخشی برای بیماران مبتلا به بیماری عروق کرونر است نتایج گروهی از تحقیقات نشان داد بیمارانیکه در طول دوره درمان در تمرینات مقاومتی شرکت کرده بودند، بیشترین پیشرفت و تحمل در کیفیت زندگی نسبت به تمرین استقامتی نشان دادند همچنین نجاتیافتهگان از سرطان که از پروتکلهای ورزشی 10 هفتهای استفاده کرده بودند، خستگی و استرس اکسیداتیو سیستمیک درآنها کاهش یافته است از سوی دیگر ورزش با افزایش بیان پروتئین آلفای فعال شده با تکثیرکننده پراکسیزوم proliferator-activated receptorgamma coactivator 1- alpha) Peroxisome ( PGC- 1α همراه است و نشان داده شده است که سازگاریهای میتوکندریای شامل افزایش میتوکندری، بیوانرژی، دینامیک و ظرفیت اکسیداتیو عضله را تسهیل میکند. علاوه بر این، فعالیت ورزشی میتواند منجر به تحریک بیوژنز برای افزایش محتوی و کیفیت میتوکندری شود. نتایج مطالعات نشان داده است که تمرین ورزشی میتواند منجر به تغییرات در رمودلینگ (افزایش ظرفیت هوازی) میتوکندریایی شود سرانجام، تحقیقات در حال انجام است و همچنان به ارزیابی مداخلات ورزشی در پیشگیری از سمیت ناشی از DOX میپردازد (27-25).
تأثیر محافظتی کورکومین در برابر سمیت ناشی ازDOX : در مورد اثر کورکومین بر سمیت قلبی ناشی از DOX نظرات ضد و نقیضی وجود دارد. با این وجود اثرات درمانی کورکومین در نتیجه احتباس کوتاه آن در گردش خون محدود میگردد. برای رفع این نقیصه در پژوهش حاضر از نانوکورکومین استفاده شد. مطالعات اخیر فعالیتهای ضد توموری کورکومین و مکانیسم آن را گزارش کردهاند، یکی از آنها توانایی ایجاد آپوپتوز در سلولهای سرطانی است. مطالعات متعدد سلولی و پیشبالینی نشان داد که کورکومین با مهار رادیکالهای آزاد و گونههای فعال اکسیژن موجب مهار آسیبهای DNA ناشی از عوامل اکسیداتیو مانند پرتوهای یونیزان میشود بنابراین ممکن است به عنوان یک عامل محافظتی بالقوه در برابر آپوپتوز ناشی از DOX در بافت قلب بهکار رود. همچنین به تازگی نشان داده شده است کورکومین، اثر محافظتی در مقابل سمیت قلبی ناشی از دوکسوروبیسین دارد و دارای پتانسیل درمانی برای بیماریهای قلبی عروقی است پژوهشگران از نتایج مطالعه خود استنتاج کردند که استفاده همزمان عصاره زردچوبه با دوکسوروبیسین در برابر سمیت قلبی حاد ناشی از DOX از طریق بهبود آنزیمهای قلب و تنظیم مسیرهایی که آپوپتوز قلبی را به راه میاندازند مانند کاهش سطح گلوتاتیون (GSH) افزایش کلسیم و تولید بیش از حد رادیکالهای اکسید کننده و در نهایت، طبیعی کردن آنزیمهای آنتیاکسیدان محافظت میکند. (28). همچنین گزارش شده کورکومین از قلب در برابر سمیت قلبی ناشی از DOXبهوسیله القاء اتوفاژی و کاهش آپوپتوز کاردیومیوسیتها محافظت میکند که مکانیزم آن شامل تغییر متابولیسم JNK است که منجر به کاهش آپوپتوز میشود. به علاوه فیبروبلاستهای طبیعی به دنبال درمان کورکومین دندروزومی (نانوکورکومین) متحمل آپوپتوز نمیشوند. اما، هدف قرار دادن 53p توسط دخالت RNA حساسیت فیبروبلاستها را به آپوپتوز ناشی از کورکومین دندروزومی افزایش میدهد اثرات محافظتی مشابه ایجاد شده توسط 53p در فیبروبلاستهای طبیعی در برابر اشعه ماوراء بنفش و عوامل شیمیدرمانی متعدد مانند کربوپلاتین، دوکسوروبیسین و غیره گزارش شده است. توضیحات چندگانه برای این مشاهدات وجود دارد. (29). پروتئین 53p نقش مهمی در تنظیم آپوپتوز ناشی از آسیب DNA در بسیاری از انواع سلولها دارد. تعدادی از مطالعات قبلی، بهویژه آنهایی که از سلولهای سرطانی استفاده کردند، نشان دادهاند که عملکرد 53p موجب افزایش مقاومت به عوامل شیمیدرمانی میشود همچنین در مقابل، ثابت شده است که 53p دارای فعالیت ضد آپوپتوزی است و مطالعات متعدد افزایش سمیت سلولی را به انواع مختلفی از داروها در ابتدا که سلولهای غیر مبدل فاقد53p هستند را نشان دادهاند. این نتایج متناقض نشان میدهد که غیرفعالسازی53p در غیاب سایر تغییرات ژنتیکی، منجر به افزایش حساسیت و نه مقاومت در برابر عوامل شیمیدرمانی متعدد میشود. این موضوع به خاطر این واقعیت است که مقاومت در برابر دارو در سلولهای تومور ممکن است ناشی از چندین اختلال ژنتیکی باشد. علاوه بر این، نقش 53p در حساسیت دارو ممکن است وابسته به نوع عامل شیمیدرمانی باشد پتانسیل آنتیاکسیدان کورکومین تولید رادیکالهای آزاد سیتوتوکسیک در اثر آسیبهای قلبی ناشی از DOX را خنثی میکند، از اینرو در مقابل از بین رفتن تمامیت غشاء محافظت میکند، ثبات غشاء را در نتیجه مهار نشت آنزیمها محافظت میکند (33-30). همچنین مکانیزمهای مربوط به کورکومین ممکن است شامل حفاظت تقویت شده توسط کورکومین به علت خواص آنتیاکسیدانی موثر آن باشد. خواص آنتیاکسیدانی کورکومین انتشار 2H2O از DOX را مهار میکند که منجر به سرکوب فعالسازی سیگنال آپوپتوزی میشود. نشان داده شده است که دوکسوروبیسین فعالیت 53p و ATM را افزایش داده و نسبت 2Bax/Bcl- را افزایش میدهد و موجب آسیب DNA و آپوپتوز سلولی میشود. از طرفی، نانوکورکومین از مرگ کاردیو میوسیتها با واسطه کاسپاز محافظت کرده و از آسیب DNA جلوگیری میکند. همچنین کورکومین مسئول ترمیم و نگهداری یکپارچگی ساختاری و معماری طبیعی میوسیتهای قلبی است که میتواند به دلیل خاصیت کورکومین در تثبیتکنندگی غشاء به حساب آید (34). بعضی از مطالعات بر باز شدن بیش از حد منفذ انتقال نفوذپذیری میتوکندری MPTP)) به عنوان عامل کلیدی برای آپوپتوز ناشی از دوکسوروبیسین دلالت دارند. با توجه به اینکه حامل فسفات میتوکندری (Pic) یک مؤلفه کلیدی MPTP است و تنظیم مثبت آن آپوپتوز را افزایش میدهد،Katamura و همکاران نشان دادند که دوکسوروبیسین PiC را تنظیم مثبت میکند و کورکومین PiC را تنظیم منفی میکند و از آپوپتوز سلولی محافظت میکند احتمال دارد که کورکومین بیان حامل فسفات میتوکندری را کاهش دهد و بالقوه آسیب استرس اکسیداتیو میتوکندری را بهبود بخشیده، میزان آپوپتوز سلولهای قلب را کاهش دهد و بنابراین سلولهای قلب را محافظت کند. این مورد ممکن است یک روش دیگر حفاظت کورکومین در برابر سمیت آنتراسایکلین علاوه بر مکانیزمهای شناخته شده مانند تخلیه یا خنثیسازی رادیکالهای آزاد، مهار آنزیمهای اکسیدانی مانند سیتوکروم 450P فرو نشاندن اکسیژن و آن را کمتر برای واکنش اکسیداتیو در دسترس قرار دادن، اثر متقابل با آبشار اکسیداتیو و جلوگیری از نتایج آن و خلع سلاح کردن خواص اکسیداتیو یونهای فلزی مانند آهن باشد (35). نتایج مطالعه دیگری نشان داد که استفاده همزمان عصاره زردچوبه با دوکسوروبیسین در برابر سمیت قلبی حاد ناشی از DOXاز طریق بهبود آنزیمهای قلب و تنظیم مسیرهایی که آپوپتوز قلبی را به راه میاندازند مانند کاهش سطح گلوتاتیون (GSH) افزایش کلسیم و تولید بیش از حد رادیکالهای اکسیدکننده و در نهایت، طبیعی،کردن آنزیمهای آنتیاکسیدان محافظت میکند. همچنین کورکومین از قلب در برابر سمیت قلبی ناشی از DOX بهوسیله القاء اتوفاگی و کاهش آپوپتوز کاردیومیوسیتها محافظت میکند که منجر به کاهش آپوپتوز میشود. از آنجا که DOX باعث کاهش معنیدار در میزان NO و آلبومین سرم میشود اما در مقابل عصاره زردچوبه با فعالیتهای درمانی متعدد اثر محافظتی و رفع مؤثر بر سمیت قلبی و کبدی ناشی از DOXرا دارد اثر محافظتی عصاره زردچوبه با خواص آنتیاکسیدانی و زدودن رادیکال آزاد آن همراه است (36،37) .
مکانیسم محافظتی فعایت بدنی و کورکومین در برابر سمیت ناشی از DOX: در حالیکه به خوبی مشخص شده است که فعالیت بدنی و کورکومین، سازگاریهای سلولی لازم را برای جلوگیری از سمیت ناشی از DOX ایجاد میکنند، اما مکانیسمهای مسئول این محافظت در برابر سمزدایی ناشناخته ماندهاند. بسیاری از مسیرها برای کاهش سمیت بافت غیر سرطانی ناشی از فعالیت بدنی و کورکومین فرض شده است. شرح کاملی از درک فعلی نقش محافظتی فعالیت بدنی و کورکومین و به خصوص فعالیت بدنی در برابر سمیت ناشی از DOX به شرح زیر بیان میگردد.
آنتی اکسیدانهای درونزا، پروتئینهای شوک گرمایی: درزمینۀ پاسخ آنزیمهای ضد اکسایشی نسبت به فعالیتهای بدنی باید گفت احتمالاً همراه با افزایش تولید رادیکالهای آزاد، سازگاریهایی در میزان تولید و فعالیت سیستم آنتیاکسیدانی آنزیمی سلولها رخ میدهد که اثرات نامطلوب آنرا خنثی میکند. از طرف دیگر، مطالعات نشان میدهد افزایش فعالیت آنزیمهای اکسایشی یک سازگاری شناخته شده نسبت به تمرینات استقامتی و کورکومین است که موجب استفاده بیشتر گلوتاتیون در سیستم دفاعی آنتیاکسیدانی بدن میشود. مکانیزمهای این دو سازگاری هنوز شناسایی نشدهاند، اما این سازگاریهای به ظاهر متناقض، تغییراتی هستند که با تمرین رخ میدهند (38) شواهد نشان میدهد که کاهش استرس اکسیداتیو ممکن است فعالسازی سیگنال آپوپتوزی را محدود کند. در میان مکانیزمهایی که تمرین ورزشی و کورکومین، آپوپتوز ناشی از DOX را در قلب موش محدود میکند میتوان به افزایش بیان HSP و فعالیت در اثر تمرین، اشاره کرد. نقش محافظتی این پروتئینهای مهم بهوسیله پیشگیری از مرگ سلولی آپوپتوزی مشخص شده است ممکن است که تمرینات ورزشی بیشتر موجب افزایش آنزیمهای آنتیاکسیدان میتوکندری قلبی شود که میتواند نقش مهمی در پیشگیری از انتشار ROS میتوکندریایی ناشی از DOX ایجاد کند و بنابراین از فعال شدن پروتئازهای قلب ناشی از DOXکه باعث آسیب قلبی و آپوپتوز میشود جلوگیری کند مکانیزمهای احتمالی که پروتئینهای شوک گرمایی میتوانند از کاردیومیوسیتها محافظت کنند شامل کنترل تاخوردن پروتئین، جلوگیری از دناتوره شدن و تجمع پروتئینهای داخل سلولی و شتاب شکست پروتئینهای آسیب دیده است. از سوی دیگر، ورزش محدودیتهای خاصی را به بافت قلبی تحمیل میکند که در نتیجه استرس مکانیکی و متابولیک ناشی از تقاضای انرژی و عملکرد افزایش یافته است. به علاوه این افزایش فشارهای فیزیولوژیک، همراه با پاسخ التهابی سیستمیک ناشی از ورزش، باعث فعالشدن آبشارهای سیگنالینگ داخل سلولی میشود، بنابراین برخی از مکانیزمهای با واسطه میتوکندری در این فرایند را مورد هدف قرار میدهند که شامل سیگنالینگ مرتبط به اکسایش-کاهش و یا آسیب سلولی و حوادث بخش بخش زیرسلولی، مسیرهای مرگ و نوسازی همچنین سیگنالینگ کنترل کیفیت و پویایی است که در این پدیده تحمل متقابل ورزش که رهایی دهنده از سمیت DOX است، شبکهای میتوکندری را درگیر میکند علاوه بر این نقش پیشگیری کننده مشاهده شده ورزش مزمن، میتواند مرتبط با افزایش مقاومت میتوکندریها باشد که دستخوش تحول نفوذپذیری و فعال شدن سیگنالینگ آپوپتوز میشود (40،39). فعالیت بدنی دارای توان بالقوه برای کاهش آپوپتوز با تنظیم مثبت مقادیر پروتئینهای حساس به استرس محافظتی ازجمله فاکتور هستهای کاپا(NF-kB) B و فاکتور رشد شبه انسولین1 IGF- است. ورزش باعث جلوگیری از پراکسیداسیون لیپیدی قلب بهطور عمده از طریق تنظیم مثبت سیستم گلوتاتیون میشود ورزش هوازی، سازگاری مطلوب در اداره کلسیم قلب ایجاد میکند که با جلوگیری از اضافه بار کلسیم در میوسیت میتواند مسمومیت قلبی را محدود کند. همچنین تمرین هوازی ممکن است موجب بسیج و لانهگزینی CPC (cardiac progenitor cells) پس از تجویز دوکسوروبیسین شود و در نتیجه میزان تغییر و تبدیل مایوسیتها را محدود کند.گزارش شده است که افزایش بیان زنجیره سنگین میوزین (MHC) وATPase شبکه سارکواندوپلاسمی (SERCA2a) بهطور مستقل یا جمعی، در حفاظت قلبی حاصل از ورزش شرکت میکنند. بهطور خاص، بیان پروتئینSERCA2a پس از قرار گرفتن در معرض DOX کاهش مییابد. کاهشSERCA2a موجب اختلال در اداره + 2 Ca و عملکرد قلب میشود. با اینحال، گزارش شده است که ورزش محتوای پروتئینSERCA2a را افزایش میدهد و عملکرد قلبی را بهبود میبخشد. بنابراین محتمل است که حفظ بیان پروتئین SERCA2a حاصل از ورزش، ممکن است محافظت کننده قلبی در برابر سمیت قلبی DOX باشد. دیگر مکانیزمهای پیشنهادی محافظت قلبی ناشی از ورزش در برابر سمیت DOX عبارتند از: تضعیف سیگنالینگ اوتوفاگی قلب، کاهش تجمع دارو و کاهش بیان RNA پیک و رونویسی ژنهای آتروفیFoxO از طرفی از نظر بیولوژیکی قابل قبول به نظر میرسد که ورزش هوازی، به عنوان یک فعالکننده قوی AMPK قلب، ممکن است سلولهای قلب را در برابر سمیت ناشی از دوکسوروبیسین محافظت کند، اگر چه هیچ مطالعهای تا به امروز این موضوع را مورد بررسی قرار نداده است (43-41). آسیب گونههای اکسیژن واکنشپذیر و پروتئینهای شوک گرمایی: نقش مرکزی ROS ناشی از دوکسوروبیسین در فعالشدن مسیرهای اصلی که منجر به آسیب قلبی میشود، پیشنهاد میدهد که استخراج قابلیت تولید ویا فعالیت ROS نویدهای قابلتوجه درمان را متوقف میکند. تمرین هوازی قلب را در برابر ROS با افزایش دستگاههای محافظتی آنتیاکسیدان درونزا محافظت میکند ورزش همچنین برای کاهش انتشار ROS ناشی از دوکسوروبیسین مستدل شده است. در واقع، دویدن بر روی نوارگردان با شدت متوسط قبل از تزریق دوکسوروبیسین، نه تنها تولید ROS از میتوکندری قلب را در مدلهای موشی کاهش میدهد، بلکه باعث افزایش بیان آنزیمهای آنتیاکسیدانی مانند گلوتاتیون پراکسیداز، کاتالاز و سوپراکسید دیسموتاز منگنز در بافت قلب میشود افزایش میزان فعالیت پروتئینهای شوک گرمایی 60 و 72 ناشی از ورزش میتواند حداقل تا حدی به حفاظت از قلب در برابر دوکسوروبیسین کمک کند. مکانیزمهای احتمالی که پروتئینهای شوک گرما میتوانند از کاردیومیوسیتها محافظت کنند شامل کنترل تاخوردن پروتئین، جلوگیری از دناتوره شدن و تجمع پروتئینهای داخل سلولی و شتاب شکست پروتئینهای آسیب دیده است (45،44).
آپوپتوز تارهای عضلانی قلب: تمرین هوازی ممکن است با تنظیم سیگنالینگ پروآپوپتوزی، محافظ قلبی باشد. Asançao و همکاران Chico و همکاران گزارش دادند که ورزش باعث جلوگیری از افزایش ناشی ازدوکسوروبیسین در فعالیت واسطههای پروآپوپتوز Bax و کاسپاز 3 بافت قلبی میشود. در مطالعههای Werner و همکارانش نشان دادند که دویدن کوتاهمدت (21) روز باعث کاهش بیان قلبی 53p (یک میانجی آپوپتوز) توسط نیمی از موشهای تحت درمان با دوکسوروبیسین شد و به میزان 5 برابر کاردیومیوسیتهای آپوپتوتیک را کاهش داد (46).
سرکوب شدن سنتز پروتئین تارهای عضلانی قلب: تمرین هوازی ممکن است موجب بسیج و لانهگزینی CPCها پس از تجویز دوکسوروبیسین شود و در نتیجه میزان تغییر و تبدیل مایوسیتها را محدود کند. این نظریه در آپوپتوز کاردیومیوسیتها مورد بررسی قرار نگرفته است. تکثیر CPC به میزان 200% افزایش یافت و با حضور سلولهای KIT (یک عامل مهم سلولهای بنیادی برای بسیج سلولهای پیشساز به محل آسیب) در قلب تکمیل شد که روی هم رفته منجر به فراوانی بیشتر کاردیومیوسیتها در حیوانات تمرین کرده نسبت به حیوانات بیتحرکت شد. بنابراین، ورزش هوازی میتواند آزادسازی، بسیج و تعقیب CPCها پس از تضعیف شدن با دوکسوروبیسین را افزایش دهد تا واکنش جبرانی را تسهیل کند. شناسایی عمل کنندههای هستهای ورزش ممکن است بینشی نسبت به مسیرهای تنظیمی رهاسازی CPC و بقای مایوسیت ایجاد کند. جالب توجه اینکه، افزایش ژنتیکی یا دارویی4GATA- مانع از آپوپتوز کاردیومیوسیت و سمیت قلبی ناشی از دارو میشود. محتمل شده است که سطح 4GATA- توسط آگونیستهای آدرنرژیک 1α - تنظیم میشود که توسط ورزش تعدیل میشوند (45). مطلوب در اداره کلسیم قلب ایجاد میکند که با جلوگیری از اضافه بار کلسیم در میوسیت میتواند مسمومیت قلبی را محدود کند. در واقع تمرین، اختلالات سیستولی و دیاستولی را با بهبود اداره کلسیم (انتشار کلسیم شبکه سارکوپلاسمی، ترشح کلسیم شبکه سارکوپلاسمی دیاستولی و تجزیه کلسیم شبکه سارکوپلاسمی) بهبود میبخشد. تنظیم فعالسازی کالپاین نیز ممکن است در این فرآیند درگیر باشد (47).
تغییرات در متابولیسم انرژی قلب: AMPK در پاسخ به تغییرات انرژی سلولی، در درجه اول با افزایشAMP و کاهش ATP یا فسفوکراتین فعال میشود. ورزش یک فعالکننده قوی فعالیت AMPK در ماهیچه اسکلتی است که از طریق فسفوریلاسیون ACC و کاهش متعاقب مالونیل CoA- منجر به تحریک حاد اکسیداسیون اسیدهای چرب میشود. تمرین هوازی همچنین یک تنظیم کننده قوی فعالیت AMPK در بافت قلب است. از نظر بیولوژیکی، قابل قبول به نظر میرسد که ورزش هوازی، به عنوان یک فعالکننده قوی AMPK قلب، ممکن است سلولهای قلب را در برابر سمیت ناشی از دوکسوروبیسین محافظت کند، اگر چه مطالعهای تا به امروز این موضوع را مورد بررسی قرار نداده است (48).
نتیجهگیری
با توجه به اثربخشی DOX در برابر طیف گستردهای از تومورها و بدخیمیها یافتن یک راهکار متقابل برای محافظت از سمیت سلولی ناشی از DOX مهم است. نتایج تحقیقات مختلف نشان میدهد که فعالیت بدنی و مکمل کورکومین استراتژیهای امیدوار کنندهای برای جلوگیری و یا درمان آسیبهای قلبی ناشی از دوکسوروبیسین است. همه مطالعات بهطور مثبت فعالیت بدنی و مکمل کورکومین را به عنوان روشهای برای تقلیل دادن سمیت قلبی از طریق افزایش عملکرد قلب، کاهش عوامل پیشبرنده آپوپتوزی، کاهش آسیب استرس اکسیداتیو، افزایش ظرفیت آنتیاکسیدانی و بهبود هموستاز کلسیم میشناسند. اما در حال حاضر نیز مناسبترین و مؤثرترین نسخه شامل فعالیت بدنی و مکمل کورکومین برای پیشگیری و یا درمان بیماری قلبی عروقی ناشی از آنتراسایکلین معرفی نشده است. اگر چه در تعدادی از مطالعات نشان داده شده است که فعالیت بدنی و مکمل کورکومین بر سمیت قلبی ناشی از DOX مفید است، ولی با توجه به بررسیهای انجام شده هیچ آزمایش بالینی انسانی منتشر شده برای ارزیابی فعالیت بدنی و مکمل کورکومین به عنوان مداخلهای برای جلوگیری و یا درمان سمیت ناشی از DOX در بیماران مبتلا به سرطان وجود ندارد و مطالعات حیوانی نیز در ابتدای راه شناخت این مکانیزمها هستند. مطالعات آینده برای تشریح بیشتر مکانیزمهای مولکولی به واسطه خاصیت محافظتی قلبی فعالیت بدنی و مکمل کورکومین در قبل، در طول و بعد از قرار گرفتن در معرض دکسوروبیسین مورد نیاز است. همچنین با توجه به این که فعالیت بدنی و مکمل کورکومین سازگارهای مفیدی را در سیستمهای مختلف بدن ایجاد میکنند، طراحی پروتکل فعالیت بدنی و نیز میزان دوزهای مصرفی برای بیمارانی که شیمیدرمانی DOX دریافت میکنند ضروری است. علاوه بر این، برای روشن شدن مکانسیمهای مربوط به محافظت سلول ناشی از فعالیت بدنی و مکمل کورکومین باید این مداخلات بهصورت مداوم انجام شود تا به توسعه درمانهای دارویی مقابله با اثرات سمی ناشی از DOXکمک کند (شکل4).

شکل 4: بهطور کلی تمرینات ورزشی باعث افزایش آنتیاکسیدانهای درون سلولی و پروتئینهای شوک گرمایی به ویژه 72 مقاوم به دارو در سلولهای تمرین کرده میشود (49)

شکل 5: کورکومین از مرگ کاردیومیوسیتها با واسطه کاسپاز محافظت کرده و از آسیب DNA جلوگیری میکند. همچنین کورکومین مسئول تعمیر و نگهداری یکپارچگی ساختاری و معماری طبیعی میوسیتهای قلبی است که میتواند به دلیل خاصیت کورکومین در تثبیتکنندگی غشاء بهحساب آید (49)
سپاسگزاری
نویسندگان از دانشگاه علامه طباطبایی و پردیس شهید چمران دانشگاه فرهنگیان و دانشگاه آزاد اسلامی واحد اسلامشهر جهت حمایتهای مالی و معنوی از این مقاله تشکر میکنند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد پرند تائید شده است (کد اخلاق : IR.IAU.PIAU.REC.1400.005).
مشارکت نویسندگان
در ایده، نگارش و ویرایش مقاله کلیه نویسندگان مشارکت داشتند.
References:
1- Lipshultz SE, Alvarez JA, Scully RE. Anthracycline Associated Cardiotoxicity in Survivors of Childhood Cancer. Heart 2008; 94(4): 525-33.
2- Simůnek T, Stérba M, Popelová O, Adamcová M, Hrdina R, Gersl V. Anthracycline-Induced Cardiotoxicity: Overview of Studies Examining the Roles of Oxidative Stress and Free Cellular Iron .Pharmacol Rep 2009; 61(1): 154-71.
3- Marinello J, Delcuratolo M, Capranico G. Anthracyclines as Topoisomerase II Poisons: From Early Studies to New Perspectives. Int J Mol Sci 2018; 19(11): 3480.
4- Hershman DL, McBride RB, Eisenberger A, Tsai WY, Grann VR, Jacobson JS. Doxorubicin, Cardiac Risk Factors, and Cardiac Toxicity in Elderly Patients with Diffuse B-Cell Non-Hodgkin's Lymphoma. J Clin Oncol 2008; 26(19): 3159-65.
5- Kalyanaraman B. Teaching the Basics of the Mechanism of Doxorubicin-Induced Cardiotoxicity: Have We Been Barking Up the Wrong Tree? Redox Biol 2020; 29: 101394.
6- Volkova M, Russell R 3rd. Anthracycline Cardiotoxicity: Prevalence, Pathogenesis and Treatment. Curr Cardiol Rev 2011; 7(4): 214-20.
7- Chen ZC, Chen LJ, Cheng JT. Doxorubicin-Induced Cardiac Toxicity is Mediated by Lowering of Peroxisome Proliferator-Activated Receptor Δ Expression in Rats. PPAR Res 2013: 2013; 456042.
8- Heger Z, Cernei N, Kudr J, Gumulec J, Blazkova I, Zitka O, et al. A Novel Insight into the Cardiotoxicity of Antineoplastic Drug Doxorubicin. International journal of molecular sciences 2013; 14(11): 21629-46.
9- De Beer EL, Bottone AE, Voest EE. Doxorubicin and Mechanical Performance of Cardiac Trabeculae after Acute and Chronic Treatment: A Review. European journal of pharmacology 2001; 415: 1-11.
10- Lipshultz SE, Alvarez JA, Scully RE. Anthracycline Associated Cardiotoxicity in Survivors of Childhood Cancer. Heart 2008; 94(4): 525-33.
11- Renu K, V G A, P B TP, Arunachalam S. Molecular Mechanism of Doxorubicin-Induced Cardiomyopathy-An Update. Eur J Pharmacol 2018; 818: 241-53.
12- Kollárová-Brázdová P, Jirkovská A, Karabanovich G, Pokorná Z, Bavlovič Piskáčková H, Jirkovský E, et al. Investigation of Structure-Activity Relationships of Dexrazoxane Analogs Reveals Topoisomerase Iiβ Interaction as a Prerequisite for Effective Protection Against Anthracycline Cardiotoxicity. J Pharmacol Exp Ther 2020; 373(3): 402-15.
13- Kalyanaraman B. Teaching the Basics of the Mechanism of Doxorubicin-Induced Cardiotoxicity: Have We Been Barking Up the Wrong Tree? Redox Biol 2020; 29: 101394.
14- El-Awady RA, Semreen MH, Saber MM, Cyprian F, Menon V, Al-Tel TH. Modulation of DNA Damage Response and Induction of Apoptosis Mediates Synergism between Doxorubicin and a New Imidazopyridine Derivative in Breast and Lung Cancer Cells. DNA Repair 2016; 37: 1-11.
15- Marques-Aleixo I, Santos-Alves E, Torrella JR, Oliveira PJ, Magalha˜es J, Ascensa˜oA. Exercise and Doxorubicin Treatment Modulate Cardiac Mitochondrial Quality Control Signaling. Cardiovasc Toxicol 2018; 18(1): 43-55.
16- Ahmadian M, Dabidi Roshan V, Leicht AS. Age-Related Effect of Aerobic Exercise Training on Antioxidant and Oxidative Markers in the Liver Challenged by Doxorubicin in Rats. Free Radic Res 2018; 52(7): 775-82.
17- Xia P, Chen J, Liu Y, Fletcher M, Jensen B C, Cheng Z. Doxorubicin Induces Cardiomyocyte Apoptosis and Atrophy through Cyclin-Dependent Kinase 2-Mediated Activation of Forkhead Box O1. J Biol Chem 2020; 19: 1- 21
18- Xia P, Chen J, Liu Y, Fletcher M, Jensen Bc, Cheng Z. Doxorubicin Induces Cardiomyocyte Apoptosis and Atrophy through Cyclin-Dependent Kinase 2-Mediated Activation of Forkhead Box O1. J Biol Chem 2020; 295(13): 4265-76.
19- Shirinbayan V, Dabidi Roshan V. Pretreatment Effect of Running Exercise on HSP7 and DOX Induced Cardiotoxicity. Asian Pacific J Cancer Prev 2012; 13(11): 5849-55.
20- Angsutararux P, Luanpitpong S, Issaragrisil S. Chemotherapy-Induced Cardiotoxicity: Overview of the Roles of Oxidative Stress. Oxid Med Cell Longev 2015; 2015: 795602.
21- Mohajeri M, Sahebkar A. Protective Effects of Curcumin against Doxorubicin-Induced Toxicity and Resistance: A Review. Crit Rev in Oncol / Hema 2018; 30-51.
22- Yap MY, Lo YL, Talbot K, Ong WY. Oxidative Stress Reduces Levels of Dysbindin-1A Via its PEST Domain. Neurochem Int 2014; 79: 65-9.
23- Ataollahi MR, Sharifi J, Paknahad MR, Paknahad A. Breast Cancer and Associated Factors: A Review. J Med Life 2015; 8(Spec Iss 4): 6-11.
24- Ascensão A, Magalha˜es J, Soares JMC, Ferreira R, Neuparth MJ, Marques F, et al. Moderateendurance Training Prevents Doxorubicin-Induced in Vivo Mitochondriopathy and Reduces the Development of Cardiac Apoptosis. Am J Physiol Heart Circ Physiol 2005; 289: 722-31.
25- Pfannenstiel K, Hayward R. Effects of Resistance Exercise Training on Doxorubicin-Induced Cardiotoxicity. J Cardiovasc Effects of Resistance Exercise Training on Doxorubicin-Induced Cardiotoxicity.e. Int J Mol Sci 2016; 18(1): 23.
26- Bishayee A, Mandal A, Bhattacharyya P, Bhatia D. Pomegranate Exerts Chemoprevention of Experimentally Induced Mammary Tumorigenesis by Suppression of Cell Proliferation and Induction Of Apoptosis. Nutr cancer 2016; 68(1): 120-30.
27- Hashemi C SZ, Dabidiroshan V. The Effect of Pretreatment of Aerobic Training on Some of the Pulmonary Stress Indices against the Toxicity of Doxorubicin. J Isfahan Med Scho 2022; 37(559): 1422-7. [Persian]
28- Kavazis AN, Smuder AJ, Min K, Tümer N, Powers SK. Short-Term Exercise Training Protects Againstdoxorubicin-Induced Cardiac Mitochondrial Damage Independent of HSP72. Am J Physiol Heart Circ Physiol 2010; 299: 1515-24.
29- El-Sayed EM, El-azeem ASA, Afify AA, Shabana MH, Ahmed HH. Cardioprotective Effects of Curcuma Longa L. Extracts against Doxorubicin-Induced Cardiotoxicity in Rats. Journal of Medicinal Plants Research 2011; 5: 4049-58.
30- Katamura M, Iwai-Kanai E, Nakaoka M, Okawa Y, Ariyoshi M, Mita Y, et al. Curcumin Attenuates Doxorubicin-Induced Cardiotoxicity by Inducing Autophagy Via the Regulation of JNK Phosphorylation. J Clin & Exp Cardiology 2014; 5: 9.
31- Heidarzadeh A, Ahadi AM, Panahi A, Sadeghizadeh M. Tumor Suppressor P53 Can Protect Normal Cells Against Dendrosomal Curcumin-Induced Apoptosis. Biomacromol J 2015; 1(2): 220-9.
32- RH, El-Bastawesy AM, Zekry ZK, Al-Mehdar HA, Al-said MGAM, Aly SS, et al. The Role of Curcuma Longa Against Doxorubicin (Adriamycin)-Induced Toxicity in Rats. Journal of Medicinal Food 2009; 12(2): 394-402.
33- Duarte JA, Le Nguyen B, Hyatt H. Endurance Exercise Protects Skeletal Muscle against both Doxorubicin-Induced and Inactivity-Induced Muscle Wasting. Pflugers Arch 2019; 471(3): 441-53
34- Doerr V, Nguyen BL, Kelley RC, Smuder AJ. Consideration of Sex as a Biological Variable in the Development of Doxorubicin Myotoxicity and the Efficacy of Exercise as a Therapeutic Intervention. Antioxidants (Basel) 2021; 10(3): 343.
35- Wakefield ZR, Tanaka M, Pampo C, Lepler S, Rice L, Guingab-Cagmat J, Garrett TJ, Siemann DW. Normal Tissue and Tumor Microenvironment Adaptations to Aerobic Exercise Enhance Doxorubicin Anti-Tumor Efficacy and Ameliorate Its Cardiotoxicity in Retired Breeder Mice. Oncotarget 2021; 12(18):1737-48.
36- Lea Haverbeck S, Garritson J, Nicholas A. Hayward PR. First Published Exercise Preconditioning Preserves Cardiac Function and Enhances Cardiac Recovery Following Dobutamine Stimulation in Doxorubicin-Treated Rat Hearts. FASEB 2022; 36(S1).
37- Russo MKB, Becker T, Guecheva TN, Teixeira LV, Lehnen AM, Schaun MI, Leguisamo NM . Preventive Aerobic Training Preserves Sympathovagal Function and Improves DNA Repair Capacity of Peripheral Blood Mononuclear Cells in Rats with Cardiomyopathy. Sci Rep 2022; 12(1): 6422.
38- Jeyabal P, Peng ZH, kleinerman E. Exercise Inhibits Doxorubicin-Induced Cardiotoxicity by Preventing Cardiomyocyte Cellular Senescence. Originally publishe Circulation 2022; 146: A10138.
39- Costa Godinho LRL, Cella PS, Guimarães TAS, Palma GHD, Nunes JHC, Deminice R. Creatine Supplementation Potentiates Exercise Protective Effects against Doxorubicin-Induced Hepatotoxicity in Mice. Antioxidants (Basel) 2023; 12(4): 823.
40- Montalvo R, Boeno F, Ozdemir M, Dowllah I, Doerr V, Matthew P, et al. Smuderfirst Published (Response of Subsarcolemmal and Intermyofibrillar Mitochondria to Exercise and Doxorubicin-Induced Cardiotoxicityryan. The FASEB Journal 2022; 36(S1): 0R83
41- Souza RRd, Santos SMd, Maifrino LBM, Gama EF, Caperuto EC, Maldonado DC. Resistancetraining attenuates the effects of aging in the aorta of Wistar rats. Motriz, Rio Claro 2019; 21(4): 421-7.
42- Ho KL, Karwi QG, Connolly D, Pherwani S, Ketema EB, Ussher JR, Lopaschuk GD. Metabolic, Structural and Biochemical Changes in Diabetes and the Development of Heart Failure. Diabetologia 2022; 65(3): 411-423.
43- Fusco MJ, West HJ, Walko CM. Tumor Mutation Burden And Cancer Treatment. JAMA oncology 2021; 7(2):316.
44- Britt KL, Cuzick J, Phillips KA. Key Steps for Effective Breast Cancer Prevention. Nat Rev Cancer 2020; 20(8): 417-36.
45- Christidi E, Brunham LR. Regulated Cell Death Pathways In Doxorubicin-Induced Cardiotoxicity. Cell Death Dis 2021; 12(4): 339.
46- Brakenhielm E, Alitalo K. Cardiac Lymphatics in Health and Disease. Nat Rev Cardiol 2019; 16(1): 56-68.
47- Moghiseh M, Mirzayan Shanjani S, Banaifar AA, Kazemzadeh Y. The Effectof Aerobic Exercise Training and Micelles on the Consumption of Curcumin Nano Expression Level of CASP3, CASP9, Bax and BCL2 with Genes on Cardiac Tissues of Balb/C Mice Induced Breast Cancer Treated With Doxorubicin. IJBD 2023; 16(2): 67-83. [Persian]
48- Moghiseh M, Mirzayan Shanjani S, Banaifar AA, Kazemzadeh Y. Effect of Aerobic Training and Use of Nanomicelle Curcumin on Geneexpression of GPX, Cat, SOD and MDA Enzymes in Heart Tissue of Balbc Female Mice with Induced Breast Cancer in Treatment Phase with Doxorubicin. Journal of Shahid Sadoughi University of Medical Sciences 2023; 15(1): 63(13). [Persian]
49- Moghiseh M, Mirzayan Shanjani S, Banaifar AA, Kazemzadeh Y. The Effect of Aerobic Training and Nanomicelle Curcumin Supplementation on MDA Concentration and BAX and BCL2 Activity Levels on Toxicity Heart of Female Rats with Mammary Cancer in Mania Phase with Doxorubicin. Journal of Zabol Medical School 2023; 6(2): 71-82. [Persian].
1- Lipshultz SE, Alvarez JA, Scully RE. Anthracycline Associated Cardiotoxicity in Survivors of Childhood Cancer. Heart 2008; 94(4): 525-33.
2- Simůnek T, Stérba M, Popelová O, Adamcová M, Hrdina R, Gersl V. Anthracycline-Induced Cardiotoxicity: Overview of Studies Examining the Roles of Oxidative Stress and Free Cellular Iron .Pharmacol Rep 2009; 61(1): 154-71.
3- Marinello J, Delcuratolo M, Capranico G. Anthracyclines as Topoisomerase II Poisons: From Early Studies to New Perspectives. Int J Mol Sci 2018; 19(11): 3480.
4- Hershman DL, McBride RB, Eisenberger A, Tsai WY, Grann VR, Jacobson JS. Doxorubicin, Cardiac Risk Factors, and Cardiac Toxicity in Elderly Patients with Diffuse B-Cell Non-Hodgkin's Lymphoma. J Clin Oncol 2008; 26(19): 3159-65.
5- Kalyanaraman B. Teaching the Basics of the Mechanism of Doxorubicin-Induced Cardiotoxicity: Have We Been Barking Up the Wrong Tree? Redox Biol 2020; 29: 101394.
6- Volkova M, Russell R 3rd. Anthracycline Cardiotoxicity: Prevalence, Pathogenesis and Treatment. Curr Cardiol Rev 2011; 7(4): 214-20.
7- Chen ZC, Chen LJ, Cheng JT. Doxorubicin-Induced Cardiac Toxicity is Mediated by Lowering of Peroxisome Proliferator-Activated Receptor Δ Expression in Rats. PPAR Res 2013: 2013; 456042.
8- Heger Z, Cernei N, Kudr J, Gumulec J, Blazkova I, Zitka O, et al. A Novel Insight into the Cardiotoxicity of Antineoplastic Drug Doxorubicin. International journal of molecular sciences 2013; 14(11): 21629-46.
9- De Beer EL, Bottone AE, Voest EE. Doxorubicin and Mechanical Performance of Cardiac Trabeculae after Acute and Chronic Treatment: A Review. European journal of pharmacology 2001; 415: 1-11.
10- Lipshultz SE, Alvarez JA, Scully RE. Anthracycline Associated Cardiotoxicity in Survivors of Childhood Cancer. Heart 2008; 94(4): 525-33.
11- Renu K, V G A, P B TP, Arunachalam S. Molecular Mechanism of Doxorubicin-Induced Cardiomyopathy-An Update. Eur J Pharmacol 2018; 818: 241-53.
12- Kollárová-Brázdová P, Jirkovská A, Karabanovich G, Pokorná Z, Bavlovič Piskáčková H, Jirkovský E, et al. Investigation of Structure-Activity Relationships of Dexrazoxane Analogs Reveals Topoisomerase Iiβ Interaction as a Prerequisite for Effective Protection Against Anthracycline Cardiotoxicity. J Pharmacol Exp Ther 2020; 373(3): 402-15.
13- Kalyanaraman B. Teaching the Basics of the Mechanism of Doxorubicin-Induced Cardiotoxicity: Have We Been Barking Up the Wrong Tree? Redox Biol 2020; 29: 101394.
14- El-Awady RA, Semreen MH, Saber MM, Cyprian F, Menon V, Al-Tel TH. Modulation of DNA Damage Response and Induction of Apoptosis Mediates Synergism between Doxorubicin and a New Imidazopyridine Derivative in Breast and Lung Cancer Cells. DNA Repair 2016; 37: 1-11.
15- Marques-Aleixo I, Santos-Alves E, Torrella JR, Oliveira PJ, Magalha˜es J, Ascensa˜oA. Exercise and Doxorubicin Treatment Modulate Cardiac Mitochondrial Quality Control Signaling. Cardiovasc Toxicol 2018; 18(1): 43-55.
16- Ahmadian M, Dabidi Roshan V, Leicht AS. Age-Related Effect of Aerobic Exercise Training on Antioxidant and Oxidative Markers in the Liver Challenged by Doxorubicin in Rats. Free Radic Res 2018; 52(7): 775-82.
17- Xia P, Chen J, Liu Y, Fletcher M, Jensen B C, Cheng Z. Doxorubicin Induces Cardiomyocyte Apoptosis and Atrophy through Cyclin-Dependent Kinase 2-Mediated Activation of Forkhead Box O1. J Biol Chem 2020; 19: 1- 21
18- Xia P, Chen J, Liu Y, Fletcher M, Jensen Bc, Cheng Z. Doxorubicin Induces Cardiomyocyte Apoptosis and Atrophy through Cyclin-Dependent Kinase 2-Mediated Activation of Forkhead Box O1. J Biol Chem 2020; 295(13): 4265-76.
19- Shirinbayan V, Dabidi Roshan V. Pretreatment Effect of Running Exercise on HSP7 and DOX Induced Cardiotoxicity. Asian Pacific J Cancer Prev 2012; 13(11): 5849-55.
20- Angsutararux P, Luanpitpong S, Issaragrisil S. Chemotherapy-Induced Cardiotoxicity: Overview of the Roles of Oxidative Stress. Oxid Med Cell Longev 2015; 2015: 795602.
21- Mohajeri M, Sahebkar A. Protective Effects of Curcumin against Doxorubicin-Induced Toxicity and Resistance: A Review. Crit Rev in Oncol / Hema 2018; 30-51.
22- Yap MY, Lo YL, Talbot K, Ong WY. Oxidative Stress Reduces Levels of Dysbindin-1A Via its PEST Domain. Neurochem Int 2014; 79: 65-9.
23- Ataollahi MR, Sharifi J, Paknahad MR, Paknahad A. Breast Cancer and Associated Factors: A Review. J Med Life 2015; 8(Spec Iss 4): 6-11.
24- Ascensão A, Magalha˜es J, Soares JMC, Ferreira R, Neuparth MJ, Marques F, et al. Moderateendurance Training Prevents Doxorubicin-Induced in Vivo Mitochondriopathy and Reduces the Development of Cardiac Apoptosis. Am J Physiol Heart Circ Physiol 2005; 289: 722-31.
25- Pfannenstiel K, Hayward R. Effects of Resistance Exercise Training on Doxorubicin-Induced Cardiotoxicity. J Cardiovasc Effects of Resistance Exercise Training on Doxorubicin-Induced Cardiotoxicity.e. Int J Mol Sci 2016; 18(1): 23.
26- Bishayee A, Mandal A, Bhattacharyya P, Bhatia D. Pomegranate Exerts Chemoprevention of Experimentally Induced Mammary Tumorigenesis by Suppression of Cell Proliferation and Induction Of Apoptosis. Nutr cancer 2016; 68(1): 120-30.
27- Hashemi C SZ, Dabidiroshan V. The Effect of Pretreatment of Aerobic Training on Some of the Pulmonary Stress Indices against the Toxicity of Doxorubicin. J Isfahan Med Scho 2022; 37(559): 1422-7. [Persian]
28- Kavazis AN, Smuder AJ, Min K, Tümer N, Powers SK. Short-Term Exercise Training Protects Againstdoxorubicin-Induced Cardiac Mitochondrial Damage Independent of HSP72. Am J Physiol Heart Circ Physiol 2010; 299: 1515-24.
29- El-Sayed EM, El-azeem ASA, Afify AA, Shabana MH, Ahmed HH. Cardioprotective Effects of Curcuma Longa L. Extracts against Doxorubicin-Induced Cardiotoxicity in Rats. Journal of Medicinal Plants Research 2011; 5: 4049-58.
30- Katamura M, Iwai-Kanai E, Nakaoka M, Okawa Y, Ariyoshi M, Mita Y, et al. Curcumin Attenuates Doxorubicin-Induced Cardiotoxicity by Inducing Autophagy Via the Regulation of JNK Phosphorylation. J Clin & Exp Cardiology 2014; 5: 9.
31- Heidarzadeh A, Ahadi AM, Panahi A, Sadeghizadeh M. Tumor Suppressor P53 Can Protect Normal Cells Against Dendrosomal Curcumin-Induced Apoptosis. Biomacromol J 2015; 1(2): 220-9.
32- RH, El-Bastawesy AM, Zekry ZK, Al-Mehdar HA, Al-said MGAM, Aly SS, et al. The Role of Curcuma Longa Against Doxorubicin (Adriamycin)-Induced Toxicity in Rats. Journal of Medicinal Food 2009; 12(2): 394-402.
33- Duarte JA, Le Nguyen B, Hyatt H. Endurance Exercise Protects Skeletal Muscle against both Doxorubicin-Induced and Inactivity-Induced Muscle Wasting. Pflugers Arch 2019; 471(3): 441-53
34- Doerr V, Nguyen BL, Kelley RC, Smuder AJ. Consideration of Sex as a Biological Variable in the Development of Doxorubicin Myotoxicity and the Efficacy of Exercise as a Therapeutic Intervention. Antioxidants (Basel) 2021; 10(3): 343.
35- Wakefield ZR, Tanaka M, Pampo C, Lepler S, Rice L, Guingab-Cagmat J, Garrett TJ, Siemann DW. Normal Tissue and Tumor Microenvironment Adaptations to Aerobic Exercise Enhance Doxorubicin Anti-Tumor Efficacy and Ameliorate Its Cardiotoxicity in Retired Breeder Mice. Oncotarget 2021; 12(18):1737-48.
36- Lea Haverbeck S, Garritson J, Nicholas A. Hayward PR. First Published Exercise Preconditioning Preserves Cardiac Function and Enhances Cardiac Recovery Following Dobutamine Stimulation in Doxorubicin-Treated Rat Hearts. FASEB 2022; 36(S1).
37- Russo MKB, Becker T, Guecheva TN, Teixeira LV, Lehnen AM, Schaun MI, Leguisamo NM . Preventive Aerobic Training Preserves Sympathovagal Function and Improves DNA Repair Capacity of Peripheral Blood Mononuclear Cells in Rats with Cardiomyopathy. Sci Rep 2022; 12(1): 6422.
38- Jeyabal P, Peng ZH, kleinerman E. Exercise Inhibits Doxorubicin-Induced Cardiotoxicity by Preventing Cardiomyocyte Cellular Senescence. Originally publishe Circulation 2022; 146: A10138.
39- Costa Godinho LRL, Cella PS, Guimarães TAS, Palma GHD, Nunes JHC, Deminice R. Creatine Supplementation Potentiates Exercise Protective Effects against Doxorubicin-Induced Hepatotoxicity in Mice. Antioxidants (Basel) 2023; 12(4): 823.
40- Montalvo R, Boeno F, Ozdemir M, Dowllah I, Doerr V, Matthew P, et al. Smuderfirst Published (Response of Subsarcolemmal and Intermyofibrillar Mitochondria to Exercise and Doxorubicin-Induced Cardiotoxicityryan. The FASEB Journal 2022; 36(S1): 0R83
41- Souza RRd, Santos SMd, Maifrino LBM, Gama EF, Caperuto EC, Maldonado DC. Resistancetraining attenuates the effects of aging in the aorta of Wistar rats. Motriz, Rio Claro 2019; 21(4): 421-7.
42- Ho KL, Karwi QG, Connolly D, Pherwani S, Ketema EB, Ussher JR, Lopaschuk GD. Metabolic, Structural and Biochemical Changes in Diabetes and the Development of Heart Failure. Diabetologia 2022; 65(3): 411-423.
43- Fusco MJ, West HJ, Walko CM. Tumor Mutation Burden And Cancer Treatment. JAMA oncology 2021; 7(2):316.
44- Britt KL, Cuzick J, Phillips KA. Key Steps for Effective Breast Cancer Prevention. Nat Rev Cancer 2020; 20(8): 417-36.
45- Christidi E, Brunham LR. Regulated Cell Death Pathways In Doxorubicin-Induced Cardiotoxicity. Cell Death Dis 2021; 12(4): 339.
46- Brakenhielm E, Alitalo K. Cardiac Lymphatics in Health and Disease. Nat Rev Cardiol 2019; 16(1): 56-68.
47- Moghiseh M, Mirzayan Shanjani S, Banaifar AA, Kazemzadeh Y. The Effectof Aerobic Exercise Training and Micelles on the Consumption of Curcumin Nano Expression Level of CASP3, CASP9, Bax and BCL2 with Genes on Cardiac Tissues of Balb/C Mice Induced Breast Cancer Treated With Doxorubicin. IJBD 2023; 16(2): 67-83. [Persian]
48- Moghiseh M, Mirzayan Shanjani S, Banaifar AA, Kazemzadeh Y. Effect of Aerobic Training and Use of Nanomicelle Curcumin on Geneexpression of GPX, Cat, SOD and MDA Enzymes in Heart Tissue of Balbc Female Mice with Induced Breast Cancer in Treatment Phase with Doxorubicin. Journal of Shahid Sadoughi University of Medical Sciences 2023; 15(1): 63(13). [Persian]
49- Moghiseh M, Mirzayan Shanjani S, Banaifar AA, Kazemzadeh Y. The Effect of Aerobic Training and Nanomicelle Curcumin Supplementation on MDA Concentration and BAX and BCL2 Activity Levels on Toxicity Heart of Female Rats with Mammary Cancer in Mania Phase with Doxorubicin. Journal of Zabol Medical School 2023; 6(2): 71-82. [Persian].
نوع مطالعه: مروری |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1402/6/23 | پذیرش: 1402/10/27 | انتشار: 1403/3/15
دریافت: 1402/6/23 | پذیرش: 1402/10/27 | انتشار: 1403/3/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







