دوره 32، شماره 1 - ( فروردین 1403 )
جلد 32 شماره 1 صفحات 7470-7459 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hosseinzadeh R, Mohammadi M, Taheri S. Investigating the important proteins in causing West Nile virus infection in retinal pigment cells. JSSU 2024; 32 (1) :7459-7470
URL: http://jssu.ssu.ac.ir/article-1-6043-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6043-fa.html
حسین زاده رضا، محمدی مهناز، طاهری صبا. بررسی پروتئینهای مهم در ایجاد عفونت بهواسطه ویروس نیل غربی در سلولهای رنگدانهدار شبکیه. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1403; 32 (1) :7459-7470
متن کامل [PDF 1208 kb]
(459 دریافت)
| چکیده (HTML) (1353 مشاهده)
متن کامل: (548 مشاهده)
مقدمه
در میان ویروسهای نوظهور منتقله از بندپایان (arbovirus)، ویروس نیل غربی (WNV) یک فلاوی ویروس است که میتواند با عفونتهای عصبی شدید در انسان مرتبط باشد. در سال 2018، اپیدمی WNV اروپا منجر به بیش از 2000 مورد شد که نشاندهنده مهمترین اپیدمی آربوویروس در قاره اروپا است. مشخص کردن التهاب و بیومارکرهای عصبی منتشر شده در طول عفونت WNV، بهویژه در زمینه اختلالات عصبی، میتواند بینشی در مورد توسعه ابزارهای پیشبینی که میتواند برای نتایج بیمار مفید باشد، ارائه دهد (1). تظاهرات چشمی یکی از ویژگیهای عفونت ویروس نیل غربی است. آنها بیشتر در ارتباط با بیماری عصبی شدید رخ میدهند. کوریورتینیت خطی نشان دهنده تشخیص است و ممکن است در صورت همراهی با علائم سیستمیک تحریک کننده و در یک زمینه اپیدمی، شک تشخیصی را ایجاد کند. تظاهرات التهابی چشمی متفاوت دیگری از جمله یووئیت قدامی، واسکولیت انسدادی شبکیه، نوریت بینایی و دوبینی گزارش شده است. پاتوفیزیولوژی بیماری چشمی نامشخص است، اما نشان دهنده تهاجم به سلولهای عصبی است. اگرچه درگیری چشمی اغلب بدون عواقب بینایی برطرف میشود، برخی از بیماران ممکن است بینایی دائمی خود را از دست بدهند که نیاز به توسعه یک درمان و/یا واکسن خاص را افزایش میدهد (2). مطالعات اخیر بر کوریورتینیت چند کانونی با ظاهر معمولی فوندوسکوپیک و آنژیوگرافی فلورسینی ضایعات کوریورتینال به عنوان یک یافته اولیه و مکرر در عفونت ویروس نیل غربی (WNV) مشخص شده است. نشانگر اختصاصی بیماری، بهویژه در بیمارانی که با مننژوانسفالیت مراجعه میکنند. مشخص شد که خوشهبندی خطی ضایعات کوریورتینال یک ویژگی برجسته است که در بیش از 80 درصد چشمهای مبتلا به کوریورتینیت مرتبط با WNV رخ میدهد (5-3). پاتوژنز کوریورتینیت مرتبط با WNV هنوز مشخص نشده است. حدس زده شده است که انتشار هماتوژن WNV به کوریوکاپیلاریس در طی ویرمی ممکن است مشیمیه را برای ایجاد کوریورتینیت چند کانونی با توزیع پراکنده یا خطی ضایعات کوریورتینال ببرد. دلیل الگوی توزیع چنین ضایعاتی نامشخص بود، اما تصور میشد که رگههای خطی سیر عروق مشیمیه را دنبال میکنند (8-6) (شکل 1). به همین دلیل یافتن مسیرهای سیگنالی، ژنها و محصولات پروتئینی مرتبط با ویروس نیل غربی یک راهکار درمان با پتانسیل بالا را ارائه میدهد. هر یک از پروتئینهای ویروسی، اعم از ساختاری یا غیرساختاری، نقش متفاوت و خاصی در بیولوژی و یا پاتوژنز عفونتهای WNV ایفا میکنند. در یک دهه گذشته استفاده از دانش بیوانفورماتیک کمک شایانی به یافتن انواع بیومارکرها از سطح ژنوم تا پروتئوم را در انواع مختلف بیماریها و بهخصوص بیماریهای عفونی به همراه داشته است (11-9). این امر موجب شده که در این مطالعه با استفاده از آنالیزهای پیوسته و یکپارچه بیوانفورماتیک به بررسی پروفایل بیان ژن عفونت بهواسطه ویروس نیل غربی در سلولهای رنگدانه شبکیه پرداخته و مسیرها و پروتئینهای اختصاصی در این سلولها را جداسازی و مورد ارزیابی بیشتر قرار دهیم.
روش بررسی
دیتاست پروفایل بیان ژن ویروس نیل غربی با سلولهای رنگدانه شبکیه چشم: در این مطالعه دیتاست GSE30719از پایگاه دادهGEO(https://www.ncbi.nlm.nih.gov/geo) انتخاب شده و مورد استفاده قرار گرفت. این دیتاست دارای 8 نمونه است که شامل دو گروه 4 عضوی به صورت سلولهای سالم شبکیه چشم و سلولهایی که 24 ساعت از عفونت آنها به WNV گذشته است بود. پلتفرم استفاده شده در این دیتاست GPL6244 - Affymetrix Human Gene 1.0 ST Array بود.
آمادهسازی دادههای پروفایل بیان ژن برای انجام آنالیزهای تکمیلی: دیتاست GSE30719 را به کمک آنالیز GEO2R جداسازی کرده سپس ژنهای با p <0.05، logFC<-1، logFC>1 جدا نموده و پس از آن ژنهای با بیان بالا و پایین را دستهبندی نمودیم. در نهایت دادهها را در فایل اکسل ذخیره نموده و برای سایر آنالیزها آماده کردیم (شکل 2).
بررسی مسیرهای سیگنالی: از دیتاست GSE30719 ژنهایی که دارای افتراق بیان بودند را بهصورت جداگانه با پایگاه داده Enrichr (https://amp.pharm.mssm.edu/Enrichr) آنالیز نموده و به کمکKEGG مسیرهای سیگنالی مرتبط و ژنهای دخیل در هرکدام را انتخاب کردیم. لازم به ذکر است که <0.05p را برای مطالعه مسیرهای سیگنالی مورد بررسی قرار دادیم (شکل 3).
بررسی ماهیت ژنها: در این قسمت، از مسیرهای سیگنالی منتخب و مرتبط با عفونت ویروس نیل غربی در شبکیه چشم ژنهای آنها را جدا نموده و به کمک پایگاه داده Enrichr و panther (http://www.pantherdb.org)/ geneListAnalysis.do)، دو بخش، فرایندهای زیستی (BP) و عملکردهای مولکولی (MF) مورد ارزیابی قرار گرفتند. در این مطالعه سنجش ژنهای با بیان بالا به دلیل انتخاب بیومارکر مناسب به خصوص در اجزای سلولی بیشتر حائز اهمیت بود. در قدم بعدی ده ژنی که بیشترین بیان و کمترین بیان را داشتند نیز بهصورت جداگانه مورد ارزیابی قرار گرفتند. در این قسمت نیز برای انتخاب بهترین Ontology ژنها p <0.05 بررسی گردید.
بررسی ارتباط بین پروتئینها: ژنهای انتخاب شده از مسیرهای سیگنالی و GO در پایگاه داده STRINGS (https://string-db.org) آپلود شده و شبکه ارتباط بین پروتئینها را بهدست آوردیم. برای نمایش بهتر دادهها از نرمافزار cytoescape ورژن 3.7.1 استفاده نمودیم.
تجزیه و تحلیل آماری
دادههای بیوانفورماتیک در این مطالعه بر اساس روش¬های قید شده و به صورت پیوسته و یکپارچه مورد ارزیابی قرار گرفتند. همچنین مقادیر بهدست آمده که P˂0.05 به عنوان دادههای معنیدار انتخاب شد.
نتایج
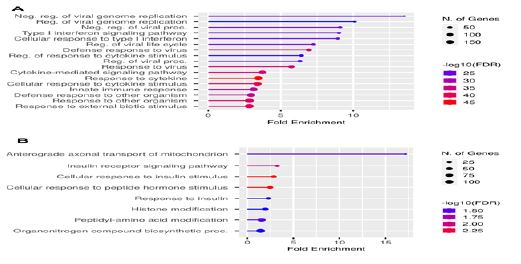
ژنهای آپوپتوز، نکروپتوز، toll like receptor و Wnt افتراق بیان بارزتری در عفونت ویروس نیل غربی در شبکیه چشم نشان دادند. آنالیز پروفایل بیان ژن GSE30719 نشان داد که 812 ژن با بیان بالا و 500 ژن با بیان پایین میتوانند در مسیرهای عفونت ویروس نیل غربی در شبکیه چشم نقش داشته باشند. مسیرهای نکروپتوز، آپوپتوز، NOD like receptor، TNF alpha، NK Kappa B، کرونا ویروس، هپاتیت C و نقص ایمنی بیان بالا داشته و مسیرهای هدایت آکسونی، AMPK، Mtor، اتوفاژی، مقاومت به انسولین و مسیر وابسته به هرپس ویروس بیان پایین داشتند (شکل 4 و جدول 1).
آنالیز Gene Ontology: در این قسمت ما ژنهای با بیان بالا و پایین را در دو بخش فرآیندهای سلولی و عملکردهای مولکولی ارزیابی کردیم. در بخش فرایندهای زیستی مسیرهای چرخه سلولی، پردازش فرایندهای سلولی، خود تنظیمی مثبت در مسیرهای متابولیسمی، تنظیم فرایندهای بیوسنتزی و انتقالات درون سلولی، همچنین در عملکردهای مولکولی فسفاتها، اتصالات فریزلد، اتصلات اینتگرینها، فاکتور رشد رگهای اندوتلیالی 2 و فعالیت سایتوکاینها وجود داشتند. همین بررسی به طور مشابه برای ژن¬های با بیان پایین نیز صورت گرفت که مسیرهای تنظیم متابولیسم فسفر، تنظیم تحرک سلولی، پاسخ به استرسهای سلولی، پاسخ به مولکولهای آلی، سازماندهی اندامکهای سلولی و اصلاح ساختار ماکرومولکول ها در فرآیندهای زیستی و فعالیتNADH dehydrogenase و فعالیت ATP در عملکرد های مولکولی شرکت داشتند.
آنالیز شبکه پروتئینی: در این مرحله ژنهای با بیان بالا و پایین را که در مسیرهای مهم شرکت داشتند، بررسی نمودیم. بر این اساس در شبکه پروتیینی با بیان بالا 147 گره و 710 لبه و برای شبکه پروتیینی با بیان پایین 138 گره و 310 لبه تشکیل شده است که ارتباط بین پروتئینها در مسیرهای عفونت ویروس نیل غربی در شبکیه چشم مشخص شدهاند (شکل 7).
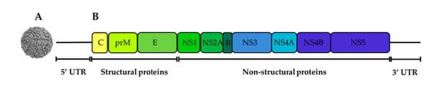
شکل 1: ساختار ویریون WNV (A) و ژنوم ویروسی با طول 11 کیلو جفت باز که با یک ORF کد کننده B: 3 پروتئین ساختاری و 7 پروتئین غیر ساختاری نشان داده شده است منبع: اقتباس شده از De Filette و همکاران (7،8).
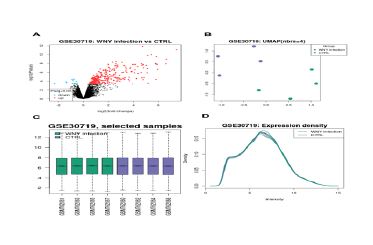
شکل2: اطلاعات کلی ار پروفایل بیان ژن دیتاست GSE30719 که مرتبط با عفونت ویروس نیل غربی در شبکیه چشم است بهدست آمده است. بر همین اساس تصویر A نموار ولکانو افتراق بیان ژنها را بین این دو گروه نشان داده است. در تصویر B نمودار تراکم بیان ژنها نشان میدهد برای آنالیز گزینه مناسبی هستند. تصویر C بار پلات از میزان تعداد ژنهای معنیدار بوده و نمودار در اراباط با شاخص T STATIC است. نمودار جعبهای نمونههای هر گروه را نیز نشان میدهد. تصویر D میزان تراکم افتراق بیان ژنها را در هر گروه نشان داده است.
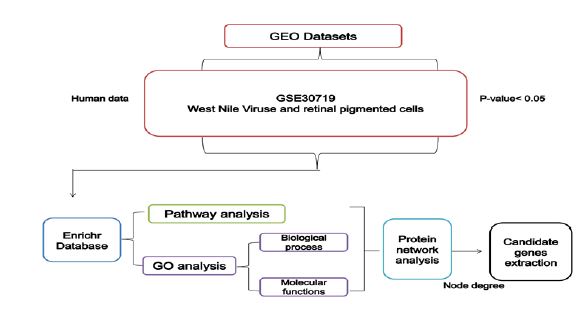
شکل 3: مسیر شماتیک نحوه انجام آنالیز بیوانفورماتیک
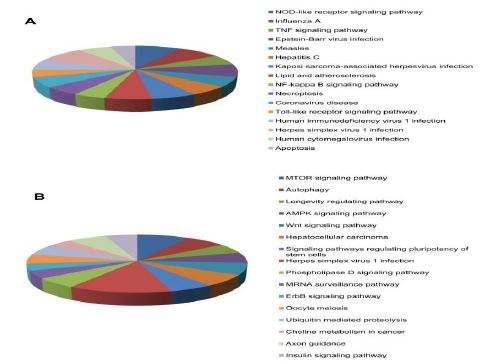
شکل 4: ارزیابی مسیرهای سیگنالی که A برای ژن های با بیان بالا و B برای ژنهای با بیان پایین مشخص شدهاند.
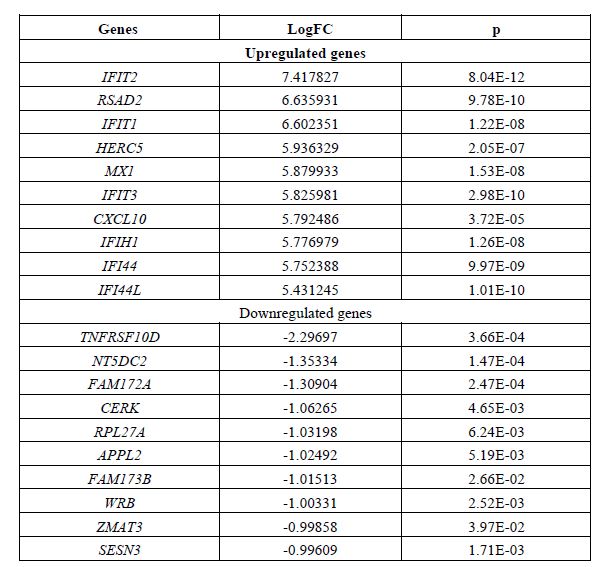
جدول 1: ده ژن اول که بیشترین افتراق بیان را در عفونت ویروس نیل غربی در شبکیه چشم، داشتند
شکل 5: بار پلات بین فرایندهای زیستی در عفونت ویروس نیل غربی در شبکیه چشم که بیان بالا و پایین داشتند به کمک پایگاه داده shiny GO ترسیم شدند.

شکل 6: در این تصویر که بهصورت خوشهبندی سلسله مراتبی است، عملکردهای مولکولی بین ژنهای با بیان بالا و پایین عفونت ویروس نیل غربی در شبکیه چشم مشخص شدند.
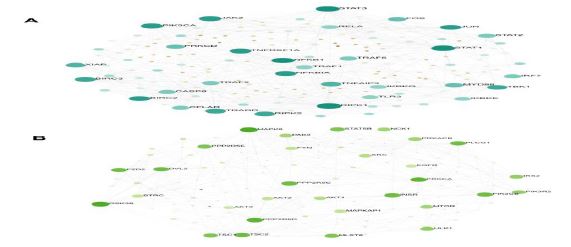
شکل 7: شبکه پروتئینی بین ژن های با بیان بالا و پایین در عفونت ویروس نیل غربی در شبکیه چشم مشخص شدهاند.
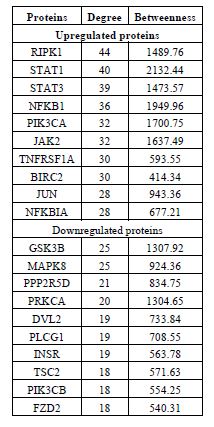
جدول 2: بیشترین ارتباطات پروتئینهای با بیان بالا و پایین در شبکه ترسیم شده
بحث
شیوع بیماریهای وابسته به عفونتهای ویروسی در کشور ایران نیز رو به افزایش است. از سوی دیگر سیستم ایمنی افراد در درازمدت تضعیف شده و یا خود بدن در دوران کهولت سنی رو به زوال میرود و از اینرو که جمعیت کشور ایران به سمت کهنسالی در حرکت است یکی از علل مهم و چالشبرانگیز در آینده نزدیک ایران خواهد بود و این مطالعه میتواند مخاطرات این موضوع را برای ما شفاف کرده تا بتوانیم مدیریت درمان بهتری را اتخاذ کنیم. از زمان اولین توصیف درگیری داخل چشمی ثانویه به عفونت WNV در سال 2003، چندین عواقب چشمی شناسایی شده است. بر اساس تجربه بالینی بیماران و بررسی مطالعات دیگر، پنج دسته از تظاهرات داخل چشمی عفونت WNV شناسایی شدند. اینها عبارتند از کوریورتینیت با ضایعات بهطور گسترده یا در آرایههای خطی، یووئیت بدون ضایعات کانونی، واسکولیت انسدادی شبکیه، اسکار کوریورتینال مادرزادی ثانویه به انتقال داخل رحمی، و نوریت بینایی (12،13). به همین دلیل این ویروس اگر ساده انگاشته شود می تواند عواقب جبرانناپذیری را به همراه داشته باشد. ما در این مطالعه بهطور دقیق و همهجانبه به شفافسازی ژنهای دخیل در این عفونت خطرناک چشمی پرداخته و مسیرهای سیگنالی، ژنها و محصولات پروتئینی مهم و دخیل در تضعیف ساختار شبکیه را ارزیابی کردیم. تا کنون فقط یک مطالعه با رویکرد نزدیک به این مطالعه صورت گرفته است. مطالعه Erazo و همکاران نشان داد، خوشهبندی عملکردی دادههای میکرواری نشان داد که خوشههای ژنی درگیر در پاسخهای ایمنی و ضد ویروسی، شامل ژنهایی مانند کموکاین (موتیف C-C) لیگاند 2 (CCL2)، کموکاین (موتیف C-C)، لیگاند 5 (CCL5-mokine (CCL5) ) لیگاند 10 (CXCL10) و گیرنده مشابه 3 (TLR3). در ارتباط با تجزیه و تحلیل کمی PCR، سایر ژنهای جدید تنظیمشده توسط عفونت WNV شامل ایندول آمین ۲،۳-دیاکسیژناز (IDO1)، ژنهای دخیل در مسیر تبدیل فاکتور رشد-β (پروتئین مورفوژنتیک استخوان و همولوگ مهارکننده متصل به غشاء اکتیوین هستند. [BAMBI] و فاکتور رونویسی فعال کننده 3 [ATF3]، و ژنهای دخیل در آپوپتوز درخانواده گیرنده فاکتور نکروز تومور، عضو 10d [TNFRSF10D]. RPE آلوده به WNV هیچ اینترفرون-γ تولید نمیکند، که نشان میدهد IDO1 توسط سایر عوامل محلول، توسط ویروس به تنهایی یا هر دو القا میشود (14). سرین/ترئونین - پروتئین کیناز 1 (RIPK1) با گیرنده برهم کنش برای اولین بار به عنوان پروتئینی کشف شد که با گیرنده مرگ، Fas1)، در مسیر انتقال سیگنال که منجر به مرگ برنامهریزی شده سلولی میشود، در تعامل است (15،16). از آن زمان، RIPK1 به عنوان یک مولکول مرکزی که مسیرهای بیولوژیکی متعددی را که منجر به مرگ و التهاب سلولی میشود، تنظیم میکند. نقش آن در تنظیم ایمنی اهمیت ویژهای دارد (17). هدف اولیه سیستم ایمنی محافظت از میزبان در برابر عوامل بیماری زا است. RIPK1 همراه با RIPK3 سیگنالهایی را برای بیان کموکاین و برای فراخوانی لکوسیتهای ضد ویروسی نفوذی در سیستم عصبی مرکزی در طول عفونت WNV نشان میدهد. موشهایی که فرم مرده کیناز RIPK1 را بیان میکردند، حساسیت بیشتری به عفونت WNV نشان دادند. حتی اگر مکانیسمهای مولکولی این اثر کاملاً درک نشده باشند، این دادهها نقش محافظتی RIPK1 در برابر WNV را نشان میدهند. مطالعات سطح RIPK1 بر عفونت WNV میتواند به تعیین اینکه آیا WNV مانع از سیگنالدهی با واسطه RIPK1 میشود کمک کند (18،19). پروتئینهایی که در این مطالعه مورد انتخاب قرار گرفتند، به خاطر مطالعات محدود مولکولی بر روی این ویروس اطلاعاتی مستقیمی اژ آنها در دسترس نیست اما بهطور کلی این امر مشخص است که این پروتئینها در مسیرهای التهابی نقش کلیدی داشته و میتواند در موقع عفونت کمک شایانی به پیشرفت عفونت در شبکیه چشم نموده و شاید منجر به نابینایی گردند. مبدلهای سیگنال و فعالکنندههای رونویسی (STAT) 1 برای پاسخهای سلولی به اینترفرونهای نوع I (IFN-Is)، با ظرفیت تعیین نتیجه عفونت ویروسی حیاتی است. قبلاً نشان داده شد که در حالیکه موشهای نوع وحشی (WT) دچار بیماری خفیف میشوند و از عفونت با ویروس کوریومننژیت لنفوسیتی (LCMV) جان سالم بهدر میبرند، عفونت LCMV موشهای دارای کمبود STAT1 منجر به یک بیماری کشنده میشود که وابسته به سلولهای IFN-I و CD4+ است. IFN-I به عنوان پلی بین ایمنی ذاتی و انطباقی عمل میکند. Junag و همکاران سهم نسبی STAT1 را در ایمنی ذاتی و تطبیقی در طول عفونت LCMV تعیین کردند. این گروه نشان داد که کمبود STAT1 منجر به یک بیماری دوفازی به دنبال عفونت LCMV میشود. فاز اولیه بیماری مبتنی بر ایمنی ذاتی با کاهش وزن سریع، ترومبوسیتوپنی، پاسخهای سیتوکین و کموکاین سیستمیک و نفوذ لکوسیت در اندامهای آلوده مشخص میشود. در غیاب پاسخ ایمنی تطبیقی، این مرحله اول بیماری تا حد زیادی برطرف شده و منجر به بقای میزبان آلوده میگردد. با اینحال، در حضور ایمنی تطبیقی، بیماری به مرحله دوم با ادامه تولید سیتوکین و کموکین، تخلیه مداوم لکوسیت به بافتهای آلوده و در نهایت مرگ میزبان پیشرفت نمود (20). عفونت سیتومگالوویروس انسانی (HCMV) چندین فعالیت متابولیکی را القا میکند که برای تکثیر ویروس ضروری هستند. علیرغم نقش مهمی که این مدولاسیون متابولیک در طول عفونت ایفا می کند، مکانیسمهای ویروسی درگیر تا حد زیادی نامشخص است. Sanchez و همکاران متوجه شدند که پروتئین HCMV UL38 مسئول بسیاری از جنبههای فعالسازی متابولیکی با واسطه HCMV است، بهطوری که UL38 برای تحریک فعالسازی گلیکولیتیک و القای کاتابولیسم اسیدهای آمینه خاص ضروری و کافی است. نقش برنامهریزی مجدد متابولیک UL38 به تعامل آن با TSC2، یک سرکوب کننده تومور که سیگنالدهی mTOR را مهار میکند، بستگی دارد. علاوه بر این، از بین بردن TSC2 با واسطه shRNA، فنوتیپهای متابولیکی مرتبط با بیان UL38 را خلاصه میکند. قابلتوجه است، این گروه نشان داد که در بسیاری از موارد، فعالسازی شار متابولیک مرتبط با بیان UL38 تا حد زیادی مستقل از فعالیت mTOR است، زیرا مهار طیف وسیع mTOR بر القای گلیکولیز با واسطه UL38، مصرف گلوتامین یا ترشح پرولین یا آلانین تأثیری ندارد. در مقابل، القای غلظت متابولیت مشاهده شده با بیان UL38 تا حد زیادی به mTOR فعال وابسته است (21،22). مطالعات قبلی نشان دادهاند که اینترفرون نوع (IFN- I) I تکثیر و پاتوژنز ویروس نیل غربی (WNV) را در بافتهای سیستم عصبی محیطی و مرکزی (CNS) محدود میکند. با اینحال، نقش درونتنی ژنهای ضد ویروسی خاص که توسط IFN-I در برابر عفونت WNV القا میشوند، بهخوبی مشخص نشده است. در مطالعه Cho و همکاران، با استفاده از موش Ifit2-/-، عملکرد ضد ویروسی ژن تحریک شده با اینترفرون (ISG) Ifit2 را در محدود کردن عفونت و بیماری در داخل بدن توسط یک سویه خطرناک آمریکای شمالی WNV تعریف کردند. در مقایسه با کنترلهای همزاد نوع وحشی، موشهای Ifit2-/- عفونت WNV را به شیوهای محدود بافتی با تکثیر ترجیحی در CNS حیوانات فاقد Ifit2 نشان دادند. تجزیه و تحلیل ویروسی ماکروفاژهای کشت داده شده، سلولهای دندریتیک، فیبروبلاست ها، نورون های سلولی گرانول مخچه، و نورون های قشر مغز، عملکردهای ضد ویروسی نوع سلولی خاص Ifit2 را در برابر WNV نشان داد. در مقایسه، اثرات کوچک Ifit2 بر القا یا بزرگی پاسخهای ایمنی ذاتی یا تطبیقی مشاهده شد. نتایج نشان میدهد که Ifit2 عفونت و پاتوژنز WNV را در بافتهای مختلف به شیوهای خاص نوع سلولی محدود میکند. ویروس نیل غربی یک ویروس در حال ظهور است که حدت آن به فرار ویروسی از IFN و دفاع ایمنی ذاتی وابسته است. فعالیتهای ژنهای تحریکشده با IFN (ISGs) کنترل عفونت ویروسی را ایجاد میکنند، اما ISGهای خاص و مسیرهای نظارتی که ویروس نیل غربی (WNV) را محدود میکنند، تعریف نشدهاند. در اینجا نشان دادند که مهارکننده فسفوریلاسیون κB کیناز ε (IKKε) STAT1 در سرین 708 (Ser-708) بیان IFIT2 را برای واسطهسازی عملکرد مؤثر ضد WNV IFN هدایت میکند. عفونت WNV در سلولهای موش IKKε-/- یا IFIT2-/- افزایش یافت. در سلولهای IKKε-/-، از دست دادن بیان IFIT2 ناشی از IFN با کمبود فسفوریلاسیون STAT1 در Ser-708 مرتبط بود، اما نه Tyr-701 و نه Ser-727. فسفوریلاسیون STAT1 Ser-708 بهطور مستقل از IRF-3 رخ میدهد، اما نیاز به سیگنالدهی از طریق گیرنده IFN-α/β به عنوان یک رویداد دیرهنگام در پاسخ ایمنی ذاتی ناشی از IFN دارد که با بیان ISGs پاسخگو به IKKϵ همزمان است. تجزیه و تحلیل های بیوشیمیایی نشان میدهد که دفسفوریلاسیون تیروزین STAT1 و انتقال هستهای سیتوپلاسمی STAT1 با واسطه CRM1 برای فسفوریلاسیون STAT1 Ser-708 مورد نیاز است. در مقایسه با موشهای WT، موشهای IKKε-/- آلوده به WNV سینتیک افزایش یافته انتشار ویروس و افزایش پاتوژنز همزمان با از دست دادن فسفوریلاسیون STAT1 Ser-708 و بیان IFIT2 را نشان میدهند. نتایج یک مسیر سیگنالینگ IKK ε ناشی از IFN از فسفوریلاسیون خاص STAT1 و بیان IFIT2 را تعریف میکند که ایمنی ضد ویروسی ذاتی را برای محدود کردن عفونت WNV و کنترل پاتوژنز ویروسی ایجاد می کند (25-23). مطالعه حاضر نشان داد که پروتیئنها و ژنهای مهمی در تقویت التهاب ویروس نیل غربی در شبکیه چشم نقش عمدهای داشته که از میان آنها RIPK1، TSC2، STAT1 و JAK2 نقش بارزتری را در این مسیر نشان دادند. البته که مطالعات مولکولی بیشتری برای اثبات دقیقتر مسیرهای ویروسی در چشم مورد نیاز است.
سپاسگزاری
این تحقیق، برگرفته از پایاننامهای میباشد، که تمام منشور اخلاقی در آن رعایت و در دانشگاه آزاد واحد اسلامشهر- تهران انجام گرفته است. بدین وسیله مراتب سپاس و قدردانی خود را از کلیه کسانی که در این پژوهش ما را یاری نمودهاند، اعلام می نماییم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد اسلامشهر تایید و تمام نکات اخلاقی در آن رعایت شده است.
مشارکت نویسندگان
خانم دکتر مهناز محمدی در طراحی مطالعه، خانم دکتر صبا طاهری در جمعآوری دادهها، آقای رضا حسینزاده در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
در میان ویروسهای نوظهور منتقله از بندپایان (arbovirus)، ویروس نیل غربی (WNV) یک فلاوی ویروس است که میتواند با عفونتهای عصبی شدید در انسان مرتبط باشد. در سال 2018، اپیدمی WNV اروپا منجر به بیش از 2000 مورد شد که نشاندهنده مهمترین اپیدمی آربوویروس در قاره اروپا است. مشخص کردن التهاب و بیومارکرهای عصبی منتشر شده در طول عفونت WNV، بهویژه در زمینه اختلالات عصبی، میتواند بینشی در مورد توسعه ابزارهای پیشبینی که میتواند برای نتایج بیمار مفید باشد، ارائه دهد (1). تظاهرات چشمی یکی از ویژگیهای عفونت ویروس نیل غربی است. آنها بیشتر در ارتباط با بیماری عصبی شدید رخ میدهند. کوریورتینیت خطی نشان دهنده تشخیص است و ممکن است در صورت همراهی با علائم سیستمیک تحریک کننده و در یک زمینه اپیدمی، شک تشخیصی را ایجاد کند. تظاهرات التهابی چشمی متفاوت دیگری از جمله یووئیت قدامی، واسکولیت انسدادی شبکیه، نوریت بینایی و دوبینی گزارش شده است. پاتوفیزیولوژی بیماری چشمی نامشخص است، اما نشان دهنده تهاجم به سلولهای عصبی است. اگرچه درگیری چشمی اغلب بدون عواقب بینایی برطرف میشود، برخی از بیماران ممکن است بینایی دائمی خود را از دست بدهند که نیاز به توسعه یک درمان و/یا واکسن خاص را افزایش میدهد (2). مطالعات اخیر بر کوریورتینیت چند کانونی با ظاهر معمولی فوندوسکوپیک و آنژیوگرافی فلورسینی ضایعات کوریورتینال به عنوان یک یافته اولیه و مکرر در عفونت ویروس نیل غربی (WNV) مشخص شده است. نشانگر اختصاصی بیماری، بهویژه در بیمارانی که با مننژوانسفالیت مراجعه میکنند. مشخص شد که خوشهبندی خطی ضایعات کوریورتینال یک ویژگی برجسته است که در بیش از 80 درصد چشمهای مبتلا به کوریورتینیت مرتبط با WNV رخ میدهد (5-3). پاتوژنز کوریورتینیت مرتبط با WNV هنوز مشخص نشده است. حدس زده شده است که انتشار هماتوژن WNV به کوریوکاپیلاریس در طی ویرمی ممکن است مشیمیه را برای ایجاد کوریورتینیت چند کانونی با توزیع پراکنده یا خطی ضایعات کوریورتینال ببرد. دلیل الگوی توزیع چنین ضایعاتی نامشخص بود، اما تصور میشد که رگههای خطی سیر عروق مشیمیه را دنبال میکنند (8-6) (شکل 1). به همین دلیل یافتن مسیرهای سیگنالی، ژنها و محصولات پروتئینی مرتبط با ویروس نیل غربی یک راهکار درمان با پتانسیل بالا را ارائه میدهد. هر یک از پروتئینهای ویروسی، اعم از ساختاری یا غیرساختاری، نقش متفاوت و خاصی در بیولوژی و یا پاتوژنز عفونتهای WNV ایفا میکنند. در یک دهه گذشته استفاده از دانش بیوانفورماتیک کمک شایانی به یافتن انواع بیومارکرها از سطح ژنوم تا پروتئوم را در انواع مختلف بیماریها و بهخصوص بیماریهای عفونی به همراه داشته است (11-9). این امر موجب شده که در این مطالعه با استفاده از آنالیزهای پیوسته و یکپارچه بیوانفورماتیک به بررسی پروفایل بیان ژن عفونت بهواسطه ویروس نیل غربی در سلولهای رنگدانه شبکیه پرداخته و مسیرها و پروتئینهای اختصاصی در این سلولها را جداسازی و مورد ارزیابی بیشتر قرار دهیم.
روش بررسی
دیتاست پروفایل بیان ژن ویروس نیل غربی با سلولهای رنگدانه شبکیه چشم: در این مطالعه دیتاست GSE30719از پایگاه دادهGEO(https://www.ncbi.nlm.nih.gov/geo) انتخاب شده و مورد استفاده قرار گرفت. این دیتاست دارای 8 نمونه است که شامل دو گروه 4 عضوی به صورت سلولهای سالم شبکیه چشم و سلولهایی که 24 ساعت از عفونت آنها به WNV گذشته است بود. پلتفرم استفاده شده در این دیتاست GPL6244 - Affymetrix Human Gene 1.0 ST Array بود.
آمادهسازی دادههای پروفایل بیان ژن برای انجام آنالیزهای تکمیلی: دیتاست GSE30719 را به کمک آنالیز GEO2R جداسازی کرده سپس ژنهای با p <0.05، logFC<-1، logFC>1 جدا نموده و پس از آن ژنهای با بیان بالا و پایین را دستهبندی نمودیم. در نهایت دادهها را در فایل اکسل ذخیره نموده و برای سایر آنالیزها آماده کردیم (شکل 2).
بررسی مسیرهای سیگنالی: از دیتاست GSE30719 ژنهایی که دارای افتراق بیان بودند را بهصورت جداگانه با پایگاه داده Enrichr (https://amp.pharm.mssm.edu/Enrichr) آنالیز نموده و به کمکKEGG مسیرهای سیگنالی مرتبط و ژنهای دخیل در هرکدام را انتخاب کردیم. لازم به ذکر است که <0.05p را برای مطالعه مسیرهای سیگنالی مورد بررسی قرار دادیم (شکل 3).
بررسی ماهیت ژنها: در این قسمت، از مسیرهای سیگنالی منتخب و مرتبط با عفونت ویروس نیل غربی در شبکیه چشم ژنهای آنها را جدا نموده و به کمک پایگاه داده Enrichr و panther (http://www.pantherdb.org)/ geneListAnalysis.do)، دو بخش، فرایندهای زیستی (BP) و عملکردهای مولکولی (MF) مورد ارزیابی قرار گرفتند. در این مطالعه سنجش ژنهای با بیان بالا به دلیل انتخاب بیومارکر مناسب به خصوص در اجزای سلولی بیشتر حائز اهمیت بود. در قدم بعدی ده ژنی که بیشترین بیان و کمترین بیان را داشتند نیز بهصورت جداگانه مورد ارزیابی قرار گرفتند. در این قسمت نیز برای انتخاب بهترین Ontology ژنها p <0.05 بررسی گردید.
بررسی ارتباط بین پروتئینها: ژنهای انتخاب شده از مسیرهای سیگنالی و GO در پایگاه داده STRINGS (https://string-db.org) آپلود شده و شبکه ارتباط بین پروتئینها را بهدست آوردیم. برای نمایش بهتر دادهها از نرمافزار cytoescape ورژن 3.7.1 استفاده نمودیم.
تجزیه و تحلیل آماری
دادههای بیوانفورماتیک در این مطالعه بر اساس روش¬های قید شده و به صورت پیوسته و یکپارچه مورد ارزیابی قرار گرفتند. همچنین مقادیر بهدست آمده که P˂0.05 به عنوان دادههای معنیدار انتخاب شد.
نتایج
ژنهای آپوپتوز، نکروپتوز، toll like receptor و Wnt افتراق بیان بارزتری در عفونت ویروس نیل غربی در شبکیه چشم نشان دادند. آنالیز پروفایل بیان ژن GSE30719 نشان داد که 812 ژن با بیان بالا و 500 ژن با بیان پایین میتوانند در مسیرهای عفونت ویروس نیل غربی در شبکیه چشم نقش داشته باشند. مسیرهای نکروپتوز، آپوپتوز، NOD like receptor، TNF alpha، NK Kappa B، کرونا ویروس، هپاتیت C و نقص ایمنی بیان بالا داشته و مسیرهای هدایت آکسونی، AMPK، Mtor، اتوفاژی، مقاومت به انسولین و مسیر وابسته به هرپس ویروس بیان پایین داشتند (شکل 4 و جدول 1).
آنالیز Gene Ontology: در این قسمت ما ژنهای با بیان بالا و پایین را در دو بخش فرآیندهای سلولی و عملکردهای مولکولی ارزیابی کردیم. در بخش فرایندهای زیستی مسیرهای چرخه سلولی، پردازش فرایندهای سلولی، خود تنظیمی مثبت در مسیرهای متابولیسمی، تنظیم فرایندهای بیوسنتزی و انتقالات درون سلولی، همچنین در عملکردهای مولکولی فسفاتها، اتصالات فریزلد، اتصلات اینتگرینها، فاکتور رشد رگهای اندوتلیالی 2 و فعالیت سایتوکاینها وجود داشتند. همین بررسی به طور مشابه برای ژن¬های با بیان پایین نیز صورت گرفت که مسیرهای تنظیم متابولیسم فسفر، تنظیم تحرک سلولی، پاسخ به استرسهای سلولی، پاسخ به مولکولهای آلی، سازماندهی اندامکهای سلولی و اصلاح ساختار ماکرومولکول ها در فرآیندهای زیستی و فعالیتNADH dehydrogenase و فعالیت ATP در عملکرد های مولکولی شرکت داشتند.
آنالیز شبکه پروتئینی: در این مرحله ژنهای با بیان بالا و پایین را که در مسیرهای مهم شرکت داشتند، بررسی نمودیم. بر این اساس در شبکه پروتیینی با بیان بالا 147 گره و 710 لبه و برای شبکه پروتیینی با بیان پایین 138 گره و 310 لبه تشکیل شده است که ارتباط بین پروتئینها در مسیرهای عفونت ویروس نیل غربی در شبکیه چشم مشخص شدهاند (شکل 7).

شکل 1: ساختار ویریون WNV (A) و ژنوم ویروسی با طول 11 کیلو جفت باز که با یک ORF کد کننده B: 3 پروتئین ساختاری و 7 پروتئین غیر ساختاری نشان داده شده است منبع: اقتباس شده از De Filette و همکاران (7،8).

شکل2: اطلاعات کلی ار پروفایل بیان ژن دیتاست GSE30719 که مرتبط با عفونت ویروس نیل غربی در شبکیه چشم است بهدست آمده است. بر همین اساس تصویر A نموار ولکانو افتراق بیان ژنها را بین این دو گروه نشان داده است. در تصویر B نمودار تراکم بیان ژنها نشان میدهد برای آنالیز گزینه مناسبی هستند. تصویر C بار پلات از میزان تعداد ژنهای معنیدار بوده و نمودار در اراباط با شاخص T STATIC است. نمودار جعبهای نمونههای هر گروه را نیز نشان میدهد. تصویر D میزان تراکم افتراق بیان ژنها را در هر گروه نشان داده است.

شکل 3: مسیر شماتیک نحوه انجام آنالیز بیوانفورماتیک

شکل 4: ارزیابی مسیرهای سیگنالی که A برای ژن های با بیان بالا و B برای ژنهای با بیان پایین مشخص شدهاند.
جدول 1: ده ژن اول که بیشترین افتراق بیان را در عفونت ویروس نیل غربی در شبکیه چشم، داشتند


شکل 5: بار پلات بین فرایندهای زیستی در عفونت ویروس نیل غربی در شبکیه چشم که بیان بالا و پایین داشتند به کمک پایگاه داده shiny GO ترسیم شدند.

شکل 6: در این تصویر که بهصورت خوشهبندی سلسله مراتبی است، عملکردهای مولکولی بین ژنهای با بیان بالا و پایین عفونت ویروس نیل غربی در شبکیه چشم مشخص شدند.

شکل 7: شبکه پروتئینی بین ژن های با بیان بالا و پایین در عفونت ویروس نیل غربی در شبکیه چشم مشخص شدهاند.
جدول 2: بیشترین ارتباطات پروتئینهای با بیان بالا و پایین در شبکه ترسیم شده

بحث
شیوع بیماریهای وابسته به عفونتهای ویروسی در کشور ایران نیز رو به افزایش است. از سوی دیگر سیستم ایمنی افراد در درازمدت تضعیف شده و یا خود بدن در دوران کهولت سنی رو به زوال میرود و از اینرو که جمعیت کشور ایران به سمت کهنسالی در حرکت است یکی از علل مهم و چالشبرانگیز در آینده نزدیک ایران خواهد بود و این مطالعه میتواند مخاطرات این موضوع را برای ما شفاف کرده تا بتوانیم مدیریت درمان بهتری را اتخاذ کنیم. از زمان اولین توصیف درگیری داخل چشمی ثانویه به عفونت WNV در سال 2003، چندین عواقب چشمی شناسایی شده است. بر اساس تجربه بالینی بیماران و بررسی مطالعات دیگر، پنج دسته از تظاهرات داخل چشمی عفونت WNV شناسایی شدند. اینها عبارتند از کوریورتینیت با ضایعات بهطور گسترده یا در آرایههای خطی، یووئیت بدون ضایعات کانونی، واسکولیت انسدادی شبکیه، اسکار کوریورتینال مادرزادی ثانویه به انتقال داخل رحمی، و نوریت بینایی (12،13). به همین دلیل این ویروس اگر ساده انگاشته شود می تواند عواقب جبرانناپذیری را به همراه داشته باشد. ما در این مطالعه بهطور دقیق و همهجانبه به شفافسازی ژنهای دخیل در این عفونت خطرناک چشمی پرداخته و مسیرهای سیگنالی، ژنها و محصولات پروتئینی مهم و دخیل در تضعیف ساختار شبکیه را ارزیابی کردیم. تا کنون فقط یک مطالعه با رویکرد نزدیک به این مطالعه صورت گرفته است. مطالعه Erazo و همکاران نشان داد، خوشهبندی عملکردی دادههای میکرواری نشان داد که خوشههای ژنی درگیر در پاسخهای ایمنی و ضد ویروسی، شامل ژنهایی مانند کموکاین (موتیف C-C) لیگاند 2 (CCL2)، کموکاین (موتیف C-C)، لیگاند 5 (CCL5-mokine (CCL5) ) لیگاند 10 (CXCL10) و گیرنده مشابه 3 (TLR3). در ارتباط با تجزیه و تحلیل کمی PCR، سایر ژنهای جدید تنظیمشده توسط عفونت WNV شامل ایندول آمین ۲،۳-دیاکسیژناز (IDO1)، ژنهای دخیل در مسیر تبدیل فاکتور رشد-β (پروتئین مورفوژنتیک استخوان و همولوگ مهارکننده متصل به غشاء اکتیوین هستند. [BAMBI] و فاکتور رونویسی فعال کننده 3 [ATF3]، و ژنهای دخیل در آپوپتوز درخانواده گیرنده فاکتور نکروز تومور، عضو 10d [TNFRSF10D]. RPE آلوده به WNV هیچ اینترفرون-γ تولید نمیکند، که نشان میدهد IDO1 توسط سایر عوامل محلول، توسط ویروس به تنهایی یا هر دو القا میشود (14). سرین/ترئونین - پروتئین کیناز 1 (RIPK1) با گیرنده برهم کنش برای اولین بار به عنوان پروتئینی کشف شد که با گیرنده مرگ، Fas1)، در مسیر انتقال سیگنال که منجر به مرگ برنامهریزی شده سلولی میشود، در تعامل است (15،16). از آن زمان، RIPK1 به عنوان یک مولکول مرکزی که مسیرهای بیولوژیکی متعددی را که منجر به مرگ و التهاب سلولی میشود، تنظیم میکند. نقش آن در تنظیم ایمنی اهمیت ویژهای دارد (17). هدف اولیه سیستم ایمنی محافظت از میزبان در برابر عوامل بیماری زا است. RIPK1 همراه با RIPK3 سیگنالهایی را برای بیان کموکاین و برای فراخوانی لکوسیتهای ضد ویروسی نفوذی در سیستم عصبی مرکزی در طول عفونت WNV نشان میدهد. موشهایی که فرم مرده کیناز RIPK1 را بیان میکردند، حساسیت بیشتری به عفونت WNV نشان دادند. حتی اگر مکانیسمهای مولکولی این اثر کاملاً درک نشده باشند، این دادهها نقش محافظتی RIPK1 در برابر WNV را نشان میدهند. مطالعات سطح RIPK1 بر عفونت WNV میتواند به تعیین اینکه آیا WNV مانع از سیگنالدهی با واسطه RIPK1 میشود کمک کند (18،19). پروتئینهایی که در این مطالعه مورد انتخاب قرار گرفتند، به خاطر مطالعات محدود مولکولی بر روی این ویروس اطلاعاتی مستقیمی اژ آنها در دسترس نیست اما بهطور کلی این امر مشخص است که این پروتئینها در مسیرهای التهابی نقش کلیدی داشته و میتواند در موقع عفونت کمک شایانی به پیشرفت عفونت در شبکیه چشم نموده و شاید منجر به نابینایی گردند. مبدلهای سیگنال و فعالکنندههای رونویسی (STAT) 1 برای پاسخهای سلولی به اینترفرونهای نوع I (IFN-Is)، با ظرفیت تعیین نتیجه عفونت ویروسی حیاتی است. قبلاً نشان داده شد که در حالیکه موشهای نوع وحشی (WT) دچار بیماری خفیف میشوند و از عفونت با ویروس کوریومننژیت لنفوسیتی (LCMV) جان سالم بهدر میبرند، عفونت LCMV موشهای دارای کمبود STAT1 منجر به یک بیماری کشنده میشود که وابسته به سلولهای IFN-I و CD4+ است. IFN-I به عنوان پلی بین ایمنی ذاتی و انطباقی عمل میکند. Junag و همکاران سهم نسبی STAT1 را در ایمنی ذاتی و تطبیقی در طول عفونت LCMV تعیین کردند. این گروه نشان داد که کمبود STAT1 منجر به یک بیماری دوفازی به دنبال عفونت LCMV میشود. فاز اولیه بیماری مبتنی بر ایمنی ذاتی با کاهش وزن سریع، ترومبوسیتوپنی، پاسخهای سیتوکین و کموکاین سیستمیک و نفوذ لکوسیت در اندامهای آلوده مشخص میشود. در غیاب پاسخ ایمنی تطبیقی، این مرحله اول بیماری تا حد زیادی برطرف شده و منجر به بقای میزبان آلوده میگردد. با اینحال، در حضور ایمنی تطبیقی، بیماری به مرحله دوم با ادامه تولید سیتوکین و کموکین، تخلیه مداوم لکوسیت به بافتهای آلوده و در نهایت مرگ میزبان پیشرفت نمود (20). عفونت سیتومگالوویروس انسانی (HCMV) چندین فعالیت متابولیکی را القا میکند که برای تکثیر ویروس ضروری هستند. علیرغم نقش مهمی که این مدولاسیون متابولیک در طول عفونت ایفا می کند، مکانیسمهای ویروسی درگیر تا حد زیادی نامشخص است. Sanchez و همکاران متوجه شدند که پروتئین HCMV UL38 مسئول بسیاری از جنبههای فعالسازی متابولیکی با واسطه HCMV است، بهطوری که UL38 برای تحریک فعالسازی گلیکولیتیک و القای کاتابولیسم اسیدهای آمینه خاص ضروری و کافی است. نقش برنامهریزی مجدد متابولیک UL38 به تعامل آن با TSC2، یک سرکوب کننده تومور که سیگنالدهی mTOR را مهار میکند، بستگی دارد. علاوه بر این، از بین بردن TSC2 با واسطه shRNA، فنوتیپهای متابولیکی مرتبط با بیان UL38 را خلاصه میکند. قابلتوجه است، این گروه نشان داد که در بسیاری از موارد، فعالسازی شار متابولیک مرتبط با بیان UL38 تا حد زیادی مستقل از فعالیت mTOR است، زیرا مهار طیف وسیع mTOR بر القای گلیکولیز با واسطه UL38، مصرف گلوتامین یا ترشح پرولین یا آلانین تأثیری ندارد. در مقابل، القای غلظت متابولیت مشاهده شده با بیان UL38 تا حد زیادی به mTOR فعال وابسته است (21،22). مطالعات قبلی نشان دادهاند که اینترفرون نوع (IFN- I) I تکثیر و پاتوژنز ویروس نیل غربی (WNV) را در بافتهای سیستم عصبی محیطی و مرکزی (CNS) محدود میکند. با اینحال، نقش درونتنی ژنهای ضد ویروسی خاص که توسط IFN-I در برابر عفونت WNV القا میشوند، بهخوبی مشخص نشده است. در مطالعه Cho و همکاران، با استفاده از موش Ifit2-/-، عملکرد ضد ویروسی ژن تحریک شده با اینترفرون (ISG) Ifit2 را در محدود کردن عفونت و بیماری در داخل بدن توسط یک سویه خطرناک آمریکای شمالی WNV تعریف کردند. در مقایسه با کنترلهای همزاد نوع وحشی، موشهای Ifit2-/- عفونت WNV را به شیوهای محدود بافتی با تکثیر ترجیحی در CNS حیوانات فاقد Ifit2 نشان دادند. تجزیه و تحلیل ویروسی ماکروفاژهای کشت داده شده، سلولهای دندریتیک، فیبروبلاست ها، نورون های سلولی گرانول مخچه، و نورون های قشر مغز، عملکردهای ضد ویروسی نوع سلولی خاص Ifit2 را در برابر WNV نشان داد. در مقایسه، اثرات کوچک Ifit2 بر القا یا بزرگی پاسخهای ایمنی ذاتی یا تطبیقی مشاهده شد. نتایج نشان میدهد که Ifit2 عفونت و پاتوژنز WNV را در بافتهای مختلف به شیوهای خاص نوع سلولی محدود میکند. ویروس نیل غربی یک ویروس در حال ظهور است که حدت آن به فرار ویروسی از IFN و دفاع ایمنی ذاتی وابسته است. فعالیتهای ژنهای تحریکشده با IFN (ISGs) کنترل عفونت ویروسی را ایجاد میکنند، اما ISGهای خاص و مسیرهای نظارتی که ویروس نیل غربی (WNV) را محدود میکنند، تعریف نشدهاند. در اینجا نشان دادند که مهارکننده فسفوریلاسیون κB کیناز ε (IKKε) STAT1 در سرین 708 (Ser-708) بیان IFIT2 را برای واسطهسازی عملکرد مؤثر ضد WNV IFN هدایت میکند. عفونت WNV در سلولهای موش IKKε-/- یا IFIT2-/- افزایش یافت. در سلولهای IKKε-/-، از دست دادن بیان IFIT2 ناشی از IFN با کمبود فسفوریلاسیون STAT1 در Ser-708 مرتبط بود، اما نه Tyr-701 و نه Ser-727. فسفوریلاسیون STAT1 Ser-708 بهطور مستقل از IRF-3 رخ میدهد، اما نیاز به سیگنالدهی از طریق گیرنده IFN-α/β به عنوان یک رویداد دیرهنگام در پاسخ ایمنی ذاتی ناشی از IFN دارد که با بیان ISGs پاسخگو به IKKϵ همزمان است. تجزیه و تحلیل های بیوشیمیایی نشان میدهد که دفسفوریلاسیون تیروزین STAT1 و انتقال هستهای سیتوپلاسمی STAT1 با واسطه CRM1 برای فسفوریلاسیون STAT1 Ser-708 مورد نیاز است. در مقایسه با موشهای WT، موشهای IKKε-/- آلوده به WNV سینتیک افزایش یافته انتشار ویروس و افزایش پاتوژنز همزمان با از دست دادن فسفوریلاسیون STAT1 Ser-708 و بیان IFIT2 را نشان میدهند. نتایج یک مسیر سیگنالینگ IKK ε ناشی از IFN از فسفوریلاسیون خاص STAT1 و بیان IFIT2 را تعریف میکند که ایمنی ضد ویروسی ذاتی را برای محدود کردن عفونت WNV و کنترل پاتوژنز ویروسی ایجاد می کند (25-23). مطالعه حاضر نشان داد که پروتیئنها و ژنهای مهمی در تقویت التهاب ویروس نیل غربی در شبکیه چشم نقش عمدهای داشته که از میان آنها RIPK1، TSC2، STAT1 و JAK2 نقش بارزتری را در این مسیر نشان دادند. البته که مطالعات مولکولی بیشتری برای اثبات دقیقتر مسیرهای ویروسی در چشم مورد نیاز است.
سپاسگزاری
این تحقیق، برگرفته از پایاننامهای میباشد، که تمام منشور اخلاقی در آن رعایت و در دانشگاه آزاد واحد اسلامشهر- تهران انجام گرفته است. بدین وسیله مراتب سپاس و قدردانی خود را از کلیه کسانی که در این پژوهش ما را یاری نمودهاند، اعلام می نماییم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد اسلامشهر تایید و تمام نکات اخلاقی در آن رعایت شده است.
مشارکت نویسندگان
خانم دکتر مهناز محمدی در طراحی مطالعه، خانم دکتر صبا طاهری در جمعآوری دادهها، آقای رضا حسینزاده در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Constant O, Barthelemy J, Nagy A, Salinas S, Simonin Y. West Nile Virus Neuroinfection in Humans: Peripheral Biomarkers of Neuroinflammation and Neuronal Damage. Viruses 2022; 14(4): 756.
2- Rousseau A, Haigh O, Ksiaa I, Khairallah M, Labetoulle M. Ocular Manifestations of West Nile Virus. Vaccines(Basel) 2020; 8(4): 641.
3- Bains HS, Jampol LM, Caughron MC, Parnell JR. Vitritis and Chorioretinitis in a Patient with West Nile Virus Infection. Arch Ophthalmol 2003; 121(2): 205-10.
4- Garg S, Jampol LM. Systemic and Intraocular Manifestations of West Nile Virus Infection. Surv Ophthalmol 2005; 50(1): 3-13.
5- Vandenbelt S, Shaikh S, Capone A Jr, Williams GA. Multifocal Choroiditis Associated with West Nile Virus Encephalitis. Retina 2003; 23(1): 97-9.
6- Khairallah M, Ben Yahia S, Attia S, Zaouali S, Ladjimi A, Messaoud R. Linear Pattern of West Nile Virus-Associated Chorioretinitis is Related to Retinal Nerve Fibres Organization. Eye(Lond) 2007; 21(7): 952-5.
7- De Filette M, Ulbert S, Diamond M, Sanders NN. Recent Progress in West Nile Virus Diagnosis and Vaccination. Vet Res 2012; 43(1): 16.
8- Venkatesan N, Deepa P, Vasudevan M, Khetan V, Reddy AM, Krishnakumar S. Integrated Analysis of Dysregulated Mirna-Gene Expression in HMGA2- Silenced Retinoblastoma Cells. Bioinform Biol Insights 2014; 8: 177-91.
9- Chen J, Sun J, Liu X, Liu F, Liu R, Wang J. Structure-Based Prediction of West Nile Virus-Human Protein--Protein Interactions. J Biomol Struct Dyn 2019; 37(9): 2310-21.
10- Pichler S, Gu W, Hartl D, Gasparoni G, Leidinger P, Keller A, et al. The Mirnome of Alzheimer’s Disease: Consistent Downregulation of the Mir-132/212 Cluster. Neurobiol Aging 2017: 50: 167. e1-167. e10.
11- Nalini V, Segu R, Deepa PR, Khetan V, Vasudevan M, Krishnakumar S. Molecular Insights on Post-Chemotherapy Retinoblastoma by Microarray Gene Expression Analysis. Bioinform Biol Insights 2013: 7: 289-306.
12- Garg S, Jampol LM. Systemic and Intraocular Manifestations of West Nile Virus Infection. Surv Ophthalmol 2005; 50(1): 3-13.
13- Appler KK, Brown AN, Stewart BS, Behr MJ, Demarest VL, Wong SJ, et al. Persistence of West Nile Virus in the Central Nervous System and Periphery of Mice. PLoS One 2010; 5(5): e10649.
14- Munoz-Erazo L, Natoli R, Provis JM, Madigan MC, King NJ. Microarray Analysis of Gene Expression in West Nile Virus–Infected Human Retinal Pigment Epithelium. Mol Vis 2012; 18: 730-43.
15- Stanger BZ, Leder P, Lee TH, Kim E, Seed B. RIP: A Novel Protein Containing a Death Domain that Interacts with Fas/APO-1 (CD95) in Yeast and Causes Cell Death. Cell 1995; 81(4): 513-23.
16- Lim PY, Behr MJ, Chadwick CM, Shi PY, Bernard KA. Keratinocytes are Cell Targets of West Nile Virus in Vivo. J Virol 2011; 85(10): 5197-201.
17- Nagata S، Golstein P. The Fas Death Factor. Science 1995; 267(5203): 1449-56.
18- Daniels BP, Snyder AG, Olsen TM, Orozco S, Oguin TH 3rd, Tait SWG, et al. RIPK3 Restricts Viral Pathogenesis Via Cell Death-Independent Neuroinflammation. Cell 2017; 169(2): 301-13.e11.
19- Wang H, Siddharthan V, Hall JO, Morrey JD. West Nile Virus Preferentially Transports Along Motor Neuron Axons after Sciatic Nerve Injection of Hamsters. J Neurovirol 2009; 15(4): 293-9.
20- Jung SR, Ashhurst TM, West PK, Viengkhou B, King NJC, Campbell IL, et al. Contribution of STAT1 to Innate and Adaptive Immunity during Type I Interferon-Mediated Lethal Virus Infection. PLoS Pathog 2020; 16(4): e1008525.
21- Rodríguez-Sánchez I, Schafer XL, Monaghan M, Munger J. The Human Cytomegalovirus UL38 Protein Drives Mtor-Independent Metabolic Flux Reprogramming by Inhibiting TSC2. PLoS Pathog 2019; 15(1): e1007569.
22- Maximova OA, Bernbaum JG, Pletnev AG. West Nile Virus Spreads Transsynaptically within the Pathways of Motor Control: Anatomical and Ultrastructural Mapping of Neuronal Virus Infection in the Primate Central Nervous System. PLoS Negl Trop Dis 2016; 10(9): e0004980.
23- Wu S, Ye S, Lin X, Chen Y, Zhang Y, Jing Z, et al. Small Hepatitis B Virus Surface Antigen Promotes Malignant Progression of Hepatocellular Carcinoma Via Endoplasmic Reticulum Stress-Induced FGF19/JAK2/STAT3 Signaling. Cancer Lett 2021; 499: 175-87.
24- Ferguson DD, Gershman K, LeBailly A, Petersen LR. Characteristics of the Rash Associated with West Nile Virus Fever. Clin Infect Dis 2005; 41(8): 1204-7.
25- Anderson RC, Horn KB, Hoang MP, Gottlieb E, Bennin B. Punctate Exanthem of West Nile Virus Infection: Report of 3 Cases. J Am Acad Dermatol 2004; 51(5): 820-3.
1- Constant O, Barthelemy J, Nagy A, Salinas S, Simonin Y. West Nile Virus Neuroinfection in Humans: Peripheral Biomarkers of Neuroinflammation and Neuronal Damage. Viruses 2022; 14(4): 756.
2- Rousseau A, Haigh O, Ksiaa I, Khairallah M, Labetoulle M. Ocular Manifestations of West Nile Virus. Vaccines(Basel) 2020; 8(4): 641.
3- Bains HS, Jampol LM, Caughron MC, Parnell JR. Vitritis and Chorioretinitis in a Patient with West Nile Virus Infection. Arch Ophthalmol 2003; 121(2): 205-10.
4- Garg S, Jampol LM. Systemic and Intraocular Manifestations of West Nile Virus Infection. Surv Ophthalmol 2005; 50(1): 3-13.
5- Vandenbelt S, Shaikh S, Capone A Jr, Williams GA. Multifocal Choroiditis Associated with West Nile Virus Encephalitis. Retina 2003; 23(1): 97-9.
6- Khairallah M, Ben Yahia S, Attia S, Zaouali S, Ladjimi A, Messaoud R. Linear Pattern of West Nile Virus-Associated Chorioretinitis is Related to Retinal Nerve Fibres Organization. Eye(Lond) 2007; 21(7): 952-5.
7- De Filette M, Ulbert S, Diamond M, Sanders NN. Recent Progress in West Nile Virus Diagnosis and Vaccination. Vet Res 2012; 43(1): 16.
8- Venkatesan N, Deepa P, Vasudevan M, Khetan V, Reddy AM, Krishnakumar S. Integrated Analysis of Dysregulated Mirna-Gene Expression in HMGA2- Silenced Retinoblastoma Cells. Bioinform Biol Insights 2014; 8: 177-91.
9- Chen J, Sun J, Liu X, Liu F, Liu R, Wang J. Structure-Based Prediction of West Nile Virus-Human Protein--Protein Interactions. J Biomol Struct Dyn 2019; 37(9): 2310-21.
10- Pichler S, Gu W, Hartl D, Gasparoni G, Leidinger P, Keller A, et al. The Mirnome of Alzheimer’s Disease: Consistent Downregulation of the Mir-132/212 Cluster. Neurobiol Aging 2017: 50: 167. e1-167. e10.
11- Nalini V, Segu R, Deepa PR, Khetan V, Vasudevan M, Krishnakumar S. Molecular Insights on Post-Chemotherapy Retinoblastoma by Microarray Gene Expression Analysis. Bioinform Biol Insights 2013: 7: 289-306.
12- Garg S, Jampol LM. Systemic and Intraocular Manifestations of West Nile Virus Infection. Surv Ophthalmol 2005; 50(1): 3-13.
13- Appler KK, Brown AN, Stewart BS, Behr MJ, Demarest VL, Wong SJ, et al. Persistence of West Nile Virus in the Central Nervous System and Periphery of Mice. PLoS One 2010; 5(5): e10649.
14- Munoz-Erazo L, Natoli R, Provis JM, Madigan MC, King NJ. Microarray Analysis of Gene Expression in West Nile Virus–Infected Human Retinal Pigment Epithelium. Mol Vis 2012; 18: 730-43.
15- Stanger BZ, Leder P, Lee TH, Kim E, Seed B. RIP: A Novel Protein Containing a Death Domain that Interacts with Fas/APO-1 (CD95) in Yeast and Causes Cell Death. Cell 1995; 81(4): 513-23.
16- Lim PY, Behr MJ, Chadwick CM, Shi PY, Bernard KA. Keratinocytes are Cell Targets of West Nile Virus in Vivo. J Virol 2011; 85(10): 5197-201.
17- Nagata S، Golstein P. The Fas Death Factor. Science 1995; 267(5203): 1449-56.
18- Daniels BP, Snyder AG, Olsen TM, Orozco S, Oguin TH 3rd, Tait SWG, et al. RIPK3 Restricts Viral Pathogenesis Via Cell Death-Independent Neuroinflammation. Cell 2017; 169(2): 301-13.e11.
19- Wang H, Siddharthan V, Hall JO, Morrey JD. West Nile Virus Preferentially Transports Along Motor Neuron Axons after Sciatic Nerve Injection of Hamsters. J Neurovirol 2009; 15(4): 293-9.
20- Jung SR, Ashhurst TM, West PK, Viengkhou B, King NJC, Campbell IL, et al. Contribution of STAT1 to Innate and Adaptive Immunity during Type I Interferon-Mediated Lethal Virus Infection. PLoS Pathog 2020; 16(4): e1008525.
21- Rodríguez-Sánchez I, Schafer XL, Monaghan M, Munger J. The Human Cytomegalovirus UL38 Protein Drives Mtor-Independent Metabolic Flux Reprogramming by Inhibiting TSC2. PLoS Pathog 2019; 15(1): e1007569.
22- Maximova OA, Bernbaum JG, Pletnev AG. West Nile Virus Spreads Transsynaptically within the Pathways of Motor Control: Anatomical and Ultrastructural Mapping of Neuronal Virus Infection in the Primate Central Nervous System. PLoS Negl Trop Dis 2016; 10(9): e0004980.
23- Wu S, Ye S, Lin X, Chen Y, Zhang Y, Jing Z, et al. Small Hepatitis B Virus Surface Antigen Promotes Malignant Progression of Hepatocellular Carcinoma Via Endoplasmic Reticulum Stress-Induced FGF19/JAK2/STAT3 Signaling. Cancer Lett 2021; 499: 175-87.
24- Ferguson DD, Gershman K, LeBailly A, Petersen LR. Characteristics of the Rash Associated with West Nile Virus Fever. Clin Infect Dis 2005; 41(8): 1204-7.
25- Anderson RC, Horn KB, Hoang MP, Gottlieb E, Bennin B. Punctate Exanthem of West Nile Virus Infection: Report of 3 Cases. J Am Acad Dermatol 2004; 51(5): 820-3.
نوع مطالعه: پژوهشي |
موضوع مقاله:
زیست شناسی
دریافت: 1402/4/20 | پذیرش: 1403/1/15 | انتشار: 1403/1/15
دریافت: 1402/4/20 | پذیرش: 1403/1/15 | انتشار: 1403/1/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







