دوره 31، شماره 10 - ( دی 1402 )
جلد 31 شماره 10 صفحات 7107-7090 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Ataei Y S. Covid-19: Investigation of Important Mutations and their Effect on Vaccine Efficacy. JSSU 2024; 31 (10) :7090-7107
URL: http://jssu.ssu.ac.ir/article-1-6018-fa.html
URL: http://jssu.ssu.ac.ir/article-1-6018-fa.html
عطایی یاسمن سادات. کووید-19: بررسی جهش های مهم و تأثیر آن ها بر کارآیی واکسن. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (10) :7090-7107
متن کامل [PDF 1090 kb]
(711 دریافت)
| چکیده (HTML) (1359 مشاهده)
متن کامل: (2461 مشاهده)
مقدمه
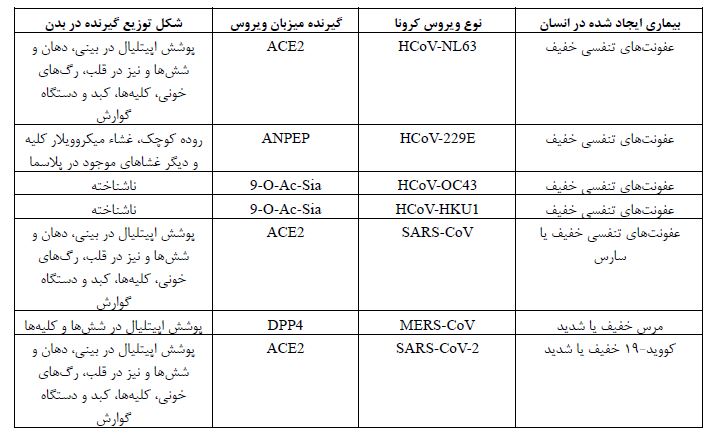
بروز پنومونی ناشناس ناشی از سندرم حاد تنفسی کروناویروس-2 (nCoV/SARS-CoV-2 2019) ابتدا در شهر ووهان چین و در ماههای پایانی سال 2019 گزارش شد (1). احتمال داده شد که اولین مورد از این پنومونی ناشناس که به عنوان کووید-19 (Covid-19) نامیده میشود از خفاشها به انسان سرایت کرده باشد، اما نحوه انتشار از انسان به انسان عمدتاً از طریق تماس با قطرات تنفسی در هوا است. عدد اصلی تکثیر این ویروس در کشورهای مختلف بین 1/4 تا 6/47 است که در مقایسه با سایر عفونتهای ویروسی کرونا از قدرت سرایت بیشتری برخوردار است (2). بر اساس تجزیه و تحلیل ژنتیکی و فیلوژنتیکی مشخص شده است که کروناویرروس-2 به همراه دو عضو غالب دیگر، یعنی کروناویروس مرتبط با سندرم تنفسی خاورمیانه (MERS-CoV) و کروناویروس سندرم تنفسی حاد شدید (SARS-CoV) متعلق به گروه ویروسهای بتا میباشد (3). در واقع تمام این عفونتهای ویروسی، شامل سارس سال 2003، مرس سال 2012 و کووید-19 سال 2019 ناشی از SARS-CoV-2 است که به خانواده Coronaviridae تعلق دارند (4). شباهتهایی از نظر بیماری ایجاد شده یا نوع و توزیع گیرنده ویروسی در بین کروناویروسهای انسانی وجود دارد که در جدول 1 آورده شده است. با توجه به اینکه این بیماری در یک بازه زمانی بسیار کوتاه به یک بیماری همهگیر جهانی تبدیل شد نگرانیهای وسیعی را در سراسر جهان ایجاد کرد که این همهگیری گسترده و میزان مرگ و میر به میزان جهشهای این ویروس مرتبط میباشد. در این مقاله تلاش شده است تا این جهشها بررسی شوند و درک اپیدمیولوژی مرتبط با آنها حاصل شود. همچنین انواع واکسنهای ساخته شده و اثرات این جهشها بر روی اثر واکسنها نیز مورد بررسی قرار گرفتهاند تا دید روشنتری نسبت به این ویروس و اثرات جهش¬های آن بر روی روند تولید واکسنها و اثرات آنها حاصل شود.
جدول1: مقایسه بین انواع ویروسهای کرونا، گیرنده آن¬ها در بدن میزبان و مدل توزیع گیرنده در بدن انسان
روش بررسی
برای بررسی منابع در رابطه با جهشهای ویروس کووید-19 و اثرات آن بر روی ویژگی¬های ویروس، و همچنین بررسی واکسنهای تولید شده و اثرات این جهشها بر روی عملکرد واکسنها، منابع مختلف موجود در پایگاههای اطلاعاتی Google Scholar، Science Direct، Scopus، Springer، Pubmed و Nature مورد بررسی قرار گرفتند. کلیدواژههای مورد استفاده نیز شامل SARS-CoV-2، Covid-19، Mutation، Vaccine و D614G بود. برای انتخاب کلیدواژهها و مقالات تلاش بر این بود که مقالاتی که به صورت دقیق و جامع توضیحات عمومی در مورد ویروس کووید-19 ارائه دادهاند انتخاب شوند. پس از آن نیز تمرکز بر روی انتخاب مقالاتی بود که به بررسی پراکندگی جغرافیایی جهشها و نیز جهشهای رخ داده در قسمتهای مختلف ویروس پرداخته باشند. در نهایت نیز واکسنها، انواع و تفاوتهای آنها و نیز اثرات جهشهای رخ داده بر روی عملکرد واکسن¬ها مورد مطالعه قرار گرفت تا تصویر جامعی از این ویروس و روشهای واکسیناسیون آن، و نیز روشهای احتمالی ویروس برای ایجاد مقاومت در آینده به دست آید. از میان 92 مقاله مطالعه شده، 46 مقاله انتخاب شد و با استفاده از آنها مطالب مورد نیاز گردآوری شد.
ساختار ویروس SARS‑CoV‑2: این ویروس از نظر ساختاری تقریباً کروی و نسبتاً پلئومورفیک است. یک ویریون معمولی آن قطر متوسط 80 تا 125 نانومتر دارد و دارای RNA های ویروسی مثبت تک رشتهای با نوکلئوکپسید است. اندازه ژنوم RNA آن 26 تا 32 کیلوباز است و 7 الی 10 عدد چهارچوب خوانش باز (Open Reading Frame: ORF) قابل ترجمه دارد. ORF1a و b به پروتئینهای pp1a و pp1ab ترجمه میشوند و این پلیپروتئینها نیز توسط پروتئازهای ویروسی جهت سنتز 16 پروتئین غیرساختاری پردازش داده میشوند. آنزیم RNA پلیمراز وابسته به RNA (RdRp) نیز در میان آنها قرار دارد که به تکثیر RNA ویروسی از طریق رونویسی یک الگوی رشته منفی کمک میکند و در طول این رونویسی شش الی نه mRNA زیر-ژنومی (sgmRNAs) تولید میکند که در نهایت به ترجمه پروتئینهای ساختاری فرودست ORF ها کمک میکنند. ژنوم ویروس همچنین تمام پروتئینهای ساختاری و عملکردی لازم برای ایجاد عفونت و تکثیر، از جمله پروتئین پوششی (E)، پروتئین نوکلئوکپسید (N)، پروتئین غشایی (M)، و پروتئین اسپایک (S) را کد میکند (5). ژنومSARS-CoV-2 همچنین دارای 15 پروتئین غیرساختاری (Non-Structural Protein: NSP) است که شامل nsp1-10 و nsp12-16 است که همراه با nsp11 در مجموع 16 پروتئین را شامل می-شود که با هشت پروتئین کمکی، یعنی ORF3a، ORF3b، ORFp6، ORF7a، ORF7b، ORF8b، ORF49b و ORF14 همراه هستند. این پروتئینها نقش کلیدی در تقویت و فعالیت ویروس دارند (6).
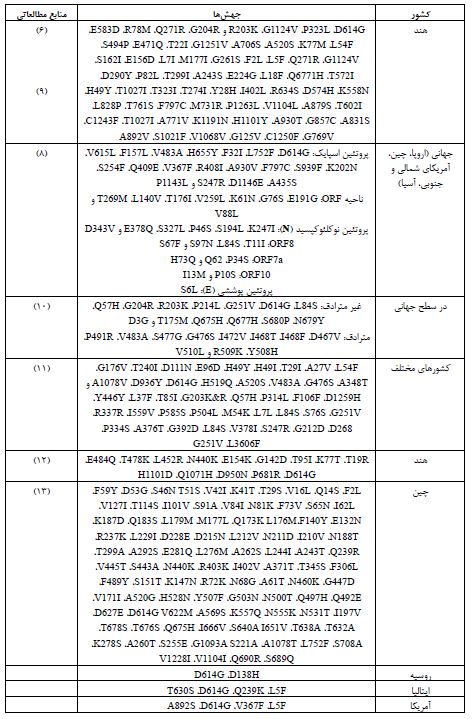
انواع جهشها و فراوانی آنها در ژنوم SARS‑CoV‑2: در این مقاله جهشهای مختلف SARS-CoV-2 در گستره جهانی بر اساس دادههای موجود در Genebank، Pubmed و GISAID گزارش شدهاند. جهش های غیر مترادف، مترادف، نقطهای، حذفی و جهشهای خاموش کل ژنوم در جدول 2 ارائه شدهاند.
پروتئینهای غیرساختاری کل ژنوم کروناویروس ORF6 را کد میکنند. بزرگترین گروه، پلیپروتئینهای ORF1ab هستند که قادر به تولید 16 پروتئین غیرساختاری (NSP) مورد نیاز برای تکثیر ویروس هستند. NSP ها بیشترین تعداد جهشهای بدمعنی در منطقه ORF1ab را متحمل میشوند. از مجموع 3328 جهش، 1344 جهش مترادف، 57 جهش حذفی، 2 جهش درجی، 7 جهش حذفی تغییر چارچوب، و 13 جهش نیز متوقف شده هستند (7). شایع ترین جهشها شامل E191G ، G76S ، K61N ، V259L، T176I، L140V، T269M و V88L در ناحیه ORF اتفاق میافتند (8).
جدول2: انواع جهشهای SARS-CoV-2 و پراکندگی آنها براساس سویههای کشورهای مختلف
تاریخچهای مختصر از واریانتهای SARS-CoV-2: واریانت¬های مختلفی از این ویروس به وجود آمده است که شامل موارد زیر میشود: آلفا (B.1.1.7, Q.1–Q.8)، بتا (B.1.351, B.1.351.2, B.1.351.3)، دلتا (B.1.617.2, AY.1, AY.2, AY.3)، گاما (P.1, P.1.1, P.1.2)، اپسیلون (B.1.427, B.1.429)، اتا (B.1.525)، آیوتا (B.1.526)، اُمیکرون (BA.2)، کاپا (B.1.617.1)، 1.617.3، مو (B.1.621, B.1.621.1)، زتا (P.2) و لامبدا (C.37). از این میان واریانتهای آلفا، بتا، دلتا و گاما در ابتدا به عنوان واریانتهایی که قابلیت انتقال و بیماریزایی بالایی دارند، و نیز از منظر تشخیص، درمان و مقاومت در برابر واکسن نگران-کننده هستند طبقه بندی شدند.
پنج واریانت نگرانکننده SARS-CoV-2 بر اساس ترتیب زمانی نامگذاری شدند. واریانت آلفا که با نامهای B.1.1.7 یا 501Y.V1 نیز شناخته می¬شود، برای اولین بار در سپتامبر 2020 در جنوب شرقی انگلستان گزارش شد و سپس به سرعت گسترش یافت و به عنوان گونه غالب در بریتانیا شناخته شد (14). فقط در چند ماه واریانت آلفا در بیش از 50 کشور گسترش یافت که این موضوع نشاندهنده قابلیت بیماریزایی بالاتر آن نسبت به واریانت اولیه است. این واریانت شامل دو جهش حذفی در آمینواسیدهای 70/69 و 145/144 در ناحیه آمین انتهایی، یک جایگزینی در ناحیه متصل شونده به گیرنده به صورت N501Y، به همراه سه جایگزینی دیگر به صورت A570D، D614G و P681H است که این جهش¬ها میل ترکیبی گیرنده ACE2 به ناحیه متصل شونده به گیرنده در ویروس را تا 7 برابر افزایش میدهند. واریانت بتا که با نامهای B.1.351، 501Y.V2 و یا 20H نیز شناخته می¬شود، متحمل 9 جهش در زیر واحد S1 شده است. این 9 جهش شامل چهار جایگزینی و یک حذف (Δ242-Δ244) در ناحیه آمین انتهایی، سه جهش تغییر آمینواسید به صورت K417N، E484K و N501Y در ناحیه متصل شونده به گیرنده و یک جایگزینی در D614G است (15). همچنین واریانت گاما که به نامهای P.1، B.1.1.248، 501Y.V3 و یا واریانت برزیل نیز معروف است، همان¬طور که از نام آن پیداست در برزیل شیوع پیدا کرد. شیوع این واریانت نیز با توجه به 12 جهشی که در پروتئین اسپایک آن به وجود آمده بود، نگرانی¬های قابل توجهی را به خود جلب کرد که از جمله این جهشها میتوان به K417T ، E484K و N501Y اشاره نمود (16). اما در اوایل سال 2021، توجهها به سمت واریانت دلتا جلب شد که برای اولین بار در اکتبر 2020 در هند ظاهر شد و سپس در بیش از 21 کشور گسترش یافت. این واریانت که B.1.617.2 نیز نامیده میشود، شامل T19R و G142D، یک حذف (Δ156–Δ157)، و جایگزینی¬های R158G، L452R، T478K، D614G، P681R، و D950N است (17). این واریانت جایگزین واریانتهای قبلی شد و به سرعت در هند گشترش یافت، به طوری که منجر به شناسایی 17 میلیون بیمار جدید در بازه زمانی مارس تا می 2021 شد. نکته قابل توجه در مورد آن مشاهده بیماری و عفونت مجدد در افراد بود. پس از آن این واریانت در بیشتر کشورها از دیگر واریانتها گستردهتر شد (18). واریانت اُمیکرون برای اولین بار در بوتسوانای آفریقای جنوبی و در ابتدای نوامبر 2021 شناسایی شد و در تاریخ 24 نوامبر توسط WHO به عنوان واریانت تحت نظر طبقهبندی شد، اما فقط دو روز بعد به عنوان واریانت نگران کننده در نظر گرفته شد. از میان توالیهای ارسال شده به GISAID، مشاهده شد که درصد توالی¬هایی که مربوط به اُمیکرون بود، از تقریباً 5% در اوایل دسامبر به تقریباً 95% در پایان این ماه در سال 2021 افزایش یافته است. اُمیکرون بیش از 60 جهش جانشینی، حذفی و درجی داشته است که آن را به واریانت نگران کننده با بیشترین جهش بدل کرد (19). واریانت B.1.617.2 که تحت عنوان واریانت دلتا نامیده میشود، برای اولین بار در اکتبر 2020 و در هند شناسایی شد. نوع دلتا از ویروس SARS-CoV-2 شامل سه زیرگروه اصلی یعنی B1.617.1، B1.617.2 و B1.617.3 میباشد که عمدتاً در ناحیه آمین انتهایی و نواحی اتصال به گیرنده در پروتئینهای S جهش یافته است. از آنجایی که این جهشها به پروتئین S در این واریانت مرتبط هستند، در مقایسه با انواع دیگر بسیار عفونیتر گزارش شدهاند و نرخ انتقال عفونت در آن بسیار سریع است. این واریانت توسط مراکز کنترل و پیشگیری از بیماری در ایالات متحده به عنوان واریانتی که پتانسیل انتقالپذیری آن در مقایسه با واریانتهای دیگر بیش از 60% افزایش یافته معرفی شد (20).
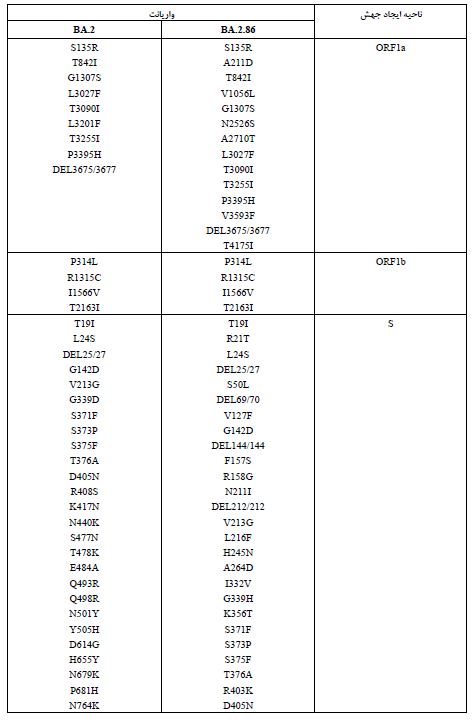
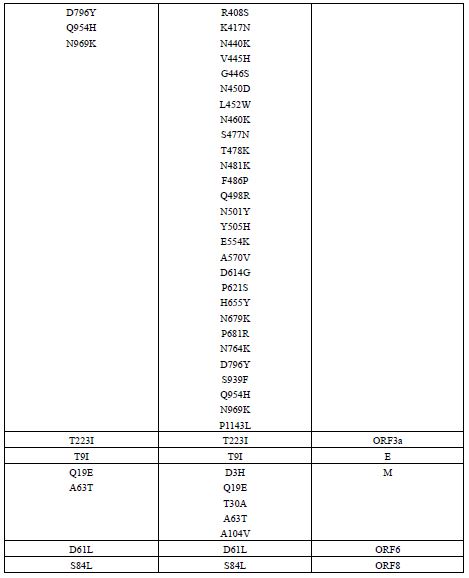
واریانت BA.2.86 یا پیرولا: نوع جدید SARS-CoV-2، BA.2.86 که با نام پیرولا نیز شناخته میشود، یک زیرمجموعه از اُمیکرون است که بهدلیل وجود جهشهای زیاد باعث نگرانی شده است. تا تاریخ 28 سپتامبر 2023، در 23 کشور264 مورد تأیید شده از این ویروس شناسایی شده است که شامل 66 مورد در بریتانیا (0/25%)، 34 مورد در ایالات متحده (87/12%)، 31 مورد در دانمارک (11/74%)، 25 مورد در سوئد (9/46%)، 20 مورد در آفریقای جنوبی (7/57%)، 20 مورد در اسپانیا (7/57%)، 15 مورد در فرانسه (5/68%)، 7 مورد در پرتغال (2/65%)، 6 مورد در ژاپن (2/27%)، 5 مورد در کانادا (1/89%)، 5 مورد در تایلند (1/89%)، 5 مورد در اسرائیل (1/89%)، 5 مورد در یونان (1/89%)، 3 مورد در آلمان (1/13%)، 3 مورد در بلژیک (1/13%)، 3 مورد در لوکزامبورگ (1/13%)، 3 مورد در هلند (1/13%)، و 3 مورد در کره جنوبی (1/13%) بوده است. در هر یک از کشورهای استرالیا، ایتالیا، ایسلند، سوئیس و چین نیز هر کدام یک مورد از این واریانت گزارش شده است. نکته جالب در مورد این واریانت این است که این در زنان (71/0%) بیشتر از مردان (29/0%) گزارش شده است. این واریانت با سرعت بیشتری نسبت به سایر انواع SARS-CoV-2 گسترش یافته و عمدتاً افراد مسن (بالای 60 سال) را درگیر میکند. با اینحال تا زمان ارائه این گزارش هیچ مورد فوتی گزارش نشده است. تظاهرات بالینی در بیماران مبتلا به واریانت پیرولا به خوبی مستند نشده است و ممکن است مشابه سویههای قبلی باشد که با علائم عفونی خفیف مانند سردرد، بدن درد، سرفه، تب، میالژی عمومی و شدید و خستگی ظاهر میشود. این واریانت نسبت به واریانتهای والد خود، یعنی XBB و BA.2، بیش از 30 جهش در پروتئین اسپایک دارد که بسیاری از آن ها به فرار ویروس از سیستم ایمنی کمک میکنند. به عنوان مثال، سرم-های به دست آمده از افراد واکسینه شده با 3 دوز از واکسنهای تک ظرفیتی، 4 دوز از واکسنهای تک ظرفیتی، واکسنهای mRNA دو ظرفیتی برای BA.1 و واکسنهای mRNA دوظرفیتی برای BA.5، نشان دادند که این واکسن¬ها اثرات ضد ویروسی بسیار کمی بر روی واریانت BA.2.86 دارند. همچنین سه آنتیبادی مونوکلونال ببتلوویماب، سوتروویماب و کیلگاویماب که بر روی واریانت BA.2 والد مؤثر هستند، در برابر BA.2.86 اثری نشان ندادند. این نتایج نشان میدهد که BA.2.86 یکی از انواع بسیار ایمن گریز تاکنون است و نیاز است تا مقامات بهداشت جهانی با انجام اقدامات پیشگیرانه، از شیوع این واریانت در حال ظهور در سراسر جهان جلوگیری کنند (22, 21). در بخش بعدی جهشهای مرتبط با پروتئینهای ساختاری کروناویروس توضیح داده شده¬اند. در انتهای آن نیز تفاوت های موجود بین جهشهای واریانت اُمیکرون (BA.2) و پیرولا (BA.2.86) در جدول 3 (23) آمدهاند.
جهشهای مرتبط با پروتئینهای ساختاری کروناویروس جهش در گلیکوپروتئین اسپایک (S): ناحیه اسپایک یک پروتئین بزرگ گذرنده از غشا است که دامنه اتصال به گیرنده (rbd) آن تمایل دارد تا به آنزیم آنزیم تبدیل کننده آنژیوتانسین 2 (ACE2) در سلولهای میزبان متصل شود. این اتصال ورود ویروس کرونا به سلول میزبان را تسهیل کرده و انتقال عفونت ناشی از ویروس را سرعت می¬بخشد. در مقایسه بین سویههای مختلف جهانی با توالی سویه اولیه مشاهده شده در ووهان چین، 394 جهش بدمعنی، 260 جهش مترادف، 5 جهش حذفی و 1 جهش تغییر چارچوب مشاهده شد (8). در میان دو منطقه فرعی پروتئین اسپایک یعنی دامنه S1 و S2، دامنه S1 دارای بیشترین تعداد جهش به صورت¬های D614G، Y28H، H49Y، R78M، K77M، Q271R، T22I G261S، E471، S494، A520S و I402L می-باشد که عوامل بیماریزایی SARS-CoV-2 هستند (9).
بر اساس مطالعات جهشهای ترکیبی با فرکانس بالا مانند D614G + I472V، D614G + K458R، D614G + V341I، D614G + Q675H، D614G + Q675H، D614G + S939F، D614G + K458R، D614G + K458R، D614G + Q675H، D614G + S939F، D614G + K458R و D614G + D93 نیز مشاهده شدهاند که موجب افزایش بیماریزایی ویروس میشوند (24). بر این اساس ممکن است پروتئین S با از دست دادن پیوندهای هیدروژنی موجود بین خودش و بخشهای مجاور، طوری تغییر ساختار بدهد که ناحیه S1 بتواند با ACE2 بیشتر پیوند برقرار کند و این موضوع موجب افزایش انتقال ویروس و انتشار بیش¬تر آن بشود. جهشهای جدیدتری نیز که منجر به موج دوم عفونتها از دسامبر 2020 تا مارس 2021 شدند، شامل جهشهای T19R، K77T، T95I، G142D، E154K، N440K، T478K، E484G، E484Q، P681R، D950N، Q1071H و H1101Dبودند (12).
جهش در پروتئین پوششی (E): پروتئین پوششی در کرونا کوچکترین و مهمترین بخشی است که در پیوند ساختاری و جوانه زدن در ویروس موثر است و حذف این پروتئین منجر به کاهش تولید ویروس میشود. پپتید غشایی به عنوان یک ویروپورین عمل میکند و غیرفعال شدن یا کمبود آن میتواند موجب تغییرات ساختاری در ویروس شود که بر روی انتقال آن موثر است. این پپتید دارای سه بخش است: بخش کربوکسیل انتهایی (عملکردی)، آمین انتهایی (آبگریز) و گذرنده از غشا (آبگریز). پروتئین پوششی به عنوان یکی از پروتئینهای بسیار حفاظت شده در نظر گرفته میشود و در مقایسه با سایر پروتئینها تعداد محدودی جهش دارد که شامل حدود 43 جهش مترادف و بدمعنی میشود (7). بر اساس مطالعات، افزایش تغییرات آمینواسیدها در بخش کربوکسیل انتهایی پروتئین پوششی، نقش کلیدی در بیماریزایی ویروس دارد. جهش در بخش گذرنده از غشا (V25A) و بسیاری از موتیفهای سیستئین سهگانه حاوی جهش (L39M، A41S، A41V، C43F، C43R، C43S، C44Y و N45R)، به عنوان انواع اصلی جهشهای پروتئین پوششی گزارش شده¬اند که ویژگیهای ساختاری و اتصالی آن را کنترل و تعیین می-کنند. جهشهای این پروتئین اهمیت بیولوژیکی زیادی دارند و در مسیر درمان میتوانند مورد توجه قرار بگیرند (25).
جهش در پروتئین غشایی (M): پروتئین غشایی ویروس کرونا فراوانترین پروتئین پوششی در کروناویروسها است. پروتئین غشایی نقشی کلیدی در تجمع ویروسی، مورفوژنز و فعالیت آنتیژنی ایفا میکند و میتواند به نوکلئوکپسید متصل شود. از نظر ساختاری دارای سه بخش گذرنده از غشا است که بخش آمین انتهایی آن از ویروس بیرون می¬آید و بخش کربوکسیل انتهایی آن نیز از سمت داخلی ویروس بیرون میآید. در مطالعات کامپیوتری مشخص شده است که پروتئین پوششی در SARS-CoV-2 بیش از 98% با SARS-CoV در خفاش و پانگولین شباهت دارد و این نشان میدهد که در طول فرآیند تکاملی محتوای ژنتیکی طبیعی آن حفظ شده است (26). گزارشات نشان میدهند که جهش در این پروتئین از دلایل افزایش تعداد موارد مثبت کووید، بهویژه در ایالات متحده بوده است. ظهور M182T و V70L جدید در سرتاسر جهان گزارش شده است و شواهد موجود در مطالعه کویاما و همکاران نشان داد که 71 جهش مترادف مرتبط با ژن این پروتئین در حال شناسایی است (7). جهش در این پروتئین از این جهت نگرانکننده است که میانگین سنی بیمارانی که بیماری آنها با جهش در این پروتئین مرتبط است بین 4/6 تا 6/3 سال است (27).
جهش در پروتئین نوکلئوکپسید (N): پروتئین نوکلئوکپسید یک پروتئین چند عملکردی است که عمدتاً بستهبندی ژنوم را تسهیل می کند و RNA ویروس را با پروتئین¬های غشایی جفت میکند. این پروتئین قادر است بازدهی رونویسی در ویروس را افزایش دهد و نیز به عنوان آنتاگونیست اینترفرون میزبان خود، فعالیت ضدویروس آن را تعدیل می¬کند. جهشهای مکرری در پروتئین نوکلئوکپسید مربوط به SARSCoV، شامل P46S، S194L، K247I، S327L، D343V و E378Q مشاهده شده است. در مطالعه کویاما و همکاران در مجموع 378 جهش گزارش شده است که از این میان 246 جهش بدمعنی، 126 جهش مترادف و 6 جهش حذفی هستند (7).
واکسنها: مطالعات و مقالات بسیاری ژنوم کل SARS-CoV-2 را مورد تحلیل قرار داده¬اند. این مطالعات و همکاریهای خوبی که بین دانشمندان مختلف شکل گرفت در نهایت به کشف و ساخت موفق واکسن¬های مختلف برای این ویروس انجامید. داده¬های کلی در مورد واکسنها در جدول 4 آمدهاند.
جدول 3: مقایسه جهشهای BA.2 و BA.2.86 در کل ناحیه ژنومی
جدول 4: واکسنهای مختلف SARS-CoV-2 و کارآیی آن¬ها

واکسنهای mRNA
BNT162b2: این واکسن توسط شرکتهای Pfizer BioNtech و Fousun pharma تهیه شد. در واقع BioNtech اولین شرکتی بود که جهت دریافت تاییدیه FDA برای واکسن کووید-19 اقدام کرد. این واکسن بر مبنای RNA عمل میکند و مبتنی بر نانوذرات لیپیدی (با تغییرات نوکلئوزیدی) است که تمام توالی پروتئین اسپایک در SARS-CoV-2 را کد میکند. در واکسن BNT162b2 دو جهش در پرولین پروتئین اسپایک، موجب میشود که ساختار در حالت پیش از درهم آمیختگی قفل شود. بهترین شرایط تزریق بر اساس مطالعات اولیه، در ابتدا در دو دوز و به فاصله 21 روز تعیین شد. پس از ورود به سلول میزبان، این واکسن کپیهای متعددی از تمام توالی پروتئین اسپایک ویروس در میان سلولهای ایمنی را تولید کرده و با 95% ایمنیزایی، بسیار خوب و موثر است. مطالعات پاسخ ایمنی و فعال شدن قابل توجه سلولهای T CD8+ و CD4+ را نشان دادند (28).
mRNA‑1273: واکسن mRNA-1273 که توسط شرکت مدرنا در ایالات متحده ساخته شده است، اولین واکسنی است که پس از توالییابی کامل ژنوم SARS-CoV-2 برای آزمایشات بالینی ثبت شد (34). این واکسن مبتنی بر mRNA است که در نانوذرات لیپیدی (LNP) انکپسوله شده است و از پروتئین اسپایک تثبیت شده در حالت پیش از در-همآمیختگی استفاده میکند. با ترجمه شده mRNA توالی کامل پروتئین اسپایک ویروسی تولید شده و موجب میشود تا پاسخ ایمنی در بدن ایجاد شده و سلول های ایمنی خاطرهای اختصاصی آنتیژن تکامل یابند. شرکت کنندگان در مطالعه بررسی اثربخشی این واکسن پس از 2 دوز، در حالیکه تست ابتلای آنها به SARS-CoV-2 منفی بوده است، تقریباً 94% اثربخشی را برای دوره پیگیری 9 هفتهای نشان دادهاند. دادههای بررسی شده نشان دادند که مزایای واکسن mRNA-1273 از خطرات احتمالی و شناخته¬شده آن کمتر است (29).
واکسنهای غیرفعال
کوواکسین (BBV152)Covaxin: اولین واکسن مربوط به COVID19 بومی هند، توسط شرکت Bharat Biotech و با همکاری شورای تحقیقات پزشکی هند و موسسه ملی ویروس شناسی ساخته شد. این واکسن از ویریون کل SARS-CoV-2 که با استفاده از β-پروپیولاکتون غیرفعال شده است ساخته شد. سویه مورد استفاده برای ساختن آن NIV-2020-770 بود که یک جهش به شکل Asp614Gly دارد. در کارآزمایی بالینی با 25800 شرکتکننده، 50 درصد کارایی را با پاسخ ایمن نشان داد، با اینحال بر اساس گزارشات، غیرفعال شدن SARS-CoV2 به وسیله β-پروپیولاکتون باعث تجمع ذرات ویروسی میشود که این موضوع باعث از دست دادن پتانسیل آن جهت فعالیت آنتی-ژنی می¬شود. همچنین این واکسن بر روی واریانتهای B.1.1.7 بریتانیا و مخصوصاً جهت خنثی کردن آنتیبادیهای IgG موثر است (30).
کروناواک (CoronaVac): واکسن CoronaVac کووید-19 که توسط شرکت Sinovac Biotech Ltd. ساخته شده است یک پاتوژن غیرفعال است. ویروس توسط β-پروپیولاکتون غیرفعال میشود و سپس با هیدروکسید آلومینیوم برای ساخت واکسن ترکیب میشود. معمولاً در یک برنامه زمانی 28-0/14 روزه برای جلوگیری از بیماری تجویز می¬شود و در برابر B.1.351، که یک واریانت از آفریقای جنوبی است و همچنین B.1.1.7 به عنوان یک واریانت بریتانیایی محافظت ایجاد میکند. مقاومت واریانتها با این واکسن می¬تواند خنثی شود. کارآزماییهای بالینی فاز 3 آن در سطح بینالمللی بر روی 9000 شرکتکننده انجام شده است (38).
BBIBP‑CorV: این واکسن که توسط سینوفارم ساخته شده است، یک واکسن غیر فعال است و بر اساس مطالعات، با دو دوز واکسن، پس از یک بازه زمانی 21 روزه با خنثی کردن آنتیبادیها میتواند تا 79/3% کارایی نشان بدهد. این واکسن مانند coronaVac عمل میکند و بر اساس سویههای بریتانیا ساخته شده است. حجم نمونه برای کارآزمایی بالینی این واکسن 1300 بود (35).
وکتورهای ویروسی
AZD1222: واکسن ChAdOx1 nCoV-19 یا AZD1222 که در دانشگاه آکسفورد ساخته شد، حاوی ژن پروتئین اسپایک ساختاری SARS-CoV-2است که ناقل آن آدنوویروس با کمبود تکثیر ChAdOx1 (شامپانزه) است (31). بر اساس گزارشات، این واکسن 28 روز پس از تزریق دو دوز از آن، 65 درصد کارایی نشان میدهد، ولی مشکل لخته شدن خون پس از واکسیناسیون را نیز نشان داده است. به همین دلیل 12 کشور در سراسر جهان از استفاده از این واکسن امتناع کردند، اما پس از اینکه انجمن ایمنی فواید واکسن را بیش از خطرات آن اعلام کرد و عدم ارتباط آن با خطر بالای لخته شدن خون را نیز تایید نمود، در تاریخ 31 مارس سال 2021، AstraZeneca، TGA، WHO و MHRA بیانیههایی را در مورد کارایی و ایمن بودن این واکسن صادر کردند. این واکسن علیه واریانتهای بریتانیایی کارکرد داشت و آنتی بادیهای القا شده با خنثی¬سازی کم بود. تعداد 32000 شرکتکننده در کارآزماییهای بالینی این واکسن شرکت کردند (39).
اسپوتنیک V (Sputnik V): موسسه تحقیقاتی Sputnik V Gamaleya، یک موسسه تحقیقات پزشکی در روسیه است که یک واکسن آدنوویروس نوترکیب به نام Sputnik V/Gam-COVID-Vac را تولید کرد. این واکسن در واقع پروتئین اسپایک SARS-CoV-2 را در قالب آدنوویروس نوترکیب هترولوگ جدیدی ارائه میکند. این ناقل آدنوویروسی هترولوگ دارای اجزای آدنوویروس 26 (Ad26) و آدنوویروس 5 (Ad5) است و با دو دوز تزریق، در مدت 21 روز کارآیی 91% را در برابر SARS-CoV-2 نشان میدهد. پاسخ ایمنی همورال و سلولی بالای این واکسن با تحمل-پذیری، ایمنیزایی و کارایی خوبی همراه است. در کارآزمایی بالینی این واکسن 40000 شرکت کننده حضور داشتند (32).
JNJ‑78436735: JNJ-78436735 یک واکسن تک ظرفیتی متشکل از یک ناقل Ad26 نوترکیب فاقد قدرت همانندسازی است که پروتئین اسپایک ویروسی SARS-CoV-2 را کد میکند. این واکسن توسط شرکت Johnson & Johnson ساخته شد و استفاده از آن به صورت دو دوز در فاصله زمانی 28 روزه میباشد که کارایی 66% را در برابر شرایط شدید کووید-19 نشان داد. موارد نادری از ترومبوز سینوس ورید مغزی پس از استفاده از این واکسن مشاهده شد، و باعث شد در حالیکه ایالات متحده تجویز واکسن را متوقف کرده بود، FDA و CDC و ACIP خطرات ناشی از آن را بررسی کنند. تا اینکه EMA در نهایت با بیان اینکه ترومبوز نادر و در صورت همراه بودن با کاهش تعداد پلاکتهای خون شایع است، آن را تأیید کرد. تعداد کل شرکتکنندگان در کارآزمایی بالینی 43783 نفر بود و این واکسن به عنوان یک واکسن موثر علیه موارد متوسط و شدید بیماری در ایالات متحده شناخته شد (40).
Ad5‑nCoV: این واکسن توسط شرکت CanSino Biologics مستقر در چین و با استفاده از ناقل آدنوویروس Canvidicea ساخته شده است. Ad5-nCoV یک واکسن مبتنی بر وکتور Ad5 (با حذف E1 و E3، و نقص در همانندسازی) است که تمام توالی پروتئین اسپایک ویروس کووید-19 (سویه Wuhan-Hu-1، YP_009724390) را با ژن پپتید سیگنال فعال کننده پلاسمینوژن بافتی بیان می-کند و پس از دو نوبت واکسیناسیون در 21 روز، بازدهی 65% را نشان میدهد. در کارآزماییهای بالینی آن 40000 شرکتکننده حضور داشتند و پس از واکسیناسیون، افزایش سطح IFN-α و پاسخ سلولهای T مشاهده شد (37).
واکسن پپتیدی اپی¬وک کرونا (EpiVacCorona): EpiVacCorona یک واکسن مبتنی بر پپتید سنتز شده شیمیایی (سه قطعه کوتاه از پروتئین اسپایک ویروسی) است که با بودجه دولتی و مرکز تحقیقات ایالتی ویروسشناسی روسیه ساخته شده است. این پپتیدهای کوتاه نشان دهنده اپیتوپهای سلولهای B هستند که باید توسط سیستم ایمنی انسان شناسایی شوند. پپتیدها متعاقباً به یک پروتئین ناقل کایمریک کونژوگه شده و به عنوان واکسن مورد استفاده قرار میگیرند. این واکسن پس از تجویز دو دوز در 21 روز، 90% کارآیی داشت و گزارشها تحملپذیری واکسن، بی¬خطر بودن و ایمنیزایی آن در برابر کووید-19 را نشان دادند. در مجموع 3000 شرکت کننده در کارآزمایی بالینی این واکسن حضور داشتند (41).
اثرات تغییرات ژنتیکی بر روی واکسیناسیون SARS-CoV-2: همانطور که گفته شد، ویروس SARS-CoV-2 از طریق گیرندههای ACE2 به سلولهای انسانی متصل میشود و برای این اتصال پروتئین اسپایک نقش مهمی ایفا میکند. این پروتئین، مخصوصاً زیر واحد S1 آن، شامل یک دامنه اتصال به گیرنده است که واسطه تولید آنتیبادیهای خنثی کننده ویروس نیز میباشد (42). این ویروس در مسیر تکامل خود جهشهای مختلفی را بر اساس آنتیبادیهای تولید شده در بدن بیماران ایجاد میکند، اما خوشبختانه تغییرات ژنتیکی واقع در ناحیه پروتئین اسپایک واریانتهای D614G و یا B.1.1.7 توسط آنتیبادیهای خنثی کننده ویروس شناسایی میشوند. در واقع واریانتهای B.1.1.7 چه شامل جهش N501Y باشند و چه بدون آن، توسط نمونههای سرمی واکسنهای Moderna و Pfizer خنثی میشوند (43). بر اساس مطالعه ژانگ و همکاران، واریانت CAL.20C یا اپسیلون، واریانت کالیفرنیای جنوبی، با جهش L452R در ناحیه اتصال به گیرنده پروتئین اسپایک، موجب کاهش حساسیت به آنتیبادیهای مونوکلونال شد (44). علاوه بر این، در واریانت 501Y.V2 یا بتا که در نیمه دوم سال 2020 در آفریقای جنوبی پدیدار شد، مقاومت در برابر آنتیبادیهای خنثیکننده دیده شد و تقریباً در 50 درصد از بیماران مبتلا به بیماری کرونا که تست PCR انجام دادند، این واریانت شناسایی شد (45). در مطالعهای که در دانشگاه Rockefeller انجام شد، مشاهده شد که توالی N501Y·V2 در ناحیه متصل شونده به گیرنده در تغییر است و این موضوع اثربخشی آنتیبادیهای ناشی از واکسنهای mRNA را بر روی ویروسهای مورد آزمایش محدود میکند. این کاهش اثربخشی واکسن میتواند به این دلیل باشد که واکسنها بر اساس ساختار اولیه پروتئین اسپایک طراحی شدهاند (15). اما جهش واریانت اُمیکرون که در پروتئین اسپایک متمرکز شده است، هدف اولیه برای واکسنهای فعلی است. واکسنهای Pfizer-BioNTech، Moderna، Janssen و AstraZeneca بر اساس یک نسخه گلیکوپروتئینی اسپایک ساخته شدهاند و از نظر اثربخشی بر روی SARS-CoV-2 متفاوت هستند (46). مطالعه دیگری که توسط اندروز و همکاران در انگلستان انجام شد، به ارزیابی اثربخشی واکسن در برابر بیماری علامتداری که توسط واریانت¬های دلتا و اُمیکرون ایجاد میشود پرداخت. ایمنی با دو دوز از Pfizer-BioNTech، Moderna یا AstraZeneca و پس از دوز حمایتی Pfizer-BioNTech یا AstraZeneca ایجاد شد. مشاهده شد که اثربخشی واکسن در برابر بیماری علامت¬دار برای اُمیکرون کمتر از دلتا بود. پس از دو دوز از AstraZeneca، هیچ پاسخی برای واریانت اُمیکرون پس از 20 هفته گزارش نشد، در حالیکه پس از دو دوز تزریق Pfizer-BioNTech در دو تا چهار هفته، اثربخشی واکسن 65/5% بود و پس از 25 هفته یا بیشتر به 8/8% کاهش یافت. این نتایج نشان دادند که ایمنی¬زایی اولیه با دو دوز از این دو واکسن، ایمنی محدودی را در برابر بیماری علامت¬دار ناشی از واریانت اُمیکرون ایجاد مینماید. اما دوزهای تقویت کننده منجر به افزایش قابل توجه محافظت در برابر سرایت جزئی شدند، هر چند که کاهش ایمنی در برابر بیماری علامتدار پس از دوزهای تقویت کننده و تکمیلی نیز مشاهده شد. یک مطالعه دیگر در بریتانیا بر روی واریانت دلتا، نشان داد که پس از دو دوز واکسن، بستری شدن در بیمارستان به طور موثری کمتر شد (47). جهش در پروتئین اسپایک در واریانت BA.2 منجر به تولید توالیهایی از اسیدهای آمینه میشود که در نهایت به تولید آنتیبادی قابل توجهی منتهی میشود. مقایسه اثربخشی واکسن در برابر موارد شدید کروناویروس، نشان داد که واکسیناسیون پس از یک ماه بر روی واریانتهای اُمیکرون در مقایسه با واریانتهای قبلی ویروس اثربخشی کمتری داشت. در واقع اثربخشی واکسن از ماه اول تا ششم پس از اتمام سری اول واکسیناسیون، برای واریانت اُمیکرون به سرعت کاهش یافت (48). علاوه بر این، در مطالعه لینگزه و همکاران مشاهده شد که اُمیکرون BA.2 با خطر بالای عفونت در افراد واکسینه نشده، افرادی که واکسن تقویتی را دریافت کرده¬اند و افرادی که کاملاً واکسینه شدهاند مرتبط است (49).
نتیجهگیری
از زمان شیوع کووید-19، بیش از سه سال گذشته است و وحشت اولیه به دلیل ناشناخته بودن و گسترش سریع این بیماری، امروز جای خود را به آرامشی نسبی داده است. از آن زمان و بعد از اعلام همه¬گیری جهانی، تلاش برای ساخت واکسنهای مختلف آغاز شد و تولید و توسعه و استفاده گسترده از واکسنها، امروزه به مهار قابل توجه بیماری منجر شده است. در دوران پس از همهگیری، شیوع مکرر و پراکنده کووید-19 ناشی از جهشهای ویروسی، همچنان عاملی است که برای سلامت جمعی خطرآفرین می¬باشد. بنابراین توسعه واکسنهای کارآمد و بهروزی که بتوانند با واریانتهای احتمالی و جدید مقابله کنند ضروری به نظر میرسد. همانطور که از یافتههای مطرح شده مشخص است، اُمیکرون به عنوان واریانتی با نرخ انتقال بالا شناخته میشود که احتمالاً بیماریزایی آن کمتر شده است. قابلیت این واریانت برای فرار از ایمنی القاء شده با واکسن¬ها، می¬تواند چالش جدیدی را برای شرکتهای تولیدکننده واکسن ایجاد نماید. به عنوان مثال فایزر و مدرنا انجام آزمایشهای بالینی با واکسنهای mRNA مبتنی بر توالی واریانت اُمیکرون را اعلام کرده¬اند. در مقابل، توانایی خنثیسازی گسترده ایجاد شده توسط واکسن اختصاصی واریانت دلتا، پتانسیل ایجاد واکسنهای مبتنی بر این واریانت را نشان میدهد، و این بدان معنا است که جهش در پروتئین اسپایک، میتواند با تغییر دادن اپیتوپ ایمنیزایی آن را کاهش دهد. برخی از جهشهای مهم مانند E484K، L452R، S477N و F486V، هنگام طراحی واکسنهای مبتنی بر پروتئین اسپایک، نه تنها در مورد واریانتهای دلتا و اُمیکرون، بلکه برای واریانت¬های احتمالی دیگر، باید در آینده به دقت مورد توجه قرار گیرند. درک مکانیسم دقیق مقابله با واکسن و همچنین پاسخهای ایمنی بدن میزبان و کشف اپیتوپهای ویروسی حیاتی نیز به توسعه و تهیه واکسنهای بهتر کمک خواهد کرد. ظهور انواع جدید SARS-CoV-2 اجتنابناپذیر است، با اینحال نمیتوان پیشبینی دقیقی از محل ایجاد واریانت جدید داشت. واریانت جدید ممکن است در ادامه واریانت اُمیکرون و یا کاملاً جدید و متفاوت باشد. تحقیقات بر روی انواع در حال ظهور ضروری است و نیاز به بررسی قدرت و سرعت انتقال، قابلیت بیماری¬زایی و شدت بیماری و پتانسیل آن برای فرار از سیستم ایمنی میباشد. علاوه بر این، باید توجه ویژهای نیز به مطالعات قبل از صدور مجوز و سیستم¬های نظارت بر واکسن پس از صدور مجوز نیز بشود و کارکنان بخش¬های مراقبتهای بهداشتی نیز آموزش-های لازم را ببینند تا از ایجاد مشکلات احتمالی تا حد امکان جلوگیری شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
بروز پنومونی ناشناس ناشی از سندرم حاد تنفسی کروناویروس-2 (nCoV/SARS-CoV-2 2019) ابتدا در شهر ووهان چین و در ماههای پایانی سال 2019 گزارش شد (1). احتمال داده شد که اولین مورد از این پنومونی ناشناس که به عنوان کووید-19 (Covid-19) نامیده میشود از خفاشها به انسان سرایت کرده باشد، اما نحوه انتشار از انسان به انسان عمدتاً از طریق تماس با قطرات تنفسی در هوا است. عدد اصلی تکثیر این ویروس در کشورهای مختلف بین 1/4 تا 6/47 است که در مقایسه با سایر عفونتهای ویروسی کرونا از قدرت سرایت بیشتری برخوردار است (2). بر اساس تجزیه و تحلیل ژنتیکی و فیلوژنتیکی مشخص شده است که کروناویرروس-2 به همراه دو عضو غالب دیگر، یعنی کروناویروس مرتبط با سندرم تنفسی خاورمیانه (MERS-CoV) و کروناویروس سندرم تنفسی حاد شدید (SARS-CoV) متعلق به گروه ویروسهای بتا میباشد (3). در واقع تمام این عفونتهای ویروسی، شامل سارس سال 2003، مرس سال 2012 و کووید-19 سال 2019 ناشی از SARS-CoV-2 است که به خانواده Coronaviridae تعلق دارند (4). شباهتهایی از نظر بیماری ایجاد شده یا نوع و توزیع گیرنده ویروسی در بین کروناویروسهای انسانی وجود دارد که در جدول 1 آورده شده است. با توجه به اینکه این بیماری در یک بازه زمانی بسیار کوتاه به یک بیماری همهگیر جهانی تبدیل شد نگرانیهای وسیعی را در سراسر جهان ایجاد کرد که این همهگیری گسترده و میزان مرگ و میر به میزان جهشهای این ویروس مرتبط میباشد. در این مقاله تلاش شده است تا این جهشها بررسی شوند و درک اپیدمیولوژی مرتبط با آنها حاصل شود. همچنین انواع واکسنهای ساخته شده و اثرات این جهشها بر روی اثر واکسنها نیز مورد بررسی قرار گرفتهاند تا دید روشنتری نسبت به این ویروس و اثرات جهش¬های آن بر روی روند تولید واکسنها و اثرات آنها حاصل شود.
جدول1: مقایسه بین انواع ویروسهای کرونا، گیرنده آن¬ها در بدن میزبان و مدل توزیع گیرنده در بدن انسان

روش بررسی
برای بررسی منابع در رابطه با جهشهای ویروس کووید-19 و اثرات آن بر روی ویژگی¬های ویروس، و همچنین بررسی واکسنهای تولید شده و اثرات این جهشها بر روی عملکرد واکسنها، منابع مختلف موجود در پایگاههای اطلاعاتی Google Scholar، Science Direct، Scopus، Springer، Pubmed و Nature مورد بررسی قرار گرفتند. کلیدواژههای مورد استفاده نیز شامل SARS-CoV-2، Covid-19، Mutation، Vaccine و D614G بود. برای انتخاب کلیدواژهها و مقالات تلاش بر این بود که مقالاتی که به صورت دقیق و جامع توضیحات عمومی در مورد ویروس کووید-19 ارائه دادهاند انتخاب شوند. پس از آن نیز تمرکز بر روی انتخاب مقالاتی بود که به بررسی پراکندگی جغرافیایی جهشها و نیز جهشهای رخ داده در قسمتهای مختلف ویروس پرداخته باشند. در نهایت نیز واکسنها، انواع و تفاوتهای آنها و نیز اثرات جهشهای رخ داده بر روی عملکرد واکسن¬ها مورد مطالعه قرار گرفت تا تصویر جامعی از این ویروس و روشهای واکسیناسیون آن، و نیز روشهای احتمالی ویروس برای ایجاد مقاومت در آینده به دست آید. از میان 92 مقاله مطالعه شده، 46 مقاله انتخاب شد و با استفاده از آنها مطالب مورد نیاز گردآوری شد.
ساختار ویروس SARS‑CoV‑2: این ویروس از نظر ساختاری تقریباً کروی و نسبتاً پلئومورفیک است. یک ویریون معمولی آن قطر متوسط 80 تا 125 نانومتر دارد و دارای RNA های ویروسی مثبت تک رشتهای با نوکلئوکپسید است. اندازه ژنوم RNA آن 26 تا 32 کیلوباز است و 7 الی 10 عدد چهارچوب خوانش باز (Open Reading Frame: ORF) قابل ترجمه دارد. ORF1a و b به پروتئینهای pp1a و pp1ab ترجمه میشوند و این پلیپروتئینها نیز توسط پروتئازهای ویروسی جهت سنتز 16 پروتئین غیرساختاری پردازش داده میشوند. آنزیم RNA پلیمراز وابسته به RNA (RdRp) نیز در میان آنها قرار دارد که به تکثیر RNA ویروسی از طریق رونویسی یک الگوی رشته منفی کمک میکند و در طول این رونویسی شش الی نه mRNA زیر-ژنومی (sgmRNAs) تولید میکند که در نهایت به ترجمه پروتئینهای ساختاری فرودست ORF ها کمک میکنند. ژنوم ویروس همچنین تمام پروتئینهای ساختاری و عملکردی لازم برای ایجاد عفونت و تکثیر، از جمله پروتئین پوششی (E)، پروتئین نوکلئوکپسید (N)، پروتئین غشایی (M)، و پروتئین اسپایک (S) را کد میکند (5). ژنومSARS-CoV-2 همچنین دارای 15 پروتئین غیرساختاری (Non-Structural Protein: NSP) است که شامل nsp1-10 و nsp12-16 است که همراه با nsp11 در مجموع 16 پروتئین را شامل می-شود که با هشت پروتئین کمکی، یعنی ORF3a، ORF3b، ORFp6، ORF7a، ORF7b، ORF8b، ORF49b و ORF14 همراه هستند. این پروتئینها نقش کلیدی در تقویت و فعالیت ویروس دارند (6).
انواع جهشها و فراوانی آنها در ژنوم SARS‑CoV‑2: در این مقاله جهشهای مختلف SARS-CoV-2 در گستره جهانی بر اساس دادههای موجود در Genebank، Pubmed و GISAID گزارش شدهاند. جهش های غیر مترادف، مترادف، نقطهای، حذفی و جهشهای خاموش کل ژنوم در جدول 2 ارائه شدهاند.
پروتئینهای غیرساختاری کل ژنوم کروناویروس ORF6 را کد میکنند. بزرگترین گروه، پلیپروتئینهای ORF1ab هستند که قادر به تولید 16 پروتئین غیرساختاری (NSP) مورد نیاز برای تکثیر ویروس هستند. NSP ها بیشترین تعداد جهشهای بدمعنی در منطقه ORF1ab را متحمل میشوند. از مجموع 3328 جهش، 1344 جهش مترادف، 57 جهش حذفی، 2 جهش درجی، 7 جهش حذفی تغییر چارچوب، و 13 جهش نیز متوقف شده هستند (7). شایع ترین جهشها شامل E191G ، G76S ، K61N ، V259L، T176I، L140V، T269M و V88L در ناحیه ORF اتفاق میافتند (8).
جدول2: انواع جهشهای SARS-CoV-2 و پراکندگی آنها براساس سویههای کشورهای مختلف

تاریخچهای مختصر از واریانتهای SARS-CoV-2: واریانت¬های مختلفی از این ویروس به وجود آمده است که شامل موارد زیر میشود: آلفا (B.1.1.7, Q.1–Q.8)، بتا (B.1.351, B.1.351.2, B.1.351.3)، دلتا (B.1.617.2, AY.1, AY.2, AY.3)، گاما (P.1, P.1.1, P.1.2)، اپسیلون (B.1.427, B.1.429)، اتا (B.1.525)، آیوتا (B.1.526)، اُمیکرون (BA.2)، کاپا (B.1.617.1)، 1.617.3، مو (B.1.621, B.1.621.1)، زتا (P.2) و لامبدا (C.37). از این میان واریانتهای آلفا، بتا، دلتا و گاما در ابتدا به عنوان واریانتهایی که قابلیت انتقال و بیماریزایی بالایی دارند، و نیز از منظر تشخیص، درمان و مقاومت در برابر واکسن نگران-کننده هستند طبقه بندی شدند.
پنج واریانت نگرانکننده SARS-CoV-2 بر اساس ترتیب زمانی نامگذاری شدند. واریانت آلفا که با نامهای B.1.1.7 یا 501Y.V1 نیز شناخته می¬شود، برای اولین بار در سپتامبر 2020 در جنوب شرقی انگلستان گزارش شد و سپس به سرعت گسترش یافت و به عنوان گونه غالب در بریتانیا شناخته شد (14). فقط در چند ماه واریانت آلفا در بیش از 50 کشور گسترش یافت که این موضوع نشاندهنده قابلیت بیماریزایی بالاتر آن نسبت به واریانت اولیه است. این واریانت شامل دو جهش حذفی در آمینواسیدهای 70/69 و 145/144 در ناحیه آمین انتهایی، یک جایگزینی در ناحیه متصل شونده به گیرنده به صورت N501Y، به همراه سه جایگزینی دیگر به صورت A570D، D614G و P681H است که این جهش¬ها میل ترکیبی گیرنده ACE2 به ناحیه متصل شونده به گیرنده در ویروس را تا 7 برابر افزایش میدهند. واریانت بتا که با نامهای B.1.351، 501Y.V2 و یا 20H نیز شناخته می¬شود، متحمل 9 جهش در زیر واحد S1 شده است. این 9 جهش شامل چهار جایگزینی و یک حذف (Δ242-Δ244) در ناحیه آمین انتهایی، سه جهش تغییر آمینواسید به صورت K417N، E484K و N501Y در ناحیه متصل شونده به گیرنده و یک جایگزینی در D614G است (15). همچنین واریانت گاما که به نامهای P.1، B.1.1.248، 501Y.V3 و یا واریانت برزیل نیز معروف است، همان¬طور که از نام آن پیداست در برزیل شیوع پیدا کرد. شیوع این واریانت نیز با توجه به 12 جهشی که در پروتئین اسپایک آن به وجود آمده بود، نگرانی¬های قابل توجهی را به خود جلب کرد که از جمله این جهشها میتوان به K417T ، E484K و N501Y اشاره نمود (16). اما در اوایل سال 2021، توجهها به سمت واریانت دلتا جلب شد که برای اولین بار در اکتبر 2020 در هند ظاهر شد و سپس در بیش از 21 کشور گسترش یافت. این واریانت که B.1.617.2 نیز نامیده میشود، شامل T19R و G142D، یک حذف (Δ156–Δ157)، و جایگزینی¬های R158G، L452R، T478K، D614G، P681R، و D950N است (17). این واریانت جایگزین واریانتهای قبلی شد و به سرعت در هند گشترش یافت، به طوری که منجر به شناسایی 17 میلیون بیمار جدید در بازه زمانی مارس تا می 2021 شد. نکته قابل توجه در مورد آن مشاهده بیماری و عفونت مجدد در افراد بود. پس از آن این واریانت در بیشتر کشورها از دیگر واریانتها گستردهتر شد (18). واریانت اُمیکرون برای اولین بار در بوتسوانای آفریقای جنوبی و در ابتدای نوامبر 2021 شناسایی شد و در تاریخ 24 نوامبر توسط WHO به عنوان واریانت تحت نظر طبقهبندی شد، اما فقط دو روز بعد به عنوان واریانت نگران کننده در نظر گرفته شد. از میان توالیهای ارسال شده به GISAID، مشاهده شد که درصد توالی¬هایی که مربوط به اُمیکرون بود، از تقریباً 5% در اوایل دسامبر به تقریباً 95% در پایان این ماه در سال 2021 افزایش یافته است. اُمیکرون بیش از 60 جهش جانشینی، حذفی و درجی داشته است که آن را به واریانت نگران کننده با بیشترین جهش بدل کرد (19). واریانت B.1.617.2 که تحت عنوان واریانت دلتا نامیده میشود، برای اولین بار در اکتبر 2020 و در هند شناسایی شد. نوع دلتا از ویروس SARS-CoV-2 شامل سه زیرگروه اصلی یعنی B1.617.1، B1.617.2 و B1.617.3 میباشد که عمدتاً در ناحیه آمین انتهایی و نواحی اتصال به گیرنده در پروتئینهای S جهش یافته است. از آنجایی که این جهشها به پروتئین S در این واریانت مرتبط هستند، در مقایسه با انواع دیگر بسیار عفونیتر گزارش شدهاند و نرخ انتقال عفونت در آن بسیار سریع است. این واریانت توسط مراکز کنترل و پیشگیری از بیماری در ایالات متحده به عنوان واریانتی که پتانسیل انتقالپذیری آن در مقایسه با واریانتهای دیگر بیش از 60% افزایش یافته معرفی شد (20).
واریانت BA.2.86 یا پیرولا: نوع جدید SARS-CoV-2، BA.2.86 که با نام پیرولا نیز شناخته میشود، یک زیرمجموعه از اُمیکرون است که بهدلیل وجود جهشهای زیاد باعث نگرانی شده است. تا تاریخ 28 سپتامبر 2023، در 23 کشور264 مورد تأیید شده از این ویروس شناسایی شده است که شامل 66 مورد در بریتانیا (0/25%)، 34 مورد در ایالات متحده (87/12%)، 31 مورد در دانمارک (11/74%)، 25 مورد در سوئد (9/46%)، 20 مورد در آفریقای جنوبی (7/57%)، 20 مورد در اسپانیا (7/57%)، 15 مورد در فرانسه (5/68%)، 7 مورد در پرتغال (2/65%)، 6 مورد در ژاپن (2/27%)، 5 مورد در کانادا (1/89%)، 5 مورد در تایلند (1/89%)، 5 مورد در اسرائیل (1/89%)، 5 مورد در یونان (1/89%)، 3 مورد در آلمان (1/13%)، 3 مورد در بلژیک (1/13%)، 3 مورد در لوکزامبورگ (1/13%)، 3 مورد در هلند (1/13%)، و 3 مورد در کره جنوبی (1/13%) بوده است. در هر یک از کشورهای استرالیا، ایتالیا، ایسلند، سوئیس و چین نیز هر کدام یک مورد از این واریانت گزارش شده است. نکته جالب در مورد این واریانت این است که این در زنان (71/0%) بیشتر از مردان (29/0%) گزارش شده است. این واریانت با سرعت بیشتری نسبت به سایر انواع SARS-CoV-2 گسترش یافته و عمدتاً افراد مسن (بالای 60 سال) را درگیر میکند. با اینحال تا زمان ارائه این گزارش هیچ مورد فوتی گزارش نشده است. تظاهرات بالینی در بیماران مبتلا به واریانت پیرولا به خوبی مستند نشده است و ممکن است مشابه سویههای قبلی باشد که با علائم عفونی خفیف مانند سردرد، بدن درد، سرفه، تب، میالژی عمومی و شدید و خستگی ظاهر میشود. این واریانت نسبت به واریانتهای والد خود، یعنی XBB و BA.2، بیش از 30 جهش در پروتئین اسپایک دارد که بسیاری از آن ها به فرار ویروس از سیستم ایمنی کمک میکنند. به عنوان مثال، سرم-های به دست آمده از افراد واکسینه شده با 3 دوز از واکسنهای تک ظرفیتی، 4 دوز از واکسنهای تک ظرفیتی، واکسنهای mRNA دو ظرفیتی برای BA.1 و واکسنهای mRNA دوظرفیتی برای BA.5، نشان دادند که این واکسن¬ها اثرات ضد ویروسی بسیار کمی بر روی واریانت BA.2.86 دارند. همچنین سه آنتیبادی مونوکلونال ببتلوویماب، سوتروویماب و کیلگاویماب که بر روی واریانت BA.2 والد مؤثر هستند، در برابر BA.2.86 اثری نشان ندادند. این نتایج نشان میدهد که BA.2.86 یکی از انواع بسیار ایمن گریز تاکنون است و نیاز است تا مقامات بهداشت جهانی با انجام اقدامات پیشگیرانه، از شیوع این واریانت در حال ظهور در سراسر جهان جلوگیری کنند (22, 21). در بخش بعدی جهشهای مرتبط با پروتئینهای ساختاری کروناویروس توضیح داده شده¬اند. در انتهای آن نیز تفاوت های موجود بین جهشهای واریانت اُمیکرون (BA.2) و پیرولا (BA.2.86) در جدول 3 (23) آمدهاند.
جهشهای مرتبط با پروتئینهای ساختاری کروناویروس جهش در گلیکوپروتئین اسپایک (S): ناحیه اسپایک یک پروتئین بزرگ گذرنده از غشا است که دامنه اتصال به گیرنده (rbd) آن تمایل دارد تا به آنزیم آنزیم تبدیل کننده آنژیوتانسین 2 (ACE2) در سلولهای میزبان متصل شود. این اتصال ورود ویروس کرونا به سلول میزبان را تسهیل کرده و انتقال عفونت ناشی از ویروس را سرعت می¬بخشد. در مقایسه بین سویههای مختلف جهانی با توالی سویه اولیه مشاهده شده در ووهان چین، 394 جهش بدمعنی، 260 جهش مترادف، 5 جهش حذفی و 1 جهش تغییر چارچوب مشاهده شد (8). در میان دو منطقه فرعی پروتئین اسپایک یعنی دامنه S1 و S2، دامنه S1 دارای بیشترین تعداد جهش به صورت¬های D614G، Y28H، H49Y، R78M، K77M، Q271R، T22I G261S، E471، S494، A520S و I402L می-باشد که عوامل بیماریزایی SARS-CoV-2 هستند (9).
بر اساس مطالعات جهشهای ترکیبی با فرکانس بالا مانند D614G + I472V، D614G + K458R، D614G + V341I، D614G + Q675H، D614G + Q675H، D614G + S939F، D614G + K458R، D614G + K458R، D614G + Q675H، D614G + S939F، D614G + K458R و D614G + D93 نیز مشاهده شدهاند که موجب افزایش بیماریزایی ویروس میشوند (24). بر این اساس ممکن است پروتئین S با از دست دادن پیوندهای هیدروژنی موجود بین خودش و بخشهای مجاور، طوری تغییر ساختار بدهد که ناحیه S1 بتواند با ACE2 بیشتر پیوند برقرار کند و این موضوع موجب افزایش انتقال ویروس و انتشار بیش¬تر آن بشود. جهشهای جدیدتری نیز که منجر به موج دوم عفونتها از دسامبر 2020 تا مارس 2021 شدند، شامل جهشهای T19R، K77T، T95I، G142D، E154K، N440K، T478K، E484G، E484Q، P681R، D950N، Q1071H و H1101Dبودند (12).
جهش در پروتئین پوششی (E): پروتئین پوششی در کرونا کوچکترین و مهمترین بخشی است که در پیوند ساختاری و جوانه زدن در ویروس موثر است و حذف این پروتئین منجر به کاهش تولید ویروس میشود. پپتید غشایی به عنوان یک ویروپورین عمل میکند و غیرفعال شدن یا کمبود آن میتواند موجب تغییرات ساختاری در ویروس شود که بر روی انتقال آن موثر است. این پپتید دارای سه بخش است: بخش کربوکسیل انتهایی (عملکردی)، آمین انتهایی (آبگریز) و گذرنده از غشا (آبگریز). پروتئین پوششی به عنوان یکی از پروتئینهای بسیار حفاظت شده در نظر گرفته میشود و در مقایسه با سایر پروتئینها تعداد محدودی جهش دارد که شامل حدود 43 جهش مترادف و بدمعنی میشود (7). بر اساس مطالعات، افزایش تغییرات آمینواسیدها در بخش کربوکسیل انتهایی پروتئین پوششی، نقش کلیدی در بیماریزایی ویروس دارد. جهش در بخش گذرنده از غشا (V25A) و بسیاری از موتیفهای سیستئین سهگانه حاوی جهش (L39M، A41S، A41V، C43F، C43R، C43S، C44Y و N45R)، به عنوان انواع اصلی جهشهای پروتئین پوششی گزارش شده¬اند که ویژگیهای ساختاری و اتصالی آن را کنترل و تعیین می-کنند. جهشهای این پروتئین اهمیت بیولوژیکی زیادی دارند و در مسیر درمان میتوانند مورد توجه قرار بگیرند (25).
جهش در پروتئین غشایی (M): پروتئین غشایی ویروس کرونا فراوانترین پروتئین پوششی در کروناویروسها است. پروتئین غشایی نقشی کلیدی در تجمع ویروسی، مورفوژنز و فعالیت آنتیژنی ایفا میکند و میتواند به نوکلئوکپسید متصل شود. از نظر ساختاری دارای سه بخش گذرنده از غشا است که بخش آمین انتهایی آن از ویروس بیرون می¬آید و بخش کربوکسیل انتهایی آن نیز از سمت داخلی ویروس بیرون میآید. در مطالعات کامپیوتری مشخص شده است که پروتئین پوششی در SARS-CoV-2 بیش از 98% با SARS-CoV در خفاش و پانگولین شباهت دارد و این نشان میدهد که در طول فرآیند تکاملی محتوای ژنتیکی طبیعی آن حفظ شده است (26). گزارشات نشان میدهند که جهش در این پروتئین از دلایل افزایش تعداد موارد مثبت کووید، بهویژه در ایالات متحده بوده است. ظهور M182T و V70L جدید در سرتاسر جهان گزارش شده است و شواهد موجود در مطالعه کویاما و همکاران نشان داد که 71 جهش مترادف مرتبط با ژن این پروتئین در حال شناسایی است (7). جهش در این پروتئین از این جهت نگرانکننده است که میانگین سنی بیمارانی که بیماری آنها با جهش در این پروتئین مرتبط است بین 4/6 تا 6/3 سال است (27).
جهش در پروتئین نوکلئوکپسید (N): پروتئین نوکلئوکپسید یک پروتئین چند عملکردی است که عمدتاً بستهبندی ژنوم را تسهیل می کند و RNA ویروس را با پروتئین¬های غشایی جفت میکند. این پروتئین قادر است بازدهی رونویسی در ویروس را افزایش دهد و نیز به عنوان آنتاگونیست اینترفرون میزبان خود، فعالیت ضدویروس آن را تعدیل می¬کند. جهشهای مکرری در پروتئین نوکلئوکپسید مربوط به SARSCoV، شامل P46S، S194L، K247I، S327L، D343V و E378Q مشاهده شده است. در مطالعه کویاما و همکاران در مجموع 378 جهش گزارش شده است که از این میان 246 جهش بدمعنی، 126 جهش مترادف و 6 جهش حذفی هستند (7).
واکسنها: مطالعات و مقالات بسیاری ژنوم کل SARS-CoV-2 را مورد تحلیل قرار داده¬اند. این مطالعات و همکاریهای خوبی که بین دانشمندان مختلف شکل گرفت در نهایت به کشف و ساخت موفق واکسن¬های مختلف برای این ویروس انجامید. داده¬های کلی در مورد واکسنها در جدول 4 آمدهاند.
جدول 3: مقایسه جهشهای BA.2 و BA.2.86 در کل ناحیه ژنومی


جدول 4: واکسنهای مختلف SARS-CoV-2 و کارآیی آن¬ها

واکسنهای mRNA
BNT162b2: این واکسن توسط شرکتهای Pfizer BioNtech و Fousun pharma تهیه شد. در واقع BioNtech اولین شرکتی بود که جهت دریافت تاییدیه FDA برای واکسن کووید-19 اقدام کرد. این واکسن بر مبنای RNA عمل میکند و مبتنی بر نانوذرات لیپیدی (با تغییرات نوکلئوزیدی) است که تمام توالی پروتئین اسپایک در SARS-CoV-2 را کد میکند. در واکسن BNT162b2 دو جهش در پرولین پروتئین اسپایک، موجب میشود که ساختار در حالت پیش از درهم آمیختگی قفل شود. بهترین شرایط تزریق بر اساس مطالعات اولیه، در ابتدا در دو دوز و به فاصله 21 روز تعیین شد. پس از ورود به سلول میزبان، این واکسن کپیهای متعددی از تمام توالی پروتئین اسپایک ویروس در میان سلولهای ایمنی را تولید کرده و با 95% ایمنیزایی، بسیار خوب و موثر است. مطالعات پاسخ ایمنی و فعال شدن قابل توجه سلولهای T CD8+ و CD4+ را نشان دادند (28).
mRNA‑1273: واکسن mRNA-1273 که توسط شرکت مدرنا در ایالات متحده ساخته شده است، اولین واکسنی است که پس از توالییابی کامل ژنوم SARS-CoV-2 برای آزمایشات بالینی ثبت شد (34). این واکسن مبتنی بر mRNA است که در نانوذرات لیپیدی (LNP) انکپسوله شده است و از پروتئین اسپایک تثبیت شده در حالت پیش از در-همآمیختگی استفاده میکند. با ترجمه شده mRNA توالی کامل پروتئین اسپایک ویروسی تولید شده و موجب میشود تا پاسخ ایمنی در بدن ایجاد شده و سلول های ایمنی خاطرهای اختصاصی آنتیژن تکامل یابند. شرکت کنندگان در مطالعه بررسی اثربخشی این واکسن پس از 2 دوز، در حالیکه تست ابتلای آنها به SARS-CoV-2 منفی بوده است، تقریباً 94% اثربخشی را برای دوره پیگیری 9 هفتهای نشان دادهاند. دادههای بررسی شده نشان دادند که مزایای واکسن mRNA-1273 از خطرات احتمالی و شناخته¬شده آن کمتر است (29).
واکسنهای غیرفعال
کوواکسین (BBV152)Covaxin: اولین واکسن مربوط به COVID19 بومی هند، توسط شرکت Bharat Biotech و با همکاری شورای تحقیقات پزشکی هند و موسسه ملی ویروس شناسی ساخته شد. این واکسن از ویریون کل SARS-CoV-2 که با استفاده از β-پروپیولاکتون غیرفعال شده است ساخته شد. سویه مورد استفاده برای ساختن آن NIV-2020-770 بود که یک جهش به شکل Asp614Gly دارد. در کارآزمایی بالینی با 25800 شرکتکننده، 50 درصد کارایی را با پاسخ ایمن نشان داد، با اینحال بر اساس گزارشات، غیرفعال شدن SARS-CoV2 به وسیله β-پروپیولاکتون باعث تجمع ذرات ویروسی میشود که این موضوع باعث از دست دادن پتانسیل آن جهت فعالیت آنتی-ژنی می¬شود. همچنین این واکسن بر روی واریانتهای B.1.1.7 بریتانیا و مخصوصاً جهت خنثی کردن آنتیبادیهای IgG موثر است (30).
کروناواک (CoronaVac): واکسن CoronaVac کووید-19 که توسط شرکت Sinovac Biotech Ltd. ساخته شده است یک پاتوژن غیرفعال است. ویروس توسط β-پروپیولاکتون غیرفعال میشود و سپس با هیدروکسید آلومینیوم برای ساخت واکسن ترکیب میشود. معمولاً در یک برنامه زمانی 28-0/14 روزه برای جلوگیری از بیماری تجویز می¬شود و در برابر B.1.351، که یک واریانت از آفریقای جنوبی است و همچنین B.1.1.7 به عنوان یک واریانت بریتانیایی محافظت ایجاد میکند. مقاومت واریانتها با این واکسن می¬تواند خنثی شود. کارآزماییهای بالینی فاز 3 آن در سطح بینالمللی بر روی 9000 شرکتکننده انجام شده است (38).
BBIBP‑CorV: این واکسن که توسط سینوفارم ساخته شده است، یک واکسن غیر فعال است و بر اساس مطالعات، با دو دوز واکسن، پس از یک بازه زمانی 21 روزه با خنثی کردن آنتیبادیها میتواند تا 79/3% کارایی نشان بدهد. این واکسن مانند coronaVac عمل میکند و بر اساس سویههای بریتانیا ساخته شده است. حجم نمونه برای کارآزمایی بالینی این واکسن 1300 بود (35).
وکتورهای ویروسی
AZD1222: واکسن ChAdOx1 nCoV-19 یا AZD1222 که در دانشگاه آکسفورد ساخته شد، حاوی ژن پروتئین اسپایک ساختاری SARS-CoV-2است که ناقل آن آدنوویروس با کمبود تکثیر ChAdOx1 (شامپانزه) است (31). بر اساس گزارشات، این واکسن 28 روز پس از تزریق دو دوز از آن، 65 درصد کارایی نشان میدهد، ولی مشکل لخته شدن خون پس از واکسیناسیون را نیز نشان داده است. به همین دلیل 12 کشور در سراسر جهان از استفاده از این واکسن امتناع کردند، اما پس از اینکه انجمن ایمنی فواید واکسن را بیش از خطرات آن اعلام کرد و عدم ارتباط آن با خطر بالای لخته شدن خون را نیز تایید نمود، در تاریخ 31 مارس سال 2021، AstraZeneca، TGA، WHO و MHRA بیانیههایی را در مورد کارایی و ایمن بودن این واکسن صادر کردند. این واکسن علیه واریانتهای بریتانیایی کارکرد داشت و آنتی بادیهای القا شده با خنثی¬سازی کم بود. تعداد 32000 شرکتکننده در کارآزماییهای بالینی این واکسن شرکت کردند (39).
اسپوتنیک V (Sputnik V): موسسه تحقیقاتی Sputnik V Gamaleya، یک موسسه تحقیقات پزشکی در روسیه است که یک واکسن آدنوویروس نوترکیب به نام Sputnik V/Gam-COVID-Vac را تولید کرد. این واکسن در واقع پروتئین اسپایک SARS-CoV-2 را در قالب آدنوویروس نوترکیب هترولوگ جدیدی ارائه میکند. این ناقل آدنوویروسی هترولوگ دارای اجزای آدنوویروس 26 (Ad26) و آدنوویروس 5 (Ad5) است و با دو دوز تزریق، در مدت 21 روز کارآیی 91% را در برابر SARS-CoV-2 نشان میدهد. پاسخ ایمنی همورال و سلولی بالای این واکسن با تحمل-پذیری، ایمنیزایی و کارایی خوبی همراه است. در کارآزمایی بالینی این واکسن 40000 شرکت کننده حضور داشتند (32).
JNJ‑78436735: JNJ-78436735 یک واکسن تک ظرفیتی متشکل از یک ناقل Ad26 نوترکیب فاقد قدرت همانندسازی است که پروتئین اسپایک ویروسی SARS-CoV-2 را کد میکند. این واکسن توسط شرکت Johnson & Johnson ساخته شد و استفاده از آن به صورت دو دوز در فاصله زمانی 28 روزه میباشد که کارایی 66% را در برابر شرایط شدید کووید-19 نشان داد. موارد نادری از ترومبوز سینوس ورید مغزی پس از استفاده از این واکسن مشاهده شد، و باعث شد در حالیکه ایالات متحده تجویز واکسن را متوقف کرده بود، FDA و CDC و ACIP خطرات ناشی از آن را بررسی کنند. تا اینکه EMA در نهایت با بیان اینکه ترومبوز نادر و در صورت همراه بودن با کاهش تعداد پلاکتهای خون شایع است، آن را تأیید کرد. تعداد کل شرکتکنندگان در کارآزمایی بالینی 43783 نفر بود و این واکسن به عنوان یک واکسن موثر علیه موارد متوسط و شدید بیماری در ایالات متحده شناخته شد (40).
Ad5‑nCoV: این واکسن توسط شرکت CanSino Biologics مستقر در چین و با استفاده از ناقل آدنوویروس Canvidicea ساخته شده است. Ad5-nCoV یک واکسن مبتنی بر وکتور Ad5 (با حذف E1 و E3، و نقص در همانندسازی) است که تمام توالی پروتئین اسپایک ویروس کووید-19 (سویه Wuhan-Hu-1، YP_009724390) را با ژن پپتید سیگنال فعال کننده پلاسمینوژن بافتی بیان می-کند و پس از دو نوبت واکسیناسیون در 21 روز، بازدهی 65% را نشان میدهد. در کارآزماییهای بالینی آن 40000 شرکتکننده حضور داشتند و پس از واکسیناسیون، افزایش سطح IFN-α و پاسخ سلولهای T مشاهده شد (37).
واکسن پپتیدی اپی¬وک کرونا (EpiVacCorona): EpiVacCorona یک واکسن مبتنی بر پپتید سنتز شده شیمیایی (سه قطعه کوتاه از پروتئین اسپایک ویروسی) است که با بودجه دولتی و مرکز تحقیقات ایالتی ویروسشناسی روسیه ساخته شده است. این پپتیدهای کوتاه نشان دهنده اپیتوپهای سلولهای B هستند که باید توسط سیستم ایمنی انسان شناسایی شوند. پپتیدها متعاقباً به یک پروتئین ناقل کایمریک کونژوگه شده و به عنوان واکسن مورد استفاده قرار میگیرند. این واکسن پس از تجویز دو دوز در 21 روز، 90% کارآیی داشت و گزارشها تحملپذیری واکسن، بی¬خطر بودن و ایمنیزایی آن در برابر کووید-19 را نشان دادند. در مجموع 3000 شرکت کننده در کارآزمایی بالینی این واکسن حضور داشتند (41).
اثرات تغییرات ژنتیکی بر روی واکسیناسیون SARS-CoV-2: همانطور که گفته شد، ویروس SARS-CoV-2 از طریق گیرندههای ACE2 به سلولهای انسانی متصل میشود و برای این اتصال پروتئین اسپایک نقش مهمی ایفا میکند. این پروتئین، مخصوصاً زیر واحد S1 آن، شامل یک دامنه اتصال به گیرنده است که واسطه تولید آنتیبادیهای خنثی کننده ویروس نیز میباشد (42). این ویروس در مسیر تکامل خود جهشهای مختلفی را بر اساس آنتیبادیهای تولید شده در بدن بیماران ایجاد میکند، اما خوشبختانه تغییرات ژنتیکی واقع در ناحیه پروتئین اسپایک واریانتهای D614G و یا B.1.1.7 توسط آنتیبادیهای خنثی کننده ویروس شناسایی میشوند. در واقع واریانتهای B.1.1.7 چه شامل جهش N501Y باشند و چه بدون آن، توسط نمونههای سرمی واکسنهای Moderna و Pfizer خنثی میشوند (43). بر اساس مطالعه ژانگ و همکاران، واریانت CAL.20C یا اپسیلون، واریانت کالیفرنیای جنوبی، با جهش L452R در ناحیه اتصال به گیرنده پروتئین اسپایک، موجب کاهش حساسیت به آنتیبادیهای مونوکلونال شد (44). علاوه بر این، در واریانت 501Y.V2 یا بتا که در نیمه دوم سال 2020 در آفریقای جنوبی پدیدار شد، مقاومت در برابر آنتیبادیهای خنثیکننده دیده شد و تقریباً در 50 درصد از بیماران مبتلا به بیماری کرونا که تست PCR انجام دادند، این واریانت شناسایی شد (45). در مطالعهای که در دانشگاه Rockefeller انجام شد، مشاهده شد که توالی N501Y·V2 در ناحیه متصل شونده به گیرنده در تغییر است و این موضوع اثربخشی آنتیبادیهای ناشی از واکسنهای mRNA را بر روی ویروسهای مورد آزمایش محدود میکند. این کاهش اثربخشی واکسن میتواند به این دلیل باشد که واکسنها بر اساس ساختار اولیه پروتئین اسپایک طراحی شدهاند (15). اما جهش واریانت اُمیکرون که در پروتئین اسپایک متمرکز شده است، هدف اولیه برای واکسنهای فعلی است. واکسنهای Pfizer-BioNTech، Moderna، Janssen و AstraZeneca بر اساس یک نسخه گلیکوپروتئینی اسپایک ساخته شدهاند و از نظر اثربخشی بر روی SARS-CoV-2 متفاوت هستند (46). مطالعه دیگری که توسط اندروز و همکاران در انگلستان انجام شد، به ارزیابی اثربخشی واکسن در برابر بیماری علامتداری که توسط واریانت¬های دلتا و اُمیکرون ایجاد میشود پرداخت. ایمنی با دو دوز از Pfizer-BioNTech، Moderna یا AstraZeneca و پس از دوز حمایتی Pfizer-BioNTech یا AstraZeneca ایجاد شد. مشاهده شد که اثربخشی واکسن در برابر بیماری علامت¬دار برای اُمیکرون کمتر از دلتا بود. پس از دو دوز از AstraZeneca، هیچ پاسخی برای واریانت اُمیکرون پس از 20 هفته گزارش نشد، در حالیکه پس از دو دوز تزریق Pfizer-BioNTech در دو تا چهار هفته، اثربخشی واکسن 65/5% بود و پس از 25 هفته یا بیشتر به 8/8% کاهش یافت. این نتایج نشان دادند که ایمنی¬زایی اولیه با دو دوز از این دو واکسن، ایمنی محدودی را در برابر بیماری علامت¬دار ناشی از واریانت اُمیکرون ایجاد مینماید. اما دوزهای تقویت کننده منجر به افزایش قابل توجه محافظت در برابر سرایت جزئی شدند، هر چند که کاهش ایمنی در برابر بیماری علامتدار پس از دوزهای تقویت کننده و تکمیلی نیز مشاهده شد. یک مطالعه دیگر در بریتانیا بر روی واریانت دلتا، نشان داد که پس از دو دوز واکسن، بستری شدن در بیمارستان به طور موثری کمتر شد (47). جهش در پروتئین اسپایک در واریانت BA.2 منجر به تولید توالیهایی از اسیدهای آمینه میشود که در نهایت به تولید آنتیبادی قابل توجهی منتهی میشود. مقایسه اثربخشی واکسن در برابر موارد شدید کروناویروس، نشان داد که واکسیناسیون پس از یک ماه بر روی واریانتهای اُمیکرون در مقایسه با واریانتهای قبلی ویروس اثربخشی کمتری داشت. در واقع اثربخشی واکسن از ماه اول تا ششم پس از اتمام سری اول واکسیناسیون، برای واریانت اُمیکرون به سرعت کاهش یافت (48). علاوه بر این، در مطالعه لینگزه و همکاران مشاهده شد که اُمیکرون BA.2 با خطر بالای عفونت در افراد واکسینه نشده، افرادی که واکسن تقویتی را دریافت کرده¬اند و افرادی که کاملاً واکسینه شدهاند مرتبط است (49).
نتیجهگیری
از زمان شیوع کووید-19، بیش از سه سال گذشته است و وحشت اولیه به دلیل ناشناخته بودن و گسترش سریع این بیماری، امروز جای خود را به آرامشی نسبی داده است. از آن زمان و بعد از اعلام همه¬گیری جهانی، تلاش برای ساخت واکسنهای مختلف آغاز شد و تولید و توسعه و استفاده گسترده از واکسنها، امروزه به مهار قابل توجه بیماری منجر شده است. در دوران پس از همهگیری، شیوع مکرر و پراکنده کووید-19 ناشی از جهشهای ویروسی، همچنان عاملی است که برای سلامت جمعی خطرآفرین می¬باشد. بنابراین توسعه واکسنهای کارآمد و بهروزی که بتوانند با واریانتهای احتمالی و جدید مقابله کنند ضروری به نظر میرسد. همانطور که از یافتههای مطرح شده مشخص است، اُمیکرون به عنوان واریانتی با نرخ انتقال بالا شناخته میشود که احتمالاً بیماریزایی آن کمتر شده است. قابلیت این واریانت برای فرار از ایمنی القاء شده با واکسن¬ها، می¬تواند چالش جدیدی را برای شرکتهای تولیدکننده واکسن ایجاد نماید. به عنوان مثال فایزر و مدرنا انجام آزمایشهای بالینی با واکسنهای mRNA مبتنی بر توالی واریانت اُمیکرون را اعلام کرده¬اند. در مقابل، توانایی خنثیسازی گسترده ایجاد شده توسط واکسن اختصاصی واریانت دلتا، پتانسیل ایجاد واکسنهای مبتنی بر این واریانت را نشان میدهد، و این بدان معنا است که جهش در پروتئین اسپایک، میتواند با تغییر دادن اپیتوپ ایمنیزایی آن را کاهش دهد. برخی از جهشهای مهم مانند E484K، L452R، S477N و F486V، هنگام طراحی واکسنهای مبتنی بر پروتئین اسپایک، نه تنها در مورد واریانتهای دلتا و اُمیکرون، بلکه برای واریانت¬های احتمالی دیگر، باید در آینده به دقت مورد توجه قرار گیرند. درک مکانیسم دقیق مقابله با واکسن و همچنین پاسخهای ایمنی بدن میزبان و کشف اپیتوپهای ویروسی حیاتی نیز به توسعه و تهیه واکسنهای بهتر کمک خواهد کرد. ظهور انواع جدید SARS-CoV-2 اجتنابناپذیر است، با اینحال نمیتوان پیشبینی دقیقی از محل ایجاد واریانت جدید داشت. واریانت جدید ممکن است در ادامه واریانت اُمیکرون و یا کاملاً جدید و متفاوت باشد. تحقیقات بر روی انواع در حال ظهور ضروری است و نیاز به بررسی قدرت و سرعت انتقال، قابلیت بیماری¬زایی و شدت بیماری و پتانسیل آن برای فرار از سیستم ایمنی میباشد. علاوه بر این، باید توجه ویژهای نیز به مطالعات قبل از صدور مجوز و سیستم¬های نظارت بر واکسن پس از صدور مجوز نیز بشود و کارکنان بخش¬های مراقبتهای بهداشتی نیز آموزش-های لازم را ببینند تا از ایجاد مشکلات احتمالی تا حد امکان جلوگیری شود.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. Addendum: A Pneumonia Outbreak Associated with a New Coronavirus of Probable Bat Origin. Nature 2020; 579(7798): 270-3.
2- Liu Y, Gayle AA, Wilder-Smith A, Rocklöv J. The Reproductive Number of COVID-19 Is Higher Compared to SARS Coronavirus. J Travel Med 2020; 27(2): taaa021.
3- Leao JC, Gusmao TPL, Zarzar AM, Leao Filho JC, Barkokebas Santos de Faria A, Morais Silva IH, et al. Coronaviridae—Old Friends, New Enemy! Oral Dis 2022; 28 Suppl 1(Suppl 1):858-66.
4- Gorbalenya AE, Baker SC, Baric RS, de Groot RJ, Drosten C, Gulyaeva AA, et al. The Species Severe Acute Respiratory Syndrome-Related Coronavirus: Classifying 2019-Ncov and Naming it SARS-Cov-2. Nat Microbiol 2020; 5(4): 536-44.
5- Ahn DG, Shin HJ, Kim MH, Lee S, Kim HS, Myoung J, et al. Current Status of Epidemiology, Diagnosis, Therapeutics, and Vaccines for Novel Coronavirus Disease 2019 (COVID-19). J Microbiol Biotechnol 2020; 30(3): 313-24.
6- Banerjee A, Subudhi S, Rapin N, Lew J, Jain R, Falzarano D, et al. Selection of Viral Variants During Persistent Infection of Insectivorous Bat Cells with Middle East Respiratory Syndrome Coronavirus. Sci Rep 2020; 10(1): 7257.
7- Koyama T, Platt D, Parida L. Variant Analysis of SARS-Cov-2 Genomes. Bull World Health Organ 2020; 98(7): 495-504.
8- Yang X, Dong N, Chan EW, Chen S. Genetic Cluster Analysis of SARS-Cov-2 and the Identification of those Responsible for the Major Outbreaks in Various Countries. Emerg Microbes Infect 2020; 9(1): 1287-99.
9- Maitra A, Sarkar MC, Raheja H, Biswas NK, Chakraborti S, Singh AK, et al. Mutations in SARS-Cov-2 Viral RNA Identified in Eastern India: Possible Implications for the Ongoing Outbreak in India and Impact on Viral Structure and Host Susceptibility. J Biosci 2020; 45(1):76.
10- Kim JS, Jang JH, Kim JM, Chung YS, Yoo CK, Han MG. Genome-Wide Identification and Characterization of Point Mutations in the SARS-Cov-2 Genome. Osong Public Health Res Perspect 2020; 11(3):101-11.
11- Mercatelli D, Giorgi FM. Geographic and Genomic Distribution of SARS-Cov-2 Mutations. Front Microbiol 2020; 11: 1800.
12- Cherian S, Potdar V, Jadhav S, Yadav P, Gupta N, Das M, et al. SARS-Cov-2 Spike Mutations, L452R, T478K, E484Q and P681R, in the Second Wave of COVID-19 in Maharashtra, India. Microorganisms 2021; 9(7): 1542.
13- Pulakuntla S, Lokhande KB, Padmavathi P, Pal M, Swamy KV, Sadasivam J, et al. Mutational Analysis in International Isolates and Drug Repurposing Against SARS-Cov-2 Spike Protein: Molecular Docking and Simulation Approach. Virusdisease 2021; 32(4): 690-702.
14- Du Plessis L, McCrone JT, Zarebski AE, Hill V, Ruis C, Gutierrez B, et al. Establishment and Lineage Dynamics of the SARS-Cov-2 Epidemic in the UK. Science 2021; 371(6530): 708-12.
15- Wang P, Nair MS, Liu L, Iketani S, Luo Y, Guo Y, et al. Antibody Resistance of SARS-Cov-2 Variants B. 1.351 and B. 1.1. 7. Nature 2021; 593(7857): 130-5.
16- Faria NR, Mellan TA, Whittaker C, Claro IM, Candido DDS, Mishra S, et al. Genomics and Epidemiology of the P. 1 SARS-Cov-2 Lineage in Manaus, Brazil. Science 2021; 372(6544): 815-21.
17- Liu J, Liu Y, Xia H, Zou J, Weaver SC, Swanson KA, et al. BNT162b2-Elicited Neutralization of B. 1.617 and other SARS-Cov-2 Variants. Nature 2021; 596(7871): 273-5.
18- Brand SPC, Ojal J, Aziza R, Were V, Okiro EA, Kombe IK, et al. COVID-19 Transmission Dynamics Underlying Epidemic Waves in Kenya. Science 2021;374(6570): 989-94.
19- He X, Hong W, Pan X, Lu G, Wei X. SARS‐Cov‐2 Omicron Variant: Characteristics and Prevention. MedComm (2020) 2021; 2(4): 838-45.
20- Planas D, Veyer D, Baidaliuk A, Staropoli I, Guivel-Benhassine F, Rajah MM, et al. Reduced Sensitivity of SARS-Cov-2 Variant Delta to Antibody Neutralization. Nature 2021; 596(7871): 276-80.
21- Meo SA, Meo AS, Klonoff DC. Omicron New Variant BA. 2.86 (Pirola): Epidemiological, Biological, and Clinical Characteristics–A Global Data-Based Analysis. Eur Rev Med Pharmacol Sci 2023; 27(19): 9470-6.
22- Uriu K, Ito J, Kosugi Y, Tanaka YL, Mugita Y, Guo Z, Hinay Jr AA, et al. Transmissibility, infectivity, and immune resistance of the SARS-CoV-2 BA. 2.86 variant. BioRxiv 2023; 2023: 1-9.
23- Scarpa F, Ciccozzi M. On the SARS‐Cov‐2 BA. 2.86 Lineage: A Mutation Point of View. J Med Virol 2023; 95(9): e29079.
24- Li Q, Wu J, Nie J, Zhang L, Hao H, Liu S, et al. The Impact of Mutations in SARS-Cov-2 Spike on Viral Infectivity and Antigenicity. Cell 2020; 182(5): 1284-94. e9.
25- Rahman MS, Hoque MN, Islam MR, Islam I, Mishu ID, Rahaman MM, et al. Mutational Insights Into the Envelope Protein of SARS-Cov-2. Gene Rep 2021; 22: 100997.
26- Thomas S. The Structure of the Membrane Protein of SARS-Cov-2 Resembles the Sugar Transporter Semisweet. Pathog Immun 2020; 5(1): 342-63.
27- Shen L, Bard JD, Triche TJ, Judkins AR, Biegel JA, Gai X. Emerging Variants of Concern in SARS-Cov-2 Membrane Protein: A Highly Conserved Target with Potential Pathological and Therapeutic Implications. Emerg Microbes Infect 2021; 10(1): 885-93.
28- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 Mrna Covid-19 Vaccine. N Engl J Med 2020; 383(27): 2603-15.
29- Wu K, Werner AP, Koch M, Choi A, Narayanan E, Stewart-Jones GBE, et al. Serum Neutralizing Activity Elicited by Mrna-1273 Vaccine. N Engl J Med 2021; 384(15): 1468-70.
30- Ella R, Vadrevu KM, Jogdand H, Prasad S, Reddy S, Sarangi V, et al. Safety and Immunogenicity of an Inactivated SARS-Cov-2 Vaccine, BBV152: A Double-Blind, Randomised, Phase 1 Trial. Lancet Infect Dis 2021; 21(5): 637-46.
31- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and Efficacy of the Chadox1 Ncov-19 Vaccine (AZD1222) Against SARS-Cov-2: An Interim Analysis Of Four Randomised Controlled Trials in Brazil, South Africa, and the UK. Lancet 2021; 397(10269): 99-111.
32- Jones I, Roy P. Sputnik V COVID-19 Vaccine Candidate Appears Safe and Effective. Lancet 2021; 397(10275): 642-3.
33- Sadoff J, Gray G, Vandebosch A, Cárdenas V, Shukarev G, Grinsztejn B, et al. Safety and Efficacy of Single-Dose Ad26. COV2. S Vaccine Against Covid-19. N Engl J Med 2021; 384(23): 2187-201.
34- Wang GL, Wang ZY, Duan LJ, Meng QC, Jiang MD, Cao J, et al. Susceptibility of Circulating SARS-Cov-2 Variants to Neutralization. N Engl J Med 2021; 384(24): 2354-6.
35- Wang H, Zhang Y, Huang B, Deng W, Quan Y, Wang W, et al. Development of an Inactivated Vaccine Candidate, BBIBP-Corv, with Potent Protection Against SARS-Cov-2. Cell 2020; 182(3): 713-21. e9.
36- Doroftei B, Ciobica A, Ilie OD, Maftei R, Ilea C. Mini-Review Discussing the Reliability and Efficiency of COVID-19 Vaccines. Diagnostics (Basel) 2021; 11(4): 579.
37- Zhu FC, Li YH, Guan XH, Hou LH, Wang WJ, Li JX, et al. Safety, Tolerability, and Immunogenicity of a Recombinant Adenovirus Type-5 Vectored COVID-19 Vaccine: A Dose-Escalation, Open-Label, Non-Randomised, First-In-Human Trial. Lancet 2020; 395(10240): 1845-54.
38- Tanriover MD, Doğanay HL, Akova M, Güner HR, Azap A, Akhan S, et al. Efficacy and Safety of an Inactivated Whole-Virion SARS-Cov-2 Vaccine (Coronavac): Interim Results of a Double-Blind, Randomised, Placebo-Controlled, Phase 3 Trial in Turkey. Lancet 2021; 398(10296): 213-22.
39- Madhi SA, Baillie V, Cutland CL, Voysey M, Koen AL, Fairlie L, et al. Efficacy of the Chadox1 Ncov-19 Covid-19 Vaccine Against the B. 1.351 Variant. N Engl J Med 2021; 384(20): 1885-98.
40- Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and Efficacy of an Rad26 and Rad5 Vector-Based Heterologous Prime-Boost COVID-19 Vaccine: an Interim Analysis of a Randomised Controlled Phase 3 Trial in Russia. Lancet 2021; 397(10275): 671-81.
41- Ryzhikov AB, Ryzhikov EА, Bogryantseva MP, Danilenko ED, Imatdinov IR, Nechaeva EA, et al. Immunogenicity and Protectivity of the Peptide Vaccine Against SARS-Cov-2. Annals of the Russian academy of medical sciences 2021; 76(1): 5-19.
42- Huang Y, Yang C, Xu XF, Xu W, Liu SW. Structural and Functional Properties of SARS-Cov-2 Spike Protein: Potential Antivirus Drug Development for COVID-19. Acta Pharmacol Sin 2020; 41(9): 1141-9.
43- Wu K, Werner AP, Moliva JI, Koch M, Choi A, Stewart-Jones GBE, et al. mRNA-1273 Vaccine Induces Neutralizing Antibodies Against Spike Mutants from Global SARS-Cov-2 Variants. BioRxiv 2021: 2021.01.25.427948.
44- Zhang W, Davis BD, Chen SS, Sincuir Martinez JM, Plummer JT, Vail E. Emergence of a Novel SARS-Cov-2 Variant in Southern California. Jama 2021; 325(13): 1324-6.
45- Wibmer CK, Ayres F, Hermanus T, Madzivhandila M, Kgagudi P, Oosthuysen B, et al. SARS-Cov-2 501Y. V2 Escapes Neutralization by South African COVID-19 Donor Plasma. Nat Med 2021; 27(4): 622-5.
46- Torjesen I. Covid-19: Omicron May be more Transmissible than other Variants and Partly Resistant to Existing Vaccines, Scientists Fear. BMJ 2021; 375: n2943.
47- Andrews N, Stowe J, Kirsebom F, Toffa S, Rickeard T, Gallagher E, et al. Covid-19 Vaccine Effectiveness Against the Omicron (B. 1.1. 529) Variant. N Engl J Med 2022; 386(16): 1532-46.
48- Higdon MM, Baidya A, Walter KK, Patel MK, Issa H, Espié E, et al. Duration of Effectiveness of Vaccination Against COVID-19 Caused by the Omicron Variant. Lancet Infect Dis 2022; 22(8): 1114-6.
49- Lyngse FP, Kirkeby CT, Denwood M, Christiansen LE, Mølbak K, Møller CH, et al. Household Transmission of SARS-Cov-2 Omicron Variant of Concern Subvariants BA. 1 and BA. 2 In Denmark. Nat Commun 2022; 13(1): 5760.
1- Zhou P, Yang XL, Wang XG, Hu B, Zhang L, Zhang W, et al. Addendum: A Pneumonia Outbreak Associated with a New Coronavirus of Probable Bat Origin. Nature 2020; 579(7798): 270-3.
2- Liu Y, Gayle AA, Wilder-Smith A, Rocklöv J. The Reproductive Number of COVID-19 Is Higher Compared to SARS Coronavirus. J Travel Med 2020; 27(2): taaa021.
3- Leao JC, Gusmao TPL, Zarzar AM, Leao Filho JC, Barkokebas Santos de Faria A, Morais Silva IH, et al. Coronaviridae—Old Friends, New Enemy! Oral Dis 2022; 28 Suppl 1(Suppl 1):858-66.
4- Gorbalenya AE, Baker SC, Baric RS, de Groot RJ, Drosten C, Gulyaeva AA, et al. The Species Severe Acute Respiratory Syndrome-Related Coronavirus: Classifying 2019-Ncov and Naming it SARS-Cov-2. Nat Microbiol 2020; 5(4): 536-44.
5- Ahn DG, Shin HJ, Kim MH, Lee S, Kim HS, Myoung J, et al. Current Status of Epidemiology, Diagnosis, Therapeutics, and Vaccines for Novel Coronavirus Disease 2019 (COVID-19). J Microbiol Biotechnol 2020; 30(3): 313-24.
6- Banerjee A, Subudhi S, Rapin N, Lew J, Jain R, Falzarano D, et al. Selection of Viral Variants During Persistent Infection of Insectivorous Bat Cells with Middle East Respiratory Syndrome Coronavirus. Sci Rep 2020; 10(1): 7257.
7- Koyama T, Platt D, Parida L. Variant Analysis of SARS-Cov-2 Genomes. Bull World Health Organ 2020; 98(7): 495-504.
8- Yang X, Dong N, Chan EW, Chen S. Genetic Cluster Analysis of SARS-Cov-2 and the Identification of those Responsible for the Major Outbreaks in Various Countries. Emerg Microbes Infect 2020; 9(1): 1287-99.
9- Maitra A, Sarkar MC, Raheja H, Biswas NK, Chakraborti S, Singh AK, et al. Mutations in SARS-Cov-2 Viral RNA Identified in Eastern India: Possible Implications for the Ongoing Outbreak in India and Impact on Viral Structure and Host Susceptibility. J Biosci 2020; 45(1):76.
10- Kim JS, Jang JH, Kim JM, Chung YS, Yoo CK, Han MG. Genome-Wide Identification and Characterization of Point Mutations in the SARS-Cov-2 Genome. Osong Public Health Res Perspect 2020; 11(3):101-11.
11- Mercatelli D, Giorgi FM. Geographic and Genomic Distribution of SARS-Cov-2 Mutations. Front Microbiol 2020; 11: 1800.
12- Cherian S, Potdar V, Jadhav S, Yadav P, Gupta N, Das M, et al. SARS-Cov-2 Spike Mutations, L452R, T478K, E484Q and P681R, in the Second Wave of COVID-19 in Maharashtra, India. Microorganisms 2021; 9(7): 1542.
13- Pulakuntla S, Lokhande KB, Padmavathi P, Pal M, Swamy KV, Sadasivam J, et al. Mutational Analysis in International Isolates and Drug Repurposing Against SARS-Cov-2 Spike Protein: Molecular Docking and Simulation Approach. Virusdisease 2021; 32(4): 690-702.
14- Du Plessis L, McCrone JT, Zarebski AE, Hill V, Ruis C, Gutierrez B, et al. Establishment and Lineage Dynamics of the SARS-Cov-2 Epidemic in the UK. Science 2021; 371(6530): 708-12.
15- Wang P, Nair MS, Liu L, Iketani S, Luo Y, Guo Y, et al. Antibody Resistance of SARS-Cov-2 Variants B. 1.351 and B. 1.1. 7. Nature 2021; 593(7857): 130-5.
16- Faria NR, Mellan TA, Whittaker C, Claro IM, Candido DDS, Mishra S, et al. Genomics and Epidemiology of the P. 1 SARS-Cov-2 Lineage in Manaus, Brazil. Science 2021; 372(6544): 815-21.
17- Liu J, Liu Y, Xia H, Zou J, Weaver SC, Swanson KA, et al. BNT162b2-Elicited Neutralization of B. 1.617 and other SARS-Cov-2 Variants. Nature 2021; 596(7871): 273-5.
18- Brand SPC, Ojal J, Aziza R, Were V, Okiro EA, Kombe IK, et al. COVID-19 Transmission Dynamics Underlying Epidemic Waves in Kenya. Science 2021;374(6570): 989-94.
19- He X, Hong W, Pan X, Lu G, Wei X. SARS‐Cov‐2 Omicron Variant: Characteristics and Prevention. MedComm (2020) 2021; 2(4): 838-45.
20- Planas D, Veyer D, Baidaliuk A, Staropoli I, Guivel-Benhassine F, Rajah MM, et al. Reduced Sensitivity of SARS-Cov-2 Variant Delta to Antibody Neutralization. Nature 2021; 596(7871): 276-80.
21- Meo SA, Meo AS, Klonoff DC. Omicron New Variant BA. 2.86 (Pirola): Epidemiological, Biological, and Clinical Characteristics–A Global Data-Based Analysis. Eur Rev Med Pharmacol Sci 2023; 27(19): 9470-6.
22- Uriu K, Ito J, Kosugi Y, Tanaka YL, Mugita Y, Guo Z, Hinay Jr AA, et al. Transmissibility, infectivity, and immune resistance of the SARS-CoV-2 BA. 2.86 variant. BioRxiv 2023; 2023: 1-9.
23- Scarpa F, Ciccozzi M. On the SARS‐Cov‐2 BA. 2.86 Lineage: A Mutation Point of View. J Med Virol 2023; 95(9): e29079.
24- Li Q, Wu J, Nie J, Zhang L, Hao H, Liu S, et al. The Impact of Mutations in SARS-Cov-2 Spike on Viral Infectivity and Antigenicity. Cell 2020; 182(5): 1284-94. e9.
25- Rahman MS, Hoque MN, Islam MR, Islam I, Mishu ID, Rahaman MM, et al. Mutational Insights Into the Envelope Protein of SARS-Cov-2. Gene Rep 2021; 22: 100997.
26- Thomas S. The Structure of the Membrane Protein of SARS-Cov-2 Resembles the Sugar Transporter Semisweet. Pathog Immun 2020; 5(1): 342-63.
27- Shen L, Bard JD, Triche TJ, Judkins AR, Biegel JA, Gai X. Emerging Variants of Concern in SARS-Cov-2 Membrane Protein: A Highly Conserved Target with Potential Pathological and Therapeutic Implications. Emerg Microbes Infect 2021; 10(1): 885-93.
28- Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 Mrna Covid-19 Vaccine. N Engl J Med 2020; 383(27): 2603-15.
29- Wu K, Werner AP, Koch M, Choi A, Narayanan E, Stewart-Jones GBE, et al. Serum Neutralizing Activity Elicited by Mrna-1273 Vaccine. N Engl J Med 2021; 384(15): 1468-70.
30- Ella R, Vadrevu KM, Jogdand H, Prasad S, Reddy S, Sarangi V, et al. Safety and Immunogenicity of an Inactivated SARS-Cov-2 Vaccine, BBV152: A Double-Blind, Randomised, Phase 1 Trial. Lancet Infect Dis 2021; 21(5): 637-46.
31- Voysey M, Clemens SAC, Madhi SA, Weckx LY, Folegatti PM, Aley PK, et al. Safety and Efficacy of the Chadox1 Ncov-19 Vaccine (AZD1222) Against SARS-Cov-2: An Interim Analysis Of Four Randomised Controlled Trials in Brazil, South Africa, and the UK. Lancet 2021; 397(10269): 99-111.
32- Jones I, Roy P. Sputnik V COVID-19 Vaccine Candidate Appears Safe and Effective. Lancet 2021; 397(10275): 642-3.
33- Sadoff J, Gray G, Vandebosch A, Cárdenas V, Shukarev G, Grinsztejn B, et al. Safety and Efficacy of Single-Dose Ad26. COV2. S Vaccine Against Covid-19. N Engl J Med 2021; 384(23): 2187-201.
34- Wang GL, Wang ZY, Duan LJ, Meng QC, Jiang MD, Cao J, et al. Susceptibility of Circulating SARS-Cov-2 Variants to Neutralization. N Engl J Med 2021; 384(24): 2354-6.
35- Wang H, Zhang Y, Huang B, Deng W, Quan Y, Wang W, et al. Development of an Inactivated Vaccine Candidate, BBIBP-Corv, with Potent Protection Against SARS-Cov-2. Cell 2020; 182(3): 713-21. e9.
36- Doroftei B, Ciobica A, Ilie OD, Maftei R, Ilea C. Mini-Review Discussing the Reliability and Efficiency of COVID-19 Vaccines. Diagnostics (Basel) 2021; 11(4): 579.
37- Zhu FC, Li YH, Guan XH, Hou LH, Wang WJ, Li JX, et al. Safety, Tolerability, and Immunogenicity of a Recombinant Adenovirus Type-5 Vectored COVID-19 Vaccine: A Dose-Escalation, Open-Label, Non-Randomised, First-In-Human Trial. Lancet 2020; 395(10240): 1845-54.
38- Tanriover MD, Doğanay HL, Akova M, Güner HR, Azap A, Akhan S, et al. Efficacy and Safety of an Inactivated Whole-Virion SARS-Cov-2 Vaccine (Coronavac): Interim Results of a Double-Blind, Randomised, Placebo-Controlled, Phase 3 Trial in Turkey. Lancet 2021; 398(10296): 213-22.
39- Madhi SA, Baillie V, Cutland CL, Voysey M, Koen AL, Fairlie L, et al. Efficacy of the Chadox1 Ncov-19 Covid-19 Vaccine Against the B. 1.351 Variant. N Engl J Med 2021; 384(20): 1885-98.
40- Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and Efficacy of an Rad26 and Rad5 Vector-Based Heterologous Prime-Boost COVID-19 Vaccine: an Interim Analysis of a Randomised Controlled Phase 3 Trial in Russia. Lancet 2021; 397(10275): 671-81.
41- Ryzhikov AB, Ryzhikov EА, Bogryantseva MP, Danilenko ED, Imatdinov IR, Nechaeva EA, et al. Immunogenicity and Protectivity of the Peptide Vaccine Against SARS-Cov-2. Annals of the Russian academy of medical sciences 2021; 76(1): 5-19.
42- Huang Y, Yang C, Xu XF, Xu W, Liu SW. Structural and Functional Properties of SARS-Cov-2 Spike Protein: Potential Antivirus Drug Development for COVID-19. Acta Pharmacol Sin 2020; 41(9): 1141-9.
43- Wu K, Werner AP, Moliva JI, Koch M, Choi A, Stewart-Jones GBE, et al. mRNA-1273 Vaccine Induces Neutralizing Antibodies Against Spike Mutants from Global SARS-Cov-2 Variants. BioRxiv 2021: 2021.01.25.427948.
44- Zhang W, Davis BD, Chen SS, Sincuir Martinez JM, Plummer JT, Vail E. Emergence of a Novel SARS-Cov-2 Variant in Southern California. Jama 2021; 325(13): 1324-6.
45- Wibmer CK, Ayres F, Hermanus T, Madzivhandila M, Kgagudi P, Oosthuysen B, et al. SARS-Cov-2 501Y. V2 Escapes Neutralization by South African COVID-19 Donor Plasma. Nat Med 2021; 27(4): 622-5.
46- Torjesen I. Covid-19: Omicron May be more Transmissible than other Variants and Partly Resistant to Existing Vaccines, Scientists Fear. BMJ 2021; 375: n2943.
47- Andrews N, Stowe J, Kirsebom F, Toffa S, Rickeard T, Gallagher E, et al. Covid-19 Vaccine Effectiveness Against the Omicron (B. 1.1. 529) Variant. N Engl J Med 2022; 386(16): 1532-46.
48- Higdon MM, Baidya A, Walter KK, Patel MK, Issa H, Espié E, et al. Duration of Effectiveness of Vaccination Against COVID-19 Caused by the Omicron Variant. Lancet Infect Dis 2022; 22(8): 1114-6.
49- Lyngse FP, Kirkeby CT, Denwood M, Christiansen LE, Mølbak K, Møller CH, et al. Household Transmission of SARS-Cov-2 Omicron Variant of Concern Subvariants BA. 1 and BA. 2 In Denmark. Nat Commun 2022; 13(1): 5760.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







