دوره 31، شماره 7 - ( مهر 1402 )
جلد 31 شماره 7 صفحات 6823-6815 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mohammadi H R, Akhoundimeybodi Z, Sadeghi M J, Ghayedi A R, Ayatollahi J, Azimi Zade M. Investigation of the Frequency of Positive PPD Test in Candidate Patients Receiving Immunosuppressive Drugs Hospitalized in Shahid Sadoughi Hospital in Years 2019-2020. JSSU 2023; 31 (7) :6815-6823
URL: http://jssu.ssu.ac.ir/article-1-5998-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5998-fa.html
محمدی حمیدرضا، آخوندی میبدی زهره، صادقی محمدجواد، قایدی احمدرضا، آیتاللهی جمشید، عظیمیزاده مرضیه. بررسی فراوانی مثبت شدن تست PPD در بیماران کاندید دریافت داروهای ایونوساپرسیو بستری در بیمارستان شهید صدوقی یزد در سالهای 1399 - 1398. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (7) :6815-6823
حمیدرضا محمدی 

 ، زهره آخوندی میبدی*
، زهره آخوندی میبدی* 

 ، محمدجواد صادقی
، محمدجواد صادقی 

 ، احمدرضا قایدی
، احمدرضا قایدی 

 ، جمشید آیتاللهی
، جمشید آیتاللهی 

 ، مرضیه عظیمیزاده
، مرضیه عظیمیزاده 




 ، زهره آخوندی میبدی*
، زهره آخوندی میبدی* 

 ، محمدجواد صادقی
، محمدجواد صادقی 

 ، احمدرضا قایدی
، احمدرضا قایدی 

 ، جمشید آیتاللهی
، جمشید آیتاللهی 

 ، مرضیه عظیمیزاده
، مرضیه عظیمیزاده 


متن کامل [PDF 904 kb]
(168 دریافت)
| چکیده (HTML) (235 مشاهده)
References:
1- Sester U, Junker H, Hodapp T, Schütz A, Thiele B, Meyerhans A, et al. Improved Efficiency in Detecting Cellular Immunity Towards M. Tuberculosis in Patients Receiving Immunosuppressive drug Therapy. Nephrol Dial Transplant 2006; 21(11): 3258-68.
2- Chadha VK. Epidemiological Situation of Tuberculosis in India. J Indian Med Assoc 2003; 101(3): 144-7.
3- Dye C, Scheele S, Dolin P, Pathania V, Raviglione MC. Consensus Statement. Global Burden of Tuberculosis: Estimated Incidence, Prevalence, and Mortality by Country. WHO Global Surveillance and Monitoring Project. JAMA 1999; 282(7): 677-86.
4- Klote MM, Agodoa LY, Abbott K. Mycobacterium Tuberculosis Infection Incidence In Hospitalized Renal Transplant Patients in the United States, 1998–2000. Am J Transplant 2004; 4(9): 1523-8.
5- John GT, Shankar V, Abraham AM, Mukundan U, Thomas PP, Jacob CK. Risk Factors for Post-Transplant Tuberculosis. Kidney Int 2001; 60(3): 1148-53.
6- Sakhuja V, Jha V, Varma PP, Joshi K, Chugh KS. The High Incidence of Tuberculosis among Renal Transplant Recipients in India. Transplantation 1996; 61(2): 211-5.
7- Drain PK, Bajema KL, Dowdy D, Dheda K, Naidoo K, Schumacher SG, et al. Incipient and Subclinical Tuberculosis: A Clinical Review of Early Stages and Progression of Infection. Clin Microbiol Rev 2018; 31(4): e00021-18.
8- Halloran PF. Immunosuppressive drugs for Kidney Transplantation. N Engl J Med 2004; 351(26): 2715-29.
9- Shankar MS, Aravindan AN, Sohal PM, Kohli HS, Sud K, Gupta KL, et al. The Prevalence of Tuberculin Sensitivity and Anergy in Chronic Renal Failure in an Endemic Area: Tuberculin Test and the Risk of Post-Transplant Tuberculosis. Nephrol Dial Transplant 2005; 20(12): 2720-4.
10- Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Cöster L, et al. Risk and Case Characteristics of Tuberculosis in Rheumatoid Arthritis Associated with Tumor Necrosis Factor Antagonists in Sweden. Arthritis Rheum 2005; 52(7): 1986-92.
11- Yousif SS, Rasool MT. Screening for Latent Tuberculosis Infection at a Rheumatology and Medical Rehabilitation Center in Duhok City, Iraq. Medical Journal of Babylon 2021; 18(1): 23-7.
12- Agarwal S, Das SK, Agarwal GG, Srivastava R. Steroids Decrease Prevalence of Positive Tuberculin Skin Test in Rheumatoid Arthritis: Implications on Anti-TNF Therapies. Interdiscip Perspect Infect Dis 2014; 2014: 430134.
13- Zellweger JP, Sotgiu G, Corradi M, Durando P. The Diagnosis of Latent Tuberculosis Infection (LTBI): Currently Available Tests, Future Developments, and Perspectives to Eliminate Tuberculosis (TB). Med Lav 2020; 111(3): 170-83.
14- Huebner RE, Schein MF, Bass Jr JB. The Tuberculin Skin Test. Clin Infect Dis 1993: 17(6): 968-75.
15- Organization WH. Treatment of Tuberculosis: Guidelines. 4th ed. Geneva: World Health Organization; 2010.
16- Dye C, Scheele S, Pathania V, Raviglione MC. Global Burden of Tuberculosis: Estimated Incidence, Prevalence, and Mortality by Country. JAMA 1999; 282(7): 677-86.
17- Spence RK, Dafoe DC, Rabin G, Grossman RA, Naji A, Barker CF, et al. Mycobacterial Infections in Renal Allograft Recipients. Arch Surg 1983; 118(3): 356-9.
18- Horsburgh CR Jr. Priorities for the Treatment of Latent Tuberculosis Infection in the United States. N Engl J Med 2004; 350(20): 2060-7.
19- Bartalesi F, Vicidomini S, Goletti D, Fiorelli C, Fiori G, Melchiorre D, et al. Quantiferon-TB Gold and the TST are Both Useful for Latent Tuberculosis Infection Screening in Autoimmune Diseases. Eur Respir J 2009; 33(3): 586-93.
20- Rezai MS, Tabrizi R, Haghdoost AA, Afshari M, Abedi S, Akbari M, et al. Estimating the Prevalence of Positive Tuberculin Skin Test Reactions in General Population and High-Risk Groups: a Meta-Analysis. Int J Prev Med 2017; 8: 97.
21- Chen C, Zhu T, Wang Z, Peng H, Kong W, Zhou Y, et al. High Latent TB Infection Rate and Associated Risk Factors in the Eastern China of Low TB Incidence. PLoS One 2015; 10(10): e0141511.
22- Mancuso JD, Diffenderfer JM, Ghassemieh BJ, Horne DJ, Kao TC. The Prevalence of Latent Tuberculosis Infection in the United States. Am J Respir Crit Care Med 2016; 194(4): 501-9.
23- Rafiza S, Rampal KG, Tahir A. Prevalence and Risk Factors of Latent Tuberculosis Infection among Health Care Workers in Malaysia. BMC Infect Dis 2011; 11: 19.
24- Agaya J, Nnadi CD, Odhiambo J, Obonyo C, Obiero V, Lipke V, et al. Tuberculosis and Latent Tuberculosis Infection among Healthcare Workers in K Isumu, K Enya. Trop Med Int Health 2015; 20(12): 1797-804.
25- Foster R, Ferguson TW, Rigatto C, Lerner B, Tangri N, Komenda P. A Retrospective Review of the Two-Step Tuberculin Skin Test in Dialysis Patients. Can J Kidney Health Dis 2016; 3: 28.
26- Manuel O, Humar A, Preiksaitis J, Doucette K, Shokoples S, Peleg AY, et al. Comparison of Quantiferon‐TB Gold with Tuberculin Skin Test for Detecting Latent Tuberculosis Infection Prior to Liver Transplantation. Am J Transplant 2007; 7(12): 2797-801.
27- Seyhan EC, Sökücü S, Altin S, Günlüoğlu G, Trablus S, Yilmaz D, et al. Comparison of the Quantiferon‐TB Gold in‐Tube Test with the Tuberculin Skin Test for Detecting Latent Tuberculosis Infection in Hemodialysis Patients. Transpl Infect Dis 2010; 12(2): 98-105.
28- Tamborenea MN, Tate G, Mysler E, Debonis J, Schijedman A. Prevalence of Positive Ppd in a Cohort of Rheumatoid Arthritis Patients. Rheumatol Int 2010; 30(5): 613-6.
29- Ponce de León D, Acevedo-Vásquez E, Sánchez-Torres A, Cucho M, Alfaro J, Perich R, et al. Attenuated Response to Purified Protein Derivative in Patients with Rheumatoid Arthritis: Study in a Population with a High Prevalence of Tuberculosis. Ann Rheum Dis 2005; 64(9): 1360-1.
30- Köker IH, Pamuk ON, Karlikaya C, Tunçbilek N, Cakir N. A Low Prevalance of Purified Protein Derivative Test Positivity in Turkish Patients with Rheumatoid Arthritis. Association with Clinical Features and HRCT Findings. Clin Exp Rheumatol 2007; 25(1): 54-9.
متن کامل: (163 مشاهده)
مقدمه
سل (Tuberculosis) با عاملMycobacterium tuberculosis یکی از شایعترین عفونتهایی است که منجر به مرگ میشود بهطوری که خطر عفونت سالانه 1/7% است و هر دقیقه یک نفر به دلیل سل جان خود را از دست میدهد (1،2). این آمار در افرادی که به دلایل مختلف دچار ضعف در سیستم ایمنی هستند تا 23% گزارش شده است (3,4). شرایط نابسامان اقتصادی و شهرنشینی، افزایش جمعیت و گسترش روزافزون HIV در جوامع در کنار مواردی مثل CRF و سیروز و... که افراد را مستعد پیوند عضو میکنند از جمله عواملی هستند که خطر بیماری سل را دو چندان کرده است (5,6). عفونت نهفته سلی یا Latent TB Infection (LTBI) اصطلاحی است که پاسخ ایمنی قوی در غیاب بار باکتریایی قابل تشخیص را بیان میکند؛ که فاکتورهای متعددی از جمله سن، زمان سپری شده از عفونت و کیفیت سیستم ایمنی در تبدیل این عفونت نهفته به عفونت فعال سلی موثر هستند (7). تصور میشود در افرادی که ایمنی مناسبی دارند این ایمنی پایدار تکثیر باکتریهای بیماریزا را زیر سطوح قابل تشخیص نگه دارد که علم به این موضوع درک فعال شدن مجدد سل نهفته را در افرادیکه تحت شرایط مختلف دچار سرکوب ایمنی شدهاند را آسانتر میکند (8). مطالعاتی در همین باره بر روی افراد دارای پیوند که داروهای ایمونوساپرسیو دریافت میکردهاند نشان داده است که بسیاری از موارد ابتلا یک سال پس از دریافت پیوند بوده است که خود میتواند بیانگر پیشرفت عفونت نهفته به بیماری فعال باشد (9). Askling و همکاران در مطالعهای نشان دادند که در مبتلایان به آرتریت روماتوئید، درمان با آنتاگونیست TNF-a (Tumour Necrosis Factor alpha)) با افزایش خطر ابتلا به سل، تا 4 برابر همراه بود (10). در مطالعهای دیگر Sabri Shawkat و همکاران بیان کردند که به دنبال درمان اولیه با آنتاگونیست TNF در بیماران مبتلا به اختلالات روماتولوژی خطر ابتلا به عفونت سل افزایش مییابد و به فعالشدن مجدد سل نهفته کمک میکند (11). لذا ضرورت دارد که افرادیکه کاندیدی برای دریافت داروهای ایمونوساپرسیو میشوند از نظر وجود سل نهفته مورد بررسی قرار گیرند تا در صورت مثبت بودن این تست، اقدامات مناسب درمانی و پروفیلاکسی از نظر سل برای آنها انجام گیرد. امروزه بهصورت گسترده از Tuberculin skin test (TST) به عنوان شاخصی برای غربالگری سل نهفته استفاده میشود (12). بهجز شرایط نگهداری محلول توبرکولین بهطور کلی تست TST از لحاظ هزینه و نحوه انجام بسیار ارزان و آسان است (13) البته میتوان بعضی از شرایط را که باعث منفی و یا مثبت کاذب در این تست میشوند (مثل سابقه واکسیناسیون سل) را نیز از نقاط ضعف آن دانست (14). در این مطالعه به غربالگری بیماران کاندید دریافت داروهای ایمونوساپرسیو از نظر سل پرداختیم.
روش بررسی
این مطالعه تحلیلی - مقطعی بر روی بیماران کاندید دریافت داروهای ایمونوساپرسیو تزریقی بستری در کلیه بخشهای بیمارستان شهید صدوقی یزد در سال 1398 تا 1399 انجام شد. در این مطالعه رضایتنامه کتبی و آگاهانه از بیماران گرفته شد و اهداف طرح برای ایشان توضیح داده شد. روش انتخاب نمونه در این مطالعه بهصورت سرشماری بود. بیمارانی که براساس شدت و سیر درمان در مرحلهای قرار داشتند که نیاز به دریافت داروهای ایمونوساپرسیو بهصورت تزریقی داشتند، تحت غربالگری از نظر ابتلا به سل قرار گرفتند تا در صورت نیاز قبل از شروع این درمان بیماران تحت درمان با رژیم درمانی سل قرار بگیرند. در ابتدا از همه بیماران واجد شرایط توسط واحد کنترل عفونت بیمارستان شهید صدوقی تست TST گرفته شد و نحوه انجام تست به این صورت بود که 5 واحد ازPurified protein derivative (PPD) معادل 0/1 سیسی بهصورت اینترادرمال در ناحیه قدامی ساعد بین دو سوم فوقانی و یک سوم تحتانی تزریق شد. بعد از 72-48 ساعت بزرگترین قطر عرضی سفتی (induration) اندازهگیری شد و بر اساس اندازه induration، افراد در سه گروه قرار گرفتند: سالم (TST=0-4)، مشکوک (TST=5-9) و مبتلا به عفونت سلی (TST≥10) (10). لازم به ذکر است که به دلیل تاثیر ثابت شده داروهای ایمونوساپرسیو بر نتایج تست TST که میتواند میزان منفی کاذب را در نتایج افزایش دهد افرادیکه پیش از این مراجعه داروهای ایمونوساپرسیو را دریافت کرده بودند در مطالعه وارد نشدند. همچنین بررسیها نشان داد هیچ یک از بیماران شواهد بالینی از سل فعال را نداشتند و سوابقی مکتوب از واکسیناسیون سل برای همه بیماران موجود نبود ولی از سال 1331 هجری شمسی در ایران واکسیناسیون گسترده علیه سل آغاز شده است (9). در حین مطالعه بیماران بر اساس علت بستری و زمینه بیماریهای درگیر در هشت گروه مشخص قرار گرفتند: 1- اختلالات روماتولوژی 2-کاندید پیوند کلیه 3- اختلالات روماتولوژی 4- درگیریهای سیستم گوارشی 5- درگیری سیستم بینایی 6- درگیری سیستم نورولوژی 7- کاندید پیوند کبد 8- کاندید پیوند مغز استخوان. اطلاعات مربوط به سن و جنس و علت بستری و نتایج تست PPD توسط چک لیست جمعآوری شد.
تجزیه و تحلیل آماری
دادهها توسط نرمافزارversion 16 SPSS مورد تحلیل قرار گرفت. دادههای کمی با میانگین و انحرافمعیار و دادههای کیفی با فراوانی و درصد نمایش داده شد و از آزمونهای آنالیز واریانس یک طرفه و کای دو استفاده شد. سطح معناداری کمتر از 0/05 از نظر آماری معنیدار در نظر گرفته شد.
ملاحظات اخلاقی
کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد با شناسه IR.SSU.MEDICINE.REC.1398.347 این طرح را مورد تایید قرار داد.
نتایج
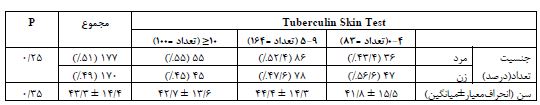
در این مطالعه از بین 380 بیمار کاندید دریافت داروهای ایمونوساپرسیو بستری در بیمارستان شهید صدوقی یزد، تعدادی از بیماران رضایت به شرکت در مطالعه نداشتند و در نهایتاً 347 بیمار شامل 177 (51%) مرد و 170 (49%) زن وارد مطالعه شدند. بر اساس نتیجه تست TST افراد در سه گروه سالم (TST=0-4)، مشکوک (TST=5-9) و مبتلا عفونت سل (TST≥10) قرار گرفتند و فراوانی در سه گروه به ترتیب برابر 83 (23/9%)، 164 (47/3%) و 100 (28/8%) بود. فراوانی زنان و مردان به ترتیب در گروه سالم برابر 36 (43/4%) و 47 (56/6%)، در گروه مشکوک برابر 86 (52/4%) و 78 (47/6%) و در گروه مبتلا عفونت سل 55 (55%) و 45 (45%) نفر بود. بین جنسیت و گروهبندی مورد مطالعه ارتباط معناداری وجود نداشت (P=0.25). همانطور که از جدول 1 مشاهده میشود بین میانگین سن و میزان پاسخ تست TST ارتباط معنادار آماری وجود نداشت (P=0.35). (جدول 1)
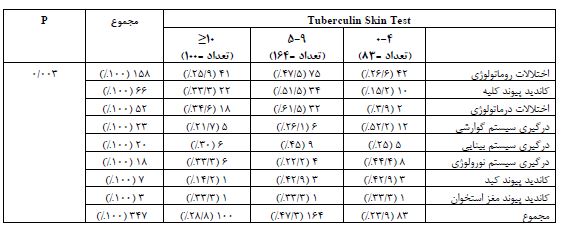
نتایج نشان داد که در بیماران مبتلا به اختلالات روماتولوژی کاندید درمان ایمونوساپرسیو 75 (47/5%) نفر مشکوک و 41 (25/9%) مبتلا به عفونت سل بودند. (نمودار 1) بر اساس آزمون کای دو بین علت مراجعه و درگیری همراه با گروهبندی حاصل از تست TST رابطه معنیداری وجود داشت (P=0.003)، بهطوری که در گروههای با اختلالات درماتولوژی 18 (34/6%) نفر در گروه مبتلا به عفونت سل قرار داشتند که بیشترین درصد را بین سایر گروهها شامل میشد. در گروه افراد دارای درگیریهای گوارشی 12 (52/2%) نفر تست در گروه سالم قرار داشتند که بهطور چشمگیری بالاتر از سایر گروهها بود. از بین افراد مبتلا به درگیری درماتولوژی 32 (61/5%) نفر در گروه 9-5= TST بودند که بالاترین میزان را از این لحاظ شامل میشد (جدول 2).
جدول 1: مقایسه ویژگیهـای جمعیتشناختی بیماران کاندید دریافت داروهای ایمونوساپرسیو برحسب نتایج تست TST
جدول 2: مقایسه نتایج تست TST در بیماران کاندید دریافت داروهای ایمونوساپرسیو برحسب درگیری همراه
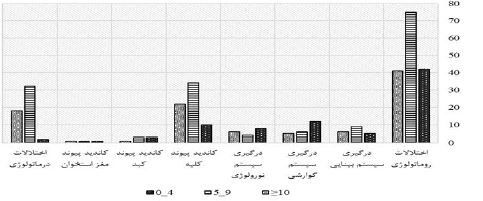
نمودار 1: توزیع فراوانی نتایج تست TST در بیماران کاندید دریافت داروهای ایمونوساپرسیو برحسب درگیری همراه
بحث
سل یکی از شایعترین علل مرگومیر ناشی از عفونت در انسان است که سالانه حدود 1/6 میلیون مرگ را شامل میشود (15). این بیماری عامل مهمی برای عوارض و مرگومیر به ویژه در میان افراد دارای نقص ایمنی است. حتی در کشورهای با شیوع کم، بروز سل در گیرندگان پیوند در مقایسه با جمعیت عمومی بیشتر است و اخیراً مرگومیر ناشی از سل 23% گزارش شده است (4,16). M. tuberculosis تا حد زیادی توسط ایمنی سلولی کنترل میشود. تصور میشود که در افراد دارای سطح ایمنی بالا، تکثیر باکتریها در زیر سطوح قابل تشخیص میباشد (8). از آنجاییکه سرکوب سیستم ایمنی ایاتروژنیک باعث کاهش قابلتوجه عملکرد ایمنی سلولی میشود، اختلال پیشرونده در ایمنی سلولی ممکن است به افزایش بروز فعال شدن مجدد عفونت نهفته کمک کند (17). Horsburgh و همکاران بیان کردند گروههای دریافتکننده ایمونوساپرسیو و کورتیکواستروئید به دلیل خطر بالای پیشرفت به سمت سل فعال، مهمترین هدف برای غربالگری و درمان سل نهفته میباشند (18). با توجه به این مطالب در این مطالعه ما به غربالگری بیماران کاندید درمان ایمونوساپرسیو از نظر ابتلا به سل پرداختیم.
در مطالعه Bartalesi و همکاران شیوع سل نهفته در بین بیماران مبتلا به بیماریهای اتوایمیون، 18/8% به دست آمد (19). در مطالعه دیگری درصد ابتلا به سل نهفته در افراد مبتلا به اختلال ایمنی 13/7% برآورد شد (20). نتایج مطالعه حاضر نشان داد که از بین بیماران کاندید دریافت ایمونوساپرسیو مراجعهکننده به مرکز سل، 28/8% دارای تست 10 ≥ TST میباشند و بهصورت قابلتوجهی بیشتر از سایر مطالعات میباشد. این تفاوت میتواند به علت تفاوت در جامعه مورد مطالعه و ویژگیهای اپیدمیولوژیک سل در استان یزد که مهاجرت به داخل از استانهای جنوب شرق و کشور افغانستان دارد باشد. در مطالعه Chen و همکاران در چین و مطالعه Mancuso و همکاران در ایالات متحده شیوع عفونت سل نهفته در میان جمعیت عمومی به ترتیب 19/98% و 4/4% برآورد شده است (21,22). در مطالعه Rafiza و همکاران در مالزی و مطالعه Agaya و همکاران در کنیا فراوانی شیوع عفونت سل نهفته در کارکنان سلامت به ترتیب برابر 10/6% و 60% میباشد که به دلیل تفاوت در روند واکسیناسیون در دو کشور و سطح اقدامات مراقبتی میباشد (23,24). در ایران نیز شیوع عفونت سل نهفته تا حدود 38/9% گزارش شده است (20). Klote و همکاران در مطالعهای بیان کردند که خطر ابتلا به عفونت اولیه یا فعالسازی مجدد M. tuberculosis در بیماران پیوند کلیه در مقایسه با جمعیت عمومی بالاتر است (4). در همین رابطه در سایر مطالعات شیوع عفونت نهفته سل در بین بیماران تحت همودیالیز به ترتیب 34 - 13% برآورد شد (27-25،19). در مطالعه حاضر نیز در بین بیماران کاندید پیوند کلیه 51/5% از شرکتکنندگان تست پوستی مشکوک و 33/3% تست پوستی مثبت داشتند. TST در حال حاضر ابزار استاندارد برای تشخیص عفونت سل نهفته است. اختلال در واکنش سلولی ایمنی در بیماران مبتلا به آرتریت روماتوئید میتواند منجر به TST منفی کاذب شود (28). در مطالعه Agarwal و همکاران مشاهده شد که 20/4% از بیماران مبتلا به آرتریت روماتوئید، مبتلا به سل نهفته میباشند که از جمعیت عمومی کمتر است. نرخ پایینتر مثبت بودن تستهای مربوط به سل در بیماران مبتلا به آرتریت روماتوئید ممکن است به خود بیماری یا داروهای مورد استفاده برای آن نسبت داده شود. همچنین در این مطالعه بیان شده است که احتمالاً متوتروکسات بر پاسخ تست توبرکولین موثر نیست اگرچه حتی دوزهای پایین استروئید میتوانند نرخ پاسخ مثبت تست توبرکولین را کاهش دهند (12). در دو مطالعه میزان ابتلا به سل نهفته در بیماران مبتلا آرتریت روماتوئید حدود 28% گزارش شده است (29,30). در مطالعه حاضر نیز براساس تست TST ابتلا به عفونت سلی در 25/9% از بیماران تشخیص داده شد. بررسیها در مطالعه حاضر نیز نشان داد که در بیماران با درگیریهای روماتولوژی و درماتولوژی و بیماران کاندید پیوند کلیه فراوانی تستهای مثبت و مشکوک نسبت به سایر گروهها قابلتوجه است و لازم است جهت غربالگری و بیمارییابی در این زیر گروهها اقدامات بیشتری انجام شود و قبل از دریافت داروهای ایمونوساپرسیو تحت درمانهای لازم چند دارویی قرار بگیرند. در این مطالعه محدودیتهایی مالی وجود داشت و امکان بررسی ابتلا به بیماری سل با تستهای تشخیصی قویتر وجود نداشت. همچنین امکان غربالگری خانواده بیماران وجود نداشته است. با وجود همکاری کادر درمان و پزشکان با توجه به گسترده بودن بیماریهای مورد مطالعه و تفاوت در شیوههای درمان، داروهای دریافتی و شیوه ارزیابی امکان بررسی ارتباط شدت بیماری در حال حاضر با نتیجه تست TST وجود نداشت. با توجه به وجود افراد مبتلا به آرتریت روماتوئید در این مطالعه امکان دارد که نتایج تست TST تحت تاثیر این بیماری قرار گرفته باشد.
نتیجهگیری
با توجه به شیوع سل نهفته و میزان مرگومیر بالای ناشی از این بیماری لازم است که در گروه بیماران پرخطر دریافتکننده داروهای سرکوبگر سیستم ایمنی غربالگری با دقت بالایی انجام شود و سایر آزمونهای تشخیصی نیز استفاده شود. در مطالعه حاضر بیماران مبتلا به اختلالات روماتولوژی (116 نفر)، درماتولوژی (50 نفر) و افراد کاندید پیوند کلیه (56 نفر) با تست TST بالاتر از 5، فراوانی قابلتوجهی داشتند و در صورت دریافت داروهای تضعیف کننده سیستم ایمنی احتمال ابتلا به عفونت اولیه سل و فعالشدن سل نهفته بیشتر خواهد شد. بنابراین لازم است کارکنان سلامت به این موضوع دقت بیشتری داشته باشند.
سپاسگزاری
این مقاله از پایاننامه دکتری حرفهای نویسنده سوم، در گروه بیماریهای عفونی، دانشکده پزشکی، دانشگاه علوم پزشکی شهید صدوقی یزد به کد 6778 استخراج شد. از همه بیماران و پرسنل درمانی و اداری بیمارستان شهید صدوقی یزد که ما را در انجام این مطالعه یاری کردند، سپاسگزار هستیم.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد
تعارض در منافع: وجود ندارد.
سل (Tuberculosis) با عاملMycobacterium tuberculosis یکی از شایعترین عفونتهایی است که منجر به مرگ میشود بهطوری که خطر عفونت سالانه 1/7% است و هر دقیقه یک نفر به دلیل سل جان خود را از دست میدهد (1،2). این آمار در افرادی که به دلایل مختلف دچار ضعف در سیستم ایمنی هستند تا 23% گزارش شده است (3,4). شرایط نابسامان اقتصادی و شهرنشینی، افزایش جمعیت و گسترش روزافزون HIV در جوامع در کنار مواردی مثل CRF و سیروز و... که افراد را مستعد پیوند عضو میکنند از جمله عواملی هستند که خطر بیماری سل را دو چندان کرده است (5,6). عفونت نهفته سلی یا Latent TB Infection (LTBI) اصطلاحی است که پاسخ ایمنی قوی در غیاب بار باکتریایی قابل تشخیص را بیان میکند؛ که فاکتورهای متعددی از جمله سن، زمان سپری شده از عفونت و کیفیت سیستم ایمنی در تبدیل این عفونت نهفته به عفونت فعال سلی موثر هستند (7). تصور میشود در افرادی که ایمنی مناسبی دارند این ایمنی پایدار تکثیر باکتریهای بیماریزا را زیر سطوح قابل تشخیص نگه دارد که علم به این موضوع درک فعال شدن مجدد سل نهفته را در افرادیکه تحت شرایط مختلف دچار سرکوب ایمنی شدهاند را آسانتر میکند (8). مطالعاتی در همین باره بر روی افراد دارای پیوند که داروهای ایمونوساپرسیو دریافت میکردهاند نشان داده است که بسیاری از موارد ابتلا یک سال پس از دریافت پیوند بوده است که خود میتواند بیانگر پیشرفت عفونت نهفته به بیماری فعال باشد (9). Askling و همکاران در مطالعهای نشان دادند که در مبتلایان به آرتریت روماتوئید، درمان با آنتاگونیست TNF-a (Tumour Necrosis Factor alpha)) با افزایش خطر ابتلا به سل، تا 4 برابر همراه بود (10). در مطالعهای دیگر Sabri Shawkat و همکاران بیان کردند که به دنبال درمان اولیه با آنتاگونیست TNF در بیماران مبتلا به اختلالات روماتولوژی خطر ابتلا به عفونت سل افزایش مییابد و به فعالشدن مجدد سل نهفته کمک میکند (11). لذا ضرورت دارد که افرادیکه کاندیدی برای دریافت داروهای ایمونوساپرسیو میشوند از نظر وجود سل نهفته مورد بررسی قرار گیرند تا در صورت مثبت بودن این تست، اقدامات مناسب درمانی و پروفیلاکسی از نظر سل برای آنها انجام گیرد. امروزه بهصورت گسترده از Tuberculin skin test (TST) به عنوان شاخصی برای غربالگری سل نهفته استفاده میشود (12). بهجز شرایط نگهداری محلول توبرکولین بهطور کلی تست TST از لحاظ هزینه و نحوه انجام بسیار ارزان و آسان است (13) البته میتوان بعضی از شرایط را که باعث منفی و یا مثبت کاذب در این تست میشوند (مثل سابقه واکسیناسیون سل) را نیز از نقاط ضعف آن دانست (14). در این مطالعه به غربالگری بیماران کاندید دریافت داروهای ایمونوساپرسیو از نظر سل پرداختیم.
روش بررسی
این مطالعه تحلیلی - مقطعی بر روی بیماران کاندید دریافت داروهای ایمونوساپرسیو تزریقی بستری در کلیه بخشهای بیمارستان شهید صدوقی یزد در سال 1398 تا 1399 انجام شد. در این مطالعه رضایتنامه کتبی و آگاهانه از بیماران گرفته شد و اهداف طرح برای ایشان توضیح داده شد. روش انتخاب نمونه در این مطالعه بهصورت سرشماری بود. بیمارانی که براساس شدت و سیر درمان در مرحلهای قرار داشتند که نیاز به دریافت داروهای ایمونوساپرسیو بهصورت تزریقی داشتند، تحت غربالگری از نظر ابتلا به سل قرار گرفتند تا در صورت نیاز قبل از شروع این درمان بیماران تحت درمان با رژیم درمانی سل قرار بگیرند. در ابتدا از همه بیماران واجد شرایط توسط واحد کنترل عفونت بیمارستان شهید صدوقی تست TST گرفته شد و نحوه انجام تست به این صورت بود که 5 واحد ازPurified protein derivative (PPD) معادل 0/1 سیسی بهصورت اینترادرمال در ناحیه قدامی ساعد بین دو سوم فوقانی و یک سوم تحتانی تزریق شد. بعد از 72-48 ساعت بزرگترین قطر عرضی سفتی (induration) اندازهگیری شد و بر اساس اندازه induration، افراد در سه گروه قرار گرفتند: سالم (TST=0-4)، مشکوک (TST=5-9) و مبتلا به عفونت سلی (TST≥10) (10). لازم به ذکر است که به دلیل تاثیر ثابت شده داروهای ایمونوساپرسیو بر نتایج تست TST که میتواند میزان منفی کاذب را در نتایج افزایش دهد افرادیکه پیش از این مراجعه داروهای ایمونوساپرسیو را دریافت کرده بودند در مطالعه وارد نشدند. همچنین بررسیها نشان داد هیچ یک از بیماران شواهد بالینی از سل فعال را نداشتند و سوابقی مکتوب از واکسیناسیون سل برای همه بیماران موجود نبود ولی از سال 1331 هجری شمسی در ایران واکسیناسیون گسترده علیه سل آغاز شده است (9). در حین مطالعه بیماران بر اساس علت بستری و زمینه بیماریهای درگیر در هشت گروه مشخص قرار گرفتند: 1- اختلالات روماتولوژی 2-کاندید پیوند کلیه 3- اختلالات روماتولوژی 4- درگیریهای سیستم گوارشی 5- درگیری سیستم بینایی 6- درگیری سیستم نورولوژی 7- کاندید پیوند کبد 8- کاندید پیوند مغز استخوان. اطلاعات مربوط به سن و جنس و علت بستری و نتایج تست PPD توسط چک لیست جمعآوری شد.
تجزیه و تحلیل آماری
دادهها توسط نرمافزارversion 16 SPSS مورد تحلیل قرار گرفت. دادههای کمی با میانگین و انحرافمعیار و دادههای کیفی با فراوانی و درصد نمایش داده شد و از آزمونهای آنالیز واریانس یک طرفه و کای دو استفاده شد. سطح معناداری کمتر از 0/05 از نظر آماری معنیدار در نظر گرفته شد.
ملاحظات اخلاقی
کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد با شناسه IR.SSU.MEDICINE.REC.1398.347 این طرح را مورد تایید قرار داد.
نتایج
در این مطالعه از بین 380 بیمار کاندید دریافت داروهای ایمونوساپرسیو بستری در بیمارستان شهید صدوقی یزد، تعدادی از بیماران رضایت به شرکت در مطالعه نداشتند و در نهایتاً 347 بیمار شامل 177 (51%) مرد و 170 (49%) زن وارد مطالعه شدند. بر اساس نتیجه تست TST افراد در سه گروه سالم (TST=0-4)، مشکوک (TST=5-9) و مبتلا عفونت سل (TST≥10) قرار گرفتند و فراوانی در سه گروه به ترتیب برابر 83 (23/9%)، 164 (47/3%) و 100 (28/8%) بود. فراوانی زنان و مردان به ترتیب در گروه سالم برابر 36 (43/4%) و 47 (56/6%)، در گروه مشکوک برابر 86 (52/4%) و 78 (47/6%) و در گروه مبتلا عفونت سل 55 (55%) و 45 (45%) نفر بود. بین جنسیت و گروهبندی مورد مطالعه ارتباط معناداری وجود نداشت (P=0.25). همانطور که از جدول 1 مشاهده میشود بین میانگین سن و میزان پاسخ تست TST ارتباط معنادار آماری وجود نداشت (P=0.35). (جدول 1)
نتایج نشان داد که در بیماران مبتلا به اختلالات روماتولوژی کاندید درمان ایمونوساپرسیو 75 (47/5%) نفر مشکوک و 41 (25/9%) مبتلا به عفونت سل بودند. (نمودار 1) بر اساس آزمون کای دو بین علت مراجعه و درگیری همراه با گروهبندی حاصل از تست TST رابطه معنیداری وجود داشت (P=0.003)، بهطوری که در گروههای با اختلالات درماتولوژی 18 (34/6%) نفر در گروه مبتلا به عفونت سل قرار داشتند که بیشترین درصد را بین سایر گروهها شامل میشد. در گروه افراد دارای درگیریهای گوارشی 12 (52/2%) نفر تست در گروه سالم قرار داشتند که بهطور چشمگیری بالاتر از سایر گروهها بود. از بین افراد مبتلا به درگیری درماتولوژی 32 (61/5%) نفر در گروه 9-5= TST بودند که بالاترین میزان را از این لحاظ شامل میشد (جدول 2).
جدول 1: مقایسه ویژگیهـای جمعیتشناختی بیماران کاندید دریافت داروهای ایمونوساپرسیو برحسب نتایج تست TST

جدول 2: مقایسه نتایج تست TST در بیماران کاندید دریافت داروهای ایمونوساپرسیو برحسب درگیری همراه


نمودار 1: توزیع فراوانی نتایج تست TST در بیماران کاندید دریافت داروهای ایمونوساپرسیو برحسب درگیری همراه
بحث
سل یکی از شایعترین علل مرگومیر ناشی از عفونت در انسان است که سالانه حدود 1/6 میلیون مرگ را شامل میشود (15). این بیماری عامل مهمی برای عوارض و مرگومیر به ویژه در میان افراد دارای نقص ایمنی است. حتی در کشورهای با شیوع کم، بروز سل در گیرندگان پیوند در مقایسه با جمعیت عمومی بیشتر است و اخیراً مرگومیر ناشی از سل 23% گزارش شده است (4,16). M. tuberculosis تا حد زیادی توسط ایمنی سلولی کنترل میشود. تصور میشود که در افراد دارای سطح ایمنی بالا، تکثیر باکتریها در زیر سطوح قابل تشخیص میباشد (8). از آنجاییکه سرکوب سیستم ایمنی ایاتروژنیک باعث کاهش قابلتوجه عملکرد ایمنی سلولی میشود، اختلال پیشرونده در ایمنی سلولی ممکن است به افزایش بروز فعال شدن مجدد عفونت نهفته کمک کند (17). Horsburgh و همکاران بیان کردند گروههای دریافتکننده ایمونوساپرسیو و کورتیکواستروئید به دلیل خطر بالای پیشرفت به سمت سل فعال، مهمترین هدف برای غربالگری و درمان سل نهفته میباشند (18). با توجه به این مطالب در این مطالعه ما به غربالگری بیماران کاندید درمان ایمونوساپرسیو از نظر ابتلا به سل پرداختیم.
در مطالعه Bartalesi و همکاران شیوع سل نهفته در بین بیماران مبتلا به بیماریهای اتوایمیون، 18/8% به دست آمد (19). در مطالعه دیگری درصد ابتلا به سل نهفته در افراد مبتلا به اختلال ایمنی 13/7% برآورد شد (20). نتایج مطالعه حاضر نشان داد که از بین بیماران کاندید دریافت ایمونوساپرسیو مراجعهکننده به مرکز سل، 28/8% دارای تست 10 ≥ TST میباشند و بهصورت قابلتوجهی بیشتر از سایر مطالعات میباشد. این تفاوت میتواند به علت تفاوت در جامعه مورد مطالعه و ویژگیهای اپیدمیولوژیک سل در استان یزد که مهاجرت به داخل از استانهای جنوب شرق و کشور افغانستان دارد باشد. در مطالعه Chen و همکاران در چین و مطالعه Mancuso و همکاران در ایالات متحده شیوع عفونت سل نهفته در میان جمعیت عمومی به ترتیب 19/98% و 4/4% برآورد شده است (21,22). در مطالعه Rafiza و همکاران در مالزی و مطالعه Agaya و همکاران در کنیا فراوانی شیوع عفونت سل نهفته در کارکنان سلامت به ترتیب برابر 10/6% و 60% میباشد که به دلیل تفاوت در روند واکسیناسیون در دو کشور و سطح اقدامات مراقبتی میباشد (23,24). در ایران نیز شیوع عفونت سل نهفته تا حدود 38/9% گزارش شده است (20). Klote و همکاران در مطالعهای بیان کردند که خطر ابتلا به عفونت اولیه یا فعالسازی مجدد M. tuberculosis در بیماران پیوند کلیه در مقایسه با جمعیت عمومی بالاتر است (4). در همین رابطه در سایر مطالعات شیوع عفونت نهفته سل در بین بیماران تحت همودیالیز به ترتیب 34 - 13% برآورد شد (27-25،19). در مطالعه حاضر نیز در بین بیماران کاندید پیوند کلیه 51/5% از شرکتکنندگان تست پوستی مشکوک و 33/3% تست پوستی مثبت داشتند. TST در حال حاضر ابزار استاندارد برای تشخیص عفونت سل نهفته است. اختلال در واکنش سلولی ایمنی در بیماران مبتلا به آرتریت روماتوئید میتواند منجر به TST منفی کاذب شود (28). در مطالعه Agarwal و همکاران مشاهده شد که 20/4% از بیماران مبتلا به آرتریت روماتوئید، مبتلا به سل نهفته میباشند که از جمعیت عمومی کمتر است. نرخ پایینتر مثبت بودن تستهای مربوط به سل در بیماران مبتلا به آرتریت روماتوئید ممکن است به خود بیماری یا داروهای مورد استفاده برای آن نسبت داده شود. همچنین در این مطالعه بیان شده است که احتمالاً متوتروکسات بر پاسخ تست توبرکولین موثر نیست اگرچه حتی دوزهای پایین استروئید میتوانند نرخ پاسخ مثبت تست توبرکولین را کاهش دهند (12). در دو مطالعه میزان ابتلا به سل نهفته در بیماران مبتلا آرتریت روماتوئید حدود 28% گزارش شده است (29,30). در مطالعه حاضر نیز براساس تست TST ابتلا به عفونت سلی در 25/9% از بیماران تشخیص داده شد. بررسیها در مطالعه حاضر نیز نشان داد که در بیماران با درگیریهای روماتولوژی و درماتولوژی و بیماران کاندید پیوند کلیه فراوانی تستهای مثبت و مشکوک نسبت به سایر گروهها قابلتوجه است و لازم است جهت غربالگری و بیمارییابی در این زیر گروهها اقدامات بیشتری انجام شود و قبل از دریافت داروهای ایمونوساپرسیو تحت درمانهای لازم چند دارویی قرار بگیرند. در این مطالعه محدودیتهایی مالی وجود داشت و امکان بررسی ابتلا به بیماری سل با تستهای تشخیصی قویتر وجود نداشت. همچنین امکان غربالگری خانواده بیماران وجود نداشته است. با وجود همکاری کادر درمان و پزشکان با توجه به گسترده بودن بیماریهای مورد مطالعه و تفاوت در شیوههای درمان، داروهای دریافتی و شیوه ارزیابی امکان بررسی ارتباط شدت بیماری در حال حاضر با نتیجه تست TST وجود نداشت. با توجه به وجود افراد مبتلا به آرتریت روماتوئید در این مطالعه امکان دارد که نتایج تست TST تحت تاثیر این بیماری قرار گرفته باشد.
نتیجهگیری
با توجه به شیوع سل نهفته و میزان مرگومیر بالای ناشی از این بیماری لازم است که در گروه بیماران پرخطر دریافتکننده داروهای سرکوبگر سیستم ایمنی غربالگری با دقت بالایی انجام شود و سایر آزمونهای تشخیصی نیز استفاده شود. در مطالعه حاضر بیماران مبتلا به اختلالات روماتولوژی (116 نفر)، درماتولوژی (50 نفر) و افراد کاندید پیوند کلیه (56 نفر) با تست TST بالاتر از 5، فراوانی قابلتوجهی داشتند و در صورت دریافت داروهای تضعیف کننده سیستم ایمنی احتمال ابتلا به عفونت اولیه سل و فعالشدن سل نهفته بیشتر خواهد شد. بنابراین لازم است کارکنان سلامت به این موضوع دقت بیشتری داشته باشند.
سپاسگزاری
این مقاله از پایاننامه دکتری حرفهای نویسنده سوم، در گروه بیماریهای عفونی، دانشکده پزشکی، دانشگاه علوم پزشکی شهید صدوقی یزد به کد 6778 استخراج شد. از همه بیماران و پرسنل درمانی و اداری بیمارستان شهید صدوقی یزد که ما را در انجام این مطالعه یاری کردند، سپاسگزار هستیم.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد
تعارض در منافع: وجود ندارد.
References:
1- Sester U, Junker H, Hodapp T, Schütz A, Thiele B, Meyerhans A, et al. Improved Efficiency in Detecting Cellular Immunity Towards M. Tuberculosis in Patients Receiving Immunosuppressive drug Therapy. Nephrol Dial Transplant 2006; 21(11): 3258-68.
2- Chadha VK. Epidemiological Situation of Tuberculosis in India. J Indian Med Assoc 2003; 101(3): 144-7.
3- Dye C, Scheele S, Dolin P, Pathania V, Raviglione MC. Consensus Statement. Global Burden of Tuberculosis: Estimated Incidence, Prevalence, and Mortality by Country. WHO Global Surveillance and Monitoring Project. JAMA 1999; 282(7): 677-86.
4- Klote MM, Agodoa LY, Abbott K. Mycobacterium Tuberculosis Infection Incidence In Hospitalized Renal Transplant Patients in the United States, 1998–2000. Am J Transplant 2004; 4(9): 1523-8.
5- John GT, Shankar V, Abraham AM, Mukundan U, Thomas PP, Jacob CK. Risk Factors for Post-Transplant Tuberculosis. Kidney Int 2001; 60(3): 1148-53.
6- Sakhuja V, Jha V, Varma PP, Joshi K, Chugh KS. The High Incidence of Tuberculosis among Renal Transplant Recipients in India. Transplantation 1996; 61(2): 211-5.
7- Drain PK, Bajema KL, Dowdy D, Dheda K, Naidoo K, Schumacher SG, et al. Incipient and Subclinical Tuberculosis: A Clinical Review of Early Stages and Progression of Infection. Clin Microbiol Rev 2018; 31(4): e00021-18.
8- Halloran PF. Immunosuppressive drugs for Kidney Transplantation. N Engl J Med 2004; 351(26): 2715-29.
9- Shankar MS, Aravindan AN, Sohal PM, Kohli HS, Sud K, Gupta KL, et al. The Prevalence of Tuberculin Sensitivity and Anergy in Chronic Renal Failure in an Endemic Area: Tuberculin Test and the Risk of Post-Transplant Tuberculosis. Nephrol Dial Transplant 2005; 20(12): 2720-4.
10- Askling J, Fored CM, Brandt L, Baecklund E, Bertilsson L, Cöster L, et al. Risk and Case Characteristics of Tuberculosis in Rheumatoid Arthritis Associated with Tumor Necrosis Factor Antagonists in Sweden. Arthritis Rheum 2005; 52(7): 1986-92.
11- Yousif SS, Rasool MT. Screening for Latent Tuberculosis Infection at a Rheumatology and Medical Rehabilitation Center in Duhok City, Iraq. Medical Journal of Babylon 2021; 18(1): 23-7.
12- Agarwal S, Das SK, Agarwal GG, Srivastava R. Steroids Decrease Prevalence of Positive Tuberculin Skin Test in Rheumatoid Arthritis: Implications on Anti-TNF Therapies. Interdiscip Perspect Infect Dis 2014; 2014: 430134.
13- Zellweger JP, Sotgiu G, Corradi M, Durando P. The Diagnosis of Latent Tuberculosis Infection (LTBI): Currently Available Tests, Future Developments, and Perspectives to Eliminate Tuberculosis (TB). Med Lav 2020; 111(3): 170-83.
14- Huebner RE, Schein MF, Bass Jr JB. The Tuberculin Skin Test. Clin Infect Dis 1993: 17(6): 968-75.
15- Organization WH. Treatment of Tuberculosis: Guidelines. 4th ed. Geneva: World Health Organization; 2010.
16- Dye C, Scheele S, Pathania V, Raviglione MC. Global Burden of Tuberculosis: Estimated Incidence, Prevalence, and Mortality by Country. JAMA 1999; 282(7): 677-86.
17- Spence RK, Dafoe DC, Rabin G, Grossman RA, Naji A, Barker CF, et al. Mycobacterial Infections in Renal Allograft Recipients. Arch Surg 1983; 118(3): 356-9.
18- Horsburgh CR Jr. Priorities for the Treatment of Latent Tuberculosis Infection in the United States. N Engl J Med 2004; 350(20): 2060-7.
19- Bartalesi F, Vicidomini S, Goletti D, Fiorelli C, Fiori G, Melchiorre D, et al. Quantiferon-TB Gold and the TST are Both Useful for Latent Tuberculosis Infection Screening in Autoimmune Diseases. Eur Respir J 2009; 33(3): 586-93.
20- Rezai MS, Tabrizi R, Haghdoost AA, Afshari M, Abedi S, Akbari M, et al. Estimating the Prevalence of Positive Tuberculin Skin Test Reactions in General Population and High-Risk Groups: a Meta-Analysis. Int J Prev Med 2017; 8: 97.
21- Chen C, Zhu T, Wang Z, Peng H, Kong W, Zhou Y, et al. High Latent TB Infection Rate and Associated Risk Factors in the Eastern China of Low TB Incidence. PLoS One 2015; 10(10): e0141511.
22- Mancuso JD, Diffenderfer JM, Ghassemieh BJ, Horne DJ, Kao TC. The Prevalence of Latent Tuberculosis Infection in the United States. Am J Respir Crit Care Med 2016; 194(4): 501-9.
23- Rafiza S, Rampal KG, Tahir A. Prevalence and Risk Factors of Latent Tuberculosis Infection among Health Care Workers in Malaysia. BMC Infect Dis 2011; 11: 19.
24- Agaya J, Nnadi CD, Odhiambo J, Obonyo C, Obiero V, Lipke V, et al. Tuberculosis and Latent Tuberculosis Infection among Healthcare Workers in K Isumu, K Enya. Trop Med Int Health 2015; 20(12): 1797-804.
25- Foster R, Ferguson TW, Rigatto C, Lerner B, Tangri N, Komenda P. A Retrospective Review of the Two-Step Tuberculin Skin Test in Dialysis Patients. Can J Kidney Health Dis 2016; 3: 28.
26- Manuel O, Humar A, Preiksaitis J, Doucette K, Shokoples S, Peleg AY, et al. Comparison of Quantiferon‐TB Gold with Tuberculin Skin Test for Detecting Latent Tuberculosis Infection Prior to Liver Transplantation. Am J Transplant 2007; 7(12): 2797-801.
27- Seyhan EC, Sökücü S, Altin S, Günlüoğlu G, Trablus S, Yilmaz D, et al. Comparison of the Quantiferon‐TB Gold in‐Tube Test with the Tuberculin Skin Test for Detecting Latent Tuberculosis Infection in Hemodialysis Patients. Transpl Infect Dis 2010; 12(2): 98-105.
28- Tamborenea MN, Tate G, Mysler E, Debonis J, Schijedman A. Prevalence of Positive Ppd in a Cohort of Rheumatoid Arthritis Patients. Rheumatol Int 2010; 30(5): 613-6.
29- Ponce de León D, Acevedo-Vásquez E, Sánchez-Torres A, Cucho M, Alfaro J, Perich R, et al. Attenuated Response to Purified Protein Derivative in Patients with Rheumatoid Arthritis: Study in a Population with a High Prevalence of Tuberculosis. Ann Rheum Dis 2005; 64(9): 1360-1.
30- Köker IH, Pamuk ON, Karlikaya C, Tunçbilek N, Cakir N. A Low Prevalance of Purified Protein Derivative Test Positivity in Turkish Patients with Rheumatoid Arthritis. Association with Clinical Features and HRCT Findings. Clin Exp Rheumatol 2007; 25(1): 54-9.
نوع مطالعه: پژوهشي |
موضوع مقاله:
بیماری های عفونی
دریافت: 1402/2/21 | پذیرش: 1402/4/13 | انتشار: 1402/7/15
دریافت: 1402/2/21 | پذیرش: 1402/4/13 | انتشار: 1402/7/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




