دوره 31، شماره 11 - ( بهمن 1402 )
جلد 31 شماره 11 صفحات 7242-7235 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Jafari N, Mahmoudi S M, Lajevardi M B. Comparative Evaluation of Mast Cells in Lichen Planus and Oral Lichenoid Reaction with Giemsa Staining. JSSU 2024; 31 (11) :7235-7242
URL: http://jssu.ssu.ac.ir/article-1-5939-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5939-fa.html
جعفری نجمه، محمودی سیدمصطفی، لاجوردی محمدباقر. بررسی مقایسهای ماستسل ها در لیکنپلان و واکنش لیکنوئید دهانی با رنگآمیزی گیمسا. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (11) :7235-7242
متن کامل [PDF 748 kb]
(486 دریافت)
| چکیده (HTML) (1174 مشاهده)
References:
1- Neville BW, Damm DD, Allen C, Bouqot J. Oral and Maxillofacial Pathology. 4th ed. Philadelphia:W.B.Saunders; 2016: 928.
2- Regezi JA, Sciubba JJ, Jordan RCK. Oral Pathology - E-Book: Clinical Pathologic Correlations. 7th ed. Elsevier Health Sciences; 2011: 496.
3- Ismail SB, Kumar SK, Zain RB. Oral Lichen Planus and Lichenoid Reactions: Etiopathogenesis, Diagnosis, Management and Malignant Transformation. J Oral Sci 2007; 49(2): 89-106.
4- Nafarzadeh S, Seyed Majidi M, Siadati S, Bijani A, Nejad Moghaddam R. Comparative Study of Mast Cells in Lichen Planus and Oral Lichenoid Reaction with Toluidine Blue. J Res Dent Sci 2012; 9(1): 44-9.
5- Reddy DS, Sivapathasundharam B, Saraswathi TR, SriRam G. Evaluation of Mast Cells, Eosinophils, Blood Capillaries in Oral Lichen Planus and Oral Lichenoid Mucositis. Indian J Dent Res 2012; 23(5): 695-6.
6- Ghalayani P, Jahanshahi G, Saberi Z. Degranulated Mast Cells and TNF-Α in Oral Lichen Planus and Oral Lichenoid Reactions Diseases. Adv Biomed Res 2012; 1: 52.
7- Koochak Dezfouli M, Montazer F, Shiva A, Moosazadeh M, Biglari Abhari M, Alidoust H, et al. Evaluation of Mast Cell Count in Oral and Cutaneous Lichen Planus Lesions. Immunopathol Persa 2022; 8(1): e3.
8- Juneja M, Mahajan S, Rao NN, George T, Boaz K. Histochemical Analysis of Pathological Alterations in Oral Lichen Planus and Oral Lichenoid Lesions. J Oral Sci 2006; 48(4): 185-93.
9- Ramalingam S, Malathi N, Thamizhchelvan H, Sangeetha N, Rajan ST. Role of Mast Cells in Oral Lichen Planus and Oral Lichenoid Reactions. Autoimmune Dis 2018; 2018: 7936564.
10- Sharma R, Sircar K, Singh S, Rastogi V. Role of Mast Cells in Pathogenesis of Oral Lichen Planus. J Oral Maxillofac Pathol 2011; 15(3): 267-71.
11- Vadivel JK, Govindarajan M, Somasundaram E, Muthukrishnan A. Mast cell expression in oral lichen planus: A systematic review. J Investig Clin Dent 2019; 10(4): e12457.
12- Jahanshahi G, Ghalayani P, Maleki L. Mast Cells Distribution and Variations in Epithelium Thickness and Basement Membrane in Oral Lichen Planus Lesion and Oral Lichenoid Reaction. Dent Res J (Isfahan) 2012; 9(2): 180-4.
13- Janardhanan M, Ramesh V. Mast Cells in Oral Lichen Planus. J Oral Maxillofac Pathol 2010; 1(2): 976-1225.
14- Zhao ZZ, Savage NW, Sugerman PB, Walsh LJ. Mast Cell/T Cell Interactions in Oral Lichen Planus. J Oral Pathol Med 2002; 31(4): 189-95.
15- Zhao ZZ, Sugerman PB, Zhou XJ, Walsh LJ, Savage NW. Mast Cell Degranulation and the Role of T Cell RANTES in Oral Lichen Planus. Oral Dis 2001; 7(4): 246-51.
16- Walsh LJ, Savage NW, Ishii T, Seymour GJ. Immunopathogenesis of Oral Lichen Planus. J Oral Pathol Med 1990; 19(9): 389-96.
17- Zhao ZZ, Savage NW, Walsh LJ. Associations between Mast Cells and Laminin in Oral Lichen Planus. J Oral Pathol Med 1998; 27(4): 163-7.
متن کامل: (827 مشاهده)
مقدمه
لیکنپلان یک بیماری پوستی - مخاطی نسبتاً شایع و مزمن است که اغلب مخاط دهان را گرفتار میکند (1). این بیماری عموماً ایمنولوژیک در نظر گرفته میشود و اگرچه علت آن ناشناخته است، اما در تعدادی از بیماران آغازکنندههای احتمالی شامل مواد دندانی، استرس، داروها و عوامل عفونی نقش دارند. این ضایعه بهوسیله نفوذ شدید سلولهای T(CD4+ و بهویژه CD8+) در حد فاصل بافت همبند و اپیتلیوم شناخته میشود (2). این بیماری 1تا 2 درصد از جمعیت بزرگسال را درگیر میکند و شیوع آن در زنان بیشتر از مردان میباشد و اغلب در افراد بالای 40 سال رخ میدهد. شایعترین محلهای درگیری داخل دهانی شامل مخاط باکال، زبان و لثه میباشد. ضایعات لیکنپلان نمای بالینی متنوعی شامل رتیکولار، پاپولر، پلاک مانند، اروزیو، آتروفیک و بولوز دارند (3). شایعترین نمای بالینی، رتیکولار است که بهوسیله خطوط سفیدرنگ فراوان (خطوط ویکهام) با الگوی توری یا حلقوی مشخص میشود و ضایعات اغلب الگوی قرینه و دو طرفه دارند (2). لیکنپلان دهانی (OLP) از نظر میکروسکوپی با هایپرکراتوزیس، دژنرسانس سلولهای قاعدهای، ضخیم شدگی غشای پایه، واکوئولیزاسیون لایه بازال همراه با کراتینوسیتهای آپوپتوتیک و تجمع نواری شکل لنفوسیتهای زیر مخاطی مشخص میگردد (1,2). واکنشهای لیکنوئید دهانی (OLR) به ضایعاتی اطلاق میشود که از نظر بالینی و هیستوپاتولوژی مشابه OLP است اما علل بروز آن متفاوت میباشد. مشخصه این ضایعات، تظاهر بالینی یکطرفه، وجود حاشیه نازک و نامعلوم از تجمع التهابی زیراپیتلیوم و وجود تعداد قابلتوجهی از پلاسماسلها میباشد. این ضایعات واکنشی در اثر داروها، بیماریهای سیستمیک مثل هپاتیتC ، دیابت و واکنشهای آلرژیک نسبت به جیوه آمالگام، مواد غذایی، گلها و بیماریGVHD (واکنش پیوند علیه میزبان) رخ میدهد (4). ماستسلها، سلولهای التهابی حاضر در مخاط دهان و پوست هستند که نقش مهمی در واکنشهای التهابی و ایمنولوژیکی دارند (5). این سلولها در اطراف عروق خونی نزدیک غشای پایه سلولهای اندوتلیال حضور داشته و میتوانند با آزاد کردن مدیاتورهای موجود در گرانولهای خود شامل هیستامین، هپارین، کیماز، تریپتاز و TNF-aو... در واکنشهای التهابی ایفای نقش کنند. بهطور مثال TNF-aبا القای مولکول چسبندگی E-selectin بر سطح سلولهای اندوتلیالی، منجر به تسریع روند چسبندگی لنفوسیتها، نوتروفیلها و منوسیتها به سلولهای اندوتلیال میشود. E-selectin در بیماریهای التهابی مثل لیکنپلان، ژینژیویت، پالپیت حاد و ... بروز پیدا میکند (7،6). مطالعات صورت گرفته بر روی شمارش ماستسلها در ضایعات لیکنوئیدی و لیکن پلان، نشان دهنده نتایح متناقضی میباشد (11-8). با توجه به مشکلات تشخیصی در افتراق ضایعات لیکنپلان و واکنشهای لیکنوئیدی و تعداد محدود مطالعات انجام شده و نتایج متناقض در این زمینه، هدف مطالعه حاضر بررسی نقش ماستسلها در پاتوژنز این دو گروه از ضایعات بوده است.
روش بررسی
این مطالعه توصیفی – مقطعی در سال 1398 در دانشکده دندانپزشکی یزد انجام گرفت. پس از بررسی پروندههای بیماران مراجعه کننده به بخش پاتولوژی 26 بلوک از لیکنپلان دهانی و 26 بلوک از ضایعات واکنشی لیکنوئیدی (مجموعا 52) که حاوی بافت کافی بودند و 5 بلوک از فیبروم تحریکی (فاقد تغییرات لیکنوئیدی یا لیکنپلان) به عنوان گروه کنترل انتخاب شد. مقاطع 4 میکرومتری تهیه شده توسط گیمسا 1% در مدت زمانی30 دقیقه در دمای 37 درجه سانتیگراد رنگآمیزی شد. لامهای تهیه شده زیر میکروسکوپ نوری با بزرگنمایی 400× توسط دو نفر پاتولوژیست مشاهده و تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله در 5 منطقه تصادفی در نوار لنفوسیتیک زیر اپیتلیوم شمرده شد و برای هر اسلاید میانگین گرفته شد (7).
تجزیه و تحلیل آماری
پس از جمعآوری دادهها نتایج با استفاده از نرمافزار SPSS version 16 و آزمونهای آماری T-testو من ویتنی) mann-whithney) و کای اسکوئر تجزیه و تحلیل شد.
نتایج
مطالعه حاضر به منظور بررسی تعداد کل ماستسلها و ماستسلهای دگرانوله در 26 نمونه لیکنپلان دهانی و 26 نمونه ضایعات واکنشی لیکنوئیدی و 5 نمونه از فیبروم تحریکی به عنوان گروه کنترل انجام شد (شکل 1).
بررسی توزیع فراوانی گروههای مورد مطالعه نشان داد که لیکنپلان دهانی در سنین بالای 50 سال و ضایعات واکنشی لیکنوئیدی درگروه سنی 35 تا 49 شایعتر میباشند. هر دو گروه در زنان و مخاط باکال از شیوع بالاتری برخوردار بودند. شمارش تعداد کل ماستسلها بین گروههای مورد مطالعه نشان داد که میانگین تعداد کل ماستسلها در OLP (P=0/001) و OLR (P=0/004) نسبت به گروه کنترل بهطور معناداری بالاتر است .از سوی دیگر میانگین تعداد ماستسل در OLP بیشتر از OLR است ولی این اختلاف معنیدار نیست (P=1/000) .(جدول 1).
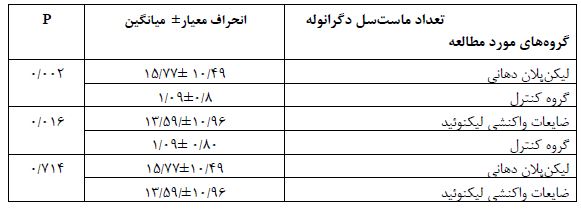
میانگین تعداد ماستسلهای دگرانوله در OLP (P=0/002) و ) OLR(P=0/016) نسبت به گروه کنترل بهطور معناداری بالاتر بود.
اختلاف میانگین ماستسل بین لیکنپلان و ضایعات واکنشی لیکنوئیدی معنیدار نبود ( 0/714=P)(جدول2).
در جدول3 مقایسه نسبت ماستسل دگرانوله به کل ماستسل بین گروههای مورد مطالعه اختلاف معنیداری را نشان نداد (P=0/108) .
مقایسه میانگین تعداد ماستسل در لیکنپلان دهانی بر اساس سن (P=0/875) ، جنس (P=0/367) و محل ضایعه (P=0/067) از نظر آماری معنیدار نشد. مقایسه میانگین ماستسل در ضایعات واکنشی لیکنوئیدی بر اساس سن (P=0/052) و محل ضایعه (P=0/738) معنیدار نشد ولی در زنان نسبت به مردان به صورت معنیداری (P=0/041) بالاتر بود.
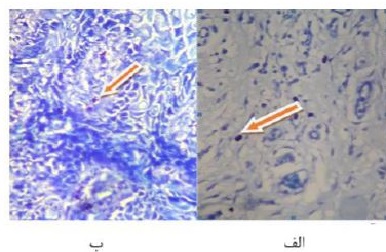
شکل 1: حضور ماستسل گرد تا بیضی با سیتوپلاسم ارغوانی تا بنفش به دو شکل
الف: گرانوله ( intact ) و ب : دگرانوله در نوار لنفوسیتیک زیر اپیتلیوم با بزرگنمایی 400x
جدول 1: مقایسه میانگین تعداد کل ماستسلها بین لیکن پلان، ضایعات واکنشی لیکنوئید و گروه کنترل

جدول 2: مقایسه میانگین تعداد ماستسلهای دگرانوله بین لیکنپلان، ضایعات واکنشی لیکنوئید و گروه کنترل
جدول 3: مقایسه نسبت ماستسلهای دگرانوله به کل ماستسلها بین لیکن پلان و ضایعات واکنشی لیکنوئید

بحث
لیکنپلان یک بیماری اتوایمیون با واسطه لنفوسیتهای T بهویژه(CD8+ ) سیتوتوکسیک میباشد که فعالیت این سلولها منجر به آپوپتوز سلولهای اپیتلیالی دهان میشود. OLR از نظر بالینی و هیستوپاتولوژیکی آنالوگ OLP محسوب میشوند ولی برخلاف آن، اکثرا یک طرفه هستند (9). این دو گروه ضایعات التهابی دهان همواره یک مشکل تشخیصی مهم برای پزشکان بودهاند (8). در تعدادی از مطالعات حضور ماستسلها در OLP و ضایعات التهابی مشخص شده است اما نقش آن بهطور دقیق در پاتوژنز این ضایعات شناخته شده نیست (9). نتیجه مطالعه حاضر نشان داد که تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله در دو گروه OLP و OLR در مقایسه با گروه کنترل بالاتر و این اختلاف از نظر آماری معنیدار بود. هر چند که رابطه دو گروه از ضایعات از نظر تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله معنی دار نبود .نتایج این مطالعه در شباهت و تناقض با تعدادی از مطالعات دیگر میباشد. نتایج مطالعه ما مشابه نتایج مطالعات (10)،Sharma (6) Ghlayani و (12) Jahanshahi میباشد. در این مطالعات همچون مطالعه حاضر تعداد کل ماستسلها بین OLP و OLR تفاوت معنیداری را نشان نداد. هر چند که در مطالعه (6) Ghlayani و (12) Jahanshahi تعداد ماستسلهای دگرانوله و نسبت ماستسلهای دگرانوله به کل ماستسلها تفاوت معنیداری را بین دو گروه مورد مطالعه نشان داد، که نتایج ما در نتاقض با این نتایج می باشد. از سوی دیگر در مطالعات (4) Nafarzadeh, (8)Juneja ، (9)Ramalingam ، (13)Janardhanan تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله در OLP نسبت به OLR به طور معنیداری بالاتر بود که در تضاد با نتایج مطالعه ما میباشد. از میان این مطالعات تنها در مطالعه نفرزاده نسبت ماستسلهای دگرانوله به کل ماستسلها رابطه معناداری نشان نداد اما در سایر مطالعات اختلاف این نسبت از نظر آماری معنیدار شد. که در این زمینه نتایج مطالعه ما مخالف با این مطالعات بود (4،8،9،13). در مطالعه ما همسو با سایر مطالعات تعداد کل ماستسلهای دو گروه OLP و OLR در مقایسه با گروه کنترل بهطور معنیداری بالاتر بود (4،6،8،9،10،12،13). در مطالعه حاضر علیرغم بالاتر بودن تعداد کل ماستسلها و ماستسلهای دگرانوله در OLP در مقایسه باOLR ، اما ارتباط معنی داری نشان داده نشد. در حالیکه در مطالعات (12) Jahanshahi و (8) Juneja این ارتباط معنیدار شد. محققان پیشنهاد میکنند به دلیل تفاوتهای شخصی و تفاوتهای موجود در محلهای مختلف حفره دهان در تعداد ماستسلها، نسبت ماستسلهای دگرانوله به کل ماستسلها به جای تعداد ماستسلهای دگرانوله، به عنوان یک مارکر تشخیصی در افتراق OLP از OLR استفاده شود. (6) Ghlayaniو (12) Jahanshahi به این نتیجه رسیدند که نسبت ماستسلهای دگرانوله به کل ماستسلها در OLR نسبت به OLP به طور معنیداری بالاتر میباشد. در مطالعه ما علیرغم بالاتر بودن این نسبت در OLR نسبت به OLP اما نتایج معنیداری از نظر آماری حاصل نشد. در سطح سلولی OLP وOLR ، ناشی از یک آپوپتوز کراتینوسیتهای لایه بازال توسط لنفوسیتهایT CD8+ سیتوتوکسیک در پاسخ به آنتی ژنهای سطحی کراتینوسیتها میباشند. دگرانوله شدن ماستسلها توسط دو مکانیسم انجام می شود: 1) فعال شدن لنفوسیت T از طریق تقابل با MHC کلاس I و II و در ادامه فعال شدن ماستسلها و دگرانوله شدن آنها 2) افزایش میزان کلسیم ثانویه به حضور کموکین که باعث دگرانوله شدن مستقیم ماستسل و آزاد شدن TNF_a و نهایتا منجر به فعال شدن لنفوسیتهای T میشود (10). این دو مکانیسم نشاندهنده تقابل لنفوسیت T و ماستسلها در پاتوژنز OLP و OLR می باشد. لنفوسیتهای T به دنبال فعالشدن RANTES و MMP ترشح میکنند.RANTES منجر به دگرانوله شدن ماستسلها و MMP منجر به آماده سازی اندوتلیوم جهت خارج شدن لنفوسیت T میشود (14). بالا بودن تعداد ماستسلها در OLP و OLR در مقایسه با گروه کنترل، نشان دهنده نقش ماستسلها در پاتوژنز این دو گروه از ضایعات با مکانیسم یکسان میباشد. با این تفاوت که فاکتور شروع کننده در OLP به خوبی مشخص نشده است، اما در OLR عواملی مانند غذا، دارو یا ترمیمهای دندانی و .. . به عنوان فاکتورهای شروع کننده احتمالی نقش دارند (10). به دنبال دگرانوله شدن ماستسلها، تعداد زیادی واسطههای پیش التهابی مانند هیستامین، TNF_a ، کیماز و تریپتاز آزاد میشود. هیستامین از طریق اتساع عروق و افزایش نفوذپذیری عروقی و TNF_a از طریق افزایش مولکولهای چسبندگی سلولی در سطح سلولهای اندوتلیال زمینه را برای اتصال و خروج لنفوسیت های T فراهم میکنند. تریپتاز منجر به تسریع فراخوانی لنفوسیتهای T شده و کیماز بهطور مستقیم یا غیر مستقیم با فعالکردن لنفوسیتهای T تولیدکننده و MMP راهی برای حمله لنفوسیتهای T CD8+ سیتوتوکسیک به اپیتلیوم و تخریب غشای پایه فراهم میکند (17-15). عدم دسترسی به نمونههای بیشتر، مشکلات مربوط در استفاده از نمونههای قدیمی و فراهم نبودن شرایط لازم در بهکارگیری تکنیکهای ایمونوهیستوشیمی به منظور رسیدن به نتایج دقیقتر از محدودیتهای مطالعه میباشد.
نتیجهگیری
نتایج مطالعه حاضر نشاندهنده نقش احتمالی ماستسلها در پاتوژنز OLP و OLR میباشد و تفاوت این دو ضایعه در فاکتورهای اتیولوژیک میباشد. معاینات بالینی و گرفتن تاریخچه مناسب میتواند نقش بهسزایی در افتراق این دو گروه از ضایعات داشته باشد. با توجه به نتایج این مطالعه تعداد ماستسلهای دگرانوله و نسبت ماستسلهای دگرانوله به کل ماستسلها نمیتواند کمک چندانی به افتراق این دو گروه از ضایعات بکند. با توجه به اینکه مطالعات بیشتری در این زمینه نیاز میباشد.
سپاسگزاری
مطالعه در آزمایشگاه دانشکده دندانپزشکی یزد انجام شده است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
ملاحظات اخلاقی
اطلاعات بیماران محرمانه حفظ شد. لازم به ذکر است که این مطالعه در «کمیته اخلاق در پژوهش دانشگاه علوم پزشکی شهید صدوقی یزد» به شماره IR.SSU.REC.1396.225 به تصویب رسیده است.
مشارکت نویسندگان
نجمه جعفری و سید مصطفی محمودی در ارائه ایده و در طراحی مطالعه، محمدباقر لاجوردی در جمعآوری دادهها، نجمه جعفری در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
لیکنپلان یک بیماری پوستی - مخاطی نسبتاً شایع و مزمن است که اغلب مخاط دهان را گرفتار میکند (1). این بیماری عموماً ایمنولوژیک در نظر گرفته میشود و اگرچه علت آن ناشناخته است، اما در تعدادی از بیماران آغازکنندههای احتمالی شامل مواد دندانی، استرس، داروها و عوامل عفونی نقش دارند. این ضایعه بهوسیله نفوذ شدید سلولهای T(CD4+ و بهویژه CD8+) در حد فاصل بافت همبند و اپیتلیوم شناخته میشود (2). این بیماری 1تا 2 درصد از جمعیت بزرگسال را درگیر میکند و شیوع آن در زنان بیشتر از مردان میباشد و اغلب در افراد بالای 40 سال رخ میدهد. شایعترین محلهای درگیری داخل دهانی شامل مخاط باکال، زبان و لثه میباشد. ضایعات لیکنپلان نمای بالینی متنوعی شامل رتیکولار، پاپولر، پلاک مانند، اروزیو، آتروفیک و بولوز دارند (3). شایعترین نمای بالینی، رتیکولار است که بهوسیله خطوط سفیدرنگ فراوان (خطوط ویکهام) با الگوی توری یا حلقوی مشخص میشود و ضایعات اغلب الگوی قرینه و دو طرفه دارند (2). لیکنپلان دهانی (OLP) از نظر میکروسکوپی با هایپرکراتوزیس، دژنرسانس سلولهای قاعدهای، ضخیم شدگی غشای پایه، واکوئولیزاسیون لایه بازال همراه با کراتینوسیتهای آپوپتوتیک و تجمع نواری شکل لنفوسیتهای زیر مخاطی مشخص میگردد (1,2). واکنشهای لیکنوئید دهانی (OLR) به ضایعاتی اطلاق میشود که از نظر بالینی و هیستوپاتولوژی مشابه OLP است اما علل بروز آن متفاوت میباشد. مشخصه این ضایعات، تظاهر بالینی یکطرفه، وجود حاشیه نازک و نامعلوم از تجمع التهابی زیراپیتلیوم و وجود تعداد قابلتوجهی از پلاسماسلها میباشد. این ضایعات واکنشی در اثر داروها، بیماریهای سیستمیک مثل هپاتیتC ، دیابت و واکنشهای آلرژیک نسبت به جیوه آمالگام، مواد غذایی، گلها و بیماریGVHD (واکنش پیوند علیه میزبان) رخ میدهد (4). ماستسلها، سلولهای التهابی حاضر در مخاط دهان و پوست هستند که نقش مهمی در واکنشهای التهابی و ایمنولوژیکی دارند (5). این سلولها در اطراف عروق خونی نزدیک غشای پایه سلولهای اندوتلیال حضور داشته و میتوانند با آزاد کردن مدیاتورهای موجود در گرانولهای خود شامل هیستامین، هپارین، کیماز، تریپتاز و TNF-aو... در واکنشهای التهابی ایفای نقش کنند. بهطور مثال TNF-aبا القای مولکول چسبندگی E-selectin بر سطح سلولهای اندوتلیالی، منجر به تسریع روند چسبندگی لنفوسیتها، نوتروفیلها و منوسیتها به سلولهای اندوتلیال میشود. E-selectin در بیماریهای التهابی مثل لیکنپلان، ژینژیویت، پالپیت حاد و ... بروز پیدا میکند (7،6). مطالعات صورت گرفته بر روی شمارش ماستسلها در ضایعات لیکنوئیدی و لیکن پلان، نشان دهنده نتایح متناقضی میباشد (11-8). با توجه به مشکلات تشخیصی در افتراق ضایعات لیکنپلان و واکنشهای لیکنوئیدی و تعداد محدود مطالعات انجام شده و نتایج متناقض در این زمینه، هدف مطالعه حاضر بررسی نقش ماستسلها در پاتوژنز این دو گروه از ضایعات بوده است.
روش بررسی
این مطالعه توصیفی – مقطعی در سال 1398 در دانشکده دندانپزشکی یزد انجام گرفت. پس از بررسی پروندههای بیماران مراجعه کننده به بخش پاتولوژی 26 بلوک از لیکنپلان دهانی و 26 بلوک از ضایعات واکنشی لیکنوئیدی (مجموعا 52) که حاوی بافت کافی بودند و 5 بلوک از فیبروم تحریکی (فاقد تغییرات لیکنوئیدی یا لیکنپلان) به عنوان گروه کنترل انتخاب شد. مقاطع 4 میکرومتری تهیه شده توسط گیمسا 1% در مدت زمانی30 دقیقه در دمای 37 درجه سانتیگراد رنگآمیزی شد. لامهای تهیه شده زیر میکروسکوپ نوری با بزرگنمایی 400× توسط دو نفر پاتولوژیست مشاهده و تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله در 5 منطقه تصادفی در نوار لنفوسیتیک زیر اپیتلیوم شمرده شد و برای هر اسلاید میانگین گرفته شد (7).
تجزیه و تحلیل آماری
پس از جمعآوری دادهها نتایج با استفاده از نرمافزار SPSS version 16 و آزمونهای آماری T-testو من ویتنی) mann-whithney) و کای اسکوئر تجزیه و تحلیل شد.
نتایج
مطالعه حاضر به منظور بررسی تعداد کل ماستسلها و ماستسلهای دگرانوله در 26 نمونه لیکنپلان دهانی و 26 نمونه ضایعات واکنشی لیکنوئیدی و 5 نمونه از فیبروم تحریکی به عنوان گروه کنترل انجام شد (شکل 1).
بررسی توزیع فراوانی گروههای مورد مطالعه نشان داد که لیکنپلان دهانی در سنین بالای 50 سال و ضایعات واکنشی لیکنوئیدی درگروه سنی 35 تا 49 شایعتر میباشند. هر دو گروه در زنان و مخاط باکال از شیوع بالاتری برخوردار بودند. شمارش تعداد کل ماستسلها بین گروههای مورد مطالعه نشان داد که میانگین تعداد کل ماستسلها در OLP (P=0/001) و OLR (P=0/004) نسبت به گروه کنترل بهطور معناداری بالاتر است .از سوی دیگر میانگین تعداد ماستسل در OLP بیشتر از OLR است ولی این اختلاف معنیدار نیست (P=1/000) .(جدول 1).
میانگین تعداد ماستسلهای دگرانوله در OLP (P=0/002) و ) OLR(P=0/016) نسبت به گروه کنترل بهطور معناداری بالاتر بود.
اختلاف میانگین ماستسل بین لیکنپلان و ضایعات واکنشی لیکنوئیدی معنیدار نبود ( 0/714=P)(جدول2).
در جدول3 مقایسه نسبت ماستسل دگرانوله به کل ماستسل بین گروههای مورد مطالعه اختلاف معنیداری را نشان نداد (P=0/108) .
مقایسه میانگین تعداد ماستسل در لیکنپلان دهانی بر اساس سن (P=0/875) ، جنس (P=0/367) و محل ضایعه (P=0/067) از نظر آماری معنیدار نشد. مقایسه میانگین ماستسل در ضایعات واکنشی لیکنوئیدی بر اساس سن (P=0/052) و محل ضایعه (P=0/738) معنیدار نشد ولی در زنان نسبت به مردان به صورت معنیداری (P=0/041) بالاتر بود.

شکل 1: حضور ماستسل گرد تا بیضی با سیتوپلاسم ارغوانی تا بنفش به دو شکل
الف: گرانوله ( intact ) و ب : دگرانوله در نوار لنفوسیتیک زیر اپیتلیوم با بزرگنمایی 400x
جدول 1: مقایسه میانگین تعداد کل ماستسلها بین لیکن پلان، ضایعات واکنشی لیکنوئید و گروه کنترل

جدول 2: مقایسه میانگین تعداد ماستسلهای دگرانوله بین لیکنپلان، ضایعات واکنشی لیکنوئید و گروه کنترل

جدول 3: مقایسه نسبت ماستسلهای دگرانوله به کل ماستسلها بین لیکن پلان و ضایعات واکنشی لیکنوئید

بحث
لیکنپلان یک بیماری اتوایمیون با واسطه لنفوسیتهای T بهویژه(CD8+ ) سیتوتوکسیک میباشد که فعالیت این سلولها منجر به آپوپتوز سلولهای اپیتلیالی دهان میشود. OLR از نظر بالینی و هیستوپاتولوژیکی آنالوگ OLP محسوب میشوند ولی برخلاف آن، اکثرا یک طرفه هستند (9). این دو گروه ضایعات التهابی دهان همواره یک مشکل تشخیصی مهم برای پزشکان بودهاند (8). در تعدادی از مطالعات حضور ماستسلها در OLP و ضایعات التهابی مشخص شده است اما نقش آن بهطور دقیق در پاتوژنز این ضایعات شناخته شده نیست (9). نتیجه مطالعه حاضر نشان داد که تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله در دو گروه OLP و OLR در مقایسه با گروه کنترل بالاتر و این اختلاف از نظر آماری معنیدار بود. هر چند که رابطه دو گروه از ضایعات از نظر تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله معنی دار نبود .نتایج این مطالعه در شباهت و تناقض با تعدادی از مطالعات دیگر میباشد. نتایج مطالعه ما مشابه نتایج مطالعات (10)،Sharma (6) Ghlayani و (12) Jahanshahi میباشد. در این مطالعات همچون مطالعه حاضر تعداد کل ماستسلها بین OLP و OLR تفاوت معنیداری را نشان نداد. هر چند که در مطالعه (6) Ghlayani و (12) Jahanshahi تعداد ماستسلهای دگرانوله و نسبت ماستسلهای دگرانوله به کل ماستسلها تفاوت معنیداری را بین دو گروه مورد مطالعه نشان داد، که نتایج ما در نتاقض با این نتایج می باشد. از سوی دیگر در مطالعات (4) Nafarzadeh, (8)Juneja ، (9)Ramalingam ، (13)Janardhanan تعداد کل ماستسلها و تعداد ماستسلهای دگرانوله در OLP نسبت به OLR به طور معنیداری بالاتر بود که در تضاد با نتایج مطالعه ما میباشد. از میان این مطالعات تنها در مطالعه نفرزاده نسبت ماستسلهای دگرانوله به کل ماستسلها رابطه معناداری نشان نداد اما در سایر مطالعات اختلاف این نسبت از نظر آماری معنیدار شد. که در این زمینه نتایج مطالعه ما مخالف با این مطالعات بود (4،8،9،13). در مطالعه ما همسو با سایر مطالعات تعداد کل ماستسلهای دو گروه OLP و OLR در مقایسه با گروه کنترل بهطور معنیداری بالاتر بود (4،6،8،9،10،12،13). در مطالعه حاضر علیرغم بالاتر بودن تعداد کل ماستسلها و ماستسلهای دگرانوله در OLP در مقایسه باOLR ، اما ارتباط معنی داری نشان داده نشد. در حالیکه در مطالعات (12) Jahanshahi و (8) Juneja این ارتباط معنیدار شد. محققان پیشنهاد میکنند به دلیل تفاوتهای شخصی و تفاوتهای موجود در محلهای مختلف حفره دهان در تعداد ماستسلها، نسبت ماستسلهای دگرانوله به کل ماستسلها به جای تعداد ماستسلهای دگرانوله، به عنوان یک مارکر تشخیصی در افتراق OLP از OLR استفاده شود. (6) Ghlayaniو (12) Jahanshahi به این نتیجه رسیدند که نسبت ماستسلهای دگرانوله به کل ماستسلها در OLR نسبت به OLP به طور معنیداری بالاتر میباشد. در مطالعه ما علیرغم بالاتر بودن این نسبت در OLR نسبت به OLP اما نتایج معنیداری از نظر آماری حاصل نشد. در سطح سلولی OLP وOLR ، ناشی از یک آپوپتوز کراتینوسیتهای لایه بازال توسط لنفوسیتهایT CD8+ سیتوتوکسیک در پاسخ به آنتی ژنهای سطحی کراتینوسیتها میباشند. دگرانوله شدن ماستسلها توسط دو مکانیسم انجام می شود: 1) فعال شدن لنفوسیت T از طریق تقابل با MHC کلاس I و II و در ادامه فعال شدن ماستسلها و دگرانوله شدن آنها 2) افزایش میزان کلسیم ثانویه به حضور کموکین که باعث دگرانوله شدن مستقیم ماستسل و آزاد شدن TNF_a و نهایتا منجر به فعال شدن لنفوسیتهای T میشود (10). این دو مکانیسم نشاندهنده تقابل لنفوسیت T و ماستسلها در پاتوژنز OLP و OLR می باشد. لنفوسیتهای T به دنبال فعالشدن RANTES و MMP ترشح میکنند.RANTES منجر به دگرانوله شدن ماستسلها و MMP منجر به آماده سازی اندوتلیوم جهت خارج شدن لنفوسیت T میشود (14). بالا بودن تعداد ماستسلها در OLP و OLR در مقایسه با گروه کنترل، نشان دهنده نقش ماستسلها در پاتوژنز این دو گروه از ضایعات با مکانیسم یکسان میباشد. با این تفاوت که فاکتور شروع کننده در OLP به خوبی مشخص نشده است، اما در OLR عواملی مانند غذا، دارو یا ترمیمهای دندانی و .. . به عنوان فاکتورهای شروع کننده احتمالی نقش دارند (10). به دنبال دگرانوله شدن ماستسلها، تعداد زیادی واسطههای پیش التهابی مانند هیستامین، TNF_a ، کیماز و تریپتاز آزاد میشود. هیستامین از طریق اتساع عروق و افزایش نفوذپذیری عروقی و TNF_a از طریق افزایش مولکولهای چسبندگی سلولی در سطح سلولهای اندوتلیال زمینه را برای اتصال و خروج لنفوسیت های T فراهم میکنند. تریپتاز منجر به تسریع فراخوانی لنفوسیتهای T شده و کیماز بهطور مستقیم یا غیر مستقیم با فعالکردن لنفوسیتهای T تولیدکننده و MMP راهی برای حمله لنفوسیتهای T CD8+ سیتوتوکسیک به اپیتلیوم و تخریب غشای پایه فراهم میکند (17-15). عدم دسترسی به نمونههای بیشتر، مشکلات مربوط در استفاده از نمونههای قدیمی و فراهم نبودن شرایط لازم در بهکارگیری تکنیکهای ایمونوهیستوشیمی به منظور رسیدن به نتایج دقیقتر از محدودیتهای مطالعه میباشد.
نتیجهگیری
نتایج مطالعه حاضر نشاندهنده نقش احتمالی ماستسلها در پاتوژنز OLP و OLR میباشد و تفاوت این دو ضایعه در فاکتورهای اتیولوژیک میباشد. معاینات بالینی و گرفتن تاریخچه مناسب میتواند نقش بهسزایی در افتراق این دو گروه از ضایعات داشته باشد. با توجه به نتایج این مطالعه تعداد ماستسلهای دگرانوله و نسبت ماستسلهای دگرانوله به کل ماستسلها نمیتواند کمک چندانی به افتراق این دو گروه از ضایعات بکند. با توجه به اینکه مطالعات بیشتری در این زمینه نیاز میباشد.
سپاسگزاری
مطالعه در آزمایشگاه دانشکده دندانپزشکی یزد انجام شده است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارند.
ملاحظات اخلاقی
اطلاعات بیماران محرمانه حفظ شد. لازم به ذکر است که این مطالعه در «کمیته اخلاق در پژوهش دانشگاه علوم پزشکی شهید صدوقی یزد» به شماره IR.SSU.REC.1396.225 به تصویب رسیده است.
مشارکت نویسندگان
نجمه جعفری و سید مصطفی محمودی در ارائه ایده و در طراحی مطالعه، محمدباقر لاجوردی در جمعآوری دادهها، نجمه جعفری در تجزیه و تحلیل دادهها مشارکت داشته و همه نویسندگان در تدوین، ویرایش اولیه و نهایی مقاله و پاسخگویی به سوالات مرتبط با مقاله سهیم هستند.
References:
1- Neville BW, Damm DD, Allen C, Bouqot J. Oral and Maxillofacial Pathology. 4th ed. Philadelphia:W.B.Saunders; 2016: 928.
2- Regezi JA, Sciubba JJ, Jordan RCK. Oral Pathology - E-Book: Clinical Pathologic Correlations. 7th ed. Elsevier Health Sciences; 2011: 496.
3- Ismail SB, Kumar SK, Zain RB. Oral Lichen Planus and Lichenoid Reactions: Etiopathogenesis, Diagnosis, Management and Malignant Transformation. J Oral Sci 2007; 49(2): 89-106.
4- Nafarzadeh S, Seyed Majidi M, Siadati S, Bijani A, Nejad Moghaddam R. Comparative Study of Mast Cells in Lichen Planus and Oral Lichenoid Reaction with Toluidine Blue. J Res Dent Sci 2012; 9(1): 44-9.
5- Reddy DS, Sivapathasundharam B, Saraswathi TR, SriRam G. Evaluation of Mast Cells, Eosinophils, Blood Capillaries in Oral Lichen Planus and Oral Lichenoid Mucositis. Indian J Dent Res 2012; 23(5): 695-6.
6- Ghalayani P, Jahanshahi G, Saberi Z. Degranulated Mast Cells and TNF-Α in Oral Lichen Planus and Oral Lichenoid Reactions Diseases. Adv Biomed Res 2012; 1: 52.
7- Koochak Dezfouli M, Montazer F, Shiva A, Moosazadeh M, Biglari Abhari M, Alidoust H, et al. Evaluation of Mast Cell Count in Oral and Cutaneous Lichen Planus Lesions. Immunopathol Persa 2022; 8(1): e3.
8- Juneja M, Mahajan S, Rao NN, George T, Boaz K. Histochemical Analysis of Pathological Alterations in Oral Lichen Planus and Oral Lichenoid Lesions. J Oral Sci 2006; 48(4): 185-93.
9- Ramalingam S, Malathi N, Thamizhchelvan H, Sangeetha N, Rajan ST. Role of Mast Cells in Oral Lichen Planus and Oral Lichenoid Reactions. Autoimmune Dis 2018; 2018: 7936564.
10- Sharma R, Sircar K, Singh S, Rastogi V. Role of Mast Cells in Pathogenesis of Oral Lichen Planus. J Oral Maxillofac Pathol 2011; 15(3): 267-71.
11- Vadivel JK, Govindarajan M, Somasundaram E, Muthukrishnan A. Mast cell expression in oral lichen planus: A systematic review. J Investig Clin Dent 2019; 10(4): e12457.
12- Jahanshahi G, Ghalayani P, Maleki L. Mast Cells Distribution and Variations in Epithelium Thickness and Basement Membrane in Oral Lichen Planus Lesion and Oral Lichenoid Reaction. Dent Res J (Isfahan) 2012; 9(2): 180-4.
13- Janardhanan M, Ramesh V. Mast Cells in Oral Lichen Planus. J Oral Maxillofac Pathol 2010; 1(2): 976-1225.
14- Zhao ZZ, Savage NW, Sugerman PB, Walsh LJ. Mast Cell/T Cell Interactions in Oral Lichen Planus. J Oral Pathol Med 2002; 31(4): 189-95.
15- Zhao ZZ, Sugerman PB, Zhou XJ, Walsh LJ, Savage NW. Mast Cell Degranulation and the Role of T Cell RANTES in Oral Lichen Planus. Oral Dis 2001; 7(4): 246-51.
16- Walsh LJ, Savage NW, Ishii T, Seymour GJ. Immunopathogenesis of Oral Lichen Planus. J Oral Pathol Med 1990; 19(9): 389-96.
17- Zhao ZZ, Savage NW, Walsh LJ. Associations between Mast Cells and Laminin in Oral Lichen Planus. J Oral Pathol Med 1998; 27(4): 163-7.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







