دوره 31، شماره 6 - ( شهریور 1402 )
جلد 31 شماره 6 صفحات 6717-6705 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Dadgar F, Rostamian A, Najafizadeh S R, Movaseghi S, Saffarian Z. New Insights into Pathogenesis, Diagnosis and Treatment of Psoriatic Arthritis. JSSU 2023; 31 (6) :6705-6717
URL: http://jssu.ssu.ac.ir/article-1-5920-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5920-fa.html
دادگر فرهاد، رستمیان عبدالرحمان، نجفیزاده سید رضا، موثقی شفیعه، صفاریان زهرا. بینش جدید در پاتوژنز، تشخیص و درمان آرتریت پسوریاتیک. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (6) :6705-6717
متن کامل [PDF 946 kb]
(565 دریافت)
| چکیده (HTML) (1541 مشاهده)
متن کامل: (1067 مشاهده)
مقدمه
آرتریت پسوریاتیک یک بیماری التهابی شایع اسکلت محیطی و محوری است. در سال 1964، آرتریت پسوریاتیک (PSA) به عنوان یک بیماری جداگانه توسط انجمن روماتیسم آمریکا (کالج روماتولوژی آمریکا) معرفی شد و اکنون به عنوان یکی از زیرگروههای طیف اسپوندیلوآرتروپاتی یا آرتریتهای سرونگاتیو طبقهبندی میشود که شامل شش زیرگروه هست (اسپوندیلیت آنکیلوزان، آرتریت واکنشی، آرتریت ناشی از بیماریهای التهابی روده، آرتریت پسوریاتیک، اسپوندیلوآرتروپاتی تمایزنیافته واسپوندیلوآرتروپاتی نوجوانان)(3-1). بیماری PSA تقریباً بهطور مساوی مردان و زنان را در سنین 40 تا 50 سال درگیر میکند. تقریباً 30 درصد بیماران سابقه درگیری خانوادگی دارند. تظاهرات بالینی بیماری بسیار متنوع بوده و در یک بیمار ممکن است الگوهای مختلفی دیده شود. الگوهای بالینی مشخص کننده آرتریت پسوریاتیک شامل درگیری مفصل اینترفالانژیال دیستال همراه با ناخن حفرهدار، درگیری مفاصل محوری، الیگوآرتروپاتی غیر قرینه، پلی آرتریت قرینه و آرتریت تخریبی شدید (موتیلان)است. با اینحال این الگوها اختصاصی نیستند و شروع درگیری مفصلی میتواند قبل یا بعد از شروع درگیری پوستی باشد (6-4). تغییرات ناخن در انگشتان دست یا پا در PSA بسیار شایع بوده و در ۹۰ درصد از موارد رخ میدهد. در حالیکه درگیر شدید و متوسط ناخن در پسوریازیس به تنهایی فقط در ۴۰ درصد از موارد دیده میشود. همچنین پسوریازیس پوستولی (پوسچولی) (Pustular Psoriasis) با آرتریت شدیدتری همراه است (3,7,8). مطالعات نشان میدهند که برای تشخیص دقیق تر PSA و افتراق از آرتریت روماتوئید میتوان از معیارهای طبقه بندی مانند CASPAR (معیارهای طبقهبندی آرتریت پسوریاتیک) استفاده کرد. معیارهای طبقهبندی CASPAR در تشخیص PSA از شواهدی نظیر الف- شواهد پسوریازیس ب- دیستروفی ناخن پسوریاتیک ج- آزمایش فاکتور روماتوئید منفی د- داکتیلیتیس (تورم انگشت دست یا انگشت پا) استفاده میکند. اما گاهی پسوریازیس "پنهان" است و به راحتی در نواحی مانند پوست سر و ناخنها شناسایی نمیشود این موارد نیز به احتمال زیاد با ایجاد PSA مرتبط هستند (9). راهنمای فعلی موسسه ملی سلامت و تعالی مراقبت برای مدیریت علائم پسوریازیس پیشنهاد میکند که پرسشنامه غربالگری و تعیین کیفیت زندگی و شدت بیماری به صورت سالانه توسط بیمار تکمیل شود تا بتوان به موقع شناسایی PSA انجام شود. از نگاه دیگر PSA یک بیماری چند سیستمی است و میتواند با یووئیت و بیماری التهابی روده همراه باشد که نیاز به مراقبتهای تخصصی مناسب دارد. بیماری همراه کلیدی دیگر در PSA، خطر بالای بیماری قلبی عروقی است که بهطور قابلتوجهی با خطر بالای سندرم متابولیک نیزهمراه است (10). مشخص شده است که 40% از بیماران PSA دارای سندرم متابولیک هستند که مدیریت موثر آن برای به حداقل رساندن عوارض و مرگ و میر بسیار کلیدی است (11,12). تا دو دهه گذشته، درمان های بسیار موثری برای PSA وجود نداشت. خوشبختانه، در سالهای اخیر، انقلابی در درمان های جدید با داروهای بیولوژیک رخ داده است که منجر به کنترل بهتر بیماری و عوارض متعاقب آن شده است. بنابراین تشخیص زودهنگام مهم است (13,14). این مقاله به بررسی یافتههای اخیر در پاتوژنزPSA، تشخیص زودهنگام بیماری و رویکردهای درمانی جدید میپردازد.
روش بررسی
این مقاله به بررسی یافتههای اخیر در پاتوژنز PSA، تشخیص زودهنگام بیماری و رویکردهای درمانی جدید میپردازد. برای انجام این مطالعه مقالات مرتبط با کلیدواژههای Psoriatic Arthritis, Screening tools, Pathogenesis, Treatment, Biomarkers از پایگاهدادههای معتبر Magiran, Scopus, Google Scholar, PubMed, ScienceDirect, Web of Science , Springer استخراج شدند. انتخاب اولیه مقالات بر اساس عنوان و بهروز بودن مقالات انجام شد و معیارهای ورود بر اساس بهروز بودن، اعتبار و در دسترسبودن متن کامل مقالات بر اساس کلیدواژههایی اصلی بود. ارزیابی اعتبارسنجی مقالات بر اساس scopus و یا ISC انجام شد. معیارهای خروج نیز عدم انطباق مقالات با کلیدواژههای مرتبط، نامه به سردبیر و گزارشات موردی بود.
پاتوژنز بیماری آرتریت پسوریازیس
در اتیولوژی بیماری PSA عوامل متعدد ژنتیکی، ایمونولوژیکی و محیطی دخیل است.
1-فاکتورهای محیطی
عوامل محیطی، از جمله عفونتها، ضربه، استرس، چاقی، و سیگار کشیدن در ایجاد آرتریت پسوریاتیک در افراد مستعد از نظر ژنتیکی، نقش دارند. برخی از مطالعات نشان میدهند که حدود 25 درصد از بیماران قبل از ظهور علائم PSA دارای تروما موضعی طولانیمدت بودند (15). علاوه براین وجود تروما در مفصل و استخوان در افراد دارای پسوریازیس به ترتیب با احتمال خطر 1به 50 و 1 به 46 برای ایجاد PSA همراه است (16). همچنین بین عفونت استرپتوکوک راه هوایی فوقانی و پسوریازیس روده ارتباطی دیده شده است به طوریکه سطوح بالایی از آنتیبادی آنتی دئوکسی ریبونوکلئاز B استرپتوکوک در افراد داری PSA یافت شده است (17). مطالعه مورد- شاهدی در سال 2011 نشان داد که درمعرض قرار گرفتن افراد دارای پسوریازیس در برابر عفونتهایی که برای درمان نیازمند مصرف آنتیبیوتیک هستند و یا صدماتی که مرتبط با بلند کردن وزنههای سنگین می باشد منجر به حساسیت ابتلا به PSA میشوند (18).
2-فاکتورهای ژنتیکی
بیماری PSA با HLA1 در ارتباط است. مطالعات نشان میدهند که HLA-B*27, HLA-B*38, HLA-B*08 و HLAB*39 با فنوتیپهای ایجاد شده در PSA مرتبط است (19,20). ژنهای گیرنده شبه ایمونوگلوبین سلول کشنده (KIR) ابتدا در اوایل دهه 2000 به عنوان ژن هایی که حساسیت به PSA را ایجاد میکنند، پیشنهاد شدند. بعدها، چاندران و همکاران ژن KIR2DS2، را به عنوان ژن کلیدی معرفی کردند، زیرا KIR با HLA-B Bw4 و HLA-Cبرای تقویت عفونت تعامل دارد (21,22). SNP های مرتبط با ژنهای عملکردی همچون سیگنالینگ NF-kB (TNIP1، NFKBIA و CARD14)، ژنهای دخیل در سیگنالینگIFN (IL28RA و TYK2)، تنظیم کننده سلولهایT ، (RUNX3، IL13، TAGAP، ETS1 و MBD2)، سسیگنالینگ های ضد ویروسی (IFIH1، DDX58، و RNF114) و ژنهای دخیل در مسیر IL-23 که با Th17 (TNFAIP3, IL23R, IL12B, TRAF3IP2, IL23A, STAT3) تعامل دارند به عنوان لوکوسهای حساسیت در PSA شناسایی شدهاند (23). همچنین لوکوسهای IL12B و IL23Rبه صورت مستقل با علائم PSA مرتبط هستند (23). مطالعات به روز شده نشان میدهند که تغییرات اپیژنتیکی نقش بالقوهای در شروع بیماری، فعالیت، پاسخ به درمان و پیشرفت بیماری PSA دارند (24,25). در واقع، متیلاسیون DNA ممکن است پایدارتر از بیان ژن باشد، به عنوان مثال مطالعهای که در سال 2022 انجام شد نشان داد که مکانهای متیله متفاوتی در خون محیطی وجود دارد که میتوانند PsA را از پسوریازیس متمایز کنند. این یافته نشان دهنده این است که متیلاسیون DNA یک نشانگر زیستی پیشبینیکننده بالقوه برای PsA میباشد (26).
3-فاکتورهای ایمونولوژیکی
مطالعات نشان میدهند که جمعیت سلولهای CD4+,CD8+ در سینوویال در PSA افزایش مییاید. از طرف دیگر رگزایی در سینوویال منجر به تسهیل مهاجرت لکوسیتها از خون به مفاصل ملتهب میشود. در این محل ترشح سایتوکائینهای التهابی رخ میدهد که در نهایت منجر به تخریب استخوان و غضروف مفصلی میشود (27). استرسهای ایجاد شده در پوست باعث آزاد شدنDNA متصل به پپتید آنتیباکتریال LL-37 میگردد این امر باعث تحریک سلول ویژه عرضه کننده آنتیژن (سلولهای دندریتیک) و آزاد شدن IFNα و تمایز Th1 وTh17 و در نهایت تولیدIL-12, IL-17, IL-22 و TFNα میگردد. هنگامیکه ضربه یا استرس بیومکانیکی در محل تاندون ایجاد میشود، IL-23 آزاد شده که سلولهای Th17 و سایتوکینهایی مانند IL-22 و TNF را فعال میکند و در نتیجه التهاب، فرسایش و تشکیل غیرطبیعی استخوان ایجاد میشود. IL-22 و سایر فاکتورها، سلولهای مزانشیمی را تحریک میکنند تا به استئوبلاستها تمایز پیدا کنند و در نهایت انتزوفیتها را در بافتهای محیطی و مفاصل و ﺳﯿﻨﺪﺳﻤﻮﻓﯿﺖها را در ستون فقرات تشکیل میدهند. همه این موارد منجر به سینوویت و تحلیل استخوان میشود. سلولهای مختلف ایمنی مانند نوتروفیلها، ماستسلها، ماکروفاژها و دنتریتیکسلها فاکتورهای پیش التهابی تولید میکنند که باعث فعال شدن سلولهای در حال گردش و سلولهای ساکن و فعالسازی سینوویوسیتها، کندروسیتها و استئوکلاستهای شبه فیبروبلاست میشود که به نوبه خود واسطههای پیشالتهابی بیشتری ترشح میکنند که میتوانند سلولهای ایمنی را در مفاصل جذب کنند و یک پاسخ التهابی دائمی ایجاد کنند. علاوه بر این، فیبروبلاستهای سینوویال ،آنزیمهای تجزیه کننده ماتریکس و RANKL ترشح میکنند که منجر به تخریب غضروف و تحلیل استخوان میشود. ریزمحیط سینوویال ملتهب منجر به التهاب مخاطی و تخریب مفصل میگردد (28,29). جدول یک نشان میدهد که هرکدام از اینترلوکینهای ترشحی در چه محلی و با چه عملکردی ترشح میشوند.
شناسایی زودهنگام آرتریت پسوریاتیک: مطالعات نشان داده است که تشخیص دیرهنگام PSA با عملکرد فیزیکی بدتری مرتبط است. Haroon و همکاران نشان دادند که حتی یک تأخیر ششماهه از شروع علائم تا اولین ویزیت توسط روماتولوژیست (تأخیر در مشاوره) منجر به پیامد بدتری برای بیماران همراه است بهطوریکه فرسایش مفصل محیطی، ساکروایلییت و نمرات بدتری از پرسشنامه ارزیابی سلامت (HAQ) مشاهده شد. همچنین فراوانی بیماریهای قلبی عروقی، دیابت، سندرم متابولیک و افسردگی در این بیماران بیشتر از دیگران مشاهده شد (30).
1-علائم کلینیکی و دستهبندی بیماران
تعداد زیادی از مطالعات نشان میدهند که تشخیص زودهنگام پسوریازیس میتواند از ابتلا به علایم مفصلی آرتریت پسوریازیس تا حدودی جلوگیری کند. برای مثال اگر بیشتر از سه بخش از بدن مبتلا به علائم پسوریازیس باشد ریسک ابتلا به آرتریت پسوریازیس حدود 2/2 برابر بیشتر میشود (30). مکانهای لزیونهای ایجاد شده دارای ریسکهای مختلفی از ابتلا به آرتریت پسوریازیس میباشد. یک مطالعه افزایش 3/98 برابری PSA را با ضایعات پوست سر و مطالعه دیگر افزایش 2/35 برابری را در ضایعات بین گلوتئال و پری آنال نشان داد. یک مطالعه آیندهنگر روی 464 بیمار مبتلا به پسوریازیس که در هنگام مراجعه به کلینیک تایید شد که آرتریت التهابی ندارند، نشان داد که 51 نفر طی یک پیگیری هشت ساله به PSA مبتلا شدند. در این مطالعات متغیرهای که به عنوان عوامل خطر برای ایجاد PSA یافت شدند، پسوریازیس شدید، سطح تحصیلات پایین و استفاده از رتینوئیدها بود (9,31,32). برای دسته بندی بیماران میتوان از معیار CASPAR استفاده کرد که تنها متخصصین روماتولوژیست میتوانند از آن به عنوان یک ابزار دقیق غربالگری استفاده کنند. برخی از ابزارهای غربالگری و حساسیت و اختصاصیت آنها در جدول دو آورده شده است:(39-33) حساسیت و اختصاصیت CASPAR بیش از 99 درصد میباشد (40) (جدول 3).
2-استفاده از تصویربرداری
سونوگرافی در تشخیص اولیه بیماران، خصوصاً آنهایی که علائم اولیه را ندارند بسیار سودمند است. در یکپایش دوساله از طریق سونوگرافی حدود سه نفر از 30 نفر فرد مبتلا به پسوریازیس، علائم آرتریت را نشان دادند. استفاده از CT اسکن نیز در تشخیص مناطق ملتهب و دژنراتیو کمککننده میباشد. به کمک MRI نیز میتوان فرسایش و ادم مغز استخوان را شناسایی نمود (41).
3-استفاده از بیومارکرها
بیومارکرها از اجزای زیستی سلول شامل محصولات ژنوم، ترنسکریپتوم و پروتئوم هستند که میتوانند با پاتوفیزیولوژی و علائم کلینیکی بیماری خاصی مرتبط باشند. انواع مختلفی از بیومارکرها در تشخیص بیماری، میزان فعالبودن بیماری، پاسخ به درمان و وجود بیماریهای همراه با آرتریت پسوریازیس استفاده میشوند که بهصورت کلی در دودسته بیومارکرهای ژنومیک (آللهای HLA) و بیومارکرهای محلول (CRP,ESR) طبقهبندی میشوند. جدول چهار (42).
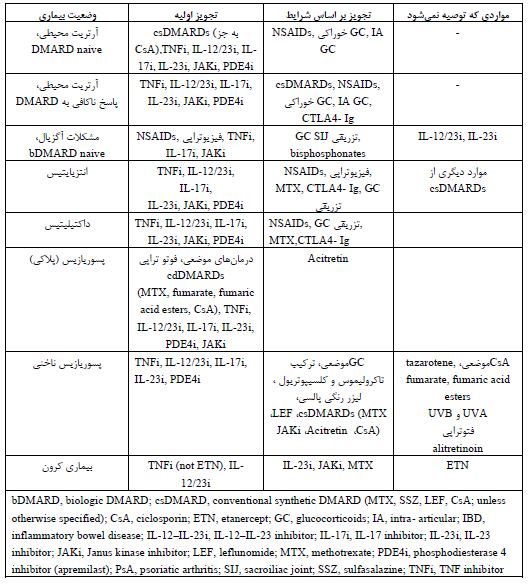
درمانهای دارویی بر اساس پیشنهاد گروه تحقیق و ارزیابی پسوریازیس و آرتریت پسوریاتیک 2021 (GRAPPA): تابهحال درمانهای مختلفی برای آرتریت پسوریازیس فعال شناخته شده است. برای شروع درمان دارویی لازم است که مناطق درگیر؛ مانند حضور پسوریازیس، درگیری ناخن، درگیری آگزیال، درگیری مفاصل محیطی، داکتیلیتیس و انتزیایتیس بررسی شود. هدف از درمان دارویی کمکردن فعالیت و شدت بیماری و افزایش کیفیت زندگی میباشد (1). درمانهای انتخابی براساس شرایط بیمار و پاسخ به دارو انعطافپذیر است و براساس شرایط تغییر میکند ولی بهطورکلی برای شروع درمان دارویی پسوریاریس و آرتریت میتوان از درمان دارویی مرسوم csDMARD (conventional synthetic DMARDs) استفاده کرد و یا تجویز bDMARD (biologic) یا tsDMARDs (targeted synthetic) به عنوان خط اول درمان دارویی پیشنهاد میشود (43). درمورد آرتریت محیطی طبق توصیه انجام شده در سال 2015، داروهای NSAID و گلوکوکورتیکوئیدهای داخل مفصلی و خوراکی برای تسکین علائم آرتریت محیطی بهصورت مشروط توصیه میشوند. استفاده از csDMARDs (متوترکسات، سولفاسالازین یا لفلونوماید) به شدت توصیه میشود. میتوان در بسیاری از شرایط، csDMARDs را به عنوان درمان خط اول دارویی استفاده کرد، (46-44). تعدادی از مطالعات نشان دادهاند که داروهای ضد تومور نکروز فاکتور (TNF) (به ویژه اتانرسپت، اینفلیکسیمب) و متوتروکسات اثرات مثبتی بر روی مفاصل و پوست دارند، التهاب را بهبود میبخشند، پیشرفت رادیوگرافی را کند میکنند و منجر به کیفیت زندگی بهتر میشوند، اگرچه تعدادی از عوارض جانبی مختلف گزارش شده است (47,48). برای بیمارانی که پاسخ ناکافی به csDMARDs دارند، شواهد زیادی مبنی بر استفاده از مهارکنندههای TNF، مهارکنندههای IL-17، مهارکنندههای IL-23 و مهارکنندههای JAK وجود دارد (43,48,49). مطالعه کارآزمایی بالینی که در سال 2023 انجام شد نشان داد که استفاده از مهارکنندههای JAK میتواند بر علایم شدید بیماری موثر باشد. نتایج اولیه از این مطالعه، کارآیی خوب و سریع و مشخصات ایمنی قابل قبول مهارکنندههای JAK (tofacitinib و upadacitinib)را در PsA گزارش کردهاند. (49). جدول پنج توصیههای دارویی را در وضعیتهای مختلف بیماری پیشنهاد میکند (43).
جدول 1: انواع سایتوکائین های ترشحی در آرتریت پسوریازیک
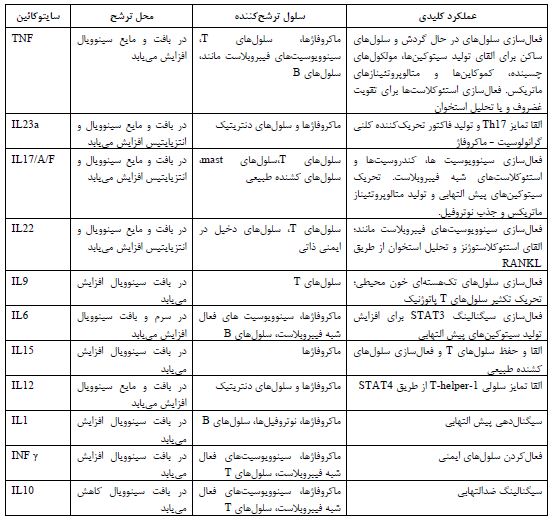
جدول 2: برخی از ابزارهای غربالگری در آرتریت پسوریازیس
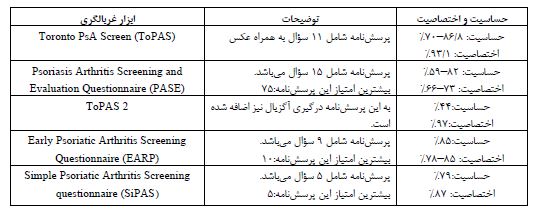
جدول 3: معیارهای CASPAR برای طبقهبندی آرتریت پسوریاتیک(بیماری مفصلی التهابی (مفاصل، ستون فقرات یا انتزی))
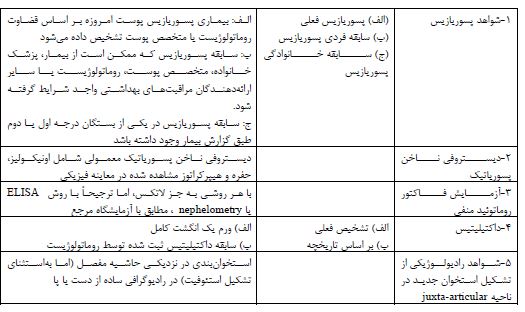
جدول 4: برخی از انواع بیومارکرهای مورداستفاده در آرتریت پسوریاتیک
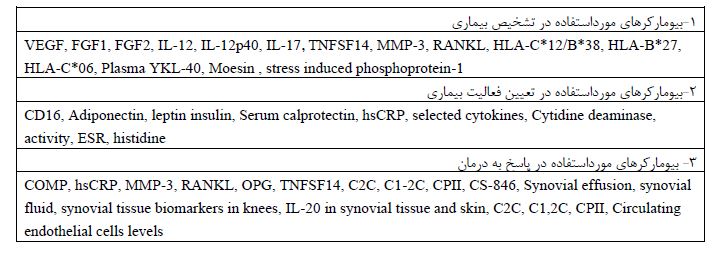
جدول 5: خلاصهای از توصیههای درمانی در آرتریت پسوریازیس
درمانهای دارویی در بیماریهای همراه بر اساس پیشنهاد GRAPPA 2021: پسوریازیس و آرتریت پسوریازیس هر دو با چندین بیماری مزمن مرتبط هستند که میتوانند بر انتخاب درمان، پاسخ به درمان، کیفیت زندگی و مرگومیر تأثیر بگذارند. کمیته فرعی بیماریهای همراه بیماریهایی را با پیوند خاصی با PSA مرتبط دانست. بیماریهای همراه بااهمیت ویژه در PSA عبارتاند از: بیماریهای قلبی عروقی (CVD)، چاقی، سندرم متابولیک، بیماری کبد (بهویژه بیماری کبد چرب)، اختلالات خلقی از جمله افسردگی و اضطراب، عفونتهای مزمن (هپاتیت B، هپاتیت C، HIV، سل و عفونتهای قارچی). بدخیمی (بهعنوانمثال، سرطان پوست و لنفوم)، پوکیاستخوان میباشد (1,32). مطالعات نشان میدهند که در تجویز دارو در بیماران مبتلا به بیماریهای همراه باید با احتیاط انجام شود. در بیماریهای قلبی عروقی، NSAIDsو داروهای مهارکننده JAK با احتیاط تجویز شود. در نارسایی احتقانی قلب و یا بیماریهای مرتبط با اختلال عصب ها و MSپیشنهاد میشود که از تجویز داروهای مهارکننده TNF پرهیز شود. در مبتلایان به کبد چرب و یا هپاتیت Bو هپاتیت C از تجویز methotrexate و leflunomide خودداری گردد. در HIV، سل و بدخیمی تجویز داروهای مهارکنندهTNF ,IL17 ,IL23 ,JAK ,PDE4 با احتیاط تجویز شود. در اختلالات خلقی از جمله افسردگی و اضطراب تجویز مهارکننده PDE4 با احتیاط انجام شود (43).
نتیجهگیری
افزایش شیوع بیماریهای غیرواگیر در کشور ما، همانند سایر کشورهای درحالتوسعه، سیستم نظام سلامت را با بار مضاعفی از بیماریهای غیرواگیر مواجه میسازد؛ لذا ایجاد ساختاری نظاممند که بتواند با این معضلات مقابله کند به شدت احساس میشود. بیماری آرتریت پسوریازیس یک بیماری غیرواگیر التهابی است که با علائم متنوعی ظاهر میشود. معمولاً علائم آرتریت پسوریازیس بعد از حضور پسوریازیس ایجاد میشود و ممکن است بیماران دارای بیماریهای همراه تهدیدکننده حیات باشند؛ لذا غربالگری و پایش بیماران باعث جلوگیری از پیشرفت بیماری شده و منجر به افزایش کیفیت زندگی میگردد. مطالعه ما نشان میدهد که ناهمگونی در علت ایجاد PSA یکی از دلایل اصلی مشکلات در طبقهبندی این طیف بیماری است. توضیح ناهمگونی این بیماری ممکن است بر تغییرات در عوامل ژنتیکی و محیطی متمرکز باشد. راهبردهای غربالگری (مثلاً معیارهای CASPAR و نشانگرهای زیستی) اولین قدم مهم در درمان اولیه میباشد. همچنین، درمانهای مختلفی برای کمک به کاهش مشکلات مفصلی، ضعف عضلانی و شدت بیماری در دسترس هستند. تشخیص فاکتورهای وابسته به PSA میتواند به مداخله زودهنگام این بیماران برای رفع نیازهای بالینی و پاراکلینیکی کمک کند. باتوجهبه پیشرفتهای اخیر و شناسایی پاتوژنز PSA، استفاده از بیومارکرهای مناسب، مصرف داروهای متناسب با علائم و ویژگیهای بیماری و بررسی شدت فعالیت بیماری و استفاده از ابزارهای غربالگری بهروز میتواند در راستای بهبود هرچه بیشتر این افراد کمککننده باشد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
آرتریت پسوریاتیک یک بیماری التهابی شایع اسکلت محیطی و محوری است. در سال 1964، آرتریت پسوریاتیک (PSA) به عنوان یک بیماری جداگانه توسط انجمن روماتیسم آمریکا (کالج روماتولوژی آمریکا) معرفی شد و اکنون به عنوان یکی از زیرگروههای طیف اسپوندیلوآرتروپاتی یا آرتریتهای سرونگاتیو طبقهبندی میشود که شامل شش زیرگروه هست (اسپوندیلیت آنکیلوزان، آرتریت واکنشی، آرتریت ناشی از بیماریهای التهابی روده، آرتریت پسوریاتیک، اسپوندیلوآرتروپاتی تمایزنیافته واسپوندیلوآرتروپاتی نوجوانان)(3-1). بیماری PSA تقریباً بهطور مساوی مردان و زنان را در سنین 40 تا 50 سال درگیر میکند. تقریباً 30 درصد بیماران سابقه درگیری خانوادگی دارند. تظاهرات بالینی بیماری بسیار متنوع بوده و در یک بیمار ممکن است الگوهای مختلفی دیده شود. الگوهای بالینی مشخص کننده آرتریت پسوریاتیک شامل درگیری مفصل اینترفالانژیال دیستال همراه با ناخن حفرهدار، درگیری مفاصل محوری، الیگوآرتروپاتی غیر قرینه، پلی آرتریت قرینه و آرتریت تخریبی شدید (موتیلان)است. با اینحال این الگوها اختصاصی نیستند و شروع درگیری مفصلی میتواند قبل یا بعد از شروع درگیری پوستی باشد (6-4). تغییرات ناخن در انگشتان دست یا پا در PSA بسیار شایع بوده و در ۹۰ درصد از موارد رخ میدهد. در حالیکه درگیر شدید و متوسط ناخن در پسوریازیس به تنهایی فقط در ۴۰ درصد از موارد دیده میشود. همچنین پسوریازیس پوستولی (پوسچولی) (Pustular Psoriasis) با آرتریت شدیدتری همراه است (3,7,8). مطالعات نشان میدهند که برای تشخیص دقیق تر PSA و افتراق از آرتریت روماتوئید میتوان از معیارهای طبقه بندی مانند CASPAR (معیارهای طبقهبندی آرتریت پسوریاتیک) استفاده کرد. معیارهای طبقهبندی CASPAR در تشخیص PSA از شواهدی نظیر الف- شواهد پسوریازیس ب- دیستروفی ناخن پسوریاتیک ج- آزمایش فاکتور روماتوئید منفی د- داکتیلیتیس (تورم انگشت دست یا انگشت پا) استفاده میکند. اما گاهی پسوریازیس "پنهان" است و به راحتی در نواحی مانند پوست سر و ناخنها شناسایی نمیشود این موارد نیز به احتمال زیاد با ایجاد PSA مرتبط هستند (9). راهنمای فعلی موسسه ملی سلامت و تعالی مراقبت برای مدیریت علائم پسوریازیس پیشنهاد میکند که پرسشنامه غربالگری و تعیین کیفیت زندگی و شدت بیماری به صورت سالانه توسط بیمار تکمیل شود تا بتوان به موقع شناسایی PSA انجام شود. از نگاه دیگر PSA یک بیماری چند سیستمی است و میتواند با یووئیت و بیماری التهابی روده همراه باشد که نیاز به مراقبتهای تخصصی مناسب دارد. بیماری همراه کلیدی دیگر در PSA، خطر بالای بیماری قلبی عروقی است که بهطور قابلتوجهی با خطر بالای سندرم متابولیک نیزهمراه است (10). مشخص شده است که 40% از بیماران PSA دارای سندرم متابولیک هستند که مدیریت موثر آن برای به حداقل رساندن عوارض و مرگ و میر بسیار کلیدی است (11,12). تا دو دهه گذشته، درمان های بسیار موثری برای PSA وجود نداشت. خوشبختانه، در سالهای اخیر، انقلابی در درمان های جدید با داروهای بیولوژیک رخ داده است که منجر به کنترل بهتر بیماری و عوارض متعاقب آن شده است. بنابراین تشخیص زودهنگام مهم است (13,14). این مقاله به بررسی یافتههای اخیر در پاتوژنزPSA، تشخیص زودهنگام بیماری و رویکردهای درمانی جدید میپردازد.
روش بررسی
این مقاله به بررسی یافتههای اخیر در پاتوژنز PSA، تشخیص زودهنگام بیماری و رویکردهای درمانی جدید میپردازد. برای انجام این مطالعه مقالات مرتبط با کلیدواژههای Psoriatic Arthritis, Screening tools, Pathogenesis, Treatment, Biomarkers از پایگاهدادههای معتبر Magiran, Scopus, Google Scholar, PubMed, ScienceDirect, Web of Science , Springer استخراج شدند. انتخاب اولیه مقالات بر اساس عنوان و بهروز بودن مقالات انجام شد و معیارهای ورود بر اساس بهروز بودن، اعتبار و در دسترسبودن متن کامل مقالات بر اساس کلیدواژههایی اصلی بود. ارزیابی اعتبارسنجی مقالات بر اساس scopus و یا ISC انجام شد. معیارهای خروج نیز عدم انطباق مقالات با کلیدواژههای مرتبط، نامه به سردبیر و گزارشات موردی بود.
پاتوژنز بیماری آرتریت پسوریازیس
در اتیولوژی بیماری PSA عوامل متعدد ژنتیکی، ایمونولوژیکی و محیطی دخیل است.
1-فاکتورهای محیطی
عوامل محیطی، از جمله عفونتها، ضربه، استرس، چاقی، و سیگار کشیدن در ایجاد آرتریت پسوریاتیک در افراد مستعد از نظر ژنتیکی، نقش دارند. برخی از مطالعات نشان میدهند که حدود 25 درصد از بیماران قبل از ظهور علائم PSA دارای تروما موضعی طولانیمدت بودند (15). علاوه براین وجود تروما در مفصل و استخوان در افراد دارای پسوریازیس به ترتیب با احتمال خطر 1به 50 و 1 به 46 برای ایجاد PSA همراه است (16). همچنین بین عفونت استرپتوکوک راه هوایی فوقانی و پسوریازیس روده ارتباطی دیده شده است به طوریکه سطوح بالایی از آنتیبادی آنتی دئوکسی ریبونوکلئاز B استرپتوکوک در افراد داری PSA یافت شده است (17). مطالعه مورد- شاهدی در سال 2011 نشان داد که درمعرض قرار گرفتن افراد دارای پسوریازیس در برابر عفونتهایی که برای درمان نیازمند مصرف آنتیبیوتیک هستند و یا صدماتی که مرتبط با بلند کردن وزنههای سنگین می باشد منجر به حساسیت ابتلا به PSA میشوند (18).
2-فاکتورهای ژنتیکی
بیماری PSA با HLA1 در ارتباط است. مطالعات نشان میدهند که HLA-B*27, HLA-B*38, HLA-B*08 و HLAB*39 با فنوتیپهای ایجاد شده در PSA مرتبط است (19,20). ژنهای گیرنده شبه ایمونوگلوبین سلول کشنده (KIR) ابتدا در اوایل دهه 2000 به عنوان ژن هایی که حساسیت به PSA را ایجاد میکنند، پیشنهاد شدند. بعدها، چاندران و همکاران ژن KIR2DS2، را به عنوان ژن کلیدی معرفی کردند، زیرا KIR با HLA-B Bw4 و HLA-Cبرای تقویت عفونت تعامل دارد (21,22). SNP های مرتبط با ژنهای عملکردی همچون سیگنالینگ NF-kB (TNIP1، NFKBIA و CARD14)، ژنهای دخیل در سیگنالینگIFN (IL28RA و TYK2)، تنظیم کننده سلولهایT ، (RUNX3، IL13، TAGAP، ETS1 و MBD2)، سسیگنالینگ های ضد ویروسی (IFIH1، DDX58، و RNF114) و ژنهای دخیل در مسیر IL-23 که با Th17 (TNFAIP3, IL23R, IL12B, TRAF3IP2, IL23A, STAT3) تعامل دارند به عنوان لوکوسهای حساسیت در PSA شناسایی شدهاند (23). همچنین لوکوسهای IL12B و IL23Rبه صورت مستقل با علائم PSA مرتبط هستند (23). مطالعات به روز شده نشان میدهند که تغییرات اپیژنتیکی نقش بالقوهای در شروع بیماری، فعالیت، پاسخ به درمان و پیشرفت بیماری PSA دارند (24,25). در واقع، متیلاسیون DNA ممکن است پایدارتر از بیان ژن باشد، به عنوان مثال مطالعهای که در سال 2022 انجام شد نشان داد که مکانهای متیله متفاوتی در خون محیطی وجود دارد که میتوانند PsA را از پسوریازیس متمایز کنند. این یافته نشان دهنده این است که متیلاسیون DNA یک نشانگر زیستی پیشبینیکننده بالقوه برای PsA میباشد (26).
3-فاکتورهای ایمونولوژیکی
مطالعات نشان میدهند که جمعیت سلولهای CD4+,CD8+ در سینوویال در PSA افزایش مییاید. از طرف دیگر رگزایی در سینوویال منجر به تسهیل مهاجرت لکوسیتها از خون به مفاصل ملتهب میشود. در این محل ترشح سایتوکائینهای التهابی رخ میدهد که در نهایت منجر به تخریب استخوان و غضروف مفصلی میشود (27). استرسهای ایجاد شده در پوست باعث آزاد شدنDNA متصل به پپتید آنتیباکتریال LL-37 میگردد این امر باعث تحریک سلول ویژه عرضه کننده آنتیژن (سلولهای دندریتیک) و آزاد شدن IFNα و تمایز Th1 وTh17 و در نهایت تولیدIL-12, IL-17, IL-22 و TFNα میگردد. هنگامیکه ضربه یا استرس بیومکانیکی در محل تاندون ایجاد میشود، IL-23 آزاد شده که سلولهای Th17 و سایتوکینهایی مانند IL-22 و TNF را فعال میکند و در نتیجه التهاب، فرسایش و تشکیل غیرطبیعی استخوان ایجاد میشود. IL-22 و سایر فاکتورها، سلولهای مزانشیمی را تحریک میکنند تا به استئوبلاستها تمایز پیدا کنند و در نهایت انتزوفیتها را در بافتهای محیطی و مفاصل و ﺳﯿﻨﺪﺳﻤﻮﻓﯿﺖها را در ستون فقرات تشکیل میدهند. همه این موارد منجر به سینوویت و تحلیل استخوان میشود. سلولهای مختلف ایمنی مانند نوتروفیلها، ماستسلها، ماکروفاژها و دنتریتیکسلها فاکتورهای پیش التهابی تولید میکنند که باعث فعال شدن سلولهای در حال گردش و سلولهای ساکن و فعالسازی سینوویوسیتها، کندروسیتها و استئوکلاستهای شبه فیبروبلاست میشود که به نوبه خود واسطههای پیشالتهابی بیشتری ترشح میکنند که میتوانند سلولهای ایمنی را در مفاصل جذب کنند و یک پاسخ التهابی دائمی ایجاد کنند. علاوه بر این، فیبروبلاستهای سینوویال ،آنزیمهای تجزیه کننده ماتریکس و RANKL ترشح میکنند که منجر به تخریب غضروف و تحلیل استخوان میشود. ریزمحیط سینوویال ملتهب منجر به التهاب مخاطی و تخریب مفصل میگردد (28,29). جدول یک نشان میدهد که هرکدام از اینترلوکینهای ترشحی در چه محلی و با چه عملکردی ترشح میشوند.
شناسایی زودهنگام آرتریت پسوریاتیک: مطالعات نشان داده است که تشخیص دیرهنگام PSA با عملکرد فیزیکی بدتری مرتبط است. Haroon و همکاران نشان دادند که حتی یک تأخیر ششماهه از شروع علائم تا اولین ویزیت توسط روماتولوژیست (تأخیر در مشاوره) منجر به پیامد بدتری برای بیماران همراه است بهطوریکه فرسایش مفصل محیطی، ساکروایلییت و نمرات بدتری از پرسشنامه ارزیابی سلامت (HAQ) مشاهده شد. همچنین فراوانی بیماریهای قلبی عروقی، دیابت، سندرم متابولیک و افسردگی در این بیماران بیشتر از دیگران مشاهده شد (30).
1-علائم کلینیکی و دستهبندی بیماران
تعداد زیادی از مطالعات نشان میدهند که تشخیص زودهنگام پسوریازیس میتواند از ابتلا به علایم مفصلی آرتریت پسوریازیس تا حدودی جلوگیری کند. برای مثال اگر بیشتر از سه بخش از بدن مبتلا به علائم پسوریازیس باشد ریسک ابتلا به آرتریت پسوریازیس حدود 2/2 برابر بیشتر میشود (30). مکانهای لزیونهای ایجاد شده دارای ریسکهای مختلفی از ابتلا به آرتریت پسوریازیس میباشد. یک مطالعه افزایش 3/98 برابری PSA را با ضایعات پوست سر و مطالعه دیگر افزایش 2/35 برابری را در ضایعات بین گلوتئال و پری آنال نشان داد. یک مطالعه آیندهنگر روی 464 بیمار مبتلا به پسوریازیس که در هنگام مراجعه به کلینیک تایید شد که آرتریت التهابی ندارند، نشان داد که 51 نفر طی یک پیگیری هشت ساله به PSA مبتلا شدند. در این مطالعات متغیرهای که به عنوان عوامل خطر برای ایجاد PSA یافت شدند، پسوریازیس شدید، سطح تحصیلات پایین و استفاده از رتینوئیدها بود (9,31,32). برای دسته بندی بیماران میتوان از معیار CASPAR استفاده کرد که تنها متخصصین روماتولوژیست میتوانند از آن به عنوان یک ابزار دقیق غربالگری استفاده کنند. برخی از ابزارهای غربالگری و حساسیت و اختصاصیت آنها در جدول دو آورده شده است:(39-33) حساسیت و اختصاصیت CASPAR بیش از 99 درصد میباشد (40) (جدول 3).
2-استفاده از تصویربرداری
سونوگرافی در تشخیص اولیه بیماران، خصوصاً آنهایی که علائم اولیه را ندارند بسیار سودمند است. در یکپایش دوساله از طریق سونوگرافی حدود سه نفر از 30 نفر فرد مبتلا به پسوریازیس، علائم آرتریت را نشان دادند. استفاده از CT اسکن نیز در تشخیص مناطق ملتهب و دژنراتیو کمککننده میباشد. به کمک MRI نیز میتوان فرسایش و ادم مغز استخوان را شناسایی نمود (41).
3-استفاده از بیومارکرها
بیومارکرها از اجزای زیستی سلول شامل محصولات ژنوم، ترنسکریپتوم و پروتئوم هستند که میتوانند با پاتوفیزیولوژی و علائم کلینیکی بیماری خاصی مرتبط باشند. انواع مختلفی از بیومارکرها در تشخیص بیماری، میزان فعالبودن بیماری، پاسخ به درمان و وجود بیماریهای همراه با آرتریت پسوریازیس استفاده میشوند که بهصورت کلی در دودسته بیومارکرهای ژنومیک (آللهای HLA) و بیومارکرهای محلول (CRP,ESR) طبقهبندی میشوند. جدول چهار (42).
درمانهای دارویی بر اساس پیشنهاد گروه تحقیق و ارزیابی پسوریازیس و آرتریت پسوریاتیک 2021 (GRAPPA): تابهحال درمانهای مختلفی برای آرتریت پسوریازیس فعال شناخته شده است. برای شروع درمان دارویی لازم است که مناطق درگیر؛ مانند حضور پسوریازیس، درگیری ناخن، درگیری آگزیال، درگیری مفاصل محیطی، داکتیلیتیس و انتزیایتیس بررسی شود. هدف از درمان دارویی کمکردن فعالیت و شدت بیماری و افزایش کیفیت زندگی میباشد (1). درمانهای انتخابی براساس شرایط بیمار و پاسخ به دارو انعطافپذیر است و براساس شرایط تغییر میکند ولی بهطورکلی برای شروع درمان دارویی پسوریاریس و آرتریت میتوان از درمان دارویی مرسوم csDMARD (conventional synthetic DMARDs) استفاده کرد و یا تجویز bDMARD (biologic) یا tsDMARDs (targeted synthetic) به عنوان خط اول درمان دارویی پیشنهاد میشود (43). درمورد آرتریت محیطی طبق توصیه انجام شده در سال 2015، داروهای NSAID و گلوکوکورتیکوئیدهای داخل مفصلی و خوراکی برای تسکین علائم آرتریت محیطی بهصورت مشروط توصیه میشوند. استفاده از csDMARDs (متوترکسات، سولفاسالازین یا لفلونوماید) به شدت توصیه میشود. میتوان در بسیاری از شرایط، csDMARDs را به عنوان درمان خط اول دارویی استفاده کرد، (46-44). تعدادی از مطالعات نشان دادهاند که داروهای ضد تومور نکروز فاکتور (TNF) (به ویژه اتانرسپت، اینفلیکسیمب) و متوتروکسات اثرات مثبتی بر روی مفاصل و پوست دارند، التهاب را بهبود میبخشند، پیشرفت رادیوگرافی را کند میکنند و منجر به کیفیت زندگی بهتر میشوند، اگرچه تعدادی از عوارض جانبی مختلف گزارش شده است (47,48). برای بیمارانی که پاسخ ناکافی به csDMARDs دارند، شواهد زیادی مبنی بر استفاده از مهارکنندههای TNF، مهارکنندههای IL-17، مهارکنندههای IL-23 و مهارکنندههای JAK وجود دارد (43,48,49). مطالعه کارآزمایی بالینی که در سال 2023 انجام شد نشان داد که استفاده از مهارکنندههای JAK میتواند بر علایم شدید بیماری موثر باشد. نتایج اولیه از این مطالعه، کارآیی خوب و سریع و مشخصات ایمنی قابل قبول مهارکنندههای JAK (tofacitinib و upadacitinib)را در PsA گزارش کردهاند. (49). جدول پنج توصیههای دارویی را در وضعیتهای مختلف بیماری پیشنهاد میکند (43).
جدول 1: انواع سایتوکائین های ترشحی در آرتریت پسوریازیک

جدول 2: برخی از ابزارهای غربالگری در آرتریت پسوریازیس

جدول 3: معیارهای CASPAR برای طبقهبندی آرتریت پسوریاتیک(بیماری مفصلی التهابی (مفاصل، ستون فقرات یا انتزی))

جدول 4: برخی از انواع بیومارکرهای مورداستفاده در آرتریت پسوریاتیک

جدول 5: خلاصهای از توصیههای درمانی در آرتریت پسوریازیس

درمانهای دارویی در بیماریهای همراه بر اساس پیشنهاد GRAPPA 2021: پسوریازیس و آرتریت پسوریازیس هر دو با چندین بیماری مزمن مرتبط هستند که میتوانند بر انتخاب درمان، پاسخ به درمان، کیفیت زندگی و مرگومیر تأثیر بگذارند. کمیته فرعی بیماریهای همراه بیماریهایی را با پیوند خاصی با PSA مرتبط دانست. بیماریهای همراه بااهمیت ویژه در PSA عبارتاند از: بیماریهای قلبی عروقی (CVD)، چاقی، سندرم متابولیک، بیماری کبد (بهویژه بیماری کبد چرب)، اختلالات خلقی از جمله افسردگی و اضطراب، عفونتهای مزمن (هپاتیت B، هپاتیت C، HIV، سل و عفونتهای قارچی). بدخیمی (بهعنوانمثال، سرطان پوست و لنفوم)، پوکیاستخوان میباشد (1,32). مطالعات نشان میدهند که در تجویز دارو در بیماران مبتلا به بیماریهای همراه باید با احتیاط انجام شود. در بیماریهای قلبی عروقی، NSAIDsو داروهای مهارکننده JAK با احتیاط تجویز شود. در نارسایی احتقانی قلب و یا بیماریهای مرتبط با اختلال عصب ها و MSپیشنهاد میشود که از تجویز داروهای مهارکننده TNF پرهیز شود. در مبتلایان به کبد چرب و یا هپاتیت Bو هپاتیت C از تجویز methotrexate و leflunomide خودداری گردد. در HIV، سل و بدخیمی تجویز داروهای مهارکنندهTNF ,IL17 ,IL23 ,JAK ,PDE4 با احتیاط تجویز شود. در اختلالات خلقی از جمله افسردگی و اضطراب تجویز مهارکننده PDE4 با احتیاط انجام شود (43).
نتیجهگیری
افزایش شیوع بیماریهای غیرواگیر در کشور ما، همانند سایر کشورهای درحالتوسعه، سیستم نظام سلامت را با بار مضاعفی از بیماریهای غیرواگیر مواجه میسازد؛ لذا ایجاد ساختاری نظاممند که بتواند با این معضلات مقابله کند به شدت احساس میشود. بیماری آرتریت پسوریازیس یک بیماری غیرواگیر التهابی است که با علائم متنوعی ظاهر میشود. معمولاً علائم آرتریت پسوریازیس بعد از حضور پسوریازیس ایجاد میشود و ممکن است بیماران دارای بیماریهای همراه تهدیدکننده حیات باشند؛ لذا غربالگری و پایش بیماران باعث جلوگیری از پیشرفت بیماری شده و منجر به افزایش کیفیت زندگی میگردد. مطالعه ما نشان میدهد که ناهمگونی در علت ایجاد PSA یکی از دلایل اصلی مشکلات در طبقهبندی این طیف بیماری است. توضیح ناهمگونی این بیماری ممکن است بر تغییرات در عوامل ژنتیکی و محیطی متمرکز باشد. راهبردهای غربالگری (مثلاً معیارهای CASPAR و نشانگرهای زیستی) اولین قدم مهم در درمان اولیه میباشد. همچنین، درمانهای مختلفی برای کمک به کاهش مشکلات مفصلی، ضعف عضلانی و شدت بیماری در دسترس هستند. تشخیص فاکتورهای وابسته به PSA میتواند به مداخله زودهنگام این بیماران برای رفع نیازهای بالینی و پاراکلینیکی کمک کند. باتوجهبه پیشرفتهای اخیر و شناسایی پاتوژنز PSA، استفاده از بیومارکرهای مناسب، مصرف داروهای متناسب با علائم و ویژگیهای بیماری و بررسی شدت فعالیت بیماری و استفاده از ابزارهای غربالگری بهروز میتواند در راستای بهبود هرچه بیشتر این افراد کمککننده باشد.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Kishimoto M, Deshpande GA, Fukuoka K, Kawakami T, Ikegaya N, Kawashima S, et al. Clinical Features of Psoriatic Arthritis. Best Pract Res Clin Rheumatol 2021; 35(2): 101670.
2- Dinulos J. Psoriasis and other Papulosquamous diseases. Habif's Clinical Dermatology. 7th ed. Philadelphia: PA; Elsevier: 2021: 6-7.
3- Moll JM, Wright V. Psoriatic Arthritis. Semin Arthritis Rheum 1973; 3(1): 55-78.
4- Samanta J, Chattopadhyay A, Sharma A. Psoriatic Arthritis Mutilans. QJM 2020; 113(10): 765-766.
5- Michelsen B, Fiane R, Diamantopoulos AP, Soldal DM, Hansen IJW, Sokka T, et al. A Comparison of disease Burden in Rheumatoid Arthritis, Psoriatic Arthritis and Axial Spondyloarthritis. PLoS One 2015; 10(4): e0123582.
6- Myers WA, Gottlieb AB, Mease P. Psoriasis and Psoriatic Arthritis: Clinical Features and Disease Mechanisms. Clin Dermatol 2006; 24(5): 438-47.
7- Krueger G, Ellis CN. Psoriasis—Recent Advances in Understanding its Pathogenesis and Treatment. J Am Acad Dermatol 2005; 53(1 Suppl 1): S94-100.
8- Jones SM, Armas JB, Cohen MG, Lovell CR, Evison G, McHugh NJ. Psoriatic Arthritis: Outcome of Disease Subsets and Relationship of Joint disease to Nail and Skin disease. Br J Rheumatol 1994; 33(9): 834-9.
9- Wilson FC, Icen M, Crowson CS, McEvoy MT, Gabriel SE, Kremers HM. Incidence and Clinical Predictors of Psoriatic Arthritis in Patients with Psoriasis: a Population‐Based Study. Arthritis Rheum 2009; 61(2): 233-9.
10- Shirani F, Khaleghi S, Nikfam M, Pourmojarab A. The Prevalence of Metabolic Syndrome in Psoriatic Arthritis Patients, a Hospital-Based Cross-Sectional Study on Iranian Population. Tehran Univ Med J 2016; 74(8): 569-577.
11- Foulkes AC, Chinoy H, Warren R. High Degree of Patient Satisfaction and Exceptional Feedback in a Specialist Combined Dermatology and Rheumatology Clinic. British Journal of Dermatology 2012.
12- Haroon M, Gallagher P, Heffernan E, FitzGerald O. High Prevalence of Metabolic Syndrome and of Insulin Resistance in Psoriatic Arthritis is Associated with the Severity of Underlying disease. J Rheumatol 2014; 41(7): 1357-65.
13- Caso F, Tasso M, Chimenti MS, Navarini L, Perricone C, Girolimetto N, et al. Late-Onset and Elderly Psoriatic Arthritis: Clinical Aspects and Management. Drugs Aging 2019; 36(10): 909-925.
14- Kumthekar A, Ashrafi M, Deodhar A. Difficult to Treat Psoriatic Arthritis—How Should We Manage? Clin Rheumatol 2023:1-15
15- Goupille P, Soutif D, Valat JP, Langevitz P, Buskila D, Gladman D. Psoriatic Arthritis Precipitated by Physical Trauma. J Rheumatol 1991; 18(4): 633.
16- Thorarensen SM, Lu N, Ogdie A, Gelfand JM, Choi HK, Love TJ. Physical Trauma Recorded in Primary Care is Associated with the Onset of Psoriatic Arthritis among Patients with Psoriasis. Ann Rheum Dis 2017; 76(3): 521-5.
17- Vasey FB, Deitz C, Fenske NA, Germain BF, Espinoza LR. Possible Involvement of Group a Streptococci in the Pathogenesis of Psoriatic Arthritis. J Rheumatol 1982; 9(5): 719-22.
18- Eder L, Law T, Chandran V, Shanmugarajah S, Shen H, Rosen CF, et al. Association between Environmental Factors and Onset of Psoriatic Arthritis in Patients with Psoriasis. Arthritis Care Res (Hoboken) 2011; 63(8): 1091-7.
19- FitzGerald O, Haroon M, Giles JT, Winchester R. Concepts of Pathogenesis in Psoriatic Arthritis: Genotype Determines Clinical Phenotype. Arthritis Res Ther 2015; 17(1): 11.
20- Tollefson MM, Crowson CS, McEvoy MT, Kremers HM. Incidence of Psoriasis in Children: a Population-Based Study. J Am Acad Dermatol 2010; 62(6): 979-87.
21- Nelson GW, Martin MP, Gladman D, Wade J, Trowsdale J, Carrington M. Cutting Edge: Heterozygote Advantage In Autoimmune Disease: Hierarchy Of Protection/Susceptibility Conferred by HLA and Killer Ig-Like Receptor Combinations in Psoriatic Arthritis. J Immunol 2004; 173(7): 4273-6.
22- Chandran V, Bull SB, Pellett FJ, Ayearst R, Pollock RA, Gladman DD. Killer-Cell Immunoglobulin-Like Receptor Gene Polymorphisms and Susceptibility to Psoriatic Arthritis. Rheumatology (Oxford) 2014; 53(2): 233-9.
23- Bowes J, Budu-Aggrey A, Huffmeier U, Uebe S, Steel K, Hebert HL, et al. Dense Genotyping of Immune-Related Susceptibility Loci Reveals New Insights into the Genetics of Psoriatic Arthritis. Nat Commun 2015; 6(1): 6046.
24- Rodríguez-Ubreva J, de la Calle-Fabregat C, Li T, Ballestar ML, Català-Moll F, Morante-Palacios O, et al. Inflammatory Cytokines Shape a Changing DNA Methylome in Monocytes Mirroring disease Activity in Rheumatoid Arthritis. Ann Rheum Dis 2019; 78(11): 1505-16.
25- Azuaga AB, Ramírez J, Cañete JD. Psoriatic Arthritis: Pathogenesis and Targeted Therapies. Int J Mol Sci 2023; 24(5): 4901.
26- Deng M, Su Y, Wu R, Li S, Zhu Y, Tang G, et al. DNA Methylation Markers in Peripheral Blood for Psoriatic Arthritis. J Dermatol Sci 2022; 108(1): 39-47.
27- De Vlam K, Gottlieb AB, Mease PJ. Current Concepts in Psoriatic Arthritis: Pathogenesis and Management. Acta Derm Venereol 2014; 94(6): 627-34.
28- Scrivo R, D’Angelo S, Carriero A, Castellani C, Perrotta FM, Conti F, et al. The Conundrum of Psoriatic Arthritis: a Pathogenetic and Clinical Pattern at the Midpoint of Autoinflammation and Autoimmunity. Clin Rev Allergy Immunol 2023; 65(1): 72-85.
29- Jongbloed SL, Lebre MC, Fraser AR, Gracie JA, Sturrock RD, Tak PP, et al. Enumeration and Phenotypical Analysis of Distinct Dendritic Cell Subsets in Psoriatic Arthritis and Rheumatoid Arthritis. Arthritis Res Ther 2005; 8(1):1-13.
30- Haroon M, Gallagher P, FitzGerald O. Diagnostic Delay of More than 6Months Contributes to Poor Radiographic and Functional Outcome in Psoriatic Arthritis. Ann Rheum Dis 2015; 74(6): 1045-50.
31- Reich K, Krüger K, Mössner R, Augustin M. Epidemiology and Clinical Pattern of Psoriatic Arthritis in Germany: a Prospective Interdisciplinary Epidemiological Study of 1511Patients with Plaque‐Type Psoriasis. Br J Dermatol 2009; 160(5): 1040-7.
32- Eder L, Haddad A, Rosen CF, Lee K-A, Chandran V, Cook R, et al. The Incidence and Risk Factors for Psoriatic Arthritis in Patients with Psoriasis: a Prospective Cohort Study. Arthritis Rheumatol 2016; 68(4): 915-23.
33- Chandran V, Schentag CT, Gladman DD. Sensitivity of the Classification of Psoriatic Arthritis Criteria in Early Psoriatic Arthritis Arthritis Rheum. Arthritis Rheum 2007; 57(8): 1560-3.
34- Chandran V, Schentag CT, Gladman DD. Sensitivity and Specificity of the CASPAR Criteria for Psoriatic Arthritis in a Family Medicine Clinic Setting. J Rheumatol 2008; 35(10): 2069-70.
35- Iragorri N, Hazlewood G, Manns B, Danthurebandara V, Spackman E. Psoriatic Arthritis Screening: a Systematic Review and Meta-Analysis. Rheumatology (Oxford) 2019; 58(4): 692-707.
36- Tinazzi I, Adami S, Zanolin EM, Caimmi C, Confente S, Girolomoni G, et al. The Early Psoriatic Arthritis Screening Questionnaire: a Simple and Fast Method for the Identification of Arthritis in Patients with Psoriasis. Rheumatology (Oxford) 2012; 51(11): 2058-63.
37- Burlando M, Cozzani E, Schiavetti I, Cicchelli S, Repetto M, Rossotto G, et al. The STRIPP Questionnaire (Screening Tool for Rheumatologic Investigation in Psoriatic Patients) as a New Tool for the Diagnosis of Early Psoriatic Arthritis. G Ital Dermatol Venereol 2020; 155(3): 294-8.
38- Salaffi F, Di Carlo M, Luchetti MM, Di Donato E, Campanati A, Benfaremo D, et al. A Validation Study of the Simple Psoriatic Arthritis Screening (Sipas) Questionnaire to Screen Psoriasis Patients for Psoriatic Arthritis. Clin Exp Rheumatol 2018; 36(1): 127-35.
39- Mishra S, Kancharla H, Dogra S, Sharma A. Comparison of Four Validated Psoriatic Arthritis Screening Tools in Diagnosing Psoriatic Arthritis in Patients with Psoriasis (COMPAQ Study). Br J Dermatol 2017; 176(3): 765-770.
40- Tillett W, Costa L, Jadon D, Wallis D, Cavill C, McHugh J, et al. The Classification for Psoriatic Arthritis (CASPAR) Criteria–A Retrospective Feasibility, Sensitivity, and Specificity Study. J Rheumatol 2012; 39(1): 154-6.
41- Tom S, Zhong Y, Cook R, Aydin SZ, Kaeley G, Eder L. Development of a Preliminary Ultrasonographic Enthesitis Score in Psoriatic Arthritis—GRAPPA Ultrasound Working Group. J Rheumatol 2019; 46(4): 384-90.
42- Generali E, Scirè CA, Favalli EG, Selmi C. Biomarkers in Psoriatic Arthritis: a Systematic Literature Review. Expert Rev Clin Immunol 2016; 12(6): 651-60.
43- Coates LC, Soriano ER, Corp N, Bertheussen H, Callis Duffin K, Campanholo CB, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): Updated Treatment Recommendations for Psoriatic Arthritis 2021. Nature Reviews Rheumatology 2022; 18(8): 465-79.
44- Coates LC, Helliwell PS. Methotrexate Efficacy in the Tight Control in Psoriatic Arthritis Study. J Rheumatol 2016; 43(2): 356-61.
45- Mease PJ, Gladman DD, Collier DH, Ritchlin CT, Helliwell PS, Liu L, et al. Etanercept and Methotrexate as Monotherapy or in Combination for Psoriatic Arthritis: Primary Results from a Randomized, Controlled Phase III Trial. Arthritis Rheumatol 2019; 71(7): 1112-24.
46- Vieira-Sousa E, Alves P, Rodrigues AM, Teixeira F, Tavares-Costa J, Bernardo A, et al. GO-DACT: a Phase 3b Randomised, Double-Blind, Placebo-Controlled Trial of Golimumab Plus Methotrexate (MTX) Versus Placebo Plus MTX in Improving Dactylitis in MTX-Naive Patients with Psoriatic Arthritis. Ann Rheum Dis 2020; 79(4): 490-8.
47- Gladman DD, Ritchlin C, Helliwell PS. Psoriatic Arthritis Clinical Registries and Genomics. Ann Rheum Dis 2005; 64(suppl2): ii103-ii5.
48- Sundanum S, Orr C, Veale D. Targeted Therapies in Psoriatic Arthritis—an Update. Int J Mol Sci 2023; 24(7): 6384.
49- Caso F, Costa L, Triggianese P, Maione F, Bertolini N, Vastarella M, et al. Recent Developments for New Investigational JAK Inhibitors in Psoriatic Arthritis. Expert Opin Investig Drugs 2023; 32(5): 361-371.
1- Kishimoto M, Deshpande GA, Fukuoka K, Kawakami T, Ikegaya N, Kawashima S, et al. Clinical Features of Psoriatic Arthritis. Best Pract Res Clin Rheumatol 2021; 35(2): 101670.
2- Dinulos J. Psoriasis and other Papulosquamous diseases. Habif's Clinical Dermatology. 7th ed. Philadelphia: PA; Elsevier: 2021: 6-7.
3- Moll JM, Wright V. Psoriatic Arthritis. Semin Arthritis Rheum 1973; 3(1): 55-78.
4- Samanta J, Chattopadhyay A, Sharma A. Psoriatic Arthritis Mutilans. QJM 2020; 113(10): 765-766.
5- Michelsen B, Fiane R, Diamantopoulos AP, Soldal DM, Hansen IJW, Sokka T, et al. A Comparison of disease Burden in Rheumatoid Arthritis, Psoriatic Arthritis and Axial Spondyloarthritis. PLoS One 2015; 10(4): e0123582.
6- Myers WA, Gottlieb AB, Mease P. Psoriasis and Psoriatic Arthritis: Clinical Features and Disease Mechanisms. Clin Dermatol 2006; 24(5): 438-47.
7- Krueger G, Ellis CN. Psoriasis—Recent Advances in Understanding its Pathogenesis and Treatment. J Am Acad Dermatol 2005; 53(1 Suppl 1): S94-100.
8- Jones SM, Armas JB, Cohen MG, Lovell CR, Evison G, McHugh NJ. Psoriatic Arthritis: Outcome of Disease Subsets and Relationship of Joint disease to Nail and Skin disease. Br J Rheumatol 1994; 33(9): 834-9.
9- Wilson FC, Icen M, Crowson CS, McEvoy MT, Gabriel SE, Kremers HM. Incidence and Clinical Predictors of Psoriatic Arthritis in Patients with Psoriasis: a Population‐Based Study. Arthritis Rheum 2009; 61(2): 233-9.
10- Shirani F, Khaleghi S, Nikfam M, Pourmojarab A. The Prevalence of Metabolic Syndrome in Psoriatic Arthritis Patients, a Hospital-Based Cross-Sectional Study on Iranian Population. Tehran Univ Med J 2016; 74(8): 569-577.
11- Foulkes AC, Chinoy H, Warren R. High Degree of Patient Satisfaction and Exceptional Feedback in a Specialist Combined Dermatology and Rheumatology Clinic. British Journal of Dermatology 2012.
12- Haroon M, Gallagher P, Heffernan E, FitzGerald O. High Prevalence of Metabolic Syndrome and of Insulin Resistance in Psoriatic Arthritis is Associated with the Severity of Underlying disease. J Rheumatol 2014; 41(7): 1357-65.
13- Caso F, Tasso M, Chimenti MS, Navarini L, Perricone C, Girolimetto N, et al. Late-Onset and Elderly Psoriatic Arthritis: Clinical Aspects and Management. Drugs Aging 2019; 36(10): 909-925.
14- Kumthekar A, Ashrafi M, Deodhar A. Difficult to Treat Psoriatic Arthritis—How Should We Manage? Clin Rheumatol 2023:1-15
15- Goupille P, Soutif D, Valat JP, Langevitz P, Buskila D, Gladman D. Psoriatic Arthritis Precipitated by Physical Trauma. J Rheumatol 1991; 18(4): 633.
16- Thorarensen SM, Lu N, Ogdie A, Gelfand JM, Choi HK, Love TJ. Physical Trauma Recorded in Primary Care is Associated with the Onset of Psoriatic Arthritis among Patients with Psoriasis. Ann Rheum Dis 2017; 76(3): 521-5.
17- Vasey FB, Deitz C, Fenske NA, Germain BF, Espinoza LR. Possible Involvement of Group a Streptococci in the Pathogenesis of Psoriatic Arthritis. J Rheumatol 1982; 9(5): 719-22.
18- Eder L, Law T, Chandran V, Shanmugarajah S, Shen H, Rosen CF, et al. Association between Environmental Factors and Onset of Psoriatic Arthritis in Patients with Psoriasis. Arthritis Care Res (Hoboken) 2011; 63(8): 1091-7.
19- FitzGerald O, Haroon M, Giles JT, Winchester R. Concepts of Pathogenesis in Psoriatic Arthritis: Genotype Determines Clinical Phenotype. Arthritis Res Ther 2015; 17(1): 11.
20- Tollefson MM, Crowson CS, McEvoy MT, Kremers HM. Incidence of Psoriasis in Children: a Population-Based Study. J Am Acad Dermatol 2010; 62(6): 979-87.
21- Nelson GW, Martin MP, Gladman D, Wade J, Trowsdale J, Carrington M. Cutting Edge: Heterozygote Advantage In Autoimmune Disease: Hierarchy Of Protection/Susceptibility Conferred by HLA and Killer Ig-Like Receptor Combinations in Psoriatic Arthritis. J Immunol 2004; 173(7): 4273-6.
22- Chandran V, Bull SB, Pellett FJ, Ayearst R, Pollock RA, Gladman DD. Killer-Cell Immunoglobulin-Like Receptor Gene Polymorphisms and Susceptibility to Psoriatic Arthritis. Rheumatology (Oxford) 2014; 53(2): 233-9.
23- Bowes J, Budu-Aggrey A, Huffmeier U, Uebe S, Steel K, Hebert HL, et al. Dense Genotyping of Immune-Related Susceptibility Loci Reveals New Insights into the Genetics of Psoriatic Arthritis. Nat Commun 2015; 6(1): 6046.
24- Rodríguez-Ubreva J, de la Calle-Fabregat C, Li T, Ballestar ML, Català-Moll F, Morante-Palacios O, et al. Inflammatory Cytokines Shape a Changing DNA Methylome in Monocytes Mirroring disease Activity in Rheumatoid Arthritis. Ann Rheum Dis 2019; 78(11): 1505-16.
25- Azuaga AB, Ramírez J, Cañete JD. Psoriatic Arthritis: Pathogenesis and Targeted Therapies. Int J Mol Sci 2023; 24(5): 4901.
26- Deng M, Su Y, Wu R, Li S, Zhu Y, Tang G, et al. DNA Methylation Markers in Peripheral Blood for Psoriatic Arthritis. J Dermatol Sci 2022; 108(1): 39-47.
27- De Vlam K, Gottlieb AB, Mease PJ. Current Concepts in Psoriatic Arthritis: Pathogenesis and Management. Acta Derm Venereol 2014; 94(6): 627-34.
28- Scrivo R, D’Angelo S, Carriero A, Castellani C, Perrotta FM, Conti F, et al. The Conundrum of Psoriatic Arthritis: a Pathogenetic and Clinical Pattern at the Midpoint of Autoinflammation and Autoimmunity. Clin Rev Allergy Immunol 2023; 65(1): 72-85.
29- Jongbloed SL, Lebre MC, Fraser AR, Gracie JA, Sturrock RD, Tak PP, et al. Enumeration and Phenotypical Analysis of Distinct Dendritic Cell Subsets in Psoriatic Arthritis and Rheumatoid Arthritis. Arthritis Res Ther 2005; 8(1):1-13.
30- Haroon M, Gallagher P, FitzGerald O. Diagnostic Delay of More than 6Months Contributes to Poor Radiographic and Functional Outcome in Psoriatic Arthritis. Ann Rheum Dis 2015; 74(6): 1045-50.
31- Reich K, Krüger K, Mössner R, Augustin M. Epidemiology and Clinical Pattern of Psoriatic Arthritis in Germany: a Prospective Interdisciplinary Epidemiological Study of 1511Patients with Plaque‐Type Psoriasis. Br J Dermatol 2009; 160(5): 1040-7.
32- Eder L, Haddad A, Rosen CF, Lee K-A, Chandran V, Cook R, et al. The Incidence and Risk Factors for Psoriatic Arthritis in Patients with Psoriasis: a Prospective Cohort Study. Arthritis Rheumatol 2016; 68(4): 915-23.
33- Chandran V, Schentag CT, Gladman DD. Sensitivity of the Classification of Psoriatic Arthritis Criteria in Early Psoriatic Arthritis Arthritis Rheum. Arthritis Rheum 2007; 57(8): 1560-3.
34- Chandran V, Schentag CT, Gladman DD. Sensitivity and Specificity of the CASPAR Criteria for Psoriatic Arthritis in a Family Medicine Clinic Setting. J Rheumatol 2008; 35(10): 2069-70.
35- Iragorri N, Hazlewood G, Manns B, Danthurebandara V, Spackman E. Psoriatic Arthritis Screening: a Systematic Review and Meta-Analysis. Rheumatology (Oxford) 2019; 58(4): 692-707.
36- Tinazzi I, Adami S, Zanolin EM, Caimmi C, Confente S, Girolomoni G, et al. The Early Psoriatic Arthritis Screening Questionnaire: a Simple and Fast Method for the Identification of Arthritis in Patients with Psoriasis. Rheumatology (Oxford) 2012; 51(11): 2058-63.
37- Burlando M, Cozzani E, Schiavetti I, Cicchelli S, Repetto M, Rossotto G, et al. The STRIPP Questionnaire (Screening Tool for Rheumatologic Investigation in Psoriatic Patients) as a New Tool for the Diagnosis of Early Psoriatic Arthritis. G Ital Dermatol Venereol 2020; 155(3): 294-8.
38- Salaffi F, Di Carlo M, Luchetti MM, Di Donato E, Campanati A, Benfaremo D, et al. A Validation Study of the Simple Psoriatic Arthritis Screening (Sipas) Questionnaire to Screen Psoriasis Patients for Psoriatic Arthritis. Clin Exp Rheumatol 2018; 36(1): 127-35.
39- Mishra S, Kancharla H, Dogra S, Sharma A. Comparison of Four Validated Psoriatic Arthritis Screening Tools in Diagnosing Psoriatic Arthritis in Patients with Psoriasis (COMPAQ Study). Br J Dermatol 2017; 176(3): 765-770.
40- Tillett W, Costa L, Jadon D, Wallis D, Cavill C, McHugh J, et al. The Classification for Psoriatic Arthritis (CASPAR) Criteria–A Retrospective Feasibility, Sensitivity, and Specificity Study. J Rheumatol 2012; 39(1): 154-6.
41- Tom S, Zhong Y, Cook R, Aydin SZ, Kaeley G, Eder L. Development of a Preliminary Ultrasonographic Enthesitis Score in Psoriatic Arthritis—GRAPPA Ultrasound Working Group. J Rheumatol 2019; 46(4): 384-90.
42- Generali E, Scirè CA, Favalli EG, Selmi C. Biomarkers in Psoriatic Arthritis: a Systematic Literature Review. Expert Rev Clin Immunol 2016; 12(6): 651-60.
43- Coates LC, Soriano ER, Corp N, Bertheussen H, Callis Duffin K, Campanholo CB, et al. Group for Research and Assessment of Psoriasis and Psoriatic Arthritis (GRAPPA): Updated Treatment Recommendations for Psoriatic Arthritis 2021. Nature Reviews Rheumatology 2022; 18(8): 465-79.
44- Coates LC, Helliwell PS. Methotrexate Efficacy in the Tight Control in Psoriatic Arthritis Study. J Rheumatol 2016; 43(2): 356-61.
45- Mease PJ, Gladman DD, Collier DH, Ritchlin CT, Helliwell PS, Liu L, et al. Etanercept and Methotrexate as Monotherapy or in Combination for Psoriatic Arthritis: Primary Results from a Randomized, Controlled Phase III Trial. Arthritis Rheumatol 2019; 71(7): 1112-24.
46- Vieira-Sousa E, Alves P, Rodrigues AM, Teixeira F, Tavares-Costa J, Bernardo A, et al. GO-DACT: a Phase 3b Randomised, Double-Blind, Placebo-Controlled Trial of Golimumab Plus Methotrexate (MTX) Versus Placebo Plus MTX in Improving Dactylitis in MTX-Naive Patients with Psoriatic Arthritis. Ann Rheum Dis 2020; 79(4): 490-8.
47- Gladman DD, Ritchlin C, Helliwell PS. Psoriatic Arthritis Clinical Registries and Genomics. Ann Rheum Dis 2005; 64(suppl2): ii103-ii5.
48- Sundanum S, Orr C, Veale D. Targeted Therapies in Psoriatic Arthritis—an Update. Int J Mol Sci 2023; 24(7): 6384.
49- Caso F, Costa L, Triggianese P, Maione F, Bertolini N, Vastarella M, et al. Recent Developments for New Investigational JAK Inhibitors in Psoriatic Arthritis. Expert Opin Investig Drugs 2023; 32(5): 361-371.
نوع مطالعه: مروری |
موضوع مقاله:
روماتولوژی
دریافت: 1401/10/29 | پذیرش: 1401/12/24 | انتشار: 1402/6/15
دریافت: 1401/10/29 | پذیرش: 1401/12/24 | انتشار: 1402/6/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







