BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
URL: http://jssu.ssu.ac.ir/article-1-5879-fa.html
سرطان به عنوان یکی از بزرگترین مشکلات سلامت عمومی و دومین عامل مرگ ومیر در جهان شناخته شده است. در حال حاضر درمانهای رایج برای این بیماری، جراحی، شیمیدرمانی و پرتودرمانی هستند. شـیمیدرمانی، بـه عنـوان یکـی از رایـجتـرین روشهـای درمان این بیماری شناخته میشود. امـا متأسـفانه یافتههای پیشین پژوهشگران، حـاکی از آن اسـت که اغلـب داروهـای شـیمیدرمـانی، دارای اثـرات جـانبی و سـمی هسـتند کـه موجـب اخـتلال در عملکـرد بافـتهـای سـالم از قبیـل کبـد و قلـب میشوند (1). یکی از شایعترین سرطانها بین زنان، سرطان سینه میباشد. شیوع سرطان سینه در بین خانمها در ایران 32% و در آمریکا 12/5% است (2،3). تحقیقات زیادی در سراسر دنیا به منظور درمان سرطان صورت گرفته است. از جمله داروهایی که بیش از 30 سال است برای درمان انواع سرطان مورد استفاده قرار میگیرد، دوکسوروبیسین میباشد. دوکسوروبیسین (DOX) یا آدریامایسین به عنوان یکی از اصلیترین و مؤثرترین داروهای این خانواده شناخته شده است (4) .اثرات سمی این داوری بسیار کارآمد استفاده از آن را محدود کرده است. در واقع اثبات شده است که DOX اثرات مخربی روی بافتهای مختلف بدن دارد (5). اما بزرگترین خطر سمیت ناشی از دوکسوروبیسین سمیت قلبی است که از تولید رادیکالهای آزاد به وجود میآید، زیرا قلب به دلیل تراکم بالای میتوکندری و نیاز به انرژی بیشتر نسبت به بقیه بافتها، حساسیت بیشتری به پراکسیداسیون لیپیدی و القای مرگ برنامهریزی شده (Apoptosis ) ناشی از دوکسوروبیسین دارد. همچنین فقدان آنزیمهای آنتیاکسیدانی مورد نیاز برای سمزدایی آنیونهای دیسموتاز و هیدروژن پراکسید در بافت باعث تولید و تجمع رادیکالهای آزاد شده و در نتیجه منجر به پراکسید اسیون لیپید، تخریب گسترده غشاء، شبکه اندوپلاسمیک و اسیدنوکلئیک میتوکندری میشود (6،7). مکانیسم ایجاد سمیت قلبی توسطDOX با مکانیسم اثرات ضد توموری آن متفاوت بوده و عمدتاً شامل افزایش استرس اکسیداتیو در بافت قلبی است که افزایش تولید گونههای واکنشگر اکسیژن و افزایش پراکسیداسیون لیپیدی تأیید کننده آن است (8،9). لذا حذف و کاهش این عوامـل مخرب، توسط یک سـازوکـار محـافظتی بـه نـام سیستم دفاع ضداکسایشی صـورت مـیگیـرد؛ کـه ترکیبــی از آنتیاکسیدانتهــای آنزیمــی و غیرآنزیمی نظیر گلوتاتیون پراکسیداز (GPX) ، کاتالاز (Cat)و سوپراکسیددیسموتاز (SOD) است که با همدیگر با اثرات مسمومیت ناشی از داروی دوکسوروبیسین مقابله میکنند (10،11). آنتیاکسیدانها میتوانند با مکانیسمهای متعددی مانند: برداشت اکسیژن یا کاهش غلظت موضعی اکسیژن، برداشت یونهای فلزی کاتالیتیک مانند و و برداشت گونههای فعال اکسیژن مانند سوپراکسید و هیدروژن پراکسید (H2O2) عمل نمایند. استرس اکسیداتیو در محیط سلولی منجر به تشکیل لیپید پراکسیدهای ناپایدار و واکنشگر میشود. یکی از مهمترین محصولات حاصل از پراکسیداسیون لیپیدها، مالون دی آلدئید است (MDA)که بسیار مورد توجه بوده و به عنوان نشانگر اصلی استرس اکسیداتیو محسوب میشود (12) استراتژیهای مختلفی جهت کاهش اثرات سمی دوکسوروبیسین بر بافتهای غیر هدف به کار گرفته شده است که از این بین میتوان به استفاده از گیاهان دارویی، رژیم غذایی و نیز انواع مختلف تمرینات طولانیمدت با هدف افزایش سطح آنتیاکسیدانی بافت اشاره کرد نتایج حاصل از این پژوهشها بهطور کلی دو راهبرد استفاده از تمرینات ورزشی و دارودرمانی را جهت حل این مشکل پیشنهاد کردهاند اما در حال حاضر هیچ ایده کلی در مورد بهترین روش برای جلوگیری از سمیت سلولی ناشی از DOX وجود ندارد بنابراین انجام تحقیقات بیشتر در زمینه آسیبشناسی مولکولی ناشی ازDOX ، برای ایجاد راهکارهای لازم جهت پیشگیری از سمیت ناشی از آن در حال انجام است (13) .از اینرو، پژوهش حاضر با هدف بررسی تأثیر تمرین هوازی به عنوان روشی موثر در دفاع آنتیاکسیدانی داخلی و کورکومین به عنوان یک آنتیاکسیدان خارجی بر مسمومیت قلبی ناشی از مصرف دوکسوروبیسین روی سطح آنزیمهای آنتیاکسیدانی کاتالاز، سوپراکسید دیسموتاز، گلوتاتیون و مالون دی آلدئید و پروتئینهای آپوپتوزی که بسیار مورد توجه بوده میباشد.
روش بررسی
تحقیق حاضر از نوع کاربردی و از لحاظ کنترل متغیرها به صورت تجربی و از حیث مکان اجرا، آزمایشگاهی بوده است در ابتدا اقدام به کسب مجوزهای لازم شد که در همه مراحل اجرای این پژوهش، قواعد مربوط به اصول کار با حیوانات آزمایشگاهی رعایت شد و سپس مطابق با دستورالعمل انجمن ایرانیان حمایت از حیوانات آزمایشگاهی موشها در قفسهایی به صورت جداگانه نگهداری شدند. در این پژوهش 36 موش ماده بالب سی Balb /c با سن شش تا هفت هفته از حیوانخانۀ انستیتو پاستور ایران (کرج) خریداری شدند. حیوانات در شرایط استاندارد 12 ساعت تاریکی و 12 ساعت روشنائی نگهداری شدند و دسترسی آزاد به آب و غذا داشتند. در تمام مراحل آزمایش تلاش شد کمترین استرس و درد به حیوانات اعمال شود.
طرح آزمایشی: برای سازگاری حیوانات به محیط، آنها به مدت یک هفته در محیط آزمایشگاه و درون قفس نگهداری شدند. در این مدت حیوانات برای آشنایی، روی نوارگردان ویژه جوندگان با سرعت 8 متر در دقیقه به مدت 10 دقیقه در روز و بهمدت 5 روزدر هفته راه رفتند. پس از این دوره، حیوانات به صورت تصادفی در یکی از 6 گروه بهطور مساوی ترتیب زیر قرار گرفتند: (جدول 1)
جدول 1: گروه موشهای مورد بررسی در این تحقیق
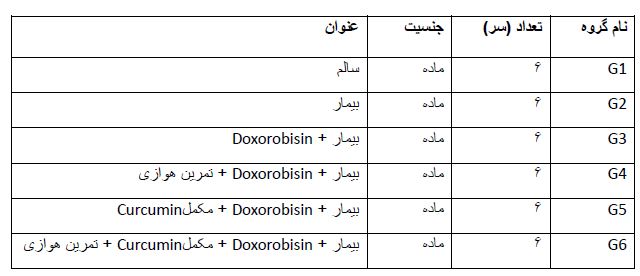
1- گروه کنترل سالم یا(CO) Healthy Control: در این گروه حیوانات سالم بدون هیچ مداخلهای مورد بررسی قرار گرفتند.
2- گروه بیمار کنترل یا Control disease: در این گروه از طریق القای سرطان پستان از رده سلولی 4T1 به وسیله تزریق یک میلیون سلول به صورت زیر جلدی به ناحیه پشت (برای جلوگیری از دسترسی و لمس تومور توسط حیوان) سلولهای سرطانی در پشت بین دوکتف تزریق و پس از 10 الی 14روز تومور سرطانی ایجاد شد.
3- گروه بیمار + مصرف دوکسوربیسین یاDisease group and doxorbicin consumptionدر این گروه حیوانات پس از سرطانی شدن (2 mg/Kg/day)، به مدت 6 هفته به صورت زیرصفافی و در روزهای 28،21،14،7،1و35 داروی دوکسوروبیسینEbedoxo (Doxorubicin) 50mg/ml ساخت شرکتEBEWE Pharma(AUSTRIA) را دریافت نمودند.
4- گروه بیمار دوکسوروبیسین + تمرین Doxorubicin disease group and exercise در این گروه حیوانات پس از سرطانی شدن و دریافت داروی دوکسوربیسین برنامه تمرین ورزشی را به مدت 6 هفته روی نوار گردان ویژه جوندگان (ساخت گروه تجهیز گستر امید: ایران) اجراکردند.
5- گروه بیمار دوکسوروبیسین + مکمل نانوکورکومین یا Doxorubicin Disease Group and Nanocurcumin Supplement در این گروه حیوانات پس از سرطانی شدن و دریافت داروی دوکسوربیسین، مکمل نانوکورکورمین ساخت شرکت اکسیرنانوسینا (ایران) را به مدت 6 هفته به صورت دهانی (گاواژ) روزانه به مقدار(100 mg/Kg/day) دریافت کردند.
6- گروه بیمار دوکسوروبیسین + تمرین + مکمل نانوکورکورمین یاDoxorubicin Disease Group, Nanocurcumin Exercise and Supplement در این گروه حیوانات پس از سرطانی شدن و دریافت داروی دوکسوربیسین به مدت 6 هفته تمرین کردند و همزمان با تمرین روزانه به مقدار (100 mg/Kg/day) مکمل نانوکورکورمین به صورت دهانی (گاواژ) دریافت کردند.
شیوه سرطانی کردن حیوانات: جهت القای سرطان پستان از رده سلولی 4T1 که از بانک سلولی انستیتو پاستور ایران خریداری شده بود استفاده شد. سلولها در محیط DMEM F12 حاوی 10 درصد سرم جنین گاو، 5 درصد اسیدهای آمینۀ غیرضروری و آنتیبیوتیکهای پنیسیلین و استرپتومایسین در انکوباتور 37 درجۀ سانتیگراد حاوی CO2 5 درصد کشت داده شدند. سپس پس از بی هوش نمودن موشها یک میلیون سلول به صورت زیر جلدی به ناحیه پشت تزریق میشود. (برای جلوگیری از دسترسی و لمس تومور توسط حیوان، سلولهای سرطانی در پشت بین دوکتف تزریق شد) پس از 10 الی 14روز با پیدایش تومور سرطانی، موشها به گروههای مدنظر تقسیم شدند (13).
برنامه تمرین هوازی:پزشکان و متخصصان توصیه نموده اند شدت تمرین برای بیماران سرطانی باید موثر، ایمن و لذت بخش باشد و برنامه تمرینی که برای فرد سالم شدت کم یا متوسط دارد، ممکن است برای بیمار مبتلا به سرطان شدید تلقی شود، لذادر این پژوهش شدت تمرین، متوسط در نظر گرفته شد. پس از آشناسازی، پروتکل اصلی تمرین استقامتی اجرا شد. برنامه تمرین استقامتی به مدت شش هفته و پنج جلسه در هفته 30 دقیقهای که مجموعاً 30 جلسه در گروههای مربوطه اجرا شد. در تحقیق حاضر جهت انجام تمرین استقامتی براساس مطالعه Lanari و همکاران (2001) و Ambers و همکاران (2004) با توجه به سرطانی بودن آزمودنیها استفاده شد که به آزمودنیهای سرطانی اختصاص داشت به این صورت که سرعت نوارگردان در دو هفته نخست 14، دو هفته دوم 16 و در دو هفته آخر 18 متر بر دقیقه در نظر گرفته شده بود. مقادیر سرعت و مدت این روش تمرینی در جدول 2 آمده است. طی دویدن روی نوارگردان سعی بر این بود که از شوک الکتریکی برای تحریک موشها به دویدن استفاده نشود.
جدول 2: سرعت، مدت و شیب مورد استفاده درپروتکل تمرینی
.JPG)
روش دریافت مکمل نانوکورکورمین: با توجه به اینکه متابولیسم، جذب و دسترسی زیست محیطی ضعیف کورکومین به عنوان مشکل اساسی بر سر استفاده از کورکومین شناخته شده است در این تحقیق بر خلاف تحقیقات قبلی جهت جذب و حلالیت بهتر و کاهش عوارض جانبی از مکمل نانوکورکورمین استفاده شد. SinaCurcumin به صورت کپسول ژلاتینی حاوی 40 میلیگرم نانوکورکورمین در هر کپسول ساخت شرکت اکسیرنانوسینا (ایران) خریداری شد که به موشهای گروههای G5 و G6 روزانه ساعت 16 بعداظهر به مدت 6 هفته پی در پی، 100 میلی گرم به ازای هرکیلوگرم وزن بدن از مایع داخل کپسول را به وسیله گاواژ دریافت کردند.
تزریق داروی دکسوربیسین: داروی دوکسوروبیسین Ebedoxo(Doxorubicin)50mg/ml ساخت شرکتEBEWE Pharma (AUSTRIA) خریداری شد، و سپس برای تهیه دوز موردنظر (2 میلیگرم بر کیلوگرم وزن بدن) با آب مقطر رقیق شد و به صورت زیرصفافی بر اساس تحقیق Shalizar و همکاران (2013) و Saalu و همکاران (2010) به تعداد 6 مرتبه و در روزهای 28،21،14،7،1 و 35 در گروههای G3 و G4 و G5 و G6 به موشها تزریق شد. همچنین با توجه به اثرات احتمالی ناشی از تزریق در گروههای دریافتکننده دوکسوروبیسین و برای جلوگیری از تأثیر آهنگ شبانه روزی تمام تزریقات همگن و در ساعت 12 ظهر در هفته تزریق شد.
روشهای اندازهگیری آزمایشگاهی شاخصها: پس از اتمام شش هفته مداخله، 24 ساعت پس از آخرین جلسه تمرین و نگهداری، حیوانات بهوسیله گاز c02 بیهوش شدند و سپس بافت قلب برداشته و بلافاصله در دمای 80- درجه سانتیگراد منجمد و تا زمان آزمونهای بیوشیمیایی نگهداری شد و سپس فعالیت و بیان ژن کاسپاز3 و 9 و میزان پروتئینهای Bcl2 و Bax در بافت قلب اندازهگیری شد.
استخراج RNA: جهت بررسی تغییرات بیان ژنها در سطح mRNA بافت قلب، لازم بود که RNA تام از نمونهها استخراج شود تا در مراحل بعدی cDNA از روی این mRNAها سنتز و برای بررسی تغییرات بیان ژن توسط real-time PCR آماده شوند. پس از انجام واکنش سنتز cDNA، به منظور تکثیر قطعه مورد نظر و ارزیابی کمی بیان ژنها ، Real-time PCR انجام گرفت. میزان بیان ژنها و ژن GAPDH به عنوان کنترل داخلی با استفاده از دستگاه real-time PCR و رنگ SYBR green تعیین شد. واکنش PCR در حجم نهایی10 میکرولیتر و بر اساس مقادیر نشان داده شده انجام شد (13).
تجزیه و تحلیل آماری
دادههای جمعآوری شده توسط نرمافزارversion 16 SPSS مورد تجزیه و تحلیل آماری قرار گرفت. نتایج برای بیان ژنهای GSH،SOD ، MDA وCat، به صورت "تعداد، حداقل، حداکثر، میانگین، انحراف معیار، میانه" گزارش شد. به منظور ارزیابی "اثر تمرین هوازی، اثر مکمل کورکومین و اثر متقابل تمرین هوازی و مکمل کورکومین"، بر بیان ژنهای مورد بررسی در بعد از مداخله، از آنالیز واریانس دوطرفه (Two-way ANOVA)، استفاده گردید. نرمال بودن توزیع فراوانی میزان فعالیت و بیان ژنهای مورد بررسی در هر یک از گروههای مورد مطالعه، با محاسبه شاخصهای چولگی (Skewness) و کشیدگی (Kurtosis)، و همچنین با استفاده از آزمون ناپارامتریک کلموگروف-اسمیرنوف (Kolmogorov-Smirnov) مورد ارزیابی قرار گرفت. آزمون بارتلت(Bartlett’s test for homogeneity of variances) نیز به منظور ارزیابی همگنی واریانس میزان فعالیت و بیان ژنهای مورد بررسی در گروههای مورد مطالعه مورد استفاده قرار گرفت. سطح معنیداری در آزمونها 0/05 در نظر گرفته شد.
ملاحظات اخلاقی
تحقیق حاضر از نوع کاربردی و از لحاظ کنترل متغیرها به صورت تجربی و از حیث مکان اجرا، ازمایشگاهی بود. با عنایت به اینکه از لحاظ محدودیتهای مکانی، اخلاقی و زمانی دسترسی به آزمودنیهای انسان مقدور نبود، لذا از آزمودنیهای حیوان (موش نژاد بالب سی) استفاده شد. در ابتدا اقدام به کسب مجوزهای لازم شد و سپس مطابق با دستورالعمل انجمن ایرانیان حمایت از حیوانات آزمایشگاهی موشها در قفسهای به صورت جداگانه نگهداری میشوند. حیوانات در شرایط استاندارد 12 ساعت تاریکی و 12 ساعت روشنائی نگهداری شدند و دسترسی آزاد به آب و غذا داشتند. اصول اخلاقی کار با حیوانات آزمایشگاهی براساس پروتکل مصوب دانشگاه آزاد اسلامی واحد پرندرو تحت نظارت کمیته اخلاق در پژوهش دانشگاه )کد اخلاق IR.IAU.PIAU.REC.1400.005) انجام شد. در تمام مراحل آزمایش تلاش شد کمترین استرس و درد به حیوانات اعمال شود.
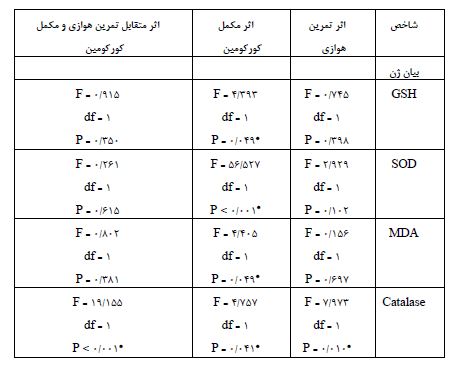
نتایج
اثر اصلی تمرین هوازی بر بیان ژن GSH در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار نبود (0/398=P). به عبارت دیگر، اثر تمرین هوازی به تنهایی بر روی بیان ژن GSH بیتأثیر بوده است. اما اثر اصلی مکمل کورکومین بر بیان ژن GSH در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار بود (0/049=P). به عبارت دیگر، صرفنظر از تمرین هوازی، مصرف مکمل کورکومین به تنهایی منجر به افزایش بیان ژن GSH شده است. لذا اثر متقابل تمرین هوازی و مکمل کورکومین بر بیان ژن GSH در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار نبود (0/398=P). به عبارت دیگر، اثر تعاملی تمرین هوازی و مکمل کورکومین بر بیان ژن GSH بیتأثیر بوده است اما صرفنظر از تمرین هوازی، مصرف مکمل کورکومین به تنهایی به طور معناداری منجر به افزایش بیان ژن GSH شده بود. همچنین اثر اصلی تمرین هوازی بر بیان ژن SOD در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار نبود (0/102=P). به عبارت دیگر، اثر تمرین هوازی به تنهایی بر روی بیان ژن SOD بیتأثیر بوده است. اما اثر اصلی مکمل کورکومین بر بیان ژن SOD در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار بود (0/001> P). به عبارت دیگر، صرفنظر از تمرین هوازی، مصرف مکمل کورکومین به تنهایی منجر به افزایش بیان ژن SOD شده است. بنابراین اثر متقابل تمرین هوازی و مکمل کورکومین بر بیان ژن SOD در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار نبود (0/615 = P). به عبارت دیگر، اثر تعاملی تمرین هوازی و مکمل کورکومین بر بیان ژن SOD بیتأثیر بوده است. اما مجدد صرفنظر از تمرین هوازی، مصرف مکمل کورکومین به تنهایی منجر به افزایش بیان ژن SOD شده بود (0/001>P). اثر اصلی تمرین هوازی بر بیان ژن Cat در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار بود (0/010=P). به عبارت دیگر، صرفنظر از مکمل کورکومین، تمرین هوازی به تنهایی منجر به افزایش بیان ژن Cat شده است. ضمناً اثر اصلی مکمل کورکومین بر بیان ژن Cat در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار بود (0/041=P). به عبارت دیگر، صرفنظر از تمرین هوازی، مصرف مکمل کورکومین به تنهایی منجر به افزایش بیان ژن Cat شده است. بنابراین اثر متقابل تمرین هوازی و مکمل کورکومین بر بیان ژن Catalase در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار بود(0/001>P). به عبارت دیگر، در موشهایی که مکمل کورکومین مصرف کردند، بعد از تمرین هوازی، بیان ژن Catalase افزایش پیدا کرده، در حالیکه در موشهایی که مکمل کورکومین مصرف نمیکردند، بعد از تمرین هوازی، بیان ژن Cat کاهش نشان داده شده بود. همچنین نتایج نشان داد که اثر اصلی تمرین هوازی بر بیان ژن MDA در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار نبود (0/697= P). به عبارت دیگر، اثر تمرین هوازی به تنهایی بر روی بیان ژن MDA بیتأثیر بوده است. اما اثر اصلی مکمل کورکومین بر بیان ژن MDA در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار بود (0/049= P). به عبارت دیگر، صرفنظر از تمرین هوازی، مصرف مکمل کورکومین به تنهایی منجر به کاهش بیان ژن MDA شده است. بنابراین اثر متقابل تمرین هوازی و مکمل کورکومین بر بیان ژن MDA در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین، از نظر آماری معنیدار نبود (0/381= P). به عبارت دیگر، اثر تعاملی تمرین هوازی و مکمل کورکومین بر بیان ژن MDA بیتأثیر بوده است. اما صرفنظر از تمرین هوازی، مصرف مکمل کورکومین به تنهایی منجر به کاهش بیان ژن MDA شده بود. لذا می توان اذعان داشت که صرف نظر از تمرین هوازی که تاثیر معناداری فقط در Cat داشت مکمل نانوکورکورمین به تنهایی میتواند در طی درمان با داروی دوکسوروبیسین در موشهای ماده بالب سی، بهطور مؤثری سبب پیشگیری از آپوپتوز و فیبروز سلولهای سالم قلبی شود.
1- یافته¬های توصیفی: جامعهای آماری این پژوهش شامل موش نژاد Balb C با وزن 20±2gr، با سن تقریبی 8-6 هفته که تعداد 36 سر از انستیتو پاستور ایران خریداری شد.
2- یافته¬های استنباطی: الف) نرمال بودن توزیع فراوانی بیان ژن¬های، GSH، SOD، MDA، و Catalase در هر یک از گروههای مورد بررسی، با محاسبه شاخصهای چولگی (Skewness) و کشیدگی (Kurtosis) مورد ارزیابی قرار گرفت. مقدار چولگی (کجی) شاخصهای مورد بررسی در محدوده 1/735- تا 1/952+ و کشیدگی شاخصهای مورد بررسی در محدوده 1/941- تا 1/998+ قرار داشت. از آن جایی که مقدار چولگی (کجی) و کشیدگی در محدوده 2- تا 2+ نشان دهنده نرمالبودن توزیع یک متغیر است، لذا میزان فعالیت و بیان ژنهای مورد بررسی از توزیع نرمال برخوردار بودند.
ب) آزمون بارتلت (Bartlett’s test for homogeneity of variances) همچنین نشان داد که واریانس میزان فعالیت و بیان ژنهای مورد بررسی در گروههای مورد مطالعه همگن میباشند، به طوریکه مقدار P آزمون بارتلت برای میزان فعالیت و بیان ژنهای مورد بررسی در محدوده 0/051 تا 0/716 قرار داشت و و از آن جایی که 0/05<P نشاندهنده همگنی واریانس میزان فعالیت و بیان ژنهای مورد بررسی در گروههای مورد مطالعه میباشد، لذا این پیشفرض نیز در دادهها برقرار بود. به منظور ارزیابی اثر تمرین هوازی، اثر مکمل کورکومین و اثر متقابل تمرین هوازی و مکمل کورکومین، بر میزان فعالیت و بیان ژنهای مورد بررسی در بعد از مداخله، از آنالیز واریانس دوطرفه (Two-way ANOVA)، استفاده گردید. لازم به ذکر است که برای انجام آنالیز واریانس دوطرفه، فقط گروههای G3 تا G6 در آنالیز مربوطه وارد شدند و گروههای G1 و G2 به دلیل عدم برخورداری از مداخله تمرین هوازی و یا مکمل کورکومین، مناسب آنالیز واریانس دوطرفه نبوده و لذا از این آنالیز کنار گذارده شدند. (جداول 3،4،5،6)
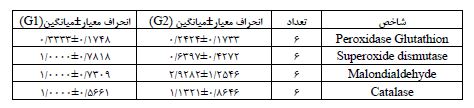
جدول 3: ویژگیهای توصیفی میزان فعالیت و بیان ژنهای مورد بررسی در گروه کنترل سالم (G1) و (G2)
جدول 4: ویژگیهای توصیفی میزان فعالیت و بیان ژنهای مورد بررسی در گروه کنترل بیمار تحت درمان دوکسوروبیسین (G3) و (G4)
جدول 5: ویژگیهای توصیفی میزان فعالیت و بیان ژنهای مورد بررسی در گروه کنترل بیمار تحت درمان دوکسوروبیسین + مکمل کورکومین (G5) و (G6)
جدول 6: اثرات اصلی و متقابل تمرین هوازی و مکمل کورکومین بر میزان فعالیت و بیان ژنهای مورد بررسی در موشهای ماده Balb/C بعد از القاء سرطان پستان و تحت درمان دوکسوروبیسین
* نشان دهنده اثر معنیدار میباشد.
بحث
سرطان به عنوان دومین علت اصلی مرگ و میر در جهان به شمار میرود.در حال حاضر درمانهای رایج برای این بیماری جراحی، پرتو درمانی و شیمیدرمانی هستند دوکسوروبیسین یک آنتی بیوتیک آنتراسیکلین است، که در درمان طیف گستردهای از سرطانها مورد استفاده قرار میگیرد متأسفانه، استفاده بالینی از این داروی بسیار کارآمد به دلیل سمیت و عوارض جانبی غیرقابل بازگشت، محدود شده است (12). در حال حاضر هیچ ایده کلی در مورد بهترین روش برای جلوگیری از سمیت وجود ندارد اما به هر حال به دلیل اثرات بالقوه داروی دوکسوربیسین در مبارزه با طیف وسیعی از سرطانها مانند سرطان سینه، تومورهای بدخیم و سرطانهای خونی، این دارو بهطور گستردهای در شیمیدرمانی مورداستفاده قرار میگیرد. شواهد روبه رشدی وجود دارد مبنی بر اینکه که این دارو میتواند به عنوان یک شمشیر دو لبه عمل نماید و به بافتهای غیر هدف آسیب برساند (12). اثرات سمیتی دوکسوروبیسین از قبیل سرکوب فعالیت خونسازی، تهوع و استفراغ، آلوپشیا و به ویژه عارضه جانبی اصلی این دارو یعنی سمیت قلبی باعث شده تا معضلی جدی در استفاده موفقیتآمیز این دارو در درمان سرطانها ایجاد شود علائم سمیت قلبی ناشی از دوکسوروبیسینcardiotoxicity) ) شامل کاهش قدرت انقباضی و قدرت پمپاژ قلب، نارسایی احتقانی قلب، کاردیومیوپاتی، اتساع قلب و اختلالات بدون علامت ریتم قلبی است که متأسفانه پیشآگهی ضعیفی داشته و کشنده میباشد. مکانیسم ایجاد سمیت قلبی توسط دوکسوروبیسین با مکانیسم اثرات ضد توموری آن متفاوت بوده و عمدتا شامل افزایش استرس اکسیداتیو در بافت قلبی است که افزایش تولید گونههای واکنشگر اکسیژن و افزایش پراکسیداسیون لیپیدی تأییدکننده آن است (15). تاکنون راهبردهای زیادی در مقابل عوارض قلبی مرتبط با درمان به وسیله دوکسوروبیسین، ارائه شده است. یکی از این راهبردها، اجرای تمرینات ورزشی و فعالیت بدنی است، که به عنوان یک راهکار غیردارویی در برابر آسیب قلبی توصیه شده است. پژوهشهای اخیر، سودمندی اثرات پیشگیرانه تمرینات استقامتی حاد، طولانیمدت، میان مدت و کوتاهمدت را بر سمیت قلبی ناشی از درمان با دوکسوروبیسین گزارش نمودهاند. این نتایج تا حدودی همسو با نتایج پژوهش کنونی است. هر چند بر اساس دانش کنونی ما، دادههای پژوهشی راجع به اثرات تمرین ورزشی بر سمیت ناشی از دوکسوروبیسین بر بافت قلب، بسیار اندک است. با این وجود در ارتباط با پاسخ آنزیمهای ضداکسایشی نسبت به فعالیتهای بدنی، پژوهشهای پیشین چنین فرضیهای را مطرح کردهاند؛ که به احتمالی همراه با افزایش تولید رادیکالهای آزاد، سازگاریهایی در میزان تولید و فعالیت سیستم آنتیاکسیدانتی آنزیمی سلولها رخ میدهد که آثار نامطلوب آن را خنثی میکند. هر چند که مسیر سیگنالینگ این وقایع تا حدودی ناشناخته باقی مانده است. ازاینرو به نظر میرسد که اجرای تمرینات ورزشی به احتمالی از طریق تنظیم مثبت آنزیمهای ضد اکسایشی از عوارض ناشی از درمان به وسیله دوکسوروبیسین، جلوگیری میکند. (12). از سوی دیگر، پژوهشگران راهبرد استفاده از مکملهای گیاهی همراه با شیمی درمانی را توصیه کردهاند. پژوهشها نشان دادند که مصرف کورکومین موجب کاهش عوارض سوء شیمیدرمانی به ویژه عوارض جانبی ناشی از درمان به وسیله دوکسوروبیسین میشود. با این وجود، مشکلات فارماکوکینتیک کورکومین نظیر جذب خوراکی و فراهم زیستی خیلی پایین در کنار غلظت پلاسمایی خیلی ناچیز (در حد نانوگرم یا نانومولار) و دفع سریع از طریق بافتهایی مانند موکوس معده و کبد (پیش از ورود به جریان خون عمومی)، به عنوان یک مانع چالش برانگیز در راستای استفاده دارویی از آن محسوب میشود (14). از اینرو، پژوهشگران سعی کردهاند که با استفاده از حاملهای پلیمری و غیر پلیمری سامانههای دارویی در ابعاد نانو، این مشکل را مرتفع نمایند. یکی از انواع سامانههای نانو که در پژوهشهای اخیر مورد مطالعه قرار گرفته است، میسلها هستند، که تاکنون توانایی آنها در مورد تهیه سامانه دارورسانی بسیاری از داروها بررسی شده است. تهیه به نسبت ساده تر و غیر وابسته به دستگاه، انعطافپذیری در طراحی پلیمرهای دوگانه دوست با در نظر گرفتن ویژگیهای دارو و نحوه عملکرد سامانه دارورسانی از جمله ویژگیهای این سامانهها است. این سامانهها سبب افزایش حضور دارو در محل اثر و همچنین افزایش حلالیت داروهای دارای حلالیت آبی پایین میگردند. با عنایت به نتایج پژوهشهای پیشین، در پژوهش کنونی از نانومیسلهای حاوی کورکومین ساخت شرکت اکسیر نانو سینا ایران، استفاده شده است. این میسلها انبوههایی از مولکولهای سورفاکتانت بوده که دارای سر آب دوست و انتهای آبگریز بوده و قادر به محلولسازی کورکومین هستند. نتایج پژوهش کنونی در تأیید نتایج پیشین و همسو با آنها، نشان داد که استفاده از مکمل نانوکورکومین میتواند تا حدودی منجر به افزایش سطوح آنزیمهای آنتیاکسیدانی گردد (16). بنابراین6 هفته مصرف مکمل غذایی کورکومین در مرحله اول و تمرین ورزشی از نوع هوازی در مرحله دوم می تواند تا حد زیادی سبب کاهش استرس اکسیداتیو ناشی از عوارض دوکسوربیسین در بافت قلب از طریق افزایش آنزیمهای آنتیاکسیدانی شود. نتایج مطالعه حاضر نشان داد تمرین هوازی و مصرف نانوکورکورمین به صورت جداگانه و یا با هم در طی درمان با داروی دوکسوروبیسین در موشهای ماده بالب سی میتواند، به طور مؤثری سبب پیشگیری از آپوپتوز وفیبروز سلولهای سالم قلبی شده بودکه نتایج این یافته همسو با پژوهش آسنسائو و همکاران میباشد (17) آنها نشان دادن که دوکسوربیسین باعث اختلال عملکرد تنفس میتوکندریایی، آسیب اکسیداتیو و ضایعات هیستوپاتولوژیک و راه انداختن آپوپتوز میشود. با این وجود تمرین استقامتی افزایش ناشی از DOX در پروتئین کربونیل، مالون دی آلدئید، Baxو فعالیت کاسپاز 3 بافت را مهارکرد. نتایج مطالعه کاوازیس و همکاران (18) نشان داد که تزریق DOXمنجر به اختلال عملکرد میتوکندری قلب، فعالسازی پروتئازها و آپوپتوز میشود. در حالیکه تمرین ورزشی آنزیمهای آنتیاکسیدان قلبی و پروتئین 72HSP را افزایش داد و از میوسیتهای قلبی آسیب میتوکندری ناشی از DOX فعالسازی پروتئاز و آپوپتوز محافظت کرد بنابراین با نتایج این تحقیق همسو بود. ضمناً نتایج مطالعه مارکوس، آلیکسو و همکاران (19) نیز به مانند این تحقیق نشان داد که درمان DOXمنجر به حساسیت افزایش یافته mPTP و سیگنالینگ آپوپتوز (کاسپازها 3،8 و 9 و نسبت 2(Bax/Bcl- میشود اما 12 هفته تمرین استقامتی بر روی نوارگردان و تمرین اختیاری چرخ دوار از عوارض ناشی از DOX که منجر به حساسیت mPTP و سیگنالینگ آپوپتوز میشود جلوگیری کردند. این نتایج با یافتههای کاوازیس و همکاران، ویسوانتا و همکاران، آسنساو و همکاران، هنینگر و همکاران، این جاک و همکاران راسکوویک و همکاران، محمود و همکاران که گزارشهایی مبنی برافزایش سمیت قلبی و کبدی ناشی ازDOX و نقش حمایتی تمرینات استقامتی در جهت کاهش این عوارض بیان نموده اند، همسو است. مطالعات متعدد سلولی و پیش بالینی نشان داد که کورکومین با مهار رادیکالهای آزاد و گونههای فعال اکسیژن موجب مهار آسیبهای DNA ناشی از عوامل اکسیداتیو مانند پرتوهای یونیزان میشود بنابراین ممکن است به عنوان یک عامل محافظتی بالقوه در برابر آپوپتوز ناشی از DOX در بافت قلب بهکار رود. همچنین به تازگی نشان داده شده است کورکومین، اثر محافظتی در مقابل سمیت قلبی ناشی از دوکسوروبیسین دارد و دارای پتانسیل درمانی برای بیماریهای قلبی عروقی است. پژوهش ال-سید و همکاران (20)، کاتمورا و همکاران (21) و همچنین مطالعه حیدرزاده و همکاران (22) همسو با یافته پژوهش حاضر هستند. ال-سید و همکاران (2011) از نتایج مطالعه خود استنتاج کردند که استفاده همزمان عصاره زردچوبه با دوکسوروبیسین در برابر سمیت قلبی حاد ناشی از DOXاز طریق بهبود آنزیمهای قلب و تنظیم مسیرهایی که آپوپتوز قلبی را به راه میاندازند مانند کاهش سطح گلوتاتیون (GSH) افزایش کلسیم و تولید بیش از حد رادیکالهای اکسیدکننده و در نهایت، طبیعی،کردن آنزیمهای آنتیاکسیدان محافظت میکند. کاتمورا و همکاران (2014) گزارش کردند کورکومین از قلب در برابر سمیت قلبی ناشی از DOX به وسیله القاء اتوفاگی و کاهش آپوپتوز کاردیومیوسیتها محافظت میکند که منجر به کاهش آپوپتوز میشود. همچنین مطالعه محمد و همکاران (23) نشان داد که عصاره زردچوبه (کورکومین) به طور مستقیم از سمیت کلی DOX محافظت میکند نتایج آنها نشان داد که DOX باعث کاهش معنیدار در میزان NO و آلبومین سرم میشود. در مقابل عصاره زردچوبه با فعالیتهای درمانی متعدد اثر محافظتی و رفع مؤثر بر سمیت قلبی و کبدی ناشی از DOXو همچنین نفرز ناشی از آن دارد اثر محافظتی عصاره زردچوبه با خواص آنتیاکسیدانی و زدودن رادیکال آزاد آن همراه است. ضمناً مطالعات هایدن و همکاران (2019)،کلی و همکاران (2021) و نیز مطالعه مروری پابلو و همکاران (2021) با نتایج این پژوهش همسو هست تمامی این مطالعات اثرات ضد سمیت و مثبت فعالیت بدنی به عنوان یک عامل محافظتی در مقابله با مسمومیت قلبی ناشی از دوکسوربیسین را بیان داشته اند. (26-23). علیرغم اینکه در پژوهش حاضر عوامل اثرگذار بر نتایج تحقیق از جمله: نژاد، سن، جنس، وزن، محیط نگهداری حیوانات، آب و غذا، چرخه روشنایی و تاریکی، سر و صدا، دما و رطوبت هوا کنترل شد؛ اما مطالعه حاضر با محدودیتهایی که از کنترل محقق خارج بودند نیز مواجه بود. برخی از این عوامل عبارتند از: عدم کنترل فعالیت شبانه آزمودنیهای پژوهش به ویژه گروههای بدون تمرین و تداخل احتمالی آن بر نتایج تحقیق. عدم کنترل تأثیر احتمالی شوک دستگاه، بر استرس در آزمودنیهای تمرین نوارگردان استقامتی هرچند تا حد امکان سعی شد تا از طریق شرطی سازی آزمودنی با صدا، استفاده از شوک الکتریکی دستگاه به حداقل برسد و همچنین بافت برداری حداقل 48 ساعت پس از آخرین جلسه تمرینی انجام شد.
عدم کنترل تأثیر احتمالی ماده بیهوشی بر شاخصهای مورد آزمون
نتیجه گیری
لذا مطالعه حاضر نشان میدهد که مصرف نانوکورکومین به همراه تمرین هوازی در مدت زمان 6 هفته ممکن است به عنوان یک کاندیدای بالقوه مفید برای محافظت سلولهای قلب از سمیت ناشی از القای دوکسوروبیسین باشد. اما با این وجود پیشنهاد میشود جهت حصول نتایج واضحتر، در پژوهشهای آتی تغییراتی در مقدار مکملگیری، طول دوره تمرینی و شدت وارده بر چرخ گردان اعمال شود. همچنین، از آنجا که شواهد پژوهشی اندکی در ارتباط با اثرات توأم این مداخلات بر سمیت ناشی از دوکسوروبیسین در بافت قلب وجود دارد، پیشنهاد میشود که جهت حصول نتایج واضحتر پژوهشهای بیشتری در این زمینه با استفاده از دوزها و دورههای مختلف مکمل درمانی در کنار تمرینات ورزشی با طول دوره تمرین و شدت متفاوت، انجام شود.
سپاسگزاری
این مقاله بخشی از پایاننامه مقطع دکتری میباشد که با زحمات اساتید راهنما و مشاور تکمیل شده است که جا دارد از همه این عزیزان کمال تشکر و قدردانی را دارا باشم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد
1- El-Awady RA, Semreen MH, Saber MM, Cyprian F, Menon V, Al-Tel TH. Modulation of DNA Damage Response and Induction of Apoptosis Mediates Synergism Between Doxorubicin and a New Imidazopyridine Derivative in Breast and Lung Cancer Cells. DNA Repair 2016; 37: 1-11.
2- Ahmadian M, Dabidi Roshan V, Leicht AS. Age-Related Effect of Aerobic Exercise Training on Antioxidant and Oxidative Markers in the Liver Challenged by Doxorubicin in Rats. Free Radical Res 2018; 52(7): 775-82.
3- Xia P, Chen J, Liu Y, Fletcher M, Jensen BC, ZH Cheng. Doxorubicin Induces Cardiomyocyte Apoptosis and Atrophy through Cyclin-Dependent Kinase 2–Mediated Activation of Forkhead Box O1. J Biol Chem 2020; 295(13): P4265-76.
4- Alkuraishy HM, Al-Gareeb AI, Al-hussani HA. Doxorubicin-Induced Cardiotoxicity: Molecular Mechanism and Protection by Conventional Drugs and Natural Products. Inter J Clin Onco Can Res 2017; 2(2): 31-44.
5- Shirinbayan V, Dabidi Roshan V. Pretreatment Effect of Running Exercise on HSP7 and DOX Induced Cardiotoxicity. Asian Pacific J Cancer Prev 2012; 13(11): 5849-55.
6- Van Deursen VM, Damman K, Hillege HL, van Beek AP, van Veldhuisen DJ, and Voors AA. Abnormal Liver Function in Relation to Hemodynamic Profile Inheart Failure Patients. J Card Fail 2010; 16: 84-90.
7- Mohajeri M, Sahebkar A. Protective Effects of Curcumin against Doxorubicin-Induced Toxicity and Resistance: A Review. Crit Rev in Oncol Hematol 2018; 122: 30-51.
8- Hashemi C SZ, Dabidiroshan V. The Effect of Pretreatment of Aerobic Training on Some of the Pulmonary Stress Indices against the Toxicity of Doxorubicin. Journal of Isfahan Medical School. 2020; 37(559): 1422-7.
9- Yap MY, Lo YL, Talbot K, Ong WY. Oxidative Stress Reduces Levels of Dysbindin-1A Via Its PEST Domain. Neurochem Int 2014; 79: 65-9.
10- Jemal A, Murray T, Ward E, Samuels A, Tiwari RC, Ghafoor A, et al. Cancer Statistics: Americancancer Society. CA Cancer J Clin 2005; 55(1): 10-30.
11- Ataollahi MR, Sharifi J, Paknahad MR, Paknahad A. Breast Cancer and Associated Factors: a Review. J Med Life 2015; 8(Spec Iss 4): 6-11. [Persian]
12- Sadat-Hoseini SK, Dabidi Roshan V, ShojaeiShahrokhababdi M. Effects of Time Courses of Treadmill Training in Tissue Toxicity Induced by Different Doses of Doxorubicin in Multiple Organs. RJMS 2017; 23(151): 31-42. [Persian]
13- Katsuhito N, Shuhei F, Ayano O, Hiroki K. Protective Effects of Taurine on Doxorubicin-Induced Acute Hepatotoxicity Through Suppression of Oxidative Stress and Apoptotic Responses. Anti-Cancer Drugs 2016; 27(1): 17-23.
14- Takemura G, Fujiwara H. Doxorubicininduced Cardiomyopathy from the Cardiotoxic Mechanisms to Management. Prog Cardiovasc Dis 2007; 49(5): 330-52.
15- Dasgupta A, Nomura M, Shuck R, Yustein J. Cancer’s Achilles’ Heel: Apoptosis and Necroptosis to the Rescue. Int J Mol Sci 2016; 18(1): 23.
16- Bishayee A, Mandal A, Bhattacharyya P, Bhatia D. Pomegranate Exerts Chemoprevention of Experimentally Induced Mammary Tumorigenesis by Suppression of Cell Proliferation and Induction of Apoptosis. Nutr cancer 2016; 68(1): 120-30.
17- Ascensão A, Magalha˜es J, Soares JMC, Ferreira R, Neuparth MJ, Marques F, et al. Moderateendurance Training Prevents Doxorubicin-Induced in Vivo Mitochondriopathy and Reduces the Development of Cardiac Apoptosis. Am J Physiol Heart Circ Physiol 2005; 289(2): 722-31.
18- Kavazis AN, Smuder AJ, Min K, Tümer N, Powers SK. Short-Term Exercise Training Protects Againstdoxorubicin-Induced Cardiac Mitochondrial Damage Independent of HSP72. Am J Physiol Heart Circ Physiol 2010; 299(5): H1515-24.
19- Marques-Aleixo I, Santos-Alves E, Torrella JR, Oliveira PJ, Magalha˜es J, Ascensa˜o A. Exercise and Doxorubicin Treatment Modulate Cardiac Mitochondrial Quality Control Signaling. Cardiovasc Toxicol 2017; 18(1): 43-55.
20- El-Sayed EM, El-azeem ASA, Afify AA, Shabana MH, Ahmed HH. Cardioprotective Effects of Curcuma Longa L. Extracts against Doxorubicin-Induced Cardiotoxicity in Rats. Journal of Medicinal Plants Research 2011; 5(17): 4049-58.
21- Katamura M, Iwai-Kanai E, Nakaoka M, Okawa Y, Ariyoshi M, Mita Y, et al. Curcumin Attenuates Doxorubicin-Induced Cardiotoxicity by Inducing Autophagy Via the Regulation of JNK Phosphorylation. Clinical & Experimental Cardiology 2014; 5: 9.
22- Heidarzadeh A, Ahadi AM, Panahi A, Sadeghizadeh M. Tumor Suppressor P53 Can Protect Normal Cells Against Dendrosomal Curcumin-Induced Apoptosis. Biomacromol J 2015; 1(2): 220-9.
23- Duarte JA, Le Nguyen B, Hyatt H. Endurance Exercise Protects Skeletal Muscle against both Doxorubicin-Induced and Inactivity-Induced Muscle Wasting. Pflügers Archiv - European Journal of Physiology 2019; 471(3): 441-53.
24- Ryan N Montalvo, Vivian Doerr, Branden L Nguyen , Rachel C Kelley, Ashley J Smuder . Consideration of Sex as a Biological Variable in the Development of Doxorubicin Myotoxicity and the Efficacy of Exercise as a Therapeutic Intervention. Antioxidants 2021; 10(3): 343.
25- Wakefield ZR, Tanaka M, Pampo C, Lepler S, Rice L, Guingab-Cagmat J, et al. Normal Tissue and Tumor Microenvironment Adaptations to Aerobic Exercise Enhance Doxorubicin Anti-Tumor Efficacy and Ameliorate Its Cardiotoxicity in Retired Breeder Mice. Oncotarget 2021; 12(18): 1737-48.
26- Ghignatti PVDC, Russo MKB, Becker T, Guecheva TN, Teixeira LV, Lehnen AM, et al. Preventive Aerobic Training Preserves Sympathovagal Function and Improves DNA Repair Capacity of Peripheral Blood Mononuclear Cells in Rats with Cardiomyopathy. Sci Rep 2022; 12(1): 6422.
دریافت: 1401/9/6 | پذیرش: 1401/10/17 | انتشار: 1402/1/15
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |