دوره 30، شماره 12 - ( اسفند 1401 )
جلد 30 شماره 12 صفحات 6243-6232 |
برگشت به فهرست نسخه ها
Ethics code: IR.SSU.MEDICINE.REC.106/1397
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Tavakoli F, Emami A, Heydari B, Abbasi M, Rezvani M E. Effects of Lipoherb with Metformin on Metabolic Parameters and Sex Hormones in Rats with Polycystic Ovary Syndrome. JSSU 2023; 30 (12) :6232-6243
URL: http://jssu.ssu.ac.ir/article-1-5830-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5830-fa.html
توکلی فاطمه، امامی آزاده، حیدری بهروز، عباسی موصلو محسن، رضوانی محمد ابراهیم. مقایسه اثر داروی گیاهی لیپوهرب با متفورمین بر پارامترهای متابولیک و هورمونهای جنسی موشهای صحرایی مبتلا به سندرم تخمدان پلیکیستیک. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (12) :6232-6243
متن کامل [PDF 1129 kb]
(200 دریافت)
| چکیده (HTML) (354 مشاهده)
References:
1- Bulsara J, Patel P, Soni A, Acharya S. A Review: Brief Insight into Polycystic Ovarian Syndrome. Endocr Metab Sci 2021; 3: 1-7.
2- Hosseinpanah F, Barzin M, Keihani S, Ramezani Tehrani F, Azizi F. Metabolic aspects of different phenotypes of polycystic ovary syndrome: Iranian PCOS Prevalence Study. Clin Endocrinol 2014; 81(1): 93-9.
3- Raja-Khan N, Shuja SA, Kunselman AR, Hogeman CS, Demers LM, Gnatuk CL, et al. Brachial artery conductance during reactive hyperemia is increased in women with polycystic ovary syndrome. Eur J Obstet Gynecol Reprod Biol 2011; 155(1): 49-53.
4- Marx TL, Mehta AE. Polycystic Ovary Syndrome: Pathogenesis and Treatment Over the Short and Long Term. Cleve Clin J Med 2003; 70(1): 31-45.
5- Pasarica M, Tchoukalova YD, Heilbronn LK, Fang X, Albu JB, Kelley DE, et al . Differential Effect of Weight Loss on Adipocyte Size Subfractions in
Patients with Type 2 Diabetes. Obesity 2009; 17: 1976-8.
6- Liu J, Liu M, Ye X, Liu K, Huang J, Wang L, et al. Delay in Oocyte Aging in Mice by the Antioxidant N-Acetyl-L- Cysteine (NAC). Hum Reprod 2012; 27(5): 1411-20.
7- Moghetti P, Castello R, Negri C, et al. Metformin Effects on Clinical Features, Endocrine and Metabolic Profiles, and Insulin Sensitivity in Polycystic Ovary Syndrome: A Randomized, Double-Blind, Placebo-Controlled 6-Month Trial, Followed by Open, Long-Term Clinical Evaluation. J Clin Endocrinol Metab 2000; 85(1): 139-46.
8- Uddin MK, Juraimi AS, Hossain MS, Nahar MA, Ali ME, Rahman MM, et al. Purslane Weed (Portulaca Oleracea): A Prospective Plant Source of Nutrition, Omega-3 Fatty Acid, and Antioxidant Attributes. Sci World J 2014: 1-6.
9- Al-Snafi AE. The Pharmacological Importance of Anethum Graveolens. A Review. Int J Pharm Pharm Sci 2014; 6(4): 11-13.
10- Yazdanparast R, Bahramikia S. Evaluation of The Effect of Anethum Graveolens L. Crude Extracts on Serum Lipids and Lipoproteins Profiles in Hypercholesterolaemic Rats. DARU J Pharmaceutical Sciences 2008; 2(16): 88-94.
11- Mohamed Abdel Magied M, Hussien SE, Mohamed Zaki SM, Mohamed EL Said R.Artichoke (Cynara scolymus L.) Leaves and Heads Extracts as Hypoglycemic and Hypocholesterolemic in Rats. J Food Nutr Res 2016; 4(1): 60-8.
12- Kassaee SM, Goodarzi MT, Kassaee SN. Ameliorative Effect of Trigonella Foenum Graecum L. on Lipid Profile, Liver Histology and LDL-Receptor Gene Expression in High Cholesterol-Fed Hamsters. Acta Endocrinol (Buchar) 2021; 17(1): 7-13.
13- Imanshahidi M, Hosseinzadeh H. Pharmacological and Therapeutic Effects of Berberis Vulgaris and Its Active Constituent, Berberine. Phytother Res 2008; 22(8): 999-1012.
14- Lee AS, Lee YJ, Lee SM, Yoon JJ, Kim JS, Kang DG, et al. Portulaca Oleracea Ameliorates Diabetic Vascular Inflammation and Endothelial Dysfunction in Db/Db Mice. Evid based Complement. Altern Med 2012; 2012: 741824.
15- Gong F, Li F, Zhang L, Li J, Zhang Z, Wang G. Hypoglycemic Effects of Crude Polysaccharide from Purslane. Int Mol Sci 2009; 10(3): 880-8.
16- El-Sayed M-IK. Effects of Portulaca Oleracea L. Seeds in Treatment of Type-2 Diabetes Mellitus Patients as Adjunctive and Alternative Therapy. J Ethnopharmacol 2011; 137(1): 643-51.
17- Bedakhanian M, Entezari M H, Ghanadian M, Askari G, Maracy MR. The Effects of Portulaca Oleracea on Lipid Profile, C-Reactive Protein, and Fasting Blood Glucose in Men with Metabolic Syndrome: A Double-Blind Randomized Clinical Trial. HSR 2017; 12(4): 478-83.
18- hosseini E, forozan far M, paye dar A. Effect of Hydroalcoholic Extract of Purslane on Serum Concentration of Estrogen, Progesterone, Prolactin and Gonadotropins in Adult Female Rats. J Shahrekord Univ Med 2014; 15(5):1-10.
19- Ahangarpour A, Lamoochi Z, Moghaddam HF, Mansouri SM, et al. Effects of Portulaca Oleracea Ethanolic Extract on Reproductive System of Aging Female Mice. Int J Reprod BioMed 2016; 14(3): 205-12.
20- Shabanian S, Bahmani M, Asadi-Samani M. The Medicinal Plants Effective on Female Hormones, A Review of the Native Medicinal Plants of Iran Effective on Estrogen, Progesterone, and Prolactin. J Chem Pharm Sci 2016; 9(3): 1270-6.
21- Akbaribazm M, Goodarzi N, Rahimi M. Female Infertility and Herbal Medicine: An Overview of the New Findings. Food Sci Nutr 2021; 9: 5869-82.
22- Fritsche J, Beindorff CM, Dachtler M, Zhang H, Lammers J. Isolation, Characterization and Determination of Minor Artichoke (Cynara Scolymus L.) Leaf Extract Compounds. Eur Food Res Technol 2002; 215: 149-57.
23- Shimoda H, Ninomiya K, Nishida N, Yoshino T, Morikawa T, Matsuda H, et al. Anti-Hyperlipidemic Sesquiterpenes and New Sesquiterpene Glycosides from the Leaves of Artichoke (Cynara Scolymus L.): Structure Requirement and Mode of Action. Bioorg Med Chem Lett 2003; 13(2): 223-8.
24- Sharma P, Kumar Verma P, Kishore Pankaj N, Agarwal S. The Phytochemical Ingredients and Therapeutic Potential of Cynara scolymus L. Pharm Biomed Res 2021; 7(3): 141-60
25- Gebhardt R. Inhibition of Cholesterol Biosynthesis in Primary Cultured Rat Hepatocytes by Artichoke (Cynara Scolymus L.) Extracts. J Pharmacol Exp Ther 1998; 286(3): 1122-8.
26- Rahimi-Madiseh M, Lorigoini Z, Zamani-gharaghoshi H, Rafieian-kopaei M. Berberis Vulgaris: Specifications and Traditional Uses. Iran J Basic Med Sci 2017; 20(5): 569-87.
27- Li Y, Ma H, Zhang Y, Kuang H, Ng EH, Hou L, et al. Effect of Berberine on Insulin Resistance in Women with Polycystic Ovary Syndrome: Study Protocol for a Randomized Multicenter Controlled Trial. Trials 2013; 14: 226.
28- Rondanelli M, Riva A, Petrangolini G, Allegrini P, Giacosa A, Fazia T, et al. Berberine Phospholipid is an Effective Insulin Sensitizer and
Improves Metabolic and Hormonal Disorders in Women with Polycystic Ovary Syndrome: A One-Group Pretest–Post-Test Explanatory Study. Nutrients 2021; 13(10): 3665.
29- An Y, Sun Z, Zhang Y, Liu B, Guan Y, Lu M. The Use of Berberine for Women with Polycystic Ovary Syndrome Undergoing IVF Treatment. Clin Endocrinal 2014; 80(3): 425-31.
30- Ashraf H, Khaneshi F, Rafei F, Nejati V. Effect of Aqueous Extract of Zarafshan Barberry Root on Testicular Tissue and Testosterone Level in Streptozotocin - Induced Diabetic Rats. Qom Univ Med Sci J 2013; 7(4): 28-35.
31- Al-Snafi AE. The Pharmacological Importance of Anethum Graveolens–A Review. Int J Pharm Pharm Sci 2014; 6(4): 11-3.
32- Monsefi M, Ghasemi M, Bahaoddini A. The Effects of Anethum Graveolens L. on Female Reproductive System. Phytother Res 2006; 20(10): 865-8.
33- Swaroop A, Bagchi M, Kumar P, Preuss HG, Tiwari K, Marone PA, et al. Safety, Efficacy and Toxicological Evaluation of a Novel, Patented Anti-Diabetic Extract of Trigonella Foenum-Graecum Seed Extract (Fenfuro). Toxicol Mech Methods 2014; 24(7): 495-503.
34- Hannan JM, Rokeya B, Faruque O, Nahar N, Mosihuzzaman M, Azad Khan AK, et al. Effect of Soluble Dietary Fibre Fraction of Trigonella Foenum Graecum on Glycemic, Insulinemic, Lipidemic and Platelet Aggregation Status of Type 2 Diabetic Model Rats. J Ethnopharmacol 2003; 88(1): 73-7.
متن کامل: (142 مشاهده)
مقدمه
سندرم تخمدان پلیکیستیک (PCOS) یکی از شایعترین بیماریهای اندوکرین زنان در سنین باروری است که منجر به عدم تخمکگذاری، قاعدگیهای نامرتب و حتی ناباروری همراه با علایم هیپرآندروژنیسم مثل آکنه و پرمویی میگردد (1). شیوع این سندرم از 4 تا 26 درصد در جمعیت جهان متفاوت است و در ایران نیز 14/8 تا 15/2درصد گزارش شده است (2). از جمله فاکتورهایی که با PCOS در ارتباط بوده و از عوامل زمینهساز و تشدیدکننده آن میباشند، میتوان مقاومت به انسولین، دیابت نوع 2، هیپرهموسیستئینمی و بیماریهای قلبی-عروقی را نام برد (3). اتیولوژی دقیق PCOS مشخص نیست. تحقیقات انجام شده نشان داده است که در PCOS تعدادی از اختلالات هورمونی- متابولیکی باعث تقویت و تشدید همدیگر میگردند. این اختلالات شامل نقص در عملکرد هیپوتالاموس- هیپوفیز، عملکرد تخمدان و عملکرد آدرنال است. در واقع PCOS با ترشحات غیرعادی گنادوتروپینهای LH و FSH، افزایش ترشح استروئیدهای تخمدان و همچنین مقاومت به انسولین همراه است (4). مبتلایان به PCOS عموماً دارای تخمدانهای بزرگ با استرومای هایپرتروفیک میباشند. این افراد به علت اختلال در روند رشد و نمو و آترزی فولیکولها، علیرغم دارا بودن تعداد زیاد فولیکول، فاقد تخمکگذاری و یا دارای تخمکگذاری نامنظم هستند (5). بهنظر میرسد که کاهش استرس اکسیداتیو با تجویز آنتیاکسیدانها میتواند سبب کاهش آثار زیانبار رادیکالهای آزاد اکسیژن و در نتیجه افزایش تعداد و کیفیت تخمک در این افراد شود. عدهای بر این باورند که تمرکز درمان در این بیماری میبایست بر روی افزایش آنتیاکسیدانها باشد (6). از درمانهای رایج این بیماری استفاده از داروهای شیمیایی مانند کلومیفن سیترات، لتروزول و متفورمین میباشد (7). با توجه به وجود ترکیبات فعال زیستی گوناگون، گیاهان به عنوان منبع بالقوهای برای ساخت ترکیبات دارویی جهت استفاده در پیشگیری و درمان بیماریها معرفی شدهاند. کپسول لیپوهرب شامل عصاره خشک پنج گیاه خرفه (Portulaca oleracea)، شوید ) graveolens (Anethum، کنگرفرنگی) scolymus (Cynara، شنبلیله foenum-graecum) (Trigonella و زرشک (Berberis vulgaris) دارای اثرات فارماکولوژیکی متعدد از جمله اثر بر پارامترهای متابولیک و هورمونی در بدن میباشند. مطالعات متعدد به اثبات رسانده است که ترکیبات امگا -۳ موجود در روغن تخم خرفه اثر بسیار بارزی در پائین آوردن تریگلیسرید و چربی خون داشته است و این ترکیبات هماکنون در سطح گستردهای به تنهائی یا همراه با مواد دیگر جهت کاهش چربی و کلسترول خون تجویز میگردند (8). مواد موثره موجود در شوید شامل فلاونوئید، فورانوکومارین، مواد معدنی از قبیل کلسیم، پتاسیم، منیزیم و فسفر، ویتامین آ و نیاسین میباشد (9). این گیاه دارای اثرات قوی در کاهش کلسترول خون احتمالا از طریق مهار فعالیت آنزیم HMG-CO reductase است که نقش اصلی در بیوسنتز کلسترول دارد و مطالعات تجربی متعدد بر روی حیوانات آزمایشگاهی و مطالعات بالینی، اثر بسیار مطلوب شوید بر فراکسیونهای مختلف چربی خون مانند HDL و LDL را تایید نموده است (10). ترکیبات موجود در برگهای کنگر فرنگی، سینارین و کلروژنیک اسید، موجب وقفه بیوسنتز کلسترول و کم شدن لیپوپروتئینهای خون میگردند (11). پژوهشی نشان داده است که ترکیبات موجود در شنبلیله با افزایش بیان ژن گیرنده LDL میتوانند باعث کاهش کلسترول خون شوند (12). ترکیبات موجود در میوه زرشک موجب ازدیاد ترشح صفرا شده دفع کلسترول را تشدید مینمایند (13). با توجه به آنچه گفته شد انتظار میرود که لیپوهرب که ترکیبی از گیاهان گفته شده است موجب کاهش LDL و تریگلیسریدهای خون شده و HDL را افزایش دهد و اثرات آنتیاکسیدانی مطلوبی داشته باشد. بنابراین مطالعه حاضر با هدف مقایسه اثر لیپوهرب با متفورمین بر تغییرات متابولیک و هورمونی موشهای صحرایی مبتلا به سندرم تخمدان پلیکیستیک (PCOS) انجام شده است.
روش بررسی
حیوانات وگروهها
نوع مطالعه، تجربی و از نوع آزمایشگاهی است. تعداد 30 سر موش صحرایی ماده ﺑﺎﻟﻎ ﻧﮋﺍﺩ ویستار ﺑﺎ ﻭﺯﻥ حدود20±200 ﮔﺮﻡ از خانه حیوانات پژوهشکده علوم تولیدمثل دانشگاه علوم پزشکی شهید صدوقی ﺗﻬﻴﻪ شد ﻭ در طول دوره آزمایش در شرایط استاندارد خانه حیوانات با دمای 2±23 درجه ﺳﺎﻧﺘﯽﮔﺮاد و دوره منظم روشنایی و تاریکی 12 ساعته نگهداری شدند. آﺏ ﻭ ﻏﺬﺍ ﺩﺭ طول مدت بررسی ﺑﻪ ﺍﻧﺪﺍﺯﻩ ﻛﺎﻓﻲ ﺩﺭ ﺍﺧﺘﻴﺎﺭ حیوانات ﻗﺮﺍﺭ گرفت. چرخه جنسی همه موشها با تهیه اسمیر واژن طی ۱۴ روز تعیین شد و 30 سر موش که سیکل منظم داشتند بهطور تصادفی به پنج گروه 6 تایی تقسیم شدند. در هر گروه موشها به مدت 8 هفته تحت درمان قرار گرفتند: گروه (1): گروه کنترل: در مدت 56 روز نرمال سالین دریافت کردند، گروه (2): به مدت 28 روز لتروزول (دوز mg/kg 1) دریافت کردند و در 28 روز بعدی نرمال سالین دریافت کردند، گروه (3): در 28 روز اول حامل لتروزول و در 28 روز بعدی لیپوهرب (دوز mg/kg 320) را دریافت کردند. گروه (4): به مدت 28 روزلتروزول (دوز mg/kg 1) و در 28 روز بعدی لیپوهرب (دوز mg/kg 320) را دریافت کردند. گروه (5): به مدت 28 روز لتروزول (دوز mg/kg 1) و در 28 روز بعدی متفورمین (دوز mg/kg 250) دریافت کردند. همه تجویزها بهصورت خوراکی و با لوله گاواژ انجام شد. وزن تمام موشها در شروع آزمایش و در پایان دوره آزمایش با استفاده از ترازوی دیجیتال اندازهگیری و ثبت شد.
تعیین چرخه جنسی موشهای صحرایی: حیوانات در ابتدای کار و قبل از انجام خونگیری از نظر نظم مراحل چرخه جنسی (هم سیکل نمودن موشهای صحرایی) مورد ارزیابی قرار گرفتند. مراحل چرخه جنسی از طریق نمونهگیری ترشحات واژن، تهیه اسمیر از ترشحات بر روی لام، رنگآمیزی گیمسا و در نهایت مشاهده سلولهای موجود در اسمیر در زیر میکروسکوپ نوری بررسی شد. در موشهای صحرایی آزمایشگاهی طول دوره استروس چهار یا پنج روز و دارای چهار مرحله اصلی است، مرحله 1: پرواستروس که در آن درلام اسمیر واژینال تمام سلولهای پوششی هستهدار دیده میشوند. مرحله 2: استروس، سلولها به شکل سلولهای شاخی هستند. مرحله 3 : مت استروس، سلولهای شاخی به همراه تعداد کمی گلبولهای سفید در لام اسمیر واژینال دیده میشوند و در نهایت مرحله دی استروس، که بیشتر گلبولهای سفید به همراه دو یا چند سلول شاخی درلام اسمیر واژینال دیده میشوند (شکل 1).
روش القای سندرم تخمدان پلیکیستیک: جهت القا سندرم تخمدان پلیکیستیک از لتروزول به میزان mg/kg 1 استفاده شد. موشها به مدت 28 روز لتروزول را بهصورت خوراکی با لوله گاواژ دریافت کردند. القای سندرم تخمدان پلیکیستیک در 6 موش جدا از گروهبندیهای مورد مطالعه بررسی شد. برای اطمینان از القای PCOS، بافت تخمدان جدا شده و پس از مقطعگیری و رنگآمیزی در زیر میکروسکوپ نوری کیستهای تخمدانی مشاهده شد (شکل 2). بعد ازآن موشهای مبتلا به سندرم پلیکیستیک در گروههای 2، 4 و 5، به ترتیب نرمالسالین (به عنوان حامل)، لیپوهرب با دوز 320 میلیگرم بر کیلوگرم و متفورمین با دوز 250 میلیگرم بر کیلوگرم دریافت نمودند.
خونگیری و اندازه گیری غلظت پارامترهای مورد مطالعه: خونگیری و اندازهگیری پارامترهای بیوشیمیایی و هورمونهای جنسی در ابتدا و قبل از شروع کار و نیز در پایان دوره 56 روزه آزمایش انجام شد. حیوانات با استفاده از مخلوط 1 به 10کتامین-زایلازین بیهوش شدند و ۳ میلیلیتر خون از قلب آنها کشیده شد. خون گرفته شده با دقت به لوله آزمایش منتقل شد تا از لیز گلبولها جلوگیری شود. نمونههای خونی در دمای اتاق به مدت 20 دقیقه با سرعت 3000 دور در دقیقه سانتریفوژ شدند. پس از جداسازی سرم، غلظت سرمی قند خون ناشتا، توتال کلسترول، HDL و LDL به روش اسپکتروفتومتری و هورمونهای پروژسترون، استروژن، تستوسترون و DHEA به روش الایزا و با استفاده از کیتهای تجاری Zellbio اندازهگیری شد.
تجزیه و تحلیل آماری
نتایج با استفاده از نرمافزارversion 16 SPSS و به کمک آنالیز واریانس یک طرفه با هم مقایسه شدند و از آزمون LSD برای مقایسه جفت گروهها استفاده شد. برای مقایسه در داخل هر گروه ازآزمون تی زوجی استفاده شد. جهت بررسی نتایج 0/05≥P به عنوان معنیدار بودن تفاوتها در نظرگرفته شد.
ملاحظات اخلاقی
اﺻﻮل اﺧﻼﻗﯽ ﻣﻄﺎﺑﻖ با ﻗﻮاﻧﯿﻦ ﺣﻤﺎیـﺖ و ﻧﮕﻬـﺪاری از ﺣﯿﻮاﻧﺎت آزﻣﺎیﺸﮕاهی رﻋﺎیﺖ ﮔﺮدیﺪ و کد IR.SSU.MEDICINE.REC.106/1397 از کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد دریافت شد.
.JPG)
شکل 1: مراحل مختلف چرخه جنسی در موش صحرایی ماده؛ در موش صحرایی آزمایشگاهی دوره استروس4 یـا 5 روز بوده و دارای چهار مرحله اصـلی پرواسـتروس(Proestrus) ، استروسEstrus) )، مـت اسـتروس (Metestrus) و دی استروس (Diestrus) است.
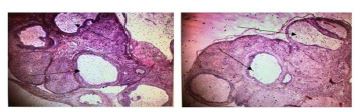
شکل 2: نمونه بافتی تخمدان تحت القای سندرم تخمدان پلیکیستیک (کیست های ایجاد شده با علامت فلش مشخص شده است)
نتایج
تغییرات وزن: نتایج این پارامتر نشان داد که میانگین وزن در تمامی گروهها افزایش یافته است. در گروه دریافتکننده لیپوهرب میانگین وزن قبل و بعد از درمان به ترتیب 4/3±193/14 و 10±213/1 گرم بود و اختلاف معناداری را بعد از درمان نشان داده است ((P<0/05).. در گروه PCOS دریافتکننده متفورمین میانگین وزن قبل و بعد از درمان به ترتیب 6/9±233/1 و 14/1±252/6 گرم بوده است که این افزایش وزن هم تفاوت معناداری را نشان داده است (P≤0/05) (نمودار 1). در بقیه گروهها افزایش معنیداری در وزن موشها پس از 56 روز درمان مشاهده نشد.
تغییرات قند خون: نتایج نشان داد که میانگین غلظت قند خون قبل و بعد از درمان در گروه PCOS دریافتکننده لیپوهرب به ترتیب 47±97/9 و 15/6±90/1 میلیگرم بر دسیلیتر بود و این کاهش غلظت بعد از درمان تفاوت معناداری را نشان نداد (P>0/05). افزون بر این، میانگین غلظت قند خون قبل و بعد از درمان در گروه PCOS دریافتکننده متفورمین به ترتیب 9±8/96 و 4±1/87 میلیگرم بر دسیلیتر بود و دراین گروه نیز اختلاف میانگین قند خون قبل و بعد از درمان تفاوت معناداری را نشان نداد (P>0/05). قبل از شروع درمان هیچ تفاوت معنیداری در قند خون گروههای مختلف وجود نداشت اما در پایان آزمایش، قند خون گروه PCOS دریافتکننده متفورمین بهصورت معنیداری کمتر از گروه دریافتکننده لتروزول به تنهایی (PCOS) بود (P<0/01) (نمودار2).
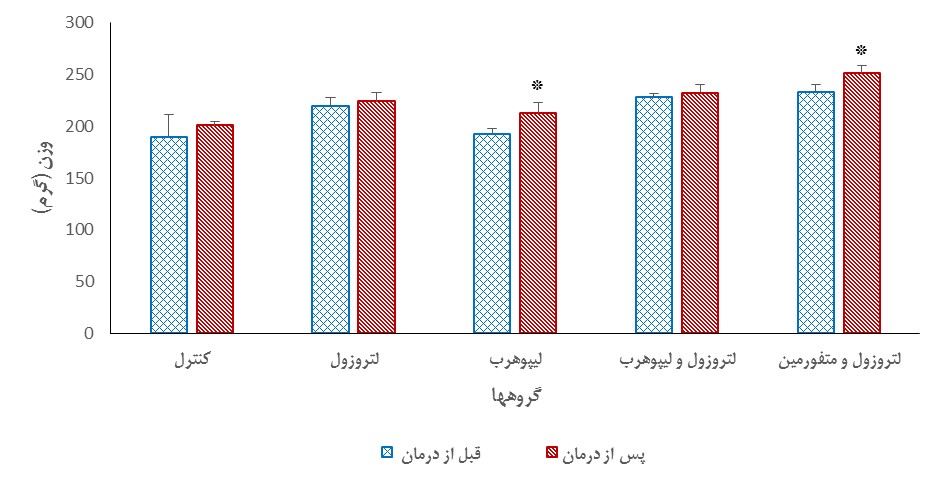
نمودار 1: مقایسه میانگین وزن قبل و بعد از درمان (تجویز دارو) در هر گروه مورد مطالعه (میانگینهای دارای تفاوت معنیدار با * مشخص شدهاند (0/05>P)).
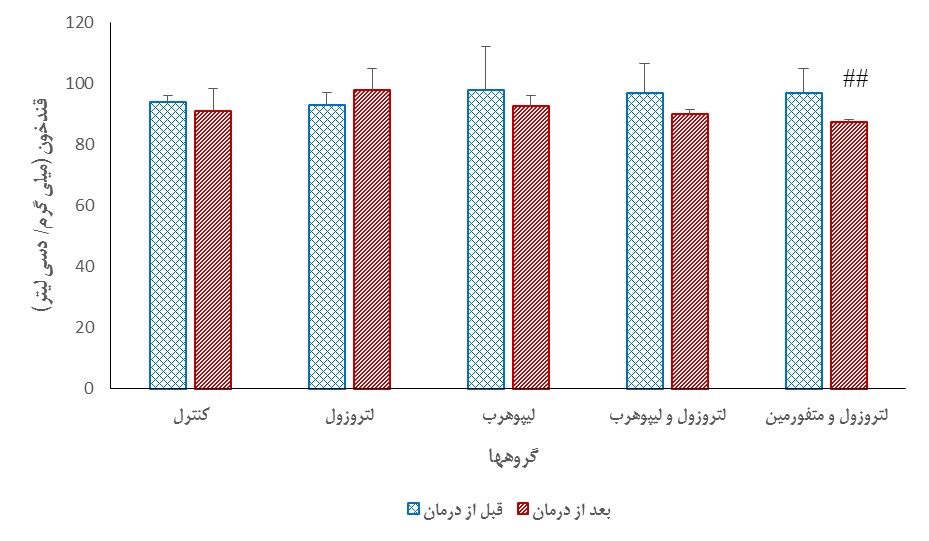
نمودار 2: مقایسه میانگین غلظت قند خون قبل و بعد از درمان (تجویز دارو) در هر گروه مورد مطالعه (میانگینهای دارای تفاوت معنیدار با * مشخص شده اند (0/05 >P)). مقایسه میانگین غلظت قند خون در گروههای مختلف در پایان آزمایش (0/01 >P## تفاوت معنیدار با گروه لتروزول به تنهایی).
تغییرات پروفایل لیپید: قبل از شروع درمان تفاوت معنیداری بین غلظت تریگلیسرید سرم در گروههای مختلف وجود نداشت اما در پایان دوره آزمایش، میزان تریگلیسرید سرم در گروهی که پس از القا PCOS با استفاده از لتروزول، لیپوهرب را دریافت کرده بود بهصورت معنیداری در مقایسه با گروه لتروزول به تنهایی کاهش یافت (P>0/05). در مقایسه درون گروهها، غلظت تریگلیسرید درگروههای لیپوهرب، لتروزول+ لیپوهرب و لتروزول+ متفورمین پس از آزمایش در مقایسه با پیش از آزمایش بهصورت معنیداری کاهش یافت (P>0/01) (نمودار 2- الف). مقایسه میانگین غلظت کلسترول LDL سرم درمیان گروههای مختلف درپایان دوره درمان نشان داد که این پارامتر درگروه دریافتکننده لتروزول و لیپوهرب در مقایسه با گروهی که تنها لتروزول دریافت کردند به صورت معناداری کاهش یافت (P>0/05)، اما در مقایسه درون گروهی، تفاوت معنیداری در میزان کلسترول LDL سرم قبل و پس از آزمایش در هیچ گروهی مشاهده نشد (نمودار 3-ب). بررسی میانگین غلظت کلسترول تام در گروههای مورد مطالعه بعد از درمان نشان داد که درگروه لتروزول+ لیپوهرب در مقایسه با دیگرگروهها، میانگین غلظت کلسترول تام بهصورت معناداری کاهش یافته است (P>0/01). در مقایسه درونگروهی نیز تنها در گروه لتروزول+ لیپوهرب کاهش معنیدار در میانگین غلظت کلسترول تام موشها در پایان دوره آزمایش مشاهده شد (P>0/01) (نمودار3 –ج). در مقایسه درونگروهی قبل و پس از دوره درمان و نیز مقایسه بین گروهها در پایان دوره درمان، هیچ اختلاف معناداری در میانگین غلظت HDL سرم در گروههای مختلف مشاهده نشد (نمودار3-د).
تغییرات هورمونهای جنسی: نتایج حاصل از بررسی سطح سرمی استروژن با توجه به نمودار 4-الف، نشان میدهد که درگروه دریافتکننده لیپوهرب سطح سرمی این هورمون بعد ازدرمان در مقایسه با قبل از شروع درمان بهطور معنیدار کاهش داشته است (P<0/05) و نیز در مقایسه بین گروهها در پایان دوره درمان، سطح سرمی استروژن در گروه دریافتکننده لیپوهرب در مقایسه با گروه لتروزول به تنهایی بهصورت معناداری کمتر است (P<0/05). مقایسه سطح سرمی پروژسترون درون گروههای مختلف قبل و پس از درمان و نیز بین گروههای مختلف در پایان درمان هیچ تفاوت معنیداری را نشان نداد (نمودار4-ب). در مقایسه درون گروهی سطح هورمون تستوسترون در تمام گروه ها قبل و پس از دوره درمان تفاوت معنی داری نداشت بجز گروه دریافتکننده لتروزول به تنهایی که افزایش میزان تستوسترون در پایان دوره در مقایسه با قبل از شروع آزمایش کاملاً معنیدار بود (001/0P<). مقایسه سطح تستوسترون خون بین گروههای مختلف در پایان آزمایش نشان داد که در گروه دریافتکننده لتروزول به تنهایی (گروه PCOS بدون درمان) سطح این هورمون از همه گروهها بیشتر است و این تفاوت از نظر آماری کاملاً معنیدار است (P<0/01)(نمودار4-ج). مانند هورمون پروژسترون، مقایسه سطح سرمی DHEA درون گروههای مختلف قبل و پس از درمان و نیز بین گروههای مختلف در پایان درمان هیچ تفاوت معنیداری را نشان نداد (نمودار4-د).
.JPG)
نمودار 3: الف. مقایسه میانگین غلظت تریگلیسرید سرم، ب. مقایسه میانگین غلظت کلسترول LDL سرم، ج. مقایسه میانگین غلظت کلسترول تام سرم، د. مقایسه میانگین غلظت کلسترول HDL سرم. مقایسه به صورت درون گروهی قبل و بعد از درمان (تجویز دارو) و نیز بین گروههای مختلف در پایان دوره درمان انجام شده است. * نشانه تفاوت معنی دار میانگینها در مقایسه درون گروهی و # نشانه تفاوت معنی دار با گروه دریافتکننده لتروزول به تنهایی است.
(0/05>P)*، (P<0/01)**، (0/05>P)#، (P<0/01)## .
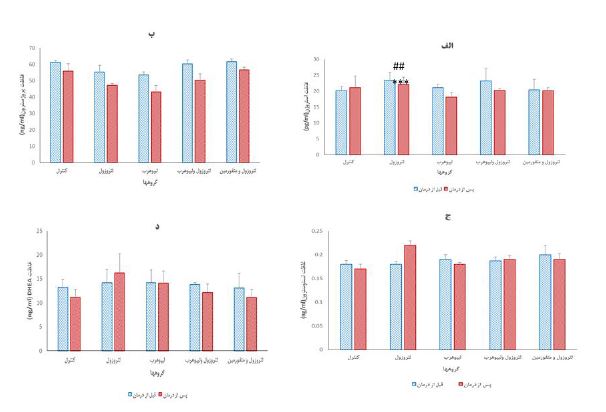
نمودار 4: الف. مقایسه میانگین غلظت هورمون استروژن در سرم، ب. مقایسه میانگین غلظت هورمون پروژسترون در سرم، ج. مقایسه میانگین غلظت هورمون تستوسترون در سرم، د. مقایسه میانگین غلظت DHEA در سرم. مقایسه به صورت درون گروهی قبل و بعد از درمان (تجویز دارو) و نیز بین گروههای مختلف در پایان دوره درمان انجام شده است. * نشانه تفاوت معنی دار میانگینها در مقایسه درون گروهی و # نشانه تفاوت معنی دار بین گروههای مختلف است. در نمودار الف غلظت استروژن در گروه دریافتکننده لیپوهرب به صورت معنی داری کمتر از گروه دریافتکننده لتروزول است. در نمودار ج غلظت تستوسترون درگروه دریافتکننده لتروزول به صورت معنی داری از همه گروههای دیگر بیشتر است. (0/05 >P)*، (P<0/001)***، (P<0/05)#، (P<0/01)## .
بحث
استفاده ازگیاهان دارویی درکناریا به عنوان جایگزینی برای داروهای شیمیایی و سنتری همواره مطرح بوده است. مطالعه حاضر با هدف بررسی اثر داروی گیاهی لیپوهرب،که حاوی پنج گیاه خرفه، شوید،کنگر فرنگی، شنبلیله و زرشک است، بر تغییرات متابولیک و هورمونی موشهای صحرایی مبتلا به سندرم تخمدان پلیکیستیک و مقایسه آن با اثرات متفورمین که یک درمان استاندارد و رایج برای PCOS است، انجام شد. تغییرات وزن، سطح قند خون ناشتا FBS) ) وپروفایل لیپید شامل کلسترول وتریگلیسرید، لیپوپروتئین با دانسیته زیاد(HDL) و لیپوپروتئین با دانسیته کمLDL)) و نیز غلظت هورمونهای جنسی شامل استروژن، پروژسترون، تستوسـترون و DHEA در سرم اندازهگیری شد. یافتههای این مطالعه نشان داد که ترکیب 5 گیاه خرفه، شوید،کنگر فرنگی، شنبلیله و زرشک در مقایسه با متفورمین، توانایی بیشتری برای اصلاح علایم متابولیک به ویژه پروفایل لیپیدی موشهای مبتلا به PCOS داشته است. هرچند توانایی متفورمین برای کاهش قند خون بیشتر از لیپوهرب (ترکیب گیاهان گفته شده) بوده است. در عین حال براساس نتایج بهدست آمده بهنظر میرسد که اثرات هورمونی لیپوهرب تفاوت معنیداری با اثرات هورمونی متفورمین در سندرم تخمدان پلیکیستیک نداشته است. خرفه توسط WHO به عنوان یکی از پرکاربردترین گیاهان طبی نام برده شده است (8). در تحقیقات قبلی نشان داده شده است که عصاره گیاه خرفه میتواند از ایجاد التهاب عروقی توسط دیابت جلوگیری کند و قند خون را کاهش دهد (16-14). گیاه خرفه دارای مواد بیولوژیکی فعالی مانند نورآدرنالین است که در آزادسازی GnRH موثر و در نهایت در تنظیم غلظت FSH نقش دارند (18,17). در مطالعات به این نتیجه رسیده اند که فیتواستروژنها مانند فلاونوییدها و کومارینها باعث کاهش آندروژنها و درنهایت کاهش سطح استروژن میشوند. همچنین کومارینهای موجود در گیاه خرفه فعالیت ضد آروماتازی از خود نشان میدهند که میتوانند باعث کاهش سطح استروژن شوند (19-21). نتایج مطالعه ما هم با مطالعات قبلی همراستا است و لیپوهرب در مقایسه با سایر گروهها در کاهش معنیدار سطح استروژن موثر بوده است. کنگرفرنگی از خانواده کاسنی است و از قدیمی ترین گیاهان دارویی جهان است. این گیاه بومی جنوب اروپا، مدیترانه، شمال آفریقا و جزایز قناری است. در ایران در بعضی مناطق کشور از جمله قزوین، اندیمشک به صورت محدود کشت داده میشود. در بیماریهایی مانند دیابت شیرین، چاقی متابولیک، کهیر، آسم، سنگ کلیه، تصلب شرائین، روماتیسم و بیماریهای پوست نظیر اگزما و التهاب مفید است. در مطالعه Fritsche و Beindorff نشان داده شده که سینارین، کلروژنیک اسید، لوتئلین و فرم گلیکوزید آن و سیناروزید عمدهترین ترکیبهای فعال بیولوژیک موجود در کنگرفرنگی هستند که فعالیت آنتی اکسیدانی دارند (22). تحقیقات نشان داده است که کنگرفرنگی به دلیل دارا بودن کلروژنیک اسید درکاهش قند خون تاثیر دارد (11). در مطالعه حاضر نیز نتایج بررسی غلظت قند خون نشان داد که میانگین غلظت قند خون قبل و بعد از درمان در گروه PCOSدریافتکننده لیپوهرب به ترتیب 12/4±97/9 و 1/6±90/15 میلی گرم در دسی لیتر بود. Shimoda و همکاران به این نتیجه رسیدند که عصاره برگ کنگرفرنگی سطح تریگلیسیرید را کاهش میدهد (23). که با نتایج مطالعه حاضر همخوانی دارد. همچنین درمطالعات مختلف اثرات مفید کنگر فرنگی شامل اثرات ضد دیابت، ضد چاقی، ضد التهاب، ضد کلسترول خون، محافظ کبد، و ضد سرطان آن اثبات شده است (24,25). از دیگر اجزای ترکیب گیاهان میتوان به عصاره زرشک اشاره نمود. زرشک یکی از گیاهانی است که تاریخچهای طولانی در طب سنتی دارد و در درمان تبهای عفونی، تیفوس و اسهال مورد استفاده قرار میگرفته است (26). مطالعات قبلی به بررسی اثر بربرین به عنوان یکی از مواد موثره زرشک در بیماران مبتلا بهPCOS پرداختند و نشان داده شده است که بربرین میتواند همانند متفورمین میزان مقاومت به انسولین را کاهش بخشد (27). بعضی از مطالعات نیز به بررسی اثر بربرین در زنان مبتلا به PCOS پرداختهاند (28). به عنوان مثال در یک مطالعه کوهورت با مشارکت 150 زن نابارور مبتلا به PCOS اثر متفورمین، بربرین و پلاسبو با یکدیگر مقایسه شد و مشاهده شدکه میزان تستوسترون، قند خون ناشتا، انسولین ناشتا، میزان اندروژن آزاد در گروه بربرین کاهش یافته بهطوری که که این اثرات با متفورمین یکسان بوده است (29). اشرف و همکاران در مطالعه ای به این نتیجه رسیدند که عصاره زرشک در افزایش سطح هورمون تستوسترون و کاهش سطح هورمون استروژن تاثیر دارد (30). نتایج مطالعه حاضر نیز نشان داد که در گروه دریافتکننده لیپوهرب سطح سرمی استروژن بعد ازدرمان به طور معنی دار کاهش داشته است (0/05 >P). گیاه شوید گیاهی علفی و معطر است که از جمله اجزای اصلی آن کاروون، فلاندرن، لیمونن و تانن میباشد (31). شوید نیز به عنوان یکی از اجزای ترکیب گیاهان میتواند در بهبود شرایط بیماران PCOS موثر باشد. این فرضیه از مطالعهای توسط منصفی و همکاران در سال 2006 بهدست آمد که از عصاره شوید در درمان موشها با سیکلهای استروس نامنظم استفاده شد و نشان داده شد که شوید میتواند مدت زمان سیکل استروس و فاز دیستروس را در موشها به شکل چشمگیری افزایش دهد. استفاده از شوید میتواند با تاثیر بر فاز لوتئال و افزایش فعالیت و بقای کورپوس لوتئوم باعث افزایش مدت زمان فاز لوتئال شود و میتوان از آن در درمان نامنظمی سیکل قاعدگی استفاده نمود (32). یکی دیگر از اجزای ترکیب گیاهان، عصاره گیاه شنبلیله میباشد. در مطالعات قبلی اثرات ضد دیابتی این گیاه در مدلهای آزمایشگاهی نشان داده شده است (33). Hannan و همکاران در مطالعهای به این نتیجه رسیدند که عصاره شنبلیله باعث افزایش کلسترول HDL و کاهش کلسترولLDL و تام و تریگلیسیرید در موشهای دیابتی نوع دو می شود (34). نتایج یافت شده در مطالعه حاضر نیز همراستا با مطالعات قبلی است. با در نظر گرفتن یافتههای این مطالعه و مقایسه آن با مطالعات دیگر میتوان گفت اثر این گیاهان به صورت ترکیبی بر روی تغییرات متابولیکی و به ویژه پروفایل لیپیدی همراستا با اثر هر کدام از آنها به تنهایی و در جهت بهبود علایم در سندرم تخمدان پلیکیستیک است. این ترکیب گیاهی همچنین توانسته است سطح تستوسترون و DHEA را در مقایسه با گروهی که تنها لتروزول دریافت کردهاند یعنی PCOS در آنها القا شده است ولی درمانی دریافت نکردهاند کاهش دهد. هرچند اثرات این ترکیب گیاهی بر روی تغییرات هورمونی بر اثرات متفورمین برتری ندارد اما تفاوت معنیداری هم با متفورمین نداد و بنابراین میتوان نتیجه گرفت که میتوان از ترکیب این گیاهان به جای و یا در کنار متفورمین برای درمان PCOS استفاده کرد.
نتیجهگیری
در نهایت میتوان گفت که در مقایسه با متفورمین، لیپوهرب که ترکیب 5 گیاه خرفه، شوید،کنگر فرنگی، شنبلیله و زرشک است، توانایی بیشتری برای اصلاح علایم متابولیک موش های مبتلا به PCOS داشته است. هرچند اثرات هورمونی لیپوهرب تفاوت معنیداری با اثرات هورمونی متفورمین در سندرم تخمدان پلیکیستیک نداشته است.
سپاسگزاری
نویسندگان مقاله، مراتب قدردانی خود را از معاونت پژوهشی و مرکز تحقیقات علوم دارویی دانشکده داروسازی علوم پزشکی شهید صدوقی یزد به واسطه تأمین هزینه و انجام این پایاننامه (کد6633) را اعلام میدارند. این پایاننامه در سال1397 در این دانشکده تصویب و در آزمایشگاه تحقیقاتی فیزیولوژی و فارماکولوژی انجام شده است هیچکدام از نویسندگان این مطالعه، تعارض منافعی برای انتشار این مقاله ندارند.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد
تعارض در منافع: وجود ندارد.
سندرم تخمدان پلیکیستیک (PCOS) یکی از شایعترین بیماریهای اندوکرین زنان در سنین باروری است که منجر به عدم تخمکگذاری، قاعدگیهای نامرتب و حتی ناباروری همراه با علایم هیپرآندروژنیسم مثل آکنه و پرمویی میگردد (1). شیوع این سندرم از 4 تا 26 درصد در جمعیت جهان متفاوت است و در ایران نیز 14/8 تا 15/2درصد گزارش شده است (2). از جمله فاکتورهایی که با PCOS در ارتباط بوده و از عوامل زمینهساز و تشدیدکننده آن میباشند، میتوان مقاومت به انسولین، دیابت نوع 2، هیپرهموسیستئینمی و بیماریهای قلبی-عروقی را نام برد (3). اتیولوژی دقیق PCOS مشخص نیست. تحقیقات انجام شده نشان داده است که در PCOS تعدادی از اختلالات هورمونی- متابولیکی باعث تقویت و تشدید همدیگر میگردند. این اختلالات شامل نقص در عملکرد هیپوتالاموس- هیپوفیز، عملکرد تخمدان و عملکرد آدرنال است. در واقع PCOS با ترشحات غیرعادی گنادوتروپینهای LH و FSH، افزایش ترشح استروئیدهای تخمدان و همچنین مقاومت به انسولین همراه است (4). مبتلایان به PCOS عموماً دارای تخمدانهای بزرگ با استرومای هایپرتروفیک میباشند. این افراد به علت اختلال در روند رشد و نمو و آترزی فولیکولها، علیرغم دارا بودن تعداد زیاد فولیکول، فاقد تخمکگذاری و یا دارای تخمکگذاری نامنظم هستند (5). بهنظر میرسد که کاهش استرس اکسیداتیو با تجویز آنتیاکسیدانها میتواند سبب کاهش آثار زیانبار رادیکالهای آزاد اکسیژن و در نتیجه افزایش تعداد و کیفیت تخمک در این افراد شود. عدهای بر این باورند که تمرکز درمان در این بیماری میبایست بر روی افزایش آنتیاکسیدانها باشد (6). از درمانهای رایج این بیماری استفاده از داروهای شیمیایی مانند کلومیفن سیترات، لتروزول و متفورمین میباشد (7). با توجه به وجود ترکیبات فعال زیستی گوناگون، گیاهان به عنوان منبع بالقوهای برای ساخت ترکیبات دارویی جهت استفاده در پیشگیری و درمان بیماریها معرفی شدهاند. کپسول لیپوهرب شامل عصاره خشک پنج گیاه خرفه (Portulaca oleracea)، شوید ) graveolens (Anethum، کنگرفرنگی) scolymus (Cynara، شنبلیله foenum-graecum) (Trigonella و زرشک (Berberis vulgaris) دارای اثرات فارماکولوژیکی متعدد از جمله اثر بر پارامترهای متابولیک و هورمونی در بدن میباشند. مطالعات متعدد به اثبات رسانده است که ترکیبات امگا -۳ موجود در روغن تخم خرفه اثر بسیار بارزی در پائین آوردن تریگلیسرید و چربی خون داشته است و این ترکیبات هماکنون در سطح گستردهای به تنهائی یا همراه با مواد دیگر جهت کاهش چربی و کلسترول خون تجویز میگردند (8). مواد موثره موجود در شوید شامل فلاونوئید، فورانوکومارین، مواد معدنی از قبیل کلسیم، پتاسیم، منیزیم و فسفر، ویتامین آ و نیاسین میباشد (9). این گیاه دارای اثرات قوی در کاهش کلسترول خون احتمالا از طریق مهار فعالیت آنزیم HMG-CO reductase است که نقش اصلی در بیوسنتز کلسترول دارد و مطالعات تجربی متعدد بر روی حیوانات آزمایشگاهی و مطالعات بالینی، اثر بسیار مطلوب شوید بر فراکسیونهای مختلف چربی خون مانند HDL و LDL را تایید نموده است (10). ترکیبات موجود در برگهای کنگر فرنگی، سینارین و کلروژنیک اسید، موجب وقفه بیوسنتز کلسترول و کم شدن لیپوپروتئینهای خون میگردند (11). پژوهشی نشان داده است که ترکیبات موجود در شنبلیله با افزایش بیان ژن گیرنده LDL میتوانند باعث کاهش کلسترول خون شوند (12). ترکیبات موجود در میوه زرشک موجب ازدیاد ترشح صفرا شده دفع کلسترول را تشدید مینمایند (13). با توجه به آنچه گفته شد انتظار میرود که لیپوهرب که ترکیبی از گیاهان گفته شده است موجب کاهش LDL و تریگلیسریدهای خون شده و HDL را افزایش دهد و اثرات آنتیاکسیدانی مطلوبی داشته باشد. بنابراین مطالعه حاضر با هدف مقایسه اثر لیپوهرب با متفورمین بر تغییرات متابولیک و هورمونی موشهای صحرایی مبتلا به سندرم تخمدان پلیکیستیک (PCOS) انجام شده است.
روش بررسی
حیوانات وگروهها
نوع مطالعه، تجربی و از نوع آزمایشگاهی است. تعداد 30 سر موش صحرایی ماده ﺑﺎﻟﻎ ﻧﮋﺍﺩ ویستار ﺑﺎ ﻭﺯﻥ حدود20±200 ﮔﺮﻡ از خانه حیوانات پژوهشکده علوم تولیدمثل دانشگاه علوم پزشکی شهید صدوقی ﺗﻬﻴﻪ شد ﻭ در طول دوره آزمایش در شرایط استاندارد خانه حیوانات با دمای 2±23 درجه ﺳﺎﻧﺘﯽﮔﺮاد و دوره منظم روشنایی و تاریکی 12 ساعته نگهداری شدند. آﺏ ﻭ ﻏﺬﺍ ﺩﺭ طول مدت بررسی ﺑﻪ ﺍﻧﺪﺍﺯﻩ ﻛﺎﻓﻲ ﺩﺭ ﺍﺧﺘﻴﺎﺭ حیوانات ﻗﺮﺍﺭ گرفت. چرخه جنسی همه موشها با تهیه اسمیر واژن طی ۱۴ روز تعیین شد و 30 سر موش که سیکل منظم داشتند بهطور تصادفی به پنج گروه 6 تایی تقسیم شدند. در هر گروه موشها به مدت 8 هفته تحت درمان قرار گرفتند: گروه (1): گروه کنترل: در مدت 56 روز نرمال سالین دریافت کردند، گروه (2): به مدت 28 روز لتروزول (دوز mg/kg 1) دریافت کردند و در 28 روز بعدی نرمال سالین دریافت کردند، گروه (3): در 28 روز اول حامل لتروزول و در 28 روز بعدی لیپوهرب (دوز mg/kg 320) را دریافت کردند. گروه (4): به مدت 28 روزلتروزول (دوز mg/kg 1) و در 28 روز بعدی لیپوهرب (دوز mg/kg 320) را دریافت کردند. گروه (5): به مدت 28 روز لتروزول (دوز mg/kg 1) و در 28 روز بعدی متفورمین (دوز mg/kg 250) دریافت کردند. همه تجویزها بهصورت خوراکی و با لوله گاواژ انجام شد. وزن تمام موشها در شروع آزمایش و در پایان دوره آزمایش با استفاده از ترازوی دیجیتال اندازهگیری و ثبت شد.
تعیین چرخه جنسی موشهای صحرایی: حیوانات در ابتدای کار و قبل از انجام خونگیری از نظر نظم مراحل چرخه جنسی (هم سیکل نمودن موشهای صحرایی) مورد ارزیابی قرار گرفتند. مراحل چرخه جنسی از طریق نمونهگیری ترشحات واژن، تهیه اسمیر از ترشحات بر روی لام، رنگآمیزی گیمسا و در نهایت مشاهده سلولهای موجود در اسمیر در زیر میکروسکوپ نوری بررسی شد. در موشهای صحرایی آزمایشگاهی طول دوره استروس چهار یا پنج روز و دارای چهار مرحله اصلی است، مرحله 1: پرواستروس که در آن درلام اسمیر واژینال تمام سلولهای پوششی هستهدار دیده میشوند. مرحله 2: استروس، سلولها به شکل سلولهای شاخی هستند. مرحله 3 : مت استروس، سلولهای شاخی به همراه تعداد کمی گلبولهای سفید در لام اسمیر واژینال دیده میشوند و در نهایت مرحله دی استروس، که بیشتر گلبولهای سفید به همراه دو یا چند سلول شاخی درلام اسمیر واژینال دیده میشوند (شکل 1).
روش القای سندرم تخمدان پلیکیستیک: جهت القا سندرم تخمدان پلیکیستیک از لتروزول به میزان mg/kg 1 استفاده شد. موشها به مدت 28 روز لتروزول را بهصورت خوراکی با لوله گاواژ دریافت کردند. القای سندرم تخمدان پلیکیستیک در 6 موش جدا از گروهبندیهای مورد مطالعه بررسی شد. برای اطمینان از القای PCOS، بافت تخمدان جدا شده و پس از مقطعگیری و رنگآمیزی در زیر میکروسکوپ نوری کیستهای تخمدانی مشاهده شد (شکل 2). بعد ازآن موشهای مبتلا به سندرم پلیکیستیک در گروههای 2، 4 و 5، به ترتیب نرمالسالین (به عنوان حامل)، لیپوهرب با دوز 320 میلیگرم بر کیلوگرم و متفورمین با دوز 250 میلیگرم بر کیلوگرم دریافت نمودند.
خونگیری و اندازه گیری غلظت پارامترهای مورد مطالعه: خونگیری و اندازهگیری پارامترهای بیوشیمیایی و هورمونهای جنسی در ابتدا و قبل از شروع کار و نیز در پایان دوره 56 روزه آزمایش انجام شد. حیوانات با استفاده از مخلوط 1 به 10کتامین-زایلازین بیهوش شدند و ۳ میلیلیتر خون از قلب آنها کشیده شد. خون گرفته شده با دقت به لوله آزمایش منتقل شد تا از لیز گلبولها جلوگیری شود. نمونههای خونی در دمای اتاق به مدت 20 دقیقه با سرعت 3000 دور در دقیقه سانتریفوژ شدند. پس از جداسازی سرم، غلظت سرمی قند خون ناشتا، توتال کلسترول، HDL و LDL به روش اسپکتروفتومتری و هورمونهای پروژسترون، استروژن، تستوسترون و DHEA به روش الایزا و با استفاده از کیتهای تجاری Zellbio اندازهگیری شد.
تجزیه و تحلیل آماری
نتایج با استفاده از نرمافزارversion 16 SPSS و به کمک آنالیز واریانس یک طرفه با هم مقایسه شدند و از آزمون LSD برای مقایسه جفت گروهها استفاده شد. برای مقایسه در داخل هر گروه ازآزمون تی زوجی استفاده شد. جهت بررسی نتایج 0/05≥P به عنوان معنیدار بودن تفاوتها در نظرگرفته شد.
ملاحظات اخلاقی
اﺻﻮل اﺧﻼﻗﯽ ﻣﻄﺎﺑﻖ با ﻗﻮاﻧﯿﻦ ﺣﻤﺎیـﺖ و ﻧﮕﻬـﺪاری از ﺣﯿﻮاﻧﺎت آزﻣﺎیﺸﮕاهی رﻋﺎیﺖ ﮔﺮدیﺪ و کد IR.SSU.MEDICINE.REC.106/1397 از کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد دریافت شد.
.JPG)
شکل 1: مراحل مختلف چرخه جنسی در موش صحرایی ماده؛ در موش صحرایی آزمایشگاهی دوره استروس4 یـا 5 روز بوده و دارای چهار مرحله اصـلی پرواسـتروس(Proestrus) ، استروسEstrus) )، مـت اسـتروس (Metestrus) و دی استروس (Diestrus) است.

شکل 2: نمونه بافتی تخمدان تحت القای سندرم تخمدان پلیکیستیک (کیست های ایجاد شده با علامت فلش مشخص شده است)
نتایج
تغییرات وزن: نتایج این پارامتر نشان داد که میانگین وزن در تمامی گروهها افزایش یافته است. در گروه دریافتکننده لیپوهرب میانگین وزن قبل و بعد از درمان به ترتیب 4/3±193/14 و 10±213/1 گرم بود و اختلاف معناداری را بعد از درمان نشان داده است ((P<0/05).. در گروه PCOS دریافتکننده متفورمین میانگین وزن قبل و بعد از درمان به ترتیب 6/9±233/1 و 14/1±252/6 گرم بوده است که این افزایش وزن هم تفاوت معناداری را نشان داده است (P≤0/05) (نمودار 1). در بقیه گروهها افزایش معنیداری در وزن موشها پس از 56 روز درمان مشاهده نشد.
تغییرات قند خون: نتایج نشان داد که میانگین غلظت قند خون قبل و بعد از درمان در گروه PCOS دریافتکننده لیپوهرب به ترتیب 47±97/9 و 15/6±90/1 میلیگرم بر دسیلیتر بود و این کاهش غلظت بعد از درمان تفاوت معناداری را نشان نداد (P>0/05). افزون بر این، میانگین غلظت قند خون قبل و بعد از درمان در گروه PCOS دریافتکننده متفورمین به ترتیب 9±8/96 و 4±1/87 میلیگرم بر دسیلیتر بود و دراین گروه نیز اختلاف میانگین قند خون قبل و بعد از درمان تفاوت معناداری را نشان نداد (P>0/05). قبل از شروع درمان هیچ تفاوت معنیداری در قند خون گروههای مختلف وجود نداشت اما در پایان آزمایش، قند خون گروه PCOS دریافتکننده متفورمین بهصورت معنیداری کمتر از گروه دریافتکننده لتروزول به تنهایی (PCOS) بود (P<0/01) (نمودار2).

نمودار 1: مقایسه میانگین وزن قبل و بعد از درمان (تجویز دارو) در هر گروه مورد مطالعه (میانگینهای دارای تفاوت معنیدار با * مشخص شدهاند (0/05>P)).

نمودار 2: مقایسه میانگین غلظت قند خون قبل و بعد از درمان (تجویز دارو) در هر گروه مورد مطالعه (میانگینهای دارای تفاوت معنیدار با * مشخص شده اند (0/05 >P)). مقایسه میانگین غلظت قند خون در گروههای مختلف در پایان آزمایش (0/01 >P## تفاوت معنیدار با گروه لتروزول به تنهایی).
تغییرات پروفایل لیپید: قبل از شروع درمان تفاوت معنیداری بین غلظت تریگلیسرید سرم در گروههای مختلف وجود نداشت اما در پایان دوره آزمایش، میزان تریگلیسرید سرم در گروهی که پس از القا PCOS با استفاده از لتروزول، لیپوهرب را دریافت کرده بود بهصورت معنیداری در مقایسه با گروه لتروزول به تنهایی کاهش یافت (P>0/05). در مقایسه درون گروهها، غلظت تریگلیسرید درگروههای لیپوهرب، لتروزول+ لیپوهرب و لتروزول+ متفورمین پس از آزمایش در مقایسه با پیش از آزمایش بهصورت معنیداری کاهش یافت (P>0/01) (نمودار 2- الف). مقایسه میانگین غلظت کلسترول LDL سرم درمیان گروههای مختلف درپایان دوره درمان نشان داد که این پارامتر درگروه دریافتکننده لتروزول و لیپوهرب در مقایسه با گروهی که تنها لتروزول دریافت کردند به صورت معناداری کاهش یافت (P>0/05)، اما در مقایسه درون گروهی، تفاوت معنیداری در میزان کلسترول LDL سرم قبل و پس از آزمایش در هیچ گروهی مشاهده نشد (نمودار 3-ب). بررسی میانگین غلظت کلسترول تام در گروههای مورد مطالعه بعد از درمان نشان داد که درگروه لتروزول+ لیپوهرب در مقایسه با دیگرگروهها، میانگین غلظت کلسترول تام بهصورت معناداری کاهش یافته است (P>0/01). در مقایسه درونگروهی نیز تنها در گروه لتروزول+ لیپوهرب کاهش معنیدار در میانگین غلظت کلسترول تام موشها در پایان دوره آزمایش مشاهده شد (P>0/01) (نمودار3 –ج). در مقایسه درونگروهی قبل و پس از دوره درمان و نیز مقایسه بین گروهها در پایان دوره درمان، هیچ اختلاف معناداری در میانگین غلظت HDL سرم در گروههای مختلف مشاهده نشد (نمودار3-د).
تغییرات هورمونهای جنسی: نتایج حاصل از بررسی سطح سرمی استروژن با توجه به نمودار 4-الف، نشان میدهد که درگروه دریافتکننده لیپوهرب سطح سرمی این هورمون بعد ازدرمان در مقایسه با قبل از شروع درمان بهطور معنیدار کاهش داشته است (P<0/05) و نیز در مقایسه بین گروهها در پایان دوره درمان، سطح سرمی استروژن در گروه دریافتکننده لیپوهرب در مقایسه با گروه لتروزول به تنهایی بهصورت معناداری کمتر است (P<0/05). مقایسه سطح سرمی پروژسترون درون گروههای مختلف قبل و پس از درمان و نیز بین گروههای مختلف در پایان درمان هیچ تفاوت معنیداری را نشان نداد (نمودار4-ب). در مقایسه درون گروهی سطح هورمون تستوسترون در تمام گروه ها قبل و پس از دوره درمان تفاوت معنی داری نداشت بجز گروه دریافتکننده لتروزول به تنهایی که افزایش میزان تستوسترون در پایان دوره در مقایسه با قبل از شروع آزمایش کاملاً معنیدار بود (001/0P<). مقایسه سطح تستوسترون خون بین گروههای مختلف در پایان آزمایش نشان داد که در گروه دریافتکننده لتروزول به تنهایی (گروه PCOS بدون درمان) سطح این هورمون از همه گروهها بیشتر است و این تفاوت از نظر آماری کاملاً معنیدار است (P<0/01)(نمودار4-ج). مانند هورمون پروژسترون، مقایسه سطح سرمی DHEA درون گروههای مختلف قبل و پس از درمان و نیز بین گروههای مختلف در پایان درمان هیچ تفاوت معنیداری را نشان نداد (نمودار4-د).
.JPG)
نمودار 3: الف. مقایسه میانگین غلظت تریگلیسرید سرم، ب. مقایسه میانگین غلظت کلسترول LDL سرم، ج. مقایسه میانگین غلظت کلسترول تام سرم، د. مقایسه میانگین غلظت کلسترول HDL سرم. مقایسه به صورت درون گروهی قبل و بعد از درمان (تجویز دارو) و نیز بین گروههای مختلف در پایان دوره درمان انجام شده است. * نشانه تفاوت معنی دار میانگینها در مقایسه درون گروهی و # نشانه تفاوت معنی دار با گروه دریافتکننده لتروزول به تنهایی است.
(0/05>P)*، (P<0/01)**، (0/05>P)#، (P<0/01)## .

نمودار 4: الف. مقایسه میانگین غلظت هورمون استروژن در سرم، ب. مقایسه میانگین غلظت هورمون پروژسترون در سرم، ج. مقایسه میانگین غلظت هورمون تستوسترون در سرم، د. مقایسه میانگین غلظت DHEA در سرم. مقایسه به صورت درون گروهی قبل و بعد از درمان (تجویز دارو) و نیز بین گروههای مختلف در پایان دوره درمان انجام شده است. * نشانه تفاوت معنی دار میانگینها در مقایسه درون گروهی و # نشانه تفاوت معنی دار بین گروههای مختلف است. در نمودار الف غلظت استروژن در گروه دریافتکننده لیپوهرب به صورت معنی داری کمتر از گروه دریافتکننده لتروزول است. در نمودار ج غلظت تستوسترون درگروه دریافتکننده لتروزول به صورت معنی داری از همه گروههای دیگر بیشتر است. (0/05 >P)*، (P<0/001)***، (P<0/05)#، (P<0/01)## .
بحث
استفاده ازگیاهان دارویی درکناریا به عنوان جایگزینی برای داروهای شیمیایی و سنتری همواره مطرح بوده است. مطالعه حاضر با هدف بررسی اثر داروی گیاهی لیپوهرب،که حاوی پنج گیاه خرفه، شوید،کنگر فرنگی، شنبلیله و زرشک است، بر تغییرات متابولیک و هورمونی موشهای صحرایی مبتلا به سندرم تخمدان پلیکیستیک و مقایسه آن با اثرات متفورمین که یک درمان استاندارد و رایج برای PCOS است، انجام شد. تغییرات وزن، سطح قند خون ناشتا FBS) ) وپروفایل لیپید شامل کلسترول وتریگلیسرید، لیپوپروتئین با دانسیته زیاد(HDL) و لیپوپروتئین با دانسیته کمLDL)) و نیز غلظت هورمونهای جنسی شامل استروژن، پروژسترون، تستوسـترون و DHEA در سرم اندازهگیری شد. یافتههای این مطالعه نشان داد که ترکیب 5 گیاه خرفه، شوید،کنگر فرنگی، شنبلیله و زرشک در مقایسه با متفورمین، توانایی بیشتری برای اصلاح علایم متابولیک به ویژه پروفایل لیپیدی موشهای مبتلا به PCOS داشته است. هرچند توانایی متفورمین برای کاهش قند خون بیشتر از لیپوهرب (ترکیب گیاهان گفته شده) بوده است. در عین حال براساس نتایج بهدست آمده بهنظر میرسد که اثرات هورمونی لیپوهرب تفاوت معنیداری با اثرات هورمونی متفورمین در سندرم تخمدان پلیکیستیک نداشته است. خرفه توسط WHO به عنوان یکی از پرکاربردترین گیاهان طبی نام برده شده است (8). در تحقیقات قبلی نشان داده شده است که عصاره گیاه خرفه میتواند از ایجاد التهاب عروقی توسط دیابت جلوگیری کند و قند خون را کاهش دهد (16-14). گیاه خرفه دارای مواد بیولوژیکی فعالی مانند نورآدرنالین است که در آزادسازی GnRH موثر و در نهایت در تنظیم غلظت FSH نقش دارند (18,17). در مطالعات به این نتیجه رسیده اند که فیتواستروژنها مانند فلاونوییدها و کومارینها باعث کاهش آندروژنها و درنهایت کاهش سطح استروژن میشوند. همچنین کومارینهای موجود در گیاه خرفه فعالیت ضد آروماتازی از خود نشان میدهند که میتوانند باعث کاهش سطح استروژن شوند (19-21). نتایج مطالعه ما هم با مطالعات قبلی همراستا است و لیپوهرب در مقایسه با سایر گروهها در کاهش معنیدار سطح استروژن موثر بوده است. کنگرفرنگی از خانواده کاسنی است و از قدیمی ترین گیاهان دارویی جهان است. این گیاه بومی جنوب اروپا، مدیترانه، شمال آفریقا و جزایز قناری است. در ایران در بعضی مناطق کشور از جمله قزوین، اندیمشک به صورت محدود کشت داده میشود. در بیماریهایی مانند دیابت شیرین، چاقی متابولیک، کهیر، آسم، سنگ کلیه، تصلب شرائین، روماتیسم و بیماریهای پوست نظیر اگزما و التهاب مفید است. در مطالعه Fritsche و Beindorff نشان داده شده که سینارین، کلروژنیک اسید، لوتئلین و فرم گلیکوزید آن و سیناروزید عمدهترین ترکیبهای فعال بیولوژیک موجود در کنگرفرنگی هستند که فعالیت آنتی اکسیدانی دارند (22). تحقیقات نشان داده است که کنگرفرنگی به دلیل دارا بودن کلروژنیک اسید درکاهش قند خون تاثیر دارد (11). در مطالعه حاضر نیز نتایج بررسی غلظت قند خون نشان داد که میانگین غلظت قند خون قبل و بعد از درمان در گروه PCOSدریافتکننده لیپوهرب به ترتیب 12/4±97/9 و 1/6±90/15 میلی گرم در دسی لیتر بود. Shimoda و همکاران به این نتیجه رسیدند که عصاره برگ کنگرفرنگی سطح تریگلیسیرید را کاهش میدهد (23). که با نتایج مطالعه حاضر همخوانی دارد. همچنین درمطالعات مختلف اثرات مفید کنگر فرنگی شامل اثرات ضد دیابت، ضد چاقی، ضد التهاب، ضد کلسترول خون، محافظ کبد، و ضد سرطان آن اثبات شده است (24,25). از دیگر اجزای ترکیب گیاهان میتوان به عصاره زرشک اشاره نمود. زرشک یکی از گیاهانی است که تاریخچهای طولانی در طب سنتی دارد و در درمان تبهای عفونی، تیفوس و اسهال مورد استفاده قرار میگرفته است (26). مطالعات قبلی به بررسی اثر بربرین به عنوان یکی از مواد موثره زرشک در بیماران مبتلا بهPCOS پرداختند و نشان داده شده است که بربرین میتواند همانند متفورمین میزان مقاومت به انسولین را کاهش بخشد (27). بعضی از مطالعات نیز به بررسی اثر بربرین در زنان مبتلا به PCOS پرداختهاند (28). به عنوان مثال در یک مطالعه کوهورت با مشارکت 150 زن نابارور مبتلا به PCOS اثر متفورمین، بربرین و پلاسبو با یکدیگر مقایسه شد و مشاهده شدکه میزان تستوسترون، قند خون ناشتا، انسولین ناشتا، میزان اندروژن آزاد در گروه بربرین کاهش یافته بهطوری که که این اثرات با متفورمین یکسان بوده است (29). اشرف و همکاران در مطالعه ای به این نتیجه رسیدند که عصاره زرشک در افزایش سطح هورمون تستوسترون و کاهش سطح هورمون استروژن تاثیر دارد (30). نتایج مطالعه حاضر نیز نشان داد که در گروه دریافتکننده لیپوهرب سطح سرمی استروژن بعد ازدرمان به طور معنی دار کاهش داشته است (0/05 >P). گیاه شوید گیاهی علفی و معطر است که از جمله اجزای اصلی آن کاروون، فلاندرن، لیمونن و تانن میباشد (31). شوید نیز به عنوان یکی از اجزای ترکیب گیاهان میتواند در بهبود شرایط بیماران PCOS موثر باشد. این فرضیه از مطالعهای توسط منصفی و همکاران در سال 2006 بهدست آمد که از عصاره شوید در درمان موشها با سیکلهای استروس نامنظم استفاده شد و نشان داده شد که شوید میتواند مدت زمان سیکل استروس و فاز دیستروس را در موشها به شکل چشمگیری افزایش دهد. استفاده از شوید میتواند با تاثیر بر فاز لوتئال و افزایش فعالیت و بقای کورپوس لوتئوم باعث افزایش مدت زمان فاز لوتئال شود و میتوان از آن در درمان نامنظمی سیکل قاعدگی استفاده نمود (32). یکی دیگر از اجزای ترکیب گیاهان، عصاره گیاه شنبلیله میباشد. در مطالعات قبلی اثرات ضد دیابتی این گیاه در مدلهای آزمایشگاهی نشان داده شده است (33). Hannan و همکاران در مطالعهای به این نتیجه رسیدند که عصاره شنبلیله باعث افزایش کلسترول HDL و کاهش کلسترولLDL و تام و تریگلیسیرید در موشهای دیابتی نوع دو می شود (34). نتایج یافت شده در مطالعه حاضر نیز همراستا با مطالعات قبلی است. با در نظر گرفتن یافتههای این مطالعه و مقایسه آن با مطالعات دیگر میتوان گفت اثر این گیاهان به صورت ترکیبی بر روی تغییرات متابولیکی و به ویژه پروفایل لیپیدی همراستا با اثر هر کدام از آنها به تنهایی و در جهت بهبود علایم در سندرم تخمدان پلیکیستیک است. این ترکیب گیاهی همچنین توانسته است سطح تستوسترون و DHEA را در مقایسه با گروهی که تنها لتروزول دریافت کردهاند یعنی PCOS در آنها القا شده است ولی درمانی دریافت نکردهاند کاهش دهد. هرچند اثرات این ترکیب گیاهی بر روی تغییرات هورمونی بر اثرات متفورمین برتری ندارد اما تفاوت معنیداری هم با متفورمین نداد و بنابراین میتوان نتیجه گرفت که میتوان از ترکیب این گیاهان به جای و یا در کنار متفورمین برای درمان PCOS استفاده کرد.
نتیجهگیری
در نهایت میتوان گفت که در مقایسه با متفورمین، لیپوهرب که ترکیب 5 گیاه خرفه، شوید،کنگر فرنگی، شنبلیله و زرشک است، توانایی بیشتری برای اصلاح علایم متابولیک موش های مبتلا به PCOS داشته است. هرچند اثرات هورمونی لیپوهرب تفاوت معنیداری با اثرات هورمونی متفورمین در سندرم تخمدان پلیکیستیک نداشته است.
سپاسگزاری
نویسندگان مقاله، مراتب قدردانی خود را از معاونت پژوهشی و مرکز تحقیقات علوم دارویی دانشکده داروسازی علوم پزشکی شهید صدوقی یزد به واسطه تأمین هزینه و انجام این پایاننامه (کد6633) را اعلام میدارند. این پایاننامه در سال1397 در این دانشکده تصویب و در آزمایشگاه تحقیقاتی فیزیولوژی و فارماکولوژی انجام شده است هیچکدام از نویسندگان این مطالعه، تعارض منافعی برای انتشار این مقاله ندارند.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد
تعارض در منافع: وجود ندارد.
References:
1- Bulsara J, Patel P, Soni A, Acharya S. A Review: Brief Insight into Polycystic Ovarian Syndrome. Endocr Metab Sci 2021; 3: 1-7.
2- Hosseinpanah F, Barzin M, Keihani S, Ramezani Tehrani F, Azizi F. Metabolic aspects of different phenotypes of polycystic ovary syndrome: Iranian PCOS Prevalence Study. Clin Endocrinol 2014; 81(1): 93-9.
3- Raja-Khan N, Shuja SA, Kunselman AR, Hogeman CS, Demers LM, Gnatuk CL, et al. Brachial artery conductance during reactive hyperemia is increased in women with polycystic ovary syndrome. Eur J Obstet Gynecol Reprod Biol 2011; 155(1): 49-53.
4- Marx TL, Mehta AE. Polycystic Ovary Syndrome: Pathogenesis and Treatment Over the Short and Long Term. Cleve Clin J Med 2003; 70(1): 31-45.
5- Pasarica M, Tchoukalova YD, Heilbronn LK, Fang X, Albu JB, Kelley DE, et al . Differential Effect of Weight Loss on Adipocyte Size Subfractions in
Patients with Type 2 Diabetes. Obesity 2009; 17: 1976-8.
6- Liu J, Liu M, Ye X, Liu K, Huang J, Wang L, et al. Delay in Oocyte Aging in Mice by the Antioxidant N-Acetyl-L- Cysteine (NAC). Hum Reprod 2012; 27(5): 1411-20.
7- Moghetti P, Castello R, Negri C, et al. Metformin Effects on Clinical Features, Endocrine and Metabolic Profiles, and Insulin Sensitivity in Polycystic Ovary Syndrome: A Randomized, Double-Blind, Placebo-Controlled 6-Month Trial, Followed by Open, Long-Term Clinical Evaluation. J Clin Endocrinol Metab 2000; 85(1): 139-46.
8- Uddin MK, Juraimi AS, Hossain MS, Nahar MA, Ali ME, Rahman MM, et al. Purslane Weed (Portulaca Oleracea): A Prospective Plant Source of Nutrition, Omega-3 Fatty Acid, and Antioxidant Attributes. Sci World J 2014: 1-6.
9- Al-Snafi AE. The Pharmacological Importance of Anethum Graveolens. A Review. Int J Pharm Pharm Sci 2014; 6(4): 11-13.
10- Yazdanparast R, Bahramikia S. Evaluation of The Effect of Anethum Graveolens L. Crude Extracts on Serum Lipids and Lipoproteins Profiles in Hypercholesterolaemic Rats. DARU J Pharmaceutical Sciences 2008; 2(16): 88-94.
11- Mohamed Abdel Magied M, Hussien SE, Mohamed Zaki SM, Mohamed EL Said R.Artichoke (Cynara scolymus L.) Leaves and Heads Extracts as Hypoglycemic and Hypocholesterolemic in Rats. J Food Nutr Res 2016; 4(1): 60-8.
12- Kassaee SM, Goodarzi MT, Kassaee SN. Ameliorative Effect of Trigonella Foenum Graecum L. on Lipid Profile, Liver Histology and LDL-Receptor Gene Expression in High Cholesterol-Fed Hamsters. Acta Endocrinol (Buchar) 2021; 17(1): 7-13.
13- Imanshahidi M, Hosseinzadeh H. Pharmacological and Therapeutic Effects of Berberis Vulgaris and Its Active Constituent, Berberine. Phytother Res 2008; 22(8): 999-1012.
14- Lee AS, Lee YJ, Lee SM, Yoon JJ, Kim JS, Kang DG, et al. Portulaca Oleracea Ameliorates Diabetic Vascular Inflammation and Endothelial Dysfunction in Db/Db Mice. Evid based Complement. Altern Med 2012; 2012: 741824.
15- Gong F, Li F, Zhang L, Li J, Zhang Z, Wang G. Hypoglycemic Effects of Crude Polysaccharide from Purslane. Int Mol Sci 2009; 10(3): 880-8.
16- El-Sayed M-IK. Effects of Portulaca Oleracea L. Seeds in Treatment of Type-2 Diabetes Mellitus Patients as Adjunctive and Alternative Therapy. J Ethnopharmacol 2011; 137(1): 643-51.
17- Bedakhanian M, Entezari M H, Ghanadian M, Askari G, Maracy MR. The Effects of Portulaca Oleracea on Lipid Profile, C-Reactive Protein, and Fasting Blood Glucose in Men with Metabolic Syndrome: A Double-Blind Randomized Clinical Trial. HSR 2017; 12(4): 478-83.
18- hosseini E, forozan far M, paye dar A. Effect of Hydroalcoholic Extract of Purslane on Serum Concentration of Estrogen, Progesterone, Prolactin and Gonadotropins in Adult Female Rats. J Shahrekord Univ Med 2014; 15(5):1-10.
19- Ahangarpour A, Lamoochi Z, Moghaddam HF, Mansouri SM, et al. Effects of Portulaca Oleracea Ethanolic Extract on Reproductive System of Aging Female Mice. Int J Reprod BioMed 2016; 14(3): 205-12.
20- Shabanian S, Bahmani M, Asadi-Samani M. The Medicinal Plants Effective on Female Hormones, A Review of the Native Medicinal Plants of Iran Effective on Estrogen, Progesterone, and Prolactin. J Chem Pharm Sci 2016; 9(3): 1270-6.
21- Akbaribazm M, Goodarzi N, Rahimi M. Female Infertility and Herbal Medicine: An Overview of the New Findings. Food Sci Nutr 2021; 9: 5869-82.
22- Fritsche J, Beindorff CM, Dachtler M, Zhang H, Lammers J. Isolation, Characterization and Determination of Minor Artichoke (Cynara Scolymus L.) Leaf Extract Compounds. Eur Food Res Technol 2002; 215: 149-57.
23- Shimoda H, Ninomiya K, Nishida N, Yoshino T, Morikawa T, Matsuda H, et al. Anti-Hyperlipidemic Sesquiterpenes and New Sesquiterpene Glycosides from the Leaves of Artichoke (Cynara Scolymus L.): Structure Requirement and Mode of Action. Bioorg Med Chem Lett 2003; 13(2): 223-8.
24- Sharma P, Kumar Verma P, Kishore Pankaj N, Agarwal S. The Phytochemical Ingredients and Therapeutic Potential of Cynara scolymus L. Pharm Biomed Res 2021; 7(3): 141-60
25- Gebhardt R. Inhibition of Cholesterol Biosynthesis in Primary Cultured Rat Hepatocytes by Artichoke (Cynara Scolymus L.) Extracts. J Pharmacol Exp Ther 1998; 286(3): 1122-8.
26- Rahimi-Madiseh M, Lorigoini Z, Zamani-gharaghoshi H, Rafieian-kopaei M. Berberis Vulgaris: Specifications and Traditional Uses. Iran J Basic Med Sci 2017; 20(5): 569-87.
27- Li Y, Ma H, Zhang Y, Kuang H, Ng EH, Hou L, et al. Effect of Berberine on Insulin Resistance in Women with Polycystic Ovary Syndrome: Study Protocol for a Randomized Multicenter Controlled Trial. Trials 2013; 14: 226.
28- Rondanelli M, Riva A, Petrangolini G, Allegrini P, Giacosa A, Fazia T, et al. Berberine Phospholipid is an Effective Insulin Sensitizer and
Improves Metabolic and Hormonal Disorders in Women with Polycystic Ovary Syndrome: A One-Group Pretest–Post-Test Explanatory Study. Nutrients 2021; 13(10): 3665.
29- An Y, Sun Z, Zhang Y, Liu B, Guan Y, Lu M. The Use of Berberine for Women with Polycystic Ovary Syndrome Undergoing IVF Treatment. Clin Endocrinal 2014; 80(3): 425-31.
30- Ashraf H, Khaneshi F, Rafei F, Nejati V. Effect of Aqueous Extract of Zarafshan Barberry Root on Testicular Tissue and Testosterone Level in Streptozotocin - Induced Diabetic Rats. Qom Univ Med Sci J 2013; 7(4): 28-35.
31- Al-Snafi AE. The Pharmacological Importance of Anethum Graveolens–A Review. Int J Pharm Pharm Sci 2014; 6(4): 11-3.
32- Monsefi M, Ghasemi M, Bahaoddini A. The Effects of Anethum Graveolens L. on Female Reproductive System. Phytother Res 2006; 20(10): 865-8.
33- Swaroop A, Bagchi M, Kumar P, Preuss HG, Tiwari K, Marone PA, et al. Safety, Efficacy and Toxicological Evaluation of a Novel, Patented Anti-Diabetic Extract of Trigonella Foenum-Graecum Seed Extract (Fenfuro). Toxicol Mech Methods 2014; 24(7): 495-503.
34- Hannan JM, Rokeya B, Faruque O, Nahar N, Mosihuzzaman M, Azad Khan AK, et al. Effect of Soluble Dietary Fibre Fraction of Trigonella Foenum Graecum on Glycemic, Insulinemic, Lipidemic and Platelet Aggregation Status of Type 2 Diabetic Model Rats. J Ethnopharmacol 2003; 88(1): 73-7.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی
دریافت: 1401/6/12 | پذیرش: 1401/7/17 | انتشار: 1401/12/15
دریافت: 1401/6/12 | پذیرش: 1401/7/17 | انتشار: 1401/12/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







