دوره 31، شماره 1 - ( فروردین 1402 )
جلد 31 شماره 1 صفحات 6277-6258 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Barzegar-Bafrouei A, Javdani M. Importance of Induction Endometritis and Vaginal Cytology in Rat Model: A Narrative Review Article. JSSU 2023; 31 (1) :6258-6277
URL: http://jssu.ssu.ac.ir/article-1-5827-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5827-fa.html
برزگر بفروئی ابوالفضل، جاودانی موسی. اهمیت القای مدل اندومتریت و سایتولوژی واژینال در موش صحرایی؛ یک مطالعه مرور روایتی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (1) :6258-6277
متن کامل [PDF 1342 kb]
(565 دریافت)
| چکیده (HTML) (1803 مشاهده)
متن کامل: (884 مشاهده)
مقدمه
اندومتریت نوعی ناهنجاری شایع سیستم تولیدمثلی در حیوانات اهلی ماده بهشمار میرود که پیامدهای حاصل از آن در گستره وسیعی از عدم تأثیر بر سیستم تناسلی تا رخداد ناباروری پایدار قرار می گیرد. از دوره پس از زایش تحت عنوان دوره نفاس یاد میشود که رحم متعاقب پاکسازی باکتریایی از طریق سیستم ایمنی رحم مادر و یا آلودگی مجدد، به راحتی تحت تأثیر عفونت قرار می گیرد. ناتوانی رحم در دفع آلودگی سبب ایجاد اندومتریت بالینی توسط باکتریهای پاتولوژیک در رحم می شود که مشخصه آن ترشحات چرکی واژینال از رحم درگیر است (1,2). گزارششده که انواع مختلفی از باکتریها که عمدتاً اشریشاکلی، سویههای استافیلوکوکوس، سویههای استرپتوکوکوس، آرکانوباکتریوم پایوژنز، پاستورلا، کبسیلا پنومونیه و فوزوباکتریوم نکروفوروزوم هستند سبب بروز اندومتریت میشوند و میتوان آنها را از رحم مبتلا به اندومتریت و یا بدون اندومتریت جدا کرد (6-3). با این حال، اندومتریت در حیوانات نیز تنها سبب ناباروری نمیشود بلکه همچنین خسارات اقتصادی فراوانی را در پی دارد و تولید شیر و عملکرد سیستم تناسلی را تحت تأثیر قرار میدهد (7,8). اندومتر دارای امکانات ایمنی اولیه همانند گیرندههای شبه تول (toll like receptors) است که بهعنوان خط اولیه دفاع علیه تهاجم میکروبها عمل میکنند (9). گیرندههای شبه تول، نقشی حیاتی در تشخیص محدوده مولفههای میکروبی ایفا میکنند و این گیرندهها سبب بیان و آزادشدن سایتوکینها و کموکینها در فعالیت و یورش نوتروفیل ها و مونوسیت ها میشوند (10,11). سایتوکینها، واسطههایی گلیکوپروتئینی با عملکرد چندگانه هستند که در التهاب موضعی و سیستمیک مشارکت می¬کنند (12,13). در رحم بسیاری از گونهها، محدوده وسیعی از سایتوکینها و کموکینها بیان میشوند (13). پس از تشخیص تهاجم باکتری، سلولهای ایمنی انواع مختلفی از سایتوکینهای التهابی و پیش برنده التهابی را آزاد میکنند (14,15). این سایتوکین ها به ویژه اینترلوکین 1، سنتز هورمون آزادکننده گنادوتروپینها (Gonadotropin-releasing hormone) را به وسیله افزایش آزادشدن کورتیکواستروئیدها سرکوب میکنند (16,17). عدم تعادل هورمونی نیز فاکتوری مشارکت کننده برای توسعه ناباروری در اندومتریت قلمداد میشود. استرس اکسیداتیو در سلولها در نتیجه عدم توازن بین سیستمهای اکسیدکننده و آنتی اکسیدان رخ می دهد. هنگامی که تولید رادیکالهای آزاد از ظرفیت دفاعی آنتی¬اکسیدان بدن برای سمزدایی از آنها بیشتر شود ، شرایطی به نام استرس اکسیداتیو رخ میدهد، به گونهای که نمیتوان از افزایش اکسیدانها و کاهش آنتیاکسیدانها جلوگیری کرد و تعادل اکسیداتیو/ آنتیاکسیدانی به سمت اکسیداتیو تغییر میکند (18). گونههای فعال اکسیژن (Reactive oxygen species)، رادیکالهای مشتق از اکسیژن هستند و پراکسیل، سوپراکسید بسیار واکنشپذیر (-O2) و هیدروکسیل (OH) و هم چنین غیر رادیکالهایی مانند پراکسی نیتریت (-ONOO) و پراکسید هیدروژن (H2O2) را شامل می¬شوند. ترکیبات مذکور توسط سیستمهای آنزیمی (نیکوتین آمید آدنین دینوکلئوتید فسفات اکسیداز (Nicotinamide adenine dinucleotide phosphate)، میلوپراکسیدازها، سیکلواکسیژناز و زانتان اکسیداز) در میکروگلیاها و گلبولهای سفید خون سنتز میشوند. گونههای اکسیژن فعال، نقش مهمی در تنظیم بسیاری از فرآیندهای تولیدمثلی همانند فولیکولوژنز، بلوغ اووسیت، لانهگزینی، امبریوژنز و توسعه اتصال واحد جنینی- جفتی ایفا میکنند. گونههای اکسیژن فعال ممکن است به ماکرومولکولها به صورت مستقیم و غیر مستقیم به وسیله فعال شدن مسیرهای سیگنالینگ از طریق واسطههای التهابی آسیب وارد کنند (19,20). هم چنین بهخوبی شناخته شده که ارتباط معناداری بین استرس اکسیداتیو و بسیاری از بیماریهای التهابی همانند اندومتریت (21)، ورم پستان (22)، آرتریت روماتوئید و کولایتیس (23) وجود دارد. میتوان از مدلهای حیوانی بهصورت جایگزین در سیستمهای آزمایشی پژوهشهای زیست پزشکی جهت نیل به هدف حصول اطلاعات درباره درمانهای جدید استفاده نمود (24,25). علی رغم این که هیچ یک از مدلهای حیوانی بهطور کامل ایدهآل نیستند، اما موش صحرایی بیشترین و گستردهترین گونه مورد استفاده در مطالعات مرتبط با بحث زنان، زایمان و مامایی است (26). پژوهشها و مطالعات درون تنی در مدلهای موش صحرایی مرتبط با زنان و زایمان دارای معایبی از جمله تفاوت شکل هندسی اندامهای تولیدمثلی موش صحرایی با انسان، اختلاف آناتومیکی بسیار زیاد آنها با انسانها و سخت بودن اجرای فرآیندها و جراحی های مرتبط با تخمدان و رحم -که از اندازه کوچک آنها ناشی میشود است (26). با وجود این، به کار گیری از مدلهای مرتبط با مبحث مامایی، زنان و زایمان موش صحرایی دارای مزایایی از جمله تغییرات اندک خصوصیات پاتوفیزیولوژیکی، فیزیکی و خواص مکانیکی در بین حیوانات، راندمان هزینه خوب، قابلیت دستورزی راحت و در دسترس بودن آن است که امکان استفاده از این مدلها در تحقیقات زیست پزشکی، علوم دارویی، جراحی و دیگر علوم وابسته را به ارمغان می¬آورد (26). علیرغم معایبی که در مدلهای حیوانی وجود دارد، با اینحال آنها میتوانند به صورت ماکتی از سیستمهای حقیقی عمل و به سهولت آنها را تجسم کنند (27). گونههای حیوانی پیشنهاد شده برای ایجاد این مدلهای مذکور دارای مزایایی از جمله قابلیت تکرار نتایج، مدیریت در طول انجام آزمایش، هزینه کم و حداقل پیامدهای اجتماعی/ اخلاقی هستند (28). تقریباً در تحقیقات درونتنی امکان جمع-آوری مناسب دادهها با توجه به شرایط فیزیوپاتولوژیک به ارمغان میآید که میتوانند در ایجاد مداخلات بالینی مؤثرتر به¬کار گرفته شوند (29). بنابراین، القای تجربی اندومتریت در مدل حیوانی موش صحرایی به صورت گسترده در بررسی این بیماری مورد استفاده قرار میگیرد. برای القای اندومتریت اشریشاکلیای در موش صحرایی، ابتدا موشهای صحرایی برای مدت 5 روز پروژسترون دریافت میکنند (با دوز 16 میلیگرم بر کیلوگرم به صورت زیر جلدی) تا فاز پروژسترونی سیکل استروس فراهم شود که برای تأیید ایجاد این فاز، از روش سایتولوژی واژن استفاده میشود. روش سایتولوژی واژینال بهعنوان یک نشانگر حساس در تعیین مرحله سیکل استروس در بسیاری از گونهها در نظر گرفته میشود که بازتابی از تعادل بین آثار استروژن و پروژسترون است. از سایتولوژی واژن در تشخیص مراحل مختلف سیکل استروس و تعیین شرایط غیر طبیعی سیستم تولیدمثلی قبل و بعد از زایمان استفاده میشود. در برخی از گونهها همانند سگ، گربه، موش سوری و خرگوش تغییرات ایجادشده در واژن تحت تأثیر مرحله سیکل استروس نسبتاً یکپارچه است؛ بنابراین میتوان روش سایتولوژی واژن را تشخیص مرحله سیکل استروس به طور قابل اعتمادی در گونههای مذکور بهکار گرفت (30). فازهای سیکل استروس به پرواستروس (مشاهده سلولهای اپیتلیومی هستهدار بیضوی در گسترش واژینال)، استروس (مشاهده سلولهای اپیتلیومی سنگفرشی شاخی¬شده با شکل نامنظم در گسترش واژینال)، مت استروس (مشاهده سلولهای اپیلتیومی شاخی شده تکهتکه شده و لوکوسیتهای کوچکتر و تیرهتر در گسترش واژینال) و دای¬استروس (مشاهده اپیتلیوم هستهدار و لوکوسیتهای نابالغ در گسترش واژینال) تقسیم میشود (31). اهمیت روزافزون بیماری اندومتریت، ناباروری ناشی از آن و شیوع گسترده این بیماری مهم در جامعه زنان ایرانی سبب تلاشی شد که ماحصل آن در قالب این مقاله مروری به رشته تحریر درآمد. هدف از مطالعه حاضر، القای اندومتریت در مدل موش صحرایی و تعیین مراحل سیکل استروس این حیوان با استفاده از روش سایتولوژی واژینال به منظور القای موفقیتآمیز این عارضه در مدل موش صحرایی بود. نویسندگان ابتدا به طرق مدلسازی اندومتریت در موش صحرایی پرداختهاند. سپس تعیین مراحل سیکل استروس در موش صحرایی جهت القای موفقیتآمیز اندومتریت در موش صحرایی را مورد بررسی قرار دادهاند و در باب مکانیسمهای دخیل در ایجاد این بیماری سخن گفتهاند.
روش بررسی
در نگارش این مقاله مروری از کلمات کلیدی القای اندومتریت، مدل موش صحرایی، سایتولوژی واژن، سیکل استروس و مقالات نمایه شده در پایگاههای اطلاعاتیScience Direct, Scopus, Pubmed, Springer Science ، Google scholar و SIDاستفاده شد. تمامی مقالات بدون در نظر گرفتن محدودیت زمانی و تا سال 2023 جستوجو شدند. پس از بررسی اولیه، مقالات تکراری و غیر مرتبط حذف شدند. سپس مقالات جستوجو شده مطابق معیارهای ورود به مطالعه وارد و طبق معیارهای خروج از مطالعه خارج شدند. از نقطهنظر این¬که اندومتریت نوعی بیماری سیستم تولیدمثلی جنس ماده است که با التهاب در قسمت غدهای اندومتریوم و بافتهای استرومایی آن مشخص میشود و هم چنین نقش کلیدی استرس اکسیداتیو در بروز این بیماری، معیارهای ورود به مطالعه شامل تمامی مقالات پژوهشی اصیل منتشر شده با تمرکز بر نقش سایتوکینهای پیشبرنده التهابی و استرس اکسیداتیو در ایجاد اندومتریت، روشهای القای اندومتریت در مدل موش صحرایی و تعیین مراحل سیکل استروس موش صحرایی با استفاده از روش سایتولوژی واژن بود. معیارهای خروج از مطالعه شامل گزارش مورد، مقالات همایشها و نامه به سردبیر بود. در نهایت در نگارش این مطالعه مروری تمامی موارد اخلاقی لازم در خصوص استفاده صحیح از مقالات استخراج شده و موازین مربوط به انتشار اثر رعایت شد. سرانجام طریقه و مکانیسم ایجاد اندومتریت، طریقه القای این بیماری در مدل موش صحرایی و تعیین مرحله سیکل استروس موش صحرایی حهت القای موفقیتآمیز اندومتریت در این مدل حیوانی در مطالعه حاضر مورد بررسی قرار گرفت.
روشهای ایجاد اندومتریت در موش صحرایی: روش اول جداسازی باکتری: بهمنظور جداسازی باکتری برای ایجاد مدل اندومتریت در موش صحرایی، میتوان از ترشحات چرکی واژینال حیوانات تازهزا استفاده کرد که دارای نشانههای بالینی اندومتریت هستند. سپس ترشحات چرکی جمعآوریشده در محیط کشت بلاد آگار، آنکوبهشده و پس از رشد میتوان نوع میکروارگانیسم را مشخص نمود (32).
روش اول ایجاد مدل اندومتریت در موش صحرایی: برای ایجاد مدل مذکور در دوره موشهای صحرایی پس از زایش، با ترکیب کتامین (با دوز 70 میلیگرم بر کیلوگرم- آلفاسان هلند) و زایلازین (با دوز 10 میلیگرم بر کیلوگرم- آلفاسان هلند) به صورت داخل صفاقی بیهوش میشوند (33). موشهای صحرایی در حالتگماری پشتی قرار داده شده و پس از آماده¬سازی موضع جراحی، یک برش 2 سانتیمتری در محوطه شکمی در ناحیه میانی شکم با فاصله 1 سانتیمتری از سمفیز لگن زده میشود. پس از برش پوست و عضلات، شاخهای رحم اکسپوزشده و برای تحریک بافت اندومتریوم 0/1 میلیلیتر از محلول استیک اسید 3% به شاخ چپ رحم و همان حجم سالین به شاخ راست رحم (به عنوان کنترل) تزریق میشود. بعد از تزریق، شاخهای رحم به داخل محوطه شکمی برگردانده شده و عضلات با نخ بخیه قابل جذب و پوست با نخ بخیه غیر قابل جذب بخیه میشوند. حیوانات تا زمان ریکاوری در قفس انفرادی قرار داده میشوند و برای مدت زمان 48 ساعت برای ردیابی علایم بیماری تحتنظر قرار میگیرند. با گذشت 4 روز پس از تزریق استیک اسید و تحریکِ بافتِ اندومتریومِ شاخِ چپِ رحمِ موشهایِ صحرایی، لاپاراتومی ثانویه انجام میشود. پس از بیهوشی و آمادهسازی موضع جراحی در شاخ چپ رحم میزان 0/3 میلیلیتر باکتری (اشریشاکلی و استافیلوکوکوس هایکوس)- که دارای 109×1 CUF (Colony-forming unit) بر میلیلیتر باکتری است تلقیح میشود و به شاخ راست نیز همان حجم سالین تزریق میگردد (17). با گذشت 4 روز پس از تلقیح باکتری در شاخ چپ رحم، موشهای صحرایی آسانکشی شده و میتوان بافت رحم را از منظر هیستوپاتولوژی و جداسازی باکتری و سایتوکینهای التهابی مورد ارزیابی قرار داد (32).
روش دوم آماده سازی باکتری: میتوان برای آمادهسازی و تهیه باکتری اشریشاکلی از استاندارد مک فارلاند برای استانداردکردن تعداد تقریبی باکتریها استفاده کرد که به عنوان جایگزین اندازهگیری میزانه کدورت شناخته شده است. سوسپانسیون باکتریایی در مقایسه با محلول استاندارد مکفارلاند برای تخمین غلظت و میزان جمعیت باکتریایی مشاهده می شود. برای به دست آوردن غلظت باکتریایی 105 CUF بر 50 میکرولیتر، با مراجعه به لولههای مک فارلاند سوسپانسیون باکتریایی 10 برابر با سالین استریل رقیق میشود. این تکنیک به صورت گسترده در فیلد میکروبیولوژی مورد استفاده قرار میگیرد (34,35).
روش دوم ایجاد مدل اندومتریت اشریشاکلی در موش صحرایی: برای القای این نوع اندومتریت در موش صحرایی، ابتدا موشهای صحرایی برای مدت 5 روز پروژسترون دریافت کردند (با دوز 16 میلیگرم بر کیلوگرم به صورت زیر جلدی) تا فاز پروژسترونی سیکل استروس فراهم شود که برای تأیید ایجاد این فاز، از روش سایتولوژی واژن استفاده میشود. در آخرین روز تزریق پروژسترون (روز 5) موشهای صحرایی با استفاده از داروی کتامین (با دوز 70 میلیگرم بر کیلوگرم) و زایلازین (با دوز 10 میلیگرم بر کیلوگرم) به صورت داخل صفاقی، بیهوش شده (36) و در حالتگماری پشتی قرار میگیرند. پس از آماده سازی موضع جراحی، یک برش 2 سانتیمتری عمود بر خط وسط شکم زده شده و با برش پوست و عضلات، محوطه شکمی نمایان میشود. سپس شاخ راست با دست به بیرون هدایت میشود. تحت شرایط استریل، میزان 50 میکرولیتر از سوسپانسیون باکتریایی حاوی 105×1 CUF به ازای هر موش صحرایی از باکتری اشریشاکلی در شاخ راست رحم تلقیح میشود (37) (شکل 1) و سپس شاخ راست با ملایمت به داخل محوطه شکمی برگردانده شده و عضلات و پوست بخیه میگردند. میتوان با گذشت 16 ساعت پس از تلقیح باکتری، روند درمانی مدنظر را شروع نمود. گسترش واژینال در روز پنجم (آخرین روز تجویز پروژسترون) و با گذشت 5، 10 و 14 روز پس از تجویز از حیوانات تهیه میشود (38).
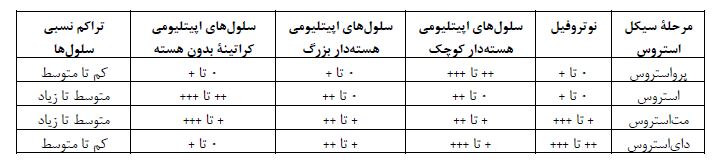
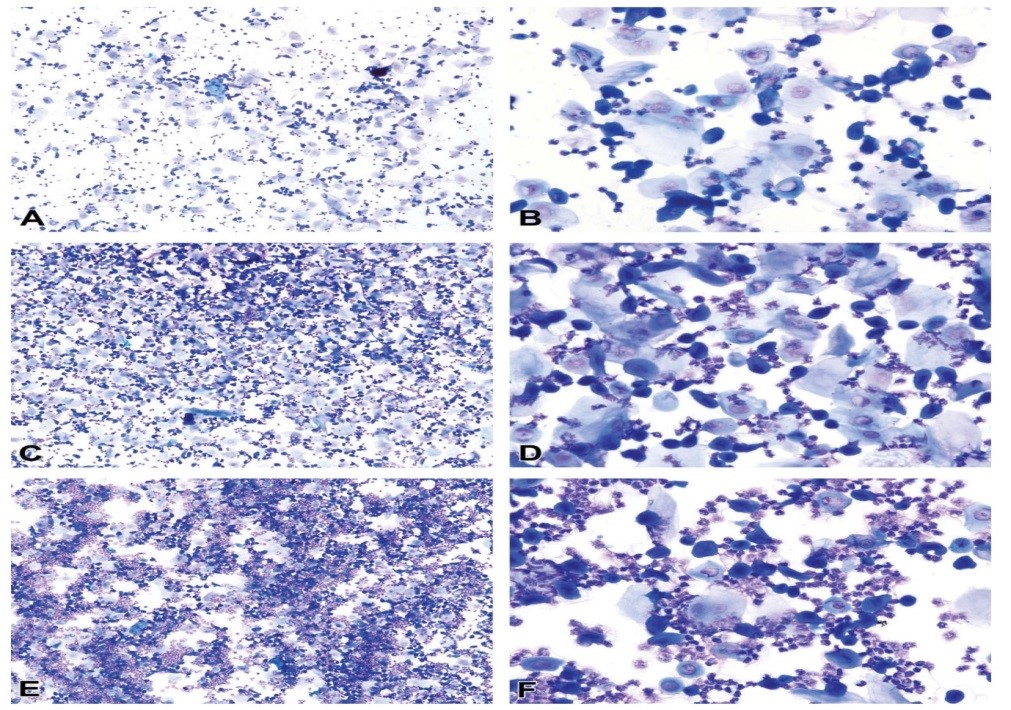
تشخیص مراحل سیکل استروس در موش صحرایی از طریق سایتولوژی واژن: عموماً سیکل استروس در موش صحرایی ماده به 4 مرحله پرواستروس، استروس، متاستروس و دای استروس تقسیمبندی میشود. خصوصیات برجسته مرحله پرواستروس، وجود سلولهای اپیلتیومی کوچک، کروی و هستهدار است که دارای ظاهر و اندازه نسبتاً یکنواخت هستند که این سلولها ممکن است در رنگآمیزی به شدت بازوفیلیک باشند. مرحله استروس بهوسیله غالب بودن سلولهای اپیلتیومی کراتینه بدون هسته در گسترش واژینال مشخص میشود. مرحله مت استروس به وسیله ترکیبی از سلولهای کراتینه بدون هسته و نوتروفیلها در گسترش واژینال مشخص میشود. مرحله دایاستروس با کاهش قابل توجه تعداد سلولهای اپیتلیومی کراتینه بدون هسته (اما الزاماً همراه با عدم حضور این سلولها نیست) مشخص میشود. تعیین مراحل سیکل استروس بر پایه انواع سلولها و نسبت هر کدام از آنها در گسترش واژینال در جدول 1 ذکر شده است. پراکندگی انواع سلولهای سیکل استروس در موش صحرایی در شکل 2 به تصویر کشیده شده است.
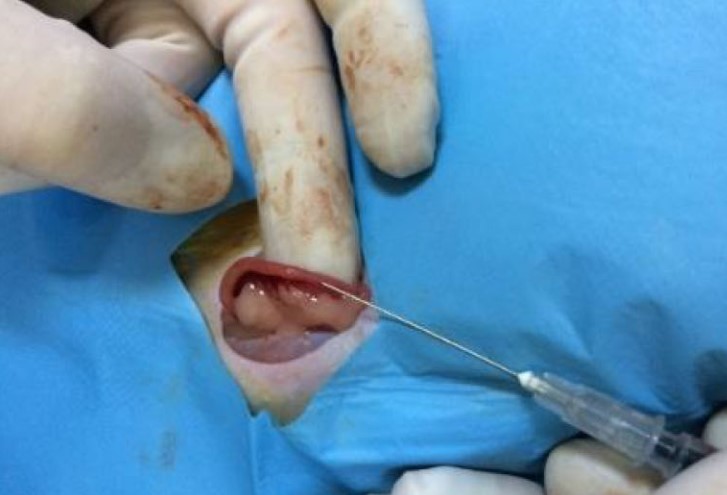
شکل 1: القای مدل اندومتریت در موش صحرایی. تلقیح باکتری اشریشاکلی به شاخ رحم در موش صحرایی تحت شرایط استریل (38).
جدول 1: طبقهبندی پایه از مراحل سیکل استروس بر پایه انواع سلولها و نسبت هر کدام از آنها در گسترش واژینال (31).
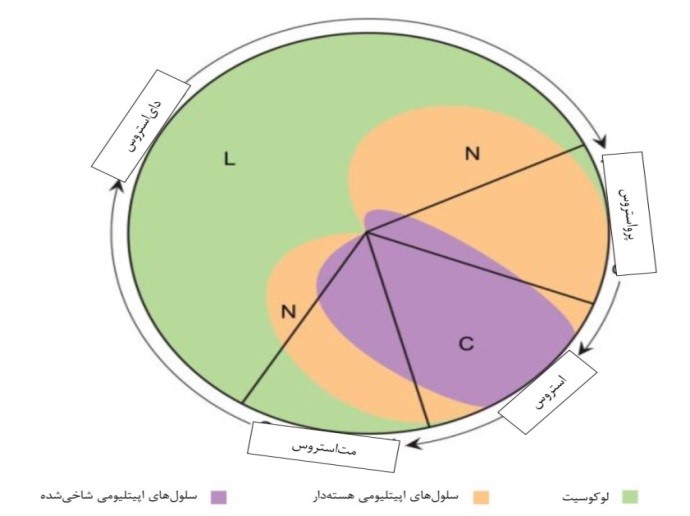
شکل 2: شکل شماتیکی از انواع سلولها و نسبت نسبی هر کدام از آنها در 4 مرحله از چرخه استروس در موش صحرایی (39).
پرواستروس: پرواستروس مرحله کوتاهی است که بهطور میانگین 14 ساعت در موش صحرایی و کمتر از 24 ساعت در موش سوری به طول میانجامد (40,41). خصوصیات برجسته این مرحله، وجود سلولهای اپیلتیومی کوچک، کروی و هستهدار است که دارای ظاهر و اندازه نسبتاً یکنواخت هستند که این سلولها ممکن است در رنگ آمیزی به شدت بازوفیلیک باشند. غالباً این سلولها به صورت دستجات (همانند خوشهانگور)، صفحات و رشته های به هم پیوسته مشاهده میشوند. با اینحال اشکال مذکور (دستهجات (همانند خوشه انگور)، صفحات و رشتههای به هم پیوسته) همیشه مشاهده نمیشود؛ به ویژه در نمونههایی که دارای تعداد کمی سلول است. نوتروفیل¬ها به¬صورت تیپیک نباید در این مرحله مشاهده شوند (شکل 3). عنوان شده که به صورت نادر نوتروفیلها گاهاً در اوایل پرواستروس در جوندگان در هنگام انتقال از دایاستروس به پرواستروس- مشاهده میشوند. نسبتاً تعداد کمی از سلولهای پوششی بزرگ و سلول های کراتینه بدون هسته ممکن است در این مرحله از سیکل استروس مشاهده شوند. با نزدیک¬شدن به مرحله استروس، بر تعداد سلولهای شاخی شده بدون هسته افزوده میشود. وجود تعداد کمی نوتروفیل یا سلول ای اپیتلیومی بزرگ و بدون هسته نباید در زمانی¬که خصوصیات بارز گسترش واژینال جمعیت سلولهای اپیتلیومی کوچک و کروی است، مانع از تشخیص مرحله پرواستروس شود (31). استروس: محدوده مرحله استروس در موش صحرایی بین 24 تا 48 ساعت و در موش سوری در حدود 12 تا 48 به طول میانجامد (40,41). این مرحله از سیکل استروس به وسیله غالب بودن سلولهای پوششی شاخی شده بدون هسته در گسترش واژینال مشخص میشود (شکل5). تعدادی باکتری ممکن است بهصورت چسبیده به دیگر سلولها یا به صورت آزاد در گسترش واژینال مشاهده شوند. گاهی سلولهای پوششی هستهدار نیز را میتوان در مرحله استروس مشاهده نمود. نوتروفیلها غالباً در گسترش واژینال این مرحله از سیکل استروس حضور ندارند اما گاهاً در اواخر استروس در هنگام انتقال از مرحله استروس به مت استروس دیده میشوند. در گسترش واژینال اواخر استروس در موش صحرایی (قبل از ظهور نوتروفیلها و مت استروس)، تعداد بیشتری از سلولهای اپیتلیومی هستهدار مشاهده میشوند (شکل 4) که شکل این سلولها، کوچک یا بزرگ، کروی یا بیضوی یا دوکی شکل دارای لبههای صاف تا نامنظم است و گاهاً در رنگآمیزی به شدت بازوفیلیک هستند. اواخر مرحله استروس نباید با پرواستروس اشتباه شود. عموماً سلولهای هستهدار موجود در مرحله پرواستروس دارای نسبت هسته به سیتوپلاسم بیشتری هستند و شکل آنها کروی تا نسبتاً بیضوی همراه با لبههای سلولی صاف است. نسبتاً تعداد زیادی از سلولهای اپیتلیومی هستهدار به صورت پراکنده همراه با سلولهای کراتینه بدون هسته در اواخر مرحله استروس در موش صحرایی در گسترش واژینال حضور دارند (42).
مت استروس: مستندات به خوبی حاکی از کوتاه بودن طول مرحله مت استروس در موش صحرایی است که این مرحله در موش صحرایی به مدت 6 تا 8 ساعت (41) و در موش سوری میتواند بیش از 24 ساعت (40) بهطول بینجامد. مرحله متاستروس به وسیله ترکیبی از سلولهای شاخی شده بدون هسته و نوتروفیلها در گسترش واژینال مشخص میشود. در موش صحرایی، سلولهای هستهدار کوچک و بزرگ اواخر استروس به تعداد کم تا متوسط در سراسر این مرحله وجود دارند (شکل5). نوتروفیل ها در اوایل مت استروس به صورت پراکنده و همراه با سلولهای اپیتلیومی مشاهده میشوند اما گاهی به صورت فشرده در کنار یک دیگر یا به صورت دسته جاتی در اطراف دیگر سلول ها نیز به نظر میآیند. در گسترش واژینال، معمولاً تعداد سلولهای اپیتلیومی در اوایل مت استروس بیشتر است اما ممکن است نسبت این سلول ها با نوتروفیل ها برابر باشد. با پیشرفت مرحله مت استروس با سرعت زیاد بر تعداد نوتروفیلها افزوده میشود ممکن است تا 10 برابر از سلولهای اپیتلیومی بیشتر شوند (43) و گسترش واژینال بسیار سلولی و متراکم خواهد شد. تعداد سلولهای اپیتلیومی در اواخر مت استروس کاهش مییابد و کاهش سلولاریتی گسترش واژینال حاکی از انتقال از مت استروس به دای استروس است. تفریق بین انتهای مت استروس و شروع دای استروس همیشه امکانپذیر نیست زیرا ظاهر و انواع سلولهای موجود در گسترش واژینال این مراحل از سیکل استروس (انتهای متاستروس و ابتدای دایاستروس) بسیار به یکدیگر شبیه است و به راحتی قابل تمیز از هم نیست (39).
دای استروس: دای استروس طولانیترین مرحله از سیکل استروس است که به طور میانگین به مدت زمان 48 تا 72 ساعت در موش سوری و موش صحرایی به طول میانجامد (40،41). این مرحله از سیکل استروس با کاهش قابلتوجه تعداد سلولهای اپیتلیومی کراتینه بدون هسته (اما الزاماً همراه با عدم حضور این سلولها نیست) مشخص میشود که نشانگر عبور از مرحله مت استروس و ورود به مرحله دای استروس است. سلولاریتی در سراسر گسترش واژینال کم تا متوسط همراه با ترکیبی از نوتروفیلها، سلولهای هستهدار کوچک و بزرگ و تعداد کمی از سلولهای کراتینه بدون هسته است (شکل 6). تعداد نوتروفیلها میتواند متغیر باشد اما معمولاً تعداد آن ها در اوایل دای استروس نسبت به سلولهای اپیتلیال بیشتر است و گاهاً گسترش واژینال منحصراً نوتروفیلیک است. گاهی در ابتدای دای استروس، ممکن است نوتروفیلها به صورت خوشهای مشاهده شوند. غیر معمول نیست که گسترشهای واژینال مرحله دایاستروس دارای سلولاریتی بسیار پایین به خصوص در روز 2 یا 3 دایاستروس باشند و فقط پراکندگی کم نوتروفیلها و سلولهای اپیتلیومی مشاهده شود (شکل 6). در اواخر دایاستروس ممکن است سلول های اپیتلیومی کروی شوند و به صورت دستهجات کوچکی آرایش یابند که حاکی از ورود به مرحله پرواستروس در روزهای آتی است؛ با اینحال ممکن است هنوز نوتروفیل ها مشاهده شوند (شکل 6) (42).

شکل 3: گسترش های واژینال مرحله پرواستروس از موش صحرایی اسپراگ داولی که به وسیله تعداد زیادی از سلول های اپیتلیومی هسته دار کوچک که مشخص می شود که به صورت تکی و یا به صورت خوشه های به هم پیوسته یافت میشوند (پیکان). شکل D، ظاهر بسیار تیپیک از مرحله پرواستروس را نشان می دهد که تحت عنوان زنجیره (بندرگاه) اپیتلیومی شناخته می شود (31) (شکل A و B با بزرگ نمایی 10؛ شکل C با بزرگ نمایی 20 و شکل D با بزرگ نمایی 40). در رنگ آمیزی اشکال A و B از رنگ آمیزی رایت گیمسای اصلاح شده و در رنگ آمیزی اشکال C و D از رنگ آمیزی تولوئیدن آبی O استفاده شده است.
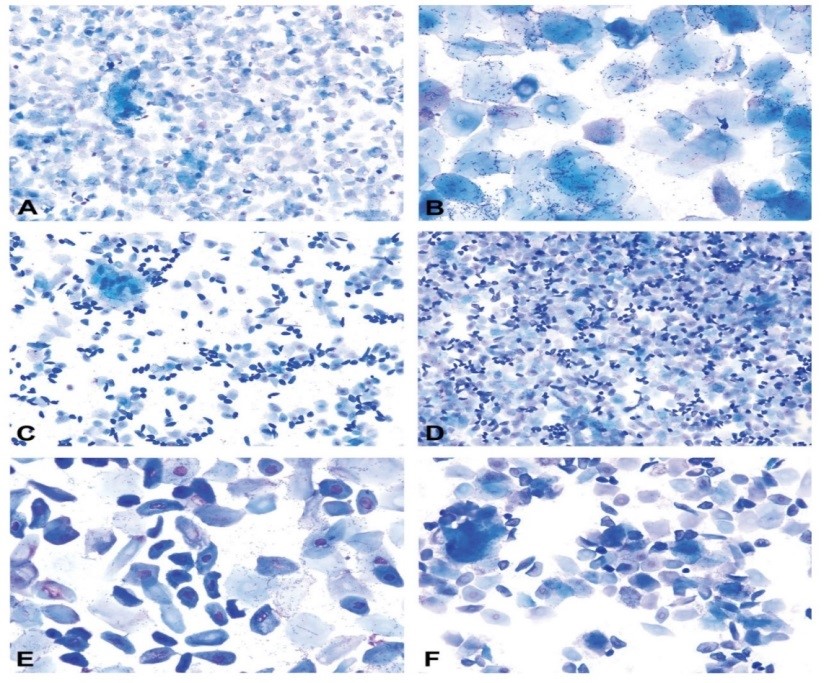
شکل 4: گسترش واژینال از مرحله استروس (A و B) و اواخر استروس (C تا F) در موش صحرایی اسپراگ داولی. اشکال A و B با تعداد زیادی از سلولهای اپیتلیومی بدون هسته به طور تیپیک حاکی از مرحله استروس هستند. گسترشهای واژینال در اشکال C تا F حاکی از اواخر مرحله استروس هستند که با سلولهای اپیتلیومی بدون هسته کروی، بیضوی و دوکیشکل با تعداد پراکندهای از سلولهای اپیلتیومی بدون هسته مشخص می شود (31) (شکل A، C و D با بزرگ نمایی 10؛ شکل F با بزرگ نمایی 20 و شکل B و E با بزرگنمایی 40). در رنگآمیزی اشکال A، B، C و E از رنگ آمیزی رایت گیمسای اصلاح شده و در رنگ آمیزی اشکال D و F از رنگ آمیزی تولوئیدن آبی O استفاده شده است.
شکل 5: گسترش واژینال از مرحله مت استروس در موش صحرایی اسپراگ داولی. مرحله مت استروس با ظهور نوتروفیلها به صورت پراکنده یا خوشهای همراه با تعدادی از سلولهای اپیتلیومی هستهدار و بدون هسته مشخص میشود (A و B). با پیشرفت مرحله مت استروس، تعداد نوتروفیلها افزایش مییابد که منجر به افزایش میزان سلولاریتی گسترش میشود (31). (شکل A، C و E با بزرگنمایی 10 و شکل B، D و F با بزرگنمایی 40). در رنگآمیزی گسترشهای واژینال از رنگآمیزی تولوئیدن آبی O استفاده شده است.
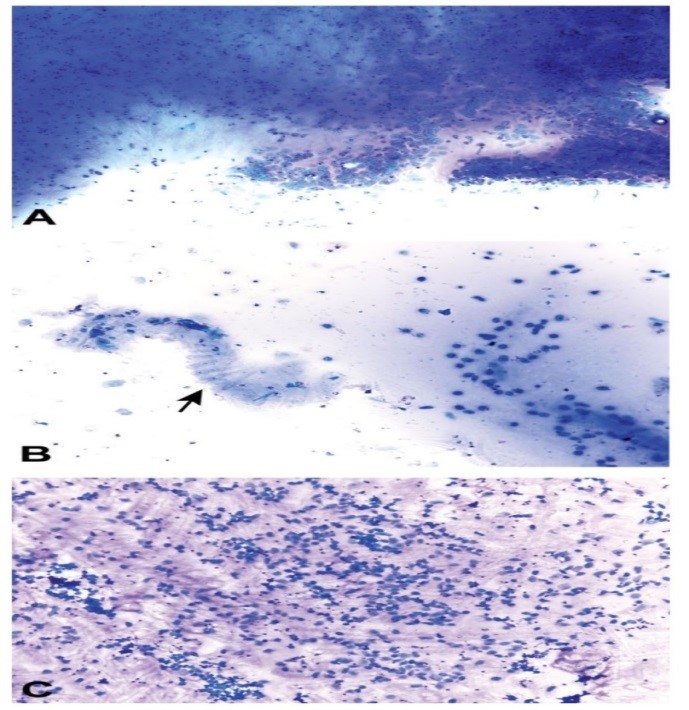
شکل 6: گسترش واژینال از مرحله دای استروس در موش صحرایی اسپراگ داولی. موکوس رنگ گرفته بازوفیلیک تا ائوزینوفیلیک، شمای نوتروفیلها و سلولهای اپیتلیومی را تخریب کرده است. موکوس کلاسیک چرخشی در شکل B مشاهده میشود (پیکان) (31). در رنگآمیزی شکل B از رنگآمیزی رایت گیمسای اصلاحشده و در رنگآمیزی اشکال A و C از رنگآمیزی تولوئیدن آبی O استفاده شده است.
بحث
از نقطه نظر شیوع گسترده عارضه اندومتریت در جامعه زنان ایرانی و ارتباط وسیع این بیماری با ناباروری، در مطالعه حاضر القای اندومتریت در مدل موش صحرایی و تعیین مراحل سیکل استروس این حیوان با استفاده از روش سایتولوژی واژینال بهمنظور القای موفقیتآمیز این عارضه در این مدل حیوانی مد نظر قرار گرفت. از طرفی با توجه به نقش کلیدی و بااهمیت التهاب و استرس اکسیداتیو در بروز اندومتریت، نویسندگان در قسمت بحث بیشتر به این مورد پرداختهاند. عنوانشده که عفونتهای رحمی، الگوی ترشح هورمونهای استروئیدی را تغییر میدهند (44). وجود لنفوسیتها، نوتروفیلها، سلولهای رحمی و ائوزینوفیلها همیشه به عنوان نشانگر اندومتریت مزمن در نظر گرفته نمیشوند، بلکه از اجزای طبیعی استرومایی اندومتریوم بهویژه کمی قبل از قاعدگی بهشمار میروند (45). التهاب سبب تغییر تولید سایتوکینهای اندومتریال میشود که ممکن است با ایجاد اختلال در عملکرد بافت اندومتری، منجر به بروز اختلالاتی در قاعدگی و کاهش پذیرش رویانی اندومتریوم شود (46). افزایش سلولهای لنفوسیت B و بیان غیرطبیعی واسطه¬های پاراکرین همانند مولکولهای چسبنده و کموکینها در اندومتر زنان مبتلا به اندومتریت مزمن مشاهده شده است (47). این محیط پاراکرین غیر طبیعی ممکن است شکست در فرآیند-های پذیرش اندومتریال و پرولیفراتیو را توضیح دهد که ممکن است در موارد اندومتریت مزمن مشاهده شود (46,48,49). گزارششده که امکان استفاده از پروفایل سایتوکینهای خاص اندومتریال برای پیشگویی در موارد لانهگزینی و سیر تکاملی آبستنی موفق در پروتکلهای IVF وجود دارد (50). همزمان با آزاد شدن واسطه های پیش التهابی، ترکیباتی جبرانی در جهت ایجاد سندرم پاسخ ضدالتهابی آزاد میشود (51). اینترلوکین 11 (IL-11)، نوعی سایتوکین دارای عملکرد چندگانه با خواص ضدالتهابی است (13). IL-11 (Interleukine) در سلولهای پوششی و داربستی تولید میشود که حداکثر تولید آن در حین دسیدوایی شدن بافت اندومتریوم است (52). عنوان شده که IL-11 و IL-11R در بافت اندومتریوم در گروهی از زنان نابارور مبتلا به اندومتریوز در مقایسه با زنان بارور، کاهش مییابد (53). علاوه بر این، CCL4 نوعی کموکین است که به عنوان جاذب قوی برای سلولهای کشنده طبیعی (Natural killer cells) و ماکروفاژهای اندومتر ایفای نقش میکند. افزایش بیان این کموکین در طول فاز پرولیفراتیو کم و در فاز ترشحی بسیار زیاد است که مطابق تغییر میزان سلولهای NK در اندومتر است (56-54). در موارد التهاب بیش از حد، میزان سایتوکین TNF-α بسیار زیاد است (57). وجود سایتوکین های پیش-برنده التهابی شامل TNF-α (Tumor necrosis factor alpha) و IL-1β قطبیت ماکروفاژ را به سمت فنوتیپ نوع یک سوق میدهند (57,58). ماکروفاژهای نوع 1 سبب تولید سایتوکینهای پیشبرنده التهابی همانند IL-1 و TNF-α، گونههای اکسیژن فعال و نیتریک اکسید میشوند که همگی در بروز التهاب و آسیب مشارکت میکنند (59). علاوه بر نقش ترشحی ماکروفاژها در فرآیند های التهابی (57)، این سلولها، منبعی از سایتوکینهای پیش برنده التهابی و گونههای اکسیژن فعال هستند که ساخت نیتریک اکسید- که در آسیب سلولی مشارکت میکنند را القا میکنند (60). بر خلاف سلولهای کشنده طبیعی رحمی، ماکروفاژها در ناحیه لانه گزینی در تمام طول دوره آبستنی در سطح بالایی هستند (56) و هم چنین در لانهگزینی و دسیدوایی شدن، مشارکت میکنند. در دوره پس از زایش، ترشح مولکولهای پیشبرنده التهابی همانند TNF-α، اینترلوکینها (IL-1، IL-6، IL-8 و IL-12) و نیتریک اکساید از ورود باکتری به داخل رحم ناشی میشود (61). آزادشدن پروتئینهای فاز حاد از کبد همراه با سایتوکینهای پیشبرنده التهابی تحریک میشود. به طور طبیعی، سطوح سایتوکینها پس از جمع شدن رحم و حذف آلودگی باکتریایی کاهش مییابد (62). بروز هر گونه اختلال در روند طبیعی دوره نفاس منجر به افزایش ترشح سایتوکینها میشود. عنوان شده که پروفایل سایتوکینها به شدت و پایداری التهاب در بافت اندومتر وابسته است (20,63,64). از طرفی درد ناشی از التهاب، دردی مزمن و طبیعی است که با آسیب بافتی و آزادشدن واسطههای التهابی از بافت آسیب دیده همراه است (65). شواهد بالینی زیادی وجود دارد که بیماریهای التهابی و عفونتها غالباً سبب ایجاد اختلال در سیستم تولیدمثلی جنس ماده میشوند (69-66). بهخوبی نشان داده شده که استرس ایمنی می تواند منجر به اختلالات تولیدمثلی همانند عدم تخمکگذاری و توقف قاعدگی شود (70). گزارش شده که IL-10 و IL-4 به عنوان سایتوکینهای مهم، نقشهای اساسیای در پاسخهای التهابی ایفا میکنند (32). TNF-α، IL-1β، IL-6، MCP-1 و IL-8 نقش مهمی در فرآیندهای فیزیولوژیک و پاتولوژیک سیستم تولیدمثلی ایفا میکنند (71,72). سایتوکینهای پیش برنده التهابی همانند IL-1α، IL-1β، TNF-α و IL-6 معمولاً در گاوهای مبتلا به اندومتریت افزایش مییابند (72,73). سایتوکین های پیشبرنده التهابی معمولاً در فلش رحمی گاو مبتلا به اندومتریت افزایش مییابند (20,73,74). علاوه بر این عنوان شده که در گاوهای مبتلا به اندومتریت تفاوت معناداری در میزان بیان ژن IL-10 مشاهده نشده است (63). واگرایی بین سطوح سایتوکینها در مطالعات مختلف ممکن است به دلیل تفاوت در گونههای حیوانی مختلف، زمان نمونهگیری و همچنین روش سنجش باشد. در موارد التهاب شدید، میزان TNF-α بیش از حد طبیعی است (57). افزایش بیان ژنهای سایتوکینهای خاص همانند IL-6، IL-8 و TNF-α میتوانند در تشخیص شدت و میزان (درجه) اندومتریت به کار گرفته شوند (75). IL-10 به عنوان نوعی سایتوکین ضد التهابی مهم در نظر گرفته میشود که نقشهای مهمی در کنترل پاسخهای التهابی ایفا میکند (76). IL-10 در حین آبستنی به عنوان یک مهارکننده ایمنی فعال مادری فعالیت میکند تا اجازه پذیرش آلوگرافت رویانی را به ارمغان آورد (77). شواهد حاکی از برهم کنش دوطرفه بین سیستم ایمنی و نورواندوکرینی با سایتوکینها است. سایتوکینها ممکن است روی نورونهای GnRH در هیپوتالاموس تأثیرگذار باشند و سنتز GnRH را مهار کنند (17). مطابق یافتههای بالینی زیر مجموعه نورون-های GnRH و فیبرهای آن میتوانند آثار مستقیم مولکولهای التهابی را حس کنند (78) که شامل فعالیت سایتوکینها در اندامهای دور از بطنهای مغزی است (81-79). علاوه بر این، ممکن است سایتوکینها در قادر به اصلاح عملکرد نورونهای GnRH به صورت مستقیم باشند. مطالعات نشان دادهاند که گیرندههایی همانند گیرندههای اینترلوکین، پروستاگلندین و TNF-α با پیشرفت پاسخ ایمنیهای ایمنی مرتبط هستند که به وفور در نورونهای GnRH موش سوری بیان می شوند (82). عنوان شده که بیان گیرنده سایتوکین پیشبرنده التهابی IL-18Rα و گیرنده سایتوکین ضد التهابی IL-18R در بخشی از نورونهای GnRH، شرایطی برای عملکرد مستقیم آن ها بر GnRH فراهم میآورند (83). IL-10 یکی از سایتوکین¬های ضد التهابی بسیار مهم است که پاسخ ایمنی در مغز را تعدیل میکند. مطالعات بالینی نشاندادهاند که IL-10 برای آبستنی طبیعی، باروری و لانهگزینی ضروری است (86-84)؛ در حالیکه کاهش IL-10 با از دست رفتن آبستنی، تولد زودرس یا فشارخون بالا در آبستنی (پرهاکلامپسی (Pre-eclampsia)) مرتبط است (77). نشان داده¬شده که فعالیت IL-10 بر نورونهای ترشحکننده GnRH ممکن است به حفظ تمامیت سیکل استروس در عفونتهای باکتریایی/ ویروسی کمک کند (83). عفونت¬های رحمی تحت عنوان پیامدی از آسیبهای وارده به مکانیسمهای دفاعی بافت رحمی شناخته میشوند که به وسیله تغییرات فیزیولوژیک ایجاد شده در دوره پس از زایش به¬وقوع می¬پیوندند. تغییر دیگری که در دوره پس از زایش رخ میدهد، افزایش تولید گونههای اکسیژن فعال است. عدم تعادل بین تولید گونههای اکسیژن فعال و پاک¬سازی آن منجر به ایجاد شرایط استرس اکسیداتیو میشود. نشان داده شده که ارتباط معناداری بین بیماریهای التهابی همانند اندومتریت و استرس اکسیداتیو وجود دارد (87,88). گونههای اکسیژن فعال در طول سنتز پروستاگلندینها تولید میشوند که افزایش تعداد لوکوسیتهای پلیمورفونوکلئار را در پی دارد. بروز تغییراتی در سنتز پروستاگلندینها در موارد مبتلا به اندومتریت سبب بروز اختلالاتی در تولید گونههای اکسیژن فعال میشود (89). بهخوبی شناختهشده که تغییراتی در جریان خون اندومتریوم در طول سیکل قاعدگی رخ میدهد (90) و تعداد چشمگیری از لوکوسیتها در بافت اندومتریوم زنان توزیع میشوند (91). رادیکالهای سوپراکسید در اندومتریوم زنان تشخیص داده شدهاند (92). نشان داده شده که آنزیم سوپراکسید دیس موتاز که یک پاککننده رادیکال آزاد اکسیژن است در اندومتریوم رحم وجود دارد و قبل و در هنگام لانهگزینی افزایش مییابد (93). علاوه بر این نشان داده شده که ژن آنزیم کاتالاز -که آب اکسیژنه را به آب و اکسیژن تجزیه میکند و نوعی آنزیم آنتی اکسیدانی به شمار میرود در زنان مبتلا به اندومتریت و آدنومیوزیس در مقایسه با گروه کنترل سالم بیشتر بیان میشود (94). رادیکال سوپراکسید و سیستم اسکونجر آن نقشی مهم در پرولیفراسیون و تمایز اندومتریوم ایفا میکنند (95). مدلهای حیوانی اندومتریت بالینی برای جلوگیری از بروز و درمان اندومتریت بسیار بااهمیت هستند و مدلهای حیوانی متعددی از اندومتریت همانند حیوانات اهلی و جوندگان از طریق انفوزیون اشریشاکلی با یا بدون دیگر باکتری¬ها داخل حفره رحم حاصل میشوند (100-96). رحم موش صحرایی دارای 2 شاخ است که هر شاخ به صورت کاملاً جداگانه به سرویکس میرسند. در اولین مدل، فقط در شاخ چپ رحم باکتری تلقیح میشود و شاخ راست به عنوان کنترل برای ارزیابی میزان اثربخشی دارو مدنظر قرار میگیرد. به محض ایجاد عفونت، پاسخ ایمنی اندومتریوم به پاتوژنها میتواند فعال شود که سبب آزادشدن سایتوکینها و کموکینها در سلولهای اندومتریال میشود که برای پاکسازی عفونت ضروری هستند. سایتوکینها یا ژنهای آنها در سرم، بافت رحم و فلش رحمی در حیوانات مبتلا به اندومتریت مشخص میشوند (63,75,101). بنابر مطالعه حاضر، با درک و فهم صحیح نحوه ایجاد و مکانیسمهای دخیل در بروز یک اختلال در بدن، میتوان به صورت دقیق سعی در درمان و رفع این مشکل نمود. بنابراین، در این مطالعه مروری تأکید اصلی نویسندگان بر طریقه و مکانیسم ایجاد اندومتریت، طریقه القای این بیماری در مدل موش صحرایی و تعیین مرحله سیکل استروس موش صحرایی حهت القای موفقیت آمیز اندومتریت در این مدل حیوانی بود. همچنین نویسندگان مقاله حاضر در قسمت بحث به نقش با اهمیت التهاب و استرس اکسیداتیو در ایجاد بیماری اندومتریت پرداختهاند.
نتیجه گیری
در ابتدا میتوان چنین عنوان نمود که اندومتریت نوعی اختلال التهابی در پوشش (آستر) آندومتریوم رحم در طول مرحله نفاس به شمار میرود. این بیماری عمدتاً به¬صورت تحت بالینی نمود پیدا میکند و از طریق ایجاد اختلال در تعادل هورمونی سبب ناباروری میشود. روش سایتولوژی واژینال بهعنوان یک نشانگر حساس در تعیین مرحله سیکل استروس در بسیاری از گونهها در نظر گرفته میشود که بازتابی از تعادل بین آثار استروژن و پروژسترون است. از سایتولوژی واژن در تشخیص مراحل مختلف سیکل استروس و تعیین شرایط غیر طبیعی سیستم تولیدمثلی قبل و بعد از زایمان استفاده میشود. این تغییرات بهوسیله درصد و انواع سلولهای موجود در اپیتلیوم واژن تعیین میشود که به سیکل تخمدانی و غلظتهای استروژن در سرم وابسته است؛ بنابراین سایتولوژی واژن همیشه انعکاسی از فعالیت استروژنیک در جنس ماده است. روش سایتولوژی واژن به عنوان استاندارد طلایی برای تعیین مرحله سیکل استروس در موشهای صحرایی ماده در نظر گرفته میشود. همچنین ارتباطی بین سطوح هورمونی تخمدانی و مرحله سیکل استروس وجود دارد که به وسیله سایتولوژی واژن مشخص میشود. در تشخیص پاتوژنز پرکتیکال عفونت رحمی در بسیاری از گونهها از روش سایتولوژی واژن استفاده میشود. سایتوکینهای متنوعی در انسان و حیوانات مبتلا به اندومتریت افزایش مییابند. هم چنین به خوبی شناخته شده که ارتباط معناداری بین استرس اکسیداتیو و بسیاری از بیماریهای التهابی همانند اندومتریت وجود دارد. سایتوکینهای متنوعی در انسان و حیوانات مبتلا به اندومتریت افزایش مییابند. افزایش بیان ژنهای سایتوکینهای خاص همانند IL-6، IL-8 و TNF-α میتوانند در تشخیص شدت و میزان (درجه) اندومتریت به کار گرفته شوند. تغییر دیگری که در دوره پس از زایش رخ میدهد، افزایش تولید گونههای اکسیژن فعال است. عدم تعادل بین تولید گونههای اکسیژن فعال و پاک سازی آن منجر به ایجاد شرایط استرس اکسیداتیو میشود و همچنین ارتباط معناداری بین بیماریهای التهابی همانند اندومتریت و استرس اکسیداتیو وجود دارد.
حامی مالی: ندارد.
تعارض منافع: وجود ندارد.
اندومتریت نوعی ناهنجاری شایع سیستم تولیدمثلی در حیوانات اهلی ماده بهشمار میرود که پیامدهای حاصل از آن در گستره وسیعی از عدم تأثیر بر سیستم تناسلی تا رخداد ناباروری پایدار قرار می گیرد. از دوره پس از زایش تحت عنوان دوره نفاس یاد میشود که رحم متعاقب پاکسازی باکتریایی از طریق سیستم ایمنی رحم مادر و یا آلودگی مجدد، به راحتی تحت تأثیر عفونت قرار می گیرد. ناتوانی رحم در دفع آلودگی سبب ایجاد اندومتریت بالینی توسط باکتریهای پاتولوژیک در رحم می شود که مشخصه آن ترشحات چرکی واژینال از رحم درگیر است (1,2). گزارششده که انواع مختلفی از باکتریها که عمدتاً اشریشاکلی، سویههای استافیلوکوکوس، سویههای استرپتوکوکوس، آرکانوباکتریوم پایوژنز، پاستورلا، کبسیلا پنومونیه و فوزوباکتریوم نکروفوروزوم هستند سبب بروز اندومتریت میشوند و میتوان آنها را از رحم مبتلا به اندومتریت و یا بدون اندومتریت جدا کرد (6-3). با این حال، اندومتریت در حیوانات نیز تنها سبب ناباروری نمیشود بلکه همچنین خسارات اقتصادی فراوانی را در پی دارد و تولید شیر و عملکرد سیستم تناسلی را تحت تأثیر قرار میدهد (7,8). اندومتر دارای امکانات ایمنی اولیه همانند گیرندههای شبه تول (toll like receptors) است که بهعنوان خط اولیه دفاع علیه تهاجم میکروبها عمل میکنند (9). گیرندههای شبه تول، نقشی حیاتی در تشخیص محدوده مولفههای میکروبی ایفا میکنند و این گیرندهها سبب بیان و آزادشدن سایتوکینها و کموکینها در فعالیت و یورش نوتروفیل ها و مونوسیت ها میشوند (10,11). سایتوکینها، واسطههایی گلیکوپروتئینی با عملکرد چندگانه هستند که در التهاب موضعی و سیستمیک مشارکت می¬کنند (12,13). در رحم بسیاری از گونهها، محدوده وسیعی از سایتوکینها و کموکینها بیان میشوند (13). پس از تشخیص تهاجم باکتری، سلولهای ایمنی انواع مختلفی از سایتوکینهای التهابی و پیش برنده التهابی را آزاد میکنند (14,15). این سایتوکین ها به ویژه اینترلوکین 1، سنتز هورمون آزادکننده گنادوتروپینها (Gonadotropin-releasing hormone) را به وسیله افزایش آزادشدن کورتیکواستروئیدها سرکوب میکنند (16,17). عدم تعادل هورمونی نیز فاکتوری مشارکت کننده برای توسعه ناباروری در اندومتریت قلمداد میشود. استرس اکسیداتیو در سلولها در نتیجه عدم توازن بین سیستمهای اکسیدکننده و آنتی اکسیدان رخ می دهد. هنگامی که تولید رادیکالهای آزاد از ظرفیت دفاعی آنتی¬اکسیدان بدن برای سمزدایی از آنها بیشتر شود ، شرایطی به نام استرس اکسیداتیو رخ میدهد، به گونهای که نمیتوان از افزایش اکسیدانها و کاهش آنتیاکسیدانها جلوگیری کرد و تعادل اکسیداتیو/ آنتیاکسیدانی به سمت اکسیداتیو تغییر میکند (18). گونههای فعال اکسیژن (Reactive oxygen species)، رادیکالهای مشتق از اکسیژن هستند و پراکسیل، سوپراکسید بسیار واکنشپذیر (-O2) و هیدروکسیل (OH) و هم چنین غیر رادیکالهایی مانند پراکسی نیتریت (-ONOO) و پراکسید هیدروژن (H2O2) را شامل می¬شوند. ترکیبات مذکور توسط سیستمهای آنزیمی (نیکوتین آمید آدنین دینوکلئوتید فسفات اکسیداز (Nicotinamide adenine dinucleotide phosphate)، میلوپراکسیدازها، سیکلواکسیژناز و زانتان اکسیداز) در میکروگلیاها و گلبولهای سفید خون سنتز میشوند. گونههای اکسیژن فعال، نقش مهمی در تنظیم بسیاری از فرآیندهای تولیدمثلی همانند فولیکولوژنز، بلوغ اووسیت، لانهگزینی، امبریوژنز و توسعه اتصال واحد جنینی- جفتی ایفا میکنند. گونههای اکسیژن فعال ممکن است به ماکرومولکولها به صورت مستقیم و غیر مستقیم به وسیله فعال شدن مسیرهای سیگنالینگ از طریق واسطههای التهابی آسیب وارد کنند (19,20). هم چنین بهخوبی شناخته شده که ارتباط معناداری بین استرس اکسیداتیو و بسیاری از بیماریهای التهابی همانند اندومتریت (21)، ورم پستان (22)، آرتریت روماتوئید و کولایتیس (23) وجود دارد. میتوان از مدلهای حیوانی بهصورت جایگزین در سیستمهای آزمایشی پژوهشهای زیست پزشکی جهت نیل به هدف حصول اطلاعات درباره درمانهای جدید استفاده نمود (24,25). علی رغم این که هیچ یک از مدلهای حیوانی بهطور کامل ایدهآل نیستند، اما موش صحرایی بیشترین و گستردهترین گونه مورد استفاده در مطالعات مرتبط با بحث زنان، زایمان و مامایی است (26). پژوهشها و مطالعات درون تنی در مدلهای موش صحرایی مرتبط با زنان و زایمان دارای معایبی از جمله تفاوت شکل هندسی اندامهای تولیدمثلی موش صحرایی با انسان، اختلاف آناتومیکی بسیار زیاد آنها با انسانها و سخت بودن اجرای فرآیندها و جراحی های مرتبط با تخمدان و رحم -که از اندازه کوچک آنها ناشی میشود است (26). با وجود این، به کار گیری از مدلهای مرتبط با مبحث مامایی، زنان و زایمان موش صحرایی دارای مزایایی از جمله تغییرات اندک خصوصیات پاتوفیزیولوژیکی، فیزیکی و خواص مکانیکی در بین حیوانات، راندمان هزینه خوب، قابلیت دستورزی راحت و در دسترس بودن آن است که امکان استفاده از این مدلها در تحقیقات زیست پزشکی، علوم دارویی، جراحی و دیگر علوم وابسته را به ارمغان می¬آورد (26). علیرغم معایبی که در مدلهای حیوانی وجود دارد، با اینحال آنها میتوانند به صورت ماکتی از سیستمهای حقیقی عمل و به سهولت آنها را تجسم کنند (27). گونههای حیوانی پیشنهاد شده برای ایجاد این مدلهای مذکور دارای مزایایی از جمله قابلیت تکرار نتایج، مدیریت در طول انجام آزمایش، هزینه کم و حداقل پیامدهای اجتماعی/ اخلاقی هستند (28). تقریباً در تحقیقات درونتنی امکان جمع-آوری مناسب دادهها با توجه به شرایط فیزیوپاتولوژیک به ارمغان میآید که میتوانند در ایجاد مداخلات بالینی مؤثرتر به¬کار گرفته شوند (29). بنابراین، القای تجربی اندومتریت در مدل حیوانی موش صحرایی به صورت گسترده در بررسی این بیماری مورد استفاده قرار میگیرد. برای القای اندومتریت اشریشاکلیای در موش صحرایی، ابتدا موشهای صحرایی برای مدت 5 روز پروژسترون دریافت میکنند (با دوز 16 میلیگرم بر کیلوگرم به صورت زیر جلدی) تا فاز پروژسترونی سیکل استروس فراهم شود که برای تأیید ایجاد این فاز، از روش سایتولوژی واژن استفاده میشود. روش سایتولوژی واژینال بهعنوان یک نشانگر حساس در تعیین مرحله سیکل استروس در بسیاری از گونهها در نظر گرفته میشود که بازتابی از تعادل بین آثار استروژن و پروژسترون است. از سایتولوژی واژن در تشخیص مراحل مختلف سیکل استروس و تعیین شرایط غیر طبیعی سیستم تولیدمثلی قبل و بعد از زایمان استفاده میشود. در برخی از گونهها همانند سگ، گربه، موش سوری و خرگوش تغییرات ایجادشده در واژن تحت تأثیر مرحله سیکل استروس نسبتاً یکپارچه است؛ بنابراین میتوان روش سایتولوژی واژن را تشخیص مرحله سیکل استروس به طور قابل اعتمادی در گونههای مذکور بهکار گرفت (30). فازهای سیکل استروس به پرواستروس (مشاهده سلولهای اپیتلیومی هستهدار بیضوی در گسترش واژینال)، استروس (مشاهده سلولهای اپیتلیومی سنگفرشی شاخی¬شده با شکل نامنظم در گسترش واژینال)، مت استروس (مشاهده سلولهای اپیلتیومی شاخی شده تکهتکه شده و لوکوسیتهای کوچکتر و تیرهتر در گسترش واژینال) و دای¬استروس (مشاهده اپیتلیوم هستهدار و لوکوسیتهای نابالغ در گسترش واژینال) تقسیم میشود (31). اهمیت روزافزون بیماری اندومتریت، ناباروری ناشی از آن و شیوع گسترده این بیماری مهم در جامعه زنان ایرانی سبب تلاشی شد که ماحصل آن در قالب این مقاله مروری به رشته تحریر درآمد. هدف از مطالعه حاضر، القای اندومتریت در مدل موش صحرایی و تعیین مراحل سیکل استروس این حیوان با استفاده از روش سایتولوژی واژینال به منظور القای موفقیتآمیز این عارضه در مدل موش صحرایی بود. نویسندگان ابتدا به طرق مدلسازی اندومتریت در موش صحرایی پرداختهاند. سپس تعیین مراحل سیکل استروس در موش صحرایی جهت القای موفقیتآمیز اندومتریت در موش صحرایی را مورد بررسی قرار دادهاند و در باب مکانیسمهای دخیل در ایجاد این بیماری سخن گفتهاند.
روش بررسی
در نگارش این مقاله مروری از کلمات کلیدی القای اندومتریت، مدل موش صحرایی، سایتولوژی واژن، سیکل استروس و مقالات نمایه شده در پایگاههای اطلاعاتیScience Direct, Scopus, Pubmed, Springer Science ، Google scholar و SIDاستفاده شد. تمامی مقالات بدون در نظر گرفتن محدودیت زمانی و تا سال 2023 جستوجو شدند. پس از بررسی اولیه، مقالات تکراری و غیر مرتبط حذف شدند. سپس مقالات جستوجو شده مطابق معیارهای ورود به مطالعه وارد و طبق معیارهای خروج از مطالعه خارج شدند. از نقطهنظر این¬که اندومتریت نوعی بیماری سیستم تولیدمثلی جنس ماده است که با التهاب در قسمت غدهای اندومتریوم و بافتهای استرومایی آن مشخص میشود و هم چنین نقش کلیدی استرس اکسیداتیو در بروز این بیماری، معیارهای ورود به مطالعه شامل تمامی مقالات پژوهشی اصیل منتشر شده با تمرکز بر نقش سایتوکینهای پیشبرنده التهابی و استرس اکسیداتیو در ایجاد اندومتریت، روشهای القای اندومتریت در مدل موش صحرایی و تعیین مراحل سیکل استروس موش صحرایی با استفاده از روش سایتولوژی واژن بود. معیارهای خروج از مطالعه شامل گزارش مورد، مقالات همایشها و نامه به سردبیر بود. در نهایت در نگارش این مطالعه مروری تمامی موارد اخلاقی لازم در خصوص استفاده صحیح از مقالات استخراج شده و موازین مربوط به انتشار اثر رعایت شد. سرانجام طریقه و مکانیسم ایجاد اندومتریت، طریقه القای این بیماری در مدل موش صحرایی و تعیین مرحله سیکل استروس موش صحرایی حهت القای موفقیتآمیز اندومتریت در این مدل حیوانی در مطالعه حاضر مورد بررسی قرار گرفت.
روشهای ایجاد اندومتریت در موش صحرایی: روش اول جداسازی باکتری: بهمنظور جداسازی باکتری برای ایجاد مدل اندومتریت در موش صحرایی، میتوان از ترشحات چرکی واژینال حیوانات تازهزا استفاده کرد که دارای نشانههای بالینی اندومتریت هستند. سپس ترشحات چرکی جمعآوریشده در محیط کشت بلاد آگار، آنکوبهشده و پس از رشد میتوان نوع میکروارگانیسم را مشخص نمود (32).
روش اول ایجاد مدل اندومتریت در موش صحرایی: برای ایجاد مدل مذکور در دوره موشهای صحرایی پس از زایش، با ترکیب کتامین (با دوز 70 میلیگرم بر کیلوگرم- آلفاسان هلند) و زایلازین (با دوز 10 میلیگرم بر کیلوگرم- آلفاسان هلند) به صورت داخل صفاقی بیهوش میشوند (33). موشهای صحرایی در حالتگماری پشتی قرار داده شده و پس از آماده¬سازی موضع جراحی، یک برش 2 سانتیمتری در محوطه شکمی در ناحیه میانی شکم با فاصله 1 سانتیمتری از سمفیز لگن زده میشود. پس از برش پوست و عضلات، شاخهای رحم اکسپوزشده و برای تحریک بافت اندومتریوم 0/1 میلیلیتر از محلول استیک اسید 3% به شاخ چپ رحم و همان حجم سالین به شاخ راست رحم (به عنوان کنترل) تزریق میشود. بعد از تزریق، شاخهای رحم به داخل محوطه شکمی برگردانده شده و عضلات با نخ بخیه قابل جذب و پوست با نخ بخیه غیر قابل جذب بخیه میشوند. حیوانات تا زمان ریکاوری در قفس انفرادی قرار داده میشوند و برای مدت زمان 48 ساعت برای ردیابی علایم بیماری تحتنظر قرار میگیرند. با گذشت 4 روز پس از تزریق استیک اسید و تحریکِ بافتِ اندومتریومِ شاخِ چپِ رحمِ موشهایِ صحرایی، لاپاراتومی ثانویه انجام میشود. پس از بیهوشی و آمادهسازی موضع جراحی در شاخ چپ رحم میزان 0/3 میلیلیتر باکتری (اشریشاکلی و استافیلوکوکوس هایکوس)- که دارای 109×1 CUF (Colony-forming unit) بر میلیلیتر باکتری است تلقیح میشود و به شاخ راست نیز همان حجم سالین تزریق میگردد (17). با گذشت 4 روز پس از تلقیح باکتری در شاخ چپ رحم، موشهای صحرایی آسانکشی شده و میتوان بافت رحم را از منظر هیستوپاتولوژی و جداسازی باکتری و سایتوکینهای التهابی مورد ارزیابی قرار داد (32).
روش دوم آماده سازی باکتری: میتوان برای آمادهسازی و تهیه باکتری اشریشاکلی از استاندارد مک فارلاند برای استانداردکردن تعداد تقریبی باکتریها استفاده کرد که به عنوان جایگزین اندازهگیری میزانه کدورت شناخته شده است. سوسپانسیون باکتریایی در مقایسه با محلول استاندارد مکفارلاند برای تخمین غلظت و میزان جمعیت باکتریایی مشاهده می شود. برای به دست آوردن غلظت باکتریایی 105 CUF بر 50 میکرولیتر، با مراجعه به لولههای مک فارلاند سوسپانسیون باکتریایی 10 برابر با سالین استریل رقیق میشود. این تکنیک به صورت گسترده در فیلد میکروبیولوژی مورد استفاده قرار میگیرد (34,35).
روش دوم ایجاد مدل اندومتریت اشریشاکلی در موش صحرایی: برای القای این نوع اندومتریت در موش صحرایی، ابتدا موشهای صحرایی برای مدت 5 روز پروژسترون دریافت کردند (با دوز 16 میلیگرم بر کیلوگرم به صورت زیر جلدی) تا فاز پروژسترونی سیکل استروس فراهم شود که برای تأیید ایجاد این فاز، از روش سایتولوژی واژن استفاده میشود. در آخرین روز تزریق پروژسترون (روز 5) موشهای صحرایی با استفاده از داروی کتامین (با دوز 70 میلیگرم بر کیلوگرم) و زایلازین (با دوز 10 میلیگرم بر کیلوگرم) به صورت داخل صفاقی، بیهوش شده (36) و در حالتگماری پشتی قرار میگیرند. پس از آماده سازی موضع جراحی، یک برش 2 سانتیمتری عمود بر خط وسط شکم زده شده و با برش پوست و عضلات، محوطه شکمی نمایان میشود. سپس شاخ راست با دست به بیرون هدایت میشود. تحت شرایط استریل، میزان 50 میکرولیتر از سوسپانسیون باکتریایی حاوی 105×1 CUF به ازای هر موش صحرایی از باکتری اشریشاکلی در شاخ راست رحم تلقیح میشود (37) (شکل 1) و سپس شاخ راست با ملایمت به داخل محوطه شکمی برگردانده شده و عضلات و پوست بخیه میگردند. میتوان با گذشت 16 ساعت پس از تلقیح باکتری، روند درمانی مدنظر را شروع نمود. گسترش واژینال در روز پنجم (آخرین روز تجویز پروژسترون) و با گذشت 5، 10 و 14 روز پس از تجویز از حیوانات تهیه میشود (38).
تشخیص مراحل سیکل استروس در موش صحرایی از طریق سایتولوژی واژن: عموماً سیکل استروس در موش صحرایی ماده به 4 مرحله پرواستروس، استروس، متاستروس و دای استروس تقسیمبندی میشود. خصوصیات برجسته مرحله پرواستروس، وجود سلولهای اپیلتیومی کوچک، کروی و هستهدار است که دارای ظاهر و اندازه نسبتاً یکنواخت هستند که این سلولها ممکن است در رنگآمیزی به شدت بازوفیلیک باشند. مرحله استروس بهوسیله غالب بودن سلولهای اپیلتیومی کراتینه بدون هسته در گسترش واژینال مشخص میشود. مرحله مت استروس به وسیله ترکیبی از سلولهای کراتینه بدون هسته و نوتروفیلها در گسترش واژینال مشخص میشود. مرحله دایاستروس با کاهش قابل توجه تعداد سلولهای اپیتلیومی کراتینه بدون هسته (اما الزاماً همراه با عدم حضور این سلولها نیست) مشخص میشود. تعیین مراحل سیکل استروس بر پایه انواع سلولها و نسبت هر کدام از آنها در گسترش واژینال در جدول 1 ذکر شده است. پراکندگی انواع سلولهای سیکل استروس در موش صحرایی در شکل 2 به تصویر کشیده شده است.

شکل 1: القای مدل اندومتریت در موش صحرایی. تلقیح باکتری اشریشاکلی به شاخ رحم در موش صحرایی تحت شرایط استریل (38).
جدول 1: طبقهبندی پایه از مراحل سیکل استروس بر پایه انواع سلولها و نسبت هر کدام از آنها در گسترش واژینال (31).


شکل 2: شکل شماتیکی از انواع سلولها و نسبت نسبی هر کدام از آنها در 4 مرحله از چرخه استروس در موش صحرایی (39).
پرواستروس: پرواستروس مرحله کوتاهی است که بهطور میانگین 14 ساعت در موش صحرایی و کمتر از 24 ساعت در موش سوری به طول میانجامد (40,41). خصوصیات برجسته این مرحله، وجود سلولهای اپیلتیومی کوچک، کروی و هستهدار است که دارای ظاهر و اندازه نسبتاً یکنواخت هستند که این سلولها ممکن است در رنگ آمیزی به شدت بازوفیلیک باشند. غالباً این سلولها به صورت دستجات (همانند خوشهانگور)، صفحات و رشته های به هم پیوسته مشاهده میشوند. با اینحال اشکال مذکور (دستهجات (همانند خوشه انگور)، صفحات و رشتههای به هم پیوسته) همیشه مشاهده نمیشود؛ به ویژه در نمونههایی که دارای تعداد کمی سلول است. نوتروفیل¬ها به¬صورت تیپیک نباید در این مرحله مشاهده شوند (شکل 3). عنوان شده که به صورت نادر نوتروفیلها گاهاً در اوایل پرواستروس در جوندگان در هنگام انتقال از دایاستروس به پرواستروس- مشاهده میشوند. نسبتاً تعداد کمی از سلولهای پوششی بزرگ و سلول های کراتینه بدون هسته ممکن است در این مرحله از سیکل استروس مشاهده شوند. با نزدیک¬شدن به مرحله استروس، بر تعداد سلولهای شاخی شده بدون هسته افزوده میشود. وجود تعداد کمی نوتروفیل یا سلول ای اپیتلیومی بزرگ و بدون هسته نباید در زمانی¬که خصوصیات بارز گسترش واژینال جمعیت سلولهای اپیتلیومی کوچک و کروی است، مانع از تشخیص مرحله پرواستروس شود (31). استروس: محدوده مرحله استروس در موش صحرایی بین 24 تا 48 ساعت و در موش سوری در حدود 12 تا 48 به طول میانجامد (40,41). این مرحله از سیکل استروس به وسیله غالب بودن سلولهای پوششی شاخی شده بدون هسته در گسترش واژینال مشخص میشود (شکل5). تعدادی باکتری ممکن است بهصورت چسبیده به دیگر سلولها یا به صورت آزاد در گسترش واژینال مشاهده شوند. گاهی سلولهای پوششی هستهدار نیز را میتوان در مرحله استروس مشاهده نمود. نوتروفیلها غالباً در گسترش واژینال این مرحله از سیکل استروس حضور ندارند اما گاهاً در اواخر استروس در هنگام انتقال از مرحله استروس به مت استروس دیده میشوند. در گسترش واژینال اواخر استروس در موش صحرایی (قبل از ظهور نوتروفیلها و مت استروس)، تعداد بیشتری از سلولهای اپیتلیومی هستهدار مشاهده میشوند (شکل 4) که شکل این سلولها، کوچک یا بزرگ، کروی یا بیضوی یا دوکی شکل دارای لبههای صاف تا نامنظم است و گاهاً در رنگآمیزی به شدت بازوفیلیک هستند. اواخر مرحله استروس نباید با پرواستروس اشتباه شود. عموماً سلولهای هستهدار موجود در مرحله پرواستروس دارای نسبت هسته به سیتوپلاسم بیشتری هستند و شکل آنها کروی تا نسبتاً بیضوی همراه با لبههای سلولی صاف است. نسبتاً تعداد زیادی از سلولهای اپیتلیومی هستهدار به صورت پراکنده همراه با سلولهای کراتینه بدون هسته در اواخر مرحله استروس در موش صحرایی در گسترش واژینال حضور دارند (42).
مت استروس: مستندات به خوبی حاکی از کوتاه بودن طول مرحله مت استروس در موش صحرایی است که این مرحله در موش صحرایی به مدت 6 تا 8 ساعت (41) و در موش سوری میتواند بیش از 24 ساعت (40) بهطول بینجامد. مرحله متاستروس به وسیله ترکیبی از سلولهای شاخی شده بدون هسته و نوتروفیلها در گسترش واژینال مشخص میشود. در موش صحرایی، سلولهای هستهدار کوچک و بزرگ اواخر استروس به تعداد کم تا متوسط در سراسر این مرحله وجود دارند (شکل5). نوتروفیل ها در اوایل مت استروس به صورت پراکنده و همراه با سلولهای اپیتلیومی مشاهده میشوند اما گاهی به صورت فشرده در کنار یک دیگر یا به صورت دسته جاتی در اطراف دیگر سلول ها نیز به نظر میآیند. در گسترش واژینال، معمولاً تعداد سلولهای اپیتلیومی در اوایل مت استروس بیشتر است اما ممکن است نسبت این سلول ها با نوتروفیل ها برابر باشد. با پیشرفت مرحله مت استروس با سرعت زیاد بر تعداد نوتروفیلها افزوده میشود ممکن است تا 10 برابر از سلولهای اپیتلیومی بیشتر شوند (43) و گسترش واژینال بسیار سلولی و متراکم خواهد شد. تعداد سلولهای اپیتلیومی در اواخر مت استروس کاهش مییابد و کاهش سلولاریتی گسترش واژینال حاکی از انتقال از مت استروس به دای استروس است. تفریق بین انتهای مت استروس و شروع دای استروس همیشه امکانپذیر نیست زیرا ظاهر و انواع سلولهای موجود در گسترش واژینال این مراحل از سیکل استروس (انتهای متاستروس و ابتدای دایاستروس) بسیار به یکدیگر شبیه است و به راحتی قابل تمیز از هم نیست (39).
دای استروس: دای استروس طولانیترین مرحله از سیکل استروس است که به طور میانگین به مدت زمان 48 تا 72 ساعت در موش سوری و موش صحرایی به طول میانجامد (40،41). این مرحله از سیکل استروس با کاهش قابلتوجه تعداد سلولهای اپیتلیومی کراتینه بدون هسته (اما الزاماً همراه با عدم حضور این سلولها نیست) مشخص میشود که نشانگر عبور از مرحله مت استروس و ورود به مرحله دای استروس است. سلولاریتی در سراسر گسترش واژینال کم تا متوسط همراه با ترکیبی از نوتروفیلها، سلولهای هستهدار کوچک و بزرگ و تعداد کمی از سلولهای کراتینه بدون هسته است (شکل 6). تعداد نوتروفیلها میتواند متغیر باشد اما معمولاً تعداد آن ها در اوایل دای استروس نسبت به سلولهای اپیتلیال بیشتر است و گاهاً گسترش واژینال منحصراً نوتروفیلیک است. گاهی در ابتدای دای استروس، ممکن است نوتروفیلها به صورت خوشهای مشاهده شوند. غیر معمول نیست که گسترشهای واژینال مرحله دایاستروس دارای سلولاریتی بسیار پایین به خصوص در روز 2 یا 3 دایاستروس باشند و فقط پراکندگی کم نوتروفیلها و سلولهای اپیتلیومی مشاهده شود (شکل 6). در اواخر دایاستروس ممکن است سلول های اپیتلیومی کروی شوند و به صورت دستهجات کوچکی آرایش یابند که حاکی از ورود به مرحله پرواستروس در روزهای آتی است؛ با اینحال ممکن است هنوز نوتروفیل ها مشاهده شوند (شکل 6) (42).

شکل 3: گسترش های واژینال مرحله پرواستروس از موش صحرایی اسپراگ داولی که به وسیله تعداد زیادی از سلول های اپیتلیومی هسته دار کوچک که مشخص می شود که به صورت تکی و یا به صورت خوشه های به هم پیوسته یافت میشوند (پیکان). شکل D، ظاهر بسیار تیپیک از مرحله پرواستروس را نشان می دهد که تحت عنوان زنجیره (بندرگاه) اپیتلیومی شناخته می شود (31) (شکل A و B با بزرگ نمایی 10؛ شکل C با بزرگ نمایی 20 و شکل D با بزرگ نمایی 40). در رنگ آمیزی اشکال A و B از رنگ آمیزی رایت گیمسای اصلاح شده و در رنگ آمیزی اشکال C و D از رنگ آمیزی تولوئیدن آبی O استفاده شده است.

شکل 4: گسترش واژینال از مرحله استروس (A و B) و اواخر استروس (C تا F) در موش صحرایی اسپراگ داولی. اشکال A و B با تعداد زیادی از سلولهای اپیتلیومی بدون هسته به طور تیپیک حاکی از مرحله استروس هستند. گسترشهای واژینال در اشکال C تا F حاکی از اواخر مرحله استروس هستند که با سلولهای اپیتلیومی بدون هسته کروی، بیضوی و دوکیشکل با تعداد پراکندهای از سلولهای اپیلتیومی بدون هسته مشخص می شود (31) (شکل A، C و D با بزرگ نمایی 10؛ شکل F با بزرگ نمایی 20 و شکل B و E با بزرگنمایی 40). در رنگآمیزی اشکال A، B، C و E از رنگ آمیزی رایت گیمسای اصلاح شده و در رنگ آمیزی اشکال D و F از رنگ آمیزی تولوئیدن آبی O استفاده شده است.

شکل 5: گسترش واژینال از مرحله مت استروس در موش صحرایی اسپراگ داولی. مرحله مت استروس با ظهور نوتروفیلها به صورت پراکنده یا خوشهای همراه با تعدادی از سلولهای اپیتلیومی هستهدار و بدون هسته مشخص میشود (A و B). با پیشرفت مرحله مت استروس، تعداد نوتروفیلها افزایش مییابد که منجر به افزایش میزان سلولاریتی گسترش میشود (31). (شکل A، C و E با بزرگنمایی 10 و شکل B، D و F با بزرگنمایی 40). در رنگآمیزی گسترشهای واژینال از رنگآمیزی تولوئیدن آبی O استفاده شده است.

شکل 6: گسترش واژینال از مرحله دای استروس در موش صحرایی اسپراگ داولی. موکوس رنگ گرفته بازوفیلیک تا ائوزینوفیلیک، شمای نوتروفیلها و سلولهای اپیتلیومی را تخریب کرده است. موکوس کلاسیک چرخشی در شکل B مشاهده میشود (پیکان) (31). در رنگآمیزی شکل B از رنگآمیزی رایت گیمسای اصلاحشده و در رنگآمیزی اشکال A و C از رنگآمیزی تولوئیدن آبی O استفاده شده است.
بحث
از نقطه نظر شیوع گسترده عارضه اندومتریت در جامعه زنان ایرانی و ارتباط وسیع این بیماری با ناباروری، در مطالعه حاضر القای اندومتریت در مدل موش صحرایی و تعیین مراحل سیکل استروس این حیوان با استفاده از روش سایتولوژی واژینال بهمنظور القای موفقیتآمیز این عارضه در این مدل حیوانی مد نظر قرار گرفت. از طرفی با توجه به نقش کلیدی و بااهمیت التهاب و استرس اکسیداتیو در بروز اندومتریت، نویسندگان در قسمت بحث بیشتر به این مورد پرداختهاند. عنوانشده که عفونتهای رحمی، الگوی ترشح هورمونهای استروئیدی را تغییر میدهند (44). وجود لنفوسیتها، نوتروفیلها، سلولهای رحمی و ائوزینوفیلها همیشه به عنوان نشانگر اندومتریت مزمن در نظر گرفته نمیشوند، بلکه از اجزای طبیعی استرومایی اندومتریوم بهویژه کمی قبل از قاعدگی بهشمار میروند (45). التهاب سبب تغییر تولید سایتوکینهای اندومتریال میشود که ممکن است با ایجاد اختلال در عملکرد بافت اندومتری، منجر به بروز اختلالاتی در قاعدگی و کاهش پذیرش رویانی اندومتریوم شود (46). افزایش سلولهای لنفوسیت B و بیان غیرطبیعی واسطه¬های پاراکرین همانند مولکولهای چسبنده و کموکینها در اندومتر زنان مبتلا به اندومتریت مزمن مشاهده شده است (47). این محیط پاراکرین غیر طبیعی ممکن است شکست در فرآیند-های پذیرش اندومتریال و پرولیفراتیو را توضیح دهد که ممکن است در موارد اندومتریت مزمن مشاهده شود (46,48,49). گزارششده که امکان استفاده از پروفایل سایتوکینهای خاص اندومتریال برای پیشگویی در موارد لانهگزینی و سیر تکاملی آبستنی موفق در پروتکلهای IVF وجود دارد (50). همزمان با آزاد شدن واسطه های پیش التهابی، ترکیباتی جبرانی در جهت ایجاد سندرم پاسخ ضدالتهابی آزاد میشود (51). اینترلوکین 11 (IL-11)، نوعی سایتوکین دارای عملکرد چندگانه با خواص ضدالتهابی است (13). IL-11 (Interleukine) در سلولهای پوششی و داربستی تولید میشود که حداکثر تولید آن در حین دسیدوایی شدن بافت اندومتریوم است (52). عنوان شده که IL-11 و IL-11R در بافت اندومتریوم در گروهی از زنان نابارور مبتلا به اندومتریوز در مقایسه با زنان بارور، کاهش مییابد (53). علاوه بر این، CCL4 نوعی کموکین است که به عنوان جاذب قوی برای سلولهای کشنده طبیعی (Natural killer cells) و ماکروفاژهای اندومتر ایفای نقش میکند. افزایش بیان این کموکین در طول فاز پرولیفراتیو کم و در فاز ترشحی بسیار زیاد است که مطابق تغییر میزان سلولهای NK در اندومتر است (56-54). در موارد التهاب بیش از حد، میزان سایتوکین TNF-α بسیار زیاد است (57). وجود سایتوکین های پیش-برنده التهابی شامل TNF-α (Tumor necrosis factor alpha) و IL-1β قطبیت ماکروفاژ را به سمت فنوتیپ نوع یک سوق میدهند (57,58). ماکروفاژهای نوع 1 سبب تولید سایتوکینهای پیشبرنده التهابی همانند IL-1 و TNF-α، گونههای اکسیژن فعال و نیتریک اکسید میشوند که همگی در بروز التهاب و آسیب مشارکت میکنند (59). علاوه بر نقش ترشحی ماکروفاژها در فرآیند های التهابی (57)، این سلولها، منبعی از سایتوکینهای پیش برنده التهابی و گونههای اکسیژن فعال هستند که ساخت نیتریک اکسید- که در آسیب سلولی مشارکت میکنند را القا میکنند (60). بر خلاف سلولهای کشنده طبیعی رحمی، ماکروفاژها در ناحیه لانه گزینی در تمام طول دوره آبستنی در سطح بالایی هستند (56) و هم چنین در لانهگزینی و دسیدوایی شدن، مشارکت میکنند. در دوره پس از زایش، ترشح مولکولهای پیشبرنده التهابی همانند TNF-α، اینترلوکینها (IL-1، IL-6، IL-8 و IL-12) و نیتریک اکساید از ورود باکتری به داخل رحم ناشی میشود (61). آزادشدن پروتئینهای فاز حاد از کبد همراه با سایتوکینهای پیشبرنده التهابی تحریک میشود. به طور طبیعی، سطوح سایتوکینها پس از جمع شدن رحم و حذف آلودگی باکتریایی کاهش مییابد (62). بروز هر گونه اختلال در روند طبیعی دوره نفاس منجر به افزایش ترشح سایتوکینها میشود. عنوان شده که پروفایل سایتوکینها به شدت و پایداری التهاب در بافت اندومتر وابسته است (20,63,64). از طرفی درد ناشی از التهاب، دردی مزمن و طبیعی است که با آسیب بافتی و آزادشدن واسطههای التهابی از بافت آسیب دیده همراه است (65). شواهد بالینی زیادی وجود دارد که بیماریهای التهابی و عفونتها غالباً سبب ایجاد اختلال در سیستم تولیدمثلی جنس ماده میشوند (69-66). بهخوبی نشان داده شده که استرس ایمنی می تواند منجر به اختلالات تولیدمثلی همانند عدم تخمکگذاری و توقف قاعدگی شود (70). گزارش شده که IL-10 و IL-4 به عنوان سایتوکینهای مهم، نقشهای اساسیای در پاسخهای التهابی ایفا میکنند (32). TNF-α، IL-1β، IL-6، MCP-1 و IL-8 نقش مهمی در فرآیندهای فیزیولوژیک و پاتولوژیک سیستم تولیدمثلی ایفا میکنند (71,72). سایتوکینهای پیش برنده التهابی همانند IL-1α، IL-1β، TNF-α و IL-6 معمولاً در گاوهای مبتلا به اندومتریت افزایش مییابند (72,73). سایتوکین های پیشبرنده التهابی معمولاً در فلش رحمی گاو مبتلا به اندومتریت افزایش مییابند (20,73,74). علاوه بر این عنوان شده که در گاوهای مبتلا به اندومتریت تفاوت معناداری در میزان بیان ژن IL-10 مشاهده نشده است (63). واگرایی بین سطوح سایتوکینها در مطالعات مختلف ممکن است به دلیل تفاوت در گونههای حیوانی مختلف، زمان نمونهگیری و همچنین روش سنجش باشد. در موارد التهاب شدید، میزان TNF-α بیش از حد طبیعی است (57). افزایش بیان ژنهای سایتوکینهای خاص همانند IL-6، IL-8 و TNF-α میتوانند در تشخیص شدت و میزان (درجه) اندومتریت به کار گرفته شوند (75). IL-10 به عنوان نوعی سایتوکین ضد التهابی مهم در نظر گرفته میشود که نقشهای مهمی در کنترل پاسخهای التهابی ایفا میکند (76). IL-10 در حین آبستنی به عنوان یک مهارکننده ایمنی فعال مادری فعالیت میکند تا اجازه پذیرش آلوگرافت رویانی را به ارمغان آورد (77). شواهد حاکی از برهم کنش دوطرفه بین سیستم ایمنی و نورواندوکرینی با سایتوکینها است. سایتوکینها ممکن است روی نورونهای GnRH در هیپوتالاموس تأثیرگذار باشند و سنتز GnRH را مهار کنند (17). مطابق یافتههای بالینی زیر مجموعه نورون-های GnRH و فیبرهای آن میتوانند آثار مستقیم مولکولهای التهابی را حس کنند (78) که شامل فعالیت سایتوکینها در اندامهای دور از بطنهای مغزی است (81-79). علاوه بر این، ممکن است سایتوکینها در قادر به اصلاح عملکرد نورونهای GnRH به صورت مستقیم باشند. مطالعات نشان دادهاند که گیرندههایی همانند گیرندههای اینترلوکین، پروستاگلندین و TNF-α با پیشرفت پاسخ ایمنیهای ایمنی مرتبط هستند که به وفور در نورونهای GnRH موش سوری بیان می شوند (82). عنوان شده که بیان گیرنده سایتوکین پیشبرنده التهابی IL-18Rα و گیرنده سایتوکین ضد التهابی IL-18R در بخشی از نورونهای GnRH، شرایطی برای عملکرد مستقیم آن ها بر GnRH فراهم میآورند (83). IL-10 یکی از سایتوکین¬های ضد التهابی بسیار مهم است که پاسخ ایمنی در مغز را تعدیل میکند. مطالعات بالینی نشاندادهاند که IL-10 برای آبستنی طبیعی، باروری و لانهگزینی ضروری است (86-84)؛ در حالیکه کاهش IL-10 با از دست رفتن آبستنی، تولد زودرس یا فشارخون بالا در آبستنی (پرهاکلامپسی (Pre-eclampsia)) مرتبط است (77). نشان داده¬شده که فعالیت IL-10 بر نورونهای ترشحکننده GnRH ممکن است به حفظ تمامیت سیکل استروس در عفونتهای باکتریایی/ ویروسی کمک کند (83). عفونت¬های رحمی تحت عنوان پیامدی از آسیبهای وارده به مکانیسمهای دفاعی بافت رحمی شناخته میشوند که به وسیله تغییرات فیزیولوژیک ایجاد شده در دوره پس از زایش به¬وقوع می¬پیوندند. تغییر دیگری که در دوره پس از زایش رخ میدهد، افزایش تولید گونههای اکسیژن فعال است. عدم تعادل بین تولید گونههای اکسیژن فعال و پاک¬سازی آن منجر به ایجاد شرایط استرس اکسیداتیو میشود. نشان داده شده که ارتباط معناداری بین بیماریهای التهابی همانند اندومتریت و استرس اکسیداتیو وجود دارد (87,88). گونههای اکسیژن فعال در طول سنتز پروستاگلندینها تولید میشوند که افزایش تعداد لوکوسیتهای پلیمورفونوکلئار را در پی دارد. بروز تغییراتی در سنتز پروستاگلندینها در موارد مبتلا به اندومتریت سبب بروز اختلالاتی در تولید گونههای اکسیژن فعال میشود (89). بهخوبی شناختهشده که تغییراتی در جریان خون اندومتریوم در طول سیکل قاعدگی رخ میدهد (90) و تعداد چشمگیری از لوکوسیتها در بافت اندومتریوم زنان توزیع میشوند (91). رادیکالهای سوپراکسید در اندومتریوم زنان تشخیص داده شدهاند (92). نشان داده شده که آنزیم سوپراکسید دیس موتاز که یک پاککننده رادیکال آزاد اکسیژن است در اندومتریوم رحم وجود دارد و قبل و در هنگام لانهگزینی افزایش مییابد (93). علاوه بر این نشان داده شده که ژن آنزیم کاتالاز -که آب اکسیژنه را به آب و اکسیژن تجزیه میکند و نوعی آنزیم آنتی اکسیدانی به شمار میرود در زنان مبتلا به اندومتریت و آدنومیوزیس در مقایسه با گروه کنترل سالم بیشتر بیان میشود (94). رادیکال سوپراکسید و سیستم اسکونجر آن نقشی مهم در پرولیفراسیون و تمایز اندومتریوم ایفا میکنند (95). مدلهای حیوانی اندومتریت بالینی برای جلوگیری از بروز و درمان اندومتریت بسیار بااهمیت هستند و مدلهای حیوانی متعددی از اندومتریت همانند حیوانات اهلی و جوندگان از طریق انفوزیون اشریشاکلی با یا بدون دیگر باکتری¬ها داخل حفره رحم حاصل میشوند (100-96). رحم موش صحرایی دارای 2 شاخ است که هر شاخ به صورت کاملاً جداگانه به سرویکس میرسند. در اولین مدل، فقط در شاخ چپ رحم باکتری تلقیح میشود و شاخ راست به عنوان کنترل برای ارزیابی میزان اثربخشی دارو مدنظر قرار میگیرد. به محض ایجاد عفونت، پاسخ ایمنی اندومتریوم به پاتوژنها میتواند فعال شود که سبب آزادشدن سایتوکینها و کموکینها در سلولهای اندومتریال میشود که برای پاکسازی عفونت ضروری هستند. سایتوکینها یا ژنهای آنها در سرم، بافت رحم و فلش رحمی در حیوانات مبتلا به اندومتریت مشخص میشوند (63,75,101). بنابر مطالعه حاضر، با درک و فهم صحیح نحوه ایجاد و مکانیسمهای دخیل در بروز یک اختلال در بدن، میتوان به صورت دقیق سعی در درمان و رفع این مشکل نمود. بنابراین، در این مطالعه مروری تأکید اصلی نویسندگان بر طریقه و مکانیسم ایجاد اندومتریت، طریقه القای این بیماری در مدل موش صحرایی و تعیین مرحله سیکل استروس موش صحرایی حهت القای موفقیت آمیز اندومتریت در این مدل حیوانی بود. همچنین نویسندگان مقاله حاضر در قسمت بحث به نقش با اهمیت التهاب و استرس اکسیداتیو در ایجاد بیماری اندومتریت پرداختهاند.
نتیجه گیری
در ابتدا میتوان چنین عنوان نمود که اندومتریت نوعی اختلال التهابی در پوشش (آستر) آندومتریوم رحم در طول مرحله نفاس به شمار میرود. این بیماری عمدتاً به¬صورت تحت بالینی نمود پیدا میکند و از طریق ایجاد اختلال در تعادل هورمونی سبب ناباروری میشود. روش سایتولوژی واژینال بهعنوان یک نشانگر حساس در تعیین مرحله سیکل استروس در بسیاری از گونهها در نظر گرفته میشود که بازتابی از تعادل بین آثار استروژن و پروژسترون است. از سایتولوژی واژن در تشخیص مراحل مختلف سیکل استروس و تعیین شرایط غیر طبیعی سیستم تولیدمثلی قبل و بعد از زایمان استفاده میشود. این تغییرات بهوسیله درصد و انواع سلولهای موجود در اپیتلیوم واژن تعیین میشود که به سیکل تخمدانی و غلظتهای استروژن در سرم وابسته است؛ بنابراین سایتولوژی واژن همیشه انعکاسی از فعالیت استروژنیک در جنس ماده است. روش سایتولوژی واژن به عنوان استاندارد طلایی برای تعیین مرحله سیکل استروس در موشهای صحرایی ماده در نظر گرفته میشود. همچنین ارتباطی بین سطوح هورمونی تخمدانی و مرحله سیکل استروس وجود دارد که به وسیله سایتولوژی واژن مشخص میشود. در تشخیص پاتوژنز پرکتیکال عفونت رحمی در بسیاری از گونهها از روش سایتولوژی واژن استفاده میشود. سایتوکینهای متنوعی در انسان و حیوانات مبتلا به اندومتریت افزایش مییابند. هم چنین به خوبی شناخته شده که ارتباط معناداری بین استرس اکسیداتیو و بسیاری از بیماریهای التهابی همانند اندومتریت وجود دارد. سایتوکینهای متنوعی در انسان و حیوانات مبتلا به اندومتریت افزایش مییابند. افزایش بیان ژنهای سایتوکینهای خاص همانند IL-6، IL-8 و TNF-α میتوانند در تشخیص شدت و میزان (درجه) اندومتریت به کار گرفته شوند. تغییر دیگری که در دوره پس از زایش رخ میدهد، افزایش تولید گونههای اکسیژن فعال است. عدم تعادل بین تولید گونههای اکسیژن فعال و پاک سازی آن منجر به ایجاد شرایط استرس اکسیداتیو میشود و همچنین ارتباط معناداری بین بیماریهای التهابی همانند اندومتریت و استرس اکسیداتیو وجود دارد.
حامی مالی: ندارد.
تعارض منافع: وجود ندارد.
References:
1- LeBlanc S. Reproductive Tract Inflammatory Disease in Postpartum Dairy Cows. Animal 2014; 8(s1): 54-63.
2- LeBlanc S, Duffield T, Leslie K, Bateman K, Keefe GP, Walton J, et al. Defining and Diagnosing Postpartum Clinical Endometritis and its Impact on Reproductive Performance in Dairy Cows. Jounral of Dairy Science 2002; 85(9): 2223-36.
3- Jana B, Kucharski J, Dzienis A, Deptuła K. Changes in Prostaglandin Production and Ovarian Function in Gilts During Endometritis Induced by Escherichia Coli Infection. Anim Reproduction Science 2007; 97(1-2): 137-50.
4- Roberson J, Moll D, Saunders G. Chronic Staphylococcus Aureus Endometritis in a Virgin Gilt. Vet Rec 2007; 161(24): 821-2.
5- Nash D, Lane E, Herath S, Martin Sheldon I. Endometrial Explant Culture for Characterizing Equine Endometritis. Am J Reprod Immunol 2008; 59(2): 105-17.
6- Mari G, Iacono E, Toni F, Predieri P, Merlo B. Evaluation of the Effectiveness of Intrauterine Treatment with Formosulphathiazole of Clinical Endometritis in Postpartum Dairy Cows. Theriogenology 2012; 78(1): 189-200.
7- Adnane M, Kaidi R, Hanzen C, England GC. Risk Factors of Clinical and Subclinical Endometritis in Cattle: A Review.Turkish Journal of Veterinary and Animal Sciences 2017; 41(1): 1-1.
8- Salah N, Yimer N. Cytological Endometritis and its Agreement with Ultrasound Examination in Postpartum Beef Cows. Vet World 2017; 10(6): 605-9.
9- Lin Z, Xu J, Jin X, Zhang X, Ge F. Modulation of Expression of Toll‐Like Receptors in the Human Endometrium. American Journal of Reproductive Immunology 2009; 61(5): 338-45.
10- Khan KN, Kitajima M, Fujishita A, Nakashima M, Masuzaki H. Toll‐Like Receptor System and Endometriosis. Journal of Obstetrics and Gynaecology Research 2013; 39(8): 1281-92.
11- Li J-Y, Liu Y, Gao X-X, Gao X, Cai H. TLR2 and TLR4 Signaling Pathways are Required for Recombinant Brucella Abortus BCSP31-Induced Cytokine Production, Functional Upregulation of Mouse Macrophages, and the Th1 Immune Response in Vivo and in Vitro. Cell Mol Immunol 2014; 11(5): 477-94.
12- Fumuso E, Giguère S, Wade J, Rogan D, Videla-Dorna I, Bowden RA. Endometrial IL-1β, IL-6 and TNF-Α, Mrna Expression in Mares Resistant or Susceptible to Post-Breeding Endometritis: Effects of Estrous Cycle, Artificial Insemination and Immunomodulation. Vet Immunol Immunopathol 2003; 96(1-2): 31-41.
13- Dimitriadis E, White CA, Jones RL, Salamonsen LA. Cytokines, Chemokines and Growth Factors in Endometrium Related to Implantation. Hum Reprod Update 2005; 11(6): 613-30.
14- Brodzki P, Kostro K, Krakowski L, Marczuk J. Inflammatory Cytokine and Acute Phase Protein Concentrations in the Peripheral Blood and Uterine Washings of Cows With Subclinical Endometritis in the Late Postpartum Period. Vet Res Commun 2015; 39(2): 143-9.
15- Salilew-Wondim D, Ibrahim S, Gebremedhn S, Tesfaye D, Heppelmann M, Bollwein H, et al. Clinical and Subclinical Endometritis Induced Alterations in Bovine Endometrial Transcriptome and Mirnome Profile. BMC Genomics 2016; 17: 218.
16- Ishikawa Y, Nakada K, Hagiwara K, Kirisawa R, Iwai H, Moriyoshi M, et al. Changes in Interleukin-6 Concentration in Peripheral Blood of Pre-And Post-Partum Dairy Cattle and its Relationship to Postpartum Reproductive Diseases. J Vet Med Sci 2004; 66(11): 1403-8.
17- Wu S, Wolfe A. Signaling of Cytokines is Important in Regulation of Gnrh Neurons. Mol Neurobiol 2012; 45(1): 119-25.
18- Fatima G, Sharma VP, Das SK, Mahdi AA. Oxidative Stress and Antioxidative Parameters in Patients with Spinal Cord Injury: Implications in the Pathogenesis of Disease. Spinal cord 2015; 53(1): 3-6.
19- Roberts RA, Laskin DL, Smith CV, Robertson FM, Allen EM, Doorn JA, et al. Nitrative and Oxidative Stress in Toxicology and Disease. Toxicol Sci 2009; 112(1): 4-16.
20- Vickers NJ. Animal Communication: When I’m Calling You, Will You Answer Too?. Curr Biol 2017; 27(14): R713-R5.
21- Nayki C, Nayki U, Gunay M, Kulhan M, Çankaya M, Kafa AHT, et al. Oxidative and Antioxidative Status in the Endometrium of Patients with Benign Gynecological Disorders. J Gynecol Obstet Hum Reprod 2017; 46(3): 243-7.
22- Turk R, Koledić M, Maćešić N, Benić M, Dobranić V, Đuričić D, et al. The Role of Oxidative Stress and Inflammatory Response in the Pathogenesis of Mastitis in Dairy Cows. Mljekarstvo 2017; 67(2): 91-101.
23- Sánchez A, Calpena AC, Clares B. Evaluating the Oxidative Stress in Inflammation: Role of Melatonin. Int J Mol Sci 2015; 16(8): 16981-17004.
24- Reinwald S, Burr D. Review of Nonprimate, Large Animal Models for Osteoporosis Research. J Bone Miner Res 2008; 23(9): 1353-68.
25- Pellegrini G, Seol YJ, Gruber R, Giannobile WV. Pre-Clinical Models for Oral and Periodontal Reconstructive Therapies. J Dent Res 2009; 88(12): 1065-76.
26- Barzegar-Bafrouei A, Javdani M. Importance and Surgical Methods of Induction of Endometriosis and Osteoporosis Following Menopause in Rats: An Overview Study. SSU_Journals 2022; 30(5): 4793-812.
27- Liebschner MAK. Biomechanical Considerations of Animal Models Used in Tissue Engineering of Bone. Biomaterials 2004; 25(9): 1697-714.
28- Cacciafesta V, Dalstra M, Bosch C, Melsen B, Andreassen TT. Growth Hormone Treatment Promotes Guided Bone Regeneration in Rat Calvarial Defects. Eur J Orthod 2001; 23(6): 733-40.
29- Gomes PS, Fernandes MH. Rodent Models in Bone-Related Research: the Relevance of Calvarial Defects in the Assessment of Bone Regeneration Strategies. Lab Anim 2011; 45(1): 14-24.
30- Goldman JM, Murr AS, Cooper RL. The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies. Birth Defects Res B Dev Reprod Toxicol 2007; 80(2): 84-97.
31- Cora MC, Kooistra L, Travlos G. Vaginal Cytology of the Laboratory Rat and Mouse: Review and Criteria for the Staging of the Estrous Cycle Using Stained Vaginal Smears. Toxicol Pathol 2015; 43(6): 776-93.
32- Xu D, Xiong H, Xiao Z, He J, Liao Q, Xue L, et al. Uterine Cytokine Profile in a Rat Model of Endometritis. Am J Reprod Immunol 2015; 73(3): 214-20.
33- Javdani M, Ghorbani R, Hashemnia M. Histopathological Evaluation of Spinal Cord with Experimental Traumatic Injury Following Implantation of a Controlled Released Drug Delivery System of Chitosan Hydrogel Loaded With Selenium Nanoparticle. Biol Trace Elem Res 2021; 199(7): 2677-86.
34- Hughes VM, Stevenson K, Sharp JM. Improved Preparation of High Molecular Weight DNA for Pulsed-Field Gel Electrophoresis From Mycobacteria. Jounral of Microbiol Methods 2001; 44(3): 209-15.
35- Khare S, Ficht TA, Santos RL, Romano J, Ficht AR, Zhang S, et al. Rapid and Sensitive Detection of Mycobacterium Avium Subsp. Paratuberculosis in Bovine Milk and Feces by a Combination of Immunomagnetic Bead Separation-Conventional PCR and Real-Time PCR. J Clin Microbiol 2004; 42(3): 1075-81.
36- Khosravian P, Javdani M, Noorbakhnia R, Moghtadaei-Khorasgani E, Barzegar A. Preparation and Evaluation of Chitosan Skin Patches Containing Mesoporous Silica Nanoparticles Loaded by Doxycycline on Skin Wound Healing. Arch Dermatol Res 2022.
37- Mikamo H, Kawazoe K, Sato Y, Izumi K, Tamaya T. Therapeutic Effects of a New Quinolone, DU-6859a, on Polymicrobial Infections in a Newly Designed Model of Rat Uterine Endometritis. J Antimicrob Chemother 1998; 41(1): 131-3.
38- Demirel MA, Han S, Tokmak A, Ercan Gokay N, Uludag MO, Yildirir Ustun T, et al. Therapeutic Effects of Resveratrol in Escherichia Coli-Induced Rat Endometritis Model. Naunyn Schmiedebergs Arch Pharmacol 2019; 392(12): 1577-89.
39- Byers SL, Wiles MV, Dunn SL, Taft RA. Mouse Estrous Cycle Identification Tool and Images. PloS one 2012; 7(4): e35538.
40- Grasso P, Rozhavskaya M, Reichert Jr LE. In Vivo Effects of Human Follicle-Stimulating Hormone-Related Synthetic Peptide Hfsh-, Β-(81–95) and its Subdomain Hfsh-Β-(90–95) on the Mouse Estrous Cycle. Biol Reprod 1998; 58(3): 821-5.
41- Mandl AM. The Phases of the Oestrous Cycle in the Adult White Rat. J Exp Biol 1951; 28(4): 576-84.
42- Ajayi AF, Akhigbe RE. Staging of the estrous cycle and induction of estrus in experimental rodents: an update. Fertil Res and Pract 2020; 6(5): 1-15.
43- Hubscher CH, Brooks DL, Johnson JR. A Quantitative Method for Assessing Stages of the Rat Estrous Cycle. Biotechnic and Histochemstry 2005; 80(2): 79-87.
44- Mishra K, Wadhwa N, Guleria K, Agarwal S. ER, PR and Ki‐67 Expression Status in Granulomatous and Chronic Non‐Specific Endometritis. J Obstet Gynaecol Res 2008; 34(3): 371-8.
45- Cicinelli E, Tinelli R, Lepera A, Pinto V, Fucci M, Resta L. Correspondence Between Hysteroscopic and Histologic Findings in Women with Chronic Endometritis. Acta Obstet Gynecol Scand 2010; 89(8): 1061-5.
46- Maybin JA, Critchley HO, Jabbour HN. Inflammatory Pathways in Endometrial Disorders. Mol Cell Endocrinol 2011; 335(1): 42-51.
47- Kitaya K, Yasuo T. Immunohistochemistrical and Clinicopathological Characterization of Chronic Endometritis. Am J Reprod Immunol 2011; 66(5): 410-5.
48- Gilmore H, Fleischhacker D, Hecht JL. Diagnosis of Chronic Endometritis in Biopsies with Stromal Breakdown. Hum Pathol 2007; 38(4): 581-4.
49- Mirkin S, Arslan M, Churikov D, Corica A, Diaz JI, Williams S, et al. In Search of Candidate Genes Critically Expressed in the Human Endometrium During the Window of Implantation. Hum Reprod 2005; 20(8): 2104-17.
50- Boomsma CM, Kavelaars A, Eijkemans MJ, Lentjes EG, Fauser BC, Heijnen CJ, et al. Endometrial Secretion Analysis Identifies a Cytokine Profile Predictive of Pregnancy in IVF. Hum Reprod 2009; 24(6): 1427-35.
51- Javdani M, Barzegar-Bafrouei A. Systemic Inflammatory Response Syndrome Due to Surgery and its Effective Therapeutic Approaches. SSU_Journals 2020; 28(5): 2614-34.
52- Von Rango U, Alfer J, Kertschanska S, Kemp B, Müller-Newen G, Heinrich P, et al. Interleukin-11 Expression: Its Significance in Eutopic and Ectopic Human Implantation. Molecular Human Reproduction 2004; 10(11): 783-92.
53- Dimitriadis E, Robb L, Liu YX, Enders AC, Martin H, Stoikos C, et al. IL-11 and IL-11Rα Immunolocalisation at Primate Implantation Sites Supports a Role for IL-11 in Placentation and Fetal Development. Reproductive Biology and Endocrinology 2003; 1: 1-10.
54- Guzeloglu-Kayisli O, Kayisli UA, Taylor HS, editors. The Role of Growth Factors and Cytokines During Implantation: Endocrine and Paracrine Interactions. InSeminars in reproductive medicine 2009; 27(1): 62-79.
55- Kitaya K, Nakayama T, Okubo T, Kuroboshi H, Fushiki S, Honjo H. Expression of Macrophage Inflammatory Protein-1β in Human Endometrium: Its Role in Endometrial Recruitment of Natural Killer Cells. The Journal of Clinical Endocrinology & Metabolism 2003; 88(4): 1809-14.
56- Fowler DJ, Nicolaides KH, Miell JP. Insulin-Like Growth Factor Binding Protein-1 (IGFBP-1): A Multifunctional Role in the Human Female Reproductive Tract. Hum Reprod Update 2000; 6(5): 495-504.
57- Javdani M, Barzegar A, Khosravian P, Hashemnia M. Evaluation of Inflammatory Response Due to Use of Controlled Release Drug Delivery System of Chitosan Hydrogel Loaded with Buprenorphine and Ketorolac in Rat with Experimental Proximal Tibial Epiphysis Defect. J Investig Surg 2022; 35(5): 996-1011.
58- Javdani M, Barzegar-Bafrouei A. The Key Role of Macrophages and Monocytes in Spinal Cord Injury: Development of Novel Therapeutic Approaches. Shefaye Khatam 2020; 8(4): 90-102.[persian]
59- Javdani M, Barzegar A. Application of Chitosan Hydrogels in Traumatic Spinal Cord Injury; A Therapeutic Approach Based on the Anti-Inflammatory and Antioxidant Properties of Selenium Nanoparticles. Frontiers in Biomedical Technologies 2023; 10(3).
60- Javdani M, Nafar M, Mohebi A, Khosravian P, Barzegar A. Evaluation of Leukocyte Response Due to Implant of a Controlled Released Drug Delivery System of Chitosan Hydrogel Loaded with Selenium Nanoparticle in Rats with Experimental Spinal Cord Injury. Tabari Biomed Stu Res J 2022; 4(2): 1-16.[persian]
61- Baumann H, Gauldie J. The Acute Phase Response. Immunol Today 1994; 15(2): 74-80.
62- Balogh O, Bruckmaier R, Keller S, Reichler IM. Effect of Maternal Metabolism on Fetal Supply: Glucose, Non-Esterified Fatty Acids and Beta-Hydroxybutyrate Concentrations in Canine Maternal Serum and Fetal Fluids at Term Pregnancy. Anim Reprod Sci 2018; 193: 209-16.
63- Galvão KN, Santos NR, Galvão JS, Gilbert RO. Association Between Endometritis and Endometrial Cytokine Expression in Postpartum Holstein Cows. Theriogenology 2011; 76(2): 290-9.
64- Boby J, Kumar H, Gupta HP, Jan MH, Singh SK, Patra MK, et al. Endometritis Increases Pro-Inflammatory Cytokines in Follicular Fluid and Cervico-Vaginal Mucus in the Buffalo Cow. Anim Biotechnol 2017; 28(3): 163-7.
65- Barzegar-Bafrouei A, Javdani M. A Review of the Occurrence and Mechanisms of Induction of Osteoporosis Following Spinal Cord Injury. SSU_Journals 2021; 29(1): 3355-74. [Persian]
66- Li LX, McSorley SJ. A Re-Evaluation of the Role of B Cells in Protective Immunity to Chlamydia Infection. Immunol Lett 2015; 164(2): 88-93.
67- Qian L, Li Q, Li H. Effect of Hepatitis B Virus Infection on Sperm Quality and Oxidative Stress State of the Semen of Infertile Males. Am J Reprod Immunol 2016; 76(3): 183-5.
68- Malvezzi H, Hernandes C, Piccinato CA, Podgaec S. Interleukin in Endometriosis-Associated Infertility-Pelvic Pain: Systematic Review and Meta-Analysis. Reproduction 2019; 158(1): 1-12.
69- Syriou V, Papanikolaou D, Kozyraki A, Goulis DG. Cytokines and Male Infertility. Eur Cytokine Netw 2018; 29(3): 73-82.
70- Pauli SA, Berga SL. Athletic Amenorrhea: Energy Deficit or Psychogenic Challenge?. Ann N Y Acad Sci 2010; 1205(1): 33-8.
71- Jana B, Kucharski J, Jedlińska-Krakowska M, Wolińska-Witort E. The Effect of Intrauterine Infusion of Inflammation-Provoking Factors on Proinflammatory Cytokines and Hormones in Rat Peripheral Blood. Pol J Vet Sci 2005; 8(4): 275-82.
72- Gabler C, Drillich M, Fischer C, Holder C, Heuwieser W, Einspanier R. Endometrial Expression of Selected Transcripts Involved in Prostaglandin Synthesis in Cows with Endometritis. Theriogenology 2009; 71(6): 993-1004.
73- Fischer C, Drillich M, Odau S, Heuwieser W, Einspanier R, Gabler C. Selected Pro-Inflammatory Factor Transcripts in Bovine Endometrial Epithelial Cells are Regulated During the Oestrous Cycle and Elevated in Case of Subclinical or Clinical Endometritis. Reprod Fertil Dev 2010; 22(5): 818-29.
74- Tibary A, Fite C, Anouassi A, Sghiri A. Infectious Causes of Reproductive Loss in Camelids. Theriogenology 2006; 66(3): 633-47.
75- Loyi T, Kumar H, Nandi S, Mathapati BS, Patra M, Pattnaik B. Differential Expression of Pro-Inflammatory Cytokines in Endometrial Tissue of Buffaloes with Clinical and Sub-Clinical Endometritis. Res Vet Sci 2013; 94(2): 336-40.
76- MacKenzie KF, Pattison MJ, Arthur JSC. Transcriptional Regulation of IL-10 and its Cell-Specific Role in Vivo. Crit Rev Immunol 2014; 34(4): 315-45.
77- Thaxton JE, Sharma S. Interleukin‐10: a Multi‐Faceted Agent of Pregnancy. Am J Reprod Immunol 2010; 63(6): 482-91.
78- Herde MK, Geist K, Campbell RE, Herbison AE. Gonadotropin-Releasing Hormone Neurons Extend Complex Highly Branched Dendritic Trees Outside the Blood-Brain Barrier. Endocrinol 2011; 152(10): 3832-41.
79- Damm J, Luheshi GN, Gerstberger R, Roth J, Rummel C. Spatiotemporal Nuclear Factor Interleukin‐6 Expression in the Rat Brain During Lipopolysaccharide‐Induced Fever is Linked to Sustained Hypothalamic Inflammatory Target Gene Induction. J Comp Neurol 2011; 519(3): 480-505.
80- LeBel Er, Vallières L, Rivest S. Selective Involvement of Interleukin-6 in the Transcriptional Activation of the Suppressor of Cytokine Signaling-3 in the Brain During Systemic Immune Challenges. Endocrinol 2000; 141(10): 3749-63.
81- Ott D, Murgott J, Rafalzik S, Wuchert F, Schmalenbeck B, Roth J, et al. Neurons and Glial Cells of the Rat Organum Vasculosum Laminae Terminalis Directly Respond to Lipopolysaccharide and Pyrogenic Cytokines. Brain Res 2010; 1363: 93-106.
82- Jasoni CL, Todman MG, Han SK, Herbison AE. Expression of Mrnas Encoding Receptors that Mediate Stress Signals in Gonadotropin-Releasing Hormone Neurons of the Mouse. Neuroendocrinology 2005; 82(5-6): 320-8.
83- Barabás K, Barad Z, Dénes Á, Bhattarai JP, Han S-K, Kiss E, et al. The Role of Interleukin-10 in Mediating the Effect of Immune Challenge on Mouse Gonadotropin-Releasing Hormone Neurons in Vivo. eNeuro 2018; 5(5): ENEURO.
84- Wegmann TG, Lin H, Guilbert L, Mosmann TR. Bidirectional Cytokine Interactions in the Maternal-Fetal Relationship: is Successful Pregnancy a TH2 Phenomenon?. Immunol Today 1993; 14(7): 353-6.
85- Van Dunné FM, de Craen AJ, Helmerhorst FM, Huizinga TW, Westendorp RG. Interleukin-10 Promoter Polymorphisms in Male and Female Fertility and Fecundity. Genes Immun 2006; 7(8): 688-92.
86- Cheng SB, Sharma S. Interleukin‐10: a Pleiotropic Regulator in Pregnancy. Am J Reprod.Immunol 2015; 73(6): 487-500.
87- Lugrin J, Rosenblatt VN, Parapanov R, Liaudet L. The Role of Oxidative Stress during Inflammatory Processes. Biological chemistry 2014; 395(2): 203-30.
88- Hussain T, Tan B, Yin Y, Blachier F, Tossou MC, Rahu N. Oxidative Stress and Inflammation: what Polyphenols Can Do for Us?. Oxid Med Cell Longev 2016; 2016: 7432797.
89- Galvao KN, Santos JEP. Recent Advances in the Immunology and Uterine Microbiology of Healthy Cows and Cows that Develop Uterine Disease. Turkish Journal of Veterinary and Animal Sciences 2014; 38(6): 577-88.
90- Economos K, MacDonald PC, Casey ML. Endothelin-1 Gene Expression and Protein Biosynthesis in Human Endometrium: Potential Modulator of Endometrial Blood Flow. The Journal of Clinical Endocrinology & Metabolism 1992; 74(1): 14-9.
91- Klentzeris LD, Bulmer JN, Warren A, Morrison L, Li T-C, Cooke ID. Endometrial Lymphoid Tissue in the Timed Endometrial Biopsy: Morphometric and Immunohistochemical Aspects. Am J Obstet Gynecol 1992; 167(3): 667-74.
92- Benedetto C, Bocci A, Dianzani MU, Ghiringhello B, Slater TF, Tomasi A, et al. Electron Spin Resonance Studies on Normal Human Uterus and Cervix and on Benign and Malignant Uterine Tumors. Cancer Res 1981; 41(7): 2936-42.
93- Narimoto K, Noda Y, Shiotani M, Tokura T, Goto Y, Takakura K, et al. Immunohistochemical Assessment of Superoxide Dismutase Expression in the Human Endometrium throughout the Menstrual Cycle. Acta Histochem Cytochem 1990; 23(4): 487-98.
94- Ota H, Igarashi S, Sato N, Tanaka H, Tanaka T. Involvement of Catalase in the Endometrium of Patients with Endometriosis and Adenomyosis. Fertil Steril 2002; 78(4): 804-9.
95- Sugino N, Shimamura K, Takiguchi S, Tamura H, Ono M, Nakata M, et al. Changes in Activity of Superoxide Dismutase in the Human Endometrium throughout the Menstrual Cycle and in Early Pregnancy. Hum Reprod 1996; 11(5): 1073-8.
96- Amos MR, Healey GD, Goldstone RJ, Mahan SM, Düvel A, Schuberth H-J, et al. Differential Endometrial Cell Sensitivity to a Cholesterol-Dependent Cytolysin Links Trueperella Pyogenes to Uterine Disease in Cattle. Biol Reprod 2014; 90(3): 1-13.
97- Zerbe H, Schuberth H-J, Engelke F, Frank J, Klug E, Leibold W. Development and Comparison of in Vivo and in Vitro Models for Endometritis in Cows and Mares. Theriogenology 2003; 60(2): 209-23.
98- HINRICHS K, Spensley M, McDonough PL. Evaluation of Progesterone Treatment to Create a Model for Equine Endometritis. Equine Vet J 1992; 24(6): 457-61.
99- Mikamo H, Kawazoe K, Sato Y, Tamaya T. Therapeutic Effects of on Injectable New Quinolone, Pazufloxacin, Against Polymicrobial Infections in the Uterine Endometritis Model. Chemotherapy 1998; 44(2): 99-102.
100- Sheldon IM, Rycroft AN, Dogan B, Craven M, Bromfield JJ, Chandler A, et al. Specific Strains of Escherichia Coli are Pathogenic for the Endometrium of Cattle and Cause Pelvic Inflammatory Disease in Cattle and Mice. PloS one 2010; 5(2): e9192.
101- Kim I-H, Kang H-G, Jeong J-K, Hur T-Y, Jung Y-H. Inflammatory Cytokine Concentrations in Uterine Flush and Serum Samples from Dairy Cows with Clinical or Subclinical Endometritis. Theriogenology 2014; 82(3): 427-32.
1- LeBlanc S. Reproductive Tract Inflammatory Disease in Postpartum Dairy Cows. Animal 2014; 8(s1): 54-63.
2- LeBlanc S, Duffield T, Leslie K, Bateman K, Keefe GP, Walton J, et al. Defining and Diagnosing Postpartum Clinical Endometritis and its Impact on Reproductive Performance in Dairy Cows. Jounral of Dairy Science 2002; 85(9): 2223-36.
3- Jana B, Kucharski J, Dzienis A, Deptuła K. Changes in Prostaglandin Production and Ovarian Function in Gilts During Endometritis Induced by Escherichia Coli Infection. Anim Reproduction Science 2007; 97(1-2): 137-50.
4- Roberson J, Moll D, Saunders G. Chronic Staphylococcus Aureus Endometritis in a Virgin Gilt. Vet Rec 2007; 161(24): 821-2.
5- Nash D, Lane E, Herath S, Martin Sheldon I. Endometrial Explant Culture for Characterizing Equine Endometritis. Am J Reprod Immunol 2008; 59(2): 105-17.
6- Mari G, Iacono E, Toni F, Predieri P, Merlo B. Evaluation of the Effectiveness of Intrauterine Treatment with Formosulphathiazole of Clinical Endometritis in Postpartum Dairy Cows. Theriogenology 2012; 78(1): 189-200.
7- Adnane M, Kaidi R, Hanzen C, England GC. Risk Factors of Clinical and Subclinical Endometritis in Cattle: A Review.Turkish Journal of Veterinary and Animal Sciences 2017; 41(1): 1-1.
8- Salah N, Yimer N. Cytological Endometritis and its Agreement with Ultrasound Examination in Postpartum Beef Cows. Vet World 2017; 10(6): 605-9.
9- Lin Z, Xu J, Jin X, Zhang X, Ge F. Modulation of Expression of Toll‐Like Receptors in the Human Endometrium. American Journal of Reproductive Immunology 2009; 61(5): 338-45.
10- Khan KN, Kitajima M, Fujishita A, Nakashima M, Masuzaki H. Toll‐Like Receptor System and Endometriosis. Journal of Obstetrics and Gynaecology Research 2013; 39(8): 1281-92.
11- Li J-Y, Liu Y, Gao X-X, Gao X, Cai H. TLR2 and TLR4 Signaling Pathways are Required for Recombinant Brucella Abortus BCSP31-Induced Cytokine Production, Functional Upregulation of Mouse Macrophages, and the Th1 Immune Response in Vivo and in Vitro. Cell Mol Immunol 2014; 11(5): 477-94.
12- Fumuso E, Giguère S, Wade J, Rogan D, Videla-Dorna I, Bowden RA. Endometrial IL-1β, IL-6 and TNF-Α, Mrna Expression in Mares Resistant or Susceptible to Post-Breeding Endometritis: Effects of Estrous Cycle, Artificial Insemination and Immunomodulation. Vet Immunol Immunopathol 2003; 96(1-2): 31-41.
13- Dimitriadis E, White CA, Jones RL, Salamonsen LA. Cytokines, Chemokines and Growth Factors in Endometrium Related to Implantation. Hum Reprod Update 2005; 11(6): 613-30.
14- Brodzki P, Kostro K, Krakowski L, Marczuk J. Inflammatory Cytokine and Acute Phase Protein Concentrations in the Peripheral Blood and Uterine Washings of Cows With Subclinical Endometritis in the Late Postpartum Period. Vet Res Commun 2015; 39(2): 143-9.
15- Salilew-Wondim D, Ibrahim S, Gebremedhn S, Tesfaye D, Heppelmann M, Bollwein H, et al. Clinical and Subclinical Endometritis Induced Alterations in Bovine Endometrial Transcriptome and Mirnome Profile. BMC Genomics 2016; 17: 218.
16- Ishikawa Y, Nakada K, Hagiwara K, Kirisawa R, Iwai H, Moriyoshi M, et al. Changes in Interleukin-6 Concentration in Peripheral Blood of Pre-And Post-Partum Dairy Cattle and its Relationship to Postpartum Reproductive Diseases. J Vet Med Sci 2004; 66(11): 1403-8.
17- Wu S, Wolfe A. Signaling of Cytokines is Important in Regulation of Gnrh Neurons. Mol Neurobiol 2012; 45(1): 119-25.
18- Fatima G, Sharma VP, Das SK, Mahdi AA. Oxidative Stress and Antioxidative Parameters in Patients with Spinal Cord Injury: Implications in the Pathogenesis of Disease. Spinal cord 2015; 53(1): 3-6.
19- Roberts RA, Laskin DL, Smith CV, Robertson FM, Allen EM, Doorn JA, et al. Nitrative and Oxidative Stress in Toxicology and Disease. Toxicol Sci 2009; 112(1): 4-16.
20- Vickers NJ. Animal Communication: When I’m Calling You, Will You Answer Too?. Curr Biol 2017; 27(14): R713-R5.
21- Nayki C, Nayki U, Gunay M, Kulhan M, Çankaya M, Kafa AHT, et al. Oxidative and Antioxidative Status in the Endometrium of Patients with Benign Gynecological Disorders. J Gynecol Obstet Hum Reprod 2017; 46(3): 243-7.
22- Turk R, Koledić M, Maćešić N, Benić M, Dobranić V, Đuričić D, et al. The Role of Oxidative Stress and Inflammatory Response in the Pathogenesis of Mastitis in Dairy Cows. Mljekarstvo 2017; 67(2): 91-101.
23- Sánchez A, Calpena AC, Clares B. Evaluating the Oxidative Stress in Inflammation: Role of Melatonin. Int J Mol Sci 2015; 16(8): 16981-17004.
24- Reinwald S, Burr D. Review of Nonprimate, Large Animal Models for Osteoporosis Research. J Bone Miner Res 2008; 23(9): 1353-68.
25- Pellegrini G, Seol YJ, Gruber R, Giannobile WV. Pre-Clinical Models for Oral and Periodontal Reconstructive Therapies. J Dent Res 2009; 88(12): 1065-76.
26- Barzegar-Bafrouei A, Javdani M. Importance and Surgical Methods of Induction of Endometriosis and Osteoporosis Following Menopause in Rats: An Overview Study. SSU_Journals 2022; 30(5): 4793-812.
27- Liebschner MAK. Biomechanical Considerations of Animal Models Used in Tissue Engineering of Bone. Biomaterials 2004; 25(9): 1697-714.
28- Cacciafesta V, Dalstra M, Bosch C, Melsen B, Andreassen TT. Growth Hormone Treatment Promotes Guided Bone Regeneration in Rat Calvarial Defects. Eur J Orthod 2001; 23(6): 733-40.
29- Gomes PS, Fernandes MH. Rodent Models in Bone-Related Research: the Relevance of Calvarial Defects in the Assessment of Bone Regeneration Strategies. Lab Anim 2011; 45(1): 14-24.
30- Goldman JM, Murr AS, Cooper RL. The Rodent Estrous Cycle: Characterization of Vaginal Cytology and its Utility in Toxicological Studies. Birth Defects Res B Dev Reprod Toxicol 2007; 80(2): 84-97.
31- Cora MC, Kooistra L, Travlos G. Vaginal Cytology of the Laboratory Rat and Mouse: Review and Criteria for the Staging of the Estrous Cycle Using Stained Vaginal Smears. Toxicol Pathol 2015; 43(6): 776-93.
32- Xu D, Xiong H, Xiao Z, He J, Liao Q, Xue L, et al. Uterine Cytokine Profile in a Rat Model of Endometritis. Am J Reprod Immunol 2015; 73(3): 214-20.
33- Javdani M, Ghorbani R, Hashemnia M. Histopathological Evaluation of Spinal Cord with Experimental Traumatic Injury Following Implantation of a Controlled Released Drug Delivery System of Chitosan Hydrogel Loaded With Selenium Nanoparticle. Biol Trace Elem Res 2021; 199(7): 2677-86.
34- Hughes VM, Stevenson K, Sharp JM. Improved Preparation of High Molecular Weight DNA for Pulsed-Field Gel Electrophoresis From Mycobacteria. Jounral of Microbiol Methods 2001; 44(3): 209-15.
35- Khare S, Ficht TA, Santos RL, Romano J, Ficht AR, Zhang S, et al. Rapid and Sensitive Detection of Mycobacterium Avium Subsp. Paratuberculosis in Bovine Milk and Feces by a Combination of Immunomagnetic Bead Separation-Conventional PCR and Real-Time PCR. J Clin Microbiol 2004; 42(3): 1075-81.
36- Khosravian P, Javdani M, Noorbakhnia R, Moghtadaei-Khorasgani E, Barzegar A. Preparation and Evaluation of Chitosan Skin Patches Containing Mesoporous Silica Nanoparticles Loaded by Doxycycline on Skin Wound Healing. Arch Dermatol Res 2022.
37- Mikamo H, Kawazoe K, Sato Y, Izumi K, Tamaya T. Therapeutic Effects of a New Quinolone, DU-6859a, on Polymicrobial Infections in a Newly Designed Model of Rat Uterine Endometritis. J Antimicrob Chemother 1998; 41(1): 131-3.
38- Demirel MA, Han S, Tokmak A, Ercan Gokay N, Uludag MO, Yildirir Ustun T, et al. Therapeutic Effects of Resveratrol in Escherichia Coli-Induced Rat Endometritis Model. Naunyn Schmiedebergs Arch Pharmacol 2019; 392(12): 1577-89.
39- Byers SL, Wiles MV, Dunn SL, Taft RA. Mouse Estrous Cycle Identification Tool and Images. PloS one 2012; 7(4): e35538.
40- Grasso P, Rozhavskaya M, Reichert Jr LE. In Vivo Effects of Human Follicle-Stimulating Hormone-Related Synthetic Peptide Hfsh-, Β-(81–95) and its Subdomain Hfsh-Β-(90–95) on the Mouse Estrous Cycle. Biol Reprod 1998; 58(3): 821-5.
41- Mandl AM. The Phases of the Oestrous Cycle in the Adult White Rat. J Exp Biol 1951; 28(4): 576-84.
42- Ajayi AF, Akhigbe RE. Staging of the estrous cycle and induction of estrus in experimental rodents: an update. Fertil Res and Pract 2020; 6(5): 1-15.
43- Hubscher CH, Brooks DL, Johnson JR. A Quantitative Method for Assessing Stages of the Rat Estrous Cycle. Biotechnic and Histochemstry 2005; 80(2): 79-87.
44- Mishra K, Wadhwa N, Guleria K, Agarwal S. ER, PR and Ki‐67 Expression Status in Granulomatous and Chronic Non‐Specific Endometritis. J Obstet Gynaecol Res 2008; 34(3): 371-8.
45- Cicinelli E, Tinelli R, Lepera A, Pinto V, Fucci M, Resta L. Correspondence Between Hysteroscopic and Histologic Findings in Women with Chronic Endometritis. Acta Obstet Gynecol Scand 2010; 89(8): 1061-5.
46- Maybin JA, Critchley HO, Jabbour HN. Inflammatory Pathways in Endometrial Disorders. Mol Cell Endocrinol 2011; 335(1): 42-51.
47- Kitaya K, Yasuo T. Immunohistochemistrical and Clinicopathological Characterization of Chronic Endometritis. Am J Reprod Immunol 2011; 66(5): 410-5.
48- Gilmore H, Fleischhacker D, Hecht JL. Diagnosis of Chronic Endometritis in Biopsies with Stromal Breakdown. Hum Pathol 2007; 38(4): 581-4.
49- Mirkin S, Arslan M, Churikov D, Corica A, Diaz JI, Williams S, et al. In Search of Candidate Genes Critically Expressed in the Human Endometrium During the Window of Implantation. Hum Reprod 2005; 20(8): 2104-17.
50- Boomsma CM, Kavelaars A, Eijkemans MJ, Lentjes EG, Fauser BC, Heijnen CJ, et al. Endometrial Secretion Analysis Identifies a Cytokine Profile Predictive of Pregnancy in IVF. Hum Reprod 2009; 24(6): 1427-35.
51- Javdani M, Barzegar-Bafrouei A. Systemic Inflammatory Response Syndrome Due to Surgery and its Effective Therapeutic Approaches. SSU_Journals 2020; 28(5): 2614-34.
52- Von Rango U, Alfer J, Kertschanska S, Kemp B, Müller-Newen G, Heinrich P, et al. Interleukin-11 Expression: Its Significance in Eutopic and Ectopic Human Implantation. Molecular Human Reproduction 2004; 10(11): 783-92.
53- Dimitriadis E, Robb L, Liu YX, Enders AC, Martin H, Stoikos C, et al. IL-11 and IL-11Rα Immunolocalisation at Primate Implantation Sites Supports a Role for IL-11 in Placentation and Fetal Development. Reproductive Biology and Endocrinology 2003; 1: 1-10.
54- Guzeloglu-Kayisli O, Kayisli UA, Taylor HS, editors. The Role of Growth Factors and Cytokines During Implantation: Endocrine and Paracrine Interactions. InSeminars in reproductive medicine 2009; 27(1): 62-79.
55- Kitaya K, Nakayama T, Okubo T, Kuroboshi H, Fushiki S, Honjo H. Expression of Macrophage Inflammatory Protein-1β in Human Endometrium: Its Role in Endometrial Recruitment of Natural Killer Cells. The Journal of Clinical Endocrinology & Metabolism 2003; 88(4): 1809-14.
56- Fowler DJ, Nicolaides KH, Miell JP. Insulin-Like Growth Factor Binding Protein-1 (IGFBP-1): A Multifunctional Role in the Human Female Reproductive Tract. Hum Reprod Update 2000; 6(5): 495-504.
57- Javdani M, Barzegar A, Khosravian P, Hashemnia M. Evaluation of Inflammatory Response Due to Use of Controlled Release Drug Delivery System of Chitosan Hydrogel Loaded with Buprenorphine and Ketorolac in Rat with Experimental Proximal Tibial Epiphysis Defect. J Investig Surg 2022; 35(5): 996-1011.
58- Javdani M, Barzegar-Bafrouei A. The Key Role of Macrophages and Monocytes in Spinal Cord Injury: Development of Novel Therapeutic Approaches. Shefaye Khatam 2020; 8(4): 90-102.[persian]
59- Javdani M, Barzegar A. Application of Chitosan Hydrogels in Traumatic Spinal Cord Injury; A Therapeutic Approach Based on the Anti-Inflammatory and Antioxidant Properties of Selenium Nanoparticles. Frontiers in Biomedical Technologies 2023; 10(3).
60- Javdani M, Nafar M, Mohebi A, Khosravian P, Barzegar A. Evaluation of Leukocyte Response Due to Implant of a Controlled Released Drug Delivery System of Chitosan Hydrogel Loaded with Selenium Nanoparticle in Rats with Experimental Spinal Cord Injury. Tabari Biomed Stu Res J 2022; 4(2): 1-16.[persian]
61- Baumann H, Gauldie J. The Acute Phase Response. Immunol Today 1994; 15(2): 74-80.
62- Balogh O, Bruckmaier R, Keller S, Reichler IM. Effect of Maternal Metabolism on Fetal Supply: Glucose, Non-Esterified Fatty Acids and Beta-Hydroxybutyrate Concentrations in Canine Maternal Serum and Fetal Fluids at Term Pregnancy. Anim Reprod Sci 2018; 193: 209-16.
63- Galvão KN, Santos NR, Galvão JS, Gilbert RO. Association Between Endometritis and Endometrial Cytokine Expression in Postpartum Holstein Cows. Theriogenology 2011; 76(2): 290-9.
64- Boby J, Kumar H, Gupta HP, Jan MH, Singh SK, Patra MK, et al. Endometritis Increases Pro-Inflammatory Cytokines in Follicular Fluid and Cervico-Vaginal Mucus in the Buffalo Cow. Anim Biotechnol 2017; 28(3): 163-7.
65- Barzegar-Bafrouei A, Javdani M. A Review of the Occurrence and Mechanisms of Induction of Osteoporosis Following Spinal Cord Injury. SSU_Journals 2021; 29(1): 3355-74. [Persian]
66- Li LX, McSorley SJ. A Re-Evaluation of the Role of B Cells in Protective Immunity to Chlamydia Infection. Immunol Lett 2015; 164(2): 88-93.
67- Qian L, Li Q, Li H. Effect of Hepatitis B Virus Infection on Sperm Quality and Oxidative Stress State of the Semen of Infertile Males. Am J Reprod Immunol 2016; 76(3): 183-5.
68- Malvezzi H, Hernandes C, Piccinato CA, Podgaec S. Interleukin in Endometriosis-Associated Infertility-Pelvic Pain: Systematic Review and Meta-Analysis. Reproduction 2019; 158(1): 1-12.
69- Syriou V, Papanikolaou D, Kozyraki A, Goulis DG. Cytokines and Male Infertility. Eur Cytokine Netw 2018; 29(3): 73-82.
70- Pauli SA, Berga SL. Athletic Amenorrhea: Energy Deficit or Psychogenic Challenge?. Ann N Y Acad Sci 2010; 1205(1): 33-8.
71- Jana B, Kucharski J, Jedlińska-Krakowska M, Wolińska-Witort E. The Effect of Intrauterine Infusion of Inflammation-Provoking Factors on Proinflammatory Cytokines and Hormones in Rat Peripheral Blood. Pol J Vet Sci 2005; 8(4): 275-82.
72- Gabler C, Drillich M, Fischer C, Holder C, Heuwieser W, Einspanier R. Endometrial Expression of Selected Transcripts Involved in Prostaglandin Synthesis in Cows with Endometritis. Theriogenology 2009; 71(6): 993-1004.
73- Fischer C, Drillich M, Odau S, Heuwieser W, Einspanier R, Gabler C. Selected Pro-Inflammatory Factor Transcripts in Bovine Endometrial Epithelial Cells are Regulated During the Oestrous Cycle and Elevated in Case of Subclinical or Clinical Endometritis. Reprod Fertil Dev 2010; 22(5): 818-29.
74- Tibary A, Fite C, Anouassi A, Sghiri A. Infectious Causes of Reproductive Loss in Camelids. Theriogenology 2006; 66(3): 633-47.
75- Loyi T, Kumar H, Nandi S, Mathapati BS, Patra M, Pattnaik B. Differential Expression of Pro-Inflammatory Cytokines in Endometrial Tissue of Buffaloes with Clinical and Sub-Clinical Endometritis. Res Vet Sci 2013; 94(2): 336-40.
76- MacKenzie KF, Pattison MJ, Arthur JSC. Transcriptional Regulation of IL-10 and its Cell-Specific Role in Vivo. Crit Rev Immunol 2014; 34(4): 315-45.
77- Thaxton JE, Sharma S. Interleukin‐10: a Multi‐Faceted Agent of Pregnancy. Am J Reprod Immunol 2010; 63(6): 482-91.
78- Herde MK, Geist K, Campbell RE, Herbison AE. Gonadotropin-Releasing Hormone Neurons Extend Complex Highly Branched Dendritic Trees Outside the Blood-Brain Barrier. Endocrinol 2011; 152(10): 3832-41.
79- Damm J, Luheshi GN, Gerstberger R, Roth J, Rummel C. Spatiotemporal Nuclear Factor Interleukin‐6 Expression in the Rat Brain During Lipopolysaccharide‐Induced Fever is Linked to Sustained Hypothalamic Inflammatory Target Gene Induction. J Comp Neurol 2011; 519(3): 480-505.
80- LeBel Er, Vallières L, Rivest S. Selective Involvement of Interleukin-6 in the Transcriptional Activation of the Suppressor of Cytokine Signaling-3 in the Brain During Systemic Immune Challenges. Endocrinol 2000; 141(10): 3749-63.
81- Ott D, Murgott J, Rafalzik S, Wuchert F, Schmalenbeck B, Roth J, et al. Neurons and Glial Cells of the Rat Organum Vasculosum Laminae Terminalis Directly Respond to Lipopolysaccharide and Pyrogenic Cytokines. Brain Res 2010; 1363: 93-106.
82- Jasoni CL, Todman MG, Han SK, Herbison AE. Expression of Mrnas Encoding Receptors that Mediate Stress Signals in Gonadotropin-Releasing Hormone Neurons of the Mouse. Neuroendocrinology 2005; 82(5-6): 320-8.
83- Barabás K, Barad Z, Dénes Á, Bhattarai JP, Han S-K, Kiss E, et al. The Role of Interleukin-10 in Mediating the Effect of Immune Challenge on Mouse Gonadotropin-Releasing Hormone Neurons in Vivo. eNeuro 2018; 5(5): ENEURO.
84- Wegmann TG, Lin H, Guilbert L, Mosmann TR. Bidirectional Cytokine Interactions in the Maternal-Fetal Relationship: is Successful Pregnancy a TH2 Phenomenon?. Immunol Today 1993; 14(7): 353-6.
85- Van Dunné FM, de Craen AJ, Helmerhorst FM, Huizinga TW, Westendorp RG. Interleukin-10 Promoter Polymorphisms in Male and Female Fertility and Fecundity. Genes Immun 2006; 7(8): 688-92.
86- Cheng SB, Sharma S. Interleukin‐10: a Pleiotropic Regulator in Pregnancy. Am J Reprod.Immunol 2015; 73(6): 487-500.
87- Lugrin J, Rosenblatt VN, Parapanov R, Liaudet L. The Role of Oxidative Stress during Inflammatory Processes. Biological chemistry 2014; 395(2): 203-30.
88- Hussain T, Tan B, Yin Y, Blachier F, Tossou MC, Rahu N. Oxidative Stress and Inflammation: what Polyphenols Can Do for Us?. Oxid Med Cell Longev 2016; 2016: 7432797.
89- Galvao KN, Santos JEP. Recent Advances in the Immunology and Uterine Microbiology of Healthy Cows and Cows that Develop Uterine Disease. Turkish Journal of Veterinary and Animal Sciences 2014; 38(6): 577-88.
90- Economos K, MacDonald PC, Casey ML. Endothelin-1 Gene Expression and Protein Biosynthesis in Human Endometrium: Potential Modulator of Endometrial Blood Flow. The Journal of Clinical Endocrinology & Metabolism 1992; 74(1): 14-9.
91- Klentzeris LD, Bulmer JN, Warren A, Morrison L, Li T-C, Cooke ID. Endometrial Lymphoid Tissue in the Timed Endometrial Biopsy: Morphometric and Immunohistochemical Aspects. Am J Obstet Gynecol 1992; 167(3): 667-74.
92- Benedetto C, Bocci A, Dianzani MU, Ghiringhello B, Slater TF, Tomasi A, et al. Electron Spin Resonance Studies on Normal Human Uterus and Cervix and on Benign and Malignant Uterine Tumors. Cancer Res 1981; 41(7): 2936-42.
93- Narimoto K, Noda Y, Shiotani M, Tokura T, Goto Y, Takakura K, et al. Immunohistochemical Assessment of Superoxide Dismutase Expression in the Human Endometrium throughout the Menstrual Cycle. Acta Histochem Cytochem 1990; 23(4): 487-98.
94- Ota H, Igarashi S, Sato N, Tanaka H, Tanaka T. Involvement of Catalase in the Endometrium of Patients with Endometriosis and Adenomyosis. Fertil Steril 2002; 78(4): 804-9.
95- Sugino N, Shimamura K, Takiguchi S, Tamura H, Ono M, Nakata M, et al. Changes in Activity of Superoxide Dismutase in the Human Endometrium throughout the Menstrual Cycle and in Early Pregnancy. Hum Reprod 1996; 11(5): 1073-8.
96- Amos MR, Healey GD, Goldstone RJ, Mahan SM, Düvel A, Schuberth H-J, et al. Differential Endometrial Cell Sensitivity to a Cholesterol-Dependent Cytolysin Links Trueperella Pyogenes to Uterine Disease in Cattle. Biol Reprod 2014; 90(3): 1-13.
97- Zerbe H, Schuberth H-J, Engelke F, Frank J, Klug E, Leibold W. Development and Comparison of in Vivo and in Vitro Models for Endometritis in Cows and Mares. Theriogenology 2003; 60(2): 209-23.
98- HINRICHS K, Spensley M, McDonough PL. Evaluation of Progesterone Treatment to Create a Model for Equine Endometritis. Equine Vet J 1992; 24(6): 457-61.
99- Mikamo H, Kawazoe K, Sato Y, Tamaya T. Therapeutic Effects of on Injectable New Quinolone, Pazufloxacin, Against Polymicrobial Infections in the Uterine Endometritis Model. Chemotherapy 1998; 44(2): 99-102.
100- Sheldon IM, Rycroft AN, Dogan B, Craven M, Bromfield JJ, Chandler A, et al. Specific Strains of Escherichia Coli are Pathogenic for the Endometrium of Cattle and Cause Pelvic Inflammatory Disease in Cattle and Mice. PloS one 2010; 5(2): e9192.
101- Kim I-H, Kang H-G, Jeong J-K, Hur T-Y, Jung Y-H. Inflammatory Cytokine Concentrations in Uterine Flush and Serum Samples from Dairy Cows with Clinical or Subclinical Endometritis. Theriogenology 2014; 82(3): 427-32.
نوع مطالعه: مروری |
موضوع مقاله:
زنان و زایمان
دریافت: 1401/6/11 | پذیرش: 1401/10/17 | انتشار: 1402/1/15
دریافت: 1401/6/11 | پذیرش: 1401/10/17 | انتشار: 1402/1/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







