دوره 31، شماره 5 - ( مرداد 1402 )
جلد 31 شماره 5 صفحات 6682-6675 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Javadi M, Soltani H, Shokri R. Antimicrobial Effect of Silver Nanoparticles and Combination with Cotrimoxazole against Salmonella Typhi in Vitro and in Animal Model. JSSU 2023; 31 (5) :6675-6682
URL: http://jssu.ssu.ac.ir/article-1-5787-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5787-fa.html
جوادی مینا، سلطانی حسین، شکری رسول. بررسی اثر ضد میکروبی نانو ذرات نقره و ترکیب با کوتریموکسازول علیه سالمونلا تیفی در شرایط آزمایشگاهی و مدل حیوانی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (5) :6675-6682
متن کامل [PDF 609 kb]
(604 دریافت)
| چکیده (HTML) (1697 مشاهده)
References:
1- Levine MM, Black RE, Lanata C. Precise Estimation of the Numbers of Chronic Carriers of Salmonella Typhi in Santiago, Chile, an Endemic Area. J Infect Dis 1982; 146(6): 724-6.
2- Merselis JG Jr, Kaye D, Connolly CS, Hook EW. Quantitative Bacteriology of the Typhoid Carrier State. Am J Trop Med Hyg 1964; 13: 425- 9.
3- Crump JA, Sjölund-Karlsson M, Gordon MA, Parry CM. Epidemiology, Clinical Presentation, Laboratory Diagnosis, Antimicrobial Resistance, and Antimicrobial Management of Invasive Salmonella Infections. Clin Microbiol Rev 2015; 28(4): 901-37.
4- Parry CM, Hien TT, Dougan G, White NJ, Farrar JJ. Typhoid Fever. N Engl J Med 2002; 347(22): 1770-82.
5- Gebert A, Rothkötter HJ, Pabst R. M Cells in Peyer's Patches of the Intestine. Int Rev Cytol 1996; 167: 91-159.
6- Forbes BA, Sahm DF, Weissfeld AS. Baily and Scott’s Diagnostic Microbiology. 12th ed. Mosby; 2007. p. 323-34.
7- Das Neves PB, Agnelli JA, Kurachi C, de Souza CW. Addition of Silver Nanoparticles to Composite Resin: Effect on Physical and Bactericidal Properties in Vitro. Braz Dent J 2014; 25(2): 141-5.
8- Ranković BR, Kosanić M. Antimicrobial Activities of Different Extracts of Lecanora Atra Lecanora Muralis, Parmelia Saxatilis, Parmelia Sulcata and Parmeliopsis Ambigua. PJB 2012; 44(1): 429-433.
9- Melvin P, James S, April M, Sharon K, Marcelo F, Romney M, Et al. Performance Standards for Antimicrobial Susceptibility Testing. M100, 30th ed. Wayne: Clinical and Laboratory Standards Institute; 2020: 156-170.
10- Nasiri Semnani Sh, Rahnema M, Ghasempour H, Alizadeh H. Evaluation of Antibacterial Effects of Lecanora Muralis SP. Extract on Staphylococcus Aureus and Salmonella Typhimurum in Vitro and in Animal Model. JABS 2014; 4(3): 318-26. [Persian]
11- Alizadeh H, Salouti M, Shapouri R, Abdollazadeh P, Nasseryan J. Antibacterial Effects of Silver Nanoparticles on Brucella Melitensis 16M in an Animal Model in Vitro. J Arak Uni Med Sci 2012; 14(7): 64-70. [Persian]
12- Lara HH, Ayala-Núñez NV, Ixtepan Turrent LD, Rodríguez Padilla C. Bacterisidal Effect of Silver Nanoparticles against Multidrudge-Resistent Bacteria. World journal of microbiology & biotechnology 2010; 26(4): 615-21.
13- Ayala-Nunez NV, Lara Villegas HH, Del Carmen Ixtepan Turrent L, Rodriguez-Padilla C. Silver Nanoparticles Toxicity and Bacterial Effect agaiens Methicillin-Resistant Staphylococcus Aureus: Nanoscale Does Matter. Nanobiotechnol 2009; 5(1): 2-9.
14- Behravan M, Panahi AH, Naghizadeh A, Ziaee M. Mahdavi R, Mirzapour A. (2019). Facile Green Synthesis of Silver Nanoparticles Using Berberis Vulgaris Leaf and Root Aqueous Extract and its Antibacterial Activity. International Journal of Biological Macromolecules 2019; 124: 148-54. [Persian]
15- Seleem MN, Munusamy P, Ranjan A, Alqublan H, Pickrell G, Sriranganathan N. Silica-Antibiotic Hybrid Nanoparticles for Targeting Intracellular Pathogens. Antimicrob Agents Chemother 2009; 53(10): 4270-4.
16- Kora AJ, Arunachalam J. Assessment of Antibactrial Activity of Silver Nanoparticles on Peseudomonas Aeruginosa and its Mechanism of Action. World J Microbiol Biotechnol 2011; 27: 1209-16.
متن کامل: (746 مشاهده)
مقدمه
سالمونلا تیفی یک باکتری گرم منفی و مسئول تب حصبه که یک بیماری خاص برای انسان است. حصبه یک بیماری حاد است که اغلب با تب بالا، کسالت و درد شکمی مشخص میشود. در سطح جهانی، کودکان بهطور نامتناسبی تحت تأثیر قرار میگیرند، به ویژه در جنوب آسیای مرکزی، آسیای جنوب شرقی، آمریکای لاتین و جنوب آفریقا، جایی که بروز مقاومت آنتیبیوتیکی باعث تشدید عوارض و مرگومیر مرتبط با این بیماری میشود. عوارض جدی شامل سوراخ شدن روده، سپتی سمی و مننژیت است که بیشترین میزان بروز این موارد در کودکان و بیماران نقص ایمنی دیده میشود. این عوارض تهدیدکننده زندگی هستند و به مراقبتهای پزشکی پیشرفته نیاز دارند که اغلب در مناطق آندمیک تیفوئید در دسترس نیست (2،1). سالمونلا تیفی با نفوذ مستقیم به بافت اپیتلیال به واسطه تنظیمکننده هدایت غشایی گذرنده سیستیک فیبروزیس (CFTR) یا از طریق سلول M، یک سلول اپیتلیال لنفوئیدی تخصصی، وارد ناحیه زیر مخاطی روده کوچک میشود. هنگامیکه این باکتری وارد زیر مخاط میشود، باعث هیپرتروفی لکههای پیر میشود (5،4،3). با پیشرفت بیماری، بیمار ممکن است دچار گیجی متناوب و یک بیحالی خاصی شود. با اینحال، درد شکمی در همه بیماران دیده میشود و میتواند از ماهیت منتشر تا دردی که شبیه آپاندیسیت است، متغیر باشد. بزرگ شدن کبد و طحال معمولاً در طول پیشرفت بیماری ایجاد میشوند (4،3). در تب رودهای و باکتریمی، آنتیبیوتیکها نقش بسیار مهمی در درمان دارند. فلوروکینولونها، کلرامفنیکل، آموکسیسیلین، آمپیسیلین، کوتریموکسازول و سفالوسپورینهای نسل سوم، آنتیبیوتیکهای مؤثری در درمان تیفوئید هستند. گونههای سالمونلا این توانایی را دارند که از راههای مختلف، مقاومتهای آنتیبیوتیکی را کسب نمایند (6). نقره، فلزی است که به دلیل طیف وسیع فعالیت خود در برابر باکتریها، قارچها و برخی ویروسها شناخته میشود و در قالب نانو ذرات خواص آن بهطور قابلتوجهی افزایشیافته است. نانو ذرات نقره با گروههای مولکولی حاوی گوگرد و فسفر موجود در غشا و درون سلول باکتری، میل ترکیبی دارند. این نانو ذرات یونهای نقره را آزاد میکنند و به انتقال الکترون غشایی آسیب میرسانند و از تکثیر DNA جلوگیری میکنند (7). با توجه به اینکه اثرات ضد میکروبی نانو ذرات نقره بر روی باکتریهای مختلف تائید شده است، مطالعه حاضر با هدف سنجش میزان فعالیت نانو ذرات نقره به عنوان روش جدید مقابله با بیماریزایی حاصل از باکتری سالمونلا تیفی در شرایط آزمایشگاهی و در مدل حیوانی انجام شد. با توجه به اینکه اثرات ضد میکروبی نانو ذرات نقره بر روی باکتریهای مختلف تائید شده است، مطالعه حاضر با هدف سنجش میزان فعالیت نانو ذرات نقره به عنوان روش جدید مقابله با بیماریزایی حاصل از باکتری سالمونلا تیفی در شرایط آزمایشگاهی و در مدل حیوانی انجام شد.
روش بررسی
در این مطالعه تجربی، سویه سالمونلا تیفی PTCC 1609 از آزمایشگاه میکروبیولوژی انستیتو پاستور تهیه شده بود. نانو ذرات نقره با غلظت ppm 4000، به قطر nm 20 با نام تجاری NANOCOLLOID از شرکتNANO NASB PARS تهیه گردید. موشهای سوری ماده شش الی هشت هفتهای (با وزن تقریبی 5±25 گرم) از موسسه تحقیقات واکسن و سرمسازی رازی کرج خریداری شدند. ابتدا برای تهیه سوسپانسیون میکروبی در شرایط استریل، از کلنیهای تک رشد کرده با استفاده از لوپ استریل وارد 10 میلی لیتر سرم فیزیولوژی گردیده و به مدت 10 دقیقه ورتکس شد. سپس جهت تایید غلظت نهایی سوسپانسیون مورد نظر به CFU/ml 108×5/1 کلنی در هر میلیلیتر معادل نیم مک فارلند، میزان جذب نوری سوسپانسیون میکروبی توسط دستگاه اسپکتروفتومتر در طول موج 620 نانومتر تعیین گردید (8). برای تعیین حساسیت سالمونلا تیفی به آنتیبیوتیکها از روش دیسک دیفیوژن استفاده شد. سوسپانسیون میکروبی (معادل نیم مک فارلند) تهیه شده بر روی محیط کشت حاوی مولر هینتون آگار (از شرکتMERCK محصول کشور آلمان) کشت داده شد، سپس دیسکهای آنتیبیوتیکی بر روی محیط کشت قرار داده شد. جهت انجام روش دیسک دیفیوژن، از دیسکهای (از شرکت بهنوژن محصول کشور ایران) تتراسایکلین (TE30) – کلرامفنیکل (C30) – سیپروفلوکساسین (CP5) _ جنتامایسین (GM10) - ایمی پنم (IPM10) – سفالوتین (CF30) – سفتازیدیم (CAZ30) – کوتریموکسازول (SXT) - آمپیسیلین (AM10) و آمیکاسین (AN30) استفاده شد. در نهایت طبق دستورالعمل کمیته ملی استانداردهای آزمایشگاه بالینی (CLSI)، نتایج به صورت حساس، نیمه حساس و مقاوم گزارش گردید (9). نانو ذرات نقره، کوتریموکسازول و ترکیب آنها در آب مقطر دیونیزه در میکرو تیوبهای استریل تهیه گردید. به منظور تعیین حداقل غلظت مهارکننده رشد (MIC) و حداقل غلظت کشنده باکتری (MBC) از روش مایکرودیلوشن (رقت در براث) در سه مرحله جدا، به شرح زیر استفاده گردید:
الف) بررسی اثر کوتریموکسازول بر باکتری سالمونلا تیفی
در این مرحله با توجه به تهیه نانو ذرات نقره با غلظت ppm 4000، غلظتهای 4000، 2000، 1000، 500، 250، 125، 62، 31، 16، 8، 4، 2، ppm 1 از کوتریموکسازول به روش رقت سازی سریال تهیه شدند. ابتدا پودر کوتریموکسازول را با سرم فیزیولوژی توسط دستگاه ورتکس مخلوط کرده تا به غلظت مورد نیاز رسانده شود سپس به مقدار 100 میکرولیتر از محیط کشت آماده مولر هینتون براث داخل 15 چاهک مورد نظر از میکروپلیت 96 خانهای ریخته شد در ادامه به اولین چاهک 100 میکرولیتر از کوتریموکسازول با غلظت ppm 4000 اضافه شد سپس از چاهک اول 100 میکرولیتر محلول برداشته و به چاهک دوم اضافه گردید. این روند تا چاهک سیزدهم انجام شد تا تمامی غلظتهای مورد نظر ساخته شوند. در نهایت به همه چاهکهای مورد نظر 10 میکرولیتر سوسپانسیون میکروبی با غلظت CFU/ml 105×5 اضافه گردید. در ضمن دو مورد از چاهکها، یکی حاوی محیط کشت و کوتریموکسازول به عنوان کنترل منفی و دیگری حاوی محیط کشت و سوسپانسیون میکروبی به عنوان کنترل مثبت در نظر گرفته شدند. در آخر میکروپلیت به مدت 20 دقیقه در انکوباتور شیکردار قرار داده شد و پسازآن به مدت 24 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. بعد از 24 ساعت، چاهکها از نظر کدورت ناشی از رشد باکتری تلقیح شده مورد بررسی شدند و اولین غلظتی که در آن هیچگونه کدورتی قابلتشخیص نبود به عنوان MIC در نظر گرفته شد. در پایان از تمامی چاهکها که در آنها رشدی مشاهده نشد به مقدار یک لوپ در پلیت حاوی محیط کشت مولر هینتون آگار کشت داده شد و پلیتها به مدت 24 ساعت در دمای 37 درجه سانتیگراد انکوبه شدند. بعد از 24 ساعت، پلیت حاوی کمترین غلظت از آنتیبیوتیک کوتریموکسازول بودند که در آن عدم رشد باکتری مشاهده گردید، به عنوان MBC در نظر گرفته شد. تمامی مراحل این روش با سه بار تکرار انجام گردید (10). ب) بررسی اثر نانو ذرات نقره بر روی باکتری سالمونلا تیفی در این مرحله، تمامی مراحل همانند روش فوق انجام گرفت. در نهایت، دو مورد از چاهکها، یکی حاوی محیط کشت و نانو ذرات نقره به عنوان شاهد منفی و دیگری حاوی محیط کشت و سوسپانسیون میکروبی به عنوان شاهد مثبت در نظر گرفته شدند. تمامی مراحل این روش با سه بار تکرار انجام گردید (10). پ) بررسی اثر نانو ذرات نقره و آنتیبیوتیک کوتریموکسازول (به صورت ترکیبی) بر روی سالمونلا تیفی در این مرحله، به هرکدام از چاهک ها 50 میکرولیتر از رقتهای تهیه شده از کوتریموکسازول و 50 میکرولیتر از رقتهای مختلف نانو ذره نقره اضافه شد در ادامه تمامی مراحل همانند روش فوق انجام گرفت که در نهایت دو مورد از چاهکها، یکی حاوی محیط کشت و نانو ذرات نقره و آنتیبیوتیک کوتریموکسازول (به صورت ترکیبی) به عنوان شاهد منفی و دیگری حاوی محیط کشت و سوسپانسیون میکروبی به عنوان شاهد مثبت در نظر گرفته شد. تمامی مراحل این روش با سه بار تکرار انجام گردید (10). در مدل حیوانی، از موشهای سوری ماده شش الی هشتهفتهای (با وزن تقریبی 5±25 گرم) استفاده شد. 15 سر موش سوری به 5 گروه سهتایی که شامل: گروه اول، اثر ضد میکروبی با آنتیبیوتیک کوتریموکسازول. گروه دوم، اثر ضد میکروبی با نانوذره نقره. گروه سوم، اثر ضد میکروبی با ترکیب کوتریموکسازول و نانو ذرات نقره (به صورت ترکیبی). گروه چهارم، به عنوان شاهد مثبت و گروه پنجم، به عنوان شاهد منفی تقسیم شدند. برای ایجاد عفونت تجربی در موشهای انتخابی، سوسپانسیون باکتریایی با غلظت CFU/ml 105×5 در شرایط استریل به مقدار 100 میکرولیتر به صورت داخل صفاقی به همه گروههای مورد نظر به غیر از گروه شاهد منفی تزریق شد و 24 ساعت به موشها فرصت ایجاد عفونت داده شد. در روز دوم، مقدار 100 میکرولیتر از آنتیبیوتیک کوتریموکسازول با غلظت 2 میکروگرم بر میلیلیتر به موشهای گروه اول، مقدار 100 میکرولیتر از نانو ذرات نقره معادل با غلظت MBC مشخصشده به موشهای گروه دوم، مقدار 100 میکرولیتر از ترکیب آنتیبیوتیک کوتریموکسازول و نانو ذرات نقره (به صورت ترکیبی) معادل با غلظت MBC مشخصشده به موشهای گروه سوم به صورت درون صفاقی تزریق شد. بعد از گذشت هفت شبانه روز دوره درمان، هر یک از موشها در دسیکاتور حاوی اتر کشته شدند و طحال موشها در شرایط استریل خارج گردیده و در 1000 میکرولیتر بافر فسفات سالین هموژنیزه گردیدند، سپس از سوسپانسیون هموژنیزه طحالی، با پورپلیت کردن بر روی محیط مولر هینتون آگار کشت داده شد و در دمای 37 درجه سانتیگراد به مدت 24 ساعت انکوبه شدند که در نهایت شمارش کلنیهای سالمونلا تیفی با استفاده از شمارش گر کلنی انجام گردید (11).
تجزیه و تحلیل آماری
به منظور تجزیهوتحلیل آماری نتایج حاصل، نرمافزار SPSS version 16 مورداستفاده قرار گرفت. در این آزمون P< 0/05 به عنوان سطح معنیداری در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد زنجان تایید شده است.
نتایج
یافتههای مطالعه حاضر نشان میدهد که نتایج حاصل از تست دیسک دیفیوژن برای تعیین حساسیت آنتیبیوتیکی سویه سالمونلا تیفی با روش انتشار دیسک طبق جدول استانداردهای آزمایشگاه بالینی (CLSI) نسبت به 10 آنتیبیوتیک در جدول 1 نشان داده شده است. آنتیبیوتیک کوتریموکسازول به دلیل در دسترس بودن انتخاب شد. نتایج به دستآمده از تعیین MIC و MBC با روش مایکرودیلوشن در جدول 2 نشان داده شده است که در غلظتهای ppm 4000-1 از نانو ذرات نقره، کوتریموکسازول و ترکیب آنها در محیط مولر هینتون آگار انجام گردید. در مدل حیوانی، آنالیز آماری نتایج مربوط به بررسی اثر ضد میکروبی نانو ذرات نقره، آنتیبیوتیک کوتریموکسازول و اثر ترکیبی آنها بر روی سالمونلا تیفی در موشهای سوری ماده در جدول 3 نشان داده شده است؛ که اختلاف معنیداری در بین گروههای تیماری مورد مطالعه وجود دارد ( P< 0/05) یعنی هر سه دارو اثر ضد میکروبی متفاوتی بر روی سالمونلا تیفی دارد.
جدول 1: میزان مقاومت و حساسیت آنتیبیوتیکها بر روی سالمونلا تیفی
.JPG)
جدول2: میزان MIC و MBC نانو ذرات نقره وکوتریموکسازول و اثرات ترکیبی آنها بر روی سالمونلا تیفی
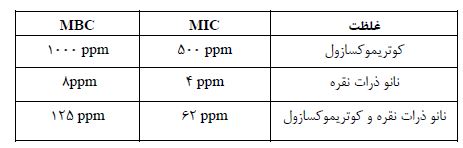
حداقل غلظت مهارکننده رشد (MIC)، حداقل غلظت کشنده باکتری (MBC)
جدول3: میانگین و انحراف معیار شمارش کلنی و اثر مهاری نانو ذرات نقره و کوتریموکسازول و اثرات ترکیبی آنها بر روی موشهای سوری آلوده به سالمونلا تیفی
نتایج شمارش کلنی (cfu/ml)

بحث
تب حصبه یا تب روده عمدتاً توسط سالمونلا تیفی ایجاد میشود. حصبه بیشتر از طریق خوردن آب یا غذای آلوده منتقل میشود. پس از ورود به روده کوچک، باکتریها از سد اپیتلیال روده عبور کرده و توسط ماکروفاژها فاگوسیتوز میشوند و به صورت سیستمیک پخش میشوند و بیماری حاد ایجاد میکنند. شایعترین محلهای عفونت ایلئوم، کبد، طحال، مغز استخوان و کیسه صفرا هستند. باکتریها از طریق عروق یا مجاری که از کبد خارج میشوند به کیسه صفرا میرسند. در طول دهه گذشته، بروز مقاومت آنتیبیوتیکی در بین گونههای سالمونلا تیفی بهطور چشمگیری در مناطق آندمیک افزایشیافته است. سویههایی که تقریباً در برابر هر آنتیبیوتیک خط اول موجود مقاوم هستند، بازیابی شدهاند و تا 60 درصد از همهسویههای جداشده مقاومت چند دارویی را نشان میدهند (2،1). با توجه به اهمیت این موضوع بهنظر میرسد که ترکیبات آنتیبیوتیکی همراه با نانو ذرات فلزی جایگزین مناسبی برای این آنتیبیوتیکها باشند. ولی تاکنون مطالعه چندانی بر روی اثر ضد میکروبی نانو ذرات نقره و اثر ترکیبی آنها با آنتیبیوتیک کوتریموکسازول علیه عفونت ناشی از سالمونلا تیفی، به خصوص در مدل حیوانی نشده است. بر اساس مطالعه حاضر، اثر نانو ذرات نقره به تنهایی بسیار مؤثرتر از سایر گروهها بهویژه آنتیبیوتیک کوتریموکسازول است. ترکیب نانو ذرات نقره با آنتیبیوتیک کوتریموکسازول نیز اثر همافزایی چشمگیری نسبت به خود آنتیبیوتیک داشته ولی نمیتواند جای نانو ذرات نقره را بگیرند ولی میتوان با استفاده از آن، میزان استفاده از ضد میکروبی کاهش داد. در مطالعه حاضر نتایج تعیین MIC و MBC به روش مایکرودایلوشن نشان داد که نانو ذرات نقره نسبت به هرکدام از عوامل به تنهایی، دارای خاصیت ضد میکروبی بیشتری بر روی سالمونلا تیفی میباشد. این یافتهها با نتایج حاصل از سایر پژوهشگران مورد بررسی قرار گرفت. هومبرتو و همکارانش (Hmberto et al)، در سال 2010 در مکزیک اثر مهاری نانو ذرات نقره را بر روی باکتریهایی که مقاومت دارویی زیادی از خود نشان میدهند مثل باکتریهای سودوموناس آئروژینوزا، اشرشیاکلی مقاوم به آمپیسیلین، استرپتوکوکوس پایوژنز مقاوم به اریترومایسین را نشان دادند آنها مشاهده کردند که نانو ذرات نقره اثر باکتریوستاتیک قابلملاحظهای بر روی این باکتریها دارند (12). در سال 2009 نیلدا و همکارانش (Nilda et al) توانستند باکتری استافیلوکوکوس اورئوس مقاوم به متیسیلین را با استفاده از نانو ذرات نقره مهار نمایند. آنها ثابت کردند فلز نقره در حالت نانو بودن اثر ضد میکروبی میتواند داشته باشد (13). همچنین در مطالعات بهروان و همکارانش (Behravan et al)، در سال 2019 فعالیت ضد میکروبی نانو ذرات نقره بر استافیلوکوکوس اورئوس و اشرشیاکلی مورد ارزیابی قرار دادند. نتایج به دست آمده نشان داد اثر ضد میکروبی نانو ذرات نقره بر باکتریهای گرم منفی بیشتر از باکتریهای گرم مثبت بود که با افزایش غلظت و تعداد نانو ذرات، مهار کامل رشد باکتری اتفاق افتاد. در باکتری گرم منفی اشرشیاکلی نانو ذرات نقره مانع از جذب و آزاد شدن فسفات، مانیتول، پرولین، گلوتامین و سوکسینات از سلول این باکتری میشوند تمایل زیاد ذرات نقره به گوگرد و فسفر در غشای سلولی دلیل اصلی خاصیت ضد باکتریایی آن است. نانو ذرات نقره با پروتئینهای حاوی گوگرد در داخل یا خارج غشای سلول واکنش میدهند که بر بقای سلولها تأثیر میگذارد (14). نتایج مطالعه حاضر بر روی مدل حیوانی نشان میدهد که نانو ذرات نقره در موشهای سوری ماده میتواند آثار ضد میکروبی خود را بر روی عفونت ناشی از سالمونلا تیفی حفظ کرده و به تنهایی دارای اثر ضد میکروبی میباشد. همچنین آنالیز آماری نتایج مدل حیوانی نشان داد که نانو ذرات نقره دارای خاصیت ضد میکروبی بیشتری علیه عفونتهای حاصل از سالمونلا تیفی نسبت به آنتیبیوتیک کوتریموکسازول میباشد. با افزایش غلظت نانو ذرات نقره، رشد میکروب کاهش یافته است لذا میتوان گفت که اثر نانو ذرات نقره وابسته به دوز مصرفی است و با افزایش غلظت آن اثر ضد میکروبی آن نیز افزایش مییابد. در مطالعه حاضر با مقایسه نتایج مربوط به مدل حیوانی، مشخص شد تأثیر ضد میکروبی بین گروههای تیماری با نانو ذرات نقره، آنتیبیوتیک کوتریموکسازول و نانو ذرات نقره و آنتیبیوتیک کوتریموکسازول (به صورت ترکیبی)، اختلاف معنیداری بود. یافتههای به دست آمده در این مطالعه با نتایج سلیم و همکارانش (Seleem et al)، در سال ۲۰۰۹ مطابقت دارد. آنها در مطالعه نشان دادند که تعداد کلنیهای باکتری سالمونلا انتریکا در طحال و کبد موش در صورت تزریق نانو ذرات سیلیکا کونژوگه شده با جنتامایسین در مقایسه با زمانی که تنها جنتامایسین آزاد به طحال و کبد موش تزریق میشود، کمتر است (15). در مطالعهای دیگر علیزاده و همکاران (Alizadeh et al)، در سال ۲۰۱۱ اثر همافزایی نانو ذرات نقره با جنتامایسین را در مدل حیوان مورد بررسی قرار دادند. آنها در این مطالعه آنتیبیوتیک جنتامایسین را به نانو ذرات نقره به صورت توأم در مدل حیوانی مورد آزمایش قرار دادند. نتایج آنها نشان داد که نانو ذرات نقره اثر همافزایی شدیدی با جنتامایسین دارد (۱۱). همچنین آرونا (Aruna) در سال 2011 خواص ضد باکتریایی نانو ذرات بر روی باکتری مقاوم سودوموناس آئروژینوزا بررسی و نتایج ضد باکتریایی نانو ذرات نقره گزارش نمود، این بررسیهایی که بر روی باکتری سودوموناس آئروژینوزا در شرایط آزمایشگاهی و مدل حیوانی انجامگرفته شد، مطابقت دارد (16). نتایج حاصل از اثر ضد میکروبی نانو ذرات نقره و ترکیب با کوتریموکسازول در شرایط آزمایشگاهی و مدل حیوانی با نتایج این پژوهشگران مطابقت داشت.
نتیجهگیری
نانو ذرات نقره به تنهایی بسیار مؤثرتر از سایر گروهها به ویژه آنتیبیوتیک کوتریموکسازول است. اثر ترکیبی نانو ذرات نقره با کوتریموکسازول تا حدی با اثر نانو ذرات نقره برابر بوده است و کاهش میزان رشد در این دو ماده بالا میباشد ولی جایگزین مناسبی در برابر نانو ذرات نقره نمیباشد. نانو ذرات نقره میتواند در آینده به عنوان عامل ضد میکروبی استفادهشده و تا میزان قابل قبولی رشد باکتریها را کنترل نمود.
سپاسگزاری
این مطالعه ماحصل بخشی از پایاننامه کارشناسی ارشد دانشگاه آزاد اسلامی زنجان بوده بدینوسیله از زحمات مسئولیت محترم مرکز تحقیقات بیولوژی دانشگاه آزاد اسلامی زنجان تشکر و قدردانی به عمل میآید.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
سالمونلا تیفی یک باکتری گرم منفی و مسئول تب حصبه که یک بیماری خاص برای انسان است. حصبه یک بیماری حاد است که اغلب با تب بالا، کسالت و درد شکمی مشخص میشود. در سطح جهانی، کودکان بهطور نامتناسبی تحت تأثیر قرار میگیرند، به ویژه در جنوب آسیای مرکزی، آسیای جنوب شرقی، آمریکای لاتین و جنوب آفریقا، جایی که بروز مقاومت آنتیبیوتیکی باعث تشدید عوارض و مرگومیر مرتبط با این بیماری میشود. عوارض جدی شامل سوراخ شدن روده، سپتی سمی و مننژیت است که بیشترین میزان بروز این موارد در کودکان و بیماران نقص ایمنی دیده میشود. این عوارض تهدیدکننده زندگی هستند و به مراقبتهای پزشکی پیشرفته نیاز دارند که اغلب در مناطق آندمیک تیفوئید در دسترس نیست (2،1). سالمونلا تیفی با نفوذ مستقیم به بافت اپیتلیال به واسطه تنظیمکننده هدایت غشایی گذرنده سیستیک فیبروزیس (CFTR) یا از طریق سلول M، یک سلول اپیتلیال لنفوئیدی تخصصی، وارد ناحیه زیر مخاطی روده کوچک میشود. هنگامیکه این باکتری وارد زیر مخاط میشود، باعث هیپرتروفی لکههای پیر میشود (5،4،3). با پیشرفت بیماری، بیمار ممکن است دچار گیجی متناوب و یک بیحالی خاصی شود. با اینحال، درد شکمی در همه بیماران دیده میشود و میتواند از ماهیت منتشر تا دردی که شبیه آپاندیسیت است، متغیر باشد. بزرگ شدن کبد و طحال معمولاً در طول پیشرفت بیماری ایجاد میشوند (4،3). در تب رودهای و باکتریمی، آنتیبیوتیکها نقش بسیار مهمی در درمان دارند. فلوروکینولونها، کلرامفنیکل، آموکسیسیلین، آمپیسیلین، کوتریموکسازول و سفالوسپورینهای نسل سوم، آنتیبیوتیکهای مؤثری در درمان تیفوئید هستند. گونههای سالمونلا این توانایی را دارند که از راههای مختلف، مقاومتهای آنتیبیوتیکی را کسب نمایند (6). نقره، فلزی است که به دلیل طیف وسیع فعالیت خود در برابر باکتریها، قارچها و برخی ویروسها شناخته میشود و در قالب نانو ذرات خواص آن بهطور قابلتوجهی افزایشیافته است. نانو ذرات نقره با گروههای مولکولی حاوی گوگرد و فسفر موجود در غشا و درون سلول باکتری، میل ترکیبی دارند. این نانو ذرات یونهای نقره را آزاد میکنند و به انتقال الکترون غشایی آسیب میرسانند و از تکثیر DNA جلوگیری میکنند (7). با توجه به اینکه اثرات ضد میکروبی نانو ذرات نقره بر روی باکتریهای مختلف تائید شده است، مطالعه حاضر با هدف سنجش میزان فعالیت نانو ذرات نقره به عنوان روش جدید مقابله با بیماریزایی حاصل از باکتری سالمونلا تیفی در شرایط آزمایشگاهی و در مدل حیوانی انجام شد. با توجه به اینکه اثرات ضد میکروبی نانو ذرات نقره بر روی باکتریهای مختلف تائید شده است، مطالعه حاضر با هدف سنجش میزان فعالیت نانو ذرات نقره به عنوان روش جدید مقابله با بیماریزایی حاصل از باکتری سالمونلا تیفی در شرایط آزمایشگاهی و در مدل حیوانی انجام شد.
روش بررسی
در این مطالعه تجربی، سویه سالمونلا تیفی PTCC 1609 از آزمایشگاه میکروبیولوژی انستیتو پاستور تهیه شده بود. نانو ذرات نقره با غلظت ppm 4000، به قطر nm 20 با نام تجاری NANOCOLLOID از شرکتNANO NASB PARS تهیه گردید. موشهای سوری ماده شش الی هشت هفتهای (با وزن تقریبی 5±25 گرم) از موسسه تحقیقات واکسن و سرمسازی رازی کرج خریداری شدند. ابتدا برای تهیه سوسپانسیون میکروبی در شرایط استریل، از کلنیهای تک رشد کرده با استفاده از لوپ استریل وارد 10 میلی لیتر سرم فیزیولوژی گردیده و به مدت 10 دقیقه ورتکس شد. سپس جهت تایید غلظت نهایی سوسپانسیون مورد نظر به CFU/ml 108×5/1 کلنی در هر میلیلیتر معادل نیم مک فارلند، میزان جذب نوری سوسپانسیون میکروبی توسط دستگاه اسپکتروفتومتر در طول موج 620 نانومتر تعیین گردید (8). برای تعیین حساسیت سالمونلا تیفی به آنتیبیوتیکها از روش دیسک دیفیوژن استفاده شد. سوسپانسیون میکروبی (معادل نیم مک فارلند) تهیه شده بر روی محیط کشت حاوی مولر هینتون آگار (از شرکتMERCK محصول کشور آلمان) کشت داده شد، سپس دیسکهای آنتیبیوتیکی بر روی محیط کشت قرار داده شد. جهت انجام روش دیسک دیفیوژن، از دیسکهای (از شرکت بهنوژن محصول کشور ایران) تتراسایکلین (TE30) – کلرامفنیکل (C30) – سیپروفلوکساسین (CP5) _ جنتامایسین (GM10) - ایمی پنم (IPM10) – سفالوتین (CF30) – سفتازیدیم (CAZ30) – کوتریموکسازول (SXT) - آمپیسیلین (AM10) و آمیکاسین (AN30) استفاده شد. در نهایت طبق دستورالعمل کمیته ملی استانداردهای آزمایشگاه بالینی (CLSI)، نتایج به صورت حساس، نیمه حساس و مقاوم گزارش گردید (9). نانو ذرات نقره، کوتریموکسازول و ترکیب آنها در آب مقطر دیونیزه در میکرو تیوبهای استریل تهیه گردید. به منظور تعیین حداقل غلظت مهارکننده رشد (MIC) و حداقل غلظت کشنده باکتری (MBC) از روش مایکرودیلوشن (رقت در براث) در سه مرحله جدا، به شرح زیر استفاده گردید:
الف) بررسی اثر کوتریموکسازول بر باکتری سالمونلا تیفی
در این مرحله با توجه به تهیه نانو ذرات نقره با غلظت ppm 4000، غلظتهای 4000، 2000، 1000، 500، 250، 125، 62، 31، 16، 8، 4، 2، ppm 1 از کوتریموکسازول به روش رقت سازی سریال تهیه شدند. ابتدا پودر کوتریموکسازول را با سرم فیزیولوژی توسط دستگاه ورتکس مخلوط کرده تا به غلظت مورد نیاز رسانده شود سپس به مقدار 100 میکرولیتر از محیط کشت آماده مولر هینتون براث داخل 15 چاهک مورد نظر از میکروپلیت 96 خانهای ریخته شد در ادامه به اولین چاهک 100 میکرولیتر از کوتریموکسازول با غلظت ppm 4000 اضافه شد سپس از چاهک اول 100 میکرولیتر محلول برداشته و به چاهک دوم اضافه گردید. این روند تا چاهک سیزدهم انجام شد تا تمامی غلظتهای مورد نظر ساخته شوند. در نهایت به همه چاهکهای مورد نظر 10 میکرولیتر سوسپانسیون میکروبی با غلظت CFU/ml 105×5 اضافه گردید. در ضمن دو مورد از چاهکها، یکی حاوی محیط کشت و کوتریموکسازول به عنوان کنترل منفی و دیگری حاوی محیط کشت و سوسپانسیون میکروبی به عنوان کنترل مثبت در نظر گرفته شدند. در آخر میکروپلیت به مدت 20 دقیقه در انکوباتور شیکردار قرار داده شد و پسازآن به مدت 24 ساعت در دمای 37 درجه سانتیگراد انکوبه گردید. بعد از 24 ساعت، چاهکها از نظر کدورت ناشی از رشد باکتری تلقیح شده مورد بررسی شدند و اولین غلظتی که در آن هیچگونه کدورتی قابلتشخیص نبود به عنوان MIC در نظر گرفته شد. در پایان از تمامی چاهکها که در آنها رشدی مشاهده نشد به مقدار یک لوپ در پلیت حاوی محیط کشت مولر هینتون آگار کشت داده شد و پلیتها به مدت 24 ساعت در دمای 37 درجه سانتیگراد انکوبه شدند. بعد از 24 ساعت، پلیت حاوی کمترین غلظت از آنتیبیوتیک کوتریموکسازول بودند که در آن عدم رشد باکتری مشاهده گردید، به عنوان MBC در نظر گرفته شد. تمامی مراحل این روش با سه بار تکرار انجام گردید (10). ب) بررسی اثر نانو ذرات نقره بر روی باکتری سالمونلا تیفی در این مرحله، تمامی مراحل همانند روش فوق انجام گرفت. در نهایت، دو مورد از چاهکها، یکی حاوی محیط کشت و نانو ذرات نقره به عنوان شاهد منفی و دیگری حاوی محیط کشت و سوسپانسیون میکروبی به عنوان شاهد مثبت در نظر گرفته شدند. تمامی مراحل این روش با سه بار تکرار انجام گردید (10). پ) بررسی اثر نانو ذرات نقره و آنتیبیوتیک کوتریموکسازول (به صورت ترکیبی) بر روی سالمونلا تیفی در این مرحله، به هرکدام از چاهک ها 50 میکرولیتر از رقتهای تهیه شده از کوتریموکسازول و 50 میکرولیتر از رقتهای مختلف نانو ذره نقره اضافه شد در ادامه تمامی مراحل همانند روش فوق انجام گرفت که در نهایت دو مورد از چاهکها، یکی حاوی محیط کشت و نانو ذرات نقره و آنتیبیوتیک کوتریموکسازول (به صورت ترکیبی) به عنوان شاهد منفی و دیگری حاوی محیط کشت و سوسپانسیون میکروبی به عنوان شاهد مثبت در نظر گرفته شد. تمامی مراحل این روش با سه بار تکرار انجام گردید (10). در مدل حیوانی، از موشهای سوری ماده شش الی هشتهفتهای (با وزن تقریبی 5±25 گرم) استفاده شد. 15 سر موش سوری به 5 گروه سهتایی که شامل: گروه اول، اثر ضد میکروبی با آنتیبیوتیک کوتریموکسازول. گروه دوم، اثر ضد میکروبی با نانوذره نقره. گروه سوم، اثر ضد میکروبی با ترکیب کوتریموکسازول و نانو ذرات نقره (به صورت ترکیبی). گروه چهارم، به عنوان شاهد مثبت و گروه پنجم، به عنوان شاهد منفی تقسیم شدند. برای ایجاد عفونت تجربی در موشهای انتخابی، سوسپانسیون باکتریایی با غلظت CFU/ml 105×5 در شرایط استریل به مقدار 100 میکرولیتر به صورت داخل صفاقی به همه گروههای مورد نظر به غیر از گروه شاهد منفی تزریق شد و 24 ساعت به موشها فرصت ایجاد عفونت داده شد. در روز دوم، مقدار 100 میکرولیتر از آنتیبیوتیک کوتریموکسازول با غلظت 2 میکروگرم بر میلیلیتر به موشهای گروه اول، مقدار 100 میکرولیتر از نانو ذرات نقره معادل با غلظت MBC مشخصشده به موشهای گروه دوم، مقدار 100 میکرولیتر از ترکیب آنتیبیوتیک کوتریموکسازول و نانو ذرات نقره (به صورت ترکیبی) معادل با غلظت MBC مشخصشده به موشهای گروه سوم به صورت درون صفاقی تزریق شد. بعد از گذشت هفت شبانه روز دوره درمان، هر یک از موشها در دسیکاتور حاوی اتر کشته شدند و طحال موشها در شرایط استریل خارج گردیده و در 1000 میکرولیتر بافر فسفات سالین هموژنیزه گردیدند، سپس از سوسپانسیون هموژنیزه طحالی، با پورپلیت کردن بر روی محیط مولر هینتون آگار کشت داده شد و در دمای 37 درجه سانتیگراد به مدت 24 ساعت انکوبه شدند که در نهایت شمارش کلنیهای سالمونلا تیفی با استفاده از شمارش گر کلنی انجام گردید (11).
تجزیه و تحلیل آماری
به منظور تجزیهوتحلیل آماری نتایج حاصل، نرمافزار SPSS version 16 مورداستفاده قرار گرفت. در این آزمون P< 0/05 به عنوان سطح معنیداری در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد زنجان تایید شده است.
نتایج
یافتههای مطالعه حاضر نشان میدهد که نتایج حاصل از تست دیسک دیفیوژن برای تعیین حساسیت آنتیبیوتیکی سویه سالمونلا تیفی با روش انتشار دیسک طبق جدول استانداردهای آزمایشگاه بالینی (CLSI) نسبت به 10 آنتیبیوتیک در جدول 1 نشان داده شده است. آنتیبیوتیک کوتریموکسازول به دلیل در دسترس بودن انتخاب شد. نتایج به دستآمده از تعیین MIC و MBC با روش مایکرودیلوشن در جدول 2 نشان داده شده است که در غلظتهای ppm 4000-1 از نانو ذرات نقره، کوتریموکسازول و ترکیب آنها در محیط مولر هینتون آگار انجام گردید. در مدل حیوانی، آنالیز آماری نتایج مربوط به بررسی اثر ضد میکروبی نانو ذرات نقره، آنتیبیوتیک کوتریموکسازول و اثر ترکیبی آنها بر روی سالمونلا تیفی در موشهای سوری ماده در جدول 3 نشان داده شده است؛ که اختلاف معنیداری در بین گروههای تیماری مورد مطالعه وجود دارد ( P< 0/05) یعنی هر سه دارو اثر ضد میکروبی متفاوتی بر روی سالمونلا تیفی دارد.
جدول 1: میزان مقاومت و حساسیت آنتیبیوتیکها بر روی سالمونلا تیفی
.JPG)
جدول2: میزان MIC و MBC نانو ذرات نقره وکوتریموکسازول و اثرات ترکیبی آنها بر روی سالمونلا تیفی

حداقل غلظت مهارکننده رشد (MIC)، حداقل غلظت کشنده باکتری (MBC)
جدول3: میانگین و انحراف معیار شمارش کلنی و اثر مهاری نانو ذرات نقره و کوتریموکسازول و اثرات ترکیبی آنها بر روی موشهای سوری آلوده به سالمونلا تیفی
نتایج شمارش کلنی (cfu/ml)

بحث
تب حصبه یا تب روده عمدتاً توسط سالمونلا تیفی ایجاد میشود. حصبه بیشتر از طریق خوردن آب یا غذای آلوده منتقل میشود. پس از ورود به روده کوچک، باکتریها از سد اپیتلیال روده عبور کرده و توسط ماکروفاژها فاگوسیتوز میشوند و به صورت سیستمیک پخش میشوند و بیماری حاد ایجاد میکنند. شایعترین محلهای عفونت ایلئوم، کبد، طحال، مغز استخوان و کیسه صفرا هستند. باکتریها از طریق عروق یا مجاری که از کبد خارج میشوند به کیسه صفرا میرسند. در طول دهه گذشته، بروز مقاومت آنتیبیوتیکی در بین گونههای سالمونلا تیفی بهطور چشمگیری در مناطق آندمیک افزایشیافته است. سویههایی که تقریباً در برابر هر آنتیبیوتیک خط اول موجود مقاوم هستند، بازیابی شدهاند و تا 60 درصد از همهسویههای جداشده مقاومت چند دارویی را نشان میدهند (2،1). با توجه به اهمیت این موضوع بهنظر میرسد که ترکیبات آنتیبیوتیکی همراه با نانو ذرات فلزی جایگزین مناسبی برای این آنتیبیوتیکها باشند. ولی تاکنون مطالعه چندانی بر روی اثر ضد میکروبی نانو ذرات نقره و اثر ترکیبی آنها با آنتیبیوتیک کوتریموکسازول علیه عفونت ناشی از سالمونلا تیفی، به خصوص در مدل حیوانی نشده است. بر اساس مطالعه حاضر، اثر نانو ذرات نقره به تنهایی بسیار مؤثرتر از سایر گروهها بهویژه آنتیبیوتیک کوتریموکسازول است. ترکیب نانو ذرات نقره با آنتیبیوتیک کوتریموکسازول نیز اثر همافزایی چشمگیری نسبت به خود آنتیبیوتیک داشته ولی نمیتواند جای نانو ذرات نقره را بگیرند ولی میتوان با استفاده از آن، میزان استفاده از ضد میکروبی کاهش داد. در مطالعه حاضر نتایج تعیین MIC و MBC به روش مایکرودایلوشن نشان داد که نانو ذرات نقره نسبت به هرکدام از عوامل به تنهایی، دارای خاصیت ضد میکروبی بیشتری بر روی سالمونلا تیفی میباشد. این یافتهها با نتایج حاصل از سایر پژوهشگران مورد بررسی قرار گرفت. هومبرتو و همکارانش (Hmberto et al)، در سال 2010 در مکزیک اثر مهاری نانو ذرات نقره را بر روی باکتریهایی که مقاومت دارویی زیادی از خود نشان میدهند مثل باکتریهای سودوموناس آئروژینوزا، اشرشیاکلی مقاوم به آمپیسیلین، استرپتوکوکوس پایوژنز مقاوم به اریترومایسین را نشان دادند آنها مشاهده کردند که نانو ذرات نقره اثر باکتریوستاتیک قابلملاحظهای بر روی این باکتریها دارند (12). در سال 2009 نیلدا و همکارانش (Nilda et al) توانستند باکتری استافیلوکوکوس اورئوس مقاوم به متیسیلین را با استفاده از نانو ذرات نقره مهار نمایند. آنها ثابت کردند فلز نقره در حالت نانو بودن اثر ضد میکروبی میتواند داشته باشد (13). همچنین در مطالعات بهروان و همکارانش (Behravan et al)، در سال 2019 فعالیت ضد میکروبی نانو ذرات نقره بر استافیلوکوکوس اورئوس و اشرشیاکلی مورد ارزیابی قرار دادند. نتایج به دست آمده نشان داد اثر ضد میکروبی نانو ذرات نقره بر باکتریهای گرم منفی بیشتر از باکتریهای گرم مثبت بود که با افزایش غلظت و تعداد نانو ذرات، مهار کامل رشد باکتری اتفاق افتاد. در باکتری گرم منفی اشرشیاکلی نانو ذرات نقره مانع از جذب و آزاد شدن فسفات، مانیتول، پرولین، گلوتامین و سوکسینات از سلول این باکتری میشوند تمایل زیاد ذرات نقره به گوگرد و فسفر در غشای سلولی دلیل اصلی خاصیت ضد باکتریایی آن است. نانو ذرات نقره با پروتئینهای حاوی گوگرد در داخل یا خارج غشای سلول واکنش میدهند که بر بقای سلولها تأثیر میگذارد (14). نتایج مطالعه حاضر بر روی مدل حیوانی نشان میدهد که نانو ذرات نقره در موشهای سوری ماده میتواند آثار ضد میکروبی خود را بر روی عفونت ناشی از سالمونلا تیفی حفظ کرده و به تنهایی دارای اثر ضد میکروبی میباشد. همچنین آنالیز آماری نتایج مدل حیوانی نشان داد که نانو ذرات نقره دارای خاصیت ضد میکروبی بیشتری علیه عفونتهای حاصل از سالمونلا تیفی نسبت به آنتیبیوتیک کوتریموکسازول میباشد. با افزایش غلظت نانو ذرات نقره، رشد میکروب کاهش یافته است لذا میتوان گفت که اثر نانو ذرات نقره وابسته به دوز مصرفی است و با افزایش غلظت آن اثر ضد میکروبی آن نیز افزایش مییابد. در مطالعه حاضر با مقایسه نتایج مربوط به مدل حیوانی، مشخص شد تأثیر ضد میکروبی بین گروههای تیماری با نانو ذرات نقره، آنتیبیوتیک کوتریموکسازول و نانو ذرات نقره و آنتیبیوتیک کوتریموکسازول (به صورت ترکیبی)، اختلاف معنیداری بود. یافتههای به دست آمده در این مطالعه با نتایج سلیم و همکارانش (Seleem et al)، در سال ۲۰۰۹ مطابقت دارد. آنها در مطالعه نشان دادند که تعداد کلنیهای باکتری سالمونلا انتریکا در طحال و کبد موش در صورت تزریق نانو ذرات سیلیکا کونژوگه شده با جنتامایسین در مقایسه با زمانی که تنها جنتامایسین آزاد به طحال و کبد موش تزریق میشود، کمتر است (15). در مطالعهای دیگر علیزاده و همکاران (Alizadeh et al)، در سال ۲۰۱۱ اثر همافزایی نانو ذرات نقره با جنتامایسین را در مدل حیوان مورد بررسی قرار دادند. آنها در این مطالعه آنتیبیوتیک جنتامایسین را به نانو ذرات نقره به صورت توأم در مدل حیوانی مورد آزمایش قرار دادند. نتایج آنها نشان داد که نانو ذرات نقره اثر همافزایی شدیدی با جنتامایسین دارد (۱۱). همچنین آرونا (Aruna) در سال 2011 خواص ضد باکتریایی نانو ذرات بر روی باکتری مقاوم سودوموناس آئروژینوزا بررسی و نتایج ضد باکتریایی نانو ذرات نقره گزارش نمود، این بررسیهایی که بر روی باکتری سودوموناس آئروژینوزا در شرایط آزمایشگاهی و مدل حیوانی انجامگرفته شد، مطابقت دارد (16). نتایج حاصل از اثر ضد میکروبی نانو ذرات نقره و ترکیب با کوتریموکسازول در شرایط آزمایشگاهی و مدل حیوانی با نتایج این پژوهشگران مطابقت داشت.
نتیجهگیری
نانو ذرات نقره به تنهایی بسیار مؤثرتر از سایر گروهها به ویژه آنتیبیوتیک کوتریموکسازول است. اثر ترکیبی نانو ذرات نقره با کوتریموکسازول تا حدی با اثر نانو ذرات نقره برابر بوده است و کاهش میزان رشد در این دو ماده بالا میباشد ولی جایگزین مناسبی در برابر نانو ذرات نقره نمیباشد. نانو ذرات نقره میتواند در آینده به عنوان عامل ضد میکروبی استفادهشده و تا میزان قابل قبولی رشد باکتریها را کنترل نمود.
سپاسگزاری
این مطالعه ماحصل بخشی از پایاننامه کارشناسی ارشد دانشگاه آزاد اسلامی زنجان بوده بدینوسیله از زحمات مسئولیت محترم مرکز تحقیقات بیولوژی دانشگاه آزاد اسلامی زنجان تشکر و قدردانی به عمل میآید.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Levine MM, Black RE, Lanata C. Precise Estimation of the Numbers of Chronic Carriers of Salmonella Typhi in Santiago, Chile, an Endemic Area. J Infect Dis 1982; 146(6): 724-6.
2- Merselis JG Jr, Kaye D, Connolly CS, Hook EW. Quantitative Bacteriology of the Typhoid Carrier State. Am J Trop Med Hyg 1964; 13: 425- 9.
3- Crump JA, Sjölund-Karlsson M, Gordon MA, Parry CM. Epidemiology, Clinical Presentation, Laboratory Diagnosis, Antimicrobial Resistance, and Antimicrobial Management of Invasive Salmonella Infections. Clin Microbiol Rev 2015; 28(4): 901-37.
4- Parry CM, Hien TT, Dougan G, White NJ, Farrar JJ. Typhoid Fever. N Engl J Med 2002; 347(22): 1770-82.
5- Gebert A, Rothkötter HJ, Pabst R. M Cells in Peyer's Patches of the Intestine. Int Rev Cytol 1996; 167: 91-159.
6- Forbes BA, Sahm DF, Weissfeld AS. Baily and Scott’s Diagnostic Microbiology. 12th ed. Mosby; 2007. p. 323-34.
7- Das Neves PB, Agnelli JA, Kurachi C, de Souza CW. Addition of Silver Nanoparticles to Composite Resin: Effect on Physical and Bactericidal Properties in Vitro. Braz Dent J 2014; 25(2): 141-5.
8- Ranković BR, Kosanić M. Antimicrobial Activities of Different Extracts of Lecanora Atra Lecanora Muralis, Parmelia Saxatilis, Parmelia Sulcata and Parmeliopsis Ambigua. PJB 2012; 44(1): 429-433.
9- Melvin P, James S, April M, Sharon K, Marcelo F, Romney M, Et al. Performance Standards for Antimicrobial Susceptibility Testing. M100, 30th ed. Wayne: Clinical and Laboratory Standards Institute; 2020: 156-170.
10- Nasiri Semnani Sh, Rahnema M, Ghasempour H, Alizadeh H. Evaluation of Antibacterial Effects of Lecanora Muralis SP. Extract on Staphylococcus Aureus and Salmonella Typhimurum in Vitro and in Animal Model. JABS 2014; 4(3): 318-26. [Persian]
11- Alizadeh H, Salouti M, Shapouri R, Abdollazadeh P, Nasseryan J. Antibacterial Effects of Silver Nanoparticles on Brucella Melitensis 16M in an Animal Model in Vitro. J Arak Uni Med Sci 2012; 14(7): 64-70. [Persian]
12- Lara HH, Ayala-Núñez NV, Ixtepan Turrent LD, Rodríguez Padilla C. Bacterisidal Effect of Silver Nanoparticles against Multidrudge-Resistent Bacteria. World journal of microbiology & biotechnology 2010; 26(4): 615-21.
13- Ayala-Nunez NV, Lara Villegas HH, Del Carmen Ixtepan Turrent L, Rodriguez-Padilla C. Silver Nanoparticles Toxicity and Bacterial Effect agaiens Methicillin-Resistant Staphylococcus Aureus: Nanoscale Does Matter. Nanobiotechnol 2009; 5(1): 2-9.
14- Behravan M, Panahi AH, Naghizadeh A, Ziaee M. Mahdavi R, Mirzapour A. (2019). Facile Green Synthesis of Silver Nanoparticles Using Berberis Vulgaris Leaf and Root Aqueous Extract and its Antibacterial Activity. International Journal of Biological Macromolecules 2019; 124: 148-54. [Persian]
15- Seleem MN, Munusamy P, Ranjan A, Alqublan H, Pickrell G, Sriranganathan N. Silica-Antibiotic Hybrid Nanoparticles for Targeting Intracellular Pathogens. Antimicrob Agents Chemother 2009; 53(10): 4270-4.
16- Kora AJ, Arunachalam J. Assessment of Antibactrial Activity of Silver Nanoparticles on Peseudomonas Aeruginosa and its Mechanism of Action. World J Microbiol Biotechnol 2011; 27: 1209-16.
نوع مطالعه: پژوهشي |
موضوع مقاله:
میکروبیولوژی
دریافت: 1401/4/17 | پذیرش: 1401/8/22 | انتشار: 1402/5/15
دریافت: 1401/4/17 | پذیرش: 1401/8/22 | انتشار: 1402/5/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







