دوره 31، شماره 2 - ( اردیبهشت 1402 )
جلد 31 شماره 2 صفحات 6439-6428 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Parandin R, Abbasi F. Antidepressant Effects of Hydroalcoholic Extract of Origanum Vulgare L. Using Adult Male Mice Model of Depression Induced by Reserpine. JSSU 2023; 31 (2) :6428-6439
URL: http://jssu.ssu.ac.ir/article-1-5755-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5755-fa.html
پرندین رحمتالله، عباسی فائزه. بررسی اثرات ضد افسردگی عصاره الکلی مرزنجوش وحشی (Origanum Vulgare L) در موش های سوری نر بالغ تحت مسمومیت با رزرپین. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1402; 31 (2) :6428-6439
متن کامل [PDF 989 kb]
(528 دریافت)
| چکیده (HTML) (1787 مشاهده)
متن کامل: (696 مشاهده)
مقدمه
افسردگی یک اختلال شایع است که در همه جنسها، سنین، در همه زمینههای اجتماعی و حتی در حیوانات رخ میدهد. همینطور افسردگی یک اختلال چند علتی است و با خطر ابتلا به سرطان، زوال عقل، دیابت، صرع و سکته مغزی مرتبط است. این بیماری با خلق افسرده، از دست دادن علاقه، از دست دادن میل و لذت، احساس گناه، تمرکز ضعیف، اعتماد به نفس پایین، اختلالات خواب و افزایش یا کاهش اشتها ظاهر میشود. این مشکلات می¬توانند مزمن یا عودکننده شده و منجر به اختلالات اساسی در توانایی فرد در مراقبت از مسئولیتهای روزمره خود گردد. در بدترین حالت، افسردگی میتواند منجر به خودکشی شود، مرگی غمانگیز که سالانه در حدود 850000 مورد در جهان را به همراه دارد (1). در پاتوفیزیولوژی افسردگی، دلایلی از جمله اختلالات ژنتیکی، ایمونولوژیکی، اختلالات غدد درونریز و نوروژنز و همینطور عوامل محیطی به عنوان مکانیسمهایی که نقش اساسی ایفا میکنند شناسایی شدهاند و گزارش شده که ترکیب و پیوند این عوامل در پاتوژنز افسردگی موثر میباشد. به این معنا که عوامل استرسزای محیطی و عوامل ژنتیکی که از راه پاسخهای ایمونولوژیک و غدد درون ریز عمل میکنند، تغییرات ساختاری و عملکردی را در بسیاری از مناطق مغز آغاز کرده، که منجر به نوروژنز ناکارآمد و اختلال در انتقال عصبی شده، و به صورت مجموعه¬ای از علائم افسردگی بروز میکند (2). گونههای فعال اکسیژن Reactive oxygen species (ROS) (ROS) نقش حیاتی در سیگنالدهی سلولی و دفاع در برابر میکروارگانیسمهای مهاجم دارند. تولید بیش از حد ROS و ضعف سیستم دفاعی آنتی¬اکسیدانی باعث ایجاد سیگنالهای پیش التهابی، آسیب رساندن به ماکرومولکول¬های حیاتی و القای آپوپتوز سلولی میشود. تنظیم حالت ردوکس Redox (کاهش و اکسیداسیون) برای زنده ماندن سلول، فعال شدن، تکثیر و عملکرد اندام حیاتی است. تغییر پاتولوژیک در این تعادل منجر به افزایش غلظت ROS می شود که منجر به تغییرات نامطلوب در اجزای سلولی مانند لیپیدها، پروتئینها و DNA می شود. در بین اندامهای بدن، مغز در برابر استرس اکسیداتیو آسیبپذیرتر است، زیرا مغز دارای مصرف اکسیژن بیشتر، محتوای لیپید بالاتر و دفاع آنتیاکسیدانی ضعیفتر است. استرس اکسیداتیو عامل اصلی تخریب سیستم عصبی است و دخالت آن در پاتوژنز افسردگی به صراحت ثابت شده است. افسردگی با کاهش غلظت آنتیاکسیدانها در مغز و پلاسما همراه است. بنابراین هدف قرار دادن این تغییرات با آنتیاکسیدانهای مناسب میتواند یک استراتژی موثر برای درمان افسردگی باشد (3). استفاده از داروهای شیمیایی ضدافسردگی به عنوان عوامل درمانی با علائمی مانند تأخیر در شروع اثر، عوارض جانبی، تداخلات دارویی و غذایی، اختلال عملکرد جنسی، مسمومیت قلبی و غیره همراه هستند. بنابراین جستجو برای کشف گزینههای درمانی جدید با اثرات درمانی کاملتر و عوارض جانبی کمتر پیوسته ادامه دارد. گیاهان دارویی از دیرباز در کشف استراتژیها و ترکیبات درمانی جدید با نقشهای امیدوارکننده در درمان بیماریهای مختلف مورد استفاده قرار گرفتهاند. در سراسر جهان، استفاده از گیاهان دارویی جهت درمان افسردگی و سایر اختلالات روانپزشکی افزایش یافته است. گیاهان دارویی در اشکال طبیعی خود با ارزش هستند، زیرا سرشار از ترکیبات فیتوشیمیایی مختلف میباشند. این ترکیبات فیتوشیمیایی، نقشهای دارویی متعددی در درمان بیماریهای مختلف دارند، به طور گسترده در طبیعت در دسترس بوده و از نظر تجاری سودمند هستند. با این حال پتانسیل عظیم خواص ضدافسردگی ترکیبات گیاهی هنوز شناسایی نشده و نیاز به بررسیهای بیشتر دارند (4). مرزنجوش وحشی با نام علمی Origanum vulgare L. گیاهی متعلق به تیره نعناعیان است که دارای قدمت طولانی در استفاده از آن به عنوان غذا و به عنوان یک گیاه دارویی میباشد. مرزنجوش وحشی گیاهی چند ساله (تا ارتفاع 80 سانتیمتر) است با برگهای معطر، بیضی تیره و گلهای سفید، صورتی یا بنفش که به صورت خوشه تشکیل میشوند. در زمآنهای قدیم، مرزنجوش وحشی نماد شادی بوده و برای مبارزه با غم و اندوه و برای خوششانسی دارای کاربرد بوده است. در مصر باستان، از مرزنجوش وحشی به عنوان پادزهر سم استفاده میشده و یونانیان از این گیاه برای درمان تحریکات و عفونتهای پوستی، آبریزش بینی و تشنج و به عنوان یک پادزهر عالی برای سموم استفاده کردهاند (6،5). این گیاه از لحاظ پزشکی سرشار از روغن های اساسی، فلانوئیدها، تاننها و گلیکوزیدها، استرولها، ویتامینها و ترکیبات ترپنوئیدی میباشد. یافتههای علمی نشان میدهند که این گیاه وحشی دارای فعالیت آنتیاکسیدان، ضدمیکروبی، اثرات ضد التهابی و کاهنده قندی، ضد سرطانی، محافظت نورونی و آرامبخشی است. مطالعات مختلفی در مورد اثرات زیستی، دارویی و تجزیه ترکیبات مرزنجوش انجام گرفته و اثرات سودمند آن در درمان برخی بیماریها مانند درمان گرفتگی عضلات، التهاب و درد گزارش شده است. در طب سنتی نیز از مرزنجوش برای آرامش اعصاب و رفع بیحوصلگی، درمان افسردگی و سر درد استفاده شده است (6،5). بنابراین با توجه به مطالب ذکر شده، در تحقیـق حاضر، اثرات آنتیاکسیدانی و محافظتی تجـویز عصاره الکلی برگ و ساقه مرزنجوش وحشی بـر افسردگی در موشهای سوری نر بالغ تحت مسمومیت با رزرپین در مدل اسـترس شـنای اجبـاری بررسی گردید.
روش بررسی
تهیه عصاره: گیاه (کد هرباریوم: 1-1400) در فصل بهار از مناطق کوهستانی استان کرمانشاه جمعآوری شد. نمونهها پس از تایید توسط گیاه شناس در سایه خشک شد. برگ و ساقه خشک شده آسیاب شده و بصورت پودر درآمد. حدود 1 کیلوگرم از پودر بهدست آمده در کلروفرم و متانول با نسبت 70:30 به مدت یک شبانه روز خیس شد. مخلوط بهدست آمده در دستگاه تقطیر و تحت فشار خلاء حلال زدایی گردید. عصاره بهدست آمده در متانول داغ حل شده و سپس در دمای 18- نگهداری شد و در ادامه عصاره خام را صاف کرده و جهت آبگیری در دی کلرومتان حل کرده و با سولفات منیزیم خشک گردید و در نهایت در دستگاه تقطیر تحت خلاء حلال زدایی شد تا عصاره خالص بهدست آید (7). حیوانات و تیمارها: در این مطالعه تجربی، 42 سر موش سوری نر از نژاد BALB/c با وزن تقریبی 28-24 گرم از مرکز پرورش حیوانات آزمایشگاهی دانشکده پزشکی کرمانشاه تهیه شد و برای مدت یک هفته در محیط سازگاری پیدا کردند. در طول مدت انجام آزمایش موشها در شرایط 12 ساعت روشنایی و 12 ساعت تاریکی، دمای 24-22 درجه سانتیگراد و میزان رطوبت 55-50 درصد، در قفسهای پلاستیکی نگهداری شدند. در این مدت، غذا و آب کافی در اختیار آنها قرار گرفت. موشها بهطور تصادفی به 6 گروه 7 تایی تقسیم شدند. گروه اول (کنترل) که نرمال سالین (1 میلیگرم بر کیلوگرم) را به صورت تک دوز داخل صفاقی دریافت کردند. گروه دوم (کنترل منفی) که رزرپین (5 میلیگرم بر کیلوگرم) را در 18 ساعت قبل از آغاز آزمون رفتاری دریافت کردند. گروه سوم (کنترل مثبت) که رزرپین (5 میلیگرم بر کیلوگرم) را دریافت و 18 ساعت بعد از آن فلوکستین (20 میلیگرم بر کیلوگرم) را به روش تک دوز داخل صفاقی دریافت کردند. گروههای چهارم، پنجم و ششم که رزرپین (5 میلیگرم بر کیلوگرم) را دریافت و 18 ساعت بعد نیز به ترتیب تحت درمان با دوزهای 100، 200 و 400 میلیگرم بر کیلوگرم عصاره الکلی برگ مرزنجوش به صورت تزریق داخل صفاقی قرار گرفتند. دوزهای عصاره بر اساس مطالعات قبلی انتخاب شدند (7،8).
آزمون شنای اجباری: یک ساعت بعد از تزریق فلوکستین و عصارهها این آزمون انجام گرفت. برای انجام این آزمون، در یک آکواریوم شیشهای با طول 25 سانتیمتر، ارتفاع 8 سانتیمتر و با عرض 12 سانتیمتر از آب لولهکشی شهری با دمای 25 درجه سانتیگراد پر شد. سپس موشها به آرامی از ارتفاع حدوداً 20 سانتیمتری در آب رها میشدند. بهطور قراردادی قطع حرکات دست و پای حیوان به عنوان زمان بیحرکتی ثبت گردید. کل زمان آزمون شنا 6 دقیقه بود که دو دقیقه ابتدائی برای تطابق حیوان با شرایط محیط لحاظ شد و در 4 دقیقه دیگر مدت زمان بیحرکتی و مدت زمان شنا کردن با استفاده از کورنومتر بر حسب ثانیه ثبت شد (9،10). پس از اتمام آزمونهای رفتاری، موش ها با کلروفرم بیهوش شده و خون از بطن چپ قلب جمعآوری گردید. سپس بلافاصله سر موشها را قطع کرده و پس از برداشتن جمجمه، مغز موشها به آرامی از درون جمجمه خارج گردید. نمونههای خون نیز سانتریفیوژ شده و سرم خون و مغزها در دمای 20- درجه سانتیگراد تا زمان انجام آزمایشات بیوشیمیایی نگهداری شدند (11).
بررسی ظرفیت آنتیاکسیدانی سرم و مغز: محلول کار با مخلوط کردن سه محلول (۱۰ میلیلیتر محلول شماره ۱، ۱ میلیلیتر محلول شماره ۲ و ۱ میلیلیتر محلول شماره ۳) تهیه شد. محلول شماره 1 از ترکیب 1/55 میلیلیتر استات سدیم و ۸ میلیلیتر اسید استیک غلیظ که با آب مقطر به حجم ۵۰۰ میلیلیتر رسانده شد به دست آمد. محلول شماره 2 شامل 270 میلیگرم کلرید آهن (III) که با آب مقطر به حجم 50 میلیلیتر رسید. محلول سوم از حل کردن ۴۷ میلیگرم تریآزین در ۴۰ میلیلیتر اسید کلریدریک ۴۰ میلیمولار بهدست آمد برای سرم 25 میکرولیتر از نمونه سرم به 1/5 میلیلیتر از محلول کار اضافه شد. برای مغز نیز بافت مغز همگن شده و با سرعت g1000 در 10 دقیقه سانتریفیوژ شد و به 1/5 میلیلیتر محلول کار اضافه شد و ۱۰ دقیقه در دمای ۳۷ درجه سانتیگراد قرار داده شد. سپس جذب نوری در طولموج ۵۹۳ ثبت شد (13-11).
اندازهگیری سطح سرمی مالوندیآلدهید (MDA): به طور خلاصه، مقدار نیم گرم تیوباربیتوریک اسید با ۸۰ میلیلیتر از اسید استیک 20 درصد مخلوط گردید و ورتکس شده و در ادامه حدود یک ساعت در بن ماری قرار گرفت. بعد از سرد شدن در دمای 0 درجه سانتی¬گراد، مقدار 250 میکرولیتر n-بوتانول به مخلوط اضافه شد و مجددا ورتکس شده و با سرعت 14000 دور در دقیقه به مدت 5 دقیقه سانتریفیوژ گردید. در نهایت با دستگاه اسپکتروفتومتر در 523 نانومتر جذب نوری آن ثبت شد (13،11).
اندازهگیری مالون دیآلدهید مغز: به این منظور، 1 گرم از بافت مغز (نواحی هیپوکمپ و کورتکی فرونتال) در محلول کلرید پتاسیم 2/5 درصد به نسبت وزنی 10 درصد (وزنی-حجمی) هموژنیزه شد و در دمای حدود 37 درجه سانتیگراد در یک شیکر به مدت یک ساعت انکوبه شد. پس از آن 1 میلیلیتر تتراکلرواستیک اسید 5 درصد به همراه 1 میلیلیتر تیوباربیتوریک اسید 67 درصد به آن اضافه شد و به خوبی مخلوط شد. سپس به لوله سانتریفوژ منتقل شده و در دور 2000 به مدت 15 دقیقه سانتریفوژ شد. پس از آن محلول رویی به لوله دیگری منتقل شده و برای مدت 10 دقیقه در حمام آب جوش قرار گرفت و پس از سرد شدن با دستگاه اسپکتروفتومتر در 535 نانومتر جذب نوری آن ثبت شد (14).
تجزیه و تحلیل آماری
تمام دادهها به صورت میانگین ± انحراف معیار بیان شدند. جهت نرمال بودن دادهها از آزمون کولموگروف اسمیرنوف استفاده شد. همه دادهها دارای مقادیر P بیشتر از 0/05 بودند که نشان دهنده توزیع نرمال دادهها بود. دادهها با استفاده از نرمافزارversion 16 SPSS آنالیز شد. برای مقایسه میانگین بین گروههای آزمایشی از ANOVA یک طرفه و آزمون توکی استفاده شد. 0/05≥p از نظر آماری معنیدار در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق در پژوهش دانشگاه پیام نور مورد تایید قرار گرفته است (کد اخلاق: IR.PNU.REC.1400.273)
نتایج
نتایج آزمون شنای اجباری: همانطور که در نمودار 1-الف مشاهده میگردد، مدت زمان بیحرکتی در گروههای کنترل منفی (0/001>p)، کنترل مثبت (0/05≥p) و عصاره مرزنجوش وحشی با غلظتهای 100 (0/001≥p) و 200 میلیگرم بر کیلوگرم (0/001≥p) در مقایسه با گروه کنترل بطور معناداری افزایش یافتند و تجویز فلوکستین (0/001≥p) و عصاره مرزنجوش وحشی در غلظتهای 200 (0/001≥p) و 400 (0/001≥p) میلیگرم بر کیلوگرم، مدتزمان بیحرکتی را بهطور معنیداری نسبت به گروه کنترل منفی کاهش دادند. در رابطه با همین آزمون در نمودار 1-ب مشاهده می¬گردد، مدت¬زمان شنا کردن در گروه¬های کنترل منفی (0/001≥p) و عصاره مرزنجوش وحشی با غلظت¬های 100 (0/001≥ p)، 200 (0/001≥p) و 400 (0/01≥ p) میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بهطور معناداری کاهش یافتند و تجویز فلوکستین (0/001≥p) و عصاره مذکور در غلظتهای 200 (0/001≥p) و 400 (0/001≥p) میلیگرم بر کیلوگرم، مدتزمان شنا کردن را بهطور معناداری نسبت به گروه کنترل منفی افزایش دادند.
نتایج اندازهگیری ظرفیت آنتیاکسیدانی سرم و مغز: همانطور که در نمودار 2-الف مشاهده میگردد، سطح آنتیاکسیدانی سرم در گروه¬های کنترل منفی و عصاره مرزنجوش وحشی با غلظت های100 و عصاره با غلظت 200 میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بهطور معناداری (0/001≥p) کاهش یافتند و تجویز فلوکستین و عصاره مرزنجوش وحشی با غلظت 400 میلیگرم بر کیلوگرم، سطح آنتیاکسیدانی سرم را بهطور معناداری (0/001≥ p) نسبت به گروه کنترل منفی افزایش دادند. در همین آزمون در نمودار 2-ب مشاهده می¬گردد، سطح آنتی¬اکسیدانی مغز در گروه¬های کنترل منفی و عصاره مرزنجوش وحشی با غلظت 100 میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بطور معناداری (0/001≥p) کاهش یافتند و تجویز فلوکستین (0/001≥p) و عصاره مرزنجوش وحشی در غلظتهای 200 (0/01≥p) و 400 (0/001≥p) میلیگرم بر کیلوگرم، سطح آنتی¬اکسیدانی مغز را بهطور معناداری نسبت به گروه کنترل منفی افزایش دادند.
نتایج سنجش مالون دیآلدئید سرم و مغز: همانطور که در نمودار 3-الف مشاهده میگردد، سطح مالون دیآلدئید خون در گروههای کنترل منفی (0/001≥p) و عصاره مورد استفاده با غلظتهای 100 (0/001≥p) و 200 (0/01≥p) در مقایسه با گروه کنترل بهطور معناداری افزایش یافتند و تجویز فلوکستین و عصاره مرزنجوش وحشی در غلظتهای 200 و 400 میلیگرم بر کیلوگرم، سطح مالون دی¬آلدئید خون را بهطور معناداری (0/001≥p) نسبت به گروه کنترل منفی کاهش دادند. در این آزمون در نمودار 3-ب مشاهده میگردد، سطح مالون دی¬آلدئید مغز در گروه¬های کنترل منفی و عصاره مرزنجوش وحشی با غلظت 100 میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بهطور معناداری (0/001≥p) افزایش یافتند و تجویز فلوکستین و عصاره در غلظتهای 200 و 400 میلیگرم بر کیلوگرم، سطح مالون دی¬آلدئید مغز را بهطور معناداری (0/001≥ (p نسبت به گروه کنترل منفی افزایش دادند.
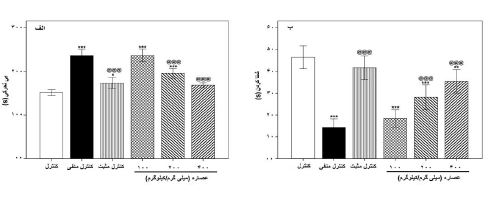
نمودار 1: اثر دوزهای مختلف عصاره الکلی مرزنجوش، رزرپین (کنترل منفی) و فلوکستین (کنترل مثبت) بر رفتار بیحرکتی (الف) و شناکردن (ب) در آزمون شنای اجباری موشهای کوچک آزمایشگاهی نر.
(p<0/05)، (p<0/01) و (p<0/001) نشاندهنده اختلاف معنادار با گروه کنترل. @@@ (0/001>p) نشاندهنده اختلاف معنادار با گروه کنترل منفی.
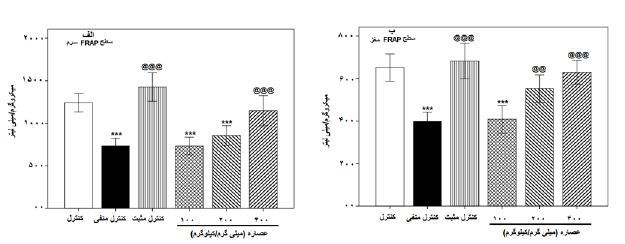
نمودار 2: اثر دوزهای مختلف عصاره الکلی مرزنجوش، رزرپین (کنترل منفی) و فلوکستین (کنترل مثبت) بر سطح آنتی اکسیدانی سرم (الف) و سطح آنتیاکسیدانی مغز (ب) در موش¬های کوچک آزمایشگاهی نر.
(p<0/001) نشاندهنده اختلاف معنادار با گروه کنترل. @@ (0/01>p) و @@@ (0/001>p) نشاندهنده اختلاف معنادار با گروه کنترل منفی.
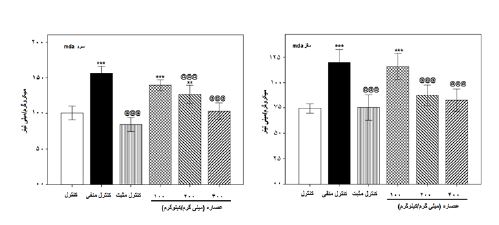
نمودار 3: اثر دوزهای مختلف عصاره الکلی مرزنجوش، رزرپین (کنترل منفی) و فلوکستین (کنترل مثبت) بر سطح مالون دی آلدئید خون (الف) و سطح مالون دی آلدئید مغز (ب) در موشهای کوچک آزمایشگاهی نر.
(p<0/01) و (p<0/001) نشاندهنده اختلاف معنادار با گروه کنترل. @@@ (0/001>p) نشاندهنده اختلاف معنادار با گروه کنترل منفی.
بحث
یافتههای حاصل از این مطالعه نشان داد که عصاره الکلی مرزنجوش وحشی در غلظتهای 200 و 400 میلیگرم برکیلوگرم وزن بدن دارای اثرات ضد افسردگی در موش¬های تحت مسمومیت با رزرپین میباشد. در این مطالعه، تیمار با فلوکستین و عصاره الکلی مرزنجوش با غلظتهای200 و 400 میلیگرم برکیلوگرم موجب افزایش مدت زمان بی¬حرکتی و شنا کردن در موشهای تحت مسمومیت با رزرپین گردید. در همین راستا در تحقیقات دیگری یافتههای مشابهی از عصاره میوه نسترن کوهی (14)، شبدر قرمز (9)، اسانس بومادران (15)، اسانس اسطوخودوس و بهار نارنج (16) و بادرنجوبه (17) گزارش شده است. رزرپین یک آلکالوئید مشتق از گیاه راولفیا سرپنتینا Rauvolfia serpentina گیاهی از خانواده خرزهره Apocynaceae است و همانند یک مهارکننده بازجذب مونوآمینی عمل مینماید که با تخلیه مونوآمینها در مغز، قادر به القای علائم افسردگی در جوندگان آزمایشگاهی میباشد. به همین دلیل از رزرپین بعنوان یک مدل پیشرفته در القای افسردگی در مطالعات جوندگان آزمایشگاهی استفاده میگردد (18). در این مطالعه، القای افسردگی توسط رزرپین موجب کاهش معنادار ظرفیت آنتیاکسیدانی و افزایش معنادار سطح مالون دیآلدئید سرم و مغز شد. تجویز عصاره الکلی مرزنجوش در غلظتهای 200 و 400 میلیگرم برکیلوگرم نیز مشابه با داروی فلوکستین در گروه کنترل مثبت موجب افزایش معنادار ظرفیت آنتیاکسیدانی و کاهش سطح مالون دیآلدئید بهعنوان یک نشانگر پراکسیداسیون لیپیدی در سرم و مغز موشهای رزرپینه شد. در برخی مطالعات قبلی رزرپین موجب کاهش ظرفیت آنتیاکسیدانی و افزایش آنزیمهای اکسیدانی شده است (12،15). در مطالعهای تزریق رزرپین با افزایش پراکسیداسیون لیپیدی و کاهش آنزیمهای آنتی-اکسیدان از جمله سوپراکسیداز دیسموتاز (SOD)، کاتالاز (CAT) و گلوتاتیون ردوکتاز (GSH) موجب القای استرس اکسیداسیون در مغز موشهای سوری شد (19). در مطالعات دیگری تزریق رزرپین علاوه بر افزایش مدت زمان بیحرکی در تست شنای اجباری و القای افسردگی موجب افزایش مالون دیآلدئید در مغز موشها شده است (15،12). در یک مطالعه انسانی نیز مشاهده شده که بیماران دچار افسردگی، دارای سطح پراکسیداسیون لیپیدی بیشتر و ظرفیت آنتی اکسیدانی کمتری در مقایسه با افراد سالم میباشند (20). مرزنجـوش یک گیاه غنی از انواع مختلفی از آنتیاکسیدآنهای قوی است که می¬تواند فعالیـت رادیکـالهـای آزاد را خنثی کرده و بر فعالیت نوروترانسمیترهای مغز اثرات تعدیلی داشته باشد. در بررسی خواص فارماکولوژیـک مرزنجـوش ترکیبـات فنلـی بـه خـصوص اسیدهای فنلی و فلاونوییدها به عنـوان عوامـل مـوثر احتمـالی مطـرح شدهاند (23-21). گزارشات پیشین نشان دادهاند که گیاه مرزنجوش غنی از روغنهای اساسی می-باشد که ترکیبات عمده آن شامل کارواکرول، تیمول، لینالول، آلفا تیوژن، آلفا پینن، اکتانون، ترپنین و پیسیمن است که همه این ترکیبات پتانسیل آنتیاکسیدانی قابلتوجهی دارند. بهعلاوه مرزنجوش حاوی مقادیر مهمی از پلیفنولها (فلاونوئیدها و اسیدهای فنولیک)، تریپرپنوئیدها و استرولها میباشد که این ترکیبات نیز قابلیت های آنتیاکسیدانی بالایی دارند (25،24). پژوهشها نشان داده اند که کارواکرول و تیمول مشابه مولکولهای ریز و چربی دوست بوده که قادرند به سهولت از سد خونیمغزی عبور کرده و بر سلول¬های نواحی متفاوت مغز تاثیر میگذارند (28-26). همینطور گزارش شده که کارواکرول و تیمول در شرایط محیط زنده و آزمایشگاهی بهطور موثری قادر به خنثی کردن فعالیت رادیکال¬های آزاد مختلف میباشند (30-28). Melo و همکاران با انجام تست شنای اجباری و آزمون معلق ماندن دم نشان دادند که تزریق کارواکرول به موشها دارای اثرات ضد افسردگی می¬باشد که این اثرات را احتمالاً از راه افزایش سطح دوپامین مغز انجام میدهد (29). بهعلاوه Yu و همکاران نیز نشان دادند که تجویز کارواکرول پس از القاء ایسکمی- ریپرفیوژن مغزی در موشها موجب بهبود آزمون¬های رفتاری و کاهش مرگ و میر نورونها شده و نکروز و آپوپتوز نورونی را به شدت کاهش میدهد، بنابراین کارواکرول به عنوان یک آنتی آپوپتوز قوی نیز معرفی شده است (31). در مطالعات دیگری اثرات ضدافسردگی تیمول در آزمونهای رفتاری شنای اجباری و معلق ماندن دم در موشها نشان داده شده و بیان شده که ممکن است تیمول این اثرات را از راه تعدیل برخی نوروترانسمیترها از جمله سروتونین و مونوآمینها و مهار پیش التهابی سیتوکینهایی مثل اینترلوکین 1 و 6 و فاکتور نکروز تومورTumor necrosis factor (TNF) (TNF) انجام دهد (33،32). لینالول و بتا پینن نیز دو مونوترپن فرار هستند که به مقدار قابلتوجهی در مرزنجوش یافت میشوند (24). نتایج تحقیقی از Guzmán-Gutiérrez و همکاران نشان میدهد که لینالول و بتا پینن از طریق تعامل با سیستم مونوآمینرژیک پتانسیل اثر ضد افسردگی را دارند (34). در تحقیق دیگری نشان داده شد که اسانس گیاه برگ بوی مکزیکی (Litsea glaucescens) دارای اثرات ضدافسردگی میباشد، که این اثرات به بتا پینن و لینالول به عنوان عناصر فعال گیاه نسبت داده شد (35). از دیگر ترکیبات موجو در مرزنجوش فلاونوئیدها میباشد (24). Hritcu و همکاران گزارش کردند که استرس اکسیداتیو بهطور واضح با پیشرفت افسردگی مرتبط است، دادههای این گزارش نشان میدهد که استفاده از فلاونوئیدها میتواند به کاهش علائم افسردگی کمک کند (36). با کمک تکنیک HPLC نشان داده شده از جمله ترکیبات فنولیک، که به مقدار فراوانی در مرزنجوش وجود دارد کلوروژنیک اسید، رزمارینیک اسید و روتین می باشند (25). Wu و همکاران نشان دادند که کلوروژنیک اسید مشتق از گیاه Eucommia ulmoides Oliver که یک گیاه در طب سنتی چین میباشد دارای اثرات ضد افسردگی میباشد که احتمالاً این اثرات را از طریق تعامل با سیستم سروتونین بروز می دهد (37). Kondo و همکاران گزارش کردند که رزمارینیک اسید دارای اثرات ضدافسردگی میباشد که این اثرات را احتمالاً از طریق تعدیل mitogen-activated protein kinase phosphatase-1MKP-1، brain-derived neurotrophic factor BDNF و تعدیل سیستم دوپامین و سنتز کورتیکواسترونها انجام میدهد (38). نتایج تحقیق دیگری نشان داد که اثر ضدافسردگی عصاره اتانولی گیاه فلفل پروئی (Schinus molle L) در آزمایش معلق ماندن دم در موش ممکن است وابسته به حضور روتین باشد که احتمالاً اثر ضد افسردگی خود را با افزایش حضور سروتونین و نورآدرنالین در فضای سیناپس اعمال میکند (39).
نتیجهگیری
در مجموع میتوان گفت که مرزنجوش به دلیل داشتن مقادیر قابلتوجهی از عناصر فعال گیاهی مثل روغن¬های اساسی و پلیفنولها دارای اثرات مفیدی بر کاهش افسردگی می¬باشد و احتمالا این اثرات را از راه فعالیت آنتیاکسیدانی و همینطور تعدیل در ترشح نوروترانسمیترهای دخیل در فرآیند افسردگی اعمال میکند. در این زمینه، مطالعات بیشتری بهویژه در مورد عناصر فعال این گیاه برای مشخص شدن مکانیسم دقیق این کار لازم است.
سپاسگزاری
از تمام کسانی که در انجام این تحقیق همکاری نمودهاند کمال تشکر و قدردانی به عمل می¬آید. این مطالعه بخشی از طرح تحقیقاتی (214/س.ک) میباشد که با حمایت حوزه معاونت پژوهشی دانشگاه پیام نور استان کرمانشاه انجام شده است.
حامی مالی: سازمان مرکزی دانشگاه پیام نور
تعارض در منافع: وجود ندارد.
افسردگی یک اختلال شایع است که در همه جنسها، سنین، در همه زمینههای اجتماعی و حتی در حیوانات رخ میدهد. همینطور افسردگی یک اختلال چند علتی است و با خطر ابتلا به سرطان، زوال عقل، دیابت، صرع و سکته مغزی مرتبط است. این بیماری با خلق افسرده، از دست دادن علاقه، از دست دادن میل و لذت، احساس گناه، تمرکز ضعیف، اعتماد به نفس پایین، اختلالات خواب و افزایش یا کاهش اشتها ظاهر میشود. این مشکلات می¬توانند مزمن یا عودکننده شده و منجر به اختلالات اساسی در توانایی فرد در مراقبت از مسئولیتهای روزمره خود گردد. در بدترین حالت، افسردگی میتواند منجر به خودکشی شود، مرگی غمانگیز که سالانه در حدود 850000 مورد در جهان را به همراه دارد (1). در پاتوفیزیولوژی افسردگی، دلایلی از جمله اختلالات ژنتیکی، ایمونولوژیکی، اختلالات غدد درونریز و نوروژنز و همینطور عوامل محیطی به عنوان مکانیسمهایی که نقش اساسی ایفا میکنند شناسایی شدهاند و گزارش شده که ترکیب و پیوند این عوامل در پاتوژنز افسردگی موثر میباشد. به این معنا که عوامل استرسزای محیطی و عوامل ژنتیکی که از راه پاسخهای ایمونولوژیک و غدد درون ریز عمل میکنند، تغییرات ساختاری و عملکردی را در بسیاری از مناطق مغز آغاز کرده، که منجر به نوروژنز ناکارآمد و اختلال در انتقال عصبی شده، و به صورت مجموعه¬ای از علائم افسردگی بروز میکند (2). گونههای فعال اکسیژن Reactive oxygen species (ROS) (ROS) نقش حیاتی در سیگنالدهی سلولی و دفاع در برابر میکروارگانیسمهای مهاجم دارند. تولید بیش از حد ROS و ضعف سیستم دفاعی آنتی¬اکسیدانی باعث ایجاد سیگنالهای پیش التهابی، آسیب رساندن به ماکرومولکول¬های حیاتی و القای آپوپتوز سلولی میشود. تنظیم حالت ردوکس Redox (کاهش و اکسیداسیون) برای زنده ماندن سلول، فعال شدن، تکثیر و عملکرد اندام حیاتی است. تغییر پاتولوژیک در این تعادل منجر به افزایش غلظت ROS می شود که منجر به تغییرات نامطلوب در اجزای سلولی مانند لیپیدها، پروتئینها و DNA می شود. در بین اندامهای بدن، مغز در برابر استرس اکسیداتیو آسیبپذیرتر است، زیرا مغز دارای مصرف اکسیژن بیشتر، محتوای لیپید بالاتر و دفاع آنتیاکسیدانی ضعیفتر است. استرس اکسیداتیو عامل اصلی تخریب سیستم عصبی است و دخالت آن در پاتوژنز افسردگی به صراحت ثابت شده است. افسردگی با کاهش غلظت آنتیاکسیدانها در مغز و پلاسما همراه است. بنابراین هدف قرار دادن این تغییرات با آنتیاکسیدانهای مناسب میتواند یک استراتژی موثر برای درمان افسردگی باشد (3). استفاده از داروهای شیمیایی ضدافسردگی به عنوان عوامل درمانی با علائمی مانند تأخیر در شروع اثر، عوارض جانبی، تداخلات دارویی و غذایی، اختلال عملکرد جنسی، مسمومیت قلبی و غیره همراه هستند. بنابراین جستجو برای کشف گزینههای درمانی جدید با اثرات درمانی کاملتر و عوارض جانبی کمتر پیوسته ادامه دارد. گیاهان دارویی از دیرباز در کشف استراتژیها و ترکیبات درمانی جدید با نقشهای امیدوارکننده در درمان بیماریهای مختلف مورد استفاده قرار گرفتهاند. در سراسر جهان، استفاده از گیاهان دارویی جهت درمان افسردگی و سایر اختلالات روانپزشکی افزایش یافته است. گیاهان دارویی در اشکال طبیعی خود با ارزش هستند، زیرا سرشار از ترکیبات فیتوشیمیایی مختلف میباشند. این ترکیبات فیتوشیمیایی، نقشهای دارویی متعددی در درمان بیماریهای مختلف دارند، به طور گسترده در طبیعت در دسترس بوده و از نظر تجاری سودمند هستند. با این حال پتانسیل عظیم خواص ضدافسردگی ترکیبات گیاهی هنوز شناسایی نشده و نیاز به بررسیهای بیشتر دارند (4). مرزنجوش وحشی با نام علمی Origanum vulgare L. گیاهی متعلق به تیره نعناعیان است که دارای قدمت طولانی در استفاده از آن به عنوان غذا و به عنوان یک گیاه دارویی میباشد. مرزنجوش وحشی گیاهی چند ساله (تا ارتفاع 80 سانتیمتر) است با برگهای معطر، بیضی تیره و گلهای سفید، صورتی یا بنفش که به صورت خوشه تشکیل میشوند. در زمآنهای قدیم، مرزنجوش وحشی نماد شادی بوده و برای مبارزه با غم و اندوه و برای خوششانسی دارای کاربرد بوده است. در مصر باستان، از مرزنجوش وحشی به عنوان پادزهر سم استفاده میشده و یونانیان از این گیاه برای درمان تحریکات و عفونتهای پوستی، آبریزش بینی و تشنج و به عنوان یک پادزهر عالی برای سموم استفاده کردهاند (6،5). این گیاه از لحاظ پزشکی سرشار از روغن های اساسی، فلانوئیدها، تاننها و گلیکوزیدها، استرولها، ویتامینها و ترکیبات ترپنوئیدی میباشد. یافتههای علمی نشان میدهند که این گیاه وحشی دارای فعالیت آنتیاکسیدان، ضدمیکروبی، اثرات ضد التهابی و کاهنده قندی، ضد سرطانی، محافظت نورونی و آرامبخشی است. مطالعات مختلفی در مورد اثرات زیستی، دارویی و تجزیه ترکیبات مرزنجوش انجام گرفته و اثرات سودمند آن در درمان برخی بیماریها مانند درمان گرفتگی عضلات، التهاب و درد گزارش شده است. در طب سنتی نیز از مرزنجوش برای آرامش اعصاب و رفع بیحوصلگی، درمان افسردگی و سر درد استفاده شده است (6،5). بنابراین با توجه به مطالب ذکر شده، در تحقیـق حاضر، اثرات آنتیاکسیدانی و محافظتی تجـویز عصاره الکلی برگ و ساقه مرزنجوش وحشی بـر افسردگی در موشهای سوری نر بالغ تحت مسمومیت با رزرپین در مدل اسـترس شـنای اجبـاری بررسی گردید.
روش بررسی
تهیه عصاره: گیاه (کد هرباریوم: 1-1400) در فصل بهار از مناطق کوهستانی استان کرمانشاه جمعآوری شد. نمونهها پس از تایید توسط گیاه شناس در سایه خشک شد. برگ و ساقه خشک شده آسیاب شده و بصورت پودر درآمد. حدود 1 کیلوگرم از پودر بهدست آمده در کلروفرم و متانول با نسبت 70:30 به مدت یک شبانه روز خیس شد. مخلوط بهدست آمده در دستگاه تقطیر و تحت فشار خلاء حلال زدایی گردید. عصاره بهدست آمده در متانول داغ حل شده و سپس در دمای 18- نگهداری شد و در ادامه عصاره خام را صاف کرده و جهت آبگیری در دی کلرومتان حل کرده و با سولفات منیزیم خشک گردید و در نهایت در دستگاه تقطیر تحت خلاء حلال زدایی شد تا عصاره خالص بهدست آید (7). حیوانات و تیمارها: در این مطالعه تجربی، 42 سر موش سوری نر از نژاد BALB/c با وزن تقریبی 28-24 گرم از مرکز پرورش حیوانات آزمایشگاهی دانشکده پزشکی کرمانشاه تهیه شد و برای مدت یک هفته در محیط سازگاری پیدا کردند. در طول مدت انجام آزمایش موشها در شرایط 12 ساعت روشنایی و 12 ساعت تاریکی، دمای 24-22 درجه سانتیگراد و میزان رطوبت 55-50 درصد، در قفسهای پلاستیکی نگهداری شدند. در این مدت، غذا و آب کافی در اختیار آنها قرار گرفت. موشها بهطور تصادفی به 6 گروه 7 تایی تقسیم شدند. گروه اول (کنترل) که نرمال سالین (1 میلیگرم بر کیلوگرم) را به صورت تک دوز داخل صفاقی دریافت کردند. گروه دوم (کنترل منفی) که رزرپین (5 میلیگرم بر کیلوگرم) را در 18 ساعت قبل از آغاز آزمون رفتاری دریافت کردند. گروه سوم (کنترل مثبت) که رزرپین (5 میلیگرم بر کیلوگرم) را دریافت و 18 ساعت بعد از آن فلوکستین (20 میلیگرم بر کیلوگرم) را به روش تک دوز داخل صفاقی دریافت کردند. گروههای چهارم، پنجم و ششم که رزرپین (5 میلیگرم بر کیلوگرم) را دریافت و 18 ساعت بعد نیز به ترتیب تحت درمان با دوزهای 100، 200 و 400 میلیگرم بر کیلوگرم عصاره الکلی برگ مرزنجوش به صورت تزریق داخل صفاقی قرار گرفتند. دوزهای عصاره بر اساس مطالعات قبلی انتخاب شدند (7،8).
آزمون شنای اجباری: یک ساعت بعد از تزریق فلوکستین و عصارهها این آزمون انجام گرفت. برای انجام این آزمون، در یک آکواریوم شیشهای با طول 25 سانتیمتر، ارتفاع 8 سانتیمتر و با عرض 12 سانتیمتر از آب لولهکشی شهری با دمای 25 درجه سانتیگراد پر شد. سپس موشها به آرامی از ارتفاع حدوداً 20 سانتیمتری در آب رها میشدند. بهطور قراردادی قطع حرکات دست و پای حیوان به عنوان زمان بیحرکتی ثبت گردید. کل زمان آزمون شنا 6 دقیقه بود که دو دقیقه ابتدائی برای تطابق حیوان با شرایط محیط لحاظ شد و در 4 دقیقه دیگر مدت زمان بیحرکتی و مدت زمان شنا کردن با استفاده از کورنومتر بر حسب ثانیه ثبت شد (9،10). پس از اتمام آزمونهای رفتاری، موش ها با کلروفرم بیهوش شده و خون از بطن چپ قلب جمعآوری گردید. سپس بلافاصله سر موشها را قطع کرده و پس از برداشتن جمجمه، مغز موشها به آرامی از درون جمجمه خارج گردید. نمونههای خون نیز سانتریفیوژ شده و سرم خون و مغزها در دمای 20- درجه سانتیگراد تا زمان انجام آزمایشات بیوشیمیایی نگهداری شدند (11).
بررسی ظرفیت آنتیاکسیدانی سرم و مغز: محلول کار با مخلوط کردن سه محلول (۱۰ میلیلیتر محلول شماره ۱، ۱ میلیلیتر محلول شماره ۲ و ۱ میلیلیتر محلول شماره ۳) تهیه شد. محلول شماره 1 از ترکیب 1/55 میلیلیتر استات سدیم و ۸ میلیلیتر اسید استیک غلیظ که با آب مقطر به حجم ۵۰۰ میلیلیتر رسانده شد به دست آمد. محلول شماره 2 شامل 270 میلیگرم کلرید آهن (III) که با آب مقطر به حجم 50 میلیلیتر رسید. محلول سوم از حل کردن ۴۷ میلیگرم تریآزین در ۴۰ میلیلیتر اسید کلریدریک ۴۰ میلیمولار بهدست آمد برای سرم 25 میکرولیتر از نمونه سرم به 1/5 میلیلیتر از محلول کار اضافه شد. برای مغز نیز بافت مغز همگن شده و با سرعت g1000 در 10 دقیقه سانتریفیوژ شد و به 1/5 میلیلیتر محلول کار اضافه شد و ۱۰ دقیقه در دمای ۳۷ درجه سانتیگراد قرار داده شد. سپس جذب نوری در طولموج ۵۹۳ ثبت شد (13-11).
اندازهگیری سطح سرمی مالوندیآلدهید (MDA): به طور خلاصه، مقدار نیم گرم تیوباربیتوریک اسید با ۸۰ میلیلیتر از اسید استیک 20 درصد مخلوط گردید و ورتکس شده و در ادامه حدود یک ساعت در بن ماری قرار گرفت. بعد از سرد شدن در دمای 0 درجه سانتی¬گراد، مقدار 250 میکرولیتر n-بوتانول به مخلوط اضافه شد و مجددا ورتکس شده و با سرعت 14000 دور در دقیقه به مدت 5 دقیقه سانتریفیوژ گردید. در نهایت با دستگاه اسپکتروفتومتر در 523 نانومتر جذب نوری آن ثبت شد (13،11).
اندازهگیری مالون دیآلدهید مغز: به این منظور، 1 گرم از بافت مغز (نواحی هیپوکمپ و کورتکی فرونتال) در محلول کلرید پتاسیم 2/5 درصد به نسبت وزنی 10 درصد (وزنی-حجمی) هموژنیزه شد و در دمای حدود 37 درجه سانتیگراد در یک شیکر به مدت یک ساعت انکوبه شد. پس از آن 1 میلیلیتر تتراکلرواستیک اسید 5 درصد به همراه 1 میلیلیتر تیوباربیتوریک اسید 67 درصد به آن اضافه شد و به خوبی مخلوط شد. سپس به لوله سانتریفوژ منتقل شده و در دور 2000 به مدت 15 دقیقه سانتریفوژ شد. پس از آن محلول رویی به لوله دیگری منتقل شده و برای مدت 10 دقیقه در حمام آب جوش قرار گرفت و پس از سرد شدن با دستگاه اسپکتروفتومتر در 535 نانومتر جذب نوری آن ثبت شد (14).
تجزیه و تحلیل آماری
تمام دادهها به صورت میانگین ± انحراف معیار بیان شدند. جهت نرمال بودن دادهها از آزمون کولموگروف اسمیرنوف استفاده شد. همه دادهها دارای مقادیر P بیشتر از 0/05 بودند که نشان دهنده توزیع نرمال دادهها بود. دادهها با استفاده از نرمافزارversion 16 SPSS آنالیز شد. برای مقایسه میانگین بین گروههای آزمایشی از ANOVA یک طرفه و آزمون توکی استفاده شد. 0/05≥p از نظر آماری معنیدار در نظر گرفته شد.
ملاحظات اخلاقی
پروپوزال این مطالعه، توسط کمیته اخلاق در پژوهش دانشگاه پیام نور مورد تایید قرار گرفته است (کد اخلاق: IR.PNU.REC.1400.273)
نتایج
نتایج آزمون شنای اجباری: همانطور که در نمودار 1-الف مشاهده میگردد، مدت زمان بیحرکتی در گروههای کنترل منفی (0/001>p)، کنترل مثبت (0/05≥p) و عصاره مرزنجوش وحشی با غلظتهای 100 (0/001≥p) و 200 میلیگرم بر کیلوگرم (0/001≥p) در مقایسه با گروه کنترل بطور معناداری افزایش یافتند و تجویز فلوکستین (0/001≥p) و عصاره مرزنجوش وحشی در غلظتهای 200 (0/001≥p) و 400 (0/001≥p) میلیگرم بر کیلوگرم، مدتزمان بیحرکتی را بهطور معنیداری نسبت به گروه کنترل منفی کاهش دادند. در رابطه با همین آزمون در نمودار 1-ب مشاهده می¬گردد، مدت¬زمان شنا کردن در گروه¬های کنترل منفی (0/001≥p) و عصاره مرزنجوش وحشی با غلظت¬های 100 (0/001≥ p)، 200 (0/001≥p) و 400 (0/01≥ p) میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بهطور معناداری کاهش یافتند و تجویز فلوکستین (0/001≥p) و عصاره مذکور در غلظتهای 200 (0/001≥p) و 400 (0/001≥p) میلیگرم بر کیلوگرم، مدتزمان شنا کردن را بهطور معناداری نسبت به گروه کنترل منفی افزایش دادند.
نتایج اندازهگیری ظرفیت آنتیاکسیدانی سرم و مغز: همانطور که در نمودار 2-الف مشاهده میگردد، سطح آنتیاکسیدانی سرم در گروه¬های کنترل منفی و عصاره مرزنجوش وحشی با غلظت های100 و عصاره با غلظت 200 میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بهطور معناداری (0/001≥p) کاهش یافتند و تجویز فلوکستین و عصاره مرزنجوش وحشی با غلظت 400 میلیگرم بر کیلوگرم، سطح آنتیاکسیدانی سرم را بهطور معناداری (0/001≥ p) نسبت به گروه کنترل منفی افزایش دادند. در همین آزمون در نمودار 2-ب مشاهده می¬گردد، سطح آنتی¬اکسیدانی مغز در گروه¬های کنترل منفی و عصاره مرزنجوش وحشی با غلظت 100 میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بطور معناداری (0/001≥p) کاهش یافتند و تجویز فلوکستین (0/001≥p) و عصاره مرزنجوش وحشی در غلظتهای 200 (0/01≥p) و 400 (0/001≥p) میلیگرم بر کیلوگرم، سطح آنتی¬اکسیدانی مغز را بهطور معناداری نسبت به گروه کنترل منفی افزایش دادند.
نتایج سنجش مالون دیآلدئید سرم و مغز: همانطور که در نمودار 3-الف مشاهده میگردد، سطح مالون دیآلدئید خون در گروههای کنترل منفی (0/001≥p) و عصاره مورد استفاده با غلظتهای 100 (0/001≥p) و 200 (0/01≥p) در مقایسه با گروه کنترل بهطور معناداری افزایش یافتند و تجویز فلوکستین و عصاره مرزنجوش وحشی در غلظتهای 200 و 400 میلیگرم بر کیلوگرم، سطح مالون دی¬آلدئید خون را بهطور معناداری (0/001≥p) نسبت به گروه کنترل منفی کاهش دادند. در این آزمون در نمودار 3-ب مشاهده میگردد، سطح مالون دی¬آلدئید مغز در گروه¬های کنترل منفی و عصاره مرزنجوش وحشی با غلظت 100 میلیگرم بر کیلوگرم در مقایسه با گروه کنترل بهطور معناداری (0/001≥p) افزایش یافتند و تجویز فلوکستین و عصاره در غلظتهای 200 و 400 میلیگرم بر کیلوگرم، سطح مالون دی¬آلدئید مغز را بهطور معناداری (0/001≥ (p نسبت به گروه کنترل منفی افزایش دادند.

نمودار 1: اثر دوزهای مختلف عصاره الکلی مرزنجوش، رزرپین (کنترل منفی) و فلوکستین (کنترل مثبت) بر رفتار بیحرکتی (الف) و شناکردن (ب) در آزمون شنای اجباری موشهای کوچک آزمایشگاهی نر.
(p<0/05)، (p<0/01) و (p<0/001) نشاندهنده اختلاف معنادار با گروه کنترل. @@@ (0/001>p) نشاندهنده اختلاف معنادار با گروه کنترل منفی.

نمودار 2: اثر دوزهای مختلف عصاره الکلی مرزنجوش، رزرپین (کنترل منفی) و فلوکستین (کنترل مثبت) بر سطح آنتی اکسیدانی سرم (الف) و سطح آنتیاکسیدانی مغز (ب) در موش¬های کوچک آزمایشگاهی نر.
(p<0/001) نشاندهنده اختلاف معنادار با گروه کنترل. @@ (0/01>p) و @@@ (0/001>p) نشاندهنده اختلاف معنادار با گروه کنترل منفی.

نمودار 3: اثر دوزهای مختلف عصاره الکلی مرزنجوش، رزرپین (کنترل منفی) و فلوکستین (کنترل مثبت) بر سطح مالون دی آلدئید خون (الف) و سطح مالون دی آلدئید مغز (ب) در موشهای کوچک آزمایشگاهی نر.
(p<0/01) و (p<0/001) نشاندهنده اختلاف معنادار با گروه کنترل. @@@ (0/001>p) نشاندهنده اختلاف معنادار با گروه کنترل منفی.
بحث
یافتههای حاصل از این مطالعه نشان داد که عصاره الکلی مرزنجوش وحشی در غلظتهای 200 و 400 میلیگرم برکیلوگرم وزن بدن دارای اثرات ضد افسردگی در موش¬های تحت مسمومیت با رزرپین میباشد. در این مطالعه، تیمار با فلوکستین و عصاره الکلی مرزنجوش با غلظتهای200 و 400 میلیگرم برکیلوگرم موجب افزایش مدت زمان بی¬حرکتی و شنا کردن در موشهای تحت مسمومیت با رزرپین گردید. در همین راستا در تحقیقات دیگری یافتههای مشابهی از عصاره میوه نسترن کوهی (14)، شبدر قرمز (9)، اسانس بومادران (15)، اسانس اسطوخودوس و بهار نارنج (16) و بادرنجوبه (17) گزارش شده است. رزرپین یک آلکالوئید مشتق از گیاه راولفیا سرپنتینا Rauvolfia serpentina گیاهی از خانواده خرزهره Apocynaceae است و همانند یک مهارکننده بازجذب مونوآمینی عمل مینماید که با تخلیه مونوآمینها در مغز، قادر به القای علائم افسردگی در جوندگان آزمایشگاهی میباشد. به همین دلیل از رزرپین بعنوان یک مدل پیشرفته در القای افسردگی در مطالعات جوندگان آزمایشگاهی استفاده میگردد (18). در این مطالعه، القای افسردگی توسط رزرپین موجب کاهش معنادار ظرفیت آنتیاکسیدانی و افزایش معنادار سطح مالون دیآلدئید سرم و مغز شد. تجویز عصاره الکلی مرزنجوش در غلظتهای 200 و 400 میلیگرم برکیلوگرم نیز مشابه با داروی فلوکستین در گروه کنترل مثبت موجب افزایش معنادار ظرفیت آنتیاکسیدانی و کاهش سطح مالون دیآلدئید بهعنوان یک نشانگر پراکسیداسیون لیپیدی در سرم و مغز موشهای رزرپینه شد. در برخی مطالعات قبلی رزرپین موجب کاهش ظرفیت آنتیاکسیدانی و افزایش آنزیمهای اکسیدانی شده است (12،15). در مطالعهای تزریق رزرپین با افزایش پراکسیداسیون لیپیدی و کاهش آنزیمهای آنتی-اکسیدان از جمله سوپراکسیداز دیسموتاز (SOD)، کاتالاز (CAT) و گلوتاتیون ردوکتاز (GSH) موجب القای استرس اکسیداسیون در مغز موشهای سوری شد (19). در مطالعات دیگری تزریق رزرپین علاوه بر افزایش مدت زمان بیحرکی در تست شنای اجباری و القای افسردگی موجب افزایش مالون دیآلدئید در مغز موشها شده است (15،12). در یک مطالعه انسانی نیز مشاهده شده که بیماران دچار افسردگی، دارای سطح پراکسیداسیون لیپیدی بیشتر و ظرفیت آنتی اکسیدانی کمتری در مقایسه با افراد سالم میباشند (20). مرزنجـوش یک گیاه غنی از انواع مختلفی از آنتیاکسیدآنهای قوی است که می¬تواند فعالیـت رادیکـالهـای آزاد را خنثی کرده و بر فعالیت نوروترانسمیترهای مغز اثرات تعدیلی داشته باشد. در بررسی خواص فارماکولوژیـک مرزنجـوش ترکیبـات فنلـی بـه خـصوص اسیدهای فنلی و فلاونوییدها به عنـوان عوامـل مـوثر احتمـالی مطـرح شدهاند (23-21). گزارشات پیشین نشان دادهاند که گیاه مرزنجوش غنی از روغنهای اساسی می-باشد که ترکیبات عمده آن شامل کارواکرول، تیمول، لینالول، آلفا تیوژن، آلفا پینن، اکتانون، ترپنین و پیسیمن است که همه این ترکیبات پتانسیل آنتیاکسیدانی قابلتوجهی دارند. بهعلاوه مرزنجوش حاوی مقادیر مهمی از پلیفنولها (فلاونوئیدها و اسیدهای فنولیک)، تریپرپنوئیدها و استرولها میباشد که این ترکیبات نیز قابلیت های آنتیاکسیدانی بالایی دارند (25،24). پژوهشها نشان داده اند که کارواکرول و تیمول مشابه مولکولهای ریز و چربی دوست بوده که قادرند به سهولت از سد خونیمغزی عبور کرده و بر سلول¬های نواحی متفاوت مغز تاثیر میگذارند (28-26). همینطور گزارش شده که کارواکرول و تیمول در شرایط محیط زنده و آزمایشگاهی بهطور موثری قادر به خنثی کردن فعالیت رادیکال¬های آزاد مختلف میباشند (30-28). Melo و همکاران با انجام تست شنای اجباری و آزمون معلق ماندن دم نشان دادند که تزریق کارواکرول به موشها دارای اثرات ضد افسردگی می¬باشد که این اثرات را احتمالاً از راه افزایش سطح دوپامین مغز انجام میدهد (29). بهعلاوه Yu و همکاران نیز نشان دادند که تجویز کارواکرول پس از القاء ایسکمی- ریپرفیوژن مغزی در موشها موجب بهبود آزمون¬های رفتاری و کاهش مرگ و میر نورونها شده و نکروز و آپوپتوز نورونی را به شدت کاهش میدهد، بنابراین کارواکرول به عنوان یک آنتی آپوپتوز قوی نیز معرفی شده است (31). در مطالعات دیگری اثرات ضدافسردگی تیمول در آزمونهای رفتاری شنای اجباری و معلق ماندن دم در موشها نشان داده شده و بیان شده که ممکن است تیمول این اثرات را از راه تعدیل برخی نوروترانسمیترها از جمله سروتونین و مونوآمینها و مهار پیش التهابی سیتوکینهایی مثل اینترلوکین 1 و 6 و فاکتور نکروز تومورTumor necrosis factor (TNF) (TNF) انجام دهد (33،32). لینالول و بتا پینن نیز دو مونوترپن فرار هستند که به مقدار قابلتوجهی در مرزنجوش یافت میشوند (24). نتایج تحقیقی از Guzmán-Gutiérrez و همکاران نشان میدهد که لینالول و بتا پینن از طریق تعامل با سیستم مونوآمینرژیک پتانسیل اثر ضد افسردگی را دارند (34). در تحقیق دیگری نشان داده شد که اسانس گیاه برگ بوی مکزیکی (Litsea glaucescens) دارای اثرات ضدافسردگی میباشد، که این اثرات به بتا پینن و لینالول به عنوان عناصر فعال گیاه نسبت داده شد (35). از دیگر ترکیبات موجو در مرزنجوش فلاونوئیدها میباشد (24). Hritcu و همکاران گزارش کردند که استرس اکسیداتیو بهطور واضح با پیشرفت افسردگی مرتبط است، دادههای این گزارش نشان میدهد که استفاده از فلاونوئیدها میتواند به کاهش علائم افسردگی کمک کند (36). با کمک تکنیک HPLC نشان داده شده از جمله ترکیبات فنولیک، که به مقدار فراوانی در مرزنجوش وجود دارد کلوروژنیک اسید، رزمارینیک اسید و روتین می باشند (25). Wu و همکاران نشان دادند که کلوروژنیک اسید مشتق از گیاه Eucommia ulmoides Oliver که یک گیاه در طب سنتی چین میباشد دارای اثرات ضد افسردگی میباشد که احتمالاً این اثرات را از طریق تعامل با سیستم سروتونین بروز می دهد (37). Kondo و همکاران گزارش کردند که رزمارینیک اسید دارای اثرات ضدافسردگی میباشد که این اثرات را احتمالاً از طریق تعدیل mitogen-activated protein kinase phosphatase-1MKP-1، brain-derived neurotrophic factor BDNF و تعدیل سیستم دوپامین و سنتز کورتیکواسترونها انجام میدهد (38). نتایج تحقیق دیگری نشان داد که اثر ضدافسردگی عصاره اتانولی گیاه فلفل پروئی (Schinus molle L) در آزمایش معلق ماندن دم در موش ممکن است وابسته به حضور روتین باشد که احتمالاً اثر ضد افسردگی خود را با افزایش حضور سروتونین و نورآدرنالین در فضای سیناپس اعمال میکند (39).
نتیجهگیری
در مجموع میتوان گفت که مرزنجوش به دلیل داشتن مقادیر قابلتوجهی از عناصر فعال گیاهی مثل روغن¬های اساسی و پلیفنولها دارای اثرات مفیدی بر کاهش افسردگی می¬باشد و احتمالا این اثرات را از راه فعالیت آنتیاکسیدانی و همینطور تعدیل در ترشح نوروترانسمیترهای دخیل در فرآیند افسردگی اعمال میکند. در این زمینه، مطالعات بیشتری بهویژه در مورد عناصر فعال این گیاه برای مشخص شدن مکانیسم دقیق این کار لازم است.
سپاسگزاری
از تمام کسانی که در انجام این تحقیق همکاری نمودهاند کمال تشکر و قدردانی به عمل می¬آید. این مطالعه بخشی از طرح تحقیقاتی (214/س.ک) میباشد که با حمایت حوزه معاونت پژوهشی دانشگاه پیام نور استان کرمانشاه انجام شده است.
حامی مالی: سازمان مرکزی دانشگاه پیام نور
تعارض در منافع: وجود ندارد.
References:
1- Lang UE, Borgwardt S. Molecular Mechanisms of Depression: Perspectives on New Treatment Strategies. Cell Physiol Biochem 2013; 31(6): 761-77.
2- Jesulola E, Micalos P, Baguley IJ. Understanding the Pathophysiology of Depression: From Monoamines to the Neurogenesis Hypothesis Model - Are we there yet? Behav Brain Res 2018; 341:79-90.
3- Bhatt S, Nagappa AN, Patil CR. Role of Oxidative Stress in Depression. Drug Discov Today 2020; 25(7): 1270-76.
4- Martins J, SB. Phytochemistry and Pharmacology of Anti-Depressant Medicinal Plants: A Review. Biomed Pharmacother 2018; 104: 343-65.
5- Morshedloo MR, Ahmadi H, pirali hamedani M, Yazdani D. An Over Review to Origanum Vulgare L. And it's Pharmacological Properties. J Med Plants 2018; 17(68): 15-31.
6- Kumar V, Markovic T, Emerald M, Dey A. Herbs: Composition and Dietary Importance. Herbs: Composition and Dietary Importance. In: Caballero B, 530 Finglas PM, Toldrá F, eds. Encyclopedia of Food and Health. Academic Press; 2016: 332-37.
7- Rezaie, A., Jafari, B., Mousavi, G., Ebadi, AR., Ahmadizadeh, C., Shishegar, R., et al. Study of Anxiolytic Effect of Herbal Extract of Origanum Majorana L. Incomparison with Diazepam in Rat. Iranian Journal of Medicinal and Aromatic Plants 2014; 30(1): 134-41. [Persian]
8- Abbasi-Maleki S, Kadkhoda Z, Taghizad-Farid R. The Antidepressant-Like Effects of Origanum Majorana Essential Oil on Mice through Monoaminergic Modulation Using the Forced Swimming Test. J Tradit Complement Med 2019; 10(4): 327-35.
9- Rabiei Z, Movahedi E, Rafieian-Kopaei M, Lorigooini Z. Antidepressant Effects of Trifolium Pratense Hydroalcholic Extract in Mice. Iran J Physiol Pharmacol 2018; 2(1): 24-33.
10- Rabiei Z, Mokhtari S, Babaei F, Rafieian-kopaei M. Effect of Kombucha Tea on Depression and Motor Activity in Mice. Journal of Medicinal Plants 2017; 16(61): 156-66.
11- Bakhtiarpoor M, Setorki M, Kaffashian MR. Effects of Essential Oil of Satureja Bachtiarica Bunge in a Rat Model of Reserpine-Induced Depression. Iran J Med Sci 2018; 43(4): 409-15.
12- Shamsizadeh A, Fatehi F, Arab Baniasad F, Ayoobi F, Rezvani ME, Roohbakhsh A. The Effect of Zataria Multiflora Boiss Hydroalcoholic Extract and Fractions in Pentylenetetrazole-Induced Kindling in Mice. Avicenna J Phytomed 2016; 6(6): 597-603.
13- Bolandghamat S, Moghimi A, Iranshahi M. Effects of Ethanolic Extract of Pine Needles (Pinus Eldarica Medw.) On Reserpineinduced Depression-Like Behavior in Male Wistar Rats. Pharmacogn Mag 2011; 7(27): 248-53
14- Parandin R. Antidepressant Effects of a Hydroalcoholic Extract of Rosa Canina L. On the Depression Induced By Reserpine in Balb/C Mice. Iran South Med J 2019; 22(5): 333-46.
15- Lori-Gooini Z, Rabiei Z, Farhadi B, Bijad E, Azomon E, Rafieian-Kopaei M. Investigation of Chemical Compounds and Effects of Achilea Wilhelmsii L Essential Oil on Antioxidant and Malondialdehyde Levels of Serum and Brains of Reserpined Mice. Iran J Physiol Pharmacol 2018; 2(3): 166-176.
16- Hashemi Shahraki F, Namjoo AR, Ghasemi Pirbalout A, Lorigooini Z, Rafieian-Kopaei M, Gholami Arjenaki M. Antidepressant- Like Effect of Lavandula Angustifolia Mill and Citrus Aurantium Duh Essential Oils with Forced Swimming Test in Reserpinized Mice Balb/C. Razi Journal of Medical Sciences 2017; 23(151): 77-85. [Persian]
17- Emamghoreishi M, Talebianpour MS .Antidepressant Effect of Melissa Officinalis in the Forced Swimming Test. DARU Journal of Pharmaceutical Sciences 2009; 17(1): 42-7.
18- Ikram H, Haleem DJ. Repeated Treatment with Reserpine as a Progressive Animal Model of Depression. Pak J Pharm Sci 2017; 30(3): 897-902.
19- Dwivedi G, Tomar V. Protective Effect of Ipomoea Aquatica Against Reserpine Induced Oxidative Stress in Brain Using Mice. Int J Basic Clin Pharmacol 2016; 5(5): 2123-129.
20- Sarandol A, Sarandol E, Eker SS, Erdinc S, Vatansever E, Kirli S. Major Depressive Disorder is Accompanied with Oxidative Stress: Short‐Term Antidepressant Treatment Does Not Alter Oxidative–Antioxidative Systems. Hum Psychopharmacol 2007; 22(2): 67-73.
21- Faleiro L, Miguel G, Gomes S, Costa L, Venâncio F, Teixeira A, et al. Antibacterial and Antioxidant Activities of Essential Oils Isolated from Thymbra Capitata L. (Cav.) Andoriganum Vulgare L. J Agric Food Chem 2005; 53(21): 8162-8.
22- Kaurinovic B, Popovic M, Vlaisavljevic S, Trivic S. Antioxidant Capacity of Ocimum Basilicum L. And Origanum Vulgare L. Extracts. Molecules 2011; 16(9): 7401-14.
23- Ragerdi Kashani I, Ansari M, Mehrannia K, Moazzemi K, Vardasbi Joybary S. Teratogenic Effects of Origanum Vulgare Extract in Mice Fetals. Tehran Univ Med J 2013; 71(8): 502-8.
24- Oniga I, Pușcaș C, Silaghi-Dumitrescu R, Olah NK, Sevastre B, Marica R, et al. Origanum Vulgare Ssp. Vulgare: Chemical Composition and Biological Studies. Molecules 2018; 23(8): 2077.
25- Simin Namvar A, Mokhtari M. Study of Anticonvulsive Effects of Equeous Extract of Origanumvulgare on Chemical Kindling in Male Mice. JSSU 2016; 24 (7): 538-46. [Persian]
26- Trabace L, Zotti M, Morgese MG, Tucci P, Colaianna M, Schiavone S, et al. Estrous Cycle Affects the Neurochemical and Neurobehavioral Profile of Carvacrol-Treated Female Rats. Toxicol Appl Pharmacol 2011; 255(2): 169-75.
27- Jukic M, Politeo O, Maksimovic M, Milos M, Milos M. In Vitro Acetylcholinesterase Inhibitory Properties of Thymol, Carvacrol and their Derivatives Thymoquinone and Thymohydroquinone. Phytother Res 2007; 21(3): 259-61.
28- Kaeidi A, Rahmani MR, Hassanshahi J. The Protective Effect of Carvacrol and Thymol as Main Polyphenolic Compounds of Thyme on Some Biologic Systems in Disease Condition: A Narrative Review. J Rafsanjan Univ Med Sci 2020; 19(1): 81-96. [Persian]
29- Melo FH, Moura BA, Sousa DP, de Vasconcelos SM, Macedo DS, Fonteles MM, et al. Antidepressant‐Like Effect of Carvacrol (5‐Isopropyl‐2‐ Methylphenol) in Mice: Involvement of Dopaminergic System. Fundam Clin Pharmacol 2011; 25(3): 362-7.
30- Jin F, Wu Q, Lu Y-F, Gong Q-H, Shi J-S. Neuroprotective Effect of Resveratrol on 6-Ohdainduced Parkinson's disease in Rats. Eur J Pharmacol 2008; 600(1-3): 78-82.
31- Yu H, Zhang Z-L, Chen J, Pei A, Hua F, Qian X, et al. Carvacrol, a Food-Additive, Provides Neuroprotection on Focal Cerebral Ischemia/Reperfusion Injury in Mice. PloS One 2012; 7(3): e33584.
32- Parente MSR, Custódio FR, Cardoso NA, Lima MJA, Melo TS, Linhares MI, et al. Antidepressant-Like Effect of Lippia Sidoides CHAM (Verbenaceae) Essential Oil and its Major Compound Thymol in Mice. Sci Pharm 2018; 86(3): E27.
33- Deng X-Y, Li H-Y, Chen J-J, Li R-P, Qu R, Fu Q, et al. Thymol Produces an Antidepressant-Like Effect in a Chronic Unpredictable Mild Stress Model of Depression in Mice. Behav Brain Res 2015; 291: 12-19.
34- Guzmán-Gutiérrez SL, Bonilla-Jaime H, Gómez-Cansino R, Reyes-Chilpa R. Linalool and Β-Pinene Exert their Antidepressant-Like Activity through the Monoaminergic Pathway. Life Sci 2015; 128: 24-9.
35- Guzmán-Gutiérrez SL, Gómez-Cansino R, García-Zebadúa JC, Jiménez-Pérez NC, Reyes-Chilpa R. Antidepressant Activity of Litsea Glaucescens Essential Oil: Identification of Β-Pinene and Linalool as Active Principles. J Ethnopharmacol 2012; 143(2): 673-9.
36- Hritcu L, Ionita R, Postu PA, Gupta GK, Turkez H, Lima TC, Carvalho CUS, de Sousa DP. Antidepressant Flavonoids and their Relationship with Oxidative Stress. Oxid Med Cell Longev 2017; 2017: 5762172.
37- Wu J, Chen H, Li H, Tang Y, Yang L, Cao S, Qin D. Antidepressant Potential of Chlorogenic Acid-Enriched Extract from Eucommia Ulmoides Oliver Bark with Neuron Protection and Promotion of Serotonin Release through Enhancing Synapsin I Expression. Molecules 2016; 21(3): 260.
38- Kondo S, El Omri A, Han J, Isoda H. Antidepressant-Like Effects of Rosmarinic Acid through Mitogen-Activated Protein Kinase Phosphatase-1 and Brain-Derived Neurotrophic Factor Modulation. Journal of Functional Foods 2015; 14: 758–66.
39- Machado DG, Bettio LE, Cunha MP, Santos AR, Pizzolatti MG, Brighente IM, Rodrigues AL. Antidepressant-Like Effect of Rutin Isolated from the Ethanolic Extract from Schinus Molle L. In Mice: Evidence for the Involvement of the Serotonergic and Noradrenergic Systems. Eur J Pharmacol 2008; 587(1-3): 163-8.
1- Lang UE, Borgwardt S. Molecular Mechanisms of Depression: Perspectives on New Treatment Strategies. Cell Physiol Biochem 2013; 31(6): 761-77.
2- Jesulola E, Micalos P, Baguley IJ. Understanding the Pathophysiology of Depression: From Monoamines to the Neurogenesis Hypothesis Model - Are we there yet? Behav Brain Res 2018; 341:79-90.
3- Bhatt S, Nagappa AN, Patil CR. Role of Oxidative Stress in Depression. Drug Discov Today 2020; 25(7): 1270-76.
4- Martins J, SB. Phytochemistry and Pharmacology of Anti-Depressant Medicinal Plants: A Review. Biomed Pharmacother 2018; 104: 343-65.
5- Morshedloo MR, Ahmadi H, pirali hamedani M, Yazdani D. An Over Review to Origanum Vulgare L. And it's Pharmacological Properties. J Med Plants 2018; 17(68): 15-31.
6- Kumar V, Markovic T, Emerald M, Dey A. Herbs: Composition and Dietary Importance. Herbs: Composition and Dietary Importance. In: Caballero B, 530 Finglas PM, Toldrá F, eds. Encyclopedia of Food and Health. Academic Press; 2016: 332-37.
7- Rezaie, A., Jafari, B., Mousavi, G., Ebadi, AR., Ahmadizadeh, C., Shishegar, R., et al. Study of Anxiolytic Effect of Herbal Extract of Origanum Majorana L. Incomparison with Diazepam in Rat. Iranian Journal of Medicinal and Aromatic Plants 2014; 30(1): 134-41. [Persian]
8- Abbasi-Maleki S, Kadkhoda Z, Taghizad-Farid R. The Antidepressant-Like Effects of Origanum Majorana Essential Oil on Mice through Monoaminergic Modulation Using the Forced Swimming Test. J Tradit Complement Med 2019; 10(4): 327-35.
9- Rabiei Z, Movahedi E, Rafieian-Kopaei M, Lorigooini Z. Antidepressant Effects of Trifolium Pratense Hydroalcholic Extract in Mice. Iran J Physiol Pharmacol 2018; 2(1): 24-33.
10- Rabiei Z, Mokhtari S, Babaei F, Rafieian-kopaei M. Effect of Kombucha Tea on Depression and Motor Activity in Mice. Journal of Medicinal Plants 2017; 16(61): 156-66.
11- Bakhtiarpoor M, Setorki M, Kaffashian MR. Effects of Essential Oil of Satureja Bachtiarica Bunge in a Rat Model of Reserpine-Induced Depression. Iran J Med Sci 2018; 43(4): 409-15.
12- Shamsizadeh A, Fatehi F, Arab Baniasad F, Ayoobi F, Rezvani ME, Roohbakhsh A. The Effect of Zataria Multiflora Boiss Hydroalcoholic Extract and Fractions in Pentylenetetrazole-Induced Kindling in Mice. Avicenna J Phytomed 2016; 6(6): 597-603.
13- Bolandghamat S, Moghimi A, Iranshahi M. Effects of Ethanolic Extract of Pine Needles (Pinus Eldarica Medw.) On Reserpineinduced Depression-Like Behavior in Male Wistar Rats. Pharmacogn Mag 2011; 7(27): 248-53
14- Parandin R. Antidepressant Effects of a Hydroalcoholic Extract of Rosa Canina L. On the Depression Induced By Reserpine in Balb/C Mice. Iran South Med J 2019; 22(5): 333-46.
15- Lori-Gooini Z, Rabiei Z, Farhadi B, Bijad E, Azomon E, Rafieian-Kopaei M. Investigation of Chemical Compounds and Effects of Achilea Wilhelmsii L Essential Oil on Antioxidant and Malondialdehyde Levels of Serum and Brains of Reserpined Mice. Iran J Physiol Pharmacol 2018; 2(3): 166-176.
16- Hashemi Shahraki F, Namjoo AR, Ghasemi Pirbalout A, Lorigooini Z, Rafieian-Kopaei M, Gholami Arjenaki M. Antidepressant- Like Effect of Lavandula Angustifolia Mill and Citrus Aurantium Duh Essential Oils with Forced Swimming Test in Reserpinized Mice Balb/C. Razi Journal of Medical Sciences 2017; 23(151): 77-85. [Persian]
17- Emamghoreishi M, Talebianpour MS .Antidepressant Effect of Melissa Officinalis in the Forced Swimming Test. DARU Journal of Pharmaceutical Sciences 2009; 17(1): 42-7.
18- Ikram H, Haleem DJ. Repeated Treatment with Reserpine as a Progressive Animal Model of Depression. Pak J Pharm Sci 2017; 30(3): 897-902.
19- Dwivedi G, Tomar V. Protective Effect of Ipomoea Aquatica Against Reserpine Induced Oxidative Stress in Brain Using Mice. Int J Basic Clin Pharmacol 2016; 5(5): 2123-129.
20- Sarandol A, Sarandol E, Eker SS, Erdinc S, Vatansever E, Kirli S. Major Depressive Disorder is Accompanied with Oxidative Stress: Short‐Term Antidepressant Treatment Does Not Alter Oxidative–Antioxidative Systems. Hum Psychopharmacol 2007; 22(2): 67-73.
21- Faleiro L, Miguel G, Gomes S, Costa L, Venâncio F, Teixeira A, et al. Antibacterial and Antioxidant Activities of Essential Oils Isolated from Thymbra Capitata L. (Cav.) Andoriganum Vulgare L. J Agric Food Chem 2005; 53(21): 8162-8.
22- Kaurinovic B, Popovic M, Vlaisavljevic S, Trivic S. Antioxidant Capacity of Ocimum Basilicum L. And Origanum Vulgare L. Extracts. Molecules 2011; 16(9): 7401-14.
23- Ragerdi Kashani I, Ansari M, Mehrannia K, Moazzemi K, Vardasbi Joybary S. Teratogenic Effects of Origanum Vulgare Extract in Mice Fetals. Tehran Univ Med J 2013; 71(8): 502-8.
24- Oniga I, Pușcaș C, Silaghi-Dumitrescu R, Olah NK, Sevastre B, Marica R, et al. Origanum Vulgare Ssp. Vulgare: Chemical Composition and Biological Studies. Molecules 2018; 23(8): 2077.
25- Simin Namvar A, Mokhtari M. Study of Anticonvulsive Effects of Equeous Extract of Origanumvulgare on Chemical Kindling in Male Mice. JSSU 2016; 24 (7): 538-46. [Persian]
26- Trabace L, Zotti M, Morgese MG, Tucci P, Colaianna M, Schiavone S, et al. Estrous Cycle Affects the Neurochemical and Neurobehavioral Profile of Carvacrol-Treated Female Rats. Toxicol Appl Pharmacol 2011; 255(2): 169-75.
27- Jukic M, Politeo O, Maksimovic M, Milos M, Milos M. In Vitro Acetylcholinesterase Inhibitory Properties of Thymol, Carvacrol and their Derivatives Thymoquinone and Thymohydroquinone. Phytother Res 2007; 21(3): 259-61.
28- Kaeidi A, Rahmani MR, Hassanshahi J. The Protective Effect of Carvacrol and Thymol as Main Polyphenolic Compounds of Thyme on Some Biologic Systems in Disease Condition: A Narrative Review. J Rafsanjan Univ Med Sci 2020; 19(1): 81-96. [Persian]
29- Melo FH, Moura BA, Sousa DP, de Vasconcelos SM, Macedo DS, Fonteles MM, et al. Antidepressant‐Like Effect of Carvacrol (5‐Isopropyl‐2‐ Methylphenol) in Mice: Involvement of Dopaminergic System. Fundam Clin Pharmacol 2011; 25(3): 362-7.
30- Jin F, Wu Q, Lu Y-F, Gong Q-H, Shi J-S. Neuroprotective Effect of Resveratrol on 6-Ohdainduced Parkinson's disease in Rats. Eur J Pharmacol 2008; 600(1-3): 78-82.
31- Yu H, Zhang Z-L, Chen J, Pei A, Hua F, Qian X, et al. Carvacrol, a Food-Additive, Provides Neuroprotection on Focal Cerebral Ischemia/Reperfusion Injury in Mice. PloS One 2012; 7(3): e33584.
32- Parente MSR, Custódio FR, Cardoso NA, Lima MJA, Melo TS, Linhares MI, et al. Antidepressant-Like Effect of Lippia Sidoides CHAM (Verbenaceae) Essential Oil and its Major Compound Thymol in Mice. Sci Pharm 2018; 86(3): E27.
33- Deng X-Y, Li H-Y, Chen J-J, Li R-P, Qu R, Fu Q, et al. Thymol Produces an Antidepressant-Like Effect in a Chronic Unpredictable Mild Stress Model of Depression in Mice. Behav Brain Res 2015; 291: 12-19.
34- Guzmán-Gutiérrez SL, Bonilla-Jaime H, Gómez-Cansino R, Reyes-Chilpa R. Linalool and Β-Pinene Exert their Antidepressant-Like Activity through the Monoaminergic Pathway. Life Sci 2015; 128: 24-9.
35- Guzmán-Gutiérrez SL, Gómez-Cansino R, García-Zebadúa JC, Jiménez-Pérez NC, Reyes-Chilpa R. Antidepressant Activity of Litsea Glaucescens Essential Oil: Identification of Β-Pinene and Linalool as Active Principles. J Ethnopharmacol 2012; 143(2): 673-9.
36- Hritcu L, Ionita R, Postu PA, Gupta GK, Turkez H, Lima TC, Carvalho CUS, de Sousa DP. Antidepressant Flavonoids and their Relationship with Oxidative Stress. Oxid Med Cell Longev 2017; 2017: 5762172.
37- Wu J, Chen H, Li H, Tang Y, Yang L, Cao S, Qin D. Antidepressant Potential of Chlorogenic Acid-Enriched Extract from Eucommia Ulmoides Oliver Bark with Neuron Protection and Promotion of Serotonin Release through Enhancing Synapsin I Expression. Molecules 2016; 21(3): 260.
38- Kondo S, El Omri A, Han J, Isoda H. Antidepressant-Like Effects of Rosmarinic Acid through Mitogen-Activated Protein Kinase Phosphatase-1 and Brain-Derived Neurotrophic Factor Modulation. Journal of Functional Foods 2015; 14: 758–66.
39- Machado DG, Bettio LE, Cunha MP, Santos AR, Pizzolatti MG, Brighente IM, Rodrigues AL. Antidepressant-Like Effect of Rutin Isolated from the Ethanolic Extract from Schinus Molle L. In Mice: Evidence for the Involvement of the Serotonergic and Noradrenergic Systems. Eur J Pharmacol 2008; 587(1-3): 163-8.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی
دریافت: 1401/3/13 | پذیرش: 1401/3/28 | انتشار: 1402/2/15
دریافت: 1401/3/13 | پذیرش: 1401/3/28 | انتشار: 1402/2/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







