دوره 30، شماره 10 - ( دی 1401 )
جلد 30 شماره 10 صفحات 6012-6000 |
برگشت به فهرست نسخه ها
Ethics code: IR-SUMS.REC.1399.905
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Foroughi Pordanjani A, Salesi M, Rezaei R, Nemati J. Effect of 4 Weeks Preconditioning with High Intensity Interval Training and Moderate Intensity Continuous Training on Brain Levels of TNF-Α and TLR4 in Male Wistar Rats. JSSU 2023; 30 (10) :6000-6012
URL: http://jssu.ssu.ac.ir/article-1-5676-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5676-fa.html
فروغی پردنجانی عباس، ثالثی محسن، رضایی رسول، نعمتی جواد. تأثیر 4 هفته پیش آماده سازی با تمرین تناوبی با شدت بالا و تداومی با شدت متوسط بر مقادیر TNF-α و TLR4 مغز رتهای صحرایی نر نژاد ویستار. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (10) :6000-6012
متن کامل [PDF 1108 kb]
(656 دریافت)
| چکیده (HTML) (1815 مشاهده)
References:
1- Cuevas AG, Ong AD, Carvalho K, Ho T, Chan SW, Allen J, Chen R, Rodgers J, Biba U, Williams DR. Discrimination and Systemic Inflammation: A Critical Review and Synthesis. Brain Behav Immun 2020; 89: 465-79.
2- Enache D, Pariante CM, Mondelli V. Markers of Central Inflammation in Major Depressive Disorder: A Systematic Review and Meta-Analysis of Studies Examining Cerebrospinal Fluid, Positron Emission Tomography and Post-Mortem Brain Tissue. Brain Behav Immun 2019; 81: 24-40.
3- Khan J, Noboru N, Young A, Thomas D. Pro and Anti-Inflammatory Cytokine Levels (TNF-Α, IL-1β, IL-6 and IL-10) In Rat Model of Neuroma. Pathophysiology 2017; 24(3): 155-9.
4- Nakagawa Y, Chiba K. Role of Microglial M1/M2 Polarization in Relapse and Remission of Psychiatric Disorders and Diseases. Pharmaceuticals 2014; 7(12): 1028-48.
5- You K, Gu H, Yuan Z, Xu X. Tumor Necrosis Factor Alpha Signaling and Organogenesis. Front Cell Dev Biol 2021; 9: 1-9.
6- Ye L, Huang Y, Zhao L, Li Y, Sun L, Zhou Y, Qian G, Zheng JC. IL‐1β And TNF‐Α Induce Neurotoxicity Through Glutamate Production: A Potential Role for Neuronal Glutaminase. J Neurochem 2013; 125(6): 897-908.
7- Arroyo E, Laudato JA, Gibson BM, Dulaney CS, Vaughan JA, Followay BN, Glickman EL, Jajtner AR. Tumor Necrosis Factor-Α, TNF Receptor, and Soluble TNF Receptor Responses to Aerobic Exercise in the Heat. Cytokine X 2020; 2(3): 100033.
8- Norouzian M, Rajabi H, Panahzadeh F. The Effect of 6 Weeks Tai Chi Training on TNF-Α, BDNF Serum Levels and Cognitive and Physical Function in Women with Stroke. J Spo Exerc Physiol. 2017; 10(1): 11-19. [Persian]
9- Soltani N, Marandi SM, Kazemi M, Esmaeil N. Combined All-Extremity High-Intensity Interval Training Regulates Immunometabolic Responses Through Toll-Like Receptor 4 Adaptors and A20 Downregulation in Obese Young Females. Obes Facts 2020; 13(3): 415-31.
10- Park JW, Kim KH, Choi JK, Park TS, Song KD, Cho BW. Regulation of Toll-Like Receptors Expression in Muscle Cells by Exercise-Induced Stress. Anim Biosci 2021; 34(10): 1590-99.
11- Soori R, Vahdat H, Shabkhiz F, Ababzadeh S, Eslami Farsani M. Effects of Aerobic Exercise and Rosemary Extracts on Inflammatory Factors in Cerebellar of Male Old Rats. Qom Univ Med Sci J 2020; 14(4): 11-21. [Persian]
12- Hovanloo F, Arefirad T, Ahmadizad S. Effects of Sprint Interval and Continuous Endurance Training on Serum Levels of Inflammatory Biomarkers. J Diabetes Metab Disord 2013; 12(1): 1-5.
13- Timmons BW. Paediatric Exercise Immunology: Health and Clinical Applications. Exerc Immunol Rev 2005; 11(2005): 108-44.
14- Wang X, Zhang M, Feng R, Li WB, Ren SQ, Zhang J, Zhang F. Physical Exercise Training And Neurovascular Unit In Ischemic Stroke. Neuroscience 2014; 271: 99-107.
15- Dornbos III D, Ding Y. Mechanisms of Neuronal Damage and Neuroprotection Underlying Ischemia/Reperfusion Injury after Physical Exercise. Curr Drug Targets 2012; 13(2): 247-62.
16- Gleeson M, Bishop NC, Stensel DJ, Lindley MR, Mastana SS, Nimmo MA. The Anti-Inflammatory Effects of Exercise: Mechanisms and Implications for the Prevention and Treatment of Disease. Nat Rev Immunol 2011; 11(9): 607-15.
17- Rezaei R, Nasoohi S, Haghparast A, Khodagholi F, Bigdeli MR, Nourshahi M. High Intensity Exercise Preconditioning Provides Differential Protection Against Brain Injury Following Experimental Stroke. Life Sci 2018; 207: 30-35.
18- Bedford TG, Tipton CM, Wilson NC, Oppliger RA, Gisolfi CV. Maximum Oxygen Consumption of Rats and Its Changes with Various Experimental Procedures. J Appl Physiol 1979; 47(6): 1278-83.
19- Leandro CG, Levada AC, Hirabara SM, Manhães-De-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Cond Res. 2007; 21(3): 751-6.
20- Ramez M, Rajabi H, Ramezani F, Naderi N, Darbandi-Azar A, Nasirinezhad F. The Greater Effect of High-Intensity Interval Training versus Moderate-Intensity Continuous Training on Cardioprotection against Ischemia-Reperfusion Injury through Klotho Levels and Attenuate of Myocardial TRPC6 Expression. BMC Cardiovasc Disord 2019; 19(1): 118.
21- Sandoghchian Shotorbani S, Espotin A, Mahmoudi J, Dehghan A, Sadigh Eteghad S. Effects of HSP70 on TLR4 Expression by Increasing MAPK and NF-KB Signaling Pathways in Periodontitis. J Mashhad Dent Sch 2021; 45(1): 63-9. [Persian]
22- Kovach MA, Singer B, Martinez-Colon G, Newstead MW, Zeng X, Mancuso P, et al. IL-36γ is a Crucial Proximal Component of Protective Type-1-Mediated Lung Mucosal Immunity In Gram-Positive and-Negative Bacterial Pneumonia. Mucosal Immunol 2017; 10(5): 1320-34.
23- Huynh J, Scholz GM, Aw J, Kwa MQ, Achuthan A, Hamilton JA, Reynolds EC. IRF6 Regulates the Expression of IL-36γ By Human Oral Epithelial Cells In Response to Porphyromonas Gingivalis. J Immunol 2016; 196(5): 2230-8.
24- Pervaiz N, Hoffman-Goetz L. Immune Cell Inflammatory Cytokine Responses Differ Between Central and Systemic Compartments in Response to Acute Exercise in Mice. Exerc Immunol Rev 2012; 18: 142-57.
25- Martin-Cordero L, García JJ, Hinchado MD, Bote E, Manso R, Ortega E. Habitual Physical Exercise Improves Macrophage IL-6 and TNF-Α Deregulated Release in the Obese Zucker Rat Model of the Metabolic Syndrome. Neuroimmunomodulation 2011; 18(2): 123-30.
26- Mokhtarzade M, Ranjbar R, Majdinasab N. Acute and Chronic Effect of Upper and Lower Body Interval Training on Tumor Necrosis Factor (Tnfα) and Leptin Concentration in Women with MS. Stud Med Sci 2017; 28(5): 332-42.
27- Akbari A, Mohebbi H, Khalafi M, Moghaddami K. The Effect of Two Types of High Intensity and Moderate Intensity Continuous Training on Serum Levels of TNF-Α and IL-10 in Obese Male Rats. J Appl Health Stud Sport Physiol 2019; 6(1): 86-93. (Persian)
28- Mujumdar PP, Duerksen-Hughes PJ, Firek AF, Hessinger DA. Long-Term, Progressive, Aerobic Training Increases Adiponectin in Middle-Aged, Overweight, Untrained Males and Females. Scand J Clin Lab Invest 2011; 71(2): 101-7.
29- Stewart LK, Flynn MG, Campbell WW, Craig BA, Robinson JP, Mcfarlin BK, et al. Influence of Exercise Training and Age on CD14+ Cell-Surface Expression of Toll-Like Receptor 2 and 4. Brain Behav Immun 2005; 19(5): 389-97.
30- Shi H, Kokoeva MV, Inouye K, Tzameli I, Yin H, Flier JS. TLR4 Links Innate Immunity And Fatty Acid–Induced Insulin Resistance. J Clin Invest 2006; 116(11): 3015-25.
31- Timmerman KL, Flynn MG, Coen PM, Markofski MM, Pence BD. Exercise Training‐Induced Lowering of Inflammatory (CD14+ CD16+) Monocytes: A Role in the Anti‐Inflammatory Influence of Exercise. J Leukocyte Biol 2008; 84(5): 1271-8.
32- White LJ, Castellano V, Mc Coy SC. Cytokine Responses to Resistance Training In People with Multiple Sclerosis. J Sports Sci. 2006; 24(8): 911-4.
33- Hotamisligil GS. Mechanisms of TNF-Α-Induced Insulin Resistance. Exp Clin Endocrinol Diabetes. 1999; 107(2): 119-25.
متن کامل: (1187 مشاهده)
مقدمه
التهاب یک سازوکار دفاعی بدن در مقابل محرکهای آسیبزا است که میتواند واکنشها و خطوط دفاعی بدن را فعال کند (1). التهاب در مغز با نام التهاب عصبی شناخته شده است و میتواند بهوسیله سیگنالهای ارسال شده از نورونهای تخریب شده، ارگانیسمهای مهاجم مثل ویروسها و باکتریها، مواد شیمیایی مضر و همچنین پروتئینهای تغییر شکل یافته (مثل پپتیدهای آمیلوئید بتا) در مغز تحریک شود (2). التهاب عصبی موجب افزایش ترشح سایتوکاینهایی نظیر TNF-α (Tumor necrosis factor alpha)، اینترلوکین-1 (IL-1) و اینترلوکین-6 (IL-6) میشود که خود موجب تحریک بیان مولکولهای چسبان سلولی همانند مولکول چسبان سلولی-1 (ICAM-1)، پیسلکتین و ایسلکتین در سلولهای آندوتلیال میگردند (3). سلولهای میکروگلیا در پاسخ به عوامل التهابی نظیر لیپوپلیساکارید باکتریایی (LPS) و اینترفرون گاما (INF- γ)، سایتوکاینهای التهابی نظیر عامل نکروز دهنده تومور- آلفا (TNF-α)، اینترلوکین- 1 بتا (IL-1β)، اینترلوکین- 6، NO و ROS تولید میکنند (4). TNF-α یکی از مهمترین سایتوکاینهای التهابی و یک پلیپپتید چندوجهی و 17 کیلودالتونی است و از برخی سلولهای ایمنی همانند مونوسیتها، سلولهای کشنده طبیعی و ماکروفاژها ترشح میشود و موجب ایجاد ادم مغزی و نابودی نورونها میشود و بیانگر التهاب مغزی است (5،6). برخی پژوهشها نشان میدهند که در بیماران مبتلا به بیماریهای عصبی میزان عوامل التهابی در مقایسه با افراد سالم بیشتر است که خود میتواند دلیلی برای بروز انحطاط عصبی در این بیماران باشد (7،8). از طرفی بروز التهاب در مغز میتواند یکی از مسیرهای التهابی با نام مسیر گیرندههای شبهتول (TLRs) را فعال کند. TLRها گیرندههای انتقال پیام غشایی هستند که وظایف اساسی در دفاع ذاتی علیه میکروارگانیسمها را دارند. این گیرندههای پروتئینی، در غشای سلولهای ماکروفاژ و سلولهای دندریتیک حاضر هستند و غالباً در شناسایی مولکولهای مشتق از میکروبها تأثیرگذار میباشند (9). TLR4 (Toll-like receptor 4) یکی از گیرندههای اختصاصی تشخیص دهنده پاتوژن است که لیپوپلیساکاریدهای باکتری گرم منفی، برخی از ساختارهای محافظت شده قارچی تا پاتوژنهای مایکوباکتریایی و بعضی از لیگاندهای داخلی را تشخیص میدهد (10). با توجه به مطالعات گذشته، مشخص شده که یکی از عوامل بروز التهاب انجام فعالیت ورزشی حرفهای و مداوم است. فعالیت ورزشی مداوم و پرشدت و فعالیتهای ورزشی برونگرا، میتوانند موجب ایجاد واکنشهای التهابی قوی گردند، که توسط افزایش سایتوکاینهای التهابی در خون و بافتهای مختلف بدن مشخص میشود (11،12). اما از سویی دیگر، یافتههای برخی مطالعات، از فعالیت ورزشی مداوم به عنوان یک درمان ضدالتهابی برای افراد با اختلالات التهابی مزمن یاد کردهاند (13). تأثیر فعالیت ورزشی قبلی در ایجاد حفاظت عصبی و مقاومت نورونها در برابر التهاب سیستم عصبی، پیشآمادهسازی با فعالیت ورزشی نامیده میشود، که گستره جدیدی در زمینه تأثیر فعالیت ورزشی بر مغر بهشمار میرود (14). پژوهشهای گذشته نشان دادند که پیشآمادهسازی با فعالیت ورزشی توسط سازوکارهای گوناگون در ایجاد حفاظت عصبی آندوژن کمک میکند که یکی از این سازوکارها از طریق کاهش التهاب، کاهش ICAM-1، کاهش بیان TLR2 و TLR4 و تنظیم بهتر میزان TNF-α در مغز و پاسخ حاد آن است (15). با توجه به اینکه نقش التهابی یا ضدالتهابی فعالیت ورزشی بهخوبی مشخص نشده اما اکثر پژوهشگران از فعالیت ورزشی به عنوان یک ابزار شناخته شده برای مقابله با وضعیتهای مزمن التهابزا یاد میکنند اما مکانیسمهای آن دقیقاً مشخص نیست بهویژه در زمانی که تمرکز بر مسیر پیامرسانی TLR باشد (16). در حال حاضر هیچ اجماع نظری در مورد تنظیم گیرندههای شبهتول ناشی از فعالیت ورزشی در بین پژوهشگران وجود ندارد و این ناشی از پژوهشهای اندکی است که در مورد تأثیر انواع مختلف فعالیتهای ورزشی بر شاخصهای التهابی مغز انجام شده است. همچنین اثرگذاری تمرینات HIIT بر بافتهای عضلات اسکلتی و قلبی در افراد سالم و دارای بیماری در پژوهشهای گذشته بررسی شده است، اما تأثیر تمرینات HIIT بر سازگاریهای بافت مغزی کمتر بررسی شده است. در نهایت با توجه به اینکه پژوهشهای گذشته از اهمیت فعالیت ورزشی بهعنوان مداخلهای کاربردی در ایجاد حفاظت عصبی ناشی از التهاب مغزی، حمایت میکنند اما تاکنون اطلاعات دقیقی در مورد نوع پیشآمادهسازی با فعالیت ورزشی، مدت و شدت آن که بتواند موجب ایجاد بیشترین میزان حفاظت عصبی و کاهش التهاب مغزی گردد، موجود نیست و در کل میتوان بیان کرد که سازوکار دقیق حفاظت عصبی متعاقب پیشآمادهسازی بهطور کامل مشخص نشده است. در همین راستا نتایج ضد و نقیضی گزارش شده که برخی حاکی از اثرات مثبت تمرین تناوبی با شدت بالا و تداومی با شدت متوسط (17) و برخی حاکی از اثرات مخرب تمرین ورزشی در اثر فعالسازی گونههای اکسیژن فعال و نهایتاً ترشح سایتوکاینهای التهابی (11) هستند که اهمیت پژوهش بیشتر در این زمینه را نمایان میکند. بهطور کلی و با توجه به پژوهشهای اندک و عدم قطعیت در این زمینه پژوهش حاضر با هدف بررسی تأثیر 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط بر مقادیر پروتئینهای TNF-α، TLR4 در دو ناحیه استراتوم و قشر مغز رتهای صحرایی نر نژاد ویستار انجام گرفته است.
روش بررسی
طرح پژوهش
پژوهش حاضر از نظر هدف کاربردی و از نظر روش تحقیق تجربی میباشد که در دو گروه تجربی و یک گروه کنترل انجام شد. نمونه آماری پژوهش حاضر را 18 سر رت نر هشت هفته-ای نژاد ویستار تشکیل دادند. این تعداد نمونه بهطور تصادفی در سه گروه تمرین هوازی تناوبی پر شدت (6 سر)، تمرین هوازی تداومی با شدت متوسط (6 سر) و گروه کنترل (6 سر) قرار گرفتند. روش تصادفی سازی به این صورت بود که در ابتدا موشها شمارهگذاری شدند سپس برای انتخاب آزمودنیهای گروههای سهگانه بهصورت کاملاً تصادفی در هر گروه 6 عدد انتخاب شد و موشهای انتخاب شده در 6 قفس و هر قفس سه موش نگهداری شدند.
شرایط نگهداری
محیط نگهداری رتها قفسهایی از جنس پلیکربنات شفاف در ابعاد 20*15*15 سانتیمتر بود. حیوانات در محیطی با دمای 23-28 درجه سانتیگراد و چرخه روشنایی- تاریکی 12:12 ساعت و رطوبت 50-40 درصد نگهداری شدند. در تمامی مراحل پژوهش، غذا و آب مورد نیاز حیوانات بهصورت آزاد در اختیار آنها قرار گرفت.
پروتکل تمرینی
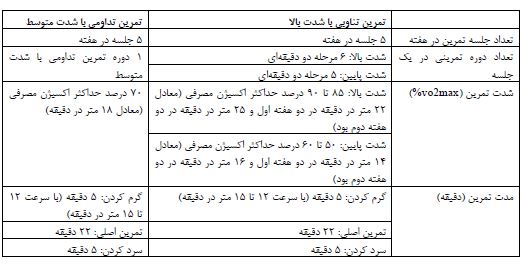
آشناسازی با تمرین بهمدت دو هفته در گروههای تمرین انجام شد و به این صورت بود که رتها 5 روز در هفته و هر روز به مدت 15 دقیقه روی تردمیل با سرعت 5 تا 15 متر در دقیقه و با شیب صفر درجه دویدند. جهت تعیین سرعت حداکثر سرعت دویدن و حداکثر اکسیژن مصرفی از آزمون فزاینده استاندارد بیدفورد و همکاران (1979) استفاده شد (18) که بهوسیله لیاندرو و همکاران (2007) جهت رتهای نژاد ویستار استانداردسازی گردیده است (19). آزمون شامل 10 مرحله سه دقیقهای است. سرعت در مرحله اول 0/3 کیلومتر بر ساعت (برابر با 5 متر بر دقیقه) و در مراحل بعدی 0/3 کیلومتر بر ساعت به سرعت نوارگردان اضافه شد. با توجه به اینکه روش آزمون واماندهساز لیاندرو و همکاران (19) دارای شیب متفاوت میباشد، در این تحقیق از شیب صفر برای تعیین سرعت حداکثر اکسیژن مصرفی استفاده شد و سرعت بدست آمده در آخرین مرحله که حیوان قادر به دویدن نبود به عنوان حداکثر سرعت دویدن حیوان استفاده شد. این آزمون در دو مرحله (پیش از شروع پروتکل تمرینی و ابتدای هفته سوم پروتکل تمرینی) اجرا گردید. در این پژوهش حداکثر سرعت دویدن در مرحله اول 20 تا 23 متر در دقیقه و در مرحله دوم 25 تا 28 متر در دقیقه بود. برنامه تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط پروتکل تمرین تناوبی با شدت بالا و تداومی با شدت متوسط شامل سه قسمت گرمکردن، تمرین اصلی و سردکردن بود. دوره تمرین به مدت 4 هفته، هر هفته 5 جلسه و هر جلسه 32 دقیقه به طول انجامید (جدول 1).
جدول 1. پروتکل تمرین (20)
روش بافتبرداری: برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل آزمودنیها در حین اجرای برنامه تمرینی، بافتبرداری در 48 ساعت پس از آخرین جلسه تمرینی انجام شد. رتها با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیب کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس با استفاده از گیوتین سر جدا شده و بافت مغز جدا گردید و با استفاده از دستگاه Brain Matrix بافتهای قشر و استراتوم جدا گردید و بلافاصله با استفاده از مایع ازت منجمد و برای سنجشهای بعدی در دمای 80- درجه سانتی گراد فریز شدند.
سنجش میزان پروتئین TNF-α و TLR4: از روش وسترن بلات برای سنجش میزان پروتئین TNF-α و TLR4 استفاده شد که شامل مراحل زیر بود:
الف) لیز کردن بافت: برای لیز کردن بافتها از Lysis buffer استفاده شد و سپس نمونهها در سانتریفیوژ مدل Eppendorph 5415 R در دمای چهار درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند. مایع شفاف (Supernatant) حاوی پروتئین استخراج و در فریزر با دمای 20- نگه داری شد.
ب) تعیین غلظت پروتئین به وسیله بردفورد: برای ساخت محلول بردفورد کوماسی بلو کاملاً در الکل بهمدت 20 دقیقه حل شد، سپس اسیدفسفوریک قطره قطره به آن اضافه شد. سپس آب را قطره قطره اضافه شد تا محلول حاصل به حجم 50 میلی لیتر رسید. محلول تهیه شده با کاغذ صافی دو بار صاف شده و در بطری تیره داخل یخچال نگهداری شد.
پ) تهیه غلظه های مختلف BSA برای رسم منحنی استاندارد: از BSA به عنوان پروتئین استاندارد برای اندازهگیری میزان پروتئین استفاده شد. غلظتهای 0/25، 0/5، 1، 0/15، 0/3، 0/6، 0/125 از پروتئین استاندارد با افزودن نصف حجم آب به غلظت قبلی ایجاد شد.
ت) آماده سازی نمونه: نمونههای پروتئینی تهیه شده قبل از ریخته شدن در چاهک، هم غلظت شده و با بافر نمونه مخلوط و به مدت 5 تا 10 دقیقه در آب 100 درجه سانتیگراد جوشانده شد. این بافر موجب سنگین شدن، احیا و خطی شدن پروتئینها میشود علاوه بر آن برموفنول بلو موجود در بافر طریقه حرکت پروتئینها را در ژل نشان میدهد.
ث) ساخت الکتروفوژ بر روی ژل SDS page: ژل SDS page از پلیمرآکریل آمید ساخته شد که بیس آکریلآمید این پلیمر را بهصورت عرضی به هم مرتبط کرد، بهگونهای که منافذ با قطر معین و یکسان در ژل حاصل شد. پلیمریزاسیون ژل با افزودن آمونیوم پرسولفات شروع شده و با اضافه کردن tetramethyethylenediamine (TEMED) موجب تشکیل رادیکالهای آزاد از APS شده که این رادیکالها باعث پلیمریزاسون میشد.
ج) روش انجام آزمایش و ساختن ژل پایین به بالا: برای دورگیری ژل، 1000 میکرولیتر از ژل پایین کاملاً فاقد تمد را برداشته و به آن 4 میکرولیتر تمد اضافه شد. سپس محلول حاصل را به سرعت از گوشههایی از فضایی دو ژل ریخته، بعد از دورگیری 15 دقیقه، فرصت داده تا کاملاً بگیرد و سپس محلول ژل کامل به همراه تمد را برداشته بهوسیله سمپلر در فضایی بین دو شیشه ریخته بهطوری که تا دوسوم شیشهها پر شد. سپس مقداری اتانول اشباع شده اسپری کرده تا مانع خشک شدن ژل شود و به علت سنگینی حاصل از آن سطح ژل صاف شد. حدود 45 دقیقه برای پلیمریزاسیون ژل پایین لازم است و در این مرحله ژل بالا 5 درصد آماده شد.
چ)الکتروفوز بر ژل SDS page: شیشههای حاوی ژل، درون تانک الکتروفوز قرار داده شد. بافر الکتروفور اضافه گردید و سپس ابتدا مارکر پروتئین رنگی به میزان دو میکرولیتر در چاهک اول و نمونهها در سایر چاهکها به میزان 12 میکرولیتر توسط سرنگ همیلتون لود شد. سپس الکترودها را به دستگاه مولد جریان وصل کرده و تا رسیدن پروتئینها به ژل پایین، حدود 45 دقیقه جریان با ولتاژ 120 برقرار شد.
ح) وسترن بلات یا ایمنوبلاتینگ: ایمنوبلاتینگ روشی است که طی آن باندهای پروتئینی جدا شده توسط ژل الکتروفوز به غشایی از جنس نیترو سلولوز یا PVDF انتقال یافته و سپس بهوسیله آنتی بادی اختصاصی پروتئینهای روی آن شناسایی میشود. انتقال نمونهها از ژل به کاغذ توسط جریان الکتریکی صورت گرفت.
خ) بعد از اتمام الکتروفوز ژل به آرامی از شیشهها جدا شده و در بافر انتقال قرار گرفت. سپس کاغذ PVDF به اندازه ژل بریده شده و برای فعال شدن به مدت 1 دقیقه در متانول شیک شده و با آب مقطر شسته شده و درون بافر انتقال قرار گرفت. در حین قرار دادن کاغذ صافی روی کاغذ PVDF و کاغذ PVDF روی ژل، حبابهایی ایجاد شده توسط حرکت آهسته اسپیسر روی کاغذ صافی خارج شد. در نهایت دستگاه و با ولتاژ 120 میلیولت به مدت یکونیم ساعت به منبع مولد جریان متصل گشته و پروتئینهای موجود در ژل به کاغذ منتقل شدند.
د) مرحله بلاکینگ: در مرحله بلاکینک، محلول Blocking به منظور پوشاندن کاغذ برای جلوگیری از واکنش غیر اختصاصی آنتیبادی اولیه به کار میرود.
ذ) مرحله انکوبه کردن با آنتیبادی اولیه و ثانویه: پس از پایان یافتن زمان بلاکینگ کاغذ با آنتیبادی اولیهای که با محلول بلاکینگ به مقدار معین آنتیبادی اولیه β-actin (sc-47778,1: 300) مخلوط و رقیق شده بود، به مدت 16 تا 18 ساعت انکوبه شد. سپس کاغذ با آنتیبادی ثانویه با غلظت (1:1000) برای آنتیبادیهای اولیه بهمدت یک ساعت و 15 دقیقه در دمای اتاق شیک شد.
ر) مرحله آشکارسازی: پس از شستوشوی نهایی مرحله قبل آب اضافی کاغذ PVDF روی سلفون قرار میگرفت و محلول کمولومینسانس با سمپلر روی نواحی باند مورد نظر ریخته شد. کاغذ در سلفون گذاشته شد و درون کاست فیلم قرار داده شد.
ز) مرحله ظهور فیلم در تاریک خانه) برای مشاهده باند پروتئینی مورد نظر فیلم عکاسی را بر کاغذ دارای پوشش نایلونی گذاشته و در کاست بسته شد. مدت زمان باقی ماندن فیلم در کاست برای آنتیبادیهای TNF-α و TLR4، 60 تا 80 ثانیه و در مورد آنتی بادی β-actin 10 ثانیه بود. سپس در تشتک آب فیلم را به مدت 20 ثانیه شسته و بعد از آن بهمدت 20 ثانیه در محلول ثبوت تکان داده شد. درنهایت مجدداً فیلم را با آب جاری شسته و با گیره آویزان شد تا خشک شود.
تجزیه و تحلیل آماری
در این پژوهش از روش آمار توصیفی شامل: فراوانی، میانگین و انحراف استاندارد، برای تعیین نرمال بودن توزیع داده ها از آزمون شاپیروویلک و برای تحلیل دادهها از آزمون تحلیل واریانس یکراهه و به کمک نرمافزارversion 16 SPSS استفاده شد.
ملاحظات اخلاقی
در پژوهش حاضر برای کار با حیوانات از ضوابط اخلاقی نگهداری و استفاده از حیوانات آزمایشگاهی کشور استرالیا استفاده گردید، همچنین این پژوهش توسط کمیته ملی اخلاق در پژوهش های زیست پزشکی دانشگاه علوم پزشکی شیراز به شماره IR-SUMS.REC.1399.905 تصویب شد.
نتایج
مقادیر پیش آزمون و پس آزمون وزن موش های صحرایی در هر سه گروه مورد مطالعه در جدول 2 ذکر شده است.
نتایج آزمون تحلیل واریانس یک راهه نشان داد متغیر TNF-α در نواحی قشر (p=0/113) و استراتوم مغزی (p=0/425) و همچنین TLR4 در نواحی قشر (p=0/162) و استراتوم مغزی (p=0/293) پس از 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط تغییر معناداری نسبت به گروه کنترل نداشتند. همچنین آزمون تعقیبی LSD تفاوت معناداری بین گروههای مورد مطالعه نشان نداد (p≥0/05). همچنین شکل های مربوط به باندهای وسترنبلات در قشر و استراتوم مغز گروه های مورد مطالعه در شکلهای 1 تا 4 قابل مشاهده است.
جدول 2: وزن موشهای صحرایی (g) در گروههای مورد مطالعه (n=6)
.JPG)
HIIT: تمرین تناوبی با شدت بالا؛ MICT: تمرین تداومی با شدت متوسط
برای تعیین نرمال بودن توزیع دادهها از آزمون شاپیروویلک استفاده شد که نتایج حاکی از نرمال بودن توزیع دادهها داشت و اجازه استفاده از آزمون پارامتریک آنالیز واریانس یکراهه به محقق داده شد. شاخصهای توصیفی مربوط به متغیرهای TNF-α و TLR4 در نواحی قشر و استراتوم مغزی در جدول 3 ذکر شده است.
جدول 3: شاخصهای توصیفی متغیرهای TNF-α و TLR4 در گروههای HIIT، MICT و کنترل

HIIT: تمرین تناوبی با شدت بالا؛ MICT: تمرین تداومی با شدت متوسط؛ TNF-α: فاکتور نکروز دهنده تومور آلفا؛ TLR4: گیرنده شبه تول 4
نتایج آزمون تحلیل واریانس یک راهه در جدول 4 ذکر شده است.
جدول 4: نتایج آزمون تحلیل واریانس یکراهه
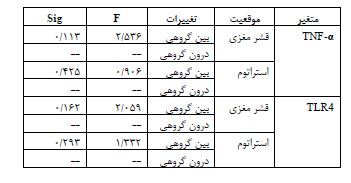
TNF-α : فاکتور نکروز دهنده تومور آلفا؛ TLR4: گیرنده شبهتول 4
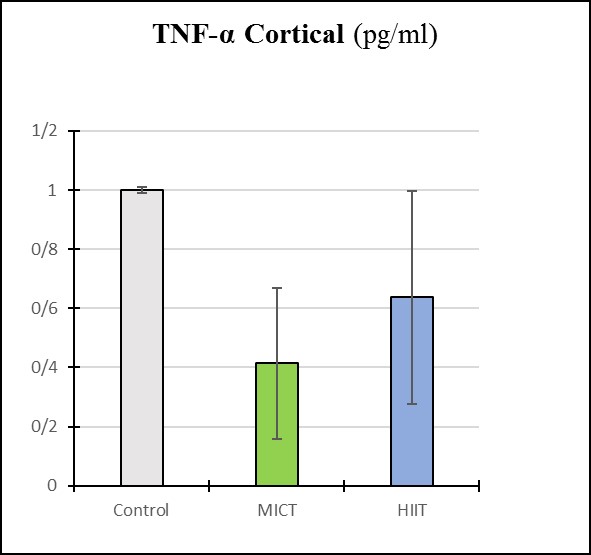
نمودار 1: بررسی میزان TNF-α در قشر مغز گروه های پژوهش
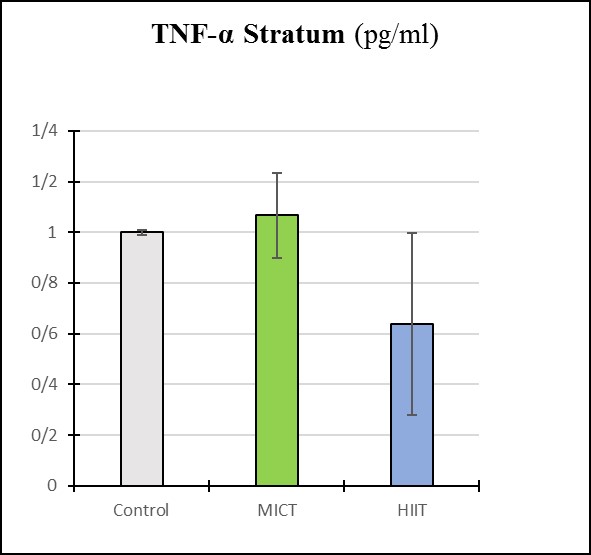
نمودار 2: بررسی میزان TNF-α در استراتوم مغز گروه های پژوهش
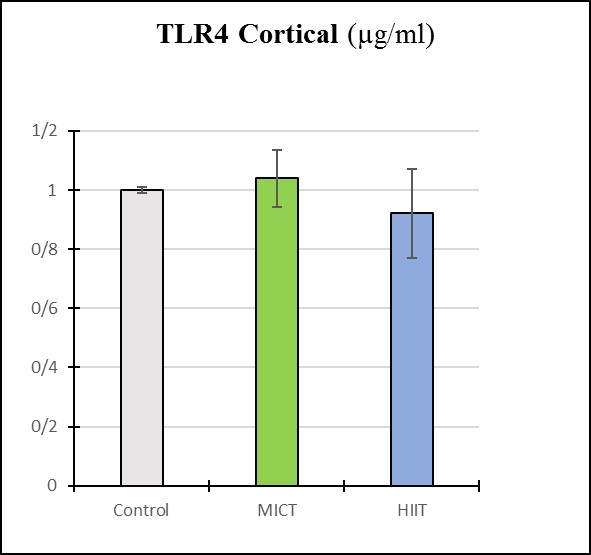
نمودار3: بررسی میزان TLR4 در قشر مغز گروه های پژوهش

نمودار 4: بررسی میزان TLR4 در استراتوم مغز گروههای پژوهش

شکل 1: باندهای وسترن بلات مربوط به فاکتور TNF-α در استراتوم گروههای پژوهش

شکل 2: باندهای وسترن بلات مربوط به فاکتور TNF-α در قشر مغزی گروه های پژوهش

شکل 3: باندهای وسترن بلات مربوط به فاکتور TLR4 در استراتوم گروههای پژوهش
شکل 4: باندهای وسترن بلات مربوط به فاکتور TLR4 در استراتوم گروههای پژوهش
بحث
پژوهش حاضر با هدف بررسی تأثیر 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط بر مقادیر پروتئینهای TNF-α، TLR4 در دو ناحیه استراتوم و قشر مغز رت¬های صحرایی نر انجام گردید. نتایج این پژوهش حاکی از عدم تأثیر 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط بر مقادیر پروتئین های TNF-α، TLR4 در دو ناحیه استراتوم و قشر مغز رت های صحرایی نر بود. ارتباط TLR4 با TNF-α با بروز التهاب و با واسطه آبشار پیام رسانی TLR4 توسط اتصال لیگاند لیپوپلی ساکارید (LPS) به دومین خارج سلولی TLR4 آغاز می گردد (21). این آبشار با میانجی گری MyD88 در پیام سانی TLR4 که عمدتاً در غشاء های پلاسمایی روی می دهد، انجام می گیرد و شامل فسفوریلاسیون کینازهای مرتبط با IL-1R، ارتباط با گیرنده TNF-α و سیگنال های پایین دست می باشد که درنهایت منجر به فعال سازی NF-κB و القاء واسطه های پیش التهابی همانند TNF-α و IL-6 می گردد (22). همچنین مشخص شده که ماکروفاژها سطوح بالایی از TLR4 را بیان می کنند و این سلول ها موقعی که با LPS فعال شوند سایتوکاین های پیشالتهابی نظیر TNF-α را تولید می کنند و این بیانگر نقش اساسی ماکروفاژها در بروز پاسخ های التهابی توسط فعال سازی TLR4 به وسیله LPS است (23). در راستای تأثیر تمرینهای HIIT و MICT بر شاخص های التهابی، نتایج ضد و نقیض است. پروایز و هافمن-گویتز (2012)، با بررسی تغییرات سایتوکاین های التهابی در پاسخ به تمرینات شدید در موشهای ماده دریافتند که میزان TNF-α پس از تمرین شدید بر روی تردمیل کاهش پیدا کرد (24). در مقابل مارتین-کوردرو و همکاران (2011)، افزایش مقادیر TNF-α را بعد از تمرین هوازی در نمونههای حیوانی دارای اختلال متابولیکی مشاهده کردند (25). مختارزاده و همکاران (2017)، در پژوهشی نشان دادند که تمرین هوازی تناوبی با شدت بالا میتواند موجب کاهش TNF-α در زنان مبتلا به مولتیپل اسکلروزیس گردد (26). اکبری و همکاران (2019)، در پژوهش خود نشان دادند که 12 هفته تمرین HIIT و MICT موجب کاهش معنادار TNF-α و IL-10 سرمی در رت های نر چاق گردید (27). احتمالاً دلیل اصلی وجود تفاوت در نتایج این پژوهش ها با پژوهش حاضر در این است که در بیشتر این پژوهش از آزمودنی های مبتلا به بیماری که شرایط بروز التهاب در آنها فراهم بوده استفاده شده و فعالیت ورزشی موجب سرکوب التهاب در این افراد شده که در پژوهش حاضر با توجه به استفاده از رت های سالم به عنوان جامعه آماری این کاهش در میزان TNF-α دیده نشد. TNF-α یک سایتوکاین پیش-التهابی است که در بروز التهاب سیستمیک نقش اساسی ایفا میکند و قادر به القای تب، مرگ برنامهریزی شده سلول، سرکوب تومورزایی، تکثیر ویروس و پاسخ به عفونت است (7). افزایش بافت چربی موجب افزایش تولید آدیپوکاینهای پیش-التهابی و بالعکس کاهش بافت چربی موجب کاهش میزان سایتوکاین های ضدالتهابی می گردد. با توجه به این رابطه میتوان بیان کرد که ورزش منظم توانایی این را دارد که با کاهش توده چربی حتی بدون کاهش وزن موجب کاهش سایتوکاینهای پیشالتهابی نظیر TNF-α گردد (28). از سویی گیرنده های TLR نقشی اساسی را در سیستم ایمنی بدن توسط شناخت و شروع یک پاسخ التهابی به سلولهای خطرناک ایفا می کنند که خود موجب رونویسی از سایتوکاین ها و کموکاین ها می شود. فعال شدن TLRها میتواند منجر به افزایش سطوح سایتوکاینهای پیشالتهابی نظیر TNF-α گردد. پژوهش های گوناگون گزارش کردند که تمرین های ورزشی منظم موجب کاهش بیان گیرندههای TLR2 و TLR4 بر روی مونوسیتها میگردد و با توجه به اینکه این گیرنده ها می توانند بیان سایتوکاین های پیش التهابی را آغاز نمایند، نتیجه مثبتی در پیشگیری از بروز التهاب داشته باشند (29). در همین راستا اکبری و همکاران (2019)، مکانیسم اصلی کاهش TNF-α را القای TLR4 بیان کردند (27). طبق این مسیر فعالسازی TLR4 با اسیدهای چرب آزاد موجب تحریک سیگنالینگ NF-κB و بیان TNF-α در آدیپوسیت ها می گردد (30). در نتیجه احتمالاً یکی از علتهای سرکوب TNF-α ناشی از تمرین ورزشی در موشهای چاق تنظیم کاهشی TLR4 باشد (27). همچنین تیمرمان و همکاران (2008)، در پژوهشی نشان دادند که تمرین های ورزشی منظم موجب کاهش مونوسیتهای در گردش میگردد و در نتیجه خود موجب کاهش عوامل التهابی میگردد (31). شاید اصلی-ترین علت در عدم کاهش TLR4 و TNF-α در پژوهش حاضر مدت زمان پژوهش و همچنین استفاده از موشهای جوان و با وزن نرمال باشد. همچنین یکی دیگر از علل احتمالی عدم وجود تفاوت معنادار مدت زمان تمرین بود. در پژوهشهای قبلی عموماً 8 هفته تمرین اجرا گردید و در این پژوهش به خاطر بررسی اجرای تمرین در مدت زمان کمتر و بررسی اثرات این نوع تمرینات از 4 هفته استفاده گردید که شاید یکی از دلایل عدم اثرگذاری تمرین بوده است. همچنین برخی پژوهش های گذشته نشان دادند که پیش آماده سازی با فعالیت ورزشی توسط سازوکارهای گوناگون در ایجاد حفاظت عصبی آندوژن کمک میکند. این سازوکارها عبارتند از؛ 1) تنظیم افزایشی بیان نوروتروفین ها مثل BDNF، NGF و IGF-1؛ 2) کاهش التهاب، کاهش ICAM-1، کاهش بیان TLR2 و TLR4 و تنظیم بهتر میزان TNF-α در مغز و پاسخ حاد آن؛ 3) افزایش قدرت آنتیاکسیدانی مغز و کاهش استرس اکسیداتیو که گزارش شده در کاهش حجم انفارکت و نتایج نورولوژیک پس بروز سکته مغزی اثرگذار است؛ 4) بهبود متابولیسم مغزی و کاهش اختلالات متابولیک مغزی بر اثر افزایش بیان GLUT-1 و GLUT-3، افزایش فعالیت AMPK و افزایش فعالیت آنزیم های گلیکولیزی مهم مغزی مثل LDH و PFK؛ 5) کاهش آپوپتوزیس و افزایش بقاء نورونی پس از آسیب ایسکمیک، خونرسانی مجدد، که وابسته به نسبت عوامل پیش آپوپتوزی همچون Bax، Bad، Bak و AIF به ضدآپوپتوزی همچون Bcl-2، HSP-70 و HSP-27 و همچنین کارایی بهتر میتوکندری ها به عنوان دروازه بان مرگ یا بقاء سلولی؛ 6) گسترش شبکه مویرگی و شریانی مغز براثر افزایش چکالی عروق مغزی، آنژیوژنز و آرتریوژنز در قسمتهای مختلف مغزی؛ 7) تقویت سد خونی- مغزی (14). بهطور کلی و با توجه به نتایج پژوهش های گذشته بهنظر میرسد تمرینات هوازی عامل اصلی و بالقوه در تغیرات مربوط به TNF-α خصوصاً در اختلالات متابولیکی باشند (32). اما از سوی دیگر پاسخ های متابولیکی در طی تمرینات تناوبی، شدیدتر از پاسخ های تمرین های تداومی و متوالی و با شدت متوسط است که همین امر موجب می گردد تا تغییرات TNF-α متعاقب تمرینات تناوبی قویتر از تغییرات آن پس از تمرینات هوازی با شدت متوسط باشد (33). بنابراین به احتمال فراوان تمرینات تناوبی همانند تمرینات تداومی طولانی مدت با تغییر در میزان دسترسی به مواد غذایی در طی ورزش و ایحاد کسر انرژی، مسیرهای متابولیکی مؤثر در تنظیم بیان TNF-α را فعال کرده و از این مسیر موجب تعدیل و تنظیم این سایتوکاین میگردد.
نتیجه گیری
با توجه به این یافته ها می توان اظهار داشت که افزایش TLR4 و TNF-α خود بیانگر افزایش التهاب در مغز است و انجام تمرین ورزشی چه با شدت بالا و چه با شدت متوسط نمیتواند عاملی مؤثر بر افزایش شاخصهای التهابی در مغز باشد.
سپاسگزاری
این پژوهش برگرفته از رساله دکتری رشته فیزیولوژی ورزشی دانشگاه شیراز می باشد. از تمامی کسانی که در انجام این پژوهش ما را یاری کردند کمال تشکر و قدردانی را داریم.
حامی مالی: دانشگاه شیراز
تعارض در منافع: وجود ندارد.
التهاب یک سازوکار دفاعی بدن در مقابل محرکهای آسیبزا است که میتواند واکنشها و خطوط دفاعی بدن را فعال کند (1). التهاب در مغز با نام التهاب عصبی شناخته شده است و میتواند بهوسیله سیگنالهای ارسال شده از نورونهای تخریب شده، ارگانیسمهای مهاجم مثل ویروسها و باکتریها، مواد شیمیایی مضر و همچنین پروتئینهای تغییر شکل یافته (مثل پپتیدهای آمیلوئید بتا) در مغز تحریک شود (2). التهاب عصبی موجب افزایش ترشح سایتوکاینهایی نظیر TNF-α (Tumor necrosis factor alpha)، اینترلوکین-1 (IL-1) و اینترلوکین-6 (IL-6) میشود که خود موجب تحریک بیان مولکولهای چسبان سلولی همانند مولکول چسبان سلولی-1 (ICAM-1)، پیسلکتین و ایسلکتین در سلولهای آندوتلیال میگردند (3). سلولهای میکروگلیا در پاسخ به عوامل التهابی نظیر لیپوپلیساکارید باکتریایی (LPS) و اینترفرون گاما (INF- γ)، سایتوکاینهای التهابی نظیر عامل نکروز دهنده تومور- آلفا (TNF-α)، اینترلوکین- 1 بتا (IL-1β)، اینترلوکین- 6، NO و ROS تولید میکنند (4). TNF-α یکی از مهمترین سایتوکاینهای التهابی و یک پلیپپتید چندوجهی و 17 کیلودالتونی است و از برخی سلولهای ایمنی همانند مونوسیتها، سلولهای کشنده طبیعی و ماکروفاژها ترشح میشود و موجب ایجاد ادم مغزی و نابودی نورونها میشود و بیانگر التهاب مغزی است (5،6). برخی پژوهشها نشان میدهند که در بیماران مبتلا به بیماریهای عصبی میزان عوامل التهابی در مقایسه با افراد سالم بیشتر است که خود میتواند دلیلی برای بروز انحطاط عصبی در این بیماران باشد (7،8). از طرفی بروز التهاب در مغز میتواند یکی از مسیرهای التهابی با نام مسیر گیرندههای شبهتول (TLRs) را فعال کند. TLRها گیرندههای انتقال پیام غشایی هستند که وظایف اساسی در دفاع ذاتی علیه میکروارگانیسمها را دارند. این گیرندههای پروتئینی، در غشای سلولهای ماکروفاژ و سلولهای دندریتیک حاضر هستند و غالباً در شناسایی مولکولهای مشتق از میکروبها تأثیرگذار میباشند (9). TLR4 (Toll-like receptor 4) یکی از گیرندههای اختصاصی تشخیص دهنده پاتوژن است که لیپوپلیساکاریدهای باکتری گرم منفی، برخی از ساختارهای محافظت شده قارچی تا پاتوژنهای مایکوباکتریایی و بعضی از لیگاندهای داخلی را تشخیص میدهد (10). با توجه به مطالعات گذشته، مشخص شده که یکی از عوامل بروز التهاب انجام فعالیت ورزشی حرفهای و مداوم است. فعالیت ورزشی مداوم و پرشدت و فعالیتهای ورزشی برونگرا، میتوانند موجب ایجاد واکنشهای التهابی قوی گردند، که توسط افزایش سایتوکاینهای التهابی در خون و بافتهای مختلف بدن مشخص میشود (11،12). اما از سویی دیگر، یافتههای برخی مطالعات، از فعالیت ورزشی مداوم به عنوان یک درمان ضدالتهابی برای افراد با اختلالات التهابی مزمن یاد کردهاند (13). تأثیر فعالیت ورزشی قبلی در ایجاد حفاظت عصبی و مقاومت نورونها در برابر التهاب سیستم عصبی، پیشآمادهسازی با فعالیت ورزشی نامیده میشود، که گستره جدیدی در زمینه تأثیر فعالیت ورزشی بر مغر بهشمار میرود (14). پژوهشهای گذشته نشان دادند که پیشآمادهسازی با فعالیت ورزشی توسط سازوکارهای گوناگون در ایجاد حفاظت عصبی آندوژن کمک میکند که یکی از این سازوکارها از طریق کاهش التهاب، کاهش ICAM-1، کاهش بیان TLR2 و TLR4 و تنظیم بهتر میزان TNF-α در مغز و پاسخ حاد آن است (15). با توجه به اینکه نقش التهابی یا ضدالتهابی فعالیت ورزشی بهخوبی مشخص نشده اما اکثر پژوهشگران از فعالیت ورزشی به عنوان یک ابزار شناخته شده برای مقابله با وضعیتهای مزمن التهابزا یاد میکنند اما مکانیسمهای آن دقیقاً مشخص نیست بهویژه در زمانی که تمرکز بر مسیر پیامرسانی TLR باشد (16). در حال حاضر هیچ اجماع نظری در مورد تنظیم گیرندههای شبهتول ناشی از فعالیت ورزشی در بین پژوهشگران وجود ندارد و این ناشی از پژوهشهای اندکی است که در مورد تأثیر انواع مختلف فعالیتهای ورزشی بر شاخصهای التهابی مغز انجام شده است. همچنین اثرگذاری تمرینات HIIT بر بافتهای عضلات اسکلتی و قلبی در افراد سالم و دارای بیماری در پژوهشهای گذشته بررسی شده است، اما تأثیر تمرینات HIIT بر سازگاریهای بافت مغزی کمتر بررسی شده است. در نهایت با توجه به اینکه پژوهشهای گذشته از اهمیت فعالیت ورزشی بهعنوان مداخلهای کاربردی در ایجاد حفاظت عصبی ناشی از التهاب مغزی، حمایت میکنند اما تاکنون اطلاعات دقیقی در مورد نوع پیشآمادهسازی با فعالیت ورزشی، مدت و شدت آن که بتواند موجب ایجاد بیشترین میزان حفاظت عصبی و کاهش التهاب مغزی گردد، موجود نیست و در کل میتوان بیان کرد که سازوکار دقیق حفاظت عصبی متعاقب پیشآمادهسازی بهطور کامل مشخص نشده است. در همین راستا نتایج ضد و نقیضی گزارش شده که برخی حاکی از اثرات مثبت تمرین تناوبی با شدت بالا و تداومی با شدت متوسط (17) و برخی حاکی از اثرات مخرب تمرین ورزشی در اثر فعالسازی گونههای اکسیژن فعال و نهایتاً ترشح سایتوکاینهای التهابی (11) هستند که اهمیت پژوهش بیشتر در این زمینه را نمایان میکند. بهطور کلی و با توجه به پژوهشهای اندک و عدم قطعیت در این زمینه پژوهش حاضر با هدف بررسی تأثیر 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط بر مقادیر پروتئینهای TNF-α، TLR4 در دو ناحیه استراتوم و قشر مغز رتهای صحرایی نر نژاد ویستار انجام گرفته است.
روش بررسی
طرح پژوهش
پژوهش حاضر از نظر هدف کاربردی و از نظر روش تحقیق تجربی میباشد که در دو گروه تجربی و یک گروه کنترل انجام شد. نمونه آماری پژوهش حاضر را 18 سر رت نر هشت هفته-ای نژاد ویستار تشکیل دادند. این تعداد نمونه بهطور تصادفی در سه گروه تمرین هوازی تناوبی پر شدت (6 سر)، تمرین هوازی تداومی با شدت متوسط (6 سر) و گروه کنترل (6 سر) قرار گرفتند. روش تصادفی سازی به این صورت بود که در ابتدا موشها شمارهگذاری شدند سپس برای انتخاب آزمودنیهای گروههای سهگانه بهصورت کاملاً تصادفی در هر گروه 6 عدد انتخاب شد و موشهای انتخاب شده در 6 قفس و هر قفس سه موش نگهداری شدند.
شرایط نگهداری
محیط نگهداری رتها قفسهایی از جنس پلیکربنات شفاف در ابعاد 20*15*15 سانتیمتر بود. حیوانات در محیطی با دمای 23-28 درجه سانتیگراد و چرخه روشنایی- تاریکی 12:12 ساعت و رطوبت 50-40 درصد نگهداری شدند. در تمامی مراحل پژوهش، غذا و آب مورد نیاز حیوانات بهصورت آزاد در اختیار آنها قرار گرفت.
پروتکل تمرینی
آشناسازی با تمرین بهمدت دو هفته در گروههای تمرین انجام شد و به این صورت بود که رتها 5 روز در هفته و هر روز به مدت 15 دقیقه روی تردمیل با سرعت 5 تا 15 متر در دقیقه و با شیب صفر درجه دویدند. جهت تعیین سرعت حداکثر سرعت دویدن و حداکثر اکسیژن مصرفی از آزمون فزاینده استاندارد بیدفورد و همکاران (1979) استفاده شد (18) که بهوسیله لیاندرو و همکاران (2007) جهت رتهای نژاد ویستار استانداردسازی گردیده است (19). آزمون شامل 10 مرحله سه دقیقهای است. سرعت در مرحله اول 0/3 کیلومتر بر ساعت (برابر با 5 متر بر دقیقه) و در مراحل بعدی 0/3 کیلومتر بر ساعت به سرعت نوارگردان اضافه شد. با توجه به اینکه روش آزمون واماندهساز لیاندرو و همکاران (19) دارای شیب متفاوت میباشد، در این تحقیق از شیب صفر برای تعیین سرعت حداکثر اکسیژن مصرفی استفاده شد و سرعت بدست آمده در آخرین مرحله که حیوان قادر به دویدن نبود به عنوان حداکثر سرعت دویدن حیوان استفاده شد. این آزمون در دو مرحله (پیش از شروع پروتکل تمرینی و ابتدای هفته سوم پروتکل تمرینی) اجرا گردید. در این پژوهش حداکثر سرعت دویدن در مرحله اول 20 تا 23 متر در دقیقه و در مرحله دوم 25 تا 28 متر در دقیقه بود. برنامه تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط پروتکل تمرین تناوبی با شدت بالا و تداومی با شدت متوسط شامل سه قسمت گرمکردن، تمرین اصلی و سردکردن بود. دوره تمرین به مدت 4 هفته، هر هفته 5 جلسه و هر جلسه 32 دقیقه به طول انجامید (جدول 1).
جدول 1. پروتکل تمرین (20)

روش بافتبرداری: برای از بین بردن آثار حاد تمرین و متغیرهای غیرقابل کنترل آزمودنیها در حین اجرای برنامه تمرینی، بافتبرداری در 48 ساعت پس از آخرین جلسه تمرینی انجام شد. رتها با رعایت اصول اخلاقی و با تزریق درون صفاقی ترکیب کتامین (30 تا 50 میلیگرم بر کیلوگرم وزن بدن) و زایلازین (3 تا 5 میلیگرم بر کیلوگرم وزن بدن)، بیهوش شدند. سپس با استفاده از گیوتین سر جدا شده و بافت مغز جدا گردید و با استفاده از دستگاه Brain Matrix بافتهای قشر و استراتوم جدا گردید و بلافاصله با استفاده از مایع ازت منجمد و برای سنجشهای بعدی در دمای 80- درجه سانتی گراد فریز شدند.
سنجش میزان پروتئین TNF-α و TLR4: از روش وسترن بلات برای سنجش میزان پروتئین TNF-α و TLR4 استفاده شد که شامل مراحل زیر بود:
الف) لیز کردن بافت: برای لیز کردن بافتها از Lysis buffer استفاده شد و سپس نمونهها در سانتریفیوژ مدل Eppendorph 5415 R در دمای چهار درجه سانتیگراد و با سرعت 12000 دور در دقیقه به مدت 10 دقیقه سانتریفیوژ شدند. مایع شفاف (Supernatant) حاوی پروتئین استخراج و در فریزر با دمای 20- نگه داری شد.
ب) تعیین غلظت پروتئین به وسیله بردفورد: برای ساخت محلول بردفورد کوماسی بلو کاملاً در الکل بهمدت 20 دقیقه حل شد، سپس اسیدفسفوریک قطره قطره به آن اضافه شد. سپس آب را قطره قطره اضافه شد تا محلول حاصل به حجم 50 میلی لیتر رسید. محلول تهیه شده با کاغذ صافی دو بار صاف شده و در بطری تیره داخل یخچال نگهداری شد.
پ) تهیه غلظه های مختلف BSA برای رسم منحنی استاندارد: از BSA به عنوان پروتئین استاندارد برای اندازهگیری میزان پروتئین استفاده شد. غلظتهای 0/25، 0/5، 1، 0/15، 0/3، 0/6، 0/125 از پروتئین استاندارد با افزودن نصف حجم آب به غلظت قبلی ایجاد شد.
ت) آماده سازی نمونه: نمونههای پروتئینی تهیه شده قبل از ریخته شدن در چاهک، هم غلظت شده و با بافر نمونه مخلوط و به مدت 5 تا 10 دقیقه در آب 100 درجه سانتیگراد جوشانده شد. این بافر موجب سنگین شدن، احیا و خطی شدن پروتئینها میشود علاوه بر آن برموفنول بلو موجود در بافر طریقه حرکت پروتئینها را در ژل نشان میدهد.
ث) ساخت الکتروفوژ بر روی ژل SDS page: ژل SDS page از پلیمرآکریل آمید ساخته شد که بیس آکریلآمید این پلیمر را بهصورت عرضی به هم مرتبط کرد، بهگونهای که منافذ با قطر معین و یکسان در ژل حاصل شد. پلیمریزاسیون ژل با افزودن آمونیوم پرسولفات شروع شده و با اضافه کردن tetramethyethylenediamine (TEMED) موجب تشکیل رادیکالهای آزاد از APS شده که این رادیکالها باعث پلیمریزاسون میشد.
ج) روش انجام آزمایش و ساختن ژل پایین به بالا: برای دورگیری ژل، 1000 میکرولیتر از ژل پایین کاملاً فاقد تمد را برداشته و به آن 4 میکرولیتر تمد اضافه شد. سپس محلول حاصل را به سرعت از گوشههایی از فضایی دو ژل ریخته، بعد از دورگیری 15 دقیقه، فرصت داده تا کاملاً بگیرد و سپس محلول ژل کامل به همراه تمد را برداشته بهوسیله سمپلر در فضایی بین دو شیشه ریخته بهطوری که تا دوسوم شیشهها پر شد. سپس مقداری اتانول اشباع شده اسپری کرده تا مانع خشک شدن ژل شود و به علت سنگینی حاصل از آن سطح ژل صاف شد. حدود 45 دقیقه برای پلیمریزاسیون ژل پایین لازم است و در این مرحله ژل بالا 5 درصد آماده شد.
چ)الکتروفوز بر ژل SDS page: شیشههای حاوی ژل، درون تانک الکتروفوز قرار داده شد. بافر الکتروفور اضافه گردید و سپس ابتدا مارکر پروتئین رنگی به میزان دو میکرولیتر در چاهک اول و نمونهها در سایر چاهکها به میزان 12 میکرولیتر توسط سرنگ همیلتون لود شد. سپس الکترودها را به دستگاه مولد جریان وصل کرده و تا رسیدن پروتئینها به ژل پایین، حدود 45 دقیقه جریان با ولتاژ 120 برقرار شد.
ح) وسترن بلات یا ایمنوبلاتینگ: ایمنوبلاتینگ روشی است که طی آن باندهای پروتئینی جدا شده توسط ژل الکتروفوز به غشایی از جنس نیترو سلولوز یا PVDF انتقال یافته و سپس بهوسیله آنتی بادی اختصاصی پروتئینهای روی آن شناسایی میشود. انتقال نمونهها از ژل به کاغذ توسط جریان الکتریکی صورت گرفت.
خ) بعد از اتمام الکتروفوز ژل به آرامی از شیشهها جدا شده و در بافر انتقال قرار گرفت. سپس کاغذ PVDF به اندازه ژل بریده شده و برای فعال شدن به مدت 1 دقیقه در متانول شیک شده و با آب مقطر شسته شده و درون بافر انتقال قرار گرفت. در حین قرار دادن کاغذ صافی روی کاغذ PVDF و کاغذ PVDF روی ژل، حبابهایی ایجاد شده توسط حرکت آهسته اسپیسر روی کاغذ صافی خارج شد. در نهایت دستگاه و با ولتاژ 120 میلیولت به مدت یکونیم ساعت به منبع مولد جریان متصل گشته و پروتئینهای موجود در ژل به کاغذ منتقل شدند.
د) مرحله بلاکینگ: در مرحله بلاکینک، محلول Blocking به منظور پوشاندن کاغذ برای جلوگیری از واکنش غیر اختصاصی آنتیبادی اولیه به کار میرود.
ذ) مرحله انکوبه کردن با آنتیبادی اولیه و ثانویه: پس از پایان یافتن زمان بلاکینگ کاغذ با آنتیبادی اولیهای که با محلول بلاکینگ به مقدار معین آنتیبادی اولیه β-actin (sc-47778,1: 300) مخلوط و رقیق شده بود، به مدت 16 تا 18 ساعت انکوبه شد. سپس کاغذ با آنتیبادی ثانویه با غلظت (1:1000) برای آنتیبادیهای اولیه بهمدت یک ساعت و 15 دقیقه در دمای اتاق شیک شد.
ر) مرحله آشکارسازی: پس از شستوشوی نهایی مرحله قبل آب اضافی کاغذ PVDF روی سلفون قرار میگرفت و محلول کمولومینسانس با سمپلر روی نواحی باند مورد نظر ریخته شد. کاغذ در سلفون گذاشته شد و درون کاست فیلم قرار داده شد.
ز) مرحله ظهور فیلم در تاریک خانه) برای مشاهده باند پروتئینی مورد نظر فیلم عکاسی را بر کاغذ دارای پوشش نایلونی گذاشته و در کاست بسته شد. مدت زمان باقی ماندن فیلم در کاست برای آنتیبادیهای TNF-α و TLR4، 60 تا 80 ثانیه و در مورد آنتی بادی β-actin 10 ثانیه بود. سپس در تشتک آب فیلم را به مدت 20 ثانیه شسته و بعد از آن بهمدت 20 ثانیه در محلول ثبوت تکان داده شد. درنهایت مجدداً فیلم را با آب جاری شسته و با گیره آویزان شد تا خشک شود.
تجزیه و تحلیل آماری
در این پژوهش از روش آمار توصیفی شامل: فراوانی، میانگین و انحراف استاندارد، برای تعیین نرمال بودن توزیع داده ها از آزمون شاپیروویلک و برای تحلیل دادهها از آزمون تحلیل واریانس یکراهه و به کمک نرمافزارversion 16 SPSS استفاده شد.
ملاحظات اخلاقی
در پژوهش حاضر برای کار با حیوانات از ضوابط اخلاقی نگهداری و استفاده از حیوانات آزمایشگاهی کشور استرالیا استفاده گردید، همچنین این پژوهش توسط کمیته ملی اخلاق در پژوهش های زیست پزشکی دانشگاه علوم پزشکی شیراز به شماره IR-SUMS.REC.1399.905 تصویب شد.
نتایج
مقادیر پیش آزمون و پس آزمون وزن موش های صحرایی در هر سه گروه مورد مطالعه در جدول 2 ذکر شده است.
نتایج آزمون تحلیل واریانس یک راهه نشان داد متغیر TNF-α در نواحی قشر (p=0/113) و استراتوم مغزی (p=0/425) و همچنین TLR4 در نواحی قشر (p=0/162) و استراتوم مغزی (p=0/293) پس از 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط تغییر معناداری نسبت به گروه کنترل نداشتند. همچنین آزمون تعقیبی LSD تفاوت معناداری بین گروههای مورد مطالعه نشان نداد (p≥0/05). همچنین شکل های مربوط به باندهای وسترنبلات در قشر و استراتوم مغز گروه های مورد مطالعه در شکلهای 1 تا 4 قابل مشاهده است.
جدول 2: وزن موشهای صحرایی (g) در گروههای مورد مطالعه (n=6)
.JPG)
HIIT: تمرین تناوبی با شدت بالا؛ MICT: تمرین تداومی با شدت متوسط
برای تعیین نرمال بودن توزیع دادهها از آزمون شاپیروویلک استفاده شد که نتایج حاکی از نرمال بودن توزیع دادهها داشت و اجازه استفاده از آزمون پارامتریک آنالیز واریانس یکراهه به محقق داده شد. شاخصهای توصیفی مربوط به متغیرهای TNF-α و TLR4 در نواحی قشر و استراتوم مغزی در جدول 3 ذکر شده است.
جدول 3: شاخصهای توصیفی متغیرهای TNF-α و TLR4 در گروههای HIIT، MICT و کنترل

HIIT: تمرین تناوبی با شدت بالا؛ MICT: تمرین تداومی با شدت متوسط؛ TNF-α: فاکتور نکروز دهنده تومور آلفا؛ TLR4: گیرنده شبه تول 4
نتایج آزمون تحلیل واریانس یک راهه در جدول 4 ذکر شده است.
جدول 4: نتایج آزمون تحلیل واریانس یکراهه

TNF-α : فاکتور نکروز دهنده تومور آلفا؛ TLR4: گیرنده شبهتول 4

نمودار 1: بررسی میزان TNF-α در قشر مغز گروه های پژوهش

نمودار 2: بررسی میزان TNF-α در استراتوم مغز گروه های پژوهش

نمودار3: بررسی میزان TLR4 در قشر مغز گروه های پژوهش

نمودار 4: بررسی میزان TLR4 در استراتوم مغز گروههای پژوهش

شکل 1: باندهای وسترن بلات مربوط به فاکتور TNF-α در استراتوم گروههای پژوهش

شکل 2: باندهای وسترن بلات مربوط به فاکتور TNF-α در قشر مغزی گروه های پژوهش

شکل 3: باندهای وسترن بلات مربوط به فاکتور TLR4 در استراتوم گروههای پژوهش

شکل 4: باندهای وسترن بلات مربوط به فاکتور TLR4 در استراتوم گروههای پژوهش
بحث
پژوهش حاضر با هدف بررسی تأثیر 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط بر مقادیر پروتئینهای TNF-α، TLR4 در دو ناحیه استراتوم و قشر مغز رت¬های صحرایی نر انجام گردید. نتایج این پژوهش حاکی از عدم تأثیر 4 هفته تمرین هوازی تناوبی با شدت بالا و تداومی با شدت متوسط بر مقادیر پروتئین های TNF-α، TLR4 در دو ناحیه استراتوم و قشر مغز رت های صحرایی نر بود. ارتباط TLR4 با TNF-α با بروز التهاب و با واسطه آبشار پیام رسانی TLR4 توسط اتصال لیگاند لیپوپلی ساکارید (LPS) به دومین خارج سلولی TLR4 آغاز می گردد (21). این آبشار با میانجی گری MyD88 در پیام سانی TLR4 که عمدتاً در غشاء های پلاسمایی روی می دهد، انجام می گیرد و شامل فسفوریلاسیون کینازهای مرتبط با IL-1R، ارتباط با گیرنده TNF-α و سیگنال های پایین دست می باشد که درنهایت منجر به فعال سازی NF-κB و القاء واسطه های پیش التهابی همانند TNF-α و IL-6 می گردد (22). همچنین مشخص شده که ماکروفاژها سطوح بالایی از TLR4 را بیان می کنند و این سلول ها موقعی که با LPS فعال شوند سایتوکاین های پیشالتهابی نظیر TNF-α را تولید می کنند و این بیانگر نقش اساسی ماکروفاژها در بروز پاسخ های التهابی توسط فعال سازی TLR4 به وسیله LPS است (23). در راستای تأثیر تمرینهای HIIT و MICT بر شاخص های التهابی، نتایج ضد و نقیض است. پروایز و هافمن-گویتز (2012)، با بررسی تغییرات سایتوکاین های التهابی در پاسخ به تمرینات شدید در موشهای ماده دریافتند که میزان TNF-α پس از تمرین شدید بر روی تردمیل کاهش پیدا کرد (24). در مقابل مارتین-کوردرو و همکاران (2011)، افزایش مقادیر TNF-α را بعد از تمرین هوازی در نمونههای حیوانی دارای اختلال متابولیکی مشاهده کردند (25). مختارزاده و همکاران (2017)، در پژوهشی نشان دادند که تمرین هوازی تناوبی با شدت بالا میتواند موجب کاهش TNF-α در زنان مبتلا به مولتیپل اسکلروزیس گردد (26). اکبری و همکاران (2019)، در پژوهش خود نشان دادند که 12 هفته تمرین HIIT و MICT موجب کاهش معنادار TNF-α و IL-10 سرمی در رت های نر چاق گردید (27). احتمالاً دلیل اصلی وجود تفاوت در نتایج این پژوهش ها با پژوهش حاضر در این است که در بیشتر این پژوهش از آزمودنی های مبتلا به بیماری که شرایط بروز التهاب در آنها فراهم بوده استفاده شده و فعالیت ورزشی موجب سرکوب التهاب در این افراد شده که در پژوهش حاضر با توجه به استفاده از رت های سالم به عنوان جامعه آماری این کاهش در میزان TNF-α دیده نشد. TNF-α یک سایتوکاین پیش-التهابی است که در بروز التهاب سیستمیک نقش اساسی ایفا میکند و قادر به القای تب، مرگ برنامهریزی شده سلول، سرکوب تومورزایی، تکثیر ویروس و پاسخ به عفونت است (7). افزایش بافت چربی موجب افزایش تولید آدیپوکاینهای پیش-التهابی و بالعکس کاهش بافت چربی موجب کاهش میزان سایتوکاین های ضدالتهابی می گردد. با توجه به این رابطه میتوان بیان کرد که ورزش منظم توانایی این را دارد که با کاهش توده چربی حتی بدون کاهش وزن موجب کاهش سایتوکاینهای پیشالتهابی نظیر TNF-α گردد (28). از سویی گیرنده های TLR نقشی اساسی را در سیستم ایمنی بدن توسط شناخت و شروع یک پاسخ التهابی به سلولهای خطرناک ایفا می کنند که خود موجب رونویسی از سایتوکاین ها و کموکاین ها می شود. فعال شدن TLRها میتواند منجر به افزایش سطوح سایتوکاینهای پیشالتهابی نظیر TNF-α گردد. پژوهش های گوناگون گزارش کردند که تمرین های ورزشی منظم موجب کاهش بیان گیرندههای TLR2 و TLR4 بر روی مونوسیتها میگردد و با توجه به اینکه این گیرنده ها می توانند بیان سایتوکاین های پیش التهابی را آغاز نمایند، نتیجه مثبتی در پیشگیری از بروز التهاب داشته باشند (29). در همین راستا اکبری و همکاران (2019)، مکانیسم اصلی کاهش TNF-α را القای TLR4 بیان کردند (27). طبق این مسیر فعالسازی TLR4 با اسیدهای چرب آزاد موجب تحریک سیگنالینگ NF-κB و بیان TNF-α در آدیپوسیت ها می گردد (30). در نتیجه احتمالاً یکی از علتهای سرکوب TNF-α ناشی از تمرین ورزشی در موشهای چاق تنظیم کاهشی TLR4 باشد (27). همچنین تیمرمان و همکاران (2008)، در پژوهشی نشان دادند که تمرین های ورزشی منظم موجب کاهش مونوسیتهای در گردش میگردد و در نتیجه خود موجب کاهش عوامل التهابی میگردد (31). شاید اصلی-ترین علت در عدم کاهش TLR4 و TNF-α در پژوهش حاضر مدت زمان پژوهش و همچنین استفاده از موشهای جوان و با وزن نرمال باشد. همچنین یکی دیگر از علل احتمالی عدم وجود تفاوت معنادار مدت زمان تمرین بود. در پژوهشهای قبلی عموماً 8 هفته تمرین اجرا گردید و در این پژوهش به خاطر بررسی اجرای تمرین در مدت زمان کمتر و بررسی اثرات این نوع تمرینات از 4 هفته استفاده گردید که شاید یکی از دلایل عدم اثرگذاری تمرین بوده است. همچنین برخی پژوهش های گذشته نشان دادند که پیش آماده سازی با فعالیت ورزشی توسط سازوکارهای گوناگون در ایجاد حفاظت عصبی آندوژن کمک میکند. این سازوکارها عبارتند از؛ 1) تنظیم افزایشی بیان نوروتروفین ها مثل BDNF، NGF و IGF-1؛ 2) کاهش التهاب، کاهش ICAM-1، کاهش بیان TLR2 و TLR4 و تنظیم بهتر میزان TNF-α در مغز و پاسخ حاد آن؛ 3) افزایش قدرت آنتیاکسیدانی مغز و کاهش استرس اکسیداتیو که گزارش شده در کاهش حجم انفارکت و نتایج نورولوژیک پس بروز سکته مغزی اثرگذار است؛ 4) بهبود متابولیسم مغزی و کاهش اختلالات متابولیک مغزی بر اثر افزایش بیان GLUT-1 و GLUT-3، افزایش فعالیت AMPK و افزایش فعالیت آنزیم های گلیکولیزی مهم مغزی مثل LDH و PFK؛ 5) کاهش آپوپتوزیس و افزایش بقاء نورونی پس از آسیب ایسکمیک، خونرسانی مجدد، که وابسته به نسبت عوامل پیش آپوپتوزی همچون Bax، Bad، Bak و AIF به ضدآپوپتوزی همچون Bcl-2، HSP-70 و HSP-27 و همچنین کارایی بهتر میتوکندری ها به عنوان دروازه بان مرگ یا بقاء سلولی؛ 6) گسترش شبکه مویرگی و شریانی مغز براثر افزایش چکالی عروق مغزی، آنژیوژنز و آرتریوژنز در قسمتهای مختلف مغزی؛ 7) تقویت سد خونی- مغزی (14). بهطور کلی و با توجه به نتایج پژوهش های گذشته بهنظر میرسد تمرینات هوازی عامل اصلی و بالقوه در تغیرات مربوط به TNF-α خصوصاً در اختلالات متابولیکی باشند (32). اما از سوی دیگر پاسخ های متابولیکی در طی تمرینات تناوبی، شدیدتر از پاسخ های تمرین های تداومی و متوالی و با شدت متوسط است که همین امر موجب می گردد تا تغییرات TNF-α متعاقب تمرینات تناوبی قویتر از تغییرات آن پس از تمرینات هوازی با شدت متوسط باشد (33). بنابراین به احتمال فراوان تمرینات تناوبی همانند تمرینات تداومی طولانی مدت با تغییر در میزان دسترسی به مواد غذایی در طی ورزش و ایحاد کسر انرژی، مسیرهای متابولیکی مؤثر در تنظیم بیان TNF-α را فعال کرده و از این مسیر موجب تعدیل و تنظیم این سایتوکاین میگردد.
نتیجه گیری
با توجه به این یافته ها می توان اظهار داشت که افزایش TLR4 و TNF-α خود بیانگر افزایش التهاب در مغز است و انجام تمرین ورزشی چه با شدت بالا و چه با شدت متوسط نمیتواند عاملی مؤثر بر افزایش شاخصهای التهابی در مغز باشد.
سپاسگزاری
این پژوهش برگرفته از رساله دکتری رشته فیزیولوژی ورزشی دانشگاه شیراز می باشد. از تمامی کسانی که در انجام این پژوهش ما را یاری کردند کمال تشکر و قدردانی را داریم.
حامی مالی: دانشگاه شیراز
تعارض در منافع: وجود ندارد.
References:
1- Cuevas AG, Ong AD, Carvalho K, Ho T, Chan SW, Allen J, Chen R, Rodgers J, Biba U, Williams DR. Discrimination and Systemic Inflammation: A Critical Review and Synthesis. Brain Behav Immun 2020; 89: 465-79.
2- Enache D, Pariante CM, Mondelli V. Markers of Central Inflammation in Major Depressive Disorder: A Systematic Review and Meta-Analysis of Studies Examining Cerebrospinal Fluid, Positron Emission Tomography and Post-Mortem Brain Tissue. Brain Behav Immun 2019; 81: 24-40.
3- Khan J, Noboru N, Young A, Thomas D. Pro and Anti-Inflammatory Cytokine Levels (TNF-Α, IL-1β, IL-6 and IL-10) In Rat Model of Neuroma. Pathophysiology 2017; 24(3): 155-9.
4- Nakagawa Y, Chiba K. Role of Microglial M1/M2 Polarization in Relapse and Remission of Psychiatric Disorders and Diseases. Pharmaceuticals 2014; 7(12): 1028-48.
5- You K, Gu H, Yuan Z, Xu X. Tumor Necrosis Factor Alpha Signaling and Organogenesis. Front Cell Dev Biol 2021; 9: 1-9.
6- Ye L, Huang Y, Zhao L, Li Y, Sun L, Zhou Y, Qian G, Zheng JC. IL‐1β And TNF‐Α Induce Neurotoxicity Through Glutamate Production: A Potential Role for Neuronal Glutaminase. J Neurochem 2013; 125(6): 897-908.
7- Arroyo E, Laudato JA, Gibson BM, Dulaney CS, Vaughan JA, Followay BN, Glickman EL, Jajtner AR. Tumor Necrosis Factor-Α, TNF Receptor, and Soluble TNF Receptor Responses to Aerobic Exercise in the Heat. Cytokine X 2020; 2(3): 100033.
8- Norouzian M, Rajabi H, Panahzadeh F. The Effect of 6 Weeks Tai Chi Training on TNF-Α, BDNF Serum Levels and Cognitive and Physical Function in Women with Stroke. J Spo Exerc Physiol. 2017; 10(1): 11-19. [Persian]
9- Soltani N, Marandi SM, Kazemi M, Esmaeil N. Combined All-Extremity High-Intensity Interval Training Regulates Immunometabolic Responses Through Toll-Like Receptor 4 Adaptors and A20 Downregulation in Obese Young Females. Obes Facts 2020; 13(3): 415-31.
10- Park JW, Kim KH, Choi JK, Park TS, Song KD, Cho BW. Regulation of Toll-Like Receptors Expression in Muscle Cells by Exercise-Induced Stress. Anim Biosci 2021; 34(10): 1590-99.
11- Soori R, Vahdat H, Shabkhiz F, Ababzadeh S, Eslami Farsani M. Effects of Aerobic Exercise and Rosemary Extracts on Inflammatory Factors in Cerebellar of Male Old Rats. Qom Univ Med Sci J 2020; 14(4): 11-21. [Persian]
12- Hovanloo F, Arefirad T, Ahmadizad S. Effects of Sprint Interval and Continuous Endurance Training on Serum Levels of Inflammatory Biomarkers. J Diabetes Metab Disord 2013; 12(1): 1-5.
13- Timmons BW. Paediatric Exercise Immunology: Health and Clinical Applications. Exerc Immunol Rev 2005; 11(2005): 108-44.
14- Wang X, Zhang M, Feng R, Li WB, Ren SQ, Zhang J, Zhang F. Physical Exercise Training And Neurovascular Unit In Ischemic Stroke. Neuroscience 2014; 271: 99-107.
15- Dornbos III D, Ding Y. Mechanisms of Neuronal Damage and Neuroprotection Underlying Ischemia/Reperfusion Injury after Physical Exercise. Curr Drug Targets 2012; 13(2): 247-62.
16- Gleeson M, Bishop NC, Stensel DJ, Lindley MR, Mastana SS, Nimmo MA. The Anti-Inflammatory Effects of Exercise: Mechanisms and Implications for the Prevention and Treatment of Disease. Nat Rev Immunol 2011; 11(9): 607-15.
17- Rezaei R, Nasoohi S, Haghparast A, Khodagholi F, Bigdeli MR, Nourshahi M. High Intensity Exercise Preconditioning Provides Differential Protection Against Brain Injury Following Experimental Stroke. Life Sci 2018; 207: 30-35.
18- Bedford TG, Tipton CM, Wilson NC, Oppliger RA, Gisolfi CV. Maximum Oxygen Consumption of Rats and Its Changes with Various Experimental Procedures. J Appl Physiol 1979; 47(6): 1278-83.
19- Leandro CG, Levada AC, Hirabara SM, Manhães-De-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Cond Res. 2007; 21(3): 751-6.
20- Ramez M, Rajabi H, Ramezani F, Naderi N, Darbandi-Azar A, Nasirinezhad F. The Greater Effect of High-Intensity Interval Training versus Moderate-Intensity Continuous Training on Cardioprotection against Ischemia-Reperfusion Injury through Klotho Levels and Attenuate of Myocardial TRPC6 Expression. BMC Cardiovasc Disord 2019; 19(1): 118.
21- Sandoghchian Shotorbani S, Espotin A, Mahmoudi J, Dehghan A, Sadigh Eteghad S. Effects of HSP70 on TLR4 Expression by Increasing MAPK and NF-KB Signaling Pathways in Periodontitis. J Mashhad Dent Sch 2021; 45(1): 63-9. [Persian]
22- Kovach MA, Singer B, Martinez-Colon G, Newstead MW, Zeng X, Mancuso P, et al. IL-36γ is a Crucial Proximal Component of Protective Type-1-Mediated Lung Mucosal Immunity In Gram-Positive and-Negative Bacterial Pneumonia. Mucosal Immunol 2017; 10(5): 1320-34.
23- Huynh J, Scholz GM, Aw J, Kwa MQ, Achuthan A, Hamilton JA, Reynolds EC. IRF6 Regulates the Expression of IL-36γ By Human Oral Epithelial Cells In Response to Porphyromonas Gingivalis. J Immunol 2016; 196(5): 2230-8.
24- Pervaiz N, Hoffman-Goetz L. Immune Cell Inflammatory Cytokine Responses Differ Between Central and Systemic Compartments in Response to Acute Exercise in Mice. Exerc Immunol Rev 2012; 18: 142-57.
25- Martin-Cordero L, García JJ, Hinchado MD, Bote E, Manso R, Ortega E. Habitual Physical Exercise Improves Macrophage IL-6 and TNF-Α Deregulated Release in the Obese Zucker Rat Model of the Metabolic Syndrome. Neuroimmunomodulation 2011; 18(2): 123-30.
26- Mokhtarzade M, Ranjbar R, Majdinasab N. Acute and Chronic Effect of Upper and Lower Body Interval Training on Tumor Necrosis Factor (Tnfα) and Leptin Concentration in Women with MS. Stud Med Sci 2017; 28(5): 332-42.
27- Akbari A, Mohebbi H, Khalafi M, Moghaddami K. The Effect of Two Types of High Intensity and Moderate Intensity Continuous Training on Serum Levels of TNF-Α and IL-10 in Obese Male Rats. J Appl Health Stud Sport Physiol 2019; 6(1): 86-93. (Persian)
28- Mujumdar PP, Duerksen-Hughes PJ, Firek AF, Hessinger DA. Long-Term, Progressive, Aerobic Training Increases Adiponectin in Middle-Aged, Overweight, Untrained Males and Females. Scand J Clin Lab Invest 2011; 71(2): 101-7.
29- Stewart LK, Flynn MG, Campbell WW, Craig BA, Robinson JP, Mcfarlin BK, et al. Influence of Exercise Training and Age on CD14+ Cell-Surface Expression of Toll-Like Receptor 2 and 4. Brain Behav Immun 2005; 19(5): 389-97.
30- Shi H, Kokoeva MV, Inouye K, Tzameli I, Yin H, Flier JS. TLR4 Links Innate Immunity And Fatty Acid–Induced Insulin Resistance. J Clin Invest 2006; 116(11): 3015-25.
31- Timmerman KL, Flynn MG, Coen PM, Markofski MM, Pence BD. Exercise Training‐Induced Lowering of Inflammatory (CD14+ CD16+) Monocytes: A Role in the Anti‐Inflammatory Influence of Exercise. J Leukocyte Biol 2008; 84(5): 1271-8.
32- White LJ, Castellano V, Mc Coy SC. Cytokine Responses to Resistance Training In People with Multiple Sclerosis. J Sports Sci. 2006; 24(8): 911-4.
33- Hotamisligil GS. Mechanisms of TNF-Α-Induced Insulin Resistance. Exp Clin Endocrinol Diabetes. 1999; 107(2): 119-25.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1400/11/21 | پذیرش: 1401/2/11 | انتشار: 1401/10/15
دریافت: 1400/11/21 | پذیرش: 1401/2/11 | انتشار: 1401/10/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







