دوره 30، شماره 8 - ( آبان 1401 )
جلد 30 شماره 8 صفحات 5178-5166 |
برگشت به فهرست نسخه ها
Ethics code: IR.SSRC.REC.1398.548
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Fereshtian S, Peeri M, Agha Alinejad H, Delfan M. Effect of 4 Weeks of High Intensity Interval Training with Curcumin Supplementation on COL-I, COL- II, SMAD3 Gene Expression in the Myocardium of Obese Male Rats with Type 2 Diabetes. JSSU 2022; 30 (8) :5166-5178
URL: http://jssu.ssu.ac.ir/article-1-5619-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5619-fa.html
فرشتیان سارا، پیری مقصود، آقاعلینژاد حمید، دلفان مریم. تاثیر4 هفته تمرین تناوبی شدید همراه با مکمل یاری کورکومین بر بیان ژنهای COL-I، II COL-، SMAD/3 در میوکارد موشهای چاق صحرایی نر مبتلا به دیابت نوع 2. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (8) :5166-5178
متن کامل [PDF 803 kb]
(314 دریافت)
| چکیده (HTML) (648 مشاهده)
متن کامل: (385 مشاهده)
مقدمه
دیابت نوع 2 که با مشخصه بارز مقاومت به انسولین ایجاد میشود ، از جمله اختلالات متابولیکی مهم است که با افزایش در تولید محصولات گلیکوزی باعث گسترش فاکتورهای پاتولوژیکی در ارگانهای حیاتی از جمله بافت قلب میشود (1). نقص در عملکرد انسولین باعث راهاندازی مسیرهای مختلف در تولید پاتوژنهای مربوط به متابولیسم گلوکز، لیپید و فاکتورهای رونویسی ژن در ماتریکس خارجی غشاء و تولید سطوح بالای کلاژنهای نوع 1 و 2 در غشاء خارج میوسیت میگردد (2)، سپس پمپاژ خون مختل میشود (3). این عامل موجب ضعف در سیستم دفاع آنتیاکسیدانی (2) و اختلال در ساختار و کاهش در عملکرد بطن چپ میگردد (4). سپس سنتز پروتئین نسبت به تجزیه آن پیشی میگیرد و عملکرد فاکتورهای میوژنین بهوسیله تولید SMAD/3 (Small mothers against decapentaplegic/3 ) مهار میشود (5) و باعث تولید و افزایش فاکتورهای التهاب زا میشود (4). همچنین افزایش در تولید SMAD/3 نیز موجب مهار در تولید و کاهش در عملکرد پروتئین تیروزینکینازی (Tyrosine kinase) می¬شود (5) و بهوسیله انسداد در مسیر Mtorc-1 فعالیت پروتئین انقباضی اکتین را کاهش میدهد (6). زیرا سنتز و فعالیت فاکتورهای میوژنین به دلیل تولیدSMAD/3 کاهش یافته و سنتز بیش از حد پروتئین در سطح غشاء تغییرات پاتولوژی در سطح سلول ایجاد میکند (5). سپس اتصال ca++ به کالمودولین تضعیف میشود و کلسیفیکاسیون افزایش یافته و باعث سنتز کلاژن نوع I میشود (7). این تغییرات در خون و اکسیژنرسانی به قلب محدودیت ایجاد میکند و بافت قلب سفت میشود (8). متعاقب آن فشار بطن چپ افزایش مییابد و منجر به پاسخ جبرانی دیگر همراه با سنتز بیشتر هر دو نوع کلاژن نوع Iو II میشود که نشان دهنده سختی باقت قلب است (5،8). تاکنون مسیرهای مختلفی در ایجاد کاردیومیوپاتی دیابتی مورد مطالعه قرار گرفته است (9)، اما علت اصلی تغییرات پاتولوژیکی و متعاقب آن اختلال قلب دیابتی بهطور دقیق شناسائی نشده است (10). با اینحال آثار تعدیلکننده تمرین با شدت متناوب به دلیل تنظیم در عملکرد ژن و بهبود بیماریهای متابولیکی در کنار سایر مراحل درمانی به تائید رسیده است (10). در این خصوص عنوان شده انجام تمرین تناوبی شدید (HIIT) همراه با درمان دارویی و رژیم غذایی در سلامت قلب و عروق (11) و بهبود کیفیت زندگی (12) در بیماران دیابتی موثر است (13). با انجام این نوع تمرین متابولیسم سلولی افزایش مییابد و موجب کاهش در فعالیت برخی از پروتئینهای خارج سلولی میشود (13). همچنین ترکیبات پلیفنولکورکومین میتواند به پیوندهای هیدروژنی DNA در هسته سلول متصل شود و با ایجاد تغییرات مستقیم ریز مولکولی گونههای فعال اکسیژن را مهار کند (14). همچنین کورکومین بهوسیله فعالسازی AMPK ((AMP-activated protein kinase بالاترین اثر را در جابجایی GLUT-4 به سطح غشاء سلول داشته، از اینرو حساسیت انسولینی را افزایش میدهد (15). در سال-های اخیر توجه محققان به بررسی تأثیر طـب گیاهی در پیشگیری و درمان مشکلات مختلف معطوف شده است. مصرف آنتیاکسیدانها و ضـدالتهابهـای موجود در طبیعت نمونهای از ایـن تـدابیر است. از جمله مهمترین ضـدالتهابهـای موجـود در طبیعـت، کورکومینوئیدها هستند. زردچوبـه حـاوی گروهی از ترکیبات پلیفنولیک به نام کورکومینوئیدهاست و در بین کورکومینوئیدها، کورکومین رایـجتـرین و فراوانترین پلـیفنـول بـا خاصـیت آنتیاکسـیدانی و ضدالتهابی قوی است. بر اساس نتـایج تحقیقات مـاده مؤثر زردچوبه (کورکـومین) قابلیـت واکنشـی بـالا بـا مولکولهای درگیر در التهاب دارد و پاسخهای التهابی را از طریـق کـاهش فعالیت آنـزیم سیکلواکسـیژناز 2، لیپواکسـیژناز و آنـزیم نیترواکسـاید سـنتاز و کاهش تولید سایتوکاینهای التهابی از جملــه TNF- α میشود (16). در مقاله مروری مارتون و همکاران (2021) عنوان شده است کورکومین مقاومت به انسولین و تحمل نسبت به گلوکز را کاهش میدهد و در نهایت سطوح پلاسمایی قند خون را کاهش داده است. همچنین عنوان شده است کورکومین با نقش ضدالتهابی خود عوارض نوروپاتی ناشی از دیابت را به حداقل رسانده و نیز سبب تقویت اعصاب محیطی شده است (17). در خصوص اثرگذاری وابسته به دوز کورکومین عنوان شده، دوز 150 میلیگرم بر کیلوگرم از وزن بدن در بهبود تحمل گلوکز موثر است (15) و دوز 200 میلیگرم بر کیلوگرم به ازای وزن بدن در روز مجاز بوده و مصرف این مقدار پیوندهای عرضی کلاژن را در موشهای دیابتی میشکند (18). با توجه به آثار جانبی مصرف برخی از داروها، به ترکیبات موثر آنتیاکسیدانی موجود در گیاهان داروئی با خواص ضد دیابتی و کم خطر از جمله کورکومین (ترکیب اصلی گیاه زردچوبه) توجه شده است (19). به طوریکه عنوان شده کورکومین بالاترین اثر را در تنظیم ژن میگذارد (18). با اینحال با توجه به تاثیر مفید تمرین تناوبی بر بهبود عملکرد قلب (11) و نیز آثار مفید مصرف کورکومین بر بهبود بیان ژن (14)، حساسیت انسولین (15) و اثر ضد ایسکمی (18)، هنوز بررسیها در زمینه ایجاد تغییرات پاتوژن قلبی در این نوع بیماران محدود میباشد (9) و نیز مطالعهای در خصوص تاثیر همزمان انجام تمرین تناوبی شدید و مصرف کورکومین بر تنظیم بیان ژن در بافت قلب بیماران مبتلا به دیابت انجام نشده است. بر این اساس مطالعه حاضر در بررسی تاثیر4 هفته تمرین تناوبی شدید همراه با مکمل یاری کورکومین بر ژنهای COL-II، II و SMAD/3 در میوکارد موشهای چاق صحرائی نر مبتلا به دیابت نوع2 انجام شد.
روش بررسی
در پژوهش تجربی- آزمایشگاهی حاضر که بر روی 35 سر موش نر نژاد ویستار از انستیتو پاستور رازی تهیه و به آزمایشگاه حیوانات دانشگاه تربیت مدرس انتقال داده شدند. سن حیوانات 8 تا 9 هفته و میانگین وزن 30±320 گرم بود. همه مراحل مختلف پژوهش با رعایت مسائل اخلاقی، مطابق دستورالعمل کمیته اخلاق کار با حیوانات آزمایشگاهی مستخرج از دستورالعمل هلیسنگی انجام شد. حیوانات به طور تصادفی به 5 گروه 7 تایی تقسیم شدند;1-گروه کنترل سالم (NC)، 2-گروه کنترل دیابتی (DC)،3-گروه کورکومین+ دیابتی (S+DC)، 4-گروه تمرین تناوبی شدید (HIIT)، 5-گروه تمرین تناوبی شدید+ کورکومین (S+HIIT). حیوانات در قفسای از جنس پلیکربنات شفاف ساخت شرکت رازی راد و در دمای محیط با 22 تا 25 درجه سانتیگراد و چرخه روشنایی- تاریکی 12:12 با دسترسی آزادانه به آب و غذای مخصوص حیوانات (پلت) نگهداری شدند.
نحوه القاء دیابت
القاء دیابت به همه موشها بهجز گروه کنترل سالم بدین صورت القاء شد: پس از یک شب ناشتائی شبانه ابتدا محلول نیکوتین آمید با دوز110 میلیگرم بر کیلوگرم وزن بدن بهصورت داخل صفاقی تزریق شد. بعد از 15 دقیقه، محلول تازه تهیه شده استرپتوزوتوسین (STZ) در بافر سیترات با 4/5PH بهصورتداخل صفاقی با دوز 60 میلیگرم بر کیلوگرم، بافر سیترات 0/05 مول بهصورت حل شده تزریق شد (20). پس از گذشت 72 ساعت از انجام تزریق، شاخص دیابتی شدن با اندازهگیری قند خون ناشتا بهوسیله گلوکومتر (01 ساخت ژاپن) از ورید دم موشها دریافت شد. سطح قند خون ناشتا بیش از 160 میلیگرم بر دسیلیتر در نظر گرفته (20) و تائید شد. جدول1 تغییرات وزن، شاخص گلوکز، انسولین و مقاومت به انسولین را به تفکیک گروههای پژوهش نشان میدهد.
آماده سازی مکمل کورکومین
مکملسازی کورکومین با حلال DMSO با غلظت 10 درصد مولار بر اساس ترکیب اصلاح شده (21) به مقدار 200 میلیگرم به ازای 200 میلیگرم بر کیلوگرم وزن بدن به مدت4 هفته، 5 روز در هفته معادل با جلسات تمرین در ساعت10 صبح، یک ساعت قبل از اجرای تمرین بهصورت خوراکی گاواژ شد (22).
روش اجرای تمرین
پس از یک هفته آشناسازی حیوانات با راه رفتن بر روی تردمیل مخصوص جوندگان با سرعت 6 متر بر دقیقه، قبل از اجرای برنامه¬های تمرین، ابتدا ارزیابی توان هوازی با محاسبه سرعت بیشینه در زمان رسیدن به VO2 max و محاسبه شدت تمرین با استفاده از آزمون فزاینده لئاندرو و همکاران (2007) بدین صورت انجام شد: بعد از 3 دقیقه گرمکردن با سرعت 5 متر بر دقیقه و با شیب صفر درجه توسط تغییر در سرعت نوار گردان که در هر 2 دقیقه یکبار m/mim 2 افزایش یافت. بر این اساس تعیین حداکثر سرعت بیشینه زمانی بود که موش¬ها حداقل 1 تا 3 دقیقه نتوانند با یک سرعت ثابت بدوند و بلافاصله با افزایش سرعت قادر به دویدن باشند (23). برنامه تمرین تناوبی شدید (HIIT) شامل 5 دقیقه گرم و سرد کردن با شدت 30 درصد سرعت بیشینه (5 متر بر دقیقه) و 6 دقیقه تناوب تمرین با شدت 85 درصد سرعت بیشینه در هفته اول که به 20 دقیقه دویدن با شدت 90 درصد سرعت بیشینه در پایان هفته چهارم رسید. تعداد تکرار تناوب با شدت بالا در دو هفته اول چهار تکرار بود که در هفتههای سوم و چهارم به پنج تکرار رسید، زمان تناوب با شدت بالا دو دقیقه و تناوب با شدت پائین نیز دو دقیقه بود. سنجش VO2max نیز در روز ششم از هفته دوم بررسی شد و سرعت تمرین بر اساس آن تا پایان هفته چهارم تعیین شد. همچنین یک روز در هفته برای استراحت در نظر گرفته شد. لازم به ذکر است که گروههای کنترل سالم و کنترل دیابتی، در برنامه تمرین شرکت نداشتند، اما برای ایجاد شرایط کاملاً یکسان 5 بار در هفته و به مدت 5 تا 10 دقیقه در هر جلسه برای سازگاری با محیط بر روی نوار گردان کاملاً بیحرکت قرار داده می شدند. در جدول2 برنامه تمرین نشان داده شده است.
روش استخراج نمونه و اندازهگیری ژنهای COL-I، COL-II، SMAD/3:
24 ساعت بعد از آخرین جلسه تمرین موشها توسط تزریق درون صفاقی کتامین 80 میلیگرم بر کیلوگرم و زایلازین 10 میلیگرم بر کیلوگرم بیهوش شدند (24)، سپس خون به طور مستقیم از بطن چپ موشها دریافت و در لولههای حاوی هپارین ریخته شد و به مدت 15 دقیقه با سرعت 3000 متر بر دقیقه در دمای 15 درجه سانتیگراد سانتریفیوژ شد. بافت بطن چپ بلافاصله استخراج و در نیتروژن 20- قرار داده شد و جهت سنجش بیان ژن در فریزر 80- نگهداری شد. سنجش بیان ژنهای COL-I،COL-II ،SMAD/3 روش Realtime-PCR با Premix Extaqit و نیز از GAPDH به عنوان ژن کنترل استفاده شد. اندازهگیری مقدار بیان این ژن بهصورت توأمان با هر یک از ژنها بهوسیله کیت 50 Mir nasy mini kit (qiagene ساخت آلمان) و طبق دستورالعمل انجام شد (25): برای استخراج RNA میزان 50 میلیگرم بافت منجمد قلب موش هموژن شده بر طبق دستورالعمل شرکت سازنده با کیت محلول RNAاز آن استخراج شد، و با آنزیم DNaseI از هرگونه آلودگی به DNAو آنزیمهای تخریب کننده RNA پاکسازی شد. از هرکدام از نمونه¬ها 2 میکروگرمmRNA برای سنتز اولین رشته cDNAاستفاده شد. مقدار نسبی بیان ژنهای مورد مطالعه در بافت قلب با کمک پرایمرهای اختصاصی آن¬ها اندازه¬گیری شد. نسبت جذبی 260 تا 280 نانوگرمی برای تمام نمونه¬های استخراج شده 1/8 تا 2 بود. جهت بررسی کیفیتRNA استخراج شده از روش الکتروفروز و ژل آگارز 1 درصد استفاده شد. قبل از سنجش cDNA برای اطمینان از نبود DNA در نمونه استخراج شده DNA streatment (thermos scientific، ساخت آلمان) انجام شد. سنتز cDNA با کیتtranse criptor first strand Cdna sinthesis kit (roch، ساخت آلمان) طبق دستورالعمل مذکور و نیز برنامه Real time PCR به وسیله دستگاه Rotrogene 6000, corbet") ساخت آلمان انجام شد. این برنامه بر اساس SYBER Green (ampligon , ساخت دانمارک) با دور 95 درجه سانتیگراد به مدت 15 دقیقه و بلافاصله 40 چرخه با 95 درجه سانتیگراد به مدت 15 ثانیه و 60 درجه سانتی¬گراد به مدت 60 ثانیه با پرایمر طراحی شده (ساخت نیکا زیست ژن ایران) انجام گردید.
تجزیه و تحلیل آماری
در بخش مربوط به آمار توصیفی از شاخص پراکندگی انحراف معیار و نمودار استفاده شد. نرمال بودن دادهها توسط آزمون شاپیروویلک بررسی گردید. جهت تعیین اختلافات بین گروهی از آزمون آنووای دو راهه و آزمون تعقیبی توکی در سطح معناداری 0/05استفاده شد. تجزیه و تحلیل دادهها با استفاده از نرمافزار Graph pad prism نسخه 8 انجام شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد واحد تهران مرکزی تایید شده است (کد اخلاق IR.SBMU.RETECH.REC.1398.548 ).
جدول 1: تغییرات وزن، شاخص گلوکز، مقدار انسولین و مقاومت به انسولین به تفکیک در گروههای پژوهش

اعداد به شکل انحراف معیار± میانگین استاندارد بیان شدهاند، *نشانۀ معناداری نسبت به¬ کنترل¬دیابتی،Yنشانه معناداری نسبت به کنترل دیابتی با مکمل.
جدول 2: برنامه تمرین تناوبی شدید در زمان رسیدن به حداکثر اکسیژن مصرفی در مدت 4 هفته

جدول 3: توالی پرایمری ژنهای مورد مطالعه

نتایج
تغییرات شاخص وزن، گلوکز و مقاومت به انسولین در گروه S+HIIT کاهش و انسولین در این گروه نسبت به گروههای DC و S+DC افزایش معناداری نشان داد. بیان COL-I در گروه S+HIIT نسبت به گروههای DC و S+DC به ترتیب (P<0/0001) و (P<0/0004) و درگروه HIIT نسبت به گروه DC (P=0/017) کاهش معناداری داشت. (شکل1). بیان COL-IIدرگروه S+HIIT نسبت به گروه¬های (P=0/001) S+DC و (P<0/0003) DC و در گروه HIIT نسبت به گروه (P=0/013) DC و (P=0/029)S+DC کاهش معناداری داشت. شکل (2). بیان ژن SMAD/3 در گروه S+HIIT نسبت به گروه¬های(P<0/0006)HIIT (P=0/008) ،S+DC (P<0/0002)، DC و در گروه HIIT نسبت به گروه NC (P=0/010)
،DC (P=0/006)) و (P=0/032) S+DC کاهش معناداری نشان داد. شکل (3). بر این اساس میتوان اظهار داشت تمرینHIIT همراه با مکمل یاری کورکومین نسبت به تمرین HIIT تاثیر بالاتری در کاهش شاخصهای گلایسمیک و تنظیم بیان ژن در میوکارد موش های مبتلا به دیابت دارد. جدول4 یافته های آزمون توکی را به منظور بررسی جایگاه تفاوتهای بین گروهی نشان میدهد. بهصورت کلی بر طبق نتایج به دست آمده، مقادیر وزن حیوانات و شاخصهای گلوکز و مقاومت به انسولین در نسبت به سایر گروه¬ها کاهش معناداری داشت. همچنین مقادیر انسولین در گروه تمرین با کورکومین افزایش معناداری نشان داد که بیانگر بهبود شاخصهای گلایسمیک در اثر ترکیب تمرین و مکمل است. بیان ژنهای COL-I و II در هر دو گروه تمرین و نیز تمرین با کورکومین کاهش معناداری داشت، اما همین شاخصها در گروه تمرین نسبت به گروه تمرین با کورکومین تفاوت معناداری وجود نداشت. ژنSMAD/3 در گروه های تمرین و تمرین باکورکومین کاهش معناداری نسبت به سایر گروهها داشت همچنین تاثیر تمرین با مکمل بر کاهش این ژن متفاوتتر از تمرین بهتنهایی بود که نشانگر تاثیر بیشتر تمرین با مکمل نسبت به تمرین یا مکمل به تنهایی است.
جدول4: یافتههای آزمون توکی به منظور بررسی جایگاه تفاوتهای بین گروهی

NC: گروه کنترل سالم، DC: گروه کنترل دیابتی، HIIT: گروه تمرین تناوبی شدید، S+HIIT گروه مکمل با تمرین تناوبی شدید

شکل 1: تغییرات بیان ژن COL-I به تفکیک گروه های پژوهش.
*معناداری نسبت به گروه کنترل سالم،$معناداری نسبت به گروه کنترل دیابتی،#معناداری نسبت به گروه کنترل دیابتی با مکمل (برابر تغییر نسبت به گروه کنترل).
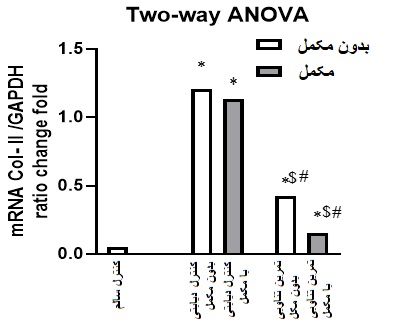
شکل 2: تغییرات بیان ژن COL-II به تفکیک گروه های پژوهش.
* معناداری نسبت به گروه کنترل سالم،$معناداری نسبت به گروه کنترل دیابتی،# معناداری نسبت به گروه کنترل دیابتی با کورکومین (برابر تغییر نسبت به گروه کنترل).

شکل3: تغییرات بیان ژن SMAD/3 به تفکیک در گروههای پژوهش.
*معناداری نسبت به گروه کنترل سالم،$معناداری نسبت به گروه کنترل دیابتی،# معناداری نسبت به گروه کنترل دیابتی با کورکومین،& معناداری نسبت به گروه تمرین تناوبی شدید (برابر تغییر نسبت به گروه کنترل).
بحث
پژوهش حاضر به بررسی اثر 4 هفته تمرین تناوبی شدید همراه با مکملیاری کورکومین بر ژنهای COL-I، II ، SMAD/3 در میوکارد موش¬های چاق صحرایی نر مبتلا به دیابت نوع 2 پرداخت. بر طبق نتایج بهدست آمده وزن، شاخص¬های گلوکز و مقاومت به انسولین در گروه تمرین با کورکومین کاهش معنادار و انسولین در این گروه افزایش معناداری نشان داد. بیان ژنهای COL-I و II در هر دو گروه تمرین و نیز تمرین با کورکومین کاهش معنادار، اما در گروه تمرین نسبت به گروه تمرین با کورکومین تفاوت معناداری نداشت. ژن SMAD/3 در گروههای تمرین و تمرین با کورکومین کاهش معناداری داشت همچنین تاثیر تمرین با مکمل بر کاهش این ژن معنادار تر از تمرین به تنهایی بود. بر طبق نتایج بررسی¬های مختلف ساز و کار مفید تمرین تناوبی شدید در بهبود حساسیت به انسولین (26)، کاهش التهاب سلولی (27)، تنظیم بیان ژن (28) و بهبود پروفایل گلوکز میباشد (27). زیرا ایجاد تنش برشی بالاتر در حین اجرای اینگونه از تمرینات باعث بهبود عملکرد عروق اندوتلیال و بهبود در خون و اکسیژنرسانی به عضلات در گیر در فعالیت و عضلات قلب و تنفس می¬گردد (9،23). مکانیسم اثرگذاری این نوع از تمرین بر تنظیم بیان ژن به دلیل اجراهای متناوب شدید عنوان شده است (28). که از دلایل آن بهکارگیری تارهای تند گلیکولیز و ایجاد هایپوکسی موقتی حین اجرا موجب تولید محرک فاکتور القاء هایپوکسی Insulin growth factor1 (HIF-α1) میگردد (29) و بهوسیله بهکارگیری پروتئین¬های کینازی، سنتز پروتئین¬های انتهای تار و تولید COL-I را کاهش میدهد (27) و از اختلال قلبی پیشگیری میکند (30). همینطور تمرین HIIT با راهاندازی مسیرIGF-1/AKT/Mtorc-1 باعث مهارSMAD/3 می¬شود (28). از طرف دیگر در اجرای تمرین HIIT، کلسیم به کالمودولین (CAMK-II) متصل شده و با راهاندازی AMPKو پروتئین P38-MAPK حرکتGLUT-4 را به سمت غشاء افزایش می¬دهد که این تاثیر تا24 ساعت بعد از تمرین ادامه مییابد (27). همینطور با سیگنالدهی مسیر PI3Kو افزایش عملکرد IGF-1 باعث اتصال بیشتر انسولین به گیرندهاش Hypoxia-inducible factor 1 α-IRS-1 میشود (31) و تا 48 ساعت بعد از تمرین حساسیت به انسولین را افزایش میدهد (26). لازم به ذکر است که انجام ریکاوری فعال با شدت کم بین تناوبهای با شدت بالا با افزایش عملکرد زنجیره انتقال الکترونی و فعالیت آنزیمهای هوازی در بهکارگیری تارهای کند انقباض، موجب بهبود عملکرد میتوکندری و کاهش التهاب می¬شود (32). در خصوص تاثیر ضددیابتی کورکومین نیز عنوان شده، کورکومین با فعالسازی AMPK در انتقال حرکتGLUT -4 به سطح غشاء سلول موثر است (14). در اثرگذاری آن بر بهبود عملکرد ژن وجود زیر مجموعههای کورکومین که شامل دیمتوکسیکورکومین و متوکسیکورکومین میباشد، دارای بالاترین اثر آنتیاکسیدانی بوده بهطوری که با اتصال مستقیم به اسیدهای نوکلئیک درDNA سلول باعث تعدیل و تنظیم در فعالیت ژن میشود (14). طبق بررسیهای مختلف مصرف کورکومین موجب فسفوریلاسیون جانوس کیناز فعال شده با میتوژن میشود و به وسیله مهار تولید کلاژن در غشاء خارجی میوسیت، ایسکمی قلبی را کاهش میدهد (18). بهنظر می-رسد مسیر مشترک و اثر اصلی تمرین HIIT و کورکومین بر بهبود هموستاز گلوکز و متعاقب آن تنظیم عملکرد ژن تاثیر بر فعالیت پروتئین کینازی فعال شده با آدنوزین مونوفسفات حلقوی (CAMP-K) باشد (14). در رابطه با تاثیر تمرینHIIT، نتایج مطالعهای نشان داد، 12 هفته تمرین تداومی با کاهش بیان ژنAng-2، رنین1و گیرندههای آن حساسیت به انسولین را افزایش میدهد (26). همینطور 8 هفته تمرین HIITبه مدت3 روز در هفته موجب فعالسازی IGF-1، AKTوMtorc-1 و کاهش SMAD/3 گردید (28). این نتایج با نتایج مطالعه حاضر همسو است. در حالیکه نتایج مطالعه دیگری نشان داد،4 هفته تمرین با شدت متوسط بر روی تردمیل، 5 روز در هفته به مدت60 دقیقه موجب کاهش تولید کلاژن نوع Iو II در بطن چپ موشهای مدل دیابتی شد (33). این نتایج با نتایج مطالعه حاضر ناهمسو است. شاید بتوان دلیل عدم همخوانی این مطالعه با مطالعه حاضر را به نوع تمرین و شدت تمرین و همچنین تفاوت نوع و نژاد حیوانات نسبت داد. در مطالعهای که به بررسی اثر تمرینHIIT و MIT که به مدت6 هفته و 4 روز در هفته انجام شد، تمرین HIITکه با شدت بین90 تا100 درصد Vo2max انجام شد، نسبت به تمرین با شدت بین 60 تا80 درصد، نتایج نشان داد، تمرین شدید تاثیر بالاتری بر بهبود بیان ژن و کاهش فاکتورهای التهابزا و نیز کاهش مقاومت به انسولین ایجاد کرد (27). این نتایج با نتایج مطالعه حاضر همسو میباشد. تفاوت در نوع تمرین بر بهبود پاسخهای سندرم متابولیک به شدت آن و مقدار عضلات درگیر در فعالیت نسبت داده شده است (8). در این خصوص عنوان شده، تمرین با شدت متوسط با تاثیر بیشتر بر بهبود عملکرد سیستم سمپاتیک (32) و تمرین شدید با تاثیر بالاتر بر متابولیسم سلولی بر بهبود پاسخ¬های قلبی در بیماران دیابتی تاثیر گذار می¬باشد (8). همچنین به نظر میرسد، مسیر مشترک و اصلی تاثیر احتمالی تمرینHIIT و کورکومین بر بهبود همئوستاز گلوکز، بهبود متابولیسم سلولی و متعاقب آن تنظیم در فعالیت ژن در مبتلایان به دیابت، تاثیر بر عملکرد پروتئینکینازی فعال شده با آدنوزین منوفسفات باشد (16،23). با اینحال نتایج بهدست آمده از پژوهش حاضر حاکی از اثرات سودمند تمرین HIIT به همراه مکمل ضد اکسایشی کورکومین در بهبود ساختار قلب بودیم. هر چند دریافت مکمل یاری کورکومین به همراه تمرینHIIT تاثیر بیشتری نسبت به تمرین به تنهایی بر تنظیم شاخص گلایسمی و کاهش بیان ژن SMAD/3 ایجاد کرده میتوان چنین اظهار داشت که کورکومین اثر تمرین را تقویت کرده است. از دلایل کمتر بودن اثر تمرین به تنهایی می تواند ناشی از وهلههای متناوب شدید که در 2 دقیقه اجرا شد نسبت داده شود، شاید اگر تناوب تمرین در زمان کمتر اما با شدت بیشتری اجرا میشد تاثیر بالاتری بر بهبود عملکرد ژنهای مذکور مشاهده میشد (28). هر چند در زمینه نوع و شدت تمرین بر بهبود بیان ژن نتایج متناقضی وجود دارد (27،28). اما با توجه به اینکه پژوهش حاضر برای اولین بار به بررسی تاثیر هم زمان تمرین و مصرف مکمل یاری کورکومین بر بهبود بیان ژن در میوکارد موشهای دیابتی انجام شد، دارای محدودیتهایی است که از آن جمله میتوان به عدم دسترسی به آزمودنیهای انسانی، عدم بررسی پروتئین ژنهای مذکور و نیز عدم انجام اکوکاردیوگرافی به دلیل کمبود بودجه پژوهش اشاره گردد. لذا پیشنهاد میشود در مطالعات آینده مدل تمرینی مذکور همراه با مکمل کورکومین در مدت زمان طولانی یا با شدت بالاتر و بهطور گستردهتر انجام شود تا بتوان نتایج دقیقتری در این زمینه بهدست آورد.
نتیجهگیری
بهطور کلی نتایج بهدست آمده حاکی از آن است که، 4 هفته تمرین تناوبی شدید همراه با مکمل کورکومین مقادیر گلوکز و مقاومت به انسولین را در موشهای چاق دیابتی کاهش داد، همچنین تمرین تناوبی شدید باعث کاهش ژنهای COL-I ،COL-II وSMAD/3 شد و کاهش بیان SMAD/3 تحت تاثیر تمرین تناوبی شدید با مکمل، احتمالاً میتواند فیبروز میوکارد را در افراد دیابتی بهبود بخشد.
حامی مالی: ندارد.
تعارض منافع: وجود ندارد.
دیابت نوع 2 که با مشخصه بارز مقاومت به انسولین ایجاد میشود ، از جمله اختلالات متابولیکی مهم است که با افزایش در تولید محصولات گلیکوزی باعث گسترش فاکتورهای پاتولوژیکی در ارگانهای حیاتی از جمله بافت قلب میشود (1). نقص در عملکرد انسولین باعث راهاندازی مسیرهای مختلف در تولید پاتوژنهای مربوط به متابولیسم گلوکز، لیپید و فاکتورهای رونویسی ژن در ماتریکس خارجی غشاء و تولید سطوح بالای کلاژنهای نوع 1 و 2 در غشاء خارج میوسیت میگردد (2)، سپس پمپاژ خون مختل میشود (3). این عامل موجب ضعف در سیستم دفاع آنتیاکسیدانی (2) و اختلال در ساختار و کاهش در عملکرد بطن چپ میگردد (4). سپس سنتز پروتئین نسبت به تجزیه آن پیشی میگیرد و عملکرد فاکتورهای میوژنین بهوسیله تولید SMAD/3 (Small mothers against decapentaplegic/3 ) مهار میشود (5) و باعث تولید و افزایش فاکتورهای التهاب زا میشود (4). همچنین افزایش در تولید SMAD/3 نیز موجب مهار در تولید و کاهش در عملکرد پروتئین تیروزینکینازی (Tyrosine kinase) می¬شود (5) و بهوسیله انسداد در مسیر Mtorc-1 فعالیت پروتئین انقباضی اکتین را کاهش میدهد (6). زیرا سنتز و فعالیت فاکتورهای میوژنین به دلیل تولیدSMAD/3 کاهش یافته و سنتز بیش از حد پروتئین در سطح غشاء تغییرات پاتولوژی در سطح سلول ایجاد میکند (5). سپس اتصال ca++ به کالمودولین تضعیف میشود و کلسیفیکاسیون افزایش یافته و باعث سنتز کلاژن نوع I میشود (7). این تغییرات در خون و اکسیژنرسانی به قلب محدودیت ایجاد میکند و بافت قلب سفت میشود (8). متعاقب آن فشار بطن چپ افزایش مییابد و منجر به پاسخ جبرانی دیگر همراه با سنتز بیشتر هر دو نوع کلاژن نوع Iو II میشود که نشان دهنده سختی باقت قلب است (5،8). تاکنون مسیرهای مختلفی در ایجاد کاردیومیوپاتی دیابتی مورد مطالعه قرار گرفته است (9)، اما علت اصلی تغییرات پاتولوژیکی و متعاقب آن اختلال قلب دیابتی بهطور دقیق شناسائی نشده است (10). با اینحال آثار تعدیلکننده تمرین با شدت متناوب به دلیل تنظیم در عملکرد ژن و بهبود بیماریهای متابولیکی در کنار سایر مراحل درمانی به تائید رسیده است (10). در این خصوص عنوان شده انجام تمرین تناوبی شدید (HIIT) همراه با درمان دارویی و رژیم غذایی در سلامت قلب و عروق (11) و بهبود کیفیت زندگی (12) در بیماران دیابتی موثر است (13). با انجام این نوع تمرین متابولیسم سلولی افزایش مییابد و موجب کاهش در فعالیت برخی از پروتئینهای خارج سلولی میشود (13). همچنین ترکیبات پلیفنولکورکومین میتواند به پیوندهای هیدروژنی DNA در هسته سلول متصل شود و با ایجاد تغییرات مستقیم ریز مولکولی گونههای فعال اکسیژن را مهار کند (14). همچنین کورکومین بهوسیله فعالسازی AMPK ((AMP-activated protein kinase بالاترین اثر را در جابجایی GLUT-4 به سطح غشاء سلول داشته، از اینرو حساسیت انسولینی را افزایش میدهد (15). در سال-های اخیر توجه محققان به بررسی تأثیر طـب گیاهی در پیشگیری و درمان مشکلات مختلف معطوف شده است. مصرف آنتیاکسیدانها و ضـدالتهابهـای موجود در طبیعت نمونهای از ایـن تـدابیر است. از جمله مهمترین ضـدالتهابهـای موجـود در طبیعـت، کورکومینوئیدها هستند. زردچوبـه حـاوی گروهی از ترکیبات پلیفنولیک به نام کورکومینوئیدهاست و در بین کورکومینوئیدها، کورکومین رایـجتـرین و فراوانترین پلـیفنـول بـا خاصـیت آنتیاکسـیدانی و ضدالتهابی قوی است. بر اساس نتـایج تحقیقات مـاده مؤثر زردچوبه (کورکـومین) قابلیـت واکنشـی بـالا بـا مولکولهای درگیر در التهاب دارد و پاسخهای التهابی را از طریـق کـاهش فعالیت آنـزیم سیکلواکسـیژناز 2، لیپواکسـیژناز و آنـزیم نیترواکسـاید سـنتاز و کاهش تولید سایتوکاینهای التهابی از جملــه TNF- α میشود (16). در مقاله مروری مارتون و همکاران (2021) عنوان شده است کورکومین مقاومت به انسولین و تحمل نسبت به گلوکز را کاهش میدهد و در نهایت سطوح پلاسمایی قند خون را کاهش داده است. همچنین عنوان شده است کورکومین با نقش ضدالتهابی خود عوارض نوروپاتی ناشی از دیابت را به حداقل رسانده و نیز سبب تقویت اعصاب محیطی شده است (17). در خصوص اثرگذاری وابسته به دوز کورکومین عنوان شده، دوز 150 میلیگرم بر کیلوگرم از وزن بدن در بهبود تحمل گلوکز موثر است (15) و دوز 200 میلیگرم بر کیلوگرم به ازای وزن بدن در روز مجاز بوده و مصرف این مقدار پیوندهای عرضی کلاژن را در موشهای دیابتی میشکند (18). با توجه به آثار جانبی مصرف برخی از داروها، به ترکیبات موثر آنتیاکسیدانی موجود در گیاهان داروئی با خواص ضد دیابتی و کم خطر از جمله کورکومین (ترکیب اصلی گیاه زردچوبه) توجه شده است (19). به طوریکه عنوان شده کورکومین بالاترین اثر را در تنظیم ژن میگذارد (18). با اینحال با توجه به تاثیر مفید تمرین تناوبی بر بهبود عملکرد قلب (11) و نیز آثار مفید مصرف کورکومین بر بهبود بیان ژن (14)، حساسیت انسولین (15) و اثر ضد ایسکمی (18)، هنوز بررسیها در زمینه ایجاد تغییرات پاتوژن قلبی در این نوع بیماران محدود میباشد (9) و نیز مطالعهای در خصوص تاثیر همزمان انجام تمرین تناوبی شدید و مصرف کورکومین بر تنظیم بیان ژن در بافت قلب بیماران مبتلا به دیابت انجام نشده است. بر این اساس مطالعه حاضر در بررسی تاثیر4 هفته تمرین تناوبی شدید همراه با مکمل یاری کورکومین بر ژنهای COL-II، II و SMAD/3 در میوکارد موشهای چاق صحرائی نر مبتلا به دیابت نوع2 انجام شد.
روش بررسی
در پژوهش تجربی- آزمایشگاهی حاضر که بر روی 35 سر موش نر نژاد ویستار از انستیتو پاستور رازی تهیه و به آزمایشگاه حیوانات دانشگاه تربیت مدرس انتقال داده شدند. سن حیوانات 8 تا 9 هفته و میانگین وزن 30±320 گرم بود. همه مراحل مختلف پژوهش با رعایت مسائل اخلاقی، مطابق دستورالعمل کمیته اخلاق کار با حیوانات آزمایشگاهی مستخرج از دستورالعمل هلیسنگی انجام شد. حیوانات به طور تصادفی به 5 گروه 7 تایی تقسیم شدند;1-گروه کنترل سالم (NC)، 2-گروه کنترل دیابتی (DC)،3-گروه کورکومین+ دیابتی (S+DC)، 4-گروه تمرین تناوبی شدید (HIIT)، 5-گروه تمرین تناوبی شدید+ کورکومین (S+HIIT). حیوانات در قفسای از جنس پلیکربنات شفاف ساخت شرکت رازی راد و در دمای محیط با 22 تا 25 درجه سانتیگراد و چرخه روشنایی- تاریکی 12:12 با دسترسی آزادانه به آب و غذای مخصوص حیوانات (پلت) نگهداری شدند.
نحوه القاء دیابت
القاء دیابت به همه موشها بهجز گروه کنترل سالم بدین صورت القاء شد: پس از یک شب ناشتائی شبانه ابتدا محلول نیکوتین آمید با دوز110 میلیگرم بر کیلوگرم وزن بدن بهصورت داخل صفاقی تزریق شد. بعد از 15 دقیقه، محلول تازه تهیه شده استرپتوزوتوسین (STZ) در بافر سیترات با 4/5PH بهصورتداخل صفاقی با دوز 60 میلیگرم بر کیلوگرم، بافر سیترات 0/05 مول بهصورت حل شده تزریق شد (20). پس از گذشت 72 ساعت از انجام تزریق، شاخص دیابتی شدن با اندازهگیری قند خون ناشتا بهوسیله گلوکومتر (01 ساخت ژاپن) از ورید دم موشها دریافت شد. سطح قند خون ناشتا بیش از 160 میلیگرم بر دسیلیتر در نظر گرفته (20) و تائید شد. جدول1 تغییرات وزن، شاخص گلوکز، انسولین و مقاومت به انسولین را به تفکیک گروههای پژوهش نشان میدهد.
آماده سازی مکمل کورکومین
مکملسازی کورکومین با حلال DMSO با غلظت 10 درصد مولار بر اساس ترکیب اصلاح شده (21) به مقدار 200 میلیگرم به ازای 200 میلیگرم بر کیلوگرم وزن بدن به مدت4 هفته، 5 روز در هفته معادل با جلسات تمرین در ساعت10 صبح، یک ساعت قبل از اجرای تمرین بهصورت خوراکی گاواژ شد (22).
روش اجرای تمرین
پس از یک هفته آشناسازی حیوانات با راه رفتن بر روی تردمیل مخصوص جوندگان با سرعت 6 متر بر دقیقه، قبل از اجرای برنامه¬های تمرین، ابتدا ارزیابی توان هوازی با محاسبه سرعت بیشینه در زمان رسیدن به VO2 max و محاسبه شدت تمرین با استفاده از آزمون فزاینده لئاندرو و همکاران (2007) بدین صورت انجام شد: بعد از 3 دقیقه گرمکردن با سرعت 5 متر بر دقیقه و با شیب صفر درجه توسط تغییر در سرعت نوار گردان که در هر 2 دقیقه یکبار m/mim 2 افزایش یافت. بر این اساس تعیین حداکثر سرعت بیشینه زمانی بود که موش¬ها حداقل 1 تا 3 دقیقه نتوانند با یک سرعت ثابت بدوند و بلافاصله با افزایش سرعت قادر به دویدن باشند (23). برنامه تمرین تناوبی شدید (HIIT) شامل 5 دقیقه گرم و سرد کردن با شدت 30 درصد سرعت بیشینه (5 متر بر دقیقه) و 6 دقیقه تناوب تمرین با شدت 85 درصد سرعت بیشینه در هفته اول که به 20 دقیقه دویدن با شدت 90 درصد سرعت بیشینه در پایان هفته چهارم رسید. تعداد تکرار تناوب با شدت بالا در دو هفته اول چهار تکرار بود که در هفتههای سوم و چهارم به پنج تکرار رسید، زمان تناوب با شدت بالا دو دقیقه و تناوب با شدت پائین نیز دو دقیقه بود. سنجش VO2max نیز در روز ششم از هفته دوم بررسی شد و سرعت تمرین بر اساس آن تا پایان هفته چهارم تعیین شد. همچنین یک روز در هفته برای استراحت در نظر گرفته شد. لازم به ذکر است که گروههای کنترل سالم و کنترل دیابتی، در برنامه تمرین شرکت نداشتند، اما برای ایجاد شرایط کاملاً یکسان 5 بار در هفته و به مدت 5 تا 10 دقیقه در هر جلسه برای سازگاری با محیط بر روی نوار گردان کاملاً بیحرکت قرار داده می شدند. در جدول2 برنامه تمرین نشان داده شده است.
روش استخراج نمونه و اندازهگیری ژنهای COL-I، COL-II، SMAD/3:
24 ساعت بعد از آخرین جلسه تمرین موشها توسط تزریق درون صفاقی کتامین 80 میلیگرم بر کیلوگرم و زایلازین 10 میلیگرم بر کیلوگرم بیهوش شدند (24)، سپس خون به طور مستقیم از بطن چپ موشها دریافت و در لولههای حاوی هپارین ریخته شد و به مدت 15 دقیقه با سرعت 3000 متر بر دقیقه در دمای 15 درجه سانتیگراد سانتریفیوژ شد. بافت بطن چپ بلافاصله استخراج و در نیتروژن 20- قرار داده شد و جهت سنجش بیان ژن در فریزر 80- نگهداری شد. سنجش بیان ژنهای COL-I،COL-II ،SMAD/3 روش Realtime-PCR با Premix Extaqit و نیز از GAPDH به عنوان ژن کنترل استفاده شد. اندازهگیری مقدار بیان این ژن بهصورت توأمان با هر یک از ژنها بهوسیله کیت 50 Mir nasy mini kit (qiagene ساخت آلمان) و طبق دستورالعمل انجام شد (25): برای استخراج RNA میزان 50 میلیگرم بافت منجمد قلب موش هموژن شده بر طبق دستورالعمل شرکت سازنده با کیت محلول RNAاز آن استخراج شد، و با آنزیم DNaseI از هرگونه آلودگی به DNAو آنزیمهای تخریب کننده RNA پاکسازی شد. از هرکدام از نمونه¬ها 2 میکروگرمmRNA برای سنتز اولین رشته cDNAاستفاده شد. مقدار نسبی بیان ژنهای مورد مطالعه در بافت قلب با کمک پرایمرهای اختصاصی آن¬ها اندازه¬گیری شد. نسبت جذبی 260 تا 280 نانوگرمی برای تمام نمونه¬های استخراج شده 1/8 تا 2 بود. جهت بررسی کیفیتRNA استخراج شده از روش الکتروفروز و ژل آگارز 1 درصد استفاده شد. قبل از سنجش cDNA برای اطمینان از نبود DNA در نمونه استخراج شده DNA streatment (thermos scientific، ساخت آلمان) انجام شد. سنتز cDNA با کیتtranse criptor first strand Cdna sinthesis kit (roch، ساخت آلمان) طبق دستورالعمل مذکور و نیز برنامه Real time PCR به وسیله دستگاه Rotrogene 6000, corbet") ساخت آلمان انجام شد. این برنامه بر اساس SYBER Green (ampligon , ساخت دانمارک) با دور 95 درجه سانتیگراد به مدت 15 دقیقه و بلافاصله 40 چرخه با 95 درجه سانتیگراد به مدت 15 ثانیه و 60 درجه سانتی¬گراد به مدت 60 ثانیه با پرایمر طراحی شده (ساخت نیکا زیست ژن ایران) انجام گردید.
تجزیه و تحلیل آماری
در بخش مربوط به آمار توصیفی از شاخص پراکندگی انحراف معیار و نمودار استفاده شد. نرمال بودن دادهها توسط آزمون شاپیروویلک بررسی گردید. جهت تعیین اختلافات بین گروهی از آزمون آنووای دو راهه و آزمون تعقیبی توکی در سطح معناداری 0/05استفاده شد. تجزیه و تحلیل دادهها با استفاده از نرمافزار Graph pad prism نسخه 8 انجام شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد واحد تهران مرکزی تایید شده است (کد اخلاق IR.SBMU.RETECH.REC.1398.548 ).
جدول 1: تغییرات وزن، شاخص گلوکز، مقدار انسولین و مقاومت به انسولین به تفکیک در گروههای پژوهش

اعداد به شکل انحراف معیار± میانگین استاندارد بیان شدهاند، *نشانۀ معناداری نسبت به¬ کنترل¬دیابتی،Yنشانه معناداری نسبت به کنترل دیابتی با مکمل.
جدول 2: برنامه تمرین تناوبی شدید در زمان رسیدن به حداکثر اکسیژن مصرفی در مدت 4 هفته

جدول 3: توالی پرایمری ژنهای مورد مطالعه

نتایج
تغییرات شاخص وزن، گلوکز و مقاومت به انسولین در گروه S+HIIT کاهش و انسولین در این گروه نسبت به گروههای DC و S+DC افزایش معناداری نشان داد. بیان COL-I در گروه S+HIIT نسبت به گروههای DC و S+DC به ترتیب (P<0/0001) و (P<0/0004) و درگروه HIIT نسبت به گروه DC (P=0/017) کاهش معناداری داشت. (شکل1). بیان COL-IIدرگروه S+HIIT نسبت به گروه¬های (P=0/001) S+DC و (P<0/0003) DC و در گروه HIIT نسبت به گروه (P=0/013) DC و (P=0/029)S+DC کاهش معناداری داشت. شکل (2). بیان ژن SMAD/3 در گروه S+HIIT نسبت به گروه¬های(P<0/0006)HIIT (P=0/008) ،S+DC (P<0/0002)، DC و در گروه HIIT نسبت به گروه NC (P=0/010)
،DC (P=0/006)) و (P=0/032) S+DC کاهش معناداری نشان داد. شکل (3). بر این اساس میتوان اظهار داشت تمرینHIIT همراه با مکمل یاری کورکومین نسبت به تمرین HIIT تاثیر بالاتری در کاهش شاخصهای گلایسمیک و تنظیم بیان ژن در میوکارد موش های مبتلا به دیابت دارد. جدول4 یافته های آزمون توکی را به منظور بررسی جایگاه تفاوتهای بین گروهی نشان میدهد. بهصورت کلی بر طبق نتایج به دست آمده، مقادیر وزن حیوانات و شاخصهای گلوکز و مقاومت به انسولین در نسبت به سایر گروه¬ها کاهش معناداری داشت. همچنین مقادیر انسولین در گروه تمرین با کورکومین افزایش معناداری نشان داد که بیانگر بهبود شاخصهای گلایسمیک در اثر ترکیب تمرین و مکمل است. بیان ژنهای COL-I و II در هر دو گروه تمرین و نیز تمرین با کورکومین کاهش معناداری داشت، اما همین شاخصها در گروه تمرین نسبت به گروه تمرین با کورکومین تفاوت معناداری وجود نداشت. ژنSMAD/3 در گروه های تمرین و تمرین باکورکومین کاهش معناداری نسبت به سایر گروهها داشت همچنین تاثیر تمرین با مکمل بر کاهش این ژن متفاوتتر از تمرین بهتنهایی بود که نشانگر تاثیر بیشتر تمرین با مکمل نسبت به تمرین یا مکمل به تنهایی است.
جدول4: یافتههای آزمون توکی به منظور بررسی جایگاه تفاوتهای بین گروهی

NC: گروه کنترل سالم، DC: گروه کنترل دیابتی، HIIT: گروه تمرین تناوبی شدید، S+HIIT گروه مکمل با تمرین تناوبی شدید

شکل 1: تغییرات بیان ژن COL-I به تفکیک گروه های پژوهش.
*معناداری نسبت به گروه کنترل سالم،$معناداری نسبت به گروه کنترل دیابتی،#معناداری نسبت به گروه کنترل دیابتی با مکمل (برابر تغییر نسبت به گروه کنترل).

شکل 2: تغییرات بیان ژن COL-II به تفکیک گروه های پژوهش.
* معناداری نسبت به گروه کنترل سالم،$معناداری نسبت به گروه کنترل دیابتی،# معناداری نسبت به گروه کنترل دیابتی با کورکومین (برابر تغییر نسبت به گروه کنترل).

شکل3: تغییرات بیان ژن SMAD/3 به تفکیک در گروههای پژوهش.
*معناداری نسبت به گروه کنترل سالم،$معناداری نسبت به گروه کنترل دیابتی،# معناداری نسبت به گروه کنترل دیابتی با کورکومین،& معناداری نسبت به گروه تمرین تناوبی شدید (برابر تغییر نسبت به گروه کنترل).
بحث
پژوهش حاضر به بررسی اثر 4 هفته تمرین تناوبی شدید همراه با مکملیاری کورکومین بر ژنهای COL-I، II ، SMAD/3 در میوکارد موش¬های چاق صحرایی نر مبتلا به دیابت نوع 2 پرداخت. بر طبق نتایج بهدست آمده وزن، شاخص¬های گلوکز و مقاومت به انسولین در گروه تمرین با کورکومین کاهش معنادار و انسولین در این گروه افزایش معناداری نشان داد. بیان ژنهای COL-I و II در هر دو گروه تمرین و نیز تمرین با کورکومین کاهش معنادار، اما در گروه تمرین نسبت به گروه تمرین با کورکومین تفاوت معناداری نداشت. ژن SMAD/3 در گروههای تمرین و تمرین با کورکومین کاهش معناداری داشت همچنین تاثیر تمرین با مکمل بر کاهش این ژن معنادار تر از تمرین به تنهایی بود. بر طبق نتایج بررسی¬های مختلف ساز و کار مفید تمرین تناوبی شدید در بهبود حساسیت به انسولین (26)، کاهش التهاب سلولی (27)، تنظیم بیان ژن (28) و بهبود پروفایل گلوکز میباشد (27). زیرا ایجاد تنش برشی بالاتر در حین اجرای اینگونه از تمرینات باعث بهبود عملکرد عروق اندوتلیال و بهبود در خون و اکسیژنرسانی به عضلات در گیر در فعالیت و عضلات قلب و تنفس می¬گردد (9،23). مکانیسم اثرگذاری این نوع از تمرین بر تنظیم بیان ژن به دلیل اجراهای متناوب شدید عنوان شده است (28). که از دلایل آن بهکارگیری تارهای تند گلیکولیز و ایجاد هایپوکسی موقتی حین اجرا موجب تولید محرک فاکتور القاء هایپوکسی Insulin growth factor1 (HIF-α1) میگردد (29) و بهوسیله بهکارگیری پروتئین¬های کینازی، سنتز پروتئین¬های انتهای تار و تولید COL-I را کاهش میدهد (27) و از اختلال قلبی پیشگیری میکند (30). همینطور تمرین HIIT با راهاندازی مسیرIGF-1/AKT/Mtorc-1 باعث مهارSMAD/3 می¬شود (28). از طرف دیگر در اجرای تمرین HIIT، کلسیم به کالمودولین (CAMK-II) متصل شده و با راهاندازی AMPKو پروتئین P38-MAPK حرکتGLUT-4 را به سمت غشاء افزایش می¬دهد که این تاثیر تا24 ساعت بعد از تمرین ادامه مییابد (27). همینطور با سیگنالدهی مسیر PI3Kو افزایش عملکرد IGF-1 باعث اتصال بیشتر انسولین به گیرندهاش Hypoxia-inducible factor 1 α-IRS-1 میشود (31) و تا 48 ساعت بعد از تمرین حساسیت به انسولین را افزایش میدهد (26). لازم به ذکر است که انجام ریکاوری فعال با شدت کم بین تناوبهای با شدت بالا با افزایش عملکرد زنجیره انتقال الکترونی و فعالیت آنزیمهای هوازی در بهکارگیری تارهای کند انقباض، موجب بهبود عملکرد میتوکندری و کاهش التهاب می¬شود (32). در خصوص تاثیر ضددیابتی کورکومین نیز عنوان شده، کورکومین با فعالسازی AMPK در انتقال حرکتGLUT -4 به سطح غشاء سلول موثر است (14). در اثرگذاری آن بر بهبود عملکرد ژن وجود زیر مجموعههای کورکومین که شامل دیمتوکسیکورکومین و متوکسیکورکومین میباشد، دارای بالاترین اثر آنتیاکسیدانی بوده بهطوری که با اتصال مستقیم به اسیدهای نوکلئیک درDNA سلول باعث تعدیل و تنظیم در فعالیت ژن میشود (14). طبق بررسیهای مختلف مصرف کورکومین موجب فسفوریلاسیون جانوس کیناز فعال شده با میتوژن میشود و به وسیله مهار تولید کلاژن در غشاء خارجی میوسیت، ایسکمی قلبی را کاهش میدهد (18). بهنظر می-رسد مسیر مشترک و اثر اصلی تمرین HIIT و کورکومین بر بهبود هموستاز گلوکز و متعاقب آن تنظیم عملکرد ژن تاثیر بر فعالیت پروتئین کینازی فعال شده با آدنوزین مونوفسفات حلقوی (CAMP-K) باشد (14). در رابطه با تاثیر تمرینHIIT، نتایج مطالعهای نشان داد، 12 هفته تمرین تداومی با کاهش بیان ژنAng-2، رنین1و گیرندههای آن حساسیت به انسولین را افزایش میدهد (26). همینطور 8 هفته تمرین HIITبه مدت3 روز در هفته موجب فعالسازی IGF-1، AKTوMtorc-1 و کاهش SMAD/3 گردید (28). این نتایج با نتایج مطالعه حاضر همسو است. در حالیکه نتایج مطالعه دیگری نشان داد،4 هفته تمرین با شدت متوسط بر روی تردمیل، 5 روز در هفته به مدت60 دقیقه موجب کاهش تولید کلاژن نوع Iو II در بطن چپ موشهای مدل دیابتی شد (33). این نتایج با نتایج مطالعه حاضر ناهمسو است. شاید بتوان دلیل عدم همخوانی این مطالعه با مطالعه حاضر را به نوع تمرین و شدت تمرین و همچنین تفاوت نوع و نژاد حیوانات نسبت داد. در مطالعهای که به بررسی اثر تمرینHIIT و MIT که به مدت6 هفته و 4 روز در هفته انجام شد، تمرین HIITکه با شدت بین90 تا100 درصد Vo2max انجام شد، نسبت به تمرین با شدت بین 60 تا80 درصد، نتایج نشان داد، تمرین شدید تاثیر بالاتری بر بهبود بیان ژن و کاهش فاکتورهای التهابزا و نیز کاهش مقاومت به انسولین ایجاد کرد (27). این نتایج با نتایج مطالعه حاضر همسو میباشد. تفاوت در نوع تمرین بر بهبود پاسخهای سندرم متابولیک به شدت آن و مقدار عضلات درگیر در فعالیت نسبت داده شده است (8). در این خصوص عنوان شده، تمرین با شدت متوسط با تاثیر بیشتر بر بهبود عملکرد سیستم سمپاتیک (32) و تمرین شدید با تاثیر بالاتر بر متابولیسم سلولی بر بهبود پاسخ¬های قلبی در بیماران دیابتی تاثیر گذار می¬باشد (8). همچنین به نظر میرسد، مسیر مشترک و اصلی تاثیر احتمالی تمرینHIIT و کورکومین بر بهبود همئوستاز گلوکز، بهبود متابولیسم سلولی و متعاقب آن تنظیم در فعالیت ژن در مبتلایان به دیابت، تاثیر بر عملکرد پروتئینکینازی فعال شده با آدنوزین منوفسفات باشد (16،23). با اینحال نتایج بهدست آمده از پژوهش حاضر حاکی از اثرات سودمند تمرین HIIT به همراه مکمل ضد اکسایشی کورکومین در بهبود ساختار قلب بودیم. هر چند دریافت مکمل یاری کورکومین به همراه تمرینHIIT تاثیر بیشتری نسبت به تمرین به تنهایی بر تنظیم شاخص گلایسمی و کاهش بیان ژن SMAD/3 ایجاد کرده میتوان چنین اظهار داشت که کورکومین اثر تمرین را تقویت کرده است. از دلایل کمتر بودن اثر تمرین به تنهایی می تواند ناشی از وهلههای متناوب شدید که در 2 دقیقه اجرا شد نسبت داده شود، شاید اگر تناوب تمرین در زمان کمتر اما با شدت بیشتری اجرا میشد تاثیر بالاتری بر بهبود عملکرد ژنهای مذکور مشاهده میشد (28). هر چند در زمینه نوع و شدت تمرین بر بهبود بیان ژن نتایج متناقضی وجود دارد (27،28). اما با توجه به اینکه پژوهش حاضر برای اولین بار به بررسی تاثیر هم زمان تمرین و مصرف مکمل یاری کورکومین بر بهبود بیان ژن در میوکارد موشهای دیابتی انجام شد، دارای محدودیتهایی است که از آن جمله میتوان به عدم دسترسی به آزمودنیهای انسانی، عدم بررسی پروتئین ژنهای مذکور و نیز عدم انجام اکوکاردیوگرافی به دلیل کمبود بودجه پژوهش اشاره گردد. لذا پیشنهاد میشود در مطالعات آینده مدل تمرینی مذکور همراه با مکمل کورکومین در مدت زمان طولانی یا با شدت بالاتر و بهطور گستردهتر انجام شود تا بتوان نتایج دقیقتری در این زمینه بهدست آورد.
نتیجهگیری
بهطور کلی نتایج بهدست آمده حاکی از آن است که، 4 هفته تمرین تناوبی شدید همراه با مکمل کورکومین مقادیر گلوکز و مقاومت به انسولین را در موشهای چاق دیابتی کاهش داد، همچنین تمرین تناوبی شدید باعث کاهش ژنهای COL-I ،COL-II وSMAD/3 شد و کاهش بیان SMAD/3 تحت تاثیر تمرین تناوبی شدید با مکمل، احتمالاً میتواند فیبروز میوکارد را در افراد دیابتی بهبود بخشد.
حامی مالی: ندارد.
تعارض منافع: وجود ندارد.
References:
1- Serra N, Rosales R, Masana L, Vallvé J-C. Simvastatin Increases Fibulin-2 Expression in Human Coronary Artery Smooth Muscle Cells Via Rhoa/Rho-Kinase Signaling Pathway Inhibition. PloS one 2015; 10(7): e0133875.
2- Wada J, Zhang H, Tsuchiyama Y, Hiragushi K, Hida K, Shikata K, et al. Gene Expression Profile in Streptozotocin-Induced Diabetic Mice Kidneys Undergoing Glomerulosclerosis. Kidney int 2001; 59(4): 1363-73.
3- Schaan BD, Quadros AS, Sarmento-Leite R, De Lucca G, Bender A, Bertoluci M. 'Correction:'Serum Transforming Growth Factor Beta-1 (TGF-Beta-1) Levels in Diabetic Patients are Not Associated with Pre-Existent Coronary Artery Disease. Cardiovasc Diabetol 2007; 6(1): 19.
4- Kraemer WJ, Ratamess NA. Hormonal Responses and Adaptations to Resistance Exercise and Training. Sports Medicine 2005; 35(4): 339-61.
5- Li W, Zhou P, Wang G, Lu X, Jiang Y, Zhao X. Anti-Inflammatory Effects of Lycopene Prevents Cardiac Dysfunction in Streptozotocin-Diabetic Rats. Int J Clin Exp Med 2016; 9(5): 8047-54.
6- Buchanan TA, Metzger BE, Freinkel N, Bergman RN. Insulin Sensitivity and B-Cell Responsiveness to Glucose During Late Pregnancy in Lean and Moderately Obese Women with Normal Glucose Tolerance or Mild Gestational Diabetes. Am J Obstet & Gynecol 1990; 162(4): 1008-14.
7- Schiaffino S, Dyar KA, Ciciliot S, Blaauw B, Sandri M. Mechanisms Regulating Skeletal Muscle Growth and Atrophy. FEBS J 2013; 280(17): 4294-314.
8- Xu X, Wan W, Ji L, Lao S, Powers AS, Zhao W, et al. Exercise Training Combined with Angiotensin II Receptor Blockade Limits Post-Infarct Ventricular Remodelling in Rats. Cardiovasc Res 2008; 78(3): 523-32.
9- Castellar A, Remedio R, Barbosa R, Gomes RJ, Caetano FH. Collagen and Reticular Fibers in Left Ventricular Muscle in Diabetic Rats: Physical Exercise Prevents its Changes? Tissue Cell 2011; 43(1): 24-8.
10- Gibala MJ, Little JP, MacDonald MJ, Hawley JA. Reply from MJ Gibala, JP Little, MJ Maddonald and JA Hawley. J Physiol 2012; 590(14): 3391.
11- Estes Rr, Malinowski A, Piacentini M, Thrush D, Salley E, Losey C, et al. The Effect of High Intensity Interval Run Training on Cross-Sectional Area of the Vastus Lateralis in Untrained College Students. Int J Exerc Sci 2017; 10(1): 137-45.
12- Kleber ME, Koller L, Goliasch G, Sulzgruber P, Scharnagl H, Silbernagel G, et al. Von Willebrand Factor Improves Risk Prediction in Addition to N-Terminal Pro B-Type Natriuretic Peptide in Patients Referred to Coronary Angiography and Signs and Symptoms of Heart Failure and Preserved Ejection Fraction. Circ Heart Fail 2015; 8(1): 25-32.
13- Santos MHH, Higuchi MdL, Tucci PJ, Garavelo SM, Reis MM, Antonio EL, et al. Previous Exercise Training Increases Levels of PPAR-Α in Long-Term Post-Myocardial Infarction in Rats, Which is Correlated with Better Inflammatory Response. Clinics 2016; 71(3): 163-8.
14- Kang C, Kim E. Synergistic Effect of Curcumin and Insulin on Muscle Cell Glucose Metabolism. Food Chem Toxicol 2010; 48(8-9): 2366-73.
15- Na LX, Zhang YL, Li Y, Liu LY, Li R, Kong T, et al. Curcumin Improves Insulin Resistance in Skeletal Muscle of Rats. Nutr Metab Cardiovasc Dis 2011; 21(7): 526-33.
16- Salimi Avansar M. The Effects of Eight Weeks Interval Training and Curcumin Consumption on TNF-Α and BDNF Levels in Men with Metabolic Syndrome. J Ardabil Univ Med Sci 2017; 17(3): 299-310.
17- Marton LT, Pescinini-e-Salzedas LM, Camargo MEC, Barbalho SM, Haber JF, Sinatora RV, et al. The Effects of Curcumin on Diabetes Mellitus: A Systematic Review. Frontiers in Endocrinology 2021; 12: 669448.
18- Maithilikarpagaselvi N, Sridhar MG, Swaminathan RP, Zachariah B. Curcumin Prevents Inflammatory Response, Oxidative Stress and Insulin Resistance in High Fructose Fed Male Wistar Rats: Potential Role of Serine Kinases. Chem-Biol Interact 2016; 244: 187-94.
19- Soudamini K, Unnikrishnan M, Soni K, Kuttan R. Inhibition of Lipid Peroxidation and Cholesterol Levels in Mice by Curcumin. Indian J Physiol Pharmacol 1992; 36: 239-43.
20- Pierre W, Gildas AJH, Ulrich MC, Modeste W-N, azTélesphore Benoît N, Albert K. Hypoglycemic and Hypolipidemic Effects of bersama Engleriana Leaves in Nicotinamide/Streptozotocin-Induced Type 2 Diabetic Rats. BMC Complement Altern Med 2012; 12(1): 264.
21- Majchrowicz E. Induction of Physical Dependence Upon Ethanol and the Associated Behavioral Changes in Rats. Psychopharmacologia 1975; 43(3): 245-54.
22- García-Niño WR, Pedraza-Chaverrí J. Protective Effect of Curcumin Against Heavy Metals-Induced Liver Damage. Food and Chemical Toxicology 2014; 69: 182-201.
23- Leandro CG, Levada AC, Hirabara SM, Manhães-de-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength and Conditioning Research 2007; 21(3): 37-43.
24- Ghaderpour S, Zare S, Pakdel F. Effects of Acute Intra-Hippocompal Injection of Bupropion on Active Avoidance Learning in Rats. Physiology and Pharmacology 2010; 14(3): 289-96. [Persian]
25- Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F. Accurate Normalization of Real-Time Quantitative RT-PCR Data by Geometric Averaging of Multiple Internal Control Genes. Genome Biology 2002; 3(7): 1-12.
26- de Oliveira Sa G, Dos Santos Neves V, de Oliveira Fraga SR, Souza-Mello V, Barbosa-da-Silva S. High-Intensity Interval Training Has Beneficial Effects on Cardiac Remodeling through Local Renin-Angiotensin System Modulation in Mice Fed High-Fat or High-Fructose Diets. Life Sci 2017; 189: 8-17.
27- Hadiono M, Kushartanti BW. High Intensity Interval Training (HIIT) and Moderate Intensity Training (MIT) Against TNF-Α and IL-6 Levels in Rats. Available at: https://www.atlantis-press.com/proceedings/icssh-18/55914034. Accssed Oct 21, 2022.
28- Launay T, Momken I, Carreira S, Mougenot N, Zhou X-L, De Koning L, et al. Acceleration-Based Training: A New Mode of Training in Senescent Rats Improving Performance and Left Ventricular and Muscle Functions. Exp Gerontol 2017; 95: 71-6.
29- Holloway TM, Bloemberg D, Da Silva ML, Simpson JA, Quadrilatero J, Spriet LL. High Intensity Interval and Endurance Training Have Opposing Effects on Markers of Heart Failure and Cardiac Remodeling in Hypertensive Rats. PloS one 2015; 10(3): e0121138.
30- Schmederer Z, Rolim N, Bowen TS, Linke A, Wisloff U, Adams V. Endothelial Function is Disturbed in a Hypertensive Diabetic Animal Model of Hfpef: Moderate Continuous Vs. High Intensity Interval Training. Int J Cardiol 2018; 273: 147-54.
31- Machida S, Booth FW. Insulin-Like Growth Factor 1 and Muscle Growth: Implication for Satellite Cell Proliferation. Proc Nutr Soc 2004; 63(2): 337-40.
32- Asilah Za'don NH, Amirul Farhana MK, Farhanim I, Sharifah Izwan TO, Appukutty M, Salim N, et al. High-Intensity Interval Training Induced PGC-1 Proportional, Variant and Adipor1 Gene Expressions and Improved Insulin Sensitivity in Obese Individuals. Med J Malaysia 2019; 74(6): 461-7.
33- Silva FS, Bortolin RH, Araujo DN, Marques DES, Lima J, Rezende AA, et al. Exercise Training Ameliorates Matrix Metalloproteinases 2 and 9 Messenger RNA Expression and Mitigates Adverse Left Ventricular Remodeling in Streptozotocin-Induced Diabetic Rats. Cardiovasc Pathol 2017; 29: 37-44.
1- Serra N, Rosales R, Masana L, Vallvé J-C. Simvastatin Increases Fibulin-2 Expression in Human Coronary Artery Smooth Muscle Cells Via Rhoa/Rho-Kinase Signaling Pathway Inhibition. PloS one 2015; 10(7): e0133875.
2- Wada J, Zhang H, Tsuchiyama Y, Hiragushi K, Hida K, Shikata K, et al. Gene Expression Profile in Streptozotocin-Induced Diabetic Mice Kidneys Undergoing Glomerulosclerosis. Kidney int 2001; 59(4): 1363-73.
3- Schaan BD, Quadros AS, Sarmento-Leite R, De Lucca G, Bender A, Bertoluci M. 'Correction:'Serum Transforming Growth Factor Beta-1 (TGF-Beta-1) Levels in Diabetic Patients are Not Associated with Pre-Existent Coronary Artery Disease. Cardiovasc Diabetol 2007; 6(1): 19.
4- Kraemer WJ, Ratamess NA. Hormonal Responses and Adaptations to Resistance Exercise and Training. Sports Medicine 2005; 35(4): 339-61.
5- Li W, Zhou P, Wang G, Lu X, Jiang Y, Zhao X. Anti-Inflammatory Effects of Lycopene Prevents Cardiac Dysfunction in Streptozotocin-Diabetic Rats. Int J Clin Exp Med 2016; 9(5): 8047-54.
6- Buchanan TA, Metzger BE, Freinkel N, Bergman RN. Insulin Sensitivity and B-Cell Responsiveness to Glucose During Late Pregnancy in Lean and Moderately Obese Women with Normal Glucose Tolerance or Mild Gestational Diabetes. Am J Obstet & Gynecol 1990; 162(4): 1008-14.
7- Schiaffino S, Dyar KA, Ciciliot S, Blaauw B, Sandri M. Mechanisms Regulating Skeletal Muscle Growth and Atrophy. FEBS J 2013; 280(17): 4294-314.
8- Xu X, Wan W, Ji L, Lao S, Powers AS, Zhao W, et al. Exercise Training Combined with Angiotensin II Receptor Blockade Limits Post-Infarct Ventricular Remodelling in Rats. Cardiovasc Res 2008; 78(3): 523-32.
9- Castellar A, Remedio R, Barbosa R, Gomes RJ, Caetano FH. Collagen and Reticular Fibers in Left Ventricular Muscle in Diabetic Rats: Physical Exercise Prevents its Changes? Tissue Cell 2011; 43(1): 24-8.
10- Gibala MJ, Little JP, MacDonald MJ, Hawley JA. Reply from MJ Gibala, JP Little, MJ Maddonald and JA Hawley. J Physiol 2012; 590(14): 3391.
11- Estes Rr, Malinowski A, Piacentini M, Thrush D, Salley E, Losey C, et al. The Effect of High Intensity Interval Run Training on Cross-Sectional Area of the Vastus Lateralis in Untrained College Students. Int J Exerc Sci 2017; 10(1): 137-45.
12- Kleber ME, Koller L, Goliasch G, Sulzgruber P, Scharnagl H, Silbernagel G, et al. Von Willebrand Factor Improves Risk Prediction in Addition to N-Terminal Pro B-Type Natriuretic Peptide in Patients Referred to Coronary Angiography and Signs and Symptoms of Heart Failure and Preserved Ejection Fraction. Circ Heart Fail 2015; 8(1): 25-32.
13- Santos MHH, Higuchi MdL, Tucci PJ, Garavelo SM, Reis MM, Antonio EL, et al. Previous Exercise Training Increases Levels of PPAR-Α in Long-Term Post-Myocardial Infarction in Rats, Which is Correlated with Better Inflammatory Response. Clinics 2016; 71(3): 163-8.
14- Kang C, Kim E. Synergistic Effect of Curcumin and Insulin on Muscle Cell Glucose Metabolism. Food Chem Toxicol 2010; 48(8-9): 2366-73.
15- Na LX, Zhang YL, Li Y, Liu LY, Li R, Kong T, et al. Curcumin Improves Insulin Resistance in Skeletal Muscle of Rats. Nutr Metab Cardiovasc Dis 2011; 21(7): 526-33.
16- Salimi Avansar M. The Effects of Eight Weeks Interval Training and Curcumin Consumption on TNF-Α and BDNF Levels in Men with Metabolic Syndrome. J Ardabil Univ Med Sci 2017; 17(3): 299-310.
17- Marton LT, Pescinini-e-Salzedas LM, Camargo MEC, Barbalho SM, Haber JF, Sinatora RV, et al. The Effects of Curcumin on Diabetes Mellitus: A Systematic Review. Frontiers in Endocrinology 2021; 12: 669448.
18- Maithilikarpagaselvi N, Sridhar MG, Swaminathan RP, Zachariah B. Curcumin Prevents Inflammatory Response, Oxidative Stress and Insulin Resistance in High Fructose Fed Male Wistar Rats: Potential Role of Serine Kinases. Chem-Biol Interact 2016; 244: 187-94.
19- Soudamini K, Unnikrishnan M, Soni K, Kuttan R. Inhibition of Lipid Peroxidation and Cholesterol Levels in Mice by Curcumin. Indian J Physiol Pharmacol 1992; 36: 239-43.
20- Pierre W, Gildas AJH, Ulrich MC, Modeste W-N, azTélesphore Benoît N, Albert K. Hypoglycemic and Hypolipidemic Effects of bersama Engleriana Leaves in Nicotinamide/Streptozotocin-Induced Type 2 Diabetic Rats. BMC Complement Altern Med 2012; 12(1): 264.
21- Majchrowicz E. Induction of Physical Dependence Upon Ethanol and the Associated Behavioral Changes in Rats. Psychopharmacologia 1975; 43(3): 245-54.
22- García-Niño WR, Pedraza-Chaverrí J. Protective Effect of Curcumin Against Heavy Metals-Induced Liver Damage. Food and Chemical Toxicology 2014; 69: 182-201.
23- Leandro CG, Levada AC, Hirabara SM, Manhães-de-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength and Conditioning Research 2007; 21(3): 37-43.
24- Ghaderpour S, Zare S, Pakdel F. Effects of Acute Intra-Hippocompal Injection of Bupropion on Active Avoidance Learning in Rats. Physiology and Pharmacology 2010; 14(3): 289-96. [Persian]
25- Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, Speleman F. Accurate Normalization of Real-Time Quantitative RT-PCR Data by Geometric Averaging of Multiple Internal Control Genes. Genome Biology 2002; 3(7): 1-12.
26- de Oliveira Sa G, Dos Santos Neves V, de Oliveira Fraga SR, Souza-Mello V, Barbosa-da-Silva S. High-Intensity Interval Training Has Beneficial Effects on Cardiac Remodeling through Local Renin-Angiotensin System Modulation in Mice Fed High-Fat or High-Fructose Diets. Life Sci 2017; 189: 8-17.
27- Hadiono M, Kushartanti BW. High Intensity Interval Training (HIIT) and Moderate Intensity Training (MIT) Against TNF-Α and IL-6 Levels in Rats. Available at: https://www.atlantis-press.com/proceedings/icssh-18/55914034. Accssed Oct 21, 2022.
28- Launay T, Momken I, Carreira S, Mougenot N, Zhou X-L, De Koning L, et al. Acceleration-Based Training: A New Mode of Training in Senescent Rats Improving Performance and Left Ventricular and Muscle Functions. Exp Gerontol 2017; 95: 71-6.
29- Holloway TM, Bloemberg D, Da Silva ML, Simpson JA, Quadrilatero J, Spriet LL. High Intensity Interval and Endurance Training Have Opposing Effects on Markers of Heart Failure and Cardiac Remodeling in Hypertensive Rats. PloS one 2015; 10(3): e0121138.
30- Schmederer Z, Rolim N, Bowen TS, Linke A, Wisloff U, Adams V. Endothelial Function is Disturbed in a Hypertensive Diabetic Animal Model of Hfpef: Moderate Continuous Vs. High Intensity Interval Training. Int J Cardiol 2018; 273: 147-54.
31- Machida S, Booth FW. Insulin-Like Growth Factor 1 and Muscle Growth: Implication for Satellite Cell Proliferation. Proc Nutr Soc 2004; 63(2): 337-40.
32- Asilah Za'don NH, Amirul Farhana MK, Farhanim I, Sharifah Izwan TO, Appukutty M, Salim N, et al. High-Intensity Interval Training Induced PGC-1 Proportional, Variant and Adipor1 Gene Expressions and Improved Insulin Sensitivity in Obese Individuals. Med J Malaysia 2019; 74(6): 461-7.
33- Silva FS, Bortolin RH, Araujo DN, Marques DES, Lima J, Rezende AA, et al. Exercise Training Ameliorates Matrix Metalloproteinases 2 and 9 Messenger RNA Expression and Mitigates Adverse Left Ventricular Remodeling in Streptozotocin-Induced Diabetic Rats. Cardiovasc Pathol 2017; 29: 37-44.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1400/9/9 | پذیرش: 1401/1/21 | انتشار: 1401/8/15
دریافت: 1400/9/9 | پذیرش: 1401/1/21 | انتشار: 1401/8/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







