دوره 30، شماره 5 - ( مرداد 1401 )
جلد 30 شماره 5 صفحات 4841-4828 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Saberi R, Ahmadi A, Khodabandeh Z, Alaee S. Effect of Taurine and Curcumin on In-Vitro Fertilization in NMRI Mice Treated with Acrylamide. JSSU 2022; 30 (5) :4828-4841
URL: http://jssu.ssu.ac.ir/article-1-5606-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5606-fa.html
صابری رزا، احمدی عباس، خدابنده زهرا، علائی ساناز. بررسی اثر تائورین و کورکومین بر لقاح داخل آزمایشگاهی در موشهای ماده نژادNMRI تحت تیمار با آکریلآمید. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (5) :4828-4841
متن کامل [PDF 977 kb]
(637 دریافت)
| چکیده (HTML) (1973 مشاهده)
References:
1- Devreker F, Van den Bergh M, Biramane J, Winston RL, Englert Y, Hardy K. Effects of Taurine on Human Embryo Development in Vitro. Hum Reprod 1999; 14(9): 2350-6.
2- Al Abdali FH, Gowri V. The Etiology of Infertility and Treatment Outcome in Couples Aged 40 Years or More in A Non-IVF Setting. Journal of Infertility and Reproductive Biology 2021; 9(2): 87-92.
3- Kahyaoglu S, Gulerman HC, Yilmaz N, Kahyaoglu I, Ustun Y. Does Preovulatory Follicle Number Affect Probability for Achievement of at Least One Top Quality Embryo from Poor Responder Women Undergoing Assisted Reproduction Treatment? Journal of Infertility and Reproductive Biology 2021; 9(2): 78-86.
4- Khodabandeh Z, Dolati P, Zamiri MJ, Mehrabani D, Bordbar H, Alaee S, et al. Protective Effect of Quercetin on Testis Structure and Apoptosis Against Lead Acetate Toxicity: An Stereological Study. Biological Trace Element Research 2021;199(9): 3371-81.
5- Soleimani A. Environmental Pollution: A Risk Factor for Female Fertility-A Letter to Editor. Journal of Infertility and Reproductive Biology 2020; 8(4): 66-7.
6- Eunice O, Homahinuchi J-AH, Ariyo JD. Sugar Intake Disrupts Some Reproductive Functions in Female Wistar Rats. Journal of Infertility and Reproductive Biology 2021; 9(1): 1-6.
7- Adler I-D, Gonda H, de Angelis MH, Jentsch I, Otten I, Speicher M. Heritable Translocations Induced by Dermal Exposure of Male Mice to Acrylamide. Cytogenet Genome Res 2004; 104(1-4): 271-6.
8- Friedman M. Chemistry, Biochemistry, and Safety of Acrylamide. A Review. J Agric Food Chem 2003; 51(16): 4504-26.
9- Semla M, Goc Z, Martiniaková M, Omelka R, Formicki G. Acrylamide: A Common Food Toxin Related to Physiological Functions and Health. Physiol Res 2017; 66(2): 205-17.
10- Timmermann CAG, Mølck SS, Kadawathagedara M, Bjerregaard AA, Törnqvist M, Brantsæter AL, et al. A Review of Dietary Intake of Acrylamide in Humans. Toxics 2021; 9(7): 155.
11- Swedish NF. Information about Acrylamide in Food. Swedish National Food Administration 2002; 4: 24.
12- Becalski A, Lau BP-Y, Lewis D, Seaman SW, Hayward S, Sahagian M, et al. Acrylamide in French Fries: Influence of Free Amino Acids and Sugars. J Agric Food Chem 2004; 52(12): 3801-6.
13- Amrein TM, Bachmann S, Noti A, Biedermann M, Barbosa MF, Biedermann-Brem S, et al. Potential of Acrylamide Formation, Sugars, and Free Asparagine in Potatoes: A Comparison of Cultivars and Farming Systems. J Agric Food Chem 2003; 51(18): 5556-60.
14- Stadler RH. Acrylamide Formation in Different Foods and Potential Strategies for Reduction. In: Friedman M, Mottram D (eds) Chemistry and safety of acrylamide in food. Adv Exp Med Biol 2005: 561; 157-69.
15- Becalski A, Lau BP-Y, Lewis D, Seaman SW. Acrylamide in Foods: Occurrence, Sources, and Modeling. J Agric Food Chem 2003; 51(3): 802-8.
16- Claus A, Mongili M, Weisz G, Schieber A, Carle R. Impact of Formulation and Technological Factors on the Acrylamide Content of Wheat Bread and Bread Rolls. Journal of Cereal Science 2008; 47(3): 546-54.
17- Besaratinia A, Pfeifer GP. A Review of Mechanisms of Acrylamide Carcinogenicity. Carcinogenesis 2007; 28(3): 519-28.
18- Aldawood N, Alrezaki A, Alanazi S, Amor N, Alwasel S, Sirotkin A, et al. Acrylamide Impairs Ovarian Function by Promoting Apoptosis and Affecting Reproductive Hormone Release, Steroidogenesis and Autophagy-Related Genes: an in Vivo Study. Ecotoxicol and Environ Safety 2020; 197: 110595.
19- Nan B, Yang C, Li L, Ye H, Yan H, Wang M, et al. Allicin Alleviated Acrylamide-Induced NLRP3 Inflammasome Activation Via Oxidative Stress and Endoplasmic Reticulum Stress in Kupffer Cells and SD Rats Liver. Food Chem Toxicol 2021; 148: 111937.
20- Adewale AO, Adedeji SI, Olusola OO, Sulaiman SO, Victoria IO. Ethanolic Extract of Combined Cynodon dactylon and Mimosa pudica Ameliorated Experimentally Induced Benign Prostatic Hyperplasia in Wistar Rats. Journal of Infertility and Reproductive Biology 2021; 9(1): 22-6.
21- Dinga HF, Ndukong NE, Adzemye NG, Fanadzenyuy MH, Limnyuy KA, Justin K, et al. Assessment of Fertility, Progesterone Profiles and Oxidative Stress Parameters after Estrus Induction and Artificial Insemination in Cows. Journal of Infertility and Reproductive Biology 2021; 9(3): 123-9.
22- Ojatula AO. Developmental Botanic: A Case Study on Chromatographic Determination of Phytocompounds in the Roots of Anthocleista Nobilis (G. Don.) as Pro-Fertility. Journal of Infertility and Reproductive Biology 2021; 9(1): 7-21.
23- Olubunmi EO, Adeoye Oyetunji O, Olorunfemi ST, Opeyemi Samson A, Taiwo Adekemi A, Olawumi Feyisike J, et al. Attenuating Effect of Polyalthia Longifolia on Cadmium Sulfate-Induced Testicular Toxicity. Journal of Infertility and Reproductive Biology 2021; 9(2): 60-6.
24- Emokpae MA, Olaode O. Dose-Dependent Effect of Garlic (Allium Sativum) Extract Feeding on Semen Characteristics and Testes in Wistar Rats. Journal of Infertility and Reproductive Biology 2021; 9(3): 130-5.
25- Guerin P, Menezo Y. Hypotaurine and Taurine in Gamete and Embryo Environments: De Novo Synthesis Via the Cysteine Sulfinic Acid Pathway in Oviduct Cells. Zygote 1995; 3(4): 333-43.
26- Leese HJ, McKeegan P, Sturmey RG. Amino Acids and the Early Mammalian Embryo: Origin, Fate, Function and Life-Long Legacy. Int J Environ Res Public Health 2021; 18(18): 9874.
27- Ogasawara M, Nakamura T, Koyama I, Nemoto M, Yoshida T. Reactivity of Taurine with Aldehydes and Its Physiological Role.Adv Exp Med Biol1994: 359: 71-8.
28- Odebiyi O, Badejo J, Alabi B, Ajayi A, Iwalewa O, Fagbemi O. Evaluation of Modulatory Effects of Taurine in the Aortic and Myocardial Tissue of Nitroglycerin-Induced Tolerance Wistar Rats. Nutrire 2021; 46(2): 1-8.
29- Gold R, Linington C, Lassmann H. Understanding Pathogenesis and Therapy of Multiple Sclerosis Via Animal Models: 70 Years of Merits and Culprits in Experimental Autoimmune Encephalomyelitis Research. Brain 2006; 129(8): 1953-71.
30- Kurd SK, Smith N, VanVoorhees A, Troxel AB, Badmaev V, Seykora JT, et al. Oral Curcumin in the Treatment of Moderate to Severe Psoriasis Vulgaris: A Prospective Clinical Trial. J Am Acad Dermatol 2008; 58(4): 625-31.
31- Golmohammadi T, Hayati Roodbari N, Mohammady Gorgi S, Vaezi G. Effect of Curcuma Longa on in Vitro Maturation of Immature Oocytes and Embryonic Development in NMRI Mice. J Mazandaran Univ Med Sci 2018; 27(157): 49-58. [Persian]
32- Azami SH, Nazarian H, Abdollahifar MA, Eini F, Farsani MA, Novin MG. The Antioxidant Curcumin Postpones Ovarian Aging in Young and Middle-Aged Mice. Reproduction, Fertility and Development 2020; 32(3): 292-303.
33- Duan X, Wang Q-C, Chen K-L, Zhu C-C, Liu J, Sun S-C. Acrylamide Toxic Effects on Mouse Oocyte Quality and Fertility in Vivo. Scientific Reports 2015; 5(1): 1-11.
34- Das J, Ghosh J, Manna P, Sil PC. Acetaminophen Induced Acute Liver Failure Via Oxidative Stress and JNK Activation: Protective Role of Taurine by the Suppression of Cytochrome P450 2E1. Free Radic Res 2010; 44(3): 340-55.
35- Dolati P, Zamiri MJ, Akhlaghi A, Khodabandeh Z, Mehrabani D, Atashi H, et al. Reproductive and Embryological Toxicity of Lead Acetate in Male Mice and their Offspring and Mitigation Effects of Quercetin. J Trace Elem Med Biol 2021; 67: 126793.
36- Van der Horst C, Brand A. Occurrence of Hypotaurine and Inositol in the Reproductive Tract of the Ewe and tts Regulation by Pregnenolone and Progesterone. Nature 1969; 223(5201): 67-8.
37- Song D, Xu C, Holck AL, Liu R. Acrylamide Inhibits Autophagy, Induces Apoptosis and Alters Cellular Metabolic Profiles. Ecotoxicol Environ Saf 2021; 208: 111543.
38- Dumoulin JC, Evers JL, Bakker JA, Bras M, Pieters MH, Geraedts JP. Temporal Effects of Taurine on Mouse Preimplantation Development in Vitro. Hum Reprod 1992; 7(3): 403-7.
39- Choi Y-H, Seng S, Toyoda Y. Effect of Taurine on in Vitro Fertilization and Embryo Development of BALB/C Mouse Strain. Journal of Reproduction and Development 1998; 44(1): 29-34.
40- Chen C-C, Hsieh M-S, Hsuuw Y-D, Huang F-J, Chan W-H. Hazardous Effects of Curcumin on Mouse Embryonic Development through a Mitochondria-Dependent Apoptotic Signaling Pathway. Int J Mol Sci 2010; 11(8): 2839-55.
41- Hsuuw YD, Chang CK, Chan WH, Yu JS. Curcumin Prevents Methylglyoxal Induced Oxidative Stress and Apoptosis in Mouse Embryonic Stem Cells and Blastocysts. J Cell Physiol 2005; 205(3): 379-86.
42- Chen C-C, Chan W-H. Injurious Effects of Curcumin on Maturation of Mouse Oocytes, Fertilization and Fetal Development Via Apoptosis. International J Mol Sci 2012; 13(4): 4655-72.
43- Huang F-J, Lan K-C, Kang H-Y, Liu Y-C, Hsuuw Y-D, Chan W-H, et al. Effect of Curcumin on in Vitro Early Post-Implantation Stages of Mouse Embryo Development. European Journal of Obstetrics & Gynecology and Reproductive Biology 2013; 166(1): 47-51.
44- Agarwal A, Aponte-Mellado A, Premkumar BJ, Shaman A, Gupta S. The Effects of Oxidative Stress on Female Reproduction: A Review. Reproductive biology and endocrinology 2012; 10(1): 1-31.
45- Behrman HR, Kodaman PH, Preston SL, Gao S. Oxidative Stress and the Ovary. Journal of the Society for Gynecologic Investigation 2001; 8(1_suppl): S40-S2.
46- Rad MR, Nejati V, Razi M, Najafi G. Nano-Micelle Curcumin; A Hazardous and/or Boosting Agent? Relation with Oocyte in-Vitro Maturation and Pre-Implantation Embryo Development in Rats. Iran J Pharm Res: IJPR 2020; 19(2): 242.
متن کامل: (900 مشاهده)
مقدمه
امروزه، مسائل مربوط به باروری و ناباروری ازجمله مسائل چالش برانگیز در علم پزشکی است. تقریباً در 15-10 درصد از زوجهایی که در سن باروری هستند، ناباروری مشاهده میشود. بنابراین میتوان استنباط کرد که بیش از 80 میلیون زوج در سراسر جهان ناباروری را تجربه میکنند (2،3). امروزه مشخص شده است که روند ایجاد ناباروری در جوامع مختلف در حال افزایش میباشد به طوریکه توجه دانشمندان را به نقش عوامل محیطی و سبک زندگی و تغذیهای سوق داده است (6-4). آکریلآمید (ACR) Acrylamide یکی از انواع مواد شیمیایی است که بهطور گسترده در لوازم آرایشی (کرمهای پوستی)، بستهبندی مواد غذایی، تولید پارچه، چسب، لنزهای تماسی، کودهای خاک، تصفیه فاضلاب و آب آشامیدنی و صنایع دخانیات و پلاستیک استفاده میشود (10-7). کشف اولیه مقادیر بالای آکریلآمید در مواد غذایی غنی از کربوهیدرات که تحت فرایندهای حرارتی بالا فرآوری می¬شوند و همچنین اعلام خواص سمیت و اثرات سرطانزایی این ترکیب، سبب بروز نگرانیهای وسیعی در سراسر جهان شده است (11). منابع غذایی مهم دریافت آکریل آمید شامل محصولات سیب زمینی، محصولات غلاتی و آردی، محصولات خشک شده، مغزهای تفت داده شده و قهوه میباشد (12،13). مسیر اصلی تشکیل آکریلآمید در فرآیندهای حرارتی، واکنش مایلارد ما بین قندهای احیا کننده و گروه آمین اسیدآمینه آزاد آسپاراژین است. میزان آکریلآمید تولید شده به دو عامل ترکیب موادغذایی و شرایط فرآوری که سبب تشدید واکنش مایلارد می¬شود، بستگی دارد (16-14). در مطالعات مختلف تاثیرات مخرب آکریلآمید بر سیستمهای گوناگون مانند سیستم عصبی و تولیدمثلی مشخص گردیده است (17،18). مشخص گردیده است که آکریل آمید اثرات خود را از طریق القای استرس اکسیداتیو اعمال میکند (19). مطالعات بسیاری اثرات مفید استفاده از آنتی اکسیدانتهای مشتق از گیاهان را در کاهش اثرات منفی موادی که میتوانند تاثیرات مخرب بر سیستم تولید مثلی داشته باشند را نشان دادهاند (24-20). بنابراین استفاده از آنتیاکسیدانت¬ها می¬تواند راهکار مناسبی برای جبران اثرات سمی آکریل آمید باشد. تائورین(Taurine) ، با نام شیمیایی (۲-آمینواتان سولفونیک اسید)، مشتقی از آمینواسید سیستئین بوده که در بسیاری از قسمتهای بدن یافت شده است. تائورین در تنظیم تعادل آب، میزان انرژی، ضربان قلب و همچنین انقباض عضلانی میتواند نقش داشته باشد. این ترکیبات بهوسیله سلول¬های اپیتلیال اویداکتی نیز سنتز میشوند (25،26). تائورین اثرات آنتیاکسیدانی غیر مستقیمی دارد به این صورت که در محدود کردن اثرات مخرب Reactive Oxygen Species (ROS) بهوسیله خنثیکردن آلدهیدهای سایتوتوکسیک، شرکت دارد (28،27). علاوه بر تائورین، یکی دیگر از ترکیبات آنتیاکسیدانی کورکومین میباشد. کورکومین ماده مؤثر و اصلی گیاه زردچوبه میباشد که اکثر فعالیتهای دارویی گیاه زردچوبه، از قبیل ویژگیهای آنتیاکسیدانی و ضد التهابی آن را به وجود کورکومین نسبت میدهند (30،29). مطالعات اندکی در مورد اثر تائورین بر لقاح داخل آزمایشگاهی وجود دارد. همچنین در مورد اثرات کورکومین بر میزان باروری نیز مطالب ضد نقیضی گزارش شده است (32،31). بنابراین تلاش برای یافتن ترکیبی نوین در درمان، تخفیف و پیشگیری از بیماریها در سالهای اخیر مورد توجه محققان بوده است. اگرچه محققان به اثرهای آنتیاکسیدانی کورکومین و تائورین اشاراتی داشتهاند اما تا کنون مطالعهای در مورد مقایسه اثر این دو ترکیب بر لقاح داخل آزمایشگاهی در موشهای تحت تیمار با آکریلآمید، صورت نگرفته است. بنابراین هدف از انجام این پژوهش بررسی تاثیر کورکومین و تائورین در برابر سمیت ناشی از آکریل آمید بر لقاح داخل آزمایشگاهی در موشهای ماده نژاد NMRI و همچنین بررسی تاثیر آن بر غلظت مالوندیآلدهید (MDA) و غلظت ظرفیت آنتیاکسیدانی تام (TAC) میباشد.
روش بررسی
این مطالعه از نوع مداخلهای- تجربی حیوانی میباشد و در مرکز تحقیقات فنآوری سلولهای بنیادی در دانشگاه علوم پزشکی شیراز انجام شده است. حیوانات مورد آزمایش در این تحقیق شامل 48 سر موش ماده بالغ 8-6 هفتهای از نژاد NMRI با میانگین وزنی 20 تا 25 گرم و 12 سر موش نر بالغ از نژاد NMRI (برای استحصال اسپرم) میباشد، که بهطور کاملاً تصادفی انتخاب و قبل از شروع درمان به مدت 2 هفته جهت سازگاری در شرایط استاندارد نگهداری شدند. اتاق حیوانات با دمای تقریباً بین 20 تا 22 درجه سانتیگراد و دوره نوری 12 ساعت روشنایی و 12 ساعت تاریکی و رطوبت نسبی هوا بین 40% تا 60% برای آنها فراهم گردید. موشها در قفسهایی از جنس پلی کربنات با سقف مشبک از جنس استیل نگهداری شدند. بستر موشها از خاک اره و تراشه چوب پوشیده بود به طوری که کف قفسها هر هفته تعویض و ضد عفونی میشد. در این پژوهش موشها به طور تصادفی ساده به 8 گروه 6 تایی بدین شرح تقسیم شدند:
گروه کنترل: در این گروه به حیوان سرم فیزیولوژی از طریق نیدل گاواژ خورانده شد. 2- گروه دریافتکننده کورکومین (ساخت شرکت مرک-آلمان) با دوز 200 میلیگرم بر کیلوگرم وزن بدن، 3- گروه دریافتکننده تائورین (ساخت شرکت مرک-آلمان) با دوز 150 میلیگرم بر کیلوگرم وزن بدن، 4- گروه دریافتکننده آکریلآمید (ساخت شرکت مرک-آلمان) با دوز50 میلیگرم بر کیلوگرم وزن بدن (33)، 5-گروههای دریافتکننده آکریلآمید+کورکومین با دوزهای 100 و 200 میلیگرم بر کیلوگرم وزن بدن، 6- گروههای دریافتکننده آکریلآمید+تائورین با دوز های 75 و 150 میلیگرم بر کیلوگرم وزن بدن (34) (حلال همه مواد سرم فیزیولوژی بوده است). تجویز سرم فیزیولوژی، آکریلآمید، تائورین و کورکومین بهصورت روزانه و به مدت 35 روز به روش دهانی و با استفاده از نیدل گاواژ انجام شد. لازم به ذکر است که تجویز تائورین و کورکومین یک ساعت قبل از تجویز آکریلآمید انجام میگرفت. پس از پایان دوره تیمار، حیوانات تحت بیهوشی کامل قرار گرفته و برای نمونه برداری سوزن استریل با گیج ۲۴ از سمت چپ قفسه سینه وارد قلب می شود. خونگیری باید به آرامی انجام شود تا ضربان قلب متوقف نشود. همچنین نمونه خون آنها درون لولههای پلاستیکی استریل جمعآوری و به مدت 20 دقیقه در دمای اتاق منعقد شد، سپس 15 دقیقه در سرعت 3000 دور سانتریفیوژ و سرم آن جداسازی گردید و در دمای 80- درجه سانتیگراد به منظور سنجش میزان غلظت مالوندیآلدهید (MDA) و غلظت ظرفیت آنتیاکسیدانی تام (TAC) نگهداری شدند.
اندازهگیری غلظت MDA: اندازهگیری غلظت MDA با تیوباربیتوریک اسید (TBA) یکی از رایجترین روشهای بررسی مقدار پراکسیداسیون لیپیدها در غشاء های بیولوژیک است. یک مولکول MDA با دو مولکول TBA واکنش میدهد و فرآورده این واکنش، مولکولی صورتی رنگ است که بیشترین جذب را در طول موج 532 نانومتر دارد. جهت این تست، 200 میکرولیتر از سرم جداسازی شده و در 800 میکرولیتر محلول کار (محلول خنک شده 1/15% KCl، سپس به نیم میلیلیتر این مخلوط، 3 میلیلیتر فسفریک اسید 1%، یک میلیلیتر تیوباربیتوریک اسید 0/6%) افزوده و در دمای 100 درجه به مدت 45 دقیقه حرارت داده شد و پس از خنککردن، با 4 میلیلیتر n-butanol به خوبی آمیخته شد. در نهایت، پس از سانتریفیوژ کردن، جذب نوری، فاز n-butanol در nm 532 اندازهگیری شد.
سنجش ظرفیت تام آنتیاکسیدانی: همچنین جهت سنجش ظرفیت تام آنتیاکسیدانتی، در نمونههای مختلف، بر اساس روش FRAPو توانایی احیاءکنندگی آهن دو ظرفیتی و با مکانیسم انتقال تک الکترون اندازه¬گیری شد. تغییر رنگ حاصل از واکنش در طول موج ۵۹۳ نانومتر توسط میکروپلیت ریدر اندازهگیری شده و برای به دست آوردن مقدار کمی ظرفیت آنتیاکسیدانتی از استاندارد و نمودار حاصل از آن استفاده گردید.
لقاح آزمایشگاهی: جهت انجام لقاح آزمایشگاهی، پس از کالبد شکافی، دُم اپیدیدیمها جدا شده و در داخل لوله فالکونهای استریل حاوی 1 میلیلیتر محیط کشت HTF (Human Tubular Fluid) حاوی 4 میلیگرم به ازای هر میلیلیتر از محیط کشت و آلبومین سرم گاوی (Bovine serum Albumin-BSA) قرار داده شدند. به منظور خارج شدن اسپرمها از اپیدیدیم، دُم اپیدیدیمها به قطعات کوچک بریده شد و سپس لوله فالکونها در انکوباتور(LEEC,England) پنج درصد CO2 با درجه حرارت 37 درجه سانتیگراد قرار گرفت، بعد از 60 دقیقه، قطعات بافتی از محیط کشت خارج شدند (35). در این مطالعه، جهت بهدست آوردن اووسیت، به منظور بررسی درصد لقاح، رشد جنینها و کیفیت رویان های حاصل از لقاح آزمایشگاهی، نیاز به تحریک تخمکگذاری در موشهای ماده بود که به این شرح صورت گرفت: ابتدا به موشهای سفید کوچک آزمایشگاهی ماده بالغنژادNMRI ،10 واحد بینالمللی (IU) هورمون گنادوتروپین مادیان آبستن (Pregnant Mare Serum Gonadotropin, PMSG)) شرکت فولیگون هلند، بهصورت داخل صفاقی تزریق شد و بعد از گذشت 48 ساعت، هورمون گنادوتروپین جفت انسان (Human Chorionic Gonadotropin, HCG) شرکت سیگما، به میزان 10 واحد بین المللی (IU)، بهصورت داخل صفاقی تزریق گردید. 12-10 ساعت بعد از تزریق HCG (صبح روز بعد)، موشها به روش جابجایی مهرههای گردنی آسانکشی شدند، سپس آویداکتها جدا شده و در داخل محیط کشت 37 درجه سانتیگراد قرار گرفتند و تخمکگیری به روش شکافتن (Dissecting) از ناحیه آمپول اوویداکت در زیر استریومیکروسکوپ (اولیمپوس، آمریکا) انجام شد. تخمکهای بهدست آمده پس از شست وشو، در داخل قطرات 500 میکرولیتری محیط کشت لقاح در زیر روغن معدنی (Mineral oil, sigma) حاوی محیط کشت HTF محتوی BSA (4 میلیگرم به ازای هر میلیلیتر) گذاشته شدند. سپس اسپرمهای جدا شده، بعد از طی روند ظرفیتیابی (Capacitation)، به طور مجزا به تعداد یک میلیون به ازای هر میلیلیتر محیط کشت اضافه شدند. عمل لقاح حدود 4-6 ساعت بعد از اضافه کردن اسپرم صورت گرفت، سپس تعداد زیگوتهای تشکیل شده در هرگروه، بررسی و بهصورت درصد لقاح بیان گردید (35). زیگوت های تشکیل شده که در مرحله پیش هسته (pronucleus)میباشند به محیط KSOM (Potassium simplex optimized medium) به مدت سه روز انتقال یافتند، تا به مرحله بلاستوسیست برسند. ارزیابی اثرات تائورین و کورکومین بر روی باروری آزمایشگاهی و روند رشد جنینی بعد از لقاح، مراحل رشد جنینی در زیر میکروسکوپ اینورت مورد ارزیابی قرار گرفت. در نهایت تعداد سلولهای اووسیت جداسازی شده، میانگین درصد لقاح، میانگین درصد جنینهای دو سلولی، جنینهای 4 و 8 سلولی، میانگین درصد جنینهای Compact و میانگین درصد بلاستوسیتها محاسبه شد.
تجزیه و تحلیل آماری
در پایان به منظور بررسی دادهها در گروههای مورد نظر از نرمافزارversion 16 SPSS و آنالیز واریانس یکطرفه و تست چند دامنهای Tukey استفاده گردید. دادهها بهصورت میانگین± انحراف معیار در سطحp<0/05 معنیدار در نظر گرفته شد. در نهایت نمودارهای مربوطه توسط نرمافزار Graph Pad Prism 8 ترسیم گردید.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشکده دامپزشکی دانشگاه ارومیه تایید شده است (کد اخلاق /3پد/IR-uu-AEC-1316)
نتایج
با توجه به جدول 1، در گروه دریافتکننده آکریلآمید میانگین غلظت MDA افزایش و میانگین غلظت TAC کاهش معنیداری را نسبت به گروه کنترل نشان داد. از طرفی کاهش معنیداری در میانگین غلظت MDA و افزایش معنیداری در میانگین غلظت TAC به ترتیب در گروههای دریافتکننده آکریلآمید + کورکومین mg/kg 200 (P<0/001) و mg/kg 100(p=0/074، p=0/006) و گروه دریافتکننده آکریلآمید + تائورین mg/kg 150 و 75 (p=0/01) نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید. برای مقایسه همه گروهها با یکدیگر از حروف a، b و c استفاده گردید. بدین صورت که وجود حداقل یک حرف مشابه در بین گروه¬ها نشان دهنده عدم اختلاف معنیدار، در بین گروه¬های مورد بررسی میباشد، اما اگر حرف مشابهای در بین گروه¬ها مشاهده نشد، نشاندهنده اختلاف معنیدار در سطح (p<0/05 ) میباشد. تعداد سلولهای اووسیت و درصد لقاح در گروه دریافتکننده آکریلآمید کاهش معنیداری را نسبت به گروه کنترل در سطح (p<0/001 ) نشان داد. افزایش معنیداری در تعداد سلولهای اووسیت و درصد لقاح در گروه سالم دریافتکننده تائورین نسبت به گروه سالم دریافتکننده کورکومین مشاهده شد (p=0/001) (شکل 1 نمودار B و A). همچنین افزایش معنیداری در میانگین تعداد سلولهای اووسیت در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 200 و 100 و گروه دریافتکننده آکریلآمید + تائورین mg/kg 150 و 75 نسبت به گروه دریافتکننده آکریلآمید در سطح (p<0/001 ) مشاهده گردید (شکل 1 نمودار A). افزایش معنیداری در میانگین درصد لقاح در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 و گروه دریافتکننده آکریلآمید + تائورین mg/kg 150 نسبت به گروه دریافتکننده آکریلآمید در سطح (p<0/001 ) مشاهده گردید (شکل 1 نمودار B). دادهها بهصورت SD ±Mean نشان داده شده است. برای مقایسه همه گروهها با یکدیگر از حروف a، b و c استفاده گردید. بدین صورت که وجود حداقل یک حرف مشابه در بین گروه¬ها نشان دهنده عدم اختلاف معنیدار، در بین گروه¬های مورد بررسی میباشد، اما اگر حرف مشابهی در بین گروه¬ها مشاهده نشد، نشاندهنده اختلاف معنیدار در سطح (p<0/05) میباشد. با توجه به شکل 2 نمودارهای A، B، C و D درصد جنینهای دو سلولی، 4 و 8 سلولی و درصد جنینهای Compact و درصد بلاستوسیت در گروه دریافتکننده آکریلآمید کاهش معنیداری را نسبت به گروه کنترل نشان داد (p<0/001 ). میانگین درصد جنینهای دو سلولی، 4 و 8 سلولی و درصد جنینهای Compact و بلاستوسیت در گروه سالم دریافتکننده کورکومین کاهش معنیداری را نسبت به گروه کنترل و تائورین نشان داد (p<0/001). همچنین افزایش معنیداری در میانگین درصد جنینهای2 سلولی، 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 (به ترتیب p=0/009، p=0/008 و p=0/005)و گروه دریافتکننده آکریلآمید + تائورین mg/kg 75 و150 (به ترتیبp=0/038، p=0/015 و p=0/028) و (p<0/001 )نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید. اختلاف معنیداری در میانگین درصد جنینهای 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 200 نسبت به گروه آکریلآمید مشاهده نشد. همچنین افزایش معنیداری در میانگین درصد جنینهای Compact و درصد بلاستوسیتها در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 و 200 و گروه دریافتکننده آکریلآمید + تائورین mg/kg 75 و150 نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید. دادهها بهصورت SD ±Mean نشان داده شده است. برای مقایسه همه گروهها با یکدیگر از حروفa ، b و c استفاده گردید. بدین صورت که وجود حداقل یک حرف مشابه در بین گروهها نشان دهنده عدم اختلاف معنیدار، در بین گروه¬های مورد بررسی میباشد، اما اگر حرف مشابهی در بین گروه¬ها مشاهده نشد، نشاندهنده اختلاف معنیدار در سطح (p<0/05 )میباشد.
جدول 1: نتایج مربوط به میانگین غلظت MDA و TAC در گروههای مورد بررسی
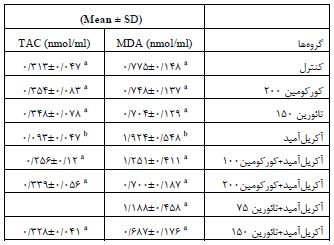
مالوندیآلدهید (MDA) و غلظت ظرفیت آنتیاکسیدانی تام (TAC)
a با a اختلاف معنیدار ندارد.
a باb اختلاف معنیدار دارد (p<0/05)
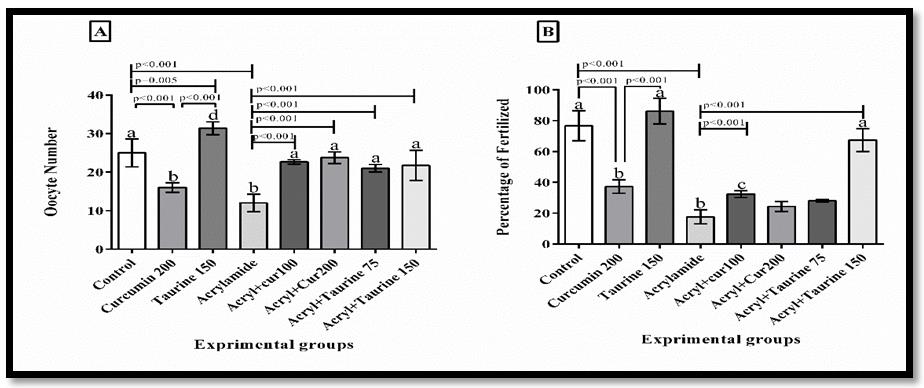
شکل 1: نتایج مربوط به میانگین تعداد سلولهای اووسیت و میزان در صد لقاح در گروه¬های مورد بررسی
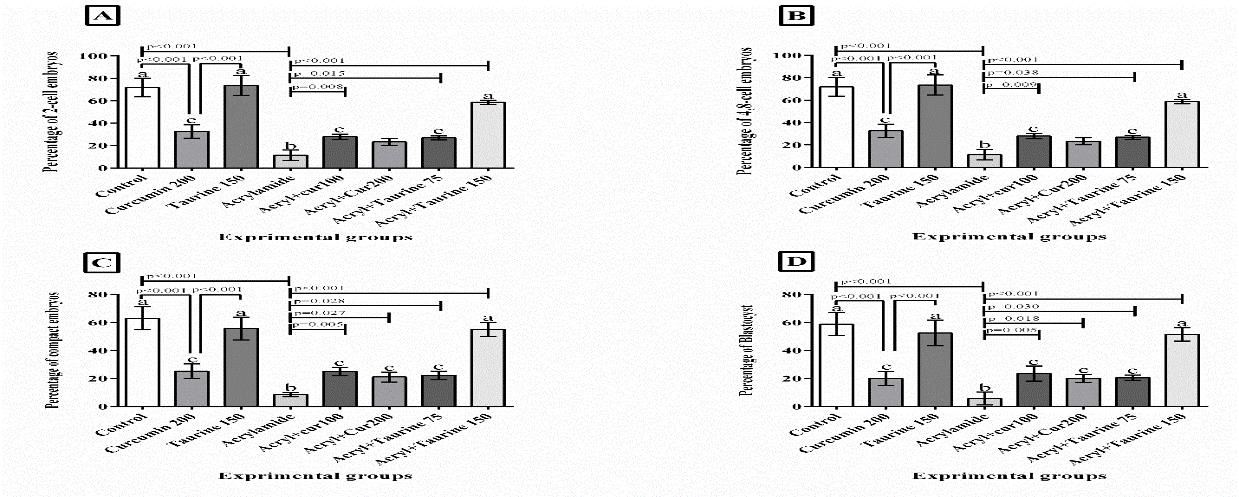
شکل 2: نتایج مربوط به میانگین درصد جنین های دوسلولی، 4 و 8 سلولی، جنینهای Compact و درصد بلاستوسیت نسبت به تعداد تخمک در گروه¬های مورد بررسی
بحث
یافتههای مطالعه حاضر نشان داد که آکریلآمید میزان لقاح، رشد جنین و ظرفیت آنتی اکسیدانی کل را در سطح معنیداری در مقایسه با گروههای تائورین و کورکومین کاهش داده بود. این در حالی بود که درمان با تائورین بیشتر از کورکومین در موشهای دریافتکننده آکریلآمید این پارامترها را افزایش داده بود. به طوریکه میانگین تعداد سلولهای اووسیت، در گروه سالم دریافتکننده تائورین نسبت به گروه کنترل افزایش معنیداری را نشان داد. افزایش معنیداری در میانگین تعداد سلولهای اووسیت، درصد لقاح، درصد جنینهای 4 و 8 سلولی در گروه سالم دریافتکننده تائورین نسبت به گروه سالم دریافت کننده کورکومین مشاهده شد. همچنین افزایش معنیداری در میانگین درصد جنینهای دو سلولی در گروه سالم دریافتکننده تائورین نسبت به گروه سالم دریافتکننده کورکومین و کنترل مشاهده شد. در مطالعهای Van der Horst و همکاران نشان دادند که تائورین در تحریک، نگهداری، حرکت و ظرفیتپذیری اسپرم و نیز فعالیت مجدد آکروزومی در داخل رحم نقش دارد، بنابراین میتواند در بهبود باروری آزمایشگاهی اووسیتها نقش مهمی داشته باشد (36). در پژوهشی که توسط Song و همکاران در سال 2021 انجام شد مشخص گردید که آکریلآمید باعث جلوگیری از فرایند اتوفاژی و افزایش محتوای ROS میشود. تجمع ROS منجر به افزایش نرخ آپوپتوز و ترشح عوامل التهابی میشود. علاوه بر این، مشخص گردید که، قرار گرفتن در معرض آکریلآمید باعث کاهش گلیکولیز/گلوکونئوژنز با کاهش سطح واسطههای گلیکولیتیک و کاهش میزان چرخه ظرفیت آنتیاکسیدانی کل میشود (37) که با نتایج تحقیق حاضر همخوانی دارد. چرا که در پژوهش حاضر، در گروه دریافتکننده آکریلآمید میانگین غلظت MDA افزایش و میانگین غلظت TAC کاهش معنیداری را نسبت به سایر گروهها نشان داد. در کنار این موضوع مشاهدات بیوشیمیایی در مطالعه حاضر نشان دادهاند که تائورین و کورکومین میتواند در سطح معنیداری میانگین غلظت MDA را کاهش و میانگین غلظت TAC را افزایش دهند و توان آنتی اکسیدانتی را بالا ببرد. در پژوهشی گزارش شده است که گلوتامین و تائورین برای رشد جنین موش در شرایط آزمایشگاهی مفید هستند (1) که در راستای نتایج تحقیق حاضر در مورد تائورین می باشد. چرا که در مطالعه حاضر مشخص گردید که تائورین سبب افزایش معنیدار تعداد جنینهای 2، 4 و 8 سلولی در شرایط آزمایشگاهی میشود.Devreker در مطالعه تصادفی شده، رشد جنینهای انسانی را در حضور 1 میلیمول در لیتر گلوتامین و 5 میلیمول در لیتر تائورین از مرحله 2-4 سلولی تا مرحله بلاستوسیست مقایسه کرد. و به این نتیجه رسید که در حضور گلوتامین یا تائورین به ترتیب 52/6% و58/3% از جنینها به مرحله بلاستوسیست رسیدند. بنابراین مشخص گردید که تائورین از رشد جنینهای 4-2 سلولی انسان تا مرحله بلاستوسیست پشتیبانی میکند (1). در تحقیقی دیگر گزارش شده است که در صورت استفاده از تائورین در محیط کشت سلولی تعداد جنینهای 2 سلولی موش به میزان قابلتوجهی به مرحله بلاستوسیست میرسند همچنین مشخص گردید که تائورین اثر مفید خود را منحصراً در طی 2 روز اول پس از تلقیح اعمال میکند (38). در گزارشی دیگر مشخص گردید که افزودن تائورین به محیط کشت سبب بهبود میزان لقاح در مقایسه با گروه شاهد میشود به طوریکه نتایج این تحقیق نشان داد که تائورین یک اثر حمایتی بر بهبود IVF در سویه موش BALB/c هم خون دارد. به طوری که جنینهای ایجاد شده در محیط کشت آزمایشگاهی، پس از انتقال جنین به مرحله بلاستوسیست توسعه یافتند (39). در مطالعه حاضر، کاهش معنیداری در تعداد سلولهای اووسیت و درصد لقاح در گروه سالم دریافتکننده کورکومین mg/kg 200 نسبت به گروه کنترل مشاهده شد. میانگین درصد جنینهای دوسلولی، 4 و 8 سلولی و درصد جنینهای Compact در گروه سالم دریافتکننده کورکومین کاهش معنیداری را نسبت به گروه کنترل نشان داد. همچنین کاهش معنیداری در میانگین درصد جنینهای Compact و درصد بلاستوسیتها در گروه سالم دریافتکننده کورکومین نسبت به گروه سالم دریافتکننده تائورین و گروه کنترل مشاهده شد. در مطالعهای که توسط گلمحمدی و همکاران درسال 2018 انجام شد مشخص گردید که با افزایش میزان دوز مصرف زردچوبه در گروههای آزمایشی، میزان تخمک¬هایی که به مرحله متافاز 2 رسیدند نسبت به گروه کنترل کاهش معنیداری یافته است. پس از انجام لقاح نیز تعداد جنین¬های 2 سلولی و 4 سلولی تشکیل شده در گروه دریافتکننده دوز حداکثر زردچوبه کاهش معنیداری را نشان میدهند (31). که با نتایج تحقیق حاضر همخوانی دارد. همچنین تعداد تخمکهای دژنره نیز در گروه دریافتکننده کورکومین نسبت به گروه شم و کنترل افزایش معنیداری را نشان داد. با توجه به انجام آزمایشات و مشاهده نتایج لقاح درون آزمایشگاهی در پژوهش گلمحمدی و همکاران، پس از لقاح، تعداد جنین¬های دو سلولی در گروه تجربی دریافتکننده کورکومین نسبت به گروه کنترل کمتر بوده است. همچنین با شمارش جنین چهار سلولی مشاهده شد که تعداد جنین¬های چهار سلولی در اثر وجود عصاره گیاه زردچوبه کاهش معنیداری را نشان میدهد. همچنین بر اساس مشاهدات انجام شده در پژوهش گلمحمدی و همکاران (2018) درصد میزان موفقیت در لقاح و تشکیل جنین در گروههای دریافتکننده زردچوبه نسبت به گروه کنترل کمتر بوده است. که با نتایج تحقیق حاضر در مورد گروه سالم دریافتکننده کورکومین مطابقت دارد. از طرفی در لقاح درون آزمایشگاهی با توجه به مشاهده حاصل از این پژوهش، پس از لقاح تعداد جنینهای دو سلولی در گروههای دریافتکننده کورکومین نسبت به گروه کنترل کمتر بوده استو میتوان نتیجه گرفت کورکومین موجب کاهش تعداد جنینهای دو سلولی حاصل از لقاح شده است. همچنین با شمارش جنین چهار سلولی پس از لقاح مشاهده شد که تعداد این جنینهای چهار و هشت سلولی نیز در اثر وجود کورکومین کاهش یافته است. لذا باید مطالعات بیشتری در سطح مولکولی جهت شناسایی مکانیسم اثر آن انجام شود. مطالعه Chen و همکارانش در سال 2010، نشان میدهد که قرار گرفتن بلاستوسیست در شرایط آزمایشگاهی با کورکومین باعث آپوپتوز سلول¬های بلاستوسیست شده، و پس از انتقال جنین به میزبان موش، پیشرفت لانهگزینی اولیه را در میزبان به تعویق میاندازد. علاوه بر این، کورکومین موجب ایجاد آپوپتوز در بلاستوسیست موش میشود و با پیشروی بیشتر فرآیندهای سیگنالینگ آپوپتوز وابسته به میتوکندری باعث اختلال در رشد جنین می¬گردد (40). این نتایج با مشاهدات و نتایج حاصل از این پژوهش مطابقت دارد و همانطورکه در این مطالعه بیان شده است، کورکومین در فرایند لقاح آزمایشگاهی ایجاد اختلال کرده و موجب کاهش جنینها می¬شود همچنین کورکومین، مانع واکنش ناشی از متیلاسیون برای تولید گونههای فعال اکسیژن (ROS) و رویدادهای مختلف بیوشیمیایی در آپوپتوز سلول¬های بنیادی جنینی و بلاستوسیست جدا شده از موش باردار می¬شود (41). بر اساس نتایج مطالعهای که توسط Chenو همکاران در سال 2012 صورت گرفت پیشنهاد شد که آسیب در رشد و نمو که توسط کورکومین ایجاد می¬شود از طریق فرایند القای آپوپتوز در فرآیندهای بلوغ تخمک و جنین در مراحل اولیه رخ میدهد. در حالیکه عملکردهای متعدد بیولوژیک برای کورکومین شناسایی شده است، هنوز فعالیت آن به عنوان القاء یا مهار آپوپتوز و مکانیسمهای مولکولی دقیق به طور کامل مشخص نمیباشد که متضمن این اقدامات باشد. تا به امروز، هیچ مطالعهای در مورد اثر نهان و بالقوه کورکومین بهعنوان یک عامل سیتوتوکسیک علیه بلوغ تخمک، لقاح و تکامل جنینی بعد از لقاح آن نپرداخته است (42) .از طرفی مشخص شده است که کورکومین موجود در زرد چوبه مانع عمل لانه گزینی پس از لقاح میشود نتایج این آزمایش نشان میدهد قرار گرفتن فولیکولها در معرض کورکومین موجب آپوپتوز و به تعویق انداختن عمل لانهگزینی پس از انتقال جنین به میزبان شده است و در مراحل اولیه پس از لانهگزینی موجب ایجاد اثر سوء میشود. به همین دلیل کورکومین یک عامل خطرناک احتمالی برای انجام عمل لقاح و رشد و نمو جنین طبیعی گزارش شده است که پس از لانهگزینی باید با احتیاط مصرف شود (43،42). همچنین در این مطالعه مشاهده شد که کورکومین در دوز بالا دارای اثر منفی در رشد جنینها در مراحل ابتدایی میباشد چرا که اختلاف معنیداری در میانگین درصد جنینهای 2، 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 200 نسبت به گروه آکریلآمید مشاهده نشد. اما افزایش معنیداری در میانگین درصد جنینهای2، 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید، که البته در حد گروه کنترل نبود و با آن نیز اختلاف معنیداری را نشان داد. لذا برای پی بردن به فرایند دقیق آن نیاز به مطالعات بیشتری است. به ویژه این که این مطالعات در سطح مولکولی و میکروسکوپ الکترونی انجام شود. با توجه به اینکه وجود تعداد مشخصی تخمک در جنس ماده از ابتدای تولد بهصورت یک منبع محدود به اثبات رسیده است و کلا جنین¬های آینده از تخمکهایی شکل میگیرند که از ابتدا بهصورت یک منبع ذخیره تخمدانی وجود داشته لذا هرنوع آسیبی که به دلایل محیطی (نظیر استفاده از آکریل¬آمید) به DNA سلولهای تخمک وارد شود، ممکن است بهصورت ناهنجاریهای ژنتیکی، عدم لانهگزینی تخمک و یا ناباروری به دلیل وجود تخمکهایی با DNA معیوب در آینده مشکلاتی را ایجاد کند. لذا نتایج مربوط به آزمایشات IVF در مطالعه حاضر قابلتوجیه میباشد. چرا که بدن تمام سعی خود را در جهت حفظ حالت پایدار خود میکند مثلا فولیکولها و سلولهای گرانولوزای بافت تخمدان که نقش پرستاری از تخمک را بر عهده دارند، با مکانیسمهای جبرانی نهایت تلاش خود را جهت حفظ تخمک به عمل می آورد، لذا ممکن است، در ابتدا ساختاری به ظاهر طبیعی از تخمک مشاهده شود. اما از آنجا که جهت انجام لقاح آزمایشگاهی تخمکهایی که قبلاً در معرض عوامل محیطی مثل آکریلآمید بودهاند و به طبع ممکن است دچار آسیبهایی در سطح مولکولی شده باشند، از سلولهای محافظ و نگهدارنده خود جهت انجام فرایندIVF جداسازی میشوند، وجود آسیبها را با عدم موفقیت در لقاح و تکوین جنین نشان میدهند. سطوح فیزیولوژیکی گونههای فعال اکسیژن بر روی گامتها و روند تولید مثلی تاثیرگذار است به طوریکه سطوح پایین گونههای فعال اکسیژن میزان بالای لقاح را افزایش میدهد. از طرفی سلولهای کومولوسی نقش مهمی در حفظ اووسیت در برابر آپوپتوز ناشی از تنش اکسیداتیو ایفا میکنند که این کار را از طریق افزایش Glotation peroxidase Px در اووسیتها انجام میدهند. سطوح آنزیم¬های GPx و Superoxide dismutase SOD در اووسیتهای فاقد توده کومولوسی کاهش مییابد (44).Agarwal و همکارانش در سال 2012 طی مطالعه که بر روی اثر تنش اکسیداتیو بر سیستم تولید مثلی ماده انجام دادند بیان داشتند که روند رشد اووسیت از مرحله میوز Ι به متافاز ΙΙ توسط عامل گونهای فعال اکسیژن به جریان می¬افتد و آنتی اکسیدانتها این جریان را محدود میکنند. از طرف دیگر ادامه میوز ΙΙ توسط آنتی اکسیدانتها به جریان میافتد که نشان دهنده ارتباط پیچیده بین گونههای فعال اکسیژن و آنتیاکسیدانتها میباشد (45,44). در مطالعهای مشخص گردید که نانومیسلهای کورکومین بهصورت وابسته به دوز، سبب کاهش درصد زیگوت، جنین 2 سلولی، بلاستوسیست و همچنین جنینهای compact در مقایسه با گروه کنترل میشود (46). که مشابه با نتایج تحقیق حاضر میباشد. در گروههای دریافتکننده دوزهای بالای نانومیسل کورکومین افزایش معنیداری در تعداد جنینهای مرده مشاهده گردید. به طورکلی نانومیسلهای کورکومین نسبتاً رشد جنین قبل از لانهگزینی را کاهش میدهد. اگرچه مطالعات بیشتری مورد نیاز است، اما کورکومین میتواند به عنوان یک سرکوب کننده پتانسیل باروری به روش IVF در نظر گرفته شود، زمانی که بهطور مزمن مصرف شود (46).
نتیجهگیری
نتایج بیانگر اثر مخرب آکریلآمید بر لقاح آزمایشگاهی میباشد. از طرفی با توجه به نتایج تحقیق حاضر، عملکرد تائورین، در کاهش عوارض، بیش از کورکومین بود. چراکه یافتهها نشان داد کورکومین ممکن است مانند یک شمشیر دولبه از یک طرف سبب کاهش عوارض آکریلآمید بر میزان غلظت مالوندیآلدهید و TAC شود و از طرفی دیگر سبب جلوگیری از لقاح آزمایشگاهی شود. لذا مصرف آن در ابتدای دوران بارداری باید با احتیاط بیشتری همراه باشد.
سپاسگزاری
بدینوسیله نویسندگان مراتب تقدیر و تشکر خود را از کلیه افرادیکه در اجرای این پژوهش نقشی ایفا کردند اعلام میدارند. همچنین این تحقیق بخشی از پایاننامه مقطع دکتری خانم رزا صابری بوده است.
حامی مالی: این پژوهش برگرفته از طرح تحقیقاتی دانشگاه ارومیه است که با حمایت معاونت مالی تحقیقات و فنآوری دانشگاه ارومیه به انجام رسیده است.
تعارض در منافع: وجود ندارد.
امروزه، مسائل مربوط به باروری و ناباروری ازجمله مسائل چالش برانگیز در علم پزشکی است. تقریباً در 15-10 درصد از زوجهایی که در سن باروری هستند، ناباروری مشاهده میشود. بنابراین میتوان استنباط کرد که بیش از 80 میلیون زوج در سراسر جهان ناباروری را تجربه میکنند (2،3). امروزه مشخص شده است که روند ایجاد ناباروری در جوامع مختلف در حال افزایش میباشد به طوریکه توجه دانشمندان را به نقش عوامل محیطی و سبک زندگی و تغذیهای سوق داده است (6-4). آکریلآمید (ACR) Acrylamide یکی از انواع مواد شیمیایی است که بهطور گسترده در لوازم آرایشی (کرمهای پوستی)، بستهبندی مواد غذایی، تولید پارچه، چسب، لنزهای تماسی، کودهای خاک، تصفیه فاضلاب و آب آشامیدنی و صنایع دخانیات و پلاستیک استفاده میشود (10-7). کشف اولیه مقادیر بالای آکریلآمید در مواد غذایی غنی از کربوهیدرات که تحت فرایندهای حرارتی بالا فرآوری می¬شوند و همچنین اعلام خواص سمیت و اثرات سرطانزایی این ترکیب، سبب بروز نگرانیهای وسیعی در سراسر جهان شده است (11). منابع غذایی مهم دریافت آکریل آمید شامل محصولات سیب زمینی، محصولات غلاتی و آردی، محصولات خشک شده، مغزهای تفت داده شده و قهوه میباشد (12،13). مسیر اصلی تشکیل آکریلآمید در فرآیندهای حرارتی، واکنش مایلارد ما بین قندهای احیا کننده و گروه آمین اسیدآمینه آزاد آسپاراژین است. میزان آکریلآمید تولید شده به دو عامل ترکیب موادغذایی و شرایط فرآوری که سبب تشدید واکنش مایلارد می¬شود، بستگی دارد (16-14). در مطالعات مختلف تاثیرات مخرب آکریلآمید بر سیستمهای گوناگون مانند سیستم عصبی و تولیدمثلی مشخص گردیده است (17،18). مشخص گردیده است که آکریل آمید اثرات خود را از طریق القای استرس اکسیداتیو اعمال میکند (19). مطالعات بسیاری اثرات مفید استفاده از آنتی اکسیدانتهای مشتق از گیاهان را در کاهش اثرات منفی موادی که میتوانند تاثیرات مخرب بر سیستم تولید مثلی داشته باشند را نشان دادهاند (24-20). بنابراین استفاده از آنتیاکسیدانت¬ها می¬تواند راهکار مناسبی برای جبران اثرات سمی آکریل آمید باشد. تائورین(Taurine) ، با نام شیمیایی (۲-آمینواتان سولفونیک اسید)، مشتقی از آمینواسید سیستئین بوده که در بسیاری از قسمتهای بدن یافت شده است. تائورین در تنظیم تعادل آب، میزان انرژی، ضربان قلب و همچنین انقباض عضلانی میتواند نقش داشته باشد. این ترکیبات بهوسیله سلول¬های اپیتلیال اویداکتی نیز سنتز میشوند (25،26). تائورین اثرات آنتیاکسیدانی غیر مستقیمی دارد به این صورت که در محدود کردن اثرات مخرب Reactive Oxygen Species (ROS) بهوسیله خنثیکردن آلدهیدهای سایتوتوکسیک، شرکت دارد (28،27). علاوه بر تائورین، یکی دیگر از ترکیبات آنتیاکسیدانی کورکومین میباشد. کورکومین ماده مؤثر و اصلی گیاه زردچوبه میباشد که اکثر فعالیتهای دارویی گیاه زردچوبه، از قبیل ویژگیهای آنتیاکسیدانی و ضد التهابی آن را به وجود کورکومین نسبت میدهند (30،29). مطالعات اندکی در مورد اثر تائورین بر لقاح داخل آزمایشگاهی وجود دارد. همچنین در مورد اثرات کورکومین بر میزان باروری نیز مطالب ضد نقیضی گزارش شده است (32،31). بنابراین تلاش برای یافتن ترکیبی نوین در درمان، تخفیف و پیشگیری از بیماریها در سالهای اخیر مورد توجه محققان بوده است. اگرچه محققان به اثرهای آنتیاکسیدانی کورکومین و تائورین اشاراتی داشتهاند اما تا کنون مطالعهای در مورد مقایسه اثر این دو ترکیب بر لقاح داخل آزمایشگاهی در موشهای تحت تیمار با آکریلآمید، صورت نگرفته است. بنابراین هدف از انجام این پژوهش بررسی تاثیر کورکومین و تائورین در برابر سمیت ناشی از آکریل آمید بر لقاح داخل آزمایشگاهی در موشهای ماده نژاد NMRI و همچنین بررسی تاثیر آن بر غلظت مالوندیآلدهید (MDA) و غلظت ظرفیت آنتیاکسیدانی تام (TAC) میباشد.
روش بررسی
این مطالعه از نوع مداخلهای- تجربی حیوانی میباشد و در مرکز تحقیقات فنآوری سلولهای بنیادی در دانشگاه علوم پزشکی شیراز انجام شده است. حیوانات مورد آزمایش در این تحقیق شامل 48 سر موش ماده بالغ 8-6 هفتهای از نژاد NMRI با میانگین وزنی 20 تا 25 گرم و 12 سر موش نر بالغ از نژاد NMRI (برای استحصال اسپرم) میباشد، که بهطور کاملاً تصادفی انتخاب و قبل از شروع درمان به مدت 2 هفته جهت سازگاری در شرایط استاندارد نگهداری شدند. اتاق حیوانات با دمای تقریباً بین 20 تا 22 درجه سانتیگراد و دوره نوری 12 ساعت روشنایی و 12 ساعت تاریکی و رطوبت نسبی هوا بین 40% تا 60% برای آنها فراهم گردید. موشها در قفسهایی از جنس پلی کربنات با سقف مشبک از جنس استیل نگهداری شدند. بستر موشها از خاک اره و تراشه چوب پوشیده بود به طوری که کف قفسها هر هفته تعویض و ضد عفونی میشد. در این پژوهش موشها به طور تصادفی ساده به 8 گروه 6 تایی بدین شرح تقسیم شدند:
گروه کنترل: در این گروه به حیوان سرم فیزیولوژی از طریق نیدل گاواژ خورانده شد. 2- گروه دریافتکننده کورکومین (ساخت شرکت مرک-آلمان) با دوز 200 میلیگرم بر کیلوگرم وزن بدن، 3- گروه دریافتکننده تائورین (ساخت شرکت مرک-آلمان) با دوز 150 میلیگرم بر کیلوگرم وزن بدن، 4- گروه دریافتکننده آکریلآمید (ساخت شرکت مرک-آلمان) با دوز50 میلیگرم بر کیلوگرم وزن بدن (33)، 5-گروههای دریافتکننده آکریلآمید+کورکومین با دوزهای 100 و 200 میلیگرم بر کیلوگرم وزن بدن، 6- گروههای دریافتکننده آکریلآمید+تائورین با دوز های 75 و 150 میلیگرم بر کیلوگرم وزن بدن (34) (حلال همه مواد سرم فیزیولوژی بوده است). تجویز سرم فیزیولوژی، آکریلآمید، تائورین و کورکومین بهصورت روزانه و به مدت 35 روز به روش دهانی و با استفاده از نیدل گاواژ انجام شد. لازم به ذکر است که تجویز تائورین و کورکومین یک ساعت قبل از تجویز آکریلآمید انجام میگرفت. پس از پایان دوره تیمار، حیوانات تحت بیهوشی کامل قرار گرفته و برای نمونه برداری سوزن استریل با گیج ۲۴ از سمت چپ قفسه سینه وارد قلب می شود. خونگیری باید به آرامی انجام شود تا ضربان قلب متوقف نشود. همچنین نمونه خون آنها درون لولههای پلاستیکی استریل جمعآوری و به مدت 20 دقیقه در دمای اتاق منعقد شد، سپس 15 دقیقه در سرعت 3000 دور سانتریفیوژ و سرم آن جداسازی گردید و در دمای 80- درجه سانتیگراد به منظور سنجش میزان غلظت مالوندیآلدهید (MDA) و غلظت ظرفیت آنتیاکسیدانی تام (TAC) نگهداری شدند.
اندازهگیری غلظت MDA: اندازهگیری غلظت MDA با تیوباربیتوریک اسید (TBA) یکی از رایجترین روشهای بررسی مقدار پراکسیداسیون لیپیدها در غشاء های بیولوژیک است. یک مولکول MDA با دو مولکول TBA واکنش میدهد و فرآورده این واکنش، مولکولی صورتی رنگ است که بیشترین جذب را در طول موج 532 نانومتر دارد. جهت این تست، 200 میکرولیتر از سرم جداسازی شده و در 800 میکرولیتر محلول کار (محلول خنک شده 1/15% KCl، سپس به نیم میلیلیتر این مخلوط، 3 میلیلیتر فسفریک اسید 1%، یک میلیلیتر تیوباربیتوریک اسید 0/6%) افزوده و در دمای 100 درجه به مدت 45 دقیقه حرارت داده شد و پس از خنککردن، با 4 میلیلیتر n-butanol به خوبی آمیخته شد. در نهایت، پس از سانتریفیوژ کردن، جذب نوری، فاز n-butanol در nm 532 اندازهگیری شد.
سنجش ظرفیت تام آنتیاکسیدانی: همچنین جهت سنجش ظرفیت تام آنتیاکسیدانتی، در نمونههای مختلف، بر اساس روش FRAPو توانایی احیاءکنندگی آهن دو ظرفیتی و با مکانیسم انتقال تک الکترون اندازه¬گیری شد. تغییر رنگ حاصل از واکنش در طول موج ۵۹۳ نانومتر توسط میکروپلیت ریدر اندازهگیری شده و برای به دست آوردن مقدار کمی ظرفیت آنتیاکسیدانتی از استاندارد و نمودار حاصل از آن استفاده گردید.
لقاح آزمایشگاهی: جهت انجام لقاح آزمایشگاهی، پس از کالبد شکافی، دُم اپیدیدیمها جدا شده و در داخل لوله فالکونهای استریل حاوی 1 میلیلیتر محیط کشت HTF (Human Tubular Fluid) حاوی 4 میلیگرم به ازای هر میلیلیتر از محیط کشت و آلبومین سرم گاوی (Bovine serum Albumin-BSA) قرار داده شدند. به منظور خارج شدن اسپرمها از اپیدیدیم، دُم اپیدیدیمها به قطعات کوچک بریده شد و سپس لوله فالکونها در انکوباتور(LEEC,England) پنج درصد CO2 با درجه حرارت 37 درجه سانتیگراد قرار گرفت، بعد از 60 دقیقه، قطعات بافتی از محیط کشت خارج شدند (35). در این مطالعه، جهت بهدست آوردن اووسیت، به منظور بررسی درصد لقاح، رشد جنینها و کیفیت رویان های حاصل از لقاح آزمایشگاهی، نیاز به تحریک تخمکگذاری در موشهای ماده بود که به این شرح صورت گرفت: ابتدا به موشهای سفید کوچک آزمایشگاهی ماده بالغنژادNMRI ،10 واحد بینالمللی (IU) هورمون گنادوتروپین مادیان آبستن (Pregnant Mare Serum Gonadotropin, PMSG)) شرکت فولیگون هلند، بهصورت داخل صفاقی تزریق شد و بعد از گذشت 48 ساعت، هورمون گنادوتروپین جفت انسان (Human Chorionic Gonadotropin, HCG) شرکت سیگما، به میزان 10 واحد بین المللی (IU)، بهصورت داخل صفاقی تزریق گردید. 12-10 ساعت بعد از تزریق HCG (صبح روز بعد)، موشها به روش جابجایی مهرههای گردنی آسانکشی شدند، سپس آویداکتها جدا شده و در داخل محیط کشت 37 درجه سانتیگراد قرار گرفتند و تخمکگیری به روش شکافتن (Dissecting) از ناحیه آمپول اوویداکت در زیر استریومیکروسکوپ (اولیمپوس، آمریکا) انجام شد. تخمکهای بهدست آمده پس از شست وشو، در داخل قطرات 500 میکرولیتری محیط کشت لقاح در زیر روغن معدنی (Mineral oil, sigma) حاوی محیط کشت HTF محتوی BSA (4 میلیگرم به ازای هر میلیلیتر) گذاشته شدند. سپس اسپرمهای جدا شده، بعد از طی روند ظرفیتیابی (Capacitation)، به طور مجزا به تعداد یک میلیون به ازای هر میلیلیتر محیط کشت اضافه شدند. عمل لقاح حدود 4-6 ساعت بعد از اضافه کردن اسپرم صورت گرفت، سپس تعداد زیگوتهای تشکیل شده در هرگروه، بررسی و بهصورت درصد لقاح بیان گردید (35). زیگوت های تشکیل شده که در مرحله پیش هسته (pronucleus)میباشند به محیط KSOM (Potassium simplex optimized medium) به مدت سه روز انتقال یافتند، تا به مرحله بلاستوسیست برسند. ارزیابی اثرات تائورین و کورکومین بر روی باروری آزمایشگاهی و روند رشد جنینی بعد از لقاح، مراحل رشد جنینی در زیر میکروسکوپ اینورت مورد ارزیابی قرار گرفت. در نهایت تعداد سلولهای اووسیت جداسازی شده، میانگین درصد لقاح، میانگین درصد جنینهای دو سلولی، جنینهای 4 و 8 سلولی، میانگین درصد جنینهای Compact و میانگین درصد بلاستوسیتها محاسبه شد.
تجزیه و تحلیل آماری
در پایان به منظور بررسی دادهها در گروههای مورد نظر از نرمافزارversion 16 SPSS و آنالیز واریانس یکطرفه و تست چند دامنهای Tukey استفاده گردید. دادهها بهصورت میانگین± انحراف معیار در سطحp<0/05 معنیدار در نظر گرفته شد. در نهایت نمودارهای مربوطه توسط نرمافزار Graph Pad Prism 8 ترسیم گردید.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشکده دامپزشکی دانشگاه ارومیه تایید شده است (کد اخلاق /3پد/IR-uu-AEC-1316)
نتایج
با توجه به جدول 1، در گروه دریافتکننده آکریلآمید میانگین غلظت MDA افزایش و میانگین غلظت TAC کاهش معنیداری را نسبت به گروه کنترل نشان داد. از طرفی کاهش معنیداری در میانگین غلظت MDA و افزایش معنیداری در میانگین غلظت TAC به ترتیب در گروههای دریافتکننده آکریلآمید + کورکومین mg/kg 200 (P<0/001) و mg/kg 100(p=0/074، p=0/006) و گروه دریافتکننده آکریلآمید + تائورین mg/kg 150 و 75 (p=0/01) نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید. برای مقایسه همه گروهها با یکدیگر از حروف a، b و c استفاده گردید. بدین صورت که وجود حداقل یک حرف مشابه در بین گروه¬ها نشان دهنده عدم اختلاف معنیدار، در بین گروه¬های مورد بررسی میباشد، اما اگر حرف مشابهای در بین گروه¬ها مشاهده نشد، نشاندهنده اختلاف معنیدار در سطح (p<0/05 ) میباشد. تعداد سلولهای اووسیت و درصد لقاح در گروه دریافتکننده آکریلآمید کاهش معنیداری را نسبت به گروه کنترل در سطح (p<0/001 ) نشان داد. افزایش معنیداری در تعداد سلولهای اووسیت و درصد لقاح در گروه سالم دریافتکننده تائورین نسبت به گروه سالم دریافتکننده کورکومین مشاهده شد (p=0/001) (شکل 1 نمودار B و A). همچنین افزایش معنیداری در میانگین تعداد سلولهای اووسیت در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 200 و 100 و گروه دریافتکننده آکریلآمید + تائورین mg/kg 150 و 75 نسبت به گروه دریافتکننده آکریلآمید در سطح (p<0/001 ) مشاهده گردید (شکل 1 نمودار A). افزایش معنیداری در میانگین درصد لقاح در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 و گروه دریافتکننده آکریلآمید + تائورین mg/kg 150 نسبت به گروه دریافتکننده آکریلآمید در سطح (p<0/001 ) مشاهده گردید (شکل 1 نمودار B). دادهها بهصورت SD ±Mean نشان داده شده است. برای مقایسه همه گروهها با یکدیگر از حروف a، b و c استفاده گردید. بدین صورت که وجود حداقل یک حرف مشابه در بین گروه¬ها نشان دهنده عدم اختلاف معنیدار، در بین گروه¬های مورد بررسی میباشد، اما اگر حرف مشابهی در بین گروه¬ها مشاهده نشد، نشاندهنده اختلاف معنیدار در سطح (p<0/05) میباشد. با توجه به شکل 2 نمودارهای A، B، C و D درصد جنینهای دو سلولی، 4 و 8 سلولی و درصد جنینهای Compact و درصد بلاستوسیت در گروه دریافتکننده آکریلآمید کاهش معنیداری را نسبت به گروه کنترل نشان داد (p<0/001 ). میانگین درصد جنینهای دو سلولی، 4 و 8 سلولی و درصد جنینهای Compact و بلاستوسیت در گروه سالم دریافتکننده کورکومین کاهش معنیداری را نسبت به گروه کنترل و تائورین نشان داد (p<0/001). همچنین افزایش معنیداری در میانگین درصد جنینهای2 سلولی، 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 (به ترتیب p=0/009، p=0/008 و p=0/005)و گروه دریافتکننده آکریلآمید + تائورین mg/kg 75 و150 (به ترتیبp=0/038، p=0/015 و p=0/028) و (p<0/001 )نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید. اختلاف معنیداری در میانگین درصد جنینهای 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 200 نسبت به گروه آکریلآمید مشاهده نشد. همچنین افزایش معنیداری در میانگین درصد جنینهای Compact و درصد بلاستوسیتها در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 و 200 و گروه دریافتکننده آکریلآمید + تائورین mg/kg 75 و150 نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید. دادهها بهصورت SD ±Mean نشان داده شده است. برای مقایسه همه گروهها با یکدیگر از حروفa ، b و c استفاده گردید. بدین صورت که وجود حداقل یک حرف مشابه در بین گروهها نشان دهنده عدم اختلاف معنیدار، در بین گروه¬های مورد بررسی میباشد، اما اگر حرف مشابهی در بین گروه¬ها مشاهده نشد، نشاندهنده اختلاف معنیدار در سطح (p<0/05 )میباشد.
جدول 1: نتایج مربوط به میانگین غلظت MDA و TAC در گروههای مورد بررسی

مالوندیآلدهید (MDA) و غلظت ظرفیت آنتیاکسیدانی تام (TAC)
a با a اختلاف معنیدار ندارد.
a باb اختلاف معنیدار دارد (p<0/05)

شکل 1: نتایج مربوط به میانگین تعداد سلولهای اووسیت و میزان در صد لقاح در گروه¬های مورد بررسی

شکل 2: نتایج مربوط به میانگین درصد جنین های دوسلولی، 4 و 8 سلولی، جنینهای Compact و درصد بلاستوسیت نسبت به تعداد تخمک در گروه¬های مورد بررسی
بحث
یافتههای مطالعه حاضر نشان داد که آکریلآمید میزان لقاح، رشد جنین و ظرفیت آنتی اکسیدانی کل را در سطح معنیداری در مقایسه با گروههای تائورین و کورکومین کاهش داده بود. این در حالی بود که درمان با تائورین بیشتر از کورکومین در موشهای دریافتکننده آکریلآمید این پارامترها را افزایش داده بود. به طوریکه میانگین تعداد سلولهای اووسیت، در گروه سالم دریافتکننده تائورین نسبت به گروه کنترل افزایش معنیداری را نشان داد. افزایش معنیداری در میانگین تعداد سلولهای اووسیت، درصد لقاح، درصد جنینهای 4 و 8 سلولی در گروه سالم دریافتکننده تائورین نسبت به گروه سالم دریافت کننده کورکومین مشاهده شد. همچنین افزایش معنیداری در میانگین درصد جنینهای دو سلولی در گروه سالم دریافتکننده تائورین نسبت به گروه سالم دریافتکننده کورکومین و کنترل مشاهده شد. در مطالعهای Van der Horst و همکاران نشان دادند که تائورین در تحریک، نگهداری، حرکت و ظرفیتپذیری اسپرم و نیز فعالیت مجدد آکروزومی در داخل رحم نقش دارد، بنابراین میتواند در بهبود باروری آزمایشگاهی اووسیتها نقش مهمی داشته باشد (36). در پژوهشی که توسط Song و همکاران در سال 2021 انجام شد مشخص گردید که آکریلآمید باعث جلوگیری از فرایند اتوفاژی و افزایش محتوای ROS میشود. تجمع ROS منجر به افزایش نرخ آپوپتوز و ترشح عوامل التهابی میشود. علاوه بر این، مشخص گردید که، قرار گرفتن در معرض آکریلآمید باعث کاهش گلیکولیز/گلوکونئوژنز با کاهش سطح واسطههای گلیکولیتیک و کاهش میزان چرخه ظرفیت آنتیاکسیدانی کل میشود (37) که با نتایج تحقیق حاضر همخوانی دارد. چرا که در پژوهش حاضر، در گروه دریافتکننده آکریلآمید میانگین غلظت MDA افزایش و میانگین غلظت TAC کاهش معنیداری را نسبت به سایر گروهها نشان داد. در کنار این موضوع مشاهدات بیوشیمیایی در مطالعه حاضر نشان دادهاند که تائورین و کورکومین میتواند در سطح معنیداری میانگین غلظت MDA را کاهش و میانگین غلظت TAC را افزایش دهند و توان آنتی اکسیدانتی را بالا ببرد. در پژوهشی گزارش شده است که گلوتامین و تائورین برای رشد جنین موش در شرایط آزمایشگاهی مفید هستند (1) که در راستای نتایج تحقیق حاضر در مورد تائورین می باشد. چرا که در مطالعه حاضر مشخص گردید که تائورین سبب افزایش معنیدار تعداد جنینهای 2، 4 و 8 سلولی در شرایط آزمایشگاهی میشود.Devreker در مطالعه تصادفی شده، رشد جنینهای انسانی را در حضور 1 میلیمول در لیتر گلوتامین و 5 میلیمول در لیتر تائورین از مرحله 2-4 سلولی تا مرحله بلاستوسیست مقایسه کرد. و به این نتیجه رسید که در حضور گلوتامین یا تائورین به ترتیب 52/6% و58/3% از جنینها به مرحله بلاستوسیست رسیدند. بنابراین مشخص گردید که تائورین از رشد جنینهای 4-2 سلولی انسان تا مرحله بلاستوسیست پشتیبانی میکند (1). در تحقیقی دیگر گزارش شده است که در صورت استفاده از تائورین در محیط کشت سلولی تعداد جنینهای 2 سلولی موش به میزان قابلتوجهی به مرحله بلاستوسیست میرسند همچنین مشخص گردید که تائورین اثر مفید خود را منحصراً در طی 2 روز اول پس از تلقیح اعمال میکند (38). در گزارشی دیگر مشخص گردید که افزودن تائورین به محیط کشت سبب بهبود میزان لقاح در مقایسه با گروه شاهد میشود به طوریکه نتایج این تحقیق نشان داد که تائورین یک اثر حمایتی بر بهبود IVF در سویه موش BALB/c هم خون دارد. به طوری که جنینهای ایجاد شده در محیط کشت آزمایشگاهی، پس از انتقال جنین به مرحله بلاستوسیست توسعه یافتند (39). در مطالعه حاضر، کاهش معنیداری در تعداد سلولهای اووسیت و درصد لقاح در گروه سالم دریافتکننده کورکومین mg/kg 200 نسبت به گروه کنترل مشاهده شد. میانگین درصد جنینهای دوسلولی، 4 و 8 سلولی و درصد جنینهای Compact در گروه سالم دریافتکننده کورکومین کاهش معنیداری را نسبت به گروه کنترل نشان داد. همچنین کاهش معنیداری در میانگین درصد جنینهای Compact و درصد بلاستوسیتها در گروه سالم دریافتکننده کورکومین نسبت به گروه سالم دریافتکننده تائورین و گروه کنترل مشاهده شد. در مطالعهای که توسط گلمحمدی و همکاران درسال 2018 انجام شد مشخص گردید که با افزایش میزان دوز مصرف زردچوبه در گروههای آزمایشی، میزان تخمک¬هایی که به مرحله متافاز 2 رسیدند نسبت به گروه کنترل کاهش معنیداری یافته است. پس از انجام لقاح نیز تعداد جنین¬های 2 سلولی و 4 سلولی تشکیل شده در گروه دریافتکننده دوز حداکثر زردچوبه کاهش معنیداری را نشان میدهند (31). که با نتایج تحقیق حاضر همخوانی دارد. همچنین تعداد تخمکهای دژنره نیز در گروه دریافتکننده کورکومین نسبت به گروه شم و کنترل افزایش معنیداری را نشان داد. با توجه به انجام آزمایشات و مشاهده نتایج لقاح درون آزمایشگاهی در پژوهش گلمحمدی و همکاران، پس از لقاح، تعداد جنین¬های دو سلولی در گروه تجربی دریافتکننده کورکومین نسبت به گروه کنترل کمتر بوده است. همچنین با شمارش جنین چهار سلولی مشاهده شد که تعداد جنین¬های چهار سلولی در اثر وجود عصاره گیاه زردچوبه کاهش معنیداری را نشان میدهد. همچنین بر اساس مشاهدات انجام شده در پژوهش گلمحمدی و همکاران (2018) درصد میزان موفقیت در لقاح و تشکیل جنین در گروههای دریافتکننده زردچوبه نسبت به گروه کنترل کمتر بوده است. که با نتایج تحقیق حاضر در مورد گروه سالم دریافتکننده کورکومین مطابقت دارد. از طرفی در لقاح درون آزمایشگاهی با توجه به مشاهده حاصل از این پژوهش، پس از لقاح تعداد جنینهای دو سلولی در گروههای دریافتکننده کورکومین نسبت به گروه کنترل کمتر بوده استو میتوان نتیجه گرفت کورکومین موجب کاهش تعداد جنینهای دو سلولی حاصل از لقاح شده است. همچنین با شمارش جنین چهار سلولی پس از لقاح مشاهده شد که تعداد این جنینهای چهار و هشت سلولی نیز در اثر وجود کورکومین کاهش یافته است. لذا باید مطالعات بیشتری در سطح مولکولی جهت شناسایی مکانیسم اثر آن انجام شود. مطالعه Chen و همکارانش در سال 2010، نشان میدهد که قرار گرفتن بلاستوسیست در شرایط آزمایشگاهی با کورکومین باعث آپوپتوز سلول¬های بلاستوسیست شده، و پس از انتقال جنین به میزبان موش، پیشرفت لانهگزینی اولیه را در میزبان به تعویق میاندازد. علاوه بر این، کورکومین موجب ایجاد آپوپتوز در بلاستوسیست موش میشود و با پیشروی بیشتر فرآیندهای سیگنالینگ آپوپتوز وابسته به میتوکندری باعث اختلال در رشد جنین می¬گردد (40). این نتایج با مشاهدات و نتایج حاصل از این پژوهش مطابقت دارد و همانطورکه در این مطالعه بیان شده است، کورکومین در فرایند لقاح آزمایشگاهی ایجاد اختلال کرده و موجب کاهش جنینها می¬شود همچنین کورکومین، مانع واکنش ناشی از متیلاسیون برای تولید گونههای فعال اکسیژن (ROS) و رویدادهای مختلف بیوشیمیایی در آپوپتوز سلول¬های بنیادی جنینی و بلاستوسیست جدا شده از موش باردار می¬شود (41). بر اساس نتایج مطالعهای که توسط Chenو همکاران در سال 2012 صورت گرفت پیشنهاد شد که آسیب در رشد و نمو که توسط کورکومین ایجاد می¬شود از طریق فرایند القای آپوپتوز در فرآیندهای بلوغ تخمک و جنین در مراحل اولیه رخ میدهد. در حالیکه عملکردهای متعدد بیولوژیک برای کورکومین شناسایی شده است، هنوز فعالیت آن به عنوان القاء یا مهار آپوپتوز و مکانیسمهای مولکولی دقیق به طور کامل مشخص نمیباشد که متضمن این اقدامات باشد. تا به امروز، هیچ مطالعهای در مورد اثر نهان و بالقوه کورکومین بهعنوان یک عامل سیتوتوکسیک علیه بلوغ تخمک، لقاح و تکامل جنینی بعد از لقاح آن نپرداخته است (42) .از طرفی مشخص شده است که کورکومین موجود در زرد چوبه مانع عمل لانه گزینی پس از لقاح میشود نتایج این آزمایش نشان میدهد قرار گرفتن فولیکولها در معرض کورکومین موجب آپوپتوز و به تعویق انداختن عمل لانهگزینی پس از انتقال جنین به میزبان شده است و در مراحل اولیه پس از لانهگزینی موجب ایجاد اثر سوء میشود. به همین دلیل کورکومین یک عامل خطرناک احتمالی برای انجام عمل لقاح و رشد و نمو جنین طبیعی گزارش شده است که پس از لانهگزینی باید با احتیاط مصرف شود (43،42). همچنین در این مطالعه مشاهده شد که کورکومین در دوز بالا دارای اثر منفی در رشد جنینها در مراحل ابتدایی میباشد چرا که اختلاف معنیداری در میانگین درصد جنینهای 2، 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 200 نسبت به گروه آکریلآمید مشاهده نشد. اما افزایش معنیداری در میانگین درصد جنینهای2، 4 و 8 سلولی در گروه دریافتکننده آکریلآمید + کورکومین mg/kg 100 نسبت به گروه دریافتکننده آکریلآمید مشاهده گردید، که البته در حد گروه کنترل نبود و با آن نیز اختلاف معنیداری را نشان داد. لذا برای پی بردن به فرایند دقیق آن نیاز به مطالعات بیشتری است. به ویژه این که این مطالعات در سطح مولکولی و میکروسکوپ الکترونی انجام شود. با توجه به اینکه وجود تعداد مشخصی تخمک در جنس ماده از ابتدای تولد بهصورت یک منبع محدود به اثبات رسیده است و کلا جنین¬های آینده از تخمکهایی شکل میگیرند که از ابتدا بهصورت یک منبع ذخیره تخمدانی وجود داشته لذا هرنوع آسیبی که به دلایل محیطی (نظیر استفاده از آکریل¬آمید) به DNA سلولهای تخمک وارد شود، ممکن است بهصورت ناهنجاریهای ژنتیکی، عدم لانهگزینی تخمک و یا ناباروری به دلیل وجود تخمکهایی با DNA معیوب در آینده مشکلاتی را ایجاد کند. لذا نتایج مربوط به آزمایشات IVF در مطالعه حاضر قابلتوجیه میباشد. چرا که بدن تمام سعی خود را در جهت حفظ حالت پایدار خود میکند مثلا فولیکولها و سلولهای گرانولوزای بافت تخمدان که نقش پرستاری از تخمک را بر عهده دارند، با مکانیسمهای جبرانی نهایت تلاش خود را جهت حفظ تخمک به عمل می آورد، لذا ممکن است، در ابتدا ساختاری به ظاهر طبیعی از تخمک مشاهده شود. اما از آنجا که جهت انجام لقاح آزمایشگاهی تخمکهایی که قبلاً در معرض عوامل محیطی مثل آکریلآمید بودهاند و به طبع ممکن است دچار آسیبهایی در سطح مولکولی شده باشند، از سلولهای محافظ و نگهدارنده خود جهت انجام فرایندIVF جداسازی میشوند، وجود آسیبها را با عدم موفقیت در لقاح و تکوین جنین نشان میدهند. سطوح فیزیولوژیکی گونههای فعال اکسیژن بر روی گامتها و روند تولید مثلی تاثیرگذار است به طوریکه سطوح پایین گونههای فعال اکسیژن میزان بالای لقاح را افزایش میدهد. از طرفی سلولهای کومولوسی نقش مهمی در حفظ اووسیت در برابر آپوپتوز ناشی از تنش اکسیداتیو ایفا میکنند که این کار را از طریق افزایش Glotation peroxidase Px در اووسیتها انجام میدهند. سطوح آنزیم¬های GPx و Superoxide dismutase SOD در اووسیتهای فاقد توده کومولوسی کاهش مییابد (44).Agarwal و همکارانش در سال 2012 طی مطالعه که بر روی اثر تنش اکسیداتیو بر سیستم تولید مثلی ماده انجام دادند بیان داشتند که روند رشد اووسیت از مرحله میوز Ι به متافاز ΙΙ توسط عامل گونهای فعال اکسیژن به جریان می¬افتد و آنتی اکسیدانتها این جریان را محدود میکنند. از طرف دیگر ادامه میوز ΙΙ توسط آنتی اکسیدانتها به جریان میافتد که نشان دهنده ارتباط پیچیده بین گونههای فعال اکسیژن و آنتیاکسیدانتها میباشد (45,44). در مطالعهای مشخص گردید که نانومیسلهای کورکومین بهصورت وابسته به دوز، سبب کاهش درصد زیگوت، جنین 2 سلولی، بلاستوسیست و همچنین جنینهای compact در مقایسه با گروه کنترل میشود (46). که مشابه با نتایج تحقیق حاضر میباشد. در گروههای دریافتکننده دوزهای بالای نانومیسل کورکومین افزایش معنیداری در تعداد جنینهای مرده مشاهده گردید. به طورکلی نانومیسلهای کورکومین نسبتاً رشد جنین قبل از لانهگزینی را کاهش میدهد. اگرچه مطالعات بیشتری مورد نیاز است، اما کورکومین میتواند به عنوان یک سرکوب کننده پتانسیل باروری به روش IVF در نظر گرفته شود، زمانی که بهطور مزمن مصرف شود (46).
نتیجهگیری
نتایج بیانگر اثر مخرب آکریلآمید بر لقاح آزمایشگاهی میباشد. از طرفی با توجه به نتایج تحقیق حاضر، عملکرد تائورین، در کاهش عوارض، بیش از کورکومین بود. چراکه یافتهها نشان داد کورکومین ممکن است مانند یک شمشیر دولبه از یک طرف سبب کاهش عوارض آکریلآمید بر میزان غلظت مالوندیآلدهید و TAC شود و از طرفی دیگر سبب جلوگیری از لقاح آزمایشگاهی شود. لذا مصرف آن در ابتدای دوران بارداری باید با احتیاط بیشتری همراه باشد.
سپاسگزاری
بدینوسیله نویسندگان مراتب تقدیر و تشکر خود را از کلیه افرادیکه در اجرای این پژوهش نقشی ایفا کردند اعلام میدارند. همچنین این تحقیق بخشی از پایاننامه مقطع دکتری خانم رزا صابری بوده است.
حامی مالی: این پژوهش برگرفته از طرح تحقیقاتی دانشگاه ارومیه است که با حمایت معاونت مالی تحقیقات و فنآوری دانشگاه ارومیه به انجام رسیده است.
تعارض در منافع: وجود ندارد.
References:
1- Devreker F, Van den Bergh M, Biramane J, Winston RL, Englert Y, Hardy K. Effects of Taurine on Human Embryo Development in Vitro. Hum Reprod 1999; 14(9): 2350-6.
2- Al Abdali FH, Gowri V. The Etiology of Infertility and Treatment Outcome in Couples Aged 40 Years or More in A Non-IVF Setting. Journal of Infertility and Reproductive Biology 2021; 9(2): 87-92.
3- Kahyaoglu S, Gulerman HC, Yilmaz N, Kahyaoglu I, Ustun Y. Does Preovulatory Follicle Number Affect Probability for Achievement of at Least One Top Quality Embryo from Poor Responder Women Undergoing Assisted Reproduction Treatment? Journal of Infertility and Reproductive Biology 2021; 9(2): 78-86.
4- Khodabandeh Z, Dolati P, Zamiri MJ, Mehrabani D, Bordbar H, Alaee S, et al. Protective Effect of Quercetin on Testis Structure and Apoptosis Against Lead Acetate Toxicity: An Stereological Study. Biological Trace Element Research 2021;199(9): 3371-81.
5- Soleimani A. Environmental Pollution: A Risk Factor for Female Fertility-A Letter to Editor. Journal of Infertility and Reproductive Biology 2020; 8(4): 66-7.
6- Eunice O, Homahinuchi J-AH, Ariyo JD. Sugar Intake Disrupts Some Reproductive Functions in Female Wistar Rats. Journal of Infertility and Reproductive Biology 2021; 9(1): 1-6.
7- Adler I-D, Gonda H, de Angelis MH, Jentsch I, Otten I, Speicher M. Heritable Translocations Induced by Dermal Exposure of Male Mice to Acrylamide. Cytogenet Genome Res 2004; 104(1-4): 271-6.
8- Friedman M. Chemistry, Biochemistry, and Safety of Acrylamide. A Review. J Agric Food Chem 2003; 51(16): 4504-26.
9- Semla M, Goc Z, Martiniaková M, Omelka R, Formicki G. Acrylamide: A Common Food Toxin Related to Physiological Functions and Health. Physiol Res 2017; 66(2): 205-17.
10- Timmermann CAG, Mølck SS, Kadawathagedara M, Bjerregaard AA, Törnqvist M, Brantsæter AL, et al. A Review of Dietary Intake of Acrylamide in Humans. Toxics 2021; 9(7): 155.
11- Swedish NF. Information about Acrylamide in Food. Swedish National Food Administration 2002; 4: 24.
12- Becalski A, Lau BP-Y, Lewis D, Seaman SW, Hayward S, Sahagian M, et al. Acrylamide in French Fries: Influence of Free Amino Acids and Sugars. J Agric Food Chem 2004; 52(12): 3801-6.
13- Amrein TM, Bachmann S, Noti A, Biedermann M, Barbosa MF, Biedermann-Brem S, et al. Potential of Acrylamide Formation, Sugars, and Free Asparagine in Potatoes: A Comparison of Cultivars and Farming Systems. J Agric Food Chem 2003; 51(18): 5556-60.
14- Stadler RH. Acrylamide Formation in Different Foods and Potential Strategies for Reduction. In: Friedman M, Mottram D (eds) Chemistry and safety of acrylamide in food. Adv Exp Med Biol 2005: 561; 157-69.
15- Becalski A, Lau BP-Y, Lewis D, Seaman SW. Acrylamide in Foods: Occurrence, Sources, and Modeling. J Agric Food Chem 2003; 51(3): 802-8.
16- Claus A, Mongili M, Weisz G, Schieber A, Carle R. Impact of Formulation and Technological Factors on the Acrylamide Content of Wheat Bread and Bread Rolls. Journal of Cereal Science 2008; 47(3): 546-54.
17- Besaratinia A, Pfeifer GP. A Review of Mechanisms of Acrylamide Carcinogenicity. Carcinogenesis 2007; 28(3): 519-28.
18- Aldawood N, Alrezaki A, Alanazi S, Amor N, Alwasel S, Sirotkin A, et al. Acrylamide Impairs Ovarian Function by Promoting Apoptosis and Affecting Reproductive Hormone Release, Steroidogenesis and Autophagy-Related Genes: an in Vivo Study. Ecotoxicol and Environ Safety 2020; 197: 110595.
19- Nan B, Yang C, Li L, Ye H, Yan H, Wang M, et al. Allicin Alleviated Acrylamide-Induced NLRP3 Inflammasome Activation Via Oxidative Stress and Endoplasmic Reticulum Stress in Kupffer Cells and SD Rats Liver. Food Chem Toxicol 2021; 148: 111937.
20- Adewale AO, Adedeji SI, Olusola OO, Sulaiman SO, Victoria IO. Ethanolic Extract of Combined Cynodon dactylon and Mimosa pudica Ameliorated Experimentally Induced Benign Prostatic Hyperplasia in Wistar Rats. Journal of Infertility and Reproductive Biology 2021; 9(1): 22-6.
21- Dinga HF, Ndukong NE, Adzemye NG, Fanadzenyuy MH, Limnyuy KA, Justin K, et al. Assessment of Fertility, Progesterone Profiles and Oxidative Stress Parameters after Estrus Induction and Artificial Insemination in Cows. Journal of Infertility and Reproductive Biology 2021; 9(3): 123-9.
22- Ojatula AO. Developmental Botanic: A Case Study on Chromatographic Determination of Phytocompounds in the Roots of Anthocleista Nobilis (G. Don.) as Pro-Fertility. Journal of Infertility and Reproductive Biology 2021; 9(1): 7-21.
23- Olubunmi EO, Adeoye Oyetunji O, Olorunfemi ST, Opeyemi Samson A, Taiwo Adekemi A, Olawumi Feyisike J, et al. Attenuating Effect of Polyalthia Longifolia on Cadmium Sulfate-Induced Testicular Toxicity. Journal of Infertility and Reproductive Biology 2021; 9(2): 60-6.
24- Emokpae MA, Olaode O. Dose-Dependent Effect of Garlic (Allium Sativum) Extract Feeding on Semen Characteristics and Testes in Wistar Rats. Journal of Infertility and Reproductive Biology 2021; 9(3): 130-5.
25- Guerin P, Menezo Y. Hypotaurine and Taurine in Gamete and Embryo Environments: De Novo Synthesis Via the Cysteine Sulfinic Acid Pathway in Oviduct Cells. Zygote 1995; 3(4): 333-43.
26- Leese HJ, McKeegan P, Sturmey RG. Amino Acids and the Early Mammalian Embryo: Origin, Fate, Function and Life-Long Legacy. Int J Environ Res Public Health 2021; 18(18): 9874.
27- Ogasawara M, Nakamura T, Koyama I, Nemoto M, Yoshida T. Reactivity of Taurine with Aldehydes and Its Physiological Role.Adv Exp Med Biol1994: 359: 71-8.
28- Odebiyi O, Badejo J, Alabi B, Ajayi A, Iwalewa O, Fagbemi O. Evaluation of Modulatory Effects of Taurine in the Aortic and Myocardial Tissue of Nitroglycerin-Induced Tolerance Wistar Rats. Nutrire 2021; 46(2): 1-8.
29- Gold R, Linington C, Lassmann H. Understanding Pathogenesis and Therapy of Multiple Sclerosis Via Animal Models: 70 Years of Merits and Culprits in Experimental Autoimmune Encephalomyelitis Research. Brain 2006; 129(8): 1953-71.
30- Kurd SK, Smith N, VanVoorhees A, Troxel AB, Badmaev V, Seykora JT, et al. Oral Curcumin in the Treatment of Moderate to Severe Psoriasis Vulgaris: A Prospective Clinical Trial. J Am Acad Dermatol 2008; 58(4): 625-31.
31- Golmohammadi T, Hayati Roodbari N, Mohammady Gorgi S, Vaezi G. Effect of Curcuma Longa on in Vitro Maturation of Immature Oocytes and Embryonic Development in NMRI Mice. J Mazandaran Univ Med Sci 2018; 27(157): 49-58. [Persian]
32- Azami SH, Nazarian H, Abdollahifar MA, Eini F, Farsani MA, Novin MG. The Antioxidant Curcumin Postpones Ovarian Aging in Young and Middle-Aged Mice. Reproduction, Fertility and Development 2020; 32(3): 292-303.
33- Duan X, Wang Q-C, Chen K-L, Zhu C-C, Liu J, Sun S-C. Acrylamide Toxic Effects on Mouse Oocyte Quality and Fertility in Vivo. Scientific Reports 2015; 5(1): 1-11.
34- Das J, Ghosh J, Manna P, Sil PC. Acetaminophen Induced Acute Liver Failure Via Oxidative Stress and JNK Activation: Protective Role of Taurine by the Suppression of Cytochrome P450 2E1. Free Radic Res 2010; 44(3): 340-55.
35- Dolati P, Zamiri MJ, Akhlaghi A, Khodabandeh Z, Mehrabani D, Atashi H, et al. Reproductive and Embryological Toxicity of Lead Acetate in Male Mice and their Offspring and Mitigation Effects of Quercetin. J Trace Elem Med Biol 2021; 67: 126793.
36- Van der Horst C, Brand A. Occurrence of Hypotaurine and Inositol in the Reproductive Tract of the Ewe and tts Regulation by Pregnenolone and Progesterone. Nature 1969; 223(5201): 67-8.
37- Song D, Xu C, Holck AL, Liu R. Acrylamide Inhibits Autophagy, Induces Apoptosis and Alters Cellular Metabolic Profiles. Ecotoxicol Environ Saf 2021; 208: 111543.
38- Dumoulin JC, Evers JL, Bakker JA, Bras M, Pieters MH, Geraedts JP. Temporal Effects of Taurine on Mouse Preimplantation Development in Vitro. Hum Reprod 1992; 7(3): 403-7.
39- Choi Y-H, Seng S, Toyoda Y. Effect of Taurine on in Vitro Fertilization and Embryo Development of BALB/C Mouse Strain. Journal of Reproduction and Development 1998; 44(1): 29-34.
40- Chen C-C, Hsieh M-S, Hsuuw Y-D, Huang F-J, Chan W-H. Hazardous Effects of Curcumin on Mouse Embryonic Development through a Mitochondria-Dependent Apoptotic Signaling Pathway. Int J Mol Sci 2010; 11(8): 2839-55.
41- Hsuuw YD, Chang CK, Chan WH, Yu JS. Curcumin Prevents Methylglyoxal Induced Oxidative Stress and Apoptosis in Mouse Embryonic Stem Cells and Blastocysts. J Cell Physiol 2005; 205(3): 379-86.
42- Chen C-C, Chan W-H. Injurious Effects of Curcumin on Maturation of Mouse Oocytes, Fertilization and Fetal Development Via Apoptosis. International J Mol Sci 2012; 13(4): 4655-72.
43- Huang F-J, Lan K-C, Kang H-Y, Liu Y-C, Hsuuw Y-D, Chan W-H, et al. Effect of Curcumin on in Vitro Early Post-Implantation Stages of Mouse Embryo Development. European Journal of Obstetrics & Gynecology and Reproductive Biology 2013; 166(1): 47-51.
44- Agarwal A, Aponte-Mellado A, Premkumar BJ, Shaman A, Gupta S. The Effects of Oxidative Stress on Female Reproduction: A Review. Reproductive biology and endocrinology 2012; 10(1): 1-31.
45- Behrman HR, Kodaman PH, Preston SL, Gao S. Oxidative Stress and the Ovary. Journal of the Society for Gynecologic Investigation 2001; 8(1_suppl): S40-S2.
46- Rad MR, Nejati V, Razi M, Najafi G. Nano-Micelle Curcumin; A Hazardous and/or Boosting Agent? Relation with Oocyte in-Vitro Maturation and Pre-Implantation Embryo Development in Rats. Iran J Pharm Res: IJPR 2020; 19(2): 242.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







