دوره 30، شماره 3 - ( خرداد 1401 )
جلد 30 شماره 3 صفحات 4619-4607 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Sadeghzadeh S, Dehghani Ashkezari M, Seifati S M, Vahidi Mehrjardi M Y, Sadeghzadeh S. Investigating the Molecular miRNAs as Biomarkers of Type 2 Diabetes. JSSU 2022; 30 (3) :4607-4619
URL: http://jssu.ssu.ac.ir/article-1-5570-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5570-fa.html
صادقزاده سلمان، دهقانی اشکذری محمود، سیفتی سید مرتضی، وحیدی مهرجردی محمد یحیی، صادق زاده سارا. بررسی میکرو RNAهای مولکولی به عنوان نشانگرهای زیستی دیابت نوع 2. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1401; 30 (3) :4607-4619
متن کامل [PDF 988 kb]
(1701 دریافت)
| چکیده (HTML) (2456 مشاهده)
References:
1- Ringborg A, Lindgren P, Martinell M, Yin DD, Schon S, Stalhammar J. Prevalence and Incidence of Type 2 Diabetes and its Complications 1996-2003-Estimates from a Swedish Population‐Based Study. Diabetic Med 2008; 25(10): 1178-86.
2- Taylor KS, Heneghan CJ, Farmer AJ, Fuller AM, Adler AI, Aronson JK, et al. All-cause and Cardiovascular Mortality in Middle-aged People with Type 2 Diabetes Compared with People without Diabetes in a Large UK Primary Care Database. Diabetes Care 2013; 36(8): 2366-71.
3- Kennon B, Leese GP, Cochrane L, Colhoun H, Wild S, Stang D, et al. Reduced Incidence of Lower-Extremity Amputations in People with Diabetes in Scotland: a Nationwide Study. Diabetes Care 2012; 35(12): 2588-90.
4- Gregg EW, Li Y, Wang J, Rios Burrows N, Ali MK, Rolka D, et al. Changes in Diabetes-Related Complications in the United States, 1990–2010. N Engl J Med 2014; 370(16): 1514-23.
5- Aghaei Zarch SM, Vahidi Mehrjardi MY, Babakhanzadeh E, Nazari M, Talebi M, Zeniali F, et al. MiR-181b Expression Levels as Molecular Biomarker for Type 2 Diabetes. J Mazandaran Univ Med Sci 2019; 29(176): 195-201. [Persian]
6- Schulze MB, Weikert C, Pischon T, M. Bergmann M, Al-Hasani H, Schleicher E, et al. Use of Multiple Metabolic and Genetic Markers to Improve the Prediction of Type 2 Diabetes: the EPIC-Potsdam Study. Diabetes Care 2009; 32(11): 2116-9.
7- Müller G. Microvesicles/ Exosomes as Potential Novel Biomarkers of Metabolic Diseases. Diabetes Metab Syndr Obes 2012; 5: 247-82.
8- Bartel DP. MicroRNAs: Genomics, Biogenesis, Mechanism, and Function. Cell 2004; 116(2): 281-97.
9- Chang TC, Mendell JT. MicroRNAs in Vertebrate Physiology and Human Disease. Annu Rev Genomics Hum Genet 2007; 8: 215-39.
10- Poy MN, Eliasson L, Krutzfeldt J, Kuwajima S, Ma XE, Macdonald P, et al. A Pancreatic Islet-specific microRNA Regulates Insulin Secretion. Nature 2004; 432(7014): 226-30.
11- Poy MN, Hausser J, Trajkovski M, Braun M, Collins S, Rorsman P, et al. miR-375 Maintains Normal Pancreatic α-and β-cell Mass. Proc Natl Acad Sci 2009; 106(14): 5813-8.
12- Roggli, E, Gattesco S, Caille D, Briet C, Boitard C, Meda P, and Regazzi R. Changes in microRNA Expression Contribute to Pancreatic β-cell Dysfunction in Prediabetic NOD Mice. Diabetes 2012; 61(7): 1742-51.
13- Roggli, E, Britan A, Gattesco S, Lin-Marq N, Abderrahmani A, Meda P, et al. Involvement of microRNAs in the Cytotoxic Effects Exerted by Proinflammatory Cytokines on Pancreatic β-cells. Diabetes 2010; 59(4): 978-986.
14- Jason DA, Chevillet JR, Kroh ME, Ruf KI, Pritchard CC, Gibson FD, et al. Argonaute2 Complexes Carry a Population of Circulating microRNAs Independent of Vesicles in Human Plasma. Precede National Academy Sci 2011; 108(12): 5003-8.
15- Derrick JG, Ciaudo C, Erhardt M, and Voinnet O. Multivesicular Bodies Associate with Components of miRNA Effector Complexes and Modulate miRNA Activity. Nat Cell Biol 2009; 11(9): 1143-9.
16- Vickers KC, Palmisano BT, Shoucri BM, Shamburek RD, Remaley AT. MicroRNAs are Transported in Plasma and Delivered to Recipient Cells by High-density Lipoproteins. Nature Cell Biology 2011; 13(4): 423-33.
17- Claudiane G, Regazzi R. Circulating microRNAs as Novel Biomarkers for Diabetes Mellitus. Nat Rev Endocrinol 2013; 9(9): 513-21.
18- Kroh EM, Parkin RK, Mitchell PS, Tewari M. Analysis of Circulating Microrna Biomarkers in Plasma and Serum Using Quantitative Reverse Transcription-PCR (Qrt-PCR). Methods 2010; 50(4): 298-301.
19- Patrick SM, Parkin KR, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, et al. Circulating microRNAs as Stable Blood-based Markers for Cancer Detection. Prec Natil Acad Sci USA 2008; 105(30): 10513-8.
20- Shlomit G, Meiri E, Yogev Y, Benjamin S, Lebanony D, Yerushalmi N, et al. Serum microRNAs are Promising Novel Biomarkers. PLoS One 2008; 3(9): e3148.
21- Andreas K, Leidinger P, Bauer A, ElSharawy A, Haas J, Backes C, et al. Toward the Blood-Borne miRNome of Human Diseases. Nat Methods 2011; 8(10): 841-3.
22- Xi C, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, et al. Characterization of microRNAs in Serum: A Novel Class of Biomarkers for Diagnosis of Cancer and other Diseases. Cell Res 2008; 18(10): 997-1006.
23- Charles HL, Gal S, Dunlop HM, Pushkaran B, Liggins AP, Pulford K, Banham AH, et al. Detection of Elevated Levels of Tumour‐Associated microRNAs in Serum of Patients with Diffuse Large B‐cell Lymphoma. Br J Haematol 2008; 141(5): 672-5.
24- Zampetaki A, Kiechl S, Drozdov I, Willeit P, Mayr U, Prokopi M, et al. Plasma microRNA Profiling Reveals Loss of Endothelial miR-126 and Other microRNAs in Type 2 Diabetes. Circulation Res 2010; 107(6): 810-7.
25- Kong L, Zhu J, Han W, Jiang X, Xu M, Zhao Y, et al. Significance of Serum microRNAs in Pre-diabetes and Newly Diagnosed Type 2 Diabetes: A Clinical Study. Acta Diabetol 2011; 48(1): 61-9.
26- Karolina DS, Tavintharan S, Armugam A, Sepramaniam S, T Pek SL, TK Wong M, et al. Circulating miRNA Profiles in Patients with Metabolic Syndrome. J Clinic Endocrinol Metab 2012; 97(12): E2271-6.
27- Zhangping Y, Chen H, Si H, Li X, Ding X, Sheng Q, et al. Serum Mir-23a, a Potential Biomarker for Diagnosis of Pre-Diabetes and Type 2 Diabetes. Acta Diabetologica 2014; 51(5): 823-31.
28- Zhang T, Li L, Shang Q, Lv C, Wang C, Su B. Circulating miR-126 is a Potential Biomarker to Predict the Onset of Type 2 Diabetes Mellitus in Susceptible Individuals. Biochem Biophys Res Commun 2015; 463(1-2): 60-3.
29- Noha AR, Sabbah NA, Saad MS. Role of microRNA 126 in Screening, Diagnosis, and Prognosis of Diabetic Patients in Egypt. IUBMB Life 2016; 68(6): 452-8.
30- Chigusa H, Nakatsuka A, Eguchi J, Teshigawara S, Kanzaki M, Katayama A, et al. Identification of Circulating Mir-101, Mir-375 and Mir-802 as Biomarkers for Type 2 Diabetes. Metabolism 2015; 64(4): 489-97.
31- Francisco JO, Mercader JM, Moreno-Navarrete JM, Rovira O, Guerra E, Esteve E, et al. Profiling of Circulating Micrornas Reveals Common Micrornas Linked To Type 2 Diabetes That Change with Insulin Sensitization. Diabetes Care 2014; 37(5): 1375-83.
32- Yang L, Gao G, Yang C, Zhou K, Shen B, Liang H, Jiang X. The role of circulating microRNA-126 (miR-126): a Novel Biomarker for Screening Prediabetes and Newly Diagnosed Type 2 Diabetes Mellitus. Int J Mol Sci 2014; 15(6): 10567-77.
33- Olivieri F, Spazzafumo L, Bonafè M, Recchioni R, Prattichizzo F, Marcheselli F, et al. MiR-21-5p and miR-126a-3p Levels in Plasma and Circulating Angiogenic Cells: Relationship with Type 2 Diabetes Complications. Oncotarget 2015; 6(34): 35372-82.
34- Samanian S, Mozdarani H, Behmanesh M, Nasli-Esfahani E. Association of Intrinsic and Induced Genomic Instability in Peripheral Blood Lymphocytes of Type 2 Diabetes Patients with Expression Level of Genes PRKCB and SP1 and microRNAS (miR-126 and miR-15a-3p). Acta Medica Mediterranea 2019; 35(2): 777-82.
35- Paola DC, Spinetti G, Specchia C, Sangalli E, La Sala L, Uccellatore A, et al. Unique Plasma microRNA Profile Defines Type 2 Diabetes Progression. PLoS One 2017; 12(12): e0188980.
36- Sadeghzadeh S, Dehghani-Ashkezari M, Seifati SM, Vahidi-Mehrjardi MY, Dehghan-Tezerjani M, Sadeghzadeh S, et al. Circulating miR-15a and miR-222 as Potential Biomarkers of Type 2 Diabetes. Diabetes Metab Syndr Obes 2020; 13: 3461-9.
37- Chakraborty C, Priya-DossCG, Bandyopadhyay S, Agoramoorthy G. Influence of miRNA in Insulin Signaling Pathway and Insulin Resistance: Micro‐molecules with a Major Role in Type‐2 Diabetes. Wiley Interdiscip Rev RNA 2014; 5(5): 697-712.
38- Banerjee J, Nema V, Dhas Y, Mishra N. Role of Micrornas in Type 2 Diabetes and Associated Vascular Complications. Biochimie 2017; 139: 9-19.
39- Kato M, Natarajan R. MicroRNAs in Diabetic Nephropathy: Functions, Biomarkers, and Therapeutic Targets. Ann N Y Acad Sci 2015; 1353(1): 72-88.
40- Plaisance V, Waeber G, Regazzi R, Abderrahmani A. Role of microRNAs in Islet Beta-cell Compensation and Failure During Diabetes. J Diabetes Res 2014; 2014: 618652.
41- Ling HY, Wen GB, Feng SD, Tuo QH, Ou HS, Yao CH, et al. MicroRNA‐375 Promotes 3T3‐L1 Adipocyte Differentiation through Modulation of Extracellular Signal‐regulated Kinase Signalling. Clin Exp Pharmacol Physiol 2011; 38(4): 239-46.
42- Wu X, Li Y, Man B, Li D. Assessing MicroRNA-375 Levels in Type 2 Diabetes Mellitus (T2DM) Patients and their First-Degree Relatives with T2DM. Diabetes, Metab Synd Obes 2021; 14: 1445-51.
43- Belgardt BF, Ahmed K, Spranger M, Latreille M, Denzler R, Kondratiuk N, et al. The microRNA-200 Family Regulates Pancreatic Beta Cell Survival in Type 2 Diabetes. Nat Med 2015; 21(6): 619-27.
44- Guo L, Wang J, Yang P, Lu Q, Zhang T, Yang Y. Micro RNA‐200 Promotes Lung Cancer Cell Growth through FOG2‐Independent AKT Activation. IUBMB Life 2015; 67(9): 720-25.
45- Yu T, Lu XJ, Li JY, Shan TD, Huang CZ, Ouyang H, et al. Overexpression of miR-429 Impairs Intestinal Barrier Function in Diabetic Mice by Down-Regulating Occludin Expression. Cell Tissue Res 2016; 366(2): 341-52.
46- Musiyenko A, Bitko V, Barik S. Ectopic Expression of miR-126*, an Intronic Product of the Vascular Endothelial EGF-like 7 Gene, Regulates Prostein Translation and Invasiveness of Prostate Cancer LNCaP Cells. J Mol Med 2008; 86(3): 313-22.
47- Chen H, Miao R, Fan J, Han Z, Wu J, Qiu G, et al. Decreased Expression of miR-126 Correlates with Metastatic Recurrence of Hepatocellular Carcinoma. Clin Exp Metastasis 2013; 30(5): 651-8.
48- Dehghani M, Aghaei-Zarch SM, Vahidi-Mehrjardi MY, Nazari M, Babakhanzadeh E, Ghadimi H, et al. Evaluation of miR-181b and miR-126-5p Expression Levels in T2DM Patients Compared to Healthy Individuals: Relationship with NF-κB Gene Expression. Endocrinol Diabetes Nutr 2020; 67(7): 454-60.
49- Hsu SD, Lin FM, Wu WY, Liang C, Huang WC, Chan WL, et al. miRTarBase: a Database Curates Experimentally Validated microRNA–Target Interactions. Nucleic Acids Res 2011; 39(suppl_1): D163-D9.
50- Sun CY, She XM, Qin Y, Chu ZB, Chen L, Ai LS, et al. miR-15a and miR-16 affect the Angiogenesis of Multiple Myeloma by Targeting VEGF. Carcinogenesis 2013; 34(2): 426-35.
51- Yin KJ, Olsen K, Hamblin M, Zhang J, Schwendeman SP, Chen YE. Vascular Endothelial Cell-specific microRNA-15a Inhibits Angiogenesis in Hindlimb Ischemia. J Biol Chem 2012; 287(32): 27055-64.
52- Rawal S, Munasinghe PE, Nagesh PT, Sheng-Lew JK, Jones GT, Williams MJA, et al. Down-regulation of miR-15a/b Accelerates Fibrotic Remodelling in the Type 2 Diabetic Human and Mouse Heart. Clin Sci 2017; 131(9): 847-63.
53- Houshmand-Oeregaard A, Schrölkamp M, Kelstrup L, Hansen NS, Hjort L, Thuesen ABC, et al. Increased Expression of microRNA-15a and microRNA-15b in Skeletal Muscle from Adult Offspring of Women with Diabetes in Pregnancy. Hum Mol Genet 2018; 27(10): 1763-71.
54- Stinson S, Lackner MR, Adai AT, Yu N, Kim HJ, O’Brien C, et al. TRPS1 Targeting by miR-221/222 promotes the Epithelial-to-Mesenchymal Transition in Breast Cancer. Sci Signaling 2011; 4(177): ra41.
55- Shi Z, Zhao C, Guo X, Ding H, Cui Y, Shen R, Liu J. Differential Expression of microRNAs in Omental Adipose Tissue from Gestational Diabetes Mellitus Subjects Reveals miR-222 as a Regulator of ERα Expression in Estrogen-Induced Insulin Resistance. Endocrinology 2014; 155(5): 1982-90.
56- Li MY, Pan SR, Qiu AY. Roles of Microrna-221/222 in Type 2 Diabetic Patients with Post-Menopausal Breast Cancer. Genet Mol Res 2016; 15(2): 10-4238.
57- Tsukita S, Yamada T, Takahashi K, Munakata Y, Hosaka S, Takahashi H, et al. MicroRNAs 106b and 222 Improve Hyperglycemia in a Mouse Model of Insulin-Deficient Diabetes via Pancreatic β-cell Proliferation. EBio Medicine 2017; 15: 163-72.
متن کامل: (3277 مشاهده)
مقدمه
دیابت شیرین گروهی از اختلالات متابولیک متنوع و پیچیده است که با نشانگرهای گلیسمی افزایشیافته مشخص میشود. دیابت نوع 1 (Diabetes mellitus type 1 ,T1DM) و دیابت نوع 2 (Diabetes mellitus type 2 ,T2DM)، دو نوع بیماری متفاوت از نظر پاتوژنز و درمان هستند. در هر دو، نقص در ترشح انسولین و یا عمل انسولین منجر به هایپرگلیسمی میشود که از ویژگیهای مهم مورد استفاده در اهداف تشخیصی و درمانی است. دیابت، و بهویژه T2D، در قرن بیست و یکم، با افزایش میزان چاقی، به عنوان یک مشکل مهم سلامتی باقی مانده است. تعداد افراد مبتلا همچنان در حال افزایش است و T2D در افراد جوان جمعیت نیز تشخیص داده میشود (1). شیوع آن نیز در سرتاسر جهان در حال افزایش است که از پیشبینیهای انجام شده در پایان قرن گذشته، فراتر رفته است. افزایش نرخ این بیماری به دلیل پیر شدن، بهبود میزان بقا، رشد جمعیتهای اقلیت در معرض خطر، افزایش چاقی و شیوه زندگی کم تحرک است (1). دیابت نوع دو میتواند اثرات ویرانکنندهای بر روی عروق خونی داشته باشد که منجر به عوارض میکروواسکولار نظیر رتینوپاتی، نفروپاتی و نوروپاتی و عوارض ماکروواسکولار نظیر سکته و پرفشاری خون شود. در صورتیکه این عوارض درمان نشوند میتوانند زندگی فرد را تهدید و کیفیت زندگی را کاهش دهند (2،3). تشخیص دیابت تنها با مستندات نشانگرهای قند خون غیر طبیعی تایید میشود. از چهار معیار برای تشخیص دیابت استفاده میشود: تست A1c بالا، گلوکز ناشتا پلاسما، گلوکز پلاسما 2 ساعت پس از تست تحمل گلوکز 75 گرم خوراکی (OGTT)، یا علائم دیابت با گلوکز پلاسمای تصادفی >200 میلیگرم در دسیلیتر است (4). یکی از راه حل¬های این مشکل شناسایی افرادی است که در مرحله پیشدیابتی قرار دارند تا بهتوان با تغییر الگوی زندگی آنها یا مداخلات دارویی، پیشرفت بیماری را به دیابت کاهش یا به تعویق انداخت. از اینرو توسعه بیومارکرهای مولکولی برای تشخیص زودرس این بیماری ضروری است (5). امروزه افراد در معرض خطر ابتلا به T2D با استفاده از فاکتورهای سرمی که به راحتی در دسترس هستند از جمله سطوح گلوکز، کلسترول، لیپوپروتئینهای تریاسیلگلیسرول، HbA1c شناخته میشوند. علاوه بر این، از خصوصیات بدنی و سبک زندگی شامل(body mass index) BMI، نسبت دور کمر به لگن، فشار خون، جنسیت، مصرف مواد غذایی، عدم تحرک بدنی و استعمال سیگار نیز میتوان برای ارزیابی خطر ابتلا به T2D استفادهکرد (6). اگرچه مولکولهای زیستی مانند سیتوکینها، آدیپوکینها، فریتین و پروتئین واکنشی C، به عنوان نشانگرهای تجاری سودمند، رواج یافتهاند، با اینحال تفاوت قابلملاحظهای نسبت به نشانگرهای تجاری قدیمی ندارند (7). میکرو RNAها (miRNAs) مولکولهای RNA کوچک غیر کدشونده 21 تا 23 نوکلئوتیدی هستند که بیان ژن را تنظیم میکنند. آنها ابتدا در کرم الگانس در سال 1993 و سپس در مهرهداران و گیاهان کشف شدند. امروزه هزاران miRNAs شناسایی شدهاند و آنها را یکی از فراوانترین مولکولهای تنظیمکننده ژن در موجودات پرسلولی میدانند. این RNAهای غیرکدشونده به صورت خاموشکنندههای ژن خاص توسط جفت شدن باز با 3 ناحیه ترجمه نشده (UTR) از RNAهای پیامرسان هدف (mRNAs) رفتار میکنند. miRNAs در بافتها و مایعات بدن از قبیل سرم، خون، اوره و بزاق وجود دارند. این مولکولها در خون محیطی پایدار بوده و از فعالیت ریبونوکلئاز (RNase) حفظ میشوند (8،9). هیپرگلیسمی یکی از نشانه های دیابت نوع 1 و 2 است. در افراد سالم، سلولهای β پانکراس پالسهای منظمی از هورمون را آزاد کرده و وارد جریان خون میکنند .این پالسها میزان قند منتشر شده توسط کبد را محدود کرده و همچنین بافتهای بدن را به سمت جذب گلوکز منتشر شده سوق میدهند. با این حال، در افراد مبتلا به قند خون بالا (یک مشخصه از دیابت نوع 2) گلوکز مازاد، سلولهای بتا را که کنترل ریتم پالسهای انسولین را بر عهده دارند، سرکوب کرده و در نتیجه تولید انسولین کاهش مییابد. افزایش مدت زمان قرارگرفتن سلول β رده سلولی MIN6 پانکراس در معرض گلوکز بالا، منجر به تغییر در بیان یک مجموعه بزرگ از miRNAs میشود (10).
روش بررسی
در این مطالعه از 57 منبع از جمله مقالات اصلی، متاآنالیز و مطالعات مروری که در بین سالهای 2004 الی 2021 در ارتباط با بیماری دیابت شیرین T2D و بیومارکرهای مربوط به آن به چاپ رسیدهاند استفاده شده است. این منابع با استفاده از جست و جوی کلید واژههای "دیابت شیرین(Type 2 Diabetes Mellitus) "، "نشانگر زیستی ((Biomarker"، "miRNA"، "دیابت (Diabetes Mellitus)"، "پانکراس (Pancreas)" و "بیان ژن (Gene Expression)" در پایگاههای اطلاعاتی ،Pubmed، Google scholar، Uptodate، Elsevier، پایگاه اطلاعات علمی جهاد دانشگاهی (SID)، سیویلیکا (CIVILICA) و ایرانداک (پژوهشگاه علوم و فناوری اطلاعات) به دسـت آمدهاند. دادههای جمع آوری شده به صورت جدول (جدول 1) ارائه شده است.
1. نقش miRNA در پاتوژنز دیابت
سلولهای β پانکراس و بافتهای مورد هدف انسولین مجموعهای کاملاً مشخص از miRNAها را بیان میکنند که به طور گسترده در بافتهای بدن انسان توزیع شدهاند. ثابت شده است که بیان miRNAهای سلولهای بتا و بافتهای هدف انسولین در بیماران مبتلا به T1D و T2D دچار تغییر شده که احتمالاً به دلیل عملکرد ناقص این بافتها تحت شرایط بیماری است. یک استثنا قابل توجه miR 375 است، یک miRNA غنیشده در جزایر لوزالمعده که بیان ژنهای دخیل در ترشح هورمون و گسترش توده سلولهای β را در پاسخ به مقاومت به انسولین، تنظیم میکند (11،12). مشخصات بیان miRNA سلولهای β و بافتهای هدف انسولین در بیماران مبتلا به T1D و T2D متغییر است، که احتمالاً به اختلال عملکرد این بافتها در شرایط بیماری کمک میکند. در مطالعهای که بر روی موشهای بیمار و سالم انجام شد، سلولهای جزایر لانگرهانس موشهای دیابتی، حاوی سطوح افزایشیافتهای از چندین miRNA از جمله miR 21 ، miR 34a ، miR 29 و miR 146a است که تأثیرات مخربی بر عملکرد سلول β دارند (12). تغییراتی در مشخصات miRNA مربوط به دیابت در بافتهای انسانی نیز گزارش شدهاست (13). در این بررسی، ما بر روی نشانگرهای زیستی مولکولی تشخیصی microRNAهای درگیر در T2D تمرکز کردیم تا زمینههای جدیدی را برای مطالعات تجربی بیشتر فراهم کنیم که در جدول 1 ارائه شدهاند.
2. نقش کاربردی برای گردش miRNA ها چیست؟
علاوه بر تنظیم بیان ژن در داخل سلولهای تولید کننده، چندین miRNA در خون و سایر مایعات بدن در ارتباط با پروتئینها، میکرووزیکولها و یا کمپلکسهای لیپوپروتئین یافت میشود (شکل 1). مطالعات آزمایشگاهی نشان میدهد که miRNAهای منتقل شده توسط اگزوزومها یا high-density lipoprotein (HDL) میتوانند به شکل فعال به سلولهای گیرنده منتقل شوند (17-14). این مشاهدات امکان دخالت miRNAها در ارتباط با فرآیندهای سلولی را افزایش میدهد. miRNAهای بیرون سلولی (گردش کننده در خون) در برابر درمان با ریبونوکلئازها، چرخههای انجماد/ذوب و سایر شرایط آزمایشی شدید، بسیار پایدار و مقاوم هستند (18،19). miRNAهای بیرون سلولی دارای چندین مزیت دیگر به عنوان نشانگرهای زیستی بالقوه هستند: آنها نه تنها در خون بلکه در سایر مایعات بیولوژیکی به راحتی در دسترس هستند (مانند ادرار، بزاق، مایع آمنیوتیک و شیر مادر). آنها را میتوان با روش کمی بسیار حساس و خاص real-time PCR تشخیص داد، و اکثر آنها از نظر تکاملی محافظت میشوند (21-18).

شکل 1: miRNA های موجود در خون با کمپلکسهای پروتئینی مانند Argonaute 2 یا با ذرات HDL همراه میشوند، یا به داخل وزیکولهای متصل به غشا مانند اگزوزومها منتقل میشوند (1). شواهد نشان میدهد که miRNA های بیرون سلولی میتوانند به صورت فعال از طریق مکانیسم های مختلف، از جمله جذب با واسطه گیرنده، اندوسیتوز یا ادغام اگزوزومها با غشای پلاسمایی سلول های دریافت کننده، جذب شوند (2). انتقال miRNA ها بین سلولهای واقع در فاصله دور، یک حالت ارتباطی بالقوه جدید را تشکیل می دهد. مخفف: miRNA ، microRNA [17].
3. MiRNAها به عنوان نشانگرهای زیستی دیابت شیرین نوع 2
ایده استفاده از miRNAهای موجود در خون به عنوان نشانگرهای زیستی نسبتاً جدید است و اولین بار برای تشخیص انواع مختلف سرطان و بیماری خود ایمنی مطرح شد (23،22،18). در حال حاضر با تجزیه و تحلیل مطالعات انجام شده بر روی مشخصات miRNAها در سرم و پلاسما یا سلولهای خونی، رویکردهای جدیدی برای پیشبینی پیشرفت دیابت شیرین ایجاد شدهاست. Zampetaki و همکارانش (24) اولین کسانی بودند که مشخصات بیان miRNA های خون را که مربوط به T2D بود شناسایی کردند. آنها در مطالعه خود نمونههای خون بیش از 800 نفر را که بهطور تصادفی از جمعیت برونک (استان بولزانو، ایتالیا) انتخاب شده بودند، را تجزیه و تحلیل کردند و زیرمجموعه ای از پنج miRNA شامل miR-15a، miR-28-3p، miR-29b، miR-223 و miR-126 را شناسایی کردند که در 80 شرکتکننده با pre-T2D یا T2D اختلال در تنظیم را نشان داد. محتوای miRNA سرم بیماران مبتلا به پیشدیابت و یا افرادی که به تازگی با T2D تشخیص داده شدهاند نیز توسط سایر گروه ها، مورد تجزیه و تحلیل قرار گرفته است. Kong و همکارانش (25) افزایش بیان هفت miRNA مرتبط با دیابت (miR 9،miR 29a ،miR 30d ،miR 34a ،miR 124a ، miR 146a وmiR 375) را در بیماران مبتلا به T2D در مقایسه با بیمارانی که پیش دیابت داشتند یا مستعد ابتلا به T2D بودند را تشخیص دادند. با این حال، هیچ تفاوتی بین افراد دارای تحمل طبیعی گلوکز و افراد مبتلا به پیشدیابت مشاهده نشد، که نشان می¬دهد سطح این miRNAها در سرم برای پیشبینی حساسیت به T2D مناسب نیست. در تحقیقی که در سال 2012 منتشر شد، Karolina و همکاران (26) miRNAهای موجود در خون و اگزوزوم 265 بیمار با شرایط مختلف سلامتی مرتبط با سندرم متابولیک را اندازهگیری کردند. آنها تنظیم افزایشیmiR 27a ، miR 150 ،miR 192 ، miR 320a و miR 375 را در بیماران مبتلا به T2D تشخیص داده و ارتباط قوی بین افزایش سطح گلوکز ناشتا و افزایش سطح miR 27a و miR-320a را مشاهده کردند. این مطالعات پیشگام پتانسیل miRNAها را به عنوان نشانگرهای زیستی برای T2D نشان میدهد. این جستجوی پیشگامانه آینده miRNAs به عنوان نشانگرهای تجاری برای T2D را نشان میدهد. پس از آن، مطالعات مختلف miRNAهای مختلفی از جملهmiR-375 ، miR-126 و miR-23a را به عنوان نشانگرهای تجاری بالقوه برای شناخت T2D در جمعیت عمومی پیشنهاد دادهاند (30-27). در بررسی که Ortega و همکاران در سال 2014 بر روی پروفایل miRNAهای در خون افراد دیابتی انجام دادند متوجه شدند که این miRNAهای mir-222 و mir-126 به ترتیب دارای افزایش و کاهش در بیان را نشان دادند. تیمار افراد با داروی متفورمین باعث کاهش معنادار در mir-222 شد (31). در سال 2014 Lio و همکاران به بررسی بیانmiR-126 در ۳۲۰ فرد دیابتی، پیشدیابتی و سالم پرداختند. میزان بیان این miRNA در خون افراد دیابتی در مقایسه با افراد پیشدیابتی به طور معنادارای کاهش پیدا کرده بود. در این افراد بعد از کنترل رژیمی و ورزش بیان این miRNA افزایش معناداری پیدا کرده بود. همچنین با بررسی قدرت بیومارکری این miRNA متوجه شدند که افراد دیابتی و سالم را با قدرت ۸۲ درصد از هم تمیز میدهد (32). در مطالعهای که Olivieri و همکاران (33) بر روی ۳۸۰ فرد دیابتی و سالم انجام دادند متوجه شدند که بیان miR-126 و miR-21 در افراد دیابتی کمتر از افراد سالم است. هم چنین با بررسی بیان این دو ژن در افراد دارای عارضههای ثانویه دیابت نظیر رتینوپاتی و نفروپاتی، مشخص شد که بیان ژنهای مذکور در این افراد نسبت به افراد دیابتی دارای کاهش بدون عارضه است. همچنین در مطالعهای که سامانیان و همکاران (34) در سال ۲۰۱۹ بر روی سلولهای لنفوسیت خونی افراد دیابتی در ایران انجام دادند، متوجه شدند که mir-15a و mir-126 کاهش پیدا کردهاست. از سوی دیگر، ژنهای هدف این miRNAها، یعنی PRKCB و SP1 با افزایش بیان همراه شدند که باعث افزایش در میزان ناپایداری و شکست دورشتهای DNA میشود. این محققان نتیجه گرفتند که کاهش بیان miRNAهای مذکور نقش مهمی در ایجاد و پیشرفت دیابت از طریق کمک به ایجاد شکستهای دورشتهای میکند. Candia و همکاران با بررسی پروفایل miRNAها در افراد پیشدیابتی و دیابتی متوجه شدند که mir-222 و mir-148 در افراد دیابتی کاهش نشان دادهاند و با میزان HBA1C رابطه مستقیم دارند (35). آقایی و همکاران در سال 2019 با بررسی میزان بیان ژن miR-181b در بیماران مبتلا به دیابت نوع 2 در جمعیت یزد نشان دادند که در میزان بیان این ژن در گروههای سالم و بیمار تحت مطالعه، تفاوت معنیداری وجود دارد (برای افراد سالم fold change = 1/05 ± 0/38و برای افراد پیشدیابتی fold change = 0/34±0/12 (5). بیان کاهشیافته mir-181-b در افراد مبتلا به دیابت نوع دو و پیشدیابتی نسبت به گروه کنترل سالم نشاندهنده این است که mir-181b پتانسیل استفاده به عنوان بیومارکر در دیابت نوع دو را دارا است. صادقزاده و همکاران به مطالعه تاثیر میزان بیان miR-222 و miR-15a در گروههای پیشدیابتی (per-T2D)، دیابتی و سالم پرداختند. بدین منظور، نود نفر از مرکز دیابت یزد که بهطور مساوی شامل افراد سالم، pre-T2D و T2D بودند، انتخاب شدند. میزان بیان miRNA در نمونههای پلاسمای جمعیت مورد نظر با روش PCR Real-time انجام شد. بیان miR-222 در نمونههای pre-T2D بهطور معنیداری در مقایسه با گروه کنترل (0/001>P) تنظیم افزایشی شد، در حالیکه اختلاف معنیداری در افراد pre-T2D نسبت به گروه T2D مشاهده نشد (0/05>P). بیان miR-15a از نظر آماری در گروههای pre-T2D و T2D تنظیم کاهشی داشت (0/05> P) (36).
4. microRNA های عمدهای که در T2D نقش دارند
4-1. miR-375
miR-375 بر روی کروموزوم 2 انسان بین ژنهای CRYBA2 و CCDC108 قرار دارد (37). miR-375 به عنوان miRNA ضروری برای هموستاز طبیعی گلوکز، تکثیر سلولهای β و گردش سلولهای β و α در نظر گرفته میشود. علاوه بر این، به عنوان miRNA سلول جزایر لوزالمعده که، mRNA میوتروفین را هدف قرار میدهد، شناسایی شده است. میوتروفین بهطور فعال در ادغام دانههای ترشحی با غشای سلولی شرکت میکند (38). بنابراین، miR-375 میتواند بهطور مستقل ترشح انسولین ناشی از گلوکز را مهار کند. همچنین، سطح بیان miR-375 به دلیل افزایش قند خون بالا و مرگ سلول β افزایش مییابد، بنابراین سطح بیان miR-375 برای پیشبینی مرگ سلول β مناسب است (39،40). تحقیقات اخیر نشان دادهاست که miR-375 به عنوان یک عامل موثر نقش مهمی در تمایز چربی 3T3-L1 از طریق مسیر سیگنالینگ ERK-PPARγ2-ap2 دارد (41). در مطالعه بالینی که اخیراً منتشر شدهاست، اهمیت miR-375 در بیماران مبتلا به دیابت نوع 2 و بستگان درجه اول آنها با تحمل طبیعی گلوکز (FD-NGT) و افراد مبتلا به T2D بیان شده است. در مقایسه با گروه کنترل، اختلاف معنیداری در بیان miR-375 در گروههای T2D و pre-T2D مشاهده شد و تنظیم افزایشی نشان داد. بنابراین، miR375 به عنوان یک نشانگر زیستی پایدار برای پیشبینی اولیه T2D در بین افراد در معرض خطر میباشد (42).
4-2. miR-200
خانواده miR-200 متشکل از 5 عضو است که رونویسی آنها را میتوان به عنوان 2 پلی سیسترونیک جداگانه pri-miRNA مشاهده کرد. miR200a/b و miR-429 در یک خوشه در کروموزوم 1 قرار دارند، در حالیکه miR-200c و miR-141 بخشی از خوشه دیگر در کروموزوم 12 هستند (43). miR-200یکی از miRNAهای مهم در مسیر پیامرسانی انسولین است که FOG2 را هدف قرار میدهد. miR-200 باعث پیامرسانی صحیح مسیر انسولین شده و از ایجاد اختلال در این مسیر، جلوگیری میکند (44). miR-200b میتواند Zeb1 را هدف گرفته و فعالیت آن را مسدود کند، که منجر به آپوپتوز سلول β میشود. بنابراین ، تغییر بیان miR-200 ممکن است با T2D همراه باشد (45،43).
4-3. miR-126
miR-126، محصول داخلی اینترون ژن Egfl7، که در جایگاه 9q34 واقع شده است. سلولهای اندوتلیال غنی از miR-126 هستند. علاوه بر این، miR-126 با هدف قرار دادن ADAM-9 در افروسیتوز که فرآیند حذف سلولهای آپوپتوتیک توسط سلولهای فاگوسیتی است، نقش مهمی ایفا میکند (46،47). در مطالعهای سطح سرمی miR-126 بیماران دیابتی، پیشدیابتی و افراد غیردیابتی را به عنوان کنترل تجزیه و تحلیل کردند و دریافتند که miR-126 در بیماران دیابتی در مقایسه با افراد پیشدیابتی بهطور قابلتوجهی کاهش یافتهاست. نتایج آن¬ها نشان داد که میزان بیان miR-126 در افراد غیردیابتی بیشتر از 2 گروه قبلی بود (32). بنابراین، سطوح بیان miR-126 ممکن است به عنوان یک نشانگر متمایز کننده بالقوه استفاده شود. با توجه به نتایج، میزان بیان miR-126 نیز میتواند به عنوان نشانگر زیستی مورد استفاده قرار گیرد (48).
4-4. miR-15a
miR-15a بر روی کرموزوم ۱۳ در انسان و در رشته معکوس قرار دارد و دارای جهت رونویسی مشابه با ژن میزبان DLEU2 است. فرم اولیه این ژن دارای ۸۳ جفت باز است. این miRNA در بافتهای زیادی از جمله کبد و چربی بیان میگردد. ساختار ثانویه این ژن در شکل 1 نشان داده شده است (49). تنظیم افزایشی miR-15a با هدف قراردادن فاکتور رشد اندوتلیال عروقی A (VEGFA) که با ایسکمی میوکارد / آسیب مجدد خونرسانی در موش همراه است، آنژیوژنز را در سلولهای پروآنژیوژنیک در شرایط in vitro کاهش میدهد (50). علاوه بر این، مهار miR-15 در سلولهای اندوتلیال عروق مغزی باعث افزایش فعالیت پروآنژیوژنیک در مدلهای حیوانی و مطالعات آزمایشگاهی میشود (51). در مطالعهای گزارش شده است که پس از قرار گرفتن طولانی مدت در معرض گلوکز، با تنظیم miR-15a میتوان بیان ژن انسولین در سلولهای انسولین موش را ارتقاء داد (52). علاوه بر این، کاهش سطح miR-15a در ماهیچههای اسکلتی از بیماران T2D هیپرگلیسمی، نیز در جمعیت دانمارک گزارش شده است (53). نتایج نشان می-دهند که miR-15a یکی از نشانگرهای زیستی جدید برای تشخیص بیماران T2D است.
4-5. miR-222
این ژن بر روی کروموزومX و در رشته ریورس قرار دارد که فرم اولیه و نابالغ آن دارای ۱۱۰ جفت باز است (49). این miRNA در بافتهای زیادی از جمله معده و خون بیان میگردد. بیان غیر طبیعی miR-222 در موارد چاقی، سرطان و آنوکسی مشاهده میشود (56-54). مطالعات نشاندادهاند که بیان miR-221/222 در موشها و افراد مبتلا به کبد چرب تنظیم افزایشی شده است (54). آنها همچنین با شاخص مقاومت به انسولین ارتباط مثبت دارند (55). تحقیقات نشان دادهاند که miR-222 به شدت در کبد موشهای چاق بیان شدهاست و خاموش کردن miR-222 میتواند بیان CAV1 را تنظیم افزایشی کند، حساسیت به انسولین را بهبود بخشد و قند خون را کاهشدهد. CAV1 یکی از پروتئینهای داربست اصلی غشای سیتوپلاسمی است که میتواند گیرندههای انسولین را تثبیت کرده و عملکرد فاکتور رونویسی گلوکز 4 را تقویت کند. با توجه به بیان miR-222، شی و همکاران افزایش در بیان miR-222 در بافتهای آدیپوز امنتال از بیماران مبتلا به دیابت حاملگی در جمعیت چینی مشاهده کردند. Li و همکاران (56) تنظیم افزایشی میزان miR-222 را در نمونههای سرمی زنان T2D در جمعیت چین نشاندادند. علاوه بر این، Tsukita و همکاران نشاندادند که miR-222 ترشح شده از مغز استخوان پس از پیوند مغز استخوان در موش¬های صحرایی دیابتی شده ناشی از استرپتوزوتوسین منجر به بازسازی سلولهای بتا و بهبود هیپرگلیسمی میشود (57). مطالعات انجام گرفته بر روی میزان بیان miR-126 نشان میدهد که این miRNA میتواند به عنوان نشانگر زیستی در دیابت شیرین مورد استفاده قرار گیرد. بنابراین، دیابت قندی منجر به تغییراتی در میزان بیان برخی از miRNAها در خون و مایعات بدن شود و به میتواند به عنوان یک بیومارکر زیستی در تشخیص زودهنگام افراد در معرض خطر ابتلا به دیابت مورد استفاده قرار بگیرد.
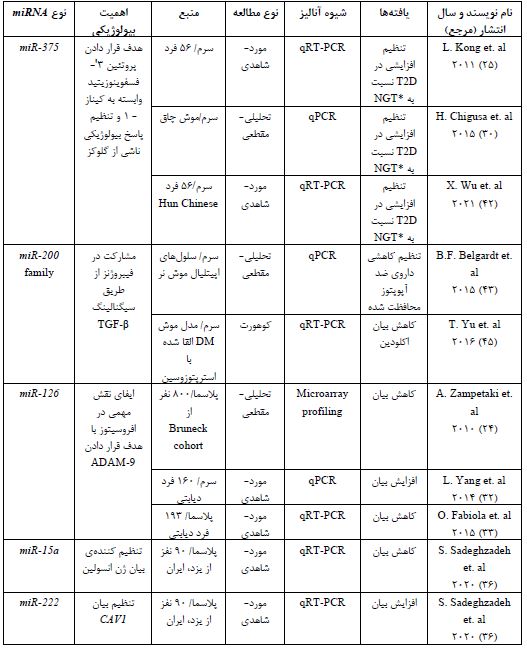
جدول 1: miRNAهای گزارش شده در دیابت نوع 2 (T2D)
نتیجهگیری
دیابت قندی یک اختلال متابولیک است و تعداد افرادی که از این سندرم رنج میبرند در سراسر جهان به سرعت در حال افزایش است و منجر به پیامدهای نامطلوب سلامتی و اقتصادی-اجتماعی میشود. از این رو کشف نشانگرهای زیستی جدید برای شناسایی افراد در معرض خطر و در نتیجه مدیریت مناسب آن به شدت مورد نیاز است. جدیدترین روند کشف نشانگرهای زیستی، جستجوی نشانگرهای زیستی حساس است که میتواند برای تمایز افراد مبتلا از همتایان سالم خود، اعمال شود و مراحل مختلف بیماری را مشخص کند. یکی دیگر از مزایای موثر نشانگرهای زیستی، در دسترس بودن آنها است بهطوری که میتوانند به راحتی از مایعات بدن مانند بزاق، ادرار یا خون بهدست آیند. تحقیقات بیشماری ثابت کردهاند که miRNAها در بافتها و انواع مختلف سلول بیان میشوند. علاوه بر این، نقش miRNAها در تنظیم مسیرهای متابولیکی مهم برای تمایز چربی، هموستاز انرژی، متابولیسم چربی، ترشح انسولین و التهاب ناشی از گلوکز اثبات شدهاست. بنابراین، اختلال در تنظیم بیان miRNAها بر انواع عملکردهای مهم سلولی از جمله تنظیم چرخه سلولی، آپوپتوز و تمایز، تأثیر میگذارد و اثر قابلتوجهی در سلامت و توسعه بیماری دارد. یافتههای توصیف شده در این مقالات تأیید میکند که miRNAها نشانگرهای زیستی جدیدی برای دیابت هستند. شناسایی نشانگرهای زیستی جدید میتواند به درک بهتر وقایع پاتوژنز درگیر در دیابت کمککند و همچنین برای تشخیص T2Dدر مراحل اولیه موثر باشد. در واقع، تغییرات در سطح زیر مجموعهای از این مولکولهای RNA کوچک در مایعات بدن، سرنخهای جدیدی برای شناسایی زودهنگام افرادی که در معرض خطر ابتلا به دیابت و عوارض مرتبط با این اختلال هستند را نوید میدهد. بنابراین، اثربخشی آنها در پیشبینی وقوع دیابت یا عوارض ناشی از آن باید بهطور سیستماتیک با نشانگرهای زیستی موجود مقایسه شود. بر اساس دادههای فعلی، miRNAهای بیرون سلولی شاید بتوانند در آینده جایگزین یا مکمل سایر اندازهگیریهای معمول شوند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
دیابت شیرین گروهی از اختلالات متابولیک متنوع و پیچیده است که با نشانگرهای گلیسمی افزایشیافته مشخص میشود. دیابت نوع 1 (Diabetes mellitus type 1 ,T1DM) و دیابت نوع 2 (Diabetes mellitus type 2 ,T2DM)، دو نوع بیماری متفاوت از نظر پاتوژنز و درمان هستند. در هر دو، نقص در ترشح انسولین و یا عمل انسولین منجر به هایپرگلیسمی میشود که از ویژگیهای مهم مورد استفاده در اهداف تشخیصی و درمانی است. دیابت، و بهویژه T2D، در قرن بیست و یکم، با افزایش میزان چاقی، به عنوان یک مشکل مهم سلامتی باقی مانده است. تعداد افراد مبتلا همچنان در حال افزایش است و T2D در افراد جوان جمعیت نیز تشخیص داده میشود (1). شیوع آن نیز در سرتاسر جهان در حال افزایش است که از پیشبینیهای انجام شده در پایان قرن گذشته، فراتر رفته است. افزایش نرخ این بیماری به دلیل پیر شدن، بهبود میزان بقا، رشد جمعیتهای اقلیت در معرض خطر، افزایش چاقی و شیوه زندگی کم تحرک است (1). دیابت نوع دو میتواند اثرات ویرانکنندهای بر روی عروق خونی داشته باشد که منجر به عوارض میکروواسکولار نظیر رتینوپاتی، نفروپاتی و نوروپاتی و عوارض ماکروواسکولار نظیر سکته و پرفشاری خون شود. در صورتیکه این عوارض درمان نشوند میتوانند زندگی فرد را تهدید و کیفیت زندگی را کاهش دهند (2،3). تشخیص دیابت تنها با مستندات نشانگرهای قند خون غیر طبیعی تایید میشود. از چهار معیار برای تشخیص دیابت استفاده میشود: تست A1c بالا، گلوکز ناشتا پلاسما، گلوکز پلاسما 2 ساعت پس از تست تحمل گلوکز 75 گرم خوراکی (OGTT)، یا علائم دیابت با گلوکز پلاسمای تصادفی >200 میلیگرم در دسیلیتر است (4). یکی از راه حل¬های این مشکل شناسایی افرادی است که در مرحله پیشدیابتی قرار دارند تا بهتوان با تغییر الگوی زندگی آنها یا مداخلات دارویی، پیشرفت بیماری را به دیابت کاهش یا به تعویق انداخت. از اینرو توسعه بیومارکرهای مولکولی برای تشخیص زودرس این بیماری ضروری است (5). امروزه افراد در معرض خطر ابتلا به T2D با استفاده از فاکتورهای سرمی که به راحتی در دسترس هستند از جمله سطوح گلوکز، کلسترول، لیپوپروتئینهای تریاسیلگلیسرول، HbA1c شناخته میشوند. علاوه بر این، از خصوصیات بدنی و سبک زندگی شامل(body mass index) BMI، نسبت دور کمر به لگن، فشار خون، جنسیت، مصرف مواد غذایی، عدم تحرک بدنی و استعمال سیگار نیز میتوان برای ارزیابی خطر ابتلا به T2D استفادهکرد (6). اگرچه مولکولهای زیستی مانند سیتوکینها، آدیپوکینها، فریتین و پروتئین واکنشی C، به عنوان نشانگرهای تجاری سودمند، رواج یافتهاند، با اینحال تفاوت قابلملاحظهای نسبت به نشانگرهای تجاری قدیمی ندارند (7). میکرو RNAها (miRNAs) مولکولهای RNA کوچک غیر کدشونده 21 تا 23 نوکلئوتیدی هستند که بیان ژن را تنظیم میکنند. آنها ابتدا در کرم الگانس در سال 1993 و سپس در مهرهداران و گیاهان کشف شدند. امروزه هزاران miRNAs شناسایی شدهاند و آنها را یکی از فراوانترین مولکولهای تنظیمکننده ژن در موجودات پرسلولی میدانند. این RNAهای غیرکدشونده به صورت خاموشکنندههای ژن خاص توسط جفت شدن باز با 3 ناحیه ترجمه نشده (UTR) از RNAهای پیامرسان هدف (mRNAs) رفتار میکنند. miRNAs در بافتها و مایعات بدن از قبیل سرم، خون، اوره و بزاق وجود دارند. این مولکولها در خون محیطی پایدار بوده و از فعالیت ریبونوکلئاز (RNase) حفظ میشوند (8،9). هیپرگلیسمی یکی از نشانه های دیابت نوع 1 و 2 است. در افراد سالم، سلولهای β پانکراس پالسهای منظمی از هورمون را آزاد کرده و وارد جریان خون میکنند .این پالسها میزان قند منتشر شده توسط کبد را محدود کرده و همچنین بافتهای بدن را به سمت جذب گلوکز منتشر شده سوق میدهند. با این حال، در افراد مبتلا به قند خون بالا (یک مشخصه از دیابت نوع 2) گلوکز مازاد، سلولهای بتا را که کنترل ریتم پالسهای انسولین را بر عهده دارند، سرکوب کرده و در نتیجه تولید انسولین کاهش مییابد. افزایش مدت زمان قرارگرفتن سلول β رده سلولی MIN6 پانکراس در معرض گلوکز بالا، منجر به تغییر در بیان یک مجموعه بزرگ از miRNAs میشود (10).
روش بررسی
در این مطالعه از 57 منبع از جمله مقالات اصلی، متاآنالیز و مطالعات مروری که در بین سالهای 2004 الی 2021 در ارتباط با بیماری دیابت شیرین T2D و بیومارکرهای مربوط به آن به چاپ رسیدهاند استفاده شده است. این منابع با استفاده از جست و جوی کلید واژههای "دیابت شیرین(Type 2 Diabetes Mellitus) "، "نشانگر زیستی ((Biomarker"، "miRNA"، "دیابت (Diabetes Mellitus)"، "پانکراس (Pancreas)" و "بیان ژن (Gene Expression)" در پایگاههای اطلاعاتی ،Pubmed، Google scholar، Uptodate، Elsevier، پایگاه اطلاعات علمی جهاد دانشگاهی (SID)، سیویلیکا (CIVILICA) و ایرانداک (پژوهشگاه علوم و فناوری اطلاعات) به دسـت آمدهاند. دادههای جمع آوری شده به صورت جدول (جدول 1) ارائه شده است.
1. نقش miRNA در پاتوژنز دیابت
سلولهای β پانکراس و بافتهای مورد هدف انسولین مجموعهای کاملاً مشخص از miRNAها را بیان میکنند که به طور گسترده در بافتهای بدن انسان توزیع شدهاند. ثابت شده است که بیان miRNAهای سلولهای بتا و بافتهای هدف انسولین در بیماران مبتلا به T1D و T2D دچار تغییر شده که احتمالاً به دلیل عملکرد ناقص این بافتها تحت شرایط بیماری است. یک استثنا قابل توجه miR 375 است، یک miRNA غنیشده در جزایر لوزالمعده که بیان ژنهای دخیل در ترشح هورمون و گسترش توده سلولهای β را در پاسخ به مقاومت به انسولین، تنظیم میکند (11،12). مشخصات بیان miRNA سلولهای β و بافتهای هدف انسولین در بیماران مبتلا به T1D و T2D متغییر است، که احتمالاً به اختلال عملکرد این بافتها در شرایط بیماری کمک میکند. در مطالعهای که بر روی موشهای بیمار و سالم انجام شد، سلولهای جزایر لانگرهانس موشهای دیابتی، حاوی سطوح افزایشیافتهای از چندین miRNA از جمله miR 21 ، miR 34a ، miR 29 و miR 146a است که تأثیرات مخربی بر عملکرد سلول β دارند (12). تغییراتی در مشخصات miRNA مربوط به دیابت در بافتهای انسانی نیز گزارش شدهاست (13). در این بررسی، ما بر روی نشانگرهای زیستی مولکولی تشخیصی microRNAهای درگیر در T2D تمرکز کردیم تا زمینههای جدیدی را برای مطالعات تجربی بیشتر فراهم کنیم که در جدول 1 ارائه شدهاند.
2. نقش کاربردی برای گردش miRNA ها چیست؟
علاوه بر تنظیم بیان ژن در داخل سلولهای تولید کننده، چندین miRNA در خون و سایر مایعات بدن در ارتباط با پروتئینها، میکرووزیکولها و یا کمپلکسهای لیپوپروتئین یافت میشود (شکل 1). مطالعات آزمایشگاهی نشان میدهد که miRNAهای منتقل شده توسط اگزوزومها یا high-density lipoprotein (HDL) میتوانند به شکل فعال به سلولهای گیرنده منتقل شوند (17-14). این مشاهدات امکان دخالت miRNAها در ارتباط با فرآیندهای سلولی را افزایش میدهد. miRNAهای بیرون سلولی (گردش کننده در خون) در برابر درمان با ریبونوکلئازها، چرخههای انجماد/ذوب و سایر شرایط آزمایشی شدید، بسیار پایدار و مقاوم هستند (18،19). miRNAهای بیرون سلولی دارای چندین مزیت دیگر به عنوان نشانگرهای زیستی بالقوه هستند: آنها نه تنها در خون بلکه در سایر مایعات بیولوژیکی به راحتی در دسترس هستند (مانند ادرار، بزاق، مایع آمنیوتیک و شیر مادر). آنها را میتوان با روش کمی بسیار حساس و خاص real-time PCR تشخیص داد، و اکثر آنها از نظر تکاملی محافظت میشوند (21-18).

شکل 1: miRNA های موجود در خون با کمپلکسهای پروتئینی مانند Argonaute 2 یا با ذرات HDL همراه میشوند، یا به داخل وزیکولهای متصل به غشا مانند اگزوزومها منتقل میشوند (1). شواهد نشان میدهد که miRNA های بیرون سلولی میتوانند به صورت فعال از طریق مکانیسم های مختلف، از جمله جذب با واسطه گیرنده، اندوسیتوز یا ادغام اگزوزومها با غشای پلاسمایی سلول های دریافت کننده، جذب شوند (2). انتقال miRNA ها بین سلولهای واقع در فاصله دور، یک حالت ارتباطی بالقوه جدید را تشکیل می دهد. مخفف: miRNA ، microRNA [17].
3. MiRNAها به عنوان نشانگرهای زیستی دیابت شیرین نوع 2
ایده استفاده از miRNAهای موجود در خون به عنوان نشانگرهای زیستی نسبتاً جدید است و اولین بار برای تشخیص انواع مختلف سرطان و بیماری خود ایمنی مطرح شد (23،22،18). در حال حاضر با تجزیه و تحلیل مطالعات انجام شده بر روی مشخصات miRNAها در سرم و پلاسما یا سلولهای خونی، رویکردهای جدیدی برای پیشبینی پیشرفت دیابت شیرین ایجاد شدهاست. Zampetaki و همکارانش (24) اولین کسانی بودند که مشخصات بیان miRNA های خون را که مربوط به T2D بود شناسایی کردند. آنها در مطالعه خود نمونههای خون بیش از 800 نفر را که بهطور تصادفی از جمعیت برونک (استان بولزانو، ایتالیا) انتخاب شده بودند، را تجزیه و تحلیل کردند و زیرمجموعه ای از پنج miRNA شامل miR-15a، miR-28-3p، miR-29b، miR-223 و miR-126 را شناسایی کردند که در 80 شرکتکننده با pre-T2D یا T2D اختلال در تنظیم را نشان داد. محتوای miRNA سرم بیماران مبتلا به پیشدیابت و یا افرادی که به تازگی با T2D تشخیص داده شدهاند نیز توسط سایر گروه ها، مورد تجزیه و تحلیل قرار گرفته است. Kong و همکارانش (25) افزایش بیان هفت miRNA مرتبط با دیابت (miR 9،miR 29a ،miR 30d ،miR 34a ،miR 124a ، miR 146a وmiR 375) را در بیماران مبتلا به T2D در مقایسه با بیمارانی که پیش دیابت داشتند یا مستعد ابتلا به T2D بودند را تشخیص دادند. با این حال، هیچ تفاوتی بین افراد دارای تحمل طبیعی گلوکز و افراد مبتلا به پیشدیابت مشاهده نشد، که نشان می¬دهد سطح این miRNAها در سرم برای پیشبینی حساسیت به T2D مناسب نیست. در تحقیقی که در سال 2012 منتشر شد، Karolina و همکاران (26) miRNAهای موجود در خون و اگزوزوم 265 بیمار با شرایط مختلف سلامتی مرتبط با سندرم متابولیک را اندازهگیری کردند. آنها تنظیم افزایشیmiR 27a ، miR 150 ،miR 192 ، miR 320a و miR 375 را در بیماران مبتلا به T2D تشخیص داده و ارتباط قوی بین افزایش سطح گلوکز ناشتا و افزایش سطح miR 27a و miR-320a را مشاهده کردند. این مطالعات پیشگام پتانسیل miRNAها را به عنوان نشانگرهای زیستی برای T2D نشان میدهد. این جستجوی پیشگامانه آینده miRNAs به عنوان نشانگرهای تجاری برای T2D را نشان میدهد. پس از آن، مطالعات مختلف miRNAهای مختلفی از جملهmiR-375 ، miR-126 و miR-23a را به عنوان نشانگرهای تجاری بالقوه برای شناخت T2D در جمعیت عمومی پیشنهاد دادهاند (30-27). در بررسی که Ortega و همکاران در سال 2014 بر روی پروفایل miRNAهای در خون افراد دیابتی انجام دادند متوجه شدند که این miRNAهای mir-222 و mir-126 به ترتیب دارای افزایش و کاهش در بیان را نشان دادند. تیمار افراد با داروی متفورمین باعث کاهش معنادار در mir-222 شد (31). در سال 2014 Lio و همکاران به بررسی بیانmiR-126 در ۳۲۰ فرد دیابتی، پیشدیابتی و سالم پرداختند. میزان بیان این miRNA در خون افراد دیابتی در مقایسه با افراد پیشدیابتی به طور معنادارای کاهش پیدا کرده بود. در این افراد بعد از کنترل رژیمی و ورزش بیان این miRNA افزایش معناداری پیدا کرده بود. همچنین با بررسی قدرت بیومارکری این miRNA متوجه شدند که افراد دیابتی و سالم را با قدرت ۸۲ درصد از هم تمیز میدهد (32). در مطالعهای که Olivieri و همکاران (33) بر روی ۳۸۰ فرد دیابتی و سالم انجام دادند متوجه شدند که بیان miR-126 و miR-21 در افراد دیابتی کمتر از افراد سالم است. هم چنین با بررسی بیان این دو ژن در افراد دارای عارضههای ثانویه دیابت نظیر رتینوپاتی و نفروپاتی، مشخص شد که بیان ژنهای مذکور در این افراد نسبت به افراد دیابتی دارای کاهش بدون عارضه است. همچنین در مطالعهای که سامانیان و همکاران (34) در سال ۲۰۱۹ بر روی سلولهای لنفوسیت خونی افراد دیابتی در ایران انجام دادند، متوجه شدند که mir-15a و mir-126 کاهش پیدا کردهاست. از سوی دیگر، ژنهای هدف این miRNAها، یعنی PRKCB و SP1 با افزایش بیان همراه شدند که باعث افزایش در میزان ناپایداری و شکست دورشتهای DNA میشود. این محققان نتیجه گرفتند که کاهش بیان miRNAهای مذکور نقش مهمی در ایجاد و پیشرفت دیابت از طریق کمک به ایجاد شکستهای دورشتهای میکند. Candia و همکاران با بررسی پروفایل miRNAها در افراد پیشدیابتی و دیابتی متوجه شدند که mir-222 و mir-148 در افراد دیابتی کاهش نشان دادهاند و با میزان HBA1C رابطه مستقیم دارند (35). آقایی و همکاران در سال 2019 با بررسی میزان بیان ژن miR-181b در بیماران مبتلا به دیابت نوع 2 در جمعیت یزد نشان دادند که در میزان بیان این ژن در گروههای سالم و بیمار تحت مطالعه، تفاوت معنیداری وجود دارد (برای افراد سالم fold change = 1/05 ± 0/38و برای افراد پیشدیابتی fold change = 0/34±0/12 (5). بیان کاهشیافته mir-181-b در افراد مبتلا به دیابت نوع دو و پیشدیابتی نسبت به گروه کنترل سالم نشاندهنده این است که mir-181b پتانسیل استفاده به عنوان بیومارکر در دیابت نوع دو را دارا است. صادقزاده و همکاران به مطالعه تاثیر میزان بیان miR-222 و miR-15a در گروههای پیشدیابتی (per-T2D)، دیابتی و سالم پرداختند. بدین منظور، نود نفر از مرکز دیابت یزد که بهطور مساوی شامل افراد سالم، pre-T2D و T2D بودند، انتخاب شدند. میزان بیان miRNA در نمونههای پلاسمای جمعیت مورد نظر با روش PCR Real-time انجام شد. بیان miR-222 در نمونههای pre-T2D بهطور معنیداری در مقایسه با گروه کنترل (0/001>P) تنظیم افزایشی شد، در حالیکه اختلاف معنیداری در افراد pre-T2D نسبت به گروه T2D مشاهده نشد (0/05>P). بیان miR-15a از نظر آماری در گروههای pre-T2D و T2D تنظیم کاهشی داشت (0/05> P) (36).
4. microRNA های عمدهای که در T2D نقش دارند
4-1. miR-375
miR-375 بر روی کروموزوم 2 انسان بین ژنهای CRYBA2 و CCDC108 قرار دارد (37). miR-375 به عنوان miRNA ضروری برای هموستاز طبیعی گلوکز، تکثیر سلولهای β و گردش سلولهای β و α در نظر گرفته میشود. علاوه بر این، به عنوان miRNA سلول جزایر لوزالمعده که، mRNA میوتروفین را هدف قرار میدهد، شناسایی شده است. میوتروفین بهطور فعال در ادغام دانههای ترشحی با غشای سلولی شرکت میکند (38). بنابراین، miR-375 میتواند بهطور مستقل ترشح انسولین ناشی از گلوکز را مهار کند. همچنین، سطح بیان miR-375 به دلیل افزایش قند خون بالا و مرگ سلول β افزایش مییابد، بنابراین سطح بیان miR-375 برای پیشبینی مرگ سلول β مناسب است (39،40). تحقیقات اخیر نشان دادهاست که miR-375 به عنوان یک عامل موثر نقش مهمی در تمایز چربی 3T3-L1 از طریق مسیر سیگنالینگ ERK-PPARγ2-ap2 دارد (41). در مطالعه بالینی که اخیراً منتشر شدهاست، اهمیت miR-375 در بیماران مبتلا به دیابت نوع 2 و بستگان درجه اول آنها با تحمل طبیعی گلوکز (FD-NGT) و افراد مبتلا به T2D بیان شده است. در مقایسه با گروه کنترل، اختلاف معنیداری در بیان miR-375 در گروههای T2D و pre-T2D مشاهده شد و تنظیم افزایشی نشان داد. بنابراین، miR375 به عنوان یک نشانگر زیستی پایدار برای پیشبینی اولیه T2D در بین افراد در معرض خطر میباشد (42).
4-2. miR-200
خانواده miR-200 متشکل از 5 عضو است که رونویسی آنها را میتوان به عنوان 2 پلی سیسترونیک جداگانه pri-miRNA مشاهده کرد. miR200a/b و miR-429 در یک خوشه در کروموزوم 1 قرار دارند، در حالیکه miR-200c و miR-141 بخشی از خوشه دیگر در کروموزوم 12 هستند (43). miR-200یکی از miRNAهای مهم در مسیر پیامرسانی انسولین است که FOG2 را هدف قرار میدهد. miR-200 باعث پیامرسانی صحیح مسیر انسولین شده و از ایجاد اختلال در این مسیر، جلوگیری میکند (44). miR-200b میتواند Zeb1 را هدف گرفته و فعالیت آن را مسدود کند، که منجر به آپوپتوز سلول β میشود. بنابراین ، تغییر بیان miR-200 ممکن است با T2D همراه باشد (45،43).
4-3. miR-126
miR-126، محصول داخلی اینترون ژن Egfl7، که در جایگاه 9q34 واقع شده است. سلولهای اندوتلیال غنی از miR-126 هستند. علاوه بر این، miR-126 با هدف قرار دادن ADAM-9 در افروسیتوز که فرآیند حذف سلولهای آپوپتوتیک توسط سلولهای فاگوسیتی است، نقش مهمی ایفا میکند (46،47). در مطالعهای سطح سرمی miR-126 بیماران دیابتی، پیشدیابتی و افراد غیردیابتی را به عنوان کنترل تجزیه و تحلیل کردند و دریافتند که miR-126 در بیماران دیابتی در مقایسه با افراد پیشدیابتی بهطور قابلتوجهی کاهش یافتهاست. نتایج آن¬ها نشان داد که میزان بیان miR-126 در افراد غیردیابتی بیشتر از 2 گروه قبلی بود (32). بنابراین، سطوح بیان miR-126 ممکن است به عنوان یک نشانگر متمایز کننده بالقوه استفاده شود. با توجه به نتایج، میزان بیان miR-126 نیز میتواند به عنوان نشانگر زیستی مورد استفاده قرار گیرد (48).
4-4. miR-15a
miR-15a بر روی کرموزوم ۱۳ در انسان و در رشته معکوس قرار دارد و دارای جهت رونویسی مشابه با ژن میزبان DLEU2 است. فرم اولیه این ژن دارای ۸۳ جفت باز است. این miRNA در بافتهای زیادی از جمله کبد و چربی بیان میگردد. ساختار ثانویه این ژن در شکل 1 نشان داده شده است (49). تنظیم افزایشی miR-15a با هدف قراردادن فاکتور رشد اندوتلیال عروقی A (VEGFA) که با ایسکمی میوکارد / آسیب مجدد خونرسانی در موش همراه است، آنژیوژنز را در سلولهای پروآنژیوژنیک در شرایط in vitro کاهش میدهد (50). علاوه بر این، مهار miR-15 در سلولهای اندوتلیال عروق مغزی باعث افزایش فعالیت پروآنژیوژنیک در مدلهای حیوانی و مطالعات آزمایشگاهی میشود (51). در مطالعهای گزارش شده است که پس از قرار گرفتن طولانی مدت در معرض گلوکز، با تنظیم miR-15a میتوان بیان ژن انسولین در سلولهای انسولین موش را ارتقاء داد (52). علاوه بر این، کاهش سطح miR-15a در ماهیچههای اسکلتی از بیماران T2D هیپرگلیسمی، نیز در جمعیت دانمارک گزارش شده است (53). نتایج نشان می-دهند که miR-15a یکی از نشانگرهای زیستی جدید برای تشخیص بیماران T2D است.
4-5. miR-222
این ژن بر روی کروموزومX و در رشته ریورس قرار دارد که فرم اولیه و نابالغ آن دارای ۱۱۰ جفت باز است (49). این miRNA در بافتهای زیادی از جمله معده و خون بیان میگردد. بیان غیر طبیعی miR-222 در موارد چاقی، سرطان و آنوکسی مشاهده میشود (56-54). مطالعات نشاندادهاند که بیان miR-221/222 در موشها و افراد مبتلا به کبد چرب تنظیم افزایشی شده است (54). آنها همچنین با شاخص مقاومت به انسولین ارتباط مثبت دارند (55). تحقیقات نشان دادهاند که miR-222 به شدت در کبد موشهای چاق بیان شدهاست و خاموش کردن miR-222 میتواند بیان CAV1 را تنظیم افزایشی کند، حساسیت به انسولین را بهبود بخشد و قند خون را کاهشدهد. CAV1 یکی از پروتئینهای داربست اصلی غشای سیتوپلاسمی است که میتواند گیرندههای انسولین را تثبیت کرده و عملکرد فاکتور رونویسی گلوکز 4 را تقویت کند. با توجه به بیان miR-222، شی و همکاران افزایش در بیان miR-222 در بافتهای آدیپوز امنتال از بیماران مبتلا به دیابت حاملگی در جمعیت چینی مشاهده کردند. Li و همکاران (56) تنظیم افزایشی میزان miR-222 را در نمونههای سرمی زنان T2D در جمعیت چین نشاندادند. علاوه بر این، Tsukita و همکاران نشاندادند که miR-222 ترشح شده از مغز استخوان پس از پیوند مغز استخوان در موش¬های صحرایی دیابتی شده ناشی از استرپتوزوتوسین منجر به بازسازی سلولهای بتا و بهبود هیپرگلیسمی میشود (57). مطالعات انجام گرفته بر روی میزان بیان miR-126 نشان میدهد که این miRNA میتواند به عنوان نشانگر زیستی در دیابت شیرین مورد استفاده قرار گیرد. بنابراین، دیابت قندی منجر به تغییراتی در میزان بیان برخی از miRNAها در خون و مایعات بدن شود و به میتواند به عنوان یک بیومارکر زیستی در تشخیص زودهنگام افراد در معرض خطر ابتلا به دیابت مورد استفاده قرار بگیرد.
جدول 1: miRNAهای گزارش شده در دیابت نوع 2 (T2D)

نتیجهگیری
دیابت قندی یک اختلال متابولیک است و تعداد افرادی که از این سندرم رنج میبرند در سراسر جهان به سرعت در حال افزایش است و منجر به پیامدهای نامطلوب سلامتی و اقتصادی-اجتماعی میشود. از این رو کشف نشانگرهای زیستی جدید برای شناسایی افراد در معرض خطر و در نتیجه مدیریت مناسب آن به شدت مورد نیاز است. جدیدترین روند کشف نشانگرهای زیستی، جستجوی نشانگرهای زیستی حساس است که میتواند برای تمایز افراد مبتلا از همتایان سالم خود، اعمال شود و مراحل مختلف بیماری را مشخص کند. یکی دیگر از مزایای موثر نشانگرهای زیستی، در دسترس بودن آنها است بهطوری که میتوانند به راحتی از مایعات بدن مانند بزاق، ادرار یا خون بهدست آیند. تحقیقات بیشماری ثابت کردهاند که miRNAها در بافتها و انواع مختلف سلول بیان میشوند. علاوه بر این، نقش miRNAها در تنظیم مسیرهای متابولیکی مهم برای تمایز چربی، هموستاز انرژی، متابولیسم چربی، ترشح انسولین و التهاب ناشی از گلوکز اثبات شدهاست. بنابراین، اختلال در تنظیم بیان miRNAها بر انواع عملکردهای مهم سلولی از جمله تنظیم چرخه سلولی، آپوپتوز و تمایز، تأثیر میگذارد و اثر قابلتوجهی در سلامت و توسعه بیماری دارد. یافتههای توصیف شده در این مقالات تأیید میکند که miRNAها نشانگرهای زیستی جدیدی برای دیابت هستند. شناسایی نشانگرهای زیستی جدید میتواند به درک بهتر وقایع پاتوژنز درگیر در دیابت کمککند و همچنین برای تشخیص T2Dدر مراحل اولیه موثر باشد. در واقع، تغییرات در سطح زیر مجموعهای از این مولکولهای RNA کوچک در مایعات بدن، سرنخهای جدیدی برای شناسایی زودهنگام افرادی که در معرض خطر ابتلا به دیابت و عوارض مرتبط با این اختلال هستند را نوید میدهد. بنابراین، اثربخشی آنها در پیشبینی وقوع دیابت یا عوارض ناشی از آن باید بهطور سیستماتیک با نشانگرهای زیستی موجود مقایسه شود. بر اساس دادههای فعلی، miRNAهای بیرون سلولی شاید بتوانند در آینده جایگزین یا مکمل سایر اندازهگیریهای معمول شوند.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Ringborg A, Lindgren P, Martinell M, Yin DD, Schon S, Stalhammar J. Prevalence and Incidence of Type 2 Diabetes and its Complications 1996-2003-Estimates from a Swedish Population‐Based Study. Diabetic Med 2008; 25(10): 1178-86.
2- Taylor KS, Heneghan CJ, Farmer AJ, Fuller AM, Adler AI, Aronson JK, et al. All-cause and Cardiovascular Mortality in Middle-aged People with Type 2 Diabetes Compared with People without Diabetes in a Large UK Primary Care Database. Diabetes Care 2013; 36(8): 2366-71.
3- Kennon B, Leese GP, Cochrane L, Colhoun H, Wild S, Stang D, et al. Reduced Incidence of Lower-Extremity Amputations in People with Diabetes in Scotland: a Nationwide Study. Diabetes Care 2012; 35(12): 2588-90.
4- Gregg EW, Li Y, Wang J, Rios Burrows N, Ali MK, Rolka D, et al. Changes in Diabetes-Related Complications in the United States, 1990–2010. N Engl J Med 2014; 370(16): 1514-23.
5- Aghaei Zarch SM, Vahidi Mehrjardi MY, Babakhanzadeh E, Nazari M, Talebi M, Zeniali F, et al. MiR-181b Expression Levels as Molecular Biomarker for Type 2 Diabetes. J Mazandaran Univ Med Sci 2019; 29(176): 195-201. [Persian]
6- Schulze MB, Weikert C, Pischon T, M. Bergmann M, Al-Hasani H, Schleicher E, et al. Use of Multiple Metabolic and Genetic Markers to Improve the Prediction of Type 2 Diabetes: the EPIC-Potsdam Study. Diabetes Care 2009; 32(11): 2116-9.
7- Müller G. Microvesicles/ Exosomes as Potential Novel Biomarkers of Metabolic Diseases. Diabetes Metab Syndr Obes 2012; 5: 247-82.
8- Bartel DP. MicroRNAs: Genomics, Biogenesis, Mechanism, and Function. Cell 2004; 116(2): 281-97.
9- Chang TC, Mendell JT. MicroRNAs in Vertebrate Physiology and Human Disease. Annu Rev Genomics Hum Genet 2007; 8: 215-39.
10- Poy MN, Eliasson L, Krutzfeldt J, Kuwajima S, Ma XE, Macdonald P, et al. A Pancreatic Islet-specific microRNA Regulates Insulin Secretion. Nature 2004; 432(7014): 226-30.
11- Poy MN, Hausser J, Trajkovski M, Braun M, Collins S, Rorsman P, et al. miR-375 Maintains Normal Pancreatic α-and β-cell Mass. Proc Natl Acad Sci 2009; 106(14): 5813-8.
12- Roggli, E, Gattesco S, Caille D, Briet C, Boitard C, Meda P, and Regazzi R. Changes in microRNA Expression Contribute to Pancreatic β-cell Dysfunction in Prediabetic NOD Mice. Diabetes 2012; 61(7): 1742-51.
13- Roggli, E, Britan A, Gattesco S, Lin-Marq N, Abderrahmani A, Meda P, et al. Involvement of microRNAs in the Cytotoxic Effects Exerted by Proinflammatory Cytokines on Pancreatic β-cells. Diabetes 2010; 59(4): 978-986.
14- Jason DA, Chevillet JR, Kroh ME, Ruf KI, Pritchard CC, Gibson FD, et al. Argonaute2 Complexes Carry a Population of Circulating microRNAs Independent of Vesicles in Human Plasma. Precede National Academy Sci 2011; 108(12): 5003-8.
15- Derrick JG, Ciaudo C, Erhardt M, and Voinnet O. Multivesicular Bodies Associate with Components of miRNA Effector Complexes and Modulate miRNA Activity. Nat Cell Biol 2009; 11(9): 1143-9.
16- Vickers KC, Palmisano BT, Shoucri BM, Shamburek RD, Remaley AT. MicroRNAs are Transported in Plasma and Delivered to Recipient Cells by High-density Lipoproteins. Nature Cell Biology 2011; 13(4): 423-33.
17- Claudiane G, Regazzi R. Circulating microRNAs as Novel Biomarkers for Diabetes Mellitus. Nat Rev Endocrinol 2013; 9(9): 513-21.
18- Kroh EM, Parkin RK, Mitchell PS, Tewari M. Analysis of Circulating Microrna Biomarkers in Plasma and Serum Using Quantitative Reverse Transcription-PCR (Qrt-PCR). Methods 2010; 50(4): 298-301.
19- Patrick SM, Parkin KR, Kroh EM, Fritz BR, Wyman SK, Pogosova-Agadjanyan EL, et al. Circulating microRNAs as Stable Blood-based Markers for Cancer Detection. Prec Natil Acad Sci USA 2008; 105(30): 10513-8.
20- Shlomit G, Meiri E, Yogev Y, Benjamin S, Lebanony D, Yerushalmi N, et al. Serum microRNAs are Promising Novel Biomarkers. PLoS One 2008; 3(9): e3148.
21- Andreas K, Leidinger P, Bauer A, ElSharawy A, Haas J, Backes C, et al. Toward the Blood-Borne miRNome of Human Diseases. Nat Methods 2011; 8(10): 841-3.
22- Xi C, Ba Y, Ma L, Cai X, Yin Y, Wang K, Guo J, et al. Characterization of microRNAs in Serum: A Novel Class of Biomarkers for Diagnosis of Cancer and other Diseases. Cell Res 2008; 18(10): 997-1006.
23- Charles HL, Gal S, Dunlop HM, Pushkaran B, Liggins AP, Pulford K, Banham AH, et al. Detection of Elevated Levels of Tumour‐Associated microRNAs in Serum of Patients with Diffuse Large B‐cell Lymphoma. Br J Haematol 2008; 141(5): 672-5.
24- Zampetaki A, Kiechl S, Drozdov I, Willeit P, Mayr U, Prokopi M, et al. Plasma microRNA Profiling Reveals Loss of Endothelial miR-126 and Other microRNAs in Type 2 Diabetes. Circulation Res 2010; 107(6): 810-7.
25- Kong L, Zhu J, Han W, Jiang X, Xu M, Zhao Y, et al. Significance of Serum microRNAs in Pre-diabetes and Newly Diagnosed Type 2 Diabetes: A Clinical Study. Acta Diabetol 2011; 48(1): 61-9.
26- Karolina DS, Tavintharan S, Armugam A, Sepramaniam S, T Pek SL, TK Wong M, et al. Circulating miRNA Profiles in Patients with Metabolic Syndrome. J Clinic Endocrinol Metab 2012; 97(12): E2271-6.
27- Zhangping Y, Chen H, Si H, Li X, Ding X, Sheng Q, et al. Serum Mir-23a, a Potential Biomarker for Diagnosis of Pre-Diabetes and Type 2 Diabetes. Acta Diabetologica 2014; 51(5): 823-31.
28- Zhang T, Li L, Shang Q, Lv C, Wang C, Su B. Circulating miR-126 is a Potential Biomarker to Predict the Onset of Type 2 Diabetes Mellitus in Susceptible Individuals. Biochem Biophys Res Commun 2015; 463(1-2): 60-3.
29- Noha AR, Sabbah NA, Saad MS. Role of microRNA 126 in Screening, Diagnosis, and Prognosis of Diabetic Patients in Egypt. IUBMB Life 2016; 68(6): 452-8.
30- Chigusa H, Nakatsuka A, Eguchi J, Teshigawara S, Kanzaki M, Katayama A, et al. Identification of Circulating Mir-101, Mir-375 and Mir-802 as Biomarkers for Type 2 Diabetes. Metabolism 2015; 64(4): 489-97.
31- Francisco JO, Mercader JM, Moreno-Navarrete JM, Rovira O, Guerra E, Esteve E, et al. Profiling of Circulating Micrornas Reveals Common Micrornas Linked To Type 2 Diabetes That Change with Insulin Sensitization. Diabetes Care 2014; 37(5): 1375-83.
32- Yang L, Gao G, Yang C, Zhou K, Shen B, Liang H, Jiang X. The role of circulating microRNA-126 (miR-126): a Novel Biomarker for Screening Prediabetes and Newly Diagnosed Type 2 Diabetes Mellitus. Int J Mol Sci 2014; 15(6): 10567-77.
33- Olivieri F, Spazzafumo L, Bonafè M, Recchioni R, Prattichizzo F, Marcheselli F, et al. MiR-21-5p and miR-126a-3p Levels in Plasma and Circulating Angiogenic Cells: Relationship with Type 2 Diabetes Complications. Oncotarget 2015; 6(34): 35372-82.
34- Samanian S, Mozdarani H, Behmanesh M, Nasli-Esfahani E. Association of Intrinsic and Induced Genomic Instability in Peripheral Blood Lymphocytes of Type 2 Diabetes Patients with Expression Level of Genes PRKCB and SP1 and microRNAS (miR-126 and miR-15a-3p). Acta Medica Mediterranea 2019; 35(2): 777-82.
35- Paola DC, Spinetti G, Specchia C, Sangalli E, La Sala L, Uccellatore A, et al. Unique Plasma microRNA Profile Defines Type 2 Diabetes Progression. PLoS One 2017; 12(12): e0188980.
36- Sadeghzadeh S, Dehghani-Ashkezari M, Seifati SM, Vahidi-Mehrjardi MY, Dehghan-Tezerjani M, Sadeghzadeh S, et al. Circulating miR-15a and miR-222 as Potential Biomarkers of Type 2 Diabetes. Diabetes Metab Syndr Obes 2020; 13: 3461-9.
37- Chakraborty C, Priya-DossCG, Bandyopadhyay S, Agoramoorthy G. Influence of miRNA in Insulin Signaling Pathway and Insulin Resistance: Micro‐molecules with a Major Role in Type‐2 Diabetes. Wiley Interdiscip Rev RNA 2014; 5(5): 697-712.
38- Banerjee J, Nema V, Dhas Y, Mishra N. Role of Micrornas in Type 2 Diabetes and Associated Vascular Complications. Biochimie 2017; 139: 9-19.
39- Kato M, Natarajan R. MicroRNAs in Diabetic Nephropathy: Functions, Biomarkers, and Therapeutic Targets. Ann N Y Acad Sci 2015; 1353(1): 72-88.
40- Plaisance V, Waeber G, Regazzi R, Abderrahmani A. Role of microRNAs in Islet Beta-cell Compensation and Failure During Diabetes. J Diabetes Res 2014; 2014: 618652.
41- Ling HY, Wen GB, Feng SD, Tuo QH, Ou HS, Yao CH, et al. MicroRNA‐375 Promotes 3T3‐L1 Adipocyte Differentiation through Modulation of Extracellular Signal‐regulated Kinase Signalling. Clin Exp Pharmacol Physiol 2011; 38(4): 239-46.
42- Wu X, Li Y, Man B, Li D. Assessing MicroRNA-375 Levels in Type 2 Diabetes Mellitus (T2DM) Patients and their First-Degree Relatives with T2DM. Diabetes, Metab Synd Obes 2021; 14: 1445-51.
43- Belgardt BF, Ahmed K, Spranger M, Latreille M, Denzler R, Kondratiuk N, et al. The microRNA-200 Family Regulates Pancreatic Beta Cell Survival in Type 2 Diabetes. Nat Med 2015; 21(6): 619-27.
44- Guo L, Wang J, Yang P, Lu Q, Zhang T, Yang Y. Micro RNA‐200 Promotes Lung Cancer Cell Growth through FOG2‐Independent AKT Activation. IUBMB Life 2015; 67(9): 720-25.
45- Yu T, Lu XJ, Li JY, Shan TD, Huang CZ, Ouyang H, et al. Overexpression of miR-429 Impairs Intestinal Barrier Function in Diabetic Mice by Down-Regulating Occludin Expression. Cell Tissue Res 2016; 366(2): 341-52.
46- Musiyenko A, Bitko V, Barik S. Ectopic Expression of miR-126*, an Intronic Product of the Vascular Endothelial EGF-like 7 Gene, Regulates Prostein Translation and Invasiveness of Prostate Cancer LNCaP Cells. J Mol Med 2008; 86(3): 313-22.
47- Chen H, Miao R, Fan J, Han Z, Wu J, Qiu G, et al. Decreased Expression of miR-126 Correlates with Metastatic Recurrence of Hepatocellular Carcinoma. Clin Exp Metastasis 2013; 30(5): 651-8.
48- Dehghani M, Aghaei-Zarch SM, Vahidi-Mehrjardi MY, Nazari M, Babakhanzadeh E, Ghadimi H, et al. Evaluation of miR-181b and miR-126-5p Expression Levels in T2DM Patients Compared to Healthy Individuals: Relationship with NF-κB Gene Expression. Endocrinol Diabetes Nutr 2020; 67(7): 454-60.
49- Hsu SD, Lin FM, Wu WY, Liang C, Huang WC, Chan WL, et al. miRTarBase: a Database Curates Experimentally Validated microRNA–Target Interactions. Nucleic Acids Res 2011; 39(suppl_1): D163-D9.
50- Sun CY, She XM, Qin Y, Chu ZB, Chen L, Ai LS, et al. miR-15a and miR-16 affect the Angiogenesis of Multiple Myeloma by Targeting VEGF. Carcinogenesis 2013; 34(2): 426-35.
51- Yin KJ, Olsen K, Hamblin M, Zhang J, Schwendeman SP, Chen YE. Vascular Endothelial Cell-specific microRNA-15a Inhibits Angiogenesis in Hindlimb Ischemia. J Biol Chem 2012; 287(32): 27055-64.
52- Rawal S, Munasinghe PE, Nagesh PT, Sheng-Lew JK, Jones GT, Williams MJA, et al. Down-regulation of miR-15a/b Accelerates Fibrotic Remodelling in the Type 2 Diabetic Human and Mouse Heart. Clin Sci 2017; 131(9): 847-63.
53- Houshmand-Oeregaard A, Schrölkamp M, Kelstrup L, Hansen NS, Hjort L, Thuesen ABC, et al. Increased Expression of microRNA-15a and microRNA-15b in Skeletal Muscle from Adult Offspring of Women with Diabetes in Pregnancy. Hum Mol Genet 2018; 27(10): 1763-71.
54- Stinson S, Lackner MR, Adai AT, Yu N, Kim HJ, O’Brien C, et al. TRPS1 Targeting by miR-221/222 promotes the Epithelial-to-Mesenchymal Transition in Breast Cancer. Sci Signaling 2011; 4(177): ra41.
55- Shi Z, Zhao C, Guo X, Ding H, Cui Y, Shen R, Liu J. Differential Expression of microRNAs in Omental Adipose Tissue from Gestational Diabetes Mellitus Subjects Reveals miR-222 as a Regulator of ERα Expression in Estrogen-Induced Insulin Resistance. Endocrinology 2014; 155(5): 1982-90.
56- Li MY, Pan SR, Qiu AY. Roles of Microrna-221/222 in Type 2 Diabetic Patients with Post-Menopausal Breast Cancer. Genet Mol Res 2016; 15(2): 10-4238.
57- Tsukita S, Yamada T, Takahashi K, Munakata Y, Hosaka S, Takahashi H, et al. MicroRNAs 106b and 222 Improve Hyperglycemia in a Mouse Model of Insulin-Deficient Diabetes via Pancreatic β-cell Proliferation. EBio Medicine 2017; 15: 163-72.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







