دوره 29، شماره 11 - ( بهمن 1400 )
جلد 29 شماره 11 صفحات 4254-4230 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Majidpour M, Zahedi Abqari A, Robat-Jazi B, Sargazi S. Epidemiology, Transmission, Clinical Features, Diagnosis, Treatment, and Prevention of COVID19: An Updated Review. JSSU 2022; 29 (11) :4230-4254
URL: http://jssu.ssu.ac.ir/article-1-5412-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5412-fa.html
مجیدپور مهدی، زاهدی عبقری آرمین، رباط جزی بهروز، سرگزی سامان. اپیدمیولوژی، انتقال، مشخصههای بالینی، تشخیص، درمان، و پیشگیری از کووید-19: یک مطالعه مروری به روز شده. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (11) :4230-4254
متن کامل [PDF 1241 kb]
(1079 دریافت)
| چکیده (HTML) (2953 مشاهده)
متن کامل: (2978 مشاهده)
مقدمه
در اواخر دسامبر2019 ذاتالریه مرتبط با کروناویروس جدید در ووهان چین اتفاق افتاد که بعد از آن توجهات جهانی را به خود جلب کرد (3-1). 7 ژانویه کروناویروسجدید جداسازی شد و 12 ژانویه به طور رسمی به سارسکروناویروس2 یا (2019-nCoV or SARS-CoV-2) نامیده شد و توالییابی کامل ژنوم آن با سازمان جهانی بهداشت(World Health Organization) یا WHO به اشتراک گذاشته شد (1). به طور کلی در دهه اخیر شاهد پاتوژنهای تهدیدکننده انسانی زیادی بودیم از جمله ویروس نیپا (Nipah virus)، بیماری ویروسی ابولا (Ebola virus disease)، ویروس چیکونگونیا (Chikungunya)، ویروس زیکا (Zika virus)، کروناویروس سندرم تنفسی خاورمیانه(Middle East respiratory syndrome coronavirus) یا MERS-CoV، کروناویروس سندرم تنفسی حاد (Severe acute respiratory syndrome coronavirus) یا SARS-CoV و سارسکروناویروس2 (4). SARS-CoV و MERS-CoV پاتوژنهای بین انسان و حیوان هستند که میتوانند بیماریهای شدید حاد تنفسی در انسان ایجاد کنند (5). مطالعات گذشته ویژگیهای اپیدمیولوژیک و کلینیکی کووید-19 را گزارش کردند اما با توجه به انتشار سریع مطالب از سراسر دنیا، مرورهای انجام شده یا جامعیت کافی را نداشته و یا اطلاعات جدیدتر را در برنمیگیرد. طبق اطلاعات بهدست آمده تحقیقات روی کووید-19، در وبسایتها و ژورنالهای مختلف حدود 4 درصد از تحقیقات جهانی در سال 2020 را شامل میشود. البته در این سال مقالات ارسال شده به مجلات مختلف در تمام موضوعات علمی نیز افزایش چشمگیری داشته است. شاید به این دلیل که بسیاری از محققان در این دوران مجبور به ماندن در خانه بوده و تمرکز بیشتری در نوشتن مقالات داشتهاند (6). این بیماری به سرعت تمام جنبههای زندگی بشری از جمله تغییرات جمعیتی، اقتصاد، مشاغل و نیز تغییرات اجتماعی را تحت تاثیر خود قرار داد (9-7). لذا به همین سبب برآن شدیم تا مروری بر آخرین مطالعات این حوزه با نگاهی جامع از ابتدا تا اواسط جولای 2021 داشته باشیم تا در اختیار علاقهمندان قرار بگیرد و کمکی باشد برای پرسنل پزشکی که در خط مقدم مدیریت بالینی این پاندمی هستند. در اینجا، ما بهطور جامع اپیدمیولوژی، ویروسشناسی، روشهای انتقال، مشخصههای بالینی، یافتههای آزمایشگاهی، و جهشهای شایع بیماری کووید-19 را توسط جستجو در پایگاههای اطلاعاتی از جملهPubMed, Scopus, Google scholar وBioRxiv مرور کردیم.
1-اپیدمیولوژی و آغاز سارسکروناویروس2
با بررسی دینامیک انتقال اولیه، ذاتالریه ایجاد شده با سارسکروناویروس2 در ووهان چین نشان داده شد که اولین مورد آن در دسامبر 2019 اتفاق افتاده است. همچنین شواهدی وجود دارد مبنی بر انتقال انسان به انسان بین کسانی که ارتباط نزدیک داشتهاند (10). با طراحی درخت فیلوژنیک نشان داده شد که سارس¬کرونا¬ویروس2 بهطور معناداری از توالی کروناویروس شبه سارس خفاش جدا شده است که توالی آن در سال 2015 در چین از خفاش Rhinolophus sinicus شناسایی شده بود که آنالیز ساختاری وجود یک جهش را در گلیکوپروتئین خارهای اتصالی نشان داده است (11). خفاشها تقریباً برای 30 کروناویروس که ژنومشان توالییابی شده است میزبان هستند (12). نتایج بهدست آمده از آنالیزها نشان میدهد که سارسکروناویروس2 احتمالاً یک ویروس نوترکیب (در گلیکوپروتئین خارهای اتصالی ویروس) است بین کروناویروس خفاش و یک کروناویروس که منشا نامشخص دارد. سارسکروناویروس2 شبیهترین اطلاعات ژنتیکی را نسبت به کروناویروس خفاشها دارد و به نظر میرسد یک نوترکیبی هومولوگ به انتقال بین گونهای سارسکروناویروس2 کمک کرده است (13). طبق مطالعات بر اساس توالی ژنتیکی ویروس سارسکروناویروس2 (کمیته بینالمللی طبقهبندی ویروسها (International Committee on Taxonomy of Viruses) یا ICTVنام سارسکروناویروس2 را پیشنهاد داد (14,15). این فرضیه مطرح شده است که این ویروس به صورت مستقیم از طریق خفاش به انسانها منتقل شده است و پس از جهش و تکامل در بدن انسان به اوج قابلیت انتقال و بیماریزایی خود رسیده است (16,17). هرچند خفاشها به عنوان مخزن ویروس معرفی شدهاند اما میزبان حد¬واسط که انتقال به انسان را ممکن کرده ناشناخته بود که مطالعات جدید نشان میدهد عامل انتقال سارسکروناویروس2 به انسان، پنگولینهایی بودهاند که از مالزی به چین قاچاق شده بودند (18). گزارش WHO از ووهان چین نیز بیان میکند که احتمالاً منشا سارسکروناویروس2 مرتبط با یک حیوان است و به شدت غیرمحتمل است که منشا آن ناشی از یک اشتباه آزمایشگاهی باشد ضمن اینکه در مطالعهای شواهد مولکولار و سرولوژیک از سارسکروناویروس2 را در خفاشها در جنوبشرقآسیا (تایلند) نشان داده است (19). این ویروس با سرعت انتقال بالا تاکنون با ابتلای بیش از 190 میلیون نفر تمام جهان را به خود درگیر کرده است و بیش از 4 میلیون نفر مرگ را نیز به ثبت رسانده است.
2-ویژگیهای سارسکروناویروس2 و راههای انتقال آن
کروناویروس یک ویروس RNA دار است و با عفونتهای حاد تنفسی در انسان مرتبط است ولی توانایی آن در آلوده کردن میزبآنها از گونههای دیگر و ایجاد چندین نوع بیماری به عنوان یک پاتوژن پیچیده تبدیل شده است (20). این ویروس به 2 نوع عمده (Strain) به نامهای L و S تکامل پیدا میکند که نوع L شایعتر و تهاجمیتر است ولی نوع S نسخه قدیمیتر یا نیایی (Ancestral version) است (21). سارسکروناویروس2 به آنزیم مبدل آنژوتانسین2 (Angiotensin-converting enzyme2) یا ACE2 باند میشود و از پروتئاز تراغشایی، سِـرین۲ (Transmembrane protease,-serine2) یاTMPRSS2 برای ورود استفاده میکند (22). آنالیز توالییابی برحسب جفت باز نشان داد که کروناویروس شبه سارس خفاش نزدیکترین ویروس به سارسکروناویروس2 بوده (88 درصد شباهت نوکلئوتیدی)، در نتیجه عضو جدیدی از خانواده بتا کروناویروس است (23,24). همچنین سارسکروناویروس2 به سلولهای میزبان از طریق پروتئین خارهای اتصالی و گیرنده CD147 تهاجم میکند (25,26). برای تایید این اتصال در شرایط In-vitro از یک آنتیبادی ضد گیرنده CD147 به نام مپلازوماب -(Meplazumab) استفاده شد که بهطور چشمگیری باعث مهار تهاجم ویروسها به سلول میزبان شد (25). انتقال کروناویروس بیشتر از طریق قطره تنفسی (Respiratory droplet) است و به صورت کمتر توسط آئروسل (Aerosol)، سوسپانسیون کلوئیدی ذرات جامد یا مایع پخش شده در گاز یا معلق در گاز، و انتقال Fomite (انتقال بیماری های عفونی با اشیاء) است (27). طی تنفس، توالت رفتن و تماس با Fomites بهطور مستقیم و غیرمستقیم منتقل میشود (28). انتقال مستقیم میتواند از طریق استنشاق قطره در هنگام سرفه یا عطسه بیمار باشد (29,30). رعایت فاصله اجتماعی با فرد سرفهکننده در کاهش حجم قطرات و همچنین بار ویروسی رسوب شده بر فرد مقابل موثر است (31). ضمناً مبتلایان به نقص ایمنی دستکم تا 2 ماه ویروسکرونا را پخش میکنند. محققین با انجام کشت سلولی در این بیماران که عمدتاً تحت شیمیدرمانی بودند توانستند ویروس زنده را تا 61 روز پس از آغاز علائم بالینی از نمونههای ماسک آنان جدا کنند. آزمایش ژنتیک نشان داد ویروس جدا شده از ماسک پس از 61 روز همان ویروسی است که بیمار را در ابتدا مبتلا کرده بود و این به معنی عفونت پایدار است (32).
3-مشخصههای بالینی و بیماریهای مرتبط
بیماریزایی سارس و مرس و سارسکروناویروس2 محدود به ریه نیست (33). چرا که گیرنده ACE2 در بافتهایی مثل قلب، توبولهای کلیه، سطح لومینال روده کوچک و رگهای خونی هم بیان میشود (37-34). از پیامدهای کشنده این بیماری میتوان به نارسایی تنفسی، سندرم زجر حاد تنفسی (Acute respiratory distress syndrome) یا ARDS، ذاتالریه و آسیب به قلب اشاره کرد (40-38). بیمارانی که ابتلا آنها به کووید-19 با Real-time RT-PCR و Next-generation sequencing یا NGS (41) تایید شده غالباً بیماری زمینهای از جمله دیابت، فشار خون و بیماریهای قلبی عروقی داشتند در آنها علایمی مثل تب، سرفه و خستگی و علایم با بروز کم مثل تولید خلط، سردرد و اسهال وجود داشت (38). این احتمال که کووید-19 به تنهایی میتواند باعث آسیب به سلولهای بتا پانکراس بهطور مستقیم شود نیز وجود دارد (42). براساس مطالعات ترکیب میکروبهای روده و مدفوع (میکروبیوم) با شدت کووید-۱۹ و غلظت پلاسمایی چندین سایتوکاین التهابی و شاخص خونی نشان دهنده آسیب بافتی، مطابقت دارد. تغییر در میکروبیوم بعد از پاک شدن سارس¬کروناویروس2 باز هم باقی میماند (43). شایعترین علائم بالینی کووید-۱۹ تب، سرفه و درد ماهیچه و یا خستگی و یافتههای آزمایشگاهی شامل لنفوپنی (0.93x109/L) و پروتئین واکنشگرC (C-Reactive Protein) یا CRP غیر-نرمال (33.72mg/dL) بودهاند (44). مطالعات نشان دادند بیمارانی که بالای60 سال داشتند علایم بیشتری مثل لنفوپنی، ترومبوسیتوپنی، و افزایش سطح CRP و لاکتات دهیدروژناز داشتند (29). بررسیهای بیشتر، افزایش CRP و سرعت رسوب گلبول قرمز ((Erythrocyte Sedimentation¬Rate یا ESR را نشان میداد و همچنین با بررسی تصویرCT علایمی همچون کدورت شیشه ماتی (Ground-glass opacification/opacity) یا GGO، رگههای فیبروزی (Fibrotic streaks)، خط شفاف زیر شامهای (Subpleural transparent line) و ششهای ضخیم مشاهده شد (45). در ادامه بررسی شیوع این ویروس روی کودکان انجام شد که باتوجه به تعداد گزارش شده مبتلایان، شمار نوزادان مبتلایِ شناسایی شده کم بود. شاید علت این امر احتمال پایینِ در معرض قرارگیری و یا عدم شناسایی کامل آنها بهدلیل داشتن علائم خفیف و یا نداشتن علائم باشد، نه مقاومت به این بیماری (46,47). اثبات شده است که کودکان حتی در صورت عدم بروز علائم بیماری میتوانند برای هفتهها (دو الی سه) ویروس سارس¬کرونا¬ویروس2 را در بینی و گلوی خود حفظ کنند و باعث انتقال ویروس به سایر افراد شوند (48). مطالعات نشان دادند که حداقل یک سوم موارد عفونت کووید-۱۹ بدون علامت هستند. همچنین تقریباً سه چهارم افرادی که در زمان تست PCR، بدون علامت بودهاند، در پیگیری به همین شکل بدون علامت باقی ماندهاند (49). در مجموع بیشترین علائم گزارش شده در بیماران کووید-۱۹ تب یا لرز، سردرد، درد در عضلات یا بدن، سرفه خشک، خستگی، تنگی نفس، کاهش لکوسیتها و شواهد رادیوگرافی ذاتالریه و علائم کمتر گزارش شده شامل اسهال، آبریزش بینی، آسیب کبدی، آسیب کلیه، حالت تهوع و استفراغ و علائم لنفوپنی و ترومبوسیتوپنی است. علائم از 2 تا 14 روز پس از مواجهه با ویروس شروع میشود (53-50, 38).
4-تشخیص
4-1-سنجشهای مبتنی بر تشخیص اسید نوکلئیک
این ویروس در نمونههای بالینی با NGS، Real-time RT-PCR، کشت سلولی و میکروسکوپ الکترونی شناسایی شده است (39,54). اگرچه RT-qPCR مناسب شناسایی است اما گاهی اوقات میتواند به دلیل آلودگی نمونه یا نقص فنی، نتایج منفی کاذب ایجاد کند که به دلیل پیامدهای شدید تشخیص نادرست در مورد کووید-۱۹، نمیتوان این مسائل را نادیده گرفت (55,56). شناسایی خارج ریوی RNA این ویروس نیز الزاما به معنی وجود ویروس در آنها نیست و اهمیت بالینی تشخیصی این ویروس خارج از مجرای تنفسی نامشخص است (57). شواهد حضور این ویروس شامل شناسایی در مایع شستشوی ریوی، PCR مستقیم و کشت سلول بود. در 3 بیمار که توالییابی کامل برای ژنوم انجام شده بود، بر پایه آنالیز ژنوم بهدست آمده از این مطالعه چندین آنالیز حساس و اختصاصی را طراحی کردند که ORF1ab و نواحی N و E این ویروس را هدف قرار دادند تا RNA آن را در نمونههای بالینی شناسایی کنند (39,58).
4-2-¬سیتی اسکن ریه (Chest Computed-Tomography)
با توجه به اینکه بیماران علائم ذاتالریه را در مراحل اولیه عفونت تجربه میکنند (59) سیتی اسکن ریه در تشخیص عفونت کووید-۱۹ اختصاصیت بیشتری نسبت به RT-qPCR دارد (60).
4-3-سنجش سرولوژی و ایمونولوژیک
برای تشخیص کسانی که در حال حاضر آلوده هستند یا قبلاً به سارسکروناویروس2 آلوده شدهاند وجود آنتیبادی IgM و IgG را ارزیابی میکنند (61). افرادی که مبتلا به کووید-۱۹ با علایم خفیف بودند، در بررسی سه ماه بعد از بروز علایم دارای سلولهای ایمنی خاطرهای لنفوسیتT و لنفوسیتB اختصاصی، آنتیبادی IgG اختصاصی و پلاسمای خنثیکننده علیه کووید-۱۹ بودهاند (62). این ارزیابی از اختصاصیت خوبی برخوردار نیست و با گسترش تستهای اختصاصی و ارزان قیمت، کمتر توصیه میشود.
4-4-دیگر روشهای تشخیص
مطالعات ضمن بیان افزایش احتمال پخش شدن سارسکروناویروس2 از طریق مدفوع نشان دادند که تست مدفوع میتواند 5 هغته بعد از منفی شدن سایر تستها ابتلای افراد را ثابت کند پس به این جهت این ویروس میتواند زیستپذیر باشد و برای چند روز در محیط باقی بماند (41). همچنین در پژوهشها استفاده از نمونه بزاق بهعنوان روش ارزانتر و با حساسیت قابل قبول (به جای نمونه سواب حلق بینی) در اکثر جمعیتها مطالعه شده است (63).
5-کووید-۱۹ و آنفولانزا
علیرغم تنوع در علایم کووید-۱۹ بیشتر بیماران تب و علایم تنفسی دارند که در مقایسه با آنفولانزا باید به تاریخچه بیمار رجوع کرد که آیا به مناطق اپیدمی واریانتهای جدید ویروس سفر داشته است یا نه (64). از تفاوتهای میان آنفولانزا و کووید-۱۹ در مورد چهره بالینی مشخص شد که کودکان مبتلا به کووید-۱۹ در مقایسه با آنفولانزا، سن بالاتری داشتهاند. همچنین احتمال وجود تب، اسهال، استفراغ، سردرد و درد قفسه سینه در کووید-۱۹ بیشتر بوده است. احتمال وجود بیماری زمینهای نیز در کووید-۱۹ بیشتر بوده است (65). بر این اساس مطالعهای با مقایسه درصد مرگ و میر در بیماران مبتلا به کووید-۱۹ و آنفولانزا بستری در ICUدریافتند که فارغ از سن، جنس، بیماریهای همزمان و شرایط در زمان بستری(SOFA score-The Sequential Organ Failure Assessment)، بیماران مبتلا به کووید-۱۹ شدید در مجموع دو برابر احتمال مرگ در بیمارستان دارند (66). با مطالعهای روی جمعیت ایتالیا نشان داده شد در مواردی که میزان واکسیناسیون آنفلوانزا بیشتر بود، مرگ کمتری از کووید-۱۹ رخ داد (67).
6-اختلالات روانشناختی
نگرانیها از کووید-۱۹ منجر به اضطراب، استرس و افسردگی عمومی شده است (68). که بهطور خاص مقیاس بالای بیماری عفونی کادر درمان را تحت فشار فیزیکی و روانی قرار داده است (69). به همین جهت برنامه مداخله روانشناختی طراحی شد که عمدتاً حوزههای مداخله روانی با ایجاد دورهای آنلاین ویژه کادر درمان و ایجاد تیم حمایتی با وظیفه راهنمایی و نظارت به مشکلات روانشناختی آنها را پوشش میداد. اجرای این خدمات مداخلهای روانی با مشکلاتی روبهرو است، مثلا کادر درمان تمایلی برای شرکت در این گروه¬ها را ندارند و پرستارهایی هم هستند که با وجود علایم پریشانی روانی و هیجان و بیقراری تمایلی برای استراحت کردن ندارند. از دلایل امتناع آنها میتوان به موارد زیر اشاره کرد¬: ابتلا به این بیماری نگرانی اصلی برای آنها نبود و نگرانی اصلی برای خانوادههای آنها بود که این ویروس به آنها منتقل نشود و اینکه کارکنان نمیدانستند که چطور با ترس و عدم آگاهی بیماران که منجر به عدم تمایل به قرنطینه یا همکاری با اقدامات پزشکی میشود رفتار کنند. همچنین کارکنان نگران کمبود تجهیزات محافظی بودند و در برابر بیمارانی که در سطح بحرانی از بیماری قرار داشتند احساس ناتوانی میکردند (70). این وضعیت بحرانی بیمارستانها در کادر درمان باعث مشکلات سلامت روانی شده که می¬توان به استرس، اضطراب، افسردگی، بیخوابی و عصبانیت که این مشکلات تمرکز کادر درمان و قدرت تصمیمگیری آنها را تحتتاثیر قرار میدهد اشاره کرد که حتی میتواند اثرات ماندگار داشته باشد. تیمهای مداخلهگر روانشناختی که به بیمارستان فرستاده شدند شامل 4 تیم بودند؛ تیم پاسخ روانی شامل مدیران و روسای روابط عمومی با وظیفه مدیریت، تیم حمایت فنی شامل کارشناسان ارشد مداخله روانی با وظیفه راهنمایی و نظارت و فرموله کردن مداخلات، تیم پزشکی مداخلهگر روانشناختی شامل روان پزشک و تیم ویژه حمایت روانی شامل داوطلبهایی با وظیفه آموزش از راه دور (تلفنی) که آموزش حمایت روانی را دریافت کرده بودند (71). همچنین در مدلهای طراحی شده، کووید-۱۹ روی امید به زندگی نیز اثرگذار بود که میزان آن در ایالات متحده آمریکا کاهش 13.1 سال در 2020 را نشان می داد که این مقدار برای سیاهپوستان و لاتینها 3 تا 4 برابر بیشتر از سفیدپوستان بود (72). اختلالات شدید روانی، با افزایش خطر ابتلا به سندرم حاد تنفسی و مرگ و میر ناشی از کووید-۱۹ نیز در ارتباط است (73).
7-واریانتهای جدید
از واریانت مهم شناسایی شده ویروس بیماری کووید-۱۹ که هرکدام جهشها و حذف های مختلفی را شامل میشوند میتوان به موارد زیر اشاره کرد :
7-1-واریانت آلفا یا B.1.1.7:
با نام دیگر 20I/501Y.V1 یا VOC-202012/01 به عبارتی دیگر سال 2020، ماه 12و واریانت 01 ¬تشخیص داده شده در سپتامبر 2020 در انگلستان که یکی از جهشها در واریانتB.1.1.7 جهش در محل دمین گیرنده اتصالی (Receptor binding domain) از نوع N501Y در ناحیه اسپایک ویروس است که در ناحیهای است که این پروتئین به گیرنده سلولی متصل می¬شود. بهطور تئوری تغییرات در این قسمت ممکن است باعث مسریتر شدن ویروس و راحتتر شدن انتشار آن در بین جمعیت شود (74). فعلاً شواهدی که نشان دهد این واریانت روی تاثیرگذاری واکسن اثری دارد، وجود ندارد (78-75). مطالعات نشان داده است که جهش N501Y (در واریانت انگلیسی) تغییرات زیادی در اسپایک ایجاد نکرده است و توسط سرم افرادی که قبلاً به کووید-۱۹ -مبتلا شدهاند خنثی میشود (79). این واریانت تفاوتهایی در سرفه و گلودرد و خستگی و درد عضلانی و تب داشت که در افراد مبتلا به این واریانت بیشتر دیده میشود. در حالی که از دست دادن حس بویایی و چشایی به شکل معناداری کمتر رخ میدهد (81،80). در گزارشهای جدید تخمین زده شده است که مسری بودن این واریانت بین 43 تا 90 درصد نسبت به واریانتهای دیگر بیشتر است (82,83).
7-2-واریانت بتا یا B.1.351 :
با نام دیگر 20H/501Y.V2 یا (VOC-202012/02) به عبارتی دیگر سال 2020، ماه 12 و واریانت 02 تشخیص داده شده در دسامبر 2020 در آفریقای جنوبی که با داشتن جهش-N501Y، جهش E484K نیز در این واریانت دیده شده که گفته میشود ممکن است روی خنثیسازی توسط آنتیبادی-های پلیکلونال و مونوکلونال نیز اثر بگذارد. فعلاً شواهدی که نشان دهد این واریانت روی شدت بیماری موثر باشد وجود ندارد (76,84,85).
7-3-واریانت گاما یا B.1.1.28:
با نام دیگر P.1 یا VOC-202101/02 به عبارتی دیگر سال 2021، ماه 01 و واریانت 02 تشخیص داده شده در ژوئن 2021 در توکیوی ژاپن، 17 جهش و سه حذف دارد و جهشهای E484K (فرار از آنتیبادیهای خنثیکننده) و N501Y (بیشتر کردن سرایت) را نیز دارد. شواهدی وجود دارد که برخی جهشهای این واریانت احتمالاً میتواند روی توانایی آنتیبادیهای تولید شده ناشی از عفونت قبلی (مانائوس برزیل) یا ناشی از واکسیناسیون برای تشخیص یا خنثیسازی ویروس اثر بگذارد (76,84,86,87).
7-4-واریانت دلتا یا B.1.617.2:
با نام دیگر G/478K.V1 در می2021 در هند شناسایی شد. واریانت دلتا مسریترین نوع ویروس بین واریانتهای شناسایی شده میباشد که در حال حاضر بزرگترین تهدید برای کنترل پاندمی کرونا در جهان محسوب میشود. واریانت دلتا بسیار سریعتر از سویه اصلی ویروس و نوع آلفا که در انگلیس شناسایی شد انتقال و گسترش مییابد (88,89). شواهد نشان میدهند که واریانت دلتا 40-60 درصد بیشتر از نوع آلفا قابلیت سرایت دارد (90,91). این سرایت پذیری بالاتر بخاطر جهشهای T478K و P681R و L452R است (92). میزان بستریها نیز حدوداً 85.1 برابر بیشتر از آلفا است (93,94). اگرچه در برخی مطالعات، تأثیرپذیری دلتا برای واکسن کمی کمتر از سایر واریانتها میباشد (95,96)، اما همچنان به نظر میرسد واکسن میتواند تا حد زیادی از شدت ابتلا در این واریانت جلوگیری نماید (96). با همه این موارد باید پذیرفت که بهترین استراتژی جهت مقابله با این واریانت، تسریع و تداوم واکسیناسیون (97,98)، استفاده از ماسک، رعایت فاصله فیزیکی و اجرای دیگر اقدامات کنترلی است. اخیرا هند واریانت دلتا پلاس (AY.1) را هم به دسته واریانتهای نگرانکننده اضافه کرده است و اعلام کرده که سرعت انتقال بیشتر و مقاومت بیشتر به برخی آنتیبادیهای مونوکلونال دارد. این واریانت جهش K417N را نیز در پروتئین اسپایک دارد که در واریانتهای بتا و گاما هم دیده میشود. البته هنوز داده کافی برای این موضوع وجود ندارد.
8-درمان با مداخلات دارویی و غیردارویی
8-1-مداخلات غیردارویی
در مطالعهای اثربخشی مداخلات غیردارویی (Nonpharmaceutical Interventions) یا NPIs دولتها در کاهش شیوع کووید-۱۹ ارزیابی شد بدین صورت که اثر به کارگیری 6068 مداخله غیر دارویی درکنترل بیماری کووید-۱۹ در 79 کشور بر شاخص Rt (معیار اندازهگیری سرعت انتشار بیماری که مقادیر بالاتر از یک به معنای افزایش عفونت و پایین تر از یک به معنای کاهش آن است) در ماههای مارس و آوریل 2020 (زمانی که اروپا و بسیاری از ایالتهای آمریکا موج اول پاندمی را تجربه میکردند) مورد بررسی قرار گرفت. در این مطالعه فاصلهگذاری اجتماعی و محدودیتهای ترددی به عنوان مهمترین شاخص تمام مداخلات غیردارویی شناخته میشود. همچنین برقراری محدودیتهای مرزی از جمله اقدامات موثر ارزیابی شد. نتایج مطالعه نشان داد که هیچ راهکار واحدی متناسب با همه جوامع وجود نداشته و هیچ مداخله غیردارویی به تنهایی نمیتواند شاخص Rt را به زیر یک کاهش دهد (99).
8-2-مداخلات دارویی
Remdesivir8-2-1-
تحقیقات اخیر نشان داده است که رمدسیویر (Remdesivir) یک درمان بالقوه برای درمان کووید-۱۹ است، بهطوری که در ایالات متحده (ایالت واشنگتن) با تجویز وریدی رمدسیویر و سایر داروهای ضدویروسی مثل ریتوناویر (Ritonavir) (100) درمان اتفاق افتاد به شکلی که علائم را کاهش داد و هیچ عارضه جانبی ایجاد نکرد (57). البته ویروسهای دارای RNA پلیمراز جهش یافته اغلب مقاومت نسبی در برابر رمدسیویر ایجاد میکنند (101,102). رمدسیویر در حال حاضر در فاز 3 آزمایشهای بالینی در ایالات متحده آمریکا است اما در اول می سال 2020، سازمان غذا و دارو (Food and Drug Administration) یا FDA مجوز استفاده اضطراری از آن را برای درمان بیماران کووید-۱۹ صادر کرد (105-103).
Lopinavir/Ritonavir8-2-2-
مطالعات نشان داده است که لوپیناویر (Lopinavir) و ریتوناویر در برابر ویروسهای SARS و MERS موثر هستند (106). اما با آزمایش بالینی ترکیبی دو داروی لوپیناویر و ریتوناویر روی بیماران کووید-۱۹ شدید مشخص شد که درمان ترکیبی این داروها اثرات مثبت قابلتوجهی ندارد (107).
Aplidin8-2-3-
مطالعه آزمایشگاهی نشان داده است که قدرت داروی Aplidin با نام دیگر پلیتیدپسین (Plitidepsin)علیه کووید-۱۹ بیست و هفت و نیم برابر بیشتر از رمدسیویر میباشد. از طرفی تاثیر دارو بر کاهش میزان تکثیر ویروس در ریه مدل موش به اثبات رسیده است. همچنین در مطالعهای دیگر مشخص شده است که دارو علیه واریانت B.1.1.7 نیز موثر است. مطالعه فاز دوم این دارو علیه کووید-۱۹ به اتمام رسیده است و هم اکنون در شروع فاز سوم میباشد (108).
Favipiravir8-2-4-
فاویپیراویر یک آنالوگ نوکلئوزیدی است که پلیمراز ویروسی را مهارکرده و از روند تکثیرRNA ویروسی جلوگیری میکند (109). مطالعات نشان داده است که فاویپیراویر باعث کاهش بار ویروسی (Viral load) در دستگاه تنفسی فوقانی و ریهها میشود (110).
Nelfinavir8-2-5-
مطالعات in-vitro نشان داده است که نلفیناویر -(Nelfinavir) از تکثیر سارسکروناویروس2 جلوگیری میکند و دارویی امیدوار کننده برای درمان عفونت ناشی ویروس کرونا است (111).
Hydroxychloroquine8-2-6-
هیدروکسیکلروکین، آزاد شدن برخی از سیتوکینها مانند اینترلوکین1 (Interleukin¬1) یا IL-1 و ¬فاکتور نکروز توموری آلفا (Tumor necrosis factor alpha) یا TNFα را کاهش میدهد و به این طریق در کاهش التهاب موثر است. هیدروکسیکلروکین با مهار گلیکوزیلاسیون انتهایی گیرنده ACE2 مانع از ورود ¬سارس¬کروناویروس¬2 و عفونت و پیشرفت بیماری میشود (112). هیدروکسیکلروکین به عنوان یک دارو در پیشگیری و درمان مستقیم بیماران کووید-۱۹استفاده میشود، اما اخیراً برخی عوارض جانبی منفی مانند ایست قلبی و آریتمی گزارش شده است (115-113). مشاهدهای گذشتهنگر در بیماران سرپایی کووید-۱۹ و نوع خفیف با حجم نمونه محدود نشان داده است که استفاده از هیدروکسیکلروکین میتواند منجر به کاهش میزان بستری شود (116). معاینات بالینی دقیق هنوز برای تأیید اثرات هیدروکسیکلروکین بر بیماران کووید-۱۹ در جریان است.
Vitamin C and D8-2-7-
ویتامین C (VC) با تحریک تولید اینترفرون، تحریک تکثیر لنفوسیتها و افزایش توانایی فاگوسیتیک نوتروفیل، ایمنی بدن را افزایش میدهد (119-117). VC میتواند علائم بالینی را در بیماران مبتلا به کووید-۱۹ بهطور قابلتوجهی بهبود ببخشد با این حال، هیچ تاثیری در مرگ و میر نداشت. برای ارزیابی بیشتر نقشVC در درمان کووید-۱۹ به مطالعات گستردهتری نیاز است (120). ویتامین D نیز در حال حاضر به عنوان تعدیلکننده (Modulator) سیستم ایمنی برای درمان کووید-۱۹ تحت آزمایشات بالینی قرار دارد (123-121). -تیمی تحقیقاتی از اسرائیل در یک مطالعه بزرگ نشان دادهاند که کمبود ویتامینD کمتر از ng/mL30، شانس ابتلا به عفونت کووید-۱۹و شانس بستری به علت کووید-۱۹ را به ترتیب 45.1 و 95.1 برابر میکند (124). در مطالعهای دیگر اثر دوز بالای مکمل زینک و VC روی طول مدت علائم در 214 بیمار سرپایی کووید-۱۹ بررسی شده است که طی آن نشان داده شد میانگین تعداد روزهایی که بیماران طی آن کاهش 50 درصدی در میزان علائم خود داشتهاند، در گروه زینک، ویتامین سی، زینک + ویتامین سی و گروه درمان معمول به ترتیب 9.5، 5.5 ، 5.5 و 7.6 بوده است که بین چهار گروه از این نظر تفاوت آماری معناداری وجود نداشته است. در نتیجه احتمالاً درمان با زینک و ویتامین سی بهصورت قابلتوجهی روی علائم کووید-۱۹ اثری ندارد (125).
EIDD-28018-2-8-
مطالعات آزمایشگاهی نشان میدهد که داروی EIDD-2801 یا مولنوپیراویر (Molnupiravir) بعد از فقط دو روز استفاده توانسته به شکل قابلتوجهی باعث کاهش وایرال لود و جلوگیری از تکثیر سارسکروناویروس2 شود و در نتیجه احتمالاً میتواند در پیشگیری قبل از مواجهه و درمان کووید-۱۹ موثر باشد. این دارو در حال حاضر توسط شرکت Merck در حال بررسی در مطالعات فاز¬ II–III میباشد (17).
Ivermectin8-2-9-
ایورمکتین داروی ضدانگلی با طیف گسترده، بیخطر برای مصارف انسانی و تأیید شده FDAمیباشد که فعالیت ضدویروسی آن در برابر سارسکروناویروس2 در شرایط آزمایشگاهی ثابت شده است (126). بر اساس مطالعهای با نام IVERCOR-COVID19 روی مبتلایان غیربستری در آرژانتین مشخص شده است که آیورمکتین در کمتر کردن میزان بستری موثر نیست (127). اما در مطالعهای متاآنالیز نشان داده شد که استفاده از آیورمکتین میتواند باعث کاهش مارکرهای التهابی مثل CRP، دی دایمر و فریتین شود (128). چالشهایی پیرامون استفاده از ایورمکتین در زمینه ویروسکرونا وجود دارد که در مطالعات اخیر چگونگی فرمولاسیون جدید آن با استفاده از فناوریهای میکرو و نانو بحث شده است (129).کارآزماییهای بالینی جهت بررسی اثربخشی این دارو در بسیاری از کشورها انجام شده و یا در حال اجرا است (132-130, 128). چهار ترایال بزرگ در دنیا در حال بررسی آیورمکتین در کووید-۱۹ هستند همانند ترایال Covidout از دانشگاه Minnesota، ترایال Principle از انگلستان، ترایال Together از برزیل و ترایال ACTIV-6 از مؤسسه ملی سلامت (National Institutes of Health) یا NIH که باید جهت تصمیمگیری بهتر منتظر انتشار نتایج آنها باشیم.
8-2-10-Progesterone
اختلاف در میزان وابستگی به رابطه جنسی و مرگ و میر در بیماران کووید-۱۹ ممکن است به تفاوت در سطح هورمون¬های استروئیدی جنسی، آندروژنها و استروژنها مربوط شود (133,134). افراد مسن با ضریب ابتلا و مرگ و میر بیشتر دارای سطوح کمتری از این هورمونهای جنسی هستند (135). از این رو رابطه جنسی و پروژسترون به عنوان یک عامل بیولوژیکی ممکن است یک مداخله درمانی بالقوه برای این بیماری را نشان دهد (136). البته استروئیدهای جنسی، مانند استروژن و پروژسترون، برای استفاده به عنوان گزینه درمانی جایگزین برای بیماران مسن کووید-۱۹ نیاز به بررسی بیشتری دارند. همچنین داروهایی از جمله باریسیتینیب (Baricitinib) (137)، آزیترومایسین (Azithromycin) (138,139)،¬ کلشی سین (Colchicine) (140,141)، متیل پردنیزولون (Methylprednisolone) (111,142)، -ناپروکسن (Naproxen) (111,143)، تیلورون (Tilorone) (144,145)، پیرفنیدون (Pirfenidone) (146) و سیکلوسپورین (Cyclosporine) (142,147) در حال حاضر تحت آزمایشات بالینی و بررسی برای نحوه و میزان اثرگذاری برای درمان کووید-۱۹ است.
9-پیشگیری و واکسیناسیون
باور عمومی هنوز بین کسب ایمنی از طریق واکسن یا ایمنی گلهای دچار تردید است به همین جهت نیاز است بدانیم که ویروس در بدن افراد ضعیف و مستعدِ بیماری شدید، سیستم ایمنی را فریب میدهد و سیستم ایمنی نمیتواند پاسخهای مناسبی ایجاد کند و همین امر موجب ایجاد فرمهای مهلک کووید-۱۹ میشود، در عوض واکسن نه تنها این کار را نمی-کند بلکه معمولاً دارای مواد محرک سیستم ایمنی هم هست. در ابتلا به کووید-۱۹ معلوم نیست چه دوزی از ویروس وارد شده و چه شدتی از بیماری را رقم خواهد زد ولی واکسن دوز ثابت و مشخصی دارد و در جمعیت تحت واکسیناسیون ایمنی همگنتری را ایجاد میکند. در بسیاری (حدود یک سوم) از افراد بهبود یافته که اتفاقاً پادتن زیادی هم تولید کردهاند این پادتن نشاندهنده ایمنی پایدار و خنثیکننده نیست چرا که نشان داده شده که این نوع تولید پادتن زیادتر از معمول می-تواند خارج از مراکز زایای عقدههای لنفاوی و توسط لنفوسیتهای Bخارج فولیکولی شکل بگیرد و حتی پاتوژن باشد و سلولهای خاطره نیز به خوبی تحریک نمیشوند. ولی نتایج منتشر شده از ترایالهای واکسنهای مطرح نشاندهنده ایجاد پادتنهای خنثیکننده، قوی و تخصصی در اکثر افراد است و دوز یادآور واکسن، تحریک کامل سلولهای خاطره را تضمین میکند. سرنوشت ابتلا به کووید-۱۹ ممکن است بیماری شدید و درد و رنج و حتی مرگ باشد ولی حداقل تا امروز هیچ مورد واکنش بسیار شدید غیرقابل کنترل و مرگی از واکسن-های مطرح گزارش نشده است (150-148).
1-9-اهمیت مراقب و واکسیناسیون در زنان باردار
در اوایل گسترش سارسکروناویروس2، بارداری به عنوان یک عامل خطر در نظر گرفته نمیشد (151,152)، اما اخیراً نشان داده است که افراد باردار مبتلا به کووید-۱۹ در معرض خطر بیشتری برای پیامدهای جانبی ویروس، از جمله مرگ هستند (155-153). زنان باردار بیشتر در معرض خطر ابتلا به سارسکروناویروس2 هستند چراکه حتی بدون هیچ عامل خطر اضافی، تقریباً 40 درصد لنفوسیتB و سلولهای کشنده طبیعی (Natural killer cell) یا NKC در خون محیطی کمتر از زنان غیرباردار دارند (156,157). مطالعهای متاآنالیزگزارش میدهد که تعداد زیادی از زنان مبتلا به عفونت کووید-۱۹ تأیید شده دارای زایمان زودرس (22 درصد) و زایمان به روش سزارین (48 درصد) هستند (158). این طیف از جامعه نیازمند یک نگاه ویژه جمعیتی هم در واکسیناسیون و هم در درمان هستند چرا که زنان ممکن است بارداری خود را بهخاطر ویروس به تعویق اندازند که این می تواند خطرات جمعی بسیاری را موجب شود (159).
2-9-بررسی آخرین نتایج تحقیقات واکسیناسیون در ایران و جهان
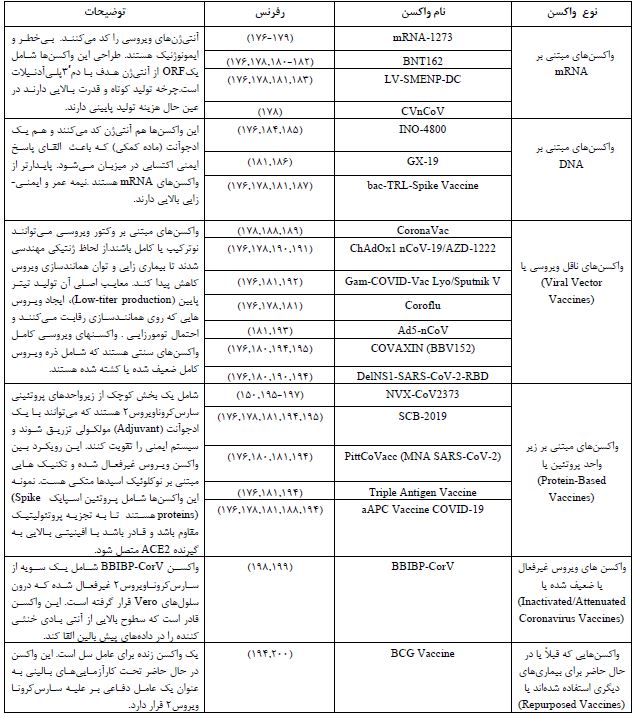
آخرین تلاشها برای دستیابی به واکسن در جدول 1 به نمایش درآمده است. ضمناً در فاز یک و دو کلینیکال ترایال واکسن روسی که 76 نفر وارد مطالعه شده بودند باعث تولید آنتیبادی خنثیکننده و پاسخ لنفوسیتT در میزان قابل قبول برای ایجاد ایمنی شده است. تیتر IgG در این افراد میزان بالاتری در مقایسه با بهبود یافتگان از کووید-۱۹ داشته است و تزریق این واکسن عوارض جانبی شدید نیز نداشته است (160). در کارآزمایی بالینی فاز سوم واکسن ساخت روسیه اسپوتنیک وی(SputnikV) یا Gam-COVID-Vacحدوداً 20 هزار نفر بررسی شدهاند که کارایی 6.91 درصد بدون عوارض جدی گزارش شده است (162, 161). جالب است بدانیم که تایید واکسن فایزر بیونتک با کارایی بیش از 90 درصد برای کاتالین کاریکو (Katalin Kariko)، اعتباری برای 40 سال فعالیت و تحقیقات اوست. وی تحقیق بر روی mRNA را در سال 1978 در آزمایشگاهی در مجارستان آغاز کرد. کاریکو نشان داد که چگونه میتواند از مولکولهای تکرشتهای کد ژنتیکی برای درمان بیماریها از سرطان و سکته مغزی گرفته تا آنفولانزا استفاده کرد در حال حاضر شرکت فایزر بیونتک و شرکت مدرنا از این تکنولوژی برای ساخت واکسن موثر بر کووید-۱۹ استفاده کردند (163). اخیراً مطالعه آزمایشگاهی منتشر شده که موثر بودن فعالیت آنتیبادیهای خنثی کننده در سرم افراد واکسینه شده با فایزر علیه جهشهای کلیدی واریانتهای B.1.1.7 و B.1.351 را نشان میدهد (164). با انجام مطالعهای واکسن mRNA ساخت شرکت مادرنا با نامmRNA-1273 علیه کووید-۱۹، در مورد واریانت B.1.1.7 هم محافظت ایجاد میکند. هر چند که محافظت این واکسن در برابر واریانت B.1.351 ¬(نوعی که اولین بار در آفریقای جنوبی یافت شد) شش برابر کمتر است اما احتمالاً با این وجود نیز تیتر آنتیبادی ایجاد شده کفایت کند (75,165). موسسه ملی ویروسشناسی و شورای پژوهش پزشکی هند و شرکت هندی Bharat Biotech واکسنی به نام کووکسین (Covaxin)یاBBV152 با دوز 2 عدد به فاصله چهار هفته، طراحی نمودهاند که در مطالعات حیوانی در موش (166) و میمون (167) ایمونوژنیسیتی این واکسن را نشان داده شده است (168) مطالعه بالینی فاز یک (169)، فاز دوم (170) و فاز سوم (که هنوز بهطور کامل منتشر نشده است) برای آن طی شد. یک مطالعه پریپرینت موثر بودن این واکسن علیه واریانت B.1.1.7 در مدل آزمایشگاهی از طریق مقایسه فعالیت آنتیبادیهای خنثیکننده نشان داده است (171). با دریافت تاییدیه و مجوز استفاده اضطراری با توجه به عدم گزارش نتایج فاز سوم (ایمنی و تاثیرگذاری) تنها هند و ایران از این واکسن استفاده میکنند. میزان تاثیرگذاری آن حدود 80 درصد گزارش شده است (171,172). همچنین هند از نظر تعداد دوز تزریقی بعد از آمریکا، چین و انگلستان در رتبه چهارم قرار دارد. در ایران، در مجموع 9 پروژه واکسیناسیون با الگوهای مختلف در حال پیگیری است (-همانند پاستور در فاز سوم، برکت در فاز 3/2، فخرا و رازی و سیناژن در فاز دوم و نورا در فاز یکم). پیش مقاله فاز حیوانی واکسن مشترک کوبا و پاستور ایران در سه دز (دو دز از سوبرانا۲ به فاصله ۲۸ روز و دز سوم از سوبرانا پلاس در فاصله ۵۶ روز) در دسترس قرار دارد (173,174). فاز ۱ و ۲ بالینی در کوبا انجام شده ولی هیچ دادهای از آن در دسترس نیست. فاز سوم نیز در کوبا انجام شده و طبق نتایج اولیه با تزریق ۲ دز تاثیرگذاری ۶۲ درصد را نشان داده و هنوز نتایج برای تزریق سه دز اعلام نشده است (174,175). واکسن برکت اما یک نمونه واکسن کشته شده کرونا است که تست حیوانی را با موفقیت گذرانده و از سوی سازمان غذا و داروی ایران برای آزمایش بر روی انسان نیز تأییدیه دریافت نموده است و هم اکنون نیز به صورت اضطراری داوطلبانه تزریق میشود.
نتیجهگیری
با توجه به گستردگی ابتلا و شیوع ویروس کرونا در سطح جهان، در راستای یافتن روشهای درمانی یا کشف واکسن یا داروهای جدید برای مقابله با این ویروس مطالعات چشمگیری در حال انجام است. تاثیرات این همهگیری نه تنها به دوران این بیماری مربوط میشود بلکه مسلماً شرایط پساکرونا نیز دارای چالشهای فراوانی مخصوصاً در حوزه جمعیتی و خانواده خواهد بود. امیدواریم اطلاعات مرور حاضر با تمرکز بر اپیدمیولوژی، ویروسشناسی، روشهای انتقال، مشخصههای بالینی، یافتههای آزمایشگاهی، و جهشهای شایع، بتواند به متخصصانی که در شرایط کنونی در حال پژوهش روی ویروسکرونا هستند، کمک شایانی نماید.
سپاسگزاری
تقدیم به روح مطهر آقای اصغر حبیبی، دانشجوی کارشناسی ارشد بیوتکنولوژی پزشکی دانشگاه علوم پزشکی تبریز، که عمر خویش را در مسیر کسب دانش و اعتلای ایران سپری و سهم بسزایی در تهیه و ویرایش این اثر ایفا نمود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
در اواخر دسامبر2019 ذاتالریه مرتبط با کروناویروس جدید در ووهان چین اتفاق افتاد که بعد از آن توجهات جهانی را به خود جلب کرد (3-1). 7 ژانویه کروناویروسجدید جداسازی شد و 12 ژانویه به طور رسمی به سارسکروناویروس2 یا (2019-nCoV or SARS-CoV-2) نامیده شد و توالییابی کامل ژنوم آن با سازمان جهانی بهداشت(World Health Organization) یا WHO به اشتراک گذاشته شد (1). به طور کلی در دهه اخیر شاهد پاتوژنهای تهدیدکننده انسانی زیادی بودیم از جمله ویروس نیپا (Nipah virus)، بیماری ویروسی ابولا (Ebola virus disease)، ویروس چیکونگونیا (Chikungunya)، ویروس زیکا (Zika virus)، کروناویروس سندرم تنفسی خاورمیانه(Middle East respiratory syndrome coronavirus) یا MERS-CoV، کروناویروس سندرم تنفسی حاد (Severe acute respiratory syndrome coronavirus) یا SARS-CoV و سارسکروناویروس2 (4). SARS-CoV و MERS-CoV پاتوژنهای بین انسان و حیوان هستند که میتوانند بیماریهای شدید حاد تنفسی در انسان ایجاد کنند (5). مطالعات گذشته ویژگیهای اپیدمیولوژیک و کلینیکی کووید-19 را گزارش کردند اما با توجه به انتشار سریع مطالب از سراسر دنیا، مرورهای انجام شده یا جامعیت کافی را نداشته و یا اطلاعات جدیدتر را در برنمیگیرد. طبق اطلاعات بهدست آمده تحقیقات روی کووید-19، در وبسایتها و ژورنالهای مختلف حدود 4 درصد از تحقیقات جهانی در سال 2020 را شامل میشود. البته در این سال مقالات ارسال شده به مجلات مختلف در تمام موضوعات علمی نیز افزایش چشمگیری داشته است. شاید به این دلیل که بسیاری از محققان در این دوران مجبور به ماندن در خانه بوده و تمرکز بیشتری در نوشتن مقالات داشتهاند (6). این بیماری به سرعت تمام جنبههای زندگی بشری از جمله تغییرات جمعیتی، اقتصاد، مشاغل و نیز تغییرات اجتماعی را تحت تاثیر خود قرار داد (9-7). لذا به همین سبب برآن شدیم تا مروری بر آخرین مطالعات این حوزه با نگاهی جامع از ابتدا تا اواسط جولای 2021 داشته باشیم تا در اختیار علاقهمندان قرار بگیرد و کمکی باشد برای پرسنل پزشکی که در خط مقدم مدیریت بالینی این پاندمی هستند. در اینجا، ما بهطور جامع اپیدمیولوژی، ویروسشناسی، روشهای انتقال، مشخصههای بالینی، یافتههای آزمایشگاهی، و جهشهای شایع بیماری کووید-19 را توسط جستجو در پایگاههای اطلاعاتی از جملهPubMed, Scopus, Google scholar وBioRxiv مرور کردیم.
1-اپیدمیولوژی و آغاز سارسکروناویروس2
با بررسی دینامیک انتقال اولیه، ذاتالریه ایجاد شده با سارسکروناویروس2 در ووهان چین نشان داده شد که اولین مورد آن در دسامبر 2019 اتفاق افتاده است. همچنین شواهدی وجود دارد مبنی بر انتقال انسان به انسان بین کسانی که ارتباط نزدیک داشتهاند (10). با طراحی درخت فیلوژنیک نشان داده شد که سارس¬کرونا¬ویروس2 بهطور معناداری از توالی کروناویروس شبه سارس خفاش جدا شده است که توالی آن در سال 2015 در چین از خفاش Rhinolophus sinicus شناسایی شده بود که آنالیز ساختاری وجود یک جهش را در گلیکوپروتئین خارهای اتصالی نشان داده است (11). خفاشها تقریباً برای 30 کروناویروس که ژنومشان توالییابی شده است میزبان هستند (12). نتایج بهدست آمده از آنالیزها نشان میدهد که سارسکروناویروس2 احتمالاً یک ویروس نوترکیب (در گلیکوپروتئین خارهای اتصالی ویروس) است بین کروناویروس خفاش و یک کروناویروس که منشا نامشخص دارد. سارسکروناویروس2 شبیهترین اطلاعات ژنتیکی را نسبت به کروناویروس خفاشها دارد و به نظر میرسد یک نوترکیبی هومولوگ به انتقال بین گونهای سارسکروناویروس2 کمک کرده است (13). طبق مطالعات بر اساس توالی ژنتیکی ویروس سارسکروناویروس2 (کمیته بینالمللی طبقهبندی ویروسها (International Committee on Taxonomy of Viruses) یا ICTVنام سارسکروناویروس2 را پیشنهاد داد (14,15). این فرضیه مطرح شده است که این ویروس به صورت مستقیم از طریق خفاش به انسانها منتقل شده است و پس از جهش و تکامل در بدن انسان به اوج قابلیت انتقال و بیماریزایی خود رسیده است (16,17). هرچند خفاشها به عنوان مخزن ویروس معرفی شدهاند اما میزبان حد¬واسط که انتقال به انسان را ممکن کرده ناشناخته بود که مطالعات جدید نشان میدهد عامل انتقال سارسکروناویروس2 به انسان، پنگولینهایی بودهاند که از مالزی به چین قاچاق شده بودند (18). گزارش WHO از ووهان چین نیز بیان میکند که احتمالاً منشا سارسکروناویروس2 مرتبط با یک حیوان است و به شدت غیرمحتمل است که منشا آن ناشی از یک اشتباه آزمایشگاهی باشد ضمن اینکه در مطالعهای شواهد مولکولار و سرولوژیک از سارسکروناویروس2 را در خفاشها در جنوبشرقآسیا (تایلند) نشان داده است (19). این ویروس با سرعت انتقال بالا تاکنون با ابتلای بیش از 190 میلیون نفر تمام جهان را به خود درگیر کرده است و بیش از 4 میلیون نفر مرگ را نیز به ثبت رسانده است.
2-ویژگیهای سارسکروناویروس2 و راههای انتقال آن
کروناویروس یک ویروس RNA دار است و با عفونتهای حاد تنفسی در انسان مرتبط است ولی توانایی آن در آلوده کردن میزبآنها از گونههای دیگر و ایجاد چندین نوع بیماری به عنوان یک پاتوژن پیچیده تبدیل شده است (20). این ویروس به 2 نوع عمده (Strain) به نامهای L و S تکامل پیدا میکند که نوع L شایعتر و تهاجمیتر است ولی نوع S نسخه قدیمیتر یا نیایی (Ancestral version) است (21). سارسکروناویروس2 به آنزیم مبدل آنژوتانسین2 (Angiotensin-converting enzyme2) یا ACE2 باند میشود و از پروتئاز تراغشایی، سِـرین۲ (Transmembrane protease,-serine2) یاTMPRSS2 برای ورود استفاده میکند (22). آنالیز توالییابی برحسب جفت باز نشان داد که کروناویروس شبه سارس خفاش نزدیکترین ویروس به سارسکروناویروس2 بوده (88 درصد شباهت نوکلئوتیدی)، در نتیجه عضو جدیدی از خانواده بتا کروناویروس است (23,24). همچنین سارسکروناویروس2 به سلولهای میزبان از طریق پروتئین خارهای اتصالی و گیرنده CD147 تهاجم میکند (25,26). برای تایید این اتصال در شرایط In-vitro از یک آنتیبادی ضد گیرنده CD147 به نام مپلازوماب -(Meplazumab) استفاده شد که بهطور چشمگیری باعث مهار تهاجم ویروسها به سلول میزبان شد (25). انتقال کروناویروس بیشتر از طریق قطره تنفسی (Respiratory droplet) است و به صورت کمتر توسط آئروسل (Aerosol)، سوسپانسیون کلوئیدی ذرات جامد یا مایع پخش شده در گاز یا معلق در گاز، و انتقال Fomite (انتقال بیماری های عفونی با اشیاء) است (27). طی تنفس، توالت رفتن و تماس با Fomites بهطور مستقیم و غیرمستقیم منتقل میشود (28). انتقال مستقیم میتواند از طریق استنشاق قطره در هنگام سرفه یا عطسه بیمار باشد (29,30). رعایت فاصله اجتماعی با فرد سرفهکننده در کاهش حجم قطرات و همچنین بار ویروسی رسوب شده بر فرد مقابل موثر است (31). ضمناً مبتلایان به نقص ایمنی دستکم تا 2 ماه ویروسکرونا را پخش میکنند. محققین با انجام کشت سلولی در این بیماران که عمدتاً تحت شیمیدرمانی بودند توانستند ویروس زنده را تا 61 روز پس از آغاز علائم بالینی از نمونههای ماسک آنان جدا کنند. آزمایش ژنتیک نشان داد ویروس جدا شده از ماسک پس از 61 روز همان ویروسی است که بیمار را در ابتدا مبتلا کرده بود و این به معنی عفونت پایدار است (32).
3-مشخصههای بالینی و بیماریهای مرتبط
بیماریزایی سارس و مرس و سارسکروناویروس2 محدود به ریه نیست (33). چرا که گیرنده ACE2 در بافتهایی مثل قلب، توبولهای کلیه، سطح لومینال روده کوچک و رگهای خونی هم بیان میشود (37-34). از پیامدهای کشنده این بیماری میتوان به نارسایی تنفسی، سندرم زجر حاد تنفسی (Acute respiratory distress syndrome) یا ARDS، ذاتالریه و آسیب به قلب اشاره کرد (40-38). بیمارانی که ابتلا آنها به کووید-19 با Real-time RT-PCR و Next-generation sequencing یا NGS (41) تایید شده غالباً بیماری زمینهای از جمله دیابت، فشار خون و بیماریهای قلبی عروقی داشتند در آنها علایمی مثل تب، سرفه و خستگی و علایم با بروز کم مثل تولید خلط، سردرد و اسهال وجود داشت (38). این احتمال که کووید-19 به تنهایی میتواند باعث آسیب به سلولهای بتا پانکراس بهطور مستقیم شود نیز وجود دارد (42). براساس مطالعات ترکیب میکروبهای روده و مدفوع (میکروبیوم) با شدت کووید-۱۹ و غلظت پلاسمایی چندین سایتوکاین التهابی و شاخص خونی نشان دهنده آسیب بافتی، مطابقت دارد. تغییر در میکروبیوم بعد از پاک شدن سارس¬کروناویروس2 باز هم باقی میماند (43). شایعترین علائم بالینی کووید-۱۹ تب، سرفه و درد ماهیچه و یا خستگی و یافتههای آزمایشگاهی شامل لنفوپنی (0.93x109/L) و پروتئین واکنشگرC (C-Reactive Protein) یا CRP غیر-نرمال (33.72mg/dL) بودهاند (44). مطالعات نشان دادند بیمارانی که بالای60 سال داشتند علایم بیشتری مثل لنفوپنی، ترومبوسیتوپنی، و افزایش سطح CRP و لاکتات دهیدروژناز داشتند (29). بررسیهای بیشتر، افزایش CRP و سرعت رسوب گلبول قرمز ((Erythrocyte Sedimentation¬Rate یا ESR را نشان میداد و همچنین با بررسی تصویرCT علایمی همچون کدورت شیشه ماتی (Ground-glass opacification/opacity) یا GGO، رگههای فیبروزی (Fibrotic streaks)، خط شفاف زیر شامهای (Subpleural transparent line) و ششهای ضخیم مشاهده شد (45). در ادامه بررسی شیوع این ویروس روی کودکان انجام شد که باتوجه به تعداد گزارش شده مبتلایان، شمار نوزادان مبتلایِ شناسایی شده کم بود. شاید علت این امر احتمال پایینِ در معرض قرارگیری و یا عدم شناسایی کامل آنها بهدلیل داشتن علائم خفیف و یا نداشتن علائم باشد، نه مقاومت به این بیماری (46,47). اثبات شده است که کودکان حتی در صورت عدم بروز علائم بیماری میتوانند برای هفتهها (دو الی سه) ویروس سارس¬کرونا¬ویروس2 را در بینی و گلوی خود حفظ کنند و باعث انتقال ویروس به سایر افراد شوند (48). مطالعات نشان دادند که حداقل یک سوم موارد عفونت کووید-۱۹ بدون علامت هستند. همچنین تقریباً سه چهارم افرادی که در زمان تست PCR، بدون علامت بودهاند، در پیگیری به همین شکل بدون علامت باقی ماندهاند (49). در مجموع بیشترین علائم گزارش شده در بیماران کووید-۱۹ تب یا لرز، سردرد، درد در عضلات یا بدن، سرفه خشک، خستگی، تنگی نفس، کاهش لکوسیتها و شواهد رادیوگرافی ذاتالریه و علائم کمتر گزارش شده شامل اسهال، آبریزش بینی، آسیب کبدی، آسیب کلیه، حالت تهوع و استفراغ و علائم لنفوپنی و ترومبوسیتوپنی است. علائم از 2 تا 14 روز پس از مواجهه با ویروس شروع میشود (53-50, 38).
4-تشخیص
4-1-سنجشهای مبتنی بر تشخیص اسید نوکلئیک
این ویروس در نمونههای بالینی با NGS، Real-time RT-PCR، کشت سلولی و میکروسکوپ الکترونی شناسایی شده است (39,54). اگرچه RT-qPCR مناسب شناسایی است اما گاهی اوقات میتواند به دلیل آلودگی نمونه یا نقص فنی، نتایج منفی کاذب ایجاد کند که به دلیل پیامدهای شدید تشخیص نادرست در مورد کووید-۱۹، نمیتوان این مسائل را نادیده گرفت (55,56). شناسایی خارج ریوی RNA این ویروس نیز الزاما به معنی وجود ویروس در آنها نیست و اهمیت بالینی تشخیصی این ویروس خارج از مجرای تنفسی نامشخص است (57). شواهد حضور این ویروس شامل شناسایی در مایع شستشوی ریوی، PCR مستقیم و کشت سلول بود. در 3 بیمار که توالییابی کامل برای ژنوم انجام شده بود، بر پایه آنالیز ژنوم بهدست آمده از این مطالعه چندین آنالیز حساس و اختصاصی را طراحی کردند که ORF1ab و نواحی N و E این ویروس را هدف قرار دادند تا RNA آن را در نمونههای بالینی شناسایی کنند (39,58).
4-2-¬سیتی اسکن ریه (Chest Computed-Tomography)
با توجه به اینکه بیماران علائم ذاتالریه را در مراحل اولیه عفونت تجربه میکنند (59) سیتی اسکن ریه در تشخیص عفونت کووید-۱۹ اختصاصیت بیشتری نسبت به RT-qPCR دارد (60).
4-3-سنجش سرولوژی و ایمونولوژیک
برای تشخیص کسانی که در حال حاضر آلوده هستند یا قبلاً به سارسکروناویروس2 آلوده شدهاند وجود آنتیبادی IgM و IgG را ارزیابی میکنند (61). افرادی که مبتلا به کووید-۱۹ با علایم خفیف بودند، در بررسی سه ماه بعد از بروز علایم دارای سلولهای ایمنی خاطرهای لنفوسیتT و لنفوسیتB اختصاصی، آنتیبادی IgG اختصاصی و پلاسمای خنثیکننده علیه کووید-۱۹ بودهاند (62). این ارزیابی از اختصاصیت خوبی برخوردار نیست و با گسترش تستهای اختصاصی و ارزان قیمت، کمتر توصیه میشود.
4-4-دیگر روشهای تشخیص
مطالعات ضمن بیان افزایش احتمال پخش شدن سارسکروناویروس2 از طریق مدفوع نشان دادند که تست مدفوع میتواند 5 هغته بعد از منفی شدن سایر تستها ابتلای افراد را ثابت کند پس به این جهت این ویروس میتواند زیستپذیر باشد و برای چند روز در محیط باقی بماند (41). همچنین در پژوهشها استفاده از نمونه بزاق بهعنوان روش ارزانتر و با حساسیت قابل قبول (به جای نمونه سواب حلق بینی) در اکثر جمعیتها مطالعه شده است (63).
5-کووید-۱۹ و آنفولانزا
علیرغم تنوع در علایم کووید-۱۹ بیشتر بیماران تب و علایم تنفسی دارند که در مقایسه با آنفولانزا باید به تاریخچه بیمار رجوع کرد که آیا به مناطق اپیدمی واریانتهای جدید ویروس سفر داشته است یا نه (64). از تفاوتهای میان آنفولانزا و کووید-۱۹ در مورد چهره بالینی مشخص شد که کودکان مبتلا به کووید-۱۹ در مقایسه با آنفولانزا، سن بالاتری داشتهاند. همچنین احتمال وجود تب، اسهال، استفراغ، سردرد و درد قفسه سینه در کووید-۱۹ بیشتر بوده است. احتمال وجود بیماری زمینهای نیز در کووید-۱۹ بیشتر بوده است (65). بر این اساس مطالعهای با مقایسه درصد مرگ و میر در بیماران مبتلا به کووید-۱۹ و آنفولانزا بستری در ICUدریافتند که فارغ از سن، جنس، بیماریهای همزمان و شرایط در زمان بستری(SOFA score-The Sequential Organ Failure Assessment)، بیماران مبتلا به کووید-۱۹ شدید در مجموع دو برابر احتمال مرگ در بیمارستان دارند (66). با مطالعهای روی جمعیت ایتالیا نشان داده شد در مواردی که میزان واکسیناسیون آنفلوانزا بیشتر بود، مرگ کمتری از کووید-۱۹ رخ داد (67).
6-اختلالات روانشناختی
نگرانیها از کووید-۱۹ منجر به اضطراب، استرس و افسردگی عمومی شده است (68). که بهطور خاص مقیاس بالای بیماری عفونی کادر درمان را تحت فشار فیزیکی و روانی قرار داده است (69). به همین جهت برنامه مداخله روانشناختی طراحی شد که عمدتاً حوزههای مداخله روانی با ایجاد دورهای آنلاین ویژه کادر درمان و ایجاد تیم حمایتی با وظیفه راهنمایی و نظارت به مشکلات روانشناختی آنها را پوشش میداد. اجرای این خدمات مداخلهای روانی با مشکلاتی روبهرو است، مثلا کادر درمان تمایلی برای شرکت در این گروه¬ها را ندارند و پرستارهایی هم هستند که با وجود علایم پریشانی روانی و هیجان و بیقراری تمایلی برای استراحت کردن ندارند. از دلایل امتناع آنها میتوان به موارد زیر اشاره کرد¬: ابتلا به این بیماری نگرانی اصلی برای آنها نبود و نگرانی اصلی برای خانوادههای آنها بود که این ویروس به آنها منتقل نشود و اینکه کارکنان نمیدانستند که چطور با ترس و عدم آگاهی بیماران که منجر به عدم تمایل به قرنطینه یا همکاری با اقدامات پزشکی میشود رفتار کنند. همچنین کارکنان نگران کمبود تجهیزات محافظی بودند و در برابر بیمارانی که در سطح بحرانی از بیماری قرار داشتند احساس ناتوانی میکردند (70). این وضعیت بحرانی بیمارستانها در کادر درمان باعث مشکلات سلامت روانی شده که می¬توان به استرس، اضطراب، افسردگی، بیخوابی و عصبانیت که این مشکلات تمرکز کادر درمان و قدرت تصمیمگیری آنها را تحتتاثیر قرار میدهد اشاره کرد که حتی میتواند اثرات ماندگار داشته باشد. تیمهای مداخلهگر روانشناختی که به بیمارستان فرستاده شدند شامل 4 تیم بودند؛ تیم پاسخ روانی شامل مدیران و روسای روابط عمومی با وظیفه مدیریت، تیم حمایت فنی شامل کارشناسان ارشد مداخله روانی با وظیفه راهنمایی و نظارت و فرموله کردن مداخلات، تیم پزشکی مداخلهگر روانشناختی شامل روان پزشک و تیم ویژه حمایت روانی شامل داوطلبهایی با وظیفه آموزش از راه دور (تلفنی) که آموزش حمایت روانی را دریافت کرده بودند (71). همچنین در مدلهای طراحی شده، کووید-۱۹ روی امید به زندگی نیز اثرگذار بود که میزان آن در ایالات متحده آمریکا کاهش 13.1 سال در 2020 را نشان می داد که این مقدار برای سیاهپوستان و لاتینها 3 تا 4 برابر بیشتر از سفیدپوستان بود (72). اختلالات شدید روانی، با افزایش خطر ابتلا به سندرم حاد تنفسی و مرگ و میر ناشی از کووید-۱۹ نیز در ارتباط است (73).
7-واریانتهای جدید
از واریانت مهم شناسایی شده ویروس بیماری کووید-۱۹ که هرکدام جهشها و حذف های مختلفی را شامل میشوند میتوان به موارد زیر اشاره کرد :
7-1-واریانت آلفا یا B.1.1.7:
با نام دیگر 20I/501Y.V1 یا VOC-202012/01 به عبارتی دیگر سال 2020، ماه 12و واریانت 01 ¬تشخیص داده شده در سپتامبر 2020 در انگلستان که یکی از جهشها در واریانتB.1.1.7 جهش در محل دمین گیرنده اتصالی (Receptor binding domain) از نوع N501Y در ناحیه اسپایک ویروس است که در ناحیهای است که این پروتئین به گیرنده سلولی متصل می¬شود. بهطور تئوری تغییرات در این قسمت ممکن است باعث مسریتر شدن ویروس و راحتتر شدن انتشار آن در بین جمعیت شود (74). فعلاً شواهدی که نشان دهد این واریانت روی تاثیرگذاری واکسن اثری دارد، وجود ندارد (78-75). مطالعات نشان داده است که جهش N501Y (در واریانت انگلیسی) تغییرات زیادی در اسپایک ایجاد نکرده است و توسط سرم افرادی که قبلاً به کووید-۱۹ -مبتلا شدهاند خنثی میشود (79). این واریانت تفاوتهایی در سرفه و گلودرد و خستگی و درد عضلانی و تب داشت که در افراد مبتلا به این واریانت بیشتر دیده میشود. در حالی که از دست دادن حس بویایی و چشایی به شکل معناداری کمتر رخ میدهد (81،80). در گزارشهای جدید تخمین زده شده است که مسری بودن این واریانت بین 43 تا 90 درصد نسبت به واریانتهای دیگر بیشتر است (82,83).
7-2-واریانت بتا یا B.1.351 :
با نام دیگر 20H/501Y.V2 یا (VOC-202012/02) به عبارتی دیگر سال 2020، ماه 12 و واریانت 02 تشخیص داده شده در دسامبر 2020 در آفریقای جنوبی که با داشتن جهش-N501Y، جهش E484K نیز در این واریانت دیده شده که گفته میشود ممکن است روی خنثیسازی توسط آنتیبادی-های پلیکلونال و مونوکلونال نیز اثر بگذارد. فعلاً شواهدی که نشان دهد این واریانت روی شدت بیماری موثر باشد وجود ندارد (76,84,85).
7-3-واریانت گاما یا B.1.1.28:
با نام دیگر P.1 یا VOC-202101/02 به عبارتی دیگر سال 2021، ماه 01 و واریانت 02 تشخیص داده شده در ژوئن 2021 در توکیوی ژاپن، 17 جهش و سه حذف دارد و جهشهای E484K (فرار از آنتیبادیهای خنثیکننده) و N501Y (بیشتر کردن سرایت) را نیز دارد. شواهدی وجود دارد که برخی جهشهای این واریانت احتمالاً میتواند روی توانایی آنتیبادیهای تولید شده ناشی از عفونت قبلی (مانائوس برزیل) یا ناشی از واکسیناسیون برای تشخیص یا خنثیسازی ویروس اثر بگذارد (76,84,86,87).
7-4-واریانت دلتا یا B.1.617.2:
با نام دیگر G/478K.V1 در می2021 در هند شناسایی شد. واریانت دلتا مسریترین نوع ویروس بین واریانتهای شناسایی شده میباشد که در حال حاضر بزرگترین تهدید برای کنترل پاندمی کرونا در جهان محسوب میشود. واریانت دلتا بسیار سریعتر از سویه اصلی ویروس و نوع آلفا که در انگلیس شناسایی شد انتقال و گسترش مییابد (88,89). شواهد نشان میدهند که واریانت دلتا 40-60 درصد بیشتر از نوع آلفا قابلیت سرایت دارد (90,91). این سرایت پذیری بالاتر بخاطر جهشهای T478K و P681R و L452R است (92). میزان بستریها نیز حدوداً 85.1 برابر بیشتر از آلفا است (93,94). اگرچه در برخی مطالعات، تأثیرپذیری دلتا برای واکسن کمی کمتر از سایر واریانتها میباشد (95,96)، اما همچنان به نظر میرسد واکسن میتواند تا حد زیادی از شدت ابتلا در این واریانت جلوگیری نماید (96). با همه این موارد باید پذیرفت که بهترین استراتژی جهت مقابله با این واریانت، تسریع و تداوم واکسیناسیون (97,98)، استفاده از ماسک، رعایت فاصله فیزیکی و اجرای دیگر اقدامات کنترلی است. اخیرا هند واریانت دلتا پلاس (AY.1) را هم به دسته واریانتهای نگرانکننده اضافه کرده است و اعلام کرده که سرعت انتقال بیشتر و مقاومت بیشتر به برخی آنتیبادیهای مونوکلونال دارد. این واریانت جهش K417N را نیز در پروتئین اسپایک دارد که در واریانتهای بتا و گاما هم دیده میشود. البته هنوز داده کافی برای این موضوع وجود ندارد.
8-درمان با مداخلات دارویی و غیردارویی
8-1-مداخلات غیردارویی
در مطالعهای اثربخشی مداخلات غیردارویی (Nonpharmaceutical Interventions) یا NPIs دولتها در کاهش شیوع کووید-۱۹ ارزیابی شد بدین صورت که اثر به کارگیری 6068 مداخله غیر دارویی درکنترل بیماری کووید-۱۹ در 79 کشور بر شاخص Rt (معیار اندازهگیری سرعت انتشار بیماری که مقادیر بالاتر از یک به معنای افزایش عفونت و پایین تر از یک به معنای کاهش آن است) در ماههای مارس و آوریل 2020 (زمانی که اروپا و بسیاری از ایالتهای آمریکا موج اول پاندمی را تجربه میکردند) مورد بررسی قرار گرفت. در این مطالعه فاصلهگذاری اجتماعی و محدودیتهای ترددی به عنوان مهمترین شاخص تمام مداخلات غیردارویی شناخته میشود. همچنین برقراری محدودیتهای مرزی از جمله اقدامات موثر ارزیابی شد. نتایج مطالعه نشان داد که هیچ راهکار واحدی متناسب با همه جوامع وجود نداشته و هیچ مداخله غیردارویی به تنهایی نمیتواند شاخص Rt را به زیر یک کاهش دهد (99).
8-2-مداخلات دارویی
Remdesivir8-2-1-
تحقیقات اخیر نشان داده است که رمدسیویر (Remdesivir) یک درمان بالقوه برای درمان کووید-۱۹ است، بهطوری که در ایالات متحده (ایالت واشنگتن) با تجویز وریدی رمدسیویر و سایر داروهای ضدویروسی مثل ریتوناویر (Ritonavir) (100) درمان اتفاق افتاد به شکلی که علائم را کاهش داد و هیچ عارضه جانبی ایجاد نکرد (57). البته ویروسهای دارای RNA پلیمراز جهش یافته اغلب مقاومت نسبی در برابر رمدسیویر ایجاد میکنند (101,102). رمدسیویر در حال حاضر در فاز 3 آزمایشهای بالینی در ایالات متحده آمریکا است اما در اول می سال 2020، سازمان غذا و دارو (Food and Drug Administration) یا FDA مجوز استفاده اضطراری از آن را برای درمان بیماران کووید-۱۹ صادر کرد (105-103).
Lopinavir/Ritonavir8-2-2-
مطالعات نشان داده است که لوپیناویر (Lopinavir) و ریتوناویر در برابر ویروسهای SARS و MERS موثر هستند (106). اما با آزمایش بالینی ترکیبی دو داروی لوپیناویر و ریتوناویر روی بیماران کووید-۱۹ شدید مشخص شد که درمان ترکیبی این داروها اثرات مثبت قابلتوجهی ندارد (107).
Aplidin8-2-3-
مطالعه آزمایشگاهی نشان داده است که قدرت داروی Aplidin با نام دیگر پلیتیدپسین (Plitidepsin)علیه کووید-۱۹ بیست و هفت و نیم برابر بیشتر از رمدسیویر میباشد. از طرفی تاثیر دارو بر کاهش میزان تکثیر ویروس در ریه مدل موش به اثبات رسیده است. همچنین در مطالعهای دیگر مشخص شده است که دارو علیه واریانت B.1.1.7 نیز موثر است. مطالعه فاز دوم این دارو علیه کووید-۱۹ به اتمام رسیده است و هم اکنون در شروع فاز سوم میباشد (108).
Favipiravir8-2-4-
فاویپیراویر یک آنالوگ نوکلئوزیدی است که پلیمراز ویروسی را مهارکرده و از روند تکثیرRNA ویروسی جلوگیری میکند (109). مطالعات نشان داده است که فاویپیراویر باعث کاهش بار ویروسی (Viral load) در دستگاه تنفسی فوقانی و ریهها میشود (110).
Nelfinavir8-2-5-
مطالعات in-vitro نشان داده است که نلفیناویر -(Nelfinavir) از تکثیر سارسکروناویروس2 جلوگیری میکند و دارویی امیدوار کننده برای درمان عفونت ناشی ویروس کرونا است (111).
Hydroxychloroquine8-2-6-
هیدروکسیکلروکین، آزاد شدن برخی از سیتوکینها مانند اینترلوکین1 (Interleukin¬1) یا IL-1 و ¬فاکتور نکروز توموری آلفا (Tumor necrosis factor alpha) یا TNFα را کاهش میدهد و به این طریق در کاهش التهاب موثر است. هیدروکسیکلروکین با مهار گلیکوزیلاسیون انتهایی گیرنده ACE2 مانع از ورود ¬سارس¬کروناویروس¬2 و عفونت و پیشرفت بیماری میشود (112). هیدروکسیکلروکین به عنوان یک دارو در پیشگیری و درمان مستقیم بیماران کووید-۱۹استفاده میشود، اما اخیراً برخی عوارض جانبی منفی مانند ایست قلبی و آریتمی گزارش شده است (115-113). مشاهدهای گذشتهنگر در بیماران سرپایی کووید-۱۹ و نوع خفیف با حجم نمونه محدود نشان داده است که استفاده از هیدروکسیکلروکین میتواند منجر به کاهش میزان بستری شود (116). معاینات بالینی دقیق هنوز برای تأیید اثرات هیدروکسیکلروکین بر بیماران کووید-۱۹ در جریان است.
Vitamin C and D8-2-7-
ویتامین C (VC) با تحریک تولید اینترفرون، تحریک تکثیر لنفوسیتها و افزایش توانایی فاگوسیتیک نوتروفیل، ایمنی بدن را افزایش میدهد (119-117). VC میتواند علائم بالینی را در بیماران مبتلا به کووید-۱۹ بهطور قابلتوجهی بهبود ببخشد با این حال، هیچ تاثیری در مرگ و میر نداشت. برای ارزیابی بیشتر نقشVC در درمان کووید-۱۹ به مطالعات گستردهتری نیاز است (120). ویتامین D نیز در حال حاضر به عنوان تعدیلکننده (Modulator) سیستم ایمنی برای درمان کووید-۱۹ تحت آزمایشات بالینی قرار دارد (123-121). -تیمی تحقیقاتی از اسرائیل در یک مطالعه بزرگ نشان دادهاند که کمبود ویتامینD کمتر از ng/mL30، شانس ابتلا به عفونت کووید-۱۹و شانس بستری به علت کووید-۱۹ را به ترتیب 45.1 و 95.1 برابر میکند (124). در مطالعهای دیگر اثر دوز بالای مکمل زینک و VC روی طول مدت علائم در 214 بیمار سرپایی کووید-۱۹ بررسی شده است که طی آن نشان داده شد میانگین تعداد روزهایی که بیماران طی آن کاهش 50 درصدی در میزان علائم خود داشتهاند، در گروه زینک، ویتامین سی، زینک + ویتامین سی و گروه درمان معمول به ترتیب 9.5، 5.5 ، 5.5 و 7.6 بوده است که بین چهار گروه از این نظر تفاوت آماری معناداری وجود نداشته است. در نتیجه احتمالاً درمان با زینک و ویتامین سی بهصورت قابلتوجهی روی علائم کووید-۱۹ اثری ندارد (125).
EIDD-28018-2-8-
مطالعات آزمایشگاهی نشان میدهد که داروی EIDD-2801 یا مولنوپیراویر (Molnupiravir) بعد از فقط دو روز استفاده توانسته به شکل قابلتوجهی باعث کاهش وایرال لود و جلوگیری از تکثیر سارسکروناویروس2 شود و در نتیجه احتمالاً میتواند در پیشگیری قبل از مواجهه و درمان کووید-۱۹ موثر باشد. این دارو در حال حاضر توسط شرکت Merck در حال بررسی در مطالعات فاز¬ II–III میباشد (17).
Ivermectin8-2-9-
ایورمکتین داروی ضدانگلی با طیف گسترده، بیخطر برای مصارف انسانی و تأیید شده FDAمیباشد که فعالیت ضدویروسی آن در برابر سارسکروناویروس2 در شرایط آزمایشگاهی ثابت شده است (126). بر اساس مطالعهای با نام IVERCOR-COVID19 روی مبتلایان غیربستری در آرژانتین مشخص شده است که آیورمکتین در کمتر کردن میزان بستری موثر نیست (127). اما در مطالعهای متاآنالیز نشان داده شد که استفاده از آیورمکتین میتواند باعث کاهش مارکرهای التهابی مثل CRP، دی دایمر و فریتین شود (128). چالشهایی پیرامون استفاده از ایورمکتین در زمینه ویروسکرونا وجود دارد که در مطالعات اخیر چگونگی فرمولاسیون جدید آن با استفاده از فناوریهای میکرو و نانو بحث شده است (129).کارآزماییهای بالینی جهت بررسی اثربخشی این دارو در بسیاری از کشورها انجام شده و یا در حال اجرا است (132-130, 128). چهار ترایال بزرگ در دنیا در حال بررسی آیورمکتین در کووید-۱۹ هستند همانند ترایال Covidout از دانشگاه Minnesota، ترایال Principle از انگلستان، ترایال Together از برزیل و ترایال ACTIV-6 از مؤسسه ملی سلامت (National Institutes of Health) یا NIH که باید جهت تصمیمگیری بهتر منتظر انتشار نتایج آنها باشیم.
8-2-10-Progesterone
اختلاف در میزان وابستگی به رابطه جنسی و مرگ و میر در بیماران کووید-۱۹ ممکن است به تفاوت در سطح هورمون¬های استروئیدی جنسی، آندروژنها و استروژنها مربوط شود (133,134). افراد مسن با ضریب ابتلا و مرگ و میر بیشتر دارای سطوح کمتری از این هورمونهای جنسی هستند (135). از این رو رابطه جنسی و پروژسترون به عنوان یک عامل بیولوژیکی ممکن است یک مداخله درمانی بالقوه برای این بیماری را نشان دهد (136). البته استروئیدهای جنسی، مانند استروژن و پروژسترون، برای استفاده به عنوان گزینه درمانی جایگزین برای بیماران مسن کووید-۱۹ نیاز به بررسی بیشتری دارند. همچنین داروهایی از جمله باریسیتینیب (Baricitinib) (137)، آزیترومایسین (Azithromycin) (138,139)،¬ کلشی سین (Colchicine) (140,141)، متیل پردنیزولون (Methylprednisolone) (111,142)، -ناپروکسن (Naproxen) (111,143)، تیلورون (Tilorone) (144,145)، پیرفنیدون (Pirfenidone) (146) و سیکلوسپورین (Cyclosporine) (142,147) در حال حاضر تحت آزمایشات بالینی و بررسی برای نحوه و میزان اثرگذاری برای درمان کووید-۱۹ است.
9-پیشگیری و واکسیناسیون
باور عمومی هنوز بین کسب ایمنی از طریق واکسن یا ایمنی گلهای دچار تردید است به همین جهت نیاز است بدانیم که ویروس در بدن افراد ضعیف و مستعدِ بیماری شدید، سیستم ایمنی را فریب میدهد و سیستم ایمنی نمیتواند پاسخهای مناسبی ایجاد کند و همین امر موجب ایجاد فرمهای مهلک کووید-۱۹ میشود، در عوض واکسن نه تنها این کار را نمی-کند بلکه معمولاً دارای مواد محرک سیستم ایمنی هم هست. در ابتلا به کووید-۱۹ معلوم نیست چه دوزی از ویروس وارد شده و چه شدتی از بیماری را رقم خواهد زد ولی واکسن دوز ثابت و مشخصی دارد و در جمعیت تحت واکسیناسیون ایمنی همگنتری را ایجاد میکند. در بسیاری (حدود یک سوم) از افراد بهبود یافته که اتفاقاً پادتن زیادی هم تولید کردهاند این پادتن نشاندهنده ایمنی پایدار و خنثیکننده نیست چرا که نشان داده شده که این نوع تولید پادتن زیادتر از معمول می-تواند خارج از مراکز زایای عقدههای لنفاوی و توسط لنفوسیتهای Bخارج فولیکولی شکل بگیرد و حتی پاتوژن باشد و سلولهای خاطره نیز به خوبی تحریک نمیشوند. ولی نتایج منتشر شده از ترایالهای واکسنهای مطرح نشاندهنده ایجاد پادتنهای خنثیکننده، قوی و تخصصی در اکثر افراد است و دوز یادآور واکسن، تحریک کامل سلولهای خاطره را تضمین میکند. سرنوشت ابتلا به کووید-۱۹ ممکن است بیماری شدید و درد و رنج و حتی مرگ باشد ولی حداقل تا امروز هیچ مورد واکنش بسیار شدید غیرقابل کنترل و مرگی از واکسن-های مطرح گزارش نشده است (150-148).
1-9-اهمیت مراقب و واکسیناسیون در زنان باردار
در اوایل گسترش سارسکروناویروس2، بارداری به عنوان یک عامل خطر در نظر گرفته نمیشد (151,152)، اما اخیراً نشان داده است که افراد باردار مبتلا به کووید-۱۹ در معرض خطر بیشتری برای پیامدهای جانبی ویروس، از جمله مرگ هستند (155-153). زنان باردار بیشتر در معرض خطر ابتلا به سارسکروناویروس2 هستند چراکه حتی بدون هیچ عامل خطر اضافی، تقریباً 40 درصد لنفوسیتB و سلولهای کشنده طبیعی (Natural killer cell) یا NKC در خون محیطی کمتر از زنان غیرباردار دارند (156,157). مطالعهای متاآنالیزگزارش میدهد که تعداد زیادی از زنان مبتلا به عفونت کووید-۱۹ تأیید شده دارای زایمان زودرس (22 درصد) و زایمان به روش سزارین (48 درصد) هستند (158). این طیف از جامعه نیازمند یک نگاه ویژه جمعیتی هم در واکسیناسیون و هم در درمان هستند چرا که زنان ممکن است بارداری خود را بهخاطر ویروس به تعویق اندازند که این می تواند خطرات جمعی بسیاری را موجب شود (159).
2-9-بررسی آخرین نتایج تحقیقات واکسیناسیون در ایران و جهان
آخرین تلاشها برای دستیابی به واکسن در جدول 1 به نمایش درآمده است. ضمناً در فاز یک و دو کلینیکال ترایال واکسن روسی که 76 نفر وارد مطالعه شده بودند باعث تولید آنتیبادی خنثیکننده و پاسخ لنفوسیتT در میزان قابل قبول برای ایجاد ایمنی شده است. تیتر IgG در این افراد میزان بالاتری در مقایسه با بهبود یافتگان از کووید-۱۹ داشته است و تزریق این واکسن عوارض جانبی شدید نیز نداشته است (160). در کارآزمایی بالینی فاز سوم واکسن ساخت روسیه اسپوتنیک وی(SputnikV) یا Gam-COVID-Vacحدوداً 20 هزار نفر بررسی شدهاند که کارایی 6.91 درصد بدون عوارض جدی گزارش شده است (162, 161). جالب است بدانیم که تایید واکسن فایزر بیونتک با کارایی بیش از 90 درصد برای کاتالین کاریکو (Katalin Kariko)، اعتباری برای 40 سال فعالیت و تحقیقات اوست. وی تحقیق بر روی mRNA را در سال 1978 در آزمایشگاهی در مجارستان آغاز کرد. کاریکو نشان داد که چگونه میتواند از مولکولهای تکرشتهای کد ژنتیکی برای درمان بیماریها از سرطان و سکته مغزی گرفته تا آنفولانزا استفاده کرد در حال حاضر شرکت فایزر بیونتک و شرکت مدرنا از این تکنولوژی برای ساخت واکسن موثر بر کووید-۱۹ استفاده کردند (163). اخیراً مطالعه آزمایشگاهی منتشر شده که موثر بودن فعالیت آنتیبادیهای خنثی کننده در سرم افراد واکسینه شده با فایزر علیه جهشهای کلیدی واریانتهای B.1.1.7 و B.1.351 را نشان میدهد (164). با انجام مطالعهای واکسن mRNA ساخت شرکت مادرنا با نامmRNA-1273 علیه کووید-۱۹، در مورد واریانت B.1.1.7 هم محافظت ایجاد میکند. هر چند که محافظت این واکسن در برابر واریانت B.1.351 ¬(نوعی که اولین بار در آفریقای جنوبی یافت شد) شش برابر کمتر است اما احتمالاً با این وجود نیز تیتر آنتیبادی ایجاد شده کفایت کند (75,165). موسسه ملی ویروسشناسی و شورای پژوهش پزشکی هند و شرکت هندی Bharat Biotech واکسنی به نام کووکسین (Covaxin)یاBBV152 با دوز 2 عدد به فاصله چهار هفته، طراحی نمودهاند که در مطالعات حیوانی در موش (166) و میمون (167) ایمونوژنیسیتی این واکسن را نشان داده شده است (168) مطالعه بالینی فاز یک (169)، فاز دوم (170) و فاز سوم (که هنوز بهطور کامل منتشر نشده است) برای آن طی شد. یک مطالعه پریپرینت موثر بودن این واکسن علیه واریانت B.1.1.7 در مدل آزمایشگاهی از طریق مقایسه فعالیت آنتیبادیهای خنثیکننده نشان داده است (171). با دریافت تاییدیه و مجوز استفاده اضطراری با توجه به عدم گزارش نتایج فاز سوم (ایمنی و تاثیرگذاری) تنها هند و ایران از این واکسن استفاده میکنند. میزان تاثیرگذاری آن حدود 80 درصد گزارش شده است (171,172). همچنین هند از نظر تعداد دوز تزریقی بعد از آمریکا، چین و انگلستان در رتبه چهارم قرار دارد. در ایران، در مجموع 9 پروژه واکسیناسیون با الگوهای مختلف در حال پیگیری است (-همانند پاستور در فاز سوم، برکت در فاز 3/2، فخرا و رازی و سیناژن در فاز دوم و نورا در فاز یکم). پیش مقاله فاز حیوانی واکسن مشترک کوبا و پاستور ایران در سه دز (دو دز از سوبرانا۲ به فاصله ۲۸ روز و دز سوم از سوبرانا پلاس در فاصله ۵۶ روز) در دسترس قرار دارد (173,174). فاز ۱ و ۲ بالینی در کوبا انجام شده ولی هیچ دادهای از آن در دسترس نیست. فاز سوم نیز در کوبا انجام شده و طبق نتایج اولیه با تزریق ۲ دز تاثیرگذاری ۶۲ درصد را نشان داده و هنوز نتایج برای تزریق سه دز اعلام نشده است (174,175). واکسن برکت اما یک نمونه واکسن کشته شده کرونا است که تست حیوانی را با موفقیت گذرانده و از سوی سازمان غذا و داروی ایران برای آزمایش بر روی انسان نیز تأییدیه دریافت نموده است و هم اکنون نیز به صورت اضطراری داوطلبانه تزریق میشود.

نتیجهگیری
با توجه به گستردگی ابتلا و شیوع ویروس کرونا در سطح جهان، در راستای یافتن روشهای درمانی یا کشف واکسن یا داروهای جدید برای مقابله با این ویروس مطالعات چشمگیری در حال انجام است. تاثیرات این همهگیری نه تنها به دوران این بیماری مربوط میشود بلکه مسلماً شرایط پساکرونا نیز دارای چالشهای فراوانی مخصوصاً در حوزه جمعیتی و خانواده خواهد بود. امیدواریم اطلاعات مرور حاضر با تمرکز بر اپیدمیولوژی، ویروسشناسی، روشهای انتقال، مشخصههای بالینی، یافتههای آزمایشگاهی، و جهشهای شایع، بتواند به متخصصانی که در شرایط کنونی در حال پژوهش روی ویروسکرونا هستند، کمک شایانی نماید.
سپاسگزاری
تقدیم به روح مطهر آقای اصغر حبیبی، دانشجوی کارشناسی ارشد بیوتکنولوژی پزشکی دانشگاه علوم پزشکی تبریز، که عمر خویش را در مسیر کسب دانش و اعتلای ایران سپری و سهم بسزایی در تهیه و ویرایش این اثر ایفا نمود.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
References:
1- Wang C, Horby PW, Hayden FG, Gao GF. A Novel Coronavirus Outbreak of Global Health Concern. Lancet 2020; 395(10223): 470-3.
2- Chilamakuri R, Agarwal S. COVID-19: Characteristics and Therapeutics. Cells 2021; 10(2): 206.
3- Ganji A, Gh M, Khaki M, Ghazavi A. A Review on Immunopathogenesis, Molecular Biology and Clinical Aspects of the 2019 Novel Coronavirus (1). J Arak Uni Med Sci (JAMS) 2020; 23(1): 8-21.
4- Shanmugaraj B, Siriwattananon K, Wangkanont K, Phoolcharoen W. Perspectives on Monoclonal Antibody Therapy as Potential Therapeutic Intervention for Coronavirus Disease-19 (1). Asian Pac J Allergy Immunol 2020; 38(1): 10-8.
5- Luk HK, Li X, Fung J, Lau SK, Woo PC. Molecular Epidemiology, Evolution and Phylogeny of SARS Coronavirus. Infect Gen Evol 2019; 71: 21-30.
6- Else H. How a Torrent of COVID Science Changed Research Publishing-In Seven Charts. Nature 2020; 588(7839): 553.
7- Pakzad B, Owlia MB. Corona Pandemic, Earth Restart Button. J Shahid Sadoughi University of Med Sci 2020; 28(1): 2229-34.
8- Imani Jajarmi H. Social Consequences of the Outbreak of Coronavirus in Iranian Society. Social Impact Assessment 2020 May1; 2: 87-103. (persian)
9- Menti H. Investigating The Effects of Coronavirus 19 on the Global Economy. Social Impact Assessment 2020; 2: 163-81.
10- Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia. New England J Med 2020; 382: 199-207.
11- Benvenuto D, Giovanetti M, Ciccozzi A, Spoto S, Angeletti S, Ciccozzi M. The 2019‐New Coronavirus Epidemic: Evidence for Virus Evolution. .J Medical Virology 2020; 92(4): 455-9.
12- Wong AC, Li X, Lau SK, Woo PC. Global Epidemiology of Bat Coronaviruses. Viruses 2019; 11(2): 174.
13- Ji W, Wang W, Zhao X, Zai J, Li X. Cross Species Transmission of the Newly Identified Coronavirus 2019‐Ncov. J Medical Virology 2020; 92(4): 433-40.
14- Of The International CSG. The Species Severe Acute Respiratory Syndrome-Related Coronavirus: Classifying 2019-Ncov and Naming It SARS-Cov-2. Nat Microbiol 2020; 5(4): 536-44.
15- Gralinski LE, Menachery VD. Return of the Coronavirus: 2019-Ncov. Viruses 2020; 12(2): 135.
16- Callaway E, Cyranoski D. Why Snakes Probably Aren’t Spreading the New China Virus. Nature 2020.
17- Wahl A, Gralinski LE, Johnson CE, Yao W, Kovarova M, Dinnon KH, et al. SARS-Cov-2 Infection is Effectively Treated and Prevented by EIDD-2801. Nature 2021; 591: 451-57.
18- Lam TT-Y, Jia N, Zhang YW, Shum MH-H, Jiang J-F, Zhu HC, et al. Identifying SARS-Cov-2-Related Coronaviruses in Malayan Pangolins. Nature 2020; 583: 282-85.
19- Wacharapluesadee S, Tan CW, Maneeorn P, Duengkae P, Zhu F, Joyjinda Y, et al. Evidence for SARS-Cov-2 Related Coronaviruses Circulating in Bats and Pangolins in Southeast Asia. Nature Communications 2021; 12: 972.
20- Fung TS, Liu DX. Human Coronavirus: Host-Pathogen Interaction. Annu Rev Microbiol 2019; 73: 529-57.
21- Tang X, Wu C, Li X, Song Y, Yao X, Wu X, et al. On the Origin and Continuing Evolution of SARS-Cov-2. National Science Review 2020; 7(6): 1012-23.
22- Blanco-Melo D, Nilsson-Payant B, Liu W-C, Møller R, Panis M, Sachs D, et al. SARS-Cov-2 Launches a Unique Transcriptional Signature from in Vitro, Ex Vivo, and in Vivo Systems. Biorxiv 2020.
23- Phan T. Novel Coronavirus: from Discovery to Clinical Diagnostics. Infect Genet Evol 2020; 79: 104211.
24- Shafique L, Ihsan A, Liu Q. Evolutionary Trajectory for the Emergence of Novel Coronavirus SARS-Cov-2. Pathogens 2020; 9(3): 240.
25- Wang K, Chen W, Zhou YS, Lian JQ, Zhang Z, Du P, et al. SARS-Cov-2 Invades Host Cells Via a Novel Route: CD147-Spike Protein. Biorxiv 2020: 1-10.
26- Wang X, Xu W, Hu G, Xia S, Sun Z, Liu Z, et al. SARS-Cov-2 Infects T Lymphocytes Through its Spike Protein-Mediated Membrane Fusion. Cell Mol Immunol 2020: 1-3.
27- Hui DS, Azhar EI, Kim YJ, Memish ZA, Oh Md, Zumla A. Middle East Respiratory Syndrome Coronavirus: Risk Factors and Determinants of Primary, Household, and Nosocomial Transmission. Lancet Infect Dis 2018; 18(8): E217-E27.
28- Santarpia JL, Rivera DN, Herrera V, Morwitzer MJ, Creager H, Santarpia GW, et al. Aerosol and Surface Transmission Potential of SARS-Cov-2. Medrxiv 2020.
29- Chan JF-W, Yuan S, Kok KH, To KK-W, Chu H, Yang J, et al. A Familial Cluster of Pneumonia Associated with the 2019 Novel Coronavirus Indicating Person-To-Person Transmission: A Study of a Family Cluster. The Lancet 2020; 395(10223): 514-23.
30- Li H, Liu Z, Ge J. Scientific Research Progress of COVID‐19/SARS‐Cov‐2 in the First Five Months. J Cellular and Molecular Med 2020; 24(12): 6558-70.
31- Li H, Leong FY, Xu G, Ge Z, Kang CW, Lim KH. Dispersion of Evaporating Cough Droplets in Tropical Outdoor Environment. Physics of Fluids 2020; 32(11): 113301.
32- Aydillo T, Gonzalez-Reiche AS, Aslam S, Van De Guchte A, Khan Z, Obla A, et al. Shedding of Viable SARS-Cov-2 after Immunosuppressive Therapy for Cancer. N Engl J Med 2020; 383(26): 2586-8.
33- Yeung ML, Yao Y, Jia L, Chan JF, Chan KH, Cheung KF, Et Al. MERS Coronavirus Induces Apoptosis in Kidney and Lung by Upregulating Smad7 and FGF2. Nat Microbiol 2016; 1(3): 16004.
34- Crackower MA, Sarao R, Oudit GY, Yagil C, Kozieradzki I, Scanga SE, et al. Angiotensin-Converting Enzyme 2 is an Essential Regulator of Heart Function. Nature 2002; 417(6891): 822-8.
35- Danilczyk U, Penninger JM. Angiotensin-Converting Enzyme II in the Heart and the Kidney. Circulation Research 2006; 98(4): 463-71.
36- Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS. Angiotensin-Converting Enzyme 2 (ACE2) as a SARS-Cov-2 Receptor: Molecular Mechanisms and Potential Therapeutic Target. Intensive Care Medicine 2020; 46(4): 586-90.
37- Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, et al. High Expression of ACE2 Receptor of 2019-Ncov on the Epithelial Cells of Oral Mucosa. International J Oral Science 2020; 12(1): 1-5.
38- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical Features of Patients Infected with 2019 Novel Coronavirus in Wuhan, China. The Lancet 2020; 10223(395): 497-506.
39- Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med 2020; 382: 727-33.
40- Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and Clinical Characteristics of 99 Cases of 2019 Novel Coronavirus Pneumonia in Wuhan, China: A Descriptive Study. The Lancet 2020; 395(10223): 507-13.
41- Wu Y, Guo C, Tang L, Hong Z, Zhou J, Dong X, et al. Prolonged Presence of SARS-Cov-2 Viral RNA in Faecal Samples. Lancet Gastroenterol Hepatol 2020; 5(5): 434-5.
42- Accili D. Can Covid-19 Cause Diabetes? Nat Metab 2021; 3(2): 123-5.
43- Yeoh YK, Zuo T, Lui GC-Y, Zhang F, Liu Q, Li AY, et al. Gut Microbiota Composition Reflects Disease Severity and Dysfunctional Immune Responses in Patients with COVID-19. Gut 2021; 70(4): 698-706.
44- Borges Do Nascimento IJ, Cacic N, Abdulazeem HM, Von Groote TC, Jayarajah U, Weerasekara I, et al. Novel Coronavirus Infection (1) in Humans: A Scoping Review and Meta-Analysis. J Clin Med 2020; 9(4): 941.
45- Zhou S, Wang Y, Zhu T, Xia L. CT Features of Coronavirus Disease 2019 (1) Pneumonia in 62 Patients in Wuhan, China. Am J Roentgenology 2020; 214(6): 1287-94.
46- Paules CI, Marston HD, Fauci AS. Coronavirus Infections—More Than Just the Common Cold. JAMA 2020; 323(8): 707-8.
47- Del Rio C, Malani PN. 2019 Novel Coronavirus—Important Information for Clinicians. JAMA 2020; 323(11): 1039-40.
48- Debiasi RL, Delaney M. Symptomatic and Asymptomatic Viral Shedding In Pediatric Patients Infected with Severe Acute Respiratory Syndrome Coronavirus 2 (Sars-Cov-2): Under the Surface. JAMA Pediatr 2020; 175(1): 16-18.
49- Oran DP, Topol EJ. The Proportion of SARS-Cov-2 Infections that are Asymptomatic: A Systematic Review. Ann Internal Med 2021; 174(5): 655-62.
50- Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (1): A Review. JAMA 2020; 324(8): 782-93.
51- Harapan H, Itoh N, Yufika A, Winardi W, Keam S, Te H, et al. Coronavirus Disease 2019 (1): A Literature Review. J Infection and Public Health 2020; 13(5): 667-73
52- Wu J, Li J, Zhu G, Zhang Y, Bi Z, Yu Y, et al. Clinical Features of Maintenance Hemodialysis Patients with 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. Clin J American Soc Nephrol 2020; 15(8): 1139-45.
53- Li T, Wei C, Li W, Hongwei F, Shi J. Beijing :union: Medical College Hospital on" Pneumonia of Novel Coronavirus Infection" Diagnosis and Treatment Proposal (V2. 0). Med J Peking :union: Med Coll Hosp 2020.
54- Udugama B, Kadhiresan P, Kozlowski HN, Malekjahani A, Osborne M, Li VY, et al. Diagnosing COVID-19: The Disease and Tools for Detection. ACS Nano 2020; 14(4): 3822-35.
55- Li X, Geng M, Peng Y, Meng L, Lu S. Molecular Immune Pathogenesis and Diagnosis of COVID-19. J Pharmaceutical Analysis 2020; 10(2): 102-8.
56- Li Y, Yao L, Li J, Chen L, Song Y, Cai Z, et al. Stability Issues of RT PCR Testing of SARS‐Cov‐2 for Hospitalized Patients Clinically Diagnosed with COVID‐19. J Medical Virology 2020; 92(7): 903-8.
57- Holshue ML, Debolt C, Lindquist S, Lofy KH, Wiesman J, Bruce H, et al. First Case of 2019 Novel Coronavirus in the United States. N Engl J Med 2020; 382: 929-36.
58- Ozma MA, Maroufi P, Khodadadi E, Köse Ş, Esposito I, Ganbarov K, et al. Clinical Manifestation, Diagnosis, Prevention and Control of SARS-Cov-2 (1) during the Outbreak Period. Infez Med 2020: 28(2): 153-65.
59- Li RL, Chu SG, Luo Y, Huang ZH, Hao Y, Fan CH. Atypical Presentation of SARS-Cov-2 Infection: A Case Report. World J Clinical Cases 2020; 8(7): 1265-70.
60- Al-Tawfiq JA, Memish ZA. Diagnosis of SARS-Cov-2 Infection Based on CT Scan Vs RT-PCR: Reflecting on Experience from MERS-Cov. J Hospital Infection 2020; 105(2): 154-5.
61- Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S, et al. Development and Clinical Application of a Rapid Igm Igg Combined Antibody Test for SARS Cov‐2 Infection Diagnosis. J Medical Virology 2020; 92(9): 1518-24.
62- Rodda LB, Netland J, Shehata L, Pruner KB, Morawski PM, Thouvenel C, et al. Functional SARS-Cov-2-Specific Immune Memory Persists after Mild COVID-19. Res Sq. 2020; rs.3.rs-57112
63- Bastos ML, Perlman-Arrow S, Menzies D, Campbell JR. The Sensitivity and Costs of Testing for SARS-Cov-2 Infection with Saliva Versus Nasopharyngeal Swabs: A Systematic Review and Meta-Analysis. Annals of Internal Medicine 2021; 174(4): 501-10.
64- Organization WH. Coronavirus Disease (COVID-19): Similarities and Differences with Influenza. Accessed September 2020; 7.
65- Song X, Delaney M, Shah RK, Campos JM, Wessel DL, Debiasi RL. Comparison of Clinical Features of COVID-19 Vs Seasonal Influenza a and B in US Children. JAMA Netw Open 2020; 3(9): E2020495.
66- Cobb NL, Sathe NA, Duan KI, Seitz KP, Thau MR, Sung CC, et al. Comparison of Clinical Features and Outcomes in Critically Ill Patients Hospitalized with COVID-19 Versus Influenza. Annals of the American Thoracic Society 2021; 18(4): 632-40
67- Marín‐Hernández D, Schwartz RE, Nixon DF. Epidemiological Evidence for Association Between Higher Influenza Vaccine Uptake in the Elderly and Lower COVID‐19 Deaths in Italy. J Medical Virology 2020.
68- Agha S. Mental Well-Being and Association of the Four Factors Coping Structure Model: A Perspective of People Living in Lockdown During COVID-19. Ethics, Medicine and Public Health 2021; 16: 100605.
69- Wu P, Fang Y, Guan Z, Fan B, Kong J, Yao Z, et al. The Psychological Impact of the SARS Epidemic on Hospital Employees in China: Exposure, Risk Perception, and Altruistic Acceptance of Risk. The Canadian J Psychiatry 2009; 54(5): 302-11.
70- Chen Q, Liang M, Li Y, Guo J, Fei D, Wang L, et al. Mental Health Care for Medical Staff in China During the COVID-19 Outbreak. The Lancet Psychiatry 2020; 7(4): E15-E6.
71- Kang L, Li Y, Hu S, Chen M, Yang C, Yang BX, et al. The Mental Health of Medical Workers in Wuhan, China Dealing with the 2019 Novel Coronavirus. The Lancet Psychiatry 2020; 7(3): E14.
72- Andrasfay T, Goldman N. Reductions in 2020 US Life Expectancy Due to COVID-19 and the Disproportionate Impact on the Black and Latino Populations. Proceedings of the National Academy of Sciences 2021; 118(5): E2014746118.
73- Mazereel V, Van Assche K, Detraux J, De Hert M. COVID-19 Vaccination for People with Severe Mental Illness: Why, What, and How? The Lancet Psychiatry 2021; 8(5): 444-50.
74- Wise J. COVID-19: New Coronavirus Variant is Identified in UK. BMJPG 2020; 371.
75- Wu K, Werner AP, Moliva JI, Koch M, Choi A, Stewart-Jones GB, et al. Mrna-1273 Vaccine Induces Neutralizing Antibodies Against Spike Mutants from Global SARS-Cov-2 Variants. Biorxiv 2021.
76- Shi PY, Xie X, Zou J, Fontes-Garfias C, Xia H, Swanson K, et al. Neutralization of N501Y Mutant SARS-Cov-2 By BNT162b2 Vaccine-Elicited Sera. Biorxiv 2021.
77- Horby P, Huntley C, Davies N, Edmunds J, Ferguson N, Medley G, et al. Update Note on B. 1.1. 7 Severity. NERVTAG 2021.
78- Iacobucci G. COVID-19: New UK Variant May Be Linked to Increased Death Rate, Early Data Indicate. BMJ 2021; 372: N230.
79- Assessment RR. Risk Related to the Spread of New SARS-Cov-2 Variants of Concern in the EU/EEA–First Update. European Centre for Disease Prevention and Control an Agency of the European :union:. 2021
80- Mahase E. COVID-19: Sore Throat, Fatigue, and Myalgia are More Common with New UK Variant. BMJ 2021: 372: N288.
81- Graham MS, Sudre CH, May A, Antonelli M, Murray B, Varsavsky T, et al. The Effect of SARS-Cov-2 Variant B. 1.1. 7 on Symptomatology, Re-Infection and Transmissibility. Medrxiv 2021.
82- Davies NG, Abbott S, Barnard RC, Jarvis CI, Kucharski AJ, Munday JD, et al. Estimated Transmissibility and Impact of SARS-Cov-2 Lineage B. 1.1. 7 in England. Science 2021 9; 372(6538).
83- Challen R, Brooks-Pollock E, Read JM, Dyson L, Tsaneva-Atanasova K, Danon L. Risk of Mortality in Patients Infected with SARS-Cov-2 Variant of Concern 202012/1: Matched Cohort Study. BMJ 2021; 372.
84- Greaney AJ, Loes AN, Crawford KH, Starr TN, Malone KD, Chu HY, et al. Comprehensive Mapping of Mutations to the SARS-Cov-2 Receptor-Binding Domain that Affect Recognition by Polyclonal Human Serum Antibodies. Biorxiv 2021; 29(3): 463-76.
85- Zhou D, Dejnirattisai W, Supasa P, Liu C, Mentzer AJ, Ginn HM, et al. Evidence of escape of SARS-CoV-2 variant B.1.351 from natural and vaccine-induced sera. Cell 2021; 184(9): 2348-61.e6.
86- Resende PC, Bezerra JF, Vasconcelos Rd, Arantes I, Appolinario L, Mendonça AC, et al. Spike E484K Mutation in the First SARS-Cov-2 Reinfection Case Confirmed in Brazil, 2020. Virological Org 2021.
87- Naveca F, Nascimento V, Souza V, Corado A, Nascimento F, Silva G, et al. Phylogenetic Relationship of SARS-Cov-2 Sequences from Amazonas with Emerging Brazilian Variants Harboring Mutations E484K and N501Y in the Spike Protein. Virological Org 2021.
88- Centers For Disease Control and Prevention. About Variants of the Virus that Causes Covid-19. Updated April 2, 2021. Https:// Www.Cdc.Gov/ Coronavirus/2019-Ncov/Transmission/Variant.Html.
89- World Health Organization. SARS-Cov-2 Variants of Concern and Variants of Interest, Updated 31 May 2021. Https:// Www.Who.Int/En/ Activities/ Tracking-SARS-Cov-2-Variants.
90- Callaway E. Delta Coronavirus Variant: Scientists Brace for Impact. Nature 2021; 595(7865): 17-8.
91- Sheikh A, Mcmenamin J, Taylor B, Robertson C. SARS-Cov-2 Delta VOC in Scotland: Demographics, Risk of Hospital Admission, and Vaccine Effectiveness. The Lancet 2021; 397 (¬10293): P2461-62
92- Starr TN, Greaney AJ, Dingens AS, Bloom JD. Complete Map of SARS-Cov-2 RBD Mutations that Escape the Monoclonal Antibody LY-Cov555 and its Cocktail with LY-Cov016. Cell Reports Medicine 2021; 2(4): 100255.
93- Bager P, Wohlfahrt J, Fonager J, Rasmussen M, Albertsen M, Michaelsen TY, et al. Risk of Hospitalisation Associated with Infection with SARS-Cov-2 Lineage B. 1.1. 7 in Denmark: An Observational Cohort Study. The Lancet Infectious Diseases 2021; 21(11): 1507-17.
94- Patone M, Thomas K, Hatch R, San Tan P, Coupland C, Liao W, et al. Mortality and Critical Care Unit Admission Associated with the SARS-Cov-2 Lineage B. 1.1. 7 in England: An Observational Cohort Study. The Lancet Infectious Diseases 2021; 21(11): 1518-28.
95- Iacobucci G. COVID-19: Single Vaccine Dose Is 33% Effective Against Variant from India, Data Show. BMJ 2021; 373: N1346.
96- Bernal JL, Andrews N, Gower C, Gallagher E, Simmons R, Thelwall S, et al. Effectiveness of Covid-19 Vaccines Against the B. 1.617. 2 Variant. N Engl J Med¬; 385(7): 585-94.
97- Bolze A, Cirulli ET, Luo S, White S, Cassens T, Jacobs S, et al. Rapid Displacement of SARS-Cov-2 Variant B. 1.1. 7 By B. 1.617. 2 And P. 1 in the United States. Medrxiv. 2021; 1-9.
98- Niesen M, Anand P, Silvert E, Suratekar R, Pawlowski C, Ghosh P, et al. COVID-19 Vaccines Dampen Genomic Diversity of SARS-Cov-2: Unvaccinated Patients Exhibit More Antigenic Mutational Variance. Medrxiv 2021.
99- Haug N, Geyrhofer L, Londei A, Dervic E, Desvars-Larrive A, Loreto V, et al. Ranking The Effectiveness Of Worldwide COVID-19 Government Interventions. Nature Human Behaviour 2020; 4(12): 1303-12.
100- Huang C. A Randomized, Open-Label, Blank-Controlled Trial for the Efficacy and Safety of Lopinavir-Ritonavir and Interferon-Alpha 2b in Hospitalization Patients with Novel Coronavirus Pneumonia (COVID-19). Chinese Clinical Trial Registry.
101- Pruijssers AJ, George AS, Schäfer A, Leist SR, Gralinksi LE, Dinnon III KH, et al. Remdesivir Inhibits SARS-Cov-2 in Human Lung Cells and Chimeric SARS-Cov Expressing the SARS-Cov-2 RNA Polymerase In Mice. Cell Reports 2020; 32(3): 107940.
102- Ye W, Yao M, Dong Y, Ye C, Wang D, Liu H, et al. Remdesivir (GS-5734) Impedes Enterovirus Replication Through Viral RNA Synthesis Inhibition. Frontiers in Microbiology 2020; 11: 1-9.
103- Han Y, Wang Z, Ren J, Wei Z, Li J. Potential Inhibitors for the Novel Coronavirus (SARS-Cov-2). Briefings in Bioinformatics 2021; 22(2): 1225-31.
104- Hussain N, Yoganathan A, Hewage S, Alom S, Harky A. The Effect of Antivirals on COVID-19: A Systematic Review. Expert Review of Anti-Infective Therapy 2021; 19(4): 473-86.
105- Yamamoto V, Bolanos JF, Fiallos J, Strand SE, Morris K, Shahrokhinia S, et al. COVID-19: Review of a 21st Century Pandemic from Etiology to Neuro-Psychiatric Implications. J Alzheimer's Disease 2020; 77: 459-504.
106- Uzunova K, Filipova E, Pavlova V, Vekov T. Insights Into Antiviral Mechanisms of Remdesivir, Lopinavir/Ritonavir and Chloroquine/Hydroxychloroquine Affecting the New SARS-Cov-2. Biomedicine & Pharmacotherapy 2020; 131: 110668.
107- Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe COVID-19. N Engl J Med 2020; 382: 1787-99.
108- White KM, Rosales R, Yildiz S, Kehrer T, Miorin L, Moreno E, et al. Plitidepsin Has Potent Preclinical Efficacy Against SARS-Cov-2 by Targeting the Host Protein Eef1a. Science 2021; 371(6532): 926-31.
109- Fang QQ, Huang WJ, Li XY, Cheng YH, Tan MJ, Liu J, et al. Effectiveness of Favipiravir (T-705) Against Wild-Type and Oseltamivir-Resistant Influenza B Virus in Mice. Virology 2020; 545: 1-9.
110- Shiraki K, Daikoku T. Favipiravir, An Anti-Influenza Drug Against Life-Threatening Rna Virus Infections. Pharmacology & Therapeutics 2020; 209: 107512.
111- Rismanbaf A. Potential Treatments for COVID-19; A Narrative Literature Review. Arch Acad Emerg Med 2020; 8.
112- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and Chloroquine Effectively Inhibit the Recently Emerged Novel Coronavirus (2019-Ncov) in Vitro. Cell Research 2020; 30(3): 269-71.
113- Offerhaus JA, Wilde AA, Remme CA. Prophylactic (Hydroxy) Chloroquine in COVID-19: Potential Relevance for Cardiac Arrhythmia Risk. Heart Rhythm 2020; 17(9): 1480-6.
114- Zang Y, Han X, He M, Shi J, Li Y. Hydroxychloroquine Use and Progression or Prognosis of COVID-19: A Systematic Review and Meta-Analysis. Naunyn-Schmiedeberg's Archives of Pharmacology 2020; 394: 775-82.
115- Lei ZN, Wu ZX, Dong S, Yang DH, Zhang L, Ke Z, et al. Chloroquine and Hydroxychloroquine in the Treatment of Malaria and Repurposing in Treating COVID-19. Pharmacology & Therapeutics 2020; 216: 107672.
116- Ip A, Ahn J, Zhou Y, Goy AH, Hansen E, Pecora AL, et al. Hydroxychloroquine in the Treatment of Outpatients with Mildly Symptomatic COVID-19: A Multi-Center Observational Study. BMC Infectious Diseases 2021; 21: 72.
117- Baladia E, Pizarro AB, Ortiz-Muñoz L, Rada G, Group C-LOW. Vitamin C for COVID-19: A Living Systematic Review. Medwave 2020; 20(6): E7978.
118- Feyaerts AF, Luyten W. Vitamin C as Prophylaxis and Adjunctive Medical Treatment for Covid-19? Nutrition 2020; 79-80: 110948:
119- Hemilä H, Chalker E. Vitamin C as A Possible Therapy for COVID-19. Infection & Chemotherapy 2020; 52(2): 222-23.
120- Muacevic A, Adler J, Kumari P, Dembra S, Dembra P, Bhawna F, et al. The Role of Vitamin C as Adjuvant Therapy In COVID-19. Cureus 2021; (11)12: E11779.
121- Mohan M, Cherian JJ, Sharma A. Exploring Links Between Vitamin D Deficiency and COVID-19. Plos Pathogens 2020; 16(9): E1008874.
122- Teymoori Rad M, Marashi SM. Vitamin D and Covid‐19: From Potential Therapeutic Effects to Unanswered Questions. Reviews In Med Virology 2020; 31(2): E2159.
123- Vyas N, Kurian SJ, Bagchi D, Manu MK, Saravu K, Unnikrishnan MK, et al. Vitamin D in Prevention and Treatment of COVID-19: Current Perspective and Future Prospects. J American College of Nutrition 2021; 40(7): 632-45.
124- Merzon E, Tworowski D, Gorohovski A, Vinker S, Golan Cohen A, Green I, et al. Low Plasma 25 (OH) Vitamin D Level is Associated with Increased Risk of COVID‐19 Infection: An Israeli Population Based Study. The FEBS J 2020; 287(17): 3693-702
125- Thomas S, Patel D, Bittel B, Wolski K, Wang Q, Kumar A, et al. Effect of High-Dose Zinc and Ascorbic Acid Supplementation Vs Usual Care on Symptom Length and Reduction among Ambulatory Patients with SARS-Cov-2 Infection: The COVID A to Z Randomized Clinical Trial. JAMA Netw Open 2021; 4(2): E210369-E.
126- Caly L, Druce JD, Catton MG, Jans DA, Wagstaff KM. The FDA-Approved Drug Ivermectin Inhibits the Replication of SARS-Cov-2 in Vitro. Antiviral Res 2020; 178: 104787.
127- Vallejos J, Zoni R, Bangher M, Villamandos S, Bobadilla A, Plano F, et al. Ivermectin to Prevent Hospitalizations in Patients with COVID-19 (IVERCOR-COVID19) A Randomized, Double-Blind, Placebo-Controlled Trial. BMC Infect Dis 2021; 21(1): 635.
128- Hill A, Abdulamir A, Ahmed S, Asghar A, Babalola OE, Basri R, et al. Meta-Analysis of Randomized Trials of Ivermectin to Treat SARS-Cov-2 Infection. Open Forum Infect Dis 2021; 8(11): Ofab358
129- Formiga FR, Leblanc R, De Souza Rebouças J, Farias LP, De Oliveira RN, Pena L. Ivermectin: An Award-Winning Drug with Expected Antiviral Activity Against COVID-19. J Controlled Release 2021; 329: 758-61.
130- López-Medina E, López P, Hurtado IC, Dávalos DM, Ramirez O, Martínez E, et al. Effect of Ivermectin on Time to Resolution of Symptoms among Adults with Mild COVID-19: A Randomized Clinical Trial. JAMA 2021; 325(14): 1426-35.
131- Khan MSI, Khan MSI, Debnath CR, Nath PN, Al Mahtab M, Nabeka H, et al. Ivermectin Treatment May Improve the Prognosis of Patients with COVID-19. Arch De Bronconeumol 2020; 56(12): 828-30.
132- Bryant A, Lawrie TA, Dowswell T, Fordham EJ, Scott M, Hill SR, et al. Ivermectin for Prevention and Treatment of COVID-19 Infection: A Systematic Review, Meta-Analysis And Trial Sequential Analysis to Inform Clinical Guidelines. Am J Ther 2021; 28(4): E434-E60.
133- Lipsa A, Prabhu JS. Gender Disparity in COVID-19: Role of Sex Steroid Hormones. Asian Pacific J Tropical Med 2021; 14(1): 5-9.
134- Mauvais-Jarvis F, Klein SL, Levin ER. Estradiol, Progesterone, Immunomodulation, and COVID-19 Outcomes. Endocrinology 2020; 161(1): Bqaa127.
135- Okpechi SC, Fong JT, Gill SS, Harman JC, Nguyen TH, Chukwurah QC, et al. Global Sex Disparity of COVID-19: A Descriptive Review of Sex Hormones and Consideration for the Potential Therapeutic Use of Hormone Replacement Therapy in Older Adults. Aging Dis 2021; 12(2): 671-83.
136- Ghandehari S, Matusov Y, Pepkowitz S, Stein D, Kaderi T, Narayanan D, et al. Progesterone in Addition to Standard of Care Vs Standard of Care Alone in the Treatment of Men Hospitalized with Moderate to Severe COVID-19: A Randomized, Controlled Pilot Trial. Chest 2021; 160(1): 74-84.
137- Liu K, Fang YY, Deng Y, Liu W, Wang MF, Ma JP, et al. Clinical Characteristics of Novel Coronavirus Cases in Tertiary Hospitals in Hubei Province. Chin Med J 2020; 133(9): 1025-31.
138- Echeverría-Esnal D, Martin-Ontiyuelo C, Navarrete-Rouco ME, De-Antonio Cuscó M, Ferrández O, Horcajada JP, et al. Azithromycin in the Treatment of COVID-19: A Review. Expert Rev Anti-Infect Ther 2021; 19(2): 147-63.
139- Oldenburg CE, Doan T. Azithromycin for Severe COVID-19. The Lancet 2020; 396(10256): 936-7.
140- Parra-Medina R, Sarmiento-Monroy JC, Rojas-Villarraga A, Garavito E, Montealegre-Gómez G, Gómez-López A. Colchicine as a Possible Therapeutic Option in COVID-19 Infection. Clin Rheumatol 2020; 39(8): 2485-6.
141- Schlesinger N, Firestein BL, Brunetti L. Colchicine in Covid-19: An Old Drug, New Use. Curr Pharmacol Rep 2020; 6(4): 137-45.
142- Tu YF, Chien CS, Yarmishyn AA, Lin YY, Luo YH, Lin YT, et al. A Review of SARS-Cov-2 and the Ongoing Clinical Trials. International. Int J Mol Sci 2020; 21(7): 2657.
143- Wongrakpanich S, Wongrakpanich A, Melhado K, Rangaswami J. A Comprehensive Review of Non-Steroidal Anti-Inflammatory Drug Use in the Elderly. Aging Dis 2018; 9(1): 143-50.
144- Ekins S, Lane TR, Madrid PB. Tilorone: A Broad-Spectrum Antiviral Invented in the USA and Commercialized in Russia and Beyond. Pharm Res 2020; 37(4): 1-8.
145- Lane TR, Massey C, Comer JE, Anantpadma M, Freundlich JS, Davey RA, et al. Repurposing the Antimalarial Pyronaridine Tetraphosphate to Protect Against Ebola Virus Infection. Plos Neglected Tropical Diseases 2019; 13(11): E0007890.
146- Seifirad S. Pirfenidone: A Novel Hypothetical Treatment for COVID-19. Med Hypotheses 2020; 144: 110005.
147- Sanchez-Pernaute O, Romero-Bueno F. Why Choose Cyclosporin A as First-Line Therapy in COVID-19 Pneumonia. Reumatol Clin 2021; 17(9): 555-57.
148- Stephens DS, Mcelrath MJ. Covid-19 and the Path to Immunity. JAMA 2020; 324(13): 1279-81.
149- Farris AD, Guthridge JM. Overlapping B Cell Pathways in Severe COVID-19 And Lupus. Nat Immunol 2020; 21(12): 1478-80.
150- Sahin U, Muik A, Derhovanessian E, Vogler I, Kranz LM, Vormehr M, et al. COVID-19 Vaccine BNT162b1 Elicits Human Antibody and TH 1 T Cell Responses. Nature 2020; 586(7830): 594-9.
151- Heath PT, Le Doare K, Khalil A. Inclusion of Pregnant Women in COVID-19 Vaccine Development. The Lancet Infectious Dis 2020; 20(9): 1007-8.
152- Shimabukuro TT, Kim SY, Myers TR, Moro PL, Oduyebo T, Panagiotakopoulos L, et al. Preliminary Findings of Mrna Covid-19 Vaccine Safety in Pregnant Persons. New England J Med 2021; 384: 2273-82.
153- Kotlar B, Gerson E, Petrillo S, Langer A, Tiemeier H. The Impact of the COVID-19 Pandemic on Maternal and Perinatal Health: A Scoping Review. Reproductive Health 2021; 18(1): 1-39.
154- Zambrano LD, Ellington S, Strid P, Galang RR, Oduyebo T, Tong VT, et al. Update: Characteristics of Symptomatic Women of Reproductive Age with Laboratory-Confirmed SARS-Cov-2 Infection by Pregnancy Status—United States, January 22–October 3, 2020. MMWR Morb Mortal Wkly Rep 2020; 69(44): 1641-47.
155- Nakamura Pereira M, Knobel R, Menezes MO, Andreucci CB, Takemoto ML. The Impact of the COVID‐19 Pandemic on Maternal Mortality in Brazil: 523 Maternal Deaths by Acute Respiratory Distress Syndrome Potentially Associated with SARS‐Cov‐2. Int J Gynecol Obstet 2021; 153(2): 360-2.
156- Hanna N, Hanna M, Sharma S. Is Pregnancy an Immunological Contributor to Severe or Controlled COVID‐19 Disease? Am J Reprod Immunol 2020; 84(5): E13317.
157- Schettini Jadc, Gomes TV, Silva Cdd, Heráclio Sda, Coelho Iccdan, Torres LC. Evaluation of Immunological Parameters in Pregnant Women: Low Levels of B and NK Cells. Rev Bras De Ginecol Obstet 2019; 41(4): 213-9.
158- Khalil A, Kalafat E, Benlioglu C, O'Brien P, Morris E, Draycott T, et al. SARS-Cov-2 Infection in Pregnancy: A Systematic Review and Meta-Analysis of Clinical Features and Pregnancy Outcomes. Eclinicalmedicine 2020; 25: 100446.
159- La Cour Freiesleben N, Nielsen HS. Timely Care for Extrauterine Pregnancies During the COVID-19 Pandemic is Needed. Lancet Reg Health-Eur 2021; 2: 100037.
160- Bar-Zeev N, Inglesby T. COVID-19 Vaccines: Early Success and Remaining Challenges. The Lancet 2020; 396(10255): 868-69.
161- Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and Efficacy of an Rad26 and Rad5 Vector-Based Heterologous Prime-Boost COVID-19 Vaccine: An Interim Analysis of A Randomised Controlled Phase 3 Trial in Russia. The Lancet 2021; 397(10275): 671-81.
162- Jones I, Roy P. Sputnik V COVID-19 Vaccine Candidate Appears Safe and Effective. Lancet. 2021; 397(10275): 642-43.
163- Lima B. Diversidade, Que Me Queira: Cepas, Linhagens E Variantes Do Coronavírus. 2021. Http://146.164.63.47/Alexandria_Wp/Artigos/
164- Xie X, Liu Y, Liu J, Zhang X, Zou J, Fontes-Garfias CR, et al. Neutralization of SARS-Cov-2 Spike 69/70 Deletion, E484K and N501Y Variants by BNT162b2 Vaccine-Elicited Sera. Nature Medicine 2021; 27: 620-21.
165- Tanne JH. COVID-19: Moderna Plans Booster Doses to Counter Variants. BMJ: British Medical J 2021; 372: N232.
166- Mohandas S, Yadav PD, Shete-Aich A, Abraham P, Vadrevu KM, Sapkal G, et al. Immunogenicity and Protective Efficacy of BBV152, Whole Virion Inactivated SARS-Cov-2 Vaccine Candidates in the Syrian Hamster Model. Iscience 2021; 24(2): 102054.
167- Yadav P, Ella R, Kumar S, Patil D, Mohandas S, Shete A, et al. Remarkable Immunogenicity and Protective Efficacy of BBV152, An Inactivated SARS-Cov-2 Vaccine in Rhesus Macaques. Nat Commun 2021; 12(1): 1386.
168- Said Yousef. COVID Vaccination and Diabetes. Jan 20, 2021. Https://Glucare.Health/Covid-Vaccination-And-Diabetes.
169- Ella R, Vadrevu KM, Jogdand H, Prasad S, Reddy S, Sarangi V, et al. Safety and Immunogenicity of an Inactivated SARS-Cov-2 Vaccine, BBV152: A Double-Blind, Randomised, Phase 1 Trial. The Lancet Infectious Diseases 2021; 21(7): 950-61.
170- Ella R, Vadrevu KM, Jogdand H, Prasad SD, Reddy S, Sarangi V, et al. Safety and Immunogenicity Trial of an Inactivated SARS-Cov-2 Vaccine-BBV152: A Phase 1, Double-Blind, Randomised Control Trial 2020.
171- Sapkal GN, Yadav P, Ella R, Deshpande G, Sahay R, Gupta N, et al. Neutralization of UK-Variant VUI-202012/01 with COVAXIN Vaccinated Human Serum. Biorxiv 2021.
172- Phase BBA. Results of COVAXIN®: India’s First COVID-19 Vaccine Demonstrates Interim Clinical Efficacy of 81%. Bharatbiotech Press Release; 2021.
173- Valdes-Balbin Y, Santana-Mederos D, Quintero L, Fernandez S, Rodriguez L, Sanchez-Ramirez B, et al. SARS-Cov-2 RBD-Tetanus Toxoid Conjugate Vaccine Induces A Strong Neutralizing Immunity in Preclinical Studies. Biorxiv 2021.
174- Moinipour S. The Islamic Republic of Iran and Children’s Right to Education: Availability & Accessibility. Human Rights Education Review 2021; 4(2): 5-25.
175- Basiri N, Koushki M. Study of Vaccine Production Abroad and Scientific and Research Challenges of COVID-19 Vaccine Production in Iran. Annals of the Romanian Society for Cell Biology 2021: 17249-56.
176- Dutta AK. Vaccine Against COVID-19 Disease–Present Status of Development. Indian J Pediatr 2020; 87(10): 810-16.
177- Wang F, Kream RM, Stefano GB. An Evidence Based Perspective on Mrna-SARS-Cov-2 Vaccine Development. Med Sci Monit 2020; 26: E924700-1.
178- Le TT, Andreadakis Z, Kumar A, Román RG, Tollefsen S, Saville M, et al. The COVID-19 Vaccine Development Landscape. Nat Rev Drug Discov 2020; 19(10): 667-68.
179- Corbett KS, Flynn B, Foulds KE, Francica JR, Boyoglu-Barnum S, Werner AP, et al. Evaluation of the Mrna-1273 Vaccine Against SARS-Cov-2 in Nonhuman Primates. N Engl J Med 2020; 383(16): 1544-55.
180- Bennet BM, Wolf J, Laureano R, Sellers RS. Review of Current Vaccine Development Strategies to Prevent Coronavirus Disease 2019 (1). Toxicologic Pathology 2020; 48(7): 800-9.
181- Kaur SP, Gupta V. COVID-19 Vaccine: A Comprehensive Status Report. Virus Res 2020:198114.
182- Walsh EE, Frenck Jr RW, Falsey AR, Kitchin N, Absalon J, Gurtman A, et al. Safety and Immunogenicity of Two RNA-Based COVID-19 Vaccine Candidates. N Engl J Medicine 2020; 383(25): 2439-50.
183- Bhagavathula AS, Aldhaleei WA, Rovetta A, Rahmani J. Vaccines and Drug Therapeutics to Lock Down Novel Coronavirus Disease 2019 (1): A Systematic Review of Clinical Trials. Cureus 2020; 12(5): E8342.
184- Smith TR, Patel A, Ramos S, Elwood D, Zhu X, Yan J, et al. Immunogenicity of A DNA Vaccine Candidate for COVID-19. Nat Commun 2020; 11(1): 2601.
185- Patel A, Walters J, Reuschel EL, Schultheis K, Parzych E, Gary EN, et al. Intradermal-Delivered DNA Vaccine Provides Anamnestic Protection in A Rhesus Macaque SARS-Cov-2 Challenge Model. Cell Rep Med 2021; 2(10): 100420.
186- Kochhar S, Salmon DA. Planning for COVID-19 Vaccines Safety Surveillance. Vaccine 2020; 38(40): 6194-8.
187- Shih HI, Wu CJ, Tu YF, Chi CY. Fighting COVID-19: A Quick Review of Diagnoses, Therapies, and Vaccines. Biomed J 2020; 43(4): 341-54.
188- Chibber P, Haq SA, Ahmed I, Andrabi NI, Singh G. Advances in the Possible Treatment of COVID-19: A Review. Eur J Pharmacol 2020; 883: 173372.
189- Funk CD, Laferrière C, Ardakani A. A Snapshot of the Global Race for Vaccines Targeting SARS-Cov-2 and The COVID-19 Pandemic. Front Pharmacol 2020; 11: 937.
190- Folegatti PM, Ewer KJ, Aley PK, Angus B, Becker S, Belij-Rammerstorfer S, et al. Safety and Immunogenicity of the Chadox1 Ncov-19 Vaccine Against SARS-Cov-2: A Preliminary Report of a Phase 1/2, Single-Blind, Randomised Controlled Trial. Lancet 2020; 396(10249): 467-78.
191- Van Doremalen N, Lambe T, Spencer A, Belij-Rammerstorfer S, Purushotham JN, Port JR, et al. Chadox1 Ncov-19 Vaccine Prevents SARS-Cov-2 Pneumonia in Rhesus Macaques. Nature 2020; 586(7830): 578-82.
192- Logunov DY, Dolzhikova IV, Zubkova OV, Tukhvatullin AI, Shcheblyakov DV, Dzharullaeva AS, et al. Safety and Immunogenicity of An Rad26 and Rad5 Vector-Based Heterologous Prime-Boost COVID-19 Vaccine in Two Formulations: Two Open, Non-Randomised Phase 1/2 Studies From Russia. Lancet 2020; 396(10255): 887-97.
193- Zhu FC, Li YH, Guan XH, Hou LH, Wang WJ, Li JX, et al. Safety, Tolerability, and Immunogenicity of A Recombinant Adenovirus Type-5 Vectored COVID-19 Vaccine: A Dose-Escalation, Open-Label, Non-Randomised, First-In-Human Trial. Lancet 2020; 395(10240): 1845-54.
194- Florindo HF, Kleiner R, Vaskovich-Koubi D, Acúrcio RC, Carreira B, Yeini E, et al. Immune-Mediated Approaches Against COVID-19. Nat Nanotechnol 2020; 15(8): 630-45.
195- Poland GA, Ovsyannikova IG, Kennedy RB. SARS-Cov-2 Immunity: Review and Applications to Phase 3 Vaccine Candidates. The Lancet 2020; 396(10262): 1595-606.
196- Francis MJ. Recent Advances in Vaccine Technologies. Vet Clin North Am Small Anim Pract 2018; 48(2): 231-41.
197- Mulligan MJ, Lyke KE, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Phase I/II Study of COVID-19 RNA Vaccine BNT162b1 in Adults. Nature 2020; 586(7830): 589-93.
198- Wang H, Zhang Y, Huang B, Deng W, Quan Y, Wang W, et al. Development of an Inactivated Vaccine Candidate, BBIBP-Corv, with Potent Protection Against SARS-Cov-2. Cell 2020; 182(3): 713-21.
199- Xia S, Zhang Y, Wang Y, Wang H, Yang Y, Gao GF, et al. Safety and Immunogenicity of an Inactivated SARS-Cov-2 Vaccine, BBIBP-Corv: A Randomised, Double-Blind, Placebo-Controlled, Phase 1/2 Trial. Lancet Infectious Dis 2021; 21(1): 39-51.
200- Gupta PK. New Disease Old Vaccine: Is Recombinant BCG Vaccine an Answer for COVID-19? Cell Immunol 2020; 356: 104187.
1- Wang C, Horby PW, Hayden FG, Gao GF. A Novel Coronavirus Outbreak of Global Health Concern. Lancet 2020; 395(10223): 470-3.
2- Chilamakuri R, Agarwal S. COVID-19: Characteristics and Therapeutics. Cells 2021; 10(2): 206.
3- Ganji A, Gh M, Khaki M, Ghazavi A. A Review on Immunopathogenesis, Molecular Biology and Clinical Aspects of the 2019 Novel Coronavirus (1). J Arak Uni Med Sci (JAMS) 2020; 23(1): 8-21.
4- Shanmugaraj B, Siriwattananon K, Wangkanont K, Phoolcharoen W. Perspectives on Monoclonal Antibody Therapy as Potential Therapeutic Intervention for Coronavirus Disease-19 (1). Asian Pac J Allergy Immunol 2020; 38(1): 10-8.
5- Luk HK, Li X, Fung J, Lau SK, Woo PC. Molecular Epidemiology, Evolution and Phylogeny of SARS Coronavirus. Infect Gen Evol 2019; 71: 21-30.
6- Else H. How a Torrent of COVID Science Changed Research Publishing-In Seven Charts. Nature 2020; 588(7839): 553.
7- Pakzad B, Owlia MB. Corona Pandemic, Earth Restart Button. J Shahid Sadoughi University of Med Sci 2020; 28(1): 2229-34.
8- Imani Jajarmi H. Social Consequences of the Outbreak of Coronavirus in Iranian Society. Social Impact Assessment 2020 May1; 2: 87-103. (persian)
9- Menti H. Investigating The Effects of Coronavirus 19 on the Global Economy. Social Impact Assessment 2020; 2: 163-81.
10- Li Q, Guan X, Wu P, Wang X, Zhou L, Tong Y, et al. Early Transmission Dynamics in Wuhan, China, of Novel Coronavirus–Infected Pneumonia. New England J Med 2020; 382: 199-207.
11- Benvenuto D, Giovanetti M, Ciccozzi A, Spoto S, Angeletti S, Ciccozzi M. The 2019‐New Coronavirus Epidemic: Evidence for Virus Evolution. .J Medical Virology 2020; 92(4): 455-9.
12- Wong AC, Li X, Lau SK, Woo PC. Global Epidemiology of Bat Coronaviruses. Viruses 2019; 11(2): 174.
13- Ji W, Wang W, Zhao X, Zai J, Li X. Cross Species Transmission of the Newly Identified Coronavirus 2019‐Ncov. J Medical Virology 2020; 92(4): 433-40.
14- Of The International CSG. The Species Severe Acute Respiratory Syndrome-Related Coronavirus: Classifying 2019-Ncov and Naming It SARS-Cov-2. Nat Microbiol 2020; 5(4): 536-44.
15- Gralinski LE, Menachery VD. Return of the Coronavirus: 2019-Ncov. Viruses 2020; 12(2): 135.
16- Callaway E, Cyranoski D. Why Snakes Probably Aren’t Spreading the New China Virus. Nature 2020.
17- Wahl A, Gralinski LE, Johnson CE, Yao W, Kovarova M, Dinnon KH, et al. SARS-Cov-2 Infection is Effectively Treated and Prevented by EIDD-2801. Nature 2021; 591: 451-57.
18- Lam TT-Y, Jia N, Zhang YW, Shum MH-H, Jiang J-F, Zhu HC, et al. Identifying SARS-Cov-2-Related Coronaviruses in Malayan Pangolins. Nature 2020; 583: 282-85.
19- Wacharapluesadee S, Tan CW, Maneeorn P, Duengkae P, Zhu F, Joyjinda Y, et al. Evidence for SARS-Cov-2 Related Coronaviruses Circulating in Bats and Pangolins in Southeast Asia. Nature Communications 2021; 12: 972.
20- Fung TS, Liu DX. Human Coronavirus: Host-Pathogen Interaction. Annu Rev Microbiol 2019; 73: 529-57.
21- Tang X, Wu C, Li X, Song Y, Yao X, Wu X, et al. On the Origin and Continuing Evolution of SARS-Cov-2. National Science Review 2020; 7(6): 1012-23.
22- Blanco-Melo D, Nilsson-Payant B, Liu W-C, Møller R, Panis M, Sachs D, et al. SARS-Cov-2 Launches a Unique Transcriptional Signature from in Vitro, Ex Vivo, and in Vivo Systems. Biorxiv 2020.
23- Phan T. Novel Coronavirus: from Discovery to Clinical Diagnostics. Infect Genet Evol 2020; 79: 104211.
24- Shafique L, Ihsan A, Liu Q. Evolutionary Trajectory for the Emergence of Novel Coronavirus SARS-Cov-2. Pathogens 2020; 9(3): 240.
25- Wang K, Chen W, Zhou YS, Lian JQ, Zhang Z, Du P, et al. SARS-Cov-2 Invades Host Cells Via a Novel Route: CD147-Spike Protein. Biorxiv 2020: 1-10.
26- Wang X, Xu W, Hu G, Xia S, Sun Z, Liu Z, et al. SARS-Cov-2 Infects T Lymphocytes Through its Spike Protein-Mediated Membrane Fusion. Cell Mol Immunol 2020: 1-3.
27- Hui DS, Azhar EI, Kim YJ, Memish ZA, Oh Md, Zumla A. Middle East Respiratory Syndrome Coronavirus: Risk Factors and Determinants of Primary, Household, and Nosocomial Transmission. Lancet Infect Dis 2018; 18(8): E217-E27.
28- Santarpia JL, Rivera DN, Herrera V, Morwitzer MJ, Creager H, Santarpia GW, et al. Aerosol and Surface Transmission Potential of SARS-Cov-2. Medrxiv 2020.
29- Chan JF-W, Yuan S, Kok KH, To KK-W, Chu H, Yang J, et al. A Familial Cluster of Pneumonia Associated with the 2019 Novel Coronavirus Indicating Person-To-Person Transmission: A Study of a Family Cluster. The Lancet 2020; 395(10223): 514-23.
30- Li H, Liu Z, Ge J. Scientific Research Progress of COVID‐19/SARS‐Cov‐2 in the First Five Months. J Cellular and Molecular Med 2020; 24(12): 6558-70.
31- Li H, Leong FY, Xu G, Ge Z, Kang CW, Lim KH. Dispersion of Evaporating Cough Droplets in Tropical Outdoor Environment. Physics of Fluids 2020; 32(11): 113301.
32- Aydillo T, Gonzalez-Reiche AS, Aslam S, Van De Guchte A, Khan Z, Obla A, et al. Shedding of Viable SARS-Cov-2 after Immunosuppressive Therapy for Cancer. N Engl J Med 2020; 383(26): 2586-8.
33- Yeung ML, Yao Y, Jia L, Chan JF, Chan KH, Cheung KF, Et Al. MERS Coronavirus Induces Apoptosis in Kidney and Lung by Upregulating Smad7 and FGF2. Nat Microbiol 2016; 1(3): 16004.
34- Crackower MA, Sarao R, Oudit GY, Yagil C, Kozieradzki I, Scanga SE, et al. Angiotensin-Converting Enzyme 2 is an Essential Regulator of Heart Function. Nature 2002; 417(6891): 822-8.
35- Danilczyk U, Penninger JM. Angiotensin-Converting Enzyme II in the Heart and the Kidney. Circulation Research 2006; 98(4): 463-71.
36- Zhang H, Penninger JM, Li Y, Zhong N, Slutsky AS. Angiotensin-Converting Enzyme 2 (ACE2) as a SARS-Cov-2 Receptor: Molecular Mechanisms and Potential Therapeutic Target. Intensive Care Medicine 2020; 46(4): 586-90.
37- Xu H, Zhong L, Deng J, Peng J, Dan H, Zeng X, et al. High Expression of ACE2 Receptor of 2019-Ncov on the Epithelial Cells of Oral Mucosa. International J Oral Science 2020; 12(1): 1-5.
38- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical Features of Patients Infected with 2019 Novel Coronavirus in Wuhan, China. The Lancet 2020; 10223(395): 497-506.
39- Zhu N, Zhang D, Wang W, Li X, Yang B, Song J, et al. A Novel Coronavirus from Patients with Pneumonia in China, 2019. N Engl J Med 2020; 382: 727-33.
40- Chen N, Zhou M, Dong X, Qu J, Gong F, Han Y, et al. Epidemiological and Clinical Characteristics of 99 Cases of 2019 Novel Coronavirus Pneumonia in Wuhan, China: A Descriptive Study. The Lancet 2020; 395(10223): 507-13.
41- Wu Y, Guo C, Tang L, Hong Z, Zhou J, Dong X, et al. Prolonged Presence of SARS-Cov-2 Viral RNA in Faecal Samples. Lancet Gastroenterol Hepatol 2020; 5(5): 434-5.
42- Accili D. Can Covid-19 Cause Diabetes? Nat Metab 2021; 3(2): 123-5.
43- Yeoh YK, Zuo T, Lui GC-Y, Zhang F, Liu Q, Li AY, et al. Gut Microbiota Composition Reflects Disease Severity and Dysfunctional Immune Responses in Patients with COVID-19. Gut 2021; 70(4): 698-706.
44- Borges Do Nascimento IJ, Cacic N, Abdulazeem HM, Von Groote TC, Jayarajah U, Weerasekara I, et al. Novel Coronavirus Infection (1) in Humans: A Scoping Review and Meta-Analysis. J Clin Med 2020; 9(4): 941.
45- Zhou S, Wang Y, Zhu T, Xia L. CT Features of Coronavirus Disease 2019 (1) Pneumonia in 62 Patients in Wuhan, China. Am J Roentgenology 2020; 214(6): 1287-94.
46- Paules CI, Marston HD, Fauci AS. Coronavirus Infections—More Than Just the Common Cold. JAMA 2020; 323(8): 707-8.
47- Del Rio C, Malani PN. 2019 Novel Coronavirus—Important Information for Clinicians. JAMA 2020; 323(11): 1039-40.
48- Debiasi RL, Delaney M. Symptomatic and Asymptomatic Viral Shedding In Pediatric Patients Infected with Severe Acute Respiratory Syndrome Coronavirus 2 (Sars-Cov-2): Under the Surface. JAMA Pediatr 2020; 175(1): 16-18.
49- Oran DP, Topol EJ. The Proportion of SARS-Cov-2 Infections that are Asymptomatic: A Systematic Review. Ann Internal Med 2021; 174(5): 655-62.
50- Wiersinga WJ, Rhodes A, Cheng AC, Peacock SJ, Prescott HC. Pathophysiology, Transmission, Diagnosis, and Treatment of Coronavirus Disease 2019 (1): A Review. JAMA 2020; 324(8): 782-93.
51- Harapan H, Itoh N, Yufika A, Winardi W, Keam S, Te H, et al. Coronavirus Disease 2019 (1): A Literature Review. J Infection and Public Health 2020; 13(5): 667-73
52- Wu J, Li J, Zhu G, Zhang Y, Bi Z, Yu Y, et al. Clinical Features of Maintenance Hemodialysis Patients with 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. Clin J American Soc Nephrol 2020; 15(8): 1139-45.
53- Li T, Wei C, Li W, Hongwei F, Shi J. Beijing :union: Medical College Hospital on" Pneumonia of Novel Coronavirus Infection" Diagnosis and Treatment Proposal (V2. 0). Med J Peking :union: Med Coll Hosp 2020.
54- Udugama B, Kadhiresan P, Kozlowski HN, Malekjahani A, Osborne M, Li VY, et al. Diagnosing COVID-19: The Disease and Tools for Detection. ACS Nano 2020; 14(4): 3822-35.
55- Li X, Geng M, Peng Y, Meng L, Lu S. Molecular Immune Pathogenesis and Diagnosis of COVID-19. J Pharmaceutical Analysis 2020; 10(2): 102-8.
56- Li Y, Yao L, Li J, Chen L, Song Y, Cai Z, et al. Stability Issues of RT PCR Testing of SARS‐Cov‐2 for Hospitalized Patients Clinically Diagnosed with COVID‐19. J Medical Virology 2020; 92(7): 903-8.
57- Holshue ML, Debolt C, Lindquist S, Lofy KH, Wiesman J, Bruce H, et al. First Case of 2019 Novel Coronavirus in the United States. N Engl J Med 2020; 382: 929-36.
58- Ozma MA, Maroufi P, Khodadadi E, Köse Ş, Esposito I, Ganbarov K, et al. Clinical Manifestation, Diagnosis, Prevention and Control of SARS-Cov-2 (1) during the Outbreak Period. Infez Med 2020: 28(2): 153-65.
59- Li RL, Chu SG, Luo Y, Huang ZH, Hao Y, Fan CH. Atypical Presentation of SARS-Cov-2 Infection: A Case Report. World J Clinical Cases 2020; 8(7): 1265-70.
60- Al-Tawfiq JA, Memish ZA. Diagnosis of SARS-Cov-2 Infection Based on CT Scan Vs RT-PCR: Reflecting on Experience from MERS-Cov. J Hospital Infection 2020; 105(2): 154-5.
61- Li Z, Yi Y, Luo X, Xiong N, Liu Y, Li S, et al. Development and Clinical Application of a Rapid Igm Igg Combined Antibody Test for SARS Cov‐2 Infection Diagnosis. J Medical Virology 2020; 92(9): 1518-24.
62- Rodda LB, Netland J, Shehata L, Pruner KB, Morawski PM, Thouvenel C, et al. Functional SARS-Cov-2-Specific Immune Memory Persists after Mild COVID-19. Res Sq. 2020; rs.3.rs-57112
63- Bastos ML, Perlman-Arrow S, Menzies D, Campbell JR. The Sensitivity and Costs of Testing for SARS-Cov-2 Infection with Saliva Versus Nasopharyngeal Swabs: A Systematic Review and Meta-Analysis. Annals of Internal Medicine 2021; 174(4): 501-10.
64- Organization WH. Coronavirus Disease (COVID-19): Similarities and Differences with Influenza. Accessed September 2020; 7.
65- Song X, Delaney M, Shah RK, Campos JM, Wessel DL, Debiasi RL. Comparison of Clinical Features of COVID-19 Vs Seasonal Influenza a and B in US Children. JAMA Netw Open 2020; 3(9): E2020495.
66- Cobb NL, Sathe NA, Duan KI, Seitz KP, Thau MR, Sung CC, et al. Comparison of Clinical Features and Outcomes in Critically Ill Patients Hospitalized with COVID-19 Versus Influenza. Annals of the American Thoracic Society 2021; 18(4): 632-40
67- Marín‐Hernández D, Schwartz RE, Nixon DF. Epidemiological Evidence for Association Between Higher Influenza Vaccine Uptake in the Elderly and Lower COVID‐19 Deaths in Italy. J Medical Virology 2020.
68- Agha S. Mental Well-Being and Association of the Four Factors Coping Structure Model: A Perspective of People Living in Lockdown During COVID-19. Ethics, Medicine and Public Health 2021; 16: 100605.
69- Wu P, Fang Y, Guan Z, Fan B, Kong J, Yao Z, et al. The Psychological Impact of the SARS Epidemic on Hospital Employees in China: Exposure, Risk Perception, and Altruistic Acceptance of Risk. The Canadian J Psychiatry 2009; 54(5): 302-11.
70- Chen Q, Liang M, Li Y, Guo J, Fei D, Wang L, et al. Mental Health Care for Medical Staff in China During the COVID-19 Outbreak. The Lancet Psychiatry 2020; 7(4): E15-E6.
71- Kang L, Li Y, Hu S, Chen M, Yang C, Yang BX, et al. The Mental Health of Medical Workers in Wuhan, China Dealing with the 2019 Novel Coronavirus. The Lancet Psychiatry 2020; 7(3): E14.
72- Andrasfay T, Goldman N. Reductions in 2020 US Life Expectancy Due to COVID-19 and the Disproportionate Impact on the Black and Latino Populations. Proceedings of the National Academy of Sciences 2021; 118(5): E2014746118.
73- Mazereel V, Van Assche K, Detraux J, De Hert M. COVID-19 Vaccination for People with Severe Mental Illness: Why, What, and How? The Lancet Psychiatry 2021; 8(5): 444-50.
74- Wise J. COVID-19: New Coronavirus Variant is Identified in UK. BMJPG 2020; 371.
75- Wu K, Werner AP, Moliva JI, Koch M, Choi A, Stewart-Jones GB, et al. Mrna-1273 Vaccine Induces Neutralizing Antibodies Against Spike Mutants from Global SARS-Cov-2 Variants. Biorxiv 2021.
76- Shi PY, Xie X, Zou J, Fontes-Garfias C, Xia H, Swanson K, et al. Neutralization of N501Y Mutant SARS-Cov-2 By BNT162b2 Vaccine-Elicited Sera. Biorxiv 2021.
77- Horby P, Huntley C, Davies N, Edmunds J, Ferguson N, Medley G, et al. Update Note on B. 1.1. 7 Severity. NERVTAG 2021.
78- Iacobucci G. COVID-19: New UK Variant May Be Linked to Increased Death Rate, Early Data Indicate. BMJ 2021; 372: N230.
79- Assessment RR. Risk Related to the Spread of New SARS-Cov-2 Variants of Concern in the EU/EEA–First Update. European Centre for Disease Prevention and Control an Agency of the European :union:. 2021
80- Mahase E. COVID-19: Sore Throat, Fatigue, and Myalgia are More Common with New UK Variant. BMJ 2021: 372: N288.
81- Graham MS, Sudre CH, May A, Antonelli M, Murray B, Varsavsky T, et al. The Effect of SARS-Cov-2 Variant B. 1.1. 7 on Symptomatology, Re-Infection and Transmissibility. Medrxiv 2021.
82- Davies NG, Abbott S, Barnard RC, Jarvis CI, Kucharski AJ, Munday JD, et al. Estimated Transmissibility and Impact of SARS-Cov-2 Lineage B. 1.1. 7 in England. Science 2021 9; 372(6538).
83- Challen R, Brooks-Pollock E, Read JM, Dyson L, Tsaneva-Atanasova K, Danon L. Risk of Mortality in Patients Infected with SARS-Cov-2 Variant of Concern 202012/1: Matched Cohort Study. BMJ 2021; 372.
84- Greaney AJ, Loes AN, Crawford KH, Starr TN, Malone KD, Chu HY, et al. Comprehensive Mapping of Mutations to the SARS-Cov-2 Receptor-Binding Domain that Affect Recognition by Polyclonal Human Serum Antibodies. Biorxiv 2021; 29(3): 463-76.
85- Zhou D, Dejnirattisai W, Supasa P, Liu C, Mentzer AJ, Ginn HM, et al. Evidence of escape of SARS-CoV-2 variant B.1.351 from natural and vaccine-induced sera. Cell 2021; 184(9): 2348-61.e6.
86- Resende PC, Bezerra JF, Vasconcelos Rd, Arantes I, Appolinario L, Mendonça AC, et al. Spike E484K Mutation in the First SARS-Cov-2 Reinfection Case Confirmed in Brazil, 2020. Virological Org 2021.
87- Naveca F, Nascimento V, Souza V, Corado A, Nascimento F, Silva G, et al. Phylogenetic Relationship of SARS-Cov-2 Sequences from Amazonas with Emerging Brazilian Variants Harboring Mutations E484K and N501Y in the Spike Protein. Virological Org 2021.
88- Centers For Disease Control and Prevention. About Variants of the Virus that Causes Covid-19. Updated April 2, 2021. Https:// Www.Cdc.Gov/ Coronavirus/2019-Ncov/Transmission/Variant.Html.
89- World Health Organization. SARS-Cov-2 Variants of Concern and Variants of Interest, Updated 31 May 2021. Https:// Www.Who.Int/En/ Activities/ Tracking-SARS-Cov-2-Variants.
90- Callaway E. Delta Coronavirus Variant: Scientists Brace for Impact. Nature 2021; 595(7865): 17-8.
91- Sheikh A, Mcmenamin J, Taylor B, Robertson C. SARS-Cov-2 Delta VOC in Scotland: Demographics, Risk of Hospital Admission, and Vaccine Effectiveness. The Lancet 2021; 397 (¬10293): P2461-62
92- Starr TN, Greaney AJ, Dingens AS, Bloom JD. Complete Map of SARS-Cov-2 RBD Mutations that Escape the Monoclonal Antibody LY-Cov555 and its Cocktail with LY-Cov016. Cell Reports Medicine 2021; 2(4): 100255.
93- Bager P, Wohlfahrt J, Fonager J, Rasmussen M, Albertsen M, Michaelsen TY, et al. Risk of Hospitalisation Associated with Infection with SARS-Cov-2 Lineage B. 1.1. 7 in Denmark: An Observational Cohort Study. The Lancet Infectious Diseases 2021; 21(11): 1507-17.
94- Patone M, Thomas K, Hatch R, San Tan P, Coupland C, Liao W, et al. Mortality and Critical Care Unit Admission Associated with the SARS-Cov-2 Lineage B. 1.1. 7 in England: An Observational Cohort Study. The Lancet Infectious Diseases 2021; 21(11): 1518-28.
95- Iacobucci G. COVID-19: Single Vaccine Dose Is 33% Effective Against Variant from India, Data Show. BMJ 2021; 373: N1346.
96- Bernal JL, Andrews N, Gower C, Gallagher E, Simmons R, Thelwall S, et al. Effectiveness of Covid-19 Vaccines Against the B. 1.617. 2 Variant. N Engl J Med¬; 385(7): 585-94.
97- Bolze A, Cirulli ET, Luo S, White S, Cassens T, Jacobs S, et al. Rapid Displacement of SARS-Cov-2 Variant B. 1.1. 7 By B. 1.617. 2 And P. 1 in the United States. Medrxiv. 2021; 1-9.
98- Niesen M, Anand P, Silvert E, Suratekar R, Pawlowski C, Ghosh P, et al. COVID-19 Vaccines Dampen Genomic Diversity of SARS-Cov-2: Unvaccinated Patients Exhibit More Antigenic Mutational Variance. Medrxiv 2021.
99- Haug N, Geyrhofer L, Londei A, Dervic E, Desvars-Larrive A, Loreto V, et al. Ranking The Effectiveness Of Worldwide COVID-19 Government Interventions. Nature Human Behaviour 2020; 4(12): 1303-12.
100- Huang C. A Randomized, Open-Label, Blank-Controlled Trial for the Efficacy and Safety of Lopinavir-Ritonavir and Interferon-Alpha 2b in Hospitalization Patients with Novel Coronavirus Pneumonia (COVID-19). Chinese Clinical Trial Registry.
101- Pruijssers AJ, George AS, Schäfer A, Leist SR, Gralinksi LE, Dinnon III KH, et al. Remdesivir Inhibits SARS-Cov-2 in Human Lung Cells and Chimeric SARS-Cov Expressing the SARS-Cov-2 RNA Polymerase In Mice. Cell Reports 2020; 32(3): 107940.
102- Ye W, Yao M, Dong Y, Ye C, Wang D, Liu H, et al. Remdesivir (GS-5734) Impedes Enterovirus Replication Through Viral RNA Synthesis Inhibition. Frontiers in Microbiology 2020; 11: 1-9.
103- Han Y, Wang Z, Ren J, Wei Z, Li J. Potential Inhibitors for the Novel Coronavirus (SARS-Cov-2). Briefings in Bioinformatics 2021; 22(2): 1225-31.
104- Hussain N, Yoganathan A, Hewage S, Alom S, Harky A. The Effect of Antivirals on COVID-19: A Systematic Review. Expert Review of Anti-Infective Therapy 2021; 19(4): 473-86.
105- Yamamoto V, Bolanos JF, Fiallos J, Strand SE, Morris K, Shahrokhinia S, et al. COVID-19: Review of a 21st Century Pandemic from Etiology to Neuro-Psychiatric Implications. J Alzheimer's Disease 2020; 77: 459-504.
106- Uzunova K, Filipova E, Pavlova V, Vekov T. Insights Into Antiviral Mechanisms of Remdesivir, Lopinavir/Ritonavir and Chloroquine/Hydroxychloroquine Affecting the New SARS-Cov-2. Biomedicine & Pharmacotherapy 2020; 131: 110668.
107- Cao B, Wang Y, Wen D, Liu W, Wang J, Fan G, et al. A Trial of Lopinavir–Ritonavir in Adults Hospitalized with Severe COVID-19. N Engl J Med 2020; 382: 1787-99.
108- White KM, Rosales R, Yildiz S, Kehrer T, Miorin L, Moreno E, et al. Plitidepsin Has Potent Preclinical Efficacy Against SARS-Cov-2 by Targeting the Host Protein Eef1a. Science 2021; 371(6532): 926-31.
109- Fang QQ, Huang WJ, Li XY, Cheng YH, Tan MJ, Liu J, et al. Effectiveness of Favipiravir (T-705) Against Wild-Type and Oseltamivir-Resistant Influenza B Virus in Mice. Virology 2020; 545: 1-9.
110- Shiraki K, Daikoku T. Favipiravir, An Anti-Influenza Drug Against Life-Threatening Rna Virus Infections. Pharmacology & Therapeutics 2020; 209: 107512.
111- Rismanbaf A. Potential Treatments for COVID-19; A Narrative Literature Review. Arch Acad Emerg Med 2020; 8.
112- Wang M, Cao R, Zhang L, Yang X, Liu J, Xu M, et al. Remdesivir and Chloroquine Effectively Inhibit the Recently Emerged Novel Coronavirus (2019-Ncov) in Vitro. Cell Research 2020; 30(3): 269-71.
113- Offerhaus JA, Wilde AA, Remme CA. Prophylactic (Hydroxy) Chloroquine in COVID-19: Potential Relevance for Cardiac Arrhythmia Risk. Heart Rhythm 2020; 17(9): 1480-6.
114- Zang Y, Han X, He M, Shi J, Li Y. Hydroxychloroquine Use and Progression or Prognosis of COVID-19: A Systematic Review and Meta-Analysis. Naunyn-Schmiedeberg's Archives of Pharmacology 2020; 394: 775-82.
115- Lei ZN, Wu ZX, Dong S, Yang DH, Zhang L, Ke Z, et al. Chloroquine and Hydroxychloroquine in the Treatment of Malaria and Repurposing in Treating COVID-19. Pharmacology & Therapeutics 2020; 216: 107672.
116- Ip A, Ahn J, Zhou Y, Goy AH, Hansen E, Pecora AL, et al. Hydroxychloroquine in the Treatment of Outpatients with Mildly Symptomatic COVID-19: A Multi-Center Observational Study. BMC Infectious Diseases 2021; 21: 72.
117- Baladia E, Pizarro AB, Ortiz-Muñoz L, Rada G, Group C-LOW. Vitamin C for COVID-19: A Living Systematic Review. Medwave 2020; 20(6): E7978.
118- Feyaerts AF, Luyten W. Vitamin C as Prophylaxis and Adjunctive Medical Treatment for Covid-19? Nutrition 2020; 79-80: 110948:
119- Hemilä H, Chalker E. Vitamin C as A Possible Therapy for COVID-19. Infection & Chemotherapy 2020; 52(2): 222-23.
120- Muacevic A, Adler J, Kumari P, Dembra S, Dembra P, Bhawna F, et al. The Role of Vitamin C as Adjuvant Therapy In COVID-19. Cureus 2021; (11)12: E11779.
121- Mohan M, Cherian JJ, Sharma A. Exploring Links Between Vitamin D Deficiency and COVID-19. Plos Pathogens 2020; 16(9): E1008874.
122- Teymoori Rad M, Marashi SM. Vitamin D and Covid‐19: From Potential Therapeutic Effects to Unanswered Questions. Reviews In Med Virology 2020; 31(2): E2159.
123- Vyas N, Kurian SJ, Bagchi D, Manu MK, Saravu K, Unnikrishnan MK, et al. Vitamin D in Prevention and Treatment of COVID-19: Current Perspective and Future Prospects. J American College of Nutrition 2021; 40(7): 632-45.
124- Merzon E, Tworowski D, Gorohovski A, Vinker S, Golan Cohen A, Green I, et al. Low Plasma 25 (OH) Vitamin D Level is Associated with Increased Risk of COVID‐19 Infection: An Israeli Population Based Study. The FEBS J 2020; 287(17): 3693-702
125- Thomas S, Patel D, Bittel B, Wolski K, Wang Q, Kumar A, et al. Effect of High-Dose Zinc and Ascorbic Acid Supplementation Vs Usual Care on Symptom Length and Reduction among Ambulatory Patients with SARS-Cov-2 Infection: The COVID A to Z Randomized Clinical Trial. JAMA Netw Open 2021; 4(2): E210369-E.
126- Caly L, Druce JD, Catton MG, Jans DA, Wagstaff KM. The FDA-Approved Drug Ivermectin Inhibits the Replication of SARS-Cov-2 in Vitro. Antiviral Res 2020; 178: 104787.
127- Vallejos J, Zoni R, Bangher M, Villamandos S, Bobadilla A, Plano F, et al. Ivermectin to Prevent Hospitalizations in Patients with COVID-19 (IVERCOR-COVID19) A Randomized, Double-Blind, Placebo-Controlled Trial. BMC Infect Dis 2021; 21(1): 635.
128- Hill A, Abdulamir A, Ahmed S, Asghar A, Babalola OE, Basri R, et al. Meta-Analysis of Randomized Trials of Ivermectin to Treat SARS-Cov-2 Infection. Open Forum Infect Dis 2021; 8(11): Ofab358
129- Formiga FR, Leblanc R, De Souza Rebouças J, Farias LP, De Oliveira RN, Pena L. Ivermectin: An Award-Winning Drug with Expected Antiviral Activity Against COVID-19. J Controlled Release 2021; 329: 758-61.
130- López-Medina E, López P, Hurtado IC, Dávalos DM, Ramirez O, Martínez E, et al. Effect of Ivermectin on Time to Resolution of Symptoms among Adults with Mild COVID-19: A Randomized Clinical Trial. JAMA 2021; 325(14): 1426-35.
131- Khan MSI, Khan MSI, Debnath CR, Nath PN, Al Mahtab M, Nabeka H, et al. Ivermectin Treatment May Improve the Prognosis of Patients with COVID-19. Arch De Bronconeumol 2020; 56(12): 828-30.
132- Bryant A, Lawrie TA, Dowswell T, Fordham EJ, Scott M, Hill SR, et al. Ivermectin for Prevention and Treatment of COVID-19 Infection: A Systematic Review, Meta-Analysis And Trial Sequential Analysis to Inform Clinical Guidelines. Am J Ther 2021; 28(4): E434-E60.
133- Lipsa A, Prabhu JS. Gender Disparity in COVID-19: Role of Sex Steroid Hormones. Asian Pacific J Tropical Med 2021; 14(1): 5-9.
134- Mauvais-Jarvis F, Klein SL, Levin ER. Estradiol, Progesterone, Immunomodulation, and COVID-19 Outcomes. Endocrinology 2020; 161(1): Bqaa127.
135- Okpechi SC, Fong JT, Gill SS, Harman JC, Nguyen TH, Chukwurah QC, et al. Global Sex Disparity of COVID-19: A Descriptive Review of Sex Hormones and Consideration for the Potential Therapeutic Use of Hormone Replacement Therapy in Older Adults. Aging Dis 2021; 12(2): 671-83.
136- Ghandehari S, Matusov Y, Pepkowitz S, Stein D, Kaderi T, Narayanan D, et al. Progesterone in Addition to Standard of Care Vs Standard of Care Alone in the Treatment of Men Hospitalized with Moderate to Severe COVID-19: A Randomized, Controlled Pilot Trial. Chest 2021; 160(1): 74-84.
137- Liu K, Fang YY, Deng Y, Liu W, Wang MF, Ma JP, et al. Clinical Characteristics of Novel Coronavirus Cases in Tertiary Hospitals in Hubei Province. Chin Med J 2020; 133(9): 1025-31.
138- Echeverría-Esnal D, Martin-Ontiyuelo C, Navarrete-Rouco ME, De-Antonio Cuscó M, Ferrández O, Horcajada JP, et al. Azithromycin in the Treatment of COVID-19: A Review. Expert Rev Anti-Infect Ther 2021; 19(2): 147-63.
139- Oldenburg CE, Doan T. Azithromycin for Severe COVID-19. The Lancet 2020; 396(10256): 936-7.
140- Parra-Medina R, Sarmiento-Monroy JC, Rojas-Villarraga A, Garavito E, Montealegre-Gómez G, Gómez-López A. Colchicine as a Possible Therapeutic Option in COVID-19 Infection. Clin Rheumatol 2020; 39(8): 2485-6.
141- Schlesinger N, Firestein BL, Brunetti L. Colchicine in Covid-19: An Old Drug, New Use. Curr Pharmacol Rep 2020; 6(4): 137-45.
142- Tu YF, Chien CS, Yarmishyn AA, Lin YY, Luo YH, Lin YT, et al. A Review of SARS-Cov-2 and the Ongoing Clinical Trials. International. Int J Mol Sci 2020; 21(7): 2657.
143- Wongrakpanich S, Wongrakpanich A, Melhado K, Rangaswami J. A Comprehensive Review of Non-Steroidal Anti-Inflammatory Drug Use in the Elderly. Aging Dis 2018; 9(1): 143-50.
144- Ekins S, Lane TR, Madrid PB. Tilorone: A Broad-Spectrum Antiviral Invented in the USA and Commercialized in Russia and Beyond. Pharm Res 2020; 37(4): 1-8.
145- Lane TR, Massey C, Comer JE, Anantpadma M, Freundlich JS, Davey RA, et al. Repurposing the Antimalarial Pyronaridine Tetraphosphate to Protect Against Ebola Virus Infection. Plos Neglected Tropical Diseases 2019; 13(11): E0007890.
146- Seifirad S. Pirfenidone: A Novel Hypothetical Treatment for COVID-19. Med Hypotheses 2020; 144: 110005.
147- Sanchez-Pernaute O, Romero-Bueno F. Why Choose Cyclosporin A as First-Line Therapy in COVID-19 Pneumonia. Reumatol Clin 2021; 17(9): 555-57.
148- Stephens DS, Mcelrath MJ. Covid-19 and the Path to Immunity. JAMA 2020; 324(13): 1279-81.
149- Farris AD, Guthridge JM. Overlapping B Cell Pathways in Severe COVID-19 And Lupus. Nat Immunol 2020; 21(12): 1478-80.
150- Sahin U, Muik A, Derhovanessian E, Vogler I, Kranz LM, Vormehr M, et al. COVID-19 Vaccine BNT162b1 Elicits Human Antibody and TH 1 T Cell Responses. Nature 2020; 586(7830): 594-9.
151- Heath PT, Le Doare K, Khalil A. Inclusion of Pregnant Women in COVID-19 Vaccine Development. The Lancet Infectious Dis 2020; 20(9): 1007-8.
152- Shimabukuro TT, Kim SY, Myers TR, Moro PL, Oduyebo T, Panagiotakopoulos L, et al. Preliminary Findings of Mrna Covid-19 Vaccine Safety in Pregnant Persons. New England J Med 2021; 384: 2273-82.
153- Kotlar B, Gerson E, Petrillo S, Langer A, Tiemeier H. The Impact of the COVID-19 Pandemic on Maternal and Perinatal Health: A Scoping Review. Reproductive Health 2021; 18(1): 1-39.
154- Zambrano LD, Ellington S, Strid P, Galang RR, Oduyebo T, Tong VT, et al. Update: Characteristics of Symptomatic Women of Reproductive Age with Laboratory-Confirmed SARS-Cov-2 Infection by Pregnancy Status—United States, January 22–October 3, 2020. MMWR Morb Mortal Wkly Rep 2020; 69(44): 1641-47.
155- Nakamura Pereira M, Knobel R, Menezes MO, Andreucci CB, Takemoto ML. The Impact of the COVID‐19 Pandemic on Maternal Mortality in Brazil: 523 Maternal Deaths by Acute Respiratory Distress Syndrome Potentially Associated with SARS‐Cov‐2. Int J Gynecol Obstet 2021; 153(2): 360-2.
156- Hanna N, Hanna M, Sharma S. Is Pregnancy an Immunological Contributor to Severe or Controlled COVID‐19 Disease? Am J Reprod Immunol 2020; 84(5): E13317.
157- Schettini Jadc, Gomes TV, Silva Cdd, Heráclio Sda, Coelho Iccdan, Torres LC. Evaluation of Immunological Parameters in Pregnant Women: Low Levels of B and NK Cells. Rev Bras De Ginecol Obstet 2019; 41(4): 213-9.
158- Khalil A, Kalafat E, Benlioglu C, O'Brien P, Morris E, Draycott T, et al. SARS-Cov-2 Infection in Pregnancy: A Systematic Review and Meta-Analysis of Clinical Features and Pregnancy Outcomes. Eclinicalmedicine 2020; 25: 100446.
159- La Cour Freiesleben N, Nielsen HS. Timely Care for Extrauterine Pregnancies During the COVID-19 Pandemic is Needed. Lancet Reg Health-Eur 2021; 2: 100037.
160- Bar-Zeev N, Inglesby T. COVID-19 Vaccines: Early Success and Remaining Challenges. The Lancet 2020; 396(10255): 868-69.
161- Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and Efficacy of an Rad26 and Rad5 Vector-Based Heterologous Prime-Boost COVID-19 Vaccine: An Interim Analysis of A Randomised Controlled Phase 3 Trial in Russia. The Lancet 2021; 397(10275): 671-81.
162- Jones I, Roy P. Sputnik V COVID-19 Vaccine Candidate Appears Safe and Effective. Lancet. 2021; 397(10275): 642-43.
163- Lima B. Diversidade, Que Me Queira: Cepas, Linhagens E Variantes Do Coronavírus. 2021. Http://146.164.63.47/Alexandria_Wp/Artigos/
164- Xie X, Liu Y, Liu J, Zhang X, Zou J, Fontes-Garfias CR, et al. Neutralization of SARS-Cov-2 Spike 69/70 Deletion, E484K and N501Y Variants by BNT162b2 Vaccine-Elicited Sera. Nature Medicine 2021; 27: 620-21.
165- Tanne JH. COVID-19: Moderna Plans Booster Doses to Counter Variants. BMJ: British Medical J 2021; 372: N232.
166- Mohandas S, Yadav PD, Shete-Aich A, Abraham P, Vadrevu KM, Sapkal G, et al. Immunogenicity and Protective Efficacy of BBV152, Whole Virion Inactivated SARS-Cov-2 Vaccine Candidates in the Syrian Hamster Model. Iscience 2021; 24(2): 102054.
167- Yadav P, Ella R, Kumar S, Patil D, Mohandas S, Shete A, et al. Remarkable Immunogenicity and Protective Efficacy of BBV152, An Inactivated SARS-Cov-2 Vaccine in Rhesus Macaques. Nat Commun 2021; 12(1): 1386.
168- Said Yousef. COVID Vaccination and Diabetes. Jan 20, 2021. Https://Glucare.Health/Covid-Vaccination-And-Diabetes.
169- Ella R, Vadrevu KM, Jogdand H, Prasad S, Reddy S, Sarangi V, et al. Safety and Immunogenicity of an Inactivated SARS-Cov-2 Vaccine, BBV152: A Double-Blind, Randomised, Phase 1 Trial. The Lancet Infectious Diseases 2021; 21(7): 950-61.
170- Ella R, Vadrevu KM, Jogdand H, Prasad SD, Reddy S, Sarangi V, et al. Safety and Immunogenicity Trial of an Inactivated SARS-Cov-2 Vaccine-BBV152: A Phase 1, Double-Blind, Randomised Control Trial 2020.
171- Sapkal GN, Yadav P, Ella R, Deshpande G, Sahay R, Gupta N, et al. Neutralization of UK-Variant VUI-202012/01 with COVAXIN Vaccinated Human Serum. Biorxiv 2021.
172- Phase BBA. Results of COVAXIN®: India’s First COVID-19 Vaccine Demonstrates Interim Clinical Efficacy of 81%. Bharatbiotech Press Release; 2021.
173- Valdes-Balbin Y, Santana-Mederos D, Quintero L, Fernandez S, Rodriguez L, Sanchez-Ramirez B, et al. SARS-Cov-2 RBD-Tetanus Toxoid Conjugate Vaccine Induces A Strong Neutralizing Immunity in Preclinical Studies. Biorxiv 2021.
174- Moinipour S. The Islamic Republic of Iran and Children’s Right to Education: Availability & Accessibility. Human Rights Education Review 2021; 4(2): 5-25.
175- Basiri N, Koushki M. Study of Vaccine Production Abroad and Scientific and Research Challenges of COVID-19 Vaccine Production in Iran. Annals of the Romanian Society for Cell Biology 2021: 17249-56.
176- Dutta AK. Vaccine Against COVID-19 Disease–Present Status of Development. Indian J Pediatr 2020; 87(10): 810-16.
177- Wang F, Kream RM, Stefano GB. An Evidence Based Perspective on Mrna-SARS-Cov-2 Vaccine Development. Med Sci Monit 2020; 26: E924700-1.
178- Le TT, Andreadakis Z, Kumar A, Román RG, Tollefsen S, Saville M, et al. The COVID-19 Vaccine Development Landscape. Nat Rev Drug Discov 2020; 19(10): 667-68.
179- Corbett KS, Flynn B, Foulds KE, Francica JR, Boyoglu-Barnum S, Werner AP, et al. Evaluation of the Mrna-1273 Vaccine Against SARS-Cov-2 in Nonhuman Primates. N Engl J Med 2020; 383(16): 1544-55.
180- Bennet BM, Wolf J, Laureano R, Sellers RS. Review of Current Vaccine Development Strategies to Prevent Coronavirus Disease 2019 (1). Toxicologic Pathology 2020; 48(7): 800-9.
181- Kaur SP, Gupta V. COVID-19 Vaccine: A Comprehensive Status Report. Virus Res 2020:198114.
182- Walsh EE, Frenck Jr RW, Falsey AR, Kitchin N, Absalon J, Gurtman A, et al. Safety and Immunogenicity of Two RNA-Based COVID-19 Vaccine Candidates. N Engl J Medicine 2020; 383(25): 2439-50.
183- Bhagavathula AS, Aldhaleei WA, Rovetta A, Rahmani J. Vaccines and Drug Therapeutics to Lock Down Novel Coronavirus Disease 2019 (1): A Systematic Review of Clinical Trials. Cureus 2020; 12(5): E8342.
184- Smith TR, Patel A, Ramos S, Elwood D, Zhu X, Yan J, et al. Immunogenicity of A DNA Vaccine Candidate for COVID-19. Nat Commun 2020; 11(1): 2601.
185- Patel A, Walters J, Reuschel EL, Schultheis K, Parzych E, Gary EN, et al. Intradermal-Delivered DNA Vaccine Provides Anamnestic Protection in A Rhesus Macaque SARS-Cov-2 Challenge Model. Cell Rep Med 2021; 2(10): 100420.
186- Kochhar S, Salmon DA. Planning for COVID-19 Vaccines Safety Surveillance. Vaccine 2020; 38(40): 6194-8.
187- Shih HI, Wu CJ, Tu YF, Chi CY. Fighting COVID-19: A Quick Review of Diagnoses, Therapies, and Vaccines. Biomed J 2020; 43(4): 341-54.
188- Chibber P, Haq SA, Ahmed I, Andrabi NI, Singh G. Advances in the Possible Treatment of COVID-19: A Review. Eur J Pharmacol 2020; 883: 173372.
189- Funk CD, Laferrière C, Ardakani A. A Snapshot of the Global Race for Vaccines Targeting SARS-Cov-2 and The COVID-19 Pandemic. Front Pharmacol 2020; 11: 937.
190- Folegatti PM, Ewer KJ, Aley PK, Angus B, Becker S, Belij-Rammerstorfer S, et al. Safety and Immunogenicity of the Chadox1 Ncov-19 Vaccine Against SARS-Cov-2: A Preliminary Report of a Phase 1/2, Single-Blind, Randomised Controlled Trial. Lancet 2020; 396(10249): 467-78.
191- Van Doremalen N, Lambe T, Spencer A, Belij-Rammerstorfer S, Purushotham JN, Port JR, et al. Chadox1 Ncov-19 Vaccine Prevents SARS-Cov-2 Pneumonia in Rhesus Macaques. Nature 2020; 586(7830): 578-82.
192- Logunov DY, Dolzhikova IV, Zubkova OV, Tukhvatullin AI, Shcheblyakov DV, Dzharullaeva AS, et al. Safety and Immunogenicity of An Rad26 and Rad5 Vector-Based Heterologous Prime-Boost COVID-19 Vaccine in Two Formulations: Two Open, Non-Randomised Phase 1/2 Studies From Russia. Lancet 2020; 396(10255): 887-97.
193- Zhu FC, Li YH, Guan XH, Hou LH, Wang WJ, Li JX, et al. Safety, Tolerability, and Immunogenicity of A Recombinant Adenovirus Type-5 Vectored COVID-19 Vaccine: A Dose-Escalation, Open-Label, Non-Randomised, First-In-Human Trial. Lancet 2020; 395(10240): 1845-54.
194- Florindo HF, Kleiner R, Vaskovich-Koubi D, Acúrcio RC, Carreira B, Yeini E, et al. Immune-Mediated Approaches Against COVID-19. Nat Nanotechnol 2020; 15(8): 630-45.
195- Poland GA, Ovsyannikova IG, Kennedy RB. SARS-Cov-2 Immunity: Review and Applications to Phase 3 Vaccine Candidates. The Lancet 2020; 396(10262): 1595-606.
196- Francis MJ. Recent Advances in Vaccine Technologies. Vet Clin North Am Small Anim Pract 2018; 48(2): 231-41.
197- Mulligan MJ, Lyke KE, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Phase I/II Study of COVID-19 RNA Vaccine BNT162b1 in Adults. Nature 2020; 586(7830): 589-93.
198- Wang H, Zhang Y, Huang B, Deng W, Quan Y, Wang W, et al. Development of an Inactivated Vaccine Candidate, BBIBP-Corv, with Potent Protection Against SARS-Cov-2. Cell 2020; 182(3): 713-21.
199- Xia S, Zhang Y, Wang Y, Wang H, Yang Y, Gao GF, et al. Safety and Immunogenicity of an Inactivated SARS-Cov-2 Vaccine, BBIBP-Corv: A Randomised, Double-Blind, Placebo-Controlled, Phase 1/2 Trial. Lancet Infectious Dis 2021; 21(1): 39-51.
200- Gupta PK. New Disease Old Vaccine: Is Recombinant BCG Vaccine an Answer for COVID-19? Cell Immunol 2020; 356: 104187.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







