دوره 28، شماره 12 - ( اسفند 1399 )
جلد 28 شماره 12 صفحات 3350-3338 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mirjalili M R, Namayandeh S M, Lotfi M H, Dehghani M R, Mirzaei M, Talebi A R, et al . COVID-19 Seroepidemiology Study of Yazd Province, First Peak, Spring 2020: A Population-Based Cross-Sectional Study. JSSU 2021; 28 (12) :3338-3350
URL: http://jssu.ssu.ac.ir/article-1-5376-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5376-fa.html
میرجلیلی محمدرضا، نماینده سیده مهدیه، لطفی محمدحسن، دهقانی محمدرضا، میرزایی محسن، طالبی علیرضا، و همکاران. و همکاران.. مطالعه سرواپیدمیولوژی کووید -۱۹ استان یزد موج اول بهار ۱۳۹۹ : یک مطالعه مقطعی مبتنی بر جمعیت. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (12) :3338-3350
محمدرضا میرجلیلی 

 ، سیده مهدیه نماینده*
، سیده مهدیه نماینده* 

 ، محمدحسن لطفی
، محمدحسن لطفی 

 ، محمدرضا دهقانی
، محمدرضا دهقانی 

 ، محسن میرزایی
، محسن میرزایی 

 ، علیرضا طالبی
، علیرضا طالبی 

 ، مسعود میرزایی
، مسعود میرزایی 

 ، سارا جامبرسنگ
، سارا جامبرسنگ 

 ، سیدمحمدجواد نظامالحسینی
، سیدمحمدجواد نظامالحسینی 

 ، مسعود شریفی
، مسعود شریفی 

 ، مهرداد منصوری
، مهرداد منصوری 




 ، سیده مهدیه نماینده*
، سیده مهدیه نماینده* 

 ، محمدحسن لطفی
، محمدحسن لطفی 

 ، محمدرضا دهقانی
، محمدرضا دهقانی 

 ، محسن میرزایی
، محسن میرزایی 

 ، علیرضا طالبی
، علیرضا طالبی 

 ، مسعود میرزایی
، مسعود میرزایی 

 ، سارا جامبرسنگ
، سارا جامبرسنگ 

 ، سیدمحمدجواد نظامالحسینی
، سیدمحمدجواد نظامالحسینی 

 ، مسعود شریفی
، مسعود شریفی 

 ، مهرداد منصوری
، مهرداد منصوری 


متن کامل [PDF 884 kb]
(1038 دریافت)
| چکیده (HTML) (2879 مشاهده)
متن کامل: (1982 مشاهده)
مقدمه
در اواخر دسامبر 2019 یک پاتوژن تنفسی جدیدی با نام کرونا ویروس SARS COV-19 در شهر ووهان چین گزارش شد و به سرعت در سرتاسر جهان منتشر شد (4-1) اولین مورد ابتلا کرونا با تست قطعی در ایران در تاریخ 30 بهمن 1398 در استان قم و اولین مورد در استان یزد در تاریخ ۶ اسفند ماه 1398 گزارش شد. سازمان بهداشت جهانی عفونت کووید 19را در تاریخ 10 بهمن 1398 یک وضعیت اضطراری (2) و در تاریخ 21اسفند یک پاندمی معرفی کرد (5). بر اساس آخرین آمار کووید19 در ایران تا تاریخ 20 بهمن 1399 1490000 مورد قطعی و 58686مورد مرگ گزارش شده است. این آمار در انتهای اردیبهشت 1398 شامل 122492 مورد قطعی و 7057 مورد مرگ بود. در هنگام همهگیری علاوه بر درمان بیماری یکی از نیازهای مهم جهت پیشگیری از گسترش بیماری شناخت اپیدمیولوژی بیماری میباشد. در جریان اپیدمیها سرعت انتشار بیماری تحت تاثیر تعداد افراد مبتلا، قابلیت انتقال ویروس و تعداد افراد حساس قرار میگیرد (6). بیماری کووید میتواند به عنوان یک بیماری بدون علامت، خفیف تا وضعیت بحرانی منجر به بستری و مرگ ظاهر شود (9-7). تعداد افراد مبتلا به کووید بدون علائم بالینی نسبت به کل افراد آلوده را نسبت بدون علامت مینامند (10). یکی از مهمترین چالشهای کووید 19 نقش افراد بدون علامت در انتقال بیماری هست اما نسبت این عفونتها و تاثیر نسبی آنها مشخص نیست (11, 8). تست RT-PCR از طریق سواپ نازوفارنژیال nasopharyngeal swabs از بیماران با تظاهرات بالینی یک تست تشخیصی استاندارد برای شناسایی و تشخیص بیماری کووید 19 میباشد اما به علت عدم شناسایی افراد بدون علامت، تعداد واقعی افراد مواجهه داشته و آلوده شده کمتر از حد واقعی برآورد میشود و لذا آمار مرگ و میر تائیده شده با توجه به عدم محاسبه افراد بدون علامت در مخرج کسر دقیق نیست (12-14). در یک اپیدمی ارزیابی تغییرات شیوع بیماری در طی زمان ابزار مهمی برای پیشبینی انتشار بیماری و تصمیمگیری مراقبتهای مورد نیاز بهداشتی میباشد (13) تستهای سرولوژی میتوانند آنتیبادیهای IgM و یا IgG در مقابل کووید 19 را به علت ماندگاری برای مدت طولانی پس از بهبود بیماری در افراد علامتدار و بدون علامت تشخیص دهند که به لحاظ تعیین دقیق نست افراد مبتلا در جامعه ارزشمند است (15, 12). بنابراین مطالعات سرولوژی ابزار مفیدی برای تخمین بروز تجمعی عفونت ناشی از مواجهه با کووید 19 براساس تفاوتهای قومیتی، سنی و شغلی (12, 5) و میزان مرگ ومیر در این افراد میباشد (16). نتایج مطالعهای در سوئد به منظور ارزیابی ارزش تشخیصی کیت سریع IgMو IgG نشان داد که حساسیت IgM و IgG به ترتیب 69 % و 93/1 % بود و ویژگی آن به ترتیب 100% و 99/2 % بود و این مطالعه تست سریع را برای ارزیابی شیوع سرولوژیک کووید 19 و ارزیابی ایمنی جمعی تایید نمود (17). در مطالعه دیگری شاخص نسبت درستنمایی مثبتPositive likelihood ratio برای آنتیبادیIgM %18/5 و برای آنتیبادی IgG %12/65 گزارش شد بنابراین احتمال پسین Posterior probability به ترتیب 90/18% و 86/26% و برای مجموع دو آنتیبادی 99/15% گزارش شد (18). شیوع سرولوژیک در مناطق مختلفی از جهان متفاوت است. در چین 3/8 % با فاصله اطمینان (5/4-2/6) (19)، در ایتالیا در 202 کارمند مراقبین بهداشتی شیوع IgM و IgG به ترتیب 14/4% و 7/4% (15). در اسپانیا بر روی یک جمعیت 60000 هزار نفری 19 در سطح کشور 5% (20) اعلام شده است. نتایج یک مطالعه متا آنالیز بر روی 399265 فرد از 23 کشور شیوع سرولوژی عفونت کووید 19 را از 0/37% تا 22/1 % برآورد کرد (12). و شیوع سرولوژی کووید 19در طی آوریل تا مه 2020 در لسآنجلس 4/65% (21)، فرانسه 4/4 % (22) و در گیلان بر روی 522 نفر 33% (23) گزارش شده است. مطالعهای شیوع سرولوژیک 17 استان و 18 شهر ایران را در مجله لنست گزارش نمود. تعداد 8902 فرد بررسی شدند. ۳۰۲۰ نفر از جامعه و بقیه از مشاغل پرخطر وارد مطالعه شدند. در کل شیوع سرولوژیک کووید 19 در این17 استان بعد از تطبیق سنی جنسی و دقت تست معادل 2/5 ± 17/1% که معادل 4265542نفر میباشد برآورد شد (24). با توجه به اینکه این بیماری در اکثر موارد بیعلامت و کم علامت میباشد، برای کنترل بهتر اپیدمی و سیاستگزاری بهداشتی به منظور قطع زنجیره انتقال و برآورد دقیقتر شاخصهای ابتلا و کشندگی بیماری نیاز به برآورد دقیقتری از ابتلا خواهیم داشت. مطالعه حاضر با هدف شناسایی شیوع سرولوژیک کووید 19 جهت تخمین دقیقتر مبتلایان در استان یزد انجام شد.
روش بررسی
مطالعه حاضر یک مطالعه مقطعی مبتنی بر اجتماع و از نوع سرواپیدمیولوژی است که جهت بررسی شیوع سرولوژیک کووید 19 در بازه زمانی 13 تا 30 خرداد ماه 1399 در استان یزد مرکز ایران انجام شد. جامعه مورد بررسی کلیه افراد تحت پوشش مراکز بهداشتی ساکن استان یزد بدون محدودیت سنی و جنسی بود. حجم نمونه جهت برآورد شیوع سرواپیدمیولوژیک با توجه یه شیوع 30% سرولوژی کووید 19 گزارش شده در استان گیلان و با دقت 5% با فاصله اطمینان 95% برای هر شهرستان 330 نفر و همینطور با پیش فرض شیوع حداقل 20% کووید در یزد 19، فاصله اطمینان 90% و خطای 6%، حداقل تعداد 120 مورد برای هر شهرستان محاسبه شد. در شهرستانهایی که به تنهایی وارد نمونهگیری شدند شیوع 30% و دقت 5% در نظر گرفته شد. شهرهایی که در مجاورت هم بودند و یک برآورد برای شیوع سرولوژیک آنها کافی به نظر میرسید تجمیع و از روش دوم با استفاده از شیوع 20% با خطای 6% استفاده گردید. با هدف برآورد شیوع سرواپیدمیولوژی جهت استان و هر شهرستان 330 نفر به صورت جداگانه و در مجموع تعداد 1830 نمونه محاسبه شد. با توجه به محدودیتهای مطالعه مقرر شد استان به 6 منطقه شامل (یزد-اشکذر)، (بافق – بهاباد) و (خاتم- مهریز – تفت)، اردکان، میبد و ابرکوه تقسیم شود لذا با توجه به حجم نمونه فوق جهت شهرستانهای یزد- اشکذر مجموعاً 330نفر، اردکان 186 نفر، میبد 179 نفر، ابرکوه 120 نفر، (بافق – بهاباد) مجموعاً 120 نفر، ( خاتم- مهریز – تفت) هم 120 نفر نمونه مجموعاً 1020 نمونه محاسبه گردید. نمونهگیری به صورت دو مرحلهای خوشهای و تصادفی ساده انجام گرفت. ابتدا با توجه به پوشش بالغ بر ۹۲% سامانه سیب در استان مراکز سلامت به عنوان چارچوب نمونهگیری انتخاب شدند. سپس بر اساس حجم نمونه در مناطق 6 گانه فوق در استان در هر شهرستان از بین کل مراکز هر کدام بر اساس جمعیت تحت پوشش هر مرکز به صورت تصادفی ساده انتخاب شد. در هر مرکز نیز به روش نمونهگیری تصادفی ساده افراد به صورت تصادفی انتخاب شدند. نمونهها توسط مراقب سلامت و با استفاده از سامانه سیب از هفتمین نفر لیست بیست نفره آن روز نمونهگیری شد. در صورت عدم دسترسی یا عدم همکاری نفر بعد (پیگیری تا 3 نفر بعد لیست) جایگزین شد. نمونهگیری تا تکمیل حجم نمونه در هر مرکز ، ادامه یافت. در مجموع 114 نفر (12%) نیاز به جایگزین پیدا کردند. نمونهگیری از 13 خرداد تا آخر خرداد ماه ادامه یافت. فرد بعد از تکمیل فرم جهت اخذ نمونه خون دعوت میشد یا در منزل انجام میگرفت. با تمهیدات فوق تا انتهای مطالعه در کل 934 نفر وارد مطالعه شدند. بافق - بهاباد 121 نفر، اردکان 186 نفر، میبد 179 نفر، اشکذر و یزد236 نفر، تفت -خاتم - مهریز112 نفر، و ابرکوه 100 نفر وارد مطالعه شدند. ابزار گردآوی اطلاعات پرسشنامهای شامل اطلاعات دموگرافی (سن- جنس- شغل- تحصیلات) سابقه علامتهای شایع کووید 19 شامل: تب، درد بدن و خستگی، سرفه خشک، تنگی نفس، سابقه بستری با تشخیص قطعی کووید همینطور میزان رعایت مداخلات غیردارویی مثل فاصله اجتماعی، ماندن در خانه بهجز جهت انجام امور ضروری، عدم شرکت در مجامع، پوشیدن ماسک در مجامع، پوشیدن دستکش، شستن مرتب دست و دوری از افراد مسنتر از 65 سال خانواده بود. تکمیل پرسشنامه توسط مراقبین بهداشت که شامل بهیاران مستقر در مراکز بهداشتی انجام گرفت. جهت انجام نمونهگیری خون با توجه به تمایل شرکتکنندگان، مراقبین سلامت جهت انجام نمونهگیری خون به محل سکونت فرد مراجعه کرده و با رعایت پروتکلهای بهداشتی نمونه خون افراد تهیه شد و یا افراد در صورت تمایل به مرکز سلامت مشخص شده جهت نمونهگیری خون دعت شدند و نمونه خون با شرایط استاندارد تهیه و به آزمایشگاه مرکزی ارسال شد. آنتیبادی IgG ,IgM با استفاده از کیت تشخیصی "کیت الیزا پیشتاز طب " با حساسیت 94/1% و ویژگی 98/3% جهت SARS-CoV-2 IgG و حساسیت 79/4% و ویژگی 97/3% برای SARS-CoV-2 IgM اندازهگیری شد. (24) موارد خاص مثل کودکان و نوزادان و افراد مسن با ابتلا به بیماری خاص جهت نمونهگیری به آزمایشگاه مرکزی یزد ارجاع شدند. موارد کمتر از 0/9 جذب نوری (Optical Density (OD منفی، نتایج سرولوژی بین 1/1-01/9((OD مشکوک و نتایج بیشتر از 1/1 (OD مثبت در نظر گرفته شد. موارد IgG مثبت یا IgM مثبت قطعی در نظر گرفته شد. موارد مشکوک IgG یا IgM مشکوک و موارد منفی IgG و موارد منفی IgM منفی در نظر گرفته شد.
تجزیه و تحلیل آماری
ویژگیهای شرکتکنندگان برای متغیرهای کمی به صورت میانگین± انحراف معیار و برای متغیرهای کیفی به صورت فراوانی (%) و برآورد شیوع± فاصله اطمینان ۹۵% برآورد شده آن گزارش شد. جهت بررسی ارتباط بین متغیرهای کیفی و نتیجه تست سرولوژی از آزمون کای دو و جهت بررسی تفاوت متغیرهای کمی براساس نتیجه تست سرولوژی از آزمون ANOVA استفاده شد. سطح معنیداری آزمون 5% در نظر گرفته شد و از نرم افزار.16 SPSS.version جهت تجزیه و تحلیل استفاده شد. توزیع سنی نمونهها بررسی گردید که با توزیع سنی جمعیت استان تفاوت معنیداری نداشت ولی توزیع جنسی نمونهها با استان متفاوت بود که تطبیق داده شد ولی از نظر سنی نیازی به تطبیق نداشت لذا برآورد سرولوژیک شیوع با تطبیق جنسی ارائه گردید. جهت برآورد شیوع سرولوژیک کووید 19 در استان ضرایب جمعیتی شهرستانها اعمال گردید.
ملاحظات اخلاقی
این پروژه در کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد با کد اخلاق IR.SSU.REC.1399.041 تایید گردید. نتایج بدون نام ثبت شد و با حفظ محرمانگی مشخصات افراد نتایج بهصورت کلی ارائه گردید.
نتایج
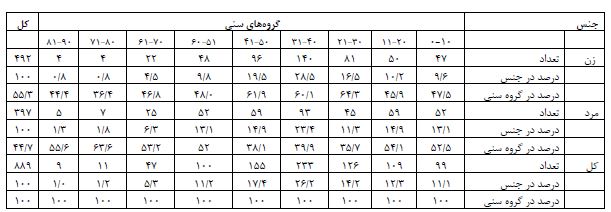
در مجموع 1020شرکتکننده به صورت تصادفی از 10 شهرستان استان یزد دعوت شدند و 934 نفر (91/5%) وارد مطالعه شدند. از شهرستانهای یزد و اشکذر 236 نفر، اردکان 186 نفر، میبد 179 نفرتفت- خاتم - مهریز 112 نفر، بافق - بهاباد 121 نفر و ابرکوه 100 نفر وارد مطالعه شدند. میانگین سنی شرکتکنندگان 17/5± 34/3 بود و 54/7 % (504 نفر) را زنان و 45/3% ( 415نفر) را مردان تشکیل دادند. نتایج نشان داد بر اساس IgM 12 نفر (1/3%) مشکوک و 59 نفر (6/3%) قطعی و بر اساس IgG 16نفر (1/7%) مشکوک و 116 نفر (12/4%) قطعی بودند. براساس تلفیق دو آزمایش IgM وIgG مواردی که هر دو قطعی بودند قطعی در نظر گرفته شد. مواردی که هردو منفی بودند منفی و مواردی که یکی از تستها مشکوک بودند مشکوک در نظر گرفته شد. با توجه به این معیار و قبل از اعمال ضریب جمعیتی شهرستانها فراوانی موارد مثبت قطعی کووید (19/9-15/1) 17/5% (163 نفر)، موارد مشکوک (1/5-5/) 2/5% (25 نفر) بود. (نمودار 1). جدول1 شیوع سرولوژی کووید 19 را براساس مناطق چندگانه استان یزد ارائه میکند. بیشترین شیوع سرولوژیک کووید 19 به ترتیب در شهرستانهای اردکان (39-25)32%، ابرکوه (29-13) 21%، بافق-بهاباد (25-11) 18%، یزد اشکذر (17/8-8/8) 13/8%، میبد (16-6 )11%، مهریز-خاتم-تفت(13/2-0/8) 7% بود. جدول2 توزیع فراوانی شیوع سرولوژیک کووید 19 را بر اساس سن و جنسیت و علایم بالینی کووید 19 در استان یزد ارائه میکند. بعد از اعمال ضرایب جمعیتی شهرستانها بر اساس آخرین سرشماری شیوع سرولوژیک موارد قطعی کووید-۱۹ استان (16/91-12/91) 14/91% و موارد مشکوک (3/85-1/85) 2/85% محاسبه شد. به عبارتی در خرداد ماه 1399 شیوع سرولوژیک کووید 19 به میزان (19/76-15/76) 17/76 مجموع موارد مشکوک و قطعی محاسبه شد. میانگین سنی کلی شرکتکنندگان 17/5 ±34/3 (محدود سنی 89-1 سال بود. جدول 3 توزیع سنی نمونهها را نشان میدهد. میانگین سنی در موارد قطعی 17/5± 34/8 (محدوده سنی 78-3)، مشکوک 13 ±38/7 (محدوده سنی 86-7 سال) و در موارد منفی 18 ±34/5 (محدوده سنی 87-1 سال) بود. نتایج آزمون آنالیز واریانس نشان داد که تفاوت معنیداری بین میانگین سن بر اساس تست سرولوژی کووید 19 وجود نداشت (P>0/05). اکثریت (62/9% موارد قطعی کووید 19 زن و فقط 36/1% مرد بودند. و در بین افراد مشکوک به کووید 19، 52% را زنان و 48% را مردان تشکیل میدادند. و در بین افراد با تست سرولوژی منفی کووید 19، 52/8 % زن و 46/2% مرد بودند. نتایج آزمون کای دو نشان داد ارتباط معنیداری بین جنسیت و ابتلا به کووید 19 وجود نداشت (P>0/05) (جدول ۴). آزمونANOVA نشان داد توزیع سنی شرکتکنندگان در مطالعه سرواپیدمیولوژی کووید 19 خرداد 1399 استان یزد در دو جنس تفاوت معنیداری ندارد (0/179=P). از مجموع ۹۳۴ شرکتکننده، 5/4% (50نفر) دچار علایم بالینی کووید 19 شامل تب، سرفه خشک، درد بدن، خستگی، تنگینفس بودند 94/6% دچار علایم فوق نبودند. از بین 50 شرکتکننده که دچار علایم بالینی کووید 19 بودند، نتیجه تست سرولوژی در 26% مثبت، 16% مشکوک و 58% منفی بودند. در بین 884شرکتکننده که علایم بالینی فوق را نداشتند، نتیجه تست سرولوژی در 17% آنها مثبت، 2/4% مشکوک و 80/6% منفی بودند. (P<0/05). (جدول 5 و 6 توزیع علائم بالینی را به تفکیک سرولوژی IgG و IgM نشان میدهند).
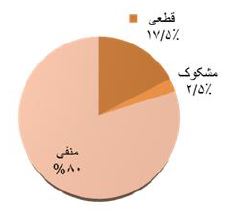
نمودار 1 : شیوع سرولوژیک کووید 19 در افراد نمونه در خرداد ماه 1399
جدول 1: نتایج سرولوژیک کووید 19 استان یزد خرداد 1399 به تفکیک مناطق 6 گانه
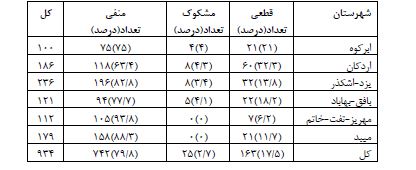
آزمون کای دو نشان داد بین شهر محل سکونت شرکتکنندگان و شیوع سرولوژی کووید 19 ارتباط معنیداری وجود داشت. P<0.0001
جدول 2: نتایج سرولوژیک کووید 19 در استان یزد در بهار 1399 به تفکیک خصوصیات دموگرافیک و علائم بالینی
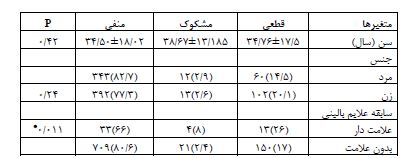
*P< 0/05
از آزمون T اختلاف بین نمونه های قطعی مشکوک و منفی از نظر سن آزمون شد. از آزمون کای دو برای بررسی اختلاف بین گروههای قطعی مشکوک و نرمال از نظر داشتن علائم استفاده شد.
جدول 3: توزیع سنی شرکتکنندگان در مطالعه سرواپیدمیولوژی کووید 19 خرداد 1399 استان یزد
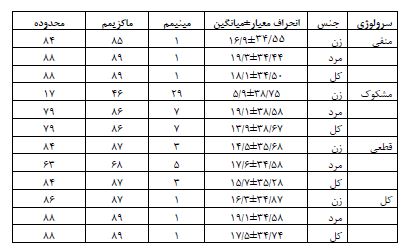
جدول 4: توزیع سنی در مطالعه سرواپیدمیولوژی کووید 19 خرداد 1399 استان یزد به تفکیک نتایج سرولوژی و جنس
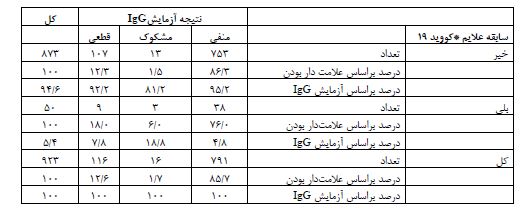
جدول 5: نتایج سرولوژی کووید-19 در ساکنین استان یزد خرداد ماه 1399 بر اساس وجود علامتهای بالینی بیماری کووید-19 در بیماران IgG مثبت
آزمون کای دو نتایج سرولوژی IgG در افرادی که دارای یکی از علایم تب درد بدن سرفه خشک تنگی نفس بودند به طور معنیداری ابتلا به کووید19 را به طور قطعی نشان داد.P<0.0001
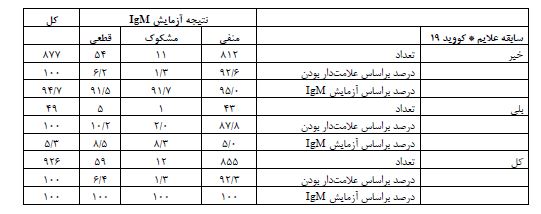
جدول ۶: نتایج سرولوژی کووید-19 در ساکنین استان یزد خرداد ماه 1399 بر اساس وجود علامتهای بالینی بیماری کووید-19 در موارد IgM مثبت
* علایم شامل تب سرفه خشک درد بدن خستگی تنگی نفس
آزمون کای –دو نتایج سرولوژیIgM در افرادی که دارای یکی از علایم تب درد بدن سرفه خشک تنگی نفس بودند بهطور معنیداری ابتلا به کووید 19 را بهطور قطعی نشان داد.P<0.0001
بحث
مطالعه حاضر بر روی 934 شرکتکننده در محدوده سنی 89-1 سال ساکن استان یزد با هدف بررسی شیوع سولوژیک کووید 19 انجام شد. یافتههای مطالعه حاضر بعد از اعمال ضرایب جمعیتی شهرستانها نشان داد که سرشماری شیوع سرولوژیک موارد قطعی کووید-19 استان یزد (16/91-12/91)14/91% و موارد مشکوک (3/85-2/85) 2/85% محاسبه شد. به عبارتی در خرداد ماه 1399 شیوع سرولوژیک کووید 19 به میزان (19/76-15/76) 17/76 مجموع موارد مشکوک و قطعی بود. اختلافات معنیدار در موارد شیوع قطعی و مشکوک کووید 19 در سطح مناطق 6 گانه استان مشاهده شد. بالاترین میزان شیوع قطعی سرولوژی کووید 19 در شهرستان اردکان 32% و کمترین آن مربوط به منطقه شهرستانهای مهریز-خاتم-تفت بود که 7% مشاهده شد. بین وجود علایم بالینی و شیوع سرولوژیک کووید 19 ارتباط معنیداری وجود داشت. شهرستان اردکان یک شهر صنعتی در استان یزد بوده و در مسیر جاده ترانزیت استان قرار دارد و مهاجرین غیر بومی زیادی به دلایل نیاز به کار ساکن این شهر میباشند که به تردد بین شهرهای خود و محل سکونت فعلی و با توجه به موارد بی علامت این بیماری، امکان شیوع بیماری را در این منطقه بیشتر نموده است. ضمناً احتمال میرود عدم باور عمومی و عدم رعایت کامل پروتکلهای بهداشتی منجر به تشدید انتقال شده باشد. مطالعهای شیوع سرولوژیک 17 استان و 18 شهر ایران را در مجله لنست گزارش نمود. تعداد 8902فرد بررسی شدند. 3020نفر مبتنی بر اجتماع بود و بقیه از مشاغل پرخطر وارد مطالعه شدند. در کل شیوع سرولوژیک کووید19 در این 17 استان بعد از تطبیق سنی جنسی و دقت تست معادل 2/5 ± 17/1% که معادل 4265542 نفر میباشد برآورد شد (24). که با یافتههای این مطالعه هماهنگ است. در هنگام یک اپیدمی جهت بررسی پویایی یک اپیدمی و سطح ایمنی جمعیت استفاده از سرولوژی جهت تعیین میزان کمیت تیتر آنتیبادی خاص یکی از بهترین روشهای موجود به خصوص در حضور موارد بی علامت یا با تشخیص ناقص بیماری عفونی است (25, 20). و همچنین یک روش راحت و سریع برای ردیابی موارد مشکوک و یا افراد در تماس با مبتلایان کووید 19 میباشد (26). میزان کشندگی ناشی از کووید 19 با احتساب موارد موارد بیعلامت و کم علامت بسیار کمتر خواهد بود و سازمان بهداشت جهانی جهت برآورد میزان دقیقتر کشندگی کووید 19 پروتکلی جهت یکسانسازی مطالعات سرولوژی منتشر کرده است (27). در مطالعه حاضر میزان شیوع سرولوژیک کووید 19 بر اساس آنتیبادی IgM و IgG حدود 18% بود. در یک مطالعه بر روی 742 فرد چینی گزارش شده است که آنتیبادی کووید 19 بین 3 تا 15 روز بعد از شروع علایم بیماری رخ داده است (26). Feng شاخص نسبت درستنمایی مثبتPositive likelihood ratio را جهت تشخیص موارد مشکوک کووید 19 برای هر دوی تست آنتیبادی IgM و IgG 99/15 درصد گزارش کرد و در این مطالعه پیشنهاد شد که با ترکیب دو روش تشخیصی تست اسید نوکلئیک و آنتیبادی میتوان به یک مسیر بالینی مطمئنتر برای تشخیص موارد مشکوک به کووید 19 دست یافت (18). در ووهان چین 4 تا 8 هفته پس از شروع همهگیری شیوع سرمی کووید 19 در بین کارکنان مراقبت بهداشتی 3/8% با فاصله اطمینان (5/4-2/6) گزارش شد (19). در مطالعه ایتالیا بر روی 202 کارمند مراقبان بهداشتی شیوع IgM و IgG به ترتیب 14/4% و 7/4% گزارش شد (15). شیوع سرمی کووید 19 بر روی 2766 فرد از 1399 خانوار در جنوا در هفته اول 4/8%، هفته دوم 8/5%، هفته سوم 10/9%، هفته چهارم 6/6% و در هفته پنجم 10/8% گزارش شد (13). در اسپانیا بر روی یک جمعیت 60000 هزار نفری شیوع سرمی کووید 19 در سطح کشور 5% و در مناطق شهری اطراف مادرید بیش از 10% گزارش شد. این تفاوت در شیوع مرتبط به موارد تایید شده آزمایشگاهی بود که در مناطق شهری بیشتر از مناطق روستایی بود (20). شیوع سرمی کووید 19 درشهرهای لسآنجلس کالیفرنیا 4/65% برآورد شد که با تطبیق جمعیتی تخمین زده شد 367000 هزار بزرگسال تا 10آوریل 2020 دارای آنتیبادی کووید 19 بودند (28). و نتایج شیوع سرمی کووید 19 در شهرهای لسآنجلس و کالیفرنیا نشان داد که مبتلایان بیش از تعداد موارد گزارش شده در همان بازه زمانی مشابه میباشند و چالشهای قابلتوجهی برای ردیابی موارد مشکوک و کنترل شیوع فراهم میشود (28). نتایج یک مطالعه متا آنالیز بر روی 399265 فرد از 23 کشور شیوع سرولوژی عفونت کووید 19 را از 0/37% تا 22/1% برآورد کرد (12). در مطالعه حاضر محدودیت سنی و جنسی وجود نداشت (محدوده سنی 89-1 سال) در حالی تقریباً تمامی مطالعات در مناطق جهان بر روی بزرگسالان صورت گرفته است و در مطالعه ما شیوع قطعی سرولوژی کووید 19 مستقل از سن شرکتکنندگان بود. لذا با توجه به شیوع کمتر بیماری در کودکان سایر مطالعات که منحصراً در بزرگسالان مطالعه کردند شیوع بیشتر از واقع را نشان دادند. در مطالعه حاضر زنان بیش از مردان شیوع سرولوژیک کووید 19 را نشان دادند اما تفاوت معنیداری از نظر شیوع قطعی سرولوژی کووید 19 در زنان (20/1%) و در مردان (14/5%) یافت نشد. در اسپانیا نیز تفاوت معنیداری در شیوع قطعی سرولوژی کووید 19 در زنان و مردان یافت نشد (20). زنان و مردان پاسخهای متفاوتی به عوامل بیماریزا میدهند که میتواند یک عامل مهم تاثیرگذار بار ویروسی و شدت مرگ و میر باشد. مطالعات نشان دادهاند ناپدید شدن RNA در مردان مبتلا به کووید 19 با تاخیر میباشد. از طرفی هورمونهای جنسی استروژن در زنان تقویتکننده سیستم ایمنی و تستوسترون سرکوبکننده سیستم ایمنی بدن است با این وجو د هنوز مکانیزم اساسی مولکولی کووید 19 در زنان و مردان شخص نیست و نیاز به مطالعات بیشتری در این زمینه می باشد (29). در مطالعه حاضر شیوع سرولوژی کووید 19 در 26% از افراد دارای علایم بالینی (تب، سرفه خشک، درد بدن، خستگی، تنگینفس) و 17% از افراد فاقد علایم بالینی کووید 19 مثبت بود (P<0/05). در مطالعات اولیه از جمله تظاهرات بالینی این بیماری، تب، سرفه خشک، گلودرد، خستگی، درد عضلانی، کاهش تعداد لکوسیتهای طبیعی، تنگینفس، شواهد رادیوگرافی از ذاتالریه گزارش شده است (32-30). در مطالعهای Hung و همکارانش بر روی 41 بیمار کووید 19 گزارش کردند که 98% از بیماران مبتلا به کووید 19 تب داشتند، و دمای بدن 78% از این افراد بالاتر ار 38 درجه بود. از کل بیماران در 76% سرفه، 44 % خستگی و درد عضلانی، 55% تنگی نفس، 28% خلط، 8% سرفه، 5 % خونریزی و در 3% اسهال گزارش شد. همچنین تست آزمایشگاهی در 25 % لکوپنی و در 63 % لنفوسیتوپنی گزارش کردند (33). همچنین استفاده از پلاسمای خون بهبود یافتگان که شامل آنتیبادیهای IgM، IgG و IgA است میتواند به بهبود سریعتر بیماران کمک کند (34). بیماری کووید 19 بیشتر از طریق قطرات تنفسی و تماس نزدیک منتقل میشود و علاوه بر داشتن سبک زندگی سالم، افزایش بهداشت فردی از جمله استفاده از ماسک، استراحت کافی و تهویه مناسب ازجمله راهکارهای مؤثر برای پیشگیری از بروز عفونت است (36, 35).
محدودیتهای مطالعه
با توجه به محدودیتهای مختلف قادر به اعلام شیوع سروپوزتیو کووید 19 را با خطای قابل قبول برای هر شهرستان به طور جداگانه نشدیم. لذا برآن شدیم استان را به مناطق ششگانه تقسیم نماییم. از طرفی پوشش 92% سامانه سیب ممکن است باعث کم برآوردی یا بیش برآوردی شیوع سرولوژیک شده باشد. تعداد 114 نفر از 934 نفر (12%) در زمان تکمیل اطلاعات پاسخگو نبود که با نفر بعدی جایگزین شد. با توجه به اینکه این میزان کمتر از 20% میباشد به احتمال قوی قابلیت تممیم نتایج را زیر سوال نخواهد برد.
پیشنهادات
پیشنهاد میشود مطالعه سرواپیدمیولوژی کووید 19 با توجه به گستردگی و دینامیک بودن روند انتقال این بیماری بهطور منظم با فواصل قابل قبول تکرار شود تا مداخلات کنترل اپیدمی و همچنین برنامه تزریق واکسن براساس ان صورت گیرد.
نتیجهگیری
در طی بهار 1399 تا ماه آخر خرداد نزدیک به 18% جمعیت استان یزد به صورت قطعی یا مشکوک به کووید 19 مبتلا بودند. به نظر میرسد 92% موارد قطعی بدون علامت هستند. لذا رعایت فاصلهگذاری اجتماعی، استفاده از ماسک و بهداشت فردی، برای عموم توصیه میشود. متاسفانه بالغ بر 25% جامعه هنوز پروتکلهای بهداشتی را رعایت نمیکنند که با توجه به میزان بالای قدرت سرایت این بیماری در صورت عدم رعایت اکثریت جمعیت میتوان گسترش شدید این بیماری را پیشبینی نمود.
سپاسگزاری
این مقاله منتج از طرح تحقیقاتی سرواپیدمیولوژی کووید 19 مصوب دانشگاه علوم پزشکی شهید صدوقی یزد میباشد. از تمام شهروندانی که در این مطالعه شرکت نمودند و همچنین از جناب آقایان دکتر حسین فرقانی، دکتر حمیدرضا دهقان، محمد میرجانی ارجانی و سرکار خانمها فاطمه مجیدپور، زهره گلشنزاده مهرجردی، سعیده انوری تفتی به خاطر زحماتی که متقبل شدند کمال تشکر را داریم.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد.
تعارض در منافع: وجود ندارد.
در اواخر دسامبر 2019 یک پاتوژن تنفسی جدیدی با نام کرونا ویروس SARS COV-19 در شهر ووهان چین گزارش شد و به سرعت در سرتاسر جهان منتشر شد (4-1) اولین مورد ابتلا کرونا با تست قطعی در ایران در تاریخ 30 بهمن 1398 در استان قم و اولین مورد در استان یزد در تاریخ ۶ اسفند ماه 1398 گزارش شد. سازمان بهداشت جهانی عفونت کووید 19را در تاریخ 10 بهمن 1398 یک وضعیت اضطراری (2) و در تاریخ 21اسفند یک پاندمی معرفی کرد (5). بر اساس آخرین آمار کووید19 در ایران تا تاریخ 20 بهمن 1399 1490000 مورد قطعی و 58686مورد مرگ گزارش شده است. این آمار در انتهای اردیبهشت 1398 شامل 122492 مورد قطعی و 7057 مورد مرگ بود. در هنگام همهگیری علاوه بر درمان بیماری یکی از نیازهای مهم جهت پیشگیری از گسترش بیماری شناخت اپیدمیولوژی بیماری میباشد. در جریان اپیدمیها سرعت انتشار بیماری تحت تاثیر تعداد افراد مبتلا، قابلیت انتقال ویروس و تعداد افراد حساس قرار میگیرد (6). بیماری کووید میتواند به عنوان یک بیماری بدون علامت، خفیف تا وضعیت بحرانی منجر به بستری و مرگ ظاهر شود (9-7). تعداد افراد مبتلا به کووید بدون علائم بالینی نسبت به کل افراد آلوده را نسبت بدون علامت مینامند (10). یکی از مهمترین چالشهای کووید 19 نقش افراد بدون علامت در انتقال بیماری هست اما نسبت این عفونتها و تاثیر نسبی آنها مشخص نیست (11, 8). تست RT-PCR از طریق سواپ نازوفارنژیال nasopharyngeal swabs از بیماران با تظاهرات بالینی یک تست تشخیصی استاندارد برای شناسایی و تشخیص بیماری کووید 19 میباشد اما به علت عدم شناسایی افراد بدون علامت، تعداد واقعی افراد مواجهه داشته و آلوده شده کمتر از حد واقعی برآورد میشود و لذا آمار مرگ و میر تائیده شده با توجه به عدم محاسبه افراد بدون علامت در مخرج کسر دقیق نیست (12-14). در یک اپیدمی ارزیابی تغییرات شیوع بیماری در طی زمان ابزار مهمی برای پیشبینی انتشار بیماری و تصمیمگیری مراقبتهای مورد نیاز بهداشتی میباشد (13) تستهای سرولوژی میتوانند آنتیبادیهای IgM و یا IgG در مقابل کووید 19 را به علت ماندگاری برای مدت طولانی پس از بهبود بیماری در افراد علامتدار و بدون علامت تشخیص دهند که به لحاظ تعیین دقیق نست افراد مبتلا در جامعه ارزشمند است (15, 12). بنابراین مطالعات سرولوژی ابزار مفیدی برای تخمین بروز تجمعی عفونت ناشی از مواجهه با کووید 19 براساس تفاوتهای قومیتی، سنی و شغلی (12, 5) و میزان مرگ ومیر در این افراد میباشد (16). نتایج مطالعهای در سوئد به منظور ارزیابی ارزش تشخیصی کیت سریع IgMو IgG نشان داد که حساسیت IgM و IgG به ترتیب 69 % و 93/1 % بود و ویژگی آن به ترتیب 100% و 99/2 % بود و این مطالعه تست سریع را برای ارزیابی شیوع سرولوژیک کووید 19 و ارزیابی ایمنی جمعی تایید نمود (17). در مطالعه دیگری شاخص نسبت درستنمایی مثبتPositive likelihood ratio برای آنتیبادیIgM %18/5 و برای آنتیبادی IgG %12/65 گزارش شد بنابراین احتمال پسین Posterior probability به ترتیب 90/18% و 86/26% و برای مجموع دو آنتیبادی 99/15% گزارش شد (18). شیوع سرولوژیک در مناطق مختلفی از جهان متفاوت است. در چین 3/8 % با فاصله اطمینان (5/4-2/6) (19)، در ایتالیا در 202 کارمند مراقبین بهداشتی شیوع IgM و IgG به ترتیب 14/4% و 7/4% (15). در اسپانیا بر روی یک جمعیت 60000 هزار نفری 19 در سطح کشور 5% (20) اعلام شده است. نتایج یک مطالعه متا آنالیز بر روی 399265 فرد از 23 کشور شیوع سرولوژی عفونت کووید 19 را از 0/37% تا 22/1 % برآورد کرد (12). و شیوع سرولوژی کووید 19در طی آوریل تا مه 2020 در لسآنجلس 4/65% (21)، فرانسه 4/4 % (22) و در گیلان بر روی 522 نفر 33% (23) گزارش شده است. مطالعهای شیوع سرولوژیک 17 استان و 18 شهر ایران را در مجله لنست گزارش نمود. تعداد 8902 فرد بررسی شدند. ۳۰۲۰ نفر از جامعه و بقیه از مشاغل پرخطر وارد مطالعه شدند. در کل شیوع سرولوژیک کووید 19 در این17 استان بعد از تطبیق سنی جنسی و دقت تست معادل 2/5 ± 17/1% که معادل 4265542نفر میباشد برآورد شد (24). با توجه به اینکه این بیماری در اکثر موارد بیعلامت و کم علامت میباشد، برای کنترل بهتر اپیدمی و سیاستگزاری بهداشتی به منظور قطع زنجیره انتقال و برآورد دقیقتر شاخصهای ابتلا و کشندگی بیماری نیاز به برآورد دقیقتری از ابتلا خواهیم داشت. مطالعه حاضر با هدف شناسایی شیوع سرولوژیک کووید 19 جهت تخمین دقیقتر مبتلایان در استان یزد انجام شد.
روش بررسی
مطالعه حاضر یک مطالعه مقطعی مبتنی بر اجتماع و از نوع سرواپیدمیولوژی است که جهت بررسی شیوع سرولوژیک کووید 19 در بازه زمانی 13 تا 30 خرداد ماه 1399 در استان یزد مرکز ایران انجام شد. جامعه مورد بررسی کلیه افراد تحت پوشش مراکز بهداشتی ساکن استان یزد بدون محدودیت سنی و جنسی بود. حجم نمونه جهت برآورد شیوع سرواپیدمیولوژیک با توجه یه شیوع 30% سرولوژی کووید 19 گزارش شده در استان گیلان و با دقت 5% با فاصله اطمینان 95% برای هر شهرستان 330 نفر و همینطور با پیش فرض شیوع حداقل 20% کووید در یزد 19، فاصله اطمینان 90% و خطای 6%، حداقل تعداد 120 مورد برای هر شهرستان محاسبه شد. در شهرستانهایی که به تنهایی وارد نمونهگیری شدند شیوع 30% و دقت 5% در نظر گرفته شد. شهرهایی که در مجاورت هم بودند و یک برآورد برای شیوع سرولوژیک آنها کافی به نظر میرسید تجمیع و از روش دوم با استفاده از شیوع 20% با خطای 6% استفاده گردید. با هدف برآورد شیوع سرواپیدمیولوژی جهت استان و هر شهرستان 330 نفر به صورت جداگانه و در مجموع تعداد 1830 نمونه محاسبه شد. با توجه به محدودیتهای مطالعه مقرر شد استان به 6 منطقه شامل (یزد-اشکذر)، (بافق – بهاباد) و (خاتم- مهریز – تفت)، اردکان، میبد و ابرکوه تقسیم شود لذا با توجه به حجم نمونه فوق جهت شهرستانهای یزد- اشکذر مجموعاً 330نفر، اردکان 186 نفر، میبد 179 نفر، ابرکوه 120 نفر، (بافق – بهاباد) مجموعاً 120 نفر، ( خاتم- مهریز – تفت) هم 120 نفر نمونه مجموعاً 1020 نمونه محاسبه گردید. نمونهگیری به صورت دو مرحلهای خوشهای و تصادفی ساده انجام گرفت. ابتدا با توجه به پوشش بالغ بر ۹۲% سامانه سیب در استان مراکز سلامت به عنوان چارچوب نمونهگیری انتخاب شدند. سپس بر اساس حجم نمونه در مناطق 6 گانه فوق در استان در هر شهرستان از بین کل مراکز هر کدام بر اساس جمعیت تحت پوشش هر مرکز به صورت تصادفی ساده انتخاب شد. در هر مرکز نیز به روش نمونهگیری تصادفی ساده افراد به صورت تصادفی انتخاب شدند. نمونهها توسط مراقب سلامت و با استفاده از سامانه سیب از هفتمین نفر لیست بیست نفره آن روز نمونهگیری شد. در صورت عدم دسترسی یا عدم همکاری نفر بعد (پیگیری تا 3 نفر بعد لیست) جایگزین شد. نمونهگیری تا تکمیل حجم نمونه در هر مرکز ، ادامه یافت. در مجموع 114 نفر (12%) نیاز به جایگزین پیدا کردند. نمونهگیری از 13 خرداد تا آخر خرداد ماه ادامه یافت. فرد بعد از تکمیل فرم جهت اخذ نمونه خون دعوت میشد یا در منزل انجام میگرفت. با تمهیدات فوق تا انتهای مطالعه در کل 934 نفر وارد مطالعه شدند. بافق - بهاباد 121 نفر، اردکان 186 نفر، میبد 179 نفر، اشکذر و یزد236 نفر، تفت -خاتم - مهریز112 نفر، و ابرکوه 100 نفر وارد مطالعه شدند. ابزار گردآوی اطلاعات پرسشنامهای شامل اطلاعات دموگرافی (سن- جنس- شغل- تحصیلات) سابقه علامتهای شایع کووید 19 شامل: تب، درد بدن و خستگی، سرفه خشک، تنگی نفس، سابقه بستری با تشخیص قطعی کووید همینطور میزان رعایت مداخلات غیردارویی مثل فاصله اجتماعی، ماندن در خانه بهجز جهت انجام امور ضروری، عدم شرکت در مجامع، پوشیدن ماسک در مجامع، پوشیدن دستکش، شستن مرتب دست و دوری از افراد مسنتر از 65 سال خانواده بود. تکمیل پرسشنامه توسط مراقبین بهداشت که شامل بهیاران مستقر در مراکز بهداشتی انجام گرفت. جهت انجام نمونهگیری خون با توجه به تمایل شرکتکنندگان، مراقبین سلامت جهت انجام نمونهگیری خون به محل سکونت فرد مراجعه کرده و با رعایت پروتکلهای بهداشتی نمونه خون افراد تهیه شد و یا افراد در صورت تمایل به مرکز سلامت مشخص شده جهت نمونهگیری خون دعت شدند و نمونه خون با شرایط استاندارد تهیه و به آزمایشگاه مرکزی ارسال شد. آنتیبادی IgG ,IgM با استفاده از کیت تشخیصی "کیت الیزا پیشتاز طب " با حساسیت 94/1% و ویژگی 98/3% جهت SARS-CoV-2 IgG و حساسیت 79/4% و ویژگی 97/3% برای SARS-CoV-2 IgM اندازهگیری شد. (24) موارد خاص مثل کودکان و نوزادان و افراد مسن با ابتلا به بیماری خاص جهت نمونهگیری به آزمایشگاه مرکزی یزد ارجاع شدند. موارد کمتر از 0/9 جذب نوری (Optical Density (OD منفی، نتایج سرولوژی بین 1/1-01/9((OD مشکوک و نتایج بیشتر از 1/1 (OD مثبت در نظر گرفته شد. موارد IgG مثبت یا IgM مثبت قطعی در نظر گرفته شد. موارد مشکوک IgG یا IgM مشکوک و موارد منفی IgG و موارد منفی IgM منفی در نظر گرفته شد.
تجزیه و تحلیل آماری
ویژگیهای شرکتکنندگان برای متغیرهای کمی به صورت میانگین± انحراف معیار و برای متغیرهای کیفی به صورت فراوانی (%) و برآورد شیوع± فاصله اطمینان ۹۵% برآورد شده آن گزارش شد. جهت بررسی ارتباط بین متغیرهای کیفی و نتیجه تست سرولوژی از آزمون کای دو و جهت بررسی تفاوت متغیرهای کمی براساس نتیجه تست سرولوژی از آزمون ANOVA استفاده شد. سطح معنیداری آزمون 5% در نظر گرفته شد و از نرم افزار.16 SPSS.version جهت تجزیه و تحلیل استفاده شد. توزیع سنی نمونهها بررسی گردید که با توزیع سنی جمعیت استان تفاوت معنیداری نداشت ولی توزیع جنسی نمونهها با استان متفاوت بود که تطبیق داده شد ولی از نظر سنی نیازی به تطبیق نداشت لذا برآورد سرولوژیک شیوع با تطبیق جنسی ارائه گردید. جهت برآورد شیوع سرولوژیک کووید 19 در استان ضرایب جمعیتی شهرستانها اعمال گردید.
ملاحظات اخلاقی
این پروژه در کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد با کد اخلاق IR.SSU.REC.1399.041 تایید گردید. نتایج بدون نام ثبت شد و با حفظ محرمانگی مشخصات افراد نتایج بهصورت کلی ارائه گردید.
نتایج
در مجموع 1020شرکتکننده به صورت تصادفی از 10 شهرستان استان یزد دعوت شدند و 934 نفر (91/5%) وارد مطالعه شدند. از شهرستانهای یزد و اشکذر 236 نفر، اردکان 186 نفر، میبد 179 نفرتفت- خاتم - مهریز 112 نفر، بافق - بهاباد 121 نفر و ابرکوه 100 نفر وارد مطالعه شدند. میانگین سنی شرکتکنندگان 17/5± 34/3 بود و 54/7 % (504 نفر) را زنان و 45/3% ( 415نفر) را مردان تشکیل دادند. نتایج نشان داد بر اساس IgM 12 نفر (1/3%) مشکوک و 59 نفر (6/3%) قطعی و بر اساس IgG 16نفر (1/7%) مشکوک و 116 نفر (12/4%) قطعی بودند. براساس تلفیق دو آزمایش IgM وIgG مواردی که هر دو قطعی بودند قطعی در نظر گرفته شد. مواردی که هردو منفی بودند منفی و مواردی که یکی از تستها مشکوک بودند مشکوک در نظر گرفته شد. با توجه به این معیار و قبل از اعمال ضریب جمعیتی شهرستانها فراوانی موارد مثبت قطعی کووید (19/9-15/1) 17/5% (163 نفر)، موارد مشکوک (1/5-5/) 2/5% (25 نفر) بود. (نمودار 1). جدول1 شیوع سرولوژی کووید 19 را براساس مناطق چندگانه استان یزد ارائه میکند. بیشترین شیوع سرولوژیک کووید 19 به ترتیب در شهرستانهای اردکان (39-25)32%، ابرکوه (29-13) 21%، بافق-بهاباد (25-11) 18%، یزد اشکذر (17/8-8/8) 13/8%، میبد (16-6 )11%، مهریز-خاتم-تفت(13/2-0/8) 7% بود. جدول2 توزیع فراوانی شیوع سرولوژیک کووید 19 را بر اساس سن و جنسیت و علایم بالینی کووید 19 در استان یزد ارائه میکند. بعد از اعمال ضرایب جمعیتی شهرستانها بر اساس آخرین سرشماری شیوع سرولوژیک موارد قطعی کووید-۱۹ استان (16/91-12/91) 14/91% و موارد مشکوک (3/85-1/85) 2/85% محاسبه شد. به عبارتی در خرداد ماه 1399 شیوع سرولوژیک کووید 19 به میزان (19/76-15/76) 17/76 مجموع موارد مشکوک و قطعی محاسبه شد. میانگین سنی کلی شرکتکنندگان 17/5 ±34/3 (محدود سنی 89-1 سال بود. جدول 3 توزیع سنی نمونهها را نشان میدهد. میانگین سنی در موارد قطعی 17/5± 34/8 (محدوده سنی 78-3)، مشکوک 13 ±38/7 (محدوده سنی 86-7 سال) و در موارد منفی 18 ±34/5 (محدوده سنی 87-1 سال) بود. نتایج آزمون آنالیز واریانس نشان داد که تفاوت معنیداری بین میانگین سن بر اساس تست سرولوژی کووید 19 وجود نداشت (P>0/05). اکثریت (62/9% موارد قطعی کووید 19 زن و فقط 36/1% مرد بودند. و در بین افراد مشکوک به کووید 19، 52% را زنان و 48% را مردان تشکیل میدادند. و در بین افراد با تست سرولوژی منفی کووید 19، 52/8 % زن و 46/2% مرد بودند. نتایج آزمون کای دو نشان داد ارتباط معنیداری بین جنسیت و ابتلا به کووید 19 وجود نداشت (P>0/05) (جدول ۴). آزمونANOVA نشان داد توزیع سنی شرکتکنندگان در مطالعه سرواپیدمیولوژی کووید 19 خرداد 1399 استان یزد در دو جنس تفاوت معنیداری ندارد (0/179=P). از مجموع ۹۳۴ شرکتکننده، 5/4% (50نفر) دچار علایم بالینی کووید 19 شامل تب، سرفه خشک، درد بدن، خستگی، تنگینفس بودند 94/6% دچار علایم فوق نبودند. از بین 50 شرکتکننده که دچار علایم بالینی کووید 19 بودند، نتیجه تست سرولوژی در 26% مثبت، 16% مشکوک و 58% منفی بودند. در بین 884شرکتکننده که علایم بالینی فوق را نداشتند، نتیجه تست سرولوژی در 17% آنها مثبت، 2/4% مشکوک و 80/6% منفی بودند. (P<0/05). (جدول 5 و 6 توزیع علائم بالینی را به تفکیک سرولوژی IgG و IgM نشان میدهند).

نمودار 1 : شیوع سرولوژیک کووید 19 در افراد نمونه در خرداد ماه 1399
جدول 1: نتایج سرولوژیک کووید 19 استان یزد خرداد 1399 به تفکیک مناطق 6 گانه

آزمون کای دو نشان داد بین شهر محل سکونت شرکتکنندگان و شیوع سرولوژی کووید 19 ارتباط معنیداری وجود داشت. P<0.0001
جدول 2: نتایج سرولوژیک کووید 19 در استان یزد در بهار 1399 به تفکیک خصوصیات دموگرافیک و علائم بالینی

*P< 0/05
از آزمون T اختلاف بین نمونه های قطعی مشکوک و منفی از نظر سن آزمون شد. از آزمون کای دو برای بررسی اختلاف بین گروههای قطعی مشکوک و نرمال از نظر داشتن علائم استفاده شد.
جدول 3: توزیع سنی شرکتکنندگان در مطالعه سرواپیدمیولوژی کووید 19 خرداد 1399 استان یزد

جدول 4: توزیع سنی در مطالعه سرواپیدمیولوژی کووید 19 خرداد 1399 استان یزد به تفکیک نتایج سرولوژی و جنس

جدول 5: نتایج سرولوژی کووید-19 در ساکنین استان یزد خرداد ماه 1399 بر اساس وجود علامتهای بالینی بیماری کووید-19 در بیماران IgG مثبت

آزمون کای دو نتایج سرولوژی IgG در افرادی که دارای یکی از علایم تب درد بدن سرفه خشک تنگی نفس بودند به طور معنیداری ابتلا به کووید19 را به طور قطعی نشان داد.P<0.0001
جدول ۶: نتایج سرولوژی کووید-19 در ساکنین استان یزد خرداد ماه 1399 بر اساس وجود علامتهای بالینی بیماری کووید-19 در موارد IgM مثبت

* علایم شامل تب سرفه خشک درد بدن خستگی تنگی نفس
آزمون کای –دو نتایج سرولوژیIgM در افرادی که دارای یکی از علایم تب درد بدن سرفه خشک تنگی نفس بودند بهطور معنیداری ابتلا به کووید 19 را بهطور قطعی نشان داد.P<0.0001
بحث
مطالعه حاضر بر روی 934 شرکتکننده در محدوده سنی 89-1 سال ساکن استان یزد با هدف بررسی شیوع سولوژیک کووید 19 انجام شد. یافتههای مطالعه حاضر بعد از اعمال ضرایب جمعیتی شهرستانها نشان داد که سرشماری شیوع سرولوژیک موارد قطعی کووید-19 استان یزد (16/91-12/91)14/91% و موارد مشکوک (3/85-2/85) 2/85% محاسبه شد. به عبارتی در خرداد ماه 1399 شیوع سرولوژیک کووید 19 به میزان (19/76-15/76) 17/76 مجموع موارد مشکوک و قطعی بود. اختلافات معنیدار در موارد شیوع قطعی و مشکوک کووید 19 در سطح مناطق 6 گانه استان مشاهده شد. بالاترین میزان شیوع قطعی سرولوژی کووید 19 در شهرستان اردکان 32% و کمترین آن مربوط به منطقه شهرستانهای مهریز-خاتم-تفت بود که 7% مشاهده شد. بین وجود علایم بالینی و شیوع سرولوژیک کووید 19 ارتباط معنیداری وجود داشت. شهرستان اردکان یک شهر صنعتی در استان یزد بوده و در مسیر جاده ترانزیت استان قرار دارد و مهاجرین غیر بومی زیادی به دلایل نیاز به کار ساکن این شهر میباشند که به تردد بین شهرهای خود و محل سکونت فعلی و با توجه به موارد بی علامت این بیماری، امکان شیوع بیماری را در این منطقه بیشتر نموده است. ضمناً احتمال میرود عدم باور عمومی و عدم رعایت کامل پروتکلهای بهداشتی منجر به تشدید انتقال شده باشد. مطالعهای شیوع سرولوژیک 17 استان و 18 شهر ایران را در مجله لنست گزارش نمود. تعداد 8902فرد بررسی شدند. 3020نفر مبتنی بر اجتماع بود و بقیه از مشاغل پرخطر وارد مطالعه شدند. در کل شیوع سرولوژیک کووید19 در این 17 استان بعد از تطبیق سنی جنسی و دقت تست معادل 2/5 ± 17/1% که معادل 4265542 نفر میباشد برآورد شد (24). که با یافتههای این مطالعه هماهنگ است. در هنگام یک اپیدمی جهت بررسی پویایی یک اپیدمی و سطح ایمنی جمعیت استفاده از سرولوژی جهت تعیین میزان کمیت تیتر آنتیبادی خاص یکی از بهترین روشهای موجود به خصوص در حضور موارد بی علامت یا با تشخیص ناقص بیماری عفونی است (25, 20). و همچنین یک روش راحت و سریع برای ردیابی موارد مشکوک و یا افراد در تماس با مبتلایان کووید 19 میباشد (26). میزان کشندگی ناشی از کووید 19 با احتساب موارد موارد بیعلامت و کم علامت بسیار کمتر خواهد بود و سازمان بهداشت جهانی جهت برآورد میزان دقیقتر کشندگی کووید 19 پروتکلی جهت یکسانسازی مطالعات سرولوژی منتشر کرده است (27). در مطالعه حاضر میزان شیوع سرولوژیک کووید 19 بر اساس آنتیبادی IgM و IgG حدود 18% بود. در یک مطالعه بر روی 742 فرد چینی گزارش شده است که آنتیبادی کووید 19 بین 3 تا 15 روز بعد از شروع علایم بیماری رخ داده است (26). Feng شاخص نسبت درستنمایی مثبتPositive likelihood ratio را جهت تشخیص موارد مشکوک کووید 19 برای هر دوی تست آنتیبادی IgM و IgG 99/15 درصد گزارش کرد و در این مطالعه پیشنهاد شد که با ترکیب دو روش تشخیصی تست اسید نوکلئیک و آنتیبادی میتوان به یک مسیر بالینی مطمئنتر برای تشخیص موارد مشکوک به کووید 19 دست یافت (18). در ووهان چین 4 تا 8 هفته پس از شروع همهگیری شیوع سرمی کووید 19 در بین کارکنان مراقبت بهداشتی 3/8% با فاصله اطمینان (5/4-2/6) گزارش شد (19). در مطالعه ایتالیا بر روی 202 کارمند مراقبان بهداشتی شیوع IgM و IgG به ترتیب 14/4% و 7/4% گزارش شد (15). شیوع سرمی کووید 19 بر روی 2766 فرد از 1399 خانوار در جنوا در هفته اول 4/8%، هفته دوم 8/5%، هفته سوم 10/9%، هفته چهارم 6/6% و در هفته پنجم 10/8% گزارش شد (13). در اسپانیا بر روی یک جمعیت 60000 هزار نفری شیوع سرمی کووید 19 در سطح کشور 5% و در مناطق شهری اطراف مادرید بیش از 10% گزارش شد. این تفاوت در شیوع مرتبط به موارد تایید شده آزمایشگاهی بود که در مناطق شهری بیشتر از مناطق روستایی بود (20). شیوع سرمی کووید 19 درشهرهای لسآنجلس کالیفرنیا 4/65% برآورد شد که با تطبیق جمعیتی تخمین زده شد 367000 هزار بزرگسال تا 10آوریل 2020 دارای آنتیبادی کووید 19 بودند (28). و نتایج شیوع سرمی کووید 19 در شهرهای لسآنجلس و کالیفرنیا نشان داد که مبتلایان بیش از تعداد موارد گزارش شده در همان بازه زمانی مشابه میباشند و چالشهای قابلتوجهی برای ردیابی موارد مشکوک و کنترل شیوع فراهم میشود (28). نتایج یک مطالعه متا آنالیز بر روی 399265 فرد از 23 کشور شیوع سرولوژی عفونت کووید 19 را از 0/37% تا 22/1% برآورد کرد (12). در مطالعه حاضر محدودیت سنی و جنسی وجود نداشت (محدوده سنی 89-1 سال) در حالی تقریباً تمامی مطالعات در مناطق جهان بر روی بزرگسالان صورت گرفته است و در مطالعه ما شیوع قطعی سرولوژی کووید 19 مستقل از سن شرکتکنندگان بود. لذا با توجه به شیوع کمتر بیماری در کودکان سایر مطالعات که منحصراً در بزرگسالان مطالعه کردند شیوع بیشتر از واقع را نشان دادند. در مطالعه حاضر زنان بیش از مردان شیوع سرولوژیک کووید 19 را نشان دادند اما تفاوت معنیداری از نظر شیوع قطعی سرولوژی کووید 19 در زنان (20/1%) و در مردان (14/5%) یافت نشد. در اسپانیا نیز تفاوت معنیداری در شیوع قطعی سرولوژی کووید 19 در زنان و مردان یافت نشد (20). زنان و مردان پاسخهای متفاوتی به عوامل بیماریزا میدهند که میتواند یک عامل مهم تاثیرگذار بار ویروسی و شدت مرگ و میر باشد. مطالعات نشان دادهاند ناپدید شدن RNA در مردان مبتلا به کووید 19 با تاخیر میباشد. از طرفی هورمونهای جنسی استروژن در زنان تقویتکننده سیستم ایمنی و تستوسترون سرکوبکننده سیستم ایمنی بدن است با این وجو د هنوز مکانیزم اساسی مولکولی کووید 19 در زنان و مردان شخص نیست و نیاز به مطالعات بیشتری در این زمینه می باشد (29). در مطالعه حاضر شیوع سرولوژی کووید 19 در 26% از افراد دارای علایم بالینی (تب، سرفه خشک، درد بدن، خستگی، تنگینفس) و 17% از افراد فاقد علایم بالینی کووید 19 مثبت بود (P<0/05). در مطالعات اولیه از جمله تظاهرات بالینی این بیماری، تب، سرفه خشک، گلودرد، خستگی، درد عضلانی، کاهش تعداد لکوسیتهای طبیعی، تنگینفس، شواهد رادیوگرافی از ذاتالریه گزارش شده است (32-30). در مطالعهای Hung و همکارانش بر روی 41 بیمار کووید 19 گزارش کردند که 98% از بیماران مبتلا به کووید 19 تب داشتند، و دمای بدن 78% از این افراد بالاتر ار 38 درجه بود. از کل بیماران در 76% سرفه، 44 % خستگی و درد عضلانی، 55% تنگی نفس، 28% خلط، 8% سرفه، 5 % خونریزی و در 3% اسهال گزارش شد. همچنین تست آزمایشگاهی در 25 % لکوپنی و در 63 % لنفوسیتوپنی گزارش کردند (33). همچنین استفاده از پلاسمای خون بهبود یافتگان که شامل آنتیبادیهای IgM، IgG و IgA است میتواند به بهبود سریعتر بیماران کمک کند (34). بیماری کووید 19 بیشتر از طریق قطرات تنفسی و تماس نزدیک منتقل میشود و علاوه بر داشتن سبک زندگی سالم، افزایش بهداشت فردی از جمله استفاده از ماسک، استراحت کافی و تهویه مناسب ازجمله راهکارهای مؤثر برای پیشگیری از بروز عفونت است (36, 35).
محدودیتهای مطالعه
با توجه به محدودیتهای مختلف قادر به اعلام شیوع سروپوزتیو کووید 19 را با خطای قابل قبول برای هر شهرستان به طور جداگانه نشدیم. لذا برآن شدیم استان را به مناطق ششگانه تقسیم نماییم. از طرفی پوشش 92% سامانه سیب ممکن است باعث کم برآوردی یا بیش برآوردی شیوع سرولوژیک شده باشد. تعداد 114 نفر از 934 نفر (12%) در زمان تکمیل اطلاعات پاسخگو نبود که با نفر بعدی جایگزین شد. با توجه به اینکه این میزان کمتر از 20% میباشد به احتمال قوی قابلیت تممیم نتایج را زیر سوال نخواهد برد.
پیشنهادات
پیشنهاد میشود مطالعه سرواپیدمیولوژی کووید 19 با توجه به گستردگی و دینامیک بودن روند انتقال این بیماری بهطور منظم با فواصل قابل قبول تکرار شود تا مداخلات کنترل اپیدمی و همچنین برنامه تزریق واکسن براساس ان صورت گیرد.
نتیجهگیری
در طی بهار 1399 تا ماه آخر خرداد نزدیک به 18% جمعیت استان یزد به صورت قطعی یا مشکوک به کووید 19 مبتلا بودند. به نظر میرسد 92% موارد قطعی بدون علامت هستند. لذا رعایت فاصلهگذاری اجتماعی، استفاده از ماسک و بهداشت فردی، برای عموم توصیه میشود. متاسفانه بالغ بر 25% جامعه هنوز پروتکلهای بهداشتی را رعایت نمیکنند که با توجه به میزان بالای قدرت سرایت این بیماری در صورت عدم رعایت اکثریت جمعیت میتوان گسترش شدید این بیماری را پیشبینی نمود.
سپاسگزاری
این مقاله منتج از طرح تحقیقاتی سرواپیدمیولوژی کووید 19 مصوب دانشگاه علوم پزشکی شهید صدوقی یزد میباشد. از تمام شهروندانی که در این مطالعه شرکت نمودند و همچنین از جناب آقایان دکتر حسین فرقانی، دکتر حمیدرضا دهقان، محمد میرجانی ارجانی و سرکار خانمها فاطمه مجیدپور، زهره گلشنزاده مهرجردی، سعیده انوری تفتی به خاطر زحماتی که متقبل شدند کمال تشکر را داریم.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد.
تعارض در منافع: وجود ندارد.
References:
1- Lauer SA, Grantz KH, Bi Q, Jones FK, Zheng Q, Meredith HR, et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) from Publicly Reported Confirmed Cases: Estimation and Application. Ann Int Med 2020: 172(9): 577-82.
2- Dawood FS, Ricks P, Njie GJ, Daugherty M, Davis W, Fuller JA, et al. Observations of the Global Epidemiology of COVID-19 from the Prepandemic Period Using Web-Based Surveillance: A Cross-Sectional Analysis. Lancet Infect Dis 2020; 20: 1255-62.
3- Young BE, Ong SWX, Kalimuddin S, Low JG, Tan SY, Loh J, et al. Epidemiologic Features and Clinical Course of Patients Infected with SARS-Cov-2 in Singapore. JAMA 2020; 323(15): 1488-94.
4- Farnoosh G, Alishiri G, Hosseini Zijoud SR, Dorostkar R, Jalali Farahani A. Understanding the 2019-novel Coronavirus (2019-nCoV) and Coronavirus Disease (COVID-19) Based on Available Evidence-A Narrative Review. J Mil Med 2020; 22(1): 1-11.
5- Rudberg AS, Havervall S, Månberg A, Falk AJ, Aguilera K, Ng H, et al. SARS-Cov-2 Exposure, Symptoms and Seroprevalence in Healthcare Workers in Sweden. Nature Communications 2020; 11(1): 1-8.
6- Lipsitch M, Swerdlow DL, Finelli L. Defining the Epidemiology of Covid-19—Studies Needed. N Engl J Med 2020; 382:1194-96.
7- Lai CC, Wang JH, Hsueh PR .Population-Based Seroprevalence Surveys of Anti-SARS-Cov-2 Antibody: An Up-To-Date Review. International J Infectious Diseases 2020; 101: 314-22.
8- Yanes-Lane M, Winters N, Fregonese F, Bastos M, Perlman-Arrow S, Campbell JR, et al. Proportion of Asymptomatic Infection among COVID-19 Positive Persons and their Transmission Potential: A Systematic Review and Meta-Analysis. PloS One 2020; 15(11): e0241536.
9- Eckerle I, Meyer B. SARS-Cov-2 Seroprevalence in COVID-19 Hotspots. The Lancet 2020; 396(10250): 514-5.
10- Mizumoto K, Kagaya K, Zarebski A, Chowell G. Estimating the Asymptomatic Proportion of Coronavirus Disease 2019 (COVID-19) Cases on Board the Diamond Princess Cruise Ship, Yokohama, Japan, 2020. Euro Surveill 2020; 25(10): 2000180.
11- Oran DP, Topol EJ. Prevalence of Asymptomatic SARS-CoV-2 Infection: A Narrative Review. Annals of Internal Medicine 2020; 173: 362-7.
12- Rostami A, Sepidarkish M, Leeflang M, Riahi S, Shiadeh MN, Esfandyari S, et al. SARS-CoV-2 Seroprevalence Worldwide: A Systematic Review and Meta-Analysis. Clin Microbiol Infect 2021; 27(3): 331-40.
13- Stringhini S, Wisniak A, Piumatti G, Azman AS, Lauer SA, Baysson H, et al. Seroprevalence
of Anti-SARS-Cov-2 Igg Antibodies in Geneva, Switzerland (Serocov-POP): A Population-Based Study. The Lancet 2020; 396(10247): 313-19.
14- Verity R, Okell LC, Dorigatti I, Winskill P, Whittaker C, Imai N, et al. Estimates of t he Severity of Coronavirus Disease 2019: A Model-Based Analysis. The Lancet Infectious Diseases 2020; 30(6): 669-77.
15- Sotgiu G, Barassi A, Miozzo M, Saderi L, Piana A, Orfeo N, et al. SARS-Cov-2 Specific Serological Pattern in Healthcare Workers of an Italian COVID-19 Forefront Hospital. BMC Pulm Med 2020; 20(1): 203.
16- Arora RK, Joseph A, Van Wyk J, et al. Serotracker: A Global Sars-Cov-2 Seroprevalence Dashboard. Lancet Infect Dis 2020.
17- Hoffman T, Nissen K, Krambrich J, Rönnberg B, Akaberi D, Esmaeilzadeh M, et al. Evaluation of a COVID-19 Igm and Igg Rapid Test; An Efficient Tool for Assessment of Past Exposure to SARS-Cov-2. Infection Ecology & Epidemiology 2020; 10(1): 1754538.
18- Feng Y. Clinical Value of SARS-CoV2 IgM and IgG Antibodies in Diagnosis of COVID-19 in Suspected Cases. J Inflammation Res 2020; 13: 1089.
19- Xu X, Sun J, Nie S, Li H, Kong Y, Liang M, et al. Seroprevalence of Immunoglobulin M and G Antibodies Against SARS-Cov-2 in China. Nat Med 2020; 20: 1193-5.
20- Pollán M, Pérez-Gómez B, Pastor-Barriuso R, Oteo J, Hernán MA, Pérez-Olmeda M, et al. Prevalence of SARS-Cov-2 in Spain (ENE-COVID): A Nationwide, Population-Based Seroepidemiological Study. The Lancet 2020; 396 (10250): 535-44.
21- Sood N, Simon P, Ebner P, Eichner D, Reynolds J, Bendavid E, et al. Seroprevalence of SARS-CoV-2–Specific Antibodies among Adults in Los Angeles County, California, on April 10-11, 2020. JAMA 2020; 323(23): 2425-7.
22- Salje H, Kiem CT, Lefrancq N, Courtejoie N, Bosetti P, Paireau J, et al. Estimating the burden of SARS-CoV-2 in France. Sci 2020; 369(6500): 208-11.
23- Shakiba M, Nazari SSH, Mehrabian F, Rezvani SM, Ghasempour Z, Heidarzadeh A. Seroprevalence of COVID-19 virus infection in Guilan province, Iran. MedRxiv 2020.
24- Poustchi H, Darvishian M, Mohammadi Z, Shayanrad A, Delavari A, Bahadorimonfared A, et al. SARS-Cov-2 Antibody Seroprevalence in the General Population and High-Risk Occupational Groups Across 18 Cities in Iran: a Population-Based Cross-Sectional Study. The Lancet Infectious Diseases 2020.
25- Metcalf CJE, Farrar J, Cutts FT, Basta NE, Graham AL, Lessler J, et al. Use of Serological Surveys to Generate Key Insights into the Changing Global Landscape of Infectious Disease. The Lancet 2016; 388(10045): 728-30.
26- Zhang J, Zhang X, Liu J, Ban Y, Li N, Wu Y, et al. Serological Detection of 2019-Ncov Respond to the Epidemic: A Useful Complement to Nucleic Acid Testing. Int Immunopharmacology 2020; 88: 106861.
27- Organization WH. Population-Based Age-Stratified Seroepidemiological Investigation Protocol for COVID-19 Virus Infection. World Health Organization; 2020. Available at: https://apps.who.int/iris/bitstream/handle/10665/331656/WHO-2019-nCoV-Seroepidemiology-2020.1-eng.pdf?sequence=1&isAllowed=y. Accessed March 17, 2020.
28- Sood N, Simon P, Ebner P, Eichner D, Reynolds J, Bendavid E, et al. Seroprevalence of SARS-Cov-2–Specific Antibodies among Adults in Los Angeles County, California, On April 10-11, 2020. JAMA 2020; 323(23): 2425-7.
29- Pradhan A, Olsson PE. Sex Differences in Severity and Mortality from COVID-19: Are Males More Vulnerable? Biology of sex Differences 2020; 53: 1-11.
30- Zu ZY, Jiang MD, Xu PP, Chen W, Ni QQ, Lu GM, et al. Coronavirus Disease 2019 (COVID-19): A Perspective from China. Radiology 2020; 296: E15-25
31- Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients with 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA 2020; 323(11): 1061-9.
32- Khan N, Fahad S. Critical Review of the Present Situation of Corona Virus in China. Available at SSRN 3543177 2020.
33- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet 2020; 395(10223): 497-506.
34- Ganji A, Mosayebi GH, Khaki M, Ghazavi A. A Review on Immunopathogenesis, Molecular Biology and Clinical Aspects of the 2019 Novel Coronavirus (COVID-19). J Arak University of Medical Sciences (JAMS) 2020; 23(1): 8-21
35- Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharmaceutical Analysis 2020; 10(2): 102-8.
36- Wang L, Wang Y, Ye D, Liu Q. A Review of the 2019 Novel Coronavirus (COVID-19) Based on Current Evidence. Inter J Antimicrob Agents 2020; 55(6): 105948.
1- Lauer SA, Grantz KH, Bi Q, Jones FK, Zheng Q, Meredith HR, et al. The Incubation Period of Coronavirus Disease 2019 (COVID-19) from Publicly Reported Confirmed Cases: Estimation and Application. Ann Int Med 2020: 172(9): 577-82.
2- Dawood FS, Ricks P, Njie GJ, Daugherty M, Davis W, Fuller JA, et al. Observations of the Global Epidemiology of COVID-19 from the Prepandemic Period Using Web-Based Surveillance: A Cross-Sectional Analysis. Lancet Infect Dis 2020; 20: 1255-62.
3- Young BE, Ong SWX, Kalimuddin S, Low JG, Tan SY, Loh J, et al. Epidemiologic Features and Clinical Course of Patients Infected with SARS-Cov-2 in Singapore. JAMA 2020; 323(15): 1488-94.
4- Farnoosh G, Alishiri G, Hosseini Zijoud SR, Dorostkar R, Jalali Farahani A. Understanding the 2019-novel Coronavirus (2019-nCoV) and Coronavirus Disease (COVID-19) Based on Available Evidence-A Narrative Review. J Mil Med 2020; 22(1): 1-11.
5- Rudberg AS, Havervall S, Månberg A, Falk AJ, Aguilera K, Ng H, et al. SARS-Cov-2 Exposure, Symptoms and Seroprevalence in Healthcare Workers in Sweden. Nature Communications 2020; 11(1): 1-8.
6- Lipsitch M, Swerdlow DL, Finelli L. Defining the Epidemiology of Covid-19—Studies Needed. N Engl J Med 2020; 382:1194-96.
7- Lai CC, Wang JH, Hsueh PR .Population-Based Seroprevalence Surveys of Anti-SARS-Cov-2 Antibody: An Up-To-Date Review. International J Infectious Diseases 2020; 101: 314-22.
8- Yanes-Lane M, Winters N, Fregonese F, Bastos M, Perlman-Arrow S, Campbell JR, et al. Proportion of Asymptomatic Infection among COVID-19 Positive Persons and their Transmission Potential: A Systematic Review and Meta-Analysis. PloS One 2020; 15(11): e0241536.
9- Eckerle I, Meyer B. SARS-Cov-2 Seroprevalence in COVID-19 Hotspots. The Lancet 2020; 396(10250): 514-5.
10- Mizumoto K, Kagaya K, Zarebski A, Chowell G. Estimating the Asymptomatic Proportion of Coronavirus Disease 2019 (COVID-19) Cases on Board the Diamond Princess Cruise Ship, Yokohama, Japan, 2020. Euro Surveill 2020; 25(10): 2000180.
11- Oran DP, Topol EJ. Prevalence of Asymptomatic SARS-CoV-2 Infection: A Narrative Review. Annals of Internal Medicine 2020; 173: 362-7.
12- Rostami A, Sepidarkish M, Leeflang M, Riahi S, Shiadeh MN, Esfandyari S, et al. SARS-CoV-2 Seroprevalence Worldwide: A Systematic Review and Meta-Analysis. Clin Microbiol Infect 2021; 27(3): 331-40.
13- Stringhini S, Wisniak A, Piumatti G, Azman AS, Lauer SA, Baysson H, et al. Seroprevalence
of Anti-SARS-Cov-2 Igg Antibodies in Geneva, Switzerland (Serocov-POP): A Population-Based Study. The Lancet 2020; 396(10247): 313-19.
14- Verity R, Okell LC, Dorigatti I, Winskill P, Whittaker C, Imai N, et al. Estimates of t he Severity of Coronavirus Disease 2019: A Model-Based Analysis. The Lancet Infectious Diseases 2020; 30(6): 669-77.
15- Sotgiu G, Barassi A, Miozzo M, Saderi L, Piana A, Orfeo N, et al. SARS-Cov-2 Specific Serological Pattern in Healthcare Workers of an Italian COVID-19 Forefront Hospital. BMC Pulm Med 2020; 20(1): 203.
16- Arora RK, Joseph A, Van Wyk J, et al. Serotracker: A Global Sars-Cov-2 Seroprevalence Dashboard. Lancet Infect Dis 2020.
17- Hoffman T, Nissen K, Krambrich J, Rönnberg B, Akaberi D, Esmaeilzadeh M, et al. Evaluation of a COVID-19 Igm and Igg Rapid Test; An Efficient Tool for Assessment of Past Exposure to SARS-Cov-2. Infection Ecology & Epidemiology 2020; 10(1): 1754538.
18- Feng Y. Clinical Value of SARS-CoV2 IgM and IgG Antibodies in Diagnosis of COVID-19 in Suspected Cases. J Inflammation Res 2020; 13: 1089.
19- Xu X, Sun J, Nie S, Li H, Kong Y, Liang M, et al. Seroprevalence of Immunoglobulin M and G Antibodies Against SARS-Cov-2 in China. Nat Med 2020; 20: 1193-5.
20- Pollán M, Pérez-Gómez B, Pastor-Barriuso R, Oteo J, Hernán MA, Pérez-Olmeda M, et al. Prevalence of SARS-Cov-2 in Spain (ENE-COVID): A Nationwide, Population-Based Seroepidemiological Study. The Lancet 2020; 396 (10250): 535-44.
21- Sood N, Simon P, Ebner P, Eichner D, Reynolds J, Bendavid E, et al. Seroprevalence of SARS-CoV-2–Specific Antibodies among Adults in Los Angeles County, California, on April 10-11, 2020. JAMA 2020; 323(23): 2425-7.
22- Salje H, Kiem CT, Lefrancq N, Courtejoie N, Bosetti P, Paireau J, et al. Estimating the burden of SARS-CoV-2 in France. Sci 2020; 369(6500): 208-11.
23- Shakiba M, Nazari SSH, Mehrabian F, Rezvani SM, Ghasempour Z, Heidarzadeh A. Seroprevalence of COVID-19 virus infection in Guilan province, Iran. MedRxiv 2020.
24- Poustchi H, Darvishian M, Mohammadi Z, Shayanrad A, Delavari A, Bahadorimonfared A, et al. SARS-Cov-2 Antibody Seroprevalence in the General Population and High-Risk Occupational Groups Across 18 Cities in Iran: a Population-Based Cross-Sectional Study. The Lancet Infectious Diseases 2020.
25- Metcalf CJE, Farrar J, Cutts FT, Basta NE, Graham AL, Lessler J, et al. Use of Serological Surveys to Generate Key Insights into the Changing Global Landscape of Infectious Disease. The Lancet 2016; 388(10045): 728-30.
26- Zhang J, Zhang X, Liu J, Ban Y, Li N, Wu Y, et al. Serological Detection of 2019-Ncov Respond to the Epidemic: A Useful Complement to Nucleic Acid Testing. Int Immunopharmacology 2020; 88: 106861.
27- Organization WH. Population-Based Age-Stratified Seroepidemiological Investigation Protocol for COVID-19 Virus Infection. World Health Organization; 2020. Available at: https://apps.who.int/iris/bitstream/handle/10665/331656/WHO-2019-nCoV-Seroepidemiology-2020.1-eng.pdf?sequence=1&isAllowed=y. Accessed March 17, 2020.
28- Sood N, Simon P, Ebner P, Eichner D, Reynolds J, Bendavid E, et al. Seroprevalence of SARS-Cov-2–Specific Antibodies among Adults in Los Angeles County, California, On April 10-11, 2020. JAMA 2020; 323(23): 2425-7.
29- Pradhan A, Olsson PE. Sex Differences in Severity and Mortality from COVID-19: Are Males More Vulnerable? Biology of sex Differences 2020; 53: 1-11.
30- Zu ZY, Jiang MD, Xu PP, Chen W, Ni QQ, Lu GM, et al. Coronavirus Disease 2019 (COVID-19): A Perspective from China. Radiology 2020; 296: E15-25
31- Wang D, Hu B, Hu C, Zhu F, Liu X, Zhang J, et al. Clinical Characteristics of 138 Hospitalized Patients with 2019 Novel Coronavirus–Infected Pneumonia in Wuhan, China. JAMA 2020; 323(11): 1061-9.
32- Khan N, Fahad S. Critical Review of the Present Situation of Corona Virus in China. Available at SSRN 3543177 2020.
33- Huang C, Wang Y, Li X, Ren L, Zhao J, Hu Y, et al. Clinical features of patients infected with 2019 novel coronavirus in Wuhan, China. The Lancet 2020; 395(10223): 497-506.
34- Ganji A, Mosayebi GH, Khaki M, Ghazavi A. A Review on Immunopathogenesis, Molecular Biology and Clinical Aspects of the 2019 Novel Coronavirus (COVID-19). J Arak University of Medical Sciences (JAMS) 2020; 23(1): 8-21
35- Li X, Geng M, Peng Y, Meng L, Lu S. Molecular immune pathogenesis and diagnosis of COVID-19. J Pharmaceutical Analysis 2020; 10(2): 102-8.
36- Wang L, Wang Y, Ye D, Liu Q. A Review of the 2019 Novel Coronavirus (COVID-19) Based on Current Evidence. Inter J Antimicrob Agents 2020; 55(6): 105948.
نوع مطالعه: پژوهشي |
موضوع مقاله:
اپیدمیولوژی
دریافت: 1399/11/29 | پذیرش: 1399/12/10 | انتشار: 1399/12/10
دریافت: 1399/11/29 | پذیرش: 1399/12/10 | انتشار: 1399/12/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




