دوره 29، شماره 6 - ( شهریور 1400 )
جلد 29 شماره 6 صفحات 3866-3854 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Dolatabadi S, Najafzadeh M J. Assessment of Virulence Potential in Rhizopus species in Larvae of Galleria Mellonella and Mice. JSSU 2021; 29 (6) :3854-3866
URL: http://jssu.ssu.ac.ir/article-1-5365-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5365-fa.html
دولتآبادی سمیه، نجفزاده محمد جواد. ارزیابی میزان عفونت زایی گونههای قارچ Rhizopus بر روی لارو حشره mellonella Galleria و موش آزمایشگاهی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (6) :3854-3866
متن کامل [PDF 984 kb]
(455 دریافت)
| چکیده (HTML) (1099 مشاهده)
متن کامل: (852 مشاهده)
مقدمه
موکورالها قارچهای ساپروفیت بوده که در محیطهای مختلفی مانند خاک، آب، و مواد در حال فساد دیده میشوند. این قارچها به عنوان تجزیه کننده مواد آلی عمل نموده و باعث فساد، تغییر طعم و مزه در محصولات کشاورزی، و تولید سم شده در نتیجه خسارات بالایی در بخش کشاورزی قابل انتظار میباشد (۱). این قارچها با توجه به سرعت رشد بالا، ساختار رشتهای، توانایی رشد در حرارت بالا، و نیز تولید طیف وسیعی از آنزیمها و متابولیتهای ثانویه، گزینههای مناسبی جهت تولید فرآوردههای زیستی در صنعت میباشند که با صرفهجویی مالی بسیار همراه خواهد بود (۲). تولید متابولیتهای ثانویهای مانند اسیدهای آلی (اسید مالیک، اسید لاکتیک)، کاروتن، آنزیمهای مختلف) لیپاز، آمیلاز، تیروزیناز، سلولاز، پکتیناز(، الکل، سوختهای زیستی، و مواد دارویی از گونههای مختلف این گروه گزارش شدهاند که هر کدام به نوبه خود میتوانند بخش عظیمی از تقاضای روزافزون این محصولات در بازارهای تجاری و صنعتهای وابسته را پوشش دهند (۳).گونههای موکورال از دیر باز در تولید غذاهای تخمیری بر پایه سویا و برنج در کشورهای آسیای دور بکار میرفتهاند (۴). از دیدگاه کلی، قارچ R. arrhizus به عنوان قارچ امن Generally Recognized As Safe (GRAS) شناخته میشود و قادر به استفاده از منابع کربنی مختلفی میباشد (3-4). این گروه قارچی همچنین قادر به ایجاد عفونت موکورمایکوزیس میباشند. بروز عفونت موکورمایکوزیس در افراد سالم نادر بوده ولیکن بروز این عفونت در بیماران با نقص سیستم ایمنی در دهههای اخیر رو به رشد بوده است (7-5). اگرچه بروز موکورمایکوزیس از شیوع کمتری نسبت به عفونتهای ناشی از قارچ آسپرژیلوس و کاندیدا برخوردار میباشد ولیکن درصد مرگ و میر و سرعت پیشرفت آن بسیار بالاتر میباشد (8). بسته به نوع بیماری زمینهای افراد، و موضع عفونت، میزان مرگ و میر بین 100-20 درصد گزارش شده است (9). در مطالعه مروری انجام شده در ایران، دیابت نوع 2 اصلیترین بیماریهای زمینهای و بیشترین درگیری این عفونت در نواحی سینوس بوده است (10). عفونت رینوسربرال رایج ترین نوع این عفونتها در سطح جهانی نیز میباشد (11). در سالهای اخیر میزان بروز این عفونت با توجه به استفاده از داروهای سرکوب کننده سیستم ایمنی؛ در بیمارانی با مشکلات خونی، پیوند اعضاء، دیابت کنترل نشده، کتواسیدوزیس، استفاده طولانی از کورتیکواستروئیدها، غلظت بالای آهن، و نوزادان نارس رو به رشد بوده است (14-12و 6). بیشترین موارد بیماریزایی از قارچهای گونه ریزوپوس Rhizopus و Lichtheimia و موکور Mucor گزارش شده است (7). Rhizopus arrhizus به تنهایی عامل ۷۰ درصد از موارد موکورمایکوزیس و 90 درصد از موارد عفونت رینوسربرال میباشد. گونههای Lichtheimia و موکور در مقام دوم قرار میگیرند. دیگر گونه ریزوپوس R. microsporus مقام سوم ایجاد عفونت در بیماران مستعد را دارا می باشد (6-5). Rhizopus arrhizus همچنین، گونه رایج در ایجاد موکورمایکوزیس در ایران است (10). Lichtheimia و Mucor در مجموع باعث ایجاد 19 درصد موارد این بیماری در اروپا میباشند (12). از دیگر نمونههای رایج در ایجاد موکورمایکوزیس، میتوان به گونههای Apophysomyces، Rhizomucor، Saksenaea، Cunninghamella اشاره نمود (17-15، 13). تهدید دیگر این گروه از قارچها، رابطه همزیستی آنها با باکتری گرم منفی Bulkholderia میباشد. این باکتری از خانواده Burkholderiaceae عامل تولید سم ریزوکسین است که خاصیت antimicrotubule داشته و با قرارگرفتن در سلولهای کوچک سرطان ریه، میتواند در درمان بیماران سرطان موثر باشد (1،3(. بروز و تولید این سم در سویه CBS 111563 جداسازی شده از ماده غذایی سوفو ردیابی شده است (18) که میتواند هشداری برای استفاده از این قارچ در صنعت مواد غذایی باشد. در گذشته تصور بر این بود که سویههای محیطی متفاوت از سویههای بالینی میباشند. ولیکن مطالعات مولکولی جدید در مورد گونه R. microsporus نشانگر تک نژادی بودن این گونه در سطح مولکولی میباشد و بر اساس مطالعات انجام شده، در مورد گونه R. arrhizus تنها دو واریته delemar, arrhizus پذیرفته میباشد (19-20). استفاده از پستادارانی مانند موش، روش ایده آل جهت بررسی شدت بیماریزایی عوامل عفونی میباشد. استفاده از موشها برای بررسی اثر داروهای ضدقارچی و نیز شدت بیماریزایی ریزوپوس مورد استفاده قرار گرفته است (21،22). اما استفاده از پستانداران در مقیاس بالا با محدودیتهای اخلاقی، زمان و هزینه مواجه میباشد. در نتیجه استفاده از مدلهای جایگزین مانند لارو حشرات مورد توجه قرار میگیرد. لارو حشره Galleria mellonella بهطور گسترده در مطالعات مربوط به قارچهای بیماریزا مورد استفاده بوده است (23،24). لارو حشره دارای سلولهای هموسیت میباشد که عملکردی مشابه فاگوسیتها دارند و بیشتر اعمال این سلولها را اجرا میکنند و با تولید مواد ضد باکتریایی مانند سوپراکسید قادر به حذف سلولهای باکتریایی مانند Burkholderia mallei میباشند (25،26). ایجاد عفونت در این لاروها با تولید ملانین همراه میباشد. ملانین در هموسل تولید و در بافتها آزاد میشود. در نتیجه لاروهای آلوده از رنگ کرم روشن به قهوهای تیره تغییر رنگ میدهند. سیستم ایمنی حشرات شباهت ساختاری و عملکردی بالایی را با سیستم ایمنی ذاتی در پستانداران بروز میدهد و در نتیجه این حشرات بهعنوان مدل مناسبی در مطالعات بالینی مطرح میگردند. لارو این حشره نیازی به خوراک دهی نداشته، دارای مزیتهایی مانند ارزان و سریع تر بودن و عدم نیاز به کد اخلاقی میباشد (24). اگرچه عفونت قارچی موکورمایکوزیس معمولاً در افراد با نقص سیستم ایمنی مانند بیماران مبتلا به دیابت و پیوند اعضاء رخ میدهد ولیکن با وجود استفاده رایج این گونهها در صنایع مختلف و امکان بروز موکورمایکوزیس، و با توجه به ماهیت فرصت طلب بودن برخی از گونههای این قارچ، بایستی مکانیسمهای بیماریزایی این گونهها مدنظر قرار گیرد تا راه حل مقابله و پیشگیری از این عفونت شناسایی شوند (27). لذا با توجه به بیماریزایی شدید گونههای ریزوپوس (28)، توانایی دو گونه رایج این قارچ، جهت ارزیابی شدت بیماریزایی و ارتباط آن با منبع جداسازی نمونهها در مدل لارو حشره Galleria mellonella مورد بررسی قرار میگیرد. تاثیر سم ریزوکسین موجود در باکتری همزیست بر ایجاد بیماری موکورمایکوزیس نیز با استفاده از سویههای مثبت و منفی از نظر تولید سم مورد بررسی قرار گرفته و نتایج حاصله با نتایج مشابه در موش آزمایشگاهی به عنوان مدل استاندارد در آزمایشات بالینی، مورد مقایسه قرار میگیرند. استفاده از مدلهای آزمایشگاهی اطلاعات گستردهای را در زمینه شناخت مولکولی موکورمایکوزیس و روشهای درمانی آن در اختیار ما قرار داده است (29). نتایج حاصله از این مطالعه بر میزان شناخت ما نسبت به عملکرد این گونهها در بالین خواهد افزود و امکان مدیریت بهتر این نوع عفونت را فراهم میآورد.
روش بررسی
آماده سازی نمونه های قارچی
در این مطالعه آزمایشگاهی، تعداد کل 26 نمونه قارچی مورد بررسی قرار گرفتند. این سویهها از مرکز CBS-KNAW (Utrecht, The Netherlands) تهیه شدند. از این میان، تعداد 13 نمونه از گونه Rhizopus microsporus بودند که شامل دو نمونه محیطی، 7 نمونه غذایی، و 4 نمونه بالینی میباشد. از این میان تعداد دو نمونه حاوی باکتری همزیست و قادر به تولید سم ریزوکسین میباشند و تعداد دو نمونه فاقد این باکتری همزیست و عاری از سم میباشند (جدول 1). حضور یا عدم حضور باکتری همزیست در این سویهها در مطالعات قبلی با استفاده از روش کشت در محیط مناسب جهت رشد باکتریها به اثبات رسیده بوده است (3). تعداد 13 نمونه از قارچ R. arrhizus نیز مورد مطالعه قرار گرفتند که شامل 5 نمونه محیطی، 5 نمونه غذایی و 3 نمونه بالینی میباشد. نمونههای زیر مجموعه قارچ R. arrhizus شامل دو واریته این گونه میباشد؛ واریته delemar (n=5), arrhizus (n=8). نمونههای استفاده شده در این مطالعه از مناطق جغرافیایی متنوعی بهدست آمدهاند (جدول 1). سویههای لیوفیلیزه شده بر روی محیط کشت مالت پپتون (MP, Oxoid, Basingstoke, U.K.) به مدت دو روز قرار گرفتند و سپس به محیط کشت مالت اکسترکت آگار (MEA, Oxoid) منتقل شده و بهمدت 2 روز در دمای ۳۰ درجه سانتیگراد انکوبه شدند. در مورد مدل آزمایشگاهی موش، پس از اسپورزایی کافی، اسپورها در بافر استریل PBS جمعآوری شده و غلظت 107 اسپور در یک میلیلیتر برای هر سویه قارچی و به ازای هر نمونه موش آزمایشگاهی و یا لارو حشره تهیه شد. اسپورها با استفاده از لام نیوبار شمارش شده و در دمای 4 °C نگهداری میشوند. از این میزان اسپور، مقدار 0/1 میلیلیتر با کمک سرنگ استریل به هر لارو تزریق میگردد تا غلظت نهایی 106 بهدست آید. بافر PBS به عنوان کنترل منفی و سویه R. microsporus CBS 102277 با منشاء بالینی به عنوان سویه مثبت مورد استفاده قرار گرفتند (۱7). در مورد آزمون لارو حشره mellonella G.، از بافر IPS (Insect Phosphate Saline; 8/76 g NaCl, 0/35 g KCl, 15/76 g Tris-HCl, 3/72 g EDTA, 4/72 g Na-citrate per litre, pH = 6/9) استفاده شد. این بافر بهعنوان کنترل منفی در این آزمون و سویهR. microsporus CBS 102277 به عنوان کنترل مثبت مورد استفاده قرار گرفت. به منظور بررسی قابلیت تکرار آزمون، از تعداد 20 عدد لارو حشره به ازای هر نمونه استفاده شده است و هر آزمون دو بار تکرار شده است.
مدل لارو حشره Galleria mellonella: لارو مرحله ششم برای این آزمون مورد استفاده قرار گرفته است. لاروها قبل از استفاده در دمای 18 °C و در تاریکی قرار گرفتند. وزن لاروها 0/4-0/3 گرم بوده است. اسپورهای تهیه شده در بافر IPS به قسمت پای شکمی لاروها تزریق شدند. نمونههای تلقیح شده و نمونههای کنترل بهمدت شش روز در 30 °C و تاریکی انکوبه و بررسی شدند. تغییر رنگ لاروها به قهوهای نشانه از بین رفتن آنها میباشد (23).
مدل موش آزمایشگاهی: تعداد 54 عدد موش ماده CD-1 با وزن 25-20 با سن 5-4 هفته، در 18 گروه دسته بندی شدند. تعداد سه موش برای هر گروه در نظر گرفته شد. شدت بیماریزایی 8 عدد از سویههای ذکر شده در مدل آزمایشگاهی لارو حشره در مدل موش نیز بررسی شدند (22). میزان 0/1 میلی لیتر از اسپور با غلظت نهایی 106 در یک میلی لیتر از طریق رگ دمی به بدن موش تزریق شد. گروه شاهد فقط بافر PBS را دریافت نمودند. مطالعه دو مرتبه تکرار شد بنابراین مجموع 54 موش مورد استفاده قرار گرفت. موشهای تزریق شده حداقل سه بار در روز مورد بررسی قرار میگرفتند. علایم بالینی مد نظر شامل بروز مواردی مانند کم آبی، کاهش وزن (حدود 15% وزن بدن در 48 ساعت و یا 20% در 24 ساعت)، افت درجه حرارت بدن تا 33 درجه سانتیگراد، سفتی عضلات گردن، بیقراری میباشد. موشهایی که این علایم را بروز دادند با حفظ اصول اخلاقی از آزمایش حذف شدند. آزمایش در روز 14 بعد از تلقیح خاتمه یافته و تمامی موشهای مورد آزمایش با بیهوشی ایزوفلوران از بین رفتند و اندام های داخلی جدا شدند. تست حرارت: تست حرارت برای تمامی سویههای قارچی که مورد مطالعه قرار گرفتند، انجام شد. سویهها در دمای ۱۵ درجه تا ۳۶ درجه سانتیگراد با فواصل 3 درجه به مدت 3 روز انکوبه شدند. همچنین سویهها در دمای ۵۵، ۵۲، ۵۰، ۴۵، و ۴۰ درجه سانتیگراد نیز انکوبه شدند. سویهها در پلیتهای 8 سانتیمتری مالت اکسترکت آگار و در تاریکی قرار گرفتند (19).
تجزیه و تحلیل آماری
تمام اطلاعات آماری به وسیله نرم افزار Graphpad Prism (GraphPad Software, San Diego, CA) نسخه 7 انجام شد. دادههای مربوط به بقاء نمونهها با استفاده از نمودارهایKaplen-Meyer رسم و با استفاده از تست log rank آنالیز شدند. میزان p.value کمتر از 0/05 درصد در نظر گرفته شد. میانگین زمانی زنده ماندن (Median Survival Time, MST) نمونهها، به معنای زمانی که نیمی از لاروها و یا موشها مردهاند، میباشد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی مشهد تایید شده است (کد اخلاق1396.457 IR.MUMS.fm.REC.)
نتایج
دمای رشد بهینه برای رشد سویههای R. microsporus دمای ۳۶ درجه سانتیگراد و دمای رشد بیشینه برای این سویهها در محدوده °C 50-52 بهدست آمد. اکثر نمونهها در بازه دمایی 30 تا 40 درجه سانتیگراد قادر به رشد مطلوب بودهاند. دمای رشد بهینه برای رشد سویههای R. arrhizus دمای ۳۰ درجه سانتیگراد و دمای رشد بیشینه برای این سویهها ۴۵ درجه سانتیگراد بهدست آمد. قابلیت تکرار در آزمون لارو حشره، با استفاده از 20 لارو به ازای هر نمونه و دو بار تکرار آزمون نشان داد که تفاوت در نتایج پس از 48 ساعت به استثنا سویههای CBS 324.35, CBS 137314 کمتر از 25% و در آخرین روز آزمون به استثنا سویههایCBS 631.82, CBS 137314، کمتر از15% بوده است. میزان مرگ و میر در آخرین روز آزمون کاملاً تکرارپذیر بوده است. R. microsporus به میزان70‒100% (av. 87.72% ± 25.33) مرگ و میر ایجاد نموده که این امر در بازه زمانی 4.5-1 روز رخ داده است (شکل 2 ب). در مورد R. arrhizus مرگ و میر به میزان 90‒100% (av. 98.34% ± 3.11) در بازه زمانی1‒2 روز بوده است. میزان مرگ و میرR. arrhizus var. delemar، 90‒100% (av. 96.67% ± 4.24) و در مورد var. arrhizus میزان مرگ و میر99.38% ± 1.76) 95‒100% (av. بوده است (شکل 2 آ). در نتیجه تفاوت بین دو واریته معنادار نمیباشد. در مورد قارچ R. microsporus میزان مرگ و میر 48.77% در دومین روز پس از تلقیح بوده است در حالیکه این رقم در مورد R. arrhizus 70% بوده است. تفاوت میان این دو گونه معنادار بوده و بیانگر بیماریزایی قوی تر گونه R. arrhizus در روز دوم میباشد. Rhizopus microsporus افزایش مرگ و میری به میزان 8/15% در روز آخر آزمایش از خود نشان میدهد. سویههای دارای باکتری همزیست که قادر به ایجاد سم میباشند، مرگ و میری به میزان(0−100%, av. 51.41% ± 40) در مقایسه با سویههای فاقد باکتری همزیست ایجاد نمودند(0−80%, av. 58.33% ± 40) . مرگ و میر در روز دوم معنادار نبود. در مقایسه با منبع جداسازی نمونهها بر اساس سه گروه نمونههای محیطی، غذایی، و بالینی، نتایج معناداری بهدست نیامد. توان بیماریزایی در سویهها با منبع مختلف مشهود بود. نتایج بهدست آمده در میان سویههای مربوط به یک گونه متغیر بودند. از میان نمونههای فوق، تعداد 8 عدد نمونه که از منابع متفاوتی جداسازی شدهاند برای آزمون موش مدنظر گرفته شدند. (4 R. microsporus, 2 R. arrhizus var. arrhizus and 2 R. arrhizus var. delemar). تمام موشها با غلظت106 /ml تلقیح شدند. میزان مرگ و میر درR. microsporus برابر با 66/66% با میانگین زمانی 6 روز بوده است (شکل 1 آ). این امر در مورد var. delemar R. arrhizus در بازه زمانی 6-5 روز رخ داده و برابر با 66/66% میباشد. در مورد var. arrhizus مرگ و میر به میزان 100% در بازه زمانی 2-3 روز بوده است (شکل 1 ب). سویههای تولیدکننده سم (CBS 339.62, CBS 112588) مرگ و میری برابر با سویههای فاقد توانایی تولید سم (CBS 700.68, CBS 631.82) از خود نشان دادند. سویه CBS 136239 (R. arrhizus var. arrhizus) که از خاک جداسازی شده است بیشترین میزان مرگ و میر را در میان دیگر نمونههای تلقیح شده در موشهای آزمایشگاهی بروز داد. در مقایسه با منبع جداسازی نمونهها بر اساس سه گروه نمونههای محیطی، غذایی، و بالینی، نتایج معناداری بهدست نیامد.
جدول ۱: نمونههای قارچی مورد استفاده در این مطالعه آزمایشگاهی: نام گونه، منبع و مکان جداسازی، وجود باکتری همزیست در برخی سویهها، نتایج حاصله در دو مدل آزمایشگاهی
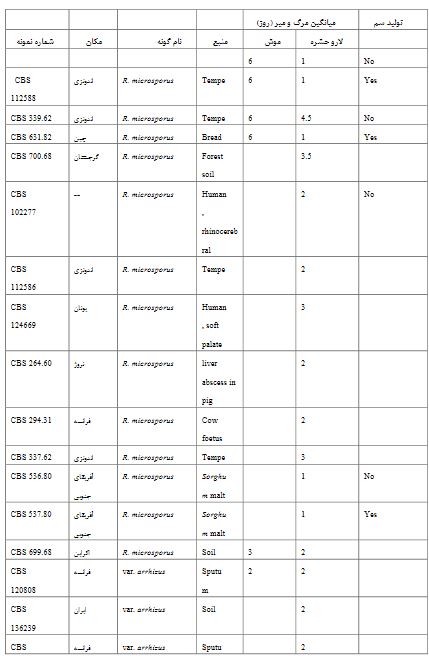


شکل 1 آ: نمودار مرگ و میر گونه R. microsporus در بازه زمانی 14 روزه در موش آرمایشگاهی.

شکل 2 ب: نمودار مرگ و میر دو واریته از گونه R. arrhizus در بازه زمانی 14 روزه در موش آرمایشگاهی.
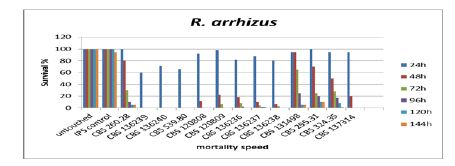
شکل 2 آ: نمودار مرگ و میر دو واریته از گونه R. arrhizus در بازه زمانی شش روزه در لارو حشره.
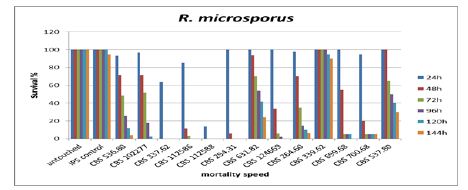
شکل 2 ب: نمودار مرگ و میر گونه R. microsporus در بازه زمانی شش روزه در لارو حشره.
بحث
در این مطالعه، با استفاده از مدل آزمایشگاهی لارو حشره، میزان بیماریزایی دو گونه رایج ریزوپوس ارزیابی گردید. استفاده از لارو حشره Galleria mellonella در بررسی بیماریزایی قارچهای پاتوژن مختلف و همچنین سویههای Madurella mycetomatis نتایج قابل قبولی را بههمراه داشته است (30،31). نتایج آزمایشگاهی بهدست آمده از این لارو جهت بررسی بیماریزایی قارچ Aspergillus وCandida با مدل پستاندار موش آزمایشگاهی قابل مقایسه (23،32) و همچنین کاربرد این مدل در مورد بیماریزایی گونههای موکورال، موفقیتآمیز بوده است (33). پستانداران مختلفی مانند خرگوش، خوکچه هندی، و موش به دلیل شباهتهای ساختاری و فیزیولوژِیکی با بدن انسان، مدل مناسبی را جهت بررسیهای آزمایشگاهی فراهم میآورند. این جانوران در مطالعات مربوط به موکورالها نیز مورد استفاده بوده اند (34،35). در این مطالعه ازمدل موش جهت مقایسه نتایج در آزمایش لارو حشره و نیز بهرهمندی از یک مدل پستاندار استفاده شده است. در دیگر مطالعات، میزان مرگ و میر گونه ریزوپوس در مقایسه با دیگر گونههای موکورال در دمای 30 و 37 درجه سانتیگراد شدیدتر گزارش شده است (33). میزان مرگ و میر R. arrhizus در لارو حشره بالاتر از گونهR. microsporus بود (تصویر 2 آ). این تفاوت میتواند در ارتباط با دمای بهینه رشد بالاتر برای R. microsporus در مقایسه با دمای بهینه کمتر برای گونه R. arrhizus و لارو حشره باشد. دمای رشد بهینه برای R. arrhizus، 30 درجه سانتیگراد و در مورد R. microsporus، 45 درجه میباشد. توان رشد در دماهای بالاتر، نیاز اولیه میکروارگانیسم ها برای آلوده کردن میزبان خونگرم میباشد. قارچهای موکورال به خوبی از این توانایی برخوردار میباشند. در مطالعه کائگر و همکاران Kaerger et al. 2015 در سال ۲۰۱۵ (36) گونههای گرمادوست توانایی بیشتری به بیماریزایی داشتند در حالیکه دیگر عوامل مانند اندازه اسپور، مقاومت در برابر استرسها، و .... تاثیری در این امر نداشتند. هر دو مدل آزمایشگاهی لارو حشره و موش، مدل عفونت سیستمی را ارائه میدهند و در نتیجه نتایج حاصله قابل مقایسه میباشد. لذا با وجود تعداد کم نمونههای بررسی شده در مدل موش آزمایشگاهی، نتایج بهدست آمده در دو مدل مشابه میباشند (29). این امر بر قابلیت مدل لارو حشره به عنوان مدل آزمایشگاهی مطلوب در مطالعات بالینی تاکید مینماید. توان بیماریزایی بالاتر گونه R. arrhizusدر هر دو مدل لارو حشره و موش مشابه شرایط موجود در بالین میباشد. تفاوت اندکی در میان دو واریته این گونه وجود دارد ولیکن تعداد سویهها ممکن است برای نتیجهگیری کلی اندک باشد. در مجموع نتایج متفاوت بین دو گونه با تفاوت در سطح سویهها مرتبط نبوده است، حتی در مطالعاتی که از تعداد بیست سویه ریزوپوس استفاده نمودهاند (35، 33). نتایج حاصل از این آزمون تفاوت معناداری را در میان نمونههای جداسازی شده از منابع مختلف، نشان نداده و این امر دلالت بر توان ذاتی این نمونه ها در ایجاد عفونت در شرایط مساعد مانند بدن فرد مبتلا به نقص سیستم ایمنی میباشد. میزان مرگ و میر ارتباطی با حضور باکتری همزیست در برخی سویهها نداشت. لذا استنباط میگردد که بیماریزایی این گونهها و عفونت موکورمایکوزیس ارتباطی با وجود این باکتری نداشته باشد (37، 28). سرعت ایجاد مرگ و میر در سویههای مورد مطالعه بالا و در همان روزهای اولیه پس از تلقیح بوده است. این امر مطابق با سرعت پیشروی عفونت در بالین و ایجاد مرگ و میر بالا در زمان کوتاه میباشد که مشخصه عفونت موکورمایکوزیس میباشد. به نظر میرسد مواردی مانند ترکیب محیط کشت، درجه حرارت، جنسیت جانور، .... بر نتایج آزمونها تاثیرگذار میباشند (29). لذا استفاده از پروتوکلهای یکسان در مطالعات ضروری بوده تا امکان مقایسه دادهها فراهم شود. به این منظور استفاده از سویههای استاندارد میکروبی و مدلهای آزمایشگاهی مناسب توصیه میشود (33). استراتژی این مطالعه استفاده از نمونههایی بوده است که دمای رشد و نمو آنها برای زندگی، نزدیک به دمای بدن انسان است. پس با بررسی زمان مرگ و میر نمونههای آلوده با این گونه قارچی و بهدست آوردن میزان درصد مرگ و میر آنها میتوان به یافتههای مقایسهای با شرایط ایجاد بیماری در بالین دست یافت. این آزمون نشان داد هر دو گونه R. arrhizus وR. microsporus و همچنین پاتوژنهای مهم فرصت طلب مانند موکور، کاندیدا، آسپیرژیلوس و فوزاریوم قادر به ایجاد عفونت در میزبان هایی با نقص سیستم ایمنی میباشند (29). پس با بهدست آوردن زمان مرگ و میر نمونهها و درصد آلودگی آنها میتوان به زمان لازم جهت بهبودی بیماران و درمان آنها و نیز روند پیشروی بیماری پی برد.
نتیجهگیری
سویههای تست شده در این آزمایش، در میزان بیماریزایی متفاوت بودند. درصد بیماریزایی بالا در نمونههای جداسازی شده از منابع محیطی نیز مشاهده شده است. لذا با توجه به گستردگی وسیع این گونه قارچی در طبیعت و نیز بیماریزایی آنها در انسان، بررسی میزان بیماریزایی این گونهها ضروری میباشد. با توجه به نتایج بدست آمده در این مطالعه قدرت ذاتی در تولید بیماری در گونههای مذکور وجود داشته و بنابراین باید به عنوان یک ریسک و خطردر عرصه بالین و صنایع مختلف با آنها برخورد نمود.
سپاسگزاری
نتایج این کار مربوط به طرح شماره 951837 دانشگاه علوم پزشکی مشهد میباشد.
حامی مالی: حامی مالی این طرح، دانشگاه علوم پزشکی مشهد.
تعارض در منافع: وجود ندارد.
موکورالها قارچهای ساپروفیت بوده که در محیطهای مختلفی مانند خاک، آب، و مواد در حال فساد دیده میشوند. این قارچها به عنوان تجزیه کننده مواد آلی عمل نموده و باعث فساد، تغییر طعم و مزه در محصولات کشاورزی، و تولید سم شده در نتیجه خسارات بالایی در بخش کشاورزی قابل انتظار میباشد (۱). این قارچها با توجه به سرعت رشد بالا، ساختار رشتهای، توانایی رشد در حرارت بالا، و نیز تولید طیف وسیعی از آنزیمها و متابولیتهای ثانویه، گزینههای مناسبی جهت تولید فرآوردههای زیستی در صنعت میباشند که با صرفهجویی مالی بسیار همراه خواهد بود (۲). تولید متابولیتهای ثانویهای مانند اسیدهای آلی (اسید مالیک، اسید لاکتیک)، کاروتن، آنزیمهای مختلف) لیپاز، آمیلاز، تیروزیناز، سلولاز، پکتیناز(، الکل، سوختهای زیستی، و مواد دارویی از گونههای مختلف این گروه گزارش شدهاند که هر کدام به نوبه خود میتوانند بخش عظیمی از تقاضای روزافزون این محصولات در بازارهای تجاری و صنعتهای وابسته را پوشش دهند (۳).گونههای موکورال از دیر باز در تولید غذاهای تخمیری بر پایه سویا و برنج در کشورهای آسیای دور بکار میرفتهاند (۴). از دیدگاه کلی، قارچ R. arrhizus به عنوان قارچ امن Generally Recognized As Safe (GRAS) شناخته میشود و قادر به استفاده از منابع کربنی مختلفی میباشد (3-4). این گروه قارچی همچنین قادر به ایجاد عفونت موکورمایکوزیس میباشند. بروز عفونت موکورمایکوزیس در افراد سالم نادر بوده ولیکن بروز این عفونت در بیماران با نقص سیستم ایمنی در دهههای اخیر رو به رشد بوده است (7-5). اگرچه بروز موکورمایکوزیس از شیوع کمتری نسبت به عفونتهای ناشی از قارچ آسپرژیلوس و کاندیدا برخوردار میباشد ولیکن درصد مرگ و میر و سرعت پیشرفت آن بسیار بالاتر میباشد (8). بسته به نوع بیماری زمینهای افراد، و موضع عفونت، میزان مرگ و میر بین 100-20 درصد گزارش شده است (9). در مطالعه مروری انجام شده در ایران، دیابت نوع 2 اصلیترین بیماریهای زمینهای و بیشترین درگیری این عفونت در نواحی سینوس بوده است (10). عفونت رینوسربرال رایج ترین نوع این عفونتها در سطح جهانی نیز میباشد (11). در سالهای اخیر میزان بروز این عفونت با توجه به استفاده از داروهای سرکوب کننده سیستم ایمنی؛ در بیمارانی با مشکلات خونی، پیوند اعضاء، دیابت کنترل نشده، کتواسیدوزیس، استفاده طولانی از کورتیکواستروئیدها، غلظت بالای آهن، و نوزادان نارس رو به رشد بوده است (14-12و 6). بیشترین موارد بیماریزایی از قارچهای گونه ریزوپوس Rhizopus و Lichtheimia و موکور Mucor گزارش شده است (7). Rhizopus arrhizus به تنهایی عامل ۷۰ درصد از موارد موکورمایکوزیس و 90 درصد از موارد عفونت رینوسربرال میباشد. گونههای Lichtheimia و موکور در مقام دوم قرار میگیرند. دیگر گونه ریزوپوس R. microsporus مقام سوم ایجاد عفونت در بیماران مستعد را دارا می باشد (6-5). Rhizopus arrhizus همچنین، گونه رایج در ایجاد موکورمایکوزیس در ایران است (10). Lichtheimia و Mucor در مجموع باعث ایجاد 19 درصد موارد این بیماری در اروپا میباشند (12). از دیگر نمونههای رایج در ایجاد موکورمایکوزیس، میتوان به گونههای Apophysomyces، Rhizomucor، Saksenaea، Cunninghamella اشاره نمود (17-15، 13). تهدید دیگر این گروه از قارچها، رابطه همزیستی آنها با باکتری گرم منفی Bulkholderia میباشد. این باکتری از خانواده Burkholderiaceae عامل تولید سم ریزوکسین است که خاصیت antimicrotubule داشته و با قرارگرفتن در سلولهای کوچک سرطان ریه، میتواند در درمان بیماران سرطان موثر باشد (1،3(. بروز و تولید این سم در سویه CBS 111563 جداسازی شده از ماده غذایی سوفو ردیابی شده است (18) که میتواند هشداری برای استفاده از این قارچ در صنعت مواد غذایی باشد. در گذشته تصور بر این بود که سویههای محیطی متفاوت از سویههای بالینی میباشند. ولیکن مطالعات مولکولی جدید در مورد گونه R. microsporus نشانگر تک نژادی بودن این گونه در سطح مولکولی میباشد و بر اساس مطالعات انجام شده، در مورد گونه R. arrhizus تنها دو واریته delemar, arrhizus پذیرفته میباشد (19-20). استفاده از پستادارانی مانند موش، روش ایده آل جهت بررسی شدت بیماریزایی عوامل عفونی میباشد. استفاده از موشها برای بررسی اثر داروهای ضدقارچی و نیز شدت بیماریزایی ریزوپوس مورد استفاده قرار گرفته است (21،22). اما استفاده از پستانداران در مقیاس بالا با محدودیتهای اخلاقی، زمان و هزینه مواجه میباشد. در نتیجه استفاده از مدلهای جایگزین مانند لارو حشرات مورد توجه قرار میگیرد. لارو حشره Galleria mellonella بهطور گسترده در مطالعات مربوط به قارچهای بیماریزا مورد استفاده بوده است (23،24). لارو حشره دارای سلولهای هموسیت میباشد که عملکردی مشابه فاگوسیتها دارند و بیشتر اعمال این سلولها را اجرا میکنند و با تولید مواد ضد باکتریایی مانند سوپراکسید قادر به حذف سلولهای باکتریایی مانند Burkholderia mallei میباشند (25،26). ایجاد عفونت در این لاروها با تولید ملانین همراه میباشد. ملانین در هموسل تولید و در بافتها آزاد میشود. در نتیجه لاروهای آلوده از رنگ کرم روشن به قهوهای تیره تغییر رنگ میدهند. سیستم ایمنی حشرات شباهت ساختاری و عملکردی بالایی را با سیستم ایمنی ذاتی در پستانداران بروز میدهد و در نتیجه این حشرات بهعنوان مدل مناسبی در مطالعات بالینی مطرح میگردند. لارو این حشره نیازی به خوراک دهی نداشته، دارای مزیتهایی مانند ارزان و سریع تر بودن و عدم نیاز به کد اخلاقی میباشد (24). اگرچه عفونت قارچی موکورمایکوزیس معمولاً در افراد با نقص سیستم ایمنی مانند بیماران مبتلا به دیابت و پیوند اعضاء رخ میدهد ولیکن با وجود استفاده رایج این گونهها در صنایع مختلف و امکان بروز موکورمایکوزیس، و با توجه به ماهیت فرصت طلب بودن برخی از گونههای این قارچ، بایستی مکانیسمهای بیماریزایی این گونهها مدنظر قرار گیرد تا راه حل مقابله و پیشگیری از این عفونت شناسایی شوند (27). لذا با توجه به بیماریزایی شدید گونههای ریزوپوس (28)، توانایی دو گونه رایج این قارچ، جهت ارزیابی شدت بیماریزایی و ارتباط آن با منبع جداسازی نمونهها در مدل لارو حشره Galleria mellonella مورد بررسی قرار میگیرد. تاثیر سم ریزوکسین موجود در باکتری همزیست بر ایجاد بیماری موکورمایکوزیس نیز با استفاده از سویههای مثبت و منفی از نظر تولید سم مورد بررسی قرار گرفته و نتایج حاصله با نتایج مشابه در موش آزمایشگاهی به عنوان مدل استاندارد در آزمایشات بالینی، مورد مقایسه قرار میگیرند. استفاده از مدلهای آزمایشگاهی اطلاعات گستردهای را در زمینه شناخت مولکولی موکورمایکوزیس و روشهای درمانی آن در اختیار ما قرار داده است (29). نتایج حاصله از این مطالعه بر میزان شناخت ما نسبت به عملکرد این گونهها در بالین خواهد افزود و امکان مدیریت بهتر این نوع عفونت را فراهم میآورد.
روش بررسی
آماده سازی نمونه های قارچی
در این مطالعه آزمایشگاهی، تعداد کل 26 نمونه قارچی مورد بررسی قرار گرفتند. این سویهها از مرکز CBS-KNAW (Utrecht, The Netherlands) تهیه شدند. از این میان، تعداد 13 نمونه از گونه Rhizopus microsporus بودند که شامل دو نمونه محیطی، 7 نمونه غذایی، و 4 نمونه بالینی میباشد. از این میان تعداد دو نمونه حاوی باکتری همزیست و قادر به تولید سم ریزوکسین میباشند و تعداد دو نمونه فاقد این باکتری همزیست و عاری از سم میباشند (جدول 1). حضور یا عدم حضور باکتری همزیست در این سویهها در مطالعات قبلی با استفاده از روش کشت در محیط مناسب جهت رشد باکتریها به اثبات رسیده بوده است (3). تعداد 13 نمونه از قارچ R. arrhizus نیز مورد مطالعه قرار گرفتند که شامل 5 نمونه محیطی، 5 نمونه غذایی و 3 نمونه بالینی میباشد. نمونههای زیر مجموعه قارچ R. arrhizus شامل دو واریته این گونه میباشد؛ واریته delemar (n=5), arrhizus (n=8). نمونههای استفاده شده در این مطالعه از مناطق جغرافیایی متنوعی بهدست آمدهاند (جدول 1). سویههای لیوفیلیزه شده بر روی محیط کشت مالت پپتون (MP, Oxoid, Basingstoke, U.K.) به مدت دو روز قرار گرفتند و سپس به محیط کشت مالت اکسترکت آگار (MEA, Oxoid) منتقل شده و بهمدت 2 روز در دمای ۳۰ درجه سانتیگراد انکوبه شدند. در مورد مدل آزمایشگاهی موش، پس از اسپورزایی کافی، اسپورها در بافر استریل PBS جمعآوری شده و غلظت 107 اسپور در یک میلیلیتر برای هر سویه قارچی و به ازای هر نمونه موش آزمایشگاهی و یا لارو حشره تهیه شد. اسپورها با استفاده از لام نیوبار شمارش شده و در دمای 4 °C نگهداری میشوند. از این میزان اسپور، مقدار 0/1 میلیلیتر با کمک سرنگ استریل به هر لارو تزریق میگردد تا غلظت نهایی 106 بهدست آید. بافر PBS به عنوان کنترل منفی و سویه R. microsporus CBS 102277 با منشاء بالینی به عنوان سویه مثبت مورد استفاده قرار گرفتند (۱7). در مورد آزمون لارو حشره mellonella G.، از بافر IPS (Insect Phosphate Saline; 8/76 g NaCl, 0/35 g KCl, 15/76 g Tris-HCl, 3/72 g EDTA, 4/72 g Na-citrate per litre, pH = 6/9) استفاده شد. این بافر بهعنوان کنترل منفی در این آزمون و سویهR. microsporus CBS 102277 به عنوان کنترل مثبت مورد استفاده قرار گرفت. به منظور بررسی قابلیت تکرار آزمون، از تعداد 20 عدد لارو حشره به ازای هر نمونه استفاده شده است و هر آزمون دو بار تکرار شده است.
مدل لارو حشره Galleria mellonella: لارو مرحله ششم برای این آزمون مورد استفاده قرار گرفته است. لاروها قبل از استفاده در دمای 18 °C و در تاریکی قرار گرفتند. وزن لاروها 0/4-0/3 گرم بوده است. اسپورهای تهیه شده در بافر IPS به قسمت پای شکمی لاروها تزریق شدند. نمونههای تلقیح شده و نمونههای کنترل بهمدت شش روز در 30 °C و تاریکی انکوبه و بررسی شدند. تغییر رنگ لاروها به قهوهای نشانه از بین رفتن آنها میباشد (23).
مدل موش آزمایشگاهی: تعداد 54 عدد موش ماده CD-1 با وزن 25-20 با سن 5-4 هفته، در 18 گروه دسته بندی شدند. تعداد سه موش برای هر گروه در نظر گرفته شد. شدت بیماریزایی 8 عدد از سویههای ذکر شده در مدل آزمایشگاهی لارو حشره در مدل موش نیز بررسی شدند (22). میزان 0/1 میلی لیتر از اسپور با غلظت نهایی 106 در یک میلی لیتر از طریق رگ دمی به بدن موش تزریق شد. گروه شاهد فقط بافر PBS را دریافت نمودند. مطالعه دو مرتبه تکرار شد بنابراین مجموع 54 موش مورد استفاده قرار گرفت. موشهای تزریق شده حداقل سه بار در روز مورد بررسی قرار میگرفتند. علایم بالینی مد نظر شامل بروز مواردی مانند کم آبی، کاهش وزن (حدود 15% وزن بدن در 48 ساعت و یا 20% در 24 ساعت)، افت درجه حرارت بدن تا 33 درجه سانتیگراد، سفتی عضلات گردن، بیقراری میباشد. موشهایی که این علایم را بروز دادند با حفظ اصول اخلاقی از آزمایش حذف شدند. آزمایش در روز 14 بعد از تلقیح خاتمه یافته و تمامی موشهای مورد آزمایش با بیهوشی ایزوفلوران از بین رفتند و اندام های داخلی جدا شدند. تست حرارت: تست حرارت برای تمامی سویههای قارچی که مورد مطالعه قرار گرفتند، انجام شد. سویهها در دمای ۱۵ درجه تا ۳۶ درجه سانتیگراد با فواصل 3 درجه به مدت 3 روز انکوبه شدند. همچنین سویهها در دمای ۵۵، ۵۲، ۵۰، ۴۵، و ۴۰ درجه سانتیگراد نیز انکوبه شدند. سویهها در پلیتهای 8 سانتیمتری مالت اکسترکت آگار و در تاریکی قرار گرفتند (19).
تجزیه و تحلیل آماری
تمام اطلاعات آماری به وسیله نرم افزار Graphpad Prism (GraphPad Software, San Diego, CA) نسخه 7 انجام شد. دادههای مربوط به بقاء نمونهها با استفاده از نمودارهایKaplen-Meyer رسم و با استفاده از تست log rank آنالیز شدند. میزان p.value کمتر از 0/05 درصد در نظر گرفته شد. میانگین زمانی زنده ماندن (Median Survival Time, MST) نمونهها، به معنای زمانی که نیمی از لاروها و یا موشها مردهاند، میباشد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی مشهد تایید شده است (کد اخلاق1396.457 IR.MUMS.fm.REC.)
نتایج
دمای رشد بهینه برای رشد سویههای R. microsporus دمای ۳۶ درجه سانتیگراد و دمای رشد بیشینه برای این سویهها در محدوده °C 50-52 بهدست آمد. اکثر نمونهها در بازه دمایی 30 تا 40 درجه سانتیگراد قادر به رشد مطلوب بودهاند. دمای رشد بهینه برای رشد سویههای R. arrhizus دمای ۳۰ درجه سانتیگراد و دمای رشد بیشینه برای این سویهها ۴۵ درجه سانتیگراد بهدست آمد. قابلیت تکرار در آزمون لارو حشره، با استفاده از 20 لارو به ازای هر نمونه و دو بار تکرار آزمون نشان داد که تفاوت در نتایج پس از 48 ساعت به استثنا سویههای CBS 324.35, CBS 137314 کمتر از 25% و در آخرین روز آزمون به استثنا سویههایCBS 631.82, CBS 137314، کمتر از15% بوده است. میزان مرگ و میر در آخرین روز آزمون کاملاً تکرارپذیر بوده است. R. microsporus به میزان70‒100% (av. 87.72% ± 25.33) مرگ و میر ایجاد نموده که این امر در بازه زمانی 4.5-1 روز رخ داده است (شکل 2 ب). در مورد R. arrhizus مرگ و میر به میزان 90‒100% (av. 98.34% ± 3.11) در بازه زمانی1‒2 روز بوده است. میزان مرگ و میرR. arrhizus var. delemar، 90‒100% (av. 96.67% ± 4.24) و در مورد var. arrhizus میزان مرگ و میر99.38% ± 1.76) 95‒100% (av. بوده است (شکل 2 آ). در نتیجه تفاوت بین دو واریته معنادار نمیباشد. در مورد قارچ R. microsporus میزان مرگ و میر 48.77% در دومین روز پس از تلقیح بوده است در حالیکه این رقم در مورد R. arrhizus 70% بوده است. تفاوت میان این دو گونه معنادار بوده و بیانگر بیماریزایی قوی تر گونه R. arrhizus در روز دوم میباشد. Rhizopus microsporus افزایش مرگ و میری به میزان 8/15% در روز آخر آزمایش از خود نشان میدهد. سویههای دارای باکتری همزیست که قادر به ایجاد سم میباشند، مرگ و میری به میزان(0−100%, av. 51.41% ± 40) در مقایسه با سویههای فاقد باکتری همزیست ایجاد نمودند(0−80%, av. 58.33% ± 40) . مرگ و میر در روز دوم معنادار نبود. در مقایسه با منبع جداسازی نمونهها بر اساس سه گروه نمونههای محیطی، غذایی، و بالینی، نتایج معناداری بهدست نیامد. توان بیماریزایی در سویهها با منبع مختلف مشهود بود. نتایج بهدست آمده در میان سویههای مربوط به یک گونه متغیر بودند. از میان نمونههای فوق، تعداد 8 عدد نمونه که از منابع متفاوتی جداسازی شدهاند برای آزمون موش مدنظر گرفته شدند. (4 R. microsporus, 2 R. arrhizus var. arrhizus and 2 R. arrhizus var. delemar). تمام موشها با غلظت106 /ml تلقیح شدند. میزان مرگ و میر درR. microsporus برابر با 66/66% با میانگین زمانی 6 روز بوده است (شکل 1 آ). این امر در مورد var. delemar R. arrhizus در بازه زمانی 6-5 روز رخ داده و برابر با 66/66% میباشد. در مورد var. arrhizus مرگ و میر به میزان 100% در بازه زمانی 2-3 روز بوده است (شکل 1 ب). سویههای تولیدکننده سم (CBS 339.62, CBS 112588) مرگ و میری برابر با سویههای فاقد توانایی تولید سم (CBS 700.68, CBS 631.82) از خود نشان دادند. سویه CBS 136239 (R. arrhizus var. arrhizus) که از خاک جداسازی شده است بیشترین میزان مرگ و میر را در میان دیگر نمونههای تلقیح شده در موشهای آزمایشگاهی بروز داد. در مقایسه با منبع جداسازی نمونهها بر اساس سه گروه نمونههای محیطی، غذایی، و بالینی، نتایج معناداری بهدست نیامد.
جدول ۱: نمونههای قارچی مورد استفاده در این مطالعه آزمایشگاهی: نام گونه، منبع و مکان جداسازی، وجود باکتری همزیست در برخی سویهها، نتایج حاصله در دو مدل آزمایشگاهی



شکل 1 آ: نمودار مرگ و میر گونه R. microsporus در بازه زمانی 14 روزه در موش آرمایشگاهی.

شکل 2 ب: نمودار مرگ و میر دو واریته از گونه R. arrhizus در بازه زمانی 14 روزه در موش آرمایشگاهی.

شکل 2 آ: نمودار مرگ و میر دو واریته از گونه R. arrhizus در بازه زمانی شش روزه در لارو حشره.

شکل 2 ب: نمودار مرگ و میر گونه R. microsporus در بازه زمانی شش روزه در لارو حشره.
بحث
در این مطالعه، با استفاده از مدل آزمایشگاهی لارو حشره، میزان بیماریزایی دو گونه رایج ریزوپوس ارزیابی گردید. استفاده از لارو حشره Galleria mellonella در بررسی بیماریزایی قارچهای پاتوژن مختلف و همچنین سویههای Madurella mycetomatis نتایج قابل قبولی را بههمراه داشته است (30،31). نتایج آزمایشگاهی بهدست آمده از این لارو جهت بررسی بیماریزایی قارچ Aspergillus وCandida با مدل پستاندار موش آزمایشگاهی قابل مقایسه (23،32) و همچنین کاربرد این مدل در مورد بیماریزایی گونههای موکورال، موفقیتآمیز بوده است (33). پستانداران مختلفی مانند خرگوش، خوکچه هندی، و موش به دلیل شباهتهای ساختاری و فیزیولوژِیکی با بدن انسان، مدل مناسبی را جهت بررسیهای آزمایشگاهی فراهم میآورند. این جانوران در مطالعات مربوط به موکورالها نیز مورد استفاده بوده اند (34،35). در این مطالعه ازمدل موش جهت مقایسه نتایج در آزمایش لارو حشره و نیز بهرهمندی از یک مدل پستاندار استفاده شده است. در دیگر مطالعات، میزان مرگ و میر گونه ریزوپوس در مقایسه با دیگر گونههای موکورال در دمای 30 و 37 درجه سانتیگراد شدیدتر گزارش شده است (33). میزان مرگ و میر R. arrhizus در لارو حشره بالاتر از گونهR. microsporus بود (تصویر 2 آ). این تفاوت میتواند در ارتباط با دمای بهینه رشد بالاتر برای R. microsporus در مقایسه با دمای بهینه کمتر برای گونه R. arrhizus و لارو حشره باشد. دمای رشد بهینه برای R. arrhizus، 30 درجه سانتیگراد و در مورد R. microsporus، 45 درجه میباشد. توان رشد در دماهای بالاتر، نیاز اولیه میکروارگانیسم ها برای آلوده کردن میزبان خونگرم میباشد. قارچهای موکورال به خوبی از این توانایی برخوردار میباشند. در مطالعه کائگر و همکاران Kaerger et al. 2015 در سال ۲۰۱۵ (36) گونههای گرمادوست توانایی بیشتری به بیماریزایی داشتند در حالیکه دیگر عوامل مانند اندازه اسپور، مقاومت در برابر استرسها، و .... تاثیری در این امر نداشتند. هر دو مدل آزمایشگاهی لارو حشره و موش، مدل عفونت سیستمی را ارائه میدهند و در نتیجه نتایج حاصله قابل مقایسه میباشد. لذا با وجود تعداد کم نمونههای بررسی شده در مدل موش آزمایشگاهی، نتایج بهدست آمده در دو مدل مشابه میباشند (29). این امر بر قابلیت مدل لارو حشره به عنوان مدل آزمایشگاهی مطلوب در مطالعات بالینی تاکید مینماید. توان بیماریزایی بالاتر گونه R. arrhizusدر هر دو مدل لارو حشره و موش مشابه شرایط موجود در بالین میباشد. تفاوت اندکی در میان دو واریته این گونه وجود دارد ولیکن تعداد سویهها ممکن است برای نتیجهگیری کلی اندک باشد. در مجموع نتایج متفاوت بین دو گونه با تفاوت در سطح سویهها مرتبط نبوده است، حتی در مطالعاتی که از تعداد بیست سویه ریزوپوس استفاده نمودهاند (35، 33). نتایج حاصل از این آزمون تفاوت معناداری را در میان نمونههای جداسازی شده از منابع مختلف، نشان نداده و این امر دلالت بر توان ذاتی این نمونه ها در ایجاد عفونت در شرایط مساعد مانند بدن فرد مبتلا به نقص سیستم ایمنی میباشد. میزان مرگ و میر ارتباطی با حضور باکتری همزیست در برخی سویهها نداشت. لذا استنباط میگردد که بیماریزایی این گونهها و عفونت موکورمایکوزیس ارتباطی با وجود این باکتری نداشته باشد (37، 28). سرعت ایجاد مرگ و میر در سویههای مورد مطالعه بالا و در همان روزهای اولیه پس از تلقیح بوده است. این امر مطابق با سرعت پیشروی عفونت در بالین و ایجاد مرگ و میر بالا در زمان کوتاه میباشد که مشخصه عفونت موکورمایکوزیس میباشد. به نظر میرسد مواردی مانند ترکیب محیط کشت، درجه حرارت، جنسیت جانور، .... بر نتایج آزمونها تاثیرگذار میباشند (29). لذا استفاده از پروتوکلهای یکسان در مطالعات ضروری بوده تا امکان مقایسه دادهها فراهم شود. به این منظور استفاده از سویههای استاندارد میکروبی و مدلهای آزمایشگاهی مناسب توصیه میشود (33). استراتژی این مطالعه استفاده از نمونههایی بوده است که دمای رشد و نمو آنها برای زندگی، نزدیک به دمای بدن انسان است. پس با بررسی زمان مرگ و میر نمونههای آلوده با این گونه قارچی و بهدست آوردن میزان درصد مرگ و میر آنها میتوان به یافتههای مقایسهای با شرایط ایجاد بیماری در بالین دست یافت. این آزمون نشان داد هر دو گونه R. arrhizus وR. microsporus و همچنین پاتوژنهای مهم فرصت طلب مانند موکور، کاندیدا، آسپیرژیلوس و فوزاریوم قادر به ایجاد عفونت در میزبان هایی با نقص سیستم ایمنی میباشند (29). پس با بهدست آوردن زمان مرگ و میر نمونهها و درصد آلودگی آنها میتوان به زمان لازم جهت بهبودی بیماران و درمان آنها و نیز روند پیشروی بیماری پی برد.
نتیجهگیری
سویههای تست شده در این آزمایش، در میزان بیماریزایی متفاوت بودند. درصد بیماریزایی بالا در نمونههای جداسازی شده از منابع محیطی نیز مشاهده شده است. لذا با توجه به گستردگی وسیع این گونه قارچی در طبیعت و نیز بیماریزایی آنها در انسان، بررسی میزان بیماریزایی این گونهها ضروری میباشد. با توجه به نتایج بدست آمده در این مطالعه قدرت ذاتی در تولید بیماری در گونههای مذکور وجود داشته و بنابراین باید به عنوان یک ریسک و خطردر عرصه بالین و صنایع مختلف با آنها برخورد نمود.
سپاسگزاری
نتایج این کار مربوط به طرح شماره 951837 دانشگاه علوم پزشکی مشهد میباشد.
حامی مالی: حامی مالی این طرح، دانشگاه علوم پزشکی مشهد.
تعارض در منافع: وجود ندارد.
References:
1- Dolatabadi S. Mucorales between Food and Infection [Thesis]. Netherlands: Amsterdam University 2015.
2- Hesseltine CW. Microbiology of Oriental Fermented Foods. Annu Rev Microbiol 1983; 37: 575-601.
3- Jennessen J, Nielsen KF, Houbraken J, Lyhne EK, Schnurer J, Frisvad JC, Samson RA. Secondary Metabolite and Mycotoxin Production by the Rhizopus Microsporus Group. J Agr Food Chem 2005; 53(5): 1833-40.
4- Hong SB, Kim DH, Lee M, Baek SY, Kwon SW, Houbraken J, Samson RA. Zygomycota Associated with Traditional Meju, A Fermented Soybean Starting Material For Soy Sauce and Soybean Paste. J Microbiol 2012; 50(3): 386-93.
5- Ibrahim AS, Spellberg B, Walsh TJ, Kontoyiannis DP. Pathogenesis of Mucormycosis. Clin Infect Dis 2012; 54: S16-S22.
6- Rammaert B, Lanternier F, Zahar JR, Dannaoui E, Bougnoux ME, Lecuit M, et al. Healthcare-Associated Mucormycosis. Clin Infect Dis 2012; 54: S44–S54.
7- Lanternier F, Sun HY, Ribaud P, Singh N, Kontoyiannis DP, Lortholary O. Mucormycosis in Organ and Stem Cell Transplant Recipients. Clin Infect Dis 2012; 54(11): S35-S43.
8- Quan C, Spellberg B. Mucormycosis, Pseudallescheriasis, and Other Uncommon Mold Infections. Proc Am Thorac Soc 2010; 7: 210-5.
9- Ribes JA, Vanover-Sams CL, Baker DJ. Zygomycetes in Human Disease. Clin Microbiol Rev 2000; 13(2): 236-301.
10- Dolatabadi S, Ahmadi B, Rezaei-Matehkolaei A, Zarrinfar H, Skiada A, Mirhendi H, et al. Mucormycosis in Iran: A Six-Year Retrospective Experience. J Mycol Med 2018; 28(2): 269-73.
11- Ribeiro LC, Wanke Da Silva M, Dias LB, Mello R, Canavarros FAPB, Leite DP, et al. Mucormycosis in Mato Grosso, Brazil: Case 1089 Reports, Caused By Rhizopus Microsporus Var. Oligosporus and Rhizopus Microsporus Var. Rhizopodiformis. Mycopathologia 2012; 173(2-3): 187-92.
12- Skiada A, Pagano L, Groll A. Analysis of 230 Cases Accrued by the Registry of the European Confederation of Medical Mycology (ECMM) Working Group on Zygomycosis Between 2005 and 2007. Clin Microbiol Infect 2011; 17(12): 1859-67.
13- Binder U, Maurer E, Lass-Flörl C. Mucormycosis from the Pathogens to the Disease. Clin Microbiol Infect 2014; 20: 6: 60-6.
14- Kontoyiannis DP, Marr KA, Park BJ, Alexander BD, Anaissie EJ, Walsh TJ, et al. Prospective Surveillance for Invasive Fungal Infections in Hematopoietic Stem Cell Transplant Recipients, 2001-2006: Overview of the Transplant-Associated Infection Surveillance Network (TRANSNET) Database. Clin Infect Dis 2010; 50(8): 1091-100.
15- Petrikkos G, Skiada A, Lortholary O, Roilides E, Walsh TJ, Kontoyiannis DP. Epidemiology and Clinical Manifestations of Mucormycosis. Clin Infect Dis 2012; 54: S23-S34.
16- Gomes MZ, Lewis RE, Kontoyiannis DP. Mucormycosis Caused by Unusual Mucormycetes, Non-Rhizopus, Mucor, and -Lichtheimia Species. Clin Microbiol Rev 2011; 24(2): 411-45.
17- Chakrabarti A, Singh R. Mucormycosis in India: Unique Features. Mycoses 2014; 57: 85-90.
18- Rohm B, Scherlach K, Möbius N, Partida-Martinez LP, Hertweck C. Toxin Production by Bacterial Endosymbionts of a Rhizopus Microsporus Strain Used for Tempe/Sufu Processing. Int J Food Microbiol 2010; 136(3): 368-71.
19- Dolatabadi S, Walther G, Gerrits Van Den Ende AHG, De Hoog GS. Diversity and Delimitation of Rhizopus Microsporus. Fungal Div 2014; 64: 145-63.
20- Dolatabadi S, De Hoog GS, Meis JF, Walther G. Species Boundaries and Nomenclature of Rhizopus Arrhizus (Syn. R. Oryzae). Mycoses 2014; 57: 108-27.
21- Odds FC, Van Gerven F, Espinel-Ingroff A, Bartlett MS, Ghannoum MA, Lancaster MV, et al. Evaluation of Possible Correlations between Antifungal Susceptibilities of Filamentous Fungi in Vitro and Antifungal Treatment Outcomes in Animal Infection Models. Antimicrob Agents Chemother 1998; 42(2): 282-88.
22- Seyedmousavi S, Melchers WJG, Verweij PE, Mouton JW. Assessment of Efficacy of Antifungals in Experimental Models of Invasive Aspergillosis in an Era of Emerging Resistance: The Value of Real-Time Quantitative PCR. Curr Opin Pharmacol 2011; 11(5): 486-93.
23- Jacobsen ID. Galleria Mellonella as a Model Host to Study Virulence of Candida. Virulence 2014; 5(2): 237-9.
24- Nappi AJ, Christensen BM. Melanogenesis and Associated Cytotoxic Reactions: Applications to Insect Innate Immunity. Insect Biochem Mol Biol 2005; 35(5): 443-59.
25- Bergin D. Galleria Mellonella Hemocytes: Identification of Proteins Homologous to the NADPH Oxidase Complex of Human Neutrophils. Infect Immun 2005; 73(7): 4161-70.
26- Mylonakis E, Casadevall A, Ausubel FM. Exploiting Amoeboid and Non-Vertebrate Animal Model Systems to Study the Virulence of Human Pathogenic Fungi. Plos Pathog 2007; 3(7): E101.
27- Alvarez E, Sutton DA, Cano J, Fothergill AW, Stchigel A, Rinaldi MG, et al. Spectrum of Zygomycete Species Identified from Clinically Significant Specimens in the United States. J Clin Microbiol 2009; 47: 1650-56.
28- Walther G, Pawłowska J, Alastruey-Izquierdo A, Wrzosek M, Rodriguez-Tudela JL, Dolatabadi S, et al. DNA Barcoding in Mucorales: An Inventory of Biodiversity. Persoonia 2013; 30: 11-47.
29- Jacobsen ID. Animal Models to Study Mucormycosis. J Fungi 2019; 5(2): 27.
30- Kloezen W, Van Helvert-Van Poppel M, Fahal AH, Van De Sande WW. A Madurella Mycetomatis Grain Model in Galleria Mellonella Larvae. Plos Neglected Tropical Disease 2015; 9: E0003926.
31- Fallon J, Kelly J, Kavanagh K. Galleria Mellonella as a Model for Fungal Pathogenicity Testing. Methods Mol Biol 2012; 845: 469-85.
32- Slater JL, Gregson L, Denning DW, Warn PA. Pathogenicity of Aspergillus Fumigatus Mutants Assessed in Galleria Mellonella Matches that in Mice. Med Mycol 2010; 49: S107-13.
33- Maurer E, Hortnagl C, Lackner M, Grassle D, Naschberger V, Moser P; et al. Galleria Mellonella as a Model System to Study Virulence Potential of Mucormycetes and Evaluation of Antifungal Treatment. Med Mycol 2018; 57(3): 351-62
34- Schwartze VU, Jacobsen ID. Mucormycoses Caused by Lichtheimia Species. Mycoses 2014; 57: 73-8.
35- Kamei K. Animal Models of Zygomycosis-Absidia, Rhizopus, Rhizomucor, and Cunninghamella. Mycopathologia 2001; 152: 5-13
36- Kaerger K, Schwartze VU, Dolatabadi S, Nyilasi I, Kovács SA, Binder U, et al. Adaptation to Thermotolerance in Rhizopus Coincides with Virulence as Revealed by Avian and Invertebrate Infection Models, Phylogeny, Physiological and Metabolic Flexibility. Virulence 2015; 6(4): 395-403.
37- Ibrahim AS, Gebremariam T, Liu M, Chamilos G, Kontoyiannis DP, Mink R, et al. Bacterial Endosymbiosis is Widely Present among Zygomycetes but Does Not Contribute to the Pathogenesis of Mucormycosis. J Infect Dis 2008; 198(7): 1083-90.
1- Dolatabadi S. Mucorales between Food and Infection [Thesis]. Netherlands: Amsterdam University 2015.
2- Hesseltine CW. Microbiology of Oriental Fermented Foods. Annu Rev Microbiol 1983; 37: 575-601.
3- Jennessen J, Nielsen KF, Houbraken J, Lyhne EK, Schnurer J, Frisvad JC, Samson RA. Secondary Metabolite and Mycotoxin Production by the Rhizopus Microsporus Group. J Agr Food Chem 2005; 53(5): 1833-40.
4- Hong SB, Kim DH, Lee M, Baek SY, Kwon SW, Houbraken J, Samson RA. Zygomycota Associated with Traditional Meju, A Fermented Soybean Starting Material For Soy Sauce and Soybean Paste. J Microbiol 2012; 50(3): 386-93.
5- Ibrahim AS, Spellberg B, Walsh TJ, Kontoyiannis DP. Pathogenesis of Mucormycosis. Clin Infect Dis 2012; 54: S16-S22.
6- Rammaert B, Lanternier F, Zahar JR, Dannaoui E, Bougnoux ME, Lecuit M, et al. Healthcare-Associated Mucormycosis. Clin Infect Dis 2012; 54: S44–S54.
7- Lanternier F, Sun HY, Ribaud P, Singh N, Kontoyiannis DP, Lortholary O. Mucormycosis in Organ and Stem Cell Transplant Recipients. Clin Infect Dis 2012; 54(11): S35-S43.
8- Quan C, Spellberg B. Mucormycosis, Pseudallescheriasis, and Other Uncommon Mold Infections. Proc Am Thorac Soc 2010; 7: 210-5.
9- Ribes JA, Vanover-Sams CL, Baker DJ. Zygomycetes in Human Disease. Clin Microbiol Rev 2000; 13(2): 236-301.
10- Dolatabadi S, Ahmadi B, Rezaei-Matehkolaei A, Zarrinfar H, Skiada A, Mirhendi H, et al. Mucormycosis in Iran: A Six-Year Retrospective Experience. J Mycol Med 2018; 28(2): 269-73.
11- Ribeiro LC, Wanke Da Silva M, Dias LB, Mello R, Canavarros FAPB, Leite DP, et al. Mucormycosis in Mato Grosso, Brazil: Case 1089 Reports, Caused By Rhizopus Microsporus Var. Oligosporus and Rhizopus Microsporus Var. Rhizopodiformis. Mycopathologia 2012; 173(2-3): 187-92.
12- Skiada A, Pagano L, Groll A. Analysis of 230 Cases Accrued by the Registry of the European Confederation of Medical Mycology (ECMM) Working Group on Zygomycosis Between 2005 and 2007. Clin Microbiol Infect 2011; 17(12): 1859-67.
13- Binder U, Maurer E, Lass-Flörl C. Mucormycosis from the Pathogens to the Disease. Clin Microbiol Infect 2014; 20: 6: 60-6.
14- Kontoyiannis DP, Marr KA, Park BJ, Alexander BD, Anaissie EJ, Walsh TJ, et al. Prospective Surveillance for Invasive Fungal Infections in Hematopoietic Stem Cell Transplant Recipients, 2001-2006: Overview of the Transplant-Associated Infection Surveillance Network (TRANSNET) Database. Clin Infect Dis 2010; 50(8): 1091-100.
15- Petrikkos G, Skiada A, Lortholary O, Roilides E, Walsh TJ, Kontoyiannis DP. Epidemiology and Clinical Manifestations of Mucormycosis. Clin Infect Dis 2012; 54: S23-S34.
16- Gomes MZ, Lewis RE, Kontoyiannis DP. Mucormycosis Caused by Unusual Mucormycetes, Non-Rhizopus, Mucor, and -Lichtheimia Species. Clin Microbiol Rev 2011; 24(2): 411-45.
17- Chakrabarti A, Singh R. Mucormycosis in India: Unique Features. Mycoses 2014; 57: 85-90.
18- Rohm B, Scherlach K, Möbius N, Partida-Martinez LP, Hertweck C. Toxin Production by Bacterial Endosymbionts of a Rhizopus Microsporus Strain Used for Tempe/Sufu Processing. Int J Food Microbiol 2010; 136(3): 368-71.
19- Dolatabadi S, Walther G, Gerrits Van Den Ende AHG, De Hoog GS. Diversity and Delimitation of Rhizopus Microsporus. Fungal Div 2014; 64: 145-63.
20- Dolatabadi S, De Hoog GS, Meis JF, Walther G. Species Boundaries and Nomenclature of Rhizopus Arrhizus (Syn. R. Oryzae). Mycoses 2014; 57: 108-27.
21- Odds FC, Van Gerven F, Espinel-Ingroff A, Bartlett MS, Ghannoum MA, Lancaster MV, et al. Evaluation of Possible Correlations between Antifungal Susceptibilities of Filamentous Fungi in Vitro and Antifungal Treatment Outcomes in Animal Infection Models. Antimicrob Agents Chemother 1998; 42(2): 282-88.
22- Seyedmousavi S, Melchers WJG, Verweij PE, Mouton JW. Assessment of Efficacy of Antifungals in Experimental Models of Invasive Aspergillosis in an Era of Emerging Resistance: The Value of Real-Time Quantitative PCR. Curr Opin Pharmacol 2011; 11(5): 486-93.
23- Jacobsen ID. Galleria Mellonella as a Model Host to Study Virulence of Candida. Virulence 2014; 5(2): 237-9.
24- Nappi AJ, Christensen BM. Melanogenesis and Associated Cytotoxic Reactions: Applications to Insect Innate Immunity. Insect Biochem Mol Biol 2005; 35(5): 443-59.
25- Bergin D. Galleria Mellonella Hemocytes: Identification of Proteins Homologous to the NADPH Oxidase Complex of Human Neutrophils. Infect Immun 2005; 73(7): 4161-70.
26- Mylonakis E, Casadevall A, Ausubel FM. Exploiting Amoeboid and Non-Vertebrate Animal Model Systems to Study the Virulence of Human Pathogenic Fungi. Plos Pathog 2007; 3(7): E101.
27- Alvarez E, Sutton DA, Cano J, Fothergill AW, Stchigel A, Rinaldi MG, et al. Spectrum of Zygomycete Species Identified from Clinically Significant Specimens in the United States. J Clin Microbiol 2009; 47: 1650-56.
28- Walther G, Pawłowska J, Alastruey-Izquierdo A, Wrzosek M, Rodriguez-Tudela JL, Dolatabadi S, et al. DNA Barcoding in Mucorales: An Inventory of Biodiversity. Persoonia 2013; 30: 11-47.
29- Jacobsen ID. Animal Models to Study Mucormycosis. J Fungi 2019; 5(2): 27.
30- Kloezen W, Van Helvert-Van Poppel M, Fahal AH, Van De Sande WW. A Madurella Mycetomatis Grain Model in Galleria Mellonella Larvae. Plos Neglected Tropical Disease 2015; 9: E0003926.
31- Fallon J, Kelly J, Kavanagh K. Galleria Mellonella as a Model for Fungal Pathogenicity Testing. Methods Mol Biol 2012; 845: 469-85.
32- Slater JL, Gregson L, Denning DW, Warn PA. Pathogenicity of Aspergillus Fumigatus Mutants Assessed in Galleria Mellonella Matches that in Mice. Med Mycol 2010; 49: S107-13.
33- Maurer E, Hortnagl C, Lackner M, Grassle D, Naschberger V, Moser P; et al. Galleria Mellonella as a Model System to Study Virulence Potential of Mucormycetes and Evaluation of Antifungal Treatment. Med Mycol 2018; 57(3): 351-62
34- Schwartze VU, Jacobsen ID. Mucormycoses Caused by Lichtheimia Species. Mycoses 2014; 57: 73-8.
35- Kamei K. Animal Models of Zygomycosis-Absidia, Rhizopus, Rhizomucor, and Cunninghamella. Mycopathologia 2001; 152: 5-13
36- Kaerger K, Schwartze VU, Dolatabadi S, Nyilasi I, Kovács SA, Binder U, et al. Adaptation to Thermotolerance in Rhizopus Coincides with Virulence as Revealed by Avian and Invertebrate Infection Models, Phylogeny, Physiological and Metabolic Flexibility. Virulence 2015; 6(4): 395-403.
37- Ibrahim AS, Gebremariam T, Liu M, Chamilos G, Kontoyiannis DP, Mink R, et al. Bacterial Endosymbiosis is Widely Present among Zygomycetes but Does Not Contribute to the Pathogenesis of Mucormycosis. J Infect Dis 2008; 198(7): 1083-90.
نوع مطالعه: پژوهشي |
موضوع مقاله:
قارچ شناسی
دریافت: 1399/11/22 | پذیرش: 1400/2/12 | انتشار: 1400/6/10
دریافت: 1399/11/22 | پذیرش: 1400/2/12 | انتشار: 1400/6/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







