دوره 29، شماره 3 - ( خرداد 1400 )
جلد 29 شماره 3 صفحات 3555-3539 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Faraj R, Khandan khademreza Z, Sharifian S, Zare H. Evaluation of White Matter Tracts in Autistic Individuals: A Review of Diffusion Tensor Imaging Studies. JSSU 2021; 29 (3) :3539-3555
URL: http://jssu.ssu.ac.ir/article-1-5295-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5295-fa.html
فرجی ریحانه، خندان خادمالرضا زهرا، شریفیان سهیلا، زارع هدی. بررسی ترکتهای ماده سفید مغز در افراد اوتیستیک: مروری بر مطالعات تصویربرداری تانسور انتشار. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (3) :3539-3555
متن کامل [PDF 1190 kb]
(723 دریافت)
| چکیده (HTML) (1412 مشاهده)
متن کامل: (3854 مشاهده)
مقدمه
اختلال طیف اوتیسم Autism spectrum disorder (ASD)، مجموعهای از اختلالات تکاملی سیستم عصبی است (1). این اختلال با علائم بسیاری از جمله نقص در عملکرد اجتماعی و ارتباطات کلامی و غیرکلامی و محدودیت در دایره علایق و فعالیتها همراه است. دیگر علائمی که میتوان در این افراد مشاهده نمود نقایص حرکتی است که زندگی روزمرهشان را دچار مشکل میکند (3, 2). به علت ناهمگنی وسیع و گستردگی علائم در بیماران مبتلا به اوتیسم، این بیماری یکی از پر چالشترین اختلالات در کودکان به شمار میرود و به همین دلیل آن را اختلال طیفی مینامند (5, 4). اختلال طیف اوتیسم به دلیل سن کم و افزایش تعداد افراد مبتلا میتواند یکی از مهمترین اختلالات عصبی رشدی دوران ما باشد (7, 6). میزان شیوع این اختلال در سه دهه گذشته به میزان قابلتوجهی در جهان افزایش یافته است، به گونهای که دو درصد یا بیشتر از کودکان در ایالات متحده دارای این اختلال هستند (8-10). تاکنون هیچ مطالعه جامعی در زمینه شیوع این اختلال در کشور ما صورت نگرفته است. مطالعات آماری در ایران، از یک ابتلا به اوتیسم در هر۱۵۰ کودک گزارش کردهاند. برخلاف تحقیقات زیادی که تا کنون انجام شده، علت اوتیسم هنوز ناشناخته است (12, 11). ارزیابیهای بالینی اختلال طیف اوتیسم ﺷﺎﻣﻞ ﻧﻤﺮاتAutism Diagnostic Observation Schedule (ADOS)، نمراتAutism Diagnostic Interview-Revised (ADI-R)، آزﻣﻮنﻫﺎی Intelligence Quotient (IQ)، مقیاس پاسخ اجتماعی Social Responsiveness Scale (SRS) و مقیاس سازگاری رفتاری Vineland Adaptive Behavior Scale (VABS) هستند. انجام این ارزیابیها بسیار وقتگیر است و وابسته به مهارت متخصص میباشد. هم چنین به دلیل این که علایم بالینی اختلال طیف اوتیسم میتوانند با علایم سایر بیماریهای روانشناختی، همپوشانی داشته باشند، لذا این آزمونها میتوانند منجر به تشخیص اشتباه و در نهایت تجویز پروتکل درمانی نادرست شوند. علاوه براین، تشخیصهای بالینی قادر به آشکار ساختن علل نوروبیولوژیکی اختلال طیف اوتیسم و نواحی آسیب دیده مغزی در اثر این اختلال نیستند. با توجه به موارد ذکر شده، روش تصویربرداری DTI مغزی میتوانند ابزار مفیدی برای تشخیص اختلال طیف اوتیسم به صورت کمی و پیشبینی شاخصهای بالینی آن باشند. (14, 13). با این حال در بسیاری مطالعات نشان داده شده است که اختلالات رفتاری، حرکتی و اجتماعی ناشی از اتصالات عملکردیFunctional Connectivity (FC) غیرنرمال بین شبکههای مغزی است. اتصالات عملکردی غیرنرمال در افراد اوتیسم میتواند بهصورت اختلال در یکپارچگی ترکتهای ماده سفید بیان شود که نواحی دوردست را به هم متصل میکند. ماده سفید مجموعهای از دستههای میلین شده آکسونها است که سیگنالهای الکتریکی را بین نواحی مختلف مغز منتقل میکند (15). برای انجام وظایف پیچیده احساسی، اجتماعی و ارتباطات، انتقال یا هدایت کارآمد اطلاعات بین ترکتهای ماده سفید ضروری است (16).
تصویربرداری تانسور انتشار: تصویربرداری تانسور انتشار Diffusion Tensor Imaging (DTI) یکی از کاربردیترین روشهای تصویربرداری پزشکی است که غیرتهاجمی بوده و برای اندازهگیری حرکات براوونی مولکولهای آب میباشد. در محیطهای همسانگرد مولکولهای آب در تمام جهات بهطور مساوی منتشر میشوند، در حالیکه انتشار در محیطهای ناهمسانگرد بهوسیله عواملی مانند ماکرومولکولها و غشای سلولها محدود میگردد (17). ماده سفید مغز محیطی ناهمسانگرد شامل آکسونهای نورونهای عصبی بوده که میلین آکسونها، حرکت مولکولهای آب را محدود میکند. مسیر عصبی در واقع به دستهای از آکسونها گفته میشود و بهوسیله روش DTI میتوان به خواص انتشار مسیرهای عصبی دست یافت (19, 18). تصویربرداری DTI امکان شناسایی تغییرات میکروساختاری و خصوصیات انتشار در بافت را فراهم میکند. به عبارت دیگر آسیب به ماده سفید باعث تغییر ویژگیهای انتشار آب در مغز میشود و بنابراین روش DTI به عنوان یک نشانگر برای کاربردهای بالینی مورد استفاده قرار میگیرد (21, 20). در این روش تصاویر تانسور انتشار با استفاده از دستگاه امآرآی گرفته میشود. این تصاویر نسبت به جایگیری مولکولهای پروتون آب در طول محور گرادیان تحریک کننده انتشار حساس هستند. اندازهگیری تانسور انتشار با بررسی مسیرهای عصبی مغز میتواند به بررسی بیماریهایی مثل اوتیسم کمک کند (22). به همین دلیل تصویربرداری تانسور انتشار یکی از مفیدترین روشها برای ارزیابی غیر تهاجمی میکروساختاری فیبرهای عصبی است که خواص دیفیوژن مولکولهای آب مانند بزرگی، ناهمسانگردی (تغییر خواص دیفیوژن با جهت) در بافتها را اندازهگیری میکند (23). چندین اندازهگیری کمی، مانند پارامترهای کسر ناهمسانگردی Fractional Anisotropy (FA)، انتشار محوری Axial Diffusivity (AD)، انتشار شعاعی Radial Diffusivity (RD) و میانگین انتشار Mean Diffusivity (MD) از دادههای DTI انجام میشود. اگرچه روابط بین این شاخصها و خصوصیات میکروساختارهای بافت پیچیده است، مطالعات انسانی و حیوانی نشان میدهد که AD مربوط به یکپارچگی آکسون است و RD نسبت به تغییرات میلین حساس میباشد (25, 24). اما پارامتری که غالباً برای ناهمسانگردی دیفیوژن استفاده میشود، FA است. که به نظر میرسد به تغییرات رشدی و اختلالات پاتولوژیکی در دانسیته، اندازه و میلینیزاسیون آکسونها و انسجام فیبرها در یک وکسل حساس است. بنابراین میتواند یک شاخص مفید برای ارزیابی یکپارچگی ساختاری ماده سفید باشد (26). در حال حاضر، چهار روش عمده پردازش برای ارزیابی اتصالات آناتومیکی از دادههای تصویربرداری تانسور انتشار وجود دارد. که شامل منطقه مورد نظر Region of interest (ROI) تجزیه و تحلیل مبتنی بر وکسل Voxel-based Analysis (VBA)، تجزیه و تحلیل کمی مبتنی بر ترکتوگرافی Tractography و آمار مکانی مبتنی بر ترکت Tract-Based Spatial Statistics (TBSS) میشود. که در ادامه به بررسی این روشها میپردازیم.
• تجزیه و تحلیل ناحیه مورد نظر
• ناحیه مورد نظر شامل قسمتهای آناتومیکی است که در یک منطقه خاص برای مطالعه انتخاب میشوند. استفاده از ROI بهطور گستردهای مورد استفاده قرار میگیرد و ابزار تحلیلیROI نسبتاً ساده است و بهطور کلی شامل ردیابی دستی یا قرار دادن خودکار ماسک ROI برای تعریف برخی از ساختارهای آناتومیکی خاص مغز است. هنگامی که ROI برای یک منطقه خاص مغز مشخص شد، اندازهگیریهای کمی میتواند برای استخراج پارامترهای FA و ... از منطقه آناتومیک مورد نظر انجام گیرد (27, 19)
• تجزیه و تحلیل مبتنی بر وکسل
• تجزیه و تحلیل مبتنی بر وکسل از دادههای تصویربرداری تانسور انتشار یک روش اکتشافی برای ارزیابی تفاوتها و تغییرات خواص انتشار در هر وکسل از یک مجموعه داده مغزی است. VBAیک ابزار تحقیقاتی بالینی قدرتمند است که بهطور گسترده مورد استفاده قرار میگیرد (28, 27).
• ترکتوگرافی: ترکتوگرافی یک روش جدید جهت شناسایی اتصالات آناتومیکی در مغز است. با محاسبه، جهتگیری انتشار کل مسیرهای فیبر عصبی را بازسازی میکند و حجم ترکتها و یکپارچگی میکرو ساختارهای ماده سفید را به صورت کمی نمایش میدهد (29). این روش تصاویر سه بعدی از ساختار فیزیکی ماده سفید مغز ارائه میدهد. دادههای DTI را میتوان با استفاده از تراکتوگرافی در مغز مورد تجزیه و تحلیل قرار داد (31, 30).
• آمار مکانی مبتنی بر ترکت
• در هر مرحله، راهنماییهایی در مورد بهینهسازی تنظیمات پارامتر به همراه جواب مثبت و منفی روشهای مختلف ارائه میشود تا به خواننده در انتخاب بهترین روش برای کاربرد آنها کمک کند. در این روش برای آنالیز وکسل از اندازهگیریهای ماده سفید کامل مغز استفاده میشود. بهطور خلاصه، میانگین همه تصاویر FA برای تولید یک اسکلت FA متوسط بهکار گرفته میشود (32, 30).
روش بررسی
در این مطالعه، مقالاتی که با استفاده از روش تصویربرداری تانسور انتشار در بازه زمانی 2009 تا 2019، ترکتهای ماده سفید مغز در افراد اوتیستیک بررسی کرده بودند، مورد نظر قرار داده شد. برای جستجوی این مقالات از کلمات کلیدی Autism, DTI و WM Tracts استفاده کرده و در پایگاههای گوگل اسکولار، پاپ مد و ساینس دایرکت جستجو انجام شد.
نتایج
شواهد حاصل از مطالعات انجام شده حاکی از آن است که مغز اوتیستیک با اختلال در یکپارچگی ترکتهای ماده سفید همراه است. هنوز بهطور قطعی مشخص نیست که کدامیک از ترکتهای ماده سفید مغز در این افراد دچار اختلال میشود (33). با این وجود در برخی مطالعات با استفاده از روش DTI و بررسی پارامترهایی چون FA، ناهنجاریهایی را در میکروساختارهای ترکتهای ماده سفید در نواحی مختلف مغز افراد ASD نسبت به گروه کنترل سالم گزارش کردهاند (34, 7). این ترکتها شامل کارپوس کالازوم Corpus Callosum ، فاسیکولوس فرونتال-اکسی پیتال تحتانی Inferior Fronto-Occipital Fasciculus (IFOF)، فاسیکولوس طولی تحتانی inferior longitudinal fasciculus (ILF)، فاسیکولوس طولی فوقانی superior longitudinal fasciculus (SLF)، فاسیکولوس چنگکی Uncinate Fasciculus، سینگولومCingulum، آمیگدالا Amygdala و پایه مغزی Cerebral Peduncle است. از آنجا که ناحیه آسیب دیده در فرد اوتیستیک باعث بروز علایم متفاوت از فردی به فرد دیگر می¬شود مطالعه این ترکتهای عصبی از اهمیت ویژهای برخوردار است. بنابراین در ادامه به بررسی مطالعات مختلف بر اساس ناحیه آناتومیک مورد آزمون میپردازیم.
کارپوس کالازوم
کارپوس کالازوم یا جسم پپینهای بزرگترین مسیر اتصال و ساختار ماده سفید در مغز انسان است و یکی از مهمترین ترکتهای ماده سفید در افراد اوتیسم است (شکل 1). این ترکت دو نیمکره مغزی را بهصورت هموتوپیکال و هتروتوپیکال متصل میکند و اطلاعات بین دو نیمکره از طریق آن منتقل میشود. کارپوس کالازوم از سمت قدام به خلف به مناطق Rostrum، Genu، Body و Splenium تقسیم میشود. دو قسمت اول لوبهای فرونتال چپ و راست مغز را به هم وصل میکنند و دو قسمت بعدی لوبهای تمپورال و اکسیپیتال دو نیمکره را به هم متصل میکنند. کارپوس کالازوم در پردازش بینایی و درک چهره و اشیا نقش مهمی دارد که میتواند مربوط به عملکرد شناختی غیر کلامی باشد (36, 35). علاوه بر این به عنوان یک تعدیل کننده، تحریک کننده و مهاری بین دو نیمکره راست و چپ عمل میکند. به دلیل ارتباط گسترده آن، تغییرات ساختاری در کارپوس کالازوم باعث تغییرات عملکردی مغز از جمله عملکردهای شناختی، ارتباطات اجتماعی و حرکتی میشود (16). مطالعات متعددی با استخراج پارامترهای دیفیوژن، تغییرات این فاکتورها در سه زیر ناحیه کارپوس کالازوم Genu، Body وSplenium و کل کارپوس کالازوم را بررسی کردند. اغلب مطالعات کاهش FA و افزایش MD، RD و AD را با استفاده از هر چهار روش تصویربرداری دیفیوژن گزارش نمودند. بهطوریکه حتی در یک مطالعه متاآنالیز هم که به بررسی مطالعاتی که از روش ROI استفاده کرده بودند، پرداخته بود کاهش FA و افزایش MD در اسپلنیوم چپ کارپوس کالازوم تأیید شد (37-43، 34, 16, 5). در یک مطالعه که توسط ولف و همکاران در سال 2012 انجام شد، نقش سن مورد توجه قرار گرفت. آنها با استفاده از روش ترکتوگرافی، کودکان اوتیسم را در سن شش و 24 ماهگی مورد بررسی قرار دادند و مؤثر بودن سن در تغییر پارامتر FA را مشاهده کردند بهطوریکه در شش ماهگی افزایش FA و در 24 ماهگی کاهش FA را در ناحیه کارپوسکالازوم ثبت کردند (44). در برخی مطالعات هم که با استفاده از روشهای مختلف تصویربرداری تانسور انتشار انجام شده بود در سه زیر ناحیه کارپوس کالازوم و تمام مسیرهای عصبی کارپوس کالازوم به سمت لوبهای مختلف مغز، افزایش FA و کاهش MD، RD، ADرا نشان دادند (45-48، 15). در مطالعاتی هم که با استفاده از روش ROI و ترکتوگرافی (49)، ROI (50) و روش ترکتوگرافی (51) انجام شده بود، اختلاف چشمگیری در میزان FA به ترتیب در قسمت قدامی، ژنو و کل کارپوس کالازوم مشاهده نکردند.
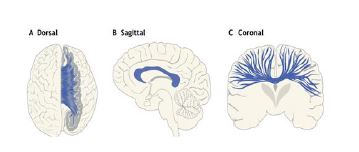
شکل1: نمای روبرو، خلفی و نیم رخ از کارپوس کالازوم (52)
فاسیکولوس فرونتال-اکسیپیتال تحتانی: فاسیکولوس فرونتال-اکسی پیتال تحتانی از لوب فرونتال، در امتداد حاشیه جانبی هسته کودیت عبور میکند. الیاف آن لوب اکسیپیتال را به فاسیکولوس چنگکی وصل میکند و به کورتکس اربیتال فرونتال ختم میشود (53). این ترکت نودهای بزرگ مغز اجتماعی را به هم وصل میکند (شکل 2). بنابراین در درک اجتماعی و در سطوج بالاتر بینایی مانند درک چهره نقش مهمی دارد (54). کاهش FA و افزایش MD، RD و AD درIFOF به صورت یکطرفه یا دوطرفه در بسیاری از مطالعات که با استفاده از روشهای مختلف تصویربرداری تانسور انتشار پارامترهای دیفیوژن را استخراج کرده بودند، گزارش شد (55-62 ،39, 37, 16, 5). در مطالعهای دیگر که با استفاده از روشهای ترکتوگرافی، VBA و ROI در ILF انجام شده بود، بین گروه اوتیستسک و کنترل اختلاف چشمگیری در میزان FA مشاهده نشد، ولی افزایش MD و RD در IFOF گزارش شد (15).
فاسیکولوس طولی تحتانی: فاسیکولوس طولی تحتانی یکی از مهمترین ترکتها است که لوب اکسی پیتال را به تمپورال وصل میکند (شکل 2) (63). ILFاز عملکردهای مغز مربوط به روشهای بصری، از جمله پردازش شی، صورت، معنای واژگان، پردازش احساسات پشتیبانی میکند و در درک احساسات چهره و درک اجتماعی نقش مهمی دارد (64). بنابراین نقص در این ترکت عصبی منجر به تعاملات اجتماعی ضعیف میشود (16). در بسیاری از مطالعات که با استفاده از هر چهار روش تصویربرداری تانسور انتشار انجام شده بود کاهش FA و افزایش MD در ILF افراد مبتلا به اوتیسم گزارش شد (65، 66، 60-62 ،56, 46, 39, 37, 16, 5) در مطالعه ولف و همکاران در سال 2012، در ناحیه فاسیکولوس طولی تحتانی نتایج مشابهی همانند ناحیه کارپوس کالازوم به ثبت رسید. بهطوریکه در شش ماهگی افزایش FA و در 24 ماهگی کاهش FA را ثبت کردند (44). در مطالعه پوگلیس و همکاران در سال 2009 که با استفاده از روشهای ترکتوگرافی، VBA و ROI انجام شده بود، بین گروه اوتیستسک و کنترل در ILF اختلاف چشمگیری در میزان FA وجود نداشت اما افزایش MD و RD را گزارش کردند (67).
فاسیکولوس طولی فوقانی: فاسیکولوس طولی فوقانی یک ترکت عصبی ارتباطی در مغز است که در نیمکره چپ، بروکا و ورنیکه را به هم متصل میکند (68). علاوه بر این اتصال دهنده لوبهای فرونتال، پریتال و تمپورال نیز میباشد (شکل 2). این ترکت در شناخت اجتماعی بسیار حائز اهمیت است. نقص در آن منجر به ارتباطات و تعاملات اجتماعی ضعیف میشود (69). مطالعات متعددی با استخراج پارامترهای دیفیوژن، تغییرات این فاکتورها در SLF را بررسی کردند. اغلب مطالعات کاهش FA و افزایش MD، RD و AD را با استفاده از هر چهار روش تصویربرداری دیفیوژن گزارش نمودند (72-70، 66, 62, 59, 56, 45, 43, 39, 37, 16, 5). برخی مطالعات افزایش FA و کاهش MD را در SLF به صورت یکطرفه و دوطرفه نشان دادند (73, 46). در مطالعه آمییس و همکاران در سال 2011، که با استفاده از روشهای ترکتوگرافی، VBA و ROI در Bilateral SLF انجام شد، بین گروه اوتیستسک و کنترل اختلاف چشمگیری در میزان FA وجود نداشت اما افزایش MD و RD را گزارش نمودند (15).
فاسیکولوس چنگکی: فاسیکولوس چنگکی، یکی از ترکتهای ماده سفید در مغز انسان است که بخشهایی از سیستم لیمبیک مانند هیپوکامپ و آمیگدال را در لوب تمپورال با قسمتهای فرونتال مانند قشر orbitofrontal متصل میکند (شکل 2) (75, 74). عملکرد این ترکت ناشناخته است. اما در یکسری از مطالعات گفته شده در چندین اختلال رشدی از جمله اختلال اوتیسم نقش داشته است. نقص در آن ممکن است بر بازیابی حافظه تأثیر بگذارد و در افراد اوتیستسک باعث بروز نقایص عاطفی- اجتماعی گردد (76). در بسیاری از مطالعات که با استفاده از هر چهار روش، تصویربرداری تانسور انتشار انجام شده بود کاهش FA و افزایش MD در فاسیکولوس چنگکی افراد مبتلا به اوتیسم گزارش شد (80-77 ،70-72، 65, 62, 60, 59, 56, 45, 42, 37). به علاوه افزایش FA در طرف راست و چپ فاسیکولوس چنگکی در مطالعاتی با استفاده از ترکیب روشهای TBSS و VBA نشان داده شد (58, 57). در مطالعه انجام شده توسط ولف و همکاران همانند ناحیههای ILF و کارپوس کالازوم، ناحیه فاسیکولوس چنگکی را مورد بررسی قرار دادند و در این ناحیه نیز مؤثر بودن سن در تغییر پارامتر FA را مشاهده کردند بهطوریکه در شش ماهگی افزایش FA و در 24 ماهگی کاهش FA را در این ناحیه به صورت دو طرفه ثبت کردند (44). در مطالعهای هم با استفاده از روشهای ترکتوگرافی، VBA و ROI درBi Lateral uncinate fasciculus بین گروه اوتیستسک و کنترل اختلاف چشمگیری در میزان FA نداشتند ولی افزایش MD و RD را گزارش نمودند (15).
سینگولوم: یکی از اولین ساختارهای شناخته شده مغز است. سینگلوم در تصاویر مختلف مغز به عنوان یک ساختار C شکل (فیبرعصبی بزرگ) است که از اطراف لوب فرونتال به لوب تمپورال، درست در بالای کالوس شکمی پیچیده میشود، که در شناخت یا درک اجتماعی، پردازش احساسات و کنترل حرکات موثر است.
دو قسمت اصلی دارد: قشر سینگولیت خلفی posterior cingulate cortex و قشر سینگولیت قدامیanterior cingulate cortex. قشر سینگولیت قدامی با احساسات مرتبط است (شکل 2). هرگونه تغییر در این ساختار میتواند منجر به تغییر عملکرد رفتارهای مرتبط با احساسات شود. بخش خلفی بیشتر مربوط به عملکردهای شناختی است که میتواند شامل توجه، مهارتهای دیداری و مکانی و حافظه باشد. به دلیل موقعیت مکانی، سینگولوم برای اتصال ساختار مغز و ادغام اطلاعاتی که دریافت میکند بسیار مهم است (82, 81). مطالعات متعددی با استخراج پارامترهای دیفیوژن، تغییرات این فاکتورها را در قسمت قدامی و خلفی سینگولوم بررسی کردند. اغلب مطالعات کاهش FA و افزایش دیفیوسیویتی را با استفاده از هر چهار روش تصویربرداری گزارش نمودند (86-82 ، 77, 70, 59, 56, 41, 39, 16،37, ,5) برخی افزایش FA را در کل حجم سینگولوم گزارش کردند (73, 46). در مطالعه پاگلیس و همکاران در سال 2009، که با روش ترکتوگرافی انجام شده بود، اختلاف چشمگیری در میزان FA بین دو گروه کنترل و اوتیستیک گزارش نشد (67).

شکل 2: ترکتهای ماده سفید مغز(57)
آمیگدال: آمیگدال یا بادامه به شکل یک توده یا کلاف عصبی است که در لوب تمپورال مغز قرار دارد. بهطور عادی در هر طرف مغز یک آمیگدال وجود دارد (شکل 3) (87). آمیگدال قسمتی از دستگاه لیمبیک در مغز انسان است که نقش مهمی در یادگیری، حافظه و درک احساسات و ایجاد پاسخ به آنها ایفا میکند. همچنین مسئول تظاهرات هیجانی چهره مانند خوشحالی و ترس است و نقش مهمی در اکتساب یادگیریهای هیجانی دارد (89, 88). آمیگدال در مغز انسان به صورت خودکار از بعضی ویژگیهای چهره برای تصمیمگیری خیلی سریع در رابطه با بیخطر بودن افراد استفاده میکند. مغز ما درست در لحظهای که چهره فرد را میبینیم از این موضوع آگاه میشود (90). افراد اوتیستیک در تشخیص عبارات احساسی صورت و "تئوری ذهن" که شامل توانایی انتساب حالتهای عاطفی به دیگران است، دچار اختلال هستند (91). در تمام مطالعات، کاهش FA را در آمیگدالا با استفاده از روشهای مختلف از قبیل TBSS (92, 16)، روش ترکتوگرافی (94, 93, 5)، روش VBA (43)، ترکیب روشهای ترکتوگرافی و ROI (48) و ترکیب روشهای ترکتوگرافی و TBSS (16) گزارش نمودند.
پایه مغزی: پایه مغزی از دو توده استوانهای الیاف عصبی در قاعده مغز ساخته شده است و در هر طرف یک پایه وجود دارد (شکل 4). peduncle اتصال دهنده ساقه مانند است. پایههای مغزی به pons متصل میشوند که مانند تورم به نظر میرسد. پایههای مغزی به انتقال تکانههای عصبی از قسمت بالاتر مغز و ساقه مغز یا قسمت تحتانی مغز به مناطق دیگر سیستم عصبی مرکزی کمک میکنند (96). پایهها با در نظر گرفتن قسمتهای مختلف بدن قبل از هدایت، دستورات را تنظیم میکنند و گاهی اوقات حرکت را کند میکنند. این ساختارها در قسمت جلوی مغز میانی میباشند که از قسمت جلوی پونها بهوجود میآیند و دارای ترکتهای عصبی بزرگ صعودی (حسی) و نزولی (حرکتی) هستند که از پونها به سمت مغز حرکت میکنند (97). بهطور کلی، پایههای مغزی در توانایی حرکتی و حسی، یادگیری مهارتهای جدید حرکتی و تبدیل اطلاعات و تعادل و حفظ وضعیت نقش دارند. آسیب این ناحیه باعث حرکاتهای نا متعارف، عدم تعادل و عدم درک احساست میشود (98). در مطالعهای که با روش VBAوTBSS انجام شده است، کاهش مداوم FA در R Cerebral Peduncle گزارش شد (98). در مطالعه دیگر با استفاده از روش ROI در SUP BL Cerebral Peduncle افزایش MD و درR MIDDLE Cerebral Peduncle وL INF Cerebral Peduncle افزایش FA و درR INF Cerebral Peduncle کاهش FA گزارش گردید (99). در مقالهای با استفاده از روش VBA و TBSS کاهش FA درR INF Cerebral Peduncle و افزایش FA در bilateral middle Cerebral Peduncle گزارش شد (66). که این افزایش و کاهشها در این ناحیه میتواند به این دلیل باشد که مسیرهای وابران مغزی، یعنی پدانکل مغزی فوقانی، سازماندهی میکروساختاری شان به دلیل تغییرات ساختاری و عملکردی مخچه تغییر کرده است و منجر به افزایش MD و کاهش FA شده که نشانگر تغییرات یکپارچگی ماده سفید ناشی از کاهش نورونها در مسیرهای خروجی است. از طرفی در پدانکلهای مغزی میانی و تحتانی که حاوی فیبرهای آوران به مخچه هستند که بخش عمدهای از این فیبرها به لوب فرونتال متصل میشوند، در کودکان ASD به دلیل تغییرات کورتیکال یا ساب کورتیکال، متفاوت از کودکان تحت کنترل سازماندهی میشود و در این نواحی افزایش FA نشان داده شده است. این افزایش و کاهش کسر ناهمسانگردی در قسمتهای مختلف پدانکل مغزی ممکن است حاکی از عدم ارتباط بین مخچه و نئوکورتکس و تغییر یکپارچگی ترکتها باشد، که این ناهنجاریها منجر به پاسخ غیر طبیعی مخچه به ورودیهای مختلف عصبی میشود و مشخصکننده نقش مخچه در ویژگیهای رفتاری این اختلال است (99).
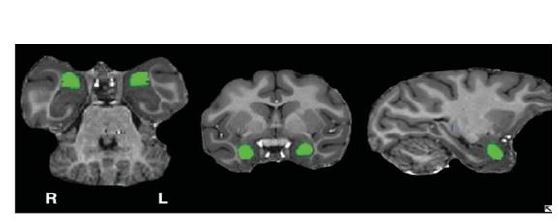
شکل3: قسمتهای سبزرنگ نشان دهنده آمیگدال است (95)
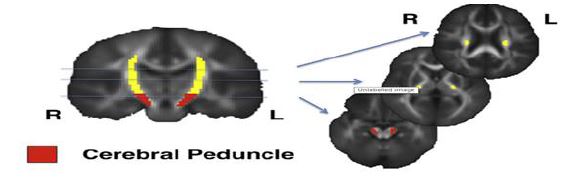
شکل 4: قسمتهای قرمز رنگ نشان دهنده پایههای مغزی راست و چپ میباشد (100)
بحث
با وجود اینکه بیشتر مطالعات مشاهدات کاهش FA و افزایش MD، RD و AD را در ترکتهای ماده سفید گزارش نمودند اما در برخی مطالعات که انگشت شمارند افزایش FA و یا فقدان اختلاف چشمگیر بین گروه کنترل و اوتیستیک گزارش شده است که این اختلاف در یافتهها ممکن است ناشی از اثرات رشدی در اوایل زندگی باشد، مطابق با فرضیه رشد زودرس، برخی از نوزادان و کودکان نوپای مبتلا به اوتیسم در اوایل رشد به دلیل افزایش بیش از حد تکثیر عصبی در دوران بارداری، دارای نورونهای کورتیکال اضافی هستند و رشد سریع مغزی را نشان میدهند و به دنبال آن ناگهان از رشد نورونی و توسعه سیناپتیک و آکسونی جلوگیری میشود. منشاء چنین تغییراتی در رشد احتمالاً قبل از تولد بوده و نشان دهنده ناهنجاری در تکثیر سلولی، مهاجرت، تمایز و توسعه آکسون و دندریتهای نورون است (48, 15). از طرفی این نتایج متناقض با توجه به مطالعات تابعی از سن بیماران است، تجزیه و تحلیل رگرسیون FA در مقابل سن نشان میدهد که افزایش FA مغز به زیر گروه افراد جوانتر اوتیستیک نسبت داده میشود، در حالیکه در سنین بالاتر کاهش FA در مقایسه با گروه کنترل گزارش شده است (73, 46). به گونهای که در مطالعهای در افراد ASD، افزایش کسر ناهمسانگردی را قبل از سه سالگی، بهطور عمده در کارپوس کالازوم و قشر فرونتال چپ و کاهش آن را در سنین بالاتر ثبت کردند (50, 58). در مطالعات مختلفی که سن افراد را به عنوان متغیر در نظر گرفتند، افزایش یا کاهش FA دقیقاً در آنها مشخص نیست و نتایج متناقض است (73). بهطور مثال، در مطالعهای کودکان ASD، در شش ماهگی افزایش میزان FA، در 12 ماهگی اختلاف چشمگیر بین دو گروه وجود نداشت و در 24 ماهگی کاهش FA را نشان دادند. این نتایج میتواند نشان دهنده رشد و نمو مجزای ساختار میکروسکوپی ترکتهای عصبی در کودکان ASD باشد و یا تغییر در حجم مغز که در سالهای اول زندگی دارای رشد شتابدار و انبساط ماکروساختاری بوده و سپس به سمت رشد آهستهتر تغییر مییابد (44) و یا وابسته به روند توسعه ترکت عصبی در سنین مختلف باشد (47). علاوه بر این میتواند به دلیل تغییرات در streamlineهای ترکتها باشد که در افراد مبتلا به اوتیسم تعدادشان و در بعضی ترکتها مانند سینگولوم طولشان در سنین پایینتر نسبت به گروه کنترل افزایش مییابد و در بزرگسالی تغییر نمیکند. و همین باعث افزایش کسر ناهمسانگردی میشود (73, 67). عامل موثر دیگر بر نتایج، جنسیت است در مطالعهای شامل شرکت کنندگان زن، بین گروه کنترل و اوتیستیک تفاوت معنیداری در میانگین FA مشاهده نشد. در حالی که اختلاف در بین پسران معنیدار بود. از آنجا که اوتیسم در بین پسران شایعتر است، میتواند مکانیسم و علت ASD بین جنسها متفاوت باشد (55). عوامل تاثیرگذار دیگر بر این نتایج اختلاف ضریب هوشی و سایر خصوصیات بالینی افراد اوتیستیک، تعداد کم شرکت کنندگان در مطالعات مورد بررسی، فنوتیپ، نقش متغیرهای ژنتیکی و اپیژنتیکی در توسعه مدارهای عصبی و نویز در دادههای تصویربرداری تانسور انتشار میباشد (44). در تفسیر مقادیر بالای FA احتیاط لازم است، به این دلیل که این تغییر انتشار میتواند ناشی از تغییرات مختلف میکروساختاری ماده سفید مانند میلینیزاسیون، اندازه و تراکم آکسونها، هندسه مسیر و مسیرهای مختلف عبور فیبر باشد(78). گاهی افزایش FA میتواند به علت کاهش اندازه سلول و یا افزایش دانسیته و افزایش میلینیسیون باشد (52). افزایش دانسیته در برخی ترکتها به دنبال افزایش فیبرهای مسطح رخ میدهد (55, 46).
نتیجهگیری
بهطور کلی، با توجه به مطالعات در بین ترکتهایی که مورد بررسی قرار گرفتند در مطالعات مورد بررسی افزایش MD، RD و AD برای تمامی نواحی گزارش شد. تمام مطالعات کاهش FA را در آمیگدال نشان دادند. اما در سایر ترکتهای عصبی ماده سفید ناسازگاریهایی وجود داشت. در اکثر مطالعات کاهش FA و در برخی افزایش یا عدم اختلاف چشمگیر در میزان FA گزارش شده است. به علت نقص در هر مطالعه و نتایج ضد و نقیض، برای اطمینان بیشتر نیاز به انجام یک مطالعه جامع و طولی در سنین کمتر (شش ماهگی تا 48 ماهگی) میباشد، که تمام پارامترهای موثر و محدودیتها در نظر گرفته شود، تا بتوان نتیجهگیری کرد که اختلال در یکپارپگی ترکتهای ماده سفید منجر به بیان ASD میشوند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
اختلال طیف اوتیسم Autism spectrum disorder (ASD)، مجموعهای از اختلالات تکاملی سیستم عصبی است (1). این اختلال با علائم بسیاری از جمله نقص در عملکرد اجتماعی و ارتباطات کلامی و غیرکلامی و محدودیت در دایره علایق و فعالیتها همراه است. دیگر علائمی که میتوان در این افراد مشاهده نمود نقایص حرکتی است که زندگی روزمرهشان را دچار مشکل میکند (3, 2). به علت ناهمگنی وسیع و گستردگی علائم در بیماران مبتلا به اوتیسم، این بیماری یکی از پر چالشترین اختلالات در کودکان به شمار میرود و به همین دلیل آن را اختلال طیفی مینامند (5, 4). اختلال طیف اوتیسم به دلیل سن کم و افزایش تعداد افراد مبتلا میتواند یکی از مهمترین اختلالات عصبی رشدی دوران ما باشد (7, 6). میزان شیوع این اختلال در سه دهه گذشته به میزان قابلتوجهی در جهان افزایش یافته است، به گونهای که دو درصد یا بیشتر از کودکان در ایالات متحده دارای این اختلال هستند (8-10). تاکنون هیچ مطالعه جامعی در زمینه شیوع این اختلال در کشور ما صورت نگرفته است. مطالعات آماری در ایران، از یک ابتلا به اوتیسم در هر۱۵۰ کودک گزارش کردهاند. برخلاف تحقیقات زیادی که تا کنون انجام شده، علت اوتیسم هنوز ناشناخته است (12, 11). ارزیابیهای بالینی اختلال طیف اوتیسم ﺷﺎﻣﻞ ﻧﻤﺮاتAutism Diagnostic Observation Schedule (ADOS)، نمراتAutism Diagnostic Interview-Revised (ADI-R)، آزﻣﻮنﻫﺎی Intelligence Quotient (IQ)، مقیاس پاسخ اجتماعی Social Responsiveness Scale (SRS) و مقیاس سازگاری رفتاری Vineland Adaptive Behavior Scale (VABS) هستند. انجام این ارزیابیها بسیار وقتگیر است و وابسته به مهارت متخصص میباشد. هم چنین به دلیل این که علایم بالینی اختلال طیف اوتیسم میتوانند با علایم سایر بیماریهای روانشناختی، همپوشانی داشته باشند، لذا این آزمونها میتوانند منجر به تشخیص اشتباه و در نهایت تجویز پروتکل درمانی نادرست شوند. علاوه براین، تشخیصهای بالینی قادر به آشکار ساختن علل نوروبیولوژیکی اختلال طیف اوتیسم و نواحی آسیب دیده مغزی در اثر این اختلال نیستند. با توجه به موارد ذکر شده، روش تصویربرداری DTI مغزی میتوانند ابزار مفیدی برای تشخیص اختلال طیف اوتیسم به صورت کمی و پیشبینی شاخصهای بالینی آن باشند. (14, 13). با این حال در بسیاری مطالعات نشان داده شده است که اختلالات رفتاری، حرکتی و اجتماعی ناشی از اتصالات عملکردیFunctional Connectivity (FC) غیرنرمال بین شبکههای مغزی است. اتصالات عملکردی غیرنرمال در افراد اوتیسم میتواند بهصورت اختلال در یکپارچگی ترکتهای ماده سفید بیان شود که نواحی دوردست را به هم متصل میکند. ماده سفید مجموعهای از دستههای میلین شده آکسونها است که سیگنالهای الکتریکی را بین نواحی مختلف مغز منتقل میکند (15). برای انجام وظایف پیچیده احساسی، اجتماعی و ارتباطات، انتقال یا هدایت کارآمد اطلاعات بین ترکتهای ماده سفید ضروری است (16).
تصویربرداری تانسور انتشار: تصویربرداری تانسور انتشار Diffusion Tensor Imaging (DTI) یکی از کاربردیترین روشهای تصویربرداری پزشکی است که غیرتهاجمی بوده و برای اندازهگیری حرکات براوونی مولکولهای آب میباشد. در محیطهای همسانگرد مولکولهای آب در تمام جهات بهطور مساوی منتشر میشوند، در حالیکه انتشار در محیطهای ناهمسانگرد بهوسیله عواملی مانند ماکرومولکولها و غشای سلولها محدود میگردد (17). ماده سفید مغز محیطی ناهمسانگرد شامل آکسونهای نورونهای عصبی بوده که میلین آکسونها، حرکت مولکولهای آب را محدود میکند. مسیر عصبی در واقع به دستهای از آکسونها گفته میشود و بهوسیله روش DTI میتوان به خواص انتشار مسیرهای عصبی دست یافت (19, 18). تصویربرداری DTI امکان شناسایی تغییرات میکروساختاری و خصوصیات انتشار در بافت را فراهم میکند. به عبارت دیگر آسیب به ماده سفید باعث تغییر ویژگیهای انتشار آب در مغز میشود و بنابراین روش DTI به عنوان یک نشانگر برای کاربردهای بالینی مورد استفاده قرار میگیرد (21, 20). در این روش تصاویر تانسور انتشار با استفاده از دستگاه امآرآی گرفته میشود. این تصاویر نسبت به جایگیری مولکولهای پروتون آب در طول محور گرادیان تحریک کننده انتشار حساس هستند. اندازهگیری تانسور انتشار با بررسی مسیرهای عصبی مغز میتواند به بررسی بیماریهایی مثل اوتیسم کمک کند (22). به همین دلیل تصویربرداری تانسور انتشار یکی از مفیدترین روشها برای ارزیابی غیر تهاجمی میکروساختاری فیبرهای عصبی است که خواص دیفیوژن مولکولهای آب مانند بزرگی، ناهمسانگردی (تغییر خواص دیفیوژن با جهت) در بافتها را اندازهگیری میکند (23). چندین اندازهگیری کمی، مانند پارامترهای کسر ناهمسانگردی Fractional Anisotropy (FA)، انتشار محوری Axial Diffusivity (AD)، انتشار شعاعی Radial Diffusivity (RD) و میانگین انتشار Mean Diffusivity (MD) از دادههای DTI انجام میشود. اگرچه روابط بین این شاخصها و خصوصیات میکروساختارهای بافت پیچیده است، مطالعات انسانی و حیوانی نشان میدهد که AD مربوط به یکپارچگی آکسون است و RD نسبت به تغییرات میلین حساس میباشد (25, 24). اما پارامتری که غالباً برای ناهمسانگردی دیفیوژن استفاده میشود، FA است. که به نظر میرسد به تغییرات رشدی و اختلالات پاتولوژیکی در دانسیته، اندازه و میلینیزاسیون آکسونها و انسجام فیبرها در یک وکسل حساس است. بنابراین میتواند یک شاخص مفید برای ارزیابی یکپارچگی ساختاری ماده سفید باشد (26). در حال حاضر، چهار روش عمده پردازش برای ارزیابی اتصالات آناتومیکی از دادههای تصویربرداری تانسور انتشار وجود دارد. که شامل منطقه مورد نظر Region of interest (ROI) تجزیه و تحلیل مبتنی بر وکسل Voxel-based Analysis (VBA)، تجزیه و تحلیل کمی مبتنی بر ترکتوگرافی Tractography و آمار مکانی مبتنی بر ترکت Tract-Based Spatial Statistics (TBSS) میشود. که در ادامه به بررسی این روشها میپردازیم.
• تجزیه و تحلیل ناحیه مورد نظر
• ناحیه مورد نظر شامل قسمتهای آناتومیکی است که در یک منطقه خاص برای مطالعه انتخاب میشوند. استفاده از ROI بهطور گستردهای مورد استفاده قرار میگیرد و ابزار تحلیلیROI نسبتاً ساده است و بهطور کلی شامل ردیابی دستی یا قرار دادن خودکار ماسک ROI برای تعریف برخی از ساختارهای آناتومیکی خاص مغز است. هنگامی که ROI برای یک منطقه خاص مغز مشخص شد، اندازهگیریهای کمی میتواند برای استخراج پارامترهای FA و ... از منطقه آناتومیک مورد نظر انجام گیرد (27, 19)
• تجزیه و تحلیل مبتنی بر وکسل
• تجزیه و تحلیل مبتنی بر وکسل از دادههای تصویربرداری تانسور انتشار یک روش اکتشافی برای ارزیابی تفاوتها و تغییرات خواص انتشار در هر وکسل از یک مجموعه داده مغزی است. VBAیک ابزار تحقیقاتی بالینی قدرتمند است که بهطور گسترده مورد استفاده قرار میگیرد (28, 27).
• ترکتوگرافی: ترکتوگرافی یک روش جدید جهت شناسایی اتصالات آناتومیکی در مغز است. با محاسبه، جهتگیری انتشار کل مسیرهای فیبر عصبی را بازسازی میکند و حجم ترکتها و یکپارچگی میکرو ساختارهای ماده سفید را به صورت کمی نمایش میدهد (29). این روش تصاویر سه بعدی از ساختار فیزیکی ماده سفید مغز ارائه میدهد. دادههای DTI را میتوان با استفاده از تراکتوگرافی در مغز مورد تجزیه و تحلیل قرار داد (31, 30).
• آمار مکانی مبتنی بر ترکت
• در هر مرحله، راهنماییهایی در مورد بهینهسازی تنظیمات پارامتر به همراه جواب مثبت و منفی روشهای مختلف ارائه میشود تا به خواننده در انتخاب بهترین روش برای کاربرد آنها کمک کند. در این روش برای آنالیز وکسل از اندازهگیریهای ماده سفید کامل مغز استفاده میشود. بهطور خلاصه، میانگین همه تصاویر FA برای تولید یک اسکلت FA متوسط بهکار گرفته میشود (32, 30).
روش بررسی
در این مطالعه، مقالاتی که با استفاده از روش تصویربرداری تانسور انتشار در بازه زمانی 2009 تا 2019، ترکتهای ماده سفید مغز در افراد اوتیستیک بررسی کرده بودند، مورد نظر قرار داده شد. برای جستجوی این مقالات از کلمات کلیدی Autism, DTI و WM Tracts استفاده کرده و در پایگاههای گوگل اسکولار، پاپ مد و ساینس دایرکت جستجو انجام شد.
نتایج
شواهد حاصل از مطالعات انجام شده حاکی از آن است که مغز اوتیستیک با اختلال در یکپارچگی ترکتهای ماده سفید همراه است. هنوز بهطور قطعی مشخص نیست که کدامیک از ترکتهای ماده سفید مغز در این افراد دچار اختلال میشود (33). با این وجود در برخی مطالعات با استفاده از روش DTI و بررسی پارامترهایی چون FA، ناهنجاریهایی را در میکروساختارهای ترکتهای ماده سفید در نواحی مختلف مغز افراد ASD نسبت به گروه کنترل سالم گزارش کردهاند (34, 7). این ترکتها شامل کارپوس کالازوم Corpus Callosum ، فاسیکولوس فرونتال-اکسی پیتال تحتانی Inferior Fronto-Occipital Fasciculus (IFOF)، فاسیکولوس طولی تحتانی inferior longitudinal fasciculus (ILF)، فاسیکولوس طولی فوقانی superior longitudinal fasciculus (SLF)، فاسیکولوس چنگکی Uncinate Fasciculus، سینگولومCingulum، آمیگدالا Amygdala و پایه مغزی Cerebral Peduncle است. از آنجا که ناحیه آسیب دیده در فرد اوتیستیک باعث بروز علایم متفاوت از فردی به فرد دیگر می¬شود مطالعه این ترکتهای عصبی از اهمیت ویژهای برخوردار است. بنابراین در ادامه به بررسی مطالعات مختلف بر اساس ناحیه آناتومیک مورد آزمون میپردازیم.
کارپوس کالازوم
کارپوس کالازوم یا جسم پپینهای بزرگترین مسیر اتصال و ساختار ماده سفید در مغز انسان است و یکی از مهمترین ترکتهای ماده سفید در افراد اوتیسم است (شکل 1). این ترکت دو نیمکره مغزی را بهصورت هموتوپیکال و هتروتوپیکال متصل میکند و اطلاعات بین دو نیمکره از طریق آن منتقل میشود. کارپوس کالازوم از سمت قدام به خلف به مناطق Rostrum، Genu، Body و Splenium تقسیم میشود. دو قسمت اول لوبهای فرونتال چپ و راست مغز را به هم وصل میکنند و دو قسمت بعدی لوبهای تمپورال و اکسیپیتال دو نیمکره را به هم متصل میکنند. کارپوس کالازوم در پردازش بینایی و درک چهره و اشیا نقش مهمی دارد که میتواند مربوط به عملکرد شناختی غیر کلامی باشد (36, 35). علاوه بر این به عنوان یک تعدیل کننده، تحریک کننده و مهاری بین دو نیمکره راست و چپ عمل میکند. به دلیل ارتباط گسترده آن، تغییرات ساختاری در کارپوس کالازوم باعث تغییرات عملکردی مغز از جمله عملکردهای شناختی، ارتباطات اجتماعی و حرکتی میشود (16). مطالعات متعددی با استخراج پارامترهای دیفیوژن، تغییرات این فاکتورها در سه زیر ناحیه کارپوس کالازوم Genu، Body وSplenium و کل کارپوس کالازوم را بررسی کردند. اغلب مطالعات کاهش FA و افزایش MD، RD و AD را با استفاده از هر چهار روش تصویربرداری دیفیوژن گزارش نمودند. بهطوریکه حتی در یک مطالعه متاآنالیز هم که به بررسی مطالعاتی که از روش ROI استفاده کرده بودند، پرداخته بود کاهش FA و افزایش MD در اسپلنیوم چپ کارپوس کالازوم تأیید شد (37-43، 34, 16, 5). در یک مطالعه که توسط ولف و همکاران در سال 2012 انجام شد، نقش سن مورد توجه قرار گرفت. آنها با استفاده از روش ترکتوگرافی، کودکان اوتیسم را در سن شش و 24 ماهگی مورد بررسی قرار دادند و مؤثر بودن سن در تغییر پارامتر FA را مشاهده کردند بهطوریکه در شش ماهگی افزایش FA و در 24 ماهگی کاهش FA را در ناحیه کارپوسکالازوم ثبت کردند (44). در برخی مطالعات هم که با استفاده از روشهای مختلف تصویربرداری تانسور انتشار انجام شده بود در سه زیر ناحیه کارپوس کالازوم و تمام مسیرهای عصبی کارپوس کالازوم به سمت لوبهای مختلف مغز، افزایش FA و کاهش MD، RD، ADرا نشان دادند (45-48، 15). در مطالعاتی هم که با استفاده از روش ROI و ترکتوگرافی (49)، ROI (50) و روش ترکتوگرافی (51) انجام شده بود، اختلاف چشمگیری در میزان FA به ترتیب در قسمت قدامی، ژنو و کل کارپوس کالازوم مشاهده نکردند.

شکل1: نمای روبرو، خلفی و نیم رخ از کارپوس کالازوم (52)
فاسیکولوس فرونتال-اکسیپیتال تحتانی: فاسیکولوس فرونتال-اکسی پیتال تحتانی از لوب فرونتال، در امتداد حاشیه جانبی هسته کودیت عبور میکند. الیاف آن لوب اکسیپیتال را به فاسیکولوس چنگکی وصل میکند و به کورتکس اربیتال فرونتال ختم میشود (53). این ترکت نودهای بزرگ مغز اجتماعی را به هم وصل میکند (شکل 2). بنابراین در درک اجتماعی و در سطوج بالاتر بینایی مانند درک چهره نقش مهمی دارد (54). کاهش FA و افزایش MD، RD و AD درIFOF به صورت یکطرفه یا دوطرفه در بسیاری از مطالعات که با استفاده از روشهای مختلف تصویربرداری تانسور انتشار پارامترهای دیفیوژن را استخراج کرده بودند، گزارش شد (55-62 ،39, 37, 16, 5). در مطالعهای دیگر که با استفاده از روشهای ترکتوگرافی، VBA و ROI در ILF انجام شده بود، بین گروه اوتیستسک و کنترل اختلاف چشمگیری در میزان FA مشاهده نشد، ولی افزایش MD و RD در IFOF گزارش شد (15).
فاسیکولوس طولی تحتانی: فاسیکولوس طولی تحتانی یکی از مهمترین ترکتها است که لوب اکسی پیتال را به تمپورال وصل میکند (شکل 2) (63). ILFاز عملکردهای مغز مربوط به روشهای بصری، از جمله پردازش شی، صورت، معنای واژگان، پردازش احساسات پشتیبانی میکند و در درک احساسات چهره و درک اجتماعی نقش مهمی دارد (64). بنابراین نقص در این ترکت عصبی منجر به تعاملات اجتماعی ضعیف میشود (16). در بسیاری از مطالعات که با استفاده از هر چهار روش تصویربرداری تانسور انتشار انجام شده بود کاهش FA و افزایش MD در ILF افراد مبتلا به اوتیسم گزارش شد (65، 66، 60-62 ،56, 46, 39, 37, 16, 5) در مطالعه ولف و همکاران در سال 2012، در ناحیه فاسیکولوس طولی تحتانی نتایج مشابهی همانند ناحیه کارپوس کالازوم به ثبت رسید. بهطوریکه در شش ماهگی افزایش FA و در 24 ماهگی کاهش FA را ثبت کردند (44). در مطالعه پوگلیس و همکاران در سال 2009 که با استفاده از روشهای ترکتوگرافی، VBA و ROI انجام شده بود، بین گروه اوتیستسک و کنترل در ILF اختلاف چشمگیری در میزان FA وجود نداشت اما افزایش MD و RD را گزارش کردند (67).
فاسیکولوس طولی فوقانی: فاسیکولوس طولی فوقانی یک ترکت عصبی ارتباطی در مغز است که در نیمکره چپ، بروکا و ورنیکه را به هم متصل میکند (68). علاوه بر این اتصال دهنده لوبهای فرونتال، پریتال و تمپورال نیز میباشد (شکل 2). این ترکت در شناخت اجتماعی بسیار حائز اهمیت است. نقص در آن منجر به ارتباطات و تعاملات اجتماعی ضعیف میشود (69). مطالعات متعددی با استخراج پارامترهای دیفیوژن، تغییرات این فاکتورها در SLF را بررسی کردند. اغلب مطالعات کاهش FA و افزایش MD، RD و AD را با استفاده از هر چهار روش تصویربرداری دیفیوژن گزارش نمودند (72-70، 66, 62, 59, 56, 45, 43, 39, 37, 16, 5). برخی مطالعات افزایش FA و کاهش MD را در SLF به صورت یکطرفه و دوطرفه نشان دادند (73, 46). در مطالعه آمییس و همکاران در سال 2011، که با استفاده از روشهای ترکتوگرافی، VBA و ROI در Bilateral SLF انجام شد، بین گروه اوتیستسک و کنترل اختلاف چشمگیری در میزان FA وجود نداشت اما افزایش MD و RD را گزارش نمودند (15).
فاسیکولوس چنگکی: فاسیکولوس چنگکی، یکی از ترکتهای ماده سفید در مغز انسان است که بخشهایی از سیستم لیمبیک مانند هیپوکامپ و آمیگدال را در لوب تمپورال با قسمتهای فرونتال مانند قشر orbitofrontal متصل میکند (شکل 2) (75, 74). عملکرد این ترکت ناشناخته است. اما در یکسری از مطالعات گفته شده در چندین اختلال رشدی از جمله اختلال اوتیسم نقش داشته است. نقص در آن ممکن است بر بازیابی حافظه تأثیر بگذارد و در افراد اوتیستسک باعث بروز نقایص عاطفی- اجتماعی گردد (76). در بسیاری از مطالعات که با استفاده از هر چهار روش، تصویربرداری تانسور انتشار انجام شده بود کاهش FA و افزایش MD در فاسیکولوس چنگکی افراد مبتلا به اوتیسم گزارش شد (80-77 ،70-72، 65, 62, 60, 59, 56, 45, 42, 37). به علاوه افزایش FA در طرف راست و چپ فاسیکولوس چنگکی در مطالعاتی با استفاده از ترکیب روشهای TBSS و VBA نشان داده شد (58, 57). در مطالعه انجام شده توسط ولف و همکاران همانند ناحیههای ILF و کارپوس کالازوم، ناحیه فاسیکولوس چنگکی را مورد بررسی قرار دادند و در این ناحیه نیز مؤثر بودن سن در تغییر پارامتر FA را مشاهده کردند بهطوریکه در شش ماهگی افزایش FA و در 24 ماهگی کاهش FA را در این ناحیه به صورت دو طرفه ثبت کردند (44). در مطالعهای هم با استفاده از روشهای ترکتوگرافی، VBA و ROI درBi Lateral uncinate fasciculus بین گروه اوتیستسک و کنترل اختلاف چشمگیری در میزان FA نداشتند ولی افزایش MD و RD را گزارش نمودند (15).
سینگولوم: یکی از اولین ساختارهای شناخته شده مغز است. سینگلوم در تصاویر مختلف مغز به عنوان یک ساختار C شکل (فیبرعصبی بزرگ) است که از اطراف لوب فرونتال به لوب تمپورال، درست در بالای کالوس شکمی پیچیده میشود، که در شناخت یا درک اجتماعی، پردازش احساسات و کنترل حرکات موثر است.
دو قسمت اصلی دارد: قشر سینگولیت خلفی posterior cingulate cortex و قشر سینگولیت قدامیanterior cingulate cortex. قشر سینگولیت قدامی با احساسات مرتبط است (شکل 2). هرگونه تغییر در این ساختار میتواند منجر به تغییر عملکرد رفتارهای مرتبط با احساسات شود. بخش خلفی بیشتر مربوط به عملکردهای شناختی است که میتواند شامل توجه، مهارتهای دیداری و مکانی و حافظه باشد. به دلیل موقعیت مکانی، سینگولوم برای اتصال ساختار مغز و ادغام اطلاعاتی که دریافت میکند بسیار مهم است (82, 81). مطالعات متعددی با استخراج پارامترهای دیفیوژن، تغییرات این فاکتورها را در قسمت قدامی و خلفی سینگولوم بررسی کردند. اغلب مطالعات کاهش FA و افزایش دیفیوسیویتی را با استفاده از هر چهار روش تصویربرداری گزارش نمودند (86-82 ، 77, 70, 59, 56, 41, 39, 16،37, ,5) برخی افزایش FA را در کل حجم سینگولوم گزارش کردند (73, 46). در مطالعه پاگلیس و همکاران در سال 2009، که با روش ترکتوگرافی انجام شده بود، اختلاف چشمگیری در میزان FA بین دو گروه کنترل و اوتیستیک گزارش نشد (67).

شکل 2: ترکتهای ماده سفید مغز(57)
آمیگدال: آمیگدال یا بادامه به شکل یک توده یا کلاف عصبی است که در لوب تمپورال مغز قرار دارد. بهطور عادی در هر طرف مغز یک آمیگدال وجود دارد (شکل 3) (87). آمیگدال قسمتی از دستگاه لیمبیک در مغز انسان است که نقش مهمی در یادگیری، حافظه و درک احساسات و ایجاد پاسخ به آنها ایفا میکند. همچنین مسئول تظاهرات هیجانی چهره مانند خوشحالی و ترس است و نقش مهمی در اکتساب یادگیریهای هیجانی دارد (89, 88). آمیگدال در مغز انسان به صورت خودکار از بعضی ویژگیهای چهره برای تصمیمگیری خیلی سریع در رابطه با بیخطر بودن افراد استفاده میکند. مغز ما درست در لحظهای که چهره فرد را میبینیم از این موضوع آگاه میشود (90). افراد اوتیستیک در تشخیص عبارات احساسی صورت و "تئوری ذهن" که شامل توانایی انتساب حالتهای عاطفی به دیگران است، دچار اختلال هستند (91). در تمام مطالعات، کاهش FA را در آمیگدالا با استفاده از روشهای مختلف از قبیل TBSS (92, 16)، روش ترکتوگرافی (94, 93, 5)، روش VBA (43)، ترکیب روشهای ترکتوگرافی و ROI (48) و ترکیب روشهای ترکتوگرافی و TBSS (16) گزارش نمودند.
پایه مغزی: پایه مغزی از دو توده استوانهای الیاف عصبی در قاعده مغز ساخته شده است و در هر طرف یک پایه وجود دارد (شکل 4). peduncle اتصال دهنده ساقه مانند است. پایههای مغزی به pons متصل میشوند که مانند تورم به نظر میرسد. پایههای مغزی به انتقال تکانههای عصبی از قسمت بالاتر مغز و ساقه مغز یا قسمت تحتانی مغز به مناطق دیگر سیستم عصبی مرکزی کمک میکنند (96). پایهها با در نظر گرفتن قسمتهای مختلف بدن قبل از هدایت، دستورات را تنظیم میکنند و گاهی اوقات حرکت را کند میکنند. این ساختارها در قسمت جلوی مغز میانی میباشند که از قسمت جلوی پونها بهوجود میآیند و دارای ترکتهای عصبی بزرگ صعودی (حسی) و نزولی (حرکتی) هستند که از پونها به سمت مغز حرکت میکنند (97). بهطور کلی، پایههای مغزی در توانایی حرکتی و حسی، یادگیری مهارتهای جدید حرکتی و تبدیل اطلاعات و تعادل و حفظ وضعیت نقش دارند. آسیب این ناحیه باعث حرکاتهای نا متعارف، عدم تعادل و عدم درک احساست میشود (98). در مطالعهای که با روش VBAوTBSS انجام شده است، کاهش مداوم FA در R Cerebral Peduncle گزارش شد (98). در مطالعه دیگر با استفاده از روش ROI در SUP BL Cerebral Peduncle افزایش MD و درR MIDDLE Cerebral Peduncle وL INF Cerebral Peduncle افزایش FA و درR INF Cerebral Peduncle کاهش FA گزارش گردید (99). در مقالهای با استفاده از روش VBA و TBSS کاهش FA درR INF Cerebral Peduncle و افزایش FA در bilateral middle Cerebral Peduncle گزارش شد (66). که این افزایش و کاهشها در این ناحیه میتواند به این دلیل باشد که مسیرهای وابران مغزی، یعنی پدانکل مغزی فوقانی، سازماندهی میکروساختاری شان به دلیل تغییرات ساختاری و عملکردی مخچه تغییر کرده است و منجر به افزایش MD و کاهش FA شده که نشانگر تغییرات یکپارچگی ماده سفید ناشی از کاهش نورونها در مسیرهای خروجی است. از طرفی در پدانکلهای مغزی میانی و تحتانی که حاوی فیبرهای آوران به مخچه هستند که بخش عمدهای از این فیبرها به لوب فرونتال متصل میشوند، در کودکان ASD به دلیل تغییرات کورتیکال یا ساب کورتیکال، متفاوت از کودکان تحت کنترل سازماندهی میشود و در این نواحی افزایش FA نشان داده شده است. این افزایش و کاهش کسر ناهمسانگردی در قسمتهای مختلف پدانکل مغزی ممکن است حاکی از عدم ارتباط بین مخچه و نئوکورتکس و تغییر یکپارچگی ترکتها باشد، که این ناهنجاریها منجر به پاسخ غیر طبیعی مخچه به ورودیهای مختلف عصبی میشود و مشخصکننده نقش مخچه در ویژگیهای رفتاری این اختلال است (99).

شکل3: قسمتهای سبزرنگ نشان دهنده آمیگدال است (95)

شکل 4: قسمتهای قرمز رنگ نشان دهنده پایههای مغزی راست و چپ میباشد (100)
بحث
با وجود اینکه بیشتر مطالعات مشاهدات کاهش FA و افزایش MD، RD و AD را در ترکتهای ماده سفید گزارش نمودند اما در برخی مطالعات که انگشت شمارند افزایش FA و یا فقدان اختلاف چشمگیر بین گروه کنترل و اوتیستیک گزارش شده است که این اختلاف در یافتهها ممکن است ناشی از اثرات رشدی در اوایل زندگی باشد، مطابق با فرضیه رشد زودرس، برخی از نوزادان و کودکان نوپای مبتلا به اوتیسم در اوایل رشد به دلیل افزایش بیش از حد تکثیر عصبی در دوران بارداری، دارای نورونهای کورتیکال اضافی هستند و رشد سریع مغزی را نشان میدهند و به دنبال آن ناگهان از رشد نورونی و توسعه سیناپتیک و آکسونی جلوگیری میشود. منشاء چنین تغییراتی در رشد احتمالاً قبل از تولد بوده و نشان دهنده ناهنجاری در تکثیر سلولی، مهاجرت، تمایز و توسعه آکسون و دندریتهای نورون است (48, 15). از طرفی این نتایج متناقض با توجه به مطالعات تابعی از سن بیماران است، تجزیه و تحلیل رگرسیون FA در مقابل سن نشان میدهد که افزایش FA مغز به زیر گروه افراد جوانتر اوتیستیک نسبت داده میشود، در حالیکه در سنین بالاتر کاهش FA در مقایسه با گروه کنترل گزارش شده است (73, 46). به گونهای که در مطالعهای در افراد ASD، افزایش کسر ناهمسانگردی را قبل از سه سالگی، بهطور عمده در کارپوس کالازوم و قشر فرونتال چپ و کاهش آن را در سنین بالاتر ثبت کردند (50, 58). در مطالعات مختلفی که سن افراد را به عنوان متغیر در نظر گرفتند، افزایش یا کاهش FA دقیقاً در آنها مشخص نیست و نتایج متناقض است (73). بهطور مثال، در مطالعهای کودکان ASD، در شش ماهگی افزایش میزان FA، در 12 ماهگی اختلاف چشمگیر بین دو گروه وجود نداشت و در 24 ماهگی کاهش FA را نشان دادند. این نتایج میتواند نشان دهنده رشد و نمو مجزای ساختار میکروسکوپی ترکتهای عصبی در کودکان ASD باشد و یا تغییر در حجم مغز که در سالهای اول زندگی دارای رشد شتابدار و انبساط ماکروساختاری بوده و سپس به سمت رشد آهستهتر تغییر مییابد (44) و یا وابسته به روند توسعه ترکت عصبی در سنین مختلف باشد (47). علاوه بر این میتواند به دلیل تغییرات در streamlineهای ترکتها باشد که در افراد مبتلا به اوتیسم تعدادشان و در بعضی ترکتها مانند سینگولوم طولشان در سنین پایینتر نسبت به گروه کنترل افزایش مییابد و در بزرگسالی تغییر نمیکند. و همین باعث افزایش کسر ناهمسانگردی میشود (73, 67). عامل موثر دیگر بر نتایج، جنسیت است در مطالعهای شامل شرکت کنندگان زن، بین گروه کنترل و اوتیستیک تفاوت معنیداری در میانگین FA مشاهده نشد. در حالی که اختلاف در بین پسران معنیدار بود. از آنجا که اوتیسم در بین پسران شایعتر است، میتواند مکانیسم و علت ASD بین جنسها متفاوت باشد (55). عوامل تاثیرگذار دیگر بر این نتایج اختلاف ضریب هوشی و سایر خصوصیات بالینی افراد اوتیستیک، تعداد کم شرکت کنندگان در مطالعات مورد بررسی، فنوتیپ، نقش متغیرهای ژنتیکی و اپیژنتیکی در توسعه مدارهای عصبی و نویز در دادههای تصویربرداری تانسور انتشار میباشد (44). در تفسیر مقادیر بالای FA احتیاط لازم است، به این دلیل که این تغییر انتشار میتواند ناشی از تغییرات مختلف میکروساختاری ماده سفید مانند میلینیزاسیون، اندازه و تراکم آکسونها، هندسه مسیر و مسیرهای مختلف عبور فیبر باشد(78). گاهی افزایش FA میتواند به علت کاهش اندازه سلول و یا افزایش دانسیته و افزایش میلینیسیون باشد (52). افزایش دانسیته در برخی ترکتها به دنبال افزایش فیبرهای مسطح رخ میدهد (55, 46).
نتیجهگیری
بهطور کلی، با توجه به مطالعات در بین ترکتهایی که مورد بررسی قرار گرفتند در مطالعات مورد بررسی افزایش MD، RD و AD برای تمامی نواحی گزارش شد. تمام مطالعات کاهش FA را در آمیگدال نشان دادند. اما در سایر ترکتهای عصبی ماده سفید ناسازگاریهایی وجود داشت. در اکثر مطالعات کاهش FA و در برخی افزایش یا عدم اختلاف چشمگیر در میزان FA گزارش شده است. به علت نقص در هر مطالعه و نتایج ضد و نقیض، برای اطمینان بیشتر نیاز به انجام یک مطالعه جامع و طولی در سنین کمتر (شش ماهگی تا 48 ماهگی) میباشد، که تمام پارامترهای موثر و محدودیتها در نظر گرفته شود، تا بتوان نتیجهگیری کرد که اختلال در یکپارپگی ترکتهای ماده سفید منجر به بیان ASD میشوند.
حامی مالی: ندارد
تعارض در منافع: وجود ندارد.
References:
1- Dekhil O, Hajjdiab H, Shalaby A, Ali MT, Ayinde B, Switala A, et al. Using Resting State Functional MRI to Build a Personalized Autism Diagnosis System. Plos One 2018; 13(10): E0206351.
2- Parmeggiani A, Corinaldesi A, Posar A. Early Features of Autism Spectrum Disorder: A Cross-Sectional Study. Italian J Pediatrics 2019; 45(1):1-8.
3- Wiggins L, Christensen D, Van Naarden Braun K, Martin L, Baio J. Comparison of Autism Spectrum Disorder Surveillance Status Based on two Different Diagnostic Schemes: Findings from the Metropolitan Atlanta Developmental Disabilities Surveillance Program, 2012. Plos One 2018; 13(11): E0208079.
4- Saad M, Islam SMR. Brain Connectivity Network Analysis and Classifications from Diffusion Tensor Imaging 2019 International Conference on Robotics. Electrical and Signal Processing Techniques (ICREST) 2019: 422-27.
5- Jou RJ, Jackowski AP, Papademetris X, Rajeevan N, Staib LH, Volkmar FR. Diffusion Tensor Imaging in Autism Spectrum Disorders: Preliminary Evidence of Abnormal Neural Connectivity. Australian & New Zealand J of Psychiatry 2011; 45(2): 153-62.
6- Fournier KA, Hass CJ, Naik SK, Lodha N, Cauraugh JH. Motor Coordination in Autism Spectrum Disorders: A Synthesis and Meta-Analysis. J Autism and Developmental Disorders 2010; 40(10): 1227-40.
7- Hanaie R, Mohri I, Kagitani-Shimono K, Tachibana M, Matsuzaki J, Watanabe Y, et al. Abnormal Corpus Callosum Connectivity, Socio-Communicative Deficits, And Motor Deficits in Children with Autism Spectrum Disorder: A Diffusion Tensor Imaging Study. J Autism and Developmental Disorders 2014; 44(9): 2209-20.
8- Frye RE, Vassall S, Kaur G, Lewis C, Karim M, Rossignol D. Emerging Biomarkers in Autism Spectrum Disorder: A Systematic Review. Ann Transl Med 2019; 7(23): 792.
9- Christensen DL, Braun KVN, Baio J, Bilder D, Charles J, Constantino JN, et al. Prevalence and Characteristics of Autism Spectrum Disorder among Children Aged 8 Years-Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2012. MMWR Surveillance Summaries 2018; 65(13): 1-23.
10- Xu G, Strathearn L, Liu B, O’Brien M, Kopelman TG, Zhu J, et al. Prevalence and Treatment Patterns of Autism Spectrum Disorder in the United States, 2016. JAMA Pediatrics 2019; 173(2): 153-9.
11- Castelli F, Frith C, Happé F, Frith U. Autism, Asperger Syndrome and Brain Mechanisms for the Attribution of Mental States to Animated Shapes. Brain 2002; 125(8): 1839-49.
12- Kennedy DP, Redcay E, Courchesne E. Failing to Deactivate: Resting Functional Abnormalities in Autism. Proceedings of the National Academy of Sci 2006; 103(21): 8275-80.
13- Just MA, Cherkassky VL, Keller TA, Minshew NJ. Cortical Activation and Synchronization During Sentence Comprehension in High-Functioning Autism: Evidence of Underconnectivity. Brain 2004; 127(8): 1811-21.
14- Villalobos ME, Mizuno A, Dahl BC, Kemmotsu N, Müller RA. Reduced Functional Connectivity Between V1 and Inferior Frontal Cortex Associated with Visuomotor Performance in Autism. Neuroimage 2005; 25(3): 916-25.
15- Ameis SH, Fan J, Rockel C, Voineskos AN, Lobaugh NJ, Soorya L, et al. Impaired Structural Connectivity of Socio-Emotional Circuits in Autism Spectrum Disorders: A Diffusion Tensor Imaging Study. Plos One 2011; 6(11): E28044.
16- Im WY, Ha JH, Kim EJ, Cheon KA, Cho J, Song DH. Impaired White Matter Integrity and Social Cognition in High-Function Autism: Diffusion Tensor Imaging Study. Psychiatry Investigation 2018; 15(3): 292-99.
17- Toossi MTB, Pourreza HR, Zare H, Sigari MH, Layegh P, Azimi A. An Effective Hair Removal Algorithm for Dermoscopy Images. Skin Res Technol 2013; 19(3): 230-5.
18- Bigham B, Zamanpour SA, Zemorshidi F, Boroumand F, Zare H, Initiative Asdn. Identification of Superficial White Matter Abnormalities in Alzheimer’s Disease and Mild Cognitive Impairment Using Diffusion Tensor Imaging. J Alzheimers Dis Rep 2020; 4(1): 49-59.
19- Rostami A, Naseri S, Momennezhad M, Zare H, Anvari K, Badkhor HS. Geometric Distortion Evaluation of Magnetic Resonance Images by a New Large Field of View Phantom for Magnetic Resonance Based Radiotherapy Purposes. International J Radiation Res 2020; 18(4): 733-42.
20- Churchill NW, Caverzasi E, Graham SJ, Hutchison MG, Schweizer TA. White Matter During Concussion Recovery: Comparing Diffusion Tensor Imaging (DTI) and Neurite Orientation Dispersion and Density Imaging (NODDI). Human Brain Mapping 2019; 40(6): 1908-18.
21- Westlye LT, Walhovd KB, Dale AM, Bjørnerud A, Due-Tønnessen P, Engvig A, et al. Life-Span Changes of the Human Brain White Matter: Diffusion Tensor Imaging (DTI) and Volumetry. Cereb Cortex 2010; 20(9): 2055-68.
22- Temur HO, Yurtsever I, Yesil G, Sharifov R, Yilmaz FT, Dundar TT, et al. Correlation Between DTI Findings and Volume of Corpus Callosum in Children with AUTISM. Curr Med Imaging 2019; 15(9): 895-9.
23- Nickel K, Tebartz Van Elst L, Perlov E, Endres D, Müller G, Riedel A, et al. Altered White Matter Integrity in Adults with Autism Spectrum Disorder and an IQ> 100: A Diffusion Tensor Imaging Study. Acta Psychiatr Scand 2017; 135(6): 573-83.
24- Budde MD, Xie M, Cross AH, Song SK. Axial Diffusivity is the Primary Correlate of Axonal Injury in the Experimental Autoimmune Encephalomyelitis Spinal Cord: A Quantitative Pixelwise Analysis. J Neurosci 2009; 29(9): 2805-13.
25- Song SK, Sun SW, Ju WK, Lin SJ, Cross AH, Neufeld AH. Diffusion Tensor Imaging Detects and Differentiates Axon and Myelin Degeneration in Mouse Optic Nerve after Retinal Ischemia. Neuroimage 2003; 20(3): 1714-22.
26- Tournier JD, Mori S, Leemans A. Diffusion Tensor Imaging and Beyond. Magn Reson Med 2011; 65(6): 1532.
27- Sun J, Li H, Liu J, Zhao J, Yuan D, Guo J, et al. The DTI Changes and Peripheral Blood Test Results Corroborate the Early Brain Damage of SIV-Infected Rhesus. Radiology of Infectious Diseases 2019; 6(1): 8-14.
1- Dekhil O, Hajjdiab H, Shalaby A, Ali MT, Ayinde B, Switala A, et al. Using Resting State Functional MRI to Build a Personalized Autism Diagnosis System. Plos One 2018; 13(10): E0206351.
2- Parmeggiani A, Corinaldesi A, Posar A. Early Features of Autism Spectrum Disorder: A Cross-Sectional Study. Italian J Pediatrics 2019; 45(1):1-8.
3- Wiggins L, Christensen D, Van Naarden Braun K, Martin L, Baio J. Comparison of Autism Spectrum Disorder Surveillance Status Based on two Different Diagnostic Schemes: Findings from the Metropolitan Atlanta Developmental Disabilities Surveillance Program, 2012. Plos One 2018; 13(11): E0208079.
4- Saad M, Islam SMR. Brain Connectivity Network Analysis and Classifications from Diffusion Tensor Imaging 2019 International Conference on Robotics. Electrical and Signal Processing Techniques (ICREST) 2019: 422-27.
5- Jou RJ, Jackowski AP, Papademetris X, Rajeevan N, Staib LH, Volkmar FR. Diffusion Tensor Imaging in Autism Spectrum Disorders: Preliminary Evidence of Abnormal Neural Connectivity. Australian & New Zealand J of Psychiatry 2011; 45(2): 153-62.
6- Fournier KA, Hass CJ, Naik SK, Lodha N, Cauraugh JH. Motor Coordination in Autism Spectrum Disorders: A Synthesis and Meta-Analysis. J Autism and Developmental Disorders 2010; 40(10): 1227-40.
7- Hanaie R, Mohri I, Kagitani-Shimono K, Tachibana M, Matsuzaki J, Watanabe Y, et al. Abnormal Corpus Callosum Connectivity, Socio-Communicative Deficits, And Motor Deficits in Children with Autism Spectrum Disorder: A Diffusion Tensor Imaging Study. J Autism and Developmental Disorders 2014; 44(9): 2209-20.
8- Frye RE, Vassall S, Kaur G, Lewis C, Karim M, Rossignol D. Emerging Biomarkers in Autism Spectrum Disorder: A Systematic Review. Ann Transl Med 2019; 7(23): 792.
9- Christensen DL, Braun KVN, Baio J, Bilder D, Charles J, Constantino JN, et al. Prevalence and Characteristics of Autism Spectrum Disorder among Children Aged 8 Years-Autism and Developmental Disabilities Monitoring Network, 11 Sites, United States, 2012. MMWR Surveillance Summaries 2018; 65(13): 1-23.
10- Xu G, Strathearn L, Liu B, O’Brien M, Kopelman TG, Zhu J, et al. Prevalence and Treatment Patterns of Autism Spectrum Disorder in the United States, 2016. JAMA Pediatrics 2019; 173(2): 153-9.
11- Castelli F, Frith C, Happé F, Frith U. Autism, Asperger Syndrome and Brain Mechanisms for the Attribution of Mental States to Animated Shapes. Brain 2002; 125(8): 1839-49.
12- Kennedy DP, Redcay E, Courchesne E. Failing to Deactivate: Resting Functional Abnormalities in Autism. Proceedings of the National Academy of Sci 2006; 103(21): 8275-80.
13- Just MA, Cherkassky VL, Keller TA, Minshew NJ. Cortical Activation and Synchronization During Sentence Comprehension in High-Functioning Autism: Evidence of Underconnectivity. Brain 2004; 127(8): 1811-21.
14- Villalobos ME, Mizuno A, Dahl BC, Kemmotsu N, Müller RA. Reduced Functional Connectivity Between V1 and Inferior Frontal Cortex Associated with Visuomotor Performance in Autism. Neuroimage 2005; 25(3): 916-25.
15- Ameis SH, Fan J, Rockel C, Voineskos AN, Lobaugh NJ, Soorya L, et al. Impaired Structural Connectivity of Socio-Emotional Circuits in Autism Spectrum Disorders: A Diffusion Tensor Imaging Study. Plos One 2011; 6(11): E28044.
16- Im WY, Ha JH, Kim EJ, Cheon KA, Cho J, Song DH. Impaired White Matter Integrity and Social Cognition in High-Function Autism: Diffusion Tensor Imaging Study. Psychiatry Investigation 2018; 15(3): 292-99.
17- Toossi MTB, Pourreza HR, Zare H, Sigari MH, Layegh P, Azimi A. An Effective Hair Removal Algorithm for Dermoscopy Images. Skin Res Technol 2013; 19(3): 230-5.
18- Bigham B, Zamanpour SA, Zemorshidi F, Boroumand F, Zare H, Initiative Asdn. Identification of Superficial White Matter Abnormalities in Alzheimer’s Disease and Mild Cognitive Impairment Using Diffusion Tensor Imaging. J Alzheimers Dis Rep 2020; 4(1): 49-59.
19- Rostami A, Naseri S, Momennezhad M, Zare H, Anvari K, Badkhor HS. Geometric Distortion Evaluation of Magnetic Resonance Images by a New Large Field of View Phantom for Magnetic Resonance Based Radiotherapy Purposes. International J Radiation Res 2020; 18(4): 733-42.
20- Churchill NW, Caverzasi E, Graham SJ, Hutchison MG, Schweizer TA. White Matter During Concussion Recovery: Comparing Diffusion Tensor Imaging (DTI) and Neurite Orientation Dispersion and Density Imaging (NODDI). Human Brain Mapping 2019; 40(6): 1908-18.
21- Westlye LT, Walhovd KB, Dale AM, Bjørnerud A, Due-Tønnessen P, Engvig A, et al. Life-Span Changes of the Human Brain White Matter: Diffusion Tensor Imaging (DTI) and Volumetry. Cereb Cortex 2010; 20(9): 2055-68.
22- Temur HO, Yurtsever I, Yesil G, Sharifov R, Yilmaz FT, Dundar TT, et al. Correlation Between DTI Findings and Volume of Corpus Callosum in Children with AUTISM. Curr Med Imaging 2019; 15(9): 895-9.
23- Nickel K, Tebartz Van Elst L, Perlov E, Endres D, Müller G, Riedel A, et al. Altered White Matter Integrity in Adults with Autism Spectrum Disorder and an IQ> 100: A Diffusion Tensor Imaging Study. Acta Psychiatr Scand 2017; 135(6): 573-83.
24- Budde MD, Xie M, Cross AH, Song SK. Axial Diffusivity is the Primary Correlate of Axonal Injury in the Experimental Autoimmune Encephalomyelitis Spinal Cord: A Quantitative Pixelwise Analysis. J Neurosci 2009; 29(9): 2805-13.
25- Song SK, Sun SW, Ju WK, Lin SJ, Cross AH, Neufeld AH. Diffusion Tensor Imaging Detects and Differentiates Axon and Myelin Degeneration in Mouse Optic Nerve after Retinal Ischemia. Neuroimage 2003; 20(3): 1714-22.
26- Tournier JD, Mori S, Leemans A. Diffusion Tensor Imaging and Beyond. Magn Reson Med 2011; 65(6): 1532.
27- Sun J, Li H, Liu J, Zhao J, Yuan D, Guo J, et al. The DTI Changes and Peripheral Blood Test Results Corroborate the Early Brain Damage of SIV-Infected Rhesus. Radiology of Infectious Diseases 2019; 6(1): 8-14.
28- Van Hecke W, Leemans A, Emsell L. DTI Analysis Methods: Voxel-Based Analysis. Diffusion Tensor Imaging: Springer; 2016: 183-203.
29- Le Bihan D. Looking Into the Functional Architecture of the Brain with Diffusion MRI. Nature Reviews Neuroscience 2003; 4(6): 469-80.
30- Tan X, Fang P, An J, Lin H, Liang Y, Shen W, et al. Micro-Structural White Matter Abnormalities in Type 2 Diabetic Patients: A DTI Study Using TBSS Analysis. Neuroradiology 2016; 58(12): 1209-16.
31- Wang K, Chen Z, Zhang F, Song Q, Hou C, Tang Y, et al. Evaluation of DTI Parameter Ratios and Diffusion Tensor Tractography Grading in the Diagnosis and Prognosis Prediction of Cervical Spondylotic Myelopathy. Spine 2017; 42(4): E202-E10.
32- Vignando M, Aiello M, Rinaldi A, Cattarruzza T, Mazzon G, Manganotti P, et al. Food Knowledge Depends Upon the Integrity of both Sensory and Functional Properties: A VBM, TBSS and DTI Tractography Study. Sci Rep 2019; 9(1): 7439.
33- Minshew NJ, Williams DL. The New Neurobiology of Autism: Cortex, Connectivity, And Neuronal Organization. Arch Neurol 2007; 64(7): 945-50.
34- Travers BG, Adluru N, Ennis C, Tromp DP, Destiche D, Doran S, et al. Diffusion Tensor Imaging in Autism Spectrum Disorder: A Review. Autism Res 2012; 5(5): 289-313.
35- Roland JL, Snyder AZ, Hacker CD, Mitra A, Shimony JS, Limbrick DD, et al. On the Role of the Corpus Callosum in Interhemispheric Functional Connectivity in Humans. Proc Natl Academy of Sci 2017; 114(50): 13278-83.
36- Song SK, Yoshino J, Le TQ, Lin SJ, Sun SW, Cross AH, et al. Demyelination Increases Radial Diffusivity in Corpus Callosum of Mouse Brain. Neuroimage 2005; 26(1): 132-40.
37- Bakhtiari R, Zürcher NR, Rogier O, Russo B, Hippolyte L, Granziera C, et al. Differences in White Matter Reflect Atypical Developmental Trajectory in Autism: A Tract-Based Spatial Statistics Study. Neuroimage Clin 2012; 1(1): 48-56.
38- Walker L, Gozzi M, Lenroot R, Thurm A, Behseta B, Swedo S, et al. Diffusion Tensor Imaging in Young Children with Autism: Biological Effects and Potential Confounds. Biol Psychiatry 2012; 72(12): 1043-51.
39- Shukla DK, Keehn B, Smylie DM, Müller RA. Microstructural Abnormalities of Short-Distance White Matter Tracts in Autism Spectrum Disorder. Neuropsychologia 2011; 49(5): 1378-82.
40- Barnea-Goraly N, Lotspeich LJ, Reiss AL. Similar White Matter Aberrations in Children with Autism and their Unaffected Siblings: A Diffusion Tensor Imaging Study Using Tract-Based Spatial Statistics. Arch Gen Psychiatry 2010; 67(10): 1052-60.
41- Langen M, Leemans A, Johnston P, Ecker C, Daly E, Murphy CM, et al. Fronto-Striatal Circuitry and Inhibitory Control in Autism: Findings from Diffusion Tensor Imaging Tractography. Cortex 2012; 48(2): 183-93.
42- Cheon KA, Kim YS, Oh SH, Park SY, Yoon HW, Herrington J, et al. Involvement of the Anterior Thalamic Radiation in Boys with High Functioning Autism Spectrum Disorders: A Diffusion Tensor Imaging Study. Brain Res 2011; 1417: 77-86.
43- Noriuchi M, Kikuchi Y, Yoshiura T, Kira R, Shigeto H, Hara T, et al. Altered White Matter Fractional Anisotropy and Social Impairment in Children with Autism Spectrum Disorder. Brain Res 2010; 1362: 141-9.
44- Wolff JJ, Gu H, Gerig G, Elison JT, Styner M, Gouttard S, et al. Differences in White Matter Fiber Tract Development Present From 6 to 24 Months iIn Infants with Autism. Am J Psychiatry 2012; 169(6): 589-600.
45- Travers BG, Tromp DP, Adluru N, Lange N, Destiche D, Ennis C, et al. Atypical Development of White Matter Microstructure of the Corpus Callosum in Males with Autism: A Longitudinal Investigation. Molecular Autism 2015; 6(1): 15.
46- Weinstein M, Ben‐Sira L, Levy Y, Zachor DA, Itzhak EB, Artzi M, et al. Abnormal White Matter Integrity in Young Children with Autism. Human Brain Mapping 2011; 32(4): 534-43.
47- Xiao Z, Qiu T, Ke X, Xiao X, Xiao T, Liang F, et al. Autism Spectrum Disorder as Early Neurodevelopmental Disorder: Evidence from the Brain Imaging Abnormalities in 2–3 Years Old Toddlers. J Autism Dev Disord 2014; 44(7): 1633-40.
48- Fingher N, Dinstein I, Ben-Shachar M, Haar S, Dale AM, Eyler L, et al. Toddlers Later Diagnosed with Autism Exhibit Multiple Structural Abnormalities in Temporal Corpus Callosum Fibers. Cortex 2017; 97: 291-305.
49- Hong S, Ke X, Tang T, Hang Y, Chu K, Huang H, et al. Detecting Abnormalities of Corpus Callosum Connectivity in Autism Using Magnetic Resonance Imaging and Diffusion Tensor Tractography. Psychiatry Res 2011; 194(3): 333-9.
50- Alexander AL, Lee JE, Lazar M, Boudos R, Dubray MB, Oakes TR, et al. Diffusion Tensor Imaging of the Corpus Callosum in Autism. Neuroimage 2007; 34(1): 61-73.
51- Thomas C, Humphreys K, Jung K-J, Minshew N, Behrmann M. The Anatomy of the Callosal and Visual-Association Pathways in High-Functioning Autism: A DTI Tractography Study. Cortex 2011; 47(7): 863-73.
52- Reyes NSDL, Bragg-Gonzalo L, Nieto M. Development and Plasticity of the Corpus Callosum. Development 2020; 147(18): dev189738.
53- Altieri R, Melcarne A, Junemann C, Zeppa P, Zenga F, Garbossa D, et al. Inferior Fronto-Occipital Fascicle Anatomy in Brain Tumor Surgeries: From Anatomy Lab to Surgical Theater. J Clin Neurosci 2019; 68: 290-4.
54- Kato Y, Kagitani-Shimono K, Matsuzaki J, Hanaie R, Yamamoto T, Tominaga K, et al. White Matter Tract-Cognitive Relationships in Children with High-Functioning Autism Spectrum Disorder. Psychiatry Investig 2019; 16(3): 220-33.
55- Bode MK, Mattila M-L, Kiviniemi V, Rahko J, Moilanen I, Ebeling H, et al. White Matter in Autism Spectrum Disorders–Evidence of Impaired Fiber Formation. Acta Radiol 2011; 52(10): 1169-74.
56- Jou R, Mateljevic N, Kaiser M, Sugrue D, Volkmar F, Pelphrey K. Structural Neural Phenotype of Autism: Preliminary Evidence from a Diffusion Tensor Imaging Study Using Tract-Based Spatial Statistics. AJNR Am J Neuroradiol 2011; 32(9): 1607-13.
57- Sahyoun CP, Belliveau JW, Mody M. White Matter Integrity and Pictorial Reasoning in High-Functioning Children with Autism. Brain Cogn 2010; 73(3): 180-8.
58- Sahyoun CP, Belliveau JW, Soulières I, Schwartz S, Mody M. Neuroimaging of the Functional and Structural Networks Underlying Visuospatial Vs. Neuropsychologia 2010; 48(1): 86-95.
59- Kumar A, Sundaram SK, Sivaswamy L, Behen ME, Makki MI, Ager J, et al. Alterations in Frontal Lobe Tracts and Corpus Callosum in Young Children with Autism Spectrum Disorder. Cerebral Cortex 2010; 20(9): 2103-13.
60- Catani M, Jones DK, Donato R, Ffytche DH. Occipito Temporal Connections in the Human Brain. Brain 2003; 126(Pt 9): 2093-107.
61- Catani M, Jones DK, Ffytche DH. Perisylvian Language Networks of the Human Brain. Ann Neurol 2005; 57(1): 8-16.
62- Bloemen OJ, Deeley Q, Sundram F, Daly EM, Barker GJ, Jones DK, et al. White Matter Integrity in Asperger Syndrome: A Preliminary Diffusion Tensor Magnetic Resonance Imaging Study in Adults. Autism Res 2010; 3(5): 203-13.
63- Herbet G, Zemmoura I, Duffau H. Functional Anatomy of the Inferior Longitudinal Fasciculus: from Historical Reports to Current Hypotheses. Frontiers in Neuroanat 2018; 12: 77.
64- Herbet G, Moritz-Gasser S, Lemaitre AL, Almairac F, Duffau H. Functional Compensation of the Left Inferior Longitudinal Fasciculus for Picture Naming. Cogn Neuropsychol 2019; 36(3-4): 140-57.
65- Aoki Y, Abe O, Nippashi Y, Yamasue H. Comparison of White Matter Integrity Between Autism Spectrum Disorder Subjects and Typically Developing Individuals: A Meta-Analysis of Diffusion Tensor Imaging Tractography Studies. Mol Autism 2013; 4(1): 25.
66- Groen WB, Buitelaar JK, Van Der Gaag RJ, Zwiers MP. Pervasive Microstructural Abnormalities in Autism: A DTI Study. J Psychiatry Neurosci 2011; 36(1): 32-40.
67- Pugliese L, Catani M, Ameis S, Dell'Acqua F, De Schotten MT, Murphy C, et al. The Anatomy of Extended Limbic Pathways in Asperger Syndrome: A Preliminary Diffusion Tensor Imaging Tractography Study. Neuroimage 2009; 47(2): 427-34.
68- Wang X, Pathak S, Stefaneanu L, Yeh FC, Li S, Fernandez-Miranda JC. Subcomponents and Connectivity of the Superior Longitudinal Fasciculus in the Human Brain. Brain Structure and Function 2016; 221(4): 2075-92.
69- Fitzgerald J, Leemans A, Kehoe E, O'Hanlon E, Gallagher L, Mcgrath J. Abnormal FrontoParietal White Matter Organisation in the Superior Longitudinal Fasciculus Branches in Autism Spectrum Disorders. Eur J Neurosci 2018; 47(6): 652-61.
70- Barnea-Goraly N, Kwon H, Menon V, Eliez S, Lotspeich L, Reiss AL. White Matter Structure in Autism: Preliminary Evidence from Diffusion Tensor Imaging. Biol Psychiatry 2004; 55(3): 323-6.
71- Cheung C, Chua S, Cheung V, Khong P, Tai K, Wong T, et al. White Matter Fractional Anisotrophy Differences and Correlates of Diagnostic Symptoms in Autism. J Child Psychol Psychiatry 2009; 50(9): 1102-12.
72- Poustka L, Jennen-Steinmetz C, Henze R, Vomstein K, Haffner J, Sieltjes B. Fronto-Temporal Disconnectivity and Symptom Severity in Children with Autism Spectrum Disorder. World J Biol Psychiatry 2012; 13(4): 269-80.
73- Billeci L, Calderoni S, Tosetti M, Catani M, Muratori F. White Matter Connectivity in Children with Autism Spectrum Disorders: A Tract-Based Spatial Statistics Study. BMC Neurology 2012; 12: 148.
74- Hau J, Sarubbo S, Houde JC, Corsini F, Girard G, Deledalle C, et al. Revisiting the Human Uncinate Fasciculus, Its Subcomponents and Asymmetries with Stem-Based Tractography and Microdissection Validation. Brain Struct Funct 2017; 222(4): 1645-62.
75- Bauer CM, Cattaneo Z, Merabet LB. Early Blindness is Associated with Increased Volume of the Uncinate Fasciculus. Eur J Neurosci 2018; 47(5): 427-32.
76- Samson AC, Dougherty RF, Lee IA, Phillips JM, Gross JJ, Hardan AY. White Matter Structure in the Uncinate Fasciculus: Implications for Socio-Affective Deficits in Autism Spectrum Disorder. Psychiatry Res Neuroimaging 2016; 255: 66-74.
77- Balconi M, Grippa E, Vanutelli ME. What Hemodynamic (Fnirs), Electrophysiological (EEG) and Autonomic Integrated Measures Can Tell Us About Emotional Processing. Brain and Cognition 2015; 95: 67-76.
78- Jeong J-W, Kumar A, Sundaram SK, Chugani HT, Chugani DC. Sharp Curvature of Frontal Lobe White Matter Pathways in Children with Autism Spectrum Disorders: Tract-Based Morphometry Analysis. American J Neuroradiology 2011; 32(9): 1600-6.
79- Vickers NJ. Animal Communication: When I’m Calling You, Will You Answer Too? Current Biology 2017; 27(14): R713-R5.
80- Pardini M, Garaci F, Bonzano L, Roccatagliata L, Palmieri M, Pompili E, et al. White Matter Reduced Streamline Coherence in Young Men with Autism and Mental Retardation. European J Neurology 2009; 16(11): 1185-90.
81- Bubb EJ, Metzler-Baddeley C, Aggleton JP. The Cingulum Bundle: Anatomy, Function, And Dysfunction. Neuroscience & Biobehavioral Reviews 2018; 92: 104-27.
82- Ameis SH, Fan J, Rockel C, Soorya L, Wang AT, Anagnostou E. Altered Cingulum Bundle Microstructure in Autism Spectrum Disorder. Acta Neuropsychiatrica 2013; 25(5): 275-82.
83- Li R, Ma Z, Yu J, He Y, Li J. Altered Local Activity and Functional Connectivity of the Anterior Cingulate Cortex in Elderly Individuals with Subthreshold Depression. Psychiatry Research: Neuroimaging 2014; 222(1-2): 29-36.
84- Lo YC, Soong WT, Gau SSF, Wu YY, Lai MC, Yeh FC, et al. The Loss of Asymmetry and Reduced Interhemispheric Connectivity in Adolescents with Autism: A Study Using Diffusion Spectrum Imaging Tractography. Psychiatry Research: Neuroimaging 2011; 192(1): 60-6.
85- Ikuta T, Shafritz KM, Bregman J, Peters BD, Gruner P, Malhotra AK, et al. Abnormal Cingulum Bundle Development in Autism: A Probabilistic Tractography Study. Psychiatry Research: Neuroimaging 2014; 221(1): 63-8.
86- Shackman AJ, Salomons TV, Slagter HA, Fox AS, Winter JJ, Davidson RJ. The Integration of Negative Affect, Pain and Cognitive Control in the Cingulate Cortex. Nature Reviews Neuroscience 2011; 12(3): 154-67.
87- Iidaka T, Kogata T, Mano Y, Komeda H. Thalamocortical Hyperconnectivity and Amygdala-Cortical Hypoconnectivity in Male Patients with Autism Spectrum Disorder. Frontiers in Psychiatry 2019; 10: 252.
88- Cardon GJ, Hepburn S, Rojas DC. Structural Covariance of Sensory Networks, The Cerebellum, and Amygdala in Autism Spectrum Disorder. Frontiers In Neurology 2017; 8: 615.
89- Chaddad A, Desrosiers C, Hassan L, Tanougast C. Hippocampus and Amygdala Radiomic Biomarkers for the Study of Autism Spectrum Disorder. BMC Neuroscience 2017; 18(1): 1-2.
90- Avino TA, Barger N, Vargas MV, Carlson EL, Amaral DG, Bauman MD, et al. Neuron Numbers Increase in the Human Amygdala from Birth to Adulthood, But Not in Autism. Proceedings of the National Academy of Sci 2018; 115(14): 3710-5.
91- Sato W, Kochiyama T, Uono S, Yoshimura S, Kubota Y, Sawada R, et al. Atypical Amygdala–Neocortex Interaction During Dynamic Facial Expression Processing in Autism Spectrum Disorder. Frontiers in Human Neuroscience 2019; 13: 351.
92- Tunç B, Yankowitz LD, Parker D, Alappatt JA, Pandey J, Schultz RT, et al. Deviation from Normative Brain Development is Associated with Symptom Severity in Autism Spectrum Disorder. Molecular Autism 2019; 10(1): 1-4.
93- Lee JE, Chung MK, Lazar M, Dubray MB, Kim J, Bigler ED, et al. A Study of Diffusion Tensor Imaging by Tissue-Specific, Smoothing-Compensated Voxel-Based Analysis. Neuroimage 2009; 44(3): 870-83.
94- Gibbard CR, Ren J, Skuse DH, Clayden JD, Clark CA. Structural Connectivity of the Amygdala in Young Adults with Autism Spectrum Disorder. Human Brain Mapping 2018; 39(3): 1270-82.
95- Rafal RD, Koller K, Bultitude JH, Mullins P, Ward R, Mitchell AS, et al. Connectivity between the Superior Colliculus and the Amygdala in Humans and Macaque Monkeys: Virtual Dissection with Probabilistic DTI Tractography. J Neurophysiology 2015; 114(3): 1947-62.
96- Chan AY, Urgun K, Tran DK, Kyong T, Hsu FP, Vadera S. Cerebral Peduncle Volume and Motor Function Following Adult Hemispherectomy. World Neurosurgery 2019; 126: 156-9.
97- Chen H, Hu Q, Raza HK, Singh S, Rai P, Zhu J, et al. An Analysis of Clinical Characteristics of Rare Bilateral Cerebral Peduncular Infarction. Frontiers in Neurology 2019; 10: 1107.
98- Di X, Azeez A, Li X, Haque E, Biswal BB. Disrupted Focal White Matter Integrity in Autism Spectrum Disorder: A Voxel-Based Meta-Analysis of Diffusion Tensor Imaging Studies. Progress in Neuro-Psychopharmacology and Biological Psychiatry 2018; 82: 242-8.
99- Sivaswamy L, Kumar A, Rajan D, Behen M, Muzik O, Chugani D, et al. A Diffusion Tensor Imaging Study of the Cerebellar Pathways in Children with Autism Spectrum Disorder. J Child Neurology 2010; 25(10): 1223-31.
100- Koyama T, Tsuji M, Nishimura H, Miyake H, Ohmura T, Domen K. Diffusion Tensor Imaging for Intracerebral Hemorrhage outcome Prediction: Comparison Using Data from the Corona Radiata/Internal Capsule and the Cerebral Peduncle. J Stroke and Cerebrovascular Dis 2013; 22(1): 72-9.
29- Le Bihan D. Looking Into the Functional Architecture of the Brain with Diffusion MRI. Nature Reviews Neuroscience 2003; 4(6): 469-80.
30- Tan X, Fang P, An J, Lin H, Liang Y, Shen W, et al. Micro-Structural White Matter Abnormalities in Type 2 Diabetic Patients: A DTI Study Using TBSS Analysis. Neuroradiology 2016; 58(12): 1209-16.
31- Wang K, Chen Z, Zhang F, Song Q, Hou C, Tang Y, et al. Evaluation of DTI Parameter Ratios and Diffusion Tensor Tractography Grading in the Diagnosis and Prognosis Prediction of Cervical Spondylotic Myelopathy. Spine 2017; 42(4): E202-E10.
32- Vignando M, Aiello M, Rinaldi A, Cattarruzza T, Mazzon G, Manganotti P, et al. Food Knowledge Depends Upon the Integrity of both Sensory and Functional Properties: A VBM, TBSS and DTI Tractography Study. Sci Rep 2019; 9(1): 7439.
33- Minshew NJ, Williams DL. The New Neurobiology of Autism: Cortex, Connectivity, And Neuronal Organization. Arch Neurol 2007; 64(7): 945-50.
34- Travers BG, Adluru N, Ennis C, Tromp DP, Destiche D, Doran S, et al. Diffusion Tensor Imaging in Autism Spectrum Disorder: A Review. Autism Res 2012; 5(5): 289-313.
35- Roland JL, Snyder AZ, Hacker CD, Mitra A, Shimony JS, Limbrick DD, et al. On the Role of the Corpus Callosum in Interhemispheric Functional Connectivity in Humans. Proc Natl Academy of Sci 2017; 114(50): 13278-83.
36- Song SK, Yoshino J, Le TQ, Lin SJ, Sun SW, Cross AH, et al. Demyelination Increases Radial Diffusivity in Corpus Callosum of Mouse Brain. Neuroimage 2005; 26(1): 132-40.
37- Bakhtiari R, Zürcher NR, Rogier O, Russo B, Hippolyte L, Granziera C, et al. Differences in White Matter Reflect Atypical Developmental Trajectory in Autism: A Tract-Based Spatial Statistics Study. Neuroimage Clin 2012; 1(1): 48-56.
38- Walker L, Gozzi M, Lenroot R, Thurm A, Behseta B, Swedo S, et al. Diffusion Tensor Imaging in Young Children with Autism: Biological Effects and Potential Confounds. Biol Psychiatry 2012; 72(12): 1043-51.
39- Shukla DK, Keehn B, Smylie DM, Müller RA. Microstructural Abnormalities of Short-Distance White Matter Tracts in Autism Spectrum Disorder. Neuropsychologia 2011; 49(5): 1378-82.
40- Barnea-Goraly N, Lotspeich LJ, Reiss AL. Similar White Matter Aberrations in Children with Autism and their Unaffected Siblings: A Diffusion Tensor Imaging Study Using Tract-Based Spatial Statistics. Arch Gen Psychiatry 2010; 67(10): 1052-60.
41- Langen M, Leemans A, Johnston P, Ecker C, Daly E, Murphy CM, et al. Fronto-Striatal Circuitry and Inhibitory Control in Autism: Findings from Diffusion Tensor Imaging Tractography. Cortex 2012; 48(2): 183-93.
42- Cheon KA, Kim YS, Oh SH, Park SY, Yoon HW, Herrington J, et al. Involvement of the Anterior Thalamic Radiation in Boys with High Functioning Autism Spectrum Disorders: A Diffusion Tensor Imaging Study. Brain Res 2011; 1417: 77-86.
43- Noriuchi M, Kikuchi Y, Yoshiura T, Kira R, Shigeto H, Hara T, et al. Altered White Matter Fractional Anisotropy and Social Impairment in Children with Autism Spectrum Disorder. Brain Res 2010; 1362: 141-9.
44- Wolff JJ, Gu H, Gerig G, Elison JT, Styner M, Gouttard S, et al. Differences in White Matter Fiber Tract Development Present From 6 to 24 Months iIn Infants with Autism. Am J Psychiatry 2012; 169(6): 589-600.
45- Travers BG, Tromp DP, Adluru N, Lange N, Destiche D, Ennis C, et al. Atypical Development of White Matter Microstructure of the Corpus Callosum in Males with Autism: A Longitudinal Investigation. Molecular Autism 2015; 6(1): 15.
46- Weinstein M, Ben‐Sira L, Levy Y, Zachor DA, Itzhak EB, Artzi M, et al. Abnormal White Matter Integrity in Young Children with Autism. Human Brain Mapping 2011; 32(4): 534-43.
47- Xiao Z, Qiu T, Ke X, Xiao X, Xiao T, Liang F, et al. Autism Spectrum Disorder as Early Neurodevelopmental Disorder: Evidence from the Brain Imaging Abnormalities in 2–3 Years Old Toddlers. J Autism Dev Disord 2014; 44(7): 1633-40.
48- Fingher N, Dinstein I, Ben-Shachar M, Haar S, Dale AM, Eyler L, et al. Toddlers Later Diagnosed with Autism Exhibit Multiple Structural Abnormalities in Temporal Corpus Callosum Fibers. Cortex 2017; 97: 291-305.
49- Hong S, Ke X, Tang T, Hang Y, Chu K, Huang H, et al. Detecting Abnormalities of Corpus Callosum Connectivity in Autism Using Magnetic Resonance Imaging and Diffusion Tensor Tractography. Psychiatry Res 2011; 194(3): 333-9.
50- Alexander AL, Lee JE, Lazar M, Boudos R, Dubray MB, Oakes TR, et al. Diffusion Tensor Imaging of the Corpus Callosum in Autism. Neuroimage 2007; 34(1): 61-73.
51- Thomas C, Humphreys K, Jung K-J, Minshew N, Behrmann M. The Anatomy of the Callosal and Visual-Association Pathways in High-Functioning Autism: A DTI Tractography Study. Cortex 2011; 47(7): 863-73.
52- Reyes NSDL, Bragg-Gonzalo L, Nieto M. Development and Plasticity of the Corpus Callosum. Development 2020; 147(18): dev189738.
53- Altieri R, Melcarne A, Junemann C, Zeppa P, Zenga F, Garbossa D, et al. Inferior Fronto-Occipital Fascicle Anatomy in Brain Tumor Surgeries: From Anatomy Lab to Surgical Theater. J Clin Neurosci 2019; 68: 290-4.
54- Kato Y, Kagitani-Shimono K, Matsuzaki J, Hanaie R, Yamamoto T, Tominaga K, et al. White Matter Tract-Cognitive Relationships in Children with High-Functioning Autism Spectrum Disorder. Psychiatry Investig 2019; 16(3): 220-33.
55- Bode MK, Mattila M-L, Kiviniemi V, Rahko J, Moilanen I, Ebeling H, et al. White Matter in Autism Spectrum Disorders–Evidence of Impaired Fiber Formation. Acta Radiol 2011; 52(10): 1169-74.
56- Jou R, Mateljevic N, Kaiser M, Sugrue D, Volkmar F, Pelphrey K. Structural Neural Phenotype of Autism: Preliminary Evidence from a Diffusion Tensor Imaging Study Using Tract-Based Spatial Statistics. AJNR Am J Neuroradiol 2011; 32(9): 1607-13.
57- Sahyoun CP, Belliveau JW, Mody M. White Matter Integrity and Pictorial Reasoning in High-Functioning Children with Autism. Brain Cogn 2010; 73(3): 180-8.
58- Sahyoun CP, Belliveau JW, Soulières I, Schwartz S, Mody M. Neuroimaging of the Functional and Structural Networks Underlying Visuospatial Vs. Neuropsychologia 2010; 48(1): 86-95.
59- Kumar A, Sundaram SK, Sivaswamy L, Behen ME, Makki MI, Ager J, et al. Alterations in Frontal Lobe Tracts and Corpus Callosum in Young Children with Autism Spectrum Disorder. Cerebral Cortex 2010; 20(9): 2103-13.
60- Catani M, Jones DK, Donato R, Ffytche DH. Occipito Temporal Connections in the Human Brain. Brain 2003; 126(Pt 9): 2093-107.
61- Catani M, Jones DK, Ffytche DH. Perisylvian Language Networks of the Human Brain. Ann Neurol 2005; 57(1): 8-16.
62- Bloemen OJ, Deeley Q, Sundram F, Daly EM, Barker GJ, Jones DK, et al. White Matter Integrity in Asperger Syndrome: A Preliminary Diffusion Tensor Magnetic Resonance Imaging Study in Adults. Autism Res 2010; 3(5): 203-13.
63- Herbet G, Zemmoura I, Duffau H. Functional Anatomy of the Inferior Longitudinal Fasciculus: from Historical Reports to Current Hypotheses. Frontiers in Neuroanat 2018; 12: 77.
64- Herbet G, Moritz-Gasser S, Lemaitre AL, Almairac F, Duffau H. Functional Compensation of the Left Inferior Longitudinal Fasciculus for Picture Naming. Cogn Neuropsychol 2019; 36(3-4): 140-57.
65- Aoki Y, Abe O, Nippashi Y, Yamasue H. Comparison of White Matter Integrity Between Autism Spectrum Disorder Subjects and Typically Developing Individuals: A Meta-Analysis of Diffusion Tensor Imaging Tractography Studies. Mol Autism 2013; 4(1): 25.
66- Groen WB, Buitelaar JK, Van Der Gaag RJ, Zwiers MP. Pervasive Microstructural Abnormalities in Autism: A DTI Study. J Psychiatry Neurosci 2011; 36(1): 32-40.
67- Pugliese L, Catani M, Ameis S, Dell'Acqua F, De Schotten MT, Murphy C, et al. The Anatomy of Extended Limbic Pathways in Asperger Syndrome: A Preliminary Diffusion Tensor Imaging Tractography Study. Neuroimage 2009; 47(2): 427-34.
68- Wang X, Pathak S, Stefaneanu L, Yeh FC, Li S, Fernandez-Miranda JC. Subcomponents and Connectivity of the Superior Longitudinal Fasciculus in the Human Brain. Brain Structure and Function 2016; 221(4): 2075-92.
69- Fitzgerald J, Leemans A, Kehoe E, O'Hanlon E, Gallagher L, Mcgrath J. Abnormal FrontoParietal White Matter Organisation in the Superior Longitudinal Fasciculus Branches in Autism Spectrum Disorders. Eur J Neurosci 2018; 47(6): 652-61.
70- Barnea-Goraly N, Kwon H, Menon V, Eliez S, Lotspeich L, Reiss AL. White Matter Structure in Autism: Preliminary Evidence from Diffusion Tensor Imaging. Biol Psychiatry 2004; 55(3): 323-6.
71- Cheung C, Chua S, Cheung V, Khong P, Tai K, Wong T, et al. White Matter Fractional Anisotrophy Differences and Correlates of Diagnostic Symptoms in Autism. J Child Psychol Psychiatry 2009; 50(9): 1102-12.
72- Poustka L, Jennen-Steinmetz C, Henze R, Vomstein K, Haffner J, Sieltjes B. Fronto-Temporal Disconnectivity and Symptom Severity in Children with Autism Spectrum Disorder. World J Biol Psychiatry 2012; 13(4): 269-80.
73- Billeci L, Calderoni S, Tosetti M, Catani M, Muratori F. White Matter Connectivity in Children with Autism Spectrum Disorders: A Tract-Based Spatial Statistics Study. BMC Neurology 2012; 12: 148.
74- Hau J, Sarubbo S, Houde JC, Corsini F, Girard G, Deledalle C, et al. Revisiting the Human Uncinate Fasciculus, Its Subcomponents and Asymmetries with Stem-Based Tractography and Microdissection Validation. Brain Struct Funct 2017; 222(4): 1645-62.
75- Bauer CM, Cattaneo Z, Merabet LB. Early Blindness is Associated with Increased Volume of the Uncinate Fasciculus. Eur J Neurosci 2018; 47(5): 427-32.
76- Samson AC, Dougherty RF, Lee IA, Phillips JM, Gross JJ, Hardan AY. White Matter Structure in the Uncinate Fasciculus: Implications for Socio-Affective Deficits in Autism Spectrum Disorder. Psychiatry Res Neuroimaging 2016; 255: 66-74.
77- Balconi M, Grippa E, Vanutelli ME. What Hemodynamic (Fnirs), Electrophysiological (EEG) and Autonomic Integrated Measures Can Tell Us About Emotional Processing. Brain and Cognition 2015; 95: 67-76.
78- Jeong J-W, Kumar A, Sundaram SK, Chugani HT, Chugani DC. Sharp Curvature of Frontal Lobe White Matter Pathways in Children with Autism Spectrum Disorders: Tract-Based Morphometry Analysis. American J Neuroradiology 2011; 32(9): 1600-6.
79- Vickers NJ. Animal Communication: When I’m Calling You, Will You Answer Too? Current Biology 2017; 27(14): R713-R5.
80- Pardini M, Garaci F, Bonzano L, Roccatagliata L, Palmieri M, Pompili E, et al. White Matter Reduced Streamline Coherence in Young Men with Autism and Mental Retardation. European J Neurology 2009; 16(11): 1185-90.
81- Bubb EJ, Metzler-Baddeley C, Aggleton JP. The Cingulum Bundle: Anatomy, Function, And Dysfunction. Neuroscience & Biobehavioral Reviews 2018; 92: 104-27.
82- Ameis SH, Fan J, Rockel C, Soorya L, Wang AT, Anagnostou E. Altered Cingulum Bundle Microstructure in Autism Spectrum Disorder. Acta Neuropsychiatrica 2013; 25(5): 275-82.
83- Li R, Ma Z, Yu J, He Y, Li J. Altered Local Activity and Functional Connectivity of the Anterior Cingulate Cortex in Elderly Individuals with Subthreshold Depression. Psychiatry Research: Neuroimaging 2014; 222(1-2): 29-36.
84- Lo YC, Soong WT, Gau SSF, Wu YY, Lai MC, Yeh FC, et al. The Loss of Asymmetry and Reduced Interhemispheric Connectivity in Adolescents with Autism: A Study Using Diffusion Spectrum Imaging Tractography. Psychiatry Research: Neuroimaging 2011; 192(1): 60-6.
85- Ikuta T, Shafritz KM, Bregman J, Peters BD, Gruner P, Malhotra AK, et al. Abnormal Cingulum Bundle Development in Autism: A Probabilistic Tractography Study. Psychiatry Research: Neuroimaging 2014; 221(1): 63-8.
86- Shackman AJ, Salomons TV, Slagter HA, Fox AS, Winter JJ, Davidson RJ. The Integration of Negative Affect, Pain and Cognitive Control in the Cingulate Cortex. Nature Reviews Neuroscience 2011; 12(3): 154-67.
87- Iidaka T, Kogata T, Mano Y, Komeda H. Thalamocortical Hyperconnectivity and Amygdala-Cortical Hypoconnectivity in Male Patients with Autism Spectrum Disorder. Frontiers in Psychiatry 2019; 10: 252.
88- Cardon GJ, Hepburn S, Rojas DC. Structural Covariance of Sensory Networks, The Cerebellum, and Amygdala in Autism Spectrum Disorder. Frontiers In Neurology 2017; 8: 615.
89- Chaddad A, Desrosiers C, Hassan L, Tanougast C. Hippocampus and Amygdala Radiomic Biomarkers for the Study of Autism Spectrum Disorder. BMC Neuroscience 2017; 18(1): 1-2.
90- Avino TA, Barger N, Vargas MV, Carlson EL, Amaral DG, Bauman MD, et al. Neuron Numbers Increase in the Human Amygdala from Birth to Adulthood, But Not in Autism. Proceedings of the National Academy of Sci 2018; 115(14): 3710-5.
91- Sato W, Kochiyama T, Uono S, Yoshimura S, Kubota Y, Sawada R, et al. Atypical Amygdala–Neocortex Interaction During Dynamic Facial Expression Processing in Autism Spectrum Disorder. Frontiers in Human Neuroscience 2019; 13: 351.
92- Tunç B, Yankowitz LD, Parker D, Alappatt JA, Pandey J, Schultz RT, et al. Deviation from Normative Brain Development is Associated with Symptom Severity in Autism Spectrum Disorder. Molecular Autism 2019; 10(1): 1-4.
93- Lee JE, Chung MK, Lazar M, Dubray MB, Kim J, Bigler ED, et al. A Study of Diffusion Tensor Imaging by Tissue-Specific, Smoothing-Compensated Voxel-Based Analysis. Neuroimage 2009; 44(3): 870-83.
94- Gibbard CR, Ren J, Skuse DH, Clayden JD, Clark CA. Structural Connectivity of the Amygdala in Young Adults with Autism Spectrum Disorder. Human Brain Mapping 2018; 39(3): 1270-82.
95- Rafal RD, Koller K, Bultitude JH, Mullins P, Ward R, Mitchell AS, et al. Connectivity between the Superior Colliculus and the Amygdala in Humans and Macaque Monkeys: Virtual Dissection with Probabilistic DTI Tractography. J Neurophysiology 2015; 114(3): 1947-62.
96- Chan AY, Urgun K, Tran DK, Kyong T, Hsu FP, Vadera S. Cerebral Peduncle Volume and Motor Function Following Adult Hemispherectomy. World Neurosurgery 2019; 126: 156-9.
97- Chen H, Hu Q, Raza HK, Singh S, Rai P, Zhu J, et al. An Analysis of Clinical Characteristics of Rare Bilateral Cerebral Peduncular Infarction. Frontiers in Neurology 2019; 10: 1107.
98- Di X, Azeez A, Li X, Haque E, Biswal BB. Disrupted Focal White Matter Integrity in Autism Spectrum Disorder: A Voxel-Based Meta-Analysis of Diffusion Tensor Imaging Studies. Progress in Neuro-Psychopharmacology and Biological Psychiatry 2018; 82: 242-8.
99- Sivaswamy L, Kumar A, Rajan D, Behen M, Muzik O, Chugani D, et al. A Diffusion Tensor Imaging Study of the Cerebellar Pathways in Children with Autism Spectrum Disorder. J Child Neurology 2010; 25(10): 1223-31.
100- Koyama T, Tsuji M, Nishimura H, Miyake H, Ohmura T, Domen K. Diffusion Tensor Imaging for Intracerebral Hemorrhage outcome Prediction: Comparison Using Data from the Corona Radiata/Internal Capsule and the Cerebral Peduncle. J Stroke and Cerebrovascular Dis 2013; 22(1): 72-9.
نوع مطالعه: مروری |
موضوع مقاله:
فیزیک پزشکی
دریافت: 1399/9/11 | پذیرش: 1399/12/10 | انتشار: 1400/3/10
دریافت: 1399/9/11 | پذیرش: 1399/12/10 | انتشار: 1400/3/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







