دوره 29، شماره 11 - ( بهمن 1400 )
جلد 29 شماره 11 صفحات 4280-4268 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Rezvan H, Hamoon Navard S, Akhzari S. Comparison of Pro-inflammatory Gene Expression Profile in Spleen and Peripheral Blood Neutrophils of BALB/C Mice Infected with Leishmania Major. JSSU 2022; 29 (11) :4268-4280
URL: http://jssu.ssu.ac.ir/article-1-5293-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5293-fa.html
رضوان حسین، هاموننورد سحر، اخزری سهیلا. مقایسه الگوی بیان ژن های پیش التهابی در نوتروفیل های خون محیطی و طحال موش های BALB/c آلوده به لیشمانیا ماژور. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (11) :4268-4280
متن کامل [PDF 868 kb]
(779 دریافت)
| چکیده (HTML) (2212 مشاهده)
متن کامل: (1753 مشاهده)
مقدمه
بیماری لیشمانیوز جلدی یا سالک یکی از بیماریهای مشترک بین انسان و دام است و بعد از مالاریا بهعنوان یک معضل بهداشتی در جهان مورد توجه قرار گرفته است. عامل این بیماری، تکیاختهای از گروه تاژکداران خانواده تریپانوزوماتیده و جنس لیشمانیا است که بهوسیله نیش پشههای ناقل گونههای فلبوتوموس به انسان منتقل میشود. علایم این بیماری به صورت زخمهایی خشک یا مرطوب ظاهر میشوند که بعضاً ممکن است تا یک سال روی نقاطی از بدن از جمله دست، پا و صورت باقی بمانند. هم اکنون تعداد افراد مبتلا به این بیماری در جهان به بیش از 12 میلیون مورد رسیده که این تعداد با وقوع بیماریهایی مانند ایدز و بحرانهای اجتماعی در مناطق آلوده در دهه¬های اخیر در حال افزایش بوده است (1). در ایران حدود پانزده هزار نفر سالانه به سالک مبتلا میشوند و بر اساس تحقیقات موجود، میزان واقعی موارد آن 4 تا 5 برابر میزانی است که گزارش می¬شود به نحوی که میزان بروز بیماری در ایران 28 در هر هزار نفر جمعیت تخمین زده میشود (2). درمانهای رایج در این بیماری استفاده از ترکیبات پنج ظرفیتی آنتیموان (پنتوستام و گلوکانتیم) است گرچه علیرغم تلاشهای فراوان، تاکنون کنترل بیماری چندان موفقیتآمیز نبوده و درمان آن نیز در عمل با مشکلات متعددی ازجمله عدم پاسخ به درمان به علت مقاومت دارویی مواجه بوده است؛ به همین دلیل در سالهای اخیر سازمان جهانی بهداشت بیماری لیشمانیوز را به عنوان یک بیماری گرمسیری فراموش شده مطرح کرده است (3). یافتههای ایمنی شناسی در لیشمانیوز عمدتاً از طریق مطالعه بر روی مدلهای حیوانی با استفاده از نژادهای خالص موش بهدست آمده است. این یافتهها نشان دادهاند که مقاومت به عفونت لیشمانیا بهطور مشخصی با فعالیت لنفوسیتهای Th1 ارتباط دارد (4). در این راستا، سلامت سیستم ایمنی میزبان و نیز گونه انگل در سیر بیماری تعیینکننده میباشند (5). مطالعات مختلف نشان دادهاند که برای کنترل عفونت لیشمانیایی در میزبان، بهوجود آمدن ایمنی سلولی مؤثر که قادر به فعال کردن ماکروفاژها باشد، مورد نیاز است (5). با وجود این که پردازش و ارائه آنتیژن توسط ماکروفاها صورت میگیرد ولی ایجاد پاسخ ایمنی به عهده لنفوسیتهایی است که در اعضایی مانند طحال و عقده¬های لنفاوی حضور دارند (6). پژوهشها نشان داده است که ژنهای پیش التهابی نقش مهمی در چگونگی فعال شدن سیستم ایمنی و در نهایت از بین بردن عفونت لیشمانیایی به عهده دارند. فعال شدن ماکروفاژها توسط سایتوکاین IFN-γ صورت میگیرد. مکانیسم اصلی برای از بین بردن انگل در این سلولها، تولید رادیکالهای آزاد اکسیژن و نیتریک اکسید است. به علاوه، IFN-γ که از لنفوسیتهای T آزاد میشود تولید TNF-α را در ماکروفاژها تحریک میکند. بنابراین TNF-α واسطه شیمیایی در هر دو نوع پاسخ ایمنی ذاتی و اکتسابی و عامل ارتباطی مهم بین پاسخهای ایمنی اکتسابی و التهاب حاد است (6). پژوهشها نشان داده است که بهبود عفونت ناشی از لیشمانیا در موشهای مقاوم نظیرC57BL/6 ، در نتیجۀ تولید سایتوکاینهای فعال کننده ماکروفاژها بهخصوص IFN-γ بوده که شاخصۀ پاسخ ایمنی Th1 است. نابودی انگلهای درون ماکروفاژ از طریق افزایش فعالیت ماکروفاژها و در نتیجه افزایش تولید نیتریک اکساید صورت میگیرد. در مقابل، حساسیت موش BALB/c به عفونت ناشی از لیشمانیا به علت تولید سایتوکاینهای مهار کننده فعالیت ماکروفاژها نظیر IL-4 و IL-10 بوده که از مشخصههای پاسخ Th2 است (7). در پژوهشهای قبلی نشان داده شده است که نوتروفیلها نقش مهمی در شناسایی، دریافت و انتقال انگل لیشمانیا به داخل ماکروفاژها دارند که این انتقال در روند پاتولوژی بیماری مؤثر است. از طرفی در موشهای BALB/c، گسترش بیماری لیشمانیوز جلدی همواره با ورود انگل به طحال همراه بوده و نهایتا منجر به مرگ حیوان میگردد. بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی در بیماری لیشمانیازیس در پژوهشهای قبلی ما نشان داده شده است (8). از طرفی با توجه به بررسی محققان در زمینه اهمیت نوتروفیلها در کنترل عفونت لیشمانیا ماژور و توانایی این انگل در ممانعت از فرآیند هضم توسط نوتروفیل با داشتن آنزیم اندونوکلئاز، بررسی بیان پروفایل سایتوکاینی شاخص در این سلولها میتواند در پیشبرد و دستیابی به نقش مهم سلولهای ایمنی ذاتی و عوامل مترشحه از این سلولها در کنترل عفونت لیشمانیا مهم بوده (9) و حتی طبق بررسی محققان، نوع گونه لیشمانیا نیز میتواند بر عملکرد و نحوه برخورد نوتروفیلها موثر باشد (10). اما بیان ژنهای پیش التهابی در طحال و مقایسه الگوی بیان این ژنها در طحال با بیان این ژنها در نوتروفیلهای خون محیطی در بیماری لیشمانیازیس تا به حال مورد بحث قرار نگرفته است. لذا در این پژوهش ارتباط بین بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی و طحال موشهای BALB/c آلوده به لیشمانیا در شرایط بدون درمان و درمان شده با داروی گلوکانتیم مورد ارزیابی و مقایسه قرار گرفت.
روش بررسی
انگل لیشمانیا
سوش وحشی انگل لیشمانیا ماژور MHOM/76/IR))، از مرکز تحقیقات بیوتکنولوژی انستیتو پاستور ایران تهیه و در محیط RPMI حاوی 10% سرم جنین گوساله در دمای C° 25 کشت داده شد.
تلقیح انگل
موشهای بالغ ماده BALB/c با سن 8 تا 12 هفته از بخش پرورش حیوانات آزمایشگاهی انستیتو پاستور ایران خریداری و بهصورت کاملاً تصادفی به دو گروه 10 تایی تقسیم شدند. انگل لیشمانیا در پاساژهای 2-4 به تعداد 2 میلیون در 100 میکرولیتر به هر موش و بهصورت داخل جلدی در ناحیه قاعده دم تزریق گردید (6). هیچگونه درمانی در موشهای گروه کنترل انجام نشد ولی موشهای گروه دوم تحت درمان 30 میلیگرم بر کیلوگرم وزن بدن داروی استاندارد (گلوکانتیم) بهصورت روزانه و به شکل تزریق در محل زخم قرار گرفتند.
جداسازی نوتروفیل
برای جداسازی نوتروفیل میزان 1 میلیلیتر خون با مقدار مساوی سرم فیزیولوژی رقیق گردید. جهت ایجاد شیب غلظت جهت جداسازی سلول طبق توصیه پروتکل منبع اشاره شده از داروی مگلومین کامپاند 76% (شرکت دارو پخش) استفاده شد. برای آمادهسازی مگلومین، این دارو به نسبت حجمی 3 به 1 با سرم فیزیولوژی مخلوط گردید و خون رقیقشده به آن اضافه شد. پس از سانتریفیوژ (g 1000 به مدت 15 دقیقه)، مایع رویی تخلیه و محلول ته لوله با حرکات دورانی و اضافه کردن 400 میلیلیتر سرم فیزیولوژی همگن و سپس ورتکس گردید. برای لیز کردن گلبولهای قرمز 10 میلیلیتر آب مقطر سرد و 5 میلیلیتر سرم فیزیولوژی 2/55% به 1 میلیلیتر نمونه اضافه و نمونهها سانتریفیوژ (g 1000 به مدت 5 دقیقه) شدند؛ این مرحله تا جایی که محلول رویی کاملاً شفاف و فاقد گلبول قرمز باشد، تکرار شد. سپس تعداد نوتروفیلها با روش متیلنبلو شمارش گردیده و سلولهای جدا شده (/ml 106×4) برای انجام آزمایش RT-PCR مورد استفاده قرار گرفتند (11).
نمونهگیری
پس از ایجاد زخم لیشمانیا در موشهای آلوده از هر دو گروه، نمونهگیری از طحال و خون به منظور بررسی ژنهای پیش التهابی در سه مرحله انجام شد؛ اولین نمونهگیری قبل از شروع درمان و سپس نمونههای بعدی در پایان هفته دوم و هفته چهارم اخذ گردید. جهت مقایسه و بهعنوان کنترل دوم، نمونههای خون و طحال از موشهای سالم نیز اخذ گردید. نمونهها بلافاصله در دمای C°80- قرار داده و تا زمان آزمایش در این دما نگهداری گردیدند.
طراحی پرایمر
جهت ارزیابی صحت PCR، بیان ژن کنترل GAPDH برای تمام نمونهها ارزیابی شد و ژنهای مورد مطالعه عبارت بودند از: IL-12p40، IL-12p35، IL-1β، IL-1α، CCR5، CCL5/RANTES، CCL4/MIP-1β، CCL3/MIP-1α، IFN-γ وTNF-α که پس از یافتن توالی ژنها در بانک ژنی، با استفاده از نرم افزار طراحی پرایمر در سایت NCBI پرایمر مناسب برای هر ژن طراحی گردید. توالی کلیه پرایمرهای مورد استفاده در جدول 1 آورده شده است.
جدول 1: توالی پرایمرهای مورد استفاده برای تشخیص ژنهای پیش التهاب

استخراج RNA
استخراج RNA با کیت تجاری استخراج RNA توتال (شرکت دنا زیست) و طبق دستورالعمل شرکت سازنده انجام شد. برای جداسازی RNA از طحال، 50 میلی¬گرم از بافت طحال در حمام اولتراسونیک هموژنیزه شده و 1 میلیلیتر از محلول G1 موجود در کیت به آن اضافه و پیپیتنگ گردید. میکروتیوب در دمای اتاق به مدت 5 دقیقه انکوبه شد و سپس با دور g 1200 به مدت 15 دقیقه سانتریفوژ گردید. در مرحلۀ بعد، مایع رویی به میکروتیوب جدید منتقل شده و پس از اضافه شدن 200 میکرولیتر کلروفروم به آن، به مدت 3 دقیقه در دمای اتاق انکوبه شد. در مرحله بعد میکروتیوبها به مدت 15 دقیقه با دور g 1200 سانتریفوژ شده و لایه رویی به میکروتیوب جدید منتقل گردید. پس از اضافه شدن همان میزان ایزوپروپانول و محلول G2 موجود در کیت و پپیتنگ، به مدت 10 دقیقه در دمای اتاق نگه¬داری شده و سپس میکروتیوب به مدت 10 دقیقه با دور g 10000 سانتریفوژ گردید و پس از حذف مایع رویی، مقدار 1 میلیلیتر اتانول70% به آن اضافه و پس از هم زدن، مجدداً به مدت 5 دقیقه با دور g10000 سانتریفوژ گردید. سپس مایع رویی کاملاً تخلیه شده و میکروتیوب در دمای آزمایشگاه تا خشک شدن محتویات قرار گرفت. در مرحله آخر 100 میکرولیتر آب مقطر دیونیزه به میکروتیوب اضافه گردید. برای استخراج RNA از نوتروفیل، ابتدا مقدار 1 میلیلیتر خون به لوله آزمایش حاوی ماده ضد انعقاد منتقل و نوتروفیلهای جدا شده با روش بالا، RNA از آنها استخراج گردید.
سنتز cDNA
تبدیل RNAبه cDNA با استفاده از کیت تجاری شرکت سینا کلون انجام پذیرفت. ابتدا برای جلوگیری از تولید محصول PCR ازDNA ژنومی سلول، فراوردهRNA با آنزیمDNase تیمار و آلودگی احتمالی DNA حذف گردید. سپس کیفیت و کمیت محصول با استفاده از ژل الکتروفورز و مورد بررسی قرار گرفته و در یک میکروتیوب به ترتیب 1 میکرولیتر پرایمر Oligo-dT، µl 1 مخلوط dNTPs و 10 میکرولیتر RNA استخراجی اضافه شد. میکروتیوب پس از قرارگرفتن در دمای °C 65 به مدت 5 دقیقه و سانتریفوژ با دور g1200 به مدت 2 دقیقه، در کنار یخ قرار گرفت. در یک میکروتیوب جدید 2 میکرولیتر بافر 10X و 100 واحدReverse Transcriptase M-MuLV اضافه شد. سپس حجم مخلوط با آب مقطر به 10 میکرولیتر رسانده شده و به میکروتیوب اول اضافه شد. پس از قرار گرفتن در دمای °C 42 به مدت 60 دقیقه و سپس در دمای °C85 به مدت 5 دقیقه، میکروتیوب در کنار یخ قرار گرفته و cDNA تهیه شده به فریزر منتقل گردید.
PCR
برای انجام واکنش PCR، 37/5 میکرولیتر آب مقطر دیونیزه دو بار تقطیر، 5 میکرولیتر بافر X10PCR، 1/5میکرولیتر MgCl2 0/8 میکرولیتر dNTP، 0/25 میکرولیتر آنزیم تگ پلیمراز، 1 میکرولیترcDNA و 2 میکرولیتر از هر یک از پرایمرهای Forward و Reverse برای ژنهای پیش التهابی (به صورت جداگانه) به هر میکروتیوب اضافه شد (حجم کل هر میکروتیوب 50 میکرولیتر). سپس میکروتیوبها به دستگاه ترموسایکلر منتقل گردیده و ابتدا به مدت 5 دقیقه با دمای C ° 95، سپس 45 ثانیه با دمای C ° 95، 45 ثانیه با دمای C° 56 ،1 دقیقه با دمای C °72 مجموعاً 32 سیکل و در نهایت 10 دقیقه با دمای C °72 انکوبه شدند. محصول نهایی PCR به همراه DNA استاندارد روی ژل آگارز 1/5% به مدت 1 ساعت الکتروفورز و با اتیدیوم بروماید رنگآمیزی گردید.
تجزیه و تحلیل آماری
بررسی بیان ژن در نمونههای مورد آزمایش با روش PCR معمولی انجام و نمونهها در ژل آگارز الکتروفورز گردید. دادهها با استفاده از نرمافزارversion 16 SPSS و آزمونهای آماری تی، آنالیز واریانس یک طرفه و توکی تجزیه و تحلیل شدند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه بوعلی سینا همدان، دانشکده پیرادامپزشکی تایید شده است (کد اخلاق به IR.BASU.REC.1398.053).
نتایج
ارزیابی اندازه زخم
پس از گذشت 1 هفته از تزریق لیشمانیا در ناحیه قاعده دم زخم مشاهده شد. در گروهی که تحت درمان با گلوکانتیم بودند به مرور زمان )21 روز( زخمها جمع شده و هیچگونه ندول یا زخم ناشی از لیشمانیوز باقی نماند در حالیکه در گروه کنترل در مدت زمان مشابه زخمهای پوستی گسترش یافته و در نهایت منجر به مرگ حیوان گردیدند.
بیان ژنهای پیش التهابی در طحال و نوتروفیلهای خون محیطی
نتایج بهدست آمده نشان داد که طبق انتظار، ژن کنترل GAPDH در تمام نمونههای مورد آزمایش بیان شده که دلیلی بر صحت انجام PCR دارد و از طرفی هیچ یک از ژنهای پیش التهابی در بافت طحال موشهای سالم بیان نشد. از طرفی در موشهای آلوده به لیشمانیا، قبل از انجام درمان ژنهای IFN-γ، IL-1β، CCR5، CCL-5، IL-12p40، IL-12p35، در نوتروفیلهای خون محیطی و فقط IFN-γدر طحال بیان شدند. در گروه موشهای کنترل تیمار شده با PBS، در هفته دوم ژن IFN-γ همچنان در نوتروفیلها و سلولهای طحال با میزان بالا بیان میشد. همچنین در نوتروفیل این موشها، بیان ژنهای IL-1β، CCR5، CCL-5، IL-12p40، IL-12p35 ادامه یافت اما در طحال آنها هیچ یک از این ژنها بیان نشد. در هفته چهارم در موشهای گروه کنترل، زخمها گسترش یافته و منجر به مرگ موشها میشدند و ژنهای IFN-γ، lL-1α، IL-1β، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL3/MIP-1α در نوتروفیلهای خون محیطی بیان شدند. در طحال هیچ ژنی بیان نشد. در گروه درمان شده با گلوکانتیم، در هفته دوم IFN-γ، lL-1α، IL-1β، IL-12p40، IL-12p35، TNF-α و CCL3/MIP-1α در نوتروفیل و lL-1α، CCR5، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL4/MIP-1β در طحال بیان شدند. در هفته چهارم در این گروه، زخمها در شرایط بهبود قرار داشته و ژنهای IFN-γ، CCR5، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL3/MIP-1α در نوتروفیل و IFN-γ، lL-1α، CCL-5، IL-12p40، IL-12p35 و TNF-αدر طحال بیان شدند (جدول 2 و شکل 1).
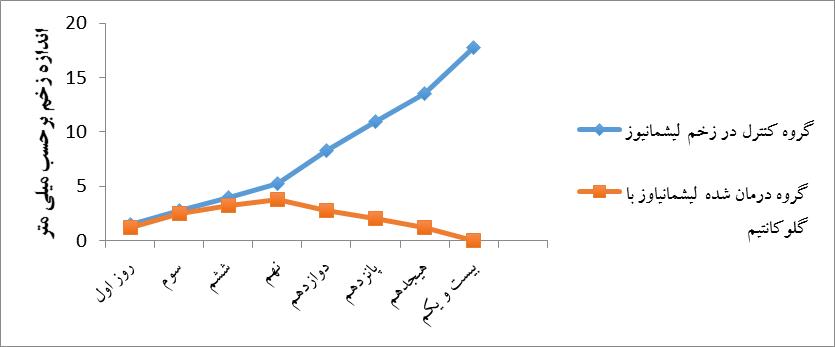
نمودار 1: مقایسه اندازه زخم لیشمانیوز: برای ایجاد لیشمانیوز تعداد 2 میلیون انگل لیشمانیا ماژور به صورت داخل جلدی به 2 گروه موشBALB/c تزریق شد. در گروه تست، مقدار mg/kg 30 گلوکانتیم به صورت داخل ضایعه در ساعات 3، 6 و 12 تزریق شد. اندازه زخم به فاصله هر 3 روز مورد ارزیابی قرار گرفت. نتایج اختلاف معناداری را بین گروه تست و کنترل نشان داد.
جدول 2: مقایسه بیان ژن در نوتروفیلهای خون محیطی و طحال در موش مبتلا به لیشمانیوز جلدی
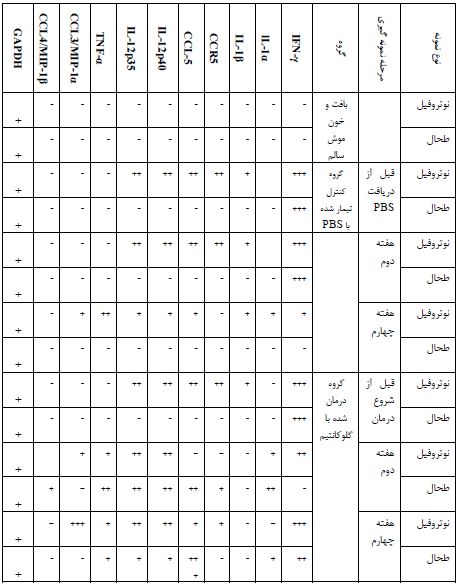
- عدم بیان ژن در حیوانات مورد آزمایش + بیان ژن در 1/3 حیوانات مورد آزمایش
++ بیان ژن در 2/3 حیوانات مورد آزمایش
+++ بیان ژن در کل حیوانات مورد آزمایش

شکل 1: بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی در موش مبتلا به لیشمانیوز جلدی: بیان ژنهای پیش التهابی در هفته اول عفونت لیشمانیوز در نوتروفیلهای خون محیطی. شماره 1 تا 12به ترتیب1. کنترل منفی، 2.استاندارد DNA 3. CCL4،4. CCL3، 5. TNF-α، 6. IL-1α، 7. IL-12p35، 8. IL-12p40، 9. CCL-5، 10. CCR5، 11. IL-1β و12. IFN-γ. اندازه باند در این ژنها bp100 می باشد.
بحث
اگرچه در اکثر مطالعات نقش پاسخ ایمنی در درمان و پیشگیری علیه انگل لیشمانیا بررسی شده است، اما کمتر به پاسخهای التهابی با میانجیگری سلولهای سیستم ایمنی و الگوی بیان ژنهای تاثیرگذار در پاسخهای التهابی توجه گردیده است. پس از مواجه سیستم ایمنی با انگل لیشمانیا، رفتار بیولوژیکی سلولهای فاگوسیت کننده به سمت میزبانی انگل تغییر پیدا نموده و سلولهای دندرتیک نیز به عنوان عامل محرک برای لنفوسیتهای T در ایجاد پاسخ محافظت کننده علیه عامل عمل میکنند. کارایی ایمنی ذاتی در مقابل انگل به عملکرد نوتروفیل بر اساس گونه لیشمانیا نیز بستگی دارد برخی از مطالعات نشان دادند که انگل لیشمانیا میتواند در داخل نوتروفیلها باقیمانده و از تشکیل فاگولیزوزوم ممانعت کند و یا در مورد لیشمانیا ماژور با داشتن اندونوکلئاز مانع از فرایند فاگوسیتوزی نوتروفیل میشود (12). اما بهطور کلی پاسخ ایمنولوژیکی پیچیدهای در روند لیشمانیوزیس ایجاد میشود که یکی از این موارد تنظیم تکثیر لنفوسیتی و تمایز به ماکروفاژها به عنوان سلول اصلی در پاسخ به عامل لیشمانیا بوده و متابولیسم ماکروفاژها مرتبط با سایتوکاینهای متفاوت بوده و نقش تعیین کنندهای در مقاومت یا حساسیت به عامل دارد. در این میان کموکاینها نقش تنظیم حرکت سلولهای ایمنی را در موضع عفونت دارند، زیرگروهای سلولهای T نیز در نوع پاسخ محافظتی در مقابل انگل نقش مهمی ایفا میکنند (13). هدف از این پژوهش، بررسی و درک بهتر الگوی بیان ژنهای پیش التهابی در مراحل مختلف ایجاد و پیشرفت بیماری سالک در سلولهای نوتروفیل و مقایسه آن با الگوی بیان این ژنها با سلولهای طحال که حاوی سلولهای ماکروفاژ و دندریتیک، به عنوان سلولهای میزبان انگل لیشمانیا، میباشد. محور بررسی این پژوهش بررسی کیفی بیان ژنهای سایتوکاینهای پیش التهابی بوده که با روش PCR معمولی سنجیده شد. در مطالعه حاضر، نتایج بیان ژنهای پیش التهابی در مدل حیوانی بسیار حائز اهمیت بوده که در ارزیابی کلی پاسخ ایمنی ناشی از انگل مهم است، اما بررسی دقیق بیان ژن، مستلزم انجام PCR کمی با روش ریل تایم و انجام تکنیک الایزا جهت تشخیص ترشح سایتوکاینهای مربوطه می باشد؛ چراکه با روش PCR معمولی نمیتوان بیان دقیقی از میزان سایتوکاین بیان شده را عنوان کرد. در این پژوهش همان طور که قابل انتظار بود در گروه مـوشهـای BALB/c تحـت درمـان بـا گلوکانتیم بر خلاف گروه کنترل در طی سه هفته بهبودی مشاهده شد. علت بهبود در گروه درمان شده را میتوان به عـدم انتـشار انگـل در سایر اندامهای موش بهخصوص طحال نسبت داد. این ویژگی یکی از شاخصهای تأثیر دارو در درمان لیشمانیوز جلـدی در موشهای حـساس مانند c BALB/ است (14). نتایج این پژوهش نشان داد که در موشهای آلوده به بیماری لیشمانیوز جلدی، ژنهای پیش التهابی بهطور قابل مقایسهای در نوتروفیلهای خون محیطی و نیز طحال بیان گردیدند اما الگوی بیان این ژنها متفاوت است. در موشهای سالم، ژنهای پیش التهابی در نوتروفیلها و سلولهای طحال در حد غیر قابل تشخیصی قرار داشت. با دقت در الگوی بیان ژنهای پیش التهابی در موشهای گروه کنترل که آلوده به لیشمانیا بوده اما تحت درمان با گلوکانتیم قرار نداشتند، میتوان نتیجه گرفت که در این گروه، انگل لیشمانیا در طحال موجب کاهش شدید ژنهای پیش التهابی شده است به نحوی که از بین همه ژنهای مورد آزمایش فقط ژنIFN-γ در طحال بیان گردید که البته بیان این ژن در اواخر دوره بیماری نیز متوقف گردید. برعکس در نوتروفیلهای خون محیطی در هفته اول بیماری ژنهای IFN-γ، IL-1β، CCR5، CCL-5، IL-12p40 و IL-12p35 بیان گردیدند و در اواخر دوره بیماری نیزlL-1α ، TNF-α و CCL3/MIP-1α بیان شدند اما بیان CCR5 متوقف گردید. پژوهشهای قبلی همواره بر نقش مهم محور IFN-γ و IL-12 در تحریک پاسخهای Th1 و ایجاد مقاومت بر علیه انگل لیشمانیا در لیشمانیوز جلدی تاکید داشته (15) و همچنین ترشح IL-1α و IL-1β را موجب افزایش تولید و آزادسازی نوتروفیل و پلاکت از مغز استخوان میدانند. در مراحل ابتدایی عفونت، بیان ژنهای التهابی در نوتروفیل بیشتر از طحال بود که این حاکی از آن است که نوتروفیل¬ها مهمترین سلول بیگانه خوار محیطی هستند که نقش بسیار مهمی را در مقابله با عوامل مهاجم از جمله لیشمانیا بر عهده دارند و با مهاجرت به کانون¬های عفونت، میکروارگانیسمهای مهاجم را نابود میسازند، لذا آغازگر فرآیند التهاب هستند (15). عدم تطابق الگوی بیان ژنهای پیش التهابی در طحال و نوتروفیل-های خون محیطی نشان دهنده عملکرد متفاوت انگل در طحال و خون است. از طرفی بیان ژنهای پیش التهابی تا آخر دوره بیماری و زمان مرگ موشها در سلولهای نوتروفیل ادامه داشتند که نشان دهنده نقش فعال نوتروفیلها در مقابله با انگل در تمام طول دوره بیماری است. البته الگوی بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی متعاقب درمان با گلوکانتیم تا حدودی تغییر میکند. به نحوی که بیان ژن IL-1β متوقف شده و ژنهای TNF-α و CCL3/MIP-1α بیان شدند که این تغییر میتواند به عنوان مارکر برای بررسی روند درمان مورد توجه قرار گیرد. همانطوری که اشاره شد، لیشمانیا ماژور ترشح سایتوکاینهای پیش التهابی را کاهش داده و از این طریق موجب تضعیف پاسخهای ایمنی میزبان میگردد. در مطالعهای که توسط لاپارا و همکاران انجام شد نقش بعضی از ترکیبات باکتریایی مانند LPS در کاهش بیان ژنهای پیش التهابی در ماکروفاژها گزارش شده است (16). محققین فرضیهای ارائه دادند که علت عدم پاسخ قوی و محافظت کننده سلولی در مقابل این انگل، پنهان شدن انگل در سلولهای فیبروبلاست، نوتروفیلها، و ماکروفاژهای M2 میباشد که عامل را دور از دسترس نگه داشته و باعث عفونت نهان میشود (17)، احتمالاً انگل لیشمانیا نیز با مکانیسمهای مشابه قادر به کنترل بیان ژنهای پیش التهابی در ماکروفاژها و این سلولها بوده که میتواند باعث پایداری بیشتر انگل در داخل این سلولها گردد. افزایش میزان TNF-α در گروه تحت درمان با گلوکانتیم در طحال حاکی از آن است که میزان TNF-αدر سیر بیماری لیشمانیوز، از مرحلۀ فعال تا بهبود قابل ردیابی است. این واسطه التهابی از سایتوکاینهای اصلی فعالکنندۀ ماکروفاژ برای تولید نیتریک اکساید است که در نابودی انگل¬های درون سلولی موثراست (18) و لذا در بهبود عفونت ناشی از عامل بیماریزای درون سلولی لیشمانیا ماژور اهمیت دارد (19). از نتایج فوق میتوان چنین استنباط کرد که هنگام استفاده از داروی ضد لیشمانیا نیز همچنان نقش سیستم ایمنی در دفع انگل غیر قابل انکار است. نقش TNF-α به همراه IL-12 و IFN-γ در ایجاد پاسخ ایمنی سلولی لنفوسیتهای(Th1) CD4+ T و کنترل عفونت لیشمانیا در موش نشان داده شده است. این موضوع در مطالعات اخیر با بررسی فعالیت محور IFN-γ و IL-12 در بیماران مبتلا به نقص سیستم ایمنی و یا افرادی که داروهای سرکوب کننده سیتم ایمنی دریافت میکنند و دارای حساسیت بیشتری نسبت به عفونتهای لیشمانیایی میباشند مورد تایید قرار گرفته است. در این بیماران، سایتوکاینهای IFN-γ و IL-12 به شدت کاهش و سایتوکاینهای پاسخهای Th2 مانند IL-5، IL-4 و TGF-β افزایش مییابد (20). البته میزان و نوع ژنهای التهابی بیان شده برای سرکوب عامل پاتوژن در مراحل اولیه تا بهبود زخم لیشمانیا متفاوت است. با توجه به این که در مراحل اولیه ایجاد التهاب، سلولهای نوتروفیل به عنوان اولین سلولها به موضع مهاجرت میکنند، عملکرد آنها تحتتاثیر عوامل تعیین کننده مانند سایتوکاینها و کموکاینها است، به عنوان مثال پس از ورود انگل به داخل ماکروفاژ، IFN-γ تولید شده توسط لنفوسیتهای Th1 میتواند باعث فعالشدن ماکروفاژهای آلوده شده و تکثیر عامل را از طریق تولید واسطههای فعال اکسیژن کنترل کند، علاوه بر نقش مهم تولید سایتوکاین توسط Th1، وجود لنفوسیتهای TCD8+ نیز میتواند با نقش دوگانه خود از یک طرف IFN-γ را تولید کرده و نقش محافظتی را ایفا کند و از طرف دیگر فعالیت اینفلامازوم NLRP3 را تحریک و IL-1β را تولید کرده و روند التهاب را تشدید نماید (21)، واکنشهای سیستم ایمنی منوط به ایجاد ارتباط بین سلولهای ایمنی از طریق تولید پروتئین-های سایتوکاینی است که به صورت زنجیروار بر یکدیگر موثرند. IL-1 یکی از اولین سایتوکاینهای تولید شده در التهاب است که در بررسی حاضر نیز افزایش یافته است. محققان نیز نشان دادند که IL-1 نقش مهمی در این عفونت داشته به نحوی که اختلال در سیستم اینفلامازوم و بهدنبال آن پردازش IL-1 مانع از کنترل بیماری میشود (22). در لیشمانیوز احشایی و جلدی معمولاً کموکاینهای التهابی مانندCCL3 و CCL4 در اثر پاسخهای التهابی القا میشوند که در اثر تماس با انگل لیشمانیا یا در اثر فعالیت سایتوکاین-های التهابی مثلTNF-α عرضه این کموکاینهای التهابی افزایش مییابد (15). CCL4 و دیگر کموکاینها دارای نقش پیش التهابی هستند و در هنگام التهاب، سلولهای ایمنی را فراخوانده و به طور کلی چسبندگی، کموتاکسی و فعالسازی بسیاری از جمعیتهای لکوسیتی را کنترل کرده و تنظیم کننده اصلی عبور و مرور لکوسیتی هستند. خانواده کموکاینها در رگزایی و بهبود زخم نیز نقش تنظیمی دارد (23). در پژوهشهای اخیر نشان داده شده است که بیماران مبتلا به نقص سیتم ایمنی و یا افرادی که به داروهای سرکوب کننده سیستم ایمنی دریافت می¬کنند، دارای حساسیت بیشتری نسبت به عفونتهای لیشمانیایی هستند. بررسی نتایج در گروه درمان شده با گلوکانتیم نشان میدهد که متعاقب درمان با این دارو، ژن¬های IFN-γ، lL-1α، CCR5، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL4/MIP-1β در طحال بیان میشوند. این موضوع نشان میدهد که علیرغم ظهور علایم بالینی بیماری که بهصورت زخم جلدی ظهور مییابد، نوع تعامل انگل با سیستم ایمنی همواره بهصورت سیستمیک بوده و تنها به واکنشهای موضعی بافتی محدود نمیگردد. بررسی بیان سایتوکاین¬های درگیر در پاسخ به لیشمانیا و خصوصاً میزان کمی آنها از جهات مختلف حائز اهمیت میباشد چراکه در گام اول، بررسی بروز این عوامل و در مراحل بعدی ارزیابی کمی این سایتوکاینها به جهت اهمیت مقادیر بیان، ضروری است؛ به عنوان نمونه محققان در این زمینه نشان دادند که اگرچه سایتوکاینی همانند IFN-γ در کنترل عفونت لیشمانیا دارای نقش کلیدی است ولی بیان بیش از حد آن میتواند آسیب بافتی و متعاقباً پیشرفت ضایعه را بهدنبال داشته باشد، بنابراین بیان این عوامل در مدل کنترل شونده باید در حد متعادل باشد و از طرفی ارائه راهکارهای درمانی در خصوص این بیماری مستلزم بررسی بیشتر در این زمینه به منظور دستیابی به حد بیان مطلوب عوامل سایتوکاینی در مقابله با این عارضه میباشد (24). و در ارائه راهکارهای درمانی لذا پژوهشهای بیشتر در مورد الگوی بیان سایتوکاینها در بیماران لیشمانیوز مبتلا به نقص یا سرکوب سیستم ایمنی میتواند برای یافتن روشهای درمانی مطمئنتر راهگشا باشد. شناخت مسیرهای فعالیت سیستم ایمنی از طریق بیان سایتوکاینها به عنوان رابط و شروعکننده پاسخهای ایمنولوژیک، میتواند در زمینه ارائه راهکارهای درمانی مناسب بر پایه ایمنوتراپی در جهت مقابله با انگل لیشمانیا مفید باشد زیرا با توجه به مطالعات اخیر انجام شده، در شرایط حاضر داروی انتخابی این عارضه دارای اثرات جانبی بوده و در دسترس نمیباشد و از طرفی تحقیقات در زمینه واکسن نیز کامل نشده و قابلیت جامعیت را ندارد، لذا درک بیشتر مسیرهای ایمنولوژیک علیه انگل میتواند در بهبود روشهای درمانی مبتنی بر ایمنوتراپی حائز اهمیت باشد (25).
نتیجهگیری
عدم شناخت کافی از چگونگی بیان ژنهای مهم سایتوکاینی در جریان پاسخهای ایمنی در طی عفونت لیشمانیوز جلدی، از علل مهم عدم دستیابی به واکسن و ارائه راهکار درمانی مؤثر علیه لیشمانیوز بوده است. مطالعه بیان ژنهای پیش التهابی در سلولها و بافتهای ایمنی چگونگی فعالیت آنها را در مقابله با انگل روشن می سازد. از طرفی باید نقش موثر دارو گلوکانتیم را به عنوان یک دارو استاندارد در مقابل با عفونت لیشمانیا با اثرگذاری سیستمیک بر تغییر پاسخ سیستم ایمنی در نظر گرفته و بررسی دقیقی از تاثیرگذاری این دارو بر روند درمانی از طریق بیان ژنهای سایتوکاینی در موضع زخم لیشمانیا، بافت طحال و کبد به عنوان ارگانهای موثر در تنظیم پاسخ ایمنی علیه انگل را انجام داد.
سپاسگزاری
این مطالعه از پایاننامه مقطع کارشناسی ارشد در رشته انگلشناسی استخراج شده و نویسندگان مایلند از دانشگاه بوعلی سینا برای تامین منابع مالی پروژه و سرکار خانم مهندس اعظمی و جناب آقای مهندس خوشروزی به جهت کمکهای فنی در طول پروژه کمال تشکر را داشته باشند.
حامی مالی: این بررسی دانشگاه بوعلی سینا همدان و دانشکده پیرا دامپزشکی میباشد.
تعارض در منافع: وجود ندارد.
بیماری لیشمانیوز جلدی یا سالک یکی از بیماریهای مشترک بین انسان و دام است و بعد از مالاریا بهعنوان یک معضل بهداشتی در جهان مورد توجه قرار گرفته است. عامل این بیماری، تکیاختهای از گروه تاژکداران خانواده تریپانوزوماتیده و جنس لیشمانیا است که بهوسیله نیش پشههای ناقل گونههای فلبوتوموس به انسان منتقل میشود. علایم این بیماری به صورت زخمهایی خشک یا مرطوب ظاهر میشوند که بعضاً ممکن است تا یک سال روی نقاطی از بدن از جمله دست، پا و صورت باقی بمانند. هم اکنون تعداد افراد مبتلا به این بیماری در جهان به بیش از 12 میلیون مورد رسیده که این تعداد با وقوع بیماریهایی مانند ایدز و بحرانهای اجتماعی در مناطق آلوده در دهه¬های اخیر در حال افزایش بوده است (1). در ایران حدود پانزده هزار نفر سالانه به سالک مبتلا میشوند و بر اساس تحقیقات موجود، میزان واقعی موارد آن 4 تا 5 برابر میزانی است که گزارش می¬شود به نحوی که میزان بروز بیماری در ایران 28 در هر هزار نفر جمعیت تخمین زده میشود (2). درمانهای رایج در این بیماری استفاده از ترکیبات پنج ظرفیتی آنتیموان (پنتوستام و گلوکانتیم) است گرچه علیرغم تلاشهای فراوان، تاکنون کنترل بیماری چندان موفقیتآمیز نبوده و درمان آن نیز در عمل با مشکلات متعددی ازجمله عدم پاسخ به درمان به علت مقاومت دارویی مواجه بوده است؛ به همین دلیل در سالهای اخیر سازمان جهانی بهداشت بیماری لیشمانیوز را به عنوان یک بیماری گرمسیری فراموش شده مطرح کرده است (3). یافتههای ایمنی شناسی در لیشمانیوز عمدتاً از طریق مطالعه بر روی مدلهای حیوانی با استفاده از نژادهای خالص موش بهدست آمده است. این یافتهها نشان دادهاند که مقاومت به عفونت لیشمانیا بهطور مشخصی با فعالیت لنفوسیتهای Th1 ارتباط دارد (4). در این راستا، سلامت سیستم ایمنی میزبان و نیز گونه انگل در سیر بیماری تعیینکننده میباشند (5). مطالعات مختلف نشان دادهاند که برای کنترل عفونت لیشمانیایی در میزبان، بهوجود آمدن ایمنی سلولی مؤثر که قادر به فعال کردن ماکروفاژها باشد، مورد نیاز است (5). با وجود این که پردازش و ارائه آنتیژن توسط ماکروفاها صورت میگیرد ولی ایجاد پاسخ ایمنی به عهده لنفوسیتهایی است که در اعضایی مانند طحال و عقده¬های لنفاوی حضور دارند (6). پژوهشها نشان داده است که ژنهای پیش التهابی نقش مهمی در چگونگی فعال شدن سیستم ایمنی و در نهایت از بین بردن عفونت لیشمانیایی به عهده دارند. فعال شدن ماکروفاژها توسط سایتوکاین IFN-γ صورت میگیرد. مکانیسم اصلی برای از بین بردن انگل در این سلولها، تولید رادیکالهای آزاد اکسیژن و نیتریک اکسید است. به علاوه، IFN-γ که از لنفوسیتهای T آزاد میشود تولید TNF-α را در ماکروفاژها تحریک میکند. بنابراین TNF-α واسطه شیمیایی در هر دو نوع پاسخ ایمنی ذاتی و اکتسابی و عامل ارتباطی مهم بین پاسخهای ایمنی اکتسابی و التهاب حاد است (6). پژوهشها نشان داده است که بهبود عفونت ناشی از لیشمانیا در موشهای مقاوم نظیرC57BL/6 ، در نتیجۀ تولید سایتوکاینهای فعال کننده ماکروفاژها بهخصوص IFN-γ بوده که شاخصۀ پاسخ ایمنی Th1 است. نابودی انگلهای درون ماکروفاژ از طریق افزایش فعالیت ماکروفاژها و در نتیجه افزایش تولید نیتریک اکساید صورت میگیرد. در مقابل، حساسیت موش BALB/c به عفونت ناشی از لیشمانیا به علت تولید سایتوکاینهای مهار کننده فعالیت ماکروفاژها نظیر IL-4 و IL-10 بوده که از مشخصههای پاسخ Th2 است (7). در پژوهشهای قبلی نشان داده شده است که نوتروفیلها نقش مهمی در شناسایی، دریافت و انتقال انگل لیشمانیا به داخل ماکروفاژها دارند که این انتقال در روند پاتولوژی بیماری مؤثر است. از طرفی در موشهای BALB/c، گسترش بیماری لیشمانیوز جلدی همواره با ورود انگل به طحال همراه بوده و نهایتا منجر به مرگ حیوان میگردد. بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی در بیماری لیشمانیازیس در پژوهشهای قبلی ما نشان داده شده است (8). از طرفی با توجه به بررسی محققان در زمینه اهمیت نوتروفیلها در کنترل عفونت لیشمانیا ماژور و توانایی این انگل در ممانعت از فرآیند هضم توسط نوتروفیل با داشتن آنزیم اندونوکلئاز، بررسی بیان پروفایل سایتوکاینی شاخص در این سلولها میتواند در پیشبرد و دستیابی به نقش مهم سلولهای ایمنی ذاتی و عوامل مترشحه از این سلولها در کنترل عفونت لیشمانیا مهم بوده (9) و حتی طبق بررسی محققان، نوع گونه لیشمانیا نیز میتواند بر عملکرد و نحوه برخورد نوتروفیلها موثر باشد (10). اما بیان ژنهای پیش التهابی در طحال و مقایسه الگوی بیان این ژنها در طحال با بیان این ژنها در نوتروفیلهای خون محیطی در بیماری لیشمانیازیس تا به حال مورد بحث قرار نگرفته است. لذا در این پژوهش ارتباط بین بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی و طحال موشهای BALB/c آلوده به لیشمانیا در شرایط بدون درمان و درمان شده با داروی گلوکانتیم مورد ارزیابی و مقایسه قرار گرفت.
روش بررسی
انگل لیشمانیا
سوش وحشی انگل لیشمانیا ماژور MHOM/76/IR))، از مرکز تحقیقات بیوتکنولوژی انستیتو پاستور ایران تهیه و در محیط RPMI حاوی 10% سرم جنین گوساله در دمای C° 25 کشت داده شد.
تلقیح انگل
موشهای بالغ ماده BALB/c با سن 8 تا 12 هفته از بخش پرورش حیوانات آزمایشگاهی انستیتو پاستور ایران خریداری و بهصورت کاملاً تصادفی به دو گروه 10 تایی تقسیم شدند. انگل لیشمانیا در پاساژهای 2-4 به تعداد 2 میلیون در 100 میکرولیتر به هر موش و بهصورت داخل جلدی در ناحیه قاعده دم تزریق گردید (6). هیچگونه درمانی در موشهای گروه کنترل انجام نشد ولی موشهای گروه دوم تحت درمان 30 میلیگرم بر کیلوگرم وزن بدن داروی استاندارد (گلوکانتیم) بهصورت روزانه و به شکل تزریق در محل زخم قرار گرفتند.
جداسازی نوتروفیل
برای جداسازی نوتروفیل میزان 1 میلیلیتر خون با مقدار مساوی سرم فیزیولوژی رقیق گردید. جهت ایجاد شیب غلظت جهت جداسازی سلول طبق توصیه پروتکل منبع اشاره شده از داروی مگلومین کامپاند 76% (شرکت دارو پخش) استفاده شد. برای آمادهسازی مگلومین، این دارو به نسبت حجمی 3 به 1 با سرم فیزیولوژی مخلوط گردید و خون رقیقشده به آن اضافه شد. پس از سانتریفیوژ (g 1000 به مدت 15 دقیقه)، مایع رویی تخلیه و محلول ته لوله با حرکات دورانی و اضافه کردن 400 میلیلیتر سرم فیزیولوژی همگن و سپس ورتکس گردید. برای لیز کردن گلبولهای قرمز 10 میلیلیتر آب مقطر سرد و 5 میلیلیتر سرم فیزیولوژی 2/55% به 1 میلیلیتر نمونه اضافه و نمونهها سانتریفیوژ (g 1000 به مدت 5 دقیقه) شدند؛ این مرحله تا جایی که محلول رویی کاملاً شفاف و فاقد گلبول قرمز باشد، تکرار شد. سپس تعداد نوتروفیلها با روش متیلنبلو شمارش گردیده و سلولهای جدا شده (/ml 106×4) برای انجام آزمایش RT-PCR مورد استفاده قرار گرفتند (11).
نمونهگیری
پس از ایجاد زخم لیشمانیا در موشهای آلوده از هر دو گروه، نمونهگیری از طحال و خون به منظور بررسی ژنهای پیش التهابی در سه مرحله انجام شد؛ اولین نمونهگیری قبل از شروع درمان و سپس نمونههای بعدی در پایان هفته دوم و هفته چهارم اخذ گردید. جهت مقایسه و بهعنوان کنترل دوم، نمونههای خون و طحال از موشهای سالم نیز اخذ گردید. نمونهها بلافاصله در دمای C°80- قرار داده و تا زمان آزمایش در این دما نگهداری گردیدند.
طراحی پرایمر
جهت ارزیابی صحت PCR، بیان ژن کنترل GAPDH برای تمام نمونهها ارزیابی شد و ژنهای مورد مطالعه عبارت بودند از: IL-12p40، IL-12p35، IL-1β، IL-1α، CCR5، CCL5/RANTES، CCL4/MIP-1β، CCL3/MIP-1α، IFN-γ وTNF-α که پس از یافتن توالی ژنها در بانک ژنی، با استفاده از نرم افزار طراحی پرایمر در سایت NCBI پرایمر مناسب برای هر ژن طراحی گردید. توالی کلیه پرایمرهای مورد استفاده در جدول 1 آورده شده است.
جدول 1: توالی پرایمرهای مورد استفاده برای تشخیص ژنهای پیش التهاب

استخراج RNA
استخراج RNA با کیت تجاری استخراج RNA توتال (شرکت دنا زیست) و طبق دستورالعمل شرکت سازنده انجام شد. برای جداسازی RNA از طحال، 50 میلی¬گرم از بافت طحال در حمام اولتراسونیک هموژنیزه شده و 1 میلیلیتر از محلول G1 موجود در کیت به آن اضافه و پیپیتنگ گردید. میکروتیوب در دمای اتاق به مدت 5 دقیقه انکوبه شد و سپس با دور g 1200 به مدت 15 دقیقه سانتریفوژ گردید. در مرحلۀ بعد، مایع رویی به میکروتیوب جدید منتقل شده و پس از اضافه شدن 200 میکرولیتر کلروفروم به آن، به مدت 3 دقیقه در دمای اتاق انکوبه شد. در مرحله بعد میکروتیوبها به مدت 15 دقیقه با دور g 1200 سانتریفوژ شده و لایه رویی به میکروتیوب جدید منتقل گردید. پس از اضافه شدن همان میزان ایزوپروپانول و محلول G2 موجود در کیت و پپیتنگ، به مدت 10 دقیقه در دمای اتاق نگه¬داری شده و سپس میکروتیوب به مدت 10 دقیقه با دور g 10000 سانتریفوژ گردید و پس از حذف مایع رویی، مقدار 1 میلیلیتر اتانول70% به آن اضافه و پس از هم زدن، مجدداً به مدت 5 دقیقه با دور g10000 سانتریفوژ گردید. سپس مایع رویی کاملاً تخلیه شده و میکروتیوب در دمای آزمایشگاه تا خشک شدن محتویات قرار گرفت. در مرحله آخر 100 میکرولیتر آب مقطر دیونیزه به میکروتیوب اضافه گردید. برای استخراج RNA از نوتروفیل، ابتدا مقدار 1 میلیلیتر خون به لوله آزمایش حاوی ماده ضد انعقاد منتقل و نوتروفیلهای جدا شده با روش بالا، RNA از آنها استخراج گردید.
سنتز cDNA
تبدیل RNAبه cDNA با استفاده از کیت تجاری شرکت سینا کلون انجام پذیرفت. ابتدا برای جلوگیری از تولید محصول PCR ازDNA ژنومی سلول، فراوردهRNA با آنزیمDNase تیمار و آلودگی احتمالی DNA حذف گردید. سپس کیفیت و کمیت محصول با استفاده از ژل الکتروفورز و مورد بررسی قرار گرفته و در یک میکروتیوب به ترتیب 1 میکرولیتر پرایمر Oligo-dT، µl 1 مخلوط dNTPs و 10 میکرولیتر RNA استخراجی اضافه شد. میکروتیوب پس از قرارگرفتن در دمای °C 65 به مدت 5 دقیقه و سانتریفوژ با دور g1200 به مدت 2 دقیقه، در کنار یخ قرار گرفت. در یک میکروتیوب جدید 2 میکرولیتر بافر 10X و 100 واحدReverse Transcriptase M-MuLV اضافه شد. سپس حجم مخلوط با آب مقطر به 10 میکرولیتر رسانده شده و به میکروتیوب اول اضافه شد. پس از قرار گرفتن در دمای °C 42 به مدت 60 دقیقه و سپس در دمای °C85 به مدت 5 دقیقه، میکروتیوب در کنار یخ قرار گرفته و cDNA تهیه شده به فریزر منتقل گردید.
PCR
برای انجام واکنش PCR، 37/5 میکرولیتر آب مقطر دیونیزه دو بار تقطیر، 5 میکرولیتر بافر X10PCR، 1/5میکرولیتر MgCl2 0/8 میکرولیتر dNTP، 0/25 میکرولیتر آنزیم تگ پلیمراز، 1 میکرولیترcDNA و 2 میکرولیتر از هر یک از پرایمرهای Forward و Reverse برای ژنهای پیش التهابی (به صورت جداگانه) به هر میکروتیوب اضافه شد (حجم کل هر میکروتیوب 50 میکرولیتر). سپس میکروتیوبها به دستگاه ترموسایکلر منتقل گردیده و ابتدا به مدت 5 دقیقه با دمای C ° 95، سپس 45 ثانیه با دمای C ° 95، 45 ثانیه با دمای C° 56 ،1 دقیقه با دمای C °72 مجموعاً 32 سیکل و در نهایت 10 دقیقه با دمای C °72 انکوبه شدند. محصول نهایی PCR به همراه DNA استاندارد روی ژل آگارز 1/5% به مدت 1 ساعت الکتروفورز و با اتیدیوم بروماید رنگآمیزی گردید.
تجزیه و تحلیل آماری
بررسی بیان ژن در نمونههای مورد آزمایش با روش PCR معمولی انجام و نمونهها در ژل آگارز الکتروفورز گردید. دادهها با استفاده از نرمافزارversion 16 SPSS و آزمونهای آماری تی، آنالیز واریانس یک طرفه و توکی تجزیه و تحلیل شدند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه بوعلی سینا همدان، دانشکده پیرادامپزشکی تایید شده است (کد اخلاق به IR.BASU.REC.1398.053).
نتایج
ارزیابی اندازه زخم
پس از گذشت 1 هفته از تزریق لیشمانیا در ناحیه قاعده دم زخم مشاهده شد. در گروهی که تحت درمان با گلوکانتیم بودند به مرور زمان )21 روز( زخمها جمع شده و هیچگونه ندول یا زخم ناشی از لیشمانیوز باقی نماند در حالیکه در گروه کنترل در مدت زمان مشابه زخمهای پوستی گسترش یافته و در نهایت منجر به مرگ حیوان گردیدند.
بیان ژنهای پیش التهابی در طحال و نوتروفیلهای خون محیطی
نتایج بهدست آمده نشان داد که طبق انتظار، ژن کنترل GAPDH در تمام نمونههای مورد آزمایش بیان شده که دلیلی بر صحت انجام PCR دارد و از طرفی هیچ یک از ژنهای پیش التهابی در بافت طحال موشهای سالم بیان نشد. از طرفی در موشهای آلوده به لیشمانیا، قبل از انجام درمان ژنهای IFN-γ، IL-1β، CCR5، CCL-5، IL-12p40، IL-12p35، در نوتروفیلهای خون محیطی و فقط IFN-γدر طحال بیان شدند. در گروه موشهای کنترل تیمار شده با PBS، در هفته دوم ژن IFN-γ همچنان در نوتروفیلها و سلولهای طحال با میزان بالا بیان میشد. همچنین در نوتروفیل این موشها، بیان ژنهای IL-1β، CCR5، CCL-5، IL-12p40، IL-12p35 ادامه یافت اما در طحال آنها هیچ یک از این ژنها بیان نشد. در هفته چهارم در موشهای گروه کنترل، زخمها گسترش یافته و منجر به مرگ موشها میشدند و ژنهای IFN-γ، lL-1α، IL-1β، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL3/MIP-1α در نوتروفیلهای خون محیطی بیان شدند. در طحال هیچ ژنی بیان نشد. در گروه درمان شده با گلوکانتیم، در هفته دوم IFN-γ، lL-1α، IL-1β، IL-12p40، IL-12p35، TNF-α و CCL3/MIP-1α در نوتروفیل و lL-1α، CCR5، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL4/MIP-1β در طحال بیان شدند. در هفته چهارم در این گروه، زخمها در شرایط بهبود قرار داشته و ژنهای IFN-γ، CCR5، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL3/MIP-1α در نوتروفیل و IFN-γ، lL-1α، CCL-5، IL-12p40، IL-12p35 و TNF-αدر طحال بیان شدند (جدول 2 و شکل 1).

نمودار 1: مقایسه اندازه زخم لیشمانیوز: برای ایجاد لیشمانیوز تعداد 2 میلیون انگل لیشمانیا ماژور به صورت داخل جلدی به 2 گروه موشBALB/c تزریق شد. در گروه تست، مقدار mg/kg 30 گلوکانتیم به صورت داخل ضایعه در ساعات 3، 6 و 12 تزریق شد. اندازه زخم به فاصله هر 3 روز مورد ارزیابی قرار گرفت. نتایج اختلاف معناداری را بین گروه تست و کنترل نشان داد.
جدول 2: مقایسه بیان ژن در نوتروفیلهای خون محیطی و طحال در موش مبتلا به لیشمانیوز جلدی

- عدم بیان ژن در حیوانات مورد آزمایش + بیان ژن در 1/3 حیوانات مورد آزمایش
++ بیان ژن در 2/3 حیوانات مورد آزمایش
+++ بیان ژن در کل حیوانات مورد آزمایش

شکل 1: بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی در موش مبتلا به لیشمانیوز جلدی: بیان ژنهای پیش التهابی در هفته اول عفونت لیشمانیوز در نوتروفیلهای خون محیطی. شماره 1 تا 12به ترتیب1. کنترل منفی، 2.استاندارد DNA 3. CCL4،4. CCL3، 5. TNF-α، 6. IL-1α، 7. IL-12p35، 8. IL-12p40، 9. CCL-5، 10. CCR5، 11. IL-1β و12. IFN-γ. اندازه باند در این ژنها bp100 می باشد.
بحث
اگرچه در اکثر مطالعات نقش پاسخ ایمنی در درمان و پیشگیری علیه انگل لیشمانیا بررسی شده است، اما کمتر به پاسخهای التهابی با میانجیگری سلولهای سیستم ایمنی و الگوی بیان ژنهای تاثیرگذار در پاسخهای التهابی توجه گردیده است. پس از مواجه سیستم ایمنی با انگل لیشمانیا، رفتار بیولوژیکی سلولهای فاگوسیت کننده به سمت میزبانی انگل تغییر پیدا نموده و سلولهای دندرتیک نیز به عنوان عامل محرک برای لنفوسیتهای T در ایجاد پاسخ محافظت کننده علیه عامل عمل میکنند. کارایی ایمنی ذاتی در مقابل انگل به عملکرد نوتروفیل بر اساس گونه لیشمانیا نیز بستگی دارد برخی از مطالعات نشان دادند که انگل لیشمانیا میتواند در داخل نوتروفیلها باقیمانده و از تشکیل فاگولیزوزوم ممانعت کند و یا در مورد لیشمانیا ماژور با داشتن اندونوکلئاز مانع از فرایند فاگوسیتوزی نوتروفیل میشود (12). اما بهطور کلی پاسخ ایمنولوژیکی پیچیدهای در روند لیشمانیوزیس ایجاد میشود که یکی از این موارد تنظیم تکثیر لنفوسیتی و تمایز به ماکروفاژها به عنوان سلول اصلی در پاسخ به عامل لیشمانیا بوده و متابولیسم ماکروفاژها مرتبط با سایتوکاینهای متفاوت بوده و نقش تعیین کنندهای در مقاومت یا حساسیت به عامل دارد. در این میان کموکاینها نقش تنظیم حرکت سلولهای ایمنی را در موضع عفونت دارند، زیرگروهای سلولهای T نیز در نوع پاسخ محافظتی در مقابل انگل نقش مهمی ایفا میکنند (13). هدف از این پژوهش، بررسی و درک بهتر الگوی بیان ژنهای پیش التهابی در مراحل مختلف ایجاد و پیشرفت بیماری سالک در سلولهای نوتروفیل و مقایسه آن با الگوی بیان این ژنها با سلولهای طحال که حاوی سلولهای ماکروفاژ و دندریتیک، به عنوان سلولهای میزبان انگل لیشمانیا، میباشد. محور بررسی این پژوهش بررسی کیفی بیان ژنهای سایتوکاینهای پیش التهابی بوده که با روش PCR معمولی سنجیده شد. در مطالعه حاضر، نتایج بیان ژنهای پیش التهابی در مدل حیوانی بسیار حائز اهمیت بوده که در ارزیابی کلی پاسخ ایمنی ناشی از انگل مهم است، اما بررسی دقیق بیان ژن، مستلزم انجام PCR کمی با روش ریل تایم و انجام تکنیک الایزا جهت تشخیص ترشح سایتوکاینهای مربوطه می باشد؛ چراکه با روش PCR معمولی نمیتوان بیان دقیقی از میزان سایتوکاین بیان شده را عنوان کرد. در این پژوهش همان طور که قابل انتظار بود در گروه مـوشهـای BALB/c تحـت درمـان بـا گلوکانتیم بر خلاف گروه کنترل در طی سه هفته بهبودی مشاهده شد. علت بهبود در گروه درمان شده را میتوان به عـدم انتـشار انگـل در سایر اندامهای موش بهخصوص طحال نسبت داد. این ویژگی یکی از شاخصهای تأثیر دارو در درمان لیشمانیوز جلـدی در موشهای حـساس مانند c BALB/ است (14). نتایج این پژوهش نشان داد که در موشهای آلوده به بیماری لیشمانیوز جلدی، ژنهای پیش التهابی بهطور قابل مقایسهای در نوتروفیلهای خون محیطی و نیز طحال بیان گردیدند اما الگوی بیان این ژنها متفاوت است. در موشهای سالم، ژنهای پیش التهابی در نوتروفیلها و سلولهای طحال در حد غیر قابل تشخیصی قرار داشت. با دقت در الگوی بیان ژنهای پیش التهابی در موشهای گروه کنترل که آلوده به لیشمانیا بوده اما تحت درمان با گلوکانتیم قرار نداشتند، میتوان نتیجه گرفت که در این گروه، انگل لیشمانیا در طحال موجب کاهش شدید ژنهای پیش التهابی شده است به نحوی که از بین همه ژنهای مورد آزمایش فقط ژنIFN-γ در طحال بیان گردید که البته بیان این ژن در اواخر دوره بیماری نیز متوقف گردید. برعکس در نوتروفیلهای خون محیطی در هفته اول بیماری ژنهای IFN-γ، IL-1β، CCR5، CCL-5، IL-12p40 و IL-12p35 بیان گردیدند و در اواخر دوره بیماری نیزlL-1α ، TNF-α و CCL3/MIP-1α بیان شدند اما بیان CCR5 متوقف گردید. پژوهشهای قبلی همواره بر نقش مهم محور IFN-γ و IL-12 در تحریک پاسخهای Th1 و ایجاد مقاومت بر علیه انگل لیشمانیا در لیشمانیوز جلدی تاکید داشته (15) و همچنین ترشح IL-1α و IL-1β را موجب افزایش تولید و آزادسازی نوتروفیل و پلاکت از مغز استخوان میدانند. در مراحل ابتدایی عفونت، بیان ژنهای التهابی در نوتروفیل بیشتر از طحال بود که این حاکی از آن است که نوتروفیل¬ها مهمترین سلول بیگانه خوار محیطی هستند که نقش بسیار مهمی را در مقابله با عوامل مهاجم از جمله لیشمانیا بر عهده دارند و با مهاجرت به کانون¬های عفونت، میکروارگانیسمهای مهاجم را نابود میسازند، لذا آغازگر فرآیند التهاب هستند (15). عدم تطابق الگوی بیان ژنهای پیش التهابی در طحال و نوتروفیل-های خون محیطی نشان دهنده عملکرد متفاوت انگل در طحال و خون است. از طرفی بیان ژنهای پیش التهابی تا آخر دوره بیماری و زمان مرگ موشها در سلولهای نوتروفیل ادامه داشتند که نشان دهنده نقش فعال نوتروفیلها در مقابله با انگل در تمام طول دوره بیماری است. البته الگوی بیان ژنهای پیش التهابی در نوتروفیلهای خون محیطی متعاقب درمان با گلوکانتیم تا حدودی تغییر میکند. به نحوی که بیان ژن IL-1β متوقف شده و ژنهای TNF-α و CCL3/MIP-1α بیان شدند که این تغییر میتواند به عنوان مارکر برای بررسی روند درمان مورد توجه قرار گیرد. همانطوری که اشاره شد، لیشمانیا ماژور ترشح سایتوکاینهای پیش التهابی را کاهش داده و از این طریق موجب تضعیف پاسخهای ایمنی میزبان میگردد. در مطالعهای که توسط لاپارا و همکاران انجام شد نقش بعضی از ترکیبات باکتریایی مانند LPS در کاهش بیان ژنهای پیش التهابی در ماکروفاژها گزارش شده است (16). محققین فرضیهای ارائه دادند که علت عدم پاسخ قوی و محافظت کننده سلولی در مقابل این انگل، پنهان شدن انگل در سلولهای فیبروبلاست، نوتروفیلها، و ماکروفاژهای M2 میباشد که عامل را دور از دسترس نگه داشته و باعث عفونت نهان میشود (17)، احتمالاً انگل لیشمانیا نیز با مکانیسمهای مشابه قادر به کنترل بیان ژنهای پیش التهابی در ماکروفاژها و این سلولها بوده که میتواند باعث پایداری بیشتر انگل در داخل این سلولها گردد. افزایش میزان TNF-α در گروه تحت درمان با گلوکانتیم در طحال حاکی از آن است که میزان TNF-αدر سیر بیماری لیشمانیوز، از مرحلۀ فعال تا بهبود قابل ردیابی است. این واسطه التهابی از سایتوکاینهای اصلی فعالکنندۀ ماکروفاژ برای تولید نیتریک اکساید است که در نابودی انگل¬های درون سلولی موثراست (18) و لذا در بهبود عفونت ناشی از عامل بیماریزای درون سلولی لیشمانیا ماژور اهمیت دارد (19). از نتایج فوق میتوان چنین استنباط کرد که هنگام استفاده از داروی ضد لیشمانیا نیز همچنان نقش سیستم ایمنی در دفع انگل غیر قابل انکار است. نقش TNF-α به همراه IL-12 و IFN-γ در ایجاد پاسخ ایمنی سلولی لنفوسیتهای(Th1) CD4+ T و کنترل عفونت لیشمانیا در موش نشان داده شده است. این موضوع در مطالعات اخیر با بررسی فعالیت محور IFN-γ و IL-12 در بیماران مبتلا به نقص سیستم ایمنی و یا افرادی که داروهای سرکوب کننده سیتم ایمنی دریافت میکنند و دارای حساسیت بیشتری نسبت به عفونتهای لیشمانیایی میباشند مورد تایید قرار گرفته است. در این بیماران، سایتوکاینهای IFN-γ و IL-12 به شدت کاهش و سایتوکاینهای پاسخهای Th2 مانند IL-5، IL-4 و TGF-β افزایش مییابد (20). البته میزان و نوع ژنهای التهابی بیان شده برای سرکوب عامل پاتوژن در مراحل اولیه تا بهبود زخم لیشمانیا متفاوت است. با توجه به این که در مراحل اولیه ایجاد التهاب، سلولهای نوتروفیل به عنوان اولین سلولها به موضع مهاجرت میکنند، عملکرد آنها تحتتاثیر عوامل تعیین کننده مانند سایتوکاینها و کموکاینها است، به عنوان مثال پس از ورود انگل به داخل ماکروفاژ، IFN-γ تولید شده توسط لنفوسیتهای Th1 میتواند باعث فعالشدن ماکروفاژهای آلوده شده و تکثیر عامل را از طریق تولید واسطههای فعال اکسیژن کنترل کند، علاوه بر نقش مهم تولید سایتوکاین توسط Th1، وجود لنفوسیتهای TCD8+ نیز میتواند با نقش دوگانه خود از یک طرف IFN-γ را تولید کرده و نقش محافظتی را ایفا کند و از طرف دیگر فعالیت اینفلامازوم NLRP3 را تحریک و IL-1β را تولید کرده و روند التهاب را تشدید نماید (21)، واکنشهای سیستم ایمنی منوط به ایجاد ارتباط بین سلولهای ایمنی از طریق تولید پروتئین-های سایتوکاینی است که به صورت زنجیروار بر یکدیگر موثرند. IL-1 یکی از اولین سایتوکاینهای تولید شده در التهاب است که در بررسی حاضر نیز افزایش یافته است. محققان نیز نشان دادند که IL-1 نقش مهمی در این عفونت داشته به نحوی که اختلال در سیستم اینفلامازوم و بهدنبال آن پردازش IL-1 مانع از کنترل بیماری میشود (22). در لیشمانیوز احشایی و جلدی معمولاً کموکاینهای التهابی مانندCCL3 و CCL4 در اثر پاسخهای التهابی القا میشوند که در اثر تماس با انگل لیشمانیا یا در اثر فعالیت سایتوکاین-های التهابی مثلTNF-α عرضه این کموکاینهای التهابی افزایش مییابد (15). CCL4 و دیگر کموکاینها دارای نقش پیش التهابی هستند و در هنگام التهاب، سلولهای ایمنی را فراخوانده و به طور کلی چسبندگی، کموتاکسی و فعالسازی بسیاری از جمعیتهای لکوسیتی را کنترل کرده و تنظیم کننده اصلی عبور و مرور لکوسیتی هستند. خانواده کموکاینها در رگزایی و بهبود زخم نیز نقش تنظیمی دارد (23). در پژوهشهای اخیر نشان داده شده است که بیماران مبتلا به نقص سیتم ایمنی و یا افرادی که به داروهای سرکوب کننده سیستم ایمنی دریافت می¬کنند، دارای حساسیت بیشتری نسبت به عفونتهای لیشمانیایی هستند. بررسی نتایج در گروه درمان شده با گلوکانتیم نشان میدهد که متعاقب درمان با این دارو، ژن¬های IFN-γ، lL-1α، CCR5، CCL-5، IL-12p40، IL-12p35، TNF-α و CCL4/MIP-1β در طحال بیان میشوند. این موضوع نشان میدهد که علیرغم ظهور علایم بالینی بیماری که بهصورت زخم جلدی ظهور مییابد، نوع تعامل انگل با سیستم ایمنی همواره بهصورت سیستمیک بوده و تنها به واکنشهای موضعی بافتی محدود نمیگردد. بررسی بیان سایتوکاین¬های درگیر در پاسخ به لیشمانیا و خصوصاً میزان کمی آنها از جهات مختلف حائز اهمیت میباشد چراکه در گام اول، بررسی بروز این عوامل و در مراحل بعدی ارزیابی کمی این سایتوکاینها به جهت اهمیت مقادیر بیان، ضروری است؛ به عنوان نمونه محققان در این زمینه نشان دادند که اگرچه سایتوکاینی همانند IFN-γ در کنترل عفونت لیشمانیا دارای نقش کلیدی است ولی بیان بیش از حد آن میتواند آسیب بافتی و متعاقباً پیشرفت ضایعه را بهدنبال داشته باشد، بنابراین بیان این عوامل در مدل کنترل شونده باید در حد متعادل باشد و از طرفی ارائه راهکارهای درمانی در خصوص این بیماری مستلزم بررسی بیشتر در این زمینه به منظور دستیابی به حد بیان مطلوب عوامل سایتوکاینی در مقابله با این عارضه میباشد (24). و در ارائه راهکارهای درمانی لذا پژوهشهای بیشتر در مورد الگوی بیان سایتوکاینها در بیماران لیشمانیوز مبتلا به نقص یا سرکوب سیستم ایمنی میتواند برای یافتن روشهای درمانی مطمئنتر راهگشا باشد. شناخت مسیرهای فعالیت سیستم ایمنی از طریق بیان سایتوکاینها به عنوان رابط و شروعکننده پاسخهای ایمنولوژیک، میتواند در زمینه ارائه راهکارهای درمانی مناسب بر پایه ایمنوتراپی در جهت مقابله با انگل لیشمانیا مفید باشد زیرا با توجه به مطالعات اخیر انجام شده، در شرایط حاضر داروی انتخابی این عارضه دارای اثرات جانبی بوده و در دسترس نمیباشد و از طرفی تحقیقات در زمینه واکسن نیز کامل نشده و قابلیت جامعیت را ندارد، لذا درک بیشتر مسیرهای ایمنولوژیک علیه انگل میتواند در بهبود روشهای درمانی مبتنی بر ایمنوتراپی حائز اهمیت باشد (25).
نتیجهگیری
عدم شناخت کافی از چگونگی بیان ژنهای مهم سایتوکاینی در جریان پاسخهای ایمنی در طی عفونت لیشمانیوز جلدی، از علل مهم عدم دستیابی به واکسن و ارائه راهکار درمانی مؤثر علیه لیشمانیوز بوده است. مطالعه بیان ژنهای پیش التهابی در سلولها و بافتهای ایمنی چگونگی فعالیت آنها را در مقابله با انگل روشن می سازد. از طرفی باید نقش موثر دارو گلوکانتیم را به عنوان یک دارو استاندارد در مقابل با عفونت لیشمانیا با اثرگذاری سیستمیک بر تغییر پاسخ سیستم ایمنی در نظر گرفته و بررسی دقیقی از تاثیرگذاری این دارو بر روند درمانی از طریق بیان ژنهای سایتوکاینی در موضع زخم لیشمانیا، بافت طحال و کبد به عنوان ارگانهای موثر در تنظیم پاسخ ایمنی علیه انگل را انجام داد.
سپاسگزاری
این مطالعه از پایاننامه مقطع کارشناسی ارشد در رشته انگلشناسی استخراج شده و نویسندگان مایلند از دانشگاه بوعلی سینا برای تامین منابع مالی پروژه و سرکار خانم مهندس اعظمی و جناب آقای مهندس خوشروزی به جهت کمکهای فنی در طول پروژه کمال تشکر را داشته باشند.
حامی مالی: این بررسی دانشگاه بوعلی سینا همدان و دانشکده پیرا دامپزشکی میباشد.
تعارض در منافع: وجود ندارد.
References:
1- Rezvan H, Mafi M. An Overview on Leishmania Vaccines: A Narrative Review Article. Vet Res Forum 2015; 6(1): 1-7.
2- Akbari M, Honma K, Kimura D, Miyakoda M, Kimura K, Matsuyama T, et al. IRF4 in Dendritic Cells Inhibits IL-12 Production and Controls Th1 Immune Responses Against Leishmania Major. J Immunology 2014; 192(5): 2271-9.
3- Carvalho AM, Cristal JR, Muniz AC, Carvalho LP, Gomes R, Miranda JC, et al. Interleukin 10-Dominant Immune Response and Increased Risk of Cutaneous Leishmaniasis after Natural Exposure to Lutzomyia Intermedia Sand Flies. J Infect Dis 2015; 212(1): 157-65.
4- Eiras DP, Kirkman LA, Murray HW. Cutaneous Leishmaniasis: Current Treatment Practices in the USA for Returning Travelers. Curr Treat Options in Infect Dis 2015; 7(1): 52-62.
5- Gois L, Badaró R, Schooley R, Grassi MF. Immune Response to Leishmania Antigens in an AIDS Patient with Mucocutaneous Leishmaniasis as a Manifestation of Immune Reconstitution Inflammatory Syndrome (IRIS): A Case Report. BMC Infect Dis 2015; 15(1): 38.
6- Ferrante CJ, Leiboich SJ. Regulation of Macrophage Polarization and Wound Healing. Ave Wound Care (New Rochelle) 2012; 1(1): 10-6.
7- Oghumu S, Stock JC, Varikuti S, Dong R, Terrazas C, Edwards JA, et al. Transgenic Expression of CXCR3 on T Cells Enhances Susceptibility to Cutaneous Leishmania Major Infection by Inhibiting Monocyte Maturation and Promoting a Th2 Response. Infect Immun 2015; 83(1): 67-76.
8- Akhzari S, Rezvan H, Zolhavareh M. Expression of Pro-Inflammatory Genes in Lesions and Neutrophils during Leishmania Major Infection in BALB/C Mice. Iran J Parasitol 2016; 11(4): 534-41.
9- Regli IB, Passelli K, Hurrell BP, Tacchini-Cottier F. Survival Mechanisms Used by Some Leishmania Species to Escape Neutrophil Killing. Front Immunol 2017; 8: 1558.
10- Hurrell BP, Regli IB, Tacchini-Cottier F. Different Leishmania Species Drive Distinct Neutrophil Functions. Trends Parasitol 2016; 32(5): 392-401.
11- Rezapur A, Majidi J. An Improved Method of Neutrophil Isolation in Peripheral Blood of Sheep. J Animal and Veterinary Advances 2009; 8(1): 11-15.
12- Bahrami F, Harandi AM, Rafati S. Biomarkers of Cutaneous Leishmaniasis. Front Cell Infect Microbiol 2018; 8: 222.
13- Bhaskar S, Ricardo S. Cytokines in the Immunity and Immunopathogenesis in Leishmaniases. Cytokine 2020; 145: 155320.
14- Oryan A. Plant-Derived Compounds in Treatment of Leishmaniasis. Iran J Vet Res 2015; 16(1): 1-19.
15- Salman KD, Salman SQ, Abdulraheem GA. Immunogenic Potential of Cytosolic Proteins against Visceral Leishmaniasis in BALB/C Mice and the Role of Chitosan as Adjuvant. Int J Adv Technol Innov Res 2015; 7(4): 540-5.
16- Lapara III NJ, Kelly BL. Suppression of LPS-Induced Inflammatory Responses in Macrophages Infected with Leishmania. J Inflamm 2010; 7(1): 8.
17- Lee SH, Charmoy M, Romano A, Paun A, Chaves MM, Cope FO, et al. Mannose Receptor High, M2 Dermal Macrophages Mediate Nonhealing Leishmania Major Infection in a Th1 Immune Environment. J Exp Med 2018; 215: 357-75.
18- Oliveira F, Bafica A, Rosato AB, Favali CB, Costa JM, Cafe V, et al. Lesion Size Correlates with Leishmania Antigen-Stimulated TNF-Levels in Human Cutaneous Leishmaniasis. Am J Tropical Med Hyg 2011; 85(1): 70-3.
19- Bousquet E, Mura F, Villain M, Rivière S, Konate A, Schneider C. Complications Infectieuses Liées Au Traitement Par Anti-Tnfα: À Propos De Deux Cas De Leishmaniose. J Français d'Ophtalmologie 2012; 35(9): 695-9.
20- Andargie TE, Ejara ED. Pro- and Anti-inflammatory Cytokines in Visceral Leishmaniasis. J Cell Science & Therapy 2015 1; 6(3): 1.
21- Novais FO, Carvalho AM, Clark ML, Carvalho LP, Beiting DP, Brodsky IE, et al. CD8+ T Cell Cytotoxicity Mediates Pathology in the Skin by Inflammasome Activation and IL-1β Production. PLoS Pathog 2017; 13(2): e1006196.
22- Hartley MA, Eren RO, Rossi M, Prevel F, Castiglioni P, Isorce N, et al. Leishmania Guyanensis Parasites Block the Activation of the Inflmmasome by Inhibiting Maturation of IL-1β. Microb Cell 2018; 5: 137-49.
23- Yurchenko E, Tritt M, Hay V, Shevach EM, Belkaid Y, Piccirillo CA. CCR5-Dependent Homing of Naturally Occurring CD4+ Regulatory T Cells to Sites of Leishmania Major Infection Favors Pathogen Persistence. J Exp Med 2006; 203(11): 2451-60.
24- Maspi N, Abdoli A and Ghaffarifar F. Pro-And Anti-Inflammatory Cytokines in Cutaneous Leishmaniasis: A Review. Pathog Glob Health 2016; 110(6): 247-60.
25- Akbari M, Oryan A, Hatam GH. Immunotherapy in Treatment of Leishmaniasis. Immunol Lett 2021; 33: 80-6.
1- Rezvan H, Mafi M. An Overview on Leishmania Vaccines: A Narrative Review Article. Vet Res Forum 2015; 6(1): 1-7.
2- Akbari M, Honma K, Kimura D, Miyakoda M, Kimura K, Matsuyama T, et al. IRF4 in Dendritic Cells Inhibits IL-12 Production and Controls Th1 Immune Responses Against Leishmania Major. J Immunology 2014; 192(5): 2271-9.
3- Carvalho AM, Cristal JR, Muniz AC, Carvalho LP, Gomes R, Miranda JC, et al. Interleukin 10-Dominant Immune Response and Increased Risk of Cutaneous Leishmaniasis after Natural Exposure to Lutzomyia Intermedia Sand Flies. J Infect Dis 2015; 212(1): 157-65.
4- Eiras DP, Kirkman LA, Murray HW. Cutaneous Leishmaniasis: Current Treatment Practices in the USA for Returning Travelers. Curr Treat Options in Infect Dis 2015; 7(1): 52-62.
5- Gois L, Badaró R, Schooley R, Grassi MF. Immune Response to Leishmania Antigens in an AIDS Patient with Mucocutaneous Leishmaniasis as a Manifestation of Immune Reconstitution Inflammatory Syndrome (IRIS): A Case Report. BMC Infect Dis 2015; 15(1): 38.
6- Ferrante CJ, Leiboich SJ. Regulation of Macrophage Polarization and Wound Healing. Ave Wound Care (New Rochelle) 2012; 1(1): 10-6.
7- Oghumu S, Stock JC, Varikuti S, Dong R, Terrazas C, Edwards JA, et al. Transgenic Expression of CXCR3 on T Cells Enhances Susceptibility to Cutaneous Leishmania Major Infection by Inhibiting Monocyte Maturation and Promoting a Th2 Response. Infect Immun 2015; 83(1): 67-76.
8- Akhzari S, Rezvan H, Zolhavareh M. Expression of Pro-Inflammatory Genes in Lesions and Neutrophils during Leishmania Major Infection in BALB/C Mice. Iran J Parasitol 2016; 11(4): 534-41.
9- Regli IB, Passelli K, Hurrell BP, Tacchini-Cottier F. Survival Mechanisms Used by Some Leishmania Species to Escape Neutrophil Killing. Front Immunol 2017; 8: 1558.
10- Hurrell BP, Regli IB, Tacchini-Cottier F. Different Leishmania Species Drive Distinct Neutrophil Functions. Trends Parasitol 2016; 32(5): 392-401.
11- Rezapur A, Majidi J. An Improved Method of Neutrophil Isolation in Peripheral Blood of Sheep. J Animal and Veterinary Advances 2009; 8(1): 11-15.
12- Bahrami F, Harandi AM, Rafati S. Biomarkers of Cutaneous Leishmaniasis. Front Cell Infect Microbiol 2018; 8: 222.
13- Bhaskar S, Ricardo S. Cytokines in the Immunity and Immunopathogenesis in Leishmaniases. Cytokine 2020; 145: 155320.
14- Oryan A. Plant-Derived Compounds in Treatment of Leishmaniasis. Iran J Vet Res 2015; 16(1): 1-19.
15- Salman KD, Salman SQ, Abdulraheem GA. Immunogenic Potential of Cytosolic Proteins against Visceral Leishmaniasis in BALB/C Mice and the Role of Chitosan as Adjuvant. Int J Adv Technol Innov Res 2015; 7(4): 540-5.
16- Lapara III NJ, Kelly BL. Suppression of LPS-Induced Inflammatory Responses in Macrophages Infected with Leishmania. J Inflamm 2010; 7(1): 8.
17- Lee SH, Charmoy M, Romano A, Paun A, Chaves MM, Cope FO, et al. Mannose Receptor High, M2 Dermal Macrophages Mediate Nonhealing Leishmania Major Infection in a Th1 Immune Environment. J Exp Med 2018; 215: 357-75.
18- Oliveira F, Bafica A, Rosato AB, Favali CB, Costa JM, Cafe V, et al. Lesion Size Correlates with Leishmania Antigen-Stimulated TNF-Levels in Human Cutaneous Leishmaniasis. Am J Tropical Med Hyg 2011; 85(1): 70-3.
19- Bousquet E, Mura F, Villain M, Rivière S, Konate A, Schneider C. Complications Infectieuses Liées Au Traitement Par Anti-Tnfα: À Propos De Deux Cas De Leishmaniose. J Français d'Ophtalmologie 2012; 35(9): 695-9.
20- Andargie TE, Ejara ED. Pro- and Anti-inflammatory Cytokines in Visceral Leishmaniasis. J Cell Science & Therapy 2015 1; 6(3): 1.
21- Novais FO, Carvalho AM, Clark ML, Carvalho LP, Beiting DP, Brodsky IE, et al. CD8+ T Cell Cytotoxicity Mediates Pathology in the Skin by Inflammasome Activation and IL-1β Production. PLoS Pathog 2017; 13(2): e1006196.
22- Hartley MA, Eren RO, Rossi M, Prevel F, Castiglioni P, Isorce N, et al. Leishmania Guyanensis Parasites Block the Activation of the Inflmmasome by Inhibiting Maturation of IL-1β. Microb Cell 2018; 5: 137-49.
23- Yurchenko E, Tritt M, Hay V, Shevach EM, Belkaid Y, Piccirillo CA. CCR5-Dependent Homing of Naturally Occurring CD4+ Regulatory T Cells to Sites of Leishmania Major Infection Favors Pathogen Persistence. J Exp Med 2006; 203(11): 2451-60.
24- Maspi N, Abdoli A and Ghaffarifar F. Pro-And Anti-Inflammatory Cytokines in Cutaneous Leishmaniasis: A Review. Pathog Glob Health 2016; 110(6): 247-60.
25- Akbari M, Oryan A, Hatam GH. Immunotherapy in Treatment of Leishmaniasis. Immunol Lett 2021; 33: 80-6.
نوع مطالعه: پژوهشي |
موضوع مقاله:
انگل شناسی
دریافت: 1399/9/9 | پذیرش: 1399/12/10 | انتشار: 1400/11/15
دریافت: 1399/9/9 | پذیرش: 1399/12/10 | انتشار: 1400/11/15
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







