دوره 29، شماره 7 - ( مهر 1400 )
جلد 29 شماره 7 صفحات 3942-3931 |
برگشت به فهرست نسخه ها
Ethics code: IR.KMU.REC.1396.1562
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Eimari Eskandari R, Matin Homaee H, Moradi L. Effect of Eight Weeks Aerobic Exercise and Vitamin-D Supplementation on Osteocalcin and Alkaline Phosphatase Gene Expression in Male Rats Poisoned with Hydrogen Peroxide. JSSU 2021; 29 (7) :3931-3942
URL: http://jssu.ssu.ac.ir/article-1-5253-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5253-fa.html
ایمری اسکندری رامین، متین همایی حسن، مرادی لیدا. اثر هشت هفته تمرین هوازی و مکمل ویتامین دی بر بیان ژن استئوکلسین و آلکالینفسفاتاز موشهای نر مسموم شده با پراکساید هیدروژن. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (7) :3931-3942
متن کامل [PDF 1105 kb]
(819 دریافت)
| چکیده (HTML) (2031 مشاهده)
متن کامل: (1339 مشاهده)
مقدمه
پوکی استخوان یک بیماری متابولیک استخوان است که با کاهش قدرت استخوان و افزایش خطر شکنندگی و شکستگی استخوان همراه است. شواهدی وجود دارد که بیان میدارد استرس اکسیداتیو با پوکی استخوان همراه است. همچنین ارتباط بیوشیمیایی بین افزایش استرس اکسیداتیو و کاهش توده معدنی استخوان (BMD) در مردان و زنان وجود دارد (1). تولید گونههای فعال اکسیژن یک نتیجه غیر قابل تغییر متابولیسم هوازی است که در ابتدا در میتوکندری اتفاق میافتد. این فرآیند سوپراکساید را که بسیار فعال است و عمر کوتاهی دارد، تولید میکند. سوپراکساید به سرعت به شکل پایدارتر و کم فعالتر پراکساید هیدورژن (H2O2 یا آب اکسیژنه) تبدیل میشود که بیشترین شکل گونههای فعال اکسیژن (Reactive Oxygen Species-ROS) است که به آزادی از غشاء میتوکندری به درون سیتوزول عبور میکند (2). این ROSها میتوانند سبب آسیب به DNA، پروتئین و چربی شوند. سطوح بالای تولید اکسیدانها در طی متابولیسم طبیعی سلول (چرخه انتقال الکترون)، تحریکات محیطی (نظیر سایتوکاینها یا اشعه ماوراء بنفش) و در زمان بیماریها، تعادل نرمال ردوکس را برهم میزنند و سلولها را به سمت وضعیت استرس اکسیداتیو هدایت میکنند (1). استخوان اما یک بافت پویا و بالقوه احیاکننده است که میتواند تحت تاثیر نیازهای فیزیکی و برای ترمیم پس از آسیب، ریمودلینگ شود. استئوبلاست نقش مهمی را در رسوب مواد معدنی به شکل کریستالهای هیدروکسی اپاتیت ساخته شده از کلسیم هیدروکسی فسفات برعهده دارد. بلوغ استئوبلاستها به دو مسیر تکثیر و افتراق بستگی دارد. افتراق و معدنیسازی در استئوبلاستها زمانی رخ میدهد که تکثیر رخ دهد و مراحل مختلف افتراق استئوبلاستها به وسیله بیان ژنهای خاص مشخص میشود. افتراق اولیه بهوسیله بیان سطوح بالای آنزیم آلکالینفسفاتاز (ALP) و افتراقهای بعدی بهوسیله بیان استئوکلسین (OC) و استئوپوئنتین مشخص میشود (3). استئوکلسین بهعنوان اسید گاما کربوکسی گلوتامیک اسید حاوی پروتئین استخوان (Bone Gamma-Carboxyglutamic Acid-Containing Protein) شناخته شده است و فراوانترین پروتئین غیرکلاژنی ماتریکس استخوان میباشد. همانگونه که اشاره شد، ژن استئوکلسین در طی تکثیر استئوبلاست ها غیرفعال است در حالیکه تا 200 برابر در طی افتراق استئوبلاستها و بلوغ آنها رونویسی میشود (4). همچنین استئوبلاست ها منشاء عظیمی از آلکالینفسفاتاز هستند، از این رو افزایش بیان ژن آلکالینفسفاتاز و همچنین سطوح سرمی آن نشانه ای از تحریک سلولهای استئوبلاست بوده و در نتیجه سیگنالینگ سلولی را در راستای افزایش تراکم مواد معدنی استخوان افزایش میدهد. ژن آلکالینفسفاتاز نقش مهمی در سوخت و ساز فعال و تامین فسفات غیر آلی آزاد با هیدرولیز اجزای فسفو بر عهده دارد. گزارش شده است که تغییر در ژن آلکالینفسفاتاز ممکن است تعیینکننده مهمی در کاهش استخوان ناشی از سن باشد و مسیر سوخت و ساز فسفات بهعنوان یک هدف جدید در پیشگیری از پوکی استخوان محسوب شود (5). تغییر در بیان ژنهای یاد شده تحتتاثیر تحریکات مکانیکی میباشد و پژوهش های انجام شده در این خصوص نشان میدهند که تمرین به اشکال مختلف هوازی بر افزایش بیان ژن آلکالینفسفاتاز و استئوکلسین اثرات مطلوبی دارد (9-6). علاوه بر فعالیت بدنی محققین استفاده از برخی مکملها جهت بهبود وضعیت توده معدنی استخوان را به افراد توصیه میکنند. از جمله این مکملها ویتامین دی می باشد که جذب و معدنیسازی ماتریکس استخوان را افزایش می دهد. از لحاظ بیولوژیکی، مکملهای کلسیم و ویتامین دی باعث کاهش سرعت تخریب توده استخوانی و خطر شکستگی میشوند (10). همچنین پژوهش ها نشان میدهد که مکمل یاری ویتامین دی تشکیل استخوان و مارکرهای استئوژنیک ALPو OC را افزایش میدهد (3). اثرات مخرب invitro پراکساید هیدروژن بر بافت استخوان نشان داد که H2O2 از دست رفتن استخوان به وسیله استئوکلاستها را تحریک و سبب پوکی استخوان میگردد (11). اثرات invivo پراکساید هیدروژن بر استخوان اما تاکنون مورد پژوهش قرار نگرفته است درحالیکه بر سایر بافتهایی نظیر کبد، کلیه، شش ها، مغز و قلب بررسی شده است (15-12). همچنین شواهد رو به رشد افزایش پوکیاستخوان در مردان ایرانی در مقایسه با همتایان آمریکایی (16) نیز بر ضرورت انجام این پژوهش تاکید دارد، لذا مطالعه حاضر به هدف بررسی اثر H2O2، فعالیت بدنی و مصرف ویتامین دی بر بیان ژنهای درگیر در روند استئوژنیک موشهای نر انجام شد.
روش بررسی
در این کارآزمایی تجربی با طرح پس آزمون 36 سر موش صحرایی نر بالغ نژاد ویستار با وزن 20±200 گرم از مرکز پرورش حیوانات دانشگاه علوم پزشکی شیراز خریداری و پس از انتقال به خانه حیوانات مرکز تحقیقات فیزیولوژی دانشگاه علوم پزشکی کرمان بهمدت یک هفته جهت سازگاری در قفس مخصوص حیوانات تحت شرایط استاندارد، دمای 2± 22 درجه سانتی گراد، رطوبت 5%±50، چرخه روشنایی/ تاریکی 12 ساعت نگهداری شدند. رتها دسترسی آزاد به آب و غذا داشتند. رژیم غذایی رتها (شرکت غذای دام پارس، تهران، ایران) از ذرت زمین، یونجه، کنجاله سویا، گندم، ویتامین ها، مواد معدنی، جوششیرین و نمک بر اساس 55% کربوهیدرات، 5/17% پروتئین، 95/1% چربی (ماده آلی محلول در اتر؛EE)، 0/56% کلسیم، 0/62% تی فسفر، 6/6% فیبر خام، انرژی متابولیزه شدن (ME) kcal/g 3/16، انرژی دفنیشن (DE) kcal/g 3/56 تشکیل شده بود. این اطلاعات توسط شرکت تولیدکننده ارائه شده است. معیار ورود شامل: موشهای سالمنر، نژاد ویستار، حداقل سن هشت هفته و وزن بالای 180 گرم بود و معیار خروج شامل: مشاهده هر گونه بیماری یا کسالت در موشها، کاهش وزن محسوس، حساسیت غذایی، هر گونه تماس پراکساید هیدروژن با پوست و عدم تمرینپذیری بود.
گروه بندی حیوانات
پیش از گروهبندی، موشها یک هفته برای آشنایی با نحوه فعالیت بر نوارگردان دویدند. سپس نمونهها به طور تصادفی بهشش گروه شش سری شامل: (1) کنترل سالم؛ (2) پراکساید هیدروژن؛ (3) پراکساید هیدروژن + ویتامین دی؛ (4) پراکساید هیدروژن + تمرین؛ (5) پراکساید هیدروژن + تمرین و ویتامین دی؛ و (6) شم (دی متیل سولفید اکساید-DMSO) تقسیم شدند.
تزریق پراکساید هیدروژن
رتهای در گروههای 2، 3، 4 و 5 تزریق درون صفاقی پراکساید هیدروژن (تهیه شده از شرکت Merck) را با دوز یک mmol/kg سه بار در هفته در روزهای زوج دریافت کردند (12).
مکمل ویتامین دی
درمان با ویتامین دی در گروههای 3 و 5 به این صورت بود که رتها gram/kgµ 0/5 میکروگرم ویتامین دی بهصورت تزریق روزانه درون صفاقی طی 8 هفته دریافت کردند (17). از آمپول ویتامین دی با نام تجاری DITHRECOL از شرکت کاسپین ویتامین؛ تهران، ایران با غلظت UI/ml 300000 استفاده شد. جهت رسیدن به دوز مناسب تزریقی از نرمال سالین برای رقیق کردن و از دی متیل سولفوکساید جهت حل کردن ویتامین دی در سالین استفاده شد. با توجه به لزوم بررسی تاثیر حلال مذکور یک گروه بنام DMSO تعریف شد که روزانه فقط حلال دریافت کردند.
برنامه تمرین
رتهای گروههای 4 و 5 به طور روزانه فعالیت تمرینی منظم بر روی تردمیل بهمدت 8 هفته انجام دادند. رتها در هفته اول با سرعتm/min 8 و شیب 10 درجه بهمدت 30 دقیقه بر روی تردمیل تمرین کردند، در هفته دوم با سرعت m/min 12 با شیب و زمان مشابه، در هفته سوم با سرعت m/min 16 با شیب مشابه بهمدت 45 دقیقه و در چهارمین هفته با سرعت m/min 20 با شیب مشابه بهمدت 45 دقیقه تمرین کردند. طی هفتههای پنجم تا هشتم رتها در سرعت m/min 20 با زاویه ده درجه بهمدت 60 دقیقه هر روز تمرین داده شدند (جدول 1) (18).
جدول1: پروتکل تمرین پژوهش

نحوه استخراج نمونه و اندازهگیری بیان ژن
بیست و چهار ساعت پس از آخرین جلسه و بعد از 12 ساعت گرسنگی، موشهای صحرایی با استنشاق کلروفرم بیهوش شدند، سپس به وسیله خونگیری مستقیم ازقلب، قربانی شدند. استخراج بافت استخوان تیبیا موشها توسط متخصص انجام شد. سپس نمونهها در کرایوتیوب در نیتروژن مایع قرار داده شدند و برای اندازهگیری بیان ژن استئوکلسین و آلکالین فسفاتاز به روش واکنش زنجیرهای پلیمراز بیدرنگ (RealTime PCR -real-time polymerase chain reaction) در دمای 70- درجه سانتیگراد نگهداری شدند. استخراج RNA بر اساس دستورالعمل کیت استخراج RNA ساخت شرکت یکتا تجهیز، با استفاده از محلولهای کیت استخراج و پروتکل پیشنهادی شرکت سازنده انجام شد. برای این منظور 30 میلیگرم بافت استخوان را در نیتروژن مایع خشک و پس از کوبیدن در آونگ استریل، درون تیوب یک و نیم قرار گرفت. اولین مرحله برای استخراج RNA از سلولهای حیوانی از بین بردن دیواره سلولها با کمک یک بافر لیزکننده (در اینجا RB Buffer) میباشد، لذا µl350 از RB Buffer به نمونه (رسوب سلولی حاصل از سانتریفیوژ) اضافه شد (از قبل به ازای هر یک میلی لیتر 10 میکرولیتر mercaptoethanol –βنیز به بافر اضافه شده بود) و بهمدت پنج دقیقه در دمای اتاق قرار داده شد. در مرحله بعد Filter Column درون Collection Tube قرار گرفت و مخلوط نمونه به Filter Column انتقال داده شد و با دور rpm14000 بهمدت دو دقیقه سانترفیوژ گردید. بعد از سانترفیوژ محلول روشن از Collection Tube به یک تیوپ میکروسانترفیوژ جدید انتقال یافت. سپس هم حجم آن یعنی µl350 اتانول 70 درصد به آن اضافه گردید سپس بهخوبی ورتکس شد. RB Mini Column درون Collection Tube قرار گرفت و نمونهای که اتانول به آن اضافه شده بود به RB Mini Column انتقال یافت و با سرعت rpm 14000 بهمدت یک دقیقه سانترفیوژ گردید و محلول درون Collection Tube دور ریخته شد. در مرحله بعد µl500 از Wash Buffer1 به RB Mini Colu mn اضافه گردید و با سرعتrpm 14000بهمدت یک دقیقه سانترفیوژ گردید و محلول درون Collection Tube دور ریخته شد. در ادامه RB Mini Column با µl750 از Wash Buffer2 با سرعت rpm14000 بهمدت یک دقیقه سانترفیوژ شد و محلول درون Collection Tube دور ریخته شد. این مرحله دوبار تکرار شد، سپس بهمدت سه دقیقه با سرعت rpm 14000 سانترفیوژ انجام شد. سپسRB Mini Column درون Elution Tube قرار داده شد و µl50 از RNase-free ddH2O به RB Mini Column اضافه شد و یک دقیقه به آن زمان داده شد و بعد از یک دقیقه بهمدت دو دقیقه با سرعت rpm14000 سانترفیوژ گردید. محلول درون Elution Tube، RNAهای استخراج شده بود که در 70- نگهداری شدند. سنتز cDNA طبق دستورالعمل موجود در کیت فرمنتاز (K1622) تهیه گردید. واکنش رونویسی معکوس با استفاده از آنزیم RevertAid™M-MuLV Reverse transcriptas صورت گرفت. هنگام تهیه cDNA از نمونه تخلیص شده پس از قرائت جذب، حجمی شامل 1000 نانوگرم RNA برداشته، سپس نیم میکرولیتر Random Hexamers (الیگودئوکسی ریبو نوکلوتید که بهعنوان یک پرایمر برای شروع سنتز cDNA استفاده میشود)، نیم میکرولیتر پرایمر oligodT و تا حجم 12 میکرولیتر آب به کیت اضافه گردید و به دمای 65 درجه برای پنج دقیقه منتقل گردید. و سپس بهمدت دو دقیقه بر روی یخ قرار گرفت. در مرحله بعد µl4 از 5X Reaction Buffer و µl 2 از dNTP Mix و µl1 از RiboLock RNase Inhibitor و µl1 از RevertAid RT به ترکیب قبل که برای پنج دقیقه در دمای 65 قرار گرفته بود اضافه شد. سپس ترکیب ابتدا بهمدت پنج دقیقه در دمای 25 قرار گرفت. بعد از آن بهمدت 60 دقیقه در دمای 42 قرار گرفت. در آخر بهمنظور از کار افتادن آنزیم RT، تیوبهای واکنش بهمدت پنج دقیقه در دمای 70 درجه سانتیگراد قرار داده شد. cDNA آماده شده جهت انجام RT- PCRمورد استفاده قرار گرفت. دمای اتصال برای همه پرایمرهاC° 60 بود. لازم بهذکر است که از GAPDH بهعنوان ژن کنترل استفاده شد. توالی پرایمرهای مورد استفاده نیز در جدول 2 نشان داده شده است. پس از اتمام فعالیت دستگاه و مشاهده نمودارها مبنی بر افزایش تعداد قطعه مورد نظر و میزان نشرفلورسانس با محاسبه ΔΔCt میزان تغییر در بیان ژن مورد نظر نسبت به GAPDH و حالت کنترل که فاقد محیطهای تمایزی است با استفاده از فرمول Ct= Ct interets- Ct GAPDHو Ct= Ct Treat- Ct Un Treat سنجیده شد، سپس با استفاد از فرمول ΔΔCt-2 میزان بیان ژنها محاسبه گردید.
تجزیه و تحلیل آماری
جهت بررسی طبیعی بودن توزیع یافتهها از آزمون شاپیروویلک و همچنین جهت تجزیه و تحلیل یافتهها از آزمونهای t مستقل، آنالیز واریانس دو طرفه همراه با آزمون تعقیبی بنفرونی در نرمافزارversion 16 SPSS استفاده شد (0/05≥p).
ملاحظات اخلاقی
تمام اصول کار با حیوانات طبق بیانیه هلسینکی سال 2008 و کد اخلاق از کمیته اخلاق وزارت بهداشت درمان و آموزش پزشکی دانشگاه علوم پزشکی و خدمات بهداشتی درمانی استان کرمان به شماره IR.KMU.REC.1396.1562 و تاییدیه پروپوزال ازگروه فیزیولوژی ورزش دانشگاه آزاد اسلامی واحد تهران مرکز صورت گرفت.
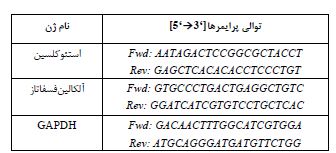
جدول2: توالی پرایمرها برای RT-PCR
نتایج
سطوح بیان ژن استئوکلسین و آلکالینفسفاتاز بافت استخوان موشهای صحرایی در جدول 3 گزارش شده است. نتایج آزمون t مستقل نشان داد مصرف پراکساید هیدروژن اثر معنیداری بر کاهش بیان ژن OC (p=0/001 ، t=-18/3) و (p=0/02 ، t=-3/1)ALP بافت استخوان موشهای صحرایی در مقایسه با گروه کنترل داشت، در حالیکه اثر تزریق DMSO در مقایسه با گروه کنترل در متغیرهای(p=0/22 ، t=-1/4) OC و(p=0/14 ، t=1/7) ALP معنادار نبود.
نتایج آزمون آنالیز واریانس دو طرفه در جدول 4 نشان داد هشت هفته تمرین (0/24= اندازه اثر، 0/46= P=0/02، F) و مصرف ویتامین دی (0/88= اندازه اثر P=0/0001، F=14/97) اثر معنیداری بر افزایش OC بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن داشت. همچنین اثرات تعاملی تمرین همراه با مصرف ویتامین دی بر OC بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن (0/34= اندازه اثر، 0/103= P=0/005، F) افزایش معنادار داشت. نتایج آزمون تعقیبی بنفرونی نشان داد، اثر مداخلات گروههای 5 و3 در مقایسه با گروههای 2 و 4 در افزایش OC بهطور معناداری بیشتر بود (0/001=p)، همچنین گروه پراکساید هیدروژن + تمرین نسبت به گروه پراکساید هیدروژن سبب افزایش معنادار OC شد (0/004=p). اما تفاوتی بین گروه پراکساید هیدروژن + تمرین و ویتامین دی با پراکساید هیدروژن + ویتامین دی در OC مشاهده نشد (شکل 1). هشت هفته تمرین (0/79= اندازه اثر، 0/0001= P، 75/74= F) و مصرف ویتامین دی (0/75= اندازه اثر، 60/67= P= 0/0001، F) اثر معنیداری بر افزایش ALP بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن داشت. تمرین همراه با مصرف ویتامین دی نیز اثرات تعاملی در افزایش ALP بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن داشت (0/61= اندازه اثر، 31/17= P= 0/0001، F) (جدول 4). نتایج آزمون تعقیبی بنفرونی نشان داد تاثیر مداخلات گروه 5 نسبت به گروه های 2، 3 و 4 بر افزایش ALP بهطور معناداری بیشتر است (0/001=p). اما تفاوتی بین گروههای پراکساید هیدروژن + ویتامین دی با پراکساید هیدروژن + تمرین در بیان ALP مشاهده نشد. اگرچه مداخلات این دو گروه نسبت به گروه پراکساید هیدروژن در افزایش بیان ALP معنادار بود (شکل 2).
جدول 3: مقادیر بیان ژن استئوکلسین و آلکالینفسفاتاز در گروه های سالم و تزریق پراکسایدهیدروژن با مداخله تمرین و ویتامین دی

جدول 4: نتایج آزمون آنووای دو راهه جهت بررسی اثر پراکساید هیدروژن، تمرین و ویتامین دی بر متغیرهای تحقیق
.JPG)
δ: اثرمعنادار تمرین بر افزایش OC و ALP؛ : اثر معنادار ویتامین دی بر افزایش OC و ALP؛ : اثر معنادار تعامل تمرین و ویتامین دی بر افزایش OC و ALP.
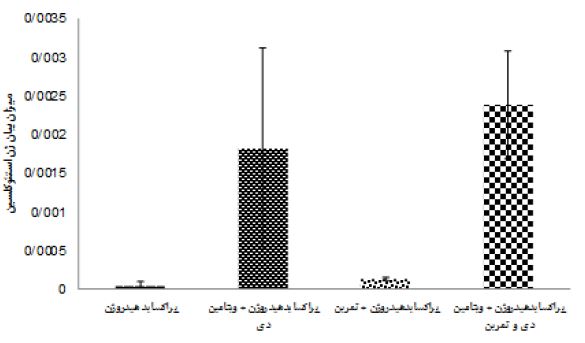
شکل 1: میانگین بیان ژن اسئوکلسین بافت استخوان در گروه های تزریق پراکسایدهیدروژن با مداخله تمرین و ویتامین دی
: aتفاوت معنادارگروه آزمایشی نسبت به گروه ویتامین دی(p<0.05)
: bتفاوت معنادارگروه آزمایشی نسبت به گروه تمرین + ویتامین دی(p<0.05)
: cتفاوت معنادارگروه های آزمایشی نسبت به گروه تمرین(p<0.05)
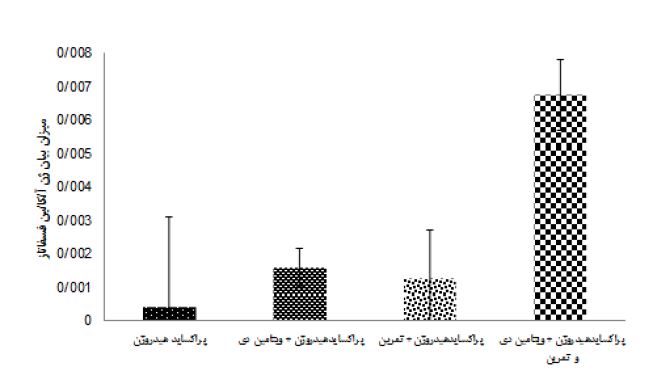
شکل 2: میانگین بیان ژن آلکالینفسفاتاز بافت استخوان در گروه های تزریق پراکسایدهیدروژن با مداخله تمرین و ویتامین دی
: a تفاوت معنادارگروه آزمایشی نسبت به گروه تمرین + ویتامین دی(p<0.05)
بحث
در مطالعه حاضر با تزریق پراکساید هیدروژن به موشهای نر سعی شد استرس اکسیداتیو در بدن آنها القا شود، سپس با انجام مداخله تمرینی به شکل هوازی و تغذیه (مصرف ویتامیندی) روند استئوژنیک را در موشها مورد بررسی قرار دادیم. نتایج نشان داد که مداخلات تمرین، مکمل ویتامین دی و تعامل آنها در افزایش بیان ژنهای استئوکلسین و آلکالینفسفاتاز معنادار بود. بیشترین افزایش در بیان ژن استئوکلسین در گروههای پراکساید هیدروژن + ویتامین دی و پراکساید هیدروژن + تمرین و ویتامین دی مشاهده شد، اما در بیان ژن آلکالینفسفاتاز گروه پراکساید هیدروژن + تمرین و ویتامین دی سبب بیشترین افزایش در مقایسه با سایر گروهها شد. کاهش معنادار بیان ژن آلکالینفسفاتاز و استئوکلسین در گروه پراکساید هیدروژن در مقایسه با گروه کنترل سالم حاکی از اثرات مخرب آن بر بافت استخوان بود، اما مکمل یاری ویتامین دی فعالیت آلکالینفسفاتاز را افزایش داد و سبب افزایش چشمگیر بیان استئوکلسین شد. پژوهشهای بسیاری تاثیر مصرف مکمل ویتامین دی را بر استخوان مورد پژوهش قرار دادند و نشان میدهند که اثرات ویتامین دی بر استخوان همچون یک تیغ دولبه است، چراکه اگرچه تاثیر آن بر فعالیت آلکالینفسفاتاز، سطوح استئوکلسین، استئوپوئنتین و کلاژن نوع I در تایید یافتههای این پژوهش مثبت گزارش شده است، اما اثرات آن بر معدنی شدن استخوان در برخی پژوهشها مثبت و در برخی منفی گزارش شده است (19, 3). همچنین مصرف دوزهای بالای ویتامین دی یا کمبود کلسیم ممکن است سبب شود ویتامین دی روند استئوکلاستوژنزیز را افزایش دهد (20). پژوهش رهام و همکارانش (2018) بر موشهای آورکتومی شده نشان داد که مصرف مکمل ویتامین دی و کلسیم با افزایش سطوح سرمی آلکالینفسفاتاز و استئوکلسین همراه بود، که یافتههای این پژوهش را تایید کرد (21). به نظر میرسد تنظیمات موضعی ویتامین دی تحتتاثیر وضعیت کلسیم و مرحله افتراق سلولهای استخوانی باشد (19). تاثیر مستقیم آنابولیکی ویتامین دی در استخوان وابسته به فعالیت گیرنده ویتامین دی (VDR) است. فعالیت VDR در استئوبلاستهای بالغ هر دو وضعیت آنابولیکی و ضد کاتابولیکی را سبب میشود. تاثیرات ضد جذبی در استخوان وابسته بهکاهش در نسبت RANKL/OPG است؛ در مقابل تاثیرات آنابولیکی آن مربوط به افزایش در بیان مسیر سیگنالینگ LRP5/Wnt است (20). همچنین ژن استئوکلسین حاوی بخش پاسخدهنده به ویتامین دی است که باعث میشود بیان استئوکلسین را از طریق مسیر VDR-VDRE در موش ها و استئوبلاستهای انسان افزایش دهد (4) که میتواند بخشی از دلایل افزایش قابل توجه بیان ژن استئوکلسین را توضیح دهد. همچنین نتایج این پژوهش نشان داد تمرین هوازی روشی موثر در افزایش بیان ژن آلکالینفسفاتاز و استئوکلسین در موشهای مسموم شده با پراکساید هیدروژن است. در تایید یافتههای این پژوهش ژانگ و همکارانش (2017) افزایش در بیان ژن استئوکلسین را در موشهای پنج هفته ای که بهطور متوسط 5000 متر در هر روز چرخ می زدند نشان دادند (7). همچنین در پژوهش ناگوئیرا و همکارانش (2016) بیان ژن استئوکلسین در موشهایی که چهار هفته بر تردمیل دویدند نیز افزایش یافت (6). گزیئالوئی و همکارانش (2015) نیز نشان دادند در موشهای اورکتومی شده فعالیت به همراه مصرف مکمل نارنجینگ بیشترین افزایش را در بیان ژن استئوکلسین در مقایسه با موشهای گروه کنترل ایجاد کرد (9). اوویی و همکارانش (2013) افزایش در مقادیر سرمی آلکالینفسفاتاز را با انجام 40 پرش در هفته گزارش دادند در حالیکه با تغییر در بار تمرین و برنامه تمرین پرش نتوانستند تغییری در مقادیر سرمی استئوکلسین گزارش کنند (22). تمرین اثر استخوانسازی بر متابولیسم استخوان دارد. سیستم اسکلتی ما به گونهای است که تحتتاثیر بار مکانیکی ناشی از جاذبه و انقباض عضلانی روند ریمودلینگ را از طریق انتقال مکانیکی تحریک میکند. انتقال مکانیکی در واقع به معنای پاسخ بیوشیمیایی به واسطه تحریک مکانیکی است. در اینجا تحریک مکانیکی ناشی از فعالیت بدنی منجر به تقویت و بهبود متابولیسم استخوان شد. مطالعه حاضر نشان داد که اثر مفید فعالیت بدنی بر استخوانسازی تحت تاثیر استرس اکسیداتیو سیستمی حداقل به واسطه تزریق پراکساید هیدروژن قرار نمیگیرد. تاثیر فعالیت بدنی و بار مکانیکی بر استخوان تاکنون به اشکال مختلف مورد بررسی قرار گرفته است (6). یکی از فواید فعالیت بدنی افزایش گردش خون در عضلات و استخوانها است که اکسیژن، مواد غذایی و هورمونهای لازم را در اختیار بافت قرار میدهد. افزایش توده عضلانی به واسطه فعالیت بدنی کشش بیشتری برای اتصالات استخوانی-تاندونی وارد می کند که سبب تحریک عوامل استخوانساز و افزایش مواد معدنی و توده استخوان میشود (6). بار تحمیل شده به وسیله تردمیل تشکیل استخوان را تحریک کرده، از کاهش استخوان در موشها میکاهد. شواهد بسیار قوی وجود دارد که نشان میدهد عدم فعالیت، سطوح mRNA مارکرهای جذب استخوان TRACP، کاتپسین و گیرندههای کلسی تونین را کاهش میدهد، در حالی که شرکت در فعالیت بدنی مارکرهای استئوژنیک نظیر استئوکلسین، آلکالینفسفاتاز، ،RUNX2، OSX، BMP2 و کلاژن نوع I را در استئوبلاست ها افزایش میدهد (23). به نظر میرسد فعالیت بدنی از طریق دستکاری سه مسیر مهم سیگنالینگ RANKL/RANK/OPG، Wnt/βCatenin وJagged/Notch 1 and 3 سبب تعدیل و اثرگذاری بر استئوبلاست ها میشود و توده استخوان را از طریق عملکرد استئوبلاستها و استئوکلاستها تنظیم میکند (23). افزایش بیان ژن استئوکلسین و آلکالینفسفاتاز در این مطالعه نشاندهنده فعالیت استئوبلاستها در موشهای تحت تمرین بود. این پژوهش برای اولین بار نشان داد که اثر تعاملی تمرین و ویتامین دی در افزایش بیان ژن آلکالینفسفاتاز و استئوکلسین در موشهای مسموم شده با تزریق صفاقی پراکساید هیدروژن موثر است. این نتایج حاکی از آن است که تمرین و مصرف ویتامین دی نقش مثبتی بر روند استئوژنیک دارد. پژوهش شریعتی و همکارانش (2019) که بر موشهای مسموم شده با پراکساید هیدروژن انجام شد، نشان داد که سطوح سرمی استئوکلسین و نه آلکالینفسفاتاز در گروه پراکساید هیدروژن +تمرین + ویتامین دی افزایش معنادار یافت (24). این یافتهها حداقل با بخشی از نتایج این پژوهش همسان است. مقادیر آلکالینفسفاتاز نیز اگرچه در گروه تعاملی نسبت به سایر گروهها بیشتر بود اما معناداری آماری را بهدست نیاورد. اگرچه یافتههای بهدست آمده( مقادیر سرمی در مقابل بیان ژن) کاملاً قابل مقایسه نمیباشند، اما شاید بتوان بیان داشت که تبدیل آنچه که بهعنوان بیان ژن میشناسیم به پروتئینهای در دسترس در سرم به زمان زیادی نیاز دارد و ممکن است افزایشهای مشاهده شده در این پژوهش بهطور دقیق بازتابی از افزایش در استئوکلسین سرم یا عدم مشاهده تغییر در آلکالینفسفاتاز نباشد. ضمناً همانگونه که محقق در پژوهش اشاره کردهاند، منابع ترشح آلکالینفسفاتاز در سرم متعدد است و اندازهگیری بیان ژن آن به درستی نشان از افزایش فعالیت استئوبلاستها دارد. پژوهش آکاگاوا و همکارانش (2018) نشان داد که مصرف فرم فعال ویتامین دی به شکل آلفاکلسیدول (Alfacalcidol) بههمراه فعالیت هوازی کم شدت برای 2 هفته یا 6 هفته همراه با تاثیراتی بر استخوان است. آنها نشان دادند که شش هفته تاثیر همزمان فعالیت و آلفاکلسیدول با افزایش معدنی شدن استخوان همراه است (25). اگرچه در این پژوهش سایر مارکرها اندازه گیری نشد، اما افزایش BMD به طور غیر مستقیم بازتابی از افزایش در فعالیت مارکرهای استئوژنیک بود. در این پژوهش همانگونه که بیان شد تاثیر تعاملی بر افزایش استئوکلسین و آلکالینفسفاتاز معنادار بود که با توجه به افزایش متغیر های یاد شده در هر یک از مداخلات، نتیجهای دور از انتظار نبود. این پژوهش برای اولین بار انجام شد تا بیان ژنهای استئوژنیک را در بافت استخوان موشهای مسموم شده با پراکساید هیدروژن مورد بررسی قرار دهد، چنانچه در این پژوهش مقادیر بیان ژن متغیرهای جذب استخوان نیز اندازهگیری می شد بسیار سودمند بود. همچنین اندازهگیری میزان پروتئین استئوکلسین و آلکالینفسفاتاز در بافت استخوان یا اندازه گیری چگالی مواد معدنی میتوانست تاثیر مداخلات را بهگونه محکم تری بر استخوان بیان دارد. لذا به سایر پژوهشگران پیشنهاد میشود علاوه بر بررسی متغیرهای یاد شده؛ پژوهشی بر گروههای سالم جهت مقایسه با گروه های تحت تزریق پراکساید هیدروژن انجام دهند.
نتیجهگیری
با توجه به اینکه تمرین و مصرف ویتامین دی اثرات ناشی از مسمویت رادیکال آزاد در استخوان را تعدیل می کنند، لذا این شیوه مداخلات میتواند در بیماران پوکی استخوان، افراد سالمند یا بیمارانی که تحت تاثیر مقادیر افزایش یافته رادیکال آزاد در بدنشان هستند، مورد استفاده قرار بگیرد. اگرچه بررسی و تعمیم دقیق نتایج به انسانها نیاز به پژوهشهای بیشتری دارد.
سپاسگزاری
بدین وسیله نویسندگان این مقاله مراتب تشکر و قدردانی خود از دکتر محمدعلی آذربایجانی، دکتر شیرین زیلائی بوری، دکتر مارینا شریعتی و دکتر غلامرضا کاکا به دلیل حمایتهایشان در اجرای طرح را اعلام میدارند، همچنین از دست اندرکاران محترم دانشگاه کرمان و همکارانی که با یاری آنها اجرای این پژوهش به پایان رسید سپاسگزاریم. مقاله حاضر از پایان نامه دکتری نویسنده اول با عنوان« تاثیر هشت هفته تمرین هوازی و مکمل یاری ویتامین دی بر بیان عوامل رشدی و مارکرهای بیوشیمیایی استخوان موشهای نر مسموم شده با پراکساید هیدروژن» مستخرج گردیده است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
پوکی استخوان یک بیماری متابولیک استخوان است که با کاهش قدرت استخوان و افزایش خطر شکنندگی و شکستگی استخوان همراه است. شواهدی وجود دارد که بیان میدارد استرس اکسیداتیو با پوکی استخوان همراه است. همچنین ارتباط بیوشیمیایی بین افزایش استرس اکسیداتیو و کاهش توده معدنی استخوان (BMD) در مردان و زنان وجود دارد (1). تولید گونههای فعال اکسیژن یک نتیجه غیر قابل تغییر متابولیسم هوازی است که در ابتدا در میتوکندری اتفاق میافتد. این فرآیند سوپراکساید را که بسیار فعال است و عمر کوتاهی دارد، تولید میکند. سوپراکساید به سرعت به شکل پایدارتر و کم فعالتر پراکساید هیدورژن (H2O2 یا آب اکسیژنه) تبدیل میشود که بیشترین شکل گونههای فعال اکسیژن (Reactive Oxygen Species-ROS) است که به آزادی از غشاء میتوکندری به درون سیتوزول عبور میکند (2). این ROSها میتوانند سبب آسیب به DNA، پروتئین و چربی شوند. سطوح بالای تولید اکسیدانها در طی متابولیسم طبیعی سلول (چرخه انتقال الکترون)، تحریکات محیطی (نظیر سایتوکاینها یا اشعه ماوراء بنفش) و در زمان بیماریها، تعادل نرمال ردوکس را برهم میزنند و سلولها را به سمت وضعیت استرس اکسیداتیو هدایت میکنند (1). استخوان اما یک بافت پویا و بالقوه احیاکننده است که میتواند تحت تاثیر نیازهای فیزیکی و برای ترمیم پس از آسیب، ریمودلینگ شود. استئوبلاست نقش مهمی را در رسوب مواد معدنی به شکل کریستالهای هیدروکسی اپاتیت ساخته شده از کلسیم هیدروکسی فسفات برعهده دارد. بلوغ استئوبلاستها به دو مسیر تکثیر و افتراق بستگی دارد. افتراق و معدنیسازی در استئوبلاستها زمانی رخ میدهد که تکثیر رخ دهد و مراحل مختلف افتراق استئوبلاستها به وسیله بیان ژنهای خاص مشخص میشود. افتراق اولیه بهوسیله بیان سطوح بالای آنزیم آلکالینفسفاتاز (ALP) و افتراقهای بعدی بهوسیله بیان استئوکلسین (OC) و استئوپوئنتین مشخص میشود (3). استئوکلسین بهعنوان اسید گاما کربوکسی گلوتامیک اسید حاوی پروتئین استخوان (Bone Gamma-Carboxyglutamic Acid-Containing Protein) شناخته شده است و فراوانترین پروتئین غیرکلاژنی ماتریکس استخوان میباشد. همانگونه که اشاره شد، ژن استئوکلسین در طی تکثیر استئوبلاست ها غیرفعال است در حالیکه تا 200 برابر در طی افتراق استئوبلاستها و بلوغ آنها رونویسی میشود (4). همچنین استئوبلاست ها منشاء عظیمی از آلکالینفسفاتاز هستند، از این رو افزایش بیان ژن آلکالینفسفاتاز و همچنین سطوح سرمی آن نشانه ای از تحریک سلولهای استئوبلاست بوده و در نتیجه سیگنالینگ سلولی را در راستای افزایش تراکم مواد معدنی استخوان افزایش میدهد. ژن آلکالینفسفاتاز نقش مهمی در سوخت و ساز فعال و تامین فسفات غیر آلی آزاد با هیدرولیز اجزای فسفو بر عهده دارد. گزارش شده است که تغییر در ژن آلکالینفسفاتاز ممکن است تعیینکننده مهمی در کاهش استخوان ناشی از سن باشد و مسیر سوخت و ساز فسفات بهعنوان یک هدف جدید در پیشگیری از پوکی استخوان محسوب شود (5). تغییر در بیان ژنهای یاد شده تحتتاثیر تحریکات مکانیکی میباشد و پژوهش های انجام شده در این خصوص نشان میدهند که تمرین به اشکال مختلف هوازی بر افزایش بیان ژن آلکالینفسفاتاز و استئوکلسین اثرات مطلوبی دارد (9-6). علاوه بر فعالیت بدنی محققین استفاده از برخی مکملها جهت بهبود وضعیت توده معدنی استخوان را به افراد توصیه میکنند. از جمله این مکملها ویتامین دی می باشد که جذب و معدنیسازی ماتریکس استخوان را افزایش می دهد. از لحاظ بیولوژیکی، مکملهای کلسیم و ویتامین دی باعث کاهش سرعت تخریب توده استخوانی و خطر شکستگی میشوند (10). همچنین پژوهش ها نشان میدهد که مکمل یاری ویتامین دی تشکیل استخوان و مارکرهای استئوژنیک ALPو OC را افزایش میدهد (3). اثرات مخرب invitro پراکساید هیدروژن بر بافت استخوان نشان داد که H2O2 از دست رفتن استخوان به وسیله استئوکلاستها را تحریک و سبب پوکی استخوان میگردد (11). اثرات invivo پراکساید هیدروژن بر استخوان اما تاکنون مورد پژوهش قرار نگرفته است درحالیکه بر سایر بافتهایی نظیر کبد، کلیه، شش ها، مغز و قلب بررسی شده است (15-12). همچنین شواهد رو به رشد افزایش پوکیاستخوان در مردان ایرانی در مقایسه با همتایان آمریکایی (16) نیز بر ضرورت انجام این پژوهش تاکید دارد، لذا مطالعه حاضر به هدف بررسی اثر H2O2، فعالیت بدنی و مصرف ویتامین دی بر بیان ژنهای درگیر در روند استئوژنیک موشهای نر انجام شد.
روش بررسی
در این کارآزمایی تجربی با طرح پس آزمون 36 سر موش صحرایی نر بالغ نژاد ویستار با وزن 20±200 گرم از مرکز پرورش حیوانات دانشگاه علوم پزشکی شیراز خریداری و پس از انتقال به خانه حیوانات مرکز تحقیقات فیزیولوژی دانشگاه علوم پزشکی کرمان بهمدت یک هفته جهت سازگاری در قفس مخصوص حیوانات تحت شرایط استاندارد، دمای 2± 22 درجه سانتی گراد، رطوبت 5%±50، چرخه روشنایی/ تاریکی 12 ساعت نگهداری شدند. رتها دسترسی آزاد به آب و غذا داشتند. رژیم غذایی رتها (شرکت غذای دام پارس، تهران، ایران) از ذرت زمین، یونجه، کنجاله سویا، گندم، ویتامین ها، مواد معدنی، جوششیرین و نمک بر اساس 55% کربوهیدرات، 5/17% پروتئین، 95/1% چربی (ماده آلی محلول در اتر؛EE)، 0/56% کلسیم، 0/62% تی فسفر، 6/6% فیبر خام، انرژی متابولیزه شدن (ME) kcal/g 3/16، انرژی دفنیشن (DE) kcal/g 3/56 تشکیل شده بود. این اطلاعات توسط شرکت تولیدکننده ارائه شده است. معیار ورود شامل: موشهای سالمنر، نژاد ویستار، حداقل سن هشت هفته و وزن بالای 180 گرم بود و معیار خروج شامل: مشاهده هر گونه بیماری یا کسالت در موشها، کاهش وزن محسوس، حساسیت غذایی، هر گونه تماس پراکساید هیدروژن با پوست و عدم تمرینپذیری بود.
گروه بندی حیوانات
پیش از گروهبندی، موشها یک هفته برای آشنایی با نحوه فعالیت بر نوارگردان دویدند. سپس نمونهها به طور تصادفی بهشش گروه شش سری شامل: (1) کنترل سالم؛ (2) پراکساید هیدروژن؛ (3) پراکساید هیدروژن + ویتامین دی؛ (4) پراکساید هیدروژن + تمرین؛ (5) پراکساید هیدروژن + تمرین و ویتامین دی؛ و (6) شم (دی متیل سولفید اکساید-DMSO) تقسیم شدند.
تزریق پراکساید هیدروژن
رتهای در گروههای 2، 3، 4 و 5 تزریق درون صفاقی پراکساید هیدروژن (تهیه شده از شرکت Merck) را با دوز یک mmol/kg سه بار در هفته در روزهای زوج دریافت کردند (12).
مکمل ویتامین دی
درمان با ویتامین دی در گروههای 3 و 5 به این صورت بود که رتها gram/kgµ 0/5 میکروگرم ویتامین دی بهصورت تزریق روزانه درون صفاقی طی 8 هفته دریافت کردند (17). از آمپول ویتامین دی با نام تجاری DITHRECOL از شرکت کاسپین ویتامین؛ تهران، ایران با غلظت UI/ml 300000 استفاده شد. جهت رسیدن به دوز مناسب تزریقی از نرمال سالین برای رقیق کردن و از دی متیل سولفوکساید جهت حل کردن ویتامین دی در سالین استفاده شد. با توجه به لزوم بررسی تاثیر حلال مذکور یک گروه بنام DMSO تعریف شد که روزانه فقط حلال دریافت کردند.
برنامه تمرین
رتهای گروههای 4 و 5 به طور روزانه فعالیت تمرینی منظم بر روی تردمیل بهمدت 8 هفته انجام دادند. رتها در هفته اول با سرعتm/min 8 و شیب 10 درجه بهمدت 30 دقیقه بر روی تردمیل تمرین کردند، در هفته دوم با سرعت m/min 12 با شیب و زمان مشابه، در هفته سوم با سرعت m/min 16 با شیب مشابه بهمدت 45 دقیقه و در چهارمین هفته با سرعت m/min 20 با شیب مشابه بهمدت 45 دقیقه تمرین کردند. طی هفتههای پنجم تا هشتم رتها در سرعت m/min 20 با زاویه ده درجه بهمدت 60 دقیقه هر روز تمرین داده شدند (جدول 1) (18).
جدول1: پروتکل تمرین پژوهش

نحوه استخراج نمونه و اندازهگیری بیان ژن
بیست و چهار ساعت پس از آخرین جلسه و بعد از 12 ساعت گرسنگی، موشهای صحرایی با استنشاق کلروفرم بیهوش شدند، سپس به وسیله خونگیری مستقیم ازقلب، قربانی شدند. استخراج بافت استخوان تیبیا موشها توسط متخصص انجام شد. سپس نمونهها در کرایوتیوب در نیتروژن مایع قرار داده شدند و برای اندازهگیری بیان ژن استئوکلسین و آلکالین فسفاتاز به روش واکنش زنجیرهای پلیمراز بیدرنگ (RealTime PCR -real-time polymerase chain reaction) در دمای 70- درجه سانتیگراد نگهداری شدند. استخراج RNA بر اساس دستورالعمل کیت استخراج RNA ساخت شرکت یکتا تجهیز، با استفاده از محلولهای کیت استخراج و پروتکل پیشنهادی شرکت سازنده انجام شد. برای این منظور 30 میلیگرم بافت استخوان را در نیتروژن مایع خشک و پس از کوبیدن در آونگ استریل، درون تیوب یک و نیم قرار گرفت. اولین مرحله برای استخراج RNA از سلولهای حیوانی از بین بردن دیواره سلولها با کمک یک بافر لیزکننده (در اینجا RB Buffer) میباشد، لذا µl350 از RB Buffer به نمونه (رسوب سلولی حاصل از سانتریفیوژ) اضافه شد (از قبل به ازای هر یک میلی لیتر 10 میکرولیتر mercaptoethanol –βنیز به بافر اضافه شده بود) و بهمدت پنج دقیقه در دمای اتاق قرار داده شد. در مرحله بعد Filter Column درون Collection Tube قرار گرفت و مخلوط نمونه به Filter Column انتقال داده شد و با دور rpm14000 بهمدت دو دقیقه سانترفیوژ گردید. بعد از سانترفیوژ محلول روشن از Collection Tube به یک تیوپ میکروسانترفیوژ جدید انتقال یافت. سپس هم حجم آن یعنی µl350 اتانول 70 درصد به آن اضافه گردید سپس بهخوبی ورتکس شد. RB Mini Column درون Collection Tube قرار گرفت و نمونهای که اتانول به آن اضافه شده بود به RB Mini Column انتقال یافت و با سرعت rpm 14000 بهمدت یک دقیقه سانترفیوژ گردید و محلول درون Collection Tube دور ریخته شد. در مرحله بعد µl500 از Wash Buffer1 به RB Mini Colu mn اضافه گردید و با سرعتrpm 14000بهمدت یک دقیقه سانترفیوژ گردید و محلول درون Collection Tube دور ریخته شد. در ادامه RB Mini Column با µl750 از Wash Buffer2 با سرعت rpm14000 بهمدت یک دقیقه سانترفیوژ شد و محلول درون Collection Tube دور ریخته شد. این مرحله دوبار تکرار شد، سپس بهمدت سه دقیقه با سرعت rpm 14000 سانترفیوژ انجام شد. سپسRB Mini Column درون Elution Tube قرار داده شد و µl50 از RNase-free ddH2O به RB Mini Column اضافه شد و یک دقیقه به آن زمان داده شد و بعد از یک دقیقه بهمدت دو دقیقه با سرعت rpm14000 سانترفیوژ گردید. محلول درون Elution Tube، RNAهای استخراج شده بود که در 70- نگهداری شدند. سنتز cDNA طبق دستورالعمل موجود در کیت فرمنتاز (K1622) تهیه گردید. واکنش رونویسی معکوس با استفاده از آنزیم RevertAid™M-MuLV Reverse transcriptas صورت گرفت. هنگام تهیه cDNA از نمونه تخلیص شده پس از قرائت جذب، حجمی شامل 1000 نانوگرم RNA برداشته، سپس نیم میکرولیتر Random Hexamers (الیگودئوکسی ریبو نوکلوتید که بهعنوان یک پرایمر برای شروع سنتز cDNA استفاده میشود)، نیم میکرولیتر پرایمر oligodT و تا حجم 12 میکرولیتر آب به کیت اضافه گردید و به دمای 65 درجه برای پنج دقیقه منتقل گردید. و سپس بهمدت دو دقیقه بر روی یخ قرار گرفت. در مرحله بعد µl4 از 5X Reaction Buffer و µl 2 از dNTP Mix و µl1 از RiboLock RNase Inhibitor و µl1 از RevertAid RT به ترکیب قبل که برای پنج دقیقه در دمای 65 قرار گرفته بود اضافه شد. سپس ترکیب ابتدا بهمدت پنج دقیقه در دمای 25 قرار گرفت. بعد از آن بهمدت 60 دقیقه در دمای 42 قرار گرفت. در آخر بهمنظور از کار افتادن آنزیم RT، تیوبهای واکنش بهمدت پنج دقیقه در دمای 70 درجه سانتیگراد قرار داده شد. cDNA آماده شده جهت انجام RT- PCRمورد استفاده قرار گرفت. دمای اتصال برای همه پرایمرهاC° 60 بود. لازم بهذکر است که از GAPDH بهعنوان ژن کنترل استفاده شد. توالی پرایمرهای مورد استفاده نیز در جدول 2 نشان داده شده است. پس از اتمام فعالیت دستگاه و مشاهده نمودارها مبنی بر افزایش تعداد قطعه مورد نظر و میزان نشرفلورسانس با محاسبه ΔΔCt میزان تغییر در بیان ژن مورد نظر نسبت به GAPDH و حالت کنترل که فاقد محیطهای تمایزی است با استفاده از فرمول Ct= Ct interets- Ct GAPDHو Ct= Ct Treat- Ct Un Treat سنجیده شد، سپس با استفاد از فرمول ΔΔCt-2 میزان بیان ژنها محاسبه گردید.
تجزیه و تحلیل آماری
جهت بررسی طبیعی بودن توزیع یافتهها از آزمون شاپیروویلک و همچنین جهت تجزیه و تحلیل یافتهها از آزمونهای t مستقل، آنالیز واریانس دو طرفه همراه با آزمون تعقیبی بنفرونی در نرمافزارversion 16 SPSS استفاده شد (0/05≥p).
ملاحظات اخلاقی
تمام اصول کار با حیوانات طبق بیانیه هلسینکی سال 2008 و کد اخلاق از کمیته اخلاق وزارت بهداشت درمان و آموزش پزشکی دانشگاه علوم پزشکی و خدمات بهداشتی درمانی استان کرمان به شماره IR.KMU.REC.1396.1562 و تاییدیه پروپوزال ازگروه فیزیولوژی ورزش دانشگاه آزاد اسلامی واحد تهران مرکز صورت گرفت.
جدول2: توالی پرایمرها برای RT-PCR

نتایج
سطوح بیان ژن استئوکلسین و آلکالینفسفاتاز بافت استخوان موشهای صحرایی در جدول 3 گزارش شده است. نتایج آزمون t مستقل نشان داد مصرف پراکساید هیدروژن اثر معنیداری بر کاهش بیان ژن OC (p=0/001 ، t=-18/3) و (p=0/02 ، t=-3/1)ALP بافت استخوان موشهای صحرایی در مقایسه با گروه کنترل داشت، در حالیکه اثر تزریق DMSO در مقایسه با گروه کنترل در متغیرهای(p=0/22 ، t=-1/4) OC و(p=0/14 ، t=1/7) ALP معنادار نبود.
نتایج آزمون آنالیز واریانس دو طرفه در جدول 4 نشان داد هشت هفته تمرین (0/24= اندازه اثر، 0/46= P=0/02، F) و مصرف ویتامین دی (0/88= اندازه اثر P=0/0001، F=14/97) اثر معنیداری بر افزایش OC بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن داشت. همچنین اثرات تعاملی تمرین همراه با مصرف ویتامین دی بر OC بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن (0/34= اندازه اثر، 0/103= P=0/005، F) افزایش معنادار داشت. نتایج آزمون تعقیبی بنفرونی نشان داد، اثر مداخلات گروههای 5 و3 در مقایسه با گروههای 2 و 4 در افزایش OC بهطور معناداری بیشتر بود (0/001=p)، همچنین گروه پراکساید هیدروژن + تمرین نسبت به گروه پراکساید هیدروژن سبب افزایش معنادار OC شد (0/004=p). اما تفاوتی بین گروه پراکساید هیدروژن + تمرین و ویتامین دی با پراکساید هیدروژن + ویتامین دی در OC مشاهده نشد (شکل 1). هشت هفته تمرین (0/79= اندازه اثر، 0/0001= P، 75/74= F) و مصرف ویتامین دی (0/75= اندازه اثر، 60/67= P= 0/0001، F) اثر معنیداری بر افزایش ALP بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن داشت. تمرین همراه با مصرف ویتامین دی نیز اثرات تعاملی در افزایش ALP بافت استخوان موشهای صحرایی مسموم شده با پراکساید هیدروژن داشت (0/61= اندازه اثر، 31/17= P= 0/0001، F) (جدول 4). نتایج آزمون تعقیبی بنفرونی نشان داد تاثیر مداخلات گروه 5 نسبت به گروه های 2، 3 و 4 بر افزایش ALP بهطور معناداری بیشتر است (0/001=p). اما تفاوتی بین گروههای پراکساید هیدروژن + ویتامین دی با پراکساید هیدروژن + تمرین در بیان ALP مشاهده نشد. اگرچه مداخلات این دو گروه نسبت به گروه پراکساید هیدروژن در افزایش بیان ALP معنادار بود (شکل 2).
جدول 3: مقادیر بیان ژن استئوکلسین و آلکالینفسفاتاز در گروه های سالم و تزریق پراکسایدهیدروژن با مداخله تمرین و ویتامین دی

جدول 4: نتایج آزمون آنووای دو راهه جهت بررسی اثر پراکساید هیدروژن، تمرین و ویتامین دی بر متغیرهای تحقیق
.JPG)
δ: اثرمعنادار تمرین بر افزایش OC و ALP؛ : اثر معنادار ویتامین دی بر افزایش OC و ALP؛ : اثر معنادار تعامل تمرین و ویتامین دی بر افزایش OC و ALP.

شکل 1: میانگین بیان ژن اسئوکلسین بافت استخوان در گروه های تزریق پراکسایدهیدروژن با مداخله تمرین و ویتامین دی
: aتفاوت معنادارگروه آزمایشی نسبت به گروه ویتامین دی(p<0.05)
: bتفاوت معنادارگروه آزمایشی نسبت به گروه تمرین + ویتامین دی(p<0.05)
: cتفاوت معنادارگروه های آزمایشی نسبت به گروه تمرین(p<0.05)

شکل 2: میانگین بیان ژن آلکالینفسفاتاز بافت استخوان در گروه های تزریق پراکسایدهیدروژن با مداخله تمرین و ویتامین دی
: a تفاوت معنادارگروه آزمایشی نسبت به گروه تمرین + ویتامین دی(p<0.05)
بحث
در مطالعه حاضر با تزریق پراکساید هیدروژن به موشهای نر سعی شد استرس اکسیداتیو در بدن آنها القا شود، سپس با انجام مداخله تمرینی به شکل هوازی و تغذیه (مصرف ویتامیندی) روند استئوژنیک را در موشها مورد بررسی قرار دادیم. نتایج نشان داد که مداخلات تمرین، مکمل ویتامین دی و تعامل آنها در افزایش بیان ژنهای استئوکلسین و آلکالینفسفاتاز معنادار بود. بیشترین افزایش در بیان ژن استئوکلسین در گروههای پراکساید هیدروژن + ویتامین دی و پراکساید هیدروژن + تمرین و ویتامین دی مشاهده شد، اما در بیان ژن آلکالینفسفاتاز گروه پراکساید هیدروژن + تمرین و ویتامین دی سبب بیشترین افزایش در مقایسه با سایر گروهها شد. کاهش معنادار بیان ژن آلکالینفسفاتاز و استئوکلسین در گروه پراکساید هیدروژن در مقایسه با گروه کنترل سالم حاکی از اثرات مخرب آن بر بافت استخوان بود، اما مکمل یاری ویتامین دی فعالیت آلکالینفسفاتاز را افزایش داد و سبب افزایش چشمگیر بیان استئوکلسین شد. پژوهشهای بسیاری تاثیر مصرف مکمل ویتامین دی را بر استخوان مورد پژوهش قرار دادند و نشان میدهند که اثرات ویتامین دی بر استخوان همچون یک تیغ دولبه است، چراکه اگرچه تاثیر آن بر فعالیت آلکالینفسفاتاز، سطوح استئوکلسین، استئوپوئنتین و کلاژن نوع I در تایید یافتههای این پژوهش مثبت گزارش شده است، اما اثرات آن بر معدنی شدن استخوان در برخی پژوهشها مثبت و در برخی منفی گزارش شده است (19, 3). همچنین مصرف دوزهای بالای ویتامین دی یا کمبود کلسیم ممکن است سبب شود ویتامین دی روند استئوکلاستوژنزیز را افزایش دهد (20). پژوهش رهام و همکارانش (2018) بر موشهای آورکتومی شده نشان داد که مصرف مکمل ویتامین دی و کلسیم با افزایش سطوح سرمی آلکالینفسفاتاز و استئوکلسین همراه بود، که یافتههای این پژوهش را تایید کرد (21). به نظر میرسد تنظیمات موضعی ویتامین دی تحتتاثیر وضعیت کلسیم و مرحله افتراق سلولهای استخوانی باشد (19). تاثیر مستقیم آنابولیکی ویتامین دی در استخوان وابسته به فعالیت گیرنده ویتامین دی (VDR) است. فعالیت VDR در استئوبلاستهای بالغ هر دو وضعیت آنابولیکی و ضد کاتابولیکی را سبب میشود. تاثیرات ضد جذبی در استخوان وابسته بهکاهش در نسبت RANKL/OPG است؛ در مقابل تاثیرات آنابولیکی آن مربوط به افزایش در بیان مسیر سیگنالینگ LRP5/Wnt است (20). همچنین ژن استئوکلسین حاوی بخش پاسخدهنده به ویتامین دی است که باعث میشود بیان استئوکلسین را از طریق مسیر VDR-VDRE در موش ها و استئوبلاستهای انسان افزایش دهد (4) که میتواند بخشی از دلایل افزایش قابل توجه بیان ژن استئوکلسین را توضیح دهد. همچنین نتایج این پژوهش نشان داد تمرین هوازی روشی موثر در افزایش بیان ژن آلکالینفسفاتاز و استئوکلسین در موشهای مسموم شده با پراکساید هیدروژن است. در تایید یافتههای این پژوهش ژانگ و همکارانش (2017) افزایش در بیان ژن استئوکلسین را در موشهای پنج هفته ای که بهطور متوسط 5000 متر در هر روز چرخ می زدند نشان دادند (7). همچنین در پژوهش ناگوئیرا و همکارانش (2016) بیان ژن استئوکلسین در موشهایی که چهار هفته بر تردمیل دویدند نیز افزایش یافت (6). گزیئالوئی و همکارانش (2015) نیز نشان دادند در موشهای اورکتومی شده فعالیت به همراه مصرف مکمل نارنجینگ بیشترین افزایش را در بیان ژن استئوکلسین در مقایسه با موشهای گروه کنترل ایجاد کرد (9). اوویی و همکارانش (2013) افزایش در مقادیر سرمی آلکالینفسفاتاز را با انجام 40 پرش در هفته گزارش دادند در حالیکه با تغییر در بار تمرین و برنامه تمرین پرش نتوانستند تغییری در مقادیر سرمی استئوکلسین گزارش کنند (22). تمرین اثر استخوانسازی بر متابولیسم استخوان دارد. سیستم اسکلتی ما به گونهای است که تحتتاثیر بار مکانیکی ناشی از جاذبه و انقباض عضلانی روند ریمودلینگ را از طریق انتقال مکانیکی تحریک میکند. انتقال مکانیکی در واقع به معنای پاسخ بیوشیمیایی به واسطه تحریک مکانیکی است. در اینجا تحریک مکانیکی ناشی از فعالیت بدنی منجر به تقویت و بهبود متابولیسم استخوان شد. مطالعه حاضر نشان داد که اثر مفید فعالیت بدنی بر استخوانسازی تحت تاثیر استرس اکسیداتیو سیستمی حداقل به واسطه تزریق پراکساید هیدروژن قرار نمیگیرد. تاثیر فعالیت بدنی و بار مکانیکی بر استخوان تاکنون به اشکال مختلف مورد بررسی قرار گرفته است (6). یکی از فواید فعالیت بدنی افزایش گردش خون در عضلات و استخوانها است که اکسیژن، مواد غذایی و هورمونهای لازم را در اختیار بافت قرار میدهد. افزایش توده عضلانی به واسطه فعالیت بدنی کشش بیشتری برای اتصالات استخوانی-تاندونی وارد می کند که سبب تحریک عوامل استخوانساز و افزایش مواد معدنی و توده استخوان میشود (6). بار تحمیل شده به وسیله تردمیل تشکیل استخوان را تحریک کرده، از کاهش استخوان در موشها میکاهد. شواهد بسیار قوی وجود دارد که نشان میدهد عدم فعالیت، سطوح mRNA مارکرهای جذب استخوان TRACP، کاتپسین و گیرندههای کلسی تونین را کاهش میدهد، در حالی که شرکت در فعالیت بدنی مارکرهای استئوژنیک نظیر استئوکلسین، آلکالینفسفاتاز، ،RUNX2، OSX، BMP2 و کلاژن نوع I را در استئوبلاست ها افزایش میدهد (23). به نظر میرسد فعالیت بدنی از طریق دستکاری سه مسیر مهم سیگنالینگ RANKL/RANK/OPG، Wnt/βCatenin وJagged/Notch 1 and 3 سبب تعدیل و اثرگذاری بر استئوبلاست ها میشود و توده استخوان را از طریق عملکرد استئوبلاستها و استئوکلاستها تنظیم میکند (23). افزایش بیان ژن استئوکلسین و آلکالینفسفاتاز در این مطالعه نشاندهنده فعالیت استئوبلاستها در موشهای تحت تمرین بود. این پژوهش برای اولین بار نشان داد که اثر تعاملی تمرین و ویتامین دی در افزایش بیان ژن آلکالینفسفاتاز و استئوکلسین در موشهای مسموم شده با تزریق صفاقی پراکساید هیدروژن موثر است. این نتایج حاکی از آن است که تمرین و مصرف ویتامین دی نقش مثبتی بر روند استئوژنیک دارد. پژوهش شریعتی و همکارانش (2019) که بر موشهای مسموم شده با پراکساید هیدروژن انجام شد، نشان داد که سطوح سرمی استئوکلسین و نه آلکالینفسفاتاز در گروه پراکساید هیدروژن +تمرین + ویتامین دی افزایش معنادار یافت (24). این یافتهها حداقل با بخشی از نتایج این پژوهش همسان است. مقادیر آلکالینفسفاتاز نیز اگرچه در گروه تعاملی نسبت به سایر گروهها بیشتر بود اما معناداری آماری را بهدست نیاورد. اگرچه یافتههای بهدست آمده( مقادیر سرمی در مقابل بیان ژن) کاملاً قابل مقایسه نمیباشند، اما شاید بتوان بیان داشت که تبدیل آنچه که بهعنوان بیان ژن میشناسیم به پروتئینهای در دسترس در سرم به زمان زیادی نیاز دارد و ممکن است افزایشهای مشاهده شده در این پژوهش بهطور دقیق بازتابی از افزایش در استئوکلسین سرم یا عدم مشاهده تغییر در آلکالینفسفاتاز نباشد. ضمناً همانگونه که محقق در پژوهش اشاره کردهاند، منابع ترشح آلکالینفسفاتاز در سرم متعدد است و اندازهگیری بیان ژن آن به درستی نشان از افزایش فعالیت استئوبلاستها دارد. پژوهش آکاگاوا و همکارانش (2018) نشان داد که مصرف فرم فعال ویتامین دی به شکل آلفاکلسیدول (Alfacalcidol) بههمراه فعالیت هوازی کم شدت برای 2 هفته یا 6 هفته همراه با تاثیراتی بر استخوان است. آنها نشان دادند که شش هفته تاثیر همزمان فعالیت و آلفاکلسیدول با افزایش معدنی شدن استخوان همراه است (25). اگرچه در این پژوهش سایر مارکرها اندازه گیری نشد، اما افزایش BMD به طور غیر مستقیم بازتابی از افزایش در فعالیت مارکرهای استئوژنیک بود. در این پژوهش همانگونه که بیان شد تاثیر تعاملی بر افزایش استئوکلسین و آلکالینفسفاتاز معنادار بود که با توجه به افزایش متغیر های یاد شده در هر یک از مداخلات، نتیجهای دور از انتظار نبود. این پژوهش برای اولین بار انجام شد تا بیان ژنهای استئوژنیک را در بافت استخوان موشهای مسموم شده با پراکساید هیدروژن مورد بررسی قرار دهد، چنانچه در این پژوهش مقادیر بیان ژن متغیرهای جذب استخوان نیز اندازهگیری می شد بسیار سودمند بود. همچنین اندازهگیری میزان پروتئین استئوکلسین و آلکالینفسفاتاز در بافت استخوان یا اندازه گیری چگالی مواد معدنی میتوانست تاثیر مداخلات را بهگونه محکم تری بر استخوان بیان دارد. لذا به سایر پژوهشگران پیشنهاد میشود علاوه بر بررسی متغیرهای یاد شده؛ پژوهشی بر گروههای سالم جهت مقایسه با گروه های تحت تزریق پراکساید هیدروژن انجام دهند.
نتیجهگیری
با توجه به اینکه تمرین و مصرف ویتامین دی اثرات ناشی از مسمویت رادیکال آزاد در استخوان را تعدیل می کنند، لذا این شیوه مداخلات میتواند در بیماران پوکی استخوان، افراد سالمند یا بیمارانی که تحت تاثیر مقادیر افزایش یافته رادیکال آزاد در بدنشان هستند، مورد استفاده قرار بگیرد. اگرچه بررسی و تعمیم دقیق نتایج به انسانها نیاز به پژوهشهای بیشتری دارد.
سپاسگزاری
بدین وسیله نویسندگان این مقاله مراتب تشکر و قدردانی خود از دکتر محمدعلی آذربایجانی، دکتر شیرین زیلائی بوری، دکتر مارینا شریعتی و دکتر غلامرضا کاکا به دلیل حمایتهایشان در اجرای طرح را اعلام میدارند، همچنین از دست اندرکاران محترم دانشگاه کرمان و همکارانی که با یاری آنها اجرای این پژوهش به پایان رسید سپاسگزاریم. مقاله حاضر از پایان نامه دکتری نویسنده اول با عنوان« تاثیر هشت هفته تمرین هوازی و مکمل یاری ویتامین دی بر بیان عوامل رشدی و مارکرهای بیوشیمیایی استخوان موشهای نر مسموم شده با پراکساید هیدروژن» مستخرج گردیده است.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1- Bai XC, Lu D, Bai J, Zheng H, Ke ZY, Li XM, et al. Oxidative Stress Inhibits Osteoblastic Differentiation of Bone Cells by ERK and NF-Κb. Biochem Biophys Res Commun 2004; 314(1): 197-207.
2- Bartell SM, Kim HN, Ambrogini E, Han L, Iyer S, Ucer SS, et al. Foxo Proteins Restrain Osteoclastogenesis and Bone Resorption by Attenuating H 2 O 2 Accumulation. Nat Commun 2014; 5: 3773.
3- Lancaster C, Harrison R. Effects of Vitamin D, K1, And K2 Supplementation on Bone Formation by Osteoblasts in Vitro: A Meta-Analysis. J Biom Biostat 2017; 8(4): 365.
1- Bai XC, Lu D, Bai J, Zheng H, Ke ZY, Li XM, et al. Oxidative Stress Inhibits Osteoblastic Differentiation of Bone Cells by ERK and NF-Κb. Biochem Biophys Res Commun 2004; 314(1): 197-207.
2- Bartell SM, Kim HN, Ambrogini E, Han L, Iyer S, Ucer SS, et al. Foxo Proteins Restrain Osteoclastogenesis and Bone Resorption by Attenuating H 2 O 2 Accumulation. Nat Commun 2014; 5: 3773.
3- Lancaster C, Harrison R. Effects of Vitamin D, K1, And K2 Supplementation on Bone Formation by Osteoblasts in Vitro: A Meta-Analysis. J Biom Biostat 2017; 8(4): 365.
4- Li J, Zhang H, Yang C, Li Y, Dai Z. An Overview of Osteocalcin Progress. J Bone Miner Metab 2016; 34(4): 367-79.
5- Tartibian B, Sheikhlou Z, Malandish A, Rahmati-Yamchi M, Afsargarebag R. Effect of Moderate-Intensity Aerobic Training on Alkaline Phosphatase Gene Expression and Serum Markers of Bone Turnover in Sedentary Postmenopausal Women. Tehran Univ Med J 2017; 74(10): 723-34. [Persian]
6- Nogueira JE, Branco LG, Issa JPM. Bone Repair: Effects of Physical Exercise and LPS Systemic Exposition. Injury 2016; 47(8): 1828-34.
7- Zhang J, Valverde P, Zhu X, Murray D, Wu Y, Yu L, et al. Exercise-Induced Irisin in Bone and Systemic Irisin Administration Reveal New Regulatory Mechanisms of Bone Metabolism. Bone Research 2017; 5: 16056.
8- Hell R, Ocarino N, Boeloni J, Silva J, Goes A, Santos R, et al. Physical Activity Improves Age‐Related Decline in the Osteogenic Potential of Rats' Bone Marrow‐Derived Mesenchymal Stem Cells. Acta Physiol 2012; 205(2): 292-301.
9- Xiaolei S, Fengbo L, Xinlong M, Jianxiong M, Bin Z, Zhang Y, et al. The Effects of Combined Treatment with Naringin and Treadmill Exercise on Osteoporosis in Ovariectomized Rats. Sci Rep 2015; 5: 1-9.
10- Tartibian B, Motabsaee N, Tolouei-Azar J. The Influence of Nine-Week Intensive Aerobic Exercises, Calcium and Vitamin D Supplementation on the Metabolic Response of Bone Formation Biomarkers. Zahedan J Res in Medical Sci 2013; 15(2): e93098. [Persian]
11- Cicek E, Cakmak E. Hydrogen Peroxide Induced Oxidative Damage on Mineral Density and Mechanical Properties of Bone. Braz Arch Biol Technol 2018; 61: E18180043.
12- Radák Z, Sasvári M, Nyakas C, Pucsok J, Nakamoto H, Goto S. Exercise Preconditioning Against Hydrogen Peroxide-Induced Oxidative Damage in Proteins of Rat Myocardium. Arch Biochem Biophys 2000; 376(2): 248-51.
13- Ganie SA, Haq E, Hamid A, Masood A, Zargar MA. Long Dose Exposure of Hydrogen Peroxide (H2O2) in Albino Rats and Effect of Podophyllum Hexandrum on Oxidative Stress. Eur Rev Med Pharmacol Sci 2011; 15(8): 906-15.
14- Li SF, Liu HX, Zhang YB, Yan YC, Li YP. The Protective Effects of Α-Ketoacids Against Oxidative Stress on Rat Spermatozoa in Vitro. Asian J Androl 2010; 12(2): 247.
15- Safrazadeh Gargari S, Matin Homaei H, Azarbayjani Ma. Effects of Continues Exercise on BAX and BCL-2 Heart Proteins Following by Different Dos of H2O2 Consumption in Rat Male. J Shahid Sadoughi University of Medical Sciences 2018; 26(4): 363-79. [Persian]
16- Omrani GR, Masoompour SM, Hamidi A, Mardanifard HA, Taghavi SM, Talezadeh P, et al. Bone Mineral Density in the Normal Iranian Population: A Comparison with American Reference Data. Arch Osteoporos 2006; 1(1-2): 29-35.
17- Halder SK, Sharan C, Al-Hendy A. 1, 25-Dihydroxyvitamin D3 Treatment Shrinks Uterine Leiomyoma Tumors in the Eker Rat Model. Biol Reprod 2012; 86(4): 116.
18- Husain K, Hazelrigg SR. Oxidative Injury Due to Chronic Nitric Oxide Synthase Inhibition in Rat: Effect of Regular Exercise on the Heart. Biochim Biophys Acta 2002; 1587(1): 75-82.
19- Gunton JE, Girgis CM, Baldock PA, Lips P. Bone Muscle Interactions and Vitamin D. Bone 2015; 80: 89-94.
20- Goltzman D. Functions of Vitamin D in Bone. Histochem Cell Biol 2018; 149(4): 305-12.
21- Mustafa RA, Alfky NA, Hijazi HH, Header EA, Azzeh FS. Biological Effect of Calcium and Vitamin D Dietary Supplements Against Osteoporosis in Ovariectomized Rats. Progress in Nutrition 2018; 20(1): 86-93.
22- Foong Kiew Ooi, Rabindarjeet S, Harbindar JS, Yoshihisa U. Effects of Jumping Exercise and Subsequent Short and Long Term Cessation of Exercise on Bone in Female Rats. Malays J Med Sci. 2008; 15(1): 119-31.
23- Tobeiha M, Moghadasian MH, Amin N, Jafarnejad S. RANKL/RANK/OPG Pathway: A Mechanism Involved In Exercise-Induced Bone Remodeling. Biomed Res Int 2020; 2020: 1-11.
24- Shariati M, Azarbayjani MA, Zilaei Bouri S, Kaka G. The Effect of Eight Weeks of Aerobic Exercise and Vitamin-D Supplementation on Osteocalcine and Alkaline Pphosphatase in Rats Poisoned with H2O2. Iranian J Nutr Sci & Food Tech 2019; 14(2): 1-10.
25- Akagawa M, Miyakoshi N, Kasukawa Y, Ono Y, Yuasa Y, Nagahata I, et al. Effects of Activated Vitamin D, Alfacalcidol, And Low-Intensity Aerobic Exercise on Osteopenia and Muscle Atrophy in Type 2 Diabetes Mellitus Model Rats. Plos One 2018; 13(10): E0204857.
5- Tartibian B, Sheikhlou Z, Malandish A, Rahmati-Yamchi M, Afsargarebag R. Effect of Moderate-Intensity Aerobic Training on Alkaline Phosphatase Gene Expression and Serum Markers of Bone Turnover in Sedentary Postmenopausal Women. Tehran Univ Med J 2017; 74(10): 723-34. [Persian]
6- Nogueira JE, Branco LG, Issa JPM. Bone Repair: Effects of Physical Exercise and LPS Systemic Exposition. Injury 2016; 47(8): 1828-34.
7- Zhang J, Valverde P, Zhu X, Murray D, Wu Y, Yu L, et al. Exercise-Induced Irisin in Bone and Systemic Irisin Administration Reveal New Regulatory Mechanisms of Bone Metabolism. Bone Research 2017; 5: 16056.
8- Hell R, Ocarino N, Boeloni J, Silva J, Goes A, Santos R, et al. Physical Activity Improves Age‐Related Decline in the Osteogenic Potential of Rats' Bone Marrow‐Derived Mesenchymal Stem Cells. Acta Physiol 2012; 205(2): 292-301.
9- Xiaolei S, Fengbo L, Xinlong M, Jianxiong M, Bin Z, Zhang Y, et al. The Effects of Combined Treatment with Naringin and Treadmill Exercise on Osteoporosis in Ovariectomized Rats. Sci Rep 2015; 5: 1-9.
10- Tartibian B, Motabsaee N, Tolouei-Azar J. The Influence of Nine-Week Intensive Aerobic Exercises, Calcium and Vitamin D Supplementation on the Metabolic Response of Bone Formation Biomarkers. Zahedan J Res in Medical Sci 2013; 15(2): e93098. [Persian]
11- Cicek E, Cakmak E. Hydrogen Peroxide Induced Oxidative Damage on Mineral Density and Mechanical Properties of Bone. Braz Arch Biol Technol 2018; 61: E18180043.
12- Radák Z, Sasvári M, Nyakas C, Pucsok J, Nakamoto H, Goto S. Exercise Preconditioning Against Hydrogen Peroxide-Induced Oxidative Damage in Proteins of Rat Myocardium. Arch Biochem Biophys 2000; 376(2): 248-51.
13- Ganie SA, Haq E, Hamid A, Masood A, Zargar MA. Long Dose Exposure of Hydrogen Peroxide (H2O2) in Albino Rats and Effect of Podophyllum Hexandrum on Oxidative Stress. Eur Rev Med Pharmacol Sci 2011; 15(8): 906-15.
14- Li SF, Liu HX, Zhang YB, Yan YC, Li YP. The Protective Effects of Α-Ketoacids Against Oxidative Stress on Rat Spermatozoa in Vitro. Asian J Androl 2010; 12(2): 247.
15- Safrazadeh Gargari S, Matin Homaei H, Azarbayjani Ma. Effects of Continues Exercise on BAX and BCL-2 Heart Proteins Following by Different Dos of H2O2 Consumption in Rat Male. J Shahid Sadoughi University of Medical Sciences 2018; 26(4): 363-79. [Persian]
16- Omrani GR, Masoompour SM, Hamidi A, Mardanifard HA, Taghavi SM, Talezadeh P, et al. Bone Mineral Density in the Normal Iranian Population: A Comparison with American Reference Data. Arch Osteoporos 2006; 1(1-2): 29-35.
17- Halder SK, Sharan C, Al-Hendy A. 1, 25-Dihydroxyvitamin D3 Treatment Shrinks Uterine Leiomyoma Tumors in the Eker Rat Model. Biol Reprod 2012; 86(4): 116.
18- Husain K, Hazelrigg SR. Oxidative Injury Due to Chronic Nitric Oxide Synthase Inhibition in Rat: Effect of Regular Exercise on the Heart. Biochim Biophys Acta 2002; 1587(1): 75-82.
19- Gunton JE, Girgis CM, Baldock PA, Lips P. Bone Muscle Interactions and Vitamin D. Bone 2015; 80: 89-94.
20- Goltzman D. Functions of Vitamin D in Bone. Histochem Cell Biol 2018; 149(4): 305-12.
21- Mustafa RA, Alfky NA, Hijazi HH, Header EA, Azzeh FS. Biological Effect of Calcium and Vitamin D Dietary Supplements Against Osteoporosis in Ovariectomized Rats. Progress in Nutrition 2018; 20(1): 86-93.
22- Foong Kiew Ooi, Rabindarjeet S, Harbindar JS, Yoshihisa U. Effects of Jumping Exercise and Subsequent Short and Long Term Cessation of Exercise on Bone in Female Rats. Malays J Med Sci. 2008; 15(1): 119-31.
23- Tobeiha M, Moghadasian MH, Amin N, Jafarnejad S. RANKL/RANK/OPG Pathway: A Mechanism Involved In Exercise-Induced Bone Remodeling. Biomed Res Int 2020; 2020: 1-11.
24- Shariati M, Azarbayjani MA, Zilaei Bouri S, Kaka G. The Effect of Eight Weeks of Aerobic Exercise and Vitamin-D Supplementation on Osteocalcine and Alkaline Pphosphatase in Rats Poisoned with H2O2. Iranian J Nutr Sci & Food Tech 2019; 14(2): 1-10.
25- Akagawa M, Miyakoshi N, Kasukawa Y, Ono Y, Yuasa Y, Nagahata I, et al. Effects of Activated Vitamin D, Alfacalcidol, And Low-Intensity Aerobic Exercise on Osteopenia and Muscle Atrophy in Type 2 Diabetes Mellitus Model Rats. Plos One 2018; 13(10): E0204857.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1399/7/28 | پذیرش: 1399/8/26 | انتشار: 1400/7/10
دریافت: 1399/7/28 | پذیرش: 1399/8/26 | انتشار: 1400/7/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







