دوره 29، شماره 7 - ( مهر 1400 )
جلد 29 شماره 7 صفحات 3897-3877 |
برگشت به فهرست نسخه ها
Ethics code: مقاله مروری است و نیاز به کد اخلاق ندارد
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Samadi A, Yazdian F, Navaei-Nigjeh M, Rashedi H. Nanocomposite Hydrogels: A Promising Approach for Developing Stimuli-responsive Platforms and their Application in Targeted Drug Delivery. JSSU 2021; 29 (7) :3877-3897
URL: http://jssu.ssu.ac.ir/article-1-5228-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5228-fa.html
صمدی امیرمسعود، یزدیان فاطمه، نوائی نیگجه منا، راشدی حمید. نانوکامپوزیت هیدروژلها: روشی نوید بخش جهت توسعه سامانههای پاسخگو به تحریک و کاربرد آن در دارورسانی هدفمند. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (7) :3877-3897
واژههای کلیدی: نانوکامپوزیت هیدروژل، رهایش حساس به تحریک، دارورسانی هدفمند، درمان سرطان و زخم پوشها
متن کامل [PDF 1015 kb]
(1269 دریافت)
| چکیده (HTML) (2237 مشاهده)
متن کامل: (2006 مشاهده)
مقدمه
در طول سالهای اخیر، کاربرد هیدروژلها در دارورسانی توجه زیادی را به خود جلب کرده است. هیدروژلها از زنجیرههای پلیمری با برهمکنشهای فیزیکی یا شیمیایی تشکیل شدهاند که منجر به شکلگیری شبکه های پلیمری سه بعدی با محتوای آب زیاد میشوند. در حقیقت، ساختار هیدروژل میتواند تا هزاران برابر وزن خشک خود آب یا سیالهای دیگر با خواص بیولوژیکی را جذب کند. ساختار هیدروژل علیرغم داشتن قابلیت تعامل با محلولهای آبی و تورم یافتن از انحلال آن جلوگیری میکند. به همین خاطر قابلیت بازگشت به حالت اولیه قبل از تورم را دارا هستند. بهبود توانایی هیدروژل در جذب آب با استفاده از گروههای عاملی آبدوست اضافه شده نظیر آمین، کربوکسیل و هیدروکسیل به زنجیرههای پلیمری حاصل میشود. همچنین، مقاومت هیدروژل در برابر انحلال به دلیل برهمکنش بین زنجیرههای شبکه افزایش مییابد (1). کاربرد هیدروژلها در مطالعات زیست پزشکی و مواردی که نیاز به تماس با بافتهای زنده است بسیار مفید است چرا که ساختار آنها شباهت زیادی به بافت زنده دارد. از دلایل این شباهت میتوان به طبیعت نرم، انعطافپذیر و میزان بالای آب در هیدروژلها اشاره کرد (2). از هیدروژلها به طور گسترده در زمینههایی مانند تحقیقات سرطان، مهندسی سلولهای بنیادی، سلول درمانی، مهندسی بافت و ایمپلنت استفاده میشود (3). علاوه بر این، برخی هیدروژلها قابلیت پاسخدهی به عوامل تحریک را به دلیل امکان تغییر در ساختار شبکه پلیمری و بهدنبال آن تغییر در ساختار هیدروژل که بهصورت تورم، انحلال یا تخریب هیدروژل رخ میدهد میتوانند داشته باشند. این دسته از هیدروژلهای حساس به تغییرات در شرایط محیطی بهعنوان هیدروژلهای هوشمند شناخته میشوند (4). نحوه قرارگیری و ورود دارو به ماتریس هیدروژل تأثیر زیادی در کنترل رهاسازی دارو و استفاده از عوامل تحریک دارد (5). هنگامی که مولکولهای فعال زیستی به صورت کووالانسی به هیدروژلها متصل هستند، آزاد شدن آنها از ساختار هیدروژل نیاز به قطع پیوند بین هیدروژل و دارو دارد. این قطع پیوند از طریق واکنش شیمیایی مانند واکنش آنزیمی یا شیمیایی، تغییر در pH یا محرک خارجی مانند نور اتفاق میافتد (6،7). اما، در هیدروژلهایی که دارو توسط فعل و انفعالات فیزیکی (8) یا فرا مولکولی (9) و از کنار هم قرار گرفتن مولکولها با پیوندهای غیرکوالانسی تشکیل شده، رهایش دارو نه تنها به دلیل واکنش شیمیایی بلکه در اثر تغییر فیزیکی در ساختار هیدروژل مانند انقباض در ساختار است که میتواند توسط تغییرات در pH، دما و سایر تغییرات فیزیکی که منجر به پاسخ عوامل تحریک شونده در هیدروژل میشوند حاصل شود. قراردادن نانو مواد در هیدروژلها رویکردی نوآورانه برای به دست آوردن سیستمهای هیدروژل هوشمند و حساس به تحریک با خواص بهبود یافته و پاسخگویی کنترل شده جهت آزادسازی هدفمند دارو و کنترل رهایش آن است. در این مطالعه مروری به بررسی روشهای مورد استفاده در تولید این سامانهها و انواع مکانیسمهای تحریک مورد استفاده میپردازیم.
عنوان مطالب:
1. برهم کنش نانوذرات و شبکه هیدروژل
2. مزیتهای کاربرد نانوذرات در هیدروژلها
3. روشهای تهیه نانوکامپوزیت هیدروژل
1.3. تشکیل هیدروژل در سوسپانسیون نانوذرات
2.3. جاسازی فیزیکی نانوذرات در هیدروژل بعد از فرآیند ژل شدن
3.3. تشکیل نانوذرات واکنش پذیر در یک ژل از پیش ساخته
4.3. استفاده از نانوذرات به عنوان اتصالدهنده متقابل جهت تشکیل هیدروژلها
5.3. تشکیل ژل با استفاده از نانوذرات، پلیمرها و مولکولهای ژلاتور مجزا
4. انواع مکانیسمهای تحریک
1.4. نانوکامپوزیت هیدروژلهای حساس به دما
2.4. نانوکامپوزیت هیدروژلهای حساس به الکتریسیته
3.4. نانوکامپوزیت هیدروژلهای حساس به مغناطیس
4.4. نانوکامپوزیت هیدروژلهای حساس به نور
5.4. نانوکامپوزیت هیدروژلهای حساس به pH
6.4. نانوکامپوزیت هیدروژلهای حساس به اکسایش- کاهش
5. کاربردهای درمانی
1.5. نانوکامپوزیت هیدروژلها بهعنوان زخم پوش
2.5. نانوکامپوزیت هیدروژلها برای درمان سرطان
روش بررسی
به منظور بررسی روشهای تولید نانوکامپوزیت هیدروژلها و کاربردهای متنوع آن در حوزه درمان بازه زمانی سال 2000 تا 2020 انتخاب گردید. نخست واژگان کلیدی توسط نویسندگان مقاله و با توجه به تجارب قبلی آنها تعیین شد و سپس از این کلیدواژهها جهت جستجوی مقالات در پایگاههای اطلاعاتی PubMed، Google Scholar، Science Direct و Scopus استفاده شد. پس از انتخاب مقالات به بررسی و طبقهبندی اطلاعات هر یک پرداخته شد و این اطلاعات به صورت فیش برداری توسط نویسندگان خلاصهنویسی شده و به دستهبندیهای نانو ذره استفاده شده در هیدروژل، مزیتها، روشهای تهیه نانوکامپوزیت هیدروژلها، انواع مکانیسمهای تحریک مورد استفاده شامل عوامل فیزیکی و شیمیایی، و کاربردهای درمانی تقسیمبندی شدند. به منظور جمعبندی بهتر موضوعات اطلاعات ارائه شده در جداول جداگانه جمعبندی شد.
1. برهم کنش نانوذرات و شبکه هیدروژل
انواع مختلف نانوذرات مانند نانوذرات معدنی سرامیکی نظیر هیدروکسی آپاتیت (10)، سیلیس، سیلیکات (11)، و کلسیم فسفات (12)، نانوذرات بر پایه فلزات یا اکسید فلزات مانند طلا (13)، نقره (14) و اکسید آهن (14)، نانوذارت بر پایه کربن مانند نانولولههای کربنی (15) و گرافن (16)، و نانوذرات پلیمری نظیر دندریمرها (17)، لیپوزوم (18) و مایسلها (19) برای تولید نانوکامپوزیت هیدروژلها با شبکه پلیمری ترکیب میشوند. قرارگیری این نانوذارت در ساختار هیدروژل توسط برهمکنشهای مختلفی انجام میشود. این برهمکنشها شامل برهمکنشهای کوالانسی (20)، هیدروژنی (21,22) و الکترواستاتیکی میباشند (23). نانوکامپوزیتهای حاصل خصوصیات فیزیکی مناسبتر با قابلیت رهایش دارو از طریق عوامل تحریککننده را دارند. نوع نانوذرات استفاده شده در ساختار هیدروژل، نوع محرکهایی که میتوانند رهایش دارو در شرایط دلخواه را کنترل کنند، تعیین میکند. اضافه شدن نانوذرات به نانوکامپوزیت هیدروژل و برهمکنش آنها با ماتریکس هیدروژل به سه طریق اتفاق میافتد.
1. ذرات هیدروژل به ابعاد میکرو یا نانو تثبیتکننده نانوذرات معدنی یا پلیمری
2. نانوذرات تثبیتشده در هیدروژل با پیوندهای غیرکوالانسی
3. نانوذرات تثبیت شده در هیدروژل با پیوندهای کوالانسی
در شکل 1، چگونگی قرارگیری نانوذرات در داخل ساختار هیدروژل نشان داده شده است.
2. مزیتهای کاربرد نانوذرات در هیدروژلها
همانطور که اشاره شد، علیرغم پتانسیل هیدروژلها برای دارورسانی، تهیه هیدروژلها با قابلیت رهایش کنترل شده و اختصاصی دارو در محل به عنوان یک چالش مطرح بوده است. بهعلاوه شماری از داروهای مورد استفاده به دلیل ماهیت آبگریز خود بارگیری ضعیفی را در هیدروژلها نشان میدهند. به دلیل برهمکنشهای میان نانوذره و شبکه هیدروژل که اشاره شد استفاده از نانوذرات در شبکه هیدروژل منجر به بهبود بارگذاری دارو بهخصوص داروهای آبگریز (26)، کنترل رهایش (27)، شکلگیری سیستمهای دارورسانی با قابلیت پاسخ به چند عامل محرک (11)، بهبود خواص مکانیکی هیدروژل، و تصویربرداری با وضوح بالاتر میشود. در جدول 1 خلاصهای از این مزایا گردآوری شده است.

شکل 1: انواع بر همکنشهای بین نانوذرات و هیدروژل تثبیت یک یا چند نانوذره در ساختار میکروژل یا نانوژل (سمت چپ)، تثبیت با پیوند کوالاتسی (وسط)، تثبیت با پیوند غیرکوالانسی (سمت راست) (24,25)
جدول1: برخی از مزیتهایکاربرد نانوذرات در هیدروژلها
3. روشهای تهیه نانوکامپوزیت هیدروژل
طیف متنوعی از نانوکامپوزیت هیدروژلها با تغییر انواع نانوذرات جاسازی (embed) شده و فرایند قرارگیری آنها در چارچوب هیدروژل ساخته شده است. پنج روش اصلی برای به دست آوردن توزیع یکنواخت نانوذرات در هیدروژلها استفاده شده است:
1. تشکیل هیدروژل در سوسپانسیون نانوذرات
2. جاسازی فیزیکی نانوذرات در هیدروژل بعد از فرآیند ژل شدن (ژلینگ)
3. تشکیل نانوذرات واکنش پذیر در یک ژل از پیش ساخته
4. استفاده از نانوذرات به عنوان اتصالدهنده متقابل جهت تشکیل هیدروژلها
5. تشکیل ژل با استفاده از نانوذرات، پلیمرها و مولکولهای ژلاتور مجزا
رویکرد انتخاب شده جهت تولید، به استفاده نهایی از نانوکامپوزیت هیدروژل بستگی دارد (24).
1.3. تشکیل هیدروژل در سوسپانسیون نانوذرات
سادهترین روش برای تشکیل یک نانوکامپوزیت هیدروژل، ژل شدن سوسپانسون نانوذرات از پیش ساخته در یک محلول مونومری تشکیل دهنده هیدروژل است. اگرچه این مرحله نسبتاً ساده است، ممکن است تجمع نانوذرات در محلول مونومر (قبل و طی فرآیند ژلینگ) مشاهده شود. علاوه بر این، احتمال بیرون آمدن نانوذرات از ماتریس هیدروژل هنگامی که چگالی اتصالدهنده متقابل کم باشد ممکن است. این روش برای تولید نانوکامپوزیت هیدروژلهای حساس به نور مورد استفاده قرار گرفته است (41). راوی و همکاران از این روش برای گنجاندن سه نوع مختلف از نانو ذرات استفاده کردند. این نانو ذرات شامل پلیاکریلآمید شبه پروتئینی، سرمآلبومین گاوی و سیلیس هیدروفیل شده با قطرات کوچک از محلول پلیمری آبدوست بودهاند که در ساختار یک ماتریس هیدروژل برای کاربرد به عنوان لنز داخل چشم مورد استفاده قرار گرفت (42). کاربرد پیشرفته نانوکامپوزیت هیدروژلها با استفاده از این پروتکل توسط لیو و همکاران برای تولید هیدروژلهای قابل تغییر با نور و پاسخگو به حرارت با استفاده از نانوصفحههای تیتانیای یک طرفه به عنوان یک اتصالدهنده متقابل فوتوکاتالیستی گزارش شده است (43).
2.3. جاسازی فیزیکی نانوذرات در هیدروژل بعد از فرآیند ژل شدن
در این شرایط، نانوذرات احتمالاً به دلیل برهمکنش فیزیکی و یا پیوند هیدروژنی بین زنجیرههای پلیمری و سطح نانوذرات بعد از فرآیند ژل شدن و تولید هیدروژل در ساختار هیدروژل قرار داده میشوند. پاردو و همکاران پس از تولید هیدروژل پلیآکریلآمید (PAAm) نانوذرات نقره را به همین روش در هیدروژل اضافه نمودند (25). تغییر فاصله بین نانوذرات نقره در این هیدروژل منجر به تولید یک هیدروژل با قابلیت پاسخ به تحریک الکتریکی شد.
3.3. تشکیل نانوذرات واکنشپذیر در یک ژل از پیش ساخته
در این روش، پیش سازهای نانوذرات به مخلوط مونومری و اتصالدهنده متقابل که تشکیل دهنده هیدروژل است اضافه میشود. پس از تشکیل هیدروژل، پیش ساز نانوذرات تبدیل به نانوذره شده و در نهایت نانوکامپوزیت هیدروژل تشکیل میشود. ساختار متخلخل شبکههای هیدروژل دامنه نانوسکوپی برای تشکیل نانوذرات (ایجاد فضای خالی در بین شبکه ژل) را فراهم میکند و از پدیده تجمع نانوذرات در یک محل جلوگیری میکند که منجر به توزیع یکنواخت نانوذرات در هیدروژل میشود (27,44,45). گروه لانگر این رویکرد را که شامل بارگذاری پیش سازهای نانوذرات در ژل به جای نانوذرات است را توسعه داده است (46). در این روش، اتصال ایزوپروپیلآکریلامید(NIPAAm) و کومونومرهای حاوی گروههای تیول یک شبکه هیدروژل حاوی یونهای تعبیه شده Au (III) تشکیل دادند. ماتریکس هیدروژل عملگرا شده با گروه تیول منجر به تشکیل نانو ذرات طلا برای قرارگیری نانو ذرات طلا با استفاده از یک ماده کاهش دهنده مانند بوروهیدریدسدیم شد. در شکل2، تصویر شماتیک تهیه نانوکامپوزیت هیدروژل طلا نشان داده شده است.
4.3. استفاده از نانوذرات به عنوان اتصالدهنده متقابل جهت تشکیل هیدروژلها
یک نمونه خاص جالب در توسعه نانوکامپوزیت هیدروژلها شامل استفاده از گروههای اتصالدهنده متقابل موجود در سطح نانوذرات است. سوزا و همکاران، شبکههای مولکولی باکتریوفاژ تولید شده توسط مونتاژ خود به خود فاژ با نانوذرات طلا را تولید کردند. شبکه هیدروژل حاصل ویژگی اتصال به گیرندههای سطح سلولی و درونگیری پپتید را حفظ کرد (47). تشکیل خود به خودی این شبکهها میتواند به وسیله تلفیق با ایمیدازول که باعث تغییرات در مورفولوژی، بعد فراکتال، و خواص نوری نزدیک مادون قرمز میشود کنترل شود. یکی از مزایای مهم استفاده از نانوذرات، امکان ایجاد پیوندهای کوالانسی بیشتر (مالتی والانسی) در شبکه ژل است در حالیکه در روشهای متداول تولید هیدروژل معمولاً دو پیوند کوالانسی بین پلیمرهای مورد استفاده در ساختار هیدروژل تشکیل میشود. این مزیت در واکنش اتصال متقاطع نانو ذرات طلای محافظت شده با مرکاپتوپروپیونیلگلیسین برای تولید ژل کلاژن با استفاده از 1-اتیل3-( 3-دیمتیلآمینوپروپیل) کربودیمید نشان داده شده است (48). در یک مطالعه اخیر، ژانگ و همکاران هیدروژلهای مبتنی بر نانوذرات نیمه هادی سنتز شده توسط پلیمریزاسیون خود آغاز شده تحت تابش نور را تولید کردند (49). این سیستم از چهار مؤلفه تشکیل شده بود.
1- آب 2- نانوذرات نیمه هادی اکسیدروی، دیاکسیدتیتانیوم، آهن (III) اکسید محلول در آب، دیاکسیدقلع، دیاکسیدزیرکونیوم، کادمیومسلنید 3- دیمتیلآکریلامید 4- نانو صفحات رس در این مطالعه، نانوذرات معدنی نیمه هادی به عنوان آغازگر برای پلیمریزاسیون دیمتیلآکریلامید عمل کردند. در شکل 3، مراحل ساخت این هیدروژلها با استفاده از نانوذرات نیمه هادی و پلیمریزاسیون توسط نور نشان داده شده است.
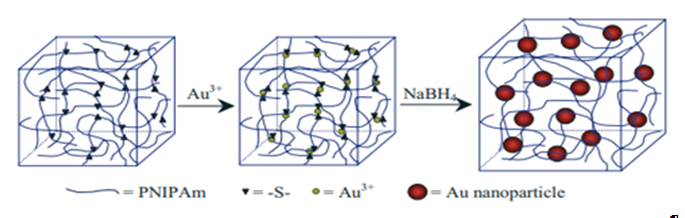
شکل 2: تصویر شماتیک تهیه نانوکامپوزیت هیدروژل طلا (46)
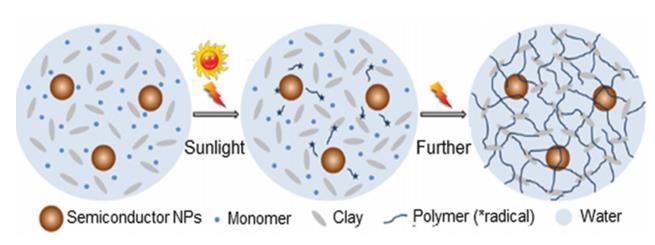
شکل 3: مراحل ساخت این هیدروژلها با استفاده از نانوذرات نیمه هادی (49)
5.3. تشکیل ژل با استفاده از نانوذرات، پلیمرها و مولکولهای ژلاتور مجزا
در این روش، برای تولید نانوکامپوزیت هیدروژل از پلیمرهای مختلف، نانوذرات و عوامل اتصالدهنده جداگانه تحت عنوان ژلاتور استفاده میشود. وو و همکاران، در مطالعهای از نانوذرات سیلیکا برای اضافه کردن آنها به هیدروژل هادی و تهیه آندها بر پایه این نانوکامپوزیت هیدروژل استفاده کردند. پلیمریزاسیون هیدروژل در محل برای تولید یک شبکه سه بعدی به خوبی اتصال متقابل یافته شامل نانوذرات سیلیکای پوشش داده شده با پلیمر رسانا انجام شد. شبکه ساخته شده ویژگیهای مثبتی از جمله شبکه رسانای پیوسته پلیآنیلین، اتصال به سطح سیلیسیم از طریق پیوند هیدروژنی با اسیدفیتیک یا تعامل الکترواستاتیک با پلیمر دارای بار مثبت، و فضای متخلخل برای گسترش حجم را با هم داراست. شکلگیری این هیدروژل با استفاده از سنتز فاز محلول با مخلوط کردن سیلیسیم با اسیدفیتریک و آنیلین در آب و به دنبال آن افزودن اکسید کننده (به عنوان مثال پرسولفات آمونیوم) بهدست آمد (50).
4. انواع مکانیسمهای تحریک
یکی از رویکردهای پیشرو در تولید و توسعه سیستمهای دارورسانی هوشمند، استفاده از مکانیزمهای تحریک ساختار دز و رهایش کنترل شده دارو از آن است. در میان این روشهای تحریک، به دو دسته کلی تحریک توسط عوامل فیزیکی و شیمیایی میتوان اشاره کرد. از جمله عوامل فیزیکی میتوان به دما، تابش نور، الکتریسیته، مغناطیس و از عوامل شیمیایی میتوان به pH یا اکسایش-کاهش اشاره کرد. در ادامه به بررسی انواع روشهای تحریک مورد استفاده در نانوکامپوزیت هیدروژلها پرداخته میشود.
1.4. نانوکامپوزیت هیدروژلهای حساس به دما
گرما یکی از رایجترین پارامترهای استفاده شده برای تحریک حاملهای داروها و رهایش موضعی دارو در پاسخ به محرک است که بهصورت مکانی و زمانی تنظیم میشود. سیستم تحویل داروی مؤثر باید پایداری خود را در موقعیتها و مکانهای نامناسب حفظ کند و دارو را با استفاده از سینتیک تنظیم شده، درون سلولها و بافتهای هدف، مثلاً تومورها، ترشح کند. احتمالاً یکی از بهترین مواد در سیستمهای دارورسانی، پلیمرهای حساس به دما هستند که میتوانند در پاسخ به تغییر دما، پیکربندی خود را از یک ساختار منقبض شده به یک ساختار منبسط شده تغییر دهند. این فرآیند معمولاً توسط دمای محلول بحرانی بالا و دمای محلول بحرانی پایین کنترل میشود (شکل 4). با تنظیم دما اطراف این دو حد بالا و پایین، یک تغییر فاز که منجر به تورم یا کوچک شدن میشود اتفاق افتاده و رهایش رخ میدهد. چن و همکاران، یک هیدروژل قابل تزریق و پاسخگو به گرما که میتواند با دمای بدن تحریک شود همراه با افزایش پایداری مکانیکی و زیست سازگاری را بهعنوان یک حامل داروی کنترل شده برای درمان سرطان، مطرح کردند (52). تیان و یانگ نیز در مطالعهای دیگر با استفاده از اضافه کردن نانوذرات سیلیکای مزوپور به هیدروژل پلیایزوپروپیلآکریلامید، یک نانوکامپوزیت هیدروژل حساس به دما برای رهایش کنترل شده ایبوپروفن توسعه دادند (53).

شکل 4: تغییرات ساختار پلیمر با دما و تاثیر آن بر ضریب نفوذ و سرعت رهایش (51)
2.4. نانوکامپوزیت هیدروژلهای حساس به الکتریسیته
با استفاده از میدان الکتریکی خارجی، میتوان از رهایش کنترل شده برای آزاد سازی داروها بهصورت مداوم، پالسی یا با رژیمی که برای رهایش داروی مورد نظر بهتر است استفاده کرد. رهایش دارو از طریق تحریک با جریان الکتریکی میتواند به سه طریق انجام شود. از جملهی این روشها میتوان به استفاده از توسعه نانوساختارهای حساس به جریان الکتریکی، بارگذاری نانوذرات حساس به الکتریسیته در ساختار هیدروژل، و ترکیب نانوذرات حساس به الکتریسیته با ترکیبات پاسخگو به تحریکهای دیگر نظیر دما و میدان مغناطیسی جهت ایجاد قابلیت پاسخدهی چندگانه به عوامل تحریک اشاره کرد. گنجاندن پلی الکترولیتهای دارای طیف گستردهای از گونههای با قابلیت یونیزه شدن در ساختار هیدروژل، امکان انقباض یا انبساط پلیمرها بهوسیله تحریک الکتریکی را فراهم میکند. برای مثال، یینگ و همکاران کامپوزیت هیدروژل حساس به الکتریسیته را برای رهایش کنترل شده داروی ضد صرع تولید کردند. افزایش سطح یونیزاسیون در ساختار نیز تحت تأثیر یک میدان الکتریکی به دلیل وجود پلیالکترولیتسدیم4- وینیلبنزنسولفونات اتفاق افتاد (54). در مطالعهای دیگر، سروانت و همکاران نانولولههای کربنی چندلایه را به هیدروژل پلیمتیلمتاکریلیت اضافه نموده تا یک سامانه رهایش دارو با رژیم جریان پالسی بوسیله قطع و وصل جریان توسعه دهند. مقدار رهایش ساکارز نشاندارشده با رادیواکتیو بهعنوان داروی مدل از نانوکامپوزیت هیدروژل در حالت تحریک شده با جریان الکرتیکی حدود 3/1 برابر بیشتر از هیدروژل بدون تحریک بود (55). مارتینز و همکاران نیز در مطالعهای، نانوفیبرهای پلیآنیلین را در هیدروژل پلیآکریلامید قرار داده و یک سامانه رهایش حساس به جریان برای رهایش آموکسیسیلین تهیه کردند (56). در شکل 5، روش تهیه این نانوکامپوزیت هیدروژل آورده شده است.
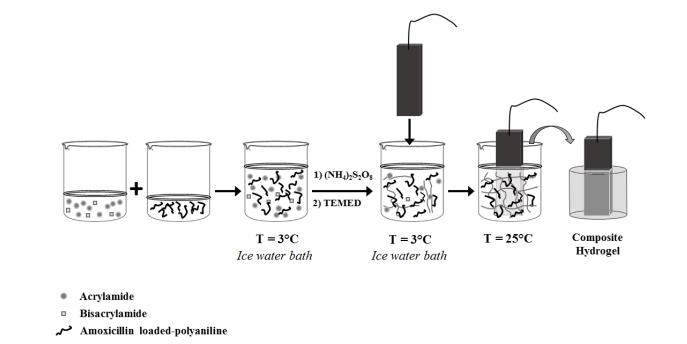
شکل 5: روش تهیه نانوکامپوزیت هیدروژل پلی آکریلامید- پلی آنیلین جهت بارگذاری داروی آموکسی سیلین (56)
3.4. نانوکامپوزیت هیدروژلهای حساس به مغناطیس
کار مقدماتی مربوط به این زمینه در سال 1960 آغاز شد. فریمن و همکارانش در ابتدا مفهوم بهکارگیری میدانهای مغناطیسی را در نقش یک محرک خارجی برای رهاسازی داروها تهیه کردند (57). در تحقیقی که توسط میناچ و همکاران انجام شد، نانوذرات آهن (III)اکسید به هیدروژل پلیاتیلنگلایکول اضافه شد. همچنین در این مطالعه تاثیر میزان اتصالدهنده متقابل در میزان رهایش دارو توسط میدان مغناطیسی متغیر بررسی شد. نتایج این بررسی نشان داد که مقدار رهایش پاکلیتاکسل تحت میدان مغناطیسی از هیدروژل با بالاترین درصد اتصالدهنده متقابل در حدود 24/1 برابر بیشتر از هیدروژل با کمترین درصد اتصالدهنده متقابل است (58). در حقیقت، استفاده از درصد بالایی از اتصالدهنده متقابل و قرار گیری دارو در ساختار مستحکم ایجاد شده در کنار میدان مغناطیسی منجر به بهبود رهایش در محل مورد نظر در مدت زمان طولانیتر شده است. وانگ و همکاران نیز در مطالعهای نانو ذرات آهن (III) اکسید را به هیدروژل پلیکاپرولاکتون اضافه نموده و داروی ضد قارچ کتوکونازول را در آن بارگذاری نمودند. نتایج حاصل از تحریک این نانوکامپوزیت هیدروژل با میدان مغناطیسی نشان داد که میزان بیشتری از دارو (حدود 3/1 برابر نسبت به هیدروژل) در اثر تحریک با میدان مغناطیسی رهاسازی میشود (59).
4.4. نانوکامپوزیت هیدروژلهای حساس به نور
تابش نور برای تحریک ساختار در برگیرنده دارو میتواند بهعنوان روشی برای رهایش کنترل شده استفاده شود. جذب انرژی فوتون توسط مواد به شکاف در باند انرژی الکترون در بالاترین مدار مولکولی پر شده بستگی دارد. مواد جذب کننده نور کاربردهای زیادی از جمله محافظت در برابر تابش اشعه ماوراء بنفش در روز، تولید برق از انرژی خورشیدی، یا مولکولهای شناساگر فلورسنت دارند. از بین تعداد محرکهای مورد استفاده در سیستمهای رهایش دارو، تابش نور به دلیل سادگی تنظیم شدت آن، امکان تنظیم زمان قرار گرفتن در معرض نور و همچنین امکان هدفگیری بافت خاص، امکان انتخاب و تعیین معیارهای پرتو مطلوب مورد توجه زیادی قرار میگیرد. همچنین، این واقعیت غیرقابل انکار که تحریک نوری یک روش غیر تهاجمی است این روش را گزینه مطرحی در میان روشهای تحریک و رهایش دارو میکند (60,61). یان و همکاران در مطالعهای با استفاده از نانوذرات لانتانیددوپ و هیدروژل پلیآکریلامید- پلیاتیلنگلایکول، یک سامانه کنترل شده برای رهایش تاموکسیفن و کلاریترومایسین ارائه کردند. نانوذرات تبدیل بالای دوپ شده با لانتانید (Up-conversion Nanoparticle) با اصلاح سطح مناسب میتوانند برای طیف وسیعی از کاربردهای زیست دارویی مانند شناسایی زیستی، درمان سرطان، برچسبگذاری زیستی، تصویربرداری فلورسانس، تصویر برداری تشدید مغناطیسی و رهایش دارو مورد استفاده قرار گیرند (62). از جمله مزیتهای کاربرد لانتانید در توسعهی سامانههای رهایش با تحریک نور میتوان به بالا بردن عمق نفوذ بافتی با تحریک نزدیک به مادون قرمز، بالا بردن پایداری علیه نوررنگبری (Photobleaching)، سوسو زدن نوری (Photoblinking) و تخریب فوتوشیمیایی (Photochemical degradation)، عدم تخریب DNA/ RNA به دلیل پایین بودن سطح انرژی برانگیختگی نور، سمیت سلولی کمتر و حساسیت تشخیص بالاتر اشاره کرد (63). در مطالعه یان و همکاران، نانوذرات لانتانیددوپ به عنوان منبع داخلی جذب تابش فرابنفش و نور مرئی در مقابل تابش اشعه ماوراء بنفش عمل کردند. هنگامی که فرمولاسیونها در 980 نانومتر تحت تابش قرار گرفتند، تجزیه ساختار توسط نور و به دنبال آن رهایش دارو مشاهده شد. این رهایش در واقع از طریق تحریک گروههای نیتروبنزیل حساس به نور که به عنوان اتصالدهنده متقابل در ساختار هیدروژل استفاده شدهاند رخ میدهد. تابش فرابنفش از بیرون به نانوذرات لانتانید دوپ و جذب آن توسط این نانوذرات، انرژی مورد نیاز برای شکست پیوندهای نیتروبنزیل را فراهم نموده که در ادامه با از بین رفتن این گروههای اتصالدهنده متقابل رهایش دارو از ساختار هیدروژل اتقاق میافتد. در شکل6، شیوه رهایش از ساختار هیدروزل نانوکامپوزیت ساخته شده بهوسیله تابش فرابنفش نشان داده شده است. چنگ و همکاران، نانوذرات NaYF4: Yb3+/ Er3+ و نانولولههای کربنی چندلایه را به هیدروژلهای به فرم دیسک ساخته شده از پلیایزوپروپیل و پلیآکریلآمید اضافه نمودند. نانوذرات NaYF4: Yb3+/ Er3+ به لایه پایینی هیدروژل پلیایزوپروپیل و پلیآکریلآمید و نانولولههای کربنی به لایه بالایی هیدروژل اضافه شدند. نانولولههای کربنی اضافه شده به لایه بالایی منجر به جذب پرتو فرابنفش شده و از انقباض هیدروژل جلوگیری میکند. در لایه پایین نانوذرات NaYF4: Yb3+/ Er3+ با خاصیت Up-conversion، برای شناسایی و رهگیری سامانه در داخل بدن استفاده شد. همچنین از پلیاتیلنگلایکول بعنوان عاملی برای افزایش منافذ هیدروژل و افزایش میزان آب در ساختار هیدروژل استفاده شد. استفاده از نانوذرات در این هیدروژل منجر به ساخت یک سامانه چند کاربردی جهت تشخیص و ردیابی دارو و همچنین رهایش آن در محل مورد نظر با استفاده از تابش ماوراء بنفش در 980 نانومتر شد. همچنین، این سامانه علاوه بر پاسخ به نور قابلیت حساسیت به دما به دلیل حساسیت هیدروژل مورد استفاده به دما را داراست. در شکل 7 طرح شماتیک این نانوکامپوزیت هیدروژل آورده شده است (64). ژنگ و همکاران نانوذرات تیانیوماکساید را بر روی نانولولههای کربنی قرارداده و سپس آن را به هیدروژل پلیاتیلنگلایکولدابلآکریلات اضافه نمودند. دوکسوروبیسین نیز به عنوان داروی مدل در نانوکامپوزیت هیدروژل بارگذاری شد. در این سامانه، نانوذرات تیانیوماکساید قرار داده شده بر روی نانولولههای کربنی چند کاربرد داشت. اولاً، این نانوذرات دراثر تابش ماوراء بنفش به عنوان اتصالدهنده متقابل عمل کردند. همچنین، این نانوذرات سلولهای سرطانی را با تولید هیپرترمی موضعی یا گونههای اکسیژن واکنشپذیر از بین بردند. استفاده از این نانوکامپوزیت هیدروژل باعث رهایش پایدار و طولانی مدت داروی ضد سرطان از هیدروژل شد. در شکل 8، مراحل تزریق اجزای نانوکامپوزیت هیدروژل به بدن و در ادامه تشکیل نانوکامپوزیت هیدروژل در اثر اتصال متقابل توسط نانوذرات با تابش ماوراءبنفش در 808 نانومتر و به دنبال آن از بین بردن تومورها در اثر گرمای ایجاد شده از طریق جذب تابش توسط نانوذرات و رهایش گونههای اکسیژن واکنشپذیر نشان داده شده است (65). علاوه بر سیستمهای محرک به عوامل فیزیکی، از عوامل شیمیایی نیز در تولید نانوکامپوزیت هیدروژلهای حساس به تحریک استفاده شده است. در ادامه به دو مورد از مهمترین آنها یعنی هیدروژلهای حساس به pH و حساس به اکسایش-کاهش میپردازیم.

شکل 6: رهایش دارو از ساختار نانوکامپوزیت هیدروژل ساخته شده بوسیله تابش فرابنفش (62)
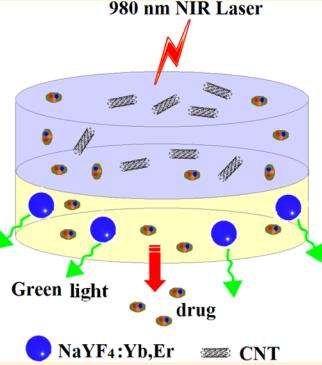
شکل 7: طرح شماتیک نانوکامپوزیت هیدروژل NaYF4: Yb3+/ Er3+ و نانولولههای کربنی چندلایه (CNT) در هیدروژل پلی ایزوپروپیل و پلیآکریلآمید (64).
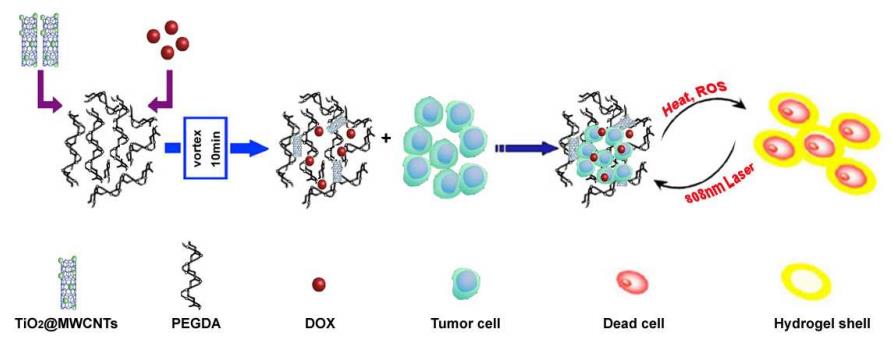
شکل 8: تزریق اجزای نانوکامپوزیت هیدروژل به بدن و تشکیل نانوکامپوزیت هیدروژل در اثر اتصال متقابل توسط نانوذرات با تابش ماوراءبنفش در 808 نانومتر و از بین بردن تومورها در اثر گرمای ایجادشده توسط نانوذرات و رهایش گونههای اکسیژن واکنش پذیر(65)
5.4. نانوکامپوزیت هیدروژلهای حساس به pH
این روش تحریک از جمله روشهای شیمیایی مورد استفاده برای تحریک نانوکامپوزیت هیدروژل و رهایش دارو میباشد. پایین بودن pH خارج سلولی در سلولهای تومور بهعنوان نتیجه گسترش سریع سلولهای سرطانی مشاهده میشود. در اثر تکثیر سریع سلولهای سرطانی، مقدار اکسیژن در دسترس سلولها کاهش یافته و منجر به تولید اسیدلاکتیک از طریق گلیکولیز میشود. این اثر، معروف به اثر Warburg، روشی مرسوم در استفاده از سیستمهای تحویل داروی پاسخگو به pH است (66). هیدروژلهای پاسخگو به pH به میزان قابل توجهی در تحویل کنترل شده داروها و کاربردهای پزشکی کمک میکنند. سامانههای رهایش داروی مختلفی بر مبنای نانوکامپوزیت هیدروژلها طراحی و ارائه شده است که در ادامه به برخی از آنها پرداخته میشود. پاپسکو و همکاران ترپلیمرهای زیست سازگار و پاسخگو به pH پلی (2-وینیلپیریدین)، پلی (اسیداکریلیک) و پلی (متیلمتاکریلات) را بهعنوان ژلاتور که در برگیرنده لیپوزومهای فسفاتیدیلکولین-کلسترول بارگذاری شده با کلسئین بهعنوان داروی هیدروفیل بودند را برای طراحی یک سامانه رهایش داروی حساس به pH مطرح کردند (18). رسول زاده و نمازی نیز در یک تحقیق نانوذرات گرافناکساید را به هیدروژل کربوکسیمتیل سلولز که با استفاده از آهن (III) کلرید اتصال متقابل یافتهاند برای رهایش کنترل شده دوکسوروبیسین طراحی کردند. این سیستم منجر به تولید یک سامانه حساس بهpH و رهایش پایدار دارو شد. همچنین، میزان رهایش دوکسوروبیسین از نانوکامپوزیت هیدروژل 6/1 برابر بیشتر از میزان داروی رهایش یافته در 4/7pH بود (67). رائو و همکارانش در تحقیقی با استفاده از نانو لولههای هالویزیت و افزودن آن به هیدروژل هیالوروناتسدیم، یک سامانه رهایش داروی پاسخگو بهpH برای رهایش داروی طبیعی 5-فلوئوراوراسیل که از خانواده فلاوونوئیدها میباشد را برای درمان سرطان روده مطرح نمودند. میزان رهایش داروی مدل از نانوکامپوزیت هیدروژل در محیط اسیدی روده (2/1=pH) حدود 10% بیشتر بود. در شکل 9، شماتیک بارگذاری مولکولهای دارو در شبکههای هیدروژل و همچنین داخل نانو لولههای هالویزیت نشان داده شده است (68).
6.4 نانوکامپوزیت هیدروژلهای حساس به اکسایش- کاهش سیستمهای رهایش دارو با پاسخ به اکسایش-کاهش یکی از تکنیکهای مفید برای تومورها و همچنین ژن درمانی هستند. نانوسیستمهای قابل تخریب حساس به اکسایش-کاهش نسبت به سایر محرکها از جمله pH جنبههای مثبتی دارند. پاسخ عالی به مقادیر بیش از حد گلوتاتیون در داخل خون، انتشار دارو به طور مستقیم به هسته و سیتوزول، و پایداری سامانه در محیط خارج سلولی که در آن گلوتاتیون خون حداقل میباشد نمونههایی از این مزایا هستند (71-69). فرایند اکسایش-کاهش تحت تأثیر گروههای مزدوج، بهعنوان مثال NADP+/ NADPH است. سیتوپلاسم دارای اکسیدازهای متابولیکی مداوم است که محیطی را برای سیگنالینگ ردوکس ایجاد میکند که تحت تأثیر آنزیمهای نیتریکاکسیدسنتاز و NADPH اکسیداز است. گائو و همکارانش در مطالعهای نانو ذرات آهن (III) اکسید اصلاح شده با وینیل توسط 2- ایزوسیاناتواتیلمتاکریلات را به هیدروژل پلیوینیلکاپرولاکتام برای توسعه یک سامانه با حساسیت به عوامل مختلف تحریک اضافه نمودند. این سامانه با سمیت کم بر سلولهای نرمال عملکرد بسیار خوبی در هدایت بهوسیله مغناطیس و رهایش از طریق واکنش اکسایش- کاهش نشان داد (72).
5. کاربردهای درمانی
کاربرد نانوکامپوزیت هیدروژلها در مهندسی پزشکی شامل موارد متعددی میشود. در ادامه به بررسی دو کاربرد متداول آنها یعنی توسعه زخم پوشها و درمان سرطان می پردازیم. در این سامانهها از خاصیت حساس به تحریک خود پلیمرها نظیر خاصیت حساسیت به pH کیتوزان یا خاصیت حساس به تحریک نانوذرات جهت رهایش دارو یا فاکتور رشد استفاده شده است.
1.5. نانوکامپوزیت هیدروژلها بهعنوان زخم پوش
توسعه نانوکامپوزیت هیدروژلها در زخم پوشها با اهدافی مانند تسریع بهبود زخم، جلوگیری از عفونت با کمک رهایش طولانی مدت، تولید کلاژن و رگزایی انجام شده است. در جدول 2 برخی از نانوکامپوزیت هیدروژلهای استفاده شده به عنوان زخم پوش گردآوری شده است.
2.5. نانوکامپوزیت هیدروژلها برای درمان سرطان
درمان سرطان به کمک نانوکامپوزیت هیدروژلها یکی دیگر از کاربردهای این سامانهها میباشد. در این سامانهها، از انواع مکانیسمهای تحریک مطرح شده برای رسانش هدفمند و کنترل شده استفاده میشود. همچنین، در برخی از این سامانهها از بیش از یک مکانیسم تحریک به صورت مرحلهای استفاده میشود (81). در جدول 3 برخی از این نمونهها خلاصه شدهاند.
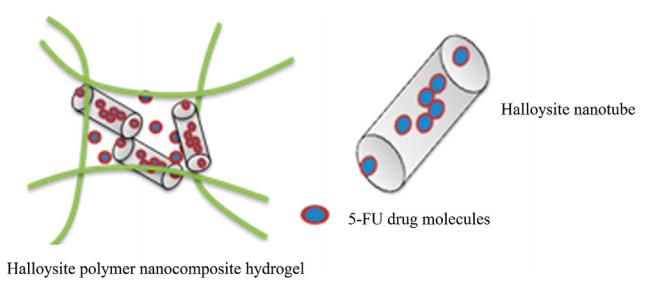
شکل 9: بارگذاری مولکولهای دارو در شبکههای هیدروژل و داخل نانولولههای هالویزیت (68).
جدول2: برخی از نانوکامپوزیت هیدروژلهای استفاده شده بهعنوان زخم پوش
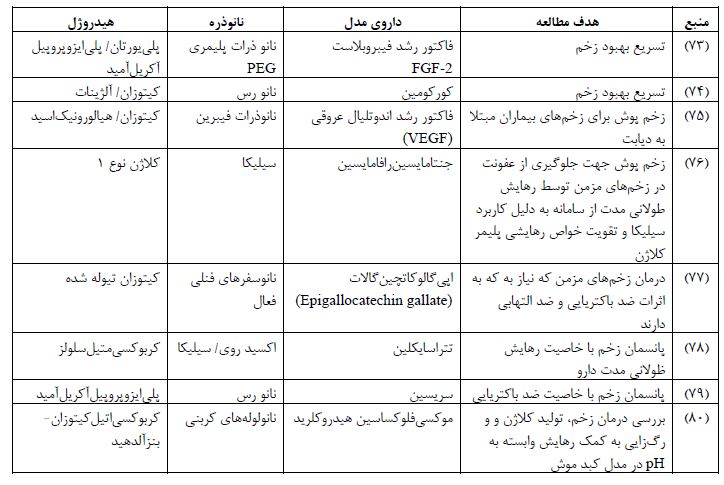
جدول3: نمونههایی از نانوکامپوزیت هیدروژلهای استفاده شده درمان سرطان به همراه داروی مدل

نتیجهگیری
در سالهای اخیر، توسعه نانوکامپوزیت هیدروژلها با استفاده از پلیمرهای مختلف و همچنین نانوذرات گوناگون افزایش یافته است. استفاده از نانوذرات در هیدروژلها میتواند به عنوان گزینهای در راستای بهبود خواص هیدروژلها از جمله خواص فیزیکی و ساختاری، بهبود بارگذاری داروهای آبگریز مورد استفاده در درمان سرطان در ساختار هیدروژل و همچنین توسعه سیستمهای دارورسانی پاسخگو به عوامل تحریک با رهایش کنترل شده و طولانیمدت مطرح شود. استفاده از سیستمهای دارورسانی حساس به تحریک میتواند منجر به تقویت انتقال دارو به سلولهای هدف بهویژه در درمان سرطان منجر شود و اثرات منفی روشهای متداول درمان سرطان مانند شیمیدرمانی را کم کند. به بیان دیگر، انتقال هدفمند دارو به محل مورد نظر به کمک عوامل تحریک منجر به کاهش اثرات تخریبی بر بافتهای سالم شده و رهایش در مدت زمان طولانی که از بهبود خواص هیدروژل حاصل میشود نیاز به تکرار دریافت دارو توسط بیمار را کاهش میدهد. همچنین، افزودن روشهای تحریک بیولوژیکی مانند آنزیمها به این سیستمها میتواند منجر به توسعه سامانههایی با قابلیت پاسخگویی به چند عامل تحریک مختلف شود که به تولید سامانههایی هوشمندتر با قابلیت انتقال هدفمندتر میانجامد.
حامی مالی: دانشگاه تهران
تعارض در منافع: وجود ندارد.
در طول سالهای اخیر، کاربرد هیدروژلها در دارورسانی توجه زیادی را به خود جلب کرده است. هیدروژلها از زنجیرههای پلیمری با برهمکنشهای فیزیکی یا شیمیایی تشکیل شدهاند که منجر به شکلگیری شبکه های پلیمری سه بعدی با محتوای آب زیاد میشوند. در حقیقت، ساختار هیدروژل میتواند تا هزاران برابر وزن خشک خود آب یا سیالهای دیگر با خواص بیولوژیکی را جذب کند. ساختار هیدروژل علیرغم داشتن قابلیت تعامل با محلولهای آبی و تورم یافتن از انحلال آن جلوگیری میکند. به همین خاطر قابلیت بازگشت به حالت اولیه قبل از تورم را دارا هستند. بهبود توانایی هیدروژل در جذب آب با استفاده از گروههای عاملی آبدوست اضافه شده نظیر آمین، کربوکسیل و هیدروکسیل به زنجیرههای پلیمری حاصل میشود. همچنین، مقاومت هیدروژل در برابر انحلال به دلیل برهمکنش بین زنجیرههای شبکه افزایش مییابد (1). کاربرد هیدروژلها در مطالعات زیست پزشکی و مواردی که نیاز به تماس با بافتهای زنده است بسیار مفید است چرا که ساختار آنها شباهت زیادی به بافت زنده دارد. از دلایل این شباهت میتوان به طبیعت نرم، انعطافپذیر و میزان بالای آب در هیدروژلها اشاره کرد (2). از هیدروژلها به طور گسترده در زمینههایی مانند تحقیقات سرطان، مهندسی سلولهای بنیادی، سلول درمانی، مهندسی بافت و ایمپلنت استفاده میشود (3). علاوه بر این، برخی هیدروژلها قابلیت پاسخدهی به عوامل تحریک را به دلیل امکان تغییر در ساختار شبکه پلیمری و بهدنبال آن تغییر در ساختار هیدروژل که بهصورت تورم، انحلال یا تخریب هیدروژل رخ میدهد میتوانند داشته باشند. این دسته از هیدروژلهای حساس به تغییرات در شرایط محیطی بهعنوان هیدروژلهای هوشمند شناخته میشوند (4). نحوه قرارگیری و ورود دارو به ماتریس هیدروژل تأثیر زیادی در کنترل رهاسازی دارو و استفاده از عوامل تحریک دارد (5). هنگامی که مولکولهای فعال زیستی به صورت کووالانسی به هیدروژلها متصل هستند، آزاد شدن آنها از ساختار هیدروژل نیاز به قطع پیوند بین هیدروژل و دارو دارد. این قطع پیوند از طریق واکنش شیمیایی مانند واکنش آنزیمی یا شیمیایی، تغییر در pH یا محرک خارجی مانند نور اتفاق میافتد (6،7). اما، در هیدروژلهایی که دارو توسط فعل و انفعالات فیزیکی (8) یا فرا مولکولی (9) و از کنار هم قرار گرفتن مولکولها با پیوندهای غیرکوالانسی تشکیل شده، رهایش دارو نه تنها به دلیل واکنش شیمیایی بلکه در اثر تغییر فیزیکی در ساختار هیدروژل مانند انقباض در ساختار است که میتواند توسط تغییرات در pH، دما و سایر تغییرات فیزیکی که منجر به پاسخ عوامل تحریک شونده در هیدروژل میشوند حاصل شود. قراردادن نانو مواد در هیدروژلها رویکردی نوآورانه برای به دست آوردن سیستمهای هیدروژل هوشمند و حساس به تحریک با خواص بهبود یافته و پاسخگویی کنترل شده جهت آزادسازی هدفمند دارو و کنترل رهایش آن است. در این مطالعه مروری به بررسی روشهای مورد استفاده در تولید این سامانهها و انواع مکانیسمهای تحریک مورد استفاده میپردازیم.
عنوان مطالب:
1. برهم کنش نانوذرات و شبکه هیدروژل
2. مزیتهای کاربرد نانوذرات در هیدروژلها
3. روشهای تهیه نانوکامپوزیت هیدروژل
1.3. تشکیل هیدروژل در سوسپانسیون نانوذرات
2.3. جاسازی فیزیکی نانوذرات در هیدروژل بعد از فرآیند ژل شدن
3.3. تشکیل نانوذرات واکنش پذیر در یک ژل از پیش ساخته
4.3. استفاده از نانوذرات به عنوان اتصالدهنده متقابل جهت تشکیل هیدروژلها
5.3. تشکیل ژل با استفاده از نانوذرات، پلیمرها و مولکولهای ژلاتور مجزا
4. انواع مکانیسمهای تحریک
1.4. نانوکامپوزیت هیدروژلهای حساس به دما
2.4. نانوکامپوزیت هیدروژلهای حساس به الکتریسیته
3.4. نانوکامپوزیت هیدروژلهای حساس به مغناطیس
4.4. نانوکامپوزیت هیدروژلهای حساس به نور
5.4. نانوکامپوزیت هیدروژلهای حساس به pH
6.4. نانوکامپوزیت هیدروژلهای حساس به اکسایش- کاهش
5. کاربردهای درمانی
1.5. نانوکامپوزیت هیدروژلها بهعنوان زخم پوش
2.5. نانوکامپوزیت هیدروژلها برای درمان سرطان
روش بررسی
به منظور بررسی روشهای تولید نانوکامپوزیت هیدروژلها و کاربردهای متنوع آن در حوزه درمان بازه زمانی سال 2000 تا 2020 انتخاب گردید. نخست واژگان کلیدی توسط نویسندگان مقاله و با توجه به تجارب قبلی آنها تعیین شد و سپس از این کلیدواژهها جهت جستجوی مقالات در پایگاههای اطلاعاتی PubMed، Google Scholar، Science Direct و Scopus استفاده شد. پس از انتخاب مقالات به بررسی و طبقهبندی اطلاعات هر یک پرداخته شد و این اطلاعات به صورت فیش برداری توسط نویسندگان خلاصهنویسی شده و به دستهبندیهای نانو ذره استفاده شده در هیدروژل، مزیتها، روشهای تهیه نانوکامپوزیت هیدروژلها، انواع مکانیسمهای تحریک مورد استفاده شامل عوامل فیزیکی و شیمیایی، و کاربردهای درمانی تقسیمبندی شدند. به منظور جمعبندی بهتر موضوعات اطلاعات ارائه شده در جداول جداگانه جمعبندی شد.
1. برهم کنش نانوذرات و شبکه هیدروژل
انواع مختلف نانوذرات مانند نانوذرات معدنی سرامیکی نظیر هیدروکسی آپاتیت (10)، سیلیس، سیلیکات (11)، و کلسیم فسفات (12)، نانوذرات بر پایه فلزات یا اکسید فلزات مانند طلا (13)، نقره (14) و اکسید آهن (14)، نانوذارت بر پایه کربن مانند نانولولههای کربنی (15) و گرافن (16)، و نانوذرات پلیمری نظیر دندریمرها (17)، لیپوزوم (18) و مایسلها (19) برای تولید نانوکامپوزیت هیدروژلها با شبکه پلیمری ترکیب میشوند. قرارگیری این نانوذارت در ساختار هیدروژل توسط برهمکنشهای مختلفی انجام میشود. این برهمکنشها شامل برهمکنشهای کوالانسی (20)، هیدروژنی (21,22) و الکترواستاتیکی میباشند (23). نانوکامپوزیتهای حاصل خصوصیات فیزیکی مناسبتر با قابلیت رهایش دارو از طریق عوامل تحریککننده را دارند. نوع نانوذرات استفاده شده در ساختار هیدروژل، نوع محرکهایی که میتوانند رهایش دارو در شرایط دلخواه را کنترل کنند، تعیین میکند. اضافه شدن نانوذرات به نانوکامپوزیت هیدروژل و برهمکنش آنها با ماتریکس هیدروژل به سه طریق اتفاق میافتد.
1. ذرات هیدروژل به ابعاد میکرو یا نانو تثبیتکننده نانوذرات معدنی یا پلیمری
2. نانوذرات تثبیتشده در هیدروژل با پیوندهای غیرکوالانسی
3. نانوذرات تثبیت شده در هیدروژل با پیوندهای کوالانسی
در شکل 1، چگونگی قرارگیری نانوذرات در داخل ساختار هیدروژل نشان داده شده است.
2. مزیتهای کاربرد نانوذرات در هیدروژلها
همانطور که اشاره شد، علیرغم پتانسیل هیدروژلها برای دارورسانی، تهیه هیدروژلها با قابلیت رهایش کنترل شده و اختصاصی دارو در محل به عنوان یک چالش مطرح بوده است. بهعلاوه شماری از داروهای مورد استفاده به دلیل ماهیت آبگریز خود بارگیری ضعیفی را در هیدروژلها نشان میدهند. به دلیل برهمکنشهای میان نانوذره و شبکه هیدروژل که اشاره شد استفاده از نانوذرات در شبکه هیدروژل منجر به بهبود بارگذاری دارو بهخصوص داروهای آبگریز (26)، کنترل رهایش (27)، شکلگیری سیستمهای دارورسانی با قابلیت پاسخ به چند عامل محرک (11)، بهبود خواص مکانیکی هیدروژل، و تصویربرداری با وضوح بالاتر میشود. در جدول 1 خلاصهای از این مزایا گردآوری شده است.

شکل 1: انواع بر همکنشهای بین نانوذرات و هیدروژل تثبیت یک یا چند نانوذره در ساختار میکروژل یا نانوژل (سمت چپ)، تثبیت با پیوند کوالاتسی (وسط)، تثبیت با پیوند غیرکوالانسی (سمت راست) (24,25)
جدول1: برخی از مزیتهایکاربرد نانوذرات در هیدروژلها

3. روشهای تهیه نانوکامپوزیت هیدروژل
طیف متنوعی از نانوکامپوزیت هیدروژلها با تغییر انواع نانوذرات جاسازی (embed) شده و فرایند قرارگیری آنها در چارچوب هیدروژل ساخته شده است. پنج روش اصلی برای به دست آوردن توزیع یکنواخت نانوذرات در هیدروژلها استفاده شده است:
1. تشکیل هیدروژل در سوسپانسیون نانوذرات
2. جاسازی فیزیکی نانوذرات در هیدروژل بعد از فرآیند ژل شدن (ژلینگ)
3. تشکیل نانوذرات واکنش پذیر در یک ژل از پیش ساخته
4. استفاده از نانوذرات به عنوان اتصالدهنده متقابل جهت تشکیل هیدروژلها
5. تشکیل ژل با استفاده از نانوذرات، پلیمرها و مولکولهای ژلاتور مجزا
رویکرد انتخاب شده جهت تولید، به استفاده نهایی از نانوکامپوزیت هیدروژل بستگی دارد (24).
1.3. تشکیل هیدروژل در سوسپانسیون نانوذرات
سادهترین روش برای تشکیل یک نانوکامپوزیت هیدروژل، ژل شدن سوسپانسون نانوذرات از پیش ساخته در یک محلول مونومری تشکیل دهنده هیدروژل است. اگرچه این مرحله نسبتاً ساده است، ممکن است تجمع نانوذرات در محلول مونومر (قبل و طی فرآیند ژلینگ) مشاهده شود. علاوه بر این، احتمال بیرون آمدن نانوذرات از ماتریس هیدروژل هنگامی که چگالی اتصالدهنده متقابل کم باشد ممکن است. این روش برای تولید نانوکامپوزیت هیدروژلهای حساس به نور مورد استفاده قرار گرفته است (41). راوی و همکاران از این روش برای گنجاندن سه نوع مختلف از نانو ذرات استفاده کردند. این نانو ذرات شامل پلیاکریلآمید شبه پروتئینی، سرمآلبومین گاوی و سیلیس هیدروفیل شده با قطرات کوچک از محلول پلیمری آبدوست بودهاند که در ساختار یک ماتریس هیدروژل برای کاربرد به عنوان لنز داخل چشم مورد استفاده قرار گرفت (42). کاربرد پیشرفته نانوکامپوزیت هیدروژلها با استفاده از این پروتکل توسط لیو و همکاران برای تولید هیدروژلهای قابل تغییر با نور و پاسخگو به حرارت با استفاده از نانوصفحههای تیتانیای یک طرفه به عنوان یک اتصالدهنده متقابل فوتوکاتالیستی گزارش شده است (43).
2.3. جاسازی فیزیکی نانوذرات در هیدروژل بعد از فرآیند ژل شدن
در این شرایط، نانوذرات احتمالاً به دلیل برهمکنش فیزیکی و یا پیوند هیدروژنی بین زنجیرههای پلیمری و سطح نانوذرات بعد از فرآیند ژل شدن و تولید هیدروژل در ساختار هیدروژل قرار داده میشوند. پاردو و همکاران پس از تولید هیدروژل پلیآکریلآمید (PAAm) نانوذرات نقره را به همین روش در هیدروژل اضافه نمودند (25). تغییر فاصله بین نانوذرات نقره در این هیدروژل منجر به تولید یک هیدروژل با قابلیت پاسخ به تحریک الکتریکی شد.
3.3. تشکیل نانوذرات واکنشپذیر در یک ژل از پیش ساخته
در این روش، پیش سازهای نانوذرات به مخلوط مونومری و اتصالدهنده متقابل که تشکیل دهنده هیدروژل است اضافه میشود. پس از تشکیل هیدروژل، پیش ساز نانوذرات تبدیل به نانوذره شده و در نهایت نانوکامپوزیت هیدروژل تشکیل میشود. ساختار متخلخل شبکههای هیدروژل دامنه نانوسکوپی برای تشکیل نانوذرات (ایجاد فضای خالی در بین شبکه ژل) را فراهم میکند و از پدیده تجمع نانوذرات در یک محل جلوگیری میکند که منجر به توزیع یکنواخت نانوذرات در هیدروژل میشود (27,44,45). گروه لانگر این رویکرد را که شامل بارگذاری پیش سازهای نانوذرات در ژل به جای نانوذرات است را توسعه داده است (46). در این روش، اتصال ایزوپروپیلآکریلامید(NIPAAm) و کومونومرهای حاوی گروههای تیول یک شبکه هیدروژل حاوی یونهای تعبیه شده Au (III) تشکیل دادند. ماتریکس هیدروژل عملگرا شده با گروه تیول منجر به تشکیل نانو ذرات طلا برای قرارگیری نانو ذرات طلا با استفاده از یک ماده کاهش دهنده مانند بوروهیدریدسدیم شد. در شکل2، تصویر شماتیک تهیه نانوکامپوزیت هیدروژل طلا نشان داده شده است.
4.3. استفاده از نانوذرات به عنوان اتصالدهنده متقابل جهت تشکیل هیدروژلها
یک نمونه خاص جالب در توسعه نانوکامپوزیت هیدروژلها شامل استفاده از گروههای اتصالدهنده متقابل موجود در سطح نانوذرات است. سوزا و همکاران، شبکههای مولکولی باکتریوفاژ تولید شده توسط مونتاژ خود به خود فاژ با نانوذرات طلا را تولید کردند. شبکه هیدروژل حاصل ویژگی اتصال به گیرندههای سطح سلولی و درونگیری پپتید را حفظ کرد (47). تشکیل خود به خودی این شبکهها میتواند به وسیله تلفیق با ایمیدازول که باعث تغییرات در مورفولوژی، بعد فراکتال، و خواص نوری نزدیک مادون قرمز میشود کنترل شود. یکی از مزایای مهم استفاده از نانوذرات، امکان ایجاد پیوندهای کوالانسی بیشتر (مالتی والانسی) در شبکه ژل است در حالیکه در روشهای متداول تولید هیدروژل معمولاً دو پیوند کوالانسی بین پلیمرهای مورد استفاده در ساختار هیدروژل تشکیل میشود. این مزیت در واکنش اتصال متقاطع نانو ذرات طلای محافظت شده با مرکاپتوپروپیونیلگلیسین برای تولید ژل کلاژن با استفاده از 1-اتیل3-( 3-دیمتیلآمینوپروپیل) کربودیمید نشان داده شده است (48). در یک مطالعه اخیر، ژانگ و همکاران هیدروژلهای مبتنی بر نانوذرات نیمه هادی سنتز شده توسط پلیمریزاسیون خود آغاز شده تحت تابش نور را تولید کردند (49). این سیستم از چهار مؤلفه تشکیل شده بود.
1- آب 2- نانوذرات نیمه هادی اکسیدروی، دیاکسیدتیتانیوم، آهن (III) اکسید محلول در آب، دیاکسیدقلع، دیاکسیدزیرکونیوم، کادمیومسلنید 3- دیمتیلآکریلامید 4- نانو صفحات رس در این مطالعه، نانوذرات معدنی نیمه هادی به عنوان آغازگر برای پلیمریزاسیون دیمتیلآکریلامید عمل کردند. در شکل 3، مراحل ساخت این هیدروژلها با استفاده از نانوذرات نیمه هادی و پلیمریزاسیون توسط نور نشان داده شده است.

شکل 2: تصویر شماتیک تهیه نانوکامپوزیت هیدروژل طلا (46)

شکل 3: مراحل ساخت این هیدروژلها با استفاده از نانوذرات نیمه هادی (49)
5.3. تشکیل ژل با استفاده از نانوذرات، پلیمرها و مولکولهای ژلاتور مجزا
در این روش، برای تولید نانوکامپوزیت هیدروژل از پلیمرهای مختلف، نانوذرات و عوامل اتصالدهنده جداگانه تحت عنوان ژلاتور استفاده میشود. وو و همکاران، در مطالعهای از نانوذرات سیلیکا برای اضافه کردن آنها به هیدروژل هادی و تهیه آندها بر پایه این نانوکامپوزیت هیدروژل استفاده کردند. پلیمریزاسیون هیدروژل در محل برای تولید یک شبکه سه بعدی به خوبی اتصال متقابل یافته شامل نانوذرات سیلیکای پوشش داده شده با پلیمر رسانا انجام شد. شبکه ساخته شده ویژگیهای مثبتی از جمله شبکه رسانای پیوسته پلیآنیلین، اتصال به سطح سیلیسیم از طریق پیوند هیدروژنی با اسیدفیتیک یا تعامل الکترواستاتیک با پلیمر دارای بار مثبت، و فضای متخلخل برای گسترش حجم را با هم داراست. شکلگیری این هیدروژل با استفاده از سنتز فاز محلول با مخلوط کردن سیلیسیم با اسیدفیتریک و آنیلین در آب و به دنبال آن افزودن اکسید کننده (به عنوان مثال پرسولفات آمونیوم) بهدست آمد (50).
4. انواع مکانیسمهای تحریک
یکی از رویکردهای پیشرو در تولید و توسعه سیستمهای دارورسانی هوشمند، استفاده از مکانیزمهای تحریک ساختار دز و رهایش کنترل شده دارو از آن است. در میان این روشهای تحریک، به دو دسته کلی تحریک توسط عوامل فیزیکی و شیمیایی میتوان اشاره کرد. از جمله عوامل فیزیکی میتوان به دما، تابش نور، الکتریسیته، مغناطیس و از عوامل شیمیایی میتوان به pH یا اکسایش-کاهش اشاره کرد. در ادامه به بررسی انواع روشهای تحریک مورد استفاده در نانوکامپوزیت هیدروژلها پرداخته میشود.
1.4. نانوکامپوزیت هیدروژلهای حساس به دما
گرما یکی از رایجترین پارامترهای استفاده شده برای تحریک حاملهای داروها و رهایش موضعی دارو در پاسخ به محرک است که بهصورت مکانی و زمانی تنظیم میشود. سیستم تحویل داروی مؤثر باید پایداری خود را در موقعیتها و مکانهای نامناسب حفظ کند و دارو را با استفاده از سینتیک تنظیم شده، درون سلولها و بافتهای هدف، مثلاً تومورها، ترشح کند. احتمالاً یکی از بهترین مواد در سیستمهای دارورسانی، پلیمرهای حساس به دما هستند که میتوانند در پاسخ به تغییر دما، پیکربندی خود را از یک ساختار منقبض شده به یک ساختار منبسط شده تغییر دهند. این فرآیند معمولاً توسط دمای محلول بحرانی بالا و دمای محلول بحرانی پایین کنترل میشود (شکل 4). با تنظیم دما اطراف این دو حد بالا و پایین، یک تغییر فاز که منجر به تورم یا کوچک شدن میشود اتفاق افتاده و رهایش رخ میدهد. چن و همکاران، یک هیدروژل قابل تزریق و پاسخگو به گرما که میتواند با دمای بدن تحریک شود همراه با افزایش پایداری مکانیکی و زیست سازگاری را بهعنوان یک حامل داروی کنترل شده برای درمان سرطان، مطرح کردند (52). تیان و یانگ نیز در مطالعهای دیگر با استفاده از اضافه کردن نانوذرات سیلیکای مزوپور به هیدروژل پلیایزوپروپیلآکریلامید، یک نانوکامپوزیت هیدروژل حساس به دما برای رهایش کنترل شده ایبوپروفن توسعه دادند (53).

شکل 4: تغییرات ساختار پلیمر با دما و تاثیر آن بر ضریب نفوذ و سرعت رهایش (51)
2.4. نانوکامپوزیت هیدروژلهای حساس به الکتریسیته
با استفاده از میدان الکتریکی خارجی، میتوان از رهایش کنترل شده برای آزاد سازی داروها بهصورت مداوم، پالسی یا با رژیمی که برای رهایش داروی مورد نظر بهتر است استفاده کرد. رهایش دارو از طریق تحریک با جریان الکتریکی میتواند به سه طریق انجام شود. از جملهی این روشها میتوان به استفاده از توسعه نانوساختارهای حساس به جریان الکتریکی، بارگذاری نانوذرات حساس به الکتریسیته در ساختار هیدروژل، و ترکیب نانوذرات حساس به الکتریسیته با ترکیبات پاسخگو به تحریکهای دیگر نظیر دما و میدان مغناطیسی جهت ایجاد قابلیت پاسخدهی چندگانه به عوامل تحریک اشاره کرد. گنجاندن پلی الکترولیتهای دارای طیف گستردهای از گونههای با قابلیت یونیزه شدن در ساختار هیدروژل، امکان انقباض یا انبساط پلیمرها بهوسیله تحریک الکتریکی را فراهم میکند. برای مثال، یینگ و همکاران کامپوزیت هیدروژل حساس به الکتریسیته را برای رهایش کنترل شده داروی ضد صرع تولید کردند. افزایش سطح یونیزاسیون در ساختار نیز تحت تأثیر یک میدان الکتریکی به دلیل وجود پلیالکترولیتسدیم4- وینیلبنزنسولفونات اتفاق افتاد (54). در مطالعهای دیگر، سروانت و همکاران نانولولههای کربنی چندلایه را به هیدروژل پلیمتیلمتاکریلیت اضافه نموده تا یک سامانه رهایش دارو با رژیم جریان پالسی بوسیله قطع و وصل جریان توسعه دهند. مقدار رهایش ساکارز نشاندارشده با رادیواکتیو بهعنوان داروی مدل از نانوکامپوزیت هیدروژل در حالت تحریک شده با جریان الکرتیکی حدود 3/1 برابر بیشتر از هیدروژل بدون تحریک بود (55). مارتینز و همکاران نیز در مطالعهای، نانوفیبرهای پلیآنیلین را در هیدروژل پلیآکریلامید قرار داده و یک سامانه رهایش حساس به جریان برای رهایش آموکسیسیلین تهیه کردند (56). در شکل 5، روش تهیه این نانوکامپوزیت هیدروژل آورده شده است.

شکل 5: روش تهیه نانوکامپوزیت هیدروژل پلی آکریلامید- پلی آنیلین جهت بارگذاری داروی آموکسی سیلین (56)
3.4. نانوکامپوزیت هیدروژلهای حساس به مغناطیس
کار مقدماتی مربوط به این زمینه در سال 1960 آغاز شد. فریمن و همکارانش در ابتدا مفهوم بهکارگیری میدانهای مغناطیسی را در نقش یک محرک خارجی برای رهاسازی داروها تهیه کردند (57). در تحقیقی که توسط میناچ و همکاران انجام شد، نانوذرات آهن (III)اکسید به هیدروژل پلیاتیلنگلایکول اضافه شد. همچنین در این مطالعه تاثیر میزان اتصالدهنده متقابل در میزان رهایش دارو توسط میدان مغناطیسی متغیر بررسی شد. نتایج این بررسی نشان داد که مقدار رهایش پاکلیتاکسل تحت میدان مغناطیسی از هیدروژل با بالاترین درصد اتصالدهنده متقابل در حدود 24/1 برابر بیشتر از هیدروژل با کمترین درصد اتصالدهنده متقابل است (58). در حقیقت، استفاده از درصد بالایی از اتصالدهنده متقابل و قرار گیری دارو در ساختار مستحکم ایجاد شده در کنار میدان مغناطیسی منجر به بهبود رهایش در محل مورد نظر در مدت زمان طولانیتر شده است. وانگ و همکاران نیز در مطالعهای نانو ذرات آهن (III) اکسید را به هیدروژل پلیکاپرولاکتون اضافه نموده و داروی ضد قارچ کتوکونازول را در آن بارگذاری نمودند. نتایج حاصل از تحریک این نانوکامپوزیت هیدروژل با میدان مغناطیسی نشان داد که میزان بیشتری از دارو (حدود 3/1 برابر نسبت به هیدروژل) در اثر تحریک با میدان مغناطیسی رهاسازی میشود (59).
4.4. نانوکامپوزیت هیدروژلهای حساس به نور
تابش نور برای تحریک ساختار در برگیرنده دارو میتواند بهعنوان روشی برای رهایش کنترل شده استفاده شود. جذب انرژی فوتون توسط مواد به شکاف در باند انرژی الکترون در بالاترین مدار مولکولی پر شده بستگی دارد. مواد جذب کننده نور کاربردهای زیادی از جمله محافظت در برابر تابش اشعه ماوراء بنفش در روز، تولید برق از انرژی خورشیدی، یا مولکولهای شناساگر فلورسنت دارند. از بین تعداد محرکهای مورد استفاده در سیستمهای رهایش دارو، تابش نور به دلیل سادگی تنظیم شدت آن، امکان تنظیم زمان قرار گرفتن در معرض نور و همچنین امکان هدفگیری بافت خاص، امکان انتخاب و تعیین معیارهای پرتو مطلوب مورد توجه زیادی قرار میگیرد. همچنین، این واقعیت غیرقابل انکار که تحریک نوری یک روش غیر تهاجمی است این روش را گزینه مطرحی در میان روشهای تحریک و رهایش دارو میکند (60,61). یان و همکاران در مطالعهای با استفاده از نانوذرات لانتانیددوپ و هیدروژل پلیآکریلامید- پلیاتیلنگلایکول، یک سامانه کنترل شده برای رهایش تاموکسیفن و کلاریترومایسین ارائه کردند. نانوذرات تبدیل بالای دوپ شده با لانتانید (Up-conversion Nanoparticle) با اصلاح سطح مناسب میتوانند برای طیف وسیعی از کاربردهای زیست دارویی مانند شناسایی زیستی، درمان سرطان، برچسبگذاری زیستی، تصویربرداری فلورسانس، تصویر برداری تشدید مغناطیسی و رهایش دارو مورد استفاده قرار گیرند (62). از جمله مزیتهای کاربرد لانتانید در توسعهی سامانههای رهایش با تحریک نور میتوان به بالا بردن عمق نفوذ بافتی با تحریک نزدیک به مادون قرمز، بالا بردن پایداری علیه نوررنگبری (Photobleaching)، سوسو زدن نوری (Photoblinking) و تخریب فوتوشیمیایی (Photochemical degradation)، عدم تخریب DNA/ RNA به دلیل پایین بودن سطح انرژی برانگیختگی نور، سمیت سلولی کمتر و حساسیت تشخیص بالاتر اشاره کرد (63). در مطالعه یان و همکاران، نانوذرات لانتانیددوپ به عنوان منبع داخلی جذب تابش فرابنفش و نور مرئی در مقابل تابش اشعه ماوراء بنفش عمل کردند. هنگامی که فرمولاسیونها در 980 نانومتر تحت تابش قرار گرفتند، تجزیه ساختار توسط نور و به دنبال آن رهایش دارو مشاهده شد. این رهایش در واقع از طریق تحریک گروههای نیتروبنزیل حساس به نور که به عنوان اتصالدهنده متقابل در ساختار هیدروژل استفاده شدهاند رخ میدهد. تابش فرابنفش از بیرون به نانوذرات لانتانید دوپ و جذب آن توسط این نانوذرات، انرژی مورد نیاز برای شکست پیوندهای نیتروبنزیل را فراهم نموده که در ادامه با از بین رفتن این گروههای اتصالدهنده متقابل رهایش دارو از ساختار هیدروژل اتقاق میافتد. در شکل6، شیوه رهایش از ساختار هیدروزل نانوکامپوزیت ساخته شده بهوسیله تابش فرابنفش نشان داده شده است. چنگ و همکاران، نانوذرات NaYF4: Yb3+/ Er3+ و نانولولههای کربنی چندلایه را به هیدروژلهای به فرم دیسک ساخته شده از پلیایزوپروپیل و پلیآکریلآمید اضافه نمودند. نانوذرات NaYF4: Yb3+/ Er3+ به لایه پایینی هیدروژل پلیایزوپروپیل و پلیآکریلآمید و نانولولههای کربنی به لایه بالایی هیدروژل اضافه شدند. نانولولههای کربنی اضافه شده به لایه بالایی منجر به جذب پرتو فرابنفش شده و از انقباض هیدروژل جلوگیری میکند. در لایه پایین نانوذرات NaYF4: Yb3+/ Er3+ با خاصیت Up-conversion، برای شناسایی و رهگیری سامانه در داخل بدن استفاده شد. همچنین از پلیاتیلنگلایکول بعنوان عاملی برای افزایش منافذ هیدروژل و افزایش میزان آب در ساختار هیدروژل استفاده شد. استفاده از نانوذرات در این هیدروژل منجر به ساخت یک سامانه چند کاربردی جهت تشخیص و ردیابی دارو و همچنین رهایش آن در محل مورد نظر با استفاده از تابش ماوراء بنفش در 980 نانومتر شد. همچنین، این سامانه علاوه بر پاسخ به نور قابلیت حساسیت به دما به دلیل حساسیت هیدروژل مورد استفاده به دما را داراست. در شکل 7 طرح شماتیک این نانوکامپوزیت هیدروژل آورده شده است (64). ژنگ و همکاران نانوذرات تیانیوماکساید را بر روی نانولولههای کربنی قرارداده و سپس آن را به هیدروژل پلیاتیلنگلایکولدابلآکریلات اضافه نمودند. دوکسوروبیسین نیز به عنوان داروی مدل در نانوکامپوزیت هیدروژل بارگذاری شد. در این سامانه، نانوذرات تیانیوماکساید قرار داده شده بر روی نانولولههای کربنی چند کاربرد داشت. اولاً، این نانوذرات دراثر تابش ماوراء بنفش به عنوان اتصالدهنده متقابل عمل کردند. همچنین، این نانوذرات سلولهای سرطانی را با تولید هیپرترمی موضعی یا گونههای اکسیژن واکنشپذیر از بین بردند. استفاده از این نانوکامپوزیت هیدروژل باعث رهایش پایدار و طولانی مدت داروی ضد سرطان از هیدروژل شد. در شکل 8، مراحل تزریق اجزای نانوکامپوزیت هیدروژل به بدن و در ادامه تشکیل نانوکامپوزیت هیدروژل در اثر اتصال متقابل توسط نانوذرات با تابش ماوراءبنفش در 808 نانومتر و به دنبال آن از بین بردن تومورها در اثر گرمای ایجاد شده از طریق جذب تابش توسط نانوذرات و رهایش گونههای اکسیژن واکنشپذیر نشان داده شده است (65). علاوه بر سیستمهای محرک به عوامل فیزیکی، از عوامل شیمیایی نیز در تولید نانوکامپوزیت هیدروژلهای حساس به تحریک استفاده شده است. در ادامه به دو مورد از مهمترین آنها یعنی هیدروژلهای حساس به pH و حساس به اکسایش-کاهش میپردازیم.

شکل 6: رهایش دارو از ساختار نانوکامپوزیت هیدروژل ساخته شده بوسیله تابش فرابنفش (62)

شکل 7: طرح شماتیک نانوکامپوزیت هیدروژل NaYF4: Yb3+/ Er3+ و نانولولههای کربنی چندلایه (CNT) در هیدروژل پلی ایزوپروپیل و پلیآکریلآمید (64).

شکل 8: تزریق اجزای نانوکامپوزیت هیدروژل به بدن و تشکیل نانوکامپوزیت هیدروژل در اثر اتصال متقابل توسط نانوذرات با تابش ماوراءبنفش در 808 نانومتر و از بین بردن تومورها در اثر گرمای ایجادشده توسط نانوذرات و رهایش گونههای اکسیژن واکنش پذیر(65)
5.4. نانوکامپوزیت هیدروژلهای حساس به pH
این روش تحریک از جمله روشهای شیمیایی مورد استفاده برای تحریک نانوکامپوزیت هیدروژل و رهایش دارو میباشد. پایین بودن pH خارج سلولی در سلولهای تومور بهعنوان نتیجه گسترش سریع سلولهای سرطانی مشاهده میشود. در اثر تکثیر سریع سلولهای سرطانی، مقدار اکسیژن در دسترس سلولها کاهش یافته و منجر به تولید اسیدلاکتیک از طریق گلیکولیز میشود. این اثر، معروف به اثر Warburg، روشی مرسوم در استفاده از سیستمهای تحویل داروی پاسخگو به pH است (66). هیدروژلهای پاسخگو به pH به میزان قابل توجهی در تحویل کنترل شده داروها و کاربردهای پزشکی کمک میکنند. سامانههای رهایش داروی مختلفی بر مبنای نانوکامپوزیت هیدروژلها طراحی و ارائه شده است که در ادامه به برخی از آنها پرداخته میشود. پاپسکو و همکاران ترپلیمرهای زیست سازگار و پاسخگو به pH پلی (2-وینیلپیریدین)، پلی (اسیداکریلیک) و پلی (متیلمتاکریلات) را بهعنوان ژلاتور که در برگیرنده لیپوزومهای فسفاتیدیلکولین-کلسترول بارگذاری شده با کلسئین بهعنوان داروی هیدروفیل بودند را برای طراحی یک سامانه رهایش داروی حساس به pH مطرح کردند (18). رسول زاده و نمازی نیز در یک تحقیق نانوذرات گرافناکساید را به هیدروژل کربوکسیمتیل سلولز که با استفاده از آهن (III) کلرید اتصال متقابل یافتهاند برای رهایش کنترل شده دوکسوروبیسین طراحی کردند. این سیستم منجر به تولید یک سامانه حساس بهpH و رهایش پایدار دارو شد. همچنین، میزان رهایش دوکسوروبیسین از نانوکامپوزیت هیدروژل 6/1 برابر بیشتر از میزان داروی رهایش یافته در 4/7pH بود (67). رائو و همکارانش در تحقیقی با استفاده از نانو لولههای هالویزیت و افزودن آن به هیدروژل هیالوروناتسدیم، یک سامانه رهایش داروی پاسخگو بهpH برای رهایش داروی طبیعی 5-فلوئوراوراسیل که از خانواده فلاوونوئیدها میباشد را برای درمان سرطان روده مطرح نمودند. میزان رهایش داروی مدل از نانوکامپوزیت هیدروژل در محیط اسیدی روده (2/1=pH) حدود 10% بیشتر بود. در شکل 9، شماتیک بارگذاری مولکولهای دارو در شبکههای هیدروژل و همچنین داخل نانو لولههای هالویزیت نشان داده شده است (68).
6.4 نانوکامپوزیت هیدروژلهای حساس به اکسایش- کاهش سیستمهای رهایش دارو با پاسخ به اکسایش-کاهش یکی از تکنیکهای مفید برای تومورها و همچنین ژن درمانی هستند. نانوسیستمهای قابل تخریب حساس به اکسایش-کاهش نسبت به سایر محرکها از جمله pH جنبههای مثبتی دارند. پاسخ عالی به مقادیر بیش از حد گلوتاتیون در داخل خون، انتشار دارو به طور مستقیم به هسته و سیتوزول، و پایداری سامانه در محیط خارج سلولی که در آن گلوتاتیون خون حداقل میباشد نمونههایی از این مزایا هستند (71-69). فرایند اکسایش-کاهش تحت تأثیر گروههای مزدوج، بهعنوان مثال NADP+/ NADPH است. سیتوپلاسم دارای اکسیدازهای متابولیکی مداوم است که محیطی را برای سیگنالینگ ردوکس ایجاد میکند که تحت تأثیر آنزیمهای نیتریکاکسیدسنتاز و NADPH اکسیداز است. گائو و همکارانش در مطالعهای نانو ذرات آهن (III) اکسید اصلاح شده با وینیل توسط 2- ایزوسیاناتواتیلمتاکریلات را به هیدروژل پلیوینیلکاپرولاکتام برای توسعه یک سامانه با حساسیت به عوامل مختلف تحریک اضافه نمودند. این سامانه با سمیت کم بر سلولهای نرمال عملکرد بسیار خوبی در هدایت بهوسیله مغناطیس و رهایش از طریق واکنش اکسایش- کاهش نشان داد (72).
5. کاربردهای درمانی
کاربرد نانوکامپوزیت هیدروژلها در مهندسی پزشکی شامل موارد متعددی میشود. در ادامه به بررسی دو کاربرد متداول آنها یعنی توسعه زخم پوشها و درمان سرطان می پردازیم. در این سامانهها از خاصیت حساس به تحریک خود پلیمرها نظیر خاصیت حساسیت به pH کیتوزان یا خاصیت حساس به تحریک نانوذرات جهت رهایش دارو یا فاکتور رشد استفاده شده است.
1.5. نانوکامپوزیت هیدروژلها بهعنوان زخم پوش
توسعه نانوکامپوزیت هیدروژلها در زخم پوشها با اهدافی مانند تسریع بهبود زخم، جلوگیری از عفونت با کمک رهایش طولانی مدت، تولید کلاژن و رگزایی انجام شده است. در جدول 2 برخی از نانوکامپوزیت هیدروژلهای استفاده شده به عنوان زخم پوش گردآوری شده است.
2.5. نانوکامپوزیت هیدروژلها برای درمان سرطان
درمان سرطان به کمک نانوکامپوزیت هیدروژلها یکی دیگر از کاربردهای این سامانهها میباشد. در این سامانهها، از انواع مکانیسمهای تحریک مطرح شده برای رسانش هدفمند و کنترل شده استفاده میشود. همچنین، در برخی از این سامانهها از بیش از یک مکانیسم تحریک به صورت مرحلهای استفاده میشود (81). در جدول 3 برخی از این نمونهها خلاصه شدهاند.

شکل 9: بارگذاری مولکولهای دارو در شبکههای هیدروژل و داخل نانولولههای هالویزیت (68).
جدول2: برخی از نانوکامپوزیت هیدروژلهای استفاده شده بهعنوان زخم پوش

جدول3: نمونههایی از نانوکامپوزیت هیدروژلهای استفاده شده درمان سرطان به همراه داروی مدل

نتیجهگیری
در سالهای اخیر، توسعه نانوکامپوزیت هیدروژلها با استفاده از پلیمرهای مختلف و همچنین نانوذرات گوناگون افزایش یافته است. استفاده از نانوذرات در هیدروژلها میتواند به عنوان گزینهای در راستای بهبود خواص هیدروژلها از جمله خواص فیزیکی و ساختاری، بهبود بارگذاری داروهای آبگریز مورد استفاده در درمان سرطان در ساختار هیدروژل و همچنین توسعه سیستمهای دارورسانی پاسخگو به عوامل تحریک با رهایش کنترل شده و طولانیمدت مطرح شود. استفاده از سیستمهای دارورسانی حساس به تحریک میتواند منجر به تقویت انتقال دارو به سلولهای هدف بهویژه در درمان سرطان منجر شود و اثرات منفی روشهای متداول درمان سرطان مانند شیمیدرمانی را کم کند. به بیان دیگر، انتقال هدفمند دارو به محل مورد نظر به کمک عوامل تحریک منجر به کاهش اثرات تخریبی بر بافتهای سالم شده و رهایش در مدت زمان طولانی که از بهبود خواص هیدروژل حاصل میشود نیاز به تکرار دریافت دارو توسط بیمار را کاهش میدهد. همچنین، افزودن روشهای تحریک بیولوژیکی مانند آنزیمها به این سیستمها میتواند منجر به توسعه سامانههایی با قابلیت پاسخگویی به چند عامل تحریک مختلف شود که به تولید سامانههایی هوشمندتر با قابلیت انتقال هدفمندتر میانجامد.
حامی مالی: دانشگاه تهران
تعارض در منافع: وجود ندارد.
References:
1- Mathur AM, Moorjani SK, Scranton AB. Methods for Synthesis of Hydrogel Networks: A Review. J Macromol Sci - Rev Macromol Chem Phys 1996; 36(2): 405-30.
2- Webster TJ. Safety of Nanoparticles from Manufacturing to Medical Applications. New York: Springer 2009: 131-57.
3- Memic A, Alhadrami HA, Hussain MA, Aldhahri M, Al Nowaiser F, Al-Hazmi F, et al. Hydrogels 2.0: Improved properties with Nanomaterial Composites for Biomedical Applications. Biomed Mater 2015; 11(1): 014104.
4- Qiu Y, Park K. Environment-Sensitive Hydrogels for Drug Delivery. Adv Drug Deliv Rev 2012; 64(SUPPL.): 49-60.
5- Hoare TR, Kohane DS. Hydrogels in Drug Delivery: Progress and Challenges. Polymer 2008; 49(8): 1993-2007.
6- Li J, Kuang Y, Gao Y, Du X, Shi J, Xu B. D-Amino Acids Boost the Selectivity and Confer Supramolecular Hydrogels of a Nonsteroidal Anti-Inflammatory Drug (NSAID). J Am Chem Soc 2013; 135(2): 542-5.
7- Schoenmakers RG, Van De Wetering P, Elbert DL, Hubbell JA. The Effect of the Linker on the Hydrolysis Rate of Drug-Linked Ester Bonds. J Control Release 2004; 95(2): 291-300.
8- Sutter M, Siepmann J, Hennink WE, Jiskoot W. Recombinant Gelatin Hydrogels for the Sustained Release of Proteins. J Control Release 2007; 119(3): 301-12.
9- Marchesan S, Qu Y, Waddington LJ, Easton CD, Glattauer V, Lithgow TJ, et al. Self-Assembly of Ciprofloxacin and a Tripeptide Into an Antimicrobial Nanostructured Hydrogel. Biomaterials 2013; 34(14): 3678-87.
10- Jeong SH, Fan YF, Baek JU, Song J, Choi TH, Kim SW, et al. Long-Lasting and Bioactive Hyaluronic Acid-Hydroxyapatite Composite Hydrogels for Injectable Dermal Fillers: Physical Properties and in Vivo Durability. J Biomater Appl 2016; 31(3): 464-74.
11- Merino S, Martín C, Kostarelos K, Prato M, Vázquez E. Nanocomposite Hydrogels: 3D Polymer-Nanoparticle Synergies for On-Demand Drug Delivery. ACS Nano 2015; 9(5): 4686-97.
12- Wei G, Ma PX. Structure and Properties of Nano-Hydroxyapatite/Polymer Composite Scaffolds for Bone Tissue Engineering. Biomaterials 2004; 25(19): 4749-57.
13- Schexnailder P, Schmidt G. Nanocomposite Polymer Hydrogels. Colloid Polym Sci 2009; 287(1): 1-11.
14- Motealleh A, Kehr NS. Nanocomposite Hydrogels and their Applications in Tissue Engineering. Adv Healthc Mater 2017; 6(1): 1600938.
15- Adewunmi AA, Ismail S, Sultan AS. Carbon Nanotubes (Cnts) Nanocomposite Hydrogels Developed for Various Applications: A Critical Review. J Inorg Organomet Polym Mater 2016; 26(4): 717-37.
16- Liu HW, Hu SH, Chen YW, Chen SY. Characterization and Drug Release Behavior of Highly Responsive Chip-Like Electrically Modulated Reduced Graphene Oxide-Poly(Vinyl Alcohol) Membranes. J Mater Chem 2012; 22(33): 17311-20.
17- Zhong S, Yung LYL. Enhanced Biological Stability of Collagen with Incorporation of PAMAM Dendrimer. J Biomed Mater Res - Part a 2009; 91(1): 114-22.
18- Popescu MT, Mourtas S, Pampalakis G, Antimisiaris SG, Tsitsilianis C. PH-Responsive Hydrogel/Liposome Soft Nanocomposites for Tuning Drug Release. Biomacromolecules 2011; 12(8): 3023-30.
19- Jin N, Morin EA, Henn DM, Cao Y, Woodcock JW, Tang S, et al. Agarose Hydrogels Embedded with Ph-Responsive Diblock Copolymer Micelles for Triggered Release of Substances. Biomacromolecules 2013; 14(8): 2713-23.
20- Gao G, Du G, Cheng Y, Fu J. Tough Nanocomposite Double Network Hydrogels Reinforced with Clay Nanorods Through Covalent Bonding and Reversible Chain Adsorption. J Mater Chem B 2014; 2(11): 1539-48.
21- Karataş D, Tekin A, Bahadori F, Çelik MS. Interaction of Curcumin in a Drug Delivery System Including a Composite with Poly(Lactic-: Co -Glycolic Acid) and Montmorillonite: A Density Functional Theory and Molecular Dynamics Study. J Mater Chem B 2017; 5(40): 8070-82.
22- Liang J, Chen B, Hu J, Huang Q, Zhang D, Wan J, et al. PH and Thermal Dual-Responsive Graphene Oxide Nanocomplexes for Targeted Drug Delivery and Photothermal-Chemo/Photodynamic Synergetic Therapy. ACS Appl Bio Mater 2019; 2(12): 5859-71.
23- Raie DS, Mhatre E, El-Desouki DS, Labena A, El-Ghannam G, Farahat LA, et al. Effect of Novel Quercetin Titanium Dioxide-Decorated Multi-Walled Carbon Nanotubes Nanocomposite on Bacillus Subtilis Biofilm Development. Materials (Basel) 2018; 11(1): 157.
24- Argenta DF, Santos TC, Campos AM, Caon T. Hydrogel Nanocomposite Systems: Physico-Chemical Characterization and Application for Drug-Delivery Systems. In Nanocarriers for Drug Delivery, Mohapatra SS, Ranjan S, Dasgupta N, Mishra RK, Thomas S, Eds; Elsevier: Amsterdam, The Netherlands 2019; 81-131.
25- Thoniyot P, Tan MJ, Karim AA, Young DJ, Loh XJ. Nanoparticle-Hydrogel Composites: Concept, Design, And Applications of these Promising, Multi-Functional Materials. Adv Sci 2015; 2(1-2): 1-13.
26- Burcu Oktay, Demir S, Kayaman-Apohan N. Magnetic Nanoparticle Containing Thiol-Ene Crosslinked Hydrogels for Controlled and Targeted Release of Hydrophobic Drugs. Polym Compos 2018; 39(S1): E200-209.
27- Samadi A, Haseli S, Pourmadadi M, Rashedi H, Yazdian F, Navaei-Nigjeh M. Curcumin-Loaded Chitosan-Agarose- Montmorillonite Hydrogel Nanocomposite for the Treatment of Breast Cance. In: 2020 27th National and 5th International Iranian Conference on Biomedical Engineering (ICBME) 2020: 148-53.
28- Servant A, Methven L, Williams RP, Kostarelos K. Electroresponsive Polymer-Carbon Nanotube Hydrogel Hybrids for Pulsatile Drug Delivery in Vivo. Adv Healthc Mater 2013; 2(6): 806-11.
29- Servant A, Leon V, Jasim D, Methven L, Limousin P, Fernandez-Pacheco EV, et al. Graphene-Based Electroresponsive Scaffolds Aas Polymeric Implants for On-Demand Drug Delivery. Adv Healthc Mater 2014; 3(8): 1334-43.
30- Liu TY, Hu SH, Liu TY, Liu DM, Chen SY. Magnetic-Sensitive Behavior of Intelligent Ferrogels for Controlled Release of Drug. Langmuir 2006; 22(14): 5974-8.
31- Campbell S, Maitland D, Hoare T. Enhanced Pulsatile Drug Release from Injectable Magnetic Hydrogels with Embedded Thermosensitive Microgels. ACS Macro Letters 2015; 4(3): 312-6.
32- Wu W, Shen J, Banerjee P, Zhou S. Core-Shell Hybrid Nanogels for Integration of Optical Temperature-Sensing, Targeted Tumor Cell Imaging, And Combined Chemo-Photothermal Treatment. Biomaterials 2010; 31(29): 7555-66.
33- Zhong D, Liu Z, Xie S, Zhang W, Zhang Y, Xue W. Study on Poly(D,L -Lactic) Microspheres Embedded in Calcium Alginate Hydrogel Beads as Dual Drug Delivery Systems. Journal of Applied Polymer Science 2013; 129: 767-72.
34- Liu T, Wu T, Liu H, Ke B, Huang H, Jiang Z, et al. Ultraviolet-Crosslinked Hydrogel Sustained-Release Hydrophobic Antibiotics with Long-Term Antibacterial Activity and Limited Cytotoxicity. J Appl Polym Sci 2014; 131(13): 1-8.
35- Kuang H, He H, Zhang Z, Qi Y, Xie Z, Jing X, Huang Y. Injectable and Biodegradable Supramolecular Hydrogels Formed by Nucleobase-Terminated Poly(Ethylene Oxide)S and Α-Cyclodextrin. J Mater Chem B 2021; 659-67.
36- Abandansari HS, Nabid MR, Rezaei SJT, Niknejad H. PH-Sensitive Nanogels Based on Boltorn® H40 and Poly(Vinylpyridine) Using Mini-Emulsion Polymerization for Delivery of Hydrophobic Anticancer Drugs. Polymer 2014; 55(16): 3579-90.
37- Watanabe K, Nishio Y, Makiura R, Nakahira A, Kojima C. Paclitaxel-Loaded Hydroxyapatite/Collagen Hybrid Gels as Drug Delivery Systems for Metastatic Cancer Cells. Int J Pharm 2013; 446(1-2): 81-6.
38- Gwak GH, Paek SM, Oh JM. Electrophoretic Preparation of an Organic-Inorganic Hybrid of Layered Metal Hydroxide and Hydrogel for a Potential Drug-Delivery System. Eur J Inorg Chem 2012; 2012(32): 5269-75.
39- Huang Y, Zheng Y, Song W, Ma Y, Wu J, Fan L. Poly(Vinyl Pyrrolidone) Wrapped Multi-Walled Carbon Nanotube/Poly (Vinyl Alcohol) Composite Hydrogels. Compos Part a Appl Sci Manuf 2011; 42(10): 1398-405. Available From: Http:// Dx.Doi.Org/10.1016/J.Compositesa.2011.06.003
40- Su S, Wang H, Liu X, Wu Y, Nie G. IRGD-Coupled Responsive Fluorescent Nanogel for Targeted Drug Delivery. Biomaterials 2013; 34(13): 3523-33.
41- Sershen SR, Westcott SL, Halas NJ, West JL. Independent Optically Addressable Nanoparticle-Polymer Optomechanical Composites. Appl Phys Lett 2002; 80(24): 4609-11.
42- Ravi N, Aliyar HA, Hamilton PD. Hydrogel Nanocomposite as a Synthetic Intra-Ocular Lens Capable of Accommodation. Macromolecular Symposia 2005; 227: 191-202.
43- Liu M, Ishida Y, Ebina Y, Sasaki T, Aida T. Photolatently Modulable Hydrogels Using Unilamellar Titania Nanosheets as Photocatalytic Crosslinkers. Nat Commun 2013; 4: 1-7.
44- Jahanizadeh S, Yazdian F, Marjani A, Omidi M, Rashedi H. Curcumin-Loaded Chitosan/ Carboxymethyl Starch/ Montmorillonite Bio-Nanocomposite for Reduction of Dental Bacterial Biofilm Formation. Int J Biol Macromol 2017; 105: 757-63.
45- Zavareh HS, Pourmadadi M, Moradi A, Yazdian F, Omidi M. Chitosan/Carbon Quantum Dot/Aptamer Complex as a Potential Anticancer Drug Delivery System Towards the Release of 5-Fluorouracil. Int J Biol Macromol 2020; 165: 1422-30.
46- Wang C, Flynn NT, Langer R. Controlled Structure and Properties of Thermoresponsive Nanoparticle-Hydrogel Composites. Adv Mater 2004; 16(13): 1074-9.
47- Souza GR, Christianson DR, Staquicini FI, Ozawa MG, Snyder EY, Sidman RL, et al. Networks of Gold Nanoparticles and Bacteriophage as Biological Sensors and Cell-Targetting Agents. Proc Natl Acad Sci USA 2006; 103(5): 1215-20.
48- Castaneda L, Valle J, Yang N, Pluskat S, Slowinska K. Collagen Cross-Linking with Au Nanoparticles. Biomacromolecules 2008; 9(12): 3383-8.
49- Zhang D, Yang J, Bao S, Wu Q, Wang Q. Semiconductor Nanoparticle-Based Hydrogels Prepared Via Self-Initiated Polymerization Under Sunlight, Even Visible Light. Sci Rep 2013; 3: 1-7.
50- Wu H, Yu G, Pan L, Liu N, Mcdowell MT, Bao Z, et al. Stable Li-Ion Battery Anodes by In-Situ Polymerization of Conducting Hydrogel to Conformally Coat Silicon Nanoparticles. Nat Commun 2013; 4: 1-6.
51- Almeida H, Amaral MH, Lobão P. Temperature and Ph Stimuli-Responsive Polymers and their Applications in Controlled and Selfregulated Drug Delivery. J Appl Pharm Sci 2012; 2(6): 1-10.
52- Chen YY, Wu HC, Sun JS, Dong GC, Wang TW. Injectable and Thermoresponsive Self-Assembled Nanocomposite Hydrogel for Long-Term Anticancer Drug Delivery. Langmuir 2013; 29(11): 3721-9.
53- Tian BS, Yang C. Thermo-Sensitive Poly(N-Isoproasepylacrylamide)/Mesoporous Silica Nanocomposites as Controlled Delivery Carriers: Loading and Rele Behaviors for Drug Ibuprofen. J Nanosci Nanotechnol 2011; 11(3): 1871-9.
54- Ying X, Wang Y, Liang J, Yue J, Xu C, Lu L, et al. Angiopep-Conjugated Electro-Responsive Hydrogel Nanoparticles: Therapeutic Potential for Epilepsy. Angewandte Chemie - International Edition 2014; 126(46): 12436-40.
55- Servant A, Bussy C, Al-Jamal K, Kostarelos K. Design, Engineering and Structural Integrity of Electro-Responsive Carbon Nanotube-Based Hydrogels for Pulsatile Drug Release. J Mater Chem B 2013; 36: 4593-600.
56- Pérez-Martínez CJ, Morales Chávez SD, Del Castillo-Castro T, Lara Ceniceros TE, Castillo-Ortega MM, Rodríguez-Félix DE, et al. Electroconductive Nanocomposite Hydrogel for Pulsatile Drug Release. React Funct Polym 2016; 100: 12-7.
57- Mishra RK, Tiwari SK, Mohapatra S, Thomas S. Efficient Nanocarriers for Drug-Delivery Systems. Nanocarriers for Drug Delivery. Elsevier Inc 2019; 1-41.
58- Meenach SA, Shapiro JM, Hilt JZ, Anderson KW. Characterization of PEG-Iron Oxide Hydrogel Nanocomposites for Dual Hyperthermia and Paclitaxel Delivery. J Biomater Sci Polym Ed 2013; 24(9): 1112-26.
59- Wang B, Zheng H, Chang MW, Ahmad Z, Li JS. Hollow Polycaprolactone Composite Fibers for Controlled Magnetic Responsive Antifungal Drug Release. Colloids Surfaces B Biointerfaces 2016; 145: 757-67.
60- Ji W, Wu Q, Han X, Zhang W, Wei W, Chen L, et al. Photosensitive Hydrogels: From Structure, Mechanisms, Design to Bioapplications. Sci China Life Sci 2020; 63(12): 1813-28.
61- Li YS, Han Y, Qin JT, Song ZY, Cai HH, Du JF, et al. Photosensitive Antibacterial and Cytotoxicity Performances of a Tio2/Carboxymethyl Chitosan/Poly(Vinyl Alcohol) Nanocomposite Hydrogel by in Situ Radiation Construction. J Appl Polym Sci 2016; 133(44): 1-10.
62- Yan B, Boyer JC, Habault D, Branda NR, Zhao Y. Near Infrared Light Triggered Release of Biomacromolecules from Hydrogels Loaded with Upconversion Nanoparticles. J Am Chem Soc 2012; 134(40): 16558-61.
63- Lin M, Zhao Y, Wang SQ, Liu M, Duan ZF, Chen YM, et al. Recent Advances in Synthesis and Surface Modification of Lanthanide-Doped Upconversion Nanoparticles for Biomedical Applications. Biotechnol Adv 2012; 30(6): 1551-61.
64- Cheng Z, Chai R, Ma P, Dai Y, Kang X, Lian H, et al. Multiwalled Carbon Nanotubes and Nayf4:Yb3+/Er 3+ Nanoparticle-Doped Bilayer Hydrogel for Concurrent NIR-Triggered Drug Release and Up-Conversion Luminescence Tagging. Langmuir 2013; 29(30): 9573-80.
65- Zhang H, Zhu X, Ji Y, Jiao X, Chen Q, Hou L, et al. Near-Infrared-Triggered in Situ Hybrid Hydrogel System for Synergistic Cancer Therapy. J Mater Chem B 2015; 3(30): 6310-26.
66- Siddiqui FA, Prakasam G, Chattopadhyay S, Rehman AU, Padder RA, Ansari MA, et al. Curcumin Decreases Warburg Effect in Cancer Cells by Down-Regulating Pyruvate Kinase M2 Via Mtor-HIF1α Inhibition. Sci Rep 2018; 8(1): 2-10.
67- Rasoulzadeh M, Namazi H. Carboxymethyl Cellulose/Graphene Oxide Bio-Nanocomposite Hydrogel Beads as Anticancer Drug Carrier Agent. Carbohydr Polym. 2017; 168: 320-6.
68- Rao KM, Nagappan S, Seo DJ, Ha CS. PH Sensitive Halloysite-Sodium Hyaluronate/Poly(Hydroxyethyl Methacrylate) Nanocomposites for Colon Cancer Drug Delivery. Appl Clay Sci 2014; 97-8: 33-42.
69- Huang WC, Lee TJ, Hsiao CS, Chen SY LD. Characterization and Drug Release Behavior of Chip-Like Amphiphilic Chitosan-Silica Hybrid Hydrogel for Electrically Modulated Release of Ethosuximide: An in Vitro Study. J Mater Chem 2011; 21(40): 6077-85.
70- Segovia N, Pont M, Oliva N, Ramos V, Borrós S AN. Hydrogel Doped with Nanoparticles for Local Sustained Release of Sirna in Breast Cancer. Adv Healthc Mater 2015; 4(2): 271-80.
71- Croy SR, Know G. Polymeric Micelles for Drug Delivery. Curr Pharm Des 2006; 12(36):4669-84.
72- Gao F, Wu X, Wu D, Yu J, Yao J, Qi Q, et al. Preparation of Degradable Magnetic Temperature- and Redox-Responsive Polymeric/Fe3O4 Nanocomposite Nanogels in Inverse Miniemulsions for Loading and Release of 5-Fluorouracil. Colloids Surfaces a Physicochem. Engineering Aspects 2020; 587: 124363.
73- Wu TH, Lin HR, Shen LH, Li JH. Wound Healing Based on PU/Hydrogel Nanocompounds Containing FGF-2 and Releated Dressings by Radiation Method. Adv Mater Res 2009; 79-82: 437-40.
74- Li X, Chen S, Zhang B, Li M, Diao K, Zhang Z, et al. In Situ Injectable Nano-Composite Hydrogel Composed of Curcumin, N,O-Carboxymethyl Chitosan and Oxidized Alginate for Wound Healing Application. Int J Pharm 2012; 437(1-2): 110-9.
75- Mohandas A, Anisha BS, Chennazhi KP, Jayakumar R. Chitosan-Hyaluronic Acid/VEGF Loaded Fibrin Nanoparticles Composite Sponges for Enhancing Angiogenesis in Wounds. Colloids Surfaces B Biointerfaces 2015; 127: 105-13.
76- Alvarez GS, Hélary C, Mebert AM, Wang X, Coradin T, Desimone MF. Antibiotic-Loaded Silica Nanoparticle-Collagen Composite Hydrogels with Prolonged Antimicrobial Activity for Wound Infection Prevention. J Mater Chem B 2014; 2(29): 4660-70.
77- Petkova P, Francesko A, Tzanov T. Enzyme-Assisted Formation of Hybrid Biopolymer Hydrogels Incorporating Active Phenolic Nanospheres. Eng Life Sci 2015; 15(4): 416-24.
78- Rakhshaei R, Namazi H. A Potential Bioactive Wound Dressing Based on Carboxymethyl Cellulose/Zno Impregnated MCM-41 Nanocomposite Hydrogel. Mater Sci Eng C 2017; 73: 456-64.
79- Yang C, Xue R, Zhang Q, Yang S, Liu P, Chen L, et al. Nanoclay Cross-Linked Semi-IPN Silk Sericin/Poly(Nipam/LMSH) Nanocomposite Hydrogel: An Outstanding Antibacterial Wound Dressing. Mater Sci Eng C 2017; 81: 303-13.
80- He J, Shi M, Liang Y, Guo B. Conductive Adhesive Self-Healing Nanocomposite Hydrogel Wound Dressing for Photothermal Therapy of Infected Full-Thickness Skin Wounds. Chem Eng J 2020; 394: 124888.
81- Zhou J, Wang M, Han Y, Lai J, Chen J. Multistage-Targeted Gold/Mesoporous Silica Nanocomposite Hydrogel as in Situ Injectable Drug Release System for Chemophotothermal Synergistic Cancer Therapy. ACS Appl Bio Mater 2020; 3(1): 421-31.
82- Akbarzadeh A, Samiei M, Joo SW, Anzaby M, Hanifehpour Y, Synthesis. Characterization and in Vitro Studies of Doxorubicin-Loaded Magnetic Nanoparticles Grafted to Smart Copolymers on A549 Lung Cancer Cell Line. J Nanobiotechnology 2012; 10: 1-13.
83- Meenach SA, Otu CG, Anderson KW, Hilt JZ. Controlled Synergistic Delivery of Paclitaxel and Heat from Poly(Β-Amino Ester)/Iron Oxide-Based Hydrogel Nanocomposites. Int J Pharm 2012; 427(2): 177-84.
84- Asasutjarit R, Thanasanchokpibull S, Fuongfuchat A, Veeranondha S. Optimization And Evaluation of Thermoresponsive Diclofenac Sodium Ophthalmic in Situ Gels. Int J Pharm 2011; 411(1-2): 128-35.
85- Strong LE, Dahotre SN, West JL. Hydrogel-Nanoparticle Composites for Optically Modulated Cancer Therapeutic Delivery. J Control Release 2014; 178(1): 63-8.
86- Zhang N, Xu X, Zhang X, Qu D, Xue L, Mo R, et al. Nanocomposite Hydrogel Incorporating Gold Nanorods and Paclitaxel-Loaded Chitosan Micelles for Combination Photothermal-Chemotherapy. Int J Pharm 2016; 497(1-2): 210-21
87- Salimi F, Dilmaghani KA, Alizadeh E, Akbarzadeh A, Davaran S. Enhancing Cisplatin Delivery to Hepatocellular Carcinoma Hepg2 Cells Using Dual Sensitive Smart Nanocomposite. Artif Cells, Nanomedicine Biotechnol 2018; 46(5): 949-58.
88- Xu X, Huang Z, Huang Z, Zhang X, He S, Sun X, et al. Injectable, NIR/Ph-Responsive Nanocomposite Hydrogel as Long-Acting Implant for Chemophotothermal Synergistic Cancer Therapy. ACS Appl Mater Interfaces 2017; 9(24): 20361-75.
89- Samadi A, Pourmadadi M, Yazdian F, Rashedi H, Navaei-Nigjeh M, Eufrasio-Da-Silva T. Ameliorating Quercetin Constraints in Cancer Therapy with Ph-Responsive Agarose-Polyvinylpyrrolidone -Hydroxyapatite Nanocomposite Encapsulated in Double Nanoemulsion. Int J Biol Macromol 2021; 182: 11-25
90- Kazemi S, Pourmadadi M, Yazdian F, Ghadami A. The Synthesis and Characterization of Targeted Delivery Curcumin Using Chitosan-Magnetite-Reduced Graphene Oxide as Nano-Carrier. Int J Biol Macromol 2021; 186: 554-62.
91- Nematollahi E, Pourmadadi M, Yazdian F, Fatoorehchi H, Rashedi H, Nigjeh MN. Synthesis and Characterization of Chitosan/Polyvinylpyrrolidone Coated Nanoporous Γ-Alumina as a Ph-Sensitive Carrier for Controlled Release of Quercetin. Int J Biol Macromol 2021; 183: 600-13.
92- Gerami SE, Pourmadadi M, Fatoorehchi H, Yazdian F, Rashedi H, Nigjeh MN. Preparation of pH-Sensitive Chitosan/Polyvinylpyrrolidone/Α-Fe2O3 Nanocomposite for Drug Delivery Application: Emphasis on Ameliorating Restrictions. Int J Biol Macromol 2021; 173: 409-20.
1- Mathur AM, Moorjani SK, Scranton AB. Methods for Synthesis of Hydrogel Networks: A Review. J Macromol Sci - Rev Macromol Chem Phys 1996; 36(2): 405-30.
2- Webster TJ. Safety of Nanoparticles from Manufacturing to Medical Applications. New York: Springer 2009: 131-57.
3- Memic A, Alhadrami HA, Hussain MA, Aldhahri M, Al Nowaiser F, Al-Hazmi F, et al. Hydrogels 2.0: Improved properties with Nanomaterial Composites for Biomedical Applications. Biomed Mater 2015; 11(1): 014104.
4- Qiu Y, Park K. Environment-Sensitive Hydrogels for Drug Delivery. Adv Drug Deliv Rev 2012; 64(SUPPL.): 49-60.
5- Hoare TR, Kohane DS. Hydrogels in Drug Delivery: Progress and Challenges. Polymer 2008; 49(8): 1993-2007.
6- Li J, Kuang Y, Gao Y, Du X, Shi J, Xu B. D-Amino Acids Boost the Selectivity and Confer Supramolecular Hydrogels of a Nonsteroidal Anti-Inflammatory Drug (NSAID). J Am Chem Soc 2013; 135(2): 542-5.
7- Schoenmakers RG, Van De Wetering P, Elbert DL, Hubbell JA. The Effect of the Linker on the Hydrolysis Rate of Drug-Linked Ester Bonds. J Control Release 2004; 95(2): 291-300.
8- Sutter M, Siepmann J, Hennink WE, Jiskoot W. Recombinant Gelatin Hydrogels for the Sustained Release of Proteins. J Control Release 2007; 119(3): 301-12.
9- Marchesan S, Qu Y, Waddington LJ, Easton CD, Glattauer V, Lithgow TJ, et al. Self-Assembly of Ciprofloxacin and a Tripeptide Into an Antimicrobial Nanostructured Hydrogel. Biomaterials 2013; 34(14): 3678-87.
10- Jeong SH, Fan YF, Baek JU, Song J, Choi TH, Kim SW, et al. Long-Lasting and Bioactive Hyaluronic Acid-Hydroxyapatite Composite Hydrogels for Injectable Dermal Fillers: Physical Properties and in Vivo Durability. J Biomater Appl 2016; 31(3): 464-74.
11- Merino S, Martín C, Kostarelos K, Prato M, Vázquez E. Nanocomposite Hydrogels: 3D Polymer-Nanoparticle Synergies for On-Demand Drug Delivery. ACS Nano 2015; 9(5): 4686-97.
12- Wei G, Ma PX. Structure and Properties of Nano-Hydroxyapatite/Polymer Composite Scaffolds for Bone Tissue Engineering. Biomaterials 2004; 25(19): 4749-57.
13- Schexnailder P, Schmidt G. Nanocomposite Polymer Hydrogels. Colloid Polym Sci 2009; 287(1): 1-11.
14- Motealleh A, Kehr NS. Nanocomposite Hydrogels and their Applications in Tissue Engineering. Adv Healthc Mater 2017; 6(1): 1600938.
15- Adewunmi AA, Ismail S, Sultan AS. Carbon Nanotubes (Cnts) Nanocomposite Hydrogels Developed for Various Applications: A Critical Review. J Inorg Organomet Polym Mater 2016; 26(4): 717-37.
16- Liu HW, Hu SH, Chen YW, Chen SY. Characterization and Drug Release Behavior of Highly Responsive Chip-Like Electrically Modulated Reduced Graphene Oxide-Poly(Vinyl Alcohol) Membranes. J Mater Chem 2012; 22(33): 17311-20.
17- Zhong S, Yung LYL. Enhanced Biological Stability of Collagen with Incorporation of PAMAM Dendrimer. J Biomed Mater Res - Part a 2009; 91(1): 114-22.
18- Popescu MT, Mourtas S, Pampalakis G, Antimisiaris SG, Tsitsilianis C. PH-Responsive Hydrogel/Liposome Soft Nanocomposites for Tuning Drug Release. Biomacromolecules 2011; 12(8): 3023-30.
19- Jin N, Morin EA, Henn DM, Cao Y, Woodcock JW, Tang S, et al. Agarose Hydrogels Embedded with Ph-Responsive Diblock Copolymer Micelles for Triggered Release of Substances. Biomacromolecules 2013; 14(8): 2713-23.
20- Gao G, Du G, Cheng Y, Fu J. Tough Nanocomposite Double Network Hydrogels Reinforced with Clay Nanorods Through Covalent Bonding and Reversible Chain Adsorption. J Mater Chem B 2014; 2(11): 1539-48.
21- Karataş D, Tekin A, Bahadori F, Çelik MS. Interaction of Curcumin in a Drug Delivery System Including a Composite with Poly(Lactic-: Co -Glycolic Acid) and Montmorillonite: A Density Functional Theory and Molecular Dynamics Study. J Mater Chem B 2017; 5(40): 8070-82.
22- Liang J, Chen B, Hu J, Huang Q, Zhang D, Wan J, et al. PH and Thermal Dual-Responsive Graphene Oxide Nanocomplexes for Targeted Drug Delivery and Photothermal-Chemo/Photodynamic Synergetic Therapy. ACS Appl Bio Mater 2019; 2(12): 5859-71.
23- Raie DS, Mhatre E, El-Desouki DS, Labena A, El-Ghannam G, Farahat LA, et al. Effect of Novel Quercetin Titanium Dioxide-Decorated Multi-Walled Carbon Nanotubes Nanocomposite on Bacillus Subtilis Biofilm Development. Materials (Basel) 2018; 11(1): 157.
24- Argenta DF, Santos TC, Campos AM, Caon T. Hydrogel Nanocomposite Systems: Physico-Chemical Characterization and Application for Drug-Delivery Systems. In Nanocarriers for Drug Delivery, Mohapatra SS, Ranjan S, Dasgupta N, Mishra RK, Thomas S, Eds; Elsevier: Amsterdam, The Netherlands 2019; 81-131.
25- Thoniyot P, Tan MJ, Karim AA, Young DJ, Loh XJ. Nanoparticle-Hydrogel Composites: Concept, Design, And Applications of these Promising, Multi-Functional Materials. Adv Sci 2015; 2(1-2): 1-13.
26- Burcu Oktay, Demir S, Kayaman-Apohan N. Magnetic Nanoparticle Containing Thiol-Ene Crosslinked Hydrogels for Controlled and Targeted Release of Hydrophobic Drugs. Polym Compos 2018; 39(S1): E200-209.
27- Samadi A, Haseli S, Pourmadadi M, Rashedi H, Yazdian F, Navaei-Nigjeh M. Curcumin-Loaded Chitosan-Agarose- Montmorillonite Hydrogel Nanocomposite for the Treatment of Breast Cance. In: 2020 27th National and 5th International Iranian Conference on Biomedical Engineering (ICBME) 2020: 148-53.
28- Servant A, Methven L, Williams RP, Kostarelos K. Electroresponsive Polymer-Carbon Nanotube Hydrogel Hybrids for Pulsatile Drug Delivery in Vivo. Adv Healthc Mater 2013; 2(6): 806-11.
29- Servant A, Leon V, Jasim D, Methven L, Limousin P, Fernandez-Pacheco EV, et al. Graphene-Based Electroresponsive Scaffolds Aas Polymeric Implants for On-Demand Drug Delivery. Adv Healthc Mater 2014; 3(8): 1334-43.
30- Liu TY, Hu SH, Liu TY, Liu DM, Chen SY. Magnetic-Sensitive Behavior of Intelligent Ferrogels for Controlled Release of Drug. Langmuir 2006; 22(14): 5974-8.
31- Campbell S, Maitland D, Hoare T. Enhanced Pulsatile Drug Release from Injectable Magnetic Hydrogels with Embedded Thermosensitive Microgels. ACS Macro Letters 2015; 4(3): 312-6.
32- Wu W, Shen J, Banerjee P, Zhou S. Core-Shell Hybrid Nanogels for Integration of Optical Temperature-Sensing, Targeted Tumor Cell Imaging, And Combined Chemo-Photothermal Treatment. Biomaterials 2010; 31(29): 7555-66.
33- Zhong D, Liu Z, Xie S, Zhang W, Zhang Y, Xue W. Study on Poly(D,L -Lactic) Microspheres Embedded in Calcium Alginate Hydrogel Beads as Dual Drug Delivery Systems. Journal of Applied Polymer Science 2013; 129: 767-72.
34- Liu T, Wu T, Liu H, Ke B, Huang H, Jiang Z, et al. Ultraviolet-Crosslinked Hydrogel Sustained-Release Hydrophobic Antibiotics with Long-Term Antibacterial Activity and Limited Cytotoxicity. J Appl Polym Sci 2014; 131(13): 1-8.
35- Kuang H, He H, Zhang Z, Qi Y, Xie Z, Jing X, Huang Y. Injectable and Biodegradable Supramolecular Hydrogels Formed by Nucleobase-Terminated Poly(Ethylene Oxide)S and Α-Cyclodextrin. J Mater Chem B 2021; 659-67.
36- Abandansari HS, Nabid MR, Rezaei SJT, Niknejad H. PH-Sensitive Nanogels Based on Boltorn® H40 and Poly(Vinylpyridine) Using Mini-Emulsion Polymerization for Delivery of Hydrophobic Anticancer Drugs. Polymer 2014; 55(16): 3579-90.
37- Watanabe K, Nishio Y, Makiura R, Nakahira A, Kojima C. Paclitaxel-Loaded Hydroxyapatite/Collagen Hybrid Gels as Drug Delivery Systems for Metastatic Cancer Cells. Int J Pharm 2013; 446(1-2): 81-6.
38- Gwak GH, Paek SM, Oh JM. Electrophoretic Preparation of an Organic-Inorganic Hybrid of Layered Metal Hydroxide and Hydrogel for a Potential Drug-Delivery System. Eur J Inorg Chem 2012; 2012(32): 5269-75.
39- Huang Y, Zheng Y, Song W, Ma Y, Wu J, Fan L. Poly(Vinyl Pyrrolidone) Wrapped Multi-Walled Carbon Nanotube/Poly (Vinyl Alcohol) Composite Hydrogels. Compos Part a Appl Sci Manuf 2011; 42(10): 1398-405. Available From: Http:// Dx.Doi.Org/10.1016/J.Compositesa.2011.06.003
40- Su S, Wang H, Liu X, Wu Y, Nie G. IRGD-Coupled Responsive Fluorescent Nanogel for Targeted Drug Delivery. Biomaterials 2013; 34(13): 3523-33.
41- Sershen SR, Westcott SL, Halas NJ, West JL. Independent Optically Addressable Nanoparticle-Polymer Optomechanical Composites. Appl Phys Lett 2002; 80(24): 4609-11.
42- Ravi N, Aliyar HA, Hamilton PD. Hydrogel Nanocomposite as a Synthetic Intra-Ocular Lens Capable of Accommodation. Macromolecular Symposia 2005; 227: 191-202.
43- Liu M, Ishida Y, Ebina Y, Sasaki T, Aida T. Photolatently Modulable Hydrogels Using Unilamellar Titania Nanosheets as Photocatalytic Crosslinkers. Nat Commun 2013; 4: 1-7.
44- Jahanizadeh S, Yazdian F, Marjani A, Omidi M, Rashedi H. Curcumin-Loaded Chitosan/ Carboxymethyl Starch/ Montmorillonite Bio-Nanocomposite for Reduction of Dental Bacterial Biofilm Formation. Int J Biol Macromol 2017; 105: 757-63.
45- Zavareh HS, Pourmadadi M, Moradi A, Yazdian F, Omidi M. Chitosan/Carbon Quantum Dot/Aptamer Complex as a Potential Anticancer Drug Delivery System Towards the Release of 5-Fluorouracil. Int J Biol Macromol 2020; 165: 1422-30.
46- Wang C, Flynn NT, Langer R. Controlled Structure and Properties of Thermoresponsive Nanoparticle-Hydrogel Composites. Adv Mater 2004; 16(13): 1074-9.
47- Souza GR, Christianson DR, Staquicini FI, Ozawa MG, Snyder EY, Sidman RL, et al. Networks of Gold Nanoparticles and Bacteriophage as Biological Sensors and Cell-Targetting Agents. Proc Natl Acad Sci USA 2006; 103(5): 1215-20.
48- Castaneda L, Valle J, Yang N, Pluskat S, Slowinska K. Collagen Cross-Linking with Au Nanoparticles. Biomacromolecules 2008; 9(12): 3383-8.
49- Zhang D, Yang J, Bao S, Wu Q, Wang Q. Semiconductor Nanoparticle-Based Hydrogels Prepared Via Self-Initiated Polymerization Under Sunlight, Even Visible Light. Sci Rep 2013; 3: 1-7.
50- Wu H, Yu G, Pan L, Liu N, Mcdowell MT, Bao Z, et al. Stable Li-Ion Battery Anodes by In-Situ Polymerization of Conducting Hydrogel to Conformally Coat Silicon Nanoparticles. Nat Commun 2013; 4: 1-6.
51- Almeida H, Amaral MH, Lobão P. Temperature and Ph Stimuli-Responsive Polymers and their Applications in Controlled and Selfregulated Drug Delivery. J Appl Pharm Sci 2012; 2(6): 1-10.
52- Chen YY, Wu HC, Sun JS, Dong GC, Wang TW. Injectable and Thermoresponsive Self-Assembled Nanocomposite Hydrogel for Long-Term Anticancer Drug Delivery. Langmuir 2013; 29(11): 3721-9.
53- Tian BS, Yang C. Thermo-Sensitive Poly(N-Isoproasepylacrylamide)/Mesoporous Silica Nanocomposites as Controlled Delivery Carriers: Loading and Rele Behaviors for Drug Ibuprofen. J Nanosci Nanotechnol 2011; 11(3): 1871-9.
54- Ying X, Wang Y, Liang J, Yue J, Xu C, Lu L, et al. Angiopep-Conjugated Electro-Responsive Hydrogel Nanoparticles: Therapeutic Potential for Epilepsy. Angewandte Chemie - International Edition 2014; 126(46): 12436-40.
55- Servant A, Bussy C, Al-Jamal K, Kostarelos K. Design, Engineering and Structural Integrity of Electro-Responsive Carbon Nanotube-Based Hydrogels for Pulsatile Drug Release. J Mater Chem B 2013; 36: 4593-600.
56- Pérez-Martínez CJ, Morales Chávez SD, Del Castillo-Castro T, Lara Ceniceros TE, Castillo-Ortega MM, Rodríguez-Félix DE, et al. Electroconductive Nanocomposite Hydrogel for Pulsatile Drug Release. React Funct Polym 2016; 100: 12-7.
57- Mishra RK, Tiwari SK, Mohapatra S, Thomas S. Efficient Nanocarriers for Drug-Delivery Systems. Nanocarriers for Drug Delivery. Elsevier Inc 2019; 1-41.
58- Meenach SA, Shapiro JM, Hilt JZ, Anderson KW. Characterization of PEG-Iron Oxide Hydrogel Nanocomposites for Dual Hyperthermia and Paclitaxel Delivery. J Biomater Sci Polym Ed 2013; 24(9): 1112-26.
59- Wang B, Zheng H, Chang MW, Ahmad Z, Li JS. Hollow Polycaprolactone Composite Fibers for Controlled Magnetic Responsive Antifungal Drug Release. Colloids Surfaces B Biointerfaces 2016; 145: 757-67.
60- Ji W, Wu Q, Han X, Zhang W, Wei W, Chen L, et al. Photosensitive Hydrogels: From Structure, Mechanisms, Design to Bioapplications. Sci China Life Sci 2020; 63(12): 1813-28.
61- Li YS, Han Y, Qin JT, Song ZY, Cai HH, Du JF, et al. Photosensitive Antibacterial and Cytotoxicity Performances of a Tio2/Carboxymethyl Chitosan/Poly(Vinyl Alcohol) Nanocomposite Hydrogel by in Situ Radiation Construction. J Appl Polym Sci 2016; 133(44): 1-10.
62- Yan B, Boyer JC, Habault D, Branda NR, Zhao Y. Near Infrared Light Triggered Release of Biomacromolecules from Hydrogels Loaded with Upconversion Nanoparticles. J Am Chem Soc 2012; 134(40): 16558-61.
63- Lin M, Zhao Y, Wang SQ, Liu M, Duan ZF, Chen YM, et al. Recent Advances in Synthesis and Surface Modification of Lanthanide-Doped Upconversion Nanoparticles for Biomedical Applications. Biotechnol Adv 2012; 30(6): 1551-61.
64- Cheng Z, Chai R, Ma P, Dai Y, Kang X, Lian H, et al. Multiwalled Carbon Nanotubes and Nayf4:Yb3+/Er 3+ Nanoparticle-Doped Bilayer Hydrogel for Concurrent NIR-Triggered Drug Release and Up-Conversion Luminescence Tagging. Langmuir 2013; 29(30): 9573-80.
65- Zhang H, Zhu X, Ji Y, Jiao X, Chen Q, Hou L, et al. Near-Infrared-Triggered in Situ Hybrid Hydrogel System for Synergistic Cancer Therapy. J Mater Chem B 2015; 3(30): 6310-26.
66- Siddiqui FA, Prakasam G, Chattopadhyay S, Rehman AU, Padder RA, Ansari MA, et al. Curcumin Decreases Warburg Effect in Cancer Cells by Down-Regulating Pyruvate Kinase M2 Via Mtor-HIF1α Inhibition. Sci Rep 2018; 8(1): 2-10.
67- Rasoulzadeh M, Namazi H. Carboxymethyl Cellulose/Graphene Oxide Bio-Nanocomposite Hydrogel Beads as Anticancer Drug Carrier Agent. Carbohydr Polym. 2017; 168: 320-6.
68- Rao KM, Nagappan S, Seo DJ, Ha CS. PH Sensitive Halloysite-Sodium Hyaluronate/Poly(Hydroxyethyl Methacrylate) Nanocomposites for Colon Cancer Drug Delivery. Appl Clay Sci 2014; 97-8: 33-42.
69- Huang WC, Lee TJ, Hsiao CS, Chen SY LD. Characterization and Drug Release Behavior of Chip-Like Amphiphilic Chitosan-Silica Hybrid Hydrogel for Electrically Modulated Release of Ethosuximide: An in Vitro Study. J Mater Chem 2011; 21(40): 6077-85.
70- Segovia N, Pont M, Oliva N, Ramos V, Borrós S AN. Hydrogel Doped with Nanoparticles for Local Sustained Release of Sirna in Breast Cancer. Adv Healthc Mater 2015; 4(2): 271-80.
71- Croy SR, Know G. Polymeric Micelles for Drug Delivery. Curr Pharm Des 2006; 12(36):4669-84.
72- Gao F, Wu X, Wu D, Yu J, Yao J, Qi Q, et al. Preparation of Degradable Magnetic Temperature- and Redox-Responsive Polymeric/Fe3O4 Nanocomposite Nanogels in Inverse Miniemulsions for Loading and Release of 5-Fluorouracil. Colloids Surfaces a Physicochem. Engineering Aspects 2020; 587: 124363.
73- Wu TH, Lin HR, Shen LH, Li JH. Wound Healing Based on PU/Hydrogel Nanocompounds Containing FGF-2 and Releated Dressings by Radiation Method. Adv Mater Res 2009; 79-82: 437-40.
74- Li X, Chen S, Zhang B, Li M, Diao K, Zhang Z, et al. In Situ Injectable Nano-Composite Hydrogel Composed of Curcumin, N,O-Carboxymethyl Chitosan and Oxidized Alginate for Wound Healing Application. Int J Pharm 2012; 437(1-2): 110-9.
75- Mohandas A, Anisha BS, Chennazhi KP, Jayakumar R. Chitosan-Hyaluronic Acid/VEGF Loaded Fibrin Nanoparticles Composite Sponges for Enhancing Angiogenesis in Wounds. Colloids Surfaces B Biointerfaces 2015; 127: 105-13.
76- Alvarez GS, Hélary C, Mebert AM, Wang X, Coradin T, Desimone MF. Antibiotic-Loaded Silica Nanoparticle-Collagen Composite Hydrogels with Prolonged Antimicrobial Activity for Wound Infection Prevention. J Mater Chem B 2014; 2(29): 4660-70.
77- Petkova P, Francesko A, Tzanov T. Enzyme-Assisted Formation of Hybrid Biopolymer Hydrogels Incorporating Active Phenolic Nanospheres. Eng Life Sci 2015; 15(4): 416-24.
78- Rakhshaei R, Namazi H. A Potential Bioactive Wound Dressing Based on Carboxymethyl Cellulose/Zno Impregnated MCM-41 Nanocomposite Hydrogel. Mater Sci Eng C 2017; 73: 456-64.
79- Yang C, Xue R, Zhang Q, Yang S, Liu P, Chen L, et al. Nanoclay Cross-Linked Semi-IPN Silk Sericin/Poly(Nipam/LMSH) Nanocomposite Hydrogel: An Outstanding Antibacterial Wound Dressing. Mater Sci Eng C 2017; 81: 303-13.
80- He J, Shi M, Liang Y, Guo B. Conductive Adhesive Self-Healing Nanocomposite Hydrogel Wound Dressing for Photothermal Therapy of Infected Full-Thickness Skin Wounds. Chem Eng J 2020; 394: 124888.
81- Zhou J, Wang M, Han Y, Lai J, Chen J. Multistage-Targeted Gold/Mesoporous Silica Nanocomposite Hydrogel as in Situ Injectable Drug Release System for Chemophotothermal Synergistic Cancer Therapy. ACS Appl Bio Mater 2020; 3(1): 421-31.
82- Akbarzadeh A, Samiei M, Joo SW, Anzaby M, Hanifehpour Y, Synthesis. Characterization and in Vitro Studies of Doxorubicin-Loaded Magnetic Nanoparticles Grafted to Smart Copolymers on A549 Lung Cancer Cell Line. J Nanobiotechnology 2012; 10: 1-13.
83- Meenach SA, Otu CG, Anderson KW, Hilt JZ. Controlled Synergistic Delivery of Paclitaxel and Heat from Poly(Β-Amino Ester)/Iron Oxide-Based Hydrogel Nanocomposites. Int J Pharm 2012; 427(2): 177-84.
84- Asasutjarit R, Thanasanchokpibull S, Fuongfuchat A, Veeranondha S. Optimization And Evaluation of Thermoresponsive Diclofenac Sodium Ophthalmic in Situ Gels. Int J Pharm 2011; 411(1-2): 128-35.
85- Strong LE, Dahotre SN, West JL. Hydrogel-Nanoparticle Composites for Optically Modulated Cancer Therapeutic Delivery. J Control Release 2014; 178(1): 63-8.
86- Zhang N, Xu X, Zhang X, Qu D, Xue L, Mo R, et al. Nanocomposite Hydrogel Incorporating Gold Nanorods and Paclitaxel-Loaded Chitosan Micelles for Combination Photothermal-Chemotherapy. Int J Pharm 2016; 497(1-2): 210-21
87- Salimi F, Dilmaghani KA, Alizadeh E, Akbarzadeh A, Davaran S. Enhancing Cisplatin Delivery to Hepatocellular Carcinoma Hepg2 Cells Using Dual Sensitive Smart Nanocomposite. Artif Cells, Nanomedicine Biotechnol 2018; 46(5): 949-58.
88- Xu X, Huang Z, Huang Z, Zhang X, He S, Sun X, et al. Injectable, NIR/Ph-Responsive Nanocomposite Hydrogel as Long-Acting Implant for Chemophotothermal Synergistic Cancer Therapy. ACS Appl Mater Interfaces 2017; 9(24): 20361-75.
89- Samadi A, Pourmadadi M, Yazdian F, Rashedi H, Navaei-Nigjeh M, Eufrasio-Da-Silva T. Ameliorating Quercetin Constraints in Cancer Therapy with Ph-Responsive Agarose-Polyvinylpyrrolidone -Hydroxyapatite Nanocomposite Encapsulated in Double Nanoemulsion. Int J Biol Macromol 2021; 182: 11-25
90- Kazemi S, Pourmadadi M, Yazdian F, Ghadami A. The Synthesis and Characterization of Targeted Delivery Curcumin Using Chitosan-Magnetite-Reduced Graphene Oxide as Nano-Carrier. Int J Biol Macromol 2021; 186: 554-62.
91- Nematollahi E, Pourmadadi M, Yazdian F, Fatoorehchi H, Rashedi H, Nigjeh MN. Synthesis and Characterization of Chitosan/Polyvinylpyrrolidone Coated Nanoporous Γ-Alumina as a Ph-Sensitive Carrier for Controlled Release of Quercetin. Int J Biol Macromol 2021; 183: 600-13.
92- Gerami SE, Pourmadadi M, Fatoorehchi H, Yazdian F, Rashedi H, Nigjeh MN. Preparation of pH-Sensitive Chitosan/Polyvinylpyrrolidone/Α-Fe2O3 Nanocomposite for Drug Delivery Application: Emphasis on Ameliorating Restrictions. Int J Biol Macromol 2021; 173: 409-20.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







