دوره 29، شماره 2 - ( اردیبهشت 1400 )
جلد 29 شماره 2 صفحات 3513-3500 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Shams Z, Akbari B, Rajabi S, Aghdami N. Manufacturing a Biomimetic Biorecator in Cardiac Tissue Engineering. JSSU 2021; 29 (2) :3500-3513
URL: http://jssu.ssu.ac.ir/article-1-5215-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5215-fa.html
شمس زهرا، اکبری بابک، رجبی سارا، اقدمی ناصر. ساخت بیورآکتور زیست تقلید در مهندسی بافت قلب. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (2) :3500-3513
زهرا شمس 

 ، بابک اکبری*
، بابک اکبری* 

 ، سارا رجبی
، سارا رجبی 

 ، ناصر اقدمی
، ناصر اقدمی 




 ، بابک اکبری*
، بابک اکبری* 

 ، سارا رجبی
، سارا رجبی 

 ، ناصر اقدمی
، ناصر اقدمی 


متن کامل [PDF 1124 kb]
(584 دریافت)
| چکیده (HTML) (1288 مشاهده)
متن کامل: (1339 مشاهده)
مقدمه
بیماریهای قلبی یکی از دلایل عمده مرگ و میر در دنیا محسوب میشوند بهطوری که تقریبا 40 درصد از مرگ و ناتوانی در کشورهای پیشرفته و جهان سوم به علت نارسایی قلبی میباشد (1). طبق تخمینهای انجام شده در سال 2013، بیشتر از 17/3 میلیون از مرگهای گزارش شده مربوط به بیماریهای قلبی بوده و انتظار میرود که این میزان در سال 2030 به 23/6 میلیون افزایش یابد (2). قلب یکی از ارگانهای پیشرفته در بدن ماست که وظیفه پمپاژ خون به سرتاسر بدن را بر عهده دارد. زمانی که بنا به هر دلیلی، خونرسانی به قسمتی از بافت قلب بهخوبی انجام نشود، سلولهای آن قسمت از بافت میمیرند و از آنجائیکه سلولهای قلبی توانایی ترمیم ندارند، شخص دچار نارسایی قلبی میگردد. در نارسایی قلبی، عملکرد قلب نیز مختل میشود (3). از گذشته تا کنون درمانهای زیادی در بیماران دارای نارسایی قلبی انجام شده است که برخی از جمله مصرف دارو، غیرتهاجمی و برخی نیز همچون آنژیوپلاستی، دستگاه حمایت کننده قلبی، پیس میکر و درنهایت پیوند قلب، تهاجمی هستند (5, 4). در این روشها هدف اصلی، کمک به قلب است که با وجود اینکه قسمتی از سلولهای خود را از دست داده است، تاحدی عملکرد خود را بهبود بخشد و توسط دارو تا حدی از پیشرفت بیماری جلوگیری گردد، ولی هیچکدام راهحلی برای ترمیم بافت از دست رفته ارائه نمیکنند. در نهایت پیوند قلبی نیز که در بیماران مرحله آخر استفاده می شود بهعلت کمبود اهداکننده و همین طور واکنش سیستم ایمنی بدن دچار محدودیتهای زیادی گردیده است. لذا در سالهای اخیر، دانشمندان به سراغ روشهای نوین همچون سلول درمانی و مهندسی بافت رفتهاند (5). در روشهای نوین، سعی بر آن است که سلولهای زنده بتوانند جایگزین سلولهای مرده گردند. تزریق سلولهای بنیادی به محل آسیب دیده یکی از روشهای مورد استفاده است که میتواند از طریق تزریق مستقیم به قسمت آسیب دیده و یا تزریق شریانی صورت گیرد (6). این روشها مشکلاتی نیز در بردارند، بهطوریکه در صورت تزریق به شریان کرونری، تنها 15 درصد از سلولها به محل مورد نظر رسیده (7) و در صورت تزریق مستقیم به بافت نیز با وجود اینکه اکثر سلولها به قسمت مورد نظر میرسند ولی بهعلت عدم وجود داربست مناسب برای تغذیه و رشد، میزان کمی از آنها دارای عملکرد مناسب خواهند بود. لذا ترکیب داربست و سلولهای پیشتاز قلبی (8) میتواند گزینه مناسبی برای درمان باشد. داربست مناسب جهت مهندسی بافت قلب باید دارای شاخصههای ذیل باشد:
- از نانوفیبرهایی همگون با قطر یکنواخت تشکیل شده باشد. توسط روشهای الکتروریسی و یا پرینت سه بعدی میتوان به داربستی با این مشخصه دست یافت (10, 9).
- ناهمسانگرد باشد، یکی از خواص عضله قلبی آن است که بارهای مکانیکی در جهت خاصی انتقال مییابند و همین باعث شده که داربست قلبی، خواص ناهمسانگردی Anisotropy داشته باشد (12, 11). در روش پرینت سه بعدی میتوان حرکت نازل را بهصورتی برنامهریزی کرد که در نهایت داربستی متشکل از نانوفیبرهای موازی داشت (8). الکتروریسی بر روی ماندرول چرخان نیز یکی از روشهای تولید داربست نانوفیبری موازی است که از نظر هزینه نیز مناسبتر از روش پرینتر سه بعدی میباشد (13, 11).
- چسبندگی و استحکام مناسب داشته باشد، از آنجاییکه بافت قلبی بهصورت مداوم و سیکل وار تحت نیروی کششی حاصل از انقباض و انبساط میباشد، لذا داربست مناسب باید بتواند این میزان کشش را تحمل کند و در طول زمان ترمیم، از سلولها حمایت مکانیکی داشته باشد (14). ماهیچههای قلبی مدول یانگی در حدود 10 تا 20 کیلو پاسکال در زمان دیاستول با کشش کمتر از 10 درصد دارد که در پایان دیاستول تا 50 کیلوپاسکال در عضله قلبی سالم و تا 200 تا 300 کیلوپاسکال در قلب آسیب دیده افزایش مییابد. بنابراین داشتن یک داربست الاستومر برای استفاده در سیکلهای انقباضی بافت قلب بسیار مناسب است (15). پلیمرهای مصنوعی نه تنها خواص مکانیکی خوبی دارند بلکه نرخ تخریبپذیری قابل کنترلی را نیز دارا میباشند (13,15). پلیکاپرولاکتون(Polycaprolactone PCL) ، یک پلیمر مصنوعی از خانواده پلییورتانهاست که به داشتن خواص الاستومری خیلی خوب شناخته شده است (16) ولی در عین حال از آنجاییکه ذاتاً هیدروفوب است نمیتواند شرایط مناسبی جهت چسبندگی سلول مهیا کند، لذا ترکیب آن با یک داربست طبیعی همچون ژلاتین Gelatin میتواند هر دو فاکتور چسبندگی و استحکام مکانیکی را ایجاد کند. البته درصد ترکیب این دو پلیمر نیز اهمیت بسیار بالایی دارد. درصد انتخابی ترکیبی باید بهگونهای باشد که داربست علاوه بر داشتن استحکام مکانیکی، چسبندگی سلولی مناسبی نیز داشته باشد و در عین حال نیز همگون باشد (15, 13). در مهندسی بافت قلب، یکی از مشکلاتی که در پیوند داربست حاوی سلولهای پروژنیتور قلبی به بافت آسیبدیده وجود دارد، این است که این سلولها پس از جایگزینی با سلولهای مرده نمیتوانند خود را حین ضربان با سلولهای طبیعی بافت قلب انطباق دهند و به همین علت موجب آریتمی میگردند. لذا اگر بتوان سلولها را قبل از پیوند به بافت، تحت اعمال بار مکانیکی با فرکانس و میزان کشش مشابه با بافت طبیعی قرار داد، ژنهایی که مربوط به انقباض سلولها و همزمانسازی آنها هستند به میزان بیشتری بیان میشوند (19-17). در این مطالعه با ساخت داربست نانوفیبری ترکیبی از 2 پلیمر PCL و ژلاتین با درصد ترکیب مناسب توسط روش الکتروریسی با ماندرول چرخان و ساخت دستگاه اعمال بار مکانیکی قادر به تولید فرکانس و درصد کشش مشخص و همچنین تولید درجه حرارت مورد نیاز زندهمانی سلولها (37 درجه سلسیوس)، سعی شده که محیط طبیعی سلولهای قلبی در بدن تا حد امکان شبیهسازی گردد. با وجود تحقیقهایی در زمینه اعمال بار مکانیکی و الکتریکی به داربست حاوی سلول و بررسی نتایج (20-22)، تاکنون دستگاهی که بتواند اعمال بار مکانیکی را بهصورت مستقیم به داربست الکتروریسی 2 بعدی ناهمسانگرد در جهت نانوفیبرهای موازی انجام دهد و همین طور بدون نیاز به انکوباتور و در محیط آزمایشگاه قادر به فراهم نمودن دمای ثابت 37 درجه سلسیوس برای سلولها باشد، طراحی و ساخته نشده است. طبق یافتههای علم فیزیک، بار مکانیکی در یک جهت مشخص بهصورت موثرتری انتقال مییابد، لذا نیروی اعمالی از سمت بیورآکتور طراحی شده در جهت نانوفیبرهای موازی به میزان بهتری انتقال یافته و لذا تولید این بیورآکتور میتواند در مهندسی بافت قلب و در پژوهشهای آینده تاثیر بسزا داشته باشد. بنابراین، درصورت کشت سلول های قلبی بر روی داربست تحت اعمال بارمکانیکی، نیروی مکانیکی در جهت نانوفیبرها انتقال یافته و سلولهای قرار گرفته در جهت نانوفیبرها، مشابه آنچه در بافت طبیعی قلب و در جهتGap Junctionها اتفاق میافتد، تحت ضربان قرار میگیرند و گزینه مناسبی برای پیوند به بافت آسیبدیده قلبی و جلوگیری از آریتمی خواهند بود.
روش بررسی
2-1- مواد
پلیکاپرولاکتون (Mw 80,000 g/mol)، ژلاتین خوکی نوع A و محیط کشت IMDM Iscove's Modified Dulbecco's Medium تهیه شده از برند سیگما آلدریچ، اسید استیک، اسید فرمیک، گلوتارآلدهید، اتانول و فسفات بافرسالین (Phosphate Buffer Saline PBS) تهیه شده از مرک و آمینواسید، پنیسیلین و الگلوتامین تهیه شده از اینویتروژن و در نهایت سرم جنین گاوی (Fetal Bovin Serum FBS) خریداری شده از گیبکو مواد مورد استفاده در این پژوهش میباشند.
2-2- بهدست آوردن پارامترهای بهینه الکتروریسی جهت تهیه داربست نانوفیبری جهتدار
در ابتدا برای بهدست آوردن محلولی با غلظت پلیمر 14%، حلال را که ترکیبی از اسیدفرمیک و اسید استیک تهیه شده از MERK آلمان با نسبتهای 7 به 3 است را آماده کرده (23) (از آنجائیکه اسید فرمیک ثابت دیالکتریک بالاتری دارد و برای الکتروریسی مناسبتر است به میزان بیشتری در حلال استفاده شد) سپس برای بهدست آوردن پارامترهای بهینه جهت الکتروریسی و داشتن نانوفیبرهای موازی و همگون، پلیمرهای PCL و ژلاتین نوع A خوکی که هر دو از کمپانی Sigma Aldrich تهیه شده بودند با نسبت PCL/Gelatin=70/30 مخلوط گردیده و به حلال اضافه شد و سپس به مدت 1 ساعت بر روی استیرر با سرعت 500 دور بر دقیقه و بدون اعمال حرارت قرار داده شد. برای تهیه داربست از محلول تهیه شده، از روش الکتروریسی استفاده شد. برای داشتن نانوفیبرهای موازی از ماندرول چرخان استفاده گردید. جهت بهدست آوردن پارامترهای بهینه الکتروریسی، با تغییر نرخ تغذیه، فاصله سوزن تا کالکتور، ولتاژ و سرعت چرخش ماندرول (24) طبق جدول 1، 6 نمونه به دست آمد. نمونهها به منظور مشخص شدن مورفولوژی، میزان همگون بودن و جهتدار بودن نانوفیبرها برای تهیه تصاویر میکروسکوپ الکترونی (Scanning Electron Microscope SEM) فرستاده شدند. برای اینکه با تابش الکترونی بتوان از سطح پلیمر تصویر تهیه کرد، بایستی روی سطح آن پوششی از طلا ایجاد کرد تا سطح رسانا گردد. سپس با اعمال ولتاژ 2000 ولت از نمونهها تصویربرداری گردید.
جدول 1: ساخت 6 داربست ترکیبی PCL/Gelatin=70/30 با تغییر پارامترهای مختلف الکتروریسی. غلظت داربست w/v(14%) بوده و فرآیند الکتروریسی در دمای محیط انجام میگیرد.
.JPG)
2-3- بهدست آوردن درصد ترکیبی بهینه برای دو پلیمر PCL و ژلاتین
پس از مشخص شدن پارامترهای مناسب جهت الکتروریسی و بهدست آوردن داربست با نانوفیبرهای موازی و توزیع یکنواخت، درصدهای ترکیبی مختلف از لحاظ میزان آبدوستی و همینطور استحکام مکانیکی مورد آزمایش قرار گرفتند. برای این منظور، 3 داربست با درصدهای ترکیبی PCL/Gelatin= 80/20، PCL/Gelatin= 70/30 و PCL/Gelatin= 60/40 با در نظر گرفتن پارامترهای بهینه الکتروریسی تولید گردیدند.
2-4- بررسی خواص فیزیکی و شیمیایی داربست
با استفاده از تصاویر میکروسکوپ الکترونی، توزیع قطری داربستها و میزان پراکندگی آنها، توسط نرمافزار تحلیل آماری SPSS با هم مقایسه شد تا همگون ترین حالت مشخص گردد. میزان آبدوستی داربستها نیز با استفاده از روش ارزیابی زاویه تماس در 3 داربست با درصدهای ترکیبی مختلف بهدست آمد. زاویه تماس استاتیک به روش قطره سسایل اندازهگیری شدکه در آن یک قطره به حجم 3 میکرولیتر بر روی پلیمر قرار داده شده و هنگامی که قطره بر روی سطح پایدار شد، با دوربین از آن عکسبرداری گردید. مقایسه استحکام مکانیکی در 3 درصد ترکیبی مختلف با استفاده از دستگاه اینسترون مدل TM-SM ساخت کشور انگلستان انجام گردید. در ابتدا طول و ضخامت نمونهها اندازهگیری و سپس با نرخ کرنش 5 میلیمتر در دقیقه، نیروی کششی در جهت نانوفیبرها به نمونهها وارد گردید (25). پس از 5 بار تکرار برای هر نمونه، نمودارهای تنش-کرنش بهدست آمده و با یکدیگر مقایسه گردید.
2-5- آنالیز بررسی اندرکنش سلول با داربست
در قدم اول، رده سلولی مورد نظر که سلولهای پروژنیتور قلبی Cardiac Progenitor Cells بودند، در پژوهشگاه رویان در محیط کشت IMDM برند سیگما حاوی 1 درصد الگلوتامین اینویتروژن، آمینواسیداینویتروژن، آنتیبیوتیک اینویتروژن و 10 درصد FBS گیبکو کشت یافتند. پیش از استفاده از داربست در محیط کشت سلولی، به منظور جلوگیری از بههم ریختن مورفولوژی نانوفیبری آن در محیط آبی به سبب وجود پلیمر آبدوست ژلاتین، داربست در محیط حمام بخار گلوتارآلدهید 25%، به مدت 6 روز شبکهای شد. بهمنظور بررسی اندرکنش سلول با داربست، در روزهای 2 و 4 و 6 پس از کشت، از نمونهها تست سمیت سلولی 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide MTS (Promega, G5421) گرفته شد تا میزان زندهمانی سلولها بررسی گردد. از آنجاییکه رنگ ارغوانی حاصل از زندهمانی سلولها در طول موج 490 تا 540 نانومتر جذب میگردد، لذا نمونه را تحت جذب در طول موج 490 نانومتر اشعه فرابنفش قرار دادیم تا میزان زندهمانی از روی میزان جذب در مقایسه با داربست PCL مقایسه گردد. در روز چهارم از داربست تصاویر میکروسکوپ الکترونی تهیه گردید.
2-6- ساخت بیورآکتور
به منظور شبیهسازی شرایط طبیعی سلولهای پروژنیتور قلبی در محیط آزمایشگاه، باید بتوان سلولهای قرار گرفته شده بر روی داربست را تحت بارمکانیکی مشابه با آنچه در بافت قلب وجود دارد، قرار داد (28-26). به این منظور دستگاهی طراحی گردید که بتواند اعمال نیرو را با فرکانس و نرخ کشش مشخصی انجام دهد.
2-6-1- طراحی مکانیکی بیورآکتور
در طراحی این بیورآکتور از یک بدنه نگهدارنده از جنس استیل و یک عدد آرمیچر که قادر است با فرکانس و نیروی مشخصی که از سمت برد فرکانسساز برایش تعیین میشود حرکت کند، استفاده شده است. داخل آرمیچر یک بوبین که حاوی سیم پیچ و هسته میباشد قرار گرفته است. هسته بوبین به یک میله فلزی متصل شده که از طریق سوراخی که بر روی درب بطری تعبیه شده، وارد بطری شده و از آنجا به دو پایه استیل دیگر متصل میگردد که محل قرارگیری داربست بر روی آنهاست. بوبین وقتی که تحت اعمال ولتاژ 5 ولت قرار میگیرد (29)، به علت میدان مغناطیسی نسبتاً قوی ایجاد شده در بین سیم پیچهایش، هسته را به سمت بالا (درجهت میدان) حرکت میدهد. با حرکت هسته به سمت بالا، دو پایه استیل که محل قرارگیری داربست قلبی هستند، از هم فاصله میگیرند. با قطع ولتاژ، پایهها به محل اولیه خود بر میگردند. حرکت پایه ها باعث میشود که به داربستی که بر روی آنها قرار خواهد گرفت، نیروی کششی با نرخ 10 درصد و فرکانس 1 هرتز اعمال گردد (30, 29, 27). کلیه قطعات در تماس مستقیم و غیرمستقیم با داربست از جنس تفلون و استیل انتخاب شده اند تا قابل اتوکلاو باشند. شکل1، شماتیک و ساختار دستگاه را نشان میدهد.

شکل1: ساختار دستگاه اعمال بار مکانیکی، (آ) شماتیک کلی دستگاه، (ب) آرمیچر جهت انتقال بار مکانیکی، (ج) برد فرکانسساز و کنترل حرارت تعبیه شده در داخل جعبه و استفاده از نمایشگر روی درب جعبه بهمنظور نمایش وضعیت خاموش و روشن بودن هیتر و همچنین دمای لحظهای محیط کشت داخل بطری، (د) سنسور غیر تماسی حرارتی، (ه) نگهدارنده از جنس استیل شامل یک هیتر به ابعاد 10 در 10 سانتیمتر در کف پلیت، (و) پایه استیل متصل به هسته آرمیچر که باعث باز و بسته شدن دو پایه دیگر که دارابست بر روی آنها قرار دارد، با فرکانس مشخص میگردد، (ز) داربست الکتروریسی شده قرار گرفته بر روی پایههای استیل، (ح) قطعه تفلونی با 8 سوراخ در فواصل یکسان (قابلیت اعمال نیروی مکانیکی در 4 محور مختلف)، R=2cm
2-6-2- طراحی برد فرکانسساز
برای تبدیل نیروی الکتریکی به مکانیکی، از آرمیچر استفاده میشود. قطع و وصل ولتاژ ورودی آرمیچر توسط یک برد فرکانسساز انجام می پذیرد. برای انجام این پژوهش، فرکانس بهینه 1 هرتز جهت اعمال نیروی مکانیکی در نظر گرفته شده است. لذا برای این منظور، بردی طراحی گردید که ولتاژی با دامنه 5 ولت و فرکانس 1 هرتز تولید کند تا توسط آن بتوان پایههای استیل را یک بار در ثانیه در جهت افقی حرکت داده و به این ترتیب داربست کامپوزیتی در هر ثانیه، یک بار تحت نیروی کشش 10 درصد قرار گیرد. مدار برد فرکانس ساز به صورت شکل2 میباشد. در طراحی این مدار از برد Arduino مدل Uno که یک پلتفرم اوپن سورس الکترونیک است بهره برده شد. برنامه تولید فرکانس مربوطه بر روی میکروکنترلر مرکزی که مدل ATMEGA328 است، نوشته شده و توسط خروجیهای 12 و 13 به درایور موتور فرستاده میشود.
2-6-3- طراحی سیستم کنترل حرارت
جهت فراهم آوردن دمای 37 درجه سانتیگراد برای سلولها بدون نیاز به قرارگیری سلولها در داخل انکوباتور، از یک المنت حرارتی، یک برد ترموستات، یک رله برای قطع و وصل جریان، یک سنسور حرارتی غیرتماسی برای کنترل دما و یک نمایشگر برای نشان دادن درجه حرارت در هر لحظه استفاده شد. سنسور غیر تماسی با نصب بر روی بطری و ارسال نور مادون قرمز به داخل محیط کشت و میزان برگشت نور، حرارت محیط داخل ظرف کشت را مشخص کرده و در صورتی که دما بیشتر یا کمتر از 37 درجه بود، به برد ترموستات و رله فرمان قطع و یا وصل شدن را ارسال میکرد. با این سیستم و کنترل مداوم درجه حرارت بر روی نمایشگر، توانستیم مطمعن شویم که دمای مناسب برای سلولها فراهم شده است. برد و نقشه کامل سیستم کنترل حرارت مورد استفاده در شکل3 مشخص شده است.
.jpg)
شکل2: مدار الکتریکی برد فرکانس ساز شامل (آ) درایور مدل L9110 و (ب) میکروکنترلر ATMEGA328
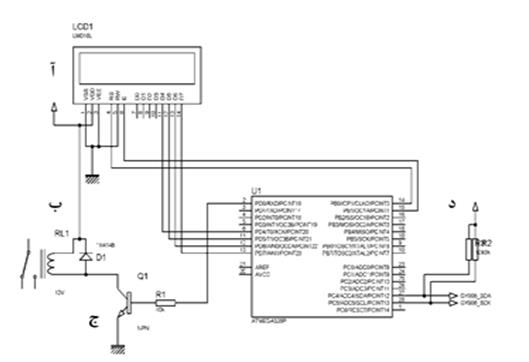
شکل 3: مدار الکتریکی برد سیستم کنترل حرارت شامل
(آ) نمایشگر، (ب) رله جهت خاموش و روشن کردن هیتر، (ج) هیتر و (د)سنسور حرارتی غیرتماسی مادون قرمز
2-7- آزمون عملی دستگاه به همراه داربست
داربست تهیه شده از دو پلیمر پلیکاپرولاکتون و ژلاتین با استفاده از چسب آنتی باکتریال سیلیکونی بر روی پایههای استیل قرار گرفته و سپس ولتاژ 5 ولت به سیستم اعمال میگردد تا با قطع و وصل ولتاژ توسط آرمیچر، فرکانس یک هرتز با نرخ کشش 10 درصد در داربست متصل به پایههای استیل ایجاد گردد. در طی بررسی کارکرد دستگاه، دمای داخل ظرف کشت که پایهها و داربست در داخل آن قرار دارند توسط سنسور غیرتماسی مادون قرمز اندازهگیری شده و بهصورت زنده بر روی نمایشگر قابل مشاهده میباشد. با ارسال دستور قطع و وصل هیتر از سمت برد کنترل حرارت، رله فعال شده و عملیات قطع و وصل شدن هیتر را انجام میدهد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه تهران تایید شده است.
نتایج
3-1- تصاویر میکروسکوپ الکترونی و توزیع قطری پس از تغییر پارامترهای الکتروریسی و درصدهای ترکیبی
با تغییر پارامترهای مختلف الکتروریسی بر طبق جدول 1، تصاویر میکروسکوپ الکترونی حاصل از داربست ترکیبی PCL/Gelatin=70/30 مطابق با شکل 4 تهیه گردید. نمونه (ب-2) از شکل4، بهعنوان مناسبترین داربست انتخاب گردیده و بهترین پارامترهای الکتروریسی به این روش مشخص شدند. سپس در نمونههای حاصل از الکتروریسی با پارامترهای بهینه و با درصدهای ترکیبی مختلف PCL/Gelatin=80/20، PCL/Gelatin=70/30 و PCL/Gelatin=60/40، تصاویر میکروسکوپ الکترونی و نمودارهای توزیع قطری نانوفیبرها تهیه گردید.
3-2- نتایج حاصل از ارزیابی زاویه تماس و استحکام مکانیکی
نتایج حاصل از ارزیابی زاویه تماس در سه داربست با درصدهای ترکیبی مختلف بر طبق شکل 5 مشخص گردید. در ادامه بهمنظور ارزیابی استحکام مکانیکی، داربستها تحت کشش 5 میلیمتر در دقیقه در جهت نانوفیبرهای موازی قرار گرفتند. پس از 5 بار تکرار برای هرنمونه، نتایج بهصورت نمودار تنش-کرنش برای هر یک از نمونهها مورد بررسی قرار گرفت (شکل5-آ).
3-3- نتایج حاصل از اندرکنش سلول با داربست
نتایج حاصل از تست سمیت سلولی MTS در روزهای دوم، چهارم و ششم بر روی داربست ترکیبی PCL/Gelatin و داربست کنترل PCL بهدست آمد که در شکل (6-ج) قابل مشاهده هستند. همچنین، تصاویر میکروسکوپ الکترونی در روز چهارم از داربست طبق شکلهای (6-آ و 6-ب) تهیه گردید.
3-4 نتایج حاصل از آزمون عملی دستگاه
با راه اندازی دستگاه اعمال بار مکانیکی به داربست مطابق شکل 7، کلیه مشخصات مورد نیاز جهت شبیهسازیمکانیکی و همینطور شرایط محیطی مناسب جهت رشد سلولهای قلبی مورد بررسی قرار گرفتند. پالس مکانیکی با فرکانس یک هرتز (باز و بسته شدن پایهها یک بار در ثانیه)، درصد کشش داربست به میزان ده درصد (باز شدن پایهها به میزان ده درصد بیشتر از فاصله اولیه پایهها از هم)، کنترل دمای 37 درجه و ارسال فرمان قطع و وصل هیتر بهمنظور ثابت نگه داشتن دما و در نهایت تحمل نرخ کشش 10 درصد با فرکانس 1 هرتز توسط داربست کامپوزیتی، از پارامترهایی بودند که باید بهمنظور شبیهسازی درست ضربان طبیعی قلب و ماتریکس خارج سلولی قلبی رعایت میشدند.

شکل4: تصاویر میکروسکوپ الکترونی داربست ترکیبی PCL/Gelatin=70/30 با پارامترهای مختلف الکتروریسی مشخص شده در جدول1( نمونه های آ-1، آ-2، آ-3، ب-1، ب-2، ب-3) و تصاویر میکروسکوپ الکترونی و درصد توزیع قطری داربست ترکیبی پلی کاپرولاکتون-ژلاتین با درصدهای ترکیبی (ج-1)PCL/Gelatin=60/40، (ج-2) PCL/Gelatin=70/30 و (ج-3) PCL/Gelatin=80/20

شکل 5: ویژگیهای فیزیکی و شیمیایی داربست، (آ) نمودار تنش-کرنش داربست های نانوفیبری ترکیبی و اندازه گیری زاویه تماس در داربست های ترکیبی (ب) PCL/Gelatin=80/20، (ج) PCL/Gelatin=70/30 و (د) PCL/Gelatin=60/40

شکل6: (آ، ب): تصاویر میکروسکوپ الکترونی حاصل از سلول های پروژنیتور قلبی کشت داده شده بر روی داربست نانوفیبری ترکیبی PCL/Gelatin=70/30 در روز چهارم کشت ثابت و (ج): نمودار زنده مانی سلولها بر روی داربست ترکیبی PCL/Gelatin=70/30 در روزهای دوم، چهارم و ششم با واریانس کمتر از 1 درصد، بهعنوان داربست کنترل استفاده گردید (تعداد تکرار=12).

شکل 7: راهاندازی دستگاه اعمال بار مکانیکی، (آ) شماتیک نمای بالا، (ب)تصویر اصلی بیورآکتور و (ج) شماتیک نمای جانبی
بحث
4-1- بررسی تصاویر میکروسکوپ الکترونی حاصل از تغییر پارامترهای الکتروریسی
با بررسی تصاویر میکروسکوپ الکترونی شکل 4 که حاصل از تغییر پارامترهای مختلف الکتروریسی در تهیه داربست ترکیبی PCL/Gelatin=70/30 میباشد، میتوانیم به نتایج زیر دست یابیم:
- با کاهش نرخ تغذیه پلیمر و افزایش فاصله سوزن تا کالکتور، همانطور که در نمونههای (آ-1) و (آ-2) مشخص است، قطر نانوفیبرها به میزان زیادی کاهش پیدا کرده و تا حدی همگون بودن الیاف از دست رفته است.
- با کاهش ولتاژ، همان طور که در نمونه (آ-3) مشخص است، نانوفیبرها تا حد بسیار زیادی بهصورت از هم گسسته و با توزیع قطری ناهمگون بر روی جمع کننده قرار گرفتند و این نشان میدهد که این ولتاژ برای تشکیل مخلوط تیلور در فرآیند الکتروریسی کافی نبوده است (24).
- وقتی از منظر سرعت چرخش ماندرول، به تصاویر نگاه میکنیم، این نتیجه حاصل میگردد که افزایش سرعت چرخش ماندرول وقتی که از حدی بیشتر شده است، نهتنها باعث جهت دار شدن بیشتر نمونه ها نگردیده بلکه باعث پخش شدن پلیمر در اطراف کالکتور شده و همانطور که در نمونه (ب-3) مشخص است، نانوفیبرهایی در خلاف جهت نانوفیبرهای موازی بهصورت ناهمگون بر روی سطح داربست تشکیل شده است. متقابلاً اگر سرعت چرخش ماندرول از حدی کمتر باشد، همانند نمونه (ب-1)، شاهد داربستی با درصد کمی از جهتآرایی خواهیم بود. با توجه به مطالب مذکور، پارامترهای الکتریسی بهکار رفته در تهیه داربست (ب-2)، به عنوان بهترین پارامترهای الکتروریسی جهت ادامه تحقیق انتخاب شدند.
4-2- بررسی توزیع قطری نانوفیبرها با درصدهای ترکیبی مختلف
همان طور که در نمودارها و تصاویر SEM شکل4 مشخص است، با افزایش درصد ژلاتین، ناهمگونی نانوفیبرها افزایش پیدا کرده است (13). علاوه بر همگونی و جهتدار بودن نانوفیبرها، برای دستیابی به بهینهترین درصد ترکیبی لازم بود که داربست¬ها از لحاظ استحکام مکانیکی و میزان چسبندگی سلولی نیز مورد بررسی قرار گیرند.
4-3- بررسی ارزیابی زاویه تماس و استحکام مکانیکی
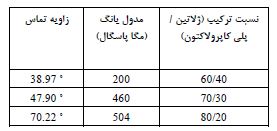
همانطور که انتظار میرفت، نتایج حاصل از ارزیابی زاویه تماس در شکل 5 نشان داد که با افزایش میزان ژلاتین که یک پلیمر آبدوست است، زاویه تماس کاهش پیدا کرده و بنابراین چسبندگی سلولی افزایش یافته است (13). در ادامه بهمنظور ارزیابی استحکام مکانیکی، داربستها تحت کشش 5 میلیمتر در دقیقه در جهت نانوفیبرهای موازی قرار گرفتند. پس از 5 بار تکرار برای هرنمونه، نتایج بهصورت نمودار تنش-کرنش برای هر یک از نمونهها مورد بررسی قرار گرفت (شکل5-آ). همانطور که در نمودار تنش-کرنش مشخص است، با افزایش درصد PCL، شیب نمودار تنش-کرنش و مدول الاستیسیته افزایش یافته است (31, 13). نقطه شکست در داربست با درصد PCL بیشتر نیز با میزان درصد کشش بیشتری اتفاق میافتد (31) که با توجه به اینکه در این پژوهش، داربست تحت اعمال بار مکانیکی با کشش 10 درصد قرار می گیرد، لذا این موضوع در پیشبرد پژوهش موثر می باشد. نتایج حاصل از آزمون زاویه تماس و استحکام مکانیکی در جدول 2 آورده شده است. در نهایت با بررسی نتایج حاصل از آزمایشهای زاویه تماس و استحکام مکانیکی و همین طور تصاویر SEM، باید بهترین درصد ترکیبی برای داربست تعیین میگردید. با توجه به تصاویر SEM شکل 4 و همینطور دادههای موجود در جدول 2، داربست PCL/Gelatin=70/30 هم از لحاظ همگون بودن نانوفیبرها مناسب بود و هم از لحاظ میزان چسبندگی سلولی و استحکام مکانیکی میتوانست جوابگوی شرایط آزمایش باشد. بنابراین داربست ترکیبی PCL/Gelatin=70/30، با زاویه تماس 47/90 درجه و نقطه شکست با 17% کشش بهعنوان داربست مورد استفاده جهت کشت سلولی دینامیک انتخاب گردید. از آنجاییکه درصد کشش در نظر گرفته شده برای داربست در این پژوهش 10 درصد بود، لذا داربست انتخابی برای انجام تست آماده بود.
جدول 2: مدول یانگ و زاویه تماس داربست های ترکیبی پلی کاپرولاکتون- ژلاتین با درصدهای مختلف
4-4- بررسی نتایج حاصل از اندرکنش سلول با داربست
نتایج حاصل از تست سمیت سلولی MTS، در شکل (6-ج)که در روزهای دوم، چه ارم و ششم بر روی داربست ترکیبی PCL/Gelatin و داربست کنترل PCL به دست آمده است، نشان داد که تعداد سلول های کشت داده شده بر روی داربستها به مرور زمان افزایش پیدا کرده و البته در مقایسه با داربست کنترل، میتوان فهمید که افزودن ژلاتین، باعث افزایش چسبندگی سلولی گردیده است. تصاویر میکروسکوپ الکترونی در روز چهارم از داربست طبق شکل های (6-آ، 6-ب) تهیه گردید که چسبندگی سلول های پروژنیتور قلبی بر روی داربست را در جهت نانوفیبرها نشان می دهد.
4-5- بررسی نتایج حاصل از آزمون عملی دستگاه
با راهاندازی بیورآکتور مطابق شکل 7، مشخص گردید که دستگاه قادر است به درستی با اعمال فرکانس و درصد کشش مناسب، بار مکانیکی را بهطور مستقیم به داربست سوار شده بر روی پایههای استیل وارد کرده و در هر مدت زمانی که مورد نیاز باشد دمای داخل ظرف کشت را ثابت نگه دارد. لذا این سیستم می تواند بمنظور ایجاد محیطی جهت زیست تقلیدی از بافت قلبی در محیط آزمایشگاه مورد استفاده قرار گیرد. برای اطمینان از عملکرد مناسب داربست و بیورآکتور طراحی شده، داربست بر روی پایههای دستگاه سوار شده و بیورآکتور بهمدت 8 روز جهت اعمال بار مکانیکی بهداربست روشن نگه داشته شد. دمای محیط داخل بطری مرتباً توسط سنسور غیرتماسی، اندازه گیری و بر روی LCD نمایش داده میشد. فرکانس یک هرتز (باز و بسته شدن پایه ها با نرخ یک بار در ثانیه) و همین طور نیروی کششی ده درصد (افزایش طول ده درصدی داربست در هنگام باز شدن پایهها از همدیگر) در طی هشت روز چک و کنترل شد. پس از گذشت هشت روز داربست توانسته بود نیروی اعمالی را تحمل کند و کاملاً حالت الاستیک خود را حفظ نماید. با توجه به اینکه مدت زمانی که معمولاً سلولها در آزمیشگاه تحت اعمال بارمکانیکی قرار میگیرند بین 3 تا هفت روز است، لذا سیستم داربست و بیورآکتور طراحی شده در این پژوهش به راحتی میتواند جهت شبیهسازی ضربان در محیط آزمایشگاه و اعمال بار مکانیکی به سلولهای قلبی در آینده مورد استفاده قرار گیرد.
نتیجهگیری
هدف از این آزمایش، ساخت داربست و بیورآکتوری بهمنظور شبیهسازی مناسب ماتریکس خارج سلول قلبی و همینطور شرایط مکانیکی موجود در ماهیچه قلبی در محیط آزمایشگاه بود. تمایز این پژوهش با سایر یافتههای علمی، اعمال بارمکانیکی به داربست دو بعدی و در جهت نانوفیبرهای موازی می باشد که بتواند کاملاً ساختار انتقال بارمکانیکی در قلب را شبیهسازی کند. زیرا ماتریکس خارج سلولی قلبی از لایههای متشکل از نانوفیبرهای موازی تشکیل شده است و ضربان قلبی در جهت نانوفیبرها به سلول ها انتقال داده می شود. با استفاده از داربست الکتروریسی با نانوفیبرهای موازی و با ترکیب 2 پلیمر PCL و ژلاتین توانستیم داربستی با چسبندگی سلولی و استحکام مکانیکی مناسب با توزیع قطری یکنواخت و همگون تولید کنیم که از نظر خواص شیمیایی و فیزیکی تا حدی شبیه به ماتریکس خارج سلولی قلبی باشد. سپس با زیست تقلیدی از عضله قلب که در آن انقباض همزمان قلبی بین سلولها صورت میپذیرد و بار مکانیکی ایجاد شده از طریق Gap Junctionها و در جهت نانوفیرهای موازی انتقال مییابد، دستگاه ضربانساز با توانایی ایجاد کشش 10 درصد با فرکانس 1 هرتز به داربست تعبیه شده بر روی آن، تولید گردید. با استفاده از این دستگاه و کشت سلولهای پروژنیتور قلبی بر روی داربست، میتوان انتظار داشت که ژن های مربوط به همزمان سازی انقباض قلبی به میزان بیشتری در این سلولها بیان گردند و لذا این سلولها به گزینه مناسبی برای پیوند به بافت آسیب دیده قلبی تبدیل گردند. در مراحل بعدی این پژوهش نیز میتوان نتایج را در شرایط درون تنی نیز بررسی نمود و مطمئن شد که آیا این سلولها که برای مدتی در محیط آزمایشگاه شرایط مکانیکی، فیزیکی و شیمیایی مشابه با بافت طبیعی قلب را بررسی کردهاند میتوانند در کنار سلولهای طبیعی قلب قرار گرفته و بهصورت همزمان با آنها، انقباض قلبی را انجام دهند و بتوانند بدون ایجاد آریتمی در قلب جایگزین مناسبی برای سلولهای بافت مرده قلبی باشند و عملکرد قلب را بهبود بخشند یا خیر. یکی از مباحث دیگری که میتوان در آینده در رابطه با این مطالعه انجام داد، بررسی تاثیر تابش مادون قرمز حاصل از سنسور غیرتماسی استفاده شده در سیستم کنترل حرارت پروژه است. همانطور که طبق مطالعات انجام شده در مارچ 2011، محققان دانشگاه Utah موفق به استفاده از تابش مادون قرمز برای تحریک سلول های قلبی موش و سلولهای گوش میانی ماهی Toadfish، از طریق فرستادن این سیگنالها بهمغز شدند (32).
سپاسگزاری
این مطالعه حاصل پایاننامه و با حمایت پژوهشگاه رویان تهران و دانشکده علوم و فنون نوین دانشگاه تهران انجام شده است که از هر دو ارگان صمیمانه سپاسگزاریم.
حامی مالی: حامیان مالی این پژوهش، پژوهشگاه رویان تهران و دانشکده علوم و فنون نوین دانشگاه تهران میباشند.
تعارض در منافع: وجود ندارد.
بیماریهای قلبی یکی از دلایل عمده مرگ و میر در دنیا محسوب میشوند بهطوری که تقریبا 40 درصد از مرگ و ناتوانی در کشورهای پیشرفته و جهان سوم به علت نارسایی قلبی میباشد (1). طبق تخمینهای انجام شده در سال 2013، بیشتر از 17/3 میلیون از مرگهای گزارش شده مربوط به بیماریهای قلبی بوده و انتظار میرود که این میزان در سال 2030 به 23/6 میلیون افزایش یابد (2). قلب یکی از ارگانهای پیشرفته در بدن ماست که وظیفه پمپاژ خون به سرتاسر بدن را بر عهده دارد. زمانی که بنا به هر دلیلی، خونرسانی به قسمتی از بافت قلب بهخوبی انجام نشود، سلولهای آن قسمت از بافت میمیرند و از آنجائیکه سلولهای قلبی توانایی ترمیم ندارند، شخص دچار نارسایی قلبی میگردد. در نارسایی قلبی، عملکرد قلب نیز مختل میشود (3). از گذشته تا کنون درمانهای زیادی در بیماران دارای نارسایی قلبی انجام شده است که برخی از جمله مصرف دارو، غیرتهاجمی و برخی نیز همچون آنژیوپلاستی، دستگاه حمایت کننده قلبی، پیس میکر و درنهایت پیوند قلب، تهاجمی هستند (5, 4). در این روشها هدف اصلی، کمک به قلب است که با وجود اینکه قسمتی از سلولهای خود را از دست داده است، تاحدی عملکرد خود را بهبود بخشد و توسط دارو تا حدی از پیشرفت بیماری جلوگیری گردد، ولی هیچکدام راهحلی برای ترمیم بافت از دست رفته ارائه نمیکنند. در نهایت پیوند قلبی نیز که در بیماران مرحله آخر استفاده می شود بهعلت کمبود اهداکننده و همین طور واکنش سیستم ایمنی بدن دچار محدودیتهای زیادی گردیده است. لذا در سالهای اخیر، دانشمندان به سراغ روشهای نوین همچون سلول درمانی و مهندسی بافت رفتهاند (5). در روشهای نوین، سعی بر آن است که سلولهای زنده بتوانند جایگزین سلولهای مرده گردند. تزریق سلولهای بنیادی به محل آسیب دیده یکی از روشهای مورد استفاده است که میتواند از طریق تزریق مستقیم به قسمت آسیب دیده و یا تزریق شریانی صورت گیرد (6). این روشها مشکلاتی نیز در بردارند، بهطوریکه در صورت تزریق به شریان کرونری، تنها 15 درصد از سلولها به محل مورد نظر رسیده (7) و در صورت تزریق مستقیم به بافت نیز با وجود اینکه اکثر سلولها به قسمت مورد نظر میرسند ولی بهعلت عدم وجود داربست مناسب برای تغذیه و رشد، میزان کمی از آنها دارای عملکرد مناسب خواهند بود. لذا ترکیب داربست و سلولهای پیشتاز قلبی (8) میتواند گزینه مناسبی برای درمان باشد. داربست مناسب جهت مهندسی بافت قلب باید دارای شاخصههای ذیل باشد:
- از نانوفیبرهایی همگون با قطر یکنواخت تشکیل شده باشد. توسط روشهای الکتروریسی و یا پرینت سه بعدی میتوان به داربستی با این مشخصه دست یافت (10, 9).
- ناهمسانگرد باشد، یکی از خواص عضله قلبی آن است که بارهای مکانیکی در جهت خاصی انتقال مییابند و همین باعث شده که داربست قلبی، خواص ناهمسانگردی Anisotropy داشته باشد (12, 11). در روش پرینت سه بعدی میتوان حرکت نازل را بهصورتی برنامهریزی کرد که در نهایت داربستی متشکل از نانوفیبرهای موازی داشت (8). الکتروریسی بر روی ماندرول چرخان نیز یکی از روشهای تولید داربست نانوفیبری موازی است که از نظر هزینه نیز مناسبتر از روش پرینتر سه بعدی میباشد (13, 11).
- چسبندگی و استحکام مناسب داشته باشد، از آنجاییکه بافت قلبی بهصورت مداوم و سیکل وار تحت نیروی کششی حاصل از انقباض و انبساط میباشد، لذا داربست مناسب باید بتواند این میزان کشش را تحمل کند و در طول زمان ترمیم، از سلولها حمایت مکانیکی داشته باشد (14). ماهیچههای قلبی مدول یانگی در حدود 10 تا 20 کیلو پاسکال در زمان دیاستول با کشش کمتر از 10 درصد دارد که در پایان دیاستول تا 50 کیلوپاسکال در عضله قلبی سالم و تا 200 تا 300 کیلوپاسکال در قلب آسیب دیده افزایش مییابد. بنابراین داشتن یک داربست الاستومر برای استفاده در سیکلهای انقباضی بافت قلب بسیار مناسب است (15). پلیمرهای مصنوعی نه تنها خواص مکانیکی خوبی دارند بلکه نرخ تخریبپذیری قابل کنترلی را نیز دارا میباشند (13,15). پلیکاپرولاکتون(Polycaprolactone PCL) ، یک پلیمر مصنوعی از خانواده پلییورتانهاست که به داشتن خواص الاستومری خیلی خوب شناخته شده است (16) ولی در عین حال از آنجاییکه ذاتاً هیدروفوب است نمیتواند شرایط مناسبی جهت چسبندگی سلول مهیا کند، لذا ترکیب آن با یک داربست طبیعی همچون ژلاتین Gelatin میتواند هر دو فاکتور چسبندگی و استحکام مکانیکی را ایجاد کند. البته درصد ترکیب این دو پلیمر نیز اهمیت بسیار بالایی دارد. درصد انتخابی ترکیبی باید بهگونهای باشد که داربست علاوه بر داشتن استحکام مکانیکی، چسبندگی سلولی مناسبی نیز داشته باشد و در عین حال نیز همگون باشد (15, 13). در مهندسی بافت قلب، یکی از مشکلاتی که در پیوند داربست حاوی سلولهای پروژنیتور قلبی به بافت آسیبدیده وجود دارد، این است که این سلولها پس از جایگزینی با سلولهای مرده نمیتوانند خود را حین ضربان با سلولهای طبیعی بافت قلب انطباق دهند و به همین علت موجب آریتمی میگردند. لذا اگر بتوان سلولها را قبل از پیوند به بافت، تحت اعمال بار مکانیکی با فرکانس و میزان کشش مشابه با بافت طبیعی قرار داد، ژنهایی که مربوط به انقباض سلولها و همزمانسازی آنها هستند به میزان بیشتری بیان میشوند (19-17). در این مطالعه با ساخت داربست نانوفیبری ترکیبی از 2 پلیمر PCL و ژلاتین با درصد ترکیب مناسب توسط روش الکتروریسی با ماندرول چرخان و ساخت دستگاه اعمال بار مکانیکی قادر به تولید فرکانس و درصد کشش مشخص و همچنین تولید درجه حرارت مورد نیاز زندهمانی سلولها (37 درجه سلسیوس)، سعی شده که محیط طبیعی سلولهای قلبی در بدن تا حد امکان شبیهسازی گردد. با وجود تحقیقهایی در زمینه اعمال بار مکانیکی و الکتریکی به داربست حاوی سلول و بررسی نتایج (20-22)، تاکنون دستگاهی که بتواند اعمال بار مکانیکی را بهصورت مستقیم به داربست الکتروریسی 2 بعدی ناهمسانگرد در جهت نانوفیبرهای موازی انجام دهد و همین طور بدون نیاز به انکوباتور و در محیط آزمایشگاه قادر به فراهم نمودن دمای ثابت 37 درجه سلسیوس برای سلولها باشد، طراحی و ساخته نشده است. طبق یافتههای علم فیزیک، بار مکانیکی در یک جهت مشخص بهصورت موثرتری انتقال مییابد، لذا نیروی اعمالی از سمت بیورآکتور طراحی شده در جهت نانوفیبرهای موازی به میزان بهتری انتقال یافته و لذا تولید این بیورآکتور میتواند در مهندسی بافت قلب و در پژوهشهای آینده تاثیر بسزا داشته باشد. بنابراین، درصورت کشت سلول های قلبی بر روی داربست تحت اعمال بارمکانیکی، نیروی مکانیکی در جهت نانوفیبرها انتقال یافته و سلولهای قرار گرفته در جهت نانوفیبرها، مشابه آنچه در بافت طبیعی قلب و در جهتGap Junctionها اتفاق میافتد، تحت ضربان قرار میگیرند و گزینه مناسبی برای پیوند به بافت آسیبدیده قلبی و جلوگیری از آریتمی خواهند بود.
روش بررسی
2-1- مواد
پلیکاپرولاکتون (Mw 80,000 g/mol)، ژلاتین خوکی نوع A و محیط کشت IMDM Iscove's Modified Dulbecco's Medium تهیه شده از برند سیگما آلدریچ، اسید استیک، اسید فرمیک، گلوتارآلدهید، اتانول و فسفات بافرسالین (Phosphate Buffer Saline PBS) تهیه شده از مرک و آمینواسید، پنیسیلین و الگلوتامین تهیه شده از اینویتروژن و در نهایت سرم جنین گاوی (Fetal Bovin Serum FBS) خریداری شده از گیبکو مواد مورد استفاده در این پژوهش میباشند.
2-2- بهدست آوردن پارامترهای بهینه الکتروریسی جهت تهیه داربست نانوفیبری جهتدار
در ابتدا برای بهدست آوردن محلولی با غلظت پلیمر 14%، حلال را که ترکیبی از اسیدفرمیک و اسید استیک تهیه شده از MERK آلمان با نسبتهای 7 به 3 است را آماده کرده (23) (از آنجائیکه اسید فرمیک ثابت دیالکتریک بالاتری دارد و برای الکتروریسی مناسبتر است به میزان بیشتری در حلال استفاده شد) سپس برای بهدست آوردن پارامترهای بهینه جهت الکتروریسی و داشتن نانوفیبرهای موازی و همگون، پلیمرهای PCL و ژلاتین نوع A خوکی که هر دو از کمپانی Sigma Aldrich تهیه شده بودند با نسبت PCL/Gelatin=70/30 مخلوط گردیده و به حلال اضافه شد و سپس به مدت 1 ساعت بر روی استیرر با سرعت 500 دور بر دقیقه و بدون اعمال حرارت قرار داده شد. برای تهیه داربست از محلول تهیه شده، از روش الکتروریسی استفاده شد. برای داشتن نانوفیبرهای موازی از ماندرول چرخان استفاده گردید. جهت بهدست آوردن پارامترهای بهینه الکتروریسی، با تغییر نرخ تغذیه، فاصله سوزن تا کالکتور، ولتاژ و سرعت چرخش ماندرول (24) طبق جدول 1، 6 نمونه به دست آمد. نمونهها به منظور مشخص شدن مورفولوژی، میزان همگون بودن و جهتدار بودن نانوفیبرها برای تهیه تصاویر میکروسکوپ الکترونی (Scanning Electron Microscope SEM) فرستاده شدند. برای اینکه با تابش الکترونی بتوان از سطح پلیمر تصویر تهیه کرد، بایستی روی سطح آن پوششی از طلا ایجاد کرد تا سطح رسانا گردد. سپس با اعمال ولتاژ 2000 ولت از نمونهها تصویربرداری گردید.
جدول 1: ساخت 6 داربست ترکیبی PCL/Gelatin=70/30 با تغییر پارامترهای مختلف الکتروریسی. غلظت داربست w/v(14%) بوده و فرآیند الکتروریسی در دمای محیط انجام میگیرد.
.JPG)
2-3- بهدست آوردن درصد ترکیبی بهینه برای دو پلیمر PCL و ژلاتین
پس از مشخص شدن پارامترهای مناسب جهت الکتروریسی و بهدست آوردن داربست با نانوفیبرهای موازی و توزیع یکنواخت، درصدهای ترکیبی مختلف از لحاظ میزان آبدوستی و همینطور استحکام مکانیکی مورد آزمایش قرار گرفتند. برای این منظور، 3 داربست با درصدهای ترکیبی PCL/Gelatin= 80/20، PCL/Gelatin= 70/30 و PCL/Gelatin= 60/40 با در نظر گرفتن پارامترهای بهینه الکتروریسی تولید گردیدند.
2-4- بررسی خواص فیزیکی و شیمیایی داربست
با استفاده از تصاویر میکروسکوپ الکترونی، توزیع قطری داربستها و میزان پراکندگی آنها، توسط نرمافزار تحلیل آماری SPSS با هم مقایسه شد تا همگون ترین حالت مشخص گردد. میزان آبدوستی داربستها نیز با استفاده از روش ارزیابی زاویه تماس در 3 داربست با درصدهای ترکیبی مختلف بهدست آمد. زاویه تماس استاتیک به روش قطره سسایل اندازهگیری شدکه در آن یک قطره به حجم 3 میکرولیتر بر روی پلیمر قرار داده شده و هنگامی که قطره بر روی سطح پایدار شد، با دوربین از آن عکسبرداری گردید. مقایسه استحکام مکانیکی در 3 درصد ترکیبی مختلف با استفاده از دستگاه اینسترون مدل TM-SM ساخت کشور انگلستان انجام گردید. در ابتدا طول و ضخامت نمونهها اندازهگیری و سپس با نرخ کرنش 5 میلیمتر در دقیقه، نیروی کششی در جهت نانوفیبرها به نمونهها وارد گردید (25). پس از 5 بار تکرار برای هر نمونه، نمودارهای تنش-کرنش بهدست آمده و با یکدیگر مقایسه گردید.
2-5- آنالیز بررسی اندرکنش سلول با داربست
در قدم اول، رده سلولی مورد نظر که سلولهای پروژنیتور قلبی Cardiac Progenitor Cells بودند، در پژوهشگاه رویان در محیط کشت IMDM برند سیگما حاوی 1 درصد الگلوتامین اینویتروژن، آمینواسیداینویتروژن، آنتیبیوتیک اینویتروژن و 10 درصد FBS گیبکو کشت یافتند. پیش از استفاده از داربست در محیط کشت سلولی، به منظور جلوگیری از بههم ریختن مورفولوژی نانوفیبری آن در محیط آبی به سبب وجود پلیمر آبدوست ژلاتین، داربست در محیط حمام بخار گلوتارآلدهید 25%، به مدت 6 روز شبکهای شد. بهمنظور بررسی اندرکنش سلول با داربست، در روزهای 2 و 4 و 6 پس از کشت، از نمونهها تست سمیت سلولی 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide MTS (Promega, G5421) گرفته شد تا میزان زندهمانی سلولها بررسی گردد. از آنجاییکه رنگ ارغوانی حاصل از زندهمانی سلولها در طول موج 490 تا 540 نانومتر جذب میگردد، لذا نمونه را تحت جذب در طول موج 490 نانومتر اشعه فرابنفش قرار دادیم تا میزان زندهمانی از روی میزان جذب در مقایسه با داربست PCL مقایسه گردد. در روز چهارم از داربست تصاویر میکروسکوپ الکترونی تهیه گردید.
2-6- ساخت بیورآکتور
به منظور شبیهسازی شرایط طبیعی سلولهای پروژنیتور قلبی در محیط آزمایشگاه، باید بتوان سلولهای قرار گرفته شده بر روی داربست را تحت بارمکانیکی مشابه با آنچه در بافت قلب وجود دارد، قرار داد (28-26). به این منظور دستگاهی طراحی گردید که بتواند اعمال نیرو را با فرکانس و نرخ کشش مشخصی انجام دهد.
2-6-1- طراحی مکانیکی بیورآکتور
در طراحی این بیورآکتور از یک بدنه نگهدارنده از جنس استیل و یک عدد آرمیچر که قادر است با فرکانس و نیروی مشخصی که از سمت برد فرکانسساز برایش تعیین میشود حرکت کند، استفاده شده است. داخل آرمیچر یک بوبین که حاوی سیم پیچ و هسته میباشد قرار گرفته است. هسته بوبین به یک میله فلزی متصل شده که از طریق سوراخی که بر روی درب بطری تعبیه شده، وارد بطری شده و از آنجا به دو پایه استیل دیگر متصل میگردد که محل قرارگیری داربست بر روی آنهاست. بوبین وقتی که تحت اعمال ولتاژ 5 ولت قرار میگیرد (29)، به علت میدان مغناطیسی نسبتاً قوی ایجاد شده در بین سیم پیچهایش، هسته را به سمت بالا (درجهت میدان) حرکت میدهد. با حرکت هسته به سمت بالا، دو پایه استیل که محل قرارگیری داربست قلبی هستند، از هم فاصله میگیرند. با قطع ولتاژ، پایهها به محل اولیه خود بر میگردند. حرکت پایه ها باعث میشود که به داربستی که بر روی آنها قرار خواهد گرفت، نیروی کششی با نرخ 10 درصد و فرکانس 1 هرتز اعمال گردد (30, 29, 27). کلیه قطعات در تماس مستقیم و غیرمستقیم با داربست از جنس تفلون و استیل انتخاب شده اند تا قابل اتوکلاو باشند. شکل1، شماتیک و ساختار دستگاه را نشان میدهد.

شکل1: ساختار دستگاه اعمال بار مکانیکی، (آ) شماتیک کلی دستگاه، (ب) آرمیچر جهت انتقال بار مکانیکی، (ج) برد فرکانسساز و کنترل حرارت تعبیه شده در داخل جعبه و استفاده از نمایشگر روی درب جعبه بهمنظور نمایش وضعیت خاموش و روشن بودن هیتر و همچنین دمای لحظهای محیط کشت داخل بطری، (د) سنسور غیر تماسی حرارتی، (ه) نگهدارنده از جنس استیل شامل یک هیتر به ابعاد 10 در 10 سانتیمتر در کف پلیت، (و) پایه استیل متصل به هسته آرمیچر که باعث باز و بسته شدن دو پایه دیگر که دارابست بر روی آنها قرار دارد، با فرکانس مشخص میگردد، (ز) داربست الکتروریسی شده قرار گرفته بر روی پایههای استیل، (ح) قطعه تفلونی با 8 سوراخ در فواصل یکسان (قابلیت اعمال نیروی مکانیکی در 4 محور مختلف)، R=2cm
2-6-2- طراحی برد فرکانسساز
برای تبدیل نیروی الکتریکی به مکانیکی، از آرمیچر استفاده میشود. قطع و وصل ولتاژ ورودی آرمیچر توسط یک برد فرکانسساز انجام می پذیرد. برای انجام این پژوهش، فرکانس بهینه 1 هرتز جهت اعمال نیروی مکانیکی در نظر گرفته شده است. لذا برای این منظور، بردی طراحی گردید که ولتاژی با دامنه 5 ولت و فرکانس 1 هرتز تولید کند تا توسط آن بتوان پایههای استیل را یک بار در ثانیه در جهت افقی حرکت داده و به این ترتیب داربست کامپوزیتی در هر ثانیه، یک بار تحت نیروی کشش 10 درصد قرار گیرد. مدار برد فرکانس ساز به صورت شکل2 میباشد. در طراحی این مدار از برد Arduino مدل Uno که یک پلتفرم اوپن سورس الکترونیک است بهره برده شد. برنامه تولید فرکانس مربوطه بر روی میکروکنترلر مرکزی که مدل ATMEGA328 است، نوشته شده و توسط خروجیهای 12 و 13 به درایور موتور فرستاده میشود.
2-6-3- طراحی سیستم کنترل حرارت
جهت فراهم آوردن دمای 37 درجه سانتیگراد برای سلولها بدون نیاز به قرارگیری سلولها در داخل انکوباتور، از یک المنت حرارتی، یک برد ترموستات، یک رله برای قطع و وصل جریان، یک سنسور حرارتی غیرتماسی برای کنترل دما و یک نمایشگر برای نشان دادن درجه حرارت در هر لحظه استفاده شد. سنسور غیر تماسی با نصب بر روی بطری و ارسال نور مادون قرمز به داخل محیط کشت و میزان برگشت نور، حرارت محیط داخل ظرف کشت را مشخص کرده و در صورتی که دما بیشتر یا کمتر از 37 درجه بود، به برد ترموستات و رله فرمان قطع و یا وصل شدن را ارسال میکرد. با این سیستم و کنترل مداوم درجه حرارت بر روی نمایشگر، توانستیم مطمعن شویم که دمای مناسب برای سلولها فراهم شده است. برد و نقشه کامل سیستم کنترل حرارت مورد استفاده در شکل3 مشخص شده است.
.jpg)
شکل2: مدار الکتریکی برد فرکانس ساز شامل (آ) درایور مدل L9110 و (ب) میکروکنترلر ATMEGA328

شکل 3: مدار الکتریکی برد سیستم کنترل حرارت شامل
(آ) نمایشگر، (ب) رله جهت خاموش و روشن کردن هیتر، (ج) هیتر و (د)سنسور حرارتی غیرتماسی مادون قرمز
2-7- آزمون عملی دستگاه به همراه داربست
داربست تهیه شده از دو پلیمر پلیکاپرولاکتون و ژلاتین با استفاده از چسب آنتی باکتریال سیلیکونی بر روی پایههای استیل قرار گرفته و سپس ولتاژ 5 ولت به سیستم اعمال میگردد تا با قطع و وصل ولتاژ توسط آرمیچر، فرکانس یک هرتز با نرخ کشش 10 درصد در داربست متصل به پایههای استیل ایجاد گردد. در طی بررسی کارکرد دستگاه، دمای داخل ظرف کشت که پایهها و داربست در داخل آن قرار دارند توسط سنسور غیرتماسی مادون قرمز اندازهگیری شده و بهصورت زنده بر روی نمایشگر قابل مشاهده میباشد. با ارسال دستور قطع و وصل هیتر از سمت برد کنترل حرارت، رله فعال شده و عملیات قطع و وصل شدن هیتر را انجام میدهد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه تهران تایید شده است.
نتایج
3-1- تصاویر میکروسکوپ الکترونی و توزیع قطری پس از تغییر پارامترهای الکتروریسی و درصدهای ترکیبی
با تغییر پارامترهای مختلف الکتروریسی بر طبق جدول 1، تصاویر میکروسکوپ الکترونی حاصل از داربست ترکیبی PCL/Gelatin=70/30 مطابق با شکل 4 تهیه گردید. نمونه (ب-2) از شکل4، بهعنوان مناسبترین داربست انتخاب گردیده و بهترین پارامترهای الکتروریسی به این روش مشخص شدند. سپس در نمونههای حاصل از الکتروریسی با پارامترهای بهینه و با درصدهای ترکیبی مختلف PCL/Gelatin=80/20، PCL/Gelatin=70/30 و PCL/Gelatin=60/40، تصاویر میکروسکوپ الکترونی و نمودارهای توزیع قطری نانوفیبرها تهیه گردید.
3-2- نتایج حاصل از ارزیابی زاویه تماس و استحکام مکانیکی
نتایج حاصل از ارزیابی زاویه تماس در سه داربست با درصدهای ترکیبی مختلف بر طبق شکل 5 مشخص گردید. در ادامه بهمنظور ارزیابی استحکام مکانیکی، داربستها تحت کشش 5 میلیمتر در دقیقه در جهت نانوفیبرهای موازی قرار گرفتند. پس از 5 بار تکرار برای هرنمونه، نتایج بهصورت نمودار تنش-کرنش برای هر یک از نمونهها مورد بررسی قرار گرفت (شکل5-آ).
3-3- نتایج حاصل از اندرکنش سلول با داربست
نتایج حاصل از تست سمیت سلولی MTS در روزهای دوم، چهارم و ششم بر روی داربست ترکیبی PCL/Gelatin و داربست کنترل PCL بهدست آمد که در شکل (6-ج) قابل مشاهده هستند. همچنین، تصاویر میکروسکوپ الکترونی در روز چهارم از داربست طبق شکلهای (6-آ و 6-ب) تهیه گردید.
3-4 نتایج حاصل از آزمون عملی دستگاه
با راه اندازی دستگاه اعمال بار مکانیکی به داربست مطابق شکل 7، کلیه مشخصات مورد نیاز جهت شبیهسازیمکانیکی و همینطور شرایط محیطی مناسب جهت رشد سلولهای قلبی مورد بررسی قرار گرفتند. پالس مکانیکی با فرکانس یک هرتز (باز و بسته شدن پایهها یک بار در ثانیه)، درصد کشش داربست به میزان ده درصد (باز شدن پایهها به میزان ده درصد بیشتر از فاصله اولیه پایهها از هم)، کنترل دمای 37 درجه و ارسال فرمان قطع و وصل هیتر بهمنظور ثابت نگه داشتن دما و در نهایت تحمل نرخ کشش 10 درصد با فرکانس 1 هرتز توسط داربست کامپوزیتی، از پارامترهایی بودند که باید بهمنظور شبیهسازی درست ضربان طبیعی قلب و ماتریکس خارج سلولی قلبی رعایت میشدند.

شکل4: تصاویر میکروسکوپ الکترونی داربست ترکیبی PCL/Gelatin=70/30 با پارامترهای مختلف الکتروریسی مشخص شده در جدول1( نمونه های آ-1، آ-2، آ-3، ب-1، ب-2، ب-3) و تصاویر میکروسکوپ الکترونی و درصد توزیع قطری داربست ترکیبی پلی کاپرولاکتون-ژلاتین با درصدهای ترکیبی (ج-1)PCL/Gelatin=60/40، (ج-2) PCL/Gelatin=70/30 و (ج-3) PCL/Gelatin=80/20

شکل 5: ویژگیهای فیزیکی و شیمیایی داربست، (آ) نمودار تنش-کرنش داربست های نانوفیبری ترکیبی و اندازه گیری زاویه تماس در داربست های ترکیبی (ب) PCL/Gelatin=80/20، (ج) PCL/Gelatin=70/30 و (د) PCL/Gelatin=60/40

شکل6: (آ، ب): تصاویر میکروسکوپ الکترونی حاصل از سلول های پروژنیتور قلبی کشت داده شده بر روی داربست نانوفیبری ترکیبی PCL/Gelatin=70/30 در روز چهارم کشت ثابت و (ج): نمودار زنده مانی سلولها بر روی داربست ترکیبی PCL/Gelatin=70/30 در روزهای دوم، چهارم و ششم با واریانس کمتر از 1 درصد، بهعنوان داربست کنترل استفاده گردید (تعداد تکرار=12).

شکل 7: راهاندازی دستگاه اعمال بار مکانیکی، (آ) شماتیک نمای بالا، (ب)تصویر اصلی بیورآکتور و (ج) شماتیک نمای جانبی
بحث
4-1- بررسی تصاویر میکروسکوپ الکترونی حاصل از تغییر پارامترهای الکتروریسی
با بررسی تصاویر میکروسکوپ الکترونی شکل 4 که حاصل از تغییر پارامترهای مختلف الکتروریسی در تهیه داربست ترکیبی PCL/Gelatin=70/30 میباشد، میتوانیم به نتایج زیر دست یابیم:
- با کاهش نرخ تغذیه پلیمر و افزایش فاصله سوزن تا کالکتور، همانطور که در نمونههای (آ-1) و (آ-2) مشخص است، قطر نانوفیبرها به میزان زیادی کاهش پیدا کرده و تا حدی همگون بودن الیاف از دست رفته است.
- با کاهش ولتاژ، همان طور که در نمونه (آ-3) مشخص است، نانوفیبرها تا حد بسیار زیادی بهصورت از هم گسسته و با توزیع قطری ناهمگون بر روی جمع کننده قرار گرفتند و این نشان میدهد که این ولتاژ برای تشکیل مخلوط تیلور در فرآیند الکتروریسی کافی نبوده است (24).
- وقتی از منظر سرعت چرخش ماندرول، به تصاویر نگاه میکنیم، این نتیجه حاصل میگردد که افزایش سرعت چرخش ماندرول وقتی که از حدی بیشتر شده است، نهتنها باعث جهت دار شدن بیشتر نمونه ها نگردیده بلکه باعث پخش شدن پلیمر در اطراف کالکتور شده و همانطور که در نمونه (ب-3) مشخص است، نانوفیبرهایی در خلاف جهت نانوفیبرهای موازی بهصورت ناهمگون بر روی سطح داربست تشکیل شده است. متقابلاً اگر سرعت چرخش ماندرول از حدی کمتر باشد، همانند نمونه (ب-1)، شاهد داربستی با درصد کمی از جهتآرایی خواهیم بود. با توجه به مطالب مذکور، پارامترهای الکتریسی بهکار رفته در تهیه داربست (ب-2)، به عنوان بهترین پارامترهای الکتروریسی جهت ادامه تحقیق انتخاب شدند.
4-2- بررسی توزیع قطری نانوفیبرها با درصدهای ترکیبی مختلف
همان طور که در نمودارها و تصاویر SEM شکل4 مشخص است، با افزایش درصد ژلاتین، ناهمگونی نانوفیبرها افزایش پیدا کرده است (13). علاوه بر همگونی و جهتدار بودن نانوفیبرها، برای دستیابی به بهینهترین درصد ترکیبی لازم بود که داربست¬ها از لحاظ استحکام مکانیکی و میزان چسبندگی سلولی نیز مورد بررسی قرار گیرند.
4-3- بررسی ارزیابی زاویه تماس و استحکام مکانیکی
همانطور که انتظار میرفت، نتایج حاصل از ارزیابی زاویه تماس در شکل 5 نشان داد که با افزایش میزان ژلاتین که یک پلیمر آبدوست است، زاویه تماس کاهش پیدا کرده و بنابراین چسبندگی سلولی افزایش یافته است (13). در ادامه بهمنظور ارزیابی استحکام مکانیکی، داربستها تحت کشش 5 میلیمتر در دقیقه در جهت نانوفیبرهای موازی قرار گرفتند. پس از 5 بار تکرار برای هرنمونه، نتایج بهصورت نمودار تنش-کرنش برای هر یک از نمونهها مورد بررسی قرار گرفت (شکل5-آ). همانطور که در نمودار تنش-کرنش مشخص است، با افزایش درصد PCL، شیب نمودار تنش-کرنش و مدول الاستیسیته افزایش یافته است (31, 13). نقطه شکست در داربست با درصد PCL بیشتر نیز با میزان درصد کشش بیشتری اتفاق میافتد (31) که با توجه به اینکه در این پژوهش، داربست تحت اعمال بار مکانیکی با کشش 10 درصد قرار می گیرد، لذا این موضوع در پیشبرد پژوهش موثر می باشد. نتایج حاصل از آزمون زاویه تماس و استحکام مکانیکی در جدول 2 آورده شده است. در نهایت با بررسی نتایج حاصل از آزمایشهای زاویه تماس و استحکام مکانیکی و همین طور تصاویر SEM، باید بهترین درصد ترکیبی برای داربست تعیین میگردید. با توجه به تصاویر SEM شکل 4 و همینطور دادههای موجود در جدول 2، داربست PCL/Gelatin=70/30 هم از لحاظ همگون بودن نانوفیبرها مناسب بود و هم از لحاظ میزان چسبندگی سلولی و استحکام مکانیکی میتوانست جوابگوی شرایط آزمایش باشد. بنابراین داربست ترکیبی PCL/Gelatin=70/30، با زاویه تماس 47/90 درجه و نقطه شکست با 17% کشش بهعنوان داربست مورد استفاده جهت کشت سلولی دینامیک انتخاب گردید. از آنجاییکه درصد کشش در نظر گرفته شده برای داربست در این پژوهش 10 درصد بود، لذا داربست انتخابی برای انجام تست آماده بود.
جدول 2: مدول یانگ و زاویه تماس داربست های ترکیبی پلی کاپرولاکتون- ژلاتین با درصدهای مختلف

4-4- بررسی نتایج حاصل از اندرکنش سلول با داربست
نتایج حاصل از تست سمیت سلولی MTS، در شکل (6-ج)که در روزهای دوم، چه ارم و ششم بر روی داربست ترکیبی PCL/Gelatin و داربست کنترل PCL به دست آمده است، نشان داد که تعداد سلول های کشت داده شده بر روی داربستها به مرور زمان افزایش پیدا کرده و البته در مقایسه با داربست کنترل، میتوان فهمید که افزودن ژلاتین، باعث افزایش چسبندگی سلولی گردیده است. تصاویر میکروسکوپ الکترونی در روز چهارم از داربست طبق شکل های (6-آ، 6-ب) تهیه گردید که چسبندگی سلول های پروژنیتور قلبی بر روی داربست را در جهت نانوفیبرها نشان می دهد.
4-5- بررسی نتایج حاصل از آزمون عملی دستگاه
با راهاندازی بیورآکتور مطابق شکل 7، مشخص گردید که دستگاه قادر است به درستی با اعمال فرکانس و درصد کشش مناسب، بار مکانیکی را بهطور مستقیم به داربست سوار شده بر روی پایههای استیل وارد کرده و در هر مدت زمانی که مورد نیاز باشد دمای داخل ظرف کشت را ثابت نگه دارد. لذا این سیستم می تواند بمنظور ایجاد محیطی جهت زیست تقلیدی از بافت قلبی در محیط آزمایشگاه مورد استفاده قرار گیرد. برای اطمینان از عملکرد مناسب داربست و بیورآکتور طراحی شده، داربست بر روی پایههای دستگاه سوار شده و بیورآکتور بهمدت 8 روز جهت اعمال بار مکانیکی بهداربست روشن نگه داشته شد. دمای محیط داخل بطری مرتباً توسط سنسور غیرتماسی، اندازه گیری و بر روی LCD نمایش داده میشد. فرکانس یک هرتز (باز و بسته شدن پایه ها با نرخ یک بار در ثانیه) و همین طور نیروی کششی ده درصد (افزایش طول ده درصدی داربست در هنگام باز شدن پایهها از همدیگر) در طی هشت روز چک و کنترل شد. پس از گذشت هشت روز داربست توانسته بود نیروی اعمالی را تحمل کند و کاملاً حالت الاستیک خود را حفظ نماید. با توجه به اینکه مدت زمانی که معمولاً سلولها در آزمیشگاه تحت اعمال بارمکانیکی قرار میگیرند بین 3 تا هفت روز است، لذا سیستم داربست و بیورآکتور طراحی شده در این پژوهش به راحتی میتواند جهت شبیهسازی ضربان در محیط آزمایشگاه و اعمال بار مکانیکی به سلولهای قلبی در آینده مورد استفاده قرار گیرد.
نتیجهگیری
هدف از این آزمایش، ساخت داربست و بیورآکتوری بهمنظور شبیهسازی مناسب ماتریکس خارج سلول قلبی و همینطور شرایط مکانیکی موجود در ماهیچه قلبی در محیط آزمایشگاه بود. تمایز این پژوهش با سایر یافتههای علمی، اعمال بارمکانیکی به داربست دو بعدی و در جهت نانوفیبرهای موازی می باشد که بتواند کاملاً ساختار انتقال بارمکانیکی در قلب را شبیهسازی کند. زیرا ماتریکس خارج سلولی قلبی از لایههای متشکل از نانوفیبرهای موازی تشکیل شده است و ضربان قلبی در جهت نانوفیبرها به سلول ها انتقال داده می شود. با استفاده از داربست الکتروریسی با نانوفیبرهای موازی و با ترکیب 2 پلیمر PCL و ژلاتین توانستیم داربستی با چسبندگی سلولی و استحکام مکانیکی مناسب با توزیع قطری یکنواخت و همگون تولید کنیم که از نظر خواص شیمیایی و فیزیکی تا حدی شبیه به ماتریکس خارج سلولی قلبی باشد. سپس با زیست تقلیدی از عضله قلب که در آن انقباض همزمان قلبی بین سلولها صورت میپذیرد و بار مکانیکی ایجاد شده از طریق Gap Junctionها و در جهت نانوفیرهای موازی انتقال مییابد، دستگاه ضربانساز با توانایی ایجاد کشش 10 درصد با فرکانس 1 هرتز به داربست تعبیه شده بر روی آن، تولید گردید. با استفاده از این دستگاه و کشت سلولهای پروژنیتور قلبی بر روی داربست، میتوان انتظار داشت که ژن های مربوط به همزمان سازی انقباض قلبی به میزان بیشتری در این سلولها بیان گردند و لذا این سلولها به گزینه مناسبی برای پیوند به بافت آسیب دیده قلبی تبدیل گردند. در مراحل بعدی این پژوهش نیز میتوان نتایج را در شرایط درون تنی نیز بررسی نمود و مطمئن شد که آیا این سلولها که برای مدتی در محیط آزمایشگاه شرایط مکانیکی، فیزیکی و شیمیایی مشابه با بافت طبیعی قلب را بررسی کردهاند میتوانند در کنار سلولهای طبیعی قلب قرار گرفته و بهصورت همزمان با آنها، انقباض قلبی را انجام دهند و بتوانند بدون ایجاد آریتمی در قلب جایگزین مناسبی برای سلولهای بافت مرده قلبی باشند و عملکرد قلب را بهبود بخشند یا خیر. یکی از مباحث دیگری که میتوان در آینده در رابطه با این مطالعه انجام داد، بررسی تاثیر تابش مادون قرمز حاصل از سنسور غیرتماسی استفاده شده در سیستم کنترل حرارت پروژه است. همانطور که طبق مطالعات انجام شده در مارچ 2011، محققان دانشگاه Utah موفق به استفاده از تابش مادون قرمز برای تحریک سلول های قلبی موش و سلولهای گوش میانی ماهی Toadfish، از طریق فرستادن این سیگنالها بهمغز شدند (32).
سپاسگزاری
این مطالعه حاصل پایاننامه و با حمایت پژوهشگاه رویان تهران و دانشکده علوم و فنون نوین دانشگاه تهران انجام شده است که از هر دو ارگان صمیمانه سپاسگزاریم.
حامی مالی: حامیان مالی این پژوهش، پژوهشگاه رویان تهران و دانشکده علوم و فنون نوین دانشگاه تهران میباشند.
تعارض در منافع: وجود ندارد.
References:
1- Sidney S, Rosamond WD, Howard VJ, Luepker RV. The “Heart Disease and Stroke Statistics-2013 Update” and the Need for A National Cardiovascular Surveillance System. American Heart Association 2013; 127(1): 21-3.
2- Henderson K, Sligar AD, Le VP, Lee J, Baker AB. Biomechanical Regulation of Mesenchymal Stem Cells For Cardiovascular Tissue Engineering. Advanced Health Care Materials 2017; 6(22): 1700556.
3- Gallagher GL, Jackson CJ, Hunyor SN. Myocardial Extracellular Matrix Remodeling in Ischemic Heart Failure. Front Biosci 2007; 12(1): 1410-9.
4- Remme WJ, Swedberg K. Comprehensive Guidelines for the Diagnosis and Treatment of Chronic Heart Failure Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur J Heart Failure 2002; 4(1):11-22.
5- Chen QZ, Harding SE, Ali NN, Lyon AR, Boccaccini AR. Biomaterials in Cardiac Tissue Engineering: Ten Years of Research Survey. Materials Science and Engineering: R: Reports 2008; 59(1-6):1-37.
6- Jawad H, Ali NN, Lyon AR, Chen QZ, Harding SE, Boccaccini AR. Myocardial Tissue Engineering: A Review. J Tissue Eng Regen Med 2007; 1(5): 327-42.
7- Donato, BB. Addressing the Heart Failure Epidemic: From Mechanical Circulatory Support to Stem Cell Therapy [dissertation]. United States: University of Arizona; 2011.
8- Gaetani R, Doevendans PA, Metz CH, Alblas J, Messina E, Giacomello A, et al. Cardiac Tissue Engineering Using Tissue Printing Technology and Human Cardiac Progenitor Cells. Biomaterials 2012; 33(6): 1782-90.
9- Teo WE, Ramakrishna S. A Review on Electrospinning Design and Nanofibre Assemblies. Nanotechnology 2006; 17(14): R89-106.
10- Gross BC, Erkal JL, Lockwood SY, Chen C, Spence DM. Evaluation of 3D Printing and its Potential Impact on Biotechnology and the Chemical Sci. Anal Chem 2014; 86(7): 3240-53.
11- Wu H, Fan J, Chu CC, Wu J. Electrospinning of Small Diameter 3-D Nanofibrous Tubular Scaffolds with Controllable Nanofiber Orientations for Vascular Grafts. J Materials Science: Materials in Medicine 2010; 21(12): 3207-15.
12- Ayaz HG, Perets A, Ayaz H, Gilroy KD, Govindaraj M, Brookstein D, et al. Textile-Templated Electrospun Anisotropic Scaffolds for Regenerative Cardiac Tissue Engineering. Biomaterials 2014; 35(30): 8540-52.
13- Ghasemi-Mobarakeh L, Prabhakaran MP, Morshed M, Nasr-Esfahani MH, Ramakrishna S. Electrospun Poly (Ɛ-Caprolactone)/Gelatin Nanofibrous Scaffolds For Nerve Tissue Engineering. Biomaterials 2008; 29(34): 4532-9.
14- Khait L, Hecker L, Blan NR, Coyan G, Migneco F, Huang YC, et al. Getting to the Heart of Tissue Engineering. J Cardiovas Trans Res 2008; 1(1): 71-84.
15- Boffito M, Sartori S, Ciardelli G. Polymeric Scaffolds for Cardiac Tissue Engineering: Requirements and Fabrication Technologies. Poly Int 2014; 63(1): 2-11.
16- Ma PX. Biomimetic Materials for Tissue Engineering. Adv Drug Deliv Rev 2008; 60(2):184-98.
17- Vunjak-Novakovic G, Tandon N, Godier A, Maidhof R, Marsano A, Martens TP, et al. Challenges in Cardiac Tissue Engineering. Tissue Engineering Part B: Rev 2010; 16(2):169-87.
18- Tandon N, Cannizzaro C, Chao PH, Maidhof R, Marsano A, Au HT, et al. Electrical Stimulation Systems for Cardiac Tissue Engineering. Nature Protocols 2009; 4(2): 155.
19- Radisic M, Park H, Shing H, Consi T, Schoen FJ, Langer Ret al. Functional Assembly of Engineered Myocardium by Electrical Stimulation of Cardiac Myocytes Cultured on Scaffolds. Proceedings of the National Academy Sci 2004; 101(52): 18129-34.
20- Shimko VF, Claycomb WC. Effect of Mechanical Loading on Three-Dimensional Cultures of Embryonic Stem Cell-Derived Cardiomyocytes. Tissue Engineering Part a 2008; 14(1): 49-58.
21- Mihic A, Li J, Miyagi Y, Gagliardi M, Li SH, Zu J, Weisel RD, Keller G, Li RK. The Effect of Cyclic Stretch on Maturation and 3D Tissue Formation of Human Embryonic Stem Cell-Derived Cardiomyocytes. Biomaterials 2014; 35(9): 2798-808.
22- Friedrich O, Schneidereit D, Nikolaev YA, Nikolova-Krstevski V, Schürmann S, Wirth-Hücking A, et al. Adding Dimension to Cellular Mechanotransduction: Advances in Biomedical Engineering of Multiaxial Cell-Stretch Systems and Their Application to Cardiovascular Biomechanics and Mechano-Signaling. Progress in Biophysics and Molecular Biology 2017; 130: 170-91.
23- Van Der Schueren L, Steyaert I, De Schoenmaker B, De Clerck K. Polycaprolactone/Chitosan Blend Nanofibres Electrospun from an Acetic Acid/Formic Acid Solvent System. Carbohydrate Polymers 2012; 88(4):1221-6.
24- Pham QP, Sharma U, Mikos AG. Electrospinning of Polymeric Nanofibers for Tissue Engineering Applications: A Review. Tissue Engineering 2006; 12(5): 1197-211.
25- Kai D, Prabhakaran MP, Jin G, Ramakrishna S. Guided Orientation of Cardiomyocytes on Electrospun Aligned Nanofibers for Cardiac Tissue Engineering. J Biomedical Materials Res Part B: Applied Biomaterials 2011; 98(2): 379-86.
26- Zimmermann WH, Schneiderbanger K, Schubert P, Didie M, Munzel F, Heubach JF, et al. Tissue Engineering of a Differentiated Cardiac Muscle Construct. Circulation Res 2002; 90(2): 223-30.
27- Zhang T, Wan LQ, Xiong Z, Marsano A, Maidhof R, Park M, et al. Channelled Scaffolds for Engineering Myocardium with Mechanical Stimulation. J Tissue Engineering and Regenerative Medicine 2012; 6(9): 748-56.
28- Yang H, Schmidt LP, Wang Z, Yang X, Shao Y, Borg TK, et al. Dynamic Myofibrillar Remodeling in Live Cardiomyocytes under Static Stretch. Scientific Reports 2016; 6(1):1-2.
29- Radisic M, Park H, Gerecht S, Cannizzaro C, Langer R, Vunjak-Novakovic G. Biomimetic Approach to Cardiac Tissue Engineering. Philosophical Transactions of the Royal Society of London B: Biological Sci 2007; 1484(362): 1357-68.
30- Zimmermann WH, Fink C, Kralisch D, Remmers U, Weil J, Eschenhagen T. Three Dimensional Engineered Heart Tissue from Neonatal Rat Cardiac Myocytes. Biotechnology and Bioengineering 2000; 68(1):106-14.
31- Zheng R, Duan H, Xue J, Liu Y, Feng B, Zhao S, et al. The Influence of Gelatin/PCL Ratio and 3-D Construct Shape of Electrospun Membranes on Cartilage Regeneration. Biomaterials 2014; 35(1): 152-64.
32- Dittami GM, Rajguru SM, Lasher RA, Hitchcock RW, Rabbitt RD. Intracellular Calcium Transients Evoked by Pulsed Infrared Radiation in Neonatal Cardiomyocytes. J Physiology 2011; 589(6): 1295-306.
1- Sidney S, Rosamond WD, Howard VJ, Luepker RV. The “Heart Disease and Stroke Statistics-2013 Update” and the Need for A National Cardiovascular Surveillance System. American Heart Association 2013; 127(1): 21-3.
2- Henderson K, Sligar AD, Le VP, Lee J, Baker AB. Biomechanical Regulation of Mesenchymal Stem Cells For Cardiovascular Tissue Engineering. Advanced Health Care Materials 2017; 6(22): 1700556.
3- Gallagher GL, Jackson CJ, Hunyor SN. Myocardial Extracellular Matrix Remodeling in Ischemic Heart Failure. Front Biosci 2007; 12(1): 1410-9.
4- Remme WJ, Swedberg K. Comprehensive Guidelines for the Diagnosis and Treatment of Chronic Heart Failure Task Force for the Diagnosis and Treatment of Chronic Heart Failure of the European Society of Cardiology. Eur J Heart Failure 2002; 4(1):11-22.
5- Chen QZ, Harding SE, Ali NN, Lyon AR, Boccaccini AR. Biomaterials in Cardiac Tissue Engineering: Ten Years of Research Survey. Materials Science and Engineering: R: Reports 2008; 59(1-6):1-37.
6- Jawad H, Ali NN, Lyon AR, Chen QZ, Harding SE, Boccaccini AR. Myocardial Tissue Engineering: A Review. J Tissue Eng Regen Med 2007; 1(5): 327-42.
7- Donato, BB. Addressing the Heart Failure Epidemic: From Mechanical Circulatory Support to Stem Cell Therapy [dissertation]. United States: University of Arizona; 2011.
8- Gaetani R, Doevendans PA, Metz CH, Alblas J, Messina E, Giacomello A, et al. Cardiac Tissue Engineering Using Tissue Printing Technology and Human Cardiac Progenitor Cells. Biomaterials 2012; 33(6): 1782-90.
9- Teo WE, Ramakrishna S. A Review on Electrospinning Design and Nanofibre Assemblies. Nanotechnology 2006; 17(14): R89-106.
10- Gross BC, Erkal JL, Lockwood SY, Chen C, Spence DM. Evaluation of 3D Printing and its Potential Impact on Biotechnology and the Chemical Sci. Anal Chem 2014; 86(7): 3240-53.
11- Wu H, Fan J, Chu CC, Wu J. Electrospinning of Small Diameter 3-D Nanofibrous Tubular Scaffolds with Controllable Nanofiber Orientations for Vascular Grafts. J Materials Science: Materials in Medicine 2010; 21(12): 3207-15.
12- Ayaz HG, Perets A, Ayaz H, Gilroy KD, Govindaraj M, Brookstein D, et al. Textile-Templated Electrospun Anisotropic Scaffolds for Regenerative Cardiac Tissue Engineering. Biomaterials 2014; 35(30): 8540-52.
13- Ghasemi-Mobarakeh L, Prabhakaran MP, Morshed M, Nasr-Esfahani MH, Ramakrishna S. Electrospun Poly (Ɛ-Caprolactone)/Gelatin Nanofibrous Scaffolds For Nerve Tissue Engineering. Biomaterials 2008; 29(34): 4532-9.
14- Khait L, Hecker L, Blan NR, Coyan G, Migneco F, Huang YC, et al. Getting to the Heart of Tissue Engineering. J Cardiovas Trans Res 2008; 1(1): 71-84.
15- Boffito M, Sartori S, Ciardelli G. Polymeric Scaffolds for Cardiac Tissue Engineering: Requirements and Fabrication Technologies. Poly Int 2014; 63(1): 2-11.
16- Ma PX. Biomimetic Materials for Tissue Engineering. Adv Drug Deliv Rev 2008; 60(2):184-98.
17- Vunjak-Novakovic G, Tandon N, Godier A, Maidhof R, Marsano A, Martens TP, et al. Challenges in Cardiac Tissue Engineering. Tissue Engineering Part B: Rev 2010; 16(2):169-87.
18- Tandon N, Cannizzaro C, Chao PH, Maidhof R, Marsano A, Au HT, et al. Electrical Stimulation Systems for Cardiac Tissue Engineering. Nature Protocols 2009; 4(2): 155.
19- Radisic M, Park H, Shing H, Consi T, Schoen FJ, Langer Ret al. Functional Assembly of Engineered Myocardium by Electrical Stimulation of Cardiac Myocytes Cultured on Scaffolds. Proceedings of the National Academy Sci 2004; 101(52): 18129-34.
20- Shimko VF, Claycomb WC. Effect of Mechanical Loading on Three-Dimensional Cultures of Embryonic Stem Cell-Derived Cardiomyocytes. Tissue Engineering Part a 2008; 14(1): 49-58.
21- Mihic A, Li J, Miyagi Y, Gagliardi M, Li SH, Zu J, Weisel RD, Keller G, Li RK. The Effect of Cyclic Stretch on Maturation and 3D Tissue Formation of Human Embryonic Stem Cell-Derived Cardiomyocytes. Biomaterials 2014; 35(9): 2798-808.
22- Friedrich O, Schneidereit D, Nikolaev YA, Nikolova-Krstevski V, Schürmann S, Wirth-Hücking A, et al. Adding Dimension to Cellular Mechanotransduction: Advances in Biomedical Engineering of Multiaxial Cell-Stretch Systems and Their Application to Cardiovascular Biomechanics and Mechano-Signaling. Progress in Biophysics and Molecular Biology 2017; 130: 170-91.
23- Van Der Schueren L, Steyaert I, De Schoenmaker B, De Clerck K. Polycaprolactone/Chitosan Blend Nanofibres Electrospun from an Acetic Acid/Formic Acid Solvent System. Carbohydrate Polymers 2012; 88(4):1221-6.
24- Pham QP, Sharma U, Mikos AG. Electrospinning of Polymeric Nanofibers for Tissue Engineering Applications: A Review. Tissue Engineering 2006; 12(5): 1197-211.
25- Kai D, Prabhakaran MP, Jin G, Ramakrishna S. Guided Orientation of Cardiomyocytes on Electrospun Aligned Nanofibers for Cardiac Tissue Engineering. J Biomedical Materials Res Part B: Applied Biomaterials 2011; 98(2): 379-86.
26- Zimmermann WH, Schneiderbanger K, Schubert P, Didie M, Munzel F, Heubach JF, et al. Tissue Engineering of a Differentiated Cardiac Muscle Construct. Circulation Res 2002; 90(2): 223-30.
27- Zhang T, Wan LQ, Xiong Z, Marsano A, Maidhof R, Park M, et al. Channelled Scaffolds for Engineering Myocardium with Mechanical Stimulation. J Tissue Engineering and Regenerative Medicine 2012; 6(9): 748-56.
28- Yang H, Schmidt LP, Wang Z, Yang X, Shao Y, Borg TK, et al. Dynamic Myofibrillar Remodeling in Live Cardiomyocytes under Static Stretch. Scientific Reports 2016; 6(1):1-2.
29- Radisic M, Park H, Gerecht S, Cannizzaro C, Langer R, Vunjak-Novakovic G. Biomimetic Approach to Cardiac Tissue Engineering. Philosophical Transactions of the Royal Society of London B: Biological Sci 2007; 1484(362): 1357-68.
30- Zimmermann WH, Fink C, Kralisch D, Remmers U, Weil J, Eschenhagen T. Three Dimensional Engineered Heart Tissue from Neonatal Rat Cardiac Myocytes. Biotechnology and Bioengineering 2000; 68(1):106-14.
31- Zheng R, Duan H, Xue J, Liu Y, Feng B, Zhao S, et al. The Influence of Gelatin/PCL Ratio and 3-D Construct Shape of Electrospun Membranes on Cartilage Regeneration. Biomaterials 2014; 35(1): 152-64.
32- Dittami GM, Rajguru SM, Lasher RA, Hitchcock RW, Rabbitt RD. Intracellular Calcium Transients Evoked by Pulsed Infrared Radiation in Neonatal Cardiomyocytes. J Physiology 2011; 589(6): 1295-306.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




