دوره 29، شماره 3 - ( خرداد 1400 )
جلد 29 شماره 3 صفحات 3619-3611 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Mosadegh Manshadi S, Nadali F, Shams Ardekani M R. Anti-proliferative Effects of Prunus Armeniaca Semen on Acute Leukemia by Regulate of Cell Cycle Progression. JSSU 2021; 29 (3) :3611-3619
URL: http://jssu.ssu.ac.ir/article-1-5208-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5208-fa.html
مصدق منشادی شیوا، نادعلی فاطمه، شمس اردکانی محمدرضا. خاصیت ضد توموری عصاره هسته زردآلو بر لوسمی های حاد از طریق تنظیم چرخه سلولی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (3) :3611-3619
متن کامل [PDF 790 kb]
(1029 دریافت)
| چکیده (HTML) (2657 مشاهده)
متن کامل: (7340 مشاهده)
مقدمه
طبق تعریف امروزی، لوسمی حاد به تکثیر سریع و کلونال سلولهای پروژنیتور لنفوئیدی و میلوئیدی که به ترتیب لنفوبلاست و میلوبلاست اطلاق میشوند، در مغز استخوان اشاره دارد (1). لوسمیهای حاد بر اساس نوع سلول بنیادی درگیر شامل دو گروه بزرگ میباشند: اگر نقص عمدتاً بر بلوغ و تمایز پیشسازهای مشترک میلوئیدی اثر بگذارد لوسمی میلوئیدی حاد و اگر اثر بر پیشسازهای مشترک لنفوئیدی باشد لوسمی از نوع لوسمی لنفوبلاستی حاد است (2). درمان این لوسمیها بهطور مرسوم شامل استفاده از داروهای شیمیدرمانی و آنتیبادیهای منوکلونال است. یک نوع از این داروها، آنالوگهای پورین مثل فلودارابین میباشد که باعث مهار سنتز DNA و ترمیم آن میشود و مسیر آپوپتوزی را فعال میکند. در حال حاضر درمان انتخابی لوسمی پیوند مغز استخوان میباشد (3). گیاهان خانواده rosacea که دارای توزیع گسترده می باشند و بادام تلخ، زردآلو و... را شامل میشوند، دارای یک ترکیب طبیعی به نام آمیگدالین میباشند (4). آمیگدالین دارای اثر ضدتوموری با رسوب دادن مواد کارسینوژن در بدن، کشتن سلولهای سرطانی، مهار منبع تغذیهای سلولهای توموری و مهار رشد سلولهای سرطانی میباشد (5). این ویژگیها آمیگدالین را به یک داروی ضد تومور نویدبخش تبدیل کرده که اگر با داروهای شیمیدرمانی مرسوم ترکیب گردد میتواند اثرات سینرژیک ایفا کند. محققین طی بررسی سرطانهای کولون، پروستات، مثانه، سرویکس، ریه و سینه نشان دادند که آمیگدالین استخراج شده از هسته زردآلو سبب تعویق پیشرفت چرخه سلولی شده و توقف درG0/G1 را افزایش میدهد. قدرت تکثیر سلولها در invitroبهوسیله این ترکیب کاهش مییابد که این امر به غلظت بالایی از این ماده نیاز دارد. همچنین قدرت تهاجمی و مهاجرت سلولها بهوسیله آمیگدالین مهار میشود (6-11 ،4). آمیگدالین مستخرج از هسته زردآلو سبب کاهش بیان ژنهای دخیل در چرخه سلولی و همچنین کاهش سطح mRNA این ژنها در سلولهای سرطان کولون انسانی میگردد (Hae-Jeong Park و همکاران (2005) (6). درمان با این ماده سبب افزایش بیان پروتئینهای پروآپوپتوتیک Bax و کاهش بیان پروتئینهای آنتیآپوپتوتیک Bcl-2 و افزایش فعالیت آنزیم کاسپاز 3 در سلولهای سرطان پروستات میشود (Hyun-Kyung CHANG و همکاران (2006) (7). آمیگدالین حاصل از هسته زردآلو بهصورت وابسته به دوز رشد و تکثیر هر 3 رده سلولی سرطان مثانه را از طریق تعویق پیشرفت چرخه سلولی و توقف درG0/G1 کاهش میدهد (Makarevic J و همکاران2014) (8). حیات سلولهای سرطان سرویکس بهطور چشمگیری بهوسیله این ترکیب مهار میشود که این عمل بهوسیله افزایش بیان پروتئینهای پروآپوپتوتیک Bax و کاهش بیان پروتئین-های آنتیآپوپتوتیک Bcl-2 و افزایش فعالیت آنزیم کاسپاز3 در سلولهای هلا (Hela) صورت میگیرد (Yu Chen و همکاران2013) (4). قدرت تکثیر سلولهای سرطان ریه در invitroبه وسیله آمیگدالین کاهش مییابد که این امر به غلظت بالایی از این ماده نیاز دارد. همچنین قدرت تهاجمی و مهاجرت سلولها بهوسیله آمیگدالین مهار میشود. آمیگدالین نقش بالقوهای در درمان و کاهش متاستاز سلولهای سرطان ریه ایفا میکند (Liyu Qian و همکاران 2015) (10). عصاره آمیگدالین دارای اثر سایتوتوکسیک بر روی گیرندههای استروژن سلولهای سه گانه منفی سرطان سینه میباشد و سبب القای آپوپتوز در این سلولها وکاهش چسبندگی آنها میشود. پس بهطور کلی آمیگدالین کاربرد بالقوهای در کاهش پیشروی سرطان سینه دارد (Hye Min Lee and Aree Moon 2016) (11). بنابراین در این مطالعه تصمیم گرفتیم تا اثرات ضد توموری عصاره هسته زردآلو که حاوی مقادیر زیادی آمیگدالین است را بر ردههای سلولی لوسمی حاد یعنی ALL (Acute Lymphoid Leukemia) و AML (Acute Myeloid Leukemia) و پیشروی چرخه سلولی که تابحال مطالعهای بر روی آنها صورت نگرفته است، سنجیده و مکانیسم القاء این اثرات را دریابیم. باتوجه به اثرات جانبی عدیدهای که داروهای شیمی درمانی برروی سلامت بیمار دارند نتایج حاصل از این پژوهش پس از انجام مطالعات تکمیلی میتواند بهعنوان درمان مکمل یا جایگزین این نوع داروها برای لوسمیها مورد استفاده قرار گیرد.
روش بررسی
رده¬های سلولی NALM-6 و KG-1 از انستیتو پاستور ایران خریداری شد. محیط کشت RPMI1640 حاوی mM 20 بافر HEPES و گلوتاماکس 1% و همچنین پنیسیلین/ استرپتومایسین از شرکت فرانسوی Biosera و سرم جنین گاوی (FBS) از شرکت Gibco آمریکا تهیه شدند. جهت تغلیظ عصارهها از روتاری Heidolph آلمان استفاده شد و جهت بررسی حیات سلولها از MTT و DMSO سیگما آلدریچ آمریکا و دستگاه الایزا ریدر BioTek ELx808 آمریکا استفاده گردید.
کشت سلولی
ردههای سلولی لوسمی لنفوئیدی حاد به نام NALM-6 و لوسمی میلوئیدی حاد به نام KG-1 هر کدام به طور جداگانه در محیط کشت RPMI1640 حاوی mM 20 بافر HEPES و گلوتاماکس 1% و10% سرم جنین گاوی FBS غیرفعال شده با حرارت و µg/ml 100 پنی سیلین/ استرپتومایسین کشت داده شدند. سلول¬های کشت داده شده در انکوباتور ◦C 37 با 5% CO2 و رطوبت 95% رشد داده شده و هر 3-2 روز محیط کشت آنها تعویض شد.
آمادهسازی عصاره
200 گرم از هستههای زردآلوی خریداری شده از بازار پس از خشک شدن با هاون آسیاب شدند. ابتدا پودر دانهها در دکانتور درمجاورت حلال اتردوپترول به مدت 48 ساعت جهت جداسازی روغن قرار گرفتند. بعد از روغن گیری اجازه داده شد تا پودر دانه کاملاً خشک شده و حلال آن تبخیر گردد. سپس 50 گرم از آن جهت تهیه عصاره آبی وزن شد. برای این منظور پودر دانه به مدت30-45 دقیقه در آب ° C 90 خیسانده و سپس با کاغذ صافی صاف شد. جهت تهیه عصاره اتیل استاتی، ml 500 اتیل استات به مابقی پودر دانه در دکانتور افزوده شد. بعد از 48 ساعت حلال خارج گشت و این کار سه بار تکرار شد. این پروسه با متانول60% به منظور تهیه عصاره هیدروالکی تکرار گردید. عصاره حاصل از هر مرحله با کاغذ صافی فیلتر شد و با روتاری در rpm 100 و دمای ° C 40 تغلیظ گشت.
تستMTT
جهت بررسی حیات سلولها از تست MTT استفاده شد. سلولها در پلیت 96 خانه با غلظت104×5 سلول در هر خانه کشت داده شد. هر دو رده سلولی با عصارههای آبی، اتیل استاتی و متانولی در غلظت 0/125 ، 0/5،0/25 و 1 mg/ml به مدت 12،24،36،48 ساعت تیمار شدند. سپس μl 50 MTT به هر خانه پلیت افزوده شد و بعد از 4 ساعت انکوباسیون مایع رویی خارج شده و μl 100 DMSO جهت حل کردن MTT اضافه گردید و به مدت 15 دقیقه انکوبه گشت. سپس جذب نوری توسط دستگاه الایزا ریدر در nm 492 خوانده شد. این تست حداقل 3 بار تکرار شد.
رنگآمیزی دوگانه فلوروسنت با میکروسکوپ فلوروسنت
یکی از روشهای تشخیص آپوپتوز سلولها بر اساس مورفولوژی سلولی، استفاده از میکروسکوپ فلوروسنت و رنگ آمیزی اتیدیوم بروماید. آکریدین اورانج است. برای انجام این تست ابتدا تعداد 105×3 سلول در هر چاهک از پلیت ۶ خانه کاشته شد. بعد از۲۴ ساعت انکوباسیون، سلولها توسط عصاره اتیل استاتی هسته زردآلو که دارای بهترین IC50 در هر دو رده بود تیمار گشته (هر رده سلولی توسط دوز IC50 ویژه خود تیمار شد) و یک خانه به عنوان کنترل خالی گذاشته شد. سلولها به مدت 48 ساعت انکوبه شدند. (زمان اپتیمومی که توسط MTT مشخص شد). پس از انکوباسیون سلولها، سوسپانسیون سلولی به داخل فالکون انتقال و به رسوب سلولی مقدار μl ۴، ترکیبی از دو رنگ اتیدیوم بروماید/آکریدین اورانج با غلظتmg/ml ۱ افزوده و توسط میکروسکوپ فلوروسنت آنالیز صورت گرفت.
آنالیز چرخه سلولی
بهمنظور تجزیه و تحلیل چرخه سلولی، جمعیت سلولهای توموری پس از قرار گرفتن در معرض عصاره اتیل استاتی هسته زردآلو با پروپیدیم یدید رنگآمیزی گردیده، با استفاده ازکیت BD Cycle TEST PLUS DNA و سپس با دستگاه BD FACS Calibur فلوسیتومتری انجام شد. دادهها با استفاده از نرمافزار BD Cell FIT جمعآوری و پیشرفت چرخه سلولی با استفاده از نرم افزار ModFit تجزیه و تحلیل شد. تعداد سلولها در هر مرحله به صورت % گزارش شد.
تجزیه و تحلیل آماری
تمام آزمایشات به صورت دوگانه و با سه بار تکرار انجام شد. IC50 با استفاده از نرم افزار Excel 2013 محاسبه شد و آنالیز چرخه سلولی با استفاده از نرمافزار BD Cell FIT انجام شد. داده¬ها بهصورت میانگینSD± (انحراف معیار) برای تمام آزمایشات بیان شد. جهت یافتن تفاوت¬های چشمگیر بین گروه تست و کنترل از نرم افزار GraphPad Prism 5.0 استفاده گردید. تفاوت آماری چشمگیر به صورت*P<0.05, **P<0.01, ***P<0.001 در مقایسه با کنترل تعریف شد.
ملاحضات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی تهران تأیید شد (کد اخلاق:IR.TUMS.SPH.RCE.1395.1342).
نتایج
محاسبه IC50 عصارههای مختلف هسته زردآلو در تستMTT
تیمار سلولها با عصارههای آبی، هیدروالکلی و اتیل استاتی هسته زردآلو در دوزهای 0/125 ، 0/25، 0/5 و 1 mg/ml به مدت 12،24،36،48 ساعت نشان داد که عصاره اتیل استاتی دارای کمترین IC50 در هر دو رده KG-1 و Nalm-6 در زمان 48 ساعت و بیشترین درصد مهار نسبت به سایر عصارهها می باشد (شکل1). بهطور کلی با افزایش غلظت تمامی عصارهها قابلیت زنده مانی سلولها کمتر شده و عصارهها در غلظت بالاتر اثر مهاری بیشتری از خود نشان میدهند. در تمامی مراحل تست سه بار تکرار شده و دادههای بهدست آمده به صورت Mean±SD بیان شدند (شکل2).
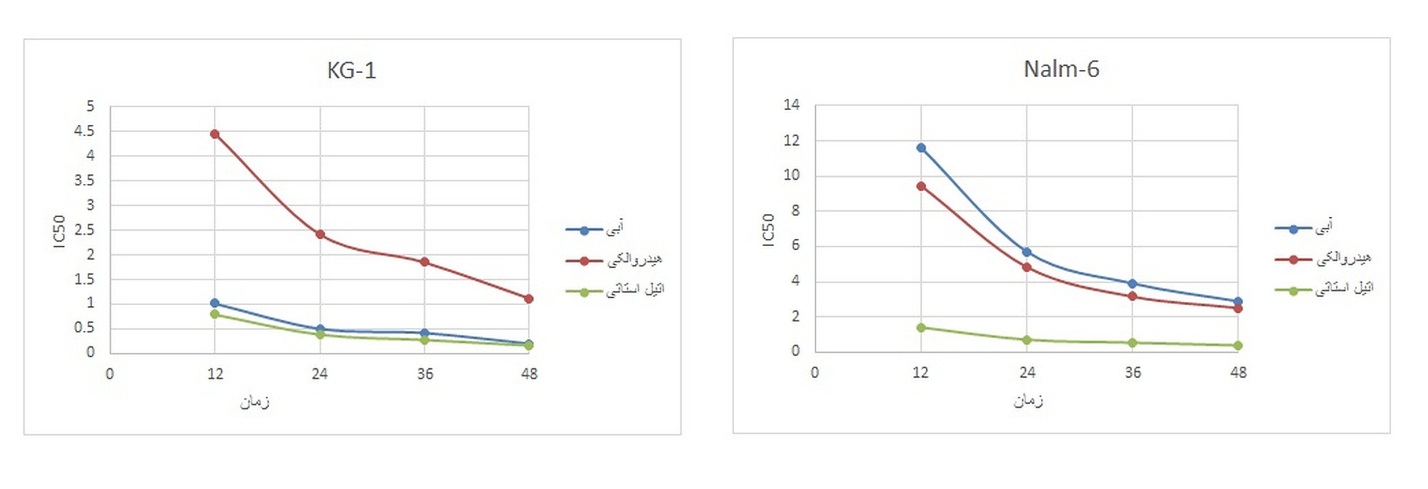
شکل1: میزان IC50 عصارههای آبی، هیدروالکلی و اتیل استاتی برای رده¬های سلولی Kg-1 و Nalm-6 در زمانهای 12 ، 24 ، 36 و 48 ساعت

شکل2: تأثیر عصارههای آبی، هیدروالکلی و اتیل استاتی هسته زردآلو بر زنده مانی ردههای سلولی KG-1 و NALM-6 . آزمایش حداقل سه بار تکرار شد. داده¬ها بیانگر میانگین SD ± (انحراف معیار) از سه آزمایش مستقل که هر کدام بهصورت سه تایی در مقایسه با کنترل انجام شدند، میباشد. NALM-6 (B), KG-1 (A) علامت*** نشانگر p<0.001 در مقایسه با کنترل می باشد.
بررسی آپوپتوز با فلوسیتومتری با رنگ آمیزی دوگانه در ردههای سلولی Nalm6وKg1 با رنگ آمیزی اتیدیم برمید / آکریدین نارنجی و تجزیه و تحلیل با میکروسکوپ فلورسنت
مطالعات میکروسکوپ فلورسنت در حضور کنترل و عصاره اتیل استاتی در غلظت IC50، هر یک از ردههای سلولی با غلظت IC50 عصاره اتیل استاتی مربوط به خود تحت تیمار قرار گرفتند، نشان داد که تمام سلولها در گروه کنترل سبز هستند، به این معنی که سلولها زنده و سالم میباشند. آکریدین نارنجی توسط سلولهای زنده جذب میشود و به DNA سلولها متصل میشود، که کروماتین سلولها به رنگ سبز در زیر میکروسکوپ فلورسنت دیده میشوند. در گروه دیگر که با عصاره اتیل استاتی تیمار شدند، سلولها دچار آپوپتوز شده و به رنگ نارنجی قرمز بودند. اتیدیم برمید فقط در سلولهای مرده جذب میشود و به DNA سلولها متصل میشود و آنها را به رنگ نارنجی قرمز در میآورد. این آزمایش بهمنظور تأیید وجود آپوپتوز در هر دو رده سلولی انجام شد (شکل3).
چرخه سلولی
عصاره اتیل استاتی هسته زردآلو بسته به نوع رده سلولی تومور، پیشرفت چرخه سلولی را تنظیم میکند. به کارگیری عصاره اتیل استاتی در رده سلولی KG-1 تعداد سلولهای G0 / G1 را افزایش داده (P = 0.0151) و تعداد سلولهای G2 / M را کاهش داد (123%=p). در سلولهای رده Nalm-6 تعداد سلول¬های فاز G0 / G1 افزایش یافته است (0114% =P)، اما تعداد سلولهای موجود در فاز G2 / M کاهش یافته است
(P =257% ) (شکل4).
.JPG)
شکل3: نتایج مربوط به میکروسکوپ فلورسنت در رده سلولی Nalm6و Kg1. (A) کنترل. (B) عصاره اتیل استاتی هسته زردآلو
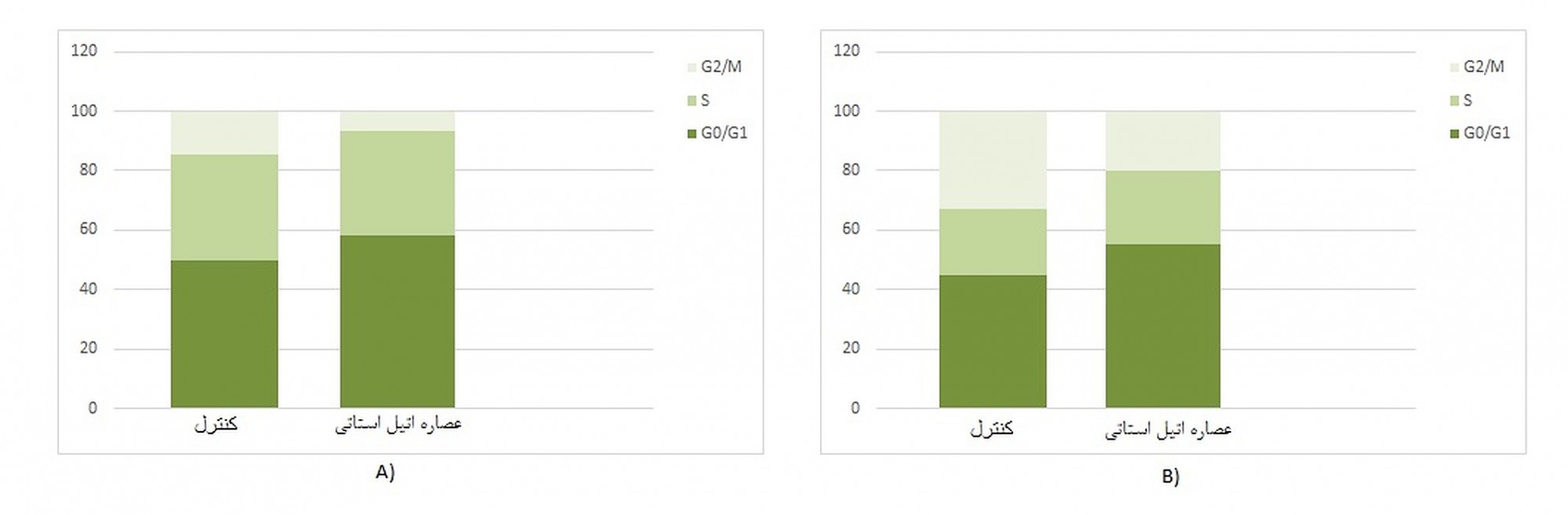
شکل4: آنالیز چرخه سلولی رده¬هایKg-1 وNalm-6 تحت تیمارقرارگرفته با عصاره اتیل استاتی به مدت 48 ساعت (کنترلها بدون تیمار باقی ماندند).
جمعیت سلولی به صورت درصد کل سلول¬های مورد بررسی بیان شده است. یک آزمایش از سه آزمایش انجام شده، نشان داده شده است.
بحث
در مطالعه حاضر، تأثیر عصاره هسته زردآلو بر زندهماندن سلولی و پیشرفت چرخه سلولی در ردههای سلولی لوسمی حاد برای تعیین مکانیسم¬های ضد تکثیری عصاره هسته زردآلو مورد بررسی قرار گرفت. نتایج نشان داد که زندهمانی سلولها در هر دو رده سلولی KG-1 و Nalm-6 به دوز عصاره و نوع سلول وابسته بوده و میزان بقای سلولهای توموری با افزایش دوز عصاره کاهش مییابد. آنالیز آپوپتوز با فلوسیتومتری با رنگآمیزی دوگانه در این رده¬های سلولی که تحت تیمار با عصاره اتیل استاتی هسته زردآلو قرار گرفته بودند، وجود آپوپتوز در هر دو رده سلولی را تأیید میکند. این عصاره پیشرفت چرخه سلولی را بسته به نوع رده سلولی تعدیل میکند و باعث افزایش تعداد سلولهای فازG0 / G1 و کاهش تعداد سلولها در فاز G2 / M میشود. امروزه فعالیتهای دارویی ترکیبات گیاهی باعث افزایش علاقه جامعه علمی به آنها به عنوان ترکیبات ضد توموری شده است (12). بسیاری از گیاهان که با خواص ضد سرطانی شناخته شدهاند، اثرات خود را از طریق القای آپوپتوز و همچنین تقویت سیستم ایمنی بدن ایفا میکنند (13). به عنوان یک گیاه دارویی، اثرات ضد تکثیری خانواده rosaceous که حاوی مقدار زیادی از یک ماده مهم به نام آمیگدالین میباشد در بسیاری از مطالعات نشان داده شده است (7). در سال 2016، Hye Min Lee وAree Moon نشان دادند که آمیگدالین آپوپتوز و چسبندگی را در سلولهای سرطان سینه سهگانه منفی Hs578T تنظیم میکند (11). Makarevic J و همکاران در سال 2014 نشان دادند که آمیگدالین مستخرج از هسته زردآلو باعث القاء آپوپتوز در سلول¬های سرطانی مثانه میشود (8). علاوه بر این در سال 2005 Hae-Jeong Park et al. نشان داد که عصاره هسته زردآلو ژنهای ویژه درگیر در چرخه سلولی در رده سلولی سرطان روده بزرگ را بهصورت منفی تنظیم میکند. در سال 2003 مشخص شد که عصاره هسته زردآلو باعث بروز آپوپتوز در لوسمی پرومیلوسیتیک انسانی (HL-60) میشود (14). در مطالعه حاضر، نتایج MTT نشان داد که با افزایش دوز عصاره بهویژه در عصاره اتیل استاتی، بقای سلولهای توموری کاهش مییابد. همانطور که در سال 2005 ، Park HJ و همکاران گزارش دادند که عصاره هسته زردآلو دارای اثر سیتوتوکسیک وابسته به دوز بر رده سلولی سرطان روده بزرگ انسان (SNU-C4) است (6). آن¬ها همچنین گزارش دادند که تیمارسلولهای لوسمی میلوئید مزمن انسان (رده سلولی K562) با آمیگدالین در غلظتهای مختلف منجر به کاهش میزان زنده مانی سلولها به حالت وابسته به دوز میشود. این یافتهها تأیید میکنند که هسته زردآلو به سبب غنی بودن از آمیگدالین دارای خاصیت ضد تکثیری میباشد (15). در این پژوهش آنالیز آپوپتوز با میکروسکوپ فلورسنت در ردههای سلولی Nalm-6 وKg-1 حضور آپوپتوز را نشان داد. عصاره اتیل استاتی هسته زردآلو در هردو رده سلولی تعداد سلولهای فاز G0 / G1 را افزایش داده و تعداد سلولهای فاز G2 / M را کاهش داد. در سال 2005 Hyun-Kyung Chang و همکاران نشان دادند که عصاره هسته زردآلو باعث القا آپوپتوز درسلول-های سرطانی پروستات میشود (7). Makarevic´ J و همکاران در سال 2014، آپوپتوز رده¬های سلولی سرطان مثانه UMUC-3، TCCSUP و RT-112 تیمار شده با آمیگدالین حاصل از هسته زردآلو در غلظتهای 1، 10، 25 میلیگرم در میلیلیتر را با استفاده از کیت Anexin-V-FITC / PI ارزیابی کردند. آن-ها رابطه وابسته به دوز بین غلظت آمیگدالین و سلولهای آنکسین V مثبت را نشان دادند. تحقیقات آن¬ها نشان داد که بسته به نوع سلول توموری، آمیگدالین پیشرفت چرخه سلولی را تعدیل میکند (8). Hee-Young Kwon و همکاران (2003) نشان دادند که عصاره هسته زردآلو باعث القاء آپوپتوز در سلول¬های لوسمی پرومیلوسیتیک انسانی (HL-60) می شود (14). بنابراین، میتوان نتیجه گرفت که عصاره هسته زردآلو دارای توانایی القاء آپوپتوز و تنظیم چرخه سلولی در رده¬های سلولی سرطانی میباشد. در مطالعات پیشین انجام شده، محققان فقط سلولها را به مدت 24 ساعت تیمار نمودند، در حالیکه ما از زمانهای 12، 24، 36 و 48 ساعت برای تیمار استفاده کردیم. در اکثر این مطالعات بهاستخراج آمیگدالین از هسته زردآلو پرداخته شده و سپس آمیگدالین خالص شده برای تیمار سلولها مورد استفاده قرار گرفت، در حالیکه در این پژوهش، ما از عصاره هسته زردآلو جهت تیمار استفاده نمودیم. در مطالعه حاضر سنجش فعالیت آنزیمی Caspase3 و آنالیز وسترنبلات پروتئینهای Bcl2 و Bax به دلیل عدم دسترسی به کیت و هزینههای بالا انجام نشد.
نتیجهگیری
بهطور کلی، مطالعه in vitro حاضر مشخص کرد که عصاره اتیل استاتی هسته زردآلو میتواند اثرات ضد تکثیری بر روی ردههای سلولی Nalm-6 و Kg-1 از طریق القای آپوپتوز و تنظیم پیشرفت چرخه سلولی داشته باشد. با اینحال، پیشنهاد میشود که مطالعات آینده بر جداسازی ترکیبات مؤثره عصاره اتیل استاتی و ارزیابی مکانیسمهای مولکولی آپوپتوز آنها در ردههای سلولی و نیز حیوانات تمرکز کند.
سپاسگزاری
این مطالعه با حمایت مالی دانشکده پیراپزشکی دانشگاه علوم پزشکی تهران انجام شد. مقاله حاصل از پایاننامه کارشناسی ارشد خانم شیوا مصدق منشادی میباشد.
حامی مالی: دانشکده پیراپزشکی، دانشگاه علوم پزشکی تهران
تعارض در منافع: وجود ندارد.
طبق تعریف امروزی، لوسمی حاد به تکثیر سریع و کلونال سلولهای پروژنیتور لنفوئیدی و میلوئیدی که به ترتیب لنفوبلاست و میلوبلاست اطلاق میشوند، در مغز استخوان اشاره دارد (1). لوسمیهای حاد بر اساس نوع سلول بنیادی درگیر شامل دو گروه بزرگ میباشند: اگر نقص عمدتاً بر بلوغ و تمایز پیشسازهای مشترک میلوئیدی اثر بگذارد لوسمی میلوئیدی حاد و اگر اثر بر پیشسازهای مشترک لنفوئیدی باشد لوسمی از نوع لوسمی لنفوبلاستی حاد است (2). درمان این لوسمیها بهطور مرسوم شامل استفاده از داروهای شیمیدرمانی و آنتیبادیهای منوکلونال است. یک نوع از این داروها، آنالوگهای پورین مثل فلودارابین میباشد که باعث مهار سنتز DNA و ترمیم آن میشود و مسیر آپوپتوزی را فعال میکند. در حال حاضر درمان انتخابی لوسمی پیوند مغز استخوان میباشد (3). گیاهان خانواده rosacea که دارای توزیع گسترده می باشند و بادام تلخ، زردآلو و... را شامل میشوند، دارای یک ترکیب طبیعی به نام آمیگدالین میباشند (4). آمیگدالین دارای اثر ضدتوموری با رسوب دادن مواد کارسینوژن در بدن، کشتن سلولهای سرطانی، مهار منبع تغذیهای سلولهای توموری و مهار رشد سلولهای سرطانی میباشد (5). این ویژگیها آمیگدالین را به یک داروی ضد تومور نویدبخش تبدیل کرده که اگر با داروهای شیمیدرمانی مرسوم ترکیب گردد میتواند اثرات سینرژیک ایفا کند. محققین طی بررسی سرطانهای کولون، پروستات، مثانه، سرویکس، ریه و سینه نشان دادند که آمیگدالین استخراج شده از هسته زردآلو سبب تعویق پیشرفت چرخه سلولی شده و توقف درG0/G1 را افزایش میدهد. قدرت تکثیر سلولها در invitroبهوسیله این ترکیب کاهش مییابد که این امر به غلظت بالایی از این ماده نیاز دارد. همچنین قدرت تهاجمی و مهاجرت سلولها بهوسیله آمیگدالین مهار میشود (6-11 ،4). آمیگدالین مستخرج از هسته زردآلو سبب کاهش بیان ژنهای دخیل در چرخه سلولی و همچنین کاهش سطح mRNA این ژنها در سلولهای سرطان کولون انسانی میگردد (Hae-Jeong Park و همکاران (2005) (6). درمان با این ماده سبب افزایش بیان پروتئینهای پروآپوپتوتیک Bax و کاهش بیان پروتئینهای آنتیآپوپتوتیک Bcl-2 و افزایش فعالیت آنزیم کاسپاز 3 در سلولهای سرطان پروستات میشود (Hyun-Kyung CHANG و همکاران (2006) (7). آمیگدالین حاصل از هسته زردآلو بهصورت وابسته به دوز رشد و تکثیر هر 3 رده سلولی سرطان مثانه را از طریق تعویق پیشرفت چرخه سلولی و توقف درG0/G1 کاهش میدهد (Makarevic J و همکاران2014) (8). حیات سلولهای سرطان سرویکس بهطور چشمگیری بهوسیله این ترکیب مهار میشود که این عمل بهوسیله افزایش بیان پروتئینهای پروآپوپتوتیک Bax و کاهش بیان پروتئین-های آنتیآپوپتوتیک Bcl-2 و افزایش فعالیت آنزیم کاسپاز3 در سلولهای هلا (Hela) صورت میگیرد (Yu Chen و همکاران2013) (4). قدرت تکثیر سلولهای سرطان ریه در invitroبه وسیله آمیگدالین کاهش مییابد که این امر به غلظت بالایی از این ماده نیاز دارد. همچنین قدرت تهاجمی و مهاجرت سلولها بهوسیله آمیگدالین مهار میشود. آمیگدالین نقش بالقوهای در درمان و کاهش متاستاز سلولهای سرطان ریه ایفا میکند (Liyu Qian و همکاران 2015) (10). عصاره آمیگدالین دارای اثر سایتوتوکسیک بر روی گیرندههای استروژن سلولهای سه گانه منفی سرطان سینه میباشد و سبب القای آپوپتوز در این سلولها وکاهش چسبندگی آنها میشود. پس بهطور کلی آمیگدالین کاربرد بالقوهای در کاهش پیشروی سرطان سینه دارد (Hye Min Lee and Aree Moon 2016) (11). بنابراین در این مطالعه تصمیم گرفتیم تا اثرات ضد توموری عصاره هسته زردآلو که حاوی مقادیر زیادی آمیگدالین است را بر ردههای سلولی لوسمی حاد یعنی ALL (Acute Lymphoid Leukemia) و AML (Acute Myeloid Leukemia) و پیشروی چرخه سلولی که تابحال مطالعهای بر روی آنها صورت نگرفته است، سنجیده و مکانیسم القاء این اثرات را دریابیم. باتوجه به اثرات جانبی عدیدهای که داروهای شیمی درمانی برروی سلامت بیمار دارند نتایج حاصل از این پژوهش پس از انجام مطالعات تکمیلی میتواند بهعنوان درمان مکمل یا جایگزین این نوع داروها برای لوسمیها مورد استفاده قرار گیرد.
روش بررسی
رده¬های سلولی NALM-6 و KG-1 از انستیتو پاستور ایران خریداری شد. محیط کشت RPMI1640 حاوی mM 20 بافر HEPES و گلوتاماکس 1% و همچنین پنیسیلین/ استرپتومایسین از شرکت فرانسوی Biosera و سرم جنین گاوی (FBS) از شرکت Gibco آمریکا تهیه شدند. جهت تغلیظ عصارهها از روتاری Heidolph آلمان استفاده شد و جهت بررسی حیات سلولها از MTT و DMSO سیگما آلدریچ آمریکا و دستگاه الایزا ریدر BioTek ELx808 آمریکا استفاده گردید.
کشت سلولی
ردههای سلولی لوسمی لنفوئیدی حاد به نام NALM-6 و لوسمی میلوئیدی حاد به نام KG-1 هر کدام به طور جداگانه در محیط کشت RPMI1640 حاوی mM 20 بافر HEPES و گلوتاماکس 1% و10% سرم جنین گاوی FBS غیرفعال شده با حرارت و µg/ml 100 پنی سیلین/ استرپتومایسین کشت داده شدند. سلول¬های کشت داده شده در انکوباتور ◦C 37 با 5% CO2 و رطوبت 95% رشد داده شده و هر 3-2 روز محیط کشت آنها تعویض شد.
آمادهسازی عصاره
200 گرم از هستههای زردآلوی خریداری شده از بازار پس از خشک شدن با هاون آسیاب شدند. ابتدا پودر دانهها در دکانتور درمجاورت حلال اتردوپترول به مدت 48 ساعت جهت جداسازی روغن قرار گرفتند. بعد از روغن گیری اجازه داده شد تا پودر دانه کاملاً خشک شده و حلال آن تبخیر گردد. سپس 50 گرم از آن جهت تهیه عصاره آبی وزن شد. برای این منظور پودر دانه به مدت30-45 دقیقه در آب ° C 90 خیسانده و سپس با کاغذ صافی صاف شد. جهت تهیه عصاره اتیل استاتی، ml 500 اتیل استات به مابقی پودر دانه در دکانتور افزوده شد. بعد از 48 ساعت حلال خارج گشت و این کار سه بار تکرار شد. این پروسه با متانول60% به منظور تهیه عصاره هیدروالکی تکرار گردید. عصاره حاصل از هر مرحله با کاغذ صافی فیلتر شد و با روتاری در rpm 100 و دمای ° C 40 تغلیظ گشت.
تستMTT
جهت بررسی حیات سلولها از تست MTT استفاده شد. سلولها در پلیت 96 خانه با غلظت104×5 سلول در هر خانه کشت داده شد. هر دو رده سلولی با عصارههای آبی، اتیل استاتی و متانولی در غلظت 0/125 ، 0/5،0/25 و 1 mg/ml به مدت 12،24،36،48 ساعت تیمار شدند. سپس μl 50 MTT به هر خانه پلیت افزوده شد و بعد از 4 ساعت انکوباسیون مایع رویی خارج شده و μl 100 DMSO جهت حل کردن MTT اضافه گردید و به مدت 15 دقیقه انکوبه گشت. سپس جذب نوری توسط دستگاه الایزا ریدر در nm 492 خوانده شد. این تست حداقل 3 بار تکرار شد.
رنگآمیزی دوگانه فلوروسنت با میکروسکوپ فلوروسنت
یکی از روشهای تشخیص آپوپتوز سلولها بر اساس مورفولوژی سلولی، استفاده از میکروسکوپ فلوروسنت و رنگ آمیزی اتیدیوم بروماید. آکریدین اورانج است. برای انجام این تست ابتدا تعداد 105×3 سلول در هر چاهک از پلیت ۶ خانه کاشته شد. بعد از۲۴ ساعت انکوباسیون، سلولها توسط عصاره اتیل استاتی هسته زردآلو که دارای بهترین IC50 در هر دو رده بود تیمار گشته (هر رده سلولی توسط دوز IC50 ویژه خود تیمار شد) و یک خانه به عنوان کنترل خالی گذاشته شد. سلولها به مدت 48 ساعت انکوبه شدند. (زمان اپتیمومی که توسط MTT مشخص شد). پس از انکوباسیون سلولها، سوسپانسیون سلولی به داخل فالکون انتقال و به رسوب سلولی مقدار μl ۴، ترکیبی از دو رنگ اتیدیوم بروماید/آکریدین اورانج با غلظتmg/ml ۱ افزوده و توسط میکروسکوپ فلوروسنت آنالیز صورت گرفت.
آنالیز چرخه سلولی
بهمنظور تجزیه و تحلیل چرخه سلولی، جمعیت سلولهای توموری پس از قرار گرفتن در معرض عصاره اتیل استاتی هسته زردآلو با پروپیدیم یدید رنگآمیزی گردیده، با استفاده ازکیت BD Cycle TEST PLUS DNA و سپس با دستگاه BD FACS Calibur فلوسیتومتری انجام شد. دادهها با استفاده از نرمافزار BD Cell FIT جمعآوری و پیشرفت چرخه سلولی با استفاده از نرم افزار ModFit تجزیه و تحلیل شد. تعداد سلولها در هر مرحله به صورت % گزارش شد.
تجزیه و تحلیل آماری
تمام آزمایشات به صورت دوگانه و با سه بار تکرار انجام شد. IC50 با استفاده از نرم افزار Excel 2013 محاسبه شد و آنالیز چرخه سلولی با استفاده از نرمافزار BD Cell FIT انجام شد. داده¬ها بهصورت میانگینSD± (انحراف معیار) برای تمام آزمایشات بیان شد. جهت یافتن تفاوت¬های چشمگیر بین گروه تست و کنترل از نرم افزار GraphPad Prism 5.0 استفاده گردید. تفاوت آماری چشمگیر به صورت*P<0.05, **P<0.01, ***P<0.001 در مقایسه با کنترل تعریف شد.
ملاحضات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی تهران تأیید شد (کد اخلاق:IR.TUMS.SPH.RCE.1395.1342).
نتایج
محاسبه IC50 عصارههای مختلف هسته زردآلو در تستMTT
تیمار سلولها با عصارههای آبی، هیدروالکلی و اتیل استاتی هسته زردآلو در دوزهای 0/125 ، 0/25، 0/5 و 1 mg/ml به مدت 12،24،36،48 ساعت نشان داد که عصاره اتیل استاتی دارای کمترین IC50 در هر دو رده KG-1 و Nalm-6 در زمان 48 ساعت و بیشترین درصد مهار نسبت به سایر عصارهها می باشد (شکل1). بهطور کلی با افزایش غلظت تمامی عصارهها قابلیت زنده مانی سلولها کمتر شده و عصارهها در غلظت بالاتر اثر مهاری بیشتری از خود نشان میدهند. در تمامی مراحل تست سه بار تکرار شده و دادههای بهدست آمده به صورت Mean±SD بیان شدند (شکل2).

شکل1: میزان IC50 عصارههای آبی، هیدروالکلی و اتیل استاتی برای رده¬های سلولی Kg-1 و Nalm-6 در زمانهای 12 ، 24 ، 36 و 48 ساعت

شکل2: تأثیر عصارههای آبی، هیدروالکلی و اتیل استاتی هسته زردآلو بر زنده مانی ردههای سلولی KG-1 و NALM-6 . آزمایش حداقل سه بار تکرار شد. داده¬ها بیانگر میانگین SD ± (انحراف معیار) از سه آزمایش مستقل که هر کدام بهصورت سه تایی در مقایسه با کنترل انجام شدند، میباشد. NALM-6 (B), KG-1 (A) علامت*** نشانگر p<0.001 در مقایسه با کنترل می باشد.
بررسی آپوپتوز با فلوسیتومتری با رنگ آمیزی دوگانه در ردههای سلولی Nalm6وKg1 با رنگ آمیزی اتیدیم برمید / آکریدین نارنجی و تجزیه و تحلیل با میکروسکوپ فلورسنت
مطالعات میکروسکوپ فلورسنت در حضور کنترل و عصاره اتیل استاتی در غلظت IC50، هر یک از ردههای سلولی با غلظت IC50 عصاره اتیل استاتی مربوط به خود تحت تیمار قرار گرفتند، نشان داد که تمام سلولها در گروه کنترل سبز هستند، به این معنی که سلولها زنده و سالم میباشند. آکریدین نارنجی توسط سلولهای زنده جذب میشود و به DNA سلولها متصل میشود، که کروماتین سلولها به رنگ سبز در زیر میکروسکوپ فلورسنت دیده میشوند. در گروه دیگر که با عصاره اتیل استاتی تیمار شدند، سلولها دچار آپوپتوز شده و به رنگ نارنجی قرمز بودند. اتیدیم برمید فقط در سلولهای مرده جذب میشود و به DNA سلولها متصل میشود و آنها را به رنگ نارنجی قرمز در میآورد. این آزمایش بهمنظور تأیید وجود آپوپتوز در هر دو رده سلولی انجام شد (شکل3).
چرخه سلولی
عصاره اتیل استاتی هسته زردآلو بسته به نوع رده سلولی تومور، پیشرفت چرخه سلولی را تنظیم میکند. به کارگیری عصاره اتیل استاتی در رده سلولی KG-1 تعداد سلولهای G0 / G1 را افزایش داده (P = 0.0151) و تعداد سلولهای G2 / M را کاهش داد (123%=p). در سلولهای رده Nalm-6 تعداد سلول¬های فاز G0 / G1 افزایش یافته است (0114% =P)، اما تعداد سلولهای موجود در فاز G2 / M کاهش یافته است
(P =257% ) (شکل4).
.JPG)
شکل3: نتایج مربوط به میکروسکوپ فلورسنت در رده سلولی Nalm6و Kg1. (A) کنترل. (B) عصاره اتیل استاتی هسته زردآلو

شکل4: آنالیز چرخه سلولی رده¬هایKg-1 وNalm-6 تحت تیمارقرارگرفته با عصاره اتیل استاتی به مدت 48 ساعت (کنترلها بدون تیمار باقی ماندند).
جمعیت سلولی به صورت درصد کل سلول¬های مورد بررسی بیان شده است. یک آزمایش از سه آزمایش انجام شده، نشان داده شده است.
بحث
در مطالعه حاضر، تأثیر عصاره هسته زردآلو بر زندهماندن سلولی و پیشرفت چرخه سلولی در ردههای سلولی لوسمی حاد برای تعیین مکانیسم¬های ضد تکثیری عصاره هسته زردآلو مورد بررسی قرار گرفت. نتایج نشان داد که زندهمانی سلولها در هر دو رده سلولی KG-1 و Nalm-6 به دوز عصاره و نوع سلول وابسته بوده و میزان بقای سلولهای توموری با افزایش دوز عصاره کاهش مییابد. آنالیز آپوپتوز با فلوسیتومتری با رنگآمیزی دوگانه در این رده¬های سلولی که تحت تیمار با عصاره اتیل استاتی هسته زردآلو قرار گرفته بودند، وجود آپوپتوز در هر دو رده سلولی را تأیید میکند. این عصاره پیشرفت چرخه سلولی را بسته به نوع رده سلولی تعدیل میکند و باعث افزایش تعداد سلولهای فازG0 / G1 و کاهش تعداد سلولها در فاز G2 / M میشود. امروزه فعالیتهای دارویی ترکیبات گیاهی باعث افزایش علاقه جامعه علمی به آنها به عنوان ترکیبات ضد توموری شده است (12). بسیاری از گیاهان که با خواص ضد سرطانی شناخته شدهاند، اثرات خود را از طریق القای آپوپتوز و همچنین تقویت سیستم ایمنی بدن ایفا میکنند (13). به عنوان یک گیاه دارویی، اثرات ضد تکثیری خانواده rosaceous که حاوی مقدار زیادی از یک ماده مهم به نام آمیگدالین میباشد در بسیاری از مطالعات نشان داده شده است (7). در سال 2016، Hye Min Lee وAree Moon نشان دادند که آمیگدالین آپوپتوز و چسبندگی را در سلولهای سرطان سینه سهگانه منفی Hs578T تنظیم میکند (11). Makarevic J و همکاران در سال 2014 نشان دادند که آمیگدالین مستخرج از هسته زردآلو باعث القاء آپوپتوز در سلول¬های سرطانی مثانه میشود (8). علاوه بر این در سال 2005 Hae-Jeong Park et al. نشان داد که عصاره هسته زردآلو ژنهای ویژه درگیر در چرخه سلولی در رده سلولی سرطان روده بزرگ را بهصورت منفی تنظیم میکند. در سال 2003 مشخص شد که عصاره هسته زردآلو باعث بروز آپوپتوز در لوسمی پرومیلوسیتیک انسانی (HL-60) میشود (14). در مطالعه حاضر، نتایج MTT نشان داد که با افزایش دوز عصاره بهویژه در عصاره اتیل استاتی، بقای سلولهای توموری کاهش مییابد. همانطور که در سال 2005 ، Park HJ و همکاران گزارش دادند که عصاره هسته زردآلو دارای اثر سیتوتوکسیک وابسته به دوز بر رده سلولی سرطان روده بزرگ انسان (SNU-C4) است (6). آن¬ها همچنین گزارش دادند که تیمارسلولهای لوسمی میلوئید مزمن انسان (رده سلولی K562) با آمیگدالین در غلظتهای مختلف منجر به کاهش میزان زنده مانی سلولها به حالت وابسته به دوز میشود. این یافتهها تأیید میکنند که هسته زردآلو به سبب غنی بودن از آمیگدالین دارای خاصیت ضد تکثیری میباشد (15). در این پژوهش آنالیز آپوپتوز با میکروسکوپ فلورسنت در ردههای سلولی Nalm-6 وKg-1 حضور آپوپتوز را نشان داد. عصاره اتیل استاتی هسته زردآلو در هردو رده سلولی تعداد سلولهای فاز G0 / G1 را افزایش داده و تعداد سلولهای فاز G2 / M را کاهش داد. در سال 2005 Hyun-Kyung Chang و همکاران نشان دادند که عصاره هسته زردآلو باعث القا آپوپتوز درسلول-های سرطانی پروستات میشود (7). Makarevic´ J و همکاران در سال 2014، آپوپتوز رده¬های سلولی سرطان مثانه UMUC-3، TCCSUP و RT-112 تیمار شده با آمیگدالین حاصل از هسته زردآلو در غلظتهای 1، 10، 25 میلیگرم در میلیلیتر را با استفاده از کیت Anexin-V-FITC / PI ارزیابی کردند. آن-ها رابطه وابسته به دوز بین غلظت آمیگدالین و سلولهای آنکسین V مثبت را نشان دادند. تحقیقات آن¬ها نشان داد که بسته به نوع سلول توموری، آمیگدالین پیشرفت چرخه سلولی را تعدیل میکند (8). Hee-Young Kwon و همکاران (2003) نشان دادند که عصاره هسته زردآلو باعث القاء آپوپتوز در سلول¬های لوسمی پرومیلوسیتیک انسانی (HL-60) می شود (14). بنابراین، میتوان نتیجه گرفت که عصاره هسته زردآلو دارای توانایی القاء آپوپتوز و تنظیم چرخه سلولی در رده¬های سلولی سرطانی میباشد. در مطالعات پیشین انجام شده، محققان فقط سلولها را به مدت 24 ساعت تیمار نمودند، در حالیکه ما از زمانهای 12، 24، 36 و 48 ساعت برای تیمار استفاده کردیم. در اکثر این مطالعات بهاستخراج آمیگدالین از هسته زردآلو پرداخته شده و سپس آمیگدالین خالص شده برای تیمار سلولها مورد استفاده قرار گرفت، در حالیکه در این پژوهش، ما از عصاره هسته زردآلو جهت تیمار استفاده نمودیم. در مطالعه حاضر سنجش فعالیت آنزیمی Caspase3 و آنالیز وسترنبلات پروتئینهای Bcl2 و Bax به دلیل عدم دسترسی به کیت و هزینههای بالا انجام نشد.
نتیجهگیری
بهطور کلی، مطالعه in vitro حاضر مشخص کرد که عصاره اتیل استاتی هسته زردآلو میتواند اثرات ضد تکثیری بر روی ردههای سلولی Nalm-6 و Kg-1 از طریق القای آپوپتوز و تنظیم پیشرفت چرخه سلولی داشته باشد. با اینحال، پیشنهاد میشود که مطالعات آینده بر جداسازی ترکیبات مؤثره عصاره اتیل استاتی و ارزیابی مکانیسمهای مولکولی آپوپتوز آنها در ردههای سلولی و نیز حیوانات تمرکز کند.
سپاسگزاری
این مطالعه با حمایت مالی دانشکده پیراپزشکی دانشگاه علوم پزشکی تهران انجام شد. مقاله حاصل از پایاننامه کارشناسی ارشد خانم شیوا مصدق منشادی میباشد.
حامی مالی: دانشکده پیراپزشکی، دانشگاه علوم پزشکی تهران
تعارض در منافع: وجود ندارد.
References:
1- Keohane EM, Smith LJ, Walenga JM. Rodak’s Hematology Clinical Principles and Applications. 5th Ed. Elsevier: Canada 2016: 605
2- Kaushansky K, Litchtman MA, Prchal JT, Levi MW, Press OW, Burns LJ, Caligiuri MA. Williams Hematology. 9th Edn. New York; Mc Graw Hill 2016; 1396: 1528
3- Hoffbrand AV, Moss PA. Hoffbrand’s Essential Haematology. 7th Ed. London: Wiley-Blackwell 2016: 149-53
4- Chen Y, Ma J, Wang F, Hu F, Cui A, Wei CH, et al . Amygdalin Induces Apoptosis in Human Cervical Cancer Cell Line Hela Cells. Immunopharmacol Immunotoxicol 2013; 35(1): 43-51
5- Song Z, Xu X. Advanced Research on Anti-Tumor Effects of Amygdalin. J Cancer Res Ther 2014; 10(5): 3-7.
6- Park HJ, Yoon SH, Han LS, Zheng LT, Jung KH, Uhm YK, et al. Amygdalin Inhibits Genes Related to Cell Cycle in SNU-C4 Human Colon Cancer Cells. World J Gastroenterol 2005; 11(33): 5156-61.
7- Chang HK, Shin MS, Yang HY, Lee JW, Kim YS, Lee MH, et al. Amygdalin Induces Apoptosis through Regulation of Bax and Bcl-2 Expressions in Human DU145 and Lncap Prostate Cancer Cells. Biol Pharm Bull 2006; 29(8):1597-602.
8- Makarević J, Rutz J, Juengel E, Kaulfuss S, Reiter M, Tsaur I, et al. Amygdalin Blocks Bladder Cancer Cell Growth in Vitro By Diminishing Cyclin a and Cdk2. Plos One 2014; 9(8): E105590.
9- Makarević J, Rutz J, Juengel E, Kaulfuss S, Tsaur I, Nelson K, et al. Amygdalin Influences Bladder Cancer Cell Adhesion and Invasion in Vitro. Plos One 2014; 9(10): E110244.
10- Qian L, Xie B, Wang Y, Qian J. Amygdalin-Mediated Inhibition of Non-Small Cell Lung Cancer Cell Invasion in Vitro. International J Clinical and Experimental Pathology 2015; 8(5): 5363.
11- Lee HM, Moon A. Amygdalin Regulates Apoptosis and Adhesion in Hs578T Triple-Negative Breast Cancer Cells. Biomol Ther (Seoul) 2016; 24(1): 62-6.
12- Rahman MM, Khan MA. Anti-Cancer Potential of South Asian Plants. Natural Products and Bioprospecting 2013; 3(3): 74-88.
13- Akerele O. Medicinal Plants and Primary Health Care: An Agenda for Action. Fitoterapia 1988; 59(5): 355-63.
14- Hee-Young K, Seon-Pyo H, Dong-Hoon H, Hee KJ. Apoptosis Induction of Persicae Semen Extract in Human Promyelocytic Leukemia (HL-60) Cells. Archives of Pharmacal Research 2003; 26(2):157-61.
15- Park HJ, Baik HW, Lee SK, Yoon SH, Zheng LT, Yim SV, et al. Amygdalin Modulates Cell Cycle Regulator Genes in Human Chronic Myeloid Leukemia Cells. Mol Cell Toxicol 2006; 2(3):159-65.
1- Keohane EM, Smith LJ, Walenga JM. Rodak’s Hematology Clinical Principles and Applications. 5th Ed. Elsevier: Canada 2016: 605
2- Kaushansky K, Litchtman MA, Prchal JT, Levi MW, Press OW, Burns LJ, Caligiuri MA. Williams Hematology. 9th Edn. New York; Mc Graw Hill 2016; 1396: 1528
3- Hoffbrand AV, Moss PA. Hoffbrand’s Essential Haematology. 7th Ed. London: Wiley-Blackwell 2016: 149-53
4- Chen Y, Ma J, Wang F, Hu F, Cui A, Wei CH, et al . Amygdalin Induces Apoptosis in Human Cervical Cancer Cell Line Hela Cells. Immunopharmacol Immunotoxicol 2013; 35(1): 43-51
5- Song Z, Xu X. Advanced Research on Anti-Tumor Effects of Amygdalin. J Cancer Res Ther 2014; 10(5): 3-7.
6- Park HJ, Yoon SH, Han LS, Zheng LT, Jung KH, Uhm YK, et al. Amygdalin Inhibits Genes Related to Cell Cycle in SNU-C4 Human Colon Cancer Cells. World J Gastroenterol 2005; 11(33): 5156-61.
7- Chang HK, Shin MS, Yang HY, Lee JW, Kim YS, Lee MH, et al. Amygdalin Induces Apoptosis through Regulation of Bax and Bcl-2 Expressions in Human DU145 and Lncap Prostate Cancer Cells. Biol Pharm Bull 2006; 29(8):1597-602.
8- Makarević J, Rutz J, Juengel E, Kaulfuss S, Reiter M, Tsaur I, et al. Amygdalin Blocks Bladder Cancer Cell Growth in Vitro By Diminishing Cyclin a and Cdk2. Plos One 2014; 9(8): E105590.
9- Makarević J, Rutz J, Juengel E, Kaulfuss S, Tsaur I, Nelson K, et al. Amygdalin Influences Bladder Cancer Cell Adhesion and Invasion in Vitro. Plos One 2014; 9(10): E110244.
10- Qian L, Xie B, Wang Y, Qian J. Amygdalin-Mediated Inhibition of Non-Small Cell Lung Cancer Cell Invasion in Vitro. International J Clinical and Experimental Pathology 2015; 8(5): 5363.
11- Lee HM, Moon A. Amygdalin Regulates Apoptosis and Adhesion in Hs578T Triple-Negative Breast Cancer Cells. Biomol Ther (Seoul) 2016; 24(1): 62-6.
12- Rahman MM, Khan MA. Anti-Cancer Potential of South Asian Plants. Natural Products and Bioprospecting 2013; 3(3): 74-88.
13- Akerele O. Medicinal Plants and Primary Health Care: An Agenda for Action. Fitoterapia 1988; 59(5): 355-63.
14- Hee-Young K, Seon-Pyo H, Dong-Hoon H, Hee KJ. Apoptosis Induction of Persicae Semen Extract in Human Promyelocytic Leukemia (HL-60) Cells. Archives of Pharmacal Research 2003; 26(2):157-61.
15- Park HJ, Baik HW, Lee SK, Yoon SH, Zheng LT, Yim SV, et al. Amygdalin Modulates Cell Cycle Regulator Genes in Human Chronic Myeloid Leukemia Cells. Mol Cell Toxicol 2006; 2(3):159-65.
نوع مطالعه: پژوهشي |
موضوع مقاله:
خون و سرطان
دریافت: 1399/5/28 | پذیرش: 1399/8/26 | انتشار: 1400/3/10
دریافت: 1399/5/28 | پذیرش: 1399/8/26 | انتشار: 1400/3/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







