دوره 29، شماره 6 - ( شهریور 1400 )
جلد 29 شماره 6 صفحات 3853-3843 |
برگشت به فهرست نسخه ها
Ethics code: 1393-968
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Hooshyar M, Abedian-Kenari S, Mohammadpour A, Mirmajidi H, Jafari-Sabet M, Ataee R. Evaluation of NOS2 Polymorphism in Gastric Adenocarcinoma Patients in Mazandaran Province. JSSU 2021; 29 (6) :3843-3853
URL: http://jssu.ssu.ac.ir/article-1-5173-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5173-fa.html
هوشیار مهشاد، عابدیان کناری سعید، محمدپور عباس، میرمجیدی حبیبه، جعفری ثابت مجید، عطایی رامین. بررسی پلیمورفیسم ژن "نیتریک اکساید 2 " در افراد مبتلا به سرطان معده در استان مازندران. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (6) :3843-3853
متن کامل [PDF 843 kb]
(902 دریافت)
| چکیده (HTML) (2480 مشاهده)
متن کامل: (1064 مشاهده)
مقدمه
سرطان معده، بعد از سرطان مری دومین سرطان کشنده و چهارمین سرطان شایع در جهان است (1). سرطان معده بیشتر در مردان بالای40 سال شایع بوده و با افزایش سن، خطر ابتلا به این سرطان افزایش مییابد (2). به دلیل پیشآگهی ضعیف و به خاطر بالا بودن نرخ مرگومیر در سراسر جهان، این سرطان کاپیتان مرگ نامیده شده است (3). در ایران برخلاف کشورهای غربی و ژاپن، میزان بروز سرطان معده در طی دو دهه گذشته رو به افزایش بوده است که بهخصوص در نواحی شمال غرب کشور بروز بسیار بالایی دارد؛ در شمال غرب فرم کاردیا و در جنوب، سرطان غیرکاردیایی آن بروز بیشتری دارد. گزارشهای مختلف نشان دادهاند که سرطان معده در ایران در مردان در مرتبه دوم و در کل در رتبه چهارم قرار دارد (5و4) پلیمورفیسمها در جمعیتهای گوناگون با فراوانیهای مختلف و ارتباط یا عدم ارتباط با بیماریهای خاص بروز میکنند. امروزه اهمیت بررسی پلیمورفیسمها وارتباط آنها با بیماریها در تعیین ریسک ابتلا به بیماری بسیار با اهمیت است. بنابراین مطالعه ارتباط یا عدم ارتباط هر پلیمورفیسم در هر جمعیتی، خاص آن میباشد که در صورت داشتن ارتباط میتوان بررسی آن را به عنوان مارکری برای تعیین ریسک ابتلا در نظر گرفت (6). پلیمورفیسم ژنهایی که در پاسخ التهابی دخیل هستند مانند نیتریکاکسیدسنتاز NOS)) در سرطانزایی معده نقش دارند. نیتریکاکسید (NO) در انسان، مولکولی کوچک با عمر کوتاه میباشد که در چندین عملکردهای فیزیولوژی و پروسههای بیولوژیکی نقش دارد از قبیل، اتساع عروق، استراحت عضلۀ صاف، و عملکرد عمومیNO ولی در غلظتهای زیاد محافظت در برابر اثرات رادیکالهای آزاد میباشد و NO و مشتقات آن ممکن است به آسیب DNAمنجر شود (7). آنزیمهای نیتریک اکساید سنتاز (Nitric Oxide Synthase: NOS) اولین بار در سال 1989 شناسایی شدند. سه ایزوفرم اصلی این آنزیم نورونی (neural NOS :nNOS)، القایی inducible NOS :iNOS) )، اندوتلیالی endothelial NOS :eNOS)) در فاصله سالهای 1391تا 1394 کلون و خالص سازی شدند. ایزوفرم های آنزیم NOS محصولات ژنهای مختلف هستند و محل بروز ، تنظیم و خصوصیات متفاوتی دارند. ساختار ژنهایNOS مشابه است و از یک ژن اجدادی مشترک مشتق شدهاند. (nNOS) NOS-I اولین بار در بافت عصبی یافت شد و متصل به غشای سلولی است. iNOS) NOS-II ) در سیتوپلاسم برخی از سلولها و بافتها یافت میشود و در پاسخهای ایمنی و التهابی نقش دارد eNOS) NOS-III) اولین بار در سلولهای اندوتلیال عروق یافت شد؛ متصل به غشای سلولی است و باعث انبساط عروق میشود و در تنظیم فشار خون نقش دارد. نیتریک اکساید (Nitric Oxide :NO) در پاسخهای التهابی که توسط محصولات میکروبی و برهم کنش های خودایمنی آغاز میشود، آزاد میشود و نقش آن در ایمنی غیراختصاصی ثابت شده است (10-8). با توجه به گسترش سرطان معده در شمال کشور و با توجه به اینکه آنزیم NOS-II در پروسههای التهابی نقش دارد وآدنوکارسینوما معده نیز یک پروسه التهابی است و از آنجا که مطالعه جامعی در خصوص پلیمورفیسم این ژن و ارتباط آن با این کانسر انجام نشده است این مطالعه به بررسی ارتباط پلیمورفیسم این ژن بین جمعیت مبتلا به ادنوکارسینوما معده و جمعیت سالم میپردازد.
روش بررسی
در این مطالعه مورد شاهدی، case-control، با هدف تعیین اثر پلیمورفیسم NOS2در آدنوکارسینوم معده از 93 فرد مبتلا به آدنوکارسینوم معده بر اساس نتایج اندوسکوپی و پاتولوژی و تایید فوق تخصص گوارش 93 فرد سالم از همراهان بیماران (زن یا مرد) بهصورت تصادفی انتخاب که در دامنه سنی 30 تا 70 سال بوده و پس از کسب رضایت آگاهانه CC5 خون محیطی گرفته شد و به منظور جلوگیری از لخته شدن در ونوجکتهای حاوی EDTA ذخیره شد. جمعآوری نمونهها و بررسی آنها طبق پروتکل اخلاقی مصوب دانشگاه علوم پزشکی مازندران با کد 968 انجام یافته است. جهت تعیین حجم نمونه برای مطالعه مورد شاهدی از معادله زیر استفاده شده است که برای مقایسه میانگین دو گروه با پیش فرض سطح اطمینان 95% و توان 80% این معادله پیشنهاد شده است که با حداقل تعداد انتخاب شده مطابقت دارد.
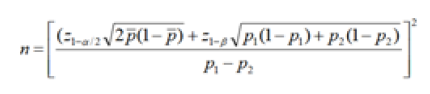
استخراج DNA به روش رسوب دهی با نمک:Salting out)): برای استخراجDNA از کیت استخراج TAKARA(DNA Extraction)(Japan) استفاده شده که برای این منظور 1 سیسی خون بیمار و فرد سالم حاوی EDTA درون میکروتیوب 1/5 سیسی منتقل و با بافر لیزکننده ɪ پر شد و به مدت 15 دقیقه در یخچال قرار داده شد این عمل باعث لیز گلبولهای قرمز میشود سپس به مدت 4 دقیقه در دور 6000 سانتریفیوژ شد. بعد از اتمام سانتریفیوژ محلول رویی، که شامل گلبولهای قرمز است دور ریخته شد. و عمل فوق روی رسوب باقی مانده، 5 بار تکرار شد تا در نهایت رسوب صورتی رنگ متمایل به سفید مشاهده شد. سپس 500 میکرولیتر از بافر لیز کنندهII به رسوب حاصله از مرحله قبل اضافه گشت و به آرامی به رسوب ضربه وارد شد تا کاملاً حل شود. سپس به مدت 50 دقیقه در بن ماری، در دمای 50 درجه سانتیگراد قرار گرفت. این بافر وظیفه لیزکردن غشای گلبول سفید و غشای هسته را داراست. میکروتیوبها از بن ماری به دمای اتاق منتقل شد و 300 میکرولیتر از پرکلرات سدیم به هر میکروتیوب افزوده شد تا پروتئینها دناتوره و جدا شوند و به صورت توده قهوهای رنگی، تجمع پیدا کنند. سپس محلول با دور 12000 دور به مدت 10 دقیقه سانتریفیوژ گردید که لایه رویی که حاوی DNA است برداشته و به میکروتیوب جدید منتقل شد 70 میکرولیتر از اتانول 96% سرد به آن اضافه و چند بار تکان داده شد. با دور 12000 به مدت 10 دقیقه سانتریفیوژ گردید تا DNA رسوب بدهد. بعد از اتمام سانتریفیوژ محلول رویی دورریخته شد و به رسوب باقی مانده، 200میکرولیتر اتانول 70% افزوده شد تا چنانچه نمک بر روی کلاف DNA وجود داشته باشد، در فاز آبی حل شود. سپس با دور 12000 به مدت 10 دقیقه سانتریفیوژگردید و در انتها محلول رویی دور ریخته شد. میکروتیوبهای حاوی رسوب DNA در دمای اتاق قرار داده شد تا خشک شود و شکل کریستالی پیدا کند سپس 80 میکرولیتر آب مقطر استریل، به هر کدام از میکروتیوبها افزوده و درب محصول با پارافیلم بسته شد. سپس درفریزر در دمای 20- درجه سانتیگراد نگهداری شد.
تعیین غلظت DNAاستخراج شده: پس از کالیبره کردن دستگاه بیوفتومتر ، 2 میکرولیتراز نمونه DNA را در روی لنز ریخته و میزان جذب، در طول موج nm260 و nm280 خوانده شد. نسبت جذب nm260 به nm280 بین 1/5 تا 2 به دست آمد که یعنی نمونهها دارای خلوص مناسبی بود.
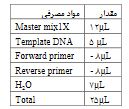
PCR-RFLP: برای تکثیر و تخلیص DNAاز کیت AccuPrep® PCR Purification Kit شرکتBioneer آلمان استفاده شد که در طی 37 چرخه که هر چرخه شامل مراحل دناتوراسیون در دمای 94 درجه در 5 دقیقه ، مرحله اتصال دردمای 94 درجه به مدت 30 ثانیه و مرحله بسط در دمای 64/5 درجه30 ثانیه و مرحله بسط نهایی زنجیره با دمای 72 درجه30 ثانیه انجام شد. دناتوراسیون (مرحله اولیه در دمای 72 درجه برای 10 دقیقه انجام شد) محصولات PCR با آنزیم محدود کننده Hin1I (BSaH) در دمای 37 درجه سانتیگراد طی 24 ساعت هضم شد در صورت حضور C در نوکلئوتید که مطابق NOS2 است محصولPCR با طولbp 436 به دو قطعه با طول bp 258 و bp 178 شکسته شد. محصولات PCR در ژل آگارز 1/5 درصد اجرا شدند و با اتیدیوم برماید قابل تشخیص شدند. در جدول 1 مواد مصرفی برای واکنش PCR و در جدول 2 مشخصات پرایمرها نشان داد که با مراجعه به سایتNBCI و نرم افزارهای مربوطه طراحی و توسط شرکت تکاپوزیست تهیه شد.
تجزیه و تحلیل آماری
در این تحقیق بررسیهای آماری با استفاده از نرمافزار MedCalc (12.1.40 V) انجام شد. آزمونهای آماری (X2) Chi-square وآزمون(OR) odds Ratio انجام گرفت و همچنین پارامترهایی مانند onfidence Interval (CI) ,P-value تعیین شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی مازندران تایید شده است (کد اخلاق 968-1393)
نتایج
در این مطالعه مورد- شاهدی تعداد 93 فرد بیمار مبتلا به سرطان معده و 93 فرد سالم از نظر پلی مورفیسم در ژن NOS2 مورد بررسی قرار گرفتند. آنالیز آماری اختلاف معنیداری را در دو گروه بیمار و کنترل نشان داد(جدول 3،4) در مجموع از میان 93 فرد کنترل 36نفر (38/7%) دارای ژنوتیپ TT، 32 نفر(34/4%) دارای ژنوتیپ CT و 25 نفر (26/4%)دارای ژنوتیپ CC بودند. در میان 111 فرد بیمار 14 نفر (12/61%) دارای ژنوتیپ TT، 57 نفر (51/35%) دارای ژنوتیپ CT و 40 نفر (36%) دارای ژنوتیپ CC بودند.P=0/0001)، Chi-Square ( )=18/722)، میتوان گفت تفاوت معنیداری در توزیع ژنوتیپی پلیمورفیسم مورد نظر ژن NOS2 بین دو گروه کنترل و بیمار وجود داشت بدین صورت که فراوانی ژنوتایپ TT در گروه بیمار نسبت به کنترل بهطور معنی دار کاهش یافت و همچنین ژنوتایپ CT در گروه بیمار نسبت به کنترل افزایش معنیداری داشته و همچنین در مورد ژنوتایپ CC در گروه بیمار نسبت به کنترل افزایشوجود داشته است (جدول 3،4) بنابراین برای بررسی ارتباط تک تک ژنوتیپها با بیماری آدنوکارسینوما از آزمون OR)) Odds-Ratio با کمک برنامه نرمافزاری MedCalc (12.1.40 V) استفاده گردید. در شکل 1 تصویر ژل آگارز حاصل از RFLP آورده شده است. به ترتیب ردیف 1 لدر و4،3،2 ژنوتیپ،CC ، TT و CT میباشند. این بررسی نشان میدهد که در سطح معنیداری P= 0/0004 CI(1/37 3/03) 95% ,OR= 2/04
تعداد آلل C با نسبت شانس همبستگی مستقیمی دارد به عبارتی افزایش تعداد آلل C در ژنوتایب منجر به افزایش شانس سرطان می شود.
جدول 1: مواد مصرفی برای واکنش PCR
جدول2: مشخصات پرایمرهای مورد استفاده

جدول 3: بررسی میزان تاثیر ژنوتیپها در شانس بیماری آدنوکارسینوما حالت اول: TT(Ref)

جدول 4: بررسی میزان تاثیر ژنوتیپها در بروز بیماری آدنوکارسینوما حالت دوم: TT+CT(Ref)

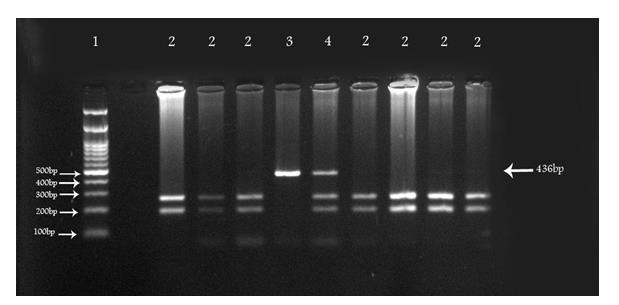
شکل 1: تصویر ژل آگارز حاصل از RFLP:. به ترتیب ردیف 1 لدر و4،3،2 ژنوتیپ ،CC ،TT وCT میباشند.
بحث
در حال حاضر سرطان معده، یکی از شایعترین سرطانها و دومین دلیل مرگ و میر ناشی از سرطان در جهان میباشد. به دلیل پیشآگاهی ضعیف، این سرطان در مراحل پیشرفته تشخیص داده میشود و همچنین به دلیل ناکارآمدی درمانهای متداول، اکثر بیماران حتی پس از جراحی، دارای بقاء پنج ساله پایینی بوده و فوت میکنند (11). تولید iNOS توسط LPS، IFN-γ (Interferon-γ)،TNF- α (TumorNecrosis Factor- α)، PAF (Platelet – activatingFactor)، GM-CSF (Stimulating Factor (Granulocyte Monocyte – Colony، IL-1 (Interleukin-1) و IL-6 فرا تنظیم میشود (12). آنزیم iNOS و mRNA مربوط به آن بسیار پایدار میباشند و به همین دلیل قادر به تولید مقادیر زیاد NOدر طی چندین روز میباشند که منجر به تولید میزان زیادی از گونههای فعال نیتروژن اکسید(Reactive Nitrogen Oxide Species =RNOS میگردد، که واسطه طیف گستردهای از تأثیرات فیزیولوژیک و پاتوفیزیولوژیک میباشد (13). نیتریک اکسید (NO) یک رادیکال آزاد بسیارفعال بوده که نشان داده شده است دارای عملکردهای مختلف بیولوژیک می باشد. NO از ال-آرژینین به وسیله خانوادهای از ایزوآنزیمها موسوم به نیتریک اکسید سنتاز ((NOS و در حضور اکسیژن تولید میشود که تولید ال – سیترولین و NO نموده که به تنظیم سطح طبیعی NO در بدن کمک مینماید (14،15). NOS از دسته اکسیدوردوکتازها بوده که با عمل بر روی یک جفت دهنده (که در این واکنش شامل اکسیژن مولکولی و NADPH میباشند) و از طریق اتصال و یا احیای اکسیژن ملکولی، واکنش خود را به انجام میرساند. این واکنش به کوفاکتورهای مختلفی از قبیل NADPH،FMN ،FAD ، تتراهیدروبیوپترین، کلسیم، کالمودولین، (Calmodulin) و اکسیژن مولکولی نیاز دارد (16،17). NOS دارای سه ایزوفرم بوده که توسط ژنهای متفاوتی بیان میشوند .ایزوفرم بافت عصبی (nNOS) و ایزوفرم اندوتلیال عروق (eNOS) که هردو وابسته به یون کلسیم و کالمودولین بوده، ایزوفرم سوم که غیر وابسته به کلسیم و کالمودولین بوده ، قابل القا ء (iNOS) میباشد (16). علی رغم اثرات مفیدNO ، تولید بیش از حدNO به علت تولید گونههای اکسیژن فعال (ROS)، نیتروژن فعال (RNS) و نیتروزیلاسیون پروتئینها، دارای اثرات سمی میباشد (18). NOقادر به عبور از غشای سلولی و طی مسافت های طولانی بوده، از این رو، باید تولید آن تحت کنترل باشد (19). نیتریکاکسیدسنتتاز القایی (iNOS) توسط ژن نیتریکاکسیدسنتتاز2 (NOS2) در تعدادی از انواع سلول بعد از تحریک به واسطه سایتوکینهای التهابی و ایمنی و همچنین رادیکالهای تولید شده در مراحل اولیۀ آپاپتوزیس و نکروز لیپویلیساکارید (LPS)بیان میشود. بنابراین پلیمورفیسم ژنهایی که در پاسخ التهابی دخیل هستند مانند نیتریک اکسید سنتتاز NOS)) در سرطانزایی معده نقش دارند (20،21). طبق مطالعهای درسال 2010 توسط یو و همکاران ارتباط پلیمورفیسم بین NOS2 و BPH مورد بررسی قرار گرفت و سه نوع SNP در ژن NOS2 که شاملT/C 278 - که در پروموتر قرار دارد و 10459953 rs (5′ UTR ) و اگزون 16 (تبدیل لوسین به سرین) با روش PCR-RLFP مورد بررسی قرار گرفت و مشاهده کردند که تنها SNP در s10459953 rsدر ارتباط با BPH است (22). در سال 2005 توسط فرانسن و همکاران افزایش بیان آنزیم NOS2 در سرطان رودۀ بزرگ مشاهده شده است در نتیجه بررسی پلیمورفیسم در پروموتور NOS2ممکن است در توسعه و پیشرفت سرطان رودۀ بزرگ نقش داشته باشد و با استفاده از روش PCR- RLFPنتیجه گرفتند که پلیمورفیسم در پروموتور NOS2 اثر محدود در شروع یا پیشرفت سرطان رودۀ بزرگ دارد (23). در سال 2011 توسط ریک و همکاران پلیمورفیسم Ser608Leuدر نیتریکاکسیدسنتتاز القایی و ژنوتیپها با ترکیبی از اطلاعات مربوط به مرحلۀ تومور، درجه، مرحلۀ پیشرفت، در بیماران مبتلا به سرطان مثانه بواسطۀ تعیین توالی مورد بررسی قرار گرفت و نشان داده شد که برای پلیمورفیسم Ser608Leu، هموزیگوت TT خطر ابتلا به سرطان معده را سه برابر بیشتر میکند و تهاجم این بیماری را نیز تحت تاثیر قرار میدهد (24). در سال 2009 توسط لی و همکاران بررسی ارتباط سرطان پروستات با ژنNOS2A در جایگاه2892T> C،Ex16 +14C>T G>A ,IVS16+88T>G524 +IVS20 و ژن NOS3 درIVS15 62G>T ،C>T43 - 7Ex،A>G26 - IVS7،G>T63 -8 Ex،762C>T -IVS1 نشان داد که درGT/TT ,NOS288 +IVS16 که با افزایش خطر سرطان پروستات و G>A524+IVS20 با کاهش خطر سرطان پروستات همراه است. و درNOS3،IVS7-26GG با افزایش خطر سرطان در ارتباط است، و همۀ اینSNPها ارتباط معنیداری با سرطان تهاجمی دارند (مرحلۀIII–IV) ولی با سرطان غیر تهاجمی ارتباط معنیداری وجود ندارد. نتایج آنها نشان داد که پلیمورفیسم ژن NOS از عوامل مهم ژنتیکی برای سرطان مهاجم پروستات میباشد (25). در سال 2010 توسط جورج و همکاران بررسی پلیمورفیسم این ژن درنقاط اگزون 16 (تبدیل سرین به لوسین در جایگاه 608) و G/C954- و C/T1173- که هر دو در پروموتور قرار دارند با روش PCR-RLFP مورد بررسی قرار گرفته و در جمعیت مورد مطالعه، مشاهده شد که SNP در جایگاههای 954- (اگزون 16) و1173- (پروموتور) مشاهده نشد. بنابراین هیچ ارتباطی با گاستریت وسرطان معده ندارند. ولی جهشی را در جایگاه G/C954- مشاهده کردند که ارتباط معنیداری با سرطان معده همراه با مصرف الکل و دخانیات دارد و این اولین گزارش از افزایش خطر مبتلا به سرطان معده در این جایگاه میباشد (26). در سال 2006 گوتو و همکاران در بررسی دیگر با روشPCR-RLFP نشان دادند که پلیمورفیسم ژن نیتریک اکسید القایی(iNOS) در موقعیت C150T در آتروفی معده و سرولوژی هلیکوباکتر هیچ وابستگی وجود ندارد، اما پلیمورفیسم در این جایگاه، در سرطان معده که مرتبط به هلیکوباکتر پیلوری است مشاهده شده است و ارتباط معنیداری با آن دارد (27). در سال 2011 توسط ژانگ و همکاران مطالعهای در رابطه با افراد مبتلا به سرطان ریه (NSCLC) که بهوسیلۀ شیمیدرمانی و رادیو تراپی تحت درمان بودند، بین سالهای 2011 - 2009 و آنالیزهای ژنوتیپ 36 تاSNP (21 مورد در NOS2A، 14 مورد در NOS3) در هر فرد بیمار به وسیلۀ استفاده از سیستم Sequenom Mass Array انجام شد و نتایج حاصل نشان داد که تغییرات ژنتیکی در ژن NOS2A و NOS3 در بیماران NSCLC در پاسخ آنها به درمان رایو درمانی و شیمی درمانی تحت تاثیر قرار نمیدهد (28). التهاب مزمن، یک عامل خطر برای سرطان رودۀ بزرگ است و در سال 2005 دیکن و همکاران SNP در ژنهای التهابی از جمله جایگاه +524T>C در NOS2A مورد بررسی قرار دادند و به این نتیجه رسیدند که هیچ ارتباط معنیداری بین SNP مورد بررسی و سرطان رودۀ بزرگ وجود ندارد (29). درسال 2007 توسط کایس و همکاران پلیمورفیسم در پروموتور iNOS (تکرار پلیمورفیسمCCTTT و-2445 C-->G SNP ) و ارتباط آن با سطح بیان mRNA نیتریک اکسید سنتتاز القایی در موکوس معده و خطر ابتلا به سرطان معده مورد بررسی قرار گرفت. نتایج حاصل از آنالیز رگرسیون چند متغیره نشان داد که تکرار طولانی CCTTT نسبت به تکرار کوتاه باعث افزایش خطر ابتلا به سرطان معده میشود، اما ارتباطی بین SNPدر -2445 C-->G و سرطان معده نشان داده نشد (30). در مطالعهای در سال 2015 بیان شد که در بسیاری از تومورها بیان iNOS زیاد است اما نقش iNOS در طی رشد و توسعه تومور متفاوت است که در برخی مواقع تشدید و در برخی مواقع مهار فعالیت آن گزارش شده است (31). در مطالعهای در سال 2018 توسط Avtandilyan N به بررسیNOS و آرژینین در کانسر پستان پرداخته شد و نتایج نشان که سطح فعالیت آرژیناز وNO و فعالیت NOS و مقادیر پلی آمینها به موازات گسترش کانسر افزایش مییابد و بعد از کموتراپی نئوادجوانت کاهش مییابد و پیشنهاد شده که مهارNOS اثرات آنتی تومور دارد و باعث کاهش پرولیفراسیون سلولی، متاستازو آنژیوژنزیس میگردد (32). در سال 2008 توسط عبد نیکفرجام و همکاران مطالعهای در رابطه با پلیمورفیسم ژن NOS2A و بیماری آرتریت روماتوئید انجام گرفت که ارتباط معنیداری با پلیمورفیسم این ژن نداشت (12). شماره رفرنس در جلوی اسامی آورده شود و رفرنس در انتهای متن ذکر گردد صورت گرفت ارتباط معنیداری با پلیمورفیسم این ژن نداشتند و نتایج ناهمسو با مطالعه حاضربودند.
نتیجهگیری
این پژوهش نشان داد که پلی مورفیسم نیتریک اکساید سنتاز 2 با افزایش شانس سرطان معده در گروه بیمار نسبت به کنترل در ارتباط میباشد و در توزیع ژنوتیپی پلیمورفیسم مورد نظر ژن NOS2 بین دو گروه کنترل و بیمار وجود دارد و پس از بررسی ارتباط تک تک ژنوتیپها با بیماری آدنوکارسینوما مشخص شد که تعداد آلل C با نسبت شانس سرطان همبستگی مستقیمی دارد به عبارتی افزایش تعداد آلل C در ژنوتایب منجر به افزایش نسبت شانس بیماری سرطان در گروه بیمار نسبت به کنترل میشود. با توجه به نتایج حاصل از این مطالعه پیشنهاد میشود که پلی مورفیسم ژن نیتریک اکسید سنتاز 2 ممکن است یک مارکر مفید در تعیین حساسیت ژنتیکی به سرطان معده باشد. محدودیتهای مطالعه و پیشنهادات
از محدودیتهای مطالعه تعداد بیماران و افراد کنترل بوده است که در بازه زمانی محدود تعداد قابل قبول که کاملاً براساس حجم نمونه محاسبه شده باشد ممکن نبوده است. برای تکمیل مطالعه پیشنهاد میشود در حجم بالاتر از نمونه ارتباط این پلیمورفیسم با دادههای دموگرافیک از جمله سن و جنس و گرید تومور برررسی شود.
سپاسگزاری
این مطالعه حاصل پایاننامه دانشجوی داروسازی خانم مهشاد هوشیار میباشد
حامی مالی: معاونت تحقیقات و فنآوری دانشگاه علوم پزشکی مازندران
تعارض در منافع: وجود ندارد.
سرطان معده، بعد از سرطان مری دومین سرطان کشنده و چهارمین سرطان شایع در جهان است (1). سرطان معده بیشتر در مردان بالای40 سال شایع بوده و با افزایش سن، خطر ابتلا به این سرطان افزایش مییابد (2). به دلیل پیشآگهی ضعیف و به خاطر بالا بودن نرخ مرگومیر در سراسر جهان، این سرطان کاپیتان مرگ نامیده شده است (3). در ایران برخلاف کشورهای غربی و ژاپن، میزان بروز سرطان معده در طی دو دهه گذشته رو به افزایش بوده است که بهخصوص در نواحی شمال غرب کشور بروز بسیار بالایی دارد؛ در شمال غرب فرم کاردیا و در جنوب، سرطان غیرکاردیایی آن بروز بیشتری دارد. گزارشهای مختلف نشان دادهاند که سرطان معده در ایران در مردان در مرتبه دوم و در کل در رتبه چهارم قرار دارد (5و4) پلیمورفیسمها در جمعیتهای گوناگون با فراوانیهای مختلف و ارتباط یا عدم ارتباط با بیماریهای خاص بروز میکنند. امروزه اهمیت بررسی پلیمورفیسمها وارتباط آنها با بیماریها در تعیین ریسک ابتلا به بیماری بسیار با اهمیت است. بنابراین مطالعه ارتباط یا عدم ارتباط هر پلیمورفیسم در هر جمعیتی، خاص آن میباشد که در صورت داشتن ارتباط میتوان بررسی آن را به عنوان مارکری برای تعیین ریسک ابتلا در نظر گرفت (6). پلیمورفیسم ژنهایی که در پاسخ التهابی دخیل هستند مانند نیتریکاکسیدسنتاز NOS)) در سرطانزایی معده نقش دارند. نیتریکاکسید (NO) در انسان، مولکولی کوچک با عمر کوتاه میباشد که در چندین عملکردهای فیزیولوژی و پروسههای بیولوژیکی نقش دارد از قبیل، اتساع عروق، استراحت عضلۀ صاف، و عملکرد عمومیNO ولی در غلظتهای زیاد محافظت در برابر اثرات رادیکالهای آزاد میباشد و NO و مشتقات آن ممکن است به آسیب DNAمنجر شود (7). آنزیمهای نیتریک اکساید سنتاز (Nitric Oxide Synthase: NOS) اولین بار در سال 1989 شناسایی شدند. سه ایزوفرم اصلی این آنزیم نورونی (neural NOS :nNOS)، القایی inducible NOS :iNOS) )، اندوتلیالی endothelial NOS :eNOS)) در فاصله سالهای 1391تا 1394 کلون و خالص سازی شدند. ایزوفرم های آنزیم NOS محصولات ژنهای مختلف هستند و محل بروز ، تنظیم و خصوصیات متفاوتی دارند. ساختار ژنهایNOS مشابه است و از یک ژن اجدادی مشترک مشتق شدهاند. (nNOS) NOS-I اولین بار در بافت عصبی یافت شد و متصل به غشای سلولی است. iNOS) NOS-II ) در سیتوپلاسم برخی از سلولها و بافتها یافت میشود و در پاسخهای ایمنی و التهابی نقش دارد eNOS) NOS-III) اولین بار در سلولهای اندوتلیال عروق یافت شد؛ متصل به غشای سلولی است و باعث انبساط عروق میشود و در تنظیم فشار خون نقش دارد. نیتریک اکساید (Nitric Oxide :NO) در پاسخهای التهابی که توسط محصولات میکروبی و برهم کنش های خودایمنی آغاز میشود، آزاد میشود و نقش آن در ایمنی غیراختصاصی ثابت شده است (10-8). با توجه به گسترش سرطان معده در شمال کشور و با توجه به اینکه آنزیم NOS-II در پروسههای التهابی نقش دارد وآدنوکارسینوما معده نیز یک پروسه التهابی است و از آنجا که مطالعه جامعی در خصوص پلیمورفیسم این ژن و ارتباط آن با این کانسر انجام نشده است این مطالعه به بررسی ارتباط پلیمورفیسم این ژن بین جمعیت مبتلا به ادنوکارسینوما معده و جمعیت سالم میپردازد.
روش بررسی
در این مطالعه مورد شاهدی، case-control، با هدف تعیین اثر پلیمورفیسم NOS2در آدنوکارسینوم معده از 93 فرد مبتلا به آدنوکارسینوم معده بر اساس نتایج اندوسکوپی و پاتولوژی و تایید فوق تخصص گوارش 93 فرد سالم از همراهان بیماران (زن یا مرد) بهصورت تصادفی انتخاب که در دامنه سنی 30 تا 70 سال بوده و پس از کسب رضایت آگاهانه CC5 خون محیطی گرفته شد و به منظور جلوگیری از لخته شدن در ونوجکتهای حاوی EDTA ذخیره شد. جمعآوری نمونهها و بررسی آنها طبق پروتکل اخلاقی مصوب دانشگاه علوم پزشکی مازندران با کد 968 انجام یافته است. جهت تعیین حجم نمونه برای مطالعه مورد شاهدی از معادله زیر استفاده شده است که برای مقایسه میانگین دو گروه با پیش فرض سطح اطمینان 95% و توان 80% این معادله پیشنهاد شده است که با حداقل تعداد انتخاب شده مطابقت دارد.
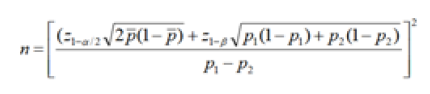
استخراج DNA به روش رسوب دهی با نمک:Salting out)): برای استخراجDNA از کیت استخراج TAKARA(DNA Extraction)(Japan) استفاده شده که برای این منظور 1 سیسی خون بیمار و فرد سالم حاوی EDTA درون میکروتیوب 1/5 سیسی منتقل و با بافر لیزکننده ɪ پر شد و به مدت 15 دقیقه در یخچال قرار داده شد این عمل باعث لیز گلبولهای قرمز میشود سپس به مدت 4 دقیقه در دور 6000 سانتریفیوژ شد. بعد از اتمام سانتریفیوژ محلول رویی، که شامل گلبولهای قرمز است دور ریخته شد. و عمل فوق روی رسوب باقی مانده، 5 بار تکرار شد تا در نهایت رسوب صورتی رنگ متمایل به سفید مشاهده شد. سپس 500 میکرولیتر از بافر لیز کنندهII به رسوب حاصله از مرحله قبل اضافه گشت و به آرامی به رسوب ضربه وارد شد تا کاملاً حل شود. سپس به مدت 50 دقیقه در بن ماری، در دمای 50 درجه سانتیگراد قرار گرفت. این بافر وظیفه لیزکردن غشای گلبول سفید و غشای هسته را داراست. میکروتیوبها از بن ماری به دمای اتاق منتقل شد و 300 میکرولیتر از پرکلرات سدیم به هر میکروتیوب افزوده شد تا پروتئینها دناتوره و جدا شوند و به صورت توده قهوهای رنگی، تجمع پیدا کنند. سپس محلول با دور 12000 دور به مدت 10 دقیقه سانتریفیوژ گردید که لایه رویی که حاوی DNA است برداشته و به میکروتیوب جدید منتقل شد 70 میکرولیتر از اتانول 96% سرد به آن اضافه و چند بار تکان داده شد. با دور 12000 به مدت 10 دقیقه سانتریفیوژ گردید تا DNA رسوب بدهد. بعد از اتمام سانتریفیوژ محلول رویی دورریخته شد و به رسوب باقی مانده، 200میکرولیتر اتانول 70% افزوده شد تا چنانچه نمک بر روی کلاف DNA وجود داشته باشد، در فاز آبی حل شود. سپس با دور 12000 به مدت 10 دقیقه سانتریفیوژگردید و در انتها محلول رویی دور ریخته شد. میکروتیوبهای حاوی رسوب DNA در دمای اتاق قرار داده شد تا خشک شود و شکل کریستالی پیدا کند سپس 80 میکرولیتر آب مقطر استریل، به هر کدام از میکروتیوبها افزوده و درب محصول با پارافیلم بسته شد. سپس درفریزر در دمای 20- درجه سانتیگراد نگهداری شد.
تعیین غلظت DNAاستخراج شده: پس از کالیبره کردن دستگاه بیوفتومتر ، 2 میکرولیتراز نمونه DNA را در روی لنز ریخته و میزان جذب، در طول موج nm260 و nm280 خوانده شد. نسبت جذب nm260 به nm280 بین 1/5 تا 2 به دست آمد که یعنی نمونهها دارای خلوص مناسبی بود.
PCR-RFLP: برای تکثیر و تخلیص DNAاز کیت AccuPrep® PCR Purification Kit شرکتBioneer آلمان استفاده شد که در طی 37 چرخه که هر چرخه شامل مراحل دناتوراسیون در دمای 94 درجه در 5 دقیقه ، مرحله اتصال دردمای 94 درجه به مدت 30 ثانیه و مرحله بسط در دمای 64/5 درجه30 ثانیه و مرحله بسط نهایی زنجیره با دمای 72 درجه30 ثانیه انجام شد. دناتوراسیون (مرحله اولیه در دمای 72 درجه برای 10 دقیقه انجام شد) محصولات PCR با آنزیم محدود کننده Hin1I (BSaH) در دمای 37 درجه سانتیگراد طی 24 ساعت هضم شد در صورت حضور C در نوکلئوتید که مطابق NOS2 است محصولPCR با طولbp 436 به دو قطعه با طول bp 258 و bp 178 شکسته شد. محصولات PCR در ژل آگارز 1/5 درصد اجرا شدند و با اتیدیوم برماید قابل تشخیص شدند. در جدول 1 مواد مصرفی برای واکنش PCR و در جدول 2 مشخصات پرایمرها نشان داد که با مراجعه به سایتNBCI و نرم افزارهای مربوطه طراحی و توسط شرکت تکاپوزیست تهیه شد.
تجزیه و تحلیل آماری
در این تحقیق بررسیهای آماری با استفاده از نرمافزار MedCalc (12.1.40 V) انجام شد. آزمونهای آماری (X2) Chi-square وآزمون(OR) odds Ratio انجام گرفت و همچنین پارامترهایی مانند onfidence Interval (CI) ,P-value تعیین شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی مازندران تایید شده است (کد اخلاق 968-1393)
نتایج
در این مطالعه مورد- شاهدی تعداد 93 فرد بیمار مبتلا به سرطان معده و 93 فرد سالم از نظر پلی مورفیسم در ژن NOS2 مورد بررسی قرار گرفتند. آنالیز آماری اختلاف معنیداری را در دو گروه بیمار و کنترل نشان داد(جدول 3،4) در مجموع از میان 93 فرد کنترل 36نفر (38/7%) دارای ژنوتیپ TT، 32 نفر(34/4%) دارای ژنوتیپ CT و 25 نفر (26/4%)دارای ژنوتیپ CC بودند. در میان 111 فرد بیمار 14 نفر (12/61%) دارای ژنوتیپ TT، 57 نفر (51/35%) دارای ژنوتیپ CT و 40 نفر (36%) دارای ژنوتیپ CC بودند.P=0/0001)، Chi-Square ( )=18/722)، میتوان گفت تفاوت معنیداری در توزیع ژنوتیپی پلیمورفیسم مورد نظر ژن NOS2 بین دو گروه کنترل و بیمار وجود داشت بدین صورت که فراوانی ژنوتایپ TT در گروه بیمار نسبت به کنترل بهطور معنی دار کاهش یافت و همچنین ژنوتایپ CT در گروه بیمار نسبت به کنترل افزایش معنیداری داشته و همچنین در مورد ژنوتایپ CC در گروه بیمار نسبت به کنترل افزایشوجود داشته است (جدول 3،4) بنابراین برای بررسی ارتباط تک تک ژنوتیپها با بیماری آدنوکارسینوما از آزمون OR)) Odds-Ratio با کمک برنامه نرمافزاری MedCalc (12.1.40 V) استفاده گردید. در شکل 1 تصویر ژل آگارز حاصل از RFLP آورده شده است. به ترتیب ردیف 1 لدر و4،3،2 ژنوتیپ،CC ، TT و CT میباشند. این بررسی نشان میدهد که در سطح معنیداری P= 0/0004 CI(1/37 3/03) 95% ,OR= 2/04
تعداد آلل C با نسبت شانس همبستگی مستقیمی دارد به عبارتی افزایش تعداد آلل C در ژنوتایب منجر به افزایش شانس سرطان می شود.
جدول 1: مواد مصرفی برای واکنش PCR

جدول2: مشخصات پرایمرهای مورد استفاده

جدول 3: بررسی میزان تاثیر ژنوتیپها در شانس بیماری آدنوکارسینوما حالت اول: TT(Ref)

جدول 4: بررسی میزان تاثیر ژنوتیپها در بروز بیماری آدنوکارسینوما حالت دوم: TT+CT(Ref)


شکل 1: تصویر ژل آگارز حاصل از RFLP:. به ترتیب ردیف 1 لدر و4،3،2 ژنوتیپ ،CC ،TT وCT میباشند.
بحث
در حال حاضر سرطان معده، یکی از شایعترین سرطانها و دومین دلیل مرگ و میر ناشی از سرطان در جهان میباشد. به دلیل پیشآگاهی ضعیف، این سرطان در مراحل پیشرفته تشخیص داده میشود و همچنین به دلیل ناکارآمدی درمانهای متداول، اکثر بیماران حتی پس از جراحی، دارای بقاء پنج ساله پایینی بوده و فوت میکنند (11). تولید iNOS توسط LPS، IFN-γ (Interferon-γ)،TNF- α (TumorNecrosis Factor- α)، PAF (Platelet – activatingFactor)، GM-CSF (Stimulating Factor (Granulocyte Monocyte – Colony، IL-1 (Interleukin-1) و IL-6 فرا تنظیم میشود (12). آنزیم iNOS و mRNA مربوط به آن بسیار پایدار میباشند و به همین دلیل قادر به تولید مقادیر زیاد NOدر طی چندین روز میباشند که منجر به تولید میزان زیادی از گونههای فعال نیتروژن اکسید(Reactive Nitrogen Oxide Species =RNOS میگردد، که واسطه طیف گستردهای از تأثیرات فیزیولوژیک و پاتوفیزیولوژیک میباشد (13). نیتریک اکسید (NO) یک رادیکال آزاد بسیارفعال بوده که نشان داده شده است دارای عملکردهای مختلف بیولوژیک می باشد. NO از ال-آرژینین به وسیله خانوادهای از ایزوآنزیمها موسوم به نیتریک اکسید سنتاز ((NOS و در حضور اکسیژن تولید میشود که تولید ال – سیترولین و NO نموده که به تنظیم سطح طبیعی NO در بدن کمک مینماید (14،15). NOS از دسته اکسیدوردوکتازها بوده که با عمل بر روی یک جفت دهنده (که در این واکنش شامل اکسیژن مولکولی و NADPH میباشند) و از طریق اتصال و یا احیای اکسیژن ملکولی، واکنش خود را به انجام میرساند. این واکنش به کوفاکتورهای مختلفی از قبیل NADPH،FMN ،FAD ، تتراهیدروبیوپترین، کلسیم، کالمودولین، (Calmodulin) و اکسیژن مولکولی نیاز دارد (16،17). NOS دارای سه ایزوفرم بوده که توسط ژنهای متفاوتی بیان میشوند .ایزوفرم بافت عصبی (nNOS) و ایزوفرم اندوتلیال عروق (eNOS) که هردو وابسته به یون کلسیم و کالمودولین بوده، ایزوفرم سوم که غیر وابسته به کلسیم و کالمودولین بوده ، قابل القا ء (iNOS) میباشد (16). علی رغم اثرات مفیدNO ، تولید بیش از حدNO به علت تولید گونههای اکسیژن فعال (ROS)، نیتروژن فعال (RNS) و نیتروزیلاسیون پروتئینها، دارای اثرات سمی میباشد (18). NOقادر به عبور از غشای سلولی و طی مسافت های طولانی بوده، از این رو، باید تولید آن تحت کنترل باشد (19). نیتریکاکسیدسنتتاز القایی (iNOS) توسط ژن نیتریکاکسیدسنتتاز2 (NOS2) در تعدادی از انواع سلول بعد از تحریک به واسطه سایتوکینهای التهابی و ایمنی و همچنین رادیکالهای تولید شده در مراحل اولیۀ آپاپتوزیس و نکروز لیپویلیساکارید (LPS)بیان میشود. بنابراین پلیمورفیسم ژنهایی که در پاسخ التهابی دخیل هستند مانند نیتریک اکسید سنتتاز NOS)) در سرطانزایی معده نقش دارند (20،21). طبق مطالعهای درسال 2010 توسط یو و همکاران ارتباط پلیمورفیسم بین NOS2 و BPH مورد بررسی قرار گرفت و سه نوع SNP در ژن NOS2 که شاملT/C 278 - که در پروموتر قرار دارد و 10459953 rs (5′ UTR ) و اگزون 16 (تبدیل لوسین به سرین) با روش PCR-RLFP مورد بررسی قرار گرفت و مشاهده کردند که تنها SNP در s10459953 rsدر ارتباط با BPH است (22). در سال 2005 توسط فرانسن و همکاران افزایش بیان آنزیم NOS2 در سرطان رودۀ بزرگ مشاهده شده است در نتیجه بررسی پلیمورفیسم در پروموتور NOS2ممکن است در توسعه و پیشرفت سرطان رودۀ بزرگ نقش داشته باشد و با استفاده از روش PCR- RLFPنتیجه گرفتند که پلیمورفیسم در پروموتور NOS2 اثر محدود در شروع یا پیشرفت سرطان رودۀ بزرگ دارد (23). در سال 2011 توسط ریک و همکاران پلیمورفیسم Ser608Leuدر نیتریکاکسیدسنتتاز القایی و ژنوتیپها با ترکیبی از اطلاعات مربوط به مرحلۀ تومور، درجه، مرحلۀ پیشرفت، در بیماران مبتلا به سرطان مثانه بواسطۀ تعیین توالی مورد بررسی قرار گرفت و نشان داده شد که برای پلیمورفیسم Ser608Leu، هموزیگوت TT خطر ابتلا به سرطان معده را سه برابر بیشتر میکند و تهاجم این بیماری را نیز تحت تاثیر قرار میدهد (24). در سال 2009 توسط لی و همکاران بررسی ارتباط سرطان پروستات با ژنNOS2A در جایگاه2892T> C،Ex16 +14C>T G>A ,IVS16+88T>G524 +IVS20 و ژن NOS3 درIVS15 62G>T ،C>T43 - 7Ex،A>G26 - IVS7،G>T63 -8 Ex،762C>T -IVS1 نشان داد که درGT/TT ,NOS288 +IVS16 که با افزایش خطر سرطان پروستات و G>A524+IVS20 با کاهش خطر سرطان پروستات همراه است. و درNOS3،IVS7-26GG با افزایش خطر سرطان در ارتباط است، و همۀ اینSNPها ارتباط معنیداری با سرطان تهاجمی دارند (مرحلۀIII–IV) ولی با سرطان غیر تهاجمی ارتباط معنیداری وجود ندارد. نتایج آنها نشان داد که پلیمورفیسم ژن NOS از عوامل مهم ژنتیکی برای سرطان مهاجم پروستات میباشد (25). در سال 2010 توسط جورج و همکاران بررسی پلیمورفیسم این ژن درنقاط اگزون 16 (تبدیل سرین به لوسین در جایگاه 608) و G/C954- و C/T1173- که هر دو در پروموتور قرار دارند با روش PCR-RLFP مورد بررسی قرار گرفته و در جمعیت مورد مطالعه، مشاهده شد که SNP در جایگاههای 954- (اگزون 16) و1173- (پروموتور) مشاهده نشد. بنابراین هیچ ارتباطی با گاستریت وسرطان معده ندارند. ولی جهشی را در جایگاه G/C954- مشاهده کردند که ارتباط معنیداری با سرطان معده همراه با مصرف الکل و دخانیات دارد و این اولین گزارش از افزایش خطر مبتلا به سرطان معده در این جایگاه میباشد (26). در سال 2006 گوتو و همکاران در بررسی دیگر با روشPCR-RLFP نشان دادند که پلیمورفیسم ژن نیتریک اکسید القایی(iNOS) در موقعیت C150T در آتروفی معده و سرولوژی هلیکوباکتر هیچ وابستگی وجود ندارد، اما پلیمورفیسم در این جایگاه، در سرطان معده که مرتبط به هلیکوباکتر پیلوری است مشاهده شده است و ارتباط معنیداری با آن دارد (27). در سال 2011 توسط ژانگ و همکاران مطالعهای در رابطه با افراد مبتلا به سرطان ریه (NSCLC) که بهوسیلۀ شیمیدرمانی و رادیو تراپی تحت درمان بودند، بین سالهای 2011 - 2009 و آنالیزهای ژنوتیپ 36 تاSNP (21 مورد در NOS2A، 14 مورد در NOS3) در هر فرد بیمار به وسیلۀ استفاده از سیستم Sequenom Mass Array انجام شد و نتایج حاصل نشان داد که تغییرات ژنتیکی در ژن NOS2A و NOS3 در بیماران NSCLC در پاسخ آنها به درمان رایو درمانی و شیمی درمانی تحت تاثیر قرار نمیدهد (28). التهاب مزمن، یک عامل خطر برای سرطان رودۀ بزرگ است و در سال 2005 دیکن و همکاران SNP در ژنهای التهابی از جمله جایگاه +524T>C در NOS2A مورد بررسی قرار دادند و به این نتیجه رسیدند که هیچ ارتباط معنیداری بین SNP مورد بررسی و سرطان رودۀ بزرگ وجود ندارد (29). درسال 2007 توسط کایس و همکاران پلیمورفیسم در پروموتور iNOS (تکرار پلیمورفیسمCCTTT و-2445 C-->G SNP ) و ارتباط آن با سطح بیان mRNA نیتریک اکسید سنتتاز القایی در موکوس معده و خطر ابتلا به سرطان معده مورد بررسی قرار گرفت. نتایج حاصل از آنالیز رگرسیون چند متغیره نشان داد که تکرار طولانی CCTTT نسبت به تکرار کوتاه باعث افزایش خطر ابتلا به سرطان معده میشود، اما ارتباطی بین SNPدر -2445 C-->G و سرطان معده نشان داده نشد (30). در مطالعهای در سال 2015 بیان شد که در بسیاری از تومورها بیان iNOS زیاد است اما نقش iNOS در طی رشد و توسعه تومور متفاوت است که در برخی مواقع تشدید و در برخی مواقع مهار فعالیت آن گزارش شده است (31). در مطالعهای در سال 2018 توسط Avtandilyan N به بررسیNOS و آرژینین در کانسر پستان پرداخته شد و نتایج نشان که سطح فعالیت آرژیناز وNO و فعالیت NOS و مقادیر پلی آمینها به موازات گسترش کانسر افزایش مییابد و بعد از کموتراپی نئوادجوانت کاهش مییابد و پیشنهاد شده که مهارNOS اثرات آنتی تومور دارد و باعث کاهش پرولیفراسیون سلولی، متاستازو آنژیوژنزیس میگردد (32). در سال 2008 توسط عبد نیکفرجام و همکاران مطالعهای در رابطه با پلیمورفیسم ژن NOS2A و بیماری آرتریت روماتوئید انجام گرفت که ارتباط معنیداری با پلیمورفیسم این ژن نداشت (12). شماره رفرنس در جلوی اسامی آورده شود و رفرنس در انتهای متن ذکر گردد صورت گرفت ارتباط معنیداری با پلیمورفیسم این ژن نداشتند و نتایج ناهمسو با مطالعه حاضربودند.
نتیجهگیری
این پژوهش نشان داد که پلی مورفیسم نیتریک اکساید سنتاز 2 با افزایش شانس سرطان معده در گروه بیمار نسبت به کنترل در ارتباط میباشد و در توزیع ژنوتیپی پلیمورفیسم مورد نظر ژن NOS2 بین دو گروه کنترل و بیمار وجود دارد و پس از بررسی ارتباط تک تک ژنوتیپها با بیماری آدنوکارسینوما مشخص شد که تعداد آلل C با نسبت شانس سرطان همبستگی مستقیمی دارد به عبارتی افزایش تعداد آلل C در ژنوتایب منجر به افزایش نسبت شانس بیماری سرطان در گروه بیمار نسبت به کنترل میشود. با توجه به نتایج حاصل از این مطالعه پیشنهاد میشود که پلی مورفیسم ژن نیتریک اکسید سنتاز 2 ممکن است یک مارکر مفید در تعیین حساسیت ژنتیکی به سرطان معده باشد. محدودیتهای مطالعه و پیشنهادات
از محدودیتهای مطالعه تعداد بیماران و افراد کنترل بوده است که در بازه زمانی محدود تعداد قابل قبول که کاملاً براساس حجم نمونه محاسبه شده باشد ممکن نبوده است. برای تکمیل مطالعه پیشنهاد میشود در حجم بالاتر از نمونه ارتباط این پلیمورفیسم با دادههای دموگرافیک از جمله سن و جنس و گرید تومور برررسی شود.
سپاسگزاری
این مطالعه حاصل پایاننامه دانشجوی داروسازی خانم مهشاد هوشیار میباشد
حامی مالی: معاونت تحقیقات و فنآوری دانشگاه علوم پزشکی مازندران
تعارض در منافع: وجود ندارد.
References:
1- Holbrook JD, Parker JS, Gallagher KT, Halsey WS, Hughes AM, Weigman VJ, et al. Deep Sequencing of Gastric Carcinoma Reveals Somatic Mutations Relevant to Personalized Medicine. J Trans Med 2011; 9(1):119.
2- Bernini M, Barbi S, Roviello F, Scarpa A, Moore P, Pedrazzani C, et al. Family History of Gastric Cancer: A Correlation between Epidemiologic Findings and Clinical Data. Gastric Cancer 2006; 9(1): 9-13.
3- Siewert JR, Maruyama K. “What's New in Gastric Cancer?”—Introduction. World J Surg 19951; 19(4): 483.
4- Zeraati H, Mahmoudi M, Mohammad K, Kazemnejad A, Mohagheghi MA, Mir MR. Postoperative Survival in Gastric Cancer Patients and its Related Factors. J School of Public Health and Institute of Public Health Research 2005; 3(4): 1-2.
5- Malekzadeh R, Derakhshan MH, Malekzadeh Z. Gastric Cancer in Iran: Epidemiology and Risk Factors. Arch Iran Med 2009; 12(6): 576-83.
6- Rejali L, Hasanzad M, Hassani M, Reza M, Fathi M, Sarzaeim MR, et al. Analysis of Endothelial Nitric Oxide Synthase (Enos) Gene Polymorphism Glu 298 Asp as a Risk Factor of Coronary Artery Disease in a Sample of Iranian Population. Medical Science 2012; 22(2): 116-21.
7- Ying L, Hofseth LJ. An Emerging Role for Endothelial Nitric Oxide Synthase in Chronic Inflammation and Cancer. Cancer Research 2007; 67: 1407-10.
8- Batra J, Chatterjee R, Ghosh B. Inducible Nitric Oxide Synthase (Inos): Role in Asthma Pathogenesis. Indian J Biochemistry & Biophysics 2007; 44: 303-5.
9- Kendall HK, Marshall RI, Bartold PM. Nitric Oxide and Tissue Destruction. Oral Diseases 2001; 7(1): 2-10.
10- Tripathi P. Nitric Oxide and Immune Response. Indian J Biochemistry & Biophysics 2007; 44(5): 310-19.
11- Zhang L, Hou YH, Wu K, Zhai JS, Lin N. Proteomic Analysis Reveals Molecular Biological Details In Varioliform Gastritis Without Helicobacter Pylori Infection. World J Gastroenterol 2010; 16(29): 3664-73.
12- Abd Nikfarjam B, Amirghofran Z, Kamali E. NOS2A Gene Polymorphism and its Association with Nitric Oxide Production in Peripheral Blood Leukocytes of Normal Individuals. Modares J Medical Sciences: Pathobiology 2008; 10(3-4): 41-50.
13- Zamora R, Vodovotz Y, Billiar TR. Inducible Nitric Oxide Synthase and Inflammatory Diseases. Molecular Medicine 2000; 6(5): 347-73.
14- Choi WS, Chang MS, Han JW, Hong SY, Lee HW. Identification of Nitric Oxide Synthase Instaphylococcus Aureus. Biochem Biophys Res Commun 1997; 237(3): 554-8.
15- Lokhande PD, Kuchekar BS, Chabukswar AR, Jagdale SC. Nitric Oxide: Role in Biological System. Asian J. Biochem 2006; 1:1-7.
16- Baek KJ, Thiel BA, Lucas S, Stuehr DJ. Macrophage Nitric Oxide Synthase Subunits. Purification, Characterization, and Role of Prosthetic Groups and Substrate in Regulating their Association into a Dimeric Enzyme. J Biological Chemistry 1993; 268(28): 21120-9.
17- Herrero MB, Gagnon C. Nitric Oxide: A Novel Mediator of Sperm Function. J Andrology 2001; 22(3): 349-56.
18- Bredt DS. Nitric Oxide Signaling Specificity—the Heart of the Problem. J Cell Science 2003; 116(1): 9-15.
19-Papi S, Ahmadizar F, Hasanvand A. The role of nitric oxide in inflammation and oxidative stress .Immunopathol Persa 2019; 5(1): e08.
20-Roshanaei G, Kazemnejad A, Sadighi S. Assessment of Risk Factors Affecting Recurrence of Patients with Gastric Cancer in the Presence of Informative Censoring in Iran. Asian Pac J Cancer Prev 2012; 12: 2443-6.
21-Tepes B. Can Gastric Cancer Be Prevented? J Physiol Pharmacol 2009; 60(Suppl 7): 71-5.
22-Yoo KH, Kim SK, Chung JH, Chang SG. Nitric Oxide Synthase 2 Gene Polymorphisms are Associated with Prostatic Volume in Korean Men with Benign Prostatic Hyperplasia. Asian J Androl. 2010; 12(5): 690.
23-Fransén K, Elander N, Söderkvist P. Nitric Oxide Synthase 2 (NOS2) Promoter Polymorphisms in Colorectal Cancer. Cancer Letters 2005; 225(1): 99-103.
19- Ryk C, Wiklund NP, Nyberg T, De Verdier PJ. Ser608Leu Polymorphisms in the Nitric Oxide Synthase-2 Gene May Influence Urinary Bladder Cancer Pathogenesis. Scandinavian J Urology and Nephrology 2011; 45(5): 319-25.
20- Lee KM, Kang D, Park SK, Berndt SI, Reding D, Chatterjee N, et al. Nitric Oxide Synthase Gene Polymorphisms and Prostate Cancer Risk. Carcinogenesis 2009; 30(4): 621-5.
21- Jorge YC, Duarte MC, Silva AE. Gastric Cancer is Associated with NOS2-954G/C Polymorphism and Environmental Factors in a Brazilian Population. BMC Gastroenterology 2010; 10: 1-5.
22- Goto Y, Ando T, Naito M, Goto H, Hamajima N. Inducible Nitric Oxide Synthase Polymorphism is Associated with the Increased Risk of Differentiated Gastric Cancer in a Japanese Population. World J Gastroenterology 2006; 12(39): 6361-65.
23- Zhang J, Li BS, Zhou CC, Yu HY, Ding XP, Sun MP, et al. Single Nucleotide Polymorphisms in NOS2A and NOS3 Genes are Not Associated with Treatment Response of Non-Small Cell Lung Cancer Patients Following the Definitive Radiochemotherapy. Neoplasma 2011; 59(6): 631-40.
24- Dicken BJ, Bigam DL, Cass C, Mackey JR, Joy AA, Hamilton SM. Gastric Adenocarcinoma: Review and Considerations for Future Directions. Annals of Surgery 2005; 241(1): 27-39.
25- Kaise M, Miwa J, Suzuki N, Mishiro S, Ohta Y, Yamasaki T, Tajiri H. Inducible Nitric Oxide Synthase Gene Promoter Polymorphism is Associated with Increased Gastric Mrna Expression of Inducible Nitric Oxide Synthase and Increased Risk of Gastric Carcinoma. European J Gastroenterology & Hepatology 2007; 19(2): 139-45.
26- Vannini F, Kashfi K, Nath N. The Dual Role of Inos in Cancer. Redox Biol 2015; 6: 334-43.
27- Avtandilyan N, Javrushyan H, Petrosyan G, Trchounian A. the Involvement of Arginase and Nitric Oxide Synthase in Breast Cancer Development: Arginase and NO Synthase as Therapeutic Targets in Cancer. Biomed Res Int 2018; 30; 2018: 8696923.
28- Zhang J, Li BS, Zhou CC, Yu HY, Ding XP, Sun MP,et al. Single Nucleotide Polymorphisms in NOS2A And NOS3 Genes Are Not Associated With Treatment Response Of Non-Small Cell Lung Cancer Patients Following The Definitive Radiochemotherapy. Neoplasma 2011; 59(6): 631-40.
29- Dicken BJ, Bigam DL, Cass C, Mackey JR, Joy AA, Hamilton SM. Gastric adenocarcinoma: review and considerations for future directions. Annals of Surgery 2005; 241(1): 27-39.
30- Kaise M, Miwa J, Suzuki N, Mishiro S, Ohta Y, Yamasaki T, Tajiri H. Inducible nitric oxide synthase gene promoter polymorphism is associated with increased gastric mRNA expression of inducible nitric oxide synthase and increased risk of gastric carcinoma. European journal of Gastroenterology & Hepatology 2007; 19(2): 139-45.
31-Vannini F, Kashfi K, Nath N. The dual role of iNOS in cancer.Redox Biol 2015; 6: 334-343.
32-Avtandilyan N, Javrushyan H, Petrosyan G, Trchounian A the Involvement of Arginase and Nitric Oxide Synthase in Breast Cancer Development: Arginase and NO Synthase as Therapeutic Targets in Cancer. Biomed Res Int. 2018; 30; 2018: 8696923.
.
1- Holbrook JD, Parker JS, Gallagher KT, Halsey WS, Hughes AM, Weigman VJ, et al. Deep Sequencing of Gastric Carcinoma Reveals Somatic Mutations Relevant to Personalized Medicine. J Trans Med 2011; 9(1):119.
2- Bernini M, Barbi S, Roviello F, Scarpa A, Moore P, Pedrazzani C, et al. Family History of Gastric Cancer: A Correlation between Epidemiologic Findings and Clinical Data. Gastric Cancer 2006; 9(1): 9-13.
3- Siewert JR, Maruyama K. “What's New in Gastric Cancer?”—Introduction. World J Surg 19951; 19(4): 483.
4- Zeraati H, Mahmoudi M, Mohammad K, Kazemnejad A, Mohagheghi MA, Mir MR. Postoperative Survival in Gastric Cancer Patients and its Related Factors. J School of Public Health and Institute of Public Health Research 2005; 3(4): 1-2.
5- Malekzadeh R, Derakhshan MH, Malekzadeh Z. Gastric Cancer in Iran: Epidemiology and Risk Factors. Arch Iran Med 2009; 12(6): 576-83.
6- Rejali L, Hasanzad M, Hassani M, Reza M, Fathi M, Sarzaeim MR, et al. Analysis of Endothelial Nitric Oxide Synthase (Enos) Gene Polymorphism Glu 298 Asp as a Risk Factor of Coronary Artery Disease in a Sample of Iranian Population. Medical Science 2012; 22(2): 116-21.
7- Ying L, Hofseth LJ. An Emerging Role for Endothelial Nitric Oxide Synthase in Chronic Inflammation and Cancer. Cancer Research 2007; 67: 1407-10.
8- Batra J, Chatterjee R, Ghosh B. Inducible Nitric Oxide Synthase (Inos): Role in Asthma Pathogenesis. Indian J Biochemistry & Biophysics 2007; 44: 303-5.
9- Kendall HK, Marshall RI, Bartold PM. Nitric Oxide and Tissue Destruction. Oral Diseases 2001; 7(1): 2-10.
10- Tripathi P. Nitric Oxide and Immune Response. Indian J Biochemistry & Biophysics 2007; 44(5): 310-19.
11- Zhang L, Hou YH, Wu K, Zhai JS, Lin N. Proteomic Analysis Reveals Molecular Biological Details In Varioliform Gastritis Without Helicobacter Pylori Infection. World J Gastroenterol 2010; 16(29): 3664-73.
12- Abd Nikfarjam B, Amirghofran Z, Kamali E. NOS2A Gene Polymorphism and its Association with Nitric Oxide Production in Peripheral Blood Leukocytes of Normal Individuals. Modares J Medical Sciences: Pathobiology 2008; 10(3-4): 41-50.
13- Zamora R, Vodovotz Y, Billiar TR. Inducible Nitric Oxide Synthase and Inflammatory Diseases. Molecular Medicine 2000; 6(5): 347-73.
14- Choi WS, Chang MS, Han JW, Hong SY, Lee HW. Identification of Nitric Oxide Synthase Instaphylococcus Aureus. Biochem Biophys Res Commun 1997; 237(3): 554-8.
15- Lokhande PD, Kuchekar BS, Chabukswar AR, Jagdale SC. Nitric Oxide: Role in Biological System. Asian J. Biochem 2006; 1:1-7.
16- Baek KJ, Thiel BA, Lucas S, Stuehr DJ. Macrophage Nitric Oxide Synthase Subunits. Purification, Characterization, and Role of Prosthetic Groups and Substrate in Regulating their Association into a Dimeric Enzyme. J Biological Chemistry 1993; 268(28): 21120-9.
17- Herrero MB, Gagnon C. Nitric Oxide: A Novel Mediator of Sperm Function. J Andrology 2001; 22(3): 349-56.
18- Bredt DS. Nitric Oxide Signaling Specificity—the Heart of the Problem. J Cell Science 2003; 116(1): 9-15.
19-Papi S, Ahmadizar F, Hasanvand A. The role of nitric oxide in inflammation and oxidative stress .Immunopathol Persa 2019; 5(1): e08.
20-Roshanaei G, Kazemnejad A, Sadighi S. Assessment of Risk Factors Affecting Recurrence of Patients with Gastric Cancer in the Presence of Informative Censoring in Iran. Asian Pac J Cancer Prev 2012; 12: 2443-6.
21-Tepes B. Can Gastric Cancer Be Prevented? J Physiol Pharmacol 2009; 60(Suppl 7): 71-5.
22-Yoo KH, Kim SK, Chung JH, Chang SG. Nitric Oxide Synthase 2 Gene Polymorphisms are Associated with Prostatic Volume in Korean Men with Benign Prostatic Hyperplasia. Asian J Androl. 2010; 12(5): 690.
23-Fransén K, Elander N, Söderkvist P. Nitric Oxide Synthase 2 (NOS2) Promoter Polymorphisms in Colorectal Cancer. Cancer Letters 2005; 225(1): 99-103.
19- Ryk C, Wiklund NP, Nyberg T, De Verdier PJ. Ser608Leu Polymorphisms in the Nitric Oxide Synthase-2 Gene May Influence Urinary Bladder Cancer Pathogenesis. Scandinavian J Urology and Nephrology 2011; 45(5): 319-25.
20- Lee KM, Kang D, Park SK, Berndt SI, Reding D, Chatterjee N, et al. Nitric Oxide Synthase Gene Polymorphisms and Prostate Cancer Risk. Carcinogenesis 2009; 30(4): 621-5.
21- Jorge YC, Duarte MC, Silva AE. Gastric Cancer is Associated with NOS2-954G/C Polymorphism and Environmental Factors in a Brazilian Population. BMC Gastroenterology 2010; 10: 1-5.
22- Goto Y, Ando T, Naito M, Goto H, Hamajima N. Inducible Nitric Oxide Synthase Polymorphism is Associated with the Increased Risk of Differentiated Gastric Cancer in a Japanese Population. World J Gastroenterology 2006; 12(39): 6361-65.
23- Zhang J, Li BS, Zhou CC, Yu HY, Ding XP, Sun MP, et al. Single Nucleotide Polymorphisms in NOS2A and NOS3 Genes are Not Associated with Treatment Response of Non-Small Cell Lung Cancer Patients Following the Definitive Radiochemotherapy. Neoplasma 2011; 59(6): 631-40.
24- Dicken BJ, Bigam DL, Cass C, Mackey JR, Joy AA, Hamilton SM. Gastric Adenocarcinoma: Review and Considerations for Future Directions. Annals of Surgery 2005; 241(1): 27-39.
25- Kaise M, Miwa J, Suzuki N, Mishiro S, Ohta Y, Yamasaki T, Tajiri H. Inducible Nitric Oxide Synthase Gene Promoter Polymorphism is Associated with Increased Gastric Mrna Expression of Inducible Nitric Oxide Synthase and Increased Risk of Gastric Carcinoma. European J Gastroenterology & Hepatology 2007; 19(2): 139-45.
26- Vannini F, Kashfi K, Nath N. The Dual Role of Inos in Cancer. Redox Biol 2015; 6: 334-43.
27- Avtandilyan N, Javrushyan H, Petrosyan G, Trchounian A. the Involvement of Arginase and Nitric Oxide Synthase in Breast Cancer Development: Arginase and NO Synthase as Therapeutic Targets in Cancer. Biomed Res Int 2018; 30; 2018: 8696923.
28- Zhang J, Li BS, Zhou CC, Yu HY, Ding XP, Sun MP,et al. Single Nucleotide Polymorphisms in NOS2A And NOS3 Genes Are Not Associated With Treatment Response Of Non-Small Cell Lung Cancer Patients Following The Definitive Radiochemotherapy. Neoplasma 2011; 59(6): 631-40.
29- Dicken BJ, Bigam DL, Cass C, Mackey JR, Joy AA, Hamilton SM. Gastric adenocarcinoma: review and considerations for future directions. Annals of Surgery 2005; 241(1): 27-39.
30- Kaise M, Miwa J, Suzuki N, Mishiro S, Ohta Y, Yamasaki T, Tajiri H. Inducible nitric oxide synthase gene promoter polymorphism is associated with increased gastric mRNA expression of inducible nitric oxide synthase and increased risk of gastric carcinoma. European journal of Gastroenterology & Hepatology 2007; 19(2): 139-45.
31-Vannini F, Kashfi K, Nath N. The dual role of iNOS in cancer.Redox Biol 2015; 6: 334-343.
32-Avtandilyan N, Javrushyan H, Petrosyan G, Trchounian A the Involvement of Arginase and Nitric Oxide Synthase in Breast Cancer Development: Arginase and NO Synthase as Therapeutic Targets in Cancer. Biomed Res Int. 2018; 30; 2018: 8696923.
.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فارماکولوژی
دریافت: 1399/4/2 | پذیرش: 1399/9/15 | انتشار: 1400/6/10
دریافت: 1399/4/2 | پذیرش: 1399/9/15 | انتشار: 1400/6/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







