دوره 28، شماره 11 - ( بهمن 1399 )
جلد 28 شماره 11 صفحات 3225-3215 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Khayampour N, Peeri M, Azarbayjani M A, Delfan M. Effects of High Intensity Interval Training on the Gene Expression of PGC1-Α, CS and P-53 in the Cardiomyocyte of Male Obese Rats in Type 2 Diabetes. JSSU 2021; 28 (11) :3215-3225
URL: http://jssu.ssu.ac.ir/article-1-5168-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5168-fa.html
خیام پور نادیا، پیری مقصود، آذربایجانی محمدعلی، دلفان مریم. تاثیر4 هفته تمرینتناوبی شدید بر بیان ژنهای PGC-1α، CS وP-53 در کاردیومیوسیت موشهای چاق صحرائی نرمبتلا به دیابت نوع 2. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (11) :3215-3225
متن کامل [PDF 859 kb]
(1223 دریافت)
| چکیده (HTML) (2843 مشاهده)
References:
1-Fealy CE, Mulya A, Axelrod CL, Kirwan JP. Mitochondrial Dynamics in Skeletal Muscle Insulin Resistance and Type 2 Diabetes. Translational Res 2018; 20(2): 69-82.
2-Shimizu I, Minamino T, Toko H, Okada S, Ikeda H, Yasuda N, et al. Excessive Cardiac Insulin Signaling Exacerbates Systolic Dysfunction Induced by Pressure Overload in Rodents. J Clinical Investigation 2010; 120(5): 1506-14.
3-Shen X, Zheng S, Thongboonkerd V, Xu M, Pierce Jr WM, Klein JB, et al. Cardiac Mitochondrial Damage and Biogenesis in a Chronic Model of Type 1 Diabetes. American Journal of Physiology-Endocrinology and Metabolism 2004; 287(5): E896-E905.
4-Balducci S, Zanuso S, Nicolucci A, Fernando F, Cavallo S, Cardelli P, et al. Anti-Inflammatory Effect of Exercise Training in Subjects with Type 2 Diabetes and the Metabolic Syndrome is Dependent on Exercise Modalities and Independent of Weight Loss. Nutrition, Metabolism and Cardiovascular Diseases 2010; 20(8): 608-17.
5-Kraemer WJ, Ratamess NA. Hormonal Responses and Adaptations to Resistance Exercise and Training. Sports Medicine 2005; 35(4): 339-61.
6-Sigal RJ, Armstrong MJ, Bacon SL, Boulé NG, Dasgupta K, Kenny GP, et al. Activité Physique et Diabète. Can J Diabetes 2018; 42(2): S54-S63.
7-Duncan J. Fong JL, Medeiros DM, Finck BN, Kelly DP. Insulin-Resistant Heart Exhibits a Mitochondrial Biogenic Response Driven by the Peroxisome Proliferator-Activated Receptor-Alpha/PGC-1alpha Gene Regulatory Pathway. Circulation 2007; 115(5): 909-17.
8-Boström P, Mann N, Wu J, Quintero PA, Plovie ER, Panáková D, et al. C/Ebpβ Controls Exercise-Induced Cardiac Growth and Protects Against Pathological Cardiac Remodeling. Cell 2010; 143(7): 1072-83.
9-Burgomaster KA, Howarth KR, Phillips SM, Rakobowchuk M, Macdonald MJ, Mcgee SL, et al. Similar Metabolic Adaptations During Exercise after Low Volume Sprint Interval and Traditional Endurance Training in Humans. Physiol 2008; 586(1): 151-60.
10-Granata C, Jamnick NA, Bishop DJ. Principles of Exercise Prescription, And How They Influence Exercise-Induced Changes of Transcription Factors and Other Regulators of Mitochondrial Biogenesis. Sports Med 2018; 48(7): 1541-59.
11-Lundby C, Jacobs RA. Adaptations of Skeletal Muscle Mitochondria to Exercise Training. Exp Physiol 2016; 101(1): 17-22.
12-Yeo WK, Mcgee SL, Carey AL, Paton CD, Garnham AP, Hargreaves M, et al. Acute Signalling Responses to Intense Endurance Training Commenced with Low or Normal Muscle Glycogen. Exp Physiol 2010; 95(2): 351-8.
13-Sahin E, Depinho RA. Axis of Ageing: Telomeres, P53 and Mitochondria. Nat Rev Mol Cell Biol 2012; 13(6): 397-404.
14-Sano M, Schneider MD. Energizer: PGC-1α Keeps the Heart Going. Cell Metab 2005; 1(4): 216-8.
15-Leek BT, Mudaliar SR, Henry R, Mathieu-Costello O, Richardson RS. Effect of Acute Exercise on Citrate Synthase Activity in Untrained and Trained Human Skeletal Muscle. Am J Physiol-Regul, Integr Comp Physiol 2001; 280(2): R441-R7.
16-Vettor R, Valerio A, Ragni M, Trevellin E, Granzotto M, Olivieri M, et al. Exercise Training Boosts Enos-Dependent Mitochondrial Biogenesis in Mouse Heart: Role in Adaptation of Glucose Metabolism. Am J Physiol-Endocrinol Metabol 2014; 306(5): E519-E28.
17-He Z, Hu Y, Feng L, Li Y, Liu G, Xi Y, et al. NRF-1 Genotypes and Endurance Exercise Capacity in Young Chinese Men. Br J Sports Med 2008; 42(5): 361-6.
18-Hinge CR, Ingle SB, Adgaonkar BD. Body Mass Index, Blood Pressure and Lipid Profile in Type 2 Diabetes-Review. Int J Cur Res Rev| Vol 2018; 10(10): 1-9.
19-Gibala MJ, Little JP, Macdonald MJ, Hawley JA. Physiological Adaptations to Low Volume, High Intensity Interval Training in Health and Disease. J Physiol 2012; 590(5): 1077-84.
20-Estes Rr, Malinowski A, Piacentini M, Thrush D, Salley E, Losey C, et al. The Effect of High Intensity Interval Run Training on Cross-Sectional Area of the Vastus Lateralis in Untrained College Students. Int J Exerc Sci 2017; 10(1): 137-145.
21-Röckl KS, Witczak CA, Goodyear LJ. Signaling Mechanisms in Skeletal Muscle: Acute Responses and Chronic Adaptations to Exercise. IUBMB Life 2008; 60(3): 145-53.
22-Pierre W, Gildas AJH, Ulrich MC, Modeste W-N, Aztélesphore Benoît N, Albert K. Hypoglycemic and Hypolipidemic Effects of Bersama Engleriana Leaves in Nicotinamide/Streptozotocin-Induced Type 2 Diabetic Rats. BMC Complementary Altern Med 2012; 12(1): 264.
23-Leandro CG, Levada AC, Hirabara SM, Manhães-De-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Cond Res 2007; 21(3): 751-6.
24-Ghaderpour S, Zare S, Ghaderi Pakdel F. Effects of Acute Intra-Hippocompal Injection of Bupropion on Active Avoidance Learning in Rats. Physiology and Pharmacology 2010; 14(3): 289-96.
25-Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, et al. Accurate Normalization of Real-Time Quantitative RT-PCR Data by Geometric Averaging of Multiple Internal Control Genes. Genom Biol 2002; 3(7): 1-12.
26-Kotenko SV, Gallagher G, Baurin VV, Lewis-Antes A, Shen M, Shah NK, et al. IFN-Λs Mediate Antiviral Protection Through a Distinct Class II Cytokine Receptor Complex. Nature Immunology 2003; 4(1): 69-77.
27-Schiaffino S, Dyar KA, Ciciliot S, Blaauw B, Sandri M. Mechanisms Regulating Skeletal Muscle Growth and Atrophy. The FEBS Journal 2013; 280(17): 4294-314.
28-Spriet LL, Howlett RA, Heigenhauser GJ. An Enzymatic Approach to Lactate Production in Human Skeletal Muscle during Exercise. Med Sci in Sports & Exerc 2000; 32(4): 756-63.
29-Bartlett JD, Hwa Joo C, Jeong TS, Louhelainen J, Cochran AJ, Gibala MJ, et al. Matched Work High-Intensity Interval and Continuous Running Induce Similar Increases in PGC-1α Mrna, AMPK, P38, And P53 Phosphorylation in Human Skeletal Muscle. J Appl Physiol 2012; 112(7): 1135-43.
30-Huang CC, Wang T, Tung YT, Lin WT. Effect of Exercise Training on Skeletal Muscle SIRT1 and PGC-1α Expression Levels in Rats of Different Age. Int J Med Sci 2016; 13(4): 260-70.
31-Saleem A, Adhihetty PJ, Hood DA. Role of P53 in Mitochondrial Biogenesis and Apoptosis in Skeletal Muscle. Physiol Genomics 2009; 37(1): 58-66.
32-Little JP, Gillen JB, Percival ME, Safdar A, Tarnopolsky MA, Punthakee Z, et al. Low-Volume High-Intensity Interval Training Reduces Hyperglycemia and Increases Muscle Mitochondrial Capacity in Patients With Type 2 Diabetes. J Appl Physiol (Bethesda, Md: 1985) 2011; 111(6): 1554-60.
متن کامل: (2102 مشاهده)
مقدمه
دیابت نوع2 از جمله بیماریهای متابولیکی است که بهواسطه هایپرگلایسمی با مشخصه بارز مقاومت بهانسولین شناخته میشود، که از دلایل ابتلا به آن چاقی، کمتحرکی و استرس محیطی ذکر شده است (1). بهطوریکه نقص در عملکرد انسولین موجب اختلال در متابولیسم کربوهیدرات، چربی و پروتئین میگردد (2)، سپس تولید رادیکالهای آزاد افزایش یافته و دفاع آنتیاکسیدانی کاهش مییابد (3) و موجب محدود شدن خون و اکسیژنرسانی به قلب میشود (4) و التهاب ایجاد میکند (5). لازم به ذکر است که اختلال میتوکندری هدف عمده در میوسیت نمونههای دیابتی است که بهدلیل استرس اکسایشی تحریک میشود (3). پس از آن ظرفیت هوازی کاهش مییابد (6). بر این اساس خطر ابتلاء به بیماریهای قلبی عروقی در افراد دیابتی تا 4 برابر افراد سالم گزارش شده است (4). همچنین به دلیل نقص در متابولیسم انرژی (7) و نیز با افزایش استرس اکسایشی مقادیر پرواکسیزوم گامای1 آلفا (PGC-1α) کاهش مییابد (8) همچنین مقادیر کاهش یافته PGC-1α زایش میتوکندری را کاهش میدهد (9). از طرفی بهدلیل ایجاد مقاومت بهانسولین نسبت ATP به ADP افزایش مییابد، زیرا متابولیسم ناقص سلولی باعث مهار پروتئینهای فسفوکینازی P-38 MAPK وAMPK میشود و مقادیر پروتئین سرین تروئونین1(SIRT-1) افزایش یافته در حالیکه اتصال انسولین به گیرندهاش تضعیف میشود (10). همچنین همراه با کاهش PGC-1α تولید و عملکرد آنزیم سیتراتسنتاز (CS) کاهش مییابد که نشاندهنده کاهش چگالی میتوکندری است (11). فاکتور PGC-1α یک تنظیمکننده کلیدی در تعادل انرژی است که موجب افزایش متابولیسم لیپید میشود(7) و از پراکسیداسیون غشاء سلول و آسیب میتوکندری جلوگیری میکند (9)، از طرفی سیتراتسنتتاز جهت اندازهگیری ظرفیت هوازی و چگالی میتوکندری جزء مهم میباشد (11)، در حالیکه مصرف گلوکز موجب فعالسازی AMPK/PGC1-α و افزایش در ساخت سیتراتسنتتاز میشود (12). از طرف دیگر بهدنبال افزایش فشار اکسایشی و مهار PGC-1α و نیز افزایش در تولید P-53 و رهاسازی سیتوکرومC بهداخل سیتوزول، میتوکندری تخریب میشود (13). به این دلیل عنوان شده PGC-1αفاکتور رونویسی مهمی است که برای زایش میتوکندری ضروری میباشد (14). همچنین افزایش میزان PGC-1α موجب هایپرتروفی فیزیولوژیک در بافت قلب می¬شود (8). در خصوص تاثیر مقادیر سیتراتسنتتاز بر افزایش چگالی میتوکندری عنوان شده، سیرات سنتاز باعث اتصال استیلکوآ بهاگزالواستات می¬شود و بهوسیله افزایش ظرفیت هوازی موجب بهبود عملکرد میتوکندری میگردد (15). وتور و همکاران (2013) نیز در تایید این فرضیات نشان داد که بعد از شش هفته تمرین شنا، بیان eNOS و PGC-1αدر بافت قلب افزایش پیدا میکند که پیامد آن افزایش بیوژنز میتوکندری بود (16). همچنین در مطالعه هیژ و همکاران (2008) بیان شده است PGC-1α بر اثر یک دوره تمرین مقاومتی با شدتهای بالا در اعمال تاثیرات محافظت قلبی-عروقی، موجب تنظیم افزایشی مسیر پیامرسانی NO/SIRT1/PGC-1α شد که منجر به تضعیف و مقابله با اختلالات میتوکندریایی در نمونههای دیابتی نوع2 میشود (17). براساس مطالعات مختلف تمرین منظم در کنار رژیمغذایی و درمان داروئی در تعادل متابولیسم سلولی (16) و تنظیم بیان ژن در بیماران دیابتی موثر است (18). زیرا انجام تمرین منظم بهوسیله افزایش در تولید و فعالیت PGC-1α عملکرد مویرگهای خونی را بهبود میبخشد و مرگ سلولی را در میوسیت مهار میکند (16). در خصوص تاثیرتمرین متناوب، برخی مطالعات اظهار داشتند اجرای تمرینHIIT شامل تناوبهای با شدت بالا و برگشت به حالت اولیه فعال در بین تناوب¬های شدید، مصرف گلوکز را افزایش میدهد (19) و از جهشهای ژنی در بیماران متابولیکی پیشگیری میکند (20). زیرا تمرینHIIT با راهاندازی مسیر GLUT-4 باعث مصرف گلوکز شده (19) و از مسیر فعالسازی کلسیم و اتصال آن به کالمودولین (CAMK-II) (18) بر بهبود تعادل انرژی (20) و جلوگیری از جهش ژن موثر است (19). اگر تمرین از شدت مناسبی برخوردار باشد موجب افزایش سیتراتسنتتاز در میتوکندری میوسیت میشود و تا 24 ساعت پس از انجام تمرین ظرفیت هوازی را افزایش میدهد (21). از آنجایی که به اجرای تمرینتناوبی شدید در بیماران دیابتی، بهعنوان راهکاری موثر در کنار سایر مراحل درمانی و بهبود سلامت قلب توجه معطوف شده و با توجه به اینکه اخیراً بیان شده است تمرینهای تناوبی با شدتهای مختلف سبب بهبود ژنهای زایش میتوکندری و تنظیم منفی عوامل مرگ برنامهریزی سلول و میتوکندری میشود، اما در رابطه با نقش تمرین در شدتهای زیاد در مدل دیابت نوع 2 و در زنهای مورد مطالعه، مطالعات محدود (16) و متناقضی وجود دارد (20)، لذا پژوهش حاضر برای اولین بار در بررسی تاثیر4 هفته تمرینتناوبی شدید بر بیان ژنهای PGC-1α، CS وp-53 در کاردیومیوسیت موشهای چاق صحرائی نرمبتلا به دیابت نوع 2 انجام شد.
روش بررسی
درپژوهش تجربی–آزمایشگاهی حاضر که با مدل حیوانی انجام شد، 18 سر موش صحرائی نر نژاد ویستار از مرکز انستیتو پاستور رازی تهیه و به آزمایشگاه حیوانات دانشگاه تربیت مدرس انتقال داده شدند. سن حیوانات 5 تا 6 هفته و میانگین وزن 280 تا 350 گرم بود. حیوانات بهطور تصادفی به 3 گروه 6 تایی تقسیم شدند: 1- تمرینتناوبی شدید HIIT، 2- کنترل دیابتی DC، 3- کنترل سالم NC. حیوانات در قفسهای پلیکربنات شفاف ساخت شرکت رازی و در محیط با دمای 3±22 درجه سانتیگراد و چرخه روشنائی تاریکی 12:12 با دسترسی آزادانه به آب و غذای مخصوص حیوانات (پلت) نگهداری شدند.
روش اجرای تحقیق
نحوه القای دیابت: دیابت در همه موشها بهجز گروه کنترل سالم بدین صورت القاء شد: پس از یک شب ناشتایی ابتدا محلول نیکوتینآمید با دوز 110 میلیگرم بر کیلوگرم وزن بدن بهصورت داخل صفاقی تزریق شد. بعد از 15 دقیقه، محلول تازه تهیه شده استرپتوزوتوسین (STZ) در بافر سیترات با 4/5 pH بهصورت داخل صفاقی با دوز 60 میلیگرم بر کیلوگرم، بافر 0/05 مول سیترات بهصورت حل شده گاواژ شد (22). گسترش هایپرگلایسمی با افزایش گلوکز خون بعد از گذشت 72 ساعت از زمان تزریق، اندازهگیری قند خون ناشتا توسط دستگاه گلوکومتر (01 ساخت ژاپن) از ورید دم موشها با در نظر گرفتن قند خون بالاتر از 200 میلیگرم بر دسیلیتر تائید شد (22). جدول1 تغییرات وزن و شاخص گلوکز را در گروههای پژوهش نشان میدهد.
جدول 1: تغییرات وزن و غلظت گلوکز به تفکیک گروهها

اعداد به شکل میانگین± انحراف استاندارد بیان شدهاند، *نشانۀ معناداری نسبت به گروه کنترل¬دیابتی.
روش اجرای تمرین
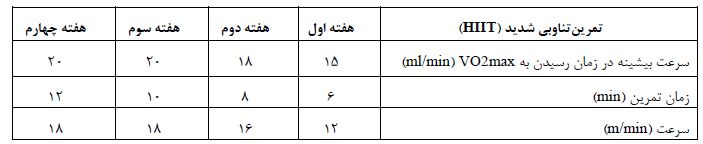
پس از یک هفته آشناسازی حیوانات با راه رفتن بر روی تردمیل مخصوص جوندگان با سرعت 6 متر بر دقیقه، قبل از اجرای برنامههای تمرین، ابتدا ارزیابی توان هوازی با محاسبه سرعت بیشینه در زمان رسیدن به VO2 max و محاسبه شدت تمرین با استفاده از آزمون فزاینده لئاندرو و همکاران (2007) بدین صورت انجام شد: بعد از 3 دقیقه گرم کردن با سرعت 5 متر بر دقیقه و با شیب صفر درجه توسط تغییر در سرعت نوارگردان که در هر 2 دقیقه یکبار m/mim 0/2 افزایش یافت. بر این اساس تعیین حداکثر سرعت بیشینه زمانی بود که حیوانات حد اقل 1 تا 3 دقیقه نتوانند با یک سرعت ثابت بدوند و بلافاصله با افزایش سرعت قادر به دویدن نباشند (23). سپس برنامه تمرین تناوبی شدید (HIIT) شامل 5 دقیقه گرم و سردکردن با شدت 30 درصد سرعت بیشینه (5 متر بر دقیقه) و 6 دقیقه تناوب تمرین با شدت 85 درصد سرعت بیشینه در هفته اول که به 20 دقیقه دویدن با شدت 90 درصد سرعت بیشینه در پایان هفته چهارم رسید. تعداد تکرار تناوب با شدت بالا در دو هفته اول چهار تکرار بود که در هفتههای سوم و چهارم به پنج تکرار رسید، زمان تناوب با شدت بالا دو دقیقه و تناوب با شدت پائین نیز دو دقیقه بود. جدول2. همچنین بر طبق الگوی تمرینی انجام شده، سنجش VO2max در روز ششم هفته دوم بررسی شد و سرعت تمرین براساس آن تا پایان هفته چهارم تعیین شد. همینطور یک روز در هفته برای استراحت در نظر گرفته شد. گروههای کنترل در هیچگونه برنامه تمرینی شرکت نداشتند، اما برای ایجاد شرایط کاملا یکسان 5 بار در هفته و به مدت 5 تا 10 دقیقه در هر جلسه برای سازگاری با محیط بر روی نوار گردان کاملا بیحرکت قرار داده میشدند.
جدول 2: برنامه تمرینتناوبی شدید طی 4 هفته
روش استخراج نمونه و سنجش ژنهای PGC-1α، CS،P-53
24 ساعت پس از آخرین جلسه تمرین موشهای چاق نر صحرائی توسط تزریق درون صفاقی کتامین 80 میلیگرم بر کیلوگرم و زایلازین 10 میلیگرم بر کیلوگرم بیهوش شدند (24). سپس خون بهطور مستقیم از بطن چپ حیوانات دریافت و در لولههای حاوی هپارین ریخته شد و به مدت 15 دقیقه با سرعت 3000 متر بر دقیقه در دمای 15 درجه سانتیگراد در دستگاه سانتریفیوژ قرار داده شد. سپس بافت بطن چپ بلافاصله استخراج و در نیتروژن 20- منجمد و برای سنجش بیان ژن در فریزر 80- نگهداری شد. جهت سنجش بیان ژنهای PGC-1α، CS، P-53 از روش Realtime-PCR با Premix Extaqit و از GAPDH بهعنوان ژن کنترل استفاده گردید. جهت اندازه¬گیری مقدار بیان ژن بهصورت توأمان با هر یک از ژن¬ها به وسیله کیت 50 Mir nasy mini kit (qiagene ساخت آلمان) بر طبق دستورالعمل Vandesompeleو همکاران (2002) انجام شد (25). برای استخراج RNA میزان 50 میلی¬گرم بافت منجمد شده قلب حیوان هموژن گردید و طبق دستورالعمل شرکت سازنده کیت محلول RNAاز آن استخراج شد، و با آنزیم DNaseIاز هرگونه آلودگی به DNA و آنزیمهای تخریبکننده RNA پاکسازی گردید. بر این اساس از هرکدام از نمونه¬ها 2 میکروگرمmRNA برای سنتز اولین رشته cDNAاستفاده شد. مقدار نسبی بیان ژن برای ژنهای مورد مطالعه در بافت قلب با کمک پرایمرهای اختصاصی آنها اندازه¬گیری شد. نسبت جذبی 260 تا 280 نانوگرمی برای تمام نمونههای استخراج شده 8/1 تا 2 بود. جهت بررسی کیفیتRNA استخراج شده از روش الکتروفروز و ژل آگارز1 درصد استفاده شد. قبل از سنجش cDNA برای اطمینان از نبودDNA در نمونه استخراج شده DNAs treatment (thermos scientific، ساخت آلمان) انجام شد. سنتز cDNA با کیتtranse criptor first strand cDNAsinthesis kit (roch ، ساخت آلمان) انجام شد (26). برنامه Real time PCR بهوسیله دستگاه Rotrogene 6000, corbet") ساخت آلمان انجام شد. این برنامه بر اساس SYBER Green (ampligon ,ساخت دانمارک) با دور 95 درجه سانتی¬گراد به مدت 15 دقیقه و بلافاصله 40 چرخه با 95 درجه سانتی¬گراد به مدت 15 ثانیه و 60 درجه سانتیگراد به مدت 60 ثانیه با پرایمر طراحی شده (ساخت نیکا زیست ژن ایران) انجام شد.
جدول 3: توالی پرایمری ژنهای مورد مطالعه

تجزیه و تحلیل آماری
در بخش مربوط به آمار توصیفی از شاخص پراکندگی، انحراف معیار و نمودار استفاده شد. از طریق آزمون لون پراکندگی واریانس ها تشخیص داده شد و نتایج نشان داد دادهها ﺗﻮزیﻊ ﻃﺒﯿﻌﯽ دارد و اﻣﮑﺎن اﺳﺘﻔﺎده از آزﻣﻮن ﭘﺎراﻣﺘﺮیﮏ وﺟﻮد دارد. نرمال بودن دادهها توسط آزمون شاپیروویلک بررسی شد. برای تعیین اختلافات بین گروهی از آنووای یکراهه و آزمون تعقیبی توکی در سطح معناداری 0/05استفاده شد. تجزیه و تحلیل دادهها با نرمافزار Graph pad prism نسخه 8 انجام شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد تهران مرکزی تایید شده است (کد اخلاق.IR.SSRC.REC.1398.548). تمام مراحل مختلف پژوهش با رعایت مسائل اخلاقی، مطابق دستور العمل کمیته اخلاق کار با حیوانات آزمایشگاهی مستخرج از دستور العمل هلیسنگی انجام شد.
نتایج
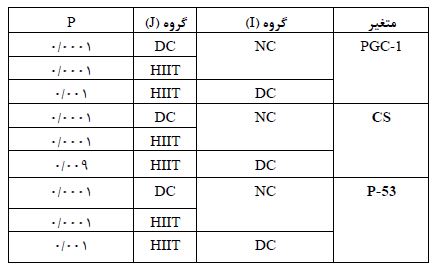
مقدار وزن و گلوکز پلاسما بعد از گذشت4 هفته تمرین HIIT کاهش معناداری داشتند. افزایش بیان ژن PGC1-α در گروه تمرینHIIT نسبت بهگروههای DC وNC به ترتیب (P=0/001) و (P=0/0001) معنادار بود. افزایش ژنCS در گروه تمرین نسبت به گروههای DC وNC به ترتیب (P=0/009) و (0/0001=P) معنادار شد. کاهش بیان ژنP-53 در گروه تمرین نسبت بهگروهDC و گروهNC بهترتیب (P=0/001) و (0/0001=P) تغییر معنادار داشت. این بدین معناست که تمرین HIIT بر تغیرات بیان ژن در کاردیومیوسیت نقش دارشته است. جدول4 یافتههای آزمون توکی را بهمنظور بررسی جایگاه تفاوتهای درون گروهی نشان میدهد.
جدول4: یافتههای آزمون توکی به منظور بررسی جایگاه تفاوت های درون گروهی
*مقایسه گروهها توسط آزمون آماری آنوای یکراهه، در سطح آلفای 0/05 انجام شد.

شکل 1: تغییرات بیان ژن PGC1-α در گروه های پژوهش.
*معناداری نسبت به گروه کنترل سالم، $معناداری نسبت به گروه کنترل دیابتی (برابر تغییر نسبت به گروه کنترل)
گروه تمرینتناوبی شدید H، گروه کنترل دیابتی DC، گروه کنترل سالم NC
.jpg)
شکل 2: تغییرات بیان ژن CS در گروه های پژوهش.
*معناداری به گروه کنترل سالم، $معناداری نسبت به گروه کنترل دیابتی (برابر نسبت تغییر به گروه کنترل)
گروه تمرینتناوبی شدید H، گروه کنترل دیابتی DC، گروه کنترل سالم NC

شکل3: تغییرات بیان ژن P-53 در گروه های پژوهش.
*معناداری به گروه کنترل سالم، $معناداری نسبت به گروه کنترل دیابتی (برابر نسبت تغییر به گروه کنترل).
گروه تمرینتناوبی شدید H، گروه کنترل دیابتی DC، گروه کنترل سالم NC
بحث
پژوهش حاضر به بررسی تاثیر4 هفته تمرینتناوبی شدید بر بیان ژنهای PGC-1α، CS وP-53 در کاردیومیوسیت موشهای چاق صحرائی نرمبتلا بهدیابت نوع 2 القاء شده با STZ پرداخت. نتایج پژوهش نشان داد بیان ژنی دو عامل اندازهگیری شده PGC-1α و CS که مرتبط با بیوژنز میتوکندریایی و تنفس سلولی است، در گروه تمرین نسبت به دو گروه کنترل روند افزایشی معناداری داشت. اما عامل P-53 که مرتبط با عوامل ضد زایش و رشد میتوکندریایی شناخته میشود بهصورت معناداری در گروه تمرین نسبت به دو گروه کنترل روند کاهشی داشت. از طرف دیگر، مقادیر گلوکز پلاسما و وزن کلی بدن حیوانات نیز در گروه تمرین روند کاهشی داشته است. نتایج این مطالعه بهصورت کلی به نقش تمرینات تناوبی شدید بر سوخت و ساز انرژی در میتوکندری عضله قلب پرداخت و برای اولین بار به این مهم پرداخت که شدت بالای تمرین در روند مولکولی و تنفس سلولی می¬تواند آبشار پیامرسانی مرتبط با بیوژنز میتوکندریایی را تقویت کند و از روند آپوپتوزیس جلوگیری کند. اما در ارتباط با مکانیسم اثر مولکولی این تمرینات باید گفت، در اجرای اینگونه تمرینات به دلیل انقباضهای مکرر و بهکارگیری تارهای تند انقباض در تناوبهای شدید با راهاندازی سیگنالهای درون سلولی در مسیر کلسیم و اتصال آن با کالمودولین (CAMK-II)، افزایش بیان پروتئین فعال شونده با میتوفیوژن (P-38MAPK) از مسیر غیرمستقیم مصرف گلوکز را افزایش داده (18) و با به-کارگیری تارهای کند انقباض در تناوبهای استراحت فعال باعث تنظیم بیان ژن میشود (20). زیرا بازگشت به حالت اولیه فعال با شدت کم پس از افزایش متابولیسم سلولی در اجرای وهلههای شدید در تمرین باعث آزادسازی متسعکنندههای عروقی و سپس PGC1-α شده و زایش میتوکندری را افزایش میدهد و از ساختار قلب محافظت می-کند (27). همچنین افزایش فعالیت آنزیم¬های هوازی با اجرای تمرینات HIIT، با استراحت فعال در اجرای این نوع از تمرینات ذکر شده است (28). تاثیرگذاری بالای تمرین HIIT به استراحت فعال بعد از تناوبهای شدید نسبت داده شده است (29). همچنین بر اساس فرضیه شاتل درون سلولی و مصرف لاکتات در چرخههوازی با راهاندازی مسیر تری کربوکسیلیک اسید (TCA) باعث مصرف لاکتات توسط میتوکندری میشود، که از راه تولید و عملکرد لاکتات دهیدروژناز (LDH) است، بعد از آن موجب افزایش مقادیر CS میشود و التهاب سلولی را کاهش می¬دهد (28). همچنین عنوان شده افزایش سنتز CS در تمرینات تناوبی بهدلیل مصرف بالای گلیکوژن درون عضلانی و افزایش نسبت ATP به ADP بهدلیل فعالیت AMP است (17،26). افزایش عملکرد آنزیمهای هوازی موجب بهبود در متابولیسم لیپید میشود (28). تمرین HIIT که در شدت-های انفجاری کوتاه مدت انجام می¬شود موجب افزایش موقتی در فشار بطن چپ میگردد که پس از آن با تولید پروتئینهای شوک گرمائی (HSP-S) از سلولهای میوسیت محافظت میکند (19). در مقایسه اثر تمرین با دو شدت متفاوت عنوان شده، تمرین با شدت متوسط (MIT) دفاع ضد اکسایشی را همراه با افزایش در سنتز آنزیم¬های هوازی افزایش داده (19)، در حالیکه تمرینتناوبی شدید (HIIT) به دلیل ایجاد اصطکاک و تنش برشی بالاتر همراه با انقباضات پی در پی و کاهش مقاومت عروقی، خون و اکسیژن بالاتری به قلب و عضلات فعال می¬رساند و حساسیت انسولینی را بهبود می-بخشد (20). مطالعات گذشته به شیوههای تمرین تداومی و مقاومتی پرداختهاند و مطالعهای که تمرینات تناوبی را در عوامل اندازهگیری شده این مطالعه گزارش کند وجود نداشت و بهمطالعات شبیهتر پرداخته شد. نتایج مطالعه یئو و همکاران (2010) نشان داد انقباض مکرر عضلانی ناشی از یک دوره تمرینات تداومی با شدت بالا موجب فعالسازی سیگنالینگ AMPK/PGC-1α و متعاقب آن افزایش تولید و فعالیتCS میشود (12). نتایج این مطالعه با مطالعه حاضر همسو بود. نتایج مطالعه وانگ و همکاران (2015) نشان داد شدت تمرین هوازی با شدت متوسط عامل موثری در افزایش رونویسی از ژن CS و افزایش بیوژنز میتوکندری تا 24 ساعت بعد از تمرین است (21) که موجب افزایش ظرفیت هوازی در مدل دیابتی نوع 2 شده بود و با مطالعه حاضر همسویی دارد. نتایج مطالعه بارتلت و همکاران (2012) نشان داد، پس از تمرین HIT با شدت 90 درصد حداکثر اکسیژن مصرفی در3 ست با 6 تکرار و استراحت فعال با شدت 70 درصد VO2max همراه با افزایش بیان PGC1-α مقادیر P-53 کاهش یافت (29). نتایج مطالعهای نشان داد، 12 هفته تمرین شنا، 5 روز در هفته به مدت 40 دقیقه در موشهای مسن موجب افزایش فعالیت SIRT-1 و کاهش ترجمه فاکتور رونویسی کاپای B (NF-KB) و پروتئین سرچنگالی (FOXO) شد و بهوسیله افزایش در PGC1-αاز تخریب سلول پیشگیری کرد و با کاهش ROS از ساختار قلب محافظت میکند (30). که با نتایج مطالعه حاضر همسو بود. در حالیکه فعالیت تناوبی سرعتی در 4 ست با 7 تکرار در 30 ثانیه در موشهای نر اسپیروگوداولی مبتلا به انفارکتوس قلبی برمقادیر PGC1-α تاثیری نداشت، اما باعث افزایش P-53 شد (31). این یافتهها با نتایج مطالعه حاضر ناهمسو است. یک وهله فعالیت حاد مقاومتی موجب افزایش P-53 شد. این نتایج با نتایج مطالعه حاضر ناهمسو است. در مطالعه دیگری که به بررسی اثر شدت تمرین پرداخت چنین نتیجهگیری کرد، تمرین HIT 3 روز در هفته بهمدت 30 دقیقه که با حجم کمتر از تمرین HIIT اجرا شد بر تنظیم گلوکز، بهبود عملکرد میتوکندری بهدلیل تولید و افزایش عملکرد آنزیم SC افزایش فعالیت زیر واحد کمپلکس پروتئین 70 کیلو دالتونی، پروتئین میتوفیوژن2 و افزایش فعالیت GLUT-4 در مبتلایان بهدیابت موثرتر بود (32). این نتایج با نتایج مطالعه حاضر همسو است. تناقض نتایج برخی مطالعات با یافتههای مطالعه حاضر میتواند نوع، شدت، مدت تمرین و سلامت آزمودنیها باشد (30). همچنین میتوان برداشت کرد در مطالعه حاضر بهدلیل برنامه 4 هفتهای، سازگاریهای هایپرتروفی عضلانی اتفاق نیفتاد که میتوان عاملی برای کاهش وزن موشهای گروه تمرین بیان کرد. همچنین شدت بالای تمرین در هفتههای اول باعث کاهش وزن عضلات بهدلیل سوخت و ساز خاص تمرینات تناوبی می-شود. از محدودیتهای این مطالعه میتوان به عدمدسترسی به نمونههای انسانی اشاره کرد، محدودیت دیگر نیز عدم استفاده از روش وسترن بلات جهت سنجش پروتئین ژنهای مذکور است که بهدلیل کمبود بودجه پژوهش میباشد. در پایان پیشنهاد میشود در مطالعات آینده مدلهای تمرینی مذکور با تمرین تداومی و بهطور گستردهتر بررسی و مقایسه شود. همچنین پیشنهاد میشود ژنها و پروتئینهای مرتبط دیگر در روند مسیر پیامرسانی متابولیسم میتوکندری در عضله قلب مورد بررسی قرار گیرند و بهصورت مطالعه مروری گزارش شود.
نتیجهگیری
بهطور کلی نتایج مطالعه حاضر نشان داد، تمرین HIIT بر سطوح نشانگرهای محرک و بازدارنده بیوژنز میتوکندری نقش دارد و موجب افزایش مصرف گلوکز خون و بهبود در عملکرد ژنهای PGC-1α ،CS و کاهش در سنتز P-53 در کاردیومیوسیت موشهای چاق صحرائی نر مبتلا به دیابت نوع 2 میگردد، بر این اساس بیان ژن را تنظیم کرده و از آنجاییکه در بیماران مبتلا بهدیابت نوع دو مسیر پیام رسانی، پروتئین و ژنهای دخیل در بیوژنز میتوکندریایی دچار بد تنظیمی میشود، احتمالاً این نوع تمرین میتواند بر بهبود کاردیومیوپاتی ناشی از دیابت موثر باشد.
سپاسگزاری
بدینوسیله از تمامی اساتید گرامی که در پیشبرد رساله دکتری و پژوهش حاضر، اینجانب را حمایت علمی نمودند کمال تشکر و قدردانی بهعمل میآید. این مقاله برگرفته از رساله دکتری خانم نادیا خیامپور، دانشجوی دکتری دانشگاه آزاد اسلامی واحد تهران مرکزی بوده است و هزینههای طرح توسط ایشان پرداخت گردیده است.
حامی مالی: ندارد.
تعارض¬درمنافع: وجود ندارد.
دیابت نوع2 از جمله بیماریهای متابولیکی است که بهواسطه هایپرگلایسمی با مشخصه بارز مقاومت بهانسولین شناخته میشود، که از دلایل ابتلا به آن چاقی، کمتحرکی و استرس محیطی ذکر شده است (1). بهطوریکه نقص در عملکرد انسولین موجب اختلال در متابولیسم کربوهیدرات، چربی و پروتئین میگردد (2)، سپس تولید رادیکالهای آزاد افزایش یافته و دفاع آنتیاکسیدانی کاهش مییابد (3) و موجب محدود شدن خون و اکسیژنرسانی به قلب میشود (4) و التهاب ایجاد میکند (5). لازم به ذکر است که اختلال میتوکندری هدف عمده در میوسیت نمونههای دیابتی است که بهدلیل استرس اکسایشی تحریک میشود (3). پس از آن ظرفیت هوازی کاهش مییابد (6). بر این اساس خطر ابتلاء به بیماریهای قلبی عروقی در افراد دیابتی تا 4 برابر افراد سالم گزارش شده است (4). همچنین به دلیل نقص در متابولیسم انرژی (7) و نیز با افزایش استرس اکسایشی مقادیر پرواکسیزوم گامای1 آلفا (PGC-1α) کاهش مییابد (8) همچنین مقادیر کاهش یافته PGC-1α زایش میتوکندری را کاهش میدهد (9). از طرفی بهدلیل ایجاد مقاومت بهانسولین نسبت ATP به ADP افزایش مییابد، زیرا متابولیسم ناقص سلولی باعث مهار پروتئینهای فسفوکینازی P-38 MAPK وAMPK میشود و مقادیر پروتئین سرین تروئونین1(SIRT-1) افزایش یافته در حالیکه اتصال انسولین به گیرندهاش تضعیف میشود (10). همچنین همراه با کاهش PGC-1α تولید و عملکرد آنزیم سیتراتسنتاز (CS) کاهش مییابد که نشاندهنده کاهش چگالی میتوکندری است (11). فاکتور PGC-1α یک تنظیمکننده کلیدی در تعادل انرژی است که موجب افزایش متابولیسم لیپید میشود(7) و از پراکسیداسیون غشاء سلول و آسیب میتوکندری جلوگیری میکند (9)، از طرفی سیتراتسنتتاز جهت اندازهگیری ظرفیت هوازی و چگالی میتوکندری جزء مهم میباشد (11)، در حالیکه مصرف گلوکز موجب فعالسازی AMPK/PGC1-α و افزایش در ساخت سیتراتسنتتاز میشود (12). از طرف دیگر بهدنبال افزایش فشار اکسایشی و مهار PGC-1α و نیز افزایش در تولید P-53 و رهاسازی سیتوکرومC بهداخل سیتوزول، میتوکندری تخریب میشود (13). به این دلیل عنوان شده PGC-1αفاکتور رونویسی مهمی است که برای زایش میتوکندری ضروری میباشد (14). همچنین افزایش میزان PGC-1α موجب هایپرتروفی فیزیولوژیک در بافت قلب می¬شود (8). در خصوص تاثیر مقادیر سیتراتسنتتاز بر افزایش چگالی میتوکندری عنوان شده، سیرات سنتاز باعث اتصال استیلکوآ بهاگزالواستات می¬شود و بهوسیله افزایش ظرفیت هوازی موجب بهبود عملکرد میتوکندری میگردد (15). وتور و همکاران (2013) نیز در تایید این فرضیات نشان داد که بعد از شش هفته تمرین شنا، بیان eNOS و PGC-1αدر بافت قلب افزایش پیدا میکند که پیامد آن افزایش بیوژنز میتوکندری بود (16). همچنین در مطالعه هیژ و همکاران (2008) بیان شده است PGC-1α بر اثر یک دوره تمرین مقاومتی با شدتهای بالا در اعمال تاثیرات محافظت قلبی-عروقی، موجب تنظیم افزایشی مسیر پیامرسانی NO/SIRT1/PGC-1α شد که منجر به تضعیف و مقابله با اختلالات میتوکندریایی در نمونههای دیابتی نوع2 میشود (17). براساس مطالعات مختلف تمرین منظم در کنار رژیمغذایی و درمان داروئی در تعادل متابولیسم سلولی (16) و تنظیم بیان ژن در بیماران دیابتی موثر است (18). زیرا انجام تمرین منظم بهوسیله افزایش در تولید و فعالیت PGC-1α عملکرد مویرگهای خونی را بهبود میبخشد و مرگ سلولی را در میوسیت مهار میکند (16). در خصوص تاثیرتمرین متناوب، برخی مطالعات اظهار داشتند اجرای تمرینHIIT شامل تناوبهای با شدت بالا و برگشت به حالت اولیه فعال در بین تناوب¬های شدید، مصرف گلوکز را افزایش میدهد (19) و از جهشهای ژنی در بیماران متابولیکی پیشگیری میکند (20). زیرا تمرینHIIT با راهاندازی مسیر GLUT-4 باعث مصرف گلوکز شده (19) و از مسیر فعالسازی کلسیم و اتصال آن به کالمودولین (CAMK-II) (18) بر بهبود تعادل انرژی (20) و جلوگیری از جهش ژن موثر است (19). اگر تمرین از شدت مناسبی برخوردار باشد موجب افزایش سیتراتسنتتاز در میتوکندری میوسیت میشود و تا 24 ساعت پس از انجام تمرین ظرفیت هوازی را افزایش میدهد (21). از آنجایی که به اجرای تمرینتناوبی شدید در بیماران دیابتی، بهعنوان راهکاری موثر در کنار سایر مراحل درمانی و بهبود سلامت قلب توجه معطوف شده و با توجه به اینکه اخیراً بیان شده است تمرینهای تناوبی با شدتهای مختلف سبب بهبود ژنهای زایش میتوکندری و تنظیم منفی عوامل مرگ برنامهریزی سلول و میتوکندری میشود، اما در رابطه با نقش تمرین در شدتهای زیاد در مدل دیابت نوع 2 و در زنهای مورد مطالعه، مطالعات محدود (16) و متناقضی وجود دارد (20)، لذا پژوهش حاضر برای اولین بار در بررسی تاثیر4 هفته تمرینتناوبی شدید بر بیان ژنهای PGC-1α، CS وp-53 در کاردیومیوسیت موشهای چاق صحرائی نرمبتلا به دیابت نوع 2 انجام شد.
روش بررسی
درپژوهش تجربی–آزمایشگاهی حاضر که با مدل حیوانی انجام شد، 18 سر موش صحرائی نر نژاد ویستار از مرکز انستیتو پاستور رازی تهیه و به آزمایشگاه حیوانات دانشگاه تربیت مدرس انتقال داده شدند. سن حیوانات 5 تا 6 هفته و میانگین وزن 280 تا 350 گرم بود. حیوانات بهطور تصادفی به 3 گروه 6 تایی تقسیم شدند: 1- تمرینتناوبی شدید HIIT، 2- کنترل دیابتی DC، 3- کنترل سالم NC. حیوانات در قفسهای پلیکربنات شفاف ساخت شرکت رازی و در محیط با دمای 3±22 درجه سانتیگراد و چرخه روشنائی تاریکی 12:12 با دسترسی آزادانه به آب و غذای مخصوص حیوانات (پلت) نگهداری شدند.
روش اجرای تحقیق
نحوه القای دیابت: دیابت در همه موشها بهجز گروه کنترل سالم بدین صورت القاء شد: پس از یک شب ناشتایی ابتدا محلول نیکوتینآمید با دوز 110 میلیگرم بر کیلوگرم وزن بدن بهصورت داخل صفاقی تزریق شد. بعد از 15 دقیقه، محلول تازه تهیه شده استرپتوزوتوسین (STZ) در بافر سیترات با 4/5 pH بهصورت داخل صفاقی با دوز 60 میلیگرم بر کیلوگرم، بافر 0/05 مول سیترات بهصورت حل شده گاواژ شد (22). گسترش هایپرگلایسمی با افزایش گلوکز خون بعد از گذشت 72 ساعت از زمان تزریق، اندازهگیری قند خون ناشتا توسط دستگاه گلوکومتر (01 ساخت ژاپن) از ورید دم موشها با در نظر گرفتن قند خون بالاتر از 200 میلیگرم بر دسیلیتر تائید شد (22). جدول1 تغییرات وزن و شاخص گلوکز را در گروههای پژوهش نشان میدهد.
جدول 1: تغییرات وزن و غلظت گلوکز به تفکیک گروهها

اعداد به شکل میانگین± انحراف استاندارد بیان شدهاند، *نشانۀ معناداری نسبت به گروه کنترل¬دیابتی.
روش اجرای تمرین
پس از یک هفته آشناسازی حیوانات با راه رفتن بر روی تردمیل مخصوص جوندگان با سرعت 6 متر بر دقیقه، قبل از اجرای برنامههای تمرین، ابتدا ارزیابی توان هوازی با محاسبه سرعت بیشینه در زمان رسیدن به VO2 max و محاسبه شدت تمرین با استفاده از آزمون فزاینده لئاندرو و همکاران (2007) بدین صورت انجام شد: بعد از 3 دقیقه گرم کردن با سرعت 5 متر بر دقیقه و با شیب صفر درجه توسط تغییر در سرعت نوارگردان که در هر 2 دقیقه یکبار m/mim 0/2 افزایش یافت. بر این اساس تعیین حداکثر سرعت بیشینه زمانی بود که حیوانات حد اقل 1 تا 3 دقیقه نتوانند با یک سرعت ثابت بدوند و بلافاصله با افزایش سرعت قادر به دویدن نباشند (23). سپس برنامه تمرین تناوبی شدید (HIIT) شامل 5 دقیقه گرم و سردکردن با شدت 30 درصد سرعت بیشینه (5 متر بر دقیقه) و 6 دقیقه تناوب تمرین با شدت 85 درصد سرعت بیشینه در هفته اول که به 20 دقیقه دویدن با شدت 90 درصد سرعت بیشینه در پایان هفته چهارم رسید. تعداد تکرار تناوب با شدت بالا در دو هفته اول چهار تکرار بود که در هفتههای سوم و چهارم به پنج تکرار رسید، زمان تناوب با شدت بالا دو دقیقه و تناوب با شدت پائین نیز دو دقیقه بود. جدول2. همچنین بر طبق الگوی تمرینی انجام شده، سنجش VO2max در روز ششم هفته دوم بررسی شد و سرعت تمرین براساس آن تا پایان هفته چهارم تعیین شد. همینطور یک روز در هفته برای استراحت در نظر گرفته شد. گروههای کنترل در هیچگونه برنامه تمرینی شرکت نداشتند، اما برای ایجاد شرایط کاملا یکسان 5 بار در هفته و به مدت 5 تا 10 دقیقه در هر جلسه برای سازگاری با محیط بر روی نوار گردان کاملا بیحرکت قرار داده میشدند.
جدول 2: برنامه تمرینتناوبی شدید طی 4 هفته

روش استخراج نمونه و سنجش ژنهای PGC-1α، CS،P-53
24 ساعت پس از آخرین جلسه تمرین موشهای چاق نر صحرائی توسط تزریق درون صفاقی کتامین 80 میلیگرم بر کیلوگرم و زایلازین 10 میلیگرم بر کیلوگرم بیهوش شدند (24). سپس خون بهطور مستقیم از بطن چپ حیوانات دریافت و در لولههای حاوی هپارین ریخته شد و به مدت 15 دقیقه با سرعت 3000 متر بر دقیقه در دمای 15 درجه سانتیگراد در دستگاه سانتریفیوژ قرار داده شد. سپس بافت بطن چپ بلافاصله استخراج و در نیتروژن 20- منجمد و برای سنجش بیان ژن در فریزر 80- نگهداری شد. جهت سنجش بیان ژنهای PGC-1α، CS، P-53 از روش Realtime-PCR با Premix Extaqit و از GAPDH بهعنوان ژن کنترل استفاده گردید. جهت اندازه¬گیری مقدار بیان ژن بهصورت توأمان با هر یک از ژن¬ها به وسیله کیت 50 Mir nasy mini kit (qiagene ساخت آلمان) بر طبق دستورالعمل Vandesompeleو همکاران (2002) انجام شد (25). برای استخراج RNA میزان 50 میلی¬گرم بافت منجمد شده قلب حیوان هموژن گردید و طبق دستورالعمل شرکت سازنده کیت محلول RNAاز آن استخراج شد، و با آنزیم DNaseIاز هرگونه آلودگی به DNA و آنزیمهای تخریبکننده RNA پاکسازی گردید. بر این اساس از هرکدام از نمونه¬ها 2 میکروگرمmRNA برای سنتز اولین رشته cDNAاستفاده شد. مقدار نسبی بیان ژن برای ژنهای مورد مطالعه در بافت قلب با کمک پرایمرهای اختصاصی آنها اندازه¬گیری شد. نسبت جذبی 260 تا 280 نانوگرمی برای تمام نمونههای استخراج شده 8/1 تا 2 بود. جهت بررسی کیفیتRNA استخراج شده از روش الکتروفروز و ژل آگارز1 درصد استفاده شد. قبل از سنجش cDNA برای اطمینان از نبودDNA در نمونه استخراج شده DNAs treatment (thermos scientific، ساخت آلمان) انجام شد. سنتز cDNA با کیتtranse criptor first strand cDNAsinthesis kit (roch ، ساخت آلمان) انجام شد (26). برنامه Real time PCR بهوسیله دستگاه Rotrogene 6000, corbet") ساخت آلمان انجام شد. این برنامه بر اساس SYBER Green (ampligon ,ساخت دانمارک) با دور 95 درجه سانتی¬گراد به مدت 15 دقیقه و بلافاصله 40 چرخه با 95 درجه سانتی¬گراد به مدت 15 ثانیه و 60 درجه سانتیگراد به مدت 60 ثانیه با پرایمر طراحی شده (ساخت نیکا زیست ژن ایران) انجام شد.
جدول 3: توالی پرایمری ژنهای مورد مطالعه

تجزیه و تحلیل آماری
در بخش مربوط به آمار توصیفی از شاخص پراکندگی، انحراف معیار و نمودار استفاده شد. از طریق آزمون لون پراکندگی واریانس ها تشخیص داده شد و نتایج نشان داد دادهها ﺗﻮزیﻊ ﻃﺒﯿﻌﯽ دارد و اﻣﮑﺎن اﺳﺘﻔﺎده از آزﻣﻮن ﭘﺎراﻣﺘﺮیﮏ وﺟﻮد دارد. نرمال بودن دادهها توسط آزمون شاپیروویلک بررسی شد. برای تعیین اختلافات بین گروهی از آنووای یکراهه و آزمون تعقیبی توکی در سطح معناداری 0/05استفاده شد. تجزیه و تحلیل دادهها با نرمافزار Graph pad prism نسخه 8 انجام شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه آزاد اسلامی واحد تهران مرکزی تایید شده است (کد اخلاق.IR.SSRC.REC.1398.548). تمام مراحل مختلف پژوهش با رعایت مسائل اخلاقی، مطابق دستور العمل کمیته اخلاق کار با حیوانات آزمایشگاهی مستخرج از دستور العمل هلیسنگی انجام شد.
نتایج
مقدار وزن و گلوکز پلاسما بعد از گذشت4 هفته تمرین HIIT کاهش معناداری داشتند. افزایش بیان ژن PGC1-α در گروه تمرینHIIT نسبت بهگروههای DC وNC به ترتیب (P=0/001) و (P=0/0001) معنادار بود. افزایش ژنCS در گروه تمرین نسبت به گروههای DC وNC به ترتیب (P=0/009) و (0/0001=P) معنادار شد. کاهش بیان ژنP-53 در گروه تمرین نسبت بهگروهDC و گروهNC بهترتیب (P=0/001) و (0/0001=P) تغییر معنادار داشت. این بدین معناست که تمرین HIIT بر تغیرات بیان ژن در کاردیومیوسیت نقش دارشته است. جدول4 یافتههای آزمون توکی را بهمنظور بررسی جایگاه تفاوتهای درون گروهی نشان میدهد.
جدول4: یافتههای آزمون توکی به منظور بررسی جایگاه تفاوت های درون گروهی

*مقایسه گروهها توسط آزمون آماری آنوای یکراهه، در سطح آلفای 0/05 انجام شد.

شکل 1: تغییرات بیان ژن PGC1-α در گروه های پژوهش.
*معناداری نسبت به گروه کنترل سالم، $معناداری نسبت به گروه کنترل دیابتی (برابر تغییر نسبت به گروه کنترل)
گروه تمرینتناوبی شدید H، گروه کنترل دیابتی DC، گروه کنترل سالم NC
.jpg)
شکل 2: تغییرات بیان ژن CS در گروه های پژوهش.
*معناداری به گروه کنترل سالم، $معناداری نسبت به گروه کنترل دیابتی (برابر نسبت تغییر به گروه کنترل)
گروه تمرینتناوبی شدید H، گروه کنترل دیابتی DC، گروه کنترل سالم NC

شکل3: تغییرات بیان ژن P-53 در گروه های پژوهش.
*معناداری به گروه کنترل سالم، $معناداری نسبت به گروه کنترل دیابتی (برابر نسبت تغییر به گروه کنترل).
گروه تمرینتناوبی شدید H، گروه کنترل دیابتی DC، گروه کنترل سالم NC
بحث
پژوهش حاضر به بررسی تاثیر4 هفته تمرینتناوبی شدید بر بیان ژنهای PGC-1α، CS وP-53 در کاردیومیوسیت موشهای چاق صحرائی نرمبتلا بهدیابت نوع 2 القاء شده با STZ پرداخت. نتایج پژوهش نشان داد بیان ژنی دو عامل اندازهگیری شده PGC-1α و CS که مرتبط با بیوژنز میتوکندریایی و تنفس سلولی است، در گروه تمرین نسبت به دو گروه کنترل روند افزایشی معناداری داشت. اما عامل P-53 که مرتبط با عوامل ضد زایش و رشد میتوکندریایی شناخته میشود بهصورت معناداری در گروه تمرین نسبت به دو گروه کنترل روند کاهشی داشت. از طرف دیگر، مقادیر گلوکز پلاسما و وزن کلی بدن حیوانات نیز در گروه تمرین روند کاهشی داشته است. نتایج این مطالعه بهصورت کلی به نقش تمرینات تناوبی شدید بر سوخت و ساز انرژی در میتوکندری عضله قلب پرداخت و برای اولین بار به این مهم پرداخت که شدت بالای تمرین در روند مولکولی و تنفس سلولی می¬تواند آبشار پیامرسانی مرتبط با بیوژنز میتوکندریایی را تقویت کند و از روند آپوپتوزیس جلوگیری کند. اما در ارتباط با مکانیسم اثر مولکولی این تمرینات باید گفت، در اجرای اینگونه تمرینات به دلیل انقباضهای مکرر و بهکارگیری تارهای تند انقباض در تناوبهای شدید با راهاندازی سیگنالهای درون سلولی در مسیر کلسیم و اتصال آن با کالمودولین (CAMK-II)، افزایش بیان پروتئین فعال شونده با میتوفیوژن (P-38MAPK) از مسیر غیرمستقیم مصرف گلوکز را افزایش داده (18) و با به-کارگیری تارهای کند انقباض در تناوبهای استراحت فعال باعث تنظیم بیان ژن میشود (20). زیرا بازگشت به حالت اولیه فعال با شدت کم پس از افزایش متابولیسم سلولی در اجرای وهلههای شدید در تمرین باعث آزادسازی متسعکنندههای عروقی و سپس PGC1-α شده و زایش میتوکندری را افزایش میدهد و از ساختار قلب محافظت می-کند (27). همچنین افزایش فعالیت آنزیم¬های هوازی با اجرای تمرینات HIIT، با استراحت فعال در اجرای این نوع از تمرینات ذکر شده است (28). تاثیرگذاری بالای تمرین HIIT به استراحت فعال بعد از تناوبهای شدید نسبت داده شده است (29). همچنین بر اساس فرضیه شاتل درون سلولی و مصرف لاکتات در چرخههوازی با راهاندازی مسیر تری کربوکسیلیک اسید (TCA) باعث مصرف لاکتات توسط میتوکندری میشود، که از راه تولید و عملکرد لاکتات دهیدروژناز (LDH) است، بعد از آن موجب افزایش مقادیر CS میشود و التهاب سلولی را کاهش می¬دهد (28). همچنین عنوان شده افزایش سنتز CS در تمرینات تناوبی بهدلیل مصرف بالای گلیکوژن درون عضلانی و افزایش نسبت ATP به ADP بهدلیل فعالیت AMP است (17،26). افزایش عملکرد آنزیمهای هوازی موجب بهبود در متابولیسم لیپید میشود (28). تمرین HIIT که در شدت-های انفجاری کوتاه مدت انجام می¬شود موجب افزایش موقتی در فشار بطن چپ میگردد که پس از آن با تولید پروتئینهای شوک گرمائی (HSP-S) از سلولهای میوسیت محافظت میکند (19). در مقایسه اثر تمرین با دو شدت متفاوت عنوان شده، تمرین با شدت متوسط (MIT) دفاع ضد اکسایشی را همراه با افزایش در سنتز آنزیم¬های هوازی افزایش داده (19)، در حالیکه تمرینتناوبی شدید (HIIT) به دلیل ایجاد اصطکاک و تنش برشی بالاتر همراه با انقباضات پی در پی و کاهش مقاومت عروقی، خون و اکسیژن بالاتری به قلب و عضلات فعال می¬رساند و حساسیت انسولینی را بهبود می-بخشد (20). مطالعات گذشته به شیوههای تمرین تداومی و مقاومتی پرداختهاند و مطالعهای که تمرینات تناوبی را در عوامل اندازهگیری شده این مطالعه گزارش کند وجود نداشت و بهمطالعات شبیهتر پرداخته شد. نتایج مطالعه یئو و همکاران (2010) نشان داد انقباض مکرر عضلانی ناشی از یک دوره تمرینات تداومی با شدت بالا موجب فعالسازی سیگنالینگ AMPK/PGC-1α و متعاقب آن افزایش تولید و فعالیتCS میشود (12). نتایج این مطالعه با مطالعه حاضر همسو بود. نتایج مطالعه وانگ و همکاران (2015) نشان داد شدت تمرین هوازی با شدت متوسط عامل موثری در افزایش رونویسی از ژن CS و افزایش بیوژنز میتوکندری تا 24 ساعت بعد از تمرین است (21) که موجب افزایش ظرفیت هوازی در مدل دیابتی نوع 2 شده بود و با مطالعه حاضر همسویی دارد. نتایج مطالعه بارتلت و همکاران (2012) نشان داد، پس از تمرین HIT با شدت 90 درصد حداکثر اکسیژن مصرفی در3 ست با 6 تکرار و استراحت فعال با شدت 70 درصد VO2max همراه با افزایش بیان PGC1-α مقادیر P-53 کاهش یافت (29). نتایج مطالعهای نشان داد، 12 هفته تمرین شنا، 5 روز در هفته به مدت 40 دقیقه در موشهای مسن موجب افزایش فعالیت SIRT-1 و کاهش ترجمه فاکتور رونویسی کاپای B (NF-KB) و پروتئین سرچنگالی (FOXO) شد و بهوسیله افزایش در PGC1-αاز تخریب سلول پیشگیری کرد و با کاهش ROS از ساختار قلب محافظت میکند (30). که با نتایج مطالعه حاضر همسو بود. در حالیکه فعالیت تناوبی سرعتی در 4 ست با 7 تکرار در 30 ثانیه در موشهای نر اسپیروگوداولی مبتلا به انفارکتوس قلبی برمقادیر PGC1-α تاثیری نداشت، اما باعث افزایش P-53 شد (31). این یافتهها با نتایج مطالعه حاضر ناهمسو است. یک وهله فعالیت حاد مقاومتی موجب افزایش P-53 شد. این نتایج با نتایج مطالعه حاضر ناهمسو است. در مطالعه دیگری که به بررسی اثر شدت تمرین پرداخت چنین نتیجهگیری کرد، تمرین HIT 3 روز در هفته بهمدت 30 دقیقه که با حجم کمتر از تمرین HIIT اجرا شد بر تنظیم گلوکز، بهبود عملکرد میتوکندری بهدلیل تولید و افزایش عملکرد آنزیم SC افزایش فعالیت زیر واحد کمپلکس پروتئین 70 کیلو دالتونی، پروتئین میتوفیوژن2 و افزایش فعالیت GLUT-4 در مبتلایان بهدیابت موثرتر بود (32). این نتایج با نتایج مطالعه حاضر همسو است. تناقض نتایج برخی مطالعات با یافتههای مطالعه حاضر میتواند نوع، شدت، مدت تمرین و سلامت آزمودنیها باشد (30). همچنین میتوان برداشت کرد در مطالعه حاضر بهدلیل برنامه 4 هفتهای، سازگاریهای هایپرتروفی عضلانی اتفاق نیفتاد که میتوان عاملی برای کاهش وزن موشهای گروه تمرین بیان کرد. همچنین شدت بالای تمرین در هفتههای اول باعث کاهش وزن عضلات بهدلیل سوخت و ساز خاص تمرینات تناوبی می-شود. از محدودیتهای این مطالعه میتوان به عدمدسترسی به نمونههای انسانی اشاره کرد، محدودیت دیگر نیز عدم استفاده از روش وسترن بلات جهت سنجش پروتئین ژنهای مذکور است که بهدلیل کمبود بودجه پژوهش میباشد. در پایان پیشنهاد میشود در مطالعات آینده مدلهای تمرینی مذکور با تمرین تداومی و بهطور گستردهتر بررسی و مقایسه شود. همچنین پیشنهاد میشود ژنها و پروتئینهای مرتبط دیگر در روند مسیر پیامرسانی متابولیسم میتوکندری در عضله قلب مورد بررسی قرار گیرند و بهصورت مطالعه مروری گزارش شود.
نتیجهگیری
بهطور کلی نتایج مطالعه حاضر نشان داد، تمرین HIIT بر سطوح نشانگرهای محرک و بازدارنده بیوژنز میتوکندری نقش دارد و موجب افزایش مصرف گلوکز خون و بهبود در عملکرد ژنهای PGC-1α ،CS و کاهش در سنتز P-53 در کاردیومیوسیت موشهای چاق صحرائی نر مبتلا به دیابت نوع 2 میگردد، بر این اساس بیان ژن را تنظیم کرده و از آنجاییکه در بیماران مبتلا بهدیابت نوع دو مسیر پیام رسانی، پروتئین و ژنهای دخیل در بیوژنز میتوکندریایی دچار بد تنظیمی میشود، احتمالاً این نوع تمرین میتواند بر بهبود کاردیومیوپاتی ناشی از دیابت موثر باشد.
سپاسگزاری
بدینوسیله از تمامی اساتید گرامی که در پیشبرد رساله دکتری و پژوهش حاضر، اینجانب را حمایت علمی نمودند کمال تشکر و قدردانی بهعمل میآید. این مقاله برگرفته از رساله دکتری خانم نادیا خیامپور، دانشجوی دکتری دانشگاه آزاد اسلامی واحد تهران مرکزی بوده است و هزینههای طرح توسط ایشان پرداخت گردیده است.
حامی مالی: ندارد.
تعارض¬درمنافع: وجود ندارد.
References:
1-Fealy CE, Mulya A, Axelrod CL, Kirwan JP. Mitochondrial Dynamics in Skeletal Muscle Insulin Resistance and Type 2 Diabetes. Translational Res 2018; 20(2): 69-82.
2-Shimizu I, Minamino T, Toko H, Okada S, Ikeda H, Yasuda N, et al. Excessive Cardiac Insulin Signaling Exacerbates Systolic Dysfunction Induced by Pressure Overload in Rodents. J Clinical Investigation 2010; 120(5): 1506-14.
3-Shen X, Zheng S, Thongboonkerd V, Xu M, Pierce Jr WM, Klein JB, et al. Cardiac Mitochondrial Damage and Biogenesis in a Chronic Model of Type 1 Diabetes. American Journal of Physiology-Endocrinology and Metabolism 2004; 287(5): E896-E905.
4-Balducci S, Zanuso S, Nicolucci A, Fernando F, Cavallo S, Cardelli P, et al. Anti-Inflammatory Effect of Exercise Training in Subjects with Type 2 Diabetes and the Metabolic Syndrome is Dependent on Exercise Modalities and Independent of Weight Loss. Nutrition, Metabolism and Cardiovascular Diseases 2010; 20(8): 608-17.
5-Kraemer WJ, Ratamess NA. Hormonal Responses and Adaptations to Resistance Exercise and Training. Sports Medicine 2005; 35(4): 339-61.
6-Sigal RJ, Armstrong MJ, Bacon SL, Boulé NG, Dasgupta K, Kenny GP, et al. Activité Physique et Diabète. Can J Diabetes 2018; 42(2): S54-S63.
7-Duncan J. Fong JL, Medeiros DM, Finck BN, Kelly DP. Insulin-Resistant Heart Exhibits a Mitochondrial Biogenic Response Driven by the Peroxisome Proliferator-Activated Receptor-Alpha/PGC-1alpha Gene Regulatory Pathway. Circulation 2007; 115(5): 909-17.
8-Boström P, Mann N, Wu J, Quintero PA, Plovie ER, Panáková D, et al. C/Ebpβ Controls Exercise-Induced Cardiac Growth and Protects Against Pathological Cardiac Remodeling. Cell 2010; 143(7): 1072-83.
9-Burgomaster KA, Howarth KR, Phillips SM, Rakobowchuk M, Macdonald MJ, Mcgee SL, et al. Similar Metabolic Adaptations During Exercise after Low Volume Sprint Interval and Traditional Endurance Training in Humans. Physiol 2008; 586(1): 151-60.
10-Granata C, Jamnick NA, Bishop DJ. Principles of Exercise Prescription, And How They Influence Exercise-Induced Changes of Transcription Factors and Other Regulators of Mitochondrial Biogenesis. Sports Med 2018; 48(7): 1541-59.
11-Lundby C, Jacobs RA. Adaptations of Skeletal Muscle Mitochondria to Exercise Training. Exp Physiol 2016; 101(1): 17-22.
12-Yeo WK, Mcgee SL, Carey AL, Paton CD, Garnham AP, Hargreaves M, et al. Acute Signalling Responses to Intense Endurance Training Commenced with Low or Normal Muscle Glycogen. Exp Physiol 2010; 95(2): 351-8.
13-Sahin E, Depinho RA. Axis of Ageing: Telomeres, P53 and Mitochondria. Nat Rev Mol Cell Biol 2012; 13(6): 397-404.
14-Sano M, Schneider MD. Energizer: PGC-1α Keeps the Heart Going. Cell Metab 2005; 1(4): 216-8.
15-Leek BT, Mudaliar SR, Henry R, Mathieu-Costello O, Richardson RS. Effect of Acute Exercise on Citrate Synthase Activity in Untrained and Trained Human Skeletal Muscle. Am J Physiol-Regul, Integr Comp Physiol 2001; 280(2): R441-R7.
16-Vettor R, Valerio A, Ragni M, Trevellin E, Granzotto M, Olivieri M, et al. Exercise Training Boosts Enos-Dependent Mitochondrial Biogenesis in Mouse Heart: Role in Adaptation of Glucose Metabolism. Am J Physiol-Endocrinol Metabol 2014; 306(5): E519-E28.
17-He Z, Hu Y, Feng L, Li Y, Liu G, Xi Y, et al. NRF-1 Genotypes and Endurance Exercise Capacity in Young Chinese Men. Br J Sports Med 2008; 42(5): 361-6.
18-Hinge CR, Ingle SB, Adgaonkar BD. Body Mass Index, Blood Pressure and Lipid Profile in Type 2 Diabetes-Review. Int J Cur Res Rev| Vol 2018; 10(10): 1-9.
19-Gibala MJ, Little JP, Macdonald MJ, Hawley JA. Physiological Adaptations to Low Volume, High Intensity Interval Training in Health and Disease. J Physiol 2012; 590(5): 1077-84.
20-Estes Rr, Malinowski A, Piacentini M, Thrush D, Salley E, Losey C, et al. The Effect of High Intensity Interval Run Training on Cross-Sectional Area of the Vastus Lateralis in Untrained College Students. Int J Exerc Sci 2017; 10(1): 137-145.
21-Röckl KS, Witczak CA, Goodyear LJ. Signaling Mechanisms in Skeletal Muscle: Acute Responses and Chronic Adaptations to Exercise. IUBMB Life 2008; 60(3): 145-53.
22-Pierre W, Gildas AJH, Ulrich MC, Modeste W-N, Aztélesphore Benoît N, Albert K. Hypoglycemic and Hypolipidemic Effects of Bersama Engleriana Leaves in Nicotinamide/Streptozotocin-Induced Type 2 Diabetic Rats. BMC Complementary Altern Med 2012; 12(1): 264.
23-Leandro CG, Levada AC, Hirabara SM, Manhães-De-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Cond Res 2007; 21(3): 751-6.
24-Ghaderpour S, Zare S, Ghaderi Pakdel F. Effects of Acute Intra-Hippocompal Injection of Bupropion on Active Avoidance Learning in Rats. Physiology and Pharmacology 2010; 14(3): 289-96.
25-Vandesompele J, De Preter K, Pattyn F, Poppe B, Van Roy N, De Paepe A, et al. Accurate Normalization of Real-Time Quantitative RT-PCR Data by Geometric Averaging of Multiple Internal Control Genes. Genom Biol 2002; 3(7): 1-12.
26-Kotenko SV, Gallagher G, Baurin VV, Lewis-Antes A, Shen M, Shah NK, et al. IFN-Λs Mediate Antiviral Protection Through a Distinct Class II Cytokine Receptor Complex. Nature Immunology 2003; 4(1): 69-77.
27-Schiaffino S, Dyar KA, Ciciliot S, Blaauw B, Sandri M. Mechanisms Regulating Skeletal Muscle Growth and Atrophy. The FEBS Journal 2013; 280(17): 4294-314.
28-Spriet LL, Howlett RA, Heigenhauser GJ. An Enzymatic Approach to Lactate Production in Human Skeletal Muscle during Exercise. Med Sci in Sports & Exerc 2000; 32(4): 756-63.
29-Bartlett JD, Hwa Joo C, Jeong TS, Louhelainen J, Cochran AJ, Gibala MJ, et al. Matched Work High-Intensity Interval and Continuous Running Induce Similar Increases in PGC-1α Mrna, AMPK, P38, And P53 Phosphorylation in Human Skeletal Muscle. J Appl Physiol 2012; 112(7): 1135-43.
30-Huang CC, Wang T, Tung YT, Lin WT. Effect of Exercise Training on Skeletal Muscle SIRT1 and PGC-1α Expression Levels in Rats of Different Age. Int J Med Sci 2016; 13(4): 260-70.
31-Saleem A, Adhihetty PJ, Hood DA. Role of P53 in Mitochondrial Biogenesis and Apoptosis in Skeletal Muscle. Physiol Genomics 2009; 37(1): 58-66.
32-Little JP, Gillen JB, Percival ME, Safdar A, Tarnopolsky MA, Punthakee Z, et al. Low-Volume High-Intensity Interval Training Reduces Hyperglycemia and Increases Muscle Mitochondrial Capacity in Patients With Type 2 Diabetes. J Appl Physiol (Bethesda, Md: 1985) 2011; 111(6): 1554-60.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1399/3/21 | پذیرش: 1399/7/13 | انتشار: 1399/11/10
دریافت: 1399/3/21 | پذیرش: 1399/7/13 | انتشار: 1399/11/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







