دوره 28، شماره 7 - ( مهر 1399 )
جلد 28 شماره 7 صفحات 2843-2833 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Safarnezhad A, Peeri M, Azarbayjani M A, Delfan M. Effect of 8 Weeks High Intensity Interval Training on the Gene Expression of BAX and BCL-2 in the Left Ventricle of Diabetic Male Wistar Rats. JSSU 2020; 28 (7) :2833-2843
URL: http://jssu.ssu.ac.ir/article-1-5145-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5145-fa.html
صفرنژاد علیرضا، پیری مقصود، آذربایجانی محمدعلی، دلفان مریم. تأثیر هشت هفته تمرین تناوبی شدید بیان ژنهای BAX و BCL-2 در بافت بطن چپ موش های صحرائی دیابتی نر ویستار. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (7) :2833-2843
متن کامل [PDF 781 kb]
(784 دریافت)
| چکیده (HTML) (1973 مشاهده)
متن کامل: (1687 مشاهده)
مقدمه
دیابت اختلالی متابولیکی است که در آن بهدلیل فقدان نسبی یا مطلق انسولین، هایپر گلایسمی ایجاد میشود (1). سپس متابولیسم کربوهیدراتها، پروتئینها و چربیها مختل میگردد (2). نقصان در مصرف گلوکز موجب عدم تعادل بین اکسیدانها و آنتی اکسیدانها شده و غشاء میتوکندری با رهاسازی سیتوکروم C آسیب میبیند (3). بر این اساس عنوان شده است که استرس اکسایشی نقش مهمی در تخریب میوسیت دارد (4). تولید و رهایش محصولات نهایی گلیکاسیونی (advance glycation end products; AGE) در خون و اتصال بهگیرندههای سطحی سلول موجب التهاب شده و در ایجاد مرگ سلولی نقش دارد (5). راهاندازی مسیر AGE ساز و کار اولیه و عامل مهمی در آتروژنز و اختلالات مزمن التهابی بهشمار میرود (6) و موجب مرگ سلولی در میوسیت میشود (7). زیرا هایپرگلایسمی طولانیمدت، خون و اکسیژنرسانی به قلب را محدود میکند (8)؛ به این دلیل عنوان شده است بافت قلب نسبت به سایر بافتها سریعتر به مرگ سلولی پاسخ میدهد (9). مرگ سلولی در ابتدا توسط نکروز ایجاد میشود، که در اولین مسیر باعث از دست دادن ساختار طبیعی قلب میشود اما این فرایند به سرعت بهبود مییابد (10) و پس از هایپرگلایسمی و افزایش مقاومت به انسولین، عملکرد پروتئین های تیروزینکیناز و فسفوکیناز تضعیف شده و مرگ سلولی در بطن چپ ایجاد میشود (11)، که به تبعیت از آن، آپوپتوز سلولهای قلبی در بیماران دیابتی بهطور گستردهای ایجاد میشود (12). آپوپتوز مرگ برنامهریزی شده یاخته و روندی فیزیولوژیک و زیستی جهت نمو فعال در شرایط طبیعی برای حفظ هومئوستاز است که از مسیرهای مختلف ایجاد میشود (13)، از جمله هایپرگلایسمی، که استرس اکسایشی و التهاب ایجاد میکند (14). افزایش قند خون میتواند موجب نامتعادل شدن فرایند آپوپتوز بهوسیله تولید و افزایش در عملکرد پروتئین پیشآپوپتوزی (bcl-2associated protein X; BAX) و کاهش در تولید و نقصان در فعالیت پروتئین ضد آپوپتوز BCL-2 B-cell) lymphoma); شود (15). فاکتور ضدآپوپتوزی BCL-2 از رهاسازی سیتوکروم C و تخریب غشاء میتوکندری از طریق حفظ یکپارچگی غشاء جلوگیری میکند (15) و نیز مقاومت به انسولین با ایجاد جهشهای ژنی و افزایش استرس سلولی در مسیرهای مختلف تخریب بافت قلب را گسترش میدهد (16). پژوهشگران معتقدند نقص در عملکرد انسولین به وسیله کاهش در فعالیت پروتئین فسفواینوزیتولکیناز3 (17) و کاهش در تولید متسعکنندههای عروقی از جمله نیتریکاکساید، عملکرد BCL-2 را تضعیف کرده و آپوپتوز در میوکارد ایجاد میکند (18). تغذیه پر کالری، شیوه زندگی کم تحرک و استرس محیطی از عوامل اصلی ابتلای به دیابت نوع 2 ذکر شده است (19،20). انجام برنامه ورزشی بهعنوان شیوهای غیردارویی و موثر در کنترل این بیماری در کنار سایر مراحل درمانی توصیه میشود (21). طبق مطالعات مختلف انجام تمرین منظم میتواند، با افزایش نسبت پروتئینهای ضد آپوپتوزی و مهار سیگنالدهی پروتئینهای پیشآپوپتوزی از ایجاد آسیبهای قلبی جلوگیری کند (22). در خصوص شدت تمرین عنوان شده تمرینHIIT با اجراهای متناوب و ریکاوری فعال در تنظیم بیان ژن و بهبود عملکرد قلب در بیماران دیابتی موثر میباشد (21). از طرفی بهدلیل انقباضهای پی در پی عضلانی با فعالسازی فاکتورGLUT-4، راه اندازی پروتئین AMPK و فعالیت کلسیم درون سلولی موجب مصرف گلوکز میشود (17). مطالعه اثرات تمرینات ورزشی بر مسیر آپوپتوزیس و فاکتورهای دخیل در آبشار پیامرسانی از موضوعاتی است که کمتر به بررسی آن پرداخته شده است و نوآوری مطالعه حاضر بررسی اثر تمرینات تناوبی شدید بر عوامل مرتبط با مرگ سلولی در میوسیت حیواناتی است که بر اثر رژیم غذایی پرچرب به دیابت نوع 2 مبتلا شدهاند. با این حال از آنجایی که آثار تمرین تابعی از نوع، شدت و مدت آن است (21) و با توجه به تناقضهای بسیار در رابطه با آثار تمرین بر کاهش مرگ سلولی میوسیت (22)، لذا مطالعه حاضر برای اولینبار به بررسی تاثیر8 هفته تمرین تناوبی شدید بر بیان ژنی BAX و BCL-2 در بافت بطن چپ موشهای صحرایی نر دیابتی انجام شد.
روش بررسی
مطالعه حاضر از نوع آزمایشگاهی و نمونهگیری تصادفی ساده میباشد. جهت انجام پژوهش 14 سر موش صحرایی نر نژاد ویستار سن 5 تا 6 هفته، وزن 160 تا 180 گرم از انستیتو پاستور تهران تهیه شد. نگهداری حیوانات در دمای 22 تا 24 درجه سانتیگراد و سیکل روشنایی تاریکی 12:12، در قفسهای مخصوص با دسترسی آزادانه به آب و غذای استاندارد حیوانات به صورت پلت بود.
جدول 1: تغییرات وزن، مقادیر گلوکز و مقاومت به انسولین را به تفکیک گروهها نشان میدهد
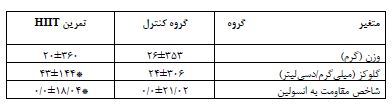
اعداد به شکل میانگین± انحراف استاندارد بیان شده اند، * نشانۀ معناداری نسبت به گروه کنترل می باشد.
نحوه القاء دیابت
موشها به مدت 16 هفته با غذای پر چرب و حاوی فروکتوز تغذیه شدند. قبل از این مدت با پلت استاندارد تغذیه میشدند و در طول دوره تمرین نیز همین رژیم تغذیه پر چرب را دریافت میکردند. تهیه غذا در انستیتوی رازی برای ساخت 100کیلوگرم پلت پرچرب، 45 کیلوگرم پودر پلت استاندارد، 30 کیلوگرم چربی حیوانی حاصل از آب کردن دنبه گاو و 25 کیلوگرم فروکتوز که بهشکل پلت استاندارد قالب زده شد. بهمنظور تایید القای دیابت نوع2، میزان قند خون ناشتا با گلوکومتر 01-mini ARKRAY (ساخت ژاپن) و با نمونهگیری خون از دم موشها اندازهگیری شد و سطوح گلوکز بیشتر از 160میلیگرم بر میلی لیتر بهعنوان شاخص دیابتی شدن نوع 2 در نظر گرفته شد (23). در طول دوره پژوهش هیچگونه درمانی با انسولین انجام نشد و در حین مراحل پژوهش 2 سر موش تلف شدند. یکی از موشهای صحرایی در روند القاء دیابت و دیگری حین مراحل تمرینی تلف شدند.
پروتکل تمرین
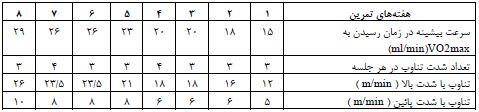
پس از القاء دیابت به شیوه ذکر شده، موشها به شکل تصادفی به 2 گروه 7 تایی تمرین شدید تناوبی (HIIT) و کنترل (C) تقسیمبندی شدند. سپس آزمودنیها یک هفته بهمدت 3 تا 10 دقیقه با سرعت 6 تا 10 متر بر دقیقه با راه رفتن بر روی تردمیل ویژه جوندگان آشنا شدند. ارزیابی توان هوازی با محاسبه سرعت بیشینه در زمان رسیدن به حداکثر اکسیژن مصرفی و محاسبه تعیین شدت تمرین با استفاده از آزمون فزاینده در ابتدای برنامه تمرینی و پایان هر هفته (24) بدینصورت انجام شد: پس از 3 دقیقه گرم با سرعت 5 متر بردقیقه توسط تغییر در سرعت نوارگردان با شیب صفر درجه در هر دو دقیقه یکبار و به مقدار 4 متر بر دقیقه افزایش یافت. بر این اساس تعیین حداکثر سرعت بیشینه زمانی بود که موشها حداقل 1 تا 3 دقیقه نتوانند با سرعت ثابت بدوند پس از آن با بالا بردن سرعت قادر به دویدن نباشند .بعد از آشناسازی و آزمون فزایندهای که در انتهای هر جلسه تمرین گرفته میشد، موشهای گروه تمرین بهمدت 8 هفته برنامه تمرین خود را اجرا نمودند. پروتکل تمرین تناوبی شدید (HIIT) شامل 5 دقیقه گرم و سرد کردن با شدت 30 درصد سرعت بیشینه (5 متر بر دقیقه) و تناوب تمرین با شدت 80 درصد سرعت بیشینه (12 متر بر دقیقه) در هفته اول، 90 درصد سرعت بیشینه (16 متر بر دقیقه) از هفته دوم تا پایان هفته هشتم اجرا شد. لازم به ذکر است با توجه به سازگاری ایجاد شده حداکثر سرعت بیشینه به 28 متر بر دقیقه رسید. تناوب با شدت پائین نیز30 درصد سرعت بیشینه (10 متر بر دقیقه)، تعداد تناوب با شدت بالا در هفته اول با 2 تکرار و در هفتههای دوم و سوم با 3 تکرار و از هفته چهارم تا هفته هشتم 4 تکرار بود. زمان تناوب با هر دو شدت بالا و پائین 2 دقیقه بود (جدول2) (23). در تمام دورههای تمرین نیز موشها همچنان تغذیه پر چرب را دریافت میکردند.
جدول 2: اجرای پروتکل تمرین HIIT را طی 8 هفته نشان میدهد.
استخراج نمونه و سنجش ژنهای BAX و BCL-2با روش Real Time- PCR، استخراج RNA و سنتزcDNA
24 ساعت بعد از آخرین جلسه تمرینی و ریکاوری پس از آن، موشها به وسیله تزریق درون صفاقی کتامین (mg/kg 90) و زایلازین (mg/kg 10) بیهوش شدند. سپس بافت بطن چپ بلافاصله استخراج و در نیتروژن 20- منجمد و برای سنجش بیان ژن در فریزر 80- نگه داری شد. به منظور استخراج Total RNA به نسبت 1 به 10 در QLAZOL LYSIS Reagent هموژن شد. جهت برداشت چاهک پروتئینی، محصول بهدست آمده در 0c4، min10، g12000 سانتریقیوژ شد. سپس بهنسبت 1به 5/0 با کلروفرم مخلوط شد و بهمدت 15 ثانیه با شدت تکان داده شد. محصول در c40، min15، g12000 سانتریفیوژ شد تا بخش معدنی از بخش آبی جدا شوند. محتوای RNA برداشته شد و با نسبت 1 به 0/5 با محلول ایزوپرویانول مخلوط و بهمدت 10 دقیقه در دامای اتاق قرار داده شد. سپس در C40، دقیقه10 با دور12000 سانتریفیوژ شد. پلات حاوی RNA توسط دستگاه (ساخت شرکت اپندورف آلمان) و در نسبت 260 به 280 بین 1/8 تا 2 بهعنوان تلخیص مطلوب شد. سنتز cDNA با استفاده از 1gµ از RNA، Randomhexamer primer و آنزیم transcriptase Mmulv Revers انجام شد. اندازهگیری بیان ژنهای BAX وBCL-2 بهترتیب (Cat. No: AP52304) و (Cat. No: AP341112) توسط روش کمیسازی Real time-pcr با استفاده از premix syper green II (ساخت شرکت آپلید کانادا) انجام شد. واکنش مخلوط در حجم نهایی Lµ20 و به صورت دوتایی انجام شد. طراحی پرایمرها نیز بر اساس اطلاعات ژنها در بانک اطلاعات NBCI (ساخت شرکت ماکروژن کشور کره) انجام شد. لازم بهذکر است که از βactin و L37a بهعنوان ژن کنترل استفاده شد. دمای مورد استفاده در 4 سیکل: 95 درجه سانتیگراد بهمدت 10 دقیقه، 95 درجه سانتیگراد به مدت 15 ثانیه، 60 درجه سانتیگراد بهمدت 1 دقیقه انجام شد. میزان بیان ژنهای موردنظر بهوسیله روش سنجش شد. اندازهگیری گلوکز پلاسما بهروش گلوکزاکسیداز (شرکت پارس آزمون) و اندازهگیری مقادیر انسولین از روش الایزا (Crystal chem ساخت کانادا) با ضریب تغییر 0/05 و حساسیت 1 ml/dl بررسی گردید. شاخص مقاومت به انسولین بهروش HOMA-IR طبق فرمول زیر اندازهگیری شد:
سنجش شد. اندازهگیری گلوکز پلاسما بهروش گلوکزاکسیداز (شرکت پارس آزمون) و اندازهگیری مقادیر انسولین از روش الایزا (Crystal chem ساخت کانادا) با ضریب تغییر 0/05 و حساسیت 1 ml/dl بررسی گردید. شاخص مقاومت به انسولین بهروش HOMA-IR طبق فرمول زیر اندازهگیری شد:
HOMA-IR = (اﻧﺴﻮﻟ ﻴﻦ ﻧﺎﺷﺘﺎ)[µU/mL) × ﻧﺎﺷﺘﺎ ﮔﻠﻮﻛﺰ) mmol/L ) ] /22.5
جدول 3: توالی پرایمری ژنهای مورد مطالعه

تجزیه و تحلیل آماری
در بخش مربوط بهآمار توصیفی از شاخص پراکندگی انحراف معیار و نمودار استفاده شد. نرمال بودن توزیع دادهها با استفاده از آزمون شاپیروویلک مشخص شد. جهت تعیین اختلاف بین گروهها از آزمون t مستقل استفاده شد. تجزیه و تحلیل دادهها با استفاده از نرم افزاز Graph pad prism نسخه 8 و در سطح معنیداری 0/05≥P محاسبه شد.
ملاحظات اخلاقی
تمام مراحل با رعایت اصول اخلاقی کار با حیوانات آزمایشگاهی (برابر پروتکل هلیسنگی 2006) مصوب دانشگاه علوم پزشکی با اخذ کد اخلاق IR.SBMU.RETECH.1395.883 تصویب و انجام شد.
نتایج
همانگونه که اطلاعات جدول 1 نشان داد، تغییرات مقدار وزن پس از گذشت هشت هفته تمرین به لحاظ آماری معنادار نشد. اما تغییرات مقادیر گلوکز و شاخص مقاومت به انسولین در گروه تمرین نسبت به گروه کنترل معنادار شد. مقادیر بیان ژن BAX در گروه تمرین کاهش معناداری را نسبت به گروه کنترل نشان داد (P=0/0001). (نمودار1). مقادیر بیان ژن BCL-2 در گروه تمرین نسبت به گروه کنترل افزایش معناداری نشان داد (P=0/0001) (نمودار2). در جدول4 مقادیر بیان ژن BAX و BCL-2 برای هر یک از نمونهها در هر دو گروه پژوهش ارائه شده است.
جدول 4: مقادیر بیان ژن BAX و BCL-2 را در بافت بطن چپ موشهای صحرایی دیابتی پس از 8 هفته تمرین HIIT را نشان میدهد.

اعداد به شکل میانگین± خطا استاندارد بیان شدهاند. * نشانه معناداری نسبت به کنترل توسط آزمون آماری t مستقل.

نمودار 1: نسبت بیان ژن BAX به میزان GAPDH بر حسب گروهها
(*) نشانه تفاوت معنادار با گروه کنترل در سطح معناداری (0/05)
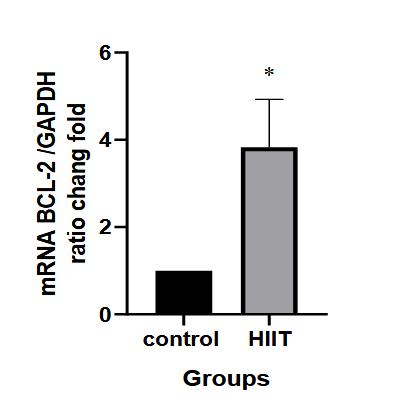
نمودار 2: نسبت بیان ژن BCL-2 به میزان GAPDH بر حسب گروهها
(*) نشانه تفاوت معنادار با گروه کنترل در سطح معناداری (0/05)
بحث
تحقیق حاضر بهبررسی تاثیر 8 هفته تمرین تناوبی شدید بر بیان ژنی BAX و BCL-2در بافت بطن چپ موشهای صحرایی دیابتی پرداخت. بر طبق یافتههای بهدست آمده در گروه تمرین ژن BAX کاهش معنادار و ژن BCL-2 افزایش معناداری نشان دادند. علیرغم کاهش شاخص گلوکز خون و مقاومت بهانسولین، وزن در گروه تمرین ثابت ماند. دلیل عدم تغییر وزن در گروه تمرین را میتوان به مصرف تغذیه پر چرب در تمام طول دوره اجرای پروتکل نسبت داد. در خصوص عوارض مقاومت به انسولین و متعاقب آن قند خون بالا در بیماران دیابتی، تاثیر واکنشهای گلیکوزیله بر ایجاد فشار اکسایشی و تولید بیش از حد رادیکالهای آزاد عنوان شده که میتواند متابولیسم سلولی را مختل و التهاب ایجاد کند (3) و بهوسیله کاهش در خون و اکسیژنرسانی به قلب (5)، غشاء میتوکندری را تخریب (3) و ظرفیت هوازی را تضعیف کند (8). بر این اساس به انجام تمرین منظم با شدت مناسب جهت بهبود عوارض هایپر گلایسمی در تنظیم بیان ژن توجه معطوف شده است (17،27،29). در این خصوص نتایج مطالعهای نشان داد انجام تمرین منظم میتواند با افزایش بیان ژن BCL-2 نسبت به BAX از وقوع آسیب ایسکمی جلوگیری کند (22). از مکانیسمهای احتمالی تاثیر تمرین تناوبی، قابلیت محافظت از سطح سلول با بهبود در خون رسانی و اکسیژنرسانی به قلب و تولید آنزیمهای هوازی پس از آن میباشد، که میتواند از ایجاد مرگ سلولی بافت قلب در بیماران دیابتی جلوگیری کند (25). زیرا سیگنالدهی داخل سلولی در پاسخ به محرک تمرین بهوسیله راه اندازی پروتئین PI3K و مصرف گلوکز با راهاندازی کلسیم درون سلولی و مسیرهای وابسته به آن نسبت ATP/ADP را تنظیم و از فرایند مرگ سلولی بهوسیله مهار ژن BAX و افزایش در سنتز و عملکرد ژن BCL-2 و استراحت فعال با شدت کم باعث کاهش در بیان پروتئین سرین تروئونین RIP/3 شده و از وقوع نکروز و آپوپتوز در میوسیت پیشگیری میکند (6). برخی مطالعات نیز چنین اظهار داشتند که اجرای ریکاوری فعال در تمرین HIIT باعث افزایش حساسیت بهانسولین، تنظیم بیان ژن و افزایش فاکتورهای متسعکننده عروقی از جمله نیتریک اکساید و پروکسی زوم آلفا میشود و در بهبود عملکرد قلب و عروق در بیماران متابولیکی موثر است (6،17،21). اما در مقایسه شدت تمرین نتایج مطالعهای نشان داد، هر دو نوع تمرین HIIT وHIT بهوسیله افزایش در بیان ژن BCL-2 فرایند آپوپتوز را z کاهش دادند (26). در حالیکه نتایج مطالعه کیم و همکاران (2010) نشان داد، 8 هفته تمرین تناوبی با سرعت 16 متر بر دقیقه و شیب 4 درصد، 5 جلسه در هفته بهمدت 40 دقیقه بر کاهش پروتئین BAX و افزایش BCL-2 تفاوت معنادار نداشت. این نتایج با یافته های بهدست آمده از مطالعه حاضر ناهمسو میباشد. سانتا و همکاران (2014) در مطالعه خود اظهار داشتند، تمرین هوازی با شدت متوسط به مدت 13 هفته و 60 دقیقه در هر روز باعث افزایش ژن BCL-2 در موشهای صحرایی نژاد ویستار شد (27). که با نتایج مطالعه حاضر همسو است. کواک و همکاران (2006) در مطالعه خود چنین بیان داشتند، 12 هفته تمرین تداومی با شدت متوسط، 5 روز در هفته و 60 دقیقه در روز نسبت BCL-2 به BAX را افزایش میدهد (28). که با نتایج بهدست آمده از مطالعه حاضر همسو است. اما در مطالعهای که توسط کرک سیک و همکاران (2008) انجام شد نتایج بهدست آمده نشان داد، یک وهله فعالیت حاد محرک تولید BAX شد و آپوپتوز را افزایش داد (29). این یافتهها با نتایج مطالعه حاضر ناهمسو میباشد. لیونا و همکاران (2017) در مطالعه خود چنین نتیجهگیری کردند، 8 هفته تمرین HIIT با شدت 95 درصد، با فعالسازی فاکتور رشد شبهانسولینی1(IGF-1)، پروتئین تیروزینکینازی AKT و m TORC-1 را افزایش داده و بهوسیله کاهش در سنتز SMAD/3 و افزایش در مصرف گلوکز، التهاب سلول را مهار و موجب بهبود حساسیت به انسولین میشود (30). نتایج بهدست آمده در خصوص کاهش گلوکز و افزایش حساسیت به انسولین با یافتههای مطالعه حاضر همسو است. در خصوص تاثیر تمرین HIIT عنوان شده این نوع تمرین از طریق مستقیم با مصرف گلوکز با راهاندازی GLUT-4 به سطح سلول و از راه غیر مستقیم بهوسیله افزایش فعالیت CAMP و راه اندازی مسیر کلسیم از سیتوزول، با افزایش در فعالیت CAMK-II در بهبود هومئوستاز گلوکز موثر باشد (17). با این حال از دلایل تناقض در یافتههای بهدست آمده با نتایج مطالعه حاضر نوع، شدت و مدت تمرین، مقدار عضله درگیر در فعالیت، مصرف دارو و نیز سطح سلامت آزمودنیها ذکر میشود (17،21،26،28،29،30). همانطوری که نتایج مطالعه حاضر نشان داد، تمرین تناوبی شدید در کاهش مقاومت به انسولین، بهبود مصرف گلوکز و نیز کاهش در آپوپتوز بافت قلب موشهای مدل دیابتی موثر بود، با این حال بهتر است قبل از طراحی اینگونه از تمرینات در صورت مصرف داروهای کاهنده قند خون و یا تزریق انسولین، از مدت زمان و دوز مصرفی و نیز سطح عملکرد قلب توسط پزشک متخصص آگاهی داشته باشد تا بتوان از تاثیر مفید اینگونه تمرینات به طور ایمن بهرهمند شد. بر اساس نتایج بهدست آمده، 8 هفته تمرین تناوبی شدید میتواند با کاهش در بیان ژن BAX و افزایش ژن BCL-2 در میوکارد موشهای مبتلا به دیابت آپوپتوز را در بطن چپ کاهش داده و احتمالاً کاردیومیوپاتی دیابتی را بهبود بخشد. از محدودیتهای مطالعه حاضر میتوان به عدم دسترسی به آزمودنیهای انسانی اشاره کرد، همچنین محدودیت دیگر نیز عدم اندازه گیری پروتئین ژنهای مذکور است که از دلایل آن کمبود بودجه پژوهش میباشد. یکی دیگر از محدودیتهای مطالعه حاضر عدم انجام پیشآزمون بین دو گروه در ابتدای مطالعه بود که سبب تایید عدم وجود تغییرات قبل از مداخله تمرینی میشد. اما پژوهشگران بهدلیل کمبودهای مالی قادر بهانجام پیشآزمون نبودند و استناد عدم وجود تفاوتهای قبل از مداخله، به گروه کنترل بسنده شد. پیشنهاد میشود در مطالعات آینده مقایسه مدل تمرینی مذکور با تمرین مقاومتی و بهطور گستردهتر بررسی گردد.
نتیجهگیری
بر اساس یافتههای بهدست آمده، 8 هفته تمرین تناوبی شدید میتواند با کاهش بیان ژن BAX و افزایش BCL-2 در میوکارد موشهای مبتلا بهدیابت احتمالاً آپوپتوز را در بطن چپ کاهش داده و ممکن است بتواند کاردیومیوپاتی دیابتی را بهبود بخشد.
سپاسگزاری
مطالعه حاضر بخشی از رساله دکترا میباشد، بدینوسیله از اساتید گرانقدر بابت راهنماییهای مبذول داشته و همه عزیزانی که در انجام این پژوهش ما را یاری رساندند تشکر و قدردانی مینماییم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
دیابت اختلالی متابولیکی است که در آن بهدلیل فقدان نسبی یا مطلق انسولین، هایپر گلایسمی ایجاد میشود (1). سپس متابولیسم کربوهیدراتها، پروتئینها و چربیها مختل میگردد (2). نقصان در مصرف گلوکز موجب عدم تعادل بین اکسیدانها و آنتی اکسیدانها شده و غشاء میتوکندری با رهاسازی سیتوکروم C آسیب میبیند (3). بر این اساس عنوان شده است که استرس اکسایشی نقش مهمی در تخریب میوسیت دارد (4). تولید و رهایش محصولات نهایی گلیکاسیونی (advance glycation end products; AGE) در خون و اتصال بهگیرندههای سطحی سلول موجب التهاب شده و در ایجاد مرگ سلولی نقش دارد (5). راهاندازی مسیر AGE ساز و کار اولیه و عامل مهمی در آتروژنز و اختلالات مزمن التهابی بهشمار میرود (6) و موجب مرگ سلولی در میوسیت میشود (7). زیرا هایپرگلایسمی طولانیمدت، خون و اکسیژنرسانی به قلب را محدود میکند (8)؛ به این دلیل عنوان شده است بافت قلب نسبت به سایر بافتها سریعتر به مرگ سلولی پاسخ میدهد (9). مرگ سلولی در ابتدا توسط نکروز ایجاد میشود، که در اولین مسیر باعث از دست دادن ساختار طبیعی قلب میشود اما این فرایند به سرعت بهبود مییابد (10) و پس از هایپرگلایسمی و افزایش مقاومت به انسولین، عملکرد پروتئین های تیروزینکیناز و فسفوکیناز تضعیف شده و مرگ سلولی در بطن چپ ایجاد میشود (11)، که به تبعیت از آن، آپوپتوز سلولهای قلبی در بیماران دیابتی بهطور گستردهای ایجاد میشود (12). آپوپتوز مرگ برنامهریزی شده یاخته و روندی فیزیولوژیک و زیستی جهت نمو فعال در شرایط طبیعی برای حفظ هومئوستاز است که از مسیرهای مختلف ایجاد میشود (13)، از جمله هایپرگلایسمی، که استرس اکسایشی و التهاب ایجاد میکند (14). افزایش قند خون میتواند موجب نامتعادل شدن فرایند آپوپتوز بهوسیله تولید و افزایش در عملکرد پروتئین پیشآپوپتوزی (bcl-2associated protein X; BAX) و کاهش در تولید و نقصان در فعالیت پروتئین ضد آپوپتوز BCL-2 B-cell) lymphoma); شود (15). فاکتور ضدآپوپتوزی BCL-2 از رهاسازی سیتوکروم C و تخریب غشاء میتوکندری از طریق حفظ یکپارچگی غشاء جلوگیری میکند (15) و نیز مقاومت به انسولین با ایجاد جهشهای ژنی و افزایش استرس سلولی در مسیرهای مختلف تخریب بافت قلب را گسترش میدهد (16). پژوهشگران معتقدند نقص در عملکرد انسولین به وسیله کاهش در فعالیت پروتئین فسفواینوزیتولکیناز3 (17) و کاهش در تولید متسعکنندههای عروقی از جمله نیتریکاکساید، عملکرد BCL-2 را تضعیف کرده و آپوپتوز در میوکارد ایجاد میکند (18). تغذیه پر کالری، شیوه زندگی کم تحرک و استرس محیطی از عوامل اصلی ابتلای به دیابت نوع 2 ذکر شده است (19،20). انجام برنامه ورزشی بهعنوان شیوهای غیردارویی و موثر در کنترل این بیماری در کنار سایر مراحل درمانی توصیه میشود (21). طبق مطالعات مختلف انجام تمرین منظم میتواند، با افزایش نسبت پروتئینهای ضد آپوپتوزی و مهار سیگنالدهی پروتئینهای پیشآپوپتوزی از ایجاد آسیبهای قلبی جلوگیری کند (22). در خصوص شدت تمرین عنوان شده تمرینHIIT با اجراهای متناوب و ریکاوری فعال در تنظیم بیان ژن و بهبود عملکرد قلب در بیماران دیابتی موثر میباشد (21). از طرفی بهدلیل انقباضهای پی در پی عضلانی با فعالسازی فاکتورGLUT-4، راه اندازی پروتئین AMPK و فعالیت کلسیم درون سلولی موجب مصرف گلوکز میشود (17). مطالعه اثرات تمرینات ورزشی بر مسیر آپوپتوزیس و فاکتورهای دخیل در آبشار پیامرسانی از موضوعاتی است که کمتر به بررسی آن پرداخته شده است و نوآوری مطالعه حاضر بررسی اثر تمرینات تناوبی شدید بر عوامل مرتبط با مرگ سلولی در میوسیت حیواناتی است که بر اثر رژیم غذایی پرچرب به دیابت نوع 2 مبتلا شدهاند. با این حال از آنجایی که آثار تمرین تابعی از نوع، شدت و مدت آن است (21) و با توجه به تناقضهای بسیار در رابطه با آثار تمرین بر کاهش مرگ سلولی میوسیت (22)، لذا مطالعه حاضر برای اولینبار به بررسی تاثیر8 هفته تمرین تناوبی شدید بر بیان ژنی BAX و BCL-2 در بافت بطن چپ موشهای صحرایی نر دیابتی انجام شد.
روش بررسی
مطالعه حاضر از نوع آزمایشگاهی و نمونهگیری تصادفی ساده میباشد. جهت انجام پژوهش 14 سر موش صحرایی نر نژاد ویستار سن 5 تا 6 هفته، وزن 160 تا 180 گرم از انستیتو پاستور تهران تهیه شد. نگهداری حیوانات در دمای 22 تا 24 درجه سانتیگراد و سیکل روشنایی تاریکی 12:12، در قفسهای مخصوص با دسترسی آزادانه به آب و غذای استاندارد حیوانات به صورت پلت بود.
جدول 1: تغییرات وزن، مقادیر گلوکز و مقاومت به انسولین را به تفکیک گروهها نشان میدهد

اعداد به شکل میانگین± انحراف استاندارد بیان شده اند، * نشانۀ معناداری نسبت به گروه کنترل می باشد.
نحوه القاء دیابت
موشها به مدت 16 هفته با غذای پر چرب و حاوی فروکتوز تغذیه شدند. قبل از این مدت با پلت استاندارد تغذیه میشدند و در طول دوره تمرین نیز همین رژیم تغذیه پر چرب را دریافت میکردند. تهیه غذا در انستیتوی رازی برای ساخت 100کیلوگرم پلت پرچرب، 45 کیلوگرم پودر پلت استاندارد، 30 کیلوگرم چربی حیوانی حاصل از آب کردن دنبه گاو و 25 کیلوگرم فروکتوز که بهشکل پلت استاندارد قالب زده شد. بهمنظور تایید القای دیابت نوع2، میزان قند خون ناشتا با گلوکومتر 01-mini ARKRAY (ساخت ژاپن) و با نمونهگیری خون از دم موشها اندازهگیری شد و سطوح گلوکز بیشتر از 160میلیگرم بر میلی لیتر بهعنوان شاخص دیابتی شدن نوع 2 در نظر گرفته شد (23). در طول دوره پژوهش هیچگونه درمانی با انسولین انجام نشد و در حین مراحل پژوهش 2 سر موش تلف شدند. یکی از موشهای صحرایی در روند القاء دیابت و دیگری حین مراحل تمرینی تلف شدند.
پروتکل تمرین
پس از القاء دیابت به شیوه ذکر شده، موشها به شکل تصادفی به 2 گروه 7 تایی تمرین شدید تناوبی (HIIT) و کنترل (C) تقسیمبندی شدند. سپس آزمودنیها یک هفته بهمدت 3 تا 10 دقیقه با سرعت 6 تا 10 متر بر دقیقه با راه رفتن بر روی تردمیل ویژه جوندگان آشنا شدند. ارزیابی توان هوازی با محاسبه سرعت بیشینه در زمان رسیدن به حداکثر اکسیژن مصرفی و محاسبه تعیین شدت تمرین با استفاده از آزمون فزاینده در ابتدای برنامه تمرینی و پایان هر هفته (24) بدینصورت انجام شد: پس از 3 دقیقه گرم با سرعت 5 متر بردقیقه توسط تغییر در سرعت نوارگردان با شیب صفر درجه در هر دو دقیقه یکبار و به مقدار 4 متر بر دقیقه افزایش یافت. بر این اساس تعیین حداکثر سرعت بیشینه زمانی بود که موشها حداقل 1 تا 3 دقیقه نتوانند با سرعت ثابت بدوند پس از آن با بالا بردن سرعت قادر به دویدن نباشند .بعد از آشناسازی و آزمون فزایندهای که در انتهای هر جلسه تمرین گرفته میشد، موشهای گروه تمرین بهمدت 8 هفته برنامه تمرین خود را اجرا نمودند. پروتکل تمرین تناوبی شدید (HIIT) شامل 5 دقیقه گرم و سرد کردن با شدت 30 درصد سرعت بیشینه (5 متر بر دقیقه) و تناوب تمرین با شدت 80 درصد سرعت بیشینه (12 متر بر دقیقه) در هفته اول، 90 درصد سرعت بیشینه (16 متر بر دقیقه) از هفته دوم تا پایان هفته هشتم اجرا شد. لازم به ذکر است با توجه به سازگاری ایجاد شده حداکثر سرعت بیشینه به 28 متر بر دقیقه رسید. تناوب با شدت پائین نیز30 درصد سرعت بیشینه (10 متر بر دقیقه)، تعداد تناوب با شدت بالا در هفته اول با 2 تکرار و در هفتههای دوم و سوم با 3 تکرار و از هفته چهارم تا هفته هشتم 4 تکرار بود. زمان تناوب با هر دو شدت بالا و پائین 2 دقیقه بود (جدول2) (23). در تمام دورههای تمرین نیز موشها همچنان تغذیه پر چرب را دریافت میکردند.
جدول 2: اجرای پروتکل تمرین HIIT را طی 8 هفته نشان میدهد.

استخراج نمونه و سنجش ژنهای BAX و BCL-2با روش Real Time- PCR، استخراج RNA و سنتزcDNA
24 ساعت بعد از آخرین جلسه تمرینی و ریکاوری پس از آن، موشها به وسیله تزریق درون صفاقی کتامین (mg/kg 90) و زایلازین (mg/kg 10) بیهوش شدند. سپس بافت بطن چپ بلافاصله استخراج و در نیتروژن 20- منجمد و برای سنجش بیان ژن در فریزر 80- نگه داری شد. به منظور استخراج Total RNA به نسبت 1 به 10 در QLAZOL LYSIS Reagent هموژن شد. جهت برداشت چاهک پروتئینی، محصول بهدست آمده در 0c4، min10، g12000 سانتریقیوژ شد. سپس بهنسبت 1به 5/0 با کلروفرم مخلوط شد و بهمدت 15 ثانیه با شدت تکان داده شد. محصول در c40، min15، g12000 سانتریفیوژ شد تا بخش معدنی از بخش آبی جدا شوند. محتوای RNA برداشته شد و با نسبت 1 به 0/5 با محلول ایزوپرویانول مخلوط و بهمدت 10 دقیقه در دامای اتاق قرار داده شد. سپس در C40، دقیقه10 با دور12000 سانتریفیوژ شد. پلات حاوی RNA توسط دستگاه (ساخت شرکت اپندورف آلمان) و در نسبت 260 به 280 بین 1/8 تا 2 بهعنوان تلخیص مطلوب شد. سنتز cDNA با استفاده از 1gµ از RNA، Randomhexamer primer و آنزیم transcriptase Mmulv Revers انجام شد. اندازهگیری بیان ژنهای BAX وBCL-2 بهترتیب (Cat. No: AP52304) و (Cat. No: AP341112) توسط روش کمیسازی Real time-pcr با استفاده از premix syper green II (ساخت شرکت آپلید کانادا) انجام شد. واکنش مخلوط در حجم نهایی Lµ20 و به صورت دوتایی انجام شد. طراحی پرایمرها نیز بر اساس اطلاعات ژنها در بانک اطلاعات NBCI (ساخت شرکت ماکروژن کشور کره) انجام شد. لازم بهذکر است که از βactin و L37a بهعنوان ژن کنترل استفاده شد. دمای مورد استفاده در 4 سیکل: 95 درجه سانتیگراد بهمدت 10 دقیقه، 95 درجه سانتیگراد به مدت 15 ثانیه، 60 درجه سانتیگراد بهمدت 1 دقیقه انجام شد. میزان بیان ژنهای موردنظر بهوسیله روش
 سنجش شد. اندازهگیری گلوکز پلاسما بهروش گلوکزاکسیداز (شرکت پارس آزمون) و اندازهگیری مقادیر انسولین از روش الایزا (Crystal chem ساخت کانادا) با ضریب تغییر 0/05 و حساسیت 1 ml/dl بررسی گردید. شاخص مقاومت به انسولین بهروش HOMA-IR طبق فرمول زیر اندازهگیری شد:
سنجش شد. اندازهگیری گلوکز پلاسما بهروش گلوکزاکسیداز (شرکت پارس آزمون) و اندازهگیری مقادیر انسولین از روش الایزا (Crystal chem ساخت کانادا) با ضریب تغییر 0/05 و حساسیت 1 ml/dl بررسی گردید. شاخص مقاومت به انسولین بهروش HOMA-IR طبق فرمول زیر اندازهگیری شد:HOMA-IR = (اﻧﺴﻮﻟ ﻴﻦ ﻧﺎﺷﺘﺎ)[µU/mL) × ﻧﺎﺷﺘﺎ ﮔﻠﻮﻛﺰ) mmol/L ) ] /22.5
جدول 3: توالی پرایمری ژنهای مورد مطالعه

تجزیه و تحلیل آماری
در بخش مربوط بهآمار توصیفی از شاخص پراکندگی انحراف معیار و نمودار استفاده شد. نرمال بودن توزیع دادهها با استفاده از آزمون شاپیروویلک مشخص شد. جهت تعیین اختلاف بین گروهها از آزمون t مستقل استفاده شد. تجزیه و تحلیل دادهها با استفاده از نرم افزاز Graph pad prism نسخه 8 و در سطح معنیداری 0/05≥P محاسبه شد.
ملاحظات اخلاقی
تمام مراحل با رعایت اصول اخلاقی کار با حیوانات آزمایشگاهی (برابر پروتکل هلیسنگی 2006) مصوب دانشگاه علوم پزشکی با اخذ کد اخلاق IR.SBMU.RETECH.1395.883 تصویب و انجام شد.
نتایج
همانگونه که اطلاعات جدول 1 نشان داد، تغییرات مقدار وزن پس از گذشت هشت هفته تمرین به لحاظ آماری معنادار نشد. اما تغییرات مقادیر گلوکز و شاخص مقاومت به انسولین در گروه تمرین نسبت به گروه کنترل معنادار شد. مقادیر بیان ژن BAX در گروه تمرین کاهش معناداری را نسبت به گروه کنترل نشان داد (P=0/0001). (نمودار1). مقادیر بیان ژن BCL-2 در گروه تمرین نسبت به گروه کنترل افزایش معناداری نشان داد (P=0/0001) (نمودار2). در جدول4 مقادیر بیان ژن BAX و BCL-2 برای هر یک از نمونهها در هر دو گروه پژوهش ارائه شده است.
جدول 4: مقادیر بیان ژن BAX و BCL-2 را در بافت بطن چپ موشهای صحرایی دیابتی پس از 8 هفته تمرین HIIT را نشان میدهد.

اعداد به شکل میانگین± خطا استاندارد بیان شدهاند. * نشانه معناداری نسبت به کنترل توسط آزمون آماری t مستقل.

نمودار 1: نسبت بیان ژن BAX به میزان GAPDH بر حسب گروهها
(*) نشانه تفاوت معنادار با گروه کنترل در سطح معناداری (0/05)

نمودار 2: نسبت بیان ژن BCL-2 به میزان GAPDH بر حسب گروهها
(*) نشانه تفاوت معنادار با گروه کنترل در سطح معناداری (0/05)
بحث
تحقیق حاضر بهبررسی تاثیر 8 هفته تمرین تناوبی شدید بر بیان ژنی BAX و BCL-2در بافت بطن چپ موشهای صحرایی دیابتی پرداخت. بر طبق یافتههای بهدست آمده در گروه تمرین ژن BAX کاهش معنادار و ژن BCL-2 افزایش معناداری نشان دادند. علیرغم کاهش شاخص گلوکز خون و مقاومت بهانسولین، وزن در گروه تمرین ثابت ماند. دلیل عدم تغییر وزن در گروه تمرین را میتوان به مصرف تغذیه پر چرب در تمام طول دوره اجرای پروتکل نسبت داد. در خصوص عوارض مقاومت به انسولین و متعاقب آن قند خون بالا در بیماران دیابتی، تاثیر واکنشهای گلیکوزیله بر ایجاد فشار اکسایشی و تولید بیش از حد رادیکالهای آزاد عنوان شده که میتواند متابولیسم سلولی را مختل و التهاب ایجاد کند (3) و بهوسیله کاهش در خون و اکسیژنرسانی به قلب (5)، غشاء میتوکندری را تخریب (3) و ظرفیت هوازی را تضعیف کند (8). بر این اساس به انجام تمرین منظم با شدت مناسب جهت بهبود عوارض هایپر گلایسمی در تنظیم بیان ژن توجه معطوف شده است (17،27،29). در این خصوص نتایج مطالعهای نشان داد انجام تمرین منظم میتواند با افزایش بیان ژن BCL-2 نسبت به BAX از وقوع آسیب ایسکمی جلوگیری کند (22). از مکانیسمهای احتمالی تاثیر تمرین تناوبی، قابلیت محافظت از سطح سلول با بهبود در خون رسانی و اکسیژنرسانی به قلب و تولید آنزیمهای هوازی پس از آن میباشد، که میتواند از ایجاد مرگ سلولی بافت قلب در بیماران دیابتی جلوگیری کند (25). زیرا سیگنالدهی داخل سلولی در پاسخ به محرک تمرین بهوسیله راه اندازی پروتئین PI3K و مصرف گلوکز با راهاندازی کلسیم درون سلولی و مسیرهای وابسته به آن نسبت ATP/ADP را تنظیم و از فرایند مرگ سلولی بهوسیله مهار ژن BAX و افزایش در سنتز و عملکرد ژن BCL-2 و استراحت فعال با شدت کم باعث کاهش در بیان پروتئین سرین تروئونین RIP/3 شده و از وقوع نکروز و آپوپتوز در میوسیت پیشگیری میکند (6). برخی مطالعات نیز چنین اظهار داشتند که اجرای ریکاوری فعال در تمرین HIIT باعث افزایش حساسیت بهانسولین، تنظیم بیان ژن و افزایش فاکتورهای متسعکننده عروقی از جمله نیتریک اکساید و پروکسی زوم آلفا میشود و در بهبود عملکرد قلب و عروق در بیماران متابولیکی موثر است (6،17،21). اما در مقایسه شدت تمرین نتایج مطالعهای نشان داد، هر دو نوع تمرین HIIT وHIT بهوسیله افزایش در بیان ژن BCL-2 فرایند آپوپتوز را z کاهش دادند (26). در حالیکه نتایج مطالعه کیم و همکاران (2010) نشان داد، 8 هفته تمرین تناوبی با سرعت 16 متر بر دقیقه و شیب 4 درصد، 5 جلسه در هفته بهمدت 40 دقیقه بر کاهش پروتئین BAX و افزایش BCL-2 تفاوت معنادار نداشت. این نتایج با یافته های بهدست آمده از مطالعه حاضر ناهمسو میباشد. سانتا و همکاران (2014) در مطالعه خود اظهار داشتند، تمرین هوازی با شدت متوسط به مدت 13 هفته و 60 دقیقه در هر روز باعث افزایش ژن BCL-2 در موشهای صحرایی نژاد ویستار شد (27). که با نتایج مطالعه حاضر همسو است. کواک و همکاران (2006) در مطالعه خود چنین بیان داشتند، 12 هفته تمرین تداومی با شدت متوسط، 5 روز در هفته و 60 دقیقه در روز نسبت BCL-2 به BAX را افزایش میدهد (28). که با نتایج بهدست آمده از مطالعه حاضر همسو است. اما در مطالعهای که توسط کرک سیک و همکاران (2008) انجام شد نتایج بهدست آمده نشان داد، یک وهله فعالیت حاد محرک تولید BAX شد و آپوپتوز را افزایش داد (29). این یافتهها با نتایج مطالعه حاضر ناهمسو میباشد. لیونا و همکاران (2017) در مطالعه خود چنین نتیجهگیری کردند، 8 هفته تمرین HIIT با شدت 95 درصد، با فعالسازی فاکتور رشد شبهانسولینی1(IGF-1)، پروتئین تیروزینکینازی AKT و m TORC-1 را افزایش داده و بهوسیله کاهش در سنتز SMAD/3 و افزایش در مصرف گلوکز، التهاب سلول را مهار و موجب بهبود حساسیت به انسولین میشود (30). نتایج بهدست آمده در خصوص کاهش گلوکز و افزایش حساسیت به انسولین با یافتههای مطالعه حاضر همسو است. در خصوص تاثیر تمرین HIIT عنوان شده این نوع تمرین از طریق مستقیم با مصرف گلوکز با راهاندازی GLUT-4 به سطح سلول و از راه غیر مستقیم بهوسیله افزایش فعالیت CAMP و راه اندازی مسیر کلسیم از سیتوزول، با افزایش در فعالیت CAMK-II در بهبود هومئوستاز گلوکز موثر باشد (17). با این حال از دلایل تناقض در یافتههای بهدست آمده با نتایج مطالعه حاضر نوع، شدت و مدت تمرین، مقدار عضله درگیر در فعالیت، مصرف دارو و نیز سطح سلامت آزمودنیها ذکر میشود (17،21،26،28،29،30). همانطوری که نتایج مطالعه حاضر نشان داد، تمرین تناوبی شدید در کاهش مقاومت به انسولین، بهبود مصرف گلوکز و نیز کاهش در آپوپتوز بافت قلب موشهای مدل دیابتی موثر بود، با این حال بهتر است قبل از طراحی اینگونه از تمرینات در صورت مصرف داروهای کاهنده قند خون و یا تزریق انسولین، از مدت زمان و دوز مصرفی و نیز سطح عملکرد قلب توسط پزشک متخصص آگاهی داشته باشد تا بتوان از تاثیر مفید اینگونه تمرینات به طور ایمن بهرهمند شد. بر اساس نتایج بهدست آمده، 8 هفته تمرین تناوبی شدید میتواند با کاهش در بیان ژن BAX و افزایش ژن BCL-2 در میوکارد موشهای مبتلا به دیابت آپوپتوز را در بطن چپ کاهش داده و احتمالاً کاردیومیوپاتی دیابتی را بهبود بخشد. از محدودیتهای مطالعه حاضر میتوان به عدم دسترسی به آزمودنیهای انسانی اشاره کرد، همچنین محدودیت دیگر نیز عدم اندازه گیری پروتئین ژنهای مذکور است که از دلایل آن کمبود بودجه پژوهش میباشد. یکی دیگر از محدودیتهای مطالعه حاضر عدم انجام پیشآزمون بین دو گروه در ابتدای مطالعه بود که سبب تایید عدم وجود تغییرات قبل از مداخله تمرینی میشد. اما پژوهشگران بهدلیل کمبودهای مالی قادر بهانجام پیشآزمون نبودند و استناد عدم وجود تفاوتهای قبل از مداخله، به گروه کنترل بسنده شد. پیشنهاد میشود در مطالعات آینده مقایسه مدل تمرینی مذکور با تمرین مقاومتی و بهطور گستردهتر بررسی گردد.
نتیجهگیری
بر اساس یافتههای بهدست آمده، 8 هفته تمرین تناوبی شدید میتواند با کاهش بیان ژن BAX و افزایش BCL-2 در میوکارد موشهای مبتلا بهدیابت احتمالاً آپوپتوز را در بطن چپ کاهش داده و ممکن است بتواند کاردیومیوپاتی دیابتی را بهبود بخشد.
سپاسگزاری
مطالعه حاضر بخشی از رساله دکترا میباشد، بدینوسیله از اساتید گرانقدر بابت راهنماییهای مبذول داشته و همه عزیزانی که در انجام این پژوهش ما را یاری رساندند تشکر و قدردانی مینماییم.
حامی مالی: ندارد.
تعارض در منافع: وجود ندارد.
References:
1-Morrison E, Ragoobirsingh D, Thompson H, Fletcher C, Smith-Richardson S, McFarlane S, et al. Phasic Insulin Dependent Diabetes Mellitus: Manifestations and Cellular Mechanisms. J Clin Endocrinology & Metabolism 1995; 80(7): 1996-2001.
2-Shimizu M, Umeda K, Sugihara N, Yoshio H, Ino H, Takeda R, et al. Collagen Remodelling in Myocardia of Patients with Diabetes. J Clin Pathology 1993; 46(1): 32-6.
3-Powers SK, Demirel HA, Vincent HK, Coombes JS, Naito H, Hamilton KL, et al. Exercise Training Improves Myocardial Tolerance to in Vivo Ischemia-Reperfusion in the Rat. Am J Physiol 1998; 275(5): R1468-77.
4-Hafstad AD, Boardman N, Aasum E. How Exercise May Amend Metabolic Disturbances in Diabetic Cardiomyopathy. Antioxid Redox Signal 2015; 22(17): 1587-605.
5-Lorenzo O, Picatoste B, Ares-Carrasco S, Ramirez E, Egido J, Tunon J. Potential Role of Nuclear Factor B in Diabetic Cardiomyopathy. Mediators Inflammation 2011; 2011: 652097
6-Newton K, Dugger DL, Maltzman A, Greve JM, Hedehus M, Martin-McNulty B, et al. RIPK3 Deficiency or Catalytically Inactive RIPK1 Provides Greater Benefit than MLKL Deficiency in Mouse Models of Inflammation and Tissue Injury. Cell Death Differ 2016; 23(9): 1565-76.
7-Grundy SM, Benjamin IJ, Burke GL, Chait A, Eckel RH, Howard BV, et al. Diabetes and Cardiovascular Disease: A Statement for Healthcare Professionals from the American Heart Association. Circulation 1999; 100(10): 1134-46.
8-Lu K, Shen Y, He J, Liu G, Song W. [Berberine Inhibits Cardiac Fibrosis of Diabetic Rats]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi 2016; 32(10): 1352-5.
9-Fowler MJ. Microvascular and Macrovascular Complications of Diabetes. Clin Diabet 2008; 26(2): 77-82.
10-Luedde M, Lutz M, Carter N, Sosna J, Jacoby C, Vucur M, et al. RIP3, A Kinase Promoting Necroptotic Cell Death, Mediates Adverse Remodelling after Myocardial Infarction. Cardiovasc Res 2014; 103(2): 206-16.
11-Borges JP, Lessa MA. Mechanisms Involved in Exercise-Induced Cardioprotection: A Systematic Review. Arq Bras De Cardiol 2015; 105(1): 71-81.
12-Shen E, Li Y, Li Y, Shan L, Zhu H, Feng Q, et al. Rac1 is Required for Cardiomyocyte Apoptosis During Hyperglycemia. Diabetes 2009; 58(10): 2386-95.
13-Köhler C, Orrenius S, Zhivotovsky B. Evaluation of Caspase Activity in Apoptotic Cells. J Immunological Method 2002; 265(1-2): 97-110.
14-Wang J, Song Y, Wang Q, Kralik PM, Epstein PN. Causes and Characteristics of Diabetic Cardiomyopathy. Rev Diabet Stud 2006; 3(3): 108.
15-Marzetti E, Privitera G, Simili V, Wohlgemuth SE, Aulisa L, Pahor M, et al. Multiple Pathways to the Same End: Mechanisms of Myonuclear Apoptosis in Sarcopenia of Aging. The Scientific World J 2010; 10: 340-9.
16-Xu X, Wan W, Ji L, Lao S, Powers AS, Zhao W, et al. Exercise Training Combined With Angiotensin II Receptor Blockade Limits Post-Infarct Ventricular Remodelling in Rats. Cardiovasc Res 2008; 78(3): 523-32.
17-Kim DY, Jung SY, Kim CJ, Sung YH, Kim JD. Treadmill Exercise Ameliorates Apoptotic Cell Death in the Retinas of Diabetic Rats. Mol Med Rep 2013; 7(6): 1745-50.
18-Tanoorsaz S, Behpour N, Tadibi V. Investigating the Effect of Mid-Term of Aerobic Exercise on Apoptosis Biomarkers in the Cardiomyocytes of Streptozotocin-Induced Diabetic Rats. J Fasa Uni Med Sci 2018; 7(4): 488-97.
19-Touvra A-M, Volaklis KA, Spassis AT, Zois CE, Douda H, Kotsa K, et al. Combined Strength and Aerobic Training Increases Transforming Growth Factor-Beta1 in Patients with Type 2 Diabetes. Hormones (Athens) 2011; 10(2): 125-30.
20-Castellar A, Remedio R, Barbosa R, Gomes RJ, Caetano FH. Collagen and Reticular Fibers in Left Ventricular Muscle in Diabetic Rats: Physical Exercise Prevents its Changes? Tissue and Cell 2011; 43(1): 24-8.
21-Estes Rr, Malinowski A, Piacentini M, Thrush D, Salley E, Losey C, et al. The Effect of High Intensity Interval Run Training on Cross-Sectional Area of the Vastus Lateralis in Untrained College Students. Int J Exerc Sci 2017; 10(1): 137-45.
22-Aboutaleb N, Shamsaei N, Khaksari M, Erfani S, Rajabi H, Nikbakht F. Pre-Ischemic Exercise Reduces Apoptosis in Hippocampal CA3 Cells After Cerebral Ischemia by Modulation of the Bax/Bcl-2 Proteins Ratio and Prevention of Caspase-3 Activation. J Physiol Sci 2015; 65(5): 435-43.
23-Khakdan S, Delfan M, Heydarpour Meymeh M, Kazerouni F, Ghaedi H, Shanaki M, et al. High-Intensity Interval Training (HIIT) Effectively Enhances Heart Function via Mir-195 Dependent Cardiomyopathy Reduction in High-Fat High-Fructose Diet-Induced Diabetic Rats. Arch Physiol Biochem 2020; 126(3): 250-7.
24-Leandro CG, Levada AC, Hirabara SM, Manhães-de-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Conditioning Res 2007; 21(3): 751.
25-Hong JH, Kim MJ, Park MR, Kwag OG, Lee IS, Byun BH, et al. Effects of Vitamin E on Oxidative Stress and Membrane Fluidity in Brain of Streptozotocin-Induced Diabetic Rats. Clin Chimica Acta 2004; 340(1-2): 107-15.
26-Bayir H, Kagan VE. Bench-To-Bedside Review: Mitochondrial Injury, Oxidative Stress and Apoptosis–There is Nothing More Practical than a Good Theory. Crit Care 2008; 12(1): 206.
27-Santana ET, Serra AJ, Silva Junior JA, Bocalini DS, Barauna VG, Krieger JE, et al. Aerobic Exercise Training Induces an Anti-Apoptotic Milieu in Myocardial Tissue. Motriz: Rev De Edu Fís 2014; 20(2): 233-8.
28-Kwak HB, Song W, Lawler JM. Exercise Training Attenuates Age-Induced Elevation in Bax/Bcl-2 Ratio, Apoptosis, and Remodeling in the Rat Heart. FASEB J 2006; 20(6): 791-3.
29-Kerksick C, Lem Taylor I, Harvey A, Willoughby D. Gender-Related Differences in Muscle Injury, Oxidative Stress, and Apoptosis. Med Sci in Sports Exer 2008; 40(10): 1772-80.
30-Launay T, Momken I, Carreira S, Mougenot N, Zhou X-L, De Koning L, et al. Acceleration-Based Training: A New Mode of Training in Senescent Rats Improving Performance and Left Ventricular and Muscle Functions. Exp Gerontol 2017; 95: 71-6.
1-Morrison E, Ragoobirsingh D, Thompson H, Fletcher C, Smith-Richardson S, McFarlane S, et al. Phasic Insulin Dependent Diabetes Mellitus: Manifestations and Cellular Mechanisms. J Clin Endocrinology & Metabolism 1995; 80(7): 1996-2001.
2-Shimizu M, Umeda K, Sugihara N, Yoshio H, Ino H, Takeda R, et al. Collagen Remodelling in Myocardia of Patients with Diabetes. J Clin Pathology 1993; 46(1): 32-6.
3-Powers SK, Demirel HA, Vincent HK, Coombes JS, Naito H, Hamilton KL, et al. Exercise Training Improves Myocardial Tolerance to in Vivo Ischemia-Reperfusion in the Rat. Am J Physiol 1998; 275(5): R1468-77.
4-Hafstad AD, Boardman N, Aasum E. How Exercise May Amend Metabolic Disturbances in Diabetic Cardiomyopathy. Antioxid Redox Signal 2015; 22(17): 1587-605.
5-Lorenzo O, Picatoste B, Ares-Carrasco S, Ramirez E, Egido J, Tunon J. Potential Role of Nuclear Factor B in Diabetic Cardiomyopathy. Mediators Inflammation 2011; 2011: 652097
6-Newton K, Dugger DL, Maltzman A, Greve JM, Hedehus M, Martin-McNulty B, et al. RIPK3 Deficiency or Catalytically Inactive RIPK1 Provides Greater Benefit than MLKL Deficiency in Mouse Models of Inflammation and Tissue Injury. Cell Death Differ 2016; 23(9): 1565-76.
7-Grundy SM, Benjamin IJ, Burke GL, Chait A, Eckel RH, Howard BV, et al. Diabetes and Cardiovascular Disease: A Statement for Healthcare Professionals from the American Heart Association. Circulation 1999; 100(10): 1134-46.
8-Lu K, Shen Y, He J, Liu G, Song W. [Berberine Inhibits Cardiac Fibrosis of Diabetic Rats]. Xi Bao Yu Fen Zi Mian Yi Xue Za Zhi 2016; 32(10): 1352-5.
9-Fowler MJ. Microvascular and Macrovascular Complications of Diabetes. Clin Diabet 2008; 26(2): 77-82.
10-Luedde M, Lutz M, Carter N, Sosna J, Jacoby C, Vucur M, et al. RIP3, A Kinase Promoting Necroptotic Cell Death, Mediates Adverse Remodelling after Myocardial Infarction. Cardiovasc Res 2014; 103(2): 206-16.
11-Borges JP, Lessa MA. Mechanisms Involved in Exercise-Induced Cardioprotection: A Systematic Review. Arq Bras De Cardiol 2015; 105(1): 71-81.
12-Shen E, Li Y, Li Y, Shan L, Zhu H, Feng Q, et al. Rac1 is Required for Cardiomyocyte Apoptosis During Hyperglycemia. Diabetes 2009; 58(10): 2386-95.
13-Köhler C, Orrenius S, Zhivotovsky B. Evaluation of Caspase Activity in Apoptotic Cells. J Immunological Method 2002; 265(1-2): 97-110.
14-Wang J, Song Y, Wang Q, Kralik PM, Epstein PN. Causes and Characteristics of Diabetic Cardiomyopathy. Rev Diabet Stud 2006; 3(3): 108.
15-Marzetti E, Privitera G, Simili V, Wohlgemuth SE, Aulisa L, Pahor M, et al. Multiple Pathways to the Same End: Mechanisms of Myonuclear Apoptosis in Sarcopenia of Aging. The Scientific World J 2010; 10: 340-9.
16-Xu X, Wan W, Ji L, Lao S, Powers AS, Zhao W, et al. Exercise Training Combined With Angiotensin II Receptor Blockade Limits Post-Infarct Ventricular Remodelling in Rats. Cardiovasc Res 2008; 78(3): 523-32.
17-Kim DY, Jung SY, Kim CJ, Sung YH, Kim JD. Treadmill Exercise Ameliorates Apoptotic Cell Death in the Retinas of Diabetic Rats. Mol Med Rep 2013; 7(6): 1745-50.
18-Tanoorsaz S, Behpour N, Tadibi V. Investigating the Effect of Mid-Term of Aerobic Exercise on Apoptosis Biomarkers in the Cardiomyocytes of Streptozotocin-Induced Diabetic Rats. J Fasa Uni Med Sci 2018; 7(4): 488-97.
19-Touvra A-M, Volaklis KA, Spassis AT, Zois CE, Douda H, Kotsa K, et al. Combined Strength and Aerobic Training Increases Transforming Growth Factor-Beta1 in Patients with Type 2 Diabetes. Hormones (Athens) 2011; 10(2): 125-30.
20-Castellar A, Remedio R, Barbosa R, Gomes RJ, Caetano FH. Collagen and Reticular Fibers in Left Ventricular Muscle in Diabetic Rats: Physical Exercise Prevents its Changes? Tissue and Cell 2011; 43(1): 24-8.
21-Estes Rr, Malinowski A, Piacentini M, Thrush D, Salley E, Losey C, et al. The Effect of High Intensity Interval Run Training on Cross-Sectional Area of the Vastus Lateralis in Untrained College Students. Int J Exerc Sci 2017; 10(1): 137-45.
22-Aboutaleb N, Shamsaei N, Khaksari M, Erfani S, Rajabi H, Nikbakht F. Pre-Ischemic Exercise Reduces Apoptosis in Hippocampal CA3 Cells After Cerebral Ischemia by Modulation of the Bax/Bcl-2 Proteins Ratio and Prevention of Caspase-3 Activation. J Physiol Sci 2015; 65(5): 435-43.
23-Khakdan S, Delfan M, Heydarpour Meymeh M, Kazerouni F, Ghaedi H, Shanaki M, et al. High-Intensity Interval Training (HIIT) Effectively Enhances Heart Function via Mir-195 Dependent Cardiomyopathy Reduction in High-Fat High-Fructose Diet-Induced Diabetic Rats. Arch Physiol Biochem 2020; 126(3): 250-7.
24-Leandro CG, Levada AC, Hirabara SM, Manhães-de-Castro R. A Program of Moderate Physical Training for Wistar Rats Based on Maximal Oxygen Consumption. J Strength Conditioning Res 2007; 21(3): 751.
25-Hong JH, Kim MJ, Park MR, Kwag OG, Lee IS, Byun BH, et al. Effects of Vitamin E on Oxidative Stress and Membrane Fluidity in Brain of Streptozotocin-Induced Diabetic Rats. Clin Chimica Acta 2004; 340(1-2): 107-15.
26-Bayir H, Kagan VE. Bench-To-Bedside Review: Mitochondrial Injury, Oxidative Stress and Apoptosis–There is Nothing More Practical than a Good Theory. Crit Care 2008; 12(1): 206.
27-Santana ET, Serra AJ, Silva Junior JA, Bocalini DS, Barauna VG, Krieger JE, et al. Aerobic Exercise Training Induces an Anti-Apoptotic Milieu in Myocardial Tissue. Motriz: Rev De Edu Fís 2014; 20(2): 233-8.
28-Kwak HB, Song W, Lawler JM. Exercise Training Attenuates Age-Induced Elevation in Bax/Bcl-2 Ratio, Apoptosis, and Remodeling in the Rat Heart. FASEB J 2006; 20(6): 791-3.
29-Kerksick C, Lem Taylor I, Harvey A, Willoughby D. Gender-Related Differences in Muscle Injury, Oxidative Stress, and Apoptosis. Med Sci in Sports Exer 2008; 40(10): 1772-80.
30-Launay T, Momken I, Carreira S, Mougenot N, Zhou X-L, De Koning L, et al. Acceleration-Based Training: A New Mode of Training in Senescent Rats Improving Performance and Left Ventricular and Muscle Functions. Exp Gerontol 2017; 95: 71-6.
نوع مطالعه: پژوهشي |
موضوع مقاله:
فیزیولوژی ورزش
دریافت: 1399/2/24 | پذیرش: 1399/7/10 | انتشار: 1399/7/10
دریافت: 1399/2/24 | پذیرش: 1399/7/10 | انتشار: 1399/7/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







