دوره 29، شماره 8 - ( آبان 1400 )
جلد 29 شماره 8 صفحات 4020-4013 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Nikkhah H, Vafaei M, Farashahi Yazd E, Arjmand F, Shahvazian E, Mahmoodi M B et al . Association between rs2228014 Polymorphism of CXCR4 and Coronary Artery Atherosclerosis: A Case-Control Study. JSSU 2021; 29 (8) :4013-4020
URL: http://jssu.ssu.ac.ir/article-1-5139-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5139-fa.html
نیکخواه هانیه، وفایی مریم، فراشاهی یزد احسان، ارجمند فاطمه، شهوازیان انسیه، محمودی محمدباقر و همکاران.. بررسی همراهی پلیمورفیسم rs2228014 از ژن CXCR4 با آترواسکلروزیس شریان کرونر: مطالعه مورد-شاهدی. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (8) :4013-4020
هانیه نیکخواه 

 ، مریم وفایی
، مریم وفایی 

 ، احسان فراشاهی یزد*
، احسان فراشاهی یزد* 

 ، فاطمه ارجمند
، فاطمه ارجمند 

 ، انسیه شهوازیان
، انسیه شهوازیان 

 ، محمدباقر محمودی
، محمدباقر محمودی 

 ، عباس اندیشمند
، عباس اندیشمند 




 ، مریم وفایی
، مریم وفایی 

 ، احسان فراشاهی یزد*
، احسان فراشاهی یزد* 

 ، فاطمه ارجمند
، فاطمه ارجمند 

 ، انسیه شهوازیان
، انسیه شهوازیان 

 ، محمدباقر محمودی
، محمدباقر محمودی 

 ، عباس اندیشمند
، عباس اندیشمند 


متن کامل [PDF 557 kb]
(741 دریافت)
| چکیده (HTML) (1975 مشاهده)
متن کامل: (851 مشاهده)
مقدمه
آترواسکلروزیس یک بیماری التهابی مزمن چند عاملی است (2, 1). آترواسکلروزیس میتواند با تغییر فعالیت مولکولهای زیستی و وابسته به سن روی دهد (3). یک پلاک آترواسکلروزیس از هسته سلولهای نکروز شده، ناحیه کلسیفیه شده، لپیدهای تغییر یافته، سلولهای ماهیچهای صاف (SMC)، سلولهای اندوتلیال (EC)، لوکوسیتها و نوع خاصی از ماکروفاژها (سلولهای حبابی) تشکیل شده است (4). این پلاکها باعث افزایش ضخامت لایه درونی رگ میشوند (5). این پلاکها در اثر متلاشی شدن نیز میتوانند باعث بروز ترومبوز در رگ شوند و این پدیده میتواند در رگهای قلبی و یا محیطی رخ دهد و عامل بسیاری از مرگ و میرها باشد. بیماریهای قلبی-عروقی یکی از علل اصلی مرگ و میر در سراسر جهان بوده که تا سال 2015 نزدیک به 31 درصد علت فوت به دلیل این عارضه بوده است. این عارضه در رگ-های محیطی بدن مهمترین عامل مرگ و میر در کشورهای غربی است که در این کشورها کمی بیش از 19% افراد مبتلای بالای 55 سال را تشکیل میدهد (15% از بیماران مرد در 5 سال اول شناسایی می¬میرند). عوامل خطر بیماری شامل مواردی مثل فشارخون بالا، دیابت شیرین و جنسیت میباشد (6). کموکاینها خانواده بزرگی از پروتئین¬ها هستند که بر اساس جایگاه 2 رزیدوی سیستئین اولی به چهار زیر گروه (CXC، C، CC و CX3C) تقسیم میشوند. هر کدام از این زیر گروهها خاصیت جاذبه شیمیایی ویژهای برای جذب گروهی از سلولها دارند (8، 7). پروتئین CXC ligand 12 (CXCL12) و گیرنده آن C-X-C chemokine receptor 4 (CXCR4) از کموکاینهای درگیر در فرایند التهابی تشکیل پلاک در بیماران آترواسکلروزیس و از گروه مولکولی کموکاینها هستند. CXCL12 که با نام stromal cell-derived factor (SDF-1) 1 نیز شناخته میشود، کموکاینی است که هم در تشکیل پلاک با فراخوانی سلولهای اندوتیال، ماکروفاژ، پلاکت و سلولهای ماهیچه صاف نقش دارد و هم با جذب نوتروفیل در متلاشی شدن پلاک و ایجاد ترومبوز دخالت میکند (9). این کموکاین مهم بعد از ایسکمی در بافتها، در ایجاد رگ جدید و اکسیژنرسانی به بافت نیز نقش ایفا میکند (10). پروتئین MCP (Monocyte Chemoattractant Protein-1) یکی دیگر از اعضای خانواده کموکاینها و یک پلیپپتید مونومری است که به سطح سلولهای اندوتلیال از طریق گیرنده خود CCR2 متصل شده و نقش مهمی در التهاب رگی، از طریق تحریک جذب لوکوسیتها، جذب فاگوسیتهای تک هسته، لنفوسیتهای T خاطره و سلولهای کشنده طبیعی و نفوذ آنها به بافت را ایفا میکند (11). ژن CXCL12، گیرنده آن CXCR4 و CCL2 دارای واریانت¬های نوکلئوتیدی متعددی، چه در ناحیه کدکننده ژن و چه در نواحی غیرکدکننده میباشند. این متغیرها بهصورت بالقوه از عواملی هستند که میتوانند بر عملکرد، پایداری و میزان غلظت این پروتئینها در سلولها نقش داشته باشند. گروهی از این تغییرات قبلاً گزارش و تایید شده این ژنها، یعنی پلیمورفیسمها، بهطور معمول در مطالعات اپیدمیولوژی و ژنتیک جمعیت (اپیدمیوژنتیکی) در قالب مطالعات ارزیابی همراهی فراوانی آللی و ژنوتیپی با بروز بیماریها و عوارضشان مورد استفاده قرار میگیرند. مطالعه حاضر با هدف ارزیابی ارتباط بین فراوانی پلیمورفیسم rs2228014 از ژن CXCR4 با آترواسکلروزیس شریان کرونر طراحی و انجام پذیرفت. مطالعات متعددی نشان دادهاند که میزان بالای SDF1 (CXCL12) در بافت میوکارد سکتهای، به خاطر نقش حمایتی آن از عضله و ارتقای عملکرد قلب پس از سکته قلبی در وضعیت in-vivo است (13, 12) و نقش محور SDF1/CXCR4/CXCR7 را در فراخوانی سلولهای پیش اندوتلیالی و بازیابی عملکرد قلب بعد از سکته مهم معرفی میکنند (16- 14). و به نظر میرسد حضور پلیمورفیسمهای متعدد در ژن SDF-1 بتوانند تغییردهنده تخمین میزان زندهمانی بیماران قلبی-عروقی باشند. در این راستا در مطالعهای به همراهی معنیدار پلیمورفیسم rs1801157 با بیماری عروق کرونری نابالغین اشاره شده است (17). CXCR4 بهعنوان گیرنده محوری CXCL12 به سلولهای دارنده خود امکان پاسخ به این سیگنال مهاجرتی فراهم میآورد. گزارشهای متعددی از حضور این پروتئین در ناحیه پلاکهای عروقی وجود دارد که به واسطه جذب سلولهای ماکروفاژی و پلاکتهای دارای این گیرنده اتفاق افتاده است (18, 16). پلیمورفیسمهای متعددی از این ژن نیز در همراهی با سرطانهای مختلف مطرح و از موارد شاخص از بین آنها rs2228014 است (19). با توجه به اهمیت ژن CXCR4 در روند پاتوژنسیتی عارضه آترواسکلروزیس بر آن شدیم که ارتباط و همراهی احتمالی rs2228014 از ژن CXCR4 را با بیماری آترواسکلروزیس شریان کرونر بررسی کنیم.
روش بررسی
DNA جمعآوری نمونه و استخراج
در این مطالعه دو گروه مورد و شاهد از افراد مراجعهکننده جهت آنژیوگرافی به مرکز قلب بیمارستان افشار یزد انتخاب گردیدند که مبنای ورود افراد به گروه مورد، تایید گرفتگی بیش از یک رگ و معیار ورود به گروه شاهد عدم گرفتگی و یا گرفتگی یک رگ توسط پزشک متخصص قلب از تست آنژیوگرافی بود. اطلاعات مربوط به سن، جنس، مصرف مواد دخانی، هایپرکلسترولمیا، دیابت میلیتوس، فشارخون در هر دو گروه قبل از نمونهگیری خون جمعآوری و پس از همسان سازی هر دو گروه بر اساس سن و جنسیت، مراحل بعدی مطالعه پیش برده شد. گروه مورد مطالعه شامل 112 بیمار مبتلا به بیماری آترواسکلروزیس شریان کرونر و گروه شاهد 142 فرد سالم بودند. در این پژوهش فرم رضایتنامه به امضای هر فرد اهداکننده نمونه رسیده و از ایشان 5 میلیلیتر خون وریدی در لولههای حاوی EDTA گرفته و برای مراحل استخراج DNA جهت آزمایشات تعیین پلیمورفیسم آماده گردید. این مطالعه تحت نظارت کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد انجام شد.
تعیین ژنوتایپ به روش Tetra-ARMS PCR
استخراج DNA با استفاده از کیت استخراج DNA (فناوری روژه، ایران) انجام پذیرفت. طراحی پرایمرها با استفاده با نرمافزار input Primer 3 انجام شد و اختصاصی بودن آنها با استفاده از Primer-BLAST و UCSC بررسی گردید (جدول1). تعیین ژنوتایپ به روش Tetra-ARMS PCR و برنامه 35 چرخهای PCR با شرایط؛ مرحله واسرشت سازی در دمای 96 به مدت 30 ثانیه، مرحله اتصال پرایمرها در دمای 65 به مدت 30 ثانیه و مرحله پلیمریزاسیون DNA در دمای 72 و به مدت 30 ثانیه انجام گرفت. بر اساس قطعات مشاهده شده حاصل از PCR بر روی ژل آگارز 1% تعیین ژنوتایپ صورت گرفت. قطعه 414 نوکلئوتیدی در صورت حضور آلل G و قطعه 326 نوکلئوتیدی در صورت حضور آلل A و محصول 689 نوکلئوتیدی کنترل داخلی بود.
تجزیه و تحلیل آماری
برای تحلیل آماری دادهها از نرمافزارversion 16 SPSS استفاده گردید. به منظور بررسی توزیع ژنتیکی پلیمورفیسم rs2228014 و بیماری آترواسکلروزیس شریان کرونر در دو گروه مورد و شاهد و همچنین ارزیابی مدلهای ژنتیکی آللی، هوموزیگوت، هتروزیگوت، غالب و مغلوب از طریق آنالیز آزمون کای-دو صورت گرفت و شانس ابتلا و فاصله اطمینان محاسبه گردید و مقادیر P کمتر از 0/05 به عنوان اختلاف معنادار در نظر گرفته شد. از سوی دیگر به منظور بررسی تعادل هاردی واینبرگ و ارزیابی تطابق فراوانی ژنوتیپهای مشاهده شده مربوط به این پلیمورفیسم در جمعیت و تعداد مورد انتظار از آزمون کای-دو استفاده شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی شهید صدوقی یزد تکمیل شده است (کد اخلاق IR.SSU.REC.1392.217688).
نتایج
تعیین فراوانی آللی این پلیمورفیسم در مجموع جمعیت مورد مطالعه بر اساس تحلیل تصاویر ژل الکتروفورزیز (شکل 1) صورت گرفت و نتایج فراوانی آلل G در کل جمعیت مطالعه به میزان 90/7% و آلل A را به میزان 9/3% بود (جدول 2). اما این فراوانیها در دو زیر جمعیت مورد و شاهد تفاوت¬هایی را نشان داد، به طوریکه در گروه مورد، فراوانی آللی A، 7/6% و در جمعیت شاهد، 10/6% بود. از سوی دیگر فراوانی آللی G در زیر جمعیت مورد 92/4% و در زیر جمعیت شاهد 89/4% بود که این تفاوت با معنی¬داری همراه نبود (P=0/333). نتایج تعیین فراوانی ژنوتیپی این پلیمورفیسم در کل جمعیت حاکی از فراوانی¬های ژنوتیپی GG به میزان تقریبی 84/2%، GA برابر با 13% و AA برابر با 2/8% بود (جدول 3). اما این فراوانیها در دو زیر جمعیت مورد و شاهد تفاوت¬هایی را نشان داد، به طوریکه در ارتباط با فراوانیهای ژنوتیپی، نسبتها در گروه مورد در مقایسه با گروه شاهد به ترتیب برای ژنوتیپ¬های GG 85/7% به 83/1%، GA 13/4% به 12/7% و AA 0/9% به 4/2% بود که این تفاوتها نیز با معنیداری همراه نبود (P=0/229). همچنین ارتباط پلیمورفیسم rs2228014 و بیماری آترواسکلروزیس شریان کرونر در مدلهای ژنتیکی هوموزیگوت(P=0/087) ، هتروزیگوت(P=0/849) ، غالب (P=0/570) و مغلوب(P=0/086) مورد بررسی قرار گرفت که هیچ یک از مدلهای ژنتیکی پلیمورفیسم rs2228014 ارتباط معناداری با بیماری آترواسکلروزیس نشان ندادند (جدول 4). از سوی دیگر ارزیابی صورت گرفته در گروه کنترل عدم تعادل هاردی-واینبرگ را در این گروه نشان میدهد.
جدول 1: پرایمرهای استفاده شده برای پلیمورفیسم rs2228014 ژن CXCR4

جدول 2: جدول مقایسه فراوانیهای آللی پلیمورفیسم rs2228014 در بیماران مبتلا به آترواسکلروزیس و گروه شاهد
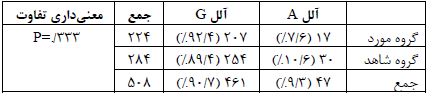
*آزمون کای-دو به منظور آنالیز آماری استفاده و مقدار P کمتر از 0.05 به عنوان معناداری در نظر گرفته شده است.
جدول 3: مقایسه فراوانیهای ژنوتیپی پلیمورفیسم rs2228014 در بیماران مبتلا به آترواسکلروزیس و گروه شاهد
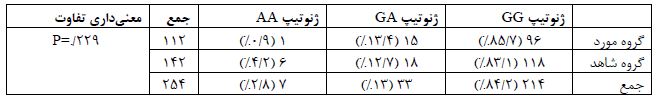
*آزمون کای-دو به منظور آنالیز آماری استفاده و مقدار P کمتر از 0.05 به عنوان معناداری در نظر گرفته شده است.
جدول 4: مدلهای ژنتیکی پلیمورفیسم rs2228014 و ارتباط آنها با بیماری آترواسکلروزیس
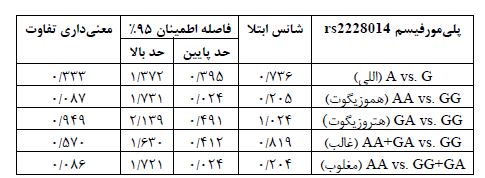
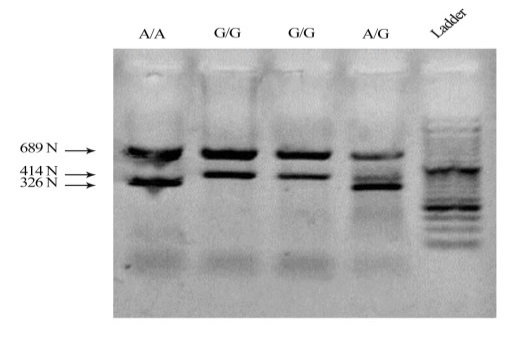
شکل 1: شکل حاضر نتایج تکثیر با پرایمرهای اختصاصی طراحی شده برای اللهای G و A پلیمورفیسم rs2228014 ژن CXCR4 را نشان میدهد. قطعه حاصل از تکثیر با پرایمر اختصاصی آلل A قطعه 326 نوکلئوتیدی را ایجاد میکند و آلل G قطعه 414 نوکلئوتیدی را تکثیر میکند. تست به صورت Tetra-Primers ARMS با همراهی دو پرایمر خارجی و به صورت تک لوله انجام گرفته است.
بحث
مطالعات متعددی در ارتباط با پلیمورفیسم rs2228014 در حوزه سرطان صورت گرفته است. بررسی پلیمورفیسم rs2228014 در بیماران مبتلا به لوسمی میلوییدی حاد در مقایسه با گروه کنترل نشان داده که این پلیمورفیسم شانس ابتلا به این نوع سرطان را به میزان معناداری افزایش می¬دهد (20). همچنین بررسی پلیمورفیسم rs2228014 در بیماران مبتلا به کارسینومای هپاتوسلولار، ارتباط معنادار این پلیمورفیسم با افزایش شانس ابتلا به این نوع سرطان را نشان می¬دهد (21). از سوی دیگر این پلیمورفیسم به میزان چشمگیری شانس زنده¬ماندن بیماران سرطان کولورکتال را کاهش میدهد (22). در زمینه ارتباط پلیمورفیسم rs2228014 و بیماری¬های قلبی-عروقی مطالعات بسیار محدودی صورت گرفته است. در این مطالعه عدم وجود اختلاف معنادار در فراوانی¬های آللی و ژنوتیپی پلیمورفیسم rs2228014 میان مبتلایان به آترواسکلروزیس و گروه کنترل نمی¬تواند به صورت قطعی حاکی از عدم ارتباط این پلیمورفیسم باشد، اما گزارشی وجود دارد که بر خلاف نتیجه بهدست آمده تاثیرگذاری این پلیمورفیسم را بر روی آترواسکلروزیس تایید می¬کند. در مطالعه رونمین و همکاران که بر روی جمعیت چینی در سال 2018 صورت گرفته (23)، خطر افزایش یافته 29 درصدی برای بیماری عروق کرونری برای آلل A بهدست آمده و در ضمن افزایش خطر برای ژنوتیپ AA و AG را در مقایسه با GG به ترتیب تقریباً 2 برابر و 27 درصد بالاتر اعلام میدارد و تفاوت عمده و مطمئناً تاثیرگذار در این مطالعه، نحوه گروهبندی مطالعه و جمعیت نمونهای آن است. در مطالعه مذکور 1200 نفر بیمار و 1200 نفر سالم را در مطالعه وارد کرده و مصرفکنندگان دخانیات و مشروبات الکلی از مطالعه خارج نشده و به وضوح تعداد افراد مصرف کننده مواد دخانی و مبتلا به دیابت در گروه بیماران بالاتر از گروه سالم است. در ضمن فراوانیهای آللی هم تقریباً معکووس مطالعه ما بوده بهطوریکه آلل A در جمعیت ما دارای فراوانی 91% و فراوانی این آلل در جمعیت چینی مورد مطالعه تنها 15% است. بنابراین امکان مقایسه منطقی بین نتایج این مطالعه و نتایج مطالعه مذکور وجود ندارد. پلیمورفیسمها به عنوان متغیرهای ژنتیکی مطمئناً بر مراحل مختلف اعم از ایجاد، پیشرفت و شدت بیماریها اثر گذارند اما در مطالعه حاضر ارتباط معنیداری در همراهی پلیمورفیسم rs2228014 از ژن CXCR4 با عارضه آترواسکلروزیس عروق کرونری در جمعیت مورد مطالعه مشاهده نشد و مطمئناً با مطالعه بر روی جمعیتی بزرگتر و متنوعتر از ایران میتوان این همراهی را مورد ارزیابی دقیقتر قرار داد. نظر به اینکه مشکلات قلبی-عروقی از اولویتهای بالای حوزههای مختلف درمانی و تحقیقاتی است و استعداد ژنتیکی ابتلا به این گروه از بیماریها امری اثبات شده است و در ضمن هر جمعیت با توجه به پروفایل ژنتیکی خود میتواند از استعداد متفاوتی برخوردار باشد، ثبت و توسعه دادههای جمعیتی-ژنتیکی مانند مطالعه حاضر میتواند در درازمدت راهگشای تخمینهای دقیقتری در ارتباط با استعداد ابتلا باشند. در مطالعات آینده در این زمینه، حجم نمونه بیشتر و گستردهتر و در نظر گرفتن تنوع ژنتیکی پیشنهاد میگردد.
سپاسگزاری
مطالعه حاضر قسمتی از طرح تحقیقاتی مصوب مرکز تحقیقات قلب و عروق بیمارستان افشار (دانشگاه علوم پزشکی شهید صدوقی یزد) با کد مصوب 2853 است. از همکارانمان در مرکز تحقیقات قلب و عروق به خاطر کمکهای فنی و عملیاتی ایشان کمال تشکر را داریم.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد، مرکز تحقیقات قلب و عروق بیمارستان افشار
تعارض در منافع: وجود ندارد.
آترواسکلروزیس یک بیماری التهابی مزمن چند عاملی است (2, 1). آترواسکلروزیس میتواند با تغییر فعالیت مولکولهای زیستی و وابسته به سن روی دهد (3). یک پلاک آترواسکلروزیس از هسته سلولهای نکروز شده، ناحیه کلسیفیه شده، لپیدهای تغییر یافته، سلولهای ماهیچهای صاف (SMC)، سلولهای اندوتلیال (EC)، لوکوسیتها و نوع خاصی از ماکروفاژها (سلولهای حبابی) تشکیل شده است (4). این پلاکها باعث افزایش ضخامت لایه درونی رگ میشوند (5). این پلاکها در اثر متلاشی شدن نیز میتوانند باعث بروز ترومبوز در رگ شوند و این پدیده میتواند در رگهای قلبی و یا محیطی رخ دهد و عامل بسیاری از مرگ و میرها باشد. بیماریهای قلبی-عروقی یکی از علل اصلی مرگ و میر در سراسر جهان بوده که تا سال 2015 نزدیک به 31 درصد علت فوت به دلیل این عارضه بوده است. این عارضه در رگ-های محیطی بدن مهمترین عامل مرگ و میر در کشورهای غربی است که در این کشورها کمی بیش از 19% افراد مبتلای بالای 55 سال را تشکیل میدهد (15% از بیماران مرد در 5 سال اول شناسایی می¬میرند). عوامل خطر بیماری شامل مواردی مثل فشارخون بالا، دیابت شیرین و جنسیت میباشد (6). کموکاینها خانواده بزرگی از پروتئین¬ها هستند که بر اساس جایگاه 2 رزیدوی سیستئین اولی به چهار زیر گروه (CXC، C، CC و CX3C) تقسیم میشوند. هر کدام از این زیر گروهها خاصیت جاذبه شیمیایی ویژهای برای جذب گروهی از سلولها دارند (8، 7). پروتئین CXC ligand 12 (CXCL12) و گیرنده آن C-X-C chemokine receptor 4 (CXCR4) از کموکاینهای درگیر در فرایند التهابی تشکیل پلاک در بیماران آترواسکلروزیس و از گروه مولکولی کموکاینها هستند. CXCL12 که با نام stromal cell-derived factor (SDF-1) 1 نیز شناخته میشود، کموکاینی است که هم در تشکیل پلاک با فراخوانی سلولهای اندوتیال، ماکروفاژ، پلاکت و سلولهای ماهیچه صاف نقش دارد و هم با جذب نوتروفیل در متلاشی شدن پلاک و ایجاد ترومبوز دخالت میکند (9). این کموکاین مهم بعد از ایسکمی در بافتها، در ایجاد رگ جدید و اکسیژنرسانی به بافت نیز نقش ایفا میکند (10). پروتئین MCP (Monocyte Chemoattractant Protein-1) یکی دیگر از اعضای خانواده کموکاینها و یک پلیپپتید مونومری است که به سطح سلولهای اندوتلیال از طریق گیرنده خود CCR2 متصل شده و نقش مهمی در التهاب رگی، از طریق تحریک جذب لوکوسیتها، جذب فاگوسیتهای تک هسته، لنفوسیتهای T خاطره و سلولهای کشنده طبیعی و نفوذ آنها به بافت را ایفا میکند (11). ژن CXCL12، گیرنده آن CXCR4 و CCL2 دارای واریانت¬های نوکلئوتیدی متعددی، چه در ناحیه کدکننده ژن و چه در نواحی غیرکدکننده میباشند. این متغیرها بهصورت بالقوه از عواملی هستند که میتوانند بر عملکرد، پایداری و میزان غلظت این پروتئینها در سلولها نقش داشته باشند. گروهی از این تغییرات قبلاً گزارش و تایید شده این ژنها، یعنی پلیمورفیسمها، بهطور معمول در مطالعات اپیدمیولوژی و ژنتیک جمعیت (اپیدمیوژنتیکی) در قالب مطالعات ارزیابی همراهی فراوانی آللی و ژنوتیپی با بروز بیماریها و عوارضشان مورد استفاده قرار میگیرند. مطالعه حاضر با هدف ارزیابی ارتباط بین فراوانی پلیمورفیسم rs2228014 از ژن CXCR4 با آترواسکلروزیس شریان کرونر طراحی و انجام پذیرفت. مطالعات متعددی نشان دادهاند که میزان بالای SDF1 (CXCL12) در بافت میوکارد سکتهای، به خاطر نقش حمایتی آن از عضله و ارتقای عملکرد قلب پس از سکته قلبی در وضعیت in-vivo است (13, 12) و نقش محور SDF1/CXCR4/CXCR7 را در فراخوانی سلولهای پیش اندوتلیالی و بازیابی عملکرد قلب بعد از سکته مهم معرفی میکنند (16- 14). و به نظر میرسد حضور پلیمورفیسمهای متعدد در ژن SDF-1 بتوانند تغییردهنده تخمین میزان زندهمانی بیماران قلبی-عروقی باشند. در این راستا در مطالعهای به همراهی معنیدار پلیمورفیسم rs1801157 با بیماری عروق کرونری نابالغین اشاره شده است (17). CXCR4 بهعنوان گیرنده محوری CXCL12 به سلولهای دارنده خود امکان پاسخ به این سیگنال مهاجرتی فراهم میآورد. گزارشهای متعددی از حضور این پروتئین در ناحیه پلاکهای عروقی وجود دارد که به واسطه جذب سلولهای ماکروفاژی و پلاکتهای دارای این گیرنده اتفاق افتاده است (18, 16). پلیمورفیسمهای متعددی از این ژن نیز در همراهی با سرطانهای مختلف مطرح و از موارد شاخص از بین آنها rs2228014 است (19). با توجه به اهمیت ژن CXCR4 در روند پاتوژنسیتی عارضه آترواسکلروزیس بر آن شدیم که ارتباط و همراهی احتمالی rs2228014 از ژن CXCR4 را با بیماری آترواسکلروزیس شریان کرونر بررسی کنیم.
روش بررسی
DNA جمعآوری نمونه و استخراج
در این مطالعه دو گروه مورد و شاهد از افراد مراجعهکننده جهت آنژیوگرافی به مرکز قلب بیمارستان افشار یزد انتخاب گردیدند که مبنای ورود افراد به گروه مورد، تایید گرفتگی بیش از یک رگ و معیار ورود به گروه شاهد عدم گرفتگی و یا گرفتگی یک رگ توسط پزشک متخصص قلب از تست آنژیوگرافی بود. اطلاعات مربوط به سن، جنس، مصرف مواد دخانی، هایپرکلسترولمیا، دیابت میلیتوس، فشارخون در هر دو گروه قبل از نمونهگیری خون جمعآوری و پس از همسان سازی هر دو گروه بر اساس سن و جنسیت، مراحل بعدی مطالعه پیش برده شد. گروه مورد مطالعه شامل 112 بیمار مبتلا به بیماری آترواسکلروزیس شریان کرونر و گروه شاهد 142 فرد سالم بودند. در این پژوهش فرم رضایتنامه به امضای هر فرد اهداکننده نمونه رسیده و از ایشان 5 میلیلیتر خون وریدی در لولههای حاوی EDTA گرفته و برای مراحل استخراج DNA جهت آزمایشات تعیین پلیمورفیسم آماده گردید. این مطالعه تحت نظارت کمیته اخلاق دانشگاه علوم پزشکی شهید صدوقی یزد انجام شد.
تعیین ژنوتایپ به روش Tetra-ARMS PCR
استخراج DNA با استفاده از کیت استخراج DNA (فناوری روژه، ایران) انجام پذیرفت. طراحی پرایمرها با استفاده با نرمافزار input Primer 3 انجام شد و اختصاصی بودن آنها با استفاده از Primer-BLAST و UCSC بررسی گردید (جدول1). تعیین ژنوتایپ به روش Tetra-ARMS PCR و برنامه 35 چرخهای PCR با شرایط؛ مرحله واسرشت سازی در دمای 96 به مدت 30 ثانیه، مرحله اتصال پرایمرها در دمای 65 به مدت 30 ثانیه و مرحله پلیمریزاسیون DNA در دمای 72 و به مدت 30 ثانیه انجام گرفت. بر اساس قطعات مشاهده شده حاصل از PCR بر روی ژل آگارز 1% تعیین ژنوتایپ صورت گرفت. قطعه 414 نوکلئوتیدی در صورت حضور آلل G و قطعه 326 نوکلئوتیدی در صورت حضور آلل A و محصول 689 نوکلئوتیدی کنترل داخلی بود.
تجزیه و تحلیل آماری
برای تحلیل آماری دادهها از نرمافزارversion 16 SPSS استفاده گردید. به منظور بررسی توزیع ژنتیکی پلیمورفیسم rs2228014 و بیماری آترواسکلروزیس شریان کرونر در دو گروه مورد و شاهد و همچنین ارزیابی مدلهای ژنتیکی آللی، هوموزیگوت، هتروزیگوت، غالب و مغلوب از طریق آنالیز آزمون کای-دو صورت گرفت و شانس ابتلا و فاصله اطمینان محاسبه گردید و مقادیر P کمتر از 0/05 به عنوان اختلاف معنادار در نظر گرفته شد. از سوی دیگر به منظور بررسی تعادل هاردی واینبرگ و ارزیابی تطابق فراوانی ژنوتیپهای مشاهده شده مربوط به این پلیمورفیسم در جمعیت و تعداد مورد انتظار از آزمون کای-دو استفاده شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی شهید صدوقی یزد تکمیل شده است (کد اخلاق IR.SSU.REC.1392.217688).
نتایج
تعیین فراوانی آللی این پلیمورفیسم در مجموع جمعیت مورد مطالعه بر اساس تحلیل تصاویر ژل الکتروفورزیز (شکل 1) صورت گرفت و نتایج فراوانی آلل G در کل جمعیت مطالعه به میزان 90/7% و آلل A را به میزان 9/3% بود (جدول 2). اما این فراوانیها در دو زیر جمعیت مورد و شاهد تفاوت¬هایی را نشان داد، به طوریکه در گروه مورد، فراوانی آللی A، 7/6% و در جمعیت شاهد، 10/6% بود. از سوی دیگر فراوانی آللی G در زیر جمعیت مورد 92/4% و در زیر جمعیت شاهد 89/4% بود که این تفاوت با معنی¬داری همراه نبود (P=0/333). نتایج تعیین فراوانی ژنوتیپی این پلیمورفیسم در کل جمعیت حاکی از فراوانی¬های ژنوتیپی GG به میزان تقریبی 84/2%، GA برابر با 13% و AA برابر با 2/8% بود (جدول 3). اما این فراوانیها در دو زیر جمعیت مورد و شاهد تفاوت¬هایی را نشان داد، به طوریکه در ارتباط با فراوانیهای ژنوتیپی، نسبتها در گروه مورد در مقایسه با گروه شاهد به ترتیب برای ژنوتیپ¬های GG 85/7% به 83/1%، GA 13/4% به 12/7% و AA 0/9% به 4/2% بود که این تفاوتها نیز با معنیداری همراه نبود (P=0/229). همچنین ارتباط پلیمورفیسم rs2228014 و بیماری آترواسکلروزیس شریان کرونر در مدلهای ژنتیکی هوموزیگوت(P=0/087) ، هتروزیگوت(P=0/849) ، غالب (P=0/570) و مغلوب(P=0/086) مورد بررسی قرار گرفت که هیچ یک از مدلهای ژنتیکی پلیمورفیسم rs2228014 ارتباط معناداری با بیماری آترواسکلروزیس نشان ندادند (جدول 4). از سوی دیگر ارزیابی صورت گرفته در گروه کنترل عدم تعادل هاردی-واینبرگ را در این گروه نشان میدهد.
جدول 1: پرایمرهای استفاده شده برای پلیمورفیسم rs2228014 ژن CXCR4

جدول 2: جدول مقایسه فراوانیهای آللی پلیمورفیسم rs2228014 در بیماران مبتلا به آترواسکلروزیس و گروه شاهد

*آزمون کای-دو به منظور آنالیز آماری استفاده و مقدار P کمتر از 0.05 به عنوان معناداری در نظر گرفته شده است.
جدول 3: مقایسه فراوانیهای ژنوتیپی پلیمورفیسم rs2228014 در بیماران مبتلا به آترواسکلروزیس و گروه شاهد

*آزمون کای-دو به منظور آنالیز آماری استفاده و مقدار P کمتر از 0.05 به عنوان معناداری در نظر گرفته شده است.
جدول 4: مدلهای ژنتیکی پلیمورفیسم rs2228014 و ارتباط آنها با بیماری آترواسکلروزیس


شکل 1: شکل حاضر نتایج تکثیر با پرایمرهای اختصاصی طراحی شده برای اللهای G و A پلیمورفیسم rs2228014 ژن CXCR4 را نشان میدهد. قطعه حاصل از تکثیر با پرایمر اختصاصی آلل A قطعه 326 نوکلئوتیدی را ایجاد میکند و آلل G قطعه 414 نوکلئوتیدی را تکثیر میکند. تست به صورت Tetra-Primers ARMS با همراهی دو پرایمر خارجی و به صورت تک لوله انجام گرفته است.
بحث
مطالعات متعددی در ارتباط با پلیمورفیسم rs2228014 در حوزه سرطان صورت گرفته است. بررسی پلیمورفیسم rs2228014 در بیماران مبتلا به لوسمی میلوییدی حاد در مقایسه با گروه کنترل نشان داده که این پلیمورفیسم شانس ابتلا به این نوع سرطان را به میزان معناداری افزایش می¬دهد (20). همچنین بررسی پلیمورفیسم rs2228014 در بیماران مبتلا به کارسینومای هپاتوسلولار، ارتباط معنادار این پلیمورفیسم با افزایش شانس ابتلا به این نوع سرطان را نشان می¬دهد (21). از سوی دیگر این پلیمورفیسم به میزان چشمگیری شانس زنده¬ماندن بیماران سرطان کولورکتال را کاهش میدهد (22). در زمینه ارتباط پلیمورفیسم rs2228014 و بیماری¬های قلبی-عروقی مطالعات بسیار محدودی صورت گرفته است. در این مطالعه عدم وجود اختلاف معنادار در فراوانی¬های آللی و ژنوتیپی پلیمورفیسم rs2228014 میان مبتلایان به آترواسکلروزیس و گروه کنترل نمی¬تواند به صورت قطعی حاکی از عدم ارتباط این پلیمورفیسم باشد، اما گزارشی وجود دارد که بر خلاف نتیجه بهدست آمده تاثیرگذاری این پلیمورفیسم را بر روی آترواسکلروزیس تایید می¬کند. در مطالعه رونمین و همکاران که بر روی جمعیت چینی در سال 2018 صورت گرفته (23)، خطر افزایش یافته 29 درصدی برای بیماری عروق کرونری برای آلل A بهدست آمده و در ضمن افزایش خطر برای ژنوتیپ AA و AG را در مقایسه با GG به ترتیب تقریباً 2 برابر و 27 درصد بالاتر اعلام میدارد و تفاوت عمده و مطمئناً تاثیرگذار در این مطالعه، نحوه گروهبندی مطالعه و جمعیت نمونهای آن است. در مطالعه مذکور 1200 نفر بیمار و 1200 نفر سالم را در مطالعه وارد کرده و مصرفکنندگان دخانیات و مشروبات الکلی از مطالعه خارج نشده و به وضوح تعداد افراد مصرف کننده مواد دخانی و مبتلا به دیابت در گروه بیماران بالاتر از گروه سالم است. در ضمن فراوانیهای آللی هم تقریباً معکووس مطالعه ما بوده بهطوریکه آلل A در جمعیت ما دارای فراوانی 91% و فراوانی این آلل در جمعیت چینی مورد مطالعه تنها 15% است. بنابراین امکان مقایسه منطقی بین نتایج این مطالعه و نتایج مطالعه مذکور وجود ندارد. پلیمورفیسمها به عنوان متغیرهای ژنتیکی مطمئناً بر مراحل مختلف اعم از ایجاد، پیشرفت و شدت بیماریها اثر گذارند اما در مطالعه حاضر ارتباط معنیداری در همراهی پلیمورفیسم rs2228014 از ژن CXCR4 با عارضه آترواسکلروزیس عروق کرونری در جمعیت مورد مطالعه مشاهده نشد و مطمئناً با مطالعه بر روی جمعیتی بزرگتر و متنوعتر از ایران میتوان این همراهی را مورد ارزیابی دقیقتر قرار داد. نظر به اینکه مشکلات قلبی-عروقی از اولویتهای بالای حوزههای مختلف درمانی و تحقیقاتی است و استعداد ژنتیکی ابتلا به این گروه از بیماریها امری اثبات شده است و در ضمن هر جمعیت با توجه به پروفایل ژنتیکی خود میتواند از استعداد متفاوتی برخوردار باشد، ثبت و توسعه دادههای جمعیتی-ژنتیکی مانند مطالعه حاضر میتواند در درازمدت راهگشای تخمینهای دقیقتری در ارتباط با استعداد ابتلا باشند. در مطالعات آینده در این زمینه، حجم نمونه بیشتر و گستردهتر و در نظر گرفتن تنوع ژنتیکی پیشنهاد میگردد.
سپاسگزاری
مطالعه حاضر قسمتی از طرح تحقیقاتی مصوب مرکز تحقیقات قلب و عروق بیمارستان افشار (دانشگاه علوم پزشکی شهید صدوقی یزد) با کد مصوب 2853 است. از همکارانمان در مرکز تحقیقات قلب و عروق به خاطر کمکهای فنی و عملیاتی ایشان کمال تشکر را داریم.
حامی مالی: دانشگاه علوم پزشکی شهید صدوقی یزد، مرکز تحقیقات قلب و عروق بیمارستان افشار
تعارض در منافع: وجود ندارد.
References:
1- Van Hinsbergh VW. Arteriosclerosis. Impairment of Cellular Interactions in the Arterial Wall. Annals of the New York Academy Of Sciences 1992; 673: 321-30.
2- Mallat Z, Besnard S, Duriez M, Deleuze V, Emmanuel F, Bureau MF, et al. Protective Role of Interleukin-10 in Atherosclerosis. Cir Res 1999; 85(8): E17-24.
3- Kaunitz H. Medium Chain Triglycerides (MCT) in Aging and Arteriosclerosis. Environ Pathol Toxicol Oncol 1986; 6(3-4): 115-21.
4- Galkina E, Ley K. Immune And Inflammatory Mechanisms of Atherosclerosis. Ann Rev Immunol 2009; 27: 165-97.
5- Hansson GK. Inflammation, Atherosclerosis, And Coronary Artery Disease. N Engl J Med 2005; 352(16): 1685-95.
6- Dwyer JH, Navab M, Dwyer KM, Hassan K, Sun P, Shircore A, et al. Oxygenated Carotenoid Lutein and Progression of Early Atherosclerosis: The Los Angeles Atherosclerosis Study. Circulation 2001; 103(24): 2922-7.
7- Ho TK, Tsui J, Xu S, Leoni P, Abraham DJ, Baker DM. Angiogenic Effects of Stromal Cell-Derived Factor-1 (SDF-1/CXCL12) Variants in Vitro and the in Vivo Expressions of CXCL12 Variants and CXCR4 in Human Critical Leg Ischemia. J Vasc Surg 2010; 51(3): 689-99.
8- Braunersreuther V, Mach F, Steffens S. The Specific Role of Chemokines in Atherosclerosis. Thrombosis Haemostasis 2007; 97(5): 714-21.
9- Van Der Vorst EP, Doring Y, Weber C. Chemokines and their Receptors in Atherosclerosis. J Mol Med (Berl) 2015; 93(9): 963-71.
10- Williams SA, Harata-Lee Y, Comerford I, Anderson RL, Smyth MJ, Mccoll SR. Multiple Functions of CXCL12 in a Syngeneic Model of Breast Cancer. Mol Cancer 2010; 9: 250.
11- Deshmane SL, Kremlev S, Amini S, Sawaya BE. Monocyte Chemoattractant Protein-1 (MCP-1): An Overview. J Interferon Cytokine Res 2009; 29(6): 313-26.
12- Abbott JD, Huang Y, Liu D, Hickey R, Krause DS, Giordano FJ. Stromal Cell-Derived Factor-1alpha Plays a Critical Role in Stem Cell Recruitment to the Heart after Myocardial Infarction but is Not Sufficient to Induce Homing in the Absence of Injury. Circulation 2004; 110(21): 3300-5.
13- Zaruba MM, Theiss HD, Vallaster M, Mehl U, Brunner S, David R, et al. Synergy Between CD26/DPP-IV Inhibition and G-CSF Improves Cardiac Function after Acute Myocardial Infarction. Cell Stem Cell 2009; 4(4): 313-23.
14- Hu X, Dai S, Wu WJ, Tan W, Zhu X, Mu J, et al. Stromal Cell Derived Factor-1 Alpha Confers Protection Against Myocardial Ischemia/ Reperfusion Injury: Role of the Cardiac Stromal Cell Derived Factor-1 Alpha CXCR4 Axis. Circulation 2007; 116(6): 654-63.
15- Zhang D, Fan GC, Zhou X, Zhao T, Pasha Z, Xu M, et al. Over-Expression of CXCR4 on Mesenchymal Stem Cells Augments Myoangiogenesis in the Infarcted Myocardium. J Mol Cell Cardiol 2008; 44(2): 281-92.
16- Rath D, Chatterjee M, Borst O, Muller K, Stellos K, Mack AF, et al. Expression of Stromal Cell-Derived Factor-1 Receptors CXCR4 and CXCR7 on Circulating Platelets of Patients with Acute Coronary Syndrome and Association with Left Ventricular Functional Recovery. Eur Heart J 2014; 35(6): 386-94.
17- Feng L, Nian SY, Hao YL, Xu WB, Ye D, Zhang XF, et al. A Single Nucleotide Polymorphism in the Stromal Cell-Derived Factor 1 Gene is Associated with Coronary Heart Disease in Chinese Patients. Int J Mol Sci 2014; 15(6): 11054-63.
18- Weiberg D, Thackeray JT, Daum G, Sohns JM, Kropf S, Wester HJ, et al. Clinical Molecular Imaging of Chemokine Receptor CXCR4 Expression in Atherosclerotic Plaque Using (68)Ga-Pentixafor PET: Correlation with Cardiovascular Risk Factors and Calcified Plaque Burden. J Nucl Med 2018; 59(2): 266-72.
19- De Oliveira KB, Guembarovski RL, Guembarovski AM, Da Silva Do Amaral Herrera AC, Sobrinho WJ, Ariza CB, et al. CXCL12, CXCR4 and Ifngamma Genes Expression: Implications for Proinflammatory Microenvironment of Breast Cancer. Clin Exp Med 2013; 13(3): 211-9.
20- Zheng Q, Shuai X, Ye Y, Jin Y, Jiang N, Chen X, et al. The Role of Polymorphisms of Stromal-Derived Factor-1 and CXC Receptor 4 in Acute Myeloid Leukemia and Leukemia Cell Dissemination. Gene 2016; 588(2): 103-8.
21- Qin LF, Qin JM, Zhang JQ, Lv XP, Huang LY, Wang JJ. CXCL12 and CXCR4 Polymorphisms and Expressions in Peripheral Blood from Patients of Hepatocellular Carcinoma. Future Oncology 2018; 14(13): 1261-71.
22- Matsusaka S, Cao S, Hanna D, Sunakawa Y, Ueno M, Mizunuma N, et al. CXCR4 Polymorphism Predicts Progression-Free Survival In Metastatic Colorectal Cancer Patients Treated With First-Line Bevacizumab- Based Chemotherapy. Pharmacogenomics J 2017; 17(6): 543-50.
23- Runmin G, Jiamei J, Zhiliang J, Yonghua C, Zhizhou S, Guizhou T, et al. Genetic Variation of CXCR4 And Risk of Coronary Artery Disease: Epidemiological Study and Functional Validation of CRISPR/Cas9 System. Oncotarget 2018; 9(18): 14077-83.
1- Van Hinsbergh VW. Arteriosclerosis. Impairment of Cellular Interactions in the Arterial Wall. Annals of the New York Academy Of Sciences 1992; 673: 321-30.
2- Mallat Z, Besnard S, Duriez M, Deleuze V, Emmanuel F, Bureau MF, et al. Protective Role of Interleukin-10 in Atherosclerosis. Cir Res 1999; 85(8): E17-24.
3- Kaunitz H. Medium Chain Triglycerides (MCT) in Aging and Arteriosclerosis. Environ Pathol Toxicol Oncol 1986; 6(3-4): 115-21.
4- Galkina E, Ley K. Immune And Inflammatory Mechanisms of Atherosclerosis. Ann Rev Immunol 2009; 27: 165-97.
5- Hansson GK. Inflammation, Atherosclerosis, And Coronary Artery Disease. N Engl J Med 2005; 352(16): 1685-95.
6- Dwyer JH, Navab M, Dwyer KM, Hassan K, Sun P, Shircore A, et al. Oxygenated Carotenoid Lutein and Progression of Early Atherosclerosis: The Los Angeles Atherosclerosis Study. Circulation 2001; 103(24): 2922-7.
7- Ho TK, Tsui J, Xu S, Leoni P, Abraham DJ, Baker DM. Angiogenic Effects of Stromal Cell-Derived Factor-1 (SDF-1/CXCL12) Variants in Vitro and the in Vivo Expressions of CXCL12 Variants and CXCR4 in Human Critical Leg Ischemia. J Vasc Surg 2010; 51(3): 689-99.
8- Braunersreuther V, Mach F, Steffens S. The Specific Role of Chemokines in Atherosclerosis. Thrombosis Haemostasis 2007; 97(5): 714-21.
9- Van Der Vorst EP, Doring Y, Weber C. Chemokines and their Receptors in Atherosclerosis. J Mol Med (Berl) 2015; 93(9): 963-71.
10- Williams SA, Harata-Lee Y, Comerford I, Anderson RL, Smyth MJ, Mccoll SR. Multiple Functions of CXCL12 in a Syngeneic Model of Breast Cancer. Mol Cancer 2010; 9: 250.
11- Deshmane SL, Kremlev S, Amini S, Sawaya BE. Monocyte Chemoattractant Protein-1 (MCP-1): An Overview. J Interferon Cytokine Res 2009; 29(6): 313-26.
12- Abbott JD, Huang Y, Liu D, Hickey R, Krause DS, Giordano FJ. Stromal Cell-Derived Factor-1alpha Plays a Critical Role in Stem Cell Recruitment to the Heart after Myocardial Infarction but is Not Sufficient to Induce Homing in the Absence of Injury. Circulation 2004; 110(21): 3300-5.
13- Zaruba MM, Theiss HD, Vallaster M, Mehl U, Brunner S, David R, et al. Synergy Between CD26/DPP-IV Inhibition and G-CSF Improves Cardiac Function after Acute Myocardial Infarction. Cell Stem Cell 2009; 4(4): 313-23.
14- Hu X, Dai S, Wu WJ, Tan W, Zhu X, Mu J, et al. Stromal Cell Derived Factor-1 Alpha Confers Protection Against Myocardial Ischemia/ Reperfusion Injury: Role of the Cardiac Stromal Cell Derived Factor-1 Alpha CXCR4 Axis. Circulation 2007; 116(6): 654-63.
15- Zhang D, Fan GC, Zhou X, Zhao T, Pasha Z, Xu M, et al. Over-Expression of CXCR4 on Mesenchymal Stem Cells Augments Myoangiogenesis in the Infarcted Myocardium. J Mol Cell Cardiol 2008; 44(2): 281-92.
16- Rath D, Chatterjee M, Borst O, Muller K, Stellos K, Mack AF, et al. Expression of Stromal Cell-Derived Factor-1 Receptors CXCR4 and CXCR7 on Circulating Platelets of Patients with Acute Coronary Syndrome and Association with Left Ventricular Functional Recovery. Eur Heart J 2014; 35(6): 386-94.
17- Feng L, Nian SY, Hao YL, Xu WB, Ye D, Zhang XF, et al. A Single Nucleotide Polymorphism in the Stromal Cell-Derived Factor 1 Gene is Associated with Coronary Heart Disease in Chinese Patients. Int J Mol Sci 2014; 15(6): 11054-63.
18- Weiberg D, Thackeray JT, Daum G, Sohns JM, Kropf S, Wester HJ, et al. Clinical Molecular Imaging of Chemokine Receptor CXCR4 Expression in Atherosclerotic Plaque Using (68)Ga-Pentixafor PET: Correlation with Cardiovascular Risk Factors and Calcified Plaque Burden. J Nucl Med 2018; 59(2): 266-72.
19- De Oliveira KB, Guembarovski RL, Guembarovski AM, Da Silva Do Amaral Herrera AC, Sobrinho WJ, Ariza CB, et al. CXCL12, CXCR4 and Ifngamma Genes Expression: Implications for Proinflammatory Microenvironment of Breast Cancer. Clin Exp Med 2013; 13(3): 211-9.
20- Zheng Q, Shuai X, Ye Y, Jin Y, Jiang N, Chen X, et al. The Role of Polymorphisms of Stromal-Derived Factor-1 and CXC Receptor 4 in Acute Myeloid Leukemia and Leukemia Cell Dissemination. Gene 2016; 588(2): 103-8.
21- Qin LF, Qin JM, Zhang JQ, Lv XP, Huang LY, Wang JJ. CXCL12 and CXCR4 Polymorphisms and Expressions in Peripheral Blood from Patients of Hepatocellular Carcinoma. Future Oncology 2018; 14(13): 1261-71.
22- Matsusaka S, Cao S, Hanna D, Sunakawa Y, Ueno M, Mizunuma N, et al. CXCR4 Polymorphism Predicts Progression-Free Survival In Metastatic Colorectal Cancer Patients Treated With First-Line Bevacizumab- Based Chemotherapy. Pharmacogenomics J 2017; 17(6): 543-50.
23- Runmin G, Jiamei J, Zhiliang J, Yonghua C, Zhizhou S, Guizhou T, et al. Genetic Variation of CXCR4 And Risk of Coronary Artery Disease: Epidemiological Study and Functional Validation of CRISPR/Cas9 System. Oncotarget 2018; 9(18): 14077-83.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |




