دوره 29، شماره 2 - ( اردیبهشت 1400 )
جلد 29 شماره 2 صفحات 3499-3491 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Govahi M, Ranjbar M, Norouzi Jobie F, Azizi H. Antimicrobial and Antioxidant Effects of Aqueous Extract of Lythrum Salicaria. JSSU 2021; 29 (2) :3491-3499
URL: http://jssu.ssu.ac.ir/article-1-5116-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5116-fa.html
گواهی مصطفی، رنجبر مجتبی، نوروزی جوبی فاطمه، عزیزی حسین. بررسی اثرات ضد میکروبی و آنتیاکسیدانی عصاره آبی گیاه خونفام (Lythrum Salicaria). مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1400; 29 (2) :3491-3499
متن کامل [PDF 655 kb]
(589 دریافت)
| چکیده (HTML) (1288 مشاهده)
متن کامل: (808 مشاهده)
مقدمه
یکی از عوامل اصلی مرگ و میر در جهان مربوط به بیماریهای عفونی بوده که روزانه حدود ۵۰ هزار نفر به این علت جان خود را از دست میدهند. در سالهای اخیر، مقاومت دارویی در برابر باکتریهای پاتوژن انسانی از سراسر جهان گزارش شده است که بهدلیل استفاده مداوم از آنتیبیوتیکها، میکروارگانیسمها مقاوم شدهاند. علاوه بر این مشکل، بعضی از آنتیبیوتیکها دارای اثرات نامطلوب بر روی میزبان هستند که شامل حساسیت شدید، سرکوب سیستم ایمنی و واکنشهای آلرژیک میباشد. این امر مشکلات بالینی زیادی در درمان بیماریهای عفونی ایجاد کرده بنابراین نیاز به توسعه داروهای ضدمیکروبی طبیعی و جایگزین، برای درمان بیماریهای عفونی وجود دارد .در مطالعات دهههای اخیر، مواد گیاهی بهعنوان یک منبع طبیعی برای درمان بیماریهای عفونی در جهان مورد توجه قرار گرفته است (1). تعادل بین رادیکالهای آزاد و آنتیاکسیدانها برای عملکرد فیزیولوژیکی مناسب ضروری است. رادیکالهای آزاد، لیپیدها، پروتئینها و DNA را آلوده میکنند و منجر به برخی از بیماریها از جمله سرطان، دیابت، آلزایمر، پارکینسون و غیره میشوند. از این رو استفاده از منبع خارجی آنتیاکسیدانها به مقابله با این استرس اکسیداتیو کمک میکند. اخیراً آنتیاکسیدانهای مصنوعی مانند هیدروکسی تولوئن و بوتیل هیدروکسی آنیزول گزارش شدهاند، که برای سلامت انسان خطرناک است. بنابراین، جستجو برای ترکیبات موثر و غیر سمی طبیعی با فعالیت آنتیاکسیدانی در سالهای اخیر افزایش یافته است (2). گیاهان دارویی، منابع طبیعی ارزشمندی هستند که امروزه مورد توجه قرار گرفته و بهعنوان مواد اولیه برای تبدیل به داروهای بیخطر برای انسان تلقی میشوند. محققین داروساز، داروهای قرن بیست و یکم را در گیاهان جستجو میکنند و معتقدند که حلال مشکلات پزشکی در آینده گیاهان میباشند، زیرا تاکنون بسیاری از داروهای درمان عفونت، آنتی-اکسیدان، ضدسرطان و غیره از گیاهان استخراج شدهاند. از جمله گیاهانی که امروزه در علم طب سنتی مورد استفاده قرار میگیرد، میتوان به گیاه خونفام اشاره کرد که برای درمان عفونتها، التیام زخمها، ورم روده، کمبود ویتامین ث (اسکوروی) و خونریزی بیش از اندازه مورد توجه قرار گرفته است. گیاه خونفام با نام علمی Lythrun salicaria از خانوادهLythraceae بوده که در مناطق مختلف ایران به خصوص در استانهای مازندران، لرستان، همدان، گیلان، گرگان رشد میکند. با توجه به موارد ذکر شده، هدف از انجام این پژوهش، استخراج عصاره گیاه خونفام و بررسی اثرات ضدمیکروبی و آنتیاکسیدانی آن است.
روش بررسی
تهیه عصاره آبی گیاه خونفام
گیاه خونفام از شهرستان بهشهر در شرق مازندران جمع آوری و توسط دکتر علیرضا نقینژاد در گروه زیستشناسی دانشگاه مازندران، ایران شناسایی شد. برگهای گیاه خونفام سه بار با آب مقطر دیونیزه شسته شدند تا ذرات گرد و غبار از بین بروند و سپس در دمای 50 درجه سانتیگراد در آون خشک شدند. برگهای خشک شده در آسیاب پودر شدند. پنج گرم پودر برگ خشک شده در 100 میلیلیتر آب مقطر مخلوط شده و در دمای 80 درجه سانتیگراد به مدت 60 دقیقه بر روی هیتر استریر قرار گرفت. در ادامه محلول ساخته شده بر روی سکوی آزمایشگاه قرار گرفت تا به دمای محیط برسد. سپس با دور6000 به مدت10 دقیقه سانتریفیوژ و سپس با کاغذ واتمن صاف شد. عصاره بهدست آمده در یخچال نگهداری شد تا در آزمایشهای بعدی مورد استفاده قرار گیرد (3).
تعیین میزان ترکیبات فنلی کل
تعیین مقدار فنل تام
جهت ارزیابی میزان محتوای فنلی تام موجود در عصاره گیاه خونفام از روش فولین سیو-کالتو استفاده شد. در این آزمایش 300 میکرولیتر عصاره با 1500 میکرولیتر معرف فولین سیوکالتو و1200 میکرولیتر کربنات سدیم 20 درصد (w/v) مخلوط شده و به مدت60 دقیقه در تاریکی نگهداری شد و جذب در 765 نانومتر اندازهگیری شد. نتایج محتویات فنلی بهصورت میلیگرم اسید گالیک در گرم وزن خشک عصاره بیان شد. از (300میکرولیتر) متانول80 درصد، (1500 میکرولیتر) فولین و (1200 میکرولیتر) کربنات سدیم بهعنوان شاهد دستگاه و از گالیک اسید در غلظتهای 0/3، 0/2، 0/1، 0/075، 0/024 میکروگرم بر میلیلیتر برای تهیه منحنی استاندارد استفاده شد (4).
تعیین مقدار فلاونوئید تام
مقدار فلاونوئید تام عصاره با استفاده از روش رنگسنجی آلومینیوم کلرید مشخص شد. در این روش، 1500 میکرولیتر عصاره (1 میکروگرم بر میلیلیتر) با 1500 میکرولیتر کلرید آلومینیوم (20 گرم بر لیتر) ترکیب و به مدت 40 دقیقه در دمای20 درجه نگهداری و جذب در طول موج 415 نانومتر قرائت شد (5).
تعیین مقدار فلاونول تام
جهت ارزیابی میزان محتوای فلاونول تام موجود در عصاره گیاه خونفام، (1میکروگرم بر میلیلیتر) 600 میکرولیتر عصاره، 600 میکرولیتر آلومینیوم کلراید و 1800 میکرولیتر استات سدیم را با هم مخلوط نموده و سپس بهمدت 2/5 ساعت در دمای 20 درجه سانتیگراد نگهداری شد و جذب آن در طول موج 440 نانومتر قرائت شد. برای رسم منحنی استاندارد از غلظت¬های مختلف 0/025، 0/05، 0/1، 0/15و 0/2 میکروگرم برمیلیلیتر کوئرسیتین استفاده شد (6).
تعیین فعالیت آنتیاکسیدانی
تعیین قدرت کاهندگی آهن
روش احیاء آهن بهعنوان شاخصی از قدرت آنتیاکسیدانی است که طی آن آهن (III) به آهن (II) احیاء میشود و تغییر رنگ مخلوط آزمایش این واکنش را تأیید می¬کند. 1000میکرولیتر عصاره در غلظتهای مختلف (1000و500, 250 میکروگرم برمیلیلیتر) در لولههای آزمایش ریخته و با 1000 میکرولیتر بافر فسفات 0/2 مولار با PH=6/6 مخلوط کرده سپس 1000 میکرولیتر پتاسیم فری سیانات به آن اضافه شد و به مدت 20 دقیقه در دمای 50 درجه سانتیگراد قرار داده شد. سپس 1000 میکرولیتر محلول تریکلریداسید اضافه شد. 1500 میلی لیتر از محلول حاصل را برداشته در یک لوله آزمایش حاوی 1500 میکرولیتر آب ریخته و به آن 600 میکرولیتر کلرید آهن (III) اضافه شد. سپس جذب نمونهها با استفاده از اسپکتروفتومتر در طول موج 700 نانومتر قرائت شد. از تمام ترکیبات بالا به غیر از عصاره که به جای آن آب مقطر استفاده کردیم بهعنوان شاهد در نظر گرفته شد (4).
تعیین فعالیت مهار رادیکال آزاد DPPH
برای انجام این آزمایش از رادیکالهای پایدارDPPH استفاده شد. 1000 میکرولیتر عصاره مورد نظر با غلظتهای مختلف (10, 20, 40 میکروگرم بر میلیلیتر) در تیوپ ریخته و با 300 میکرولیتر محلول (0/002%) DPPH مخلوط کرده و بهمدت 30 دقیقه در تاریکی قرار داده و سپس جذب آن با استفاده از اسپکتروفتومتر در طول موج 517 نانومتر قرائت شد. 1000 میکرولیتر متانول با300 میکرولیتر DPPHترکیب و بهعنوان شاهد استفاده شد. این آزمایش 3 بار برای هر غلظت تکرار شد و سپس درصد به داماندازی رادیکال DPPH از فرمول زیر محاسبه گردید (7).
I (%) = (A0-A)/ A0 ×100
A0: جذب شاهد، A: جذب نمونه، I (%): درصد به داماندازی رادیکال DPPH
در این آزمایش از بوتیلات هیدروکسی تولوئن، BHT (آنتیاکسیدان سنتزی)، بهعنوان کنترل مثبت استفاده شد.
آزمایش ضدمیکروبی
روش دیسک دیفیوژن برای بررسی فعالیت ضدمیکروبی استفاده شد. از آنتیبیوتیک سیپروفلوکساسین به عنوان استاندارد برای فعالیت ضدباکتریایی و آمفوتریسین B برای فعالیت ضدقارچی استفاده شد. به منظور انجام آزمایش ابتدا باکتری گرم مثبت استافیلوکوکوس اورئوس و باسیلوس سوبتلیس و باکتری گرم منفی اشریشیاکلای مورد نظر در محیط کشت نوترینت براث و قارچهای فوزاریوم تاپسینوم و پریکولاریا اوریزه در محیط کشت دکستروز رشد داده شد. سپس از میکروبهای رشد کرده سوسپانسیونی معادل با نیم مک فارلند تهیه شد. در ادامه از سوسپانسیون تهیه شده 100 میکرولیتر بر روی محیط کشت مولر هینتون آگار و دکستروز آگار بهطور یکنواخت پخش گردید. سپس ۳۰ میکرولیتر از سه غلظت مختلف 40، 70 و 100میکرولیتر بر میلیلیتر عصاره گیاه خونفام بر روی دیسکهای کاغذی (۶ میلیمتری) اضافه شد. در پایان پلیتهای باکتری در دمای 37 درجه و پلیتهای قارچ در دمای 30 درجه در گرمخانه به مدت ۲۴ ساعت نگهداری شدند. سپس قطر ناحیه مهار شده بر حسب میلیمتر اندازهگیری شد (11و 9،10، 8).
تجزیه و تحلیل آماری
آنالیز آماری دادهها بهصورت خطای استاندارد ± میانگین ارائه گردیده است. اختلاف معنیدار توسط آنالیز واریانس یک-طرفه (ANOVA) با آزمون تعقیبی چند دامنه¬ای دانکن و با استفاده از نرمافزارversion 16 SPSS مورد بررسی قرار گرفت و مقادیرP کمتر از 0/05 معنیدار در نظر گرفته شدند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه تخصصی فناوری¬های نوین آمل با کد اخلاق IR.AUSMT.REC.1399.01.35 تأیید شده است.
نتایج
محتوی فنولی، فلاونول و فلاونوئید
محتوای فنلی، فلاونول و فلاونوئید کل عصاره آبی گیاه خونفام مورد بررسی قرار گرفت. نتایج نشان داد که این گیاه دارای محتوای فنل کل (1/27 ± 36/53 میلیگرم گالیک اسید برگرم عصاره)، فلاونول (0/4 ± 5/2 میلیگرم کوئرستین بر گرم عصاره) و فلاونوئیدها ( 0/95 ± 20/8 کوئرستین بر گرم عصاره) است.
نتایج سنجش فعالیت آنتیاکسیدانی
نتایج قدرت احیاءکنندگی آهن
مطالعات مختلف نشان دادند که آنتیاکسیدانها دارای خواص الکترون دهندگی میباشد. در این آزمایش هر چه عصاره یا ترکیب آنتیاکسیدان بتواند باعث احیاء کل بیشتر (III) Feبه (II) Fe شود میتواند از تبدیل 2O2 Hبه °OH که یک رادیکال بسیار پایدار و خطرناک است جلوگیری کند. نتایج آزمایش نشان داد که با افزایش میزان غلظت عصاره میزان قدرت احیاکنندگی آهن افزایش مییابد بهطوریکه در غلظت 100 میکروگرم بر میلیلیتر برابر با 0/017± 0/126، در غلظت 300 میکروگرم بر میلی¬لیتر برابر با 430/025±0/0، 600 میکروگرم بر میلیلیتر برابر با 0/033± 1/115 و در غلظت 900 میکروگرم برمیلیلیتر برابر با 0/03 ± 1/604 بود.
نتایج فعالیت مهار رادیکالهای DPPH
اثر آنتی¬اکسیدانی عصاره با درصد مهار رادیکال DPPH محاسبه شد. رنگ بنفش محلول DPPH به تدریج در حضور عصاره به رنگ زرد کمرنگ تغییر یافت که نشانگر ظرفیت آنتی¬اکسیدانی عصاره خونفام است. نتایج نشان داد که با افزایش غلظت عصاره میزان مهار رادیکال DPPH افزایش یافته و کمترین مهار در غلظت 10 میکروگرم بر میلیلیتر عصاره (1/02 ± 27/6 میکروگرم بر میلیلیتر) و بیشترین میزان مهار در غلظت40 میکروگرم برمیلیلیتر عصاره ( 2/27 ± 69/5 میکروگرم بر میلیلیتر) مشاهده شد (شکل 1). میزان IC50 بوتیلات هیدروکسی تولوئن (BHT) نیز برابر با 0/2 ± 4/85 میکروگرم بر میلی لیتر به دست آمد.
نتایج ضدمیکروبی عصاره خونفام
فعالیت ضدباکتریایی عصاره خونفام در غلظتهای مختلف بر روی 2 سویه باکتری گرم مثبت و 4 سویه باکتری گرم منفی در محیط کشت مولر هینتون آگار بهروش دیسک دیفیوژن بررسی شد. نتایج جدول 1 نشان داد که با افزایش عصاره، سطح هاله مهاری افزایش مییابد. سطح مهار حاصل از عصاره با 3 غلظت مختلف (40، 70 و100 میکروگرم بر میلیلیتر) با آنتی¬بیوتیک سیپروفلوکساسین (5 میکروگرم بر دیسک) به عنوان استاندارد مقایسه شد. نتایج بهدست آمده در شکل 2 و جدول 1 ارائه شده که نشان می¬دهد بیشترین سطح هاله مهار رشد در غلظت 100 میکروگرم برمیلیلیتر به ترتیب مربوط به باسیلوس سوبتلیس (20 میلیمتر) و استافیلوکوکوس اورئوس (17 میلیمتر) می¬باشد. بیشترین سطح هاله مهار رشد در غلظت 70 میکروگرم بر میلیلیتر به ترتیب مربوط باسیلوس سوبتلیس (16 میلیمتر) و استافیلوکوکوس اورئوس (14میلیمتر) میباشد. همچنین بیشترین اندازه هاله مهار رشد در غلظت 40 میکروگرم بر میلیلیتر به ترتیب مربوط به باسیلوس سوبتلیس (13میلیمتر) و استافیلوکوکوس اورئوس (12میلیمتر) میباشد. در حالیکه عصاره خونفام منجر به مهار باکتری اشرشیا کلی نشد، دیسک¬ آنتیبیوتیک سیپروفلوکساسین منجر به مهار 33 میلی¬متری باسیلوس سوبتلیس، 36 میلی¬متری استافیلوکوکوس اورئوس و 28 میلیمتری اشریشیاکلای شد. فعالیت ضد قارچی عصاره خونفام در 3 غلظت مختلف (70،40، 100 میکروگرم بر میلیلیتر) مورد بررسی قرار گرفت. نتایج به دست آمده در شکل 1 و جدول 2 نشان داد که بیشترین اندازه هاله مهاری در غلظت 100 میکروگرم بر میلیلیتر به ترتیب مربوط به فوزاریوم تاپسینوم (24 میلیمتر) و پریکولاریا اوریزه (21 میلی¬متر) می¬باشد. در¬حالیکه بیشترین اندازه هاله مهاری در غلظت 70 میکروگرم بر میلیلیتر به ترتیب مربوط به فوزاریوم تاپسینوم (21 میلیمتر) و پری کولاریا اوریزه (19 میلیمتر) می¬باشد. در غلظت 40 میکروگرم بر میلیلیتر بیشترین اندازه سطح مهار متعلق به فوزاریوم تاپسینوم (17میلیمتر) و پریکولاریا اوریزه (14 میلی¬متر) است. هاله مهار رشد آنتی¬بیوتیک آمفوتریسین B در قارچ پری¬کولاریا اوریزه 34 میلیمتر است، درحالیکه این آنتیبیوتیک منجر به مهار قارچ فوزاریوم تاپسینوم نشد.
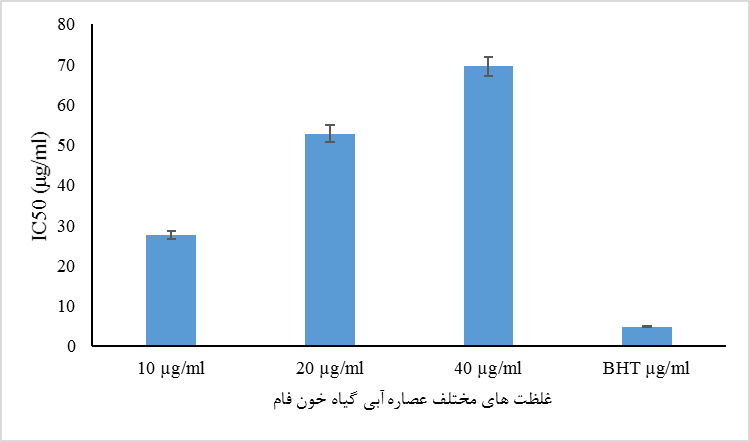
شکل 1: میزان فعالیت مهار رادیکال های DPPH توسط عصاره آبی گیاه خونفام

شکل2: نتاج آزمایش ضدمیکروبی عصاره گیاه خونفام، a) غلظت100 میکروگرم بر میلیلیتر b) غلظت70 میکروگرم بر میلیلیترc ) غلظت40 میکروگرم بر میلیلیتر d) دیسک آنتیبیوتیک
جدول1: میانگین هاله عدم رشد غلظتهای مختلف عصاره گیاه خونفام برتعدادی از میکروارگانیسمها برحسب میلیمتر

بحث
اهمیت آنتیاکسیدانها مخصوصاً از دو جنبه قابل بررسی است. یکی از این موارد، تامین سلامتی انسانها بهمنظور حذف رادیکالهای آزاد و دیگری در زمینه صنعت غذا است. با توجه به مضرات آنتیاکسیدانهای مصنوعی توجه زیادی به سمت آنتیاکسیدانهای طبیعی معطوف شده است. نتایج حاصل از این پژوهش نشان داد که گیاه خونفام دارای 1/27 ± 36/53 میلیگرم گالیک اسید بر گرم عصاره فنل، 0/95 ± 20/8 کوئرستین برگرم عصاره فلاونوئید و 0/4 ± 5/2 میلیگرم کوئرستین برگرم عصاره فلاونول میباشد. نتایج بهدست آمده در یک تحقیق بر روی عصاره آبی 9 گیاه نشان داد که عصاره آبی گیاه برگ بو و ریحان میزان فنل بالاتری نسبت به دیگر عصارههای آبی مورد مطالعه داشتند (12). در تحقیقی گواهی و همکاران (2019) با بررسی فعالیتهای آنتیاکسیدانی روی گیاه دارویی Scutellaria pekinensis نشان دادند که بیشترین میزان مهار رادیکال آزاد و قدرت احیاء کنندگی آهن مربوط به عصاره آبی این گیاه در مقایسه با عصاره متانولی آن میباشد (13). در مطالعهای فعالیت آنتیاکسیدانی چهار گونه نعناع توسط رنجبر و همکاران (2020) مورد بررسی قرار گرفت. در بین گونههای مورد مطالعه عصاره متانولی نعناع پیپریتا بالاترین میزان فنل کل، فلاونوئید، فلاونول و درصد مهار رادیکال آزاد را دارا بوده است. همچنین در تحقیق مذکور میزان جذب احیاء کنندگی آهن از 0/189 تا 1/16 گزارش شده است و یک همخوانی خوبی بین نتایج این ازمایش و نتایج ما وجود داشته بهطوریکه در هر دو آزمایش رابطه مثبتی بین افزایش غلظت عصاره و میزان قدرت احیاء کنندگی وجود دارد (4). بنابراین میتوان گفت که عصاره آبی خونفام دارای ظرفیت الکتروندهی و احیاءکنندگی آهن بالایی می¬باشد. نتایج این تحقیق و مطالعات قبلی نشان داده که رابطه مثبتی بین میزان ترکیبات فنلی و قدرت آنتیاکسیدانی گیاه وجود دارد بهطوریکه هر چقدر میزان فنل و فلاونوئید کل بیشتر باشد عصاره خاصیت آنتیاکسیدانی بیشتری دارد (14،15). از دلایل احتمالی تفاوت ظرفیت آنتیاکسیدانی این آزمایش با گزارشات قبلی میتوان به تفاوت نوع و میزان فنل، فلاونوئید و فلاونول اشاره کرد. نتایج فعالیت ضد میکروبی عصاره گیاه خونفام نشان داد که عصاره این گیاه توانایی مهارکنندگی خوبی نسبت به گونههای میکروبی مورد مطالعه به جزء اشرشیاکلای دارد. در یک مطالعه صفری و همکاران (2019) نشان دادند که عصاره متانولی گیاه Mespilus germanica دارای اثر مهار کنندگی بیشتری بر روی رشد استافیلوکوکوس اورئوس نسبت به گونه اشرشیاکلای می باشد (16). هاشمی و همکاران (2018)، خاصیت ضد قارچی و آنتیاکسیدانی ترکیب صمغ بادام تلخ با عصاره Satureja intermedia را ارزیابی کردند نتایج آنها نشان داد که بیشترین سطح مهارکنندگی بر روی قارچ penicillium citrinum مشاهده شد. همچنین ترکیب مورد نظر دارای خاصیت آنتیاکسیدانی قابلتوجهی بود (17). در مقایسه با مهار رشد باکتریها توسط عصاره گیاه خونفام، میزان مهار عصاره بر روی قارچها کمتر بوده و دلیل آن میتواند مربوط به حضور کتین در دیواره سلولی قارچها باشد که مقاومت بیشتری نسبت به لیپوپلیساکاریدها در دیواره سلولی باکتری دارد. بهطور کلی مکانسیمهای احتمالی فعالیت ضد میکروبی عصاره را میتوان به از بین رفتن یکپارچگی غشای سلولی ناشی از اختلال در لایه فسفولیپید، بهعنوان یکی از مهم ترین مکانیسمهای مهاری اشاره کرد. همچنین استرس اکسیداتیو ناشی از تولید انواع اکسیژن فعال (ROS) یکی دیگر از ساز و کارهای مهم بوده و این مولکول های ROS بیشتر با مهار یا تغییر در همانندسازی DNA، چرخه سنتز پروتئین، چرخه متابولیسم غذایی یا چرخه تنفسی باعث مرگ میکروب میشوند (20-18).
نتیجهگیری
گیاه خونفام از زمانهای قدیم مورد توجه طب سنتی واقع شده است اما بهطور جدی به جنبههای دارویی آن توجه نشده است. نتایج بهدست آمده در این تحقیق میتواند اهمیت این گیاه دارویی را بیشتر از گذشته نشان دهد. نتایج حاکی از آن است که عصاره خونفام خاصیت ضدمیکروبی و آنتیاکسیدانی خوبی از خود نشان میدهند و حتی میتوان آن را بهعنوان یک جایگزین مناسب برای آنتیبیوتیک ها و آنتیاکسیدانهای موجود در بازار در نظر گرفت.
سپاسگزاری
این طرح تحقیقاتی ( کد: 81/9712) با استفاده از اعتبارات ویژه پژوهشی (گرنت) دانشگاه تخصصی فناویهای نوین آمل انجام گردیده است.
حامی مالی: دانشگاه تخصصی فناوری های نوین آمل
تعارض در منافع: وجود ندارد.
یکی از عوامل اصلی مرگ و میر در جهان مربوط به بیماریهای عفونی بوده که روزانه حدود ۵۰ هزار نفر به این علت جان خود را از دست میدهند. در سالهای اخیر، مقاومت دارویی در برابر باکتریهای پاتوژن انسانی از سراسر جهان گزارش شده است که بهدلیل استفاده مداوم از آنتیبیوتیکها، میکروارگانیسمها مقاوم شدهاند. علاوه بر این مشکل، بعضی از آنتیبیوتیکها دارای اثرات نامطلوب بر روی میزبان هستند که شامل حساسیت شدید، سرکوب سیستم ایمنی و واکنشهای آلرژیک میباشد. این امر مشکلات بالینی زیادی در درمان بیماریهای عفونی ایجاد کرده بنابراین نیاز به توسعه داروهای ضدمیکروبی طبیعی و جایگزین، برای درمان بیماریهای عفونی وجود دارد .در مطالعات دهههای اخیر، مواد گیاهی بهعنوان یک منبع طبیعی برای درمان بیماریهای عفونی در جهان مورد توجه قرار گرفته است (1). تعادل بین رادیکالهای آزاد و آنتیاکسیدانها برای عملکرد فیزیولوژیکی مناسب ضروری است. رادیکالهای آزاد، لیپیدها، پروتئینها و DNA را آلوده میکنند و منجر به برخی از بیماریها از جمله سرطان، دیابت، آلزایمر، پارکینسون و غیره میشوند. از این رو استفاده از منبع خارجی آنتیاکسیدانها به مقابله با این استرس اکسیداتیو کمک میکند. اخیراً آنتیاکسیدانهای مصنوعی مانند هیدروکسی تولوئن و بوتیل هیدروکسی آنیزول گزارش شدهاند، که برای سلامت انسان خطرناک است. بنابراین، جستجو برای ترکیبات موثر و غیر سمی طبیعی با فعالیت آنتیاکسیدانی در سالهای اخیر افزایش یافته است (2). گیاهان دارویی، منابع طبیعی ارزشمندی هستند که امروزه مورد توجه قرار گرفته و بهعنوان مواد اولیه برای تبدیل به داروهای بیخطر برای انسان تلقی میشوند. محققین داروساز، داروهای قرن بیست و یکم را در گیاهان جستجو میکنند و معتقدند که حلال مشکلات پزشکی در آینده گیاهان میباشند، زیرا تاکنون بسیاری از داروهای درمان عفونت، آنتی-اکسیدان، ضدسرطان و غیره از گیاهان استخراج شدهاند. از جمله گیاهانی که امروزه در علم طب سنتی مورد استفاده قرار میگیرد، میتوان به گیاه خونفام اشاره کرد که برای درمان عفونتها، التیام زخمها، ورم روده، کمبود ویتامین ث (اسکوروی) و خونریزی بیش از اندازه مورد توجه قرار گرفته است. گیاه خونفام با نام علمی Lythrun salicaria از خانوادهLythraceae بوده که در مناطق مختلف ایران به خصوص در استانهای مازندران، لرستان، همدان، گیلان، گرگان رشد میکند. با توجه به موارد ذکر شده، هدف از انجام این پژوهش، استخراج عصاره گیاه خونفام و بررسی اثرات ضدمیکروبی و آنتیاکسیدانی آن است.
روش بررسی
تهیه عصاره آبی گیاه خونفام
گیاه خونفام از شهرستان بهشهر در شرق مازندران جمع آوری و توسط دکتر علیرضا نقینژاد در گروه زیستشناسی دانشگاه مازندران، ایران شناسایی شد. برگهای گیاه خونفام سه بار با آب مقطر دیونیزه شسته شدند تا ذرات گرد و غبار از بین بروند و سپس در دمای 50 درجه سانتیگراد در آون خشک شدند. برگهای خشک شده در آسیاب پودر شدند. پنج گرم پودر برگ خشک شده در 100 میلیلیتر آب مقطر مخلوط شده و در دمای 80 درجه سانتیگراد به مدت 60 دقیقه بر روی هیتر استریر قرار گرفت. در ادامه محلول ساخته شده بر روی سکوی آزمایشگاه قرار گرفت تا به دمای محیط برسد. سپس با دور6000 به مدت10 دقیقه سانتریفیوژ و سپس با کاغذ واتمن صاف شد. عصاره بهدست آمده در یخچال نگهداری شد تا در آزمایشهای بعدی مورد استفاده قرار گیرد (3).
تعیین میزان ترکیبات فنلی کل
تعیین مقدار فنل تام
جهت ارزیابی میزان محتوای فنلی تام موجود در عصاره گیاه خونفام از روش فولین سیو-کالتو استفاده شد. در این آزمایش 300 میکرولیتر عصاره با 1500 میکرولیتر معرف فولین سیوکالتو و1200 میکرولیتر کربنات سدیم 20 درصد (w/v) مخلوط شده و به مدت60 دقیقه در تاریکی نگهداری شد و جذب در 765 نانومتر اندازهگیری شد. نتایج محتویات فنلی بهصورت میلیگرم اسید گالیک در گرم وزن خشک عصاره بیان شد. از (300میکرولیتر) متانول80 درصد، (1500 میکرولیتر) فولین و (1200 میکرولیتر) کربنات سدیم بهعنوان شاهد دستگاه و از گالیک اسید در غلظتهای 0/3، 0/2، 0/1، 0/075، 0/024 میکروگرم بر میلیلیتر برای تهیه منحنی استاندارد استفاده شد (4).
تعیین مقدار فلاونوئید تام
مقدار فلاونوئید تام عصاره با استفاده از روش رنگسنجی آلومینیوم کلرید مشخص شد. در این روش، 1500 میکرولیتر عصاره (1 میکروگرم بر میلیلیتر) با 1500 میکرولیتر کلرید آلومینیوم (20 گرم بر لیتر) ترکیب و به مدت 40 دقیقه در دمای20 درجه نگهداری و جذب در طول موج 415 نانومتر قرائت شد (5).
تعیین مقدار فلاونول تام
جهت ارزیابی میزان محتوای فلاونول تام موجود در عصاره گیاه خونفام، (1میکروگرم بر میلیلیتر) 600 میکرولیتر عصاره، 600 میکرولیتر آلومینیوم کلراید و 1800 میکرولیتر استات سدیم را با هم مخلوط نموده و سپس بهمدت 2/5 ساعت در دمای 20 درجه سانتیگراد نگهداری شد و جذب آن در طول موج 440 نانومتر قرائت شد. برای رسم منحنی استاندارد از غلظت¬های مختلف 0/025، 0/05، 0/1، 0/15و 0/2 میکروگرم برمیلیلیتر کوئرسیتین استفاده شد (6).
تعیین فعالیت آنتیاکسیدانی
تعیین قدرت کاهندگی آهن
روش احیاء آهن بهعنوان شاخصی از قدرت آنتیاکسیدانی است که طی آن آهن (III) به آهن (II) احیاء میشود و تغییر رنگ مخلوط آزمایش این واکنش را تأیید می¬کند. 1000میکرولیتر عصاره در غلظتهای مختلف (1000و500, 250 میکروگرم برمیلیلیتر) در لولههای آزمایش ریخته و با 1000 میکرولیتر بافر فسفات 0/2 مولار با PH=6/6 مخلوط کرده سپس 1000 میکرولیتر پتاسیم فری سیانات به آن اضافه شد و به مدت 20 دقیقه در دمای 50 درجه سانتیگراد قرار داده شد. سپس 1000 میکرولیتر محلول تریکلریداسید اضافه شد. 1500 میلی لیتر از محلول حاصل را برداشته در یک لوله آزمایش حاوی 1500 میکرولیتر آب ریخته و به آن 600 میکرولیتر کلرید آهن (III) اضافه شد. سپس جذب نمونهها با استفاده از اسپکتروفتومتر در طول موج 700 نانومتر قرائت شد. از تمام ترکیبات بالا به غیر از عصاره که به جای آن آب مقطر استفاده کردیم بهعنوان شاهد در نظر گرفته شد (4).
تعیین فعالیت مهار رادیکال آزاد DPPH
برای انجام این آزمایش از رادیکالهای پایدارDPPH استفاده شد. 1000 میکرولیتر عصاره مورد نظر با غلظتهای مختلف (10, 20, 40 میکروگرم بر میلیلیتر) در تیوپ ریخته و با 300 میکرولیتر محلول (0/002%) DPPH مخلوط کرده و بهمدت 30 دقیقه در تاریکی قرار داده و سپس جذب آن با استفاده از اسپکتروفتومتر در طول موج 517 نانومتر قرائت شد. 1000 میکرولیتر متانول با300 میکرولیتر DPPHترکیب و بهعنوان شاهد استفاده شد. این آزمایش 3 بار برای هر غلظت تکرار شد و سپس درصد به داماندازی رادیکال DPPH از فرمول زیر محاسبه گردید (7).
I (%) = (A0-A)/ A0 ×100
A0: جذب شاهد، A: جذب نمونه، I (%): درصد به داماندازی رادیکال DPPH
در این آزمایش از بوتیلات هیدروکسی تولوئن، BHT (آنتیاکسیدان سنتزی)، بهعنوان کنترل مثبت استفاده شد.
آزمایش ضدمیکروبی
روش دیسک دیفیوژن برای بررسی فعالیت ضدمیکروبی استفاده شد. از آنتیبیوتیک سیپروفلوکساسین به عنوان استاندارد برای فعالیت ضدباکتریایی و آمفوتریسین B برای فعالیت ضدقارچی استفاده شد. به منظور انجام آزمایش ابتدا باکتری گرم مثبت استافیلوکوکوس اورئوس و باسیلوس سوبتلیس و باکتری گرم منفی اشریشیاکلای مورد نظر در محیط کشت نوترینت براث و قارچهای فوزاریوم تاپسینوم و پریکولاریا اوریزه در محیط کشت دکستروز رشد داده شد. سپس از میکروبهای رشد کرده سوسپانسیونی معادل با نیم مک فارلند تهیه شد. در ادامه از سوسپانسیون تهیه شده 100 میکرولیتر بر روی محیط کشت مولر هینتون آگار و دکستروز آگار بهطور یکنواخت پخش گردید. سپس ۳۰ میکرولیتر از سه غلظت مختلف 40، 70 و 100میکرولیتر بر میلیلیتر عصاره گیاه خونفام بر روی دیسکهای کاغذی (۶ میلیمتری) اضافه شد. در پایان پلیتهای باکتری در دمای 37 درجه و پلیتهای قارچ در دمای 30 درجه در گرمخانه به مدت ۲۴ ساعت نگهداری شدند. سپس قطر ناحیه مهار شده بر حسب میلیمتر اندازهگیری شد (11و 9،10، 8).
تجزیه و تحلیل آماری
آنالیز آماری دادهها بهصورت خطای استاندارد ± میانگین ارائه گردیده است. اختلاف معنیدار توسط آنالیز واریانس یک-طرفه (ANOVA) با آزمون تعقیبی چند دامنه¬ای دانکن و با استفاده از نرمافزارversion 16 SPSS مورد بررسی قرار گرفت و مقادیرP کمتر از 0/05 معنیدار در نظر گرفته شدند.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه تخصصی فناوری¬های نوین آمل با کد اخلاق IR.AUSMT.REC.1399.01.35 تأیید شده است.
نتایج
محتوی فنولی، فلاونول و فلاونوئید
محتوای فنلی، فلاونول و فلاونوئید کل عصاره آبی گیاه خونفام مورد بررسی قرار گرفت. نتایج نشان داد که این گیاه دارای محتوای فنل کل (1/27 ± 36/53 میلیگرم گالیک اسید برگرم عصاره)، فلاونول (0/4 ± 5/2 میلیگرم کوئرستین بر گرم عصاره) و فلاونوئیدها ( 0/95 ± 20/8 کوئرستین بر گرم عصاره) است.
نتایج سنجش فعالیت آنتیاکسیدانی
نتایج قدرت احیاءکنندگی آهن
مطالعات مختلف نشان دادند که آنتیاکسیدانها دارای خواص الکترون دهندگی میباشد. در این آزمایش هر چه عصاره یا ترکیب آنتیاکسیدان بتواند باعث احیاء کل بیشتر (III) Feبه (II) Fe شود میتواند از تبدیل 2O2 Hبه °OH که یک رادیکال بسیار پایدار و خطرناک است جلوگیری کند. نتایج آزمایش نشان داد که با افزایش میزان غلظت عصاره میزان قدرت احیاکنندگی آهن افزایش مییابد بهطوریکه در غلظت 100 میکروگرم بر میلیلیتر برابر با 0/017± 0/126، در غلظت 300 میکروگرم بر میلی¬لیتر برابر با 430/025±0/0، 600 میکروگرم بر میلیلیتر برابر با 0/033± 1/115 و در غلظت 900 میکروگرم برمیلیلیتر برابر با 0/03 ± 1/604 بود.
نتایج فعالیت مهار رادیکالهای DPPH
اثر آنتی¬اکسیدانی عصاره با درصد مهار رادیکال DPPH محاسبه شد. رنگ بنفش محلول DPPH به تدریج در حضور عصاره به رنگ زرد کمرنگ تغییر یافت که نشانگر ظرفیت آنتی¬اکسیدانی عصاره خونفام است. نتایج نشان داد که با افزایش غلظت عصاره میزان مهار رادیکال DPPH افزایش یافته و کمترین مهار در غلظت 10 میکروگرم بر میلیلیتر عصاره (1/02 ± 27/6 میکروگرم بر میلیلیتر) و بیشترین میزان مهار در غلظت40 میکروگرم برمیلیلیتر عصاره ( 2/27 ± 69/5 میکروگرم بر میلیلیتر) مشاهده شد (شکل 1). میزان IC50 بوتیلات هیدروکسی تولوئن (BHT) نیز برابر با 0/2 ± 4/85 میکروگرم بر میلی لیتر به دست آمد.
نتایج ضدمیکروبی عصاره خونفام
فعالیت ضدباکتریایی عصاره خونفام در غلظتهای مختلف بر روی 2 سویه باکتری گرم مثبت و 4 سویه باکتری گرم منفی در محیط کشت مولر هینتون آگار بهروش دیسک دیفیوژن بررسی شد. نتایج جدول 1 نشان داد که با افزایش عصاره، سطح هاله مهاری افزایش مییابد. سطح مهار حاصل از عصاره با 3 غلظت مختلف (40، 70 و100 میکروگرم بر میلیلیتر) با آنتی¬بیوتیک سیپروفلوکساسین (5 میکروگرم بر دیسک) به عنوان استاندارد مقایسه شد. نتایج بهدست آمده در شکل 2 و جدول 1 ارائه شده که نشان می¬دهد بیشترین سطح هاله مهار رشد در غلظت 100 میکروگرم برمیلیلیتر به ترتیب مربوط به باسیلوس سوبتلیس (20 میلیمتر) و استافیلوکوکوس اورئوس (17 میلیمتر) می¬باشد. بیشترین سطح هاله مهار رشد در غلظت 70 میکروگرم بر میلیلیتر به ترتیب مربوط باسیلوس سوبتلیس (16 میلیمتر) و استافیلوکوکوس اورئوس (14میلیمتر) میباشد. همچنین بیشترین اندازه هاله مهار رشد در غلظت 40 میکروگرم بر میلیلیتر به ترتیب مربوط به باسیلوس سوبتلیس (13میلیمتر) و استافیلوکوکوس اورئوس (12میلیمتر) میباشد. در حالیکه عصاره خونفام منجر به مهار باکتری اشرشیا کلی نشد، دیسک¬ آنتیبیوتیک سیپروفلوکساسین منجر به مهار 33 میلی¬متری باسیلوس سوبتلیس، 36 میلی¬متری استافیلوکوکوس اورئوس و 28 میلیمتری اشریشیاکلای شد. فعالیت ضد قارچی عصاره خونفام در 3 غلظت مختلف (70،40، 100 میکروگرم بر میلیلیتر) مورد بررسی قرار گرفت. نتایج به دست آمده در شکل 1 و جدول 2 نشان داد که بیشترین اندازه هاله مهاری در غلظت 100 میکروگرم بر میلیلیتر به ترتیب مربوط به فوزاریوم تاپسینوم (24 میلیمتر) و پریکولاریا اوریزه (21 میلی¬متر) می¬باشد. در¬حالیکه بیشترین اندازه هاله مهاری در غلظت 70 میکروگرم بر میلیلیتر به ترتیب مربوط به فوزاریوم تاپسینوم (21 میلیمتر) و پری کولاریا اوریزه (19 میلیمتر) می¬باشد. در غلظت 40 میکروگرم بر میلیلیتر بیشترین اندازه سطح مهار متعلق به فوزاریوم تاپسینوم (17میلیمتر) و پریکولاریا اوریزه (14 میلی¬متر) است. هاله مهار رشد آنتی¬بیوتیک آمفوتریسین B در قارچ پری¬کولاریا اوریزه 34 میلیمتر است، درحالیکه این آنتیبیوتیک منجر به مهار قارچ فوزاریوم تاپسینوم نشد.

شکل 1: میزان فعالیت مهار رادیکال های DPPH توسط عصاره آبی گیاه خونفام

شکل2: نتاج آزمایش ضدمیکروبی عصاره گیاه خونفام، a) غلظت100 میکروگرم بر میلیلیتر b) غلظت70 میکروگرم بر میلیلیترc ) غلظت40 میکروگرم بر میلیلیتر d) دیسک آنتیبیوتیک
جدول1: میانگین هاله عدم رشد غلظتهای مختلف عصاره گیاه خونفام برتعدادی از میکروارگانیسمها برحسب میلیمتر

بحث
اهمیت آنتیاکسیدانها مخصوصاً از دو جنبه قابل بررسی است. یکی از این موارد، تامین سلامتی انسانها بهمنظور حذف رادیکالهای آزاد و دیگری در زمینه صنعت غذا است. با توجه به مضرات آنتیاکسیدانهای مصنوعی توجه زیادی به سمت آنتیاکسیدانهای طبیعی معطوف شده است. نتایج حاصل از این پژوهش نشان داد که گیاه خونفام دارای 1/27 ± 36/53 میلیگرم گالیک اسید بر گرم عصاره فنل، 0/95 ± 20/8 کوئرستین برگرم عصاره فلاونوئید و 0/4 ± 5/2 میلیگرم کوئرستین برگرم عصاره فلاونول میباشد. نتایج بهدست آمده در یک تحقیق بر روی عصاره آبی 9 گیاه نشان داد که عصاره آبی گیاه برگ بو و ریحان میزان فنل بالاتری نسبت به دیگر عصارههای آبی مورد مطالعه داشتند (12). در تحقیقی گواهی و همکاران (2019) با بررسی فعالیتهای آنتیاکسیدانی روی گیاه دارویی Scutellaria pekinensis نشان دادند که بیشترین میزان مهار رادیکال آزاد و قدرت احیاء کنندگی آهن مربوط به عصاره آبی این گیاه در مقایسه با عصاره متانولی آن میباشد (13). در مطالعهای فعالیت آنتیاکسیدانی چهار گونه نعناع توسط رنجبر و همکاران (2020) مورد بررسی قرار گرفت. در بین گونههای مورد مطالعه عصاره متانولی نعناع پیپریتا بالاترین میزان فنل کل، فلاونوئید، فلاونول و درصد مهار رادیکال آزاد را دارا بوده است. همچنین در تحقیق مذکور میزان جذب احیاء کنندگی آهن از 0/189 تا 1/16 گزارش شده است و یک همخوانی خوبی بین نتایج این ازمایش و نتایج ما وجود داشته بهطوریکه در هر دو آزمایش رابطه مثبتی بین افزایش غلظت عصاره و میزان قدرت احیاء کنندگی وجود دارد (4). بنابراین میتوان گفت که عصاره آبی خونفام دارای ظرفیت الکتروندهی و احیاءکنندگی آهن بالایی می¬باشد. نتایج این تحقیق و مطالعات قبلی نشان داده که رابطه مثبتی بین میزان ترکیبات فنلی و قدرت آنتیاکسیدانی گیاه وجود دارد بهطوریکه هر چقدر میزان فنل و فلاونوئید کل بیشتر باشد عصاره خاصیت آنتیاکسیدانی بیشتری دارد (14،15). از دلایل احتمالی تفاوت ظرفیت آنتیاکسیدانی این آزمایش با گزارشات قبلی میتوان به تفاوت نوع و میزان فنل، فلاونوئید و فلاونول اشاره کرد. نتایج فعالیت ضد میکروبی عصاره گیاه خونفام نشان داد که عصاره این گیاه توانایی مهارکنندگی خوبی نسبت به گونههای میکروبی مورد مطالعه به جزء اشرشیاکلای دارد. در یک مطالعه صفری و همکاران (2019) نشان دادند که عصاره متانولی گیاه Mespilus germanica دارای اثر مهار کنندگی بیشتری بر روی رشد استافیلوکوکوس اورئوس نسبت به گونه اشرشیاکلای می باشد (16). هاشمی و همکاران (2018)، خاصیت ضد قارچی و آنتیاکسیدانی ترکیب صمغ بادام تلخ با عصاره Satureja intermedia را ارزیابی کردند نتایج آنها نشان داد که بیشترین سطح مهارکنندگی بر روی قارچ penicillium citrinum مشاهده شد. همچنین ترکیب مورد نظر دارای خاصیت آنتیاکسیدانی قابلتوجهی بود (17). در مقایسه با مهار رشد باکتریها توسط عصاره گیاه خونفام، میزان مهار عصاره بر روی قارچها کمتر بوده و دلیل آن میتواند مربوط به حضور کتین در دیواره سلولی قارچها باشد که مقاومت بیشتری نسبت به لیپوپلیساکاریدها در دیواره سلولی باکتری دارد. بهطور کلی مکانسیمهای احتمالی فعالیت ضد میکروبی عصاره را میتوان به از بین رفتن یکپارچگی غشای سلولی ناشی از اختلال در لایه فسفولیپید، بهعنوان یکی از مهم ترین مکانیسمهای مهاری اشاره کرد. همچنین استرس اکسیداتیو ناشی از تولید انواع اکسیژن فعال (ROS) یکی دیگر از ساز و کارهای مهم بوده و این مولکول های ROS بیشتر با مهار یا تغییر در همانندسازی DNA، چرخه سنتز پروتئین، چرخه متابولیسم غذایی یا چرخه تنفسی باعث مرگ میکروب میشوند (20-18).
نتیجهگیری
گیاه خونفام از زمانهای قدیم مورد توجه طب سنتی واقع شده است اما بهطور جدی به جنبههای دارویی آن توجه نشده است. نتایج بهدست آمده در این تحقیق میتواند اهمیت این گیاه دارویی را بیشتر از گذشته نشان دهد. نتایج حاکی از آن است که عصاره خونفام خاصیت ضدمیکروبی و آنتیاکسیدانی خوبی از خود نشان میدهند و حتی میتوان آن را بهعنوان یک جایگزین مناسب برای آنتیبیوتیک ها و آنتیاکسیدانهای موجود در بازار در نظر گرفت.
سپاسگزاری
این طرح تحقیقاتی ( کد: 81/9712) با استفاده از اعتبارات ویژه پژوهشی (گرنت) دانشگاه تخصصی فناویهای نوین آمل انجام گردیده است.
حامی مالی: دانشگاه تخصصی فناوری های نوین آمل
تعارض در منافع: وجود ندارد.
References:
1- Alavijeh PK, Alavijeh PK, Sharma D. A Study of Antimicrobial Activity of Few Medicinal Herbs. Asian J Plant Sci Res 2012; 2(4): 496-502.
2- Lobo V, Patil A, Phatak A, Chandra N. Free Radicals, Antioxidants and Functional Foods: Impact on Human Health. Pharmacognosy Reviews 2010; 4(8): 118-26.
3- Singh A, Singh NB, Hussain I, Singh H, Yadav V Singh SC. Green Synthesis of Nano Zinc Oxide and Evaluation of its Impact on Germination and Metabolic Activity of Solanum Lycopersicum. J Biotechnology 2016; 233: 84-94.
4- Ranjbar M, Kiani M, Nikpay A. Antioxidant and Scolicidal Activities of Four Iranian Mentha Species (Lamiaceae) in Relation to Phenolic Elements. J. Herbmed Pharmacol 2020; 9(3): 200-8.
5- Moreno MI, Isla MI, Sampietro AR, Vattuone MA. Comparison of the Free Radical-Scavenging Activity of Propolis from Several Regions of Argentina. J Ethnopharmacol 2000; 71(1): 109-14.
6- Loziene K, Venskutonis PR, Sipailiene A, Labokas J. Radical Scavenging and Antibacterial Properties of the Extracts from Different Thymus Pulegioides L. Chemotypes. Food Chem 2007; 103(2): 546-59.
7- Singh HP, Mittal S, Kaur S, Batish DR, Kohli RK. Chemical Composition and Antioxidant Activity of Essential Oil from Residues of Artemisia Scoparia. Food Chem 2009; 114(2): 642-45.
8- Do QD, Angkawijaya AE, Tran-Nguyen PL, Huynh LH, Soetaredjo FE, Ismadji S, et al. Effect of Extraction Solvent on Total Phenol Content, Total Flavonoid Content, And Antioxidant Activity of Limnophila Aromatica. J Food and Drug Analysis 2014; 22(3): 296-302.
9- Khan ZUH, Sadiq HM, Shah NS, Khan AU, Muhammad N, Hassan SU, et al. Greener Synthesis of Zinc Oxide Nanoparticles Using Trianthema Portulacastrum Extract and Evaluation of its Photocatalytic and Biological Applications. J Photochemistry and Photobiology B: Biology 2019; 192: 147-57.
10- Gupta M, Tomar RS, Kaushik S, Sharma D, Mishra RK. Effective Antimicrobial Activity of Green Zno Nano Particles of Catharanthus Roseus. Frontiers in Microbiology 2018; 9: 2030.
11- Rao B, Tang RC. Green Synthesis of Silver Nanoparticles with Antibacterial Activities Using Aqueous Eriobotrya Japonica Leaf Extract. Advances in Natural Sciences: Nanoscience and Nanotechnology 2017; 8(1): 015014.
12- Mirzaei A, Mohammadi J, Mirzaei N, Mirzaei M. The Antioxidant Capacities and Total Phenolic Contents of Some Medicinal Plants in Iran. J Fasa University Medical Sci 2011; 1(3):160-7. [Persian]
13- Govahi M, Ghorbani F, Ranjbar M, Rahaiee S, Azizi H. Evaluation of Antioxidant and Antibacterial Activity, and Determination of Phenolic and Flavonoid Content of Aqueous and Methanolic Extracts of Scutellaria Pekinensis. Scientific J Ilam Uni Med Sci 2019; 27(3): 91-100. [Persian]
14- Kamkar A, Shariatifar N, Jamshidi AH, Mohammdian M. Study of Antioxidant Functional of the Water, Methanol, And Ethanol Extracts Endemic Cuminum Cyminum L. and Cardaria Draba L. in the Invitro Systems. Ofogh-E-Danesh. GMUHS J 2010; 16(2): 37-44. [Persian]
15- Salamian SH, Sadeghi Mahoonak AR, Alami M, Ghorbani M. Evaluation of Total Phenolic, Flavonoid, Anthocyanin Compounds, Antibacterial and Antioxidant Activity of Hawthorn (Crataegus Elbursensis) Fruit Acetonic Extract. JRUMS 2013; 13(1): 53-66. [Persian]
16- Safari M, Ahmady-Asbchin S. Evaluation of Antioxidant and Antibacterial Activities of Methanolic Extract of Medlar (Mespilus Germanica L.) Leaves. Biotechnology and Biotechnological Equipment 2018; 33(1): 372-8.
17- Hashemi SMB, Raeisi S. Evaluation of Antifungal and Antioxidant Properties of Edible Coating Based on Apricot (Prunus Armeniaca) Gum Containing Satureja Intermedia Extract in Fresh Wild Almond (Amygdalus Scoparia) Kernels. J Food Measurement and Characterization 2018; 12(1): 362-9.
18- Roy S. Green Synthesized Gold Nanoparticles: Study of Antimicrobial Activity. J Bionanosci 2017; 11(2): 131-5.
19- Stoimenov PK, Klinger RL, Marchin GL, Klabunde KJ. Metal Oxide Nanoparticles as Bactericidal Agents. Langmuir 2011; 18: 6679-86.
20- Umadevi M, Rani T, Balakrishnan T, Ramanibai R. Antimicrobial Activity of Silver Nanoparticles Prepared Under an Ultrasonic Field. Int J Pharm Sci Nanotechnol 2011; 4(3): 1491-96.
1- Alavijeh PK, Alavijeh PK, Sharma D. A Study of Antimicrobial Activity of Few Medicinal Herbs. Asian J Plant Sci Res 2012; 2(4): 496-502.
2- Lobo V, Patil A, Phatak A, Chandra N. Free Radicals, Antioxidants and Functional Foods: Impact on Human Health. Pharmacognosy Reviews 2010; 4(8): 118-26.
3- Singh A, Singh NB, Hussain I, Singh H, Yadav V Singh SC. Green Synthesis of Nano Zinc Oxide and Evaluation of its Impact on Germination and Metabolic Activity of Solanum Lycopersicum. J Biotechnology 2016; 233: 84-94.
4- Ranjbar M, Kiani M, Nikpay A. Antioxidant and Scolicidal Activities of Four Iranian Mentha Species (Lamiaceae) in Relation to Phenolic Elements. J. Herbmed Pharmacol 2020; 9(3): 200-8.
5- Moreno MI, Isla MI, Sampietro AR, Vattuone MA. Comparison of the Free Radical-Scavenging Activity of Propolis from Several Regions of Argentina. J Ethnopharmacol 2000; 71(1): 109-14.
6- Loziene K, Venskutonis PR, Sipailiene A, Labokas J. Radical Scavenging and Antibacterial Properties of the Extracts from Different Thymus Pulegioides L. Chemotypes. Food Chem 2007; 103(2): 546-59.
7- Singh HP, Mittal S, Kaur S, Batish DR, Kohli RK. Chemical Composition and Antioxidant Activity of Essential Oil from Residues of Artemisia Scoparia. Food Chem 2009; 114(2): 642-45.
8- Do QD, Angkawijaya AE, Tran-Nguyen PL, Huynh LH, Soetaredjo FE, Ismadji S, et al. Effect of Extraction Solvent on Total Phenol Content, Total Flavonoid Content, And Antioxidant Activity of Limnophila Aromatica. J Food and Drug Analysis 2014; 22(3): 296-302.
9- Khan ZUH, Sadiq HM, Shah NS, Khan AU, Muhammad N, Hassan SU, et al. Greener Synthesis of Zinc Oxide Nanoparticles Using Trianthema Portulacastrum Extract and Evaluation of its Photocatalytic and Biological Applications. J Photochemistry and Photobiology B: Biology 2019; 192: 147-57.
10- Gupta M, Tomar RS, Kaushik S, Sharma D, Mishra RK. Effective Antimicrobial Activity of Green Zno Nano Particles of Catharanthus Roseus. Frontiers in Microbiology 2018; 9: 2030.
11- Rao B, Tang RC. Green Synthesis of Silver Nanoparticles with Antibacterial Activities Using Aqueous Eriobotrya Japonica Leaf Extract. Advances in Natural Sciences: Nanoscience and Nanotechnology 2017; 8(1): 015014.
12- Mirzaei A, Mohammadi J, Mirzaei N, Mirzaei M. The Antioxidant Capacities and Total Phenolic Contents of Some Medicinal Plants in Iran. J Fasa University Medical Sci 2011; 1(3):160-7. [Persian]
13- Govahi M, Ghorbani F, Ranjbar M, Rahaiee S, Azizi H. Evaluation of Antioxidant and Antibacterial Activity, and Determination of Phenolic and Flavonoid Content of Aqueous and Methanolic Extracts of Scutellaria Pekinensis. Scientific J Ilam Uni Med Sci 2019; 27(3): 91-100. [Persian]
14- Kamkar A, Shariatifar N, Jamshidi AH, Mohammdian M. Study of Antioxidant Functional of the Water, Methanol, And Ethanol Extracts Endemic Cuminum Cyminum L. and Cardaria Draba L. in the Invitro Systems. Ofogh-E-Danesh. GMUHS J 2010; 16(2): 37-44. [Persian]
15- Salamian SH, Sadeghi Mahoonak AR, Alami M, Ghorbani M. Evaluation of Total Phenolic, Flavonoid, Anthocyanin Compounds, Antibacterial and Antioxidant Activity of Hawthorn (Crataegus Elbursensis) Fruit Acetonic Extract. JRUMS 2013; 13(1): 53-66. [Persian]
16- Safari M, Ahmady-Asbchin S. Evaluation of Antioxidant and Antibacterial Activities of Methanolic Extract of Medlar (Mespilus Germanica L.) Leaves. Biotechnology and Biotechnological Equipment 2018; 33(1): 372-8.
17- Hashemi SMB, Raeisi S. Evaluation of Antifungal and Antioxidant Properties of Edible Coating Based on Apricot (Prunus Armeniaca) Gum Containing Satureja Intermedia Extract in Fresh Wild Almond (Amygdalus Scoparia) Kernels. J Food Measurement and Characterization 2018; 12(1): 362-9.
18- Roy S. Green Synthesized Gold Nanoparticles: Study of Antimicrobial Activity. J Bionanosci 2017; 11(2): 131-5.
19- Stoimenov PK, Klinger RL, Marchin GL, Klabunde KJ. Metal Oxide Nanoparticles as Bactericidal Agents. Langmuir 2011; 18: 6679-86.
20- Umadevi M, Rani T, Balakrishnan T, Ramanibai R. Antimicrobial Activity of Silver Nanoparticles Prepared Under an Ultrasonic Field. Int J Pharm Sci Nanotechnol 2011; 4(3): 1491-96.
نوع مطالعه: پژوهشي |
موضوع مقاله:
زیست شناسی
دریافت: 1399/1/19 | پذیرش: 1400/2/10 | انتشار: 1400/2/10
دریافت: 1399/1/19 | پذیرش: 1400/2/10 | انتشار: 1400/2/10
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







