دوره 28، شماره 9 - ( آذر 1399 )
جلد 28 شماره 9 صفحات 3029-3017 |
برگشت به فهرست نسخه ها
Download citation:
BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:



BibTeX | RIS | EndNote | Medlars | ProCite | Reference Manager | RefWorks
Send citation to:
Darvishi E, Minadi M, Mirsadeghi S, Shiri B. Design and Construction of Ph-Sensitive Drug Delivery System Based on Metal-Organic Framework (MOF) Nanoparticles for Cancer Treatment by Drug Delivery System Containing Curcumin. JSSU 2020; 28 (9) :3017-3029
URL: http://jssu.ssu.ac.ir/article-1-5109-fa.html
URL: http://jssu.ssu.ac.ir/article-1-5109-fa.html
درویشی الهه، مینادی مهسا، میرصادقی سمیه، شیری ورنامخواستی بهرنگ. طراحی و ساخت سامانه دارورسان حساس به pH بر پایه نانوذرات چارچوب فلز-آلی (MOF) جهت درمان سرطان به وسیله نانوسامانه دارویی حاوی کورکومین. مجله علمي پژوهشي دانشگاه علوم پزشكي شهید صدوقی يزد. 1399; 28 (9) :3017-3029
متن کامل [PDF 973 kb]
(1294 دریافت)
| چکیده (HTML) (2002 مشاهده)
متن کامل: (3748 مشاهده)
مقدمه
بیماری سرطان دومین بیماری کشنده دنیا میباشد که در سالهای اخیر بهویژه با افزایش استفاده از مواد شیمیایی و دیگر عوامل جهشزا و از طرف دیگر افزایش متوسط طول عمر بهدلیل پیشرفتهای پزشکی و در نتیجه شیوع بیش از پیش آن در میان جوامع مختلف، تبدیل به یکی از بزرگترین چالشهای علم پزشکی دنیا شده است (1). بهدلیل شرایط خاص این بیماری و توجه به این مطلب که داروهای مورد استفاده در کنترل این بیماری عوارض جدی و بسیاری بر بافتهای تکثیر شونده بدن مانند سلولهای ایمنی دارند و نیز اینکه تکثیر سریع بههمراه جهشهای فراوان در بافتهای توموری موجبات ایجاد مقاومت دارویی را فراهم میکند رسانش هدفمند داروها به بافتها و سلولهای سرطانی مهمترین چالش مبارزه با این بیماری است (2). داروهای زیادی بسته به نوع و مرحله بیماری برای درمان سرطانهای مختلف بهکار گرفته میشوند که در بسیاری از موارد استفاده یک داروی بسیار کارآمد بهدلیل خصوصیاتی چون آبگریز بودن یا ناپایداری در محیط بدن، ناممکن یا بسیار مشکل شده و همین معایب بازدهی دارو در درمان بیماری را بهشدت تحت تأثیر قرار میدهد. بهمنظور رفع این مشکلات سیستمهای دارو رسانی بسیاری توسط گروههای تحقیقاتی مختلف به این منظور ارائه و تعدادی از آنها نیز به مرحله تجاری رسیده یا در مراحل آزمایشهای کلینیکی هستند (3). با توسعه سامانههای جدید دارورسانی، مشکلات داروهای موجود هم چون زیست فراهمی پایین، انتقال ضعیف از غشاءهای زیستی، نامحلول بودن در آب و یا ناپایداری در محیطهای زیستی و همچنین مقاومتهای دارویی کاهش یافته است. در زمینه دارورسانی هدفمند به سلولهای سرطانی، سامانههای دارورسانی حساس به pH کاندیدهای مناسبی میباشند. زیرا pH در نواحی بافت تومور (6-5/5) دارای اسیدیته بیشتری از خون و بافتهای دیگر (7/4) است. این سیستمها، دارو را در محل تومور بیشتر و سریعتر از بافتهای معمولی اطراف آن که دارای pH فیزیولوژیک7/4 هستند آزاد میکند. نانوذرات متخلخل برای دارورسانی حساس به pH بسیار مناسبند زیرا نانوذرات توانایی بالایی در عبور از غشاهای سلولی دارند و همچنین توسط سلولهای سرطانی بازجذب میشوند. علاوه بر این مساحت سطح ویژه جزء مهمترین فاکتورهای ارزیابی میزان ظرفیت حفره است و با تعداد مولکولهایی که تماس مستقیم دارند در ارتباط میباشد بههمین دلیل در بحث دارورسانی مساحت سطح ویژه برای بارگذاری داروها از اهمیت زیادی برخوردار است (4). چارچوب فلز-آلی MOF به دلیل داشتن حفرات با اندازه بزرگ، سطح ویژه زیاد، جذب انتخابپذیر مولکولهای کوچک، امروزه در دارورسانی مورد توجه قرار گرفتهاند. این نانوذرات زیست سازگار بوده و در محیطهای اسیدی دارو را آزاد میکنند اما یکی از معایب آنها این است که در محیطهای آبی و فیزیولوژیکی بدن ناپایدار میباشند (5). نانوذرات ZIF-8دستهای ازMOFها هستند که نانو ساختارهای متخلخل و زیست سازگارند و در محیط فیزیولوژیکی بدن پایدار میباشند و دارای ظرفیت بالایی برای بارگذاری دارو هستند. ساختارهای ZIF-8 در محیط اسیدی با از بین رفتن پیوند بین روی و یون ایمیدازول باعث آزاد شدن دارو میشود (6). در این پروژه از این نانوذره برای بارگیری و حمل داروی کورکومین استفاده شده است. کورکومین یک ترکیب پلیفنل زرد رنگ، آبگریز و با وزن مولکولی پایین میباشد (شکل 1). این ماده از ریزومهای گیاه کورکوما لانگا (Curcuma Loga) استخراج میشود (7). این گیاه از خانواده زنجبیل و بومی مناطق جنوب و جنوب شرق آسیا میباشد. بخش اعظم پودر استخراج شده که در زبان فارسی به آن زردچوبه گفته میشود را کورکومین تشکیل میدهد. زردچوبه از ریزوم این گیاه مشتق میشود و در طول تاریخ در طب سنتی چین و هند بسیار مورد استفاده قرار میگرفت. در طی مطالعات انجام شده در سال 2015 توسط شانگموگان و همکارانش کورکومین دارای خواص بسیار زیادی میباشد از جمله خواص آنتیاکسیدانی، ضدالتهابی، ضدکارسینوم و ضدتوموری و همچنین دارای خواص هپاتوپروتکتیو و کاردیوپروتکتیو میباشد (8). کورکومین عامل اصلی رنگ زرد و طلایی زردچوبه میباشد و همچنین بهعنوان مسئول بسیاری از خواص زردچوبه تشخیص داده شده است.

شکل 1: ساختار ترکیب کورکوکین
روش بررسی
1-2 سنتز نانو ذرات ZIF-8 با استفاده از روش همرسوبی در حلال آلی
نانوذرات کریستالی ZIF-8 از طریق افزودن محلول آبی Zn(NO3)2•6H2O به محلول آبی 2-متیل ایمیدازول در دمای اتاق و همزدن محلول بهمدت پنج دقیقه تهیه شدند. قبل از مخلوط کردن، دو محلول فیلتر و سپس به هم اضافه می¬شوند. 1/17 گرم نیترات روی درون بشر 20 میلیلیتری ریخته شد سپس 8 میلی لیتر آب مقطر را به بشر اضافه کرده و روی استیرر در دما و فشار اتاق گذاشته شد تا پودر کاملاً حل شود. سپس در یک بشر دیگر، 2/27 گرم 2-متیل ایمیدازول را که با ترازو حساس وزن شده را نیز در بشر ریخته و 8 میلیلیتر آب مقطر بهبشر اضافه شد و روی استیرر در دما و فشار اتاق قرار گرفت تا پودر کاملاً حل شد. باید توجه داشت که حل شدن 2-متیل ایمیدازول زمانبر میباشد. بعد از حل شدن کامل، محلول نیترات روی را با سمپلر بهصورت قطره قطره به محلول 2-متیل ایمیدازول که روی استیرر قرار داشت با دور نسبتا سریع در حال استیرر بود، اضافه شد. رنگ شیری حاصل نشان دهنده تشکیل نانوذره است. محلول به مدت پنج دقیقه بر روی استیرر همزده شد. بهمنظور جمعآوری نانوذرات، محلول با سرعت rpm6500 بهمدت 10 دقیقه سانتریفیوژ شد و رسوب حاصل سه بار با آب مقطر شستشو داده شد. سپس نانوذرات سنتز شده، یک شب در دمای 65 درجه سانتیگراد در آون قرار گرفت تا کاملاً خشک شده و مورد خصوصیتیابی قرار گرفتند.
2-2 کپسوله کردن دارو درZIF-8 به صورت درجا
150 میلیگرم نیترات روی در 5 میلیلیتر آب مقطر حل شد، سپس در بشر دیگر330 میلیگرم از2-متیلایمیدازول و 5 میلیگرم کورکومین در 10 سی¬سی متانول حل شد. وقتی محلول 2-متیل¬ایمیدازول و کورکومین در حال هم¬خوردن بود، محلول نیترات روی به آن اضافه شد که بعد از مدت 10 دقیقه رنگ نارنجی روشن محلول به نارنجی کدر تغییر یافت این تغییر رنگ نشان¬دهنده تشکیل نانوذرات ZIF-8 حاوی کورکومین (CCM@ZIF-8) است. محلول با سرعت rpm8000 بهمدت 15 دقیقه سانتریفیوژ شد سپس نمونه جمعآوری شده برای جدا کردن ترکیبات واکنش نداده سه بار با متانول شسته شد. بعد از خشک شدن برای بررسی رهایش دارو و خصوصیتیابی از آن استفاده گردید.
2-3 محاسبه درصد بارگیری دارو در نانوذرات
درصد بارگیری عبارت است از مقدار ماده فعال یافت شده اعم از داروها، اسانسها، پروتئینها و سایر اجزای قابل شناسایی در فرمولاسیون نسبت به مقدار آنها در ابتدای شروع واکنش که محاسبه آن از طریق فرمول زیر انجام میشود:
EE% = (Wt /Wi) ×100
که در آن Wt مقدار ماده ترکیب شده در فرمولاسیون و Wi مقدار کل مادهای است که از ابتدا جهت ترکیب در فرمولاسیون مصرف میشود. این دو مقدار میتوانند به روشهای اسپکتروسکوپی یا کروماتوگرافی اندازهگیری شوند (9). بهمنظور محاسبه درصد بارگیری دارو از رونشین بهدست آمده بعد از سانتریفیوژ استفاده گردید و مقدار جذب آن در دستگاه اسپکتروفتومتری در طول موج 420 نانومتر بررسی شد و با قرار دادن در نمودار کالیبراسیون، مقدار داروی بارگیری شده با استفاده از فرمول فوق محاسبه گردید.
3-2 بررسی خصوصیات فیزیکوشیمیایی نانوذرات
بهمنظور بررسی خصوصیات فیزیکی، شیمیایی سامانه دارویی مورد استفاده در این تحقیق، آنالیزهای مختلفی انجام شد. اندازه ذره¬ای و توزیع نانوذرات توسط دستگاه DLS اندازهگیری شد. ساختار کریستالی نانوذره توسط داده¬های دستگاه پراش اشعه ایکس (XRD) بررسی شد. همچنین مورفولوژی و سایز دقیق نانوذرات با استفاده از میکروسکوپ الکترونی روبشی (SEM) و میکروسکوپ الکترونی عبوری (TEM) بهدست آمد. برای اثبات بارگیری کورکومین در نانوذرات از تست طیفسنجی تبدیل فوریه مادون قرمز (FTIR) صورت گرفت.
4-2 مطالعه رهایش کورکومین در محیط بافر فسفاتی
بهمنظور بهبود حلالیت و پایداری کورکومین، مخلوط محلولهای تویین-80 به میزان یک دهم درصد وزنی حجمی با بافر فسفات سالین درpH های 5 و همچنین 7/4 برای مطالعه رفتار رهایش CCM@ZIF-8 استفاده شد. حداکثرحلالیت کورکومین در محلول حاوی تویین-80 در حدود 65 میکروگرم بر میلیلیتر برای pH پنج و 69 میکروگرم بر میلیلیتر برای pH هفت و چهاردهم است. 5 میلیگرم CCM@ZIF-8 در 2 میلیلیتر محلول حاوی تویین-80 آماده شد، در کیسه دیالیز مهر و موم شده در بشر حاوی 15 میلی-لیتر بافر و تحت آزمایش در انکوباتور در دمای 37 درجه سانتیگراد تحت نوسان در شیکرانکوباتور قرار داده شد. در فواصل زمانی انتخاب شده در طی 72 ساعت، 1 میلیلیتر از محلول بافر خارج از کیسه دیالیز برداشته شد و با یک میلیلیتر بافر تازه جایگزین شد. مقدار کورکومین آزاد شده با استفاده از تعیین جذب در طول موج 420 نانومتر و با کمک از یک منحنی کالیبراسیون در همان بافر اندازهگیری شد. سپس وزن تجمعی و درصد نسبی کورکومین آزاد شده بهعنوان عملکرد ZIF-8 تهیه شده، مورد محاسبه قرار گرفت.
5-2 ارزیابی نانوذرات تهیه شده در شرایط برون تن
1-5-2 ردههای سلولی
در این تحقیق برای ارزیابی اثر ضدسرطانی نانوذرات تهیه شده در شرایط برونتن، ردههای سلولی PC3 و ATCC CRL-4001 مورد استفاده قرار گرفتند. رده سلولهای انسانی با منشا بافت سرطان پروستات PC3 و رده سلولیهای انسانی با بافت منشا فیبروبلاستATCC CRL-4001 (بهعنوان سلول غیرسرطانی) میباشد که هر دوی آنها منشا اپیتلیالی دارند که از انستیتو پاستور خریداری شد.
2-5-2 کشت سلولها
سلولهای PC3 و فیبروبلاست در فلاسک حاوی محیط کشت DMEM،10% سرم جنین گاوی، پنی سیلین G 100 واحد بر میلیلیتر و استرپتومایسین 100 میلی گرم بر میلی لیتر کشت داده شد. فلاسک حاوی سلولها برای رشد، داخل انکوباتور کشت سلولی و در شرایط دمای 37 درجه سانتیگراد و رطوبت 95% و دی اکسید کربن 5% قرارداده شده است (10).
3-5-2 آزمون سنجش میزان سمیت سلولی با روش MTT
جهت کنترل وضعیت سلولها در محیط کشت، میزان بقا و همچنین بررسی وضعیت سلولها بعد از تیمارهای مختلف دارویی از روش¬های مختلفی استفاده می¬شود که یکی از این روشها تست MTT میباشد. آزمایش MTTیک روش رنگ سنجی است که بر اساس احیا شدن و شکسته شدن کریستالهای زرد رنگ تترازولیوم بوسیله آنزیم سوکسینات دهیدروژناز موجود در میتوکندری فعال سلولهای زنده و تشکیل کریستالهای آبی رنگ نامحلول انجام می¬شود. بهمنظور بررسی میزان اثر سایتوتوکسیسیتی نانوذرات در محیط برون تن، پس از کشت ردههای سلولی مورد نظر و رسیدن به تراکم مناسب سلولی، سلول ها در پلیت 96 خانهای به ازای هر خانه 103×5 سلول کاشته شد و یک روز پس از کشت، سلولها با غلظتهای مختلفی (1، 5، 10، 20، 40 و 80 و 100 میکروگرم در میلی لیتر) تیمار شدند از نانوذرات حاوی داروی کورکومین، نانوذرات بدون داروی کورکومین، داروی کورکومین بهعنوان کنترل مثبت و محیط کشت بدون دارو بهعنوان کنترل منفی تیمار شدند. سپس 0/5 میلیگرم بر میلیلیتر محلول MTT به هر چاهک اضافه شد و به مدت 2 تا 4 ساعت انکوبه شد. سپس چاهکها با PBS شستشو داده شد تا MTT غیر واکنشی حذف شود. بعد از آن، برای حذف کردن بلورهای فورمازان، DMSO به هر چاهک اضافه شد. سپس چگالی اپتیکی نمونهها بر روی یک صفحه ELISA اندازهگیری شد. تراکم نوری محلول حاصل با استفاده از دستگاه اسپکتروفتومتر در طول موج ۵٧0 نانومتر اندازهگیری شد. پر واضح است که هرچه میزان جذب خوانده شده نسبت به حالت کنترل کمتر باشد میتوان نتیجه گرفت که تعداد سلولهای زنده کم شده و مهار رشد بیشتری صورت گرفته است. نتایج حاصل از تست MTT پس از 24 و 48 ساعت از تیمار سلول¬ها بررسی شد. این آزمایش سه بار مورد تکرار قرار گرفت.
تجزیه و تحلیل آماری
داده¬ها به صورت عدد متوسط انحراف از معیار گزارش شده-اند. تفاوتها از طریق آزمون تحلیل واریانس (Analysis of variance (ANOVA))با استفاده از نرم افزار SPSS version 16 مقایسه و وجود یا عدم وجود تفاوت معنیدار بین آنها مشخص شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی کرمانشاه تایید شده است (IR.KUMS.REC.1397.1052).
نتایج
1-4 بررسی خصوصیات فیزیکوشیمیایی نانوذرات
بهمنظور تعیین حدودی اندازه نانوذرات از آنالیز DLS استفاده شد. در این آنالیز شعاع هیدرودینامیکی نانوذرات و شاخص پراکندگی اندازه آنها (PDI) به دست آمد. نتایج به دست آمده نشان داد که نانوذرات دارای شعاع هیدرودینامیکی 216 نانومتر بوده و شاخص پراکندگی اندازه ذرات 0/247 بود که بسیار مناسب بوده و نشان دهنده سنتز نانوذرات همگن و با اندازه یکنواخت است.این نانوذرات اندازه مطلوب برای اهداف دارورسانی دارند. برای بررسی سایز دقیق نانوذرات از دستگاه میکروسکوپ الکترونی استفاده شد.

شکل2: توزیع اندازه ذرات به دست آمده توسط دستگاه زتا سایزر در شرایط بهینه
بهمنظور شناسایی و تعیین ساختار بلوری نانوذرات تولید شده از این آنالیز پراش اشعه ایکس استفاده شد. نمونه¬ها بهصورت پودری و کاملاً خشک بدون هیچ رطوبتی مورد استفاده قرارگرفت. با تغییر دایم زاویه برخورد پرتو ایکس بهنمونه، طیفی با شدت متغیر در برابر زاویه بین پرتو برخوردی بهنمونه و پرتو پراشیده ثبت شد. با استفاده از طیفسنجی پراش پرتو ایکس، تشخیص نوع مواد و همچنین فاز و خصوصیات کریستالی و فاصله بین صفحات کریستالی آن بهدست آمد (11). این آنالیز از طریق پردازش و آنالیز پرتو X بازگشتی از سطح نمونه صورت گرفت. با توجه به الگوی XRD گزارش شده و مقایسه آن با الگوهای استاندارد و مقالات معتبر کورکومین پیکهایی در محدوده 10 تا 30 درجه دارد و در محدودههای 13/82و 25/44 و 26/50 درجه پیکهای شاخص مشاهده میشود (شکل 3 الف). همچنین ساختار کریستالی کورکومین بهعنوان یک داروی طبیعی اثبات شد (12،13). با توجه بهنتایج بهدست آمده از الگوی پراش اشعه ایکس نانوذرات ZIF-8 سنتز شده، خصوصیات کریستالی نانوذرات مشخص شد. با مقایسه پیکهای حاصل شده با منابع استاندارد و مشاهده پیکهای شاخص در ناحیههای هفت تا 32 درجه (شکل 3 ب) شامل پیکهای 7/4 و 16/5 و22/1 میتوان اثبات کرد که نانوذره به درستی سنتز شده است. نتایج این تحقیق با نتایج سایر محققین کاملاً مطابقت دارد (15, 14). در گزارش الگوی پراش اشعه ایکس نانوذرات ZIF-8 بارگذاری شده با کورکومین (شکل 3 ج)، ساختار کریستالی نانوذرات تولید شده مشاهده شد. همچنین با بررسی پیکهای گزارش شده در نواحی 25/44 و26/50 درجه نتیجهگیری میشود که کورکومین در نانوذره بارگذاری شده و ساختار سنتز شده با ساختار استانداردهای گزارش شده در منابع مطابقت دارد. همچنین اثبات شد که با قرار گرفتن کورکومین در نانوذره تغییری در ساختار آن مشاهده نشده و پیکهای موجود در نواحی 7/4 و 16/5 و 22 این نتیجه را بیان میکنند (16). با توجه به نتایج حاصل از میکروسکوپ الکترونی روبشی (شکل4) و تعیین سایز نانوذره توسط نرمافزار ImageJ، اندازه میانگین ذرات حدودا بین 120-110 نانومتر میباشد و میتوان نتیجه گرفت که پراکندگی سایز ذرات مناسب بوده و از اختلاف اندازه کمی برخودارند. باتوجه به نتایج حاصل از میکروسکوپ الکترونی عبوری (شکل 5) نانوذرات دوازده وجهی هستند و از گستره توزیع مناسبی برخوردارند. با استفاده از نرمافزارImageJ اندازه نانوذرات در تصویر بهدست آمد که متوسط اندازه نانوذره ZIF-8 تقریباً برابر با60-80 نانومتر (شکل 8 الف) و اندازه نانوذره حاوی کورکومین CCM@NZIF-8 تقریباً برابر با 120-110 نانومتر (شکل 5 ب) است.

شکل 3: الگوی پراش اشعه ایکس: الف)کورکومین ب) نانوذرات ZIF-8 ج) نانوذرات ZIF-8 حاوی کورکومین

شکل 4: تصویرSEM از نانوذرات ZIF- 8 در شرایط بهینه

شکل 5: تصاویرTEM از الف) نانوذره ZIF-8 ب) نانوذرات CCM@NZIF-8 در شرایط بهینه
برای شناسایی کیفی نانوذرات، نوع گروههای عاملی و پیوندهای موجود در مولکولهای آن، طیف مادون قرمز نمونه تهیه شد و با مراجعه به جداول مربوطه که موقعیت ارتعاش پیوندهای مختلف و یا طیف IR اجسام را نشان میدهند، عدد موجی گروهها و پیوندها شناسایی شد. بهمنظور اطمینان از بارگیری دارو در نانوذرات، از داروی کورکومین و همچنین نانوذرات همراه دارو و نانوذرات بدون دارو طیف سنجی فروسرخ به عمل آمد و دادههای حاصل از این طیف سنجی با یکدیگر مقایسه گردید. مطلوب است که طیف نانوذرات حاوی داروی کورکومین علاوه بر پیکهای مهم طیف نانوذرات به تنهایی، شاهد پیکهای داروی کورکومین نیز باشیم. پیک موجود در عدد موجی cm-1 3415 در طیف نانوذرات حاوی داروی کورکومین (شکل 6 ج) با پیک cm-13414 طیف کورکومین (شکل 6 الف) مطابقت داشته و مرتبط با هیدروکسیل میباشد. در رابطه با پیک مربوط به طول موج cm-12924 و cm-12854 می¬توان گفت که قابل تطابق با پیک cm-12924 و cm-12852 کورکومین و مرتبط با ارتعاشات کششی C-H آلیفاتیک و آروماتیک میباشد. پیک cm-11616 نانوذرات حاوی دارو قابل تطابق با cm-11622 کورکومین بوده که مربوط به پیکهای دوگانه آلکنهاست. پیکهای مشترک مشاهده شده در طیف فروسرخ نانوذرات حاوی کورکومین و طیفهای فروسرخ کورکومین و نانوذرات ZIF-8 نشاندهنده اثبات بارگذاری کورکومین در نانوذرات است که با مطالعات صورت گرفته توسط تیواری و سینق در سال 2017 همخوانی دارد (17).
2-4 نتایج حاصل از آزمون درصد بارگیری نانوذرات
مقدار اولیه داروی به کار رفته پنج میلیگرم میباشد و مقدار داروی بارگذاری نشده که از طریق بهدست آوردن جذب محلول رونشین و قرار دادن در رابطه حاصل از نمودار کالیبراسیون بهدست آمد برابر با 1/4 میلیگرم میباشد درنتیجه 3/6 میلیگرم از دارو بارگیری شد که درصد بارگیری با قرار دادن در فرمول مذکور، 72% بهدست آمد. درصد بارگیری در نانوذرات بیانگر میزان داروی به دام افتاده در نانوحاملها میباشد .بهمنظور تعیین مقدار دارو در فرآیند درصد بارگیری و بررسی رهش، ابتدا منحنی استاندارد دارو تهیه شد:
3-4 بررسی میزان رهش دارو از نانوذرات
1-3-4 رسم نمودار کالیبراسیون در دو محیط بافری حاوی تویین-80 با Phهای 5 و7/4 برای سنجش مقدار دارو آزادساز شده، دو نمودار کالیبراسیون با مقدار مشخص از غلظتهای مختلف کورکومین در pH های 5 و7/4 رسم شد و میزان جذب آنها توسط دستگاه اسپکتروفتومتری اندازه گرفته شد: طی 72 ساعت در فاصلههای زمانی مشخص از محلول دیالیز شده نمونه برداری انجام گرفت. از نمونهها طیف UV گرفته شد و با استفاده از نمودار کالیبراسیون دارو، غلظت داروی آزادشده در هر زمان مشخص و رهایش کورکومین به صورت نمودار رسم شد.
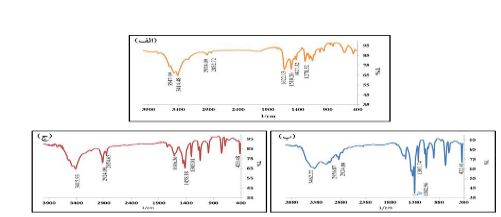
شکل 6: طیف FTIR از الف) کورکومین ب) نانوذرات ZIF-8 ج) نانوذرات ZIF-8 حاوی کورکومین
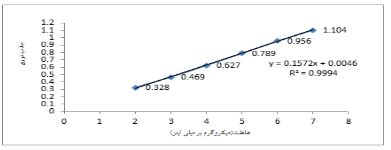
شکل 7: نمودار کالیبراسیون داروی کورکومین

شکل 8: نمودار کالیبراسیون کورکومین در محیط بافر فسفات سالین و تویین-80 در pH=5
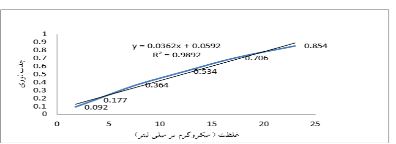
شکل 9: نمودار کالیبراسیون کورکومین در محیط بافر فسفات سالین و تویین-80 در 4/7 =pH

شکل 10: منحنی درجه صفر رهش دارو از محلول نانوذرات بر حسب زمان
4-4 بررسی نتایج حاصل از آزمایشات برون تن
در بررسیهای برونتن، فعالیت سایتوتوکسیک نانوذرات بارگذاری شده با کورکومین، نانوذرات فاقد کورکومین و داروی کورکومین به روش MTT در رده سلولهای سالم و سرطانی طی 24 تا 48 ساعت بهصورت جداگانه مورد مطالعه قرار گرفتند (شکل 11). با مقایسه نتایج نمودارهای درصد زنده-مانی سلولهای سالم و سرطانی میتوان نتیجه گرفت که اثر کشندگی نانوذرات حاوی کورکومین بسیار بیشتر از اثر کشندگی کورکومین و نانوذره به تنهایی بود. همچنین با توجه به طراحی سیستم حساس به pH بر پایه نانوذرات چارچوب فلز-آلی MOF حاوی کورکومین و با توجه به اسیدی بودن محیط اطراف سلولهای سرطانی و رهایش بیشتر دارو در این محیط، درصد مرگ سلولهای سرطانی نسبت بهسلولهای سالم بیشتر بود. در واقع با توجه به عملکرد نانوذرات حاوی کورکومین در سلولهای سرطانی و سالم تیمار شده با نانوذرات حاوی کورکومین و بالاتر بودن عملکرد این نانوذرات در سلولهای سرطانی نشان از طراحی و سنتز صحیح سیستم دارورسانی حساس به pH میباشد. بنابراین برای استفاده از این سامانه میتوان از غلظتهایی از نانوذره حاوی کورکومین استفاده کرد که برای سلولهای فیبروبلاست امنتر باشد ولی برای سلولهای سرطانی کشندگی بالاتری دارد. همچنین میتوان نتیجه گرفت نانوذرات حاوی کورکومین اثرات ضد سرطانی یکدیگر را افزایش میدهند یا به عبارتی اثر هم افزایی را اعمال میکنند.
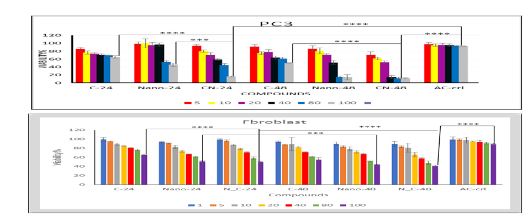
شکل 11: نمودارهای درصد حیات سلولهای تیمار شده با محلول نانوذرات حاوی دارو، نانوذرات فاقد دارو و داروی کورکومین با غلظتهای مختلف بر روی الف) رده سلولهای سالم فیبروبلاست ب) رده سلولهای PC3 (p˂ 0.0001).
بحث
امروزه استفاده از فناوری نانو بهمنظور درمان و تشخیص انواع بیماریها از جمله سرطانها بسیار مورد توجه قرار گرفته است. فناوری نانو بر روشهای نوین و جایگزین حمل و ارائه داروها و افزایش کارآمدی آنها در درمان سرطان تمرکز دارد. دارورسانی یکی از عرصههای مهم تحقیق در دنیا و شامل بخشهای مختلفی همچون تنظیم خواص فیزیکوشیمیایی عوامل موثر موجود در داروها، رسانش هدفمند داروها به عضو مورد نظر، کنترل سینتیکی رهایش دارو و طراحی فرمول مناسب دارویی گردیده است. امروزه یکی از بیشترین حوزههای تحقیقاتی فعال برای سیستمهای دارورسانی، توانایی کپسوله کردن و آزادسازی داروها با پاسخ به یک محیط اسیدی میباشد. با توجه به اینکه pH در نواحی بافت تومور دارای اسیدیته بیشتری از خون و بافتهای دیگر است بنابراین با استفاده از نانوحاملهای حساس به pH میتوان دارو را بهطور هدفمند به سلولهای سرطانی تحویل داد. نانوذرات متخلخل کاندیدهای خوبی برای سیستمهای دارورسانی حساس به pH هستند. دارورسانی در شرایط برونتن نانوذرات باید زیستسازگار باشد که در مطالعات انجام شده توسط هونگمین و هوکسین در سال 2021 به آن اشاره شده است. نانوذرات چارچوب فلز-آلی بهدلیل داشتن حفرات با اندازه بزرگ، سطح ویژه زیاد، جذب انتخابپذیر مولکولهای کوچک امروزه در دارورسانی مورد توجه قرار گرفتهاند (18). زئولیتیک ایمیدازولات-8 زیردستهای از MOF میباشند که از یونهای زینک و 2-متیل ایمیدازول تشکیل شده است. در pH های پنج یا شش پیوند بین یونهای ایمیدازولات-روی از بین می-رود و باعث آزاد شدن دارو میگردد. در این پروژه خصوصیات ظرفیت بالا و زیست سازگاری نانوذرات به اثبات رسیده است و با انجام محاسبات مقدار 72% بارگذاری دارو مشاهده شد که در مطالعات مشابه نیز این مقادیر به نتایج حاصل از پژوهش انجام گرفته بسیار نزدیک است. واسگونسلوس و همکاران در سال 2012 داروی ضد سرطان دوکسوروبیسین را درون نانوذره ZIF-8 بارگذاری کرده و گزارش کردهاند که بهدلیل بزرگ بودن اندازه ذره¬ای داروی دوکسوروبیسین 49% از دارو درون نانوذره بارگذاری شده که به نسبت نانوذرات متخلل دیگر میزان خوبی میباشد پس این مطالعات ظرفیت بالای نانوذرات زئولیتیک را به درستی اثبات میکند (19). ساختارهای ZIF-8 در محیط اسیدی با از بین رفتن پیوند بین روی و یون ایمیدازول باعث آزاد شدن دارو میشود. در این تحقیق میزان آزادسازی دارو در دو محیط بافر فسفات سالین همراه تویین-80 در دو pH مختلف پنج و 7/4 صورت گرفت بهطوریکه در pH اسیدی حدود از80% رهایش دارو گزارش شد و در pH بافری رهایش دارو کمتر از 20% در طی 72 ساعت بود. مطالعات مشابهی نیز درستی این موضوع را ثابت کردهاند بهطوریکه در مطالعات صورت گرفته توسط چون ایی و چاو در سال 2012 میزان رهایشFU-5 را در دو محیط اسیدی و بافری اندازهگیری شده که در محیط اسیدی بهمدت 12 ساعت بیشتر از 80% دارو آزاد شده بود و در محیط بافر فسفات سالین تنها 17% دارو آزاد شده بود (20). در بررسی نتایج آزمایشات برونتن بر روی ردههای سلولی فیبروبلاست و PC3 مشاهده شد که نانوذرات سنتز شده حاوی کورکومین اثرات کشندگی به مراتب بیشتری بر روی سلولهای سرطانی نسبت به سلولهای سالم داشتند.
نتیجهگیری
بهدلیل شرایط خاص بیماری سرطان و توجه به مشکلات درمان دارویی و عوارض جانبی جدی داروهای ضد سرطان بر بافتهای تکثیر شونده بدن مانند سلولهای ایمنی و امکان ایجاد مقاومتهای دارویی، رسانش هدفمند داروها به بافت¬ها و سلولهای سرطانی مهمترین چالش مبارزه با این بیماری است. در این تحقیق سعی شد که سامانه دارورسان حساس به pH بر پایه نانوذرات چارچوب فلز-آلی MOF حاوی کورکومین جهت درمان سرطان، طراحی و ساخته شود. نانوذرات حاصل به درستی سنتز و در تست¬های گوناگون ظرفیت بالایی در درمان سرطان پروستات و حداقل آسیب به سلولهای سالم از خود نشان دادند. میتوان گفت استفاده از این فرمولاسیون جهت دارورسانی هدفمند سرطان نه تنها عوارض داروهای ضد سرطان را کم میکند بلکه اثر بخشی آنها را افزایش داده و همچنین میتواند برای دارورسانی داروهای کم محلول و یا نامحلول در محیطهای بیولوژیکی مورد استفاده قرار گیرد. امید است با پژوهشهای بیشتر و بررسی دقیقتر جزئیات این ریزذرات بتوان در آینده نه چندان دور از آنان در مصارف درمانی استفاده کرد.
سپاسگزاری
این تحقیق، حاصل طرح مصوب در دانشگاه علوم پزشکی کرمانشاه میباشد. از کلیه کسانی که به نوعی در تهیه این مقاله مشارکت داشتهاند تقدیر و تشکر به عمل میآید.
حامی مالی: دانشگاه علوم پزشکی کرمانشاه
تعارض در منافع: وجود ندارد.
بیماری سرطان دومین بیماری کشنده دنیا میباشد که در سالهای اخیر بهویژه با افزایش استفاده از مواد شیمیایی و دیگر عوامل جهشزا و از طرف دیگر افزایش متوسط طول عمر بهدلیل پیشرفتهای پزشکی و در نتیجه شیوع بیش از پیش آن در میان جوامع مختلف، تبدیل به یکی از بزرگترین چالشهای علم پزشکی دنیا شده است (1). بهدلیل شرایط خاص این بیماری و توجه به این مطلب که داروهای مورد استفاده در کنترل این بیماری عوارض جدی و بسیاری بر بافتهای تکثیر شونده بدن مانند سلولهای ایمنی دارند و نیز اینکه تکثیر سریع بههمراه جهشهای فراوان در بافتهای توموری موجبات ایجاد مقاومت دارویی را فراهم میکند رسانش هدفمند داروها به بافتها و سلولهای سرطانی مهمترین چالش مبارزه با این بیماری است (2). داروهای زیادی بسته به نوع و مرحله بیماری برای درمان سرطانهای مختلف بهکار گرفته میشوند که در بسیاری از موارد استفاده یک داروی بسیار کارآمد بهدلیل خصوصیاتی چون آبگریز بودن یا ناپایداری در محیط بدن، ناممکن یا بسیار مشکل شده و همین معایب بازدهی دارو در درمان بیماری را بهشدت تحت تأثیر قرار میدهد. بهمنظور رفع این مشکلات سیستمهای دارو رسانی بسیاری توسط گروههای تحقیقاتی مختلف به این منظور ارائه و تعدادی از آنها نیز به مرحله تجاری رسیده یا در مراحل آزمایشهای کلینیکی هستند (3). با توسعه سامانههای جدید دارورسانی، مشکلات داروهای موجود هم چون زیست فراهمی پایین، انتقال ضعیف از غشاءهای زیستی، نامحلول بودن در آب و یا ناپایداری در محیطهای زیستی و همچنین مقاومتهای دارویی کاهش یافته است. در زمینه دارورسانی هدفمند به سلولهای سرطانی، سامانههای دارورسانی حساس به pH کاندیدهای مناسبی میباشند. زیرا pH در نواحی بافت تومور (6-5/5) دارای اسیدیته بیشتری از خون و بافتهای دیگر (7/4) است. این سیستمها، دارو را در محل تومور بیشتر و سریعتر از بافتهای معمولی اطراف آن که دارای pH فیزیولوژیک7/4 هستند آزاد میکند. نانوذرات متخلخل برای دارورسانی حساس به pH بسیار مناسبند زیرا نانوذرات توانایی بالایی در عبور از غشاهای سلولی دارند و همچنین توسط سلولهای سرطانی بازجذب میشوند. علاوه بر این مساحت سطح ویژه جزء مهمترین فاکتورهای ارزیابی میزان ظرفیت حفره است و با تعداد مولکولهایی که تماس مستقیم دارند در ارتباط میباشد بههمین دلیل در بحث دارورسانی مساحت سطح ویژه برای بارگذاری داروها از اهمیت زیادی برخوردار است (4). چارچوب فلز-آلی MOF به دلیل داشتن حفرات با اندازه بزرگ، سطح ویژه زیاد، جذب انتخابپذیر مولکولهای کوچک، امروزه در دارورسانی مورد توجه قرار گرفتهاند. این نانوذرات زیست سازگار بوده و در محیطهای اسیدی دارو را آزاد میکنند اما یکی از معایب آنها این است که در محیطهای آبی و فیزیولوژیکی بدن ناپایدار میباشند (5). نانوذرات ZIF-8دستهای ازMOFها هستند که نانو ساختارهای متخلخل و زیست سازگارند و در محیط فیزیولوژیکی بدن پایدار میباشند و دارای ظرفیت بالایی برای بارگذاری دارو هستند. ساختارهای ZIF-8 در محیط اسیدی با از بین رفتن پیوند بین روی و یون ایمیدازول باعث آزاد شدن دارو میشود (6). در این پروژه از این نانوذره برای بارگیری و حمل داروی کورکومین استفاده شده است. کورکومین یک ترکیب پلیفنل زرد رنگ، آبگریز و با وزن مولکولی پایین میباشد (شکل 1). این ماده از ریزومهای گیاه کورکوما لانگا (Curcuma Loga) استخراج میشود (7). این گیاه از خانواده زنجبیل و بومی مناطق جنوب و جنوب شرق آسیا میباشد. بخش اعظم پودر استخراج شده که در زبان فارسی به آن زردچوبه گفته میشود را کورکومین تشکیل میدهد. زردچوبه از ریزوم این گیاه مشتق میشود و در طول تاریخ در طب سنتی چین و هند بسیار مورد استفاده قرار میگرفت. در طی مطالعات انجام شده در سال 2015 توسط شانگموگان و همکارانش کورکومین دارای خواص بسیار زیادی میباشد از جمله خواص آنتیاکسیدانی، ضدالتهابی، ضدکارسینوم و ضدتوموری و همچنین دارای خواص هپاتوپروتکتیو و کاردیوپروتکتیو میباشد (8). کورکومین عامل اصلی رنگ زرد و طلایی زردچوبه میباشد و همچنین بهعنوان مسئول بسیاری از خواص زردچوبه تشخیص داده شده است.

شکل 1: ساختار ترکیب کورکوکین
روش بررسی
1-2 سنتز نانو ذرات ZIF-8 با استفاده از روش همرسوبی در حلال آلی
نانوذرات کریستالی ZIF-8 از طریق افزودن محلول آبی Zn(NO3)2•6H2O به محلول آبی 2-متیل ایمیدازول در دمای اتاق و همزدن محلول بهمدت پنج دقیقه تهیه شدند. قبل از مخلوط کردن، دو محلول فیلتر و سپس به هم اضافه می¬شوند. 1/17 گرم نیترات روی درون بشر 20 میلیلیتری ریخته شد سپس 8 میلی لیتر آب مقطر را به بشر اضافه کرده و روی استیرر در دما و فشار اتاق گذاشته شد تا پودر کاملاً حل شود. سپس در یک بشر دیگر، 2/27 گرم 2-متیل ایمیدازول را که با ترازو حساس وزن شده را نیز در بشر ریخته و 8 میلیلیتر آب مقطر بهبشر اضافه شد و روی استیرر در دما و فشار اتاق قرار گرفت تا پودر کاملاً حل شد. باید توجه داشت که حل شدن 2-متیل ایمیدازول زمانبر میباشد. بعد از حل شدن کامل، محلول نیترات روی را با سمپلر بهصورت قطره قطره به محلول 2-متیل ایمیدازول که روی استیرر قرار داشت با دور نسبتا سریع در حال استیرر بود، اضافه شد. رنگ شیری حاصل نشان دهنده تشکیل نانوذره است. محلول به مدت پنج دقیقه بر روی استیرر همزده شد. بهمنظور جمعآوری نانوذرات، محلول با سرعت rpm6500 بهمدت 10 دقیقه سانتریفیوژ شد و رسوب حاصل سه بار با آب مقطر شستشو داده شد. سپس نانوذرات سنتز شده، یک شب در دمای 65 درجه سانتیگراد در آون قرار گرفت تا کاملاً خشک شده و مورد خصوصیتیابی قرار گرفتند.
2-2 کپسوله کردن دارو درZIF-8 به صورت درجا
150 میلیگرم نیترات روی در 5 میلیلیتر آب مقطر حل شد، سپس در بشر دیگر330 میلیگرم از2-متیلایمیدازول و 5 میلیگرم کورکومین در 10 سی¬سی متانول حل شد. وقتی محلول 2-متیل¬ایمیدازول و کورکومین در حال هم¬خوردن بود، محلول نیترات روی به آن اضافه شد که بعد از مدت 10 دقیقه رنگ نارنجی روشن محلول به نارنجی کدر تغییر یافت این تغییر رنگ نشان¬دهنده تشکیل نانوذرات ZIF-8 حاوی کورکومین (CCM@ZIF-8) است. محلول با سرعت rpm8000 بهمدت 15 دقیقه سانتریفیوژ شد سپس نمونه جمعآوری شده برای جدا کردن ترکیبات واکنش نداده سه بار با متانول شسته شد. بعد از خشک شدن برای بررسی رهایش دارو و خصوصیتیابی از آن استفاده گردید.
2-3 محاسبه درصد بارگیری دارو در نانوذرات
درصد بارگیری عبارت است از مقدار ماده فعال یافت شده اعم از داروها، اسانسها، پروتئینها و سایر اجزای قابل شناسایی در فرمولاسیون نسبت به مقدار آنها در ابتدای شروع واکنش که محاسبه آن از طریق فرمول زیر انجام میشود:
EE% = (Wt /Wi) ×100
که در آن Wt مقدار ماده ترکیب شده در فرمولاسیون و Wi مقدار کل مادهای است که از ابتدا جهت ترکیب در فرمولاسیون مصرف میشود. این دو مقدار میتوانند به روشهای اسپکتروسکوپی یا کروماتوگرافی اندازهگیری شوند (9). بهمنظور محاسبه درصد بارگیری دارو از رونشین بهدست آمده بعد از سانتریفیوژ استفاده گردید و مقدار جذب آن در دستگاه اسپکتروفتومتری در طول موج 420 نانومتر بررسی شد و با قرار دادن در نمودار کالیبراسیون، مقدار داروی بارگیری شده با استفاده از فرمول فوق محاسبه گردید.
3-2 بررسی خصوصیات فیزیکوشیمیایی نانوذرات
بهمنظور بررسی خصوصیات فیزیکی، شیمیایی سامانه دارویی مورد استفاده در این تحقیق، آنالیزهای مختلفی انجام شد. اندازه ذره¬ای و توزیع نانوذرات توسط دستگاه DLS اندازهگیری شد. ساختار کریستالی نانوذره توسط داده¬های دستگاه پراش اشعه ایکس (XRD) بررسی شد. همچنین مورفولوژی و سایز دقیق نانوذرات با استفاده از میکروسکوپ الکترونی روبشی (SEM) و میکروسکوپ الکترونی عبوری (TEM) بهدست آمد. برای اثبات بارگیری کورکومین در نانوذرات از تست طیفسنجی تبدیل فوریه مادون قرمز (FTIR) صورت گرفت.
4-2 مطالعه رهایش کورکومین در محیط بافر فسفاتی
بهمنظور بهبود حلالیت و پایداری کورکومین، مخلوط محلولهای تویین-80 به میزان یک دهم درصد وزنی حجمی با بافر فسفات سالین درpH های 5 و همچنین 7/4 برای مطالعه رفتار رهایش CCM@ZIF-8 استفاده شد. حداکثرحلالیت کورکومین در محلول حاوی تویین-80 در حدود 65 میکروگرم بر میلیلیتر برای pH پنج و 69 میکروگرم بر میلیلیتر برای pH هفت و چهاردهم است. 5 میلیگرم CCM@ZIF-8 در 2 میلیلیتر محلول حاوی تویین-80 آماده شد، در کیسه دیالیز مهر و موم شده در بشر حاوی 15 میلی-لیتر بافر و تحت آزمایش در انکوباتور در دمای 37 درجه سانتیگراد تحت نوسان در شیکرانکوباتور قرار داده شد. در فواصل زمانی انتخاب شده در طی 72 ساعت، 1 میلیلیتر از محلول بافر خارج از کیسه دیالیز برداشته شد و با یک میلیلیتر بافر تازه جایگزین شد. مقدار کورکومین آزاد شده با استفاده از تعیین جذب در طول موج 420 نانومتر و با کمک از یک منحنی کالیبراسیون در همان بافر اندازهگیری شد. سپس وزن تجمعی و درصد نسبی کورکومین آزاد شده بهعنوان عملکرد ZIF-8 تهیه شده، مورد محاسبه قرار گرفت.
5-2 ارزیابی نانوذرات تهیه شده در شرایط برون تن
1-5-2 ردههای سلولی
در این تحقیق برای ارزیابی اثر ضدسرطانی نانوذرات تهیه شده در شرایط برونتن، ردههای سلولی PC3 و ATCC CRL-4001 مورد استفاده قرار گرفتند. رده سلولهای انسانی با منشا بافت سرطان پروستات PC3 و رده سلولیهای انسانی با بافت منشا فیبروبلاستATCC CRL-4001 (بهعنوان سلول غیرسرطانی) میباشد که هر دوی آنها منشا اپیتلیالی دارند که از انستیتو پاستور خریداری شد.
2-5-2 کشت سلولها
سلولهای PC3 و فیبروبلاست در فلاسک حاوی محیط کشت DMEM،10% سرم جنین گاوی، پنی سیلین G 100 واحد بر میلیلیتر و استرپتومایسین 100 میلی گرم بر میلی لیتر کشت داده شد. فلاسک حاوی سلولها برای رشد، داخل انکوباتور کشت سلولی و در شرایط دمای 37 درجه سانتیگراد و رطوبت 95% و دی اکسید کربن 5% قرارداده شده است (10).
3-5-2 آزمون سنجش میزان سمیت سلولی با روش MTT
جهت کنترل وضعیت سلولها در محیط کشت، میزان بقا و همچنین بررسی وضعیت سلولها بعد از تیمارهای مختلف دارویی از روش¬های مختلفی استفاده می¬شود که یکی از این روشها تست MTT میباشد. آزمایش MTTیک روش رنگ سنجی است که بر اساس احیا شدن و شکسته شدن کریستالهای زرد رنگ تترازولیوم بوسیله آنزیم سوکسینات دهیدروژناز موجود در میتوکندری فعال سلولهای زنده و تشکیل کریستالهای آبی رنگ نامحلول انجام می¬شود. بهمنظور بررسی میزان اثر سایتوتوکسیسیتی نانوذرات در محیط برون تن، پس از کشت ردههای سلولی مورد نظر و رسیدن به تراکم مناسب سلولی، سلول ها در پلیت 96 خانهای به ازای هر خانه 103×5 سلول کاشته شد و یک روز پس از کشت، سلولها با غلظتهای مختلفی (1، 5، 10، 20، 40 و 80 و 100 میکروگرم در میلی لیتر) تیمار شدند از نانوذرات حاوی داروی کورکومین، نانوذرات بدون داروی کورکومین، داروی کورکومین بهعنوان کنترل مثبت و محیط کشت بدون دارو بهعنوان کنترل منفی تیمار شدند. سپس 0/5 میلیگرم بر میلیلیتر محلول MTT به هر چاهک اضافه شد و به مدت 2 تا 4 ساعت انکوبه شد. سپس چاهکها با PBS شستشو داده شد تا MTT غیر واکنشی حذف شود. بعد از آن، برای حذف کردن بلورهای فورمازان، DMSO به هر چاهک اضافه شد. سپس چگالی اپتیکی نمونهها بر روی یک صفحه ELISA اندازهگیری شد. تراکم نوری محلول حاصل با استفاده از دستگاه اسپکتروفتومتر در طول موج ۵٧0 نانومتر اندازهگیری شد. پر واضح است که هرچه میزان جذب خوانده شده نسبت به حالت کنترل کمتر باشد میتوان نتیجه گرفت که تعداد سلولهای زنده کم شده و مهار رشد بیشتری صورت گرفته است. نتایج حاصل از تست MTT پس از 24 و 48 ساعت از تیمار سلول¬ها بررسی شد. این آزمایش سه بار مورد تکرار قرار گرفت.
تجزیه و تحلیل آماری
داده¬ها به صورت عدد متوسط انحراف از معیار گزارش شده-اند. تفاوتها از طریق آزمون تحلیل واریانس (Analysis of variance (ANOVA))با استفاده از نرم افزار SPSS version 16 مقایسه و وجود یا عدم وجود تفاوت معنیدار بین آنها مشخص شد.
ملاحظات اخلاقی
پروپوزال این تحقیق توسط دانشگاه علوم پزشکی کرمانشاه تایید شده است (IR.KUMS.REC.1397.1052).
نتایج
1-4 بررسی خصوصیات فیزیکوشیمیایی نانوذرات
بهمنظور تعیین حدودی اندازه نانوذرات از آنالیز DLS استفاده شد. در این آنالیز شعاع هیدرودینامیکی نانوذرات و شاخص پراکندگی اندازه آنها (PDI) به دست آمد. نتایج به دست آمده نشان داد که نانوذرات دارای شعاع هیدرودینامیکی 216 نانومتر بوده و شاخص پراکندگی اندازه ذرات 0/247 بود که بسیار مناسب بوده و نشان دهنده سنتز نانوذرات همگن و با اندازه یکنواخت است.این نانوذرات اندازه مطلوب برای اهداف دارورسانی دارند. برای بررسی سایز دقیق نانوذرات از دستگاه میکروسکوپ الکترونی استفاده شد.

شکل2: توزیع اندازه ذرات به دست آمده توسط دستگاه زتا سایزر در شرایط بهینه
بهمنظور شناسایی و تعیین ساختار بلوری نانوذرات تولید شده از این آنالیز پراش اشعه ایکس استفاده شد. نمونه¬ها بهصورت پودری و کاملاً خشک بدون هیچ رطوبتی مورد استفاده قرارگرفت. با تغییر دایم زاویه برخورد پرتو ایکس بهنمونه، طیفی با شدت متغیر در برابر زاویه بین پرتو برخوردی بهنمونه و پرتو پراشیده ثبت شد. با استفاده از طیفسنجی پراش پرتو ایکس، تشخیص نوع مواد و همچنین فاز و خصوصیات کریستالی و فاصله بین صفحات کریستالی آن بهدست آمد (11). این آنالیز از طریق پردازش و آنالیز پرتو X بازگشتی از سطح نمونه صورت گرفت. با توجه به الگوی XRD گزارش شده و مقایسه آن با الگوهای استاندارد و مقالات معتبر کورکومین پیکهایی در محدوده 10 تا 30 درجه دارد و در محدودههای 13/82و 25/44 و 26/50 درجه پیکهای شاخص مشاهده میشود (شکل 3 الف). همچنین ساختار کریستالی کورکومین بهعنوان یک داروی طبیعی اثبات شد (12،13). با توجه بهنتایج بهدست آمده از الگوی پراش اشعه ایکس نانوذرات ZIF-8 سنتز شده، خصوصیات کریستالی نانوذرات مشخص شد. با مقایسه پیکهای حاصل شده با منابع استاندارد و مشاهده پیکهای شاخص در ناحیههای هفت تا 32 درجه (شکل 3 ب) شامل پیکهای 7/4 و 16/5 و22/1 میتوان اثبات کرد که نانوذره به درستی سنتز شده است. نتایج این تحقیق با نتایج سایر محققین کاملاً مطابقت دارد (15, 14). در گزارش الگوی پراش اشعه ایکس نانوذرات ZIF-8 بارگذاری شده با کورکومین (شکل 3 ج)، ساختار کریستالی نانوذرات تولید شده مشاهده شد. همچنین با بررسی پیکهای گزارش شده در نواحی 25/44 و26/50 درجه نتیجهگیری میشود که کورکومین در نانوذره بارگذاری شده و ساختار سنتز شده با ساختار استانداردهای گزارش شده در منابع مطابقت دارد. همچنین اثبات شد که با قرار گرفتن کورکومین در نانوذره تغییری در ساختار آن مشاهده نشده و پیکهای موجود در نواحی 7/4 و 16/5 و 22 این نتیجه را بیان میکنند (16). با توجه به نتایج حاصل از میکروسکوپ الکترونی روبشی (شکل4) و تعیین سایز نانوذره توسط نرمافزار ImageJ، اندازه میانگین ذرات حدودا بین 120-110 نانومتر میباشد و میتوان نتیجه گرفت که پراکندگی سایز ذرات مناسب بوده و از اختلاف اندازه کمی برخودارند. باتوجه به نتایج حاصل از میکروسکوپ الکترونی عبوری (شکل 5) نانوذرات دوازده وجهی هستند و از گستره توزیع مناسبی برخوردارند. با استفاده از نرمافزارImageJ اندازه نانوذرات در تصویر بهدست آمد که متوسط اندازه نانوذره ZIF-8 تقریباً برابر با60-80 نانومتر (شکل 8 الف) و اندازه نانوذره حاوی کورکومین CCM@NZIF-8 تقریباً برابر با 120-110 نانومتر (شکل 5 ب) است.

شکل 3: الگوی پراش اشعه ایکس: الف)کورکومین ب) نانوذرات ZIF-8 ج) نانوذرات ZIF-8 حاوی کورکومین

شکل 4: تصویرSEM از نانوذرات ZIF- 8 در شرایط بهینه

شکل 5: تصاویرTEM از الف) نانوذره ZIF-8 ب) نانوذرات CCM@NZIF-8 در شرایط بهینه
برای شناسایی کیفی نانوذرات، نوع گروههای عاملی و پیوندهای موجود در مولکولهای آن، طیف مادون قرمز نمونه تهیه شد و با مراجعه به جداول مربوطه که موقعیت ارتعاش پیوندهای مختلف و یا طیف IR اجسام را نشان میدهند، عدد موجی گروهها و پیوندها شناسایی شد. بهمنظور اطمینان از بارگیری دارو در نانوذرات، از داروی کورکومین و همچنین نانوذرات همراه دارو و نانوذرات بدون دارو طیف سنجی فروسرخ به عمل آمد و دادههای حاصل از این طیف سنجی با یکدیگر مقایسه گردید. مطلوب است که طیف نانوذرات حاوی داروی کورکومین علاوه بر پیکهای مهم طیف نانوذرات به تنهایی، شاهد پیکهای داروی کورکومین نیز باشیم. پیک موجود در عدد موجی cm-1 3415 در طیف نانوذرات حاوی داروی کورکومین (شکل 6 ج) با پیک cm-13414 طیف کورکومین (شکل 6 الف) مطابقت داشته و مرتبط با هیدروکسیل میباشد. در رابطه با پیک مربوط به طول موج cm-12924 و cm-12854 می¬توان گفت که قابل تطابق با پیک cm-12924 و cm-12852 کورکومین و مرتبط با ارتعاشات کششی C-H آلیفاتیک و آروماتیک میباشد. پیک cm-11616 نانوذرات حاوی دارو قابل تطابق با cm-11622 کورکومین بوده که مربوط به پیکهای دوگانه آلکنهاست. پیکهای مشترک مشاهده شده در طیف فروسرخ نانوذرات حاوی کورکومین و طیفهای فروسرخ کورکومین و نانوذرات ZIF-8 نشاندهنده اثبات بارگذاری کورکومین در نانوذرات است که با مطالعات صورت گرفته توسط تیواری و سینق در سال 2017 همخوانی دارد (17).
2-4 نتایج حاصل از آزمون درصد بارگیری نانوذرات
مقدار اولیه داروی به کار رفته پنج میلیگرم میباشد و مقدار داروی بارگذاری نشده که از طریق بهدست آوردن جذب محلول رونشین و قرار دادن در رابطه حاصل از نمودار کالیبراسیون بهدست آمد برابر با 1/4 میلیگرم میباشد درنتیجه 3/6 میلیگرم از دارو بارگیری شد که درصد بارگیری با قرار دادن در فرمول مذکور، 72% بهدست آمد. درصد بارگیری در نانوذرات بیانگر میزان داروی به دام افتاده در نانوحاملها میباشد .بهمنظور تعیین مقدار دارو در فرآیند درصد بارگیری و بررسی رهش، ابتدا منحنی استاندارد دارو تهیه شد:
3-4 بررسی میزان رهش دارو از نانوذرات
1-3-4 رسم نمودار کالیبراسیون در دو محیط بافری حاوی تویین-80 با Phهای 5 و7/4 برای سنجش مقدار دارو آزادساز شده، دو نمودار کالیبراسیون با مقدار مشخص از غلظتهای مختلف کورکومین در pH های 5 و7/4 رسم شد و میزان جذب آنها توسط دستگاه اسپکتروفتومتری اندازه گرفته شد: طی 72 ساعت در فاصلههای زمانی مشخص از محلول دیالیز شده نمونه برداری انجام گرفت. از نمونهها طیف UV گرفته شد و با استفاده از نمودار کالیبراسیون دارو، غلظت داروی آزادشده در هر زمان مشخص و رهایش کورکومین به صورت نمودار رسم شد.

شکل 6: طیف FTIR از الف) کورکومین ب) نانوذرات ZIF-8 ج) نانوذرات ZIF-8 حاوی کورکومین

شکل 7: نمودار کالیبراسیون داروی کورکومین

شکل 8: نمودار کالیبراسیون کورکومین در محیط بافر فسفات سالین و تویین-80 در pH=5

شکل 9: نمودار کالیبراسیون کورکومین در محیط بافر فسفات سالین و تویین-80 در 4/7 =pH

شکل 10: منحنی درجه صفر رهش دارو از محلول نانوذرات بر حسب زمان
4-4 بررسی نتایج حاصل از آزمایشات برون تن
در بررسیهای برونتن، فعالیت سایتوتوکسیک نانوذرات بارگذاری شده با کورکومین، نانوذرات فاقد کورکومین و داروی کورکومین به روش MTT در رده سلولهای سالم و سرطانی طی 24 تا 48 ساعت بهصورت جداگانه مورد مطالعه قرار گرفتند (شکل 11). با مقایسه نتایج نمودارهای درصد زنده-مانی سلولهای سالم و سرطانی میتوان نتیجه گرفت که اثر کشندگی نانوذرات حاوی کورکومین بسیار بیشتر از اثر کشندگی کورکومین و نانوذره به تنهایی بود. همچنین با توجه به طراحی سیستم حساس به pH بر پایه نانوذرات چارچوب فلز-آلی MOF حاوی کورکومین و با توجه به اسیدی بودن محیط اطراف سلولهای سرطانی و رهایش بیشتر دارو در این محیط، درصد مرگ سلولهای سرطانی نسبت بهسلولهای سالم بیشتر بود. در واقع با توجه به عملکرد نانوذرات حاوی کورکومین در سلولهای سرطانی و سالم تیمار شده با نانوذرات حاوی کورکومین و بالاتر بودن عملکرد این نانوذرات در سلولهای سرطانی نشان از طراحی و سنتز صحیح سیستم دارورسانی حساس به pH میباشد. بنابراین برای استفاده از این سامانه میتوان از غلظتهایی از نانوذره حاوی کورکومین استفاده کرد که برای سلولهای فیبروبلاست امنتر باشد ولی برای سلولهای سرطانی کشندگی بالاتری دارد. همچنین میتوان نتیجه گرفت نانوذرات حاوی کورکومین اثرات ضد سرطانی یکدیگر را افزایش میدهند یا به عبارتی اثر هم افزایی را اعمال میکنند.

شکل 11: نمودارهای درصد حیات سلولهای تیمار شده با محلول نانوذرات حاوی دارو، نانوذرات فاقد دارو و داروی کورکومین با غلظتهای مختلف بر روی الف) رده سلولهای سالم فیبروبلاست ب) رده سلولهای PC3 (p˂ 0.0001).
بحث
امروزه استفاده از فناوری نانو بهمنظور درمان و تشخیص انواع بیماریها از جمله سرطانها بسیار مورد توجه قرار گرفته است. فناوری نانو بر روشهای نوین و جایگزین حمل و ارائه داروها و افزایش کارآمدی آنها در درمان سرطان تمرکز دارد. دارورسانی یکی از عرصههای مهم تحقیق در دنیا و شامل بخشهای مختلفی همچون تنظیم خواص فیزیکوشیمیایی عوامل موثر موجود در داروها، رسانش هدفمند داروها به عضو مورد نظر، کنترل سینتیکی رهایش دارو و طراحی فرمول مناسب دارویی گردیده است. امروزه یکی از بیشترین حوزههای تحقیقاتی فعال برای سیستمهای دارورسانی، توانایی کپسوله کردن و آزادسازی داروها با پاسخ به یک محیط اسیدی میباشد. با توجه به اینکه pH در نواحی بافت تومور دارای اسیدیته بیشتری از خون و بافتهای دیگر است بنابراین با استفاده از نانوحاملهای حساس به pH میتوان دارو را بهطور هدفمند به سلولهای سرطانی تحویل داد. نانوذرات متخلخل کاندیدهای خوبی برای سیستمهای دارورسانی حساس به pH هستند. دارورسانی در شرایط برونتن نانوذرات باید زیستسازگار باشد که در مطالعات انجام شده توسط هونگمین و هوکسین در سال 2021 به آن اشاره شده است. نانوذرات چارچوب فلز-آلی بهدلیل داشتن حفرات با اندازه بزرگ، سطح ویژه زیاد، جذب انتخابپذیر مولکولهای کوچک امروزه در دارورسانی مورد توجه قرار گرفتهاند (18). زئولیتیک ایمیدازولات-8 زیردستهای از MOF میباشند که از یونهای زینک و 2-متیل ایمیدازول تشکیل شده است. در pH های پنج یا شش پیوند بین یونهای ایمیدازولات-روی از بین می-رود و باعث آزاد شدن دارو میگردد. در این پروژه خصوصیات ظرفیت بالا و زیست سازگاری نانوذرات به اثبات رسیده است و با انجام محاسبات مقدار 72% بارگذاری دارو مشاهده شد که در مطالعات مشابه نیز این مقادیر به نتایج حاصل از پژوهش انجام گرفته بسیار نزدیک است. واسگونسلوس و همکاران در سال 2012 داروی ضد سرطان دوکسوروبیسین را درون نانوذره ZIF-8 بارگذاری کرده و گزارش کردهاند که بهدلیل بزرگ بودن اندازه ذره¬ای داروی دوکسوروبیسین 49% از دارو درون نانوذره بارگذاری شده که به نسبت نانوذرات متخلل دیگر میزان خوبی میباشد پس این مطالعات ظرفیت بالای نانوذرات زئولیتیک را به درستی اثبات میکند (19). ساختارهای ZIF-8 در محیط اسیدی با از بین رفتن پیوند بین روی و یون ایمیدازول باعث آزاد شدن دارو میشود. در این تحقیق میزان آزادسازی دارو در دو محیط بافر فسفات سالین همراه تویین-80 در دو pH مختلف پنج و 7/4 صورت گرفت بهطوریکه در pH اسیدی حدود از80% رهایش دارو گزارش شد و در pH بافری رهایش دارو کمتر از 20% در طی 72 ساعت بود. مطالعات مشابهی نیز درستی این موضوع را ثابت کردهاند بهطوریکه در مطالعات صورت گرفته توسط چون ایی و چاو در سال 2012 میزان رهایشFU-5 را در دو محیط اسیدی و بافری اندازهگیری شده که در محیط اسیدی بهمدت 12 ساعت بیشتر از 80% دارو آزاد شده بود و در محیط بافر فسفات سالین تنها 17% دارو آزاد شده بود (20). در بررسی نتایج آزمایشات برونتن بر روی ردههای سلولی فیبروبلاست و PC3 مشاهده شد که نانوذرات سنتز شده حاوی کورکومین اثرات کشندگی به مراتب بیشتری بر روی سلولهای سرطانی نسبت به سلولهای سالم داشتند.
نتیجهگیری
بهدلیل شرایط خاص بیماری سرطان و توجه به مشکلات درمان دارویی و عوارض جانبی جدی داروهای ضد سرطان بر بافتهای تکثیر شونده بدن مانند سلولهای ایمنی و امکان ایجاد مقاومتهای دارویی، رسانش هدفمند داروها به بافت¬ها و سلولهای سرطانی مهمترین چالش مبارزه با این بیماری است. در این تحقیق سعی شد که سامانه دارورسان حساس به pH بر پایه نانوذرات چارچوب فلز-آلی MOF حاوی کورکومین جهت درمان سرطان، طراحی و ساخته شود. نانوذرات حاصل به درستی سنتز و در تست¬های گوناگون ظرفیت بالایی در درمان سرطان پروستات و حداقل آسیب به سلولهای سالم از خود نشان دادند. میتوان گفت استفاده از این فرمولاسیون جهت دارورسانی هدفمند سرطان نه تنها عوارض داروهای ضد سرطان را کم میکند بلکه اثر بخشی آنها را افزایش داده و همچنین میتواند برای دارورسانی داروهای کم محلول و یا نامحلول در محیطهای بیولوژیکی مورد استفاده قرار گیرد. امید است با پژوهشهای بیشتر و بررسی دقیقتر جزئیات این ریزذرات بتوان در آینده نه چندان دور از آنان در مصارف درمانی استفاده کرد.
سپاسگزاری
این تحقیق، حاصل طرح مصوب در دانشگاه علوم پزشکی کرمانشاه میباشد. از کلیه کسانی که به نوعی در تهیه این مقاله مشارکت داشتهاند تقدیر و تشکر به عمل میآید.
حامی مالی: دانشگاه علوم پزشکی کرمانشاه
تعارض در منافع: وجود ندارد.
References:
1-Torre LA, Bray F, Siegel RL, Ferlay J, Lortet‐Tieulent J, Jemal A. Global Cancer Statistics 2012. CA: Cancer J Clin 2015;65(2):87-108.
2-Ferrari M. Cancer Nanotechnology: Opportunities and Challenges. Nat Rev Cancer 2005; 5(3): 161-71.
3-Anselmo AC, Mitragotri S. An Overview of Clinical and Commercial Impact of Drug Delivery Systems. J Controlled Release 2014; 190: 15-28.
4-Nitta SK, Numata K. Biopolymer-Based Nanoparticles for Drug/Gene Delivery and Tissue Engineering. Int J Mol Sci 2013;14(1):1629-54.
5-Gelder M, Gath D And Mayou R. Oxford Textbook of Psychiatry. Oxford University Press; 1989.
6-Tomeo CA, Colditz GA, Willett WC, Giovannucci E, Platz E, Rockhill B, et al. Harvard Report on Cancer Prevention. Prevention of Colon Cancer in the United States. Cancer Causes & Control 1999; 10(3): 167.
7-Strohmeyer TG, Slamon DJ. Proto-Oncogenes and Tumor Suppressor Genes in Human Urological Malignancies. J Urol 1994; 151(6): 1479-97.
8-Hansen MF, Cavenee WK. Genetics of Cancer Predisposition. Cancer Res 1987; 47(21): 5518-25.
9-Ong SG, Ming LC, Lee KS, Yuen KH. Influence of the Encapsulation Efficiency and Size of Liposome on the Oral Bioavailability of Griseofulvin-Loaded Liposomes. Pharmaceutics 2016; 8(3): 25.
10-Llobet L, Montoya J, López-Gallardo E, Ruiz-Pesini E. Side Effects of Culture Media Antibiotics on Cell Differentiation. Tissue Eng Part C 2015; 21(11): 1143-47.
11-Warren B. X‐Ray Diffraction Methods. J Appl Phys 1941; 12(5): 375-84.
12-Khatun B, Hussain A, Banik N, Ramteke A. Genipin Crosslinked Curcumin Loaded Chitosan/Montmorillonite K-10 (MMT) Nanoparticles for Controlled Drug Delivery Applications. J Microencapsul 2018; 35(5): 439-453.
13-Wang W, Zhu R, Xie Q, Li A, Xiao Y, Li K, et al. Enhanced Bioavailability and Efficiency of Curcumin for the Treatment of Asthma by its Formulation in Solid Lipid Nanoparticles. Int J Nanomedicine 2012; 7: 3667.
14-Mustaqim A, Yuliarto B. Modification of ZIF-8 Using Direct Mixing Method at a Room Temperature. InMaterials Science and Engineering Conference Series 2018; 432(1): 012053.
15-Nordin NAHM, Ismail AF, Yahya N. Zeolitic Imidazole Framework 8 Decorated Graphene Oxide (ZIF-8/GO) Mixed Matrix Membrane (MMM) for CO2/CH4 Separation. J Teknol, 2017; 79(1-2).
16-Gao X, Hai X, Baigude H, Guan W, Liu Z. Fabrication of Functional Hollow Microspheres Constructed from MOF Shells: Promising Drug Delivery Systems with High Loading Capacity and Targeted Transport. Scientific Reports 2016; 6: 37705.
17-Tiwari A, Singh A, Garg N, Randhawa JK. Curcumin Encapsulated Zeolitic Imidazolate Frameworks as Stimuli Responsive Drug Delivery System and their Interaction with Biomimetic Environment. Scientific Reports 2017; 7(1): 1-2.
18-Su H, Sun F, Jia J, He H, Wang A, Zhu G. A Highly Porous Medical Metal–Organic Framework Constructed from Bioactive Curcumin. Chem Commun 2015; 51(26): 5774-7.
19-Vasconcelos IB, da Silva TG, Militão GC, Soares TA, Rodrigues NM, Rodrigues MO, et al. Cytotoxicity and Slow Release of the Anti-Cancer Drug Doxorubicin from ZIF-8. RSC Advancesc 2012; 2(25): 9437-42.
20-Sun CY, Qin C, Wang XL, Yang GS, Shao KZ, Lan YQ, et al. Zeolitic Imidazolate Framework-8 As Efficient Ph-Sensitive Drug Delivery Vehicle. Dalton Trans 2012; 41(23): 6906-9.
1-Torre LA, Bray F, Siegel RL, Ferlay J, Lortet‐Tieulent J, Jemal A. Global Cancer Statistics 2012. CA: Cancer J Clin 2015;65(2):87-108.
2-Ferrari M. Cancer Nanotechnology: Opportunities and Challenges. Nat Rev Cancer 2005; 5(3): 161-71.
3-Anselmo AC, Mitragotri S. An Overview of Clinical and Commercial Impact of Drug Delivery Systems. J Controlled Release 2014; 190: 15-28.
4-Nitta SK, Numata K. Biopolymer-Based Nanoparticles for Drug/Gene Delivery and Tissue Engineering. Int J Mol Sci 2013;14(1):1629-54.
5-Gelder M, Gath D And Mayou R. Oxford Textbook of Psychiatry. Oxford University Press; 1989.
6-Tomeo CA, Colditz GA, Willett WC, Giovannucci E, Platz E, Rockhill B, et al. Harvard Report on Cancer Prevention. Prevention of Colon Cancer in the United States. Cancer Causes & Control 1999; 10(3): 167.
7-Strohmeyer TG, Slamon DJ. Proto-Oncogenes and Tumor Suppressor Genes in Human Urological Malignancies. J Urol 1994; 151(6): 1479-97.
8-Hansen MF, Cavenee WK. Genetics of Cancer Predisposition. Cancer Res 1987; 47(21): 5518-25.
9-Ong SG, Ming LC, Lee KS, Yuen KH. Influence of the Encapsulation Efficiency and Size of Liposome on the Oral Bioavailability of Griseofulvin-Loaded Liposomes. Pharmaceutics 2016; 8(3): 25.
10-Llobet L, Montoya J, López-Gallardo E, Ruiz-Pesini E. Side Effects of Culture Media Antibiotics on Cell Differentiation. Tissue Eng Part C 2015; 21(11): 1143-47.
11-Warren B. X‐Ray Diffraction Methods. J Appl Phys 1941; 12(5): 375-84.
12-Khatun B, Hussain A, Banik N, Ramteke A. Genipin Crosslinked Curcumin Loaded Chitosan/Montmorillonite K-10 (MMT) Nanoparticles for Controlled Drug Delivery Applications. J Microencapsul 2018; 35(5): 439-453.
13-Wang W, Zhu R, Xie Q, Li A, Xiao Y, Li K, et al. Enhanced Bioavailability and Efficiency of Curcumin for the Treatment of Asthma by its Formulation in Solid Lipid Nanoparticles. Int J Nanomedicine 2012; 7: 3667.
14-Mustaqim A, Yuliarto B. Modification of ZIF-8 Using Direct Mixing Method at a Room Temperature. InMaterials Science and Engineering Conference Series 2018; 432(1): 012053.
15-Nordin NAHM, Ismail AF, Yahya N. Zeolitic Imidazole Framework 8 Decorated Graphene Oxide (ZIF-8/GO) Mixed Matrix Membrane (MMM) for CO2/CH4 Separation. J Teknol, 2017; 79(1-2).
16-Gao X, Hai X, Baigude H, Guan W, Liu Z. Fabrication of Functional Hollow Microspheres Constructed from MOF Shells: Promising Drug Delivery Systems with High Loading Capacity and Targeted Transport. Scientific Reports 2016; 6: 37705.
17-Tiwari A, Singh A, Garg N, Randhawa JK. Curcumin Encapsulated Zeolitic Imidazolate Frameworks as Stimuli Responsive Drug Delivery System and their Interaction with Biomimetic Environment. Scientific Reports 2017; 7(1): 1-2.
18-Su H, Sun F, Jia J, He H, Wang A, Zhu G. A Highly Porous Medical Metal–Organic Framework Constructed from Bioactive Curcumin. Chem Commun 2015; 51(26): 5774-7.
19-Vasconcelos IB, da Silva TG, Militão GC, Soares TA, Rodrigues NM, Rodrigues MO, et al. Cytotoxicity and Slow Release of the Anti-Cancer Drug Doxorubicin from ZIF-8. RSC Advancesc 2012; 2(25): 9437-42.
20-Sun CY, Qin C, Wang XL, Yang GS, Shao KZ, Lan YQ, et al. Zeolitic Imidazolate Framework-8 As Efficient Ph-Sensitive Drug Delivery Vehicle. Dalton Trans 2012; 41(23): 6906-9.
ارسال پیام به نویسنده مسئول
| بازنشر اطلاعات | |
 |
این مقاله تحت شرایط Creative Commons Attribution-NonCommercial 4.0 International License قابل بازنشر است. |







